Спосіб виявлення нейрамінідазної активності в клітинах та внутрішньоклітинних компартментах
Номер патенту: 93816
Опубліковано: 10.03.2011
Автори: Білий Ростислав Олександрович, Стойка Ростислав Степанович, Томін Андрій Миколайович
Формула / Реферат
1. Спосіб виявлення нейрамінідазної активності в окремих клітинах та їх компартментах, який включає вирощування клітин, їх інкубацію з флуорогенним субстратом нейрамінідази, який відрізняється тим, що для дослідження компартментів клітинну мембрану роблять проникною (пермебіалізують), детектують флуоресцентний продукт нейрамінідазної реакції за допомогою флуоресцентного мікроскопу, а рівень нейрамінідазної активності оцінюють за інтенсивністю флуоресценції хромогенного субстрату нейрамінідази в різних компартментах клітини.
2. Спосіб виявлення нейрамінідазної активності в окремих клітинах та їх компартментах за п. 1, який відрізняється тим, що флуорогенним субстратом нейрамінідази є будь-яке похідне сіалової кислоти та флуоресцентної сполуки, що може реєструватись за допомогою флуоресцентного мікроскопу з використанням оптимальної довжини хвиль збудження та емісії флуоресценції.
Текст
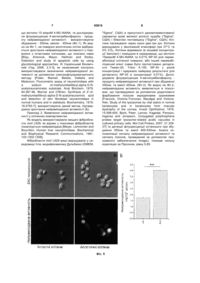
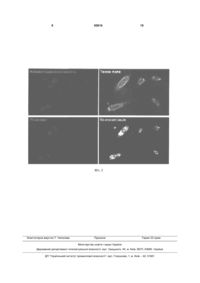
1. Спосіб виявлення нейрамінідазної активності в окремих клітинах та їх компартментах, який включає вирощування клітин, їх інкубацію з флуорогенним субстратом нейрамінідази, який відрізняється тим, що для дослідження компартментів клітинну мембрану роблять проникною (пермебіалізують), детектують флуоресцентний продукт нейрамінідазної реакції за допомогою флуоресцентного мікроскопу, а рівень нейрамінідазної активності оцінюють за інтенсивністю флуоресценції хромогенного субстрату нейрамінідази в різних компартментах клітини. 2. Спосіб виявлення нейрамінідазної активності в окремих клітинах та їх компартментах за п. 1, який відрізняється тим, що флуорогенним субстратом нейрамінідази є будь-яке похідне сіалової кислоти та флуоресцентної сполуки, що може реєструватись за допомогою флуоресцентного мікроскопу з використанням оптимальної довжини хвиль збудження та емісії флуоресценції. UA (21) a201003168 (22) 19.03.2010 (24) 10.03.2011 (46) 10.03.2011, Бюл.№ 5, 2011 р. (72) БІЛИЙ РОСТИСЛАВ ОЛЕКСАНДРОВИЧ, ТОМІН АНДРІЙ МИКОЛАЙОВИЧ, СТОЙКА РОСТИСЛАВ СТЕПАНОВИЧ (73) ІНСТИТУТ БІОЛОГІЇ КЛІТИНИ НАН УКРАЇНИ (56) US 6555698 B1, 29.04.03. WO 99/31280, 24. 06. 99. UA25688 U, 10.08.07. UA28546 U, 10.12.07. Nakano V. et al. A rapid assay of the sialidase activity in species of the Bacteroides fragilis group by using peanut lectin hemagglutination. Anaerobe, 2006, 12, 238-41. Warren L. Thiobarbituric acid assay of sialic acids. J.Biol.Chem., 1959. Volume 234, 1971-75. Landolfi N. et al. Activation of T lymphocytes results in an increase in H-2-encoded neuraminidase. Immunogenetics, 1985, 22,159-67. Francois J. et al. Study of the lysosomes by vital stains in normal keratocytes and in keratocytes from macular dystrophy of the cornea. Invest Ophthalmol, 1976, 15, 599-605. Nayak D.P. and Reichl U. Neuraminidase activity assays for monitoring MDCK cell culture derived influenza virus. J Virol. Methods, 2004, 122, 9-15 (abstract). C2 2 (19) 1 3 2006. 12.238-41], що базується на аглютинації людських еритроцитів лектином арахісу. Суть способу полягає в тому, що аглютинація відбувається внаслідок взаємодії лектину із субтермінальними залишками глікопротеїнів, які експонуються внаслідок дії нейрамінідази. Недоліком даного способу є його напів-кількісний характер та необхідність використання свіжо виділених клітин крові, що ускладнює умови аналізу та потребує забору крові для кожного аналізу. Відомий також тіобарбітуровий спосіб [Warren, Thiobarbituric acid assay of sialic acids. Methods in Enzymology, 1963. Volume 6.463-465] виявлення нейрамінідазної активності в культурі бактерій чи зразках біологічних рідин, що базуються на перйодатному окисненні сіалових кислот і наступній реакції з тіобарбутуровою кислотою. Даний спосіб використовувався у винаходах [Патент України UA25688 від 10.12.2007, МПК А61К31/44, Застосування 4-(n-бензил)амінокарбоніл-1метилпіридинію йодиду (амізону) як інгібітора нейрамінідазної активності вірусу грипу; Патент України UA28546 від 10.08.2007, МПК А61Р31/16. Застосування акридонів як інгібіторів нейрамінідазної активності вірусу грипу // Бюл.№12, 2007р.] для оцінки активності противірусних препаратівінгібіторів нейрамінідази. Суть способу полягає в тому, що окиснена сіалова кислота, утворена під дією нейрамінідази, зв'язується з тіобарбітуровою кислотою з утворенням забарвленого продукту реакції. Недоліком даного способу є його низька специфічність, оскільки тіобарбітурова кислота здатна реагувати з цілим рядом сполук, зокрема альдегідами. Крім того, низькою є чутливість методу (детекція мг сіалової кислоти), що зумовлює необхідність використання великої кількості матеріалу для аналізу. Відомий спосіб хемілюмінесцентного визначення нейрамінідазної активності [Патент США US6,555,698, від 29.03.2003, МПК C07D305/00, C07D321/00, C12N9/24, C12Q1/70, Chemiluminescent substrates for neuraminidase, assays for detection of neuraminidase and kits therefor], що базується на хімічній реакції нейрамінідази із хемілюмінесцентними похідними 1,2диоксиетану. Суть способу полягає в тому, що реакція нейрамінідази із хемілюмінесцентними похідними 1,2-диоксиетану супроводжується вивільненням оптичної енергії, що детектується хемілюмінесцентними методами. Недоліком способу є необхідність використання складного обладнання для детекції хемілюмінесценції та можливість виявляти нейрамінідазу лише у зразку, що являють собою суміш речовин, клітин чи вірусних частинок, і неможливість виявляти нейрамінідазу в окремих клітинах. Відомий спосіб флуоресцентного визначення нейрамінідазної активності в культурі бактерійних клітин [Potier, Mameli, Belisle, Dallaire and Melancon, Fluorometric assay of neuraminidase with a sodium (4-methylumbelliferyl-alpha-D-Nacetylneuraminate) substrate. Anal Biochem, 1979. 94.287-96] та в культурі евкаріотичних клітин [Warner and O'Brien, Synthesis of 2'-(4methylumbelliferyl)-alpha-D-N-acetylneuraminic acid 93816 4 and detection of skin fibroblast neuraminidase in normal humans and in sialidosis. Biochemistry, 1979. 18.2783-7, Landolfi, Leone, Womack and Cook, Activation of T lymphocytes results in an increase in H-2-encoded neuraminidase. Immunogenetics, 1985. 22.159-67], що базується на хімічній реакції нейрамінідази із флуорогенними чи флуоресцентними сполуками, що утворюються внаслідок розщеплення нейрамінідазою відповідних попередників флуорогенних чи флуоресцентних сполук із їх наступним визначенням за допомогою флуорометра чи спектрофлуорометра; серед останньої групи найбільшу відтворюваність та чутливість забезпечує використання як субстрату 4метилумбеліферил-α-D-N-ацетилнейрамінової кислоти (4-methylumbelliferyl-α-D-Nacetylneuraminic acid чи 4-MU-NANA) [Nayak and Reichl, Neuraminidase activity assays for monitoring MDCK cell culture derived influenza virus. J Virol Methods, 2004. 122.9-15]. Суть способу полягає в тому, що лізат клітин бактерійних чи евкаріотичних клітин або культуральне середовище, що містить бактерійні клітини, інкубують з флуорогенним похідним нейрамінової кислоти, розщеплення якого призводить до накопичення флуоресцентного продукту реакції, поява останнього свідчить про наявність нейрамінідазної активності. Недоліком даного способу є неможливість проведення аналізу на окремих клітинах чи їх компартментах, оскільки описаний метод вимагає процедури накопичення клітин чи вірусних частинок у зразку та їх подальшого руйнування шляхом лізису. При цьому можуть виникати операційні похибки на етапі руйнування клітин. Спосіб включає стадію накопичення субстрату в ході реакції - від 1 до 4 годин, для аналізу спосіб потребує використання флуорометра, метод є дорогим і вимагає спеціальних навичок персоналу. Найбільш близьким за технічною суттю до запропонованого є спосіб виявлення нейрамінідазної активності у середовищах, що містять частинки вірусу грипу, де виявлення нейрамінідазної активності здійснюється шляхом забору популяції вірусних частинок із подальшим їх руйнуванням. Реакція виявлення нейрамінідазної активності здійснюється шляхом взаємодії дослідного зразка з флуорогенним субстратом нейрамінідази - 4метил-умбеліферол нейрамінової кислоти; гідроліз останнього призводить до вивільнення флуоресцентного продукту - 4-метил-умбеліферолу, що детектується флуорометром, а нейрамінідазну активність оцінюють за інтенсивністю флуоресценції хромогенного субстрату нейрамінідази у зразку популяції клітин чи вірусних частинок [Міжнародна заявка WO 99/31280 від 18.12.1998, МПК C12Q1/70, G01N3/53, Screening assays for the detection and diagnosis of influenza virus // Опубл. 24.06.99]. Недоліком даного способу є неможливість проведення аналізу на окремих частинках вірусу грипу, спосіб вимагає процедури накопичення вірусних частинок у зразку і тривалого часу для проходження нейрамінідазної реакції і накопичення нейрамінідазного субстрату, що детектується. Для аналізу метод потребує використання флуорометра, метод є дорогим і вимагає спеціа 5 льних навичок персоналу. В основу винаходу поставлено завдання удосконалити спосіб виявлення нейрамінідазної активності в окремих клітинах та їх компартментах шляхом використання флуорогенного субстрату нейрамінідази - 4-метил-умбеліферол нейрамінової кислоти та флуоресцентного мікроскопу, що дозволить забезпечити швидку ідентифікацію нейрамінідазної активності на рівні окремих клітин та їх органел. Поставлене завдання вирішується так, що у способі виявлення нейрамінідазної активності в окремих клітинах та їх компартментах, який включає вирощування клітин, інкубацію їх з флуорогенним субстратом нейрамінідази, згідно з винаходом, для дослідження компартментів поверхню клітин роблять проникною (пермебіалізують), детектують флуоресцентний продукт нейрамінідазної реакції за допомогою флуоресцентного мікроскопу, а нейрамінідазну активність оцінюють за інтенсивністю флуоресценції хромогенного субстрату нейрамінідази у різних компартментах клітини. Спосіб виявлення нейрамінідазної активності в окремих клітинах та їх компартментах полягає в наступному. Авторами вперше для визначення нейрамінідазної активності запропоновано швидкий спосіб її виявлення на окремих клітинах та в клітинних компартментах, що базується на розщепленні нейрамінідазою флуорогенного субстрату із наступним виявленням флуоресцентного продукту реакції за допомогою флуоресцентного мікроскопу. Клітини, на поверхні яких, чи у компартментах яких, необхідно визначити нейрамінідазну активність, попередньо вирощуються на покривних скельцях для мікроскопії (у випадку субстратзалежних клітин) чи у суспензії у випадку суспензійних клітин. Клітини промиваються забуференим фізіологічним розчином (ЗФР,100мл розчину містить 0,9г натрію хлориду) та поміщаються у розчин Рінгера (100мл розчину містить 0,9г натрію хлориду, 0,02г калію хлориду, 0,02г кальцію хлориду, 0,02г натрію гідрокарбонату), або ЗФР що містить 1мМ іонів кальцію, та додають 4-MU-NANA до кінцевої концентрації 15мікроМ. З метою виявлення нейрамінідазної активності у внутрішньоклітинних компартментах, клітини пермебіалізують, додаючи до зразку детергент NP-40 до кінцевої концентрації 0,01%. Готують тимчасовий препарат для мікроскопії і досліджують його за допомогою флуоресцентного мікроскопу за умов збудження флуоресценції при 350нм, чи близьких значеннях, та детектують нейрамінідазну активність за флуоресценцією при 450нм, чи близьких значеннях, що відповідає максимумам збудження та емісії 4метилумбеліферону. Для дослідження використовували мікроскоп Carl Zeiss AxiolmagerAI обладнаний монохроматичною камерою Carl Zeiss AxioCam MRm (Carl Zeiss, Німеччина). Запропонований метод відрізняється від раніше описаних тим, що: нейрамінідазну активність детектують на окремих клітинах чи їх компартментах, клітини поміщають в середовище, що містить 93816 6 флуорогенний субстрат нейрамінідази, нейрамінідазна активність виявляється за флуоресценцією 4-метилумбеліферолу, що детектується за допомогою флуоресцентного мікроскопу використовуючи відповідні довжини збудження (365нм) та емісії (450нм). для виявлення нейрамінідазної активності у внутрішньоклітинних компартментах клітини поміщають у середовище що містить ноніл феноксилполіетоксилетанол (Nonidet NP-40), або інший агент (детергент), що забезпечує проникність клітинної мембрани. для виявлення нейрамінідазої активності потрібен короткий час інкубації - від 1 до 5хв. На Фіг.1. зображено: А - визначення нейрамінідазної активності на клітинах лінії Jurkat лейкемії людини (інтактні та апоптичні, дія етопозиду імікроМ, 2год.) після інкубації у присутності флуорогенного субстрату нейрамінідази 4-MU-NANA упродовж 5хв. (детекція за допомогою флуоресцентної мікроскопії); апоптичні клітини характеризувались підвищеною нейрамінідазною активністю на поверхні клітин. Б - результати визначення нейрамінідазної активності на цих же клітинах здійсненого за допомогою флюорометричного методу. 1 - інтактні клітини, 2 - апоптичні клітини. На Фіг.2. зображено клітини лінії L929 (фібробласти миші), які інкубували у присутності флуорогенного субстрату нейрамінідази 4-MU-NANA (синя флуоресценція), NP-40 для пермебіалізації клітин та виявлення нейрамінідазної активності у клітинних компартментах та маркера лізосом - акридинового оранжевого (червона флуоресценція). Клітини фотографували за допомогою високочутливої монохроматичної камери. Для візуалізації флуоресцентного сигналу зображення псевдо-зафарбовували відповідно до кольору емісії відповідного барвника. Ко-локалізацію сигналу лізосом (червоний сигнал) і нейрамінідазної активності (зелений сигнал) виявляли як жовтий сигнал (повна ко-локалізація). Кольори наведено лише для наочності, математичні обрахунки здійснюють використовуючи вихідні монохроматичні зображення. Результати аналізу ко-локалізації: Pearson's correlation Rr=0.822134; Overlap coefficient R=0.839476, Co-localization (ch2>0) m1=0.949454, Co-localization (ch1>0) m2=0.700341. Можливість реалізації способу показано на наступних прикладах. Приклад 1. Виявлення нейрамінідазної активності на поверхні клітин. Як модель використовували інтактні та апоптичні лімфоцити людини, в останніх нами було показано зростання нейрамінідазної активності на поверхні клітини. Лімфоцити людини лінії Jurkat вирощували в середовищі RPMI-1640 (Flow Laboratories, Шотландія) в присутності декомплементованої сироватки крові великої рогатої худоби ("Sigma", США) і 50мкг/мл гентаміцину ("Sigma", США). Клітини пасажували через кожні два-три дні розведенням клітинної суспензії у співвідношенні 1:5 - 1:2. Клітини вирощували у зволоженій атмосфері при 37°С та 5% СО2. Клітини відмивали (в кінцевій концентрації 3 млн/мл) і поміщали в середовище, 7 що містило 15 мікроМ 4-MU-NANA, та досліджували флуоресценцію 4-метилумбеліферолу - продукту нейрамінідазної активності - використовуючи збудження - 350нм, емісію - 450нм (Фіг.1). Як видно на Фіг.1, на поверхні апоптичних клітин відбувається зростання нейрамінідазної активності у порівнянні з інтактними клітинами, що описано нами [Bilyy, Antoniuk, Mayor, Hellman and Stoika, Detection and study of apoptotic cells by using glycobiological approaches. IX Український біохімічний з'їзд, 2006. 2.3-3], як незалежний контроль використовували визначення нейрамінідазної активності за допомогою спектрофлуорометричного методу [Potier, Mameli, Belisle, Dallaire and Melancon, Fluorometric assay of neuraminidase with a sodium (4-methylumbelliferyl-alpha-D-Nacetylneuraminate) substrate. Anal Biochem, 1979. 94.287-96, Warner and O'Brien, Synthesis of 2'-(4methylumbelliferyl)-alpha-D-N-acetylneuraminic acid and detection of skin fibroblast neuraminidase in normal humans and in sialidosis. Biochemistry, 1979. 18.2783-7], використовуючи даний метод, підтверджено зростання нейрамінідазної активності (Б). Приклад 2. Виявлення нейрамінідазної активності у клітинних компартментах. Як модель використовували мищачі фібробласти лінії L929; як відомо у лізосомах фібробластів локалізується нейрамінідаза [Meyer, Lemonnier and Bourrillon, Human liver neuraminidase. Biochemical and Biophysical Research Communications, 1981. 103.1302-1309]. Фібробласти лінії L929 миші вирощували у середовищі Ігла, модифікованому Дульбекко (DMEM, 93816 8 "Sigma", США) в присутності декомплементованої сироватки крові великої рогатої худоби ("Sigma", США) і 50мкг/мл гентаміцину ("Sigma", США). Клітини пасажували через кожні два-три дні. Клітини вирощували у зволоженій атмосфері при 37°С та 5% СО2. Клітини відмивали (в кінцевій концентрації 3млн/мл) і поміщали в середовище, що містило 15мікроМ 4-MU-NANA та 0,01% NP-40 для пермеабілізації клітинної поверхні, або інший пермеабілізуючий агент (нами було протестовано детергенти Tween-20, Triton X-100, NP-40 у різній концентрації і одержано найкращі результати для детергенту NP-40 в концентрації 0,01%). Досліджували флуоресценцію 4-метилумбеліферолу продукту нейрамінідазної активності при збудженні 350нм, та емісії 450нм. (Фіг.2). Як видно на Фіг.2, нейрамінідазна активність виявляється в лізосомах, що підтверджено за допомогою додаткового фарбування лізосом акридиновим оранжевим [Francois, Victoria-Troncoso, Maudgal and Victorialhler, Study of the lysosomes by vital stains in normal keratocytes and in keratocytes from macular dystrophy of the cornea. Invest Ophthalmol, 1976. 15.599-605, Bjork, Peter, Lenner, Kagedal, Persson, Inganas and Jonasson, Conjugated polythiophene probes target lysosome-related acidic vacuoles in cultured primary cells. Моl Cell Probes, 2007. 21.32937] та детекції флуоресценції останнього при збудженні 550нм та емісії 600-630нм. Аналіз колокалізації сигналу нейрамінідазної активності та сигналу лізосом, проведений за допомогою програмного забезпечення ImageJ, показав сильну кореляцію за Пірсоном, рівну 0,85. 9 Комп’ютерна верстка Т. Чепелева 93816 Підписне 10 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for detection of neuraminidase activity in cells and intracellular compartments
Автори англійськоюBilyi Rostyslav Oleksandrovych, Tomin Andrii Mykolaiovych, Stoika Rostyslav Stepanovych
Назва патенту російськоюСпособ обнаружения нейраминидазной активности b клетках и внутриклеточных компартментах
Автори російськоюБилый Ростислав Александрович, Томин Андрей Николаевич, Стойка Ростислав Степанович
МПК / Мітки
МПК: C12Q 1/34, G01N 21/64, C12M 1/34
Мітки: клітинах, нейрамінідазної, активності, внутрішньоклітинних, компартментах, спосіб, виявлення
Код посилання
<a href="https://ua.patents.su/5-93816-sposib-viyavlennya-nejjraminidazno-aktivnosti-v-klitinakh-ta-vnutrishnoklitinnikh-kompartmentakh.html" target="_blank" rel="follow" title="База патентів України">Спосіб виявлення нейрамінідазної активності в клітинах та внутрішньоклітинних компартментах</a>
Попередній патент: Спосіб радіаційно-хімічного зміцнення цементного каменю
Наступний патент: Спосіб одержання наноструктурованого вуглецевого матеріалу
Випадковий патент: Спосіб дезактивації радіоактивних відпрацьованих фільтруючих матеріалів витісненням