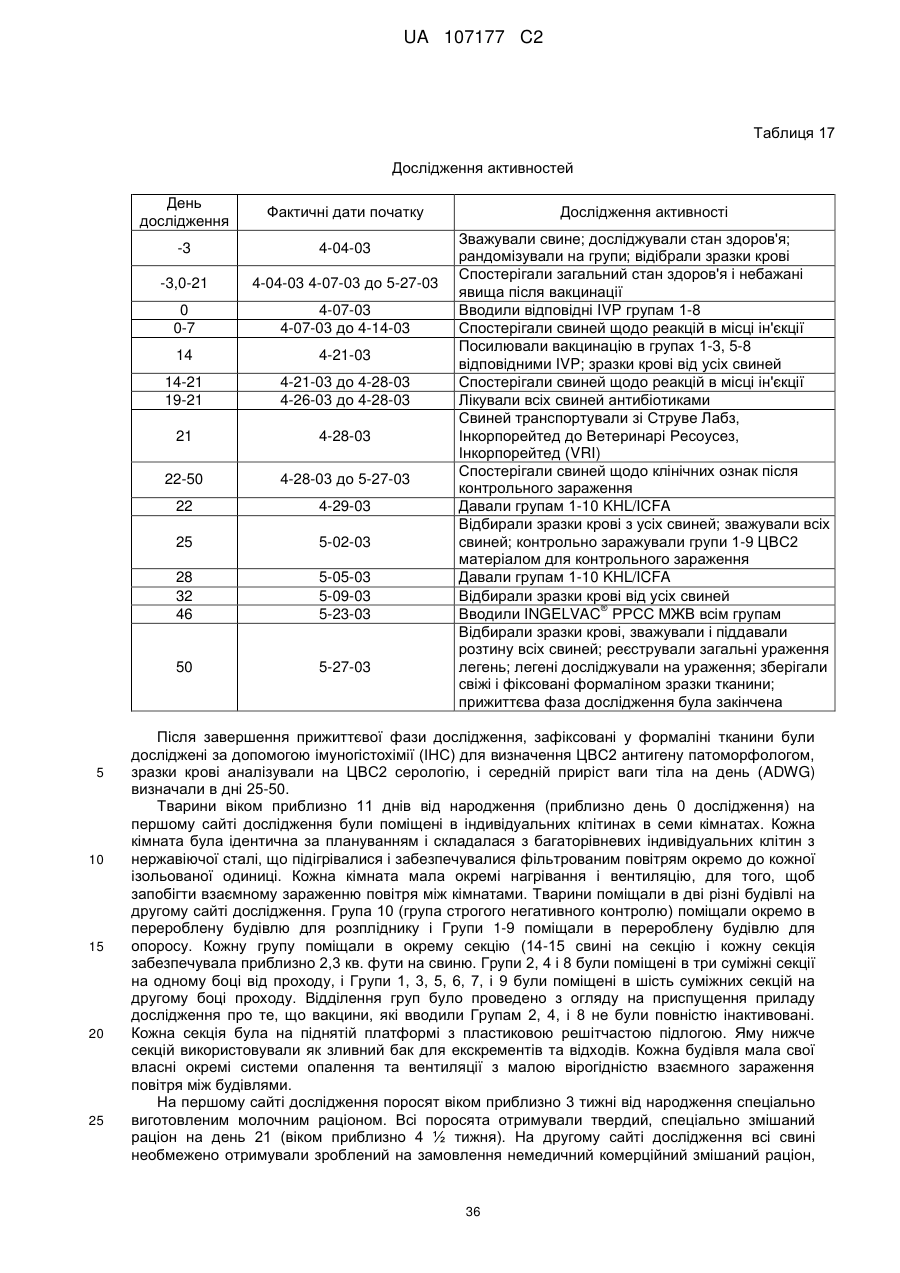
Імуногенна композиція цвс2 та спосіб приготування такої композиції
Формула / Реферат
1. Імуногенна композиція, ефективна для зменшення тяжкості клінічних симптомів, пов'язаних з інфекцією ЦВС2, що містить ЦВС2 ORF2 протеїн або його імуногенну ділянку, де згадана імуногенна ділянка має щонайменше 10 суміжних амінокислот з ЦВС2 ORF2 протеїну.
2. Імуногенна композиція за п. 1 для введення однієї дози.
3. Імуногенна композиція за п. 1 або 2, де згаданий ЦВС2 ORF2 протеїн являє собою
і) поліпептид, що містить послідовність, вибрану з групи, яка включає SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 9, SEQ ID NO: 10 або SEQ ID NO: 11;
ii) будь-який поліпептид, що є щонайменше на 80 % гомологічним поліпептиду і);
ііі) будь-яку імуногенну ділянку поліпептидів і) та/або іі);
iv) імуногенну ділянку ііі), яка містить щонайменше 10 суміжних амінокислот, включених до послідовностей SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID No: 9, SEQ ID No: 10 або SEQ ID No: 11;
v) поліпептид, що кодується ДНК, яка містить послідовність SEQ ID NO: 3 або SEQ ID NO: 4;
vi) будь-який поліпептид, що кодується полінуклеотидом, який є щонайменше на 80 % гомологічним полінуклеотиду v);
vii) будь-яка імуногенна ділянка поліпептидів, що кодуються полінуклеотидом v) та/або vi);
viii) імуногенна ділянка vii), де полінуклеотид, що кодує згадану імуногенну ділянку, містить щонайменше 30 суміжних нуклеотидів, включених до послідовностей SEQ ID No: 3 або SEQ ID No: 4.
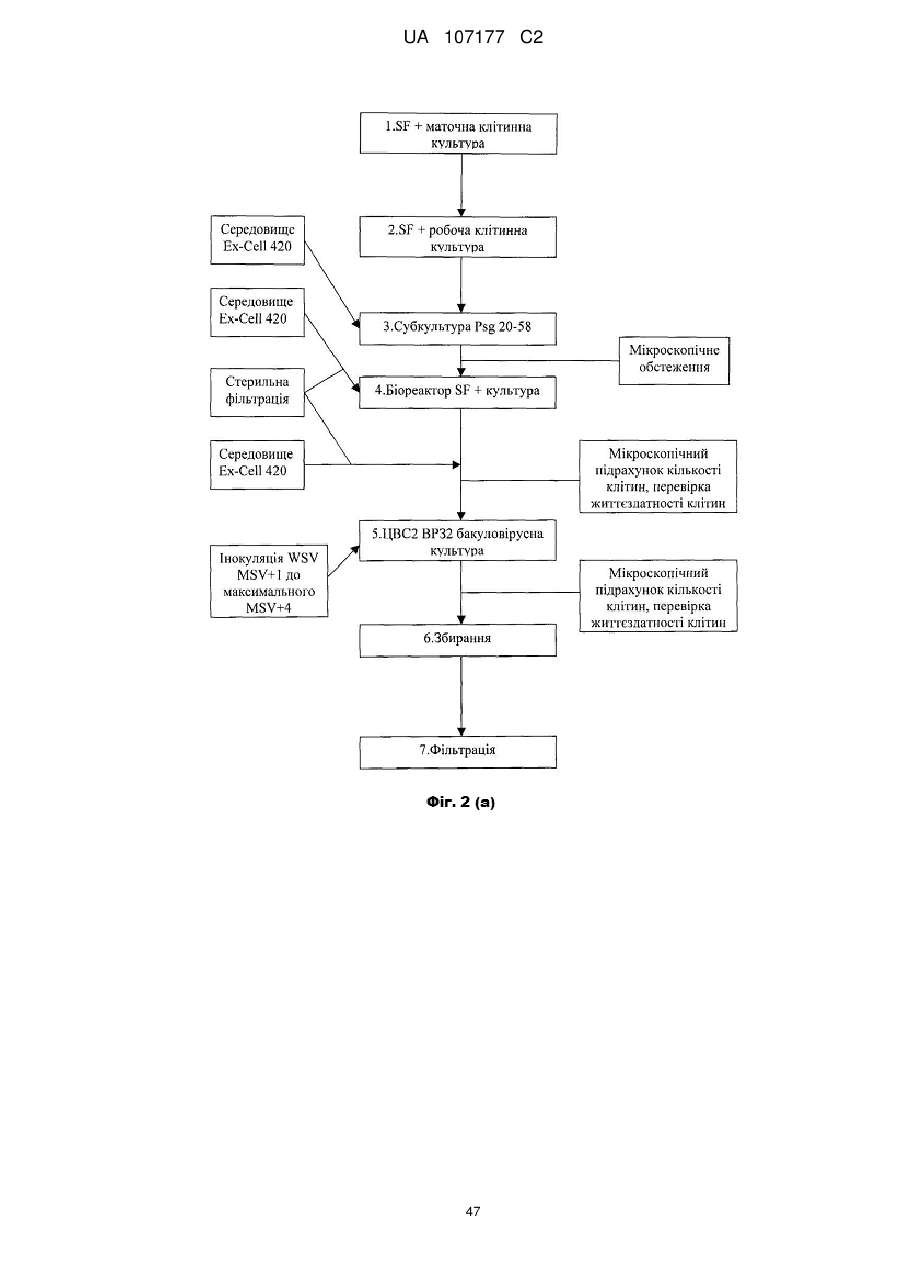
4. Імуногенна композиція за будь-яким з пп. 1-3, що додатково містить інактивований вірусний вектор і супернатант клітинної культури.
5. Імуногенна композиція за п. 4, де згаданий інактивований вірусний вектор являє собою рекомбінантний бакуловірус, що кодує ЦВС2 ORF2 протеїн.
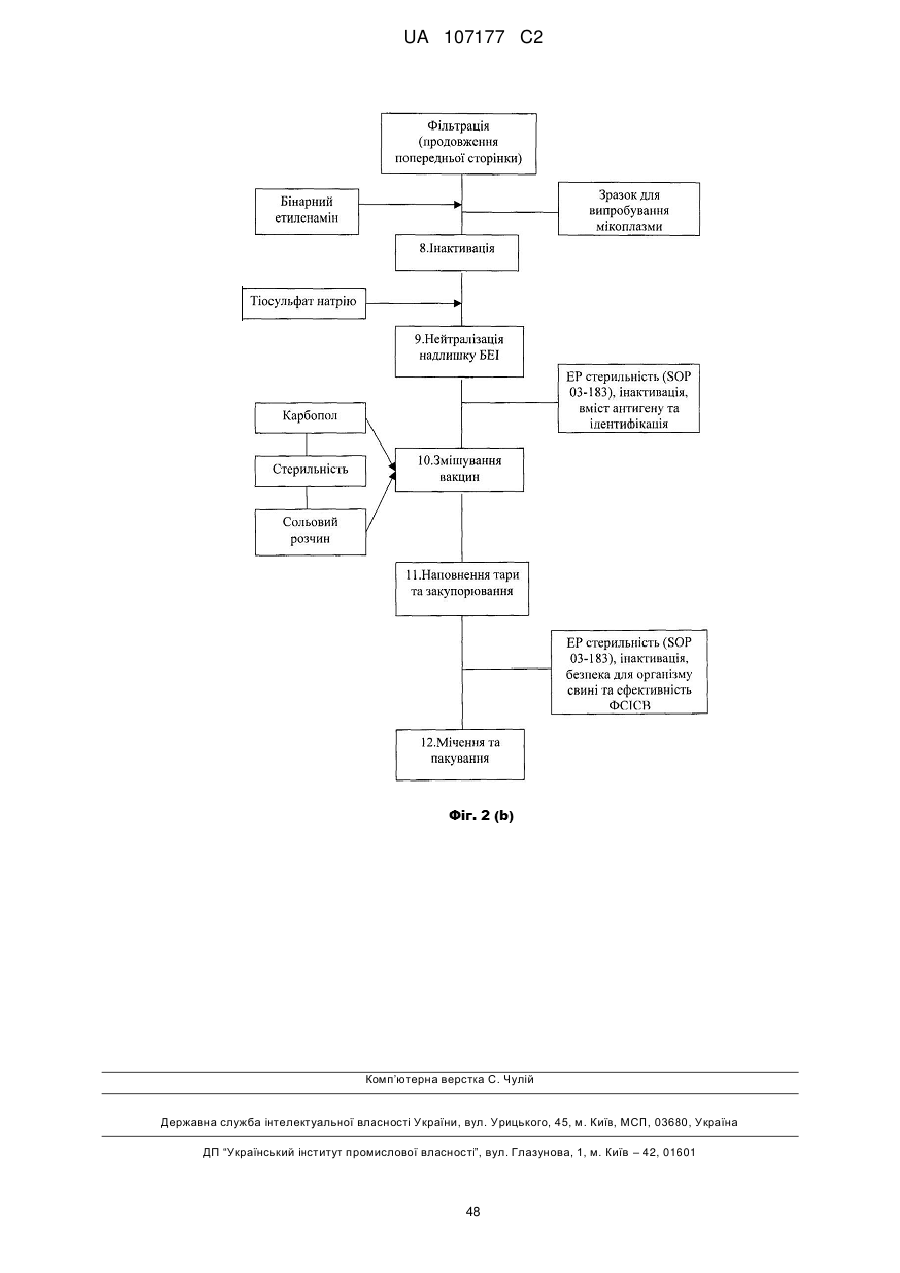
6. Імуногенна композиція за п. 4 або 5, де композиція містить БЕІ.
7. Імуногенна композиція за п. 6, де згадана композиція містить тіосульфат натрію.
8. Імуногенна композиція за будь-яким з пп. 3-7, що містить додатковий інгредієнт, вибраний з групи, що містить носії, допоміжні речовини, середовища, вірусні інактиватори, розріджувачі, ізотонічні агенти, імуномодуляторні агенти, антибіотики та їх комбінації.
9. Імуногенна композиція за п. 8, де згадана композиція містить допоміжну речовину, переважно карбопол.
10. Імуногенна композиція за п. 9, де згадана композиція містить фармацевтично прийнятну сіль, переважно сольовий розчин.
11. Імуногенна композиція за будь-яким з пп. 1-10, де згадана композиція містить щонайменше 0,2 мкг/мл ЦВС2 ORF2 протеїну.
12. Імуногенна композиція за будь-яким з пп. 1-10, де згадана композиція містить щонайменше 2 мкг ЦВС2 ORF2 протеїну.
13. Імуногенна композиція за будь-яким з пп. 1-12 для застосування в способі для (і) запобігання зараженню або повторному зараженню ЦВС2 або (іі) зменшення або усунення клінічних симптомів, викликаних в суб'єкті ЦВС2, шляхом введення суб'єкту в разі потреби лише однієї дози вказаної композиції.
14. Ємність, що містить щонайменше одну дозу імуногенної композиції за будь-яким з пп. 1-11, де одна доза включає щонайменше 2 мкг ЦВС2 ORF2 протеїну.
15. Ємність, що містить 10-250 доз імуногенної композиції за будь-яким з пп. 1-11, де одна доза містить щонайменше 2 мкг ЦВС2 ORF2 протеїну.
16. Ємність за п. 14 або 15, що додатково містить антимікробіологічний активний агент.
17. Набір, що містить ємність за будь-яким з пп. 14-16 та інструкцію про застосування, яка включає інформацію про внутрішньом'язове введення щонайменше однієї дози імуногенної композиції поросятам для зменшення тяжкості клінічних симптомів, пов'язаних з інфекцією ЦВС2.
18. Набір за п. 17, де інструкція про використання містить інформацію про друге або наступне (і) введення щонайменше однієї дози імуногенної композиції, де друге введення або будь-яке наступне введення проводять щонайменше через 14 днів після останнього введення.
Текст
Реферат: Винахід належить до імуногенної композиції, ефективної для зменшення тяжкості клінічних симптомів, пов'язаних з інфекцією ЦВС2, що містить ЦВС2 ORF2 протеїн або його імуногенну ділянку. UA 107177 C2 (12) UA 107177 C2 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ця заявка заявляє пріоритет попередньої заявки з серійним номером 60/640510, поданої 30 грудня 2004 року та заявки з серійним номером 11/034737, поданої 13 січня 2005, ідеї та сутність яких включено в дану заявку за допомогою посилань. СПИСОК ПОСЛІДОВНОСТЕЙ Дана заявка містить список послідовностей в паперовому форматі та у форматі, що зчитується комп'ютером, ідеї та суть яких включено в дану заявку за допомогою посилань. ПЕРЕДУМОВИ ВИНАХОДУ Галузь винаходу Один з аспектів даного винаходу стосується відновлення протеїну, експресованого відкритою рамкою зчитування 2 (BPЗ2) цирковірусу свині типу 2 (ЦВС2). Більш детально, цей протеїн є рекомбінантним протеїном, експресованим трансфектним вірусом, що містиь рекомбінантну кодуючу послідовність свинячого цирковірусу типу 2, відкриту рамку зчитування 2. Ще більш детально трансфектний вірус дає можливість інфікувати клітини в живильних середовищах і протеїн, експресований відкритою рамкою зчитування відновлюється в супернатанті швидше, ніж всередині клітин. Навіть більш детально, спосіб включає етапи ампліфікації гену відкритої рамки зчитування свинячого цирковірусу типу 2, клонування цієї ампліфікованої ділянки в перший вектор, вирізання відкритої рамки зчитування 2 з цього першого вектора та клонування його у вектор трансфекції, сумісної трансфекції цього вектора трансфекції з вірусним вектором в клітини в живильних середовищах, що призводить до того, що клітини стають інфікованими вірусним вектором і, таким чином, такі клітини експресують відкриту рамку зчитування 2, а також відновлення в супернатанті експресованного рекомбінантного протеїну, кодованого відкритою рамкою зчитування 2. В іншому аспекті даний винахід стосується імуногенної композиції, ефективної для викликання імунної відповіді проти ЦВС2, а також способів приготування таких імуногенних композицій. Більш детально, даний винахід стосується імунологічної композиції, ефективної для забезпечення імунної відповіді, що захищає тварину, яка отримує таку композицію і послабляє або зменшує небезпеку клінічних симптомів, пов'язаних з інфекцією ЦВС2. Ще більш детально, даний винахід стосується основаної на протеїні імунологічної композиції, що забезпечує ефективний захист проти інфекції ЦВС2. Навіть більш детально, даний винахід стосується імунологічної композиції, що включає ЦВС2 BPЗ2 (відкрита рамка зчитування), де введення ЦВС2-BPЗ2 приводить до захисту від інфекції ЦВС2. Найбільш детально даний винахід стосується імунологічної композиції, що діє для забезпечення ефективної імунізації свині, що отримує таку імунологічну композицію, і де композиція включає протеїн, експресований BPЗ2 із ЦВС2. Опис попереднього рівня техніки Свинячий цирковірус типу 2 (ЦВС2) являє собою малий (17-22 нм в діаметрі), безоболонковий ДНК вірус з ікосаедричним типом симетрії, що містить одноланцюговий циркулярний геном. ІДВС2 поділяє приблизно 80 % ідентичності послідовності зі свинячим цирковірусом типу 1 (ЦВС1). Проте, порівняно з ЦВС1, що є загалом невірулентним, свиня, інфікована ЦВС2, проявляє синдром, який звичайно має назву мультисистемний синдром виснаження після відлучення від матері (PMWS). PMWS клінічно характеризується виснаженням, блідостю шкіри, хирлявістю, респіраторним дистресом, діареєю, жовтяницею та розлиттям жовчі. У деяких інфікованих свиней буде виявлятися комбінація всіх симптомів, тоді як деякі свині будуть мати один або два з цих симптомів. Проведення розтину також виявляє мікроскопічні та макроскопічні ураження в багатьох тканинах і органах, при цьому лімфоїдні органи є найчастішим місцем уражень. Спостерігалася стійка кореляція між кількістю нуклеїнової кислоти або антигену ЦВС2 та тяжкістю мікроскопічних лімфоїдних уражень. Рівень смертності свиней, інфікованих ЦВС2, може досягати 80 %. Крім PMWS, ЦВС2 асоціюється з деякими іншими інфекціями, що включають псевдосказ, репродуктивний і респіраторний синдром свиней (РРСС), хворобу Глаззера, стрептококовий менінгіт, сальмонельоз, післявід'ємний колібацильоз, дієтичний гепатоз, а також гнійну бронхопневмонію. Протеїн відкритої рамки зчитування 2 (BPЗ2) ЦВС2, що має приблизну молекулярну вагу 30 кДа при розгонці на SDS-PAGE гелі, в минулому використовувався як антигенний компонент в вакцинах до ЦВС2. Типовий спосіб отримання BPЗ2 для застосування в таких вакцинах в загальних рисах складається з ампліфікаціі ДНК ЦВС2, що кодує BPЗ2, трансфекції вірусного вектора з ДНК BPЗ2, інфікування клітин вірусним вектором, що містить ДНК BPЗ2, забезпечення експресії вірусом протеїну BPЗ2 в клітині, та виділення протеїну BPЗ2 з клітини шляхом лізису. Ці процедури загалом тривають до чотирьох днів після інфікування клітин вірусним вектором. Проте, ці процедури мають недоліки, що полягають в тому, що процедури виділення є і коштовними, і довготривалими. Крім того, кількість BPЗ2, відновленої з клітин є не досить 1 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 високою; відповідно, велику кількість клітин необхідно інфікувати великою кількістю вірусних векторів для того, щоб отримати суттєві кількості рекомбінантного експресованого протеїну для застосування у вакцинах і т. ін. Сучасний підхід до ЦВС2 імунізації включає основану на ДНК вакцину, такі як вакцини, описані в патенті США № 6703023. Проте, такі вакцини не були ефективними в забезпеченні захисного імунітету проти інфекції ЦВС2 і клінічних симптомів, асоційованих з нею. Відповідно, існує потреба у способі отримання протеїну BPЗ2, що не потребує виділення з інфікованих клітин. Також потрібен спосіб отримання рекомбінантного протеїну BPЗ2 в кількостях, достатніх для ефективного приготування композицій для вакцин. А також потрібен спосіб отримання протеїну BPЗ2, що не потребує ускладнених і трудомістких способів, необхідних для сучасних методик виділення протеїну BPЗ2. Нарешті, відносно композицій, існує потреба в імуногенній композиції, що забезпечує захисний імунітет проти інфекції ЦВС2 і зменшує тяжкість або попереджає клінічні симптоми, асоційовані з цією інфекцією. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід долає проблеми, притаманні попередньому рівню техніки і забезпечує вагомий внесок у рівень техніки. А саме, один аспект даного винаходу ззабезпечує покращений спосіб отримання та/або виділення рекомбінантного протеїну ЦВС2 BPЗ2 і) шляхом розвитку інфекції чутливих клітин у культурі з рекомбінантним вірусним вектором, що містить кодуючу послідовність ДНК ЦВС2 BPЗ2, де протеїн BPЗ2 експресується вірусним вектором, а також іі) наступне відновлення BPЗ2 в супернатанті. Несподівано було відкрито, що цей BPЗ2 вивільнюється в супернатанті у великій кількості, якщо інфекція і наступна інкубація інфікованих клітин дозволяє вдосконалити попередній типовий процес відновлення ІДВС2 BPЗ2, який екстрагує ЦВС2 BPЗ2 з клітин. Більш того несподівано відкрили, що протеїн ЦВС BPЗ2 є стійким до прототипової деградації назовні клітин-продуцентів. Обидва відкриття дозволяють відновити велику кількість протеїну ЦВС2 BPЗ2 з супернатанту клітинних культур, інфікованих вірусними векторами, що містять ДНК ЦВС2 BPЗ2 і експресують протеїн ЦВС2 BPЗ2. Висока кількість ЦВС2 BPЗ2 протеїну означає більш ніж близько 20 мг/мл супернатанту, переважно більш ніж близько 25 мг/мл, навіть переважніше більш ніж близько 30 мг/мл, навіть переважніше більш ніж близько 40 мг/мл, навіть переважніше більш ніж близько 50 мг/мл, навіть переважніше більш ніж близько 60 мг/мл, навіть переважніше більш ніж близько 80 мг/мл, навіть переважніше більш ніж близько 100 мг/мл, навіть переважніше більш ніж близько 150 мг/мл, найпереважніше більш ніж близько 90 мг/мл. Таких рівнів експресії можна також досягти, наприклад, способами, описаними в прикладах 1-3. Переважні клітинні культури мають кількість клітин близько 0,3-2,0 × 106 клітин/мл, переважніше близько 0,35-1,9 × 106 клітин/мл, також переважніше близько 0,4-1,8 × 106 клітин/мл, навіть переважніше близько 0,45-1,7 × 106 клітин/мл, і найпереважніше близько 0,51,5 × 106 клітин/мл. Переважні клітини є такими, що підлягають визначенню фахівцями в даній галузі. Переважні клітини є такими, що чутливі до інфікування відповідним рекомбінантним вірусним вектором, що містить ДНК ЦВС2 BPЗ2 та експресує ЦВС2 BPЗ2 протеїн. Переважно такі клітини є клітинами комах, і більш переважно, вони включають клітини комах, що продаються під торговою маркою Sf+ клітини комах (Протеїнова Наукова Корпорація, Meriden, CT). Відповідні живильні середовища будуть також такими, що підлягають визначенню фахівцями в даній галузі, при цьому переважними живильними середовищами є вільні від сироватки середовища клітин комах, такі як Excell 420 (JRH Biosciences, Inc., Lenexa, KS) і подібні. Переважні вірусні вектори включають бакуловірус, наприклад BaculoGold (BD Biosciences Pharmingen, San Diego, CA), зокрема якщо клітини-продуценти є клітинами комах. Хоча переважною є система експресії бакуловірусу, фахівцям в даній галузі зрозуміло, що інші системи експресії будуть працювати для забезпечення завдань даного винаходу, а саме для експресії ЦВС2 BPЗ2 в супернатанті клітинної культури. Такі інші системи експресії можуть вимагати сигнальну послідовність для запуску експресії BPЗ2 в середовищах. Було несподівано показано, що коли BPЗ2 отримують в системі експресії бакуловірусу, не має потреби в будь-якій сигнальній послідовності або в подальшій модіфікації для запуску експресії BPЗ2 в середовищах. Припускають, що цей протеїн може незалежно утворювати вірусоподібні частки (Journal of General Virology Vol. 81, pp. 2281-2287 (2000)) і може виділятися в клітинний супернатант. Рекомбінантний вірусний вектор, що містить послідовності ДНК ЦВС2 BPЗ2, має переважну множинність зараження (МОІ) близько 0,03-1,5, переважніше близько 0,05-1,3, також переважніше близько 0,09-1,1, і найпереважніше близько 0,1-1,0, коли застосовується для зараження чутливих клітин. Переважно множинності зараження виражають рівні на один мл 6 рідини клітинної культури. Переважно, спосіб, описаний тут, включає зараження 0,35-1,9 × 10 2 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітин/мл, також переважніше близько 0,4-1,8 × 106 клітин/мл, навіть переважніше переважно 6 6 близько 0,45-1,7 × 10 клітин/мл, і найпереважніше близько 0,5-1,5 × 10 клітин/мл рекомбінантним вірусним вектором, що містить ЦВС2 BPЗ2 ДНК та експресує ЦВС2 ВРЗ протеїн, який має множинність зараження близько 0,03-1,5, переважніше близько 0,05-1,3, також переважніше близько 0,09-1,1, та найпереважніше близько 0,1-1,0. Інфіковані клітини потім інкубуть протягом періоду до десяти днів, переважніше від близько двох до близько десяти днів, також переважніше від близько чотирьох до близько дев'яти днів, і найпереважніше від близько п'яти до близько восьми днів. Переважні інкубаційні умови включають температуру близько 22-32 °C, переважніше близько 24-30 °C, також переважніше близько 25-29 °C, навіть переважніше близько 26-28 °C, і найпереважніше 27 °C. Переважно, клітини Sf+ спостерігаються внаслідок інокуляції для характерних змін, викликаних бакуловірусом. Таке спостереження може включати моніторинг відхилень щільності клітин і зниження життєспроможності протягом постінфекційного періоду. Знайшли, що пік титру вірусу спостерігається на 3-5 дні після зараження та пік вивільнення BPЗ2 з клітин в супернатант спостерігається між 5 та 8 днями, та/або коли клітинна життєспроможність знижується до менше, ніж 10 %. Таким чином, один аспект даного винаходу забезпечує покращений спосіб отримання та/або відновлення рекомбінантного ЦВС2 BPЗ2 протеїну, переважно в кількості, описаній вище, шляхом і) сприяння зараженню кількості чутливих клітин (див. вище) в культурі з рекомбінантним вірусним вектором з множинністю зараження, як зазначено вище, іі) експресії ЦВС2 BPЗ2 протеїну рекомбінантним вірусним вектором, та ііі) наступним відновленням ЦВС2 BPЗ2 в супернатанті клітин, отриманому на 5-8 день після зараження та/або після того як життєспроможність клітин знижується до менш ніж 10 %. Переважно, рекомбінантний вірусних вектор є рекомбінантним бакуловірусом, що містить кодуючі послідовності ДНК і клітини, що являють собою Sf+ клітини. Додатково, переважним є те, що культуру періодично перевіряють на макроскопічні і мікроскопічні випадки контамінації або на атипові зміни клітинної морфології протягом постінфекційного періоду. Будь-яка культура, в якій спостерігають будь-яку контамінацію, повинна вибраковуватися. Переважно, експресований BPЗ2 рекомбінантний протеїн секретується клітинами в навколишні живильні середовища, що підтримує життєспроможність клітин. BPЗ2 потім відновлюється в супернатанті, що оточує клітини, швидше, ніж з самих клітин. Процес відновленя переважно починається з сепарації клітинних уламків з експресованих BPЗ2 в середовищах шляхом етапу сепарації. Переважні етапи сепарації включають фільтрацію, центрифугування при швидкостях до близько 20,000xg, тривале проточне центрифугування, хроматографічну сепарацію із застосуванням іонного обміну або гелевої фільтрації, а також традиційних імуноафінних способів. Ці способи відомі фахівцям в даній галузі, наприклад, з (Harris і Angel (eds.), Способи очищення протеїну - практичний підхід, IRL press Oxford 1995). Найпереважніші способи сепарації включають центрифугування при швидкостях до близько 20,000xg і фільтрацію. Переважні способи фільтрації включають тупикову мікрофільтрацію та тангенціальну проточну (або перехресно проточну) фільтрацію, що включає фільтрацію порожніх волокон тупикової мікрофільтрації. З названих способів тупикова мікрофільтрація є переважною. Переважний розмір пор для тупикової мікрофільтрації складає близько 0,30-1,35 мкм, переважніше близько 0,35-1,25 мкм, також переважніше близько 0,401,10 мкм, і також найпереважніше близько 0,45-1,0 мкм. Припускають, що будь-яка стандартна фільтраційна мембрана буде забезпечувати досягнення завдань даного винаходу, при цьому поліетерсульфонові мембрани є переважними. Будь-які види нуклеїнової кислоти низької ваги видаляють протягом етапу фільтрації. Таким чином, також один аспект даного винаходу забезпечує покращений спосіб отримання та/або відновлення рекомбінантного ЦВС2 BPЗ2 протеїну, переважно в кількостях, описаних вище, шляхом і) сприяння зараженню кількості чутливих клітин (див. вище) в культурі з рекомбінантним вірусним вектором з множинністю зараження як зазначено вище, іі) експресії ЦВС2 BPЗ2 протеїну рекомбінантним вірусним вектором, та ііі) наступним відновленням ЦВС2 BPЗ2 в супернатанті клітин, отриманому на 5-8 день після зараження та/або після того, як життєспроможність клітин знижується до менш ніж 10 %, та iv) сепарації клітинних уламків з експресованої ЦВС2 BPЗ2 на етапі сепарації. Переважно, рекомбінантний вірусний вектор є бакуловірусом, що містить кодуючі послідовності ДНК BPЗ2, і клітини являють собою SF+ клітини. Переважні етапи сепарації є такими, як описано вище. Найбільш переважним є тупикова мікрофільтрація із застосуванням мембрани, що має розмір пори близько 0,30-1,35 мкм, переважніше близько 0,35-1,25 мкм, також переважніше близько 0,40-1,10 мкм, та найпереважніше близько 0,45-1,0 мкм. 3 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для відновлення ЦВС2 BPЗ2, що буде застосовуватися в імуногенній та імунологічній композиції, наприклад вакцині, перважним є включення етапу інактивації для того, щоб інактивувати вірусний вектор. "Імуногенна або імунологічна композиція" належить до композиції матеріалу, що складається із щонайменше одного антигену, що викликає імунну відповідь у хазяїна, а саме клітинну та/або імунну відповідь, викликану антитілом, на дану композицію або вакцину. Звичайно, "імунологічна відповідь" включає, але не обмежується ними, один або декілька наступних ефектів: продукція або активація антитіл, В клітин, хелперів Т клітин, супресорів Т клітин, та/або цитотоксичних Т клітин та/або yd T клітин, спрямованих специфічно на антигени, включені до даної композиції або вакцин. Переважно, хазяїн буде проявляти як терапевтичну, так і захисну імунологічну відповідь, наприклад, буде підвищуватися стійкість до нової інфекції та/або буде знижуватися клінічна тяжкість захворювання. Такий захист буде продемонстровано будь-яким з наступних шляхів: зменшенням або відсутністю симптомів, що звичайно притаманні інфікованому хазяїну, більш кротким часом одужання та/або більш низьким титром вірусу в інфікованому хазяїні. Таким чином, даний винахід також стосується способу отримання та/або відновлення рекомбінантного ЦВС2 BPЗ2 протеїну, переважно в кількості, зазначеній вище, шляхом і) сприяння зараженню кількості чутливих клітин (див. вище) в культурі з рекомбінантним вірусним вектором з множинністю зараження як зазначено вище, іі) експресії ЦВС2 BPЗ2 протеїну рекомбінантним вірусним вектором, та ііі) наступним відновленням ЦВС2 BPЗ2 в супернатанті клітин, отриманому на 5-8 день після зараження та/або після того, як життєспроможність клітин знижується до менш ніж 10 %, та iv) сепарації клітинних уламків з експресованої ЦВС2 BPЗ2 на етапі сепарації, і v) інактивуванню рекомбінантного вірусного вектора. Переважно, ця інактивація відбувається або відразу до, або відразу після етапу фільтрації, при цьому переважним часом для інактивації є період після етапу фільтрації. Будь-який традиційний спосіб фільтрації може бути застосований для досягнення завдань даного винаходу. Таким чином, інактивація може бути проведена хімічною та/або фізичною обробками. В переважній формі визначають об'єм зібраних рідин і доводять температуру до близько 3242 °C, переважніше близько 34-40 °C, та найпереважніше близько 35-39 °C. Переважні спосіби інактивації включають додавання циклізованого бінарного етиленіміну (БЕІ), переважно в концентрації від близько 1 до близько 20 мМ, переважно від близько 2 до близько 10 мМ, також переважніше від близько 2 до близько 8 мМ, також переважніше від близько 3 до близько 7 мМ, найпереважніше від близько 5 мМ. Наприклалд інактивація включає додавання розчину 2брометиленаміну гідроброміду, переважно від близько 0,4 М, який циклізовано в 0,2 М бінарний етиленімін (БЕІ) у 0,3 N NaOH, до рідин для отримання кінцевої концентрації близько 5 мМ БЕІ. Переважно, потім рідини тривало перемішують протягом 72-96 годин, ці інактивовані зібрані рідини можуть зберігатися замороженими при -40 °C або нижче або близько 1-7 °C. Після закінчення інактивації розчин тіосульфату натрію, переважно 1,0 М, додають для нейтралізації будь-яких залишкових БЕІ. Переважно, розчин тіосульфату натрію додають в еквівалентній кількості порівняно з БЕІ, що додали попередньо для інактивації. Наприклад, у випадку, коли БЕІ додається до кінцевої концентрації 5 мМ, додається 1,0 М розчину тіосульфату натрію для отримання кінцевої мінімальної концентрації 5 мМ для нейтралізації будь-якого залишкового БЕІ. Таким чином, також один аспект даного винаходу стосується способу отримання рекомбінантного ЦВС2 BPЗ2 протеїну, переважно в кількості, зазначеній вище, шляхом і) сприяння зараженню кількості чутливих клітин (див. вище) в культурі з рекомбінантним вірусним вектором з множинністю зараження як зазначено вище, іі) експресії ЦВС2 BPЗ2 протеїну рекомбінантним вірусним вектором, та ііі) наступним відновленням ЦВС2 BPЗ2 в супернатанті клітин, отриманому на 5-8 день після зараження та/або після того, як життєспроможність клітин знижується до менш ніж 10 %, та iv) сепарації клітинних уламків з експресованої ЦВС2 BPЗ2 на етапі сепарації, і v) інактивуванню рекомбінантного вірусного вектора. Переважно, рекомбінантний вірусний вектор являє собою бакуловірус, що містить кодуючі послідовності ДНК BPЗ2, і клітини являють собою SF+ клітини. Переважні етапи сепарації є такими, як зазначено вище, найбільш переважним є етап фільтрації. Переважними етапами інактивації є такі, що описані вище. Переважно, інактивація поводиться при близько 35-39 °C і в присутності від 2 до 8 мМ БЕІ, також переважно в присутності близько 5 мМ БЕІ. Несподівано було відкрито, що більш високі концентрації БЕІ негативно впливають на ЦВС2 BPЗ2 протеїн. Відповідно до ще одного аспекту даного винаходу, спосіб, описаний вище, також включає етап нейтралізаціїї після етапу v). Цей етап vi) включає додавання еквівалентної кількості агента, що нейтралізує агент інактивації в розчині. Переважно, якщо агентом інактивації є БЕІ, переважним є додавання розчину тіосульфату натрію. Таким чином, відповідно до ще одного 4 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 аспекту, етап vi) додавання розчину тіосульфату натрію до кінцевої концентрації від 1 до близько 20 мМ, переважно від близько 2 до близько 10 мМ, також переважніше від близько 2 до близько 8 мМ, також переважніше від близько 3 до близько 7 мМ, найпереважніше від близько 5 мМ, якщо агентом інактивації є БЕІ. В переважних формах і особливо у формах, що будуть застосовувати рекомбінантний ЦВС2 BPЗ2 протеїн в імуногенній композиції, наприклад вакцині, кожна серія зібраної BPЗ2 буде тестуватися на інактивацію пасажем в заякорені, бакуловірус-чутливі Sf+ клітини. В переважній формі такого тестування, 150 см2 відповідного моношару клітинної культури інокулють 1,0 мл інактивованих ЦВС2 рідин і витримують при 25-29 °C протягом 14 днів із щонайменше двома пасажами. В кінці періоду зберігання клітинні моношари досліджують на цитопатогенну дію (ЦПД), типову для ЦВС2 BPЗ2 бакуловірусу. Переважно, також використовують позитивні вірусні конролі. Такі контролі можуть складатися з однієї культури Sf+ клітин, інокульованих неінактивованим стандартизованим ЦВС2 BPЗ2 бакуловірусом і однієї колби Sf+ клітин, що залишаються неінокульованими. Після інкубації та пасажу відсутність заражених вірусом клітин у вірусних рідинах, оброблених БЕІ, буде являти собою задовільний тест на інактивацію. Контрольні клітини, інокульовані стандартизованим вірусом, повинні проявляти цитопатогенну дію, типову для ЦВС2 BPЗ2 бакуловірусу і неінокульована колба не повинна виявляти жодного проявлення цитопатогенної дії ЦВС2 BPЗ2 бакуловірусу. Альтернативно, в кінці періоду зберігання збирають зразки супернатантів та інокулюють в Sf+96-лунковому планшеті, який насичений Sf+ клітинами, і потім витримують при 25-29 °C протягом 5-6 днів. Планшети потім фіксують і фарбують з анти-ЦВС2 BPЗ2 антитілом, кон'югованим до FITC. Відсутність цитопатогенної дії (ЦПД) та експресії BPЗ2, що визначається ІФД (імунофлюоресцентне дослідження) мікроскопією, у вірусних рідинах, оброблених БЕІ, являє собою задовільний тест на інактивацію. Контрольні клітини, інокульовані стандартизованим вірусом повинні виявляти цитопотагенну дію та ІФД активність, неінокульована колба не повинна проявляти жодного випадку цитопатогенної дії ЦВС2 BPЗ2 бакуловірусу (ЦПД) і не повинна містити ІФД активність. Таким чином в наступному аспекті даний винахід стосується тесту на інактивацію, що визначає ефективність інактивації рекомбінатного вірусного вектора, що складається з етапів: і) контакт щонайменше однієї частки рідини культури, що містить рекомбінантний вірусний вектор з агентом інактивації, переважно, як описано вище, іі) додавання агента нейтралізації для нейтралізації агента інактивації, переважно як описано вище; та ііі) визначення залишкової здатності до зараження методами, описаними вище. Після інактивації відносна кількість рекомбінантного ЦВС2 BPЗ2 протеїну у зразку може бути визначена деількома способами. Переважні способи кількісного визначення включають SDSPAGE денсітометрію, ФСІСВ (фермент-сполучене імуносорбентне випробування), та дослідження вакцинації тварин, що співвідносять відомі кількості вакцини з клінічними результатами (серологія, і т.ін.). Якщо використовують SDS-PAGE для кількісного визначення, зразок матеріала, що містить невідому кількість рекомбінантного ЦВС2 BPЗ2 протеїну, розгоняють в гелі, разом із зразками, що містять різні відомі кількості рекомбінантного ЦВС2 BPЗ2 протеїну. Визначають стандартну криву, основану на відомих зразках, і кількість рекомбінантного ЦВС2 BPЗ2 у невідомому зразку може бути визначена шляхом порівняння з цією стандартною кривою. Зважаючи на те, що методи ФСІСВ звичайно розглядають як промисловий стандарт для визначення кількості антигену, ці методи є переважними для визначення кількості. Таким чином, відповідно до наступного аспекту даний винахід також стосується ФСІСВ для визначення кількості рекомбінантного ЦВС2 BPЗ2 протеїну. Переважне ФСІСВ, що забезпечується наступним, буде в загальних рисах починатися з розведення іммобілізованого антитіла 1:6000 або з відповідного робочого розведення буферу для сенсибілізації поверхні. Переважним іммобілізованим антитілом є очищений анті-ЦВС2 Pab Протеїн G свині, і переважним буфером для сенсибілізації поверхні є 0,05М карбонатний буфер, що може бути отриманий комбінаціїю 2,93 г NaHCO3 (Sigma Cat. № S-6014, або еквівалент) і 1,59 г NaCO3 (Sigma Cat. № S-6139, або еквівалент). Суміш змішують з дистильованою водою, або еквівалентом, для утворення одного літра при рН 9,6±0,1. Далі іммобілізоване антитіло розводять в буфері для утворення поверхні 1:6000, або будь-яким робочим розведенням. Наприклад, для чотирьох планшетів необхідно 42 мл буферу для утворення поверхні і 7 мкл іммобілізованого антитіла. Застосовуючи спосіб зворотного дозування, 100 мкл розведеного іммобілізованого антитіла додають до усіх лунок. Для отримання рівномірного покриття боки кожного планшета повинні мати невелику різьбу. Планшети потім герметично закривають пристосуванням для заклеювання планшетів, перед цим складають планшети у купку і накривають купку пустим 96-лунковим планшетом. Планшети інкубують протягом ночі (14-24 5 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 годин) при 35-39 °C. Кожний планшет потім відмивають тричі буфером для відмивки, використовуючи ультравідмивку та положення на мікротитрування машини для відмивки планшентів при 250 мкл/відмивка з трьома відмивками і без періоду замочування. Після останньої відмивки планшети викладують різбою на паперовий рушник. Знову, використовуючи метод зворотного дозування, 250 мкл блокуючого розчину додають до всіх лунок. Тестові планшети необхідно герметично закрити та інкубувати протягом години (± 5 хвилин) при 3537 °C. Переважно, після цього етапу планшети не складають купкою. Протягом етапу блокування всі тестові зразки дістають і відтаюють при кімнатній температурі. Далі готують чотири окремих розведених планшети шляхом додавання 200 мкл розчину для розведення до всіх залишившихся планшетів, за винятком смуги А і смуги Н, колонки 1-3. Далі шість тестових пробірок позначають наступним чином: низький титр, середній титр, високий титр, інактивований/фільтрований (1:240), інактивований/фільтрований (1:480) та внутрішній контроль. В цих визначених пробірках готують відповідне розведення для наступних тестових зразків. Відтаяні тестові зразки необхідно струснути перед застосуванням. Для чотирьох планшетів будуть зроблені наступні розведення: А) низький титр не будуть попередньо розводити: 3,0 мл низького титру; В) негативний контроль при розведенні 1:30 (SF+ клітини): 3,77 мл розчинника +130 мкл негативного контролю; С) середній титр при розведенні 1:30 (8 мг/мл): 3,77 мл розчинника + 130 мкл середнього титру; D) високий титр при розведенні 1:90 (16 мг/мл): 2,967 мл розчиннику + 33 мкл високого титру; Е) інактивований/ фільтрований при розведенні 1:240: 2,39 мл розчинника + 10 мкл інактивованого/ фільтрованого зразка; F) інактивований/ фільтрований при розведенні 1:480: 1,0 мл розчинника +1,0 мл інативованого/ фільтрованого (1:240) зразка, отриманого з Е вище; G) внутрішній конроль при розведенні 1:30: 3,77 мл розчинника + 130 мкл внутрішнього контролю. Далі додати 300 мкл отриманних зразків до відповідних пустих лунок в планшетах розведення для планшета 1 з 4. Далі застосовують багатоканальний піпетор для 100 мкл, і вмісти в смузі А змішують, набираючи в піпетку і випускаючи назад щонайменше 5 разів, а потім 100 мкл переносять на смугу В, застосовуючи метод зворотного дозування. Змінюють наконечник, і дану процедуру продовжують протягом всього планшета до смуги G. Зразки в цих планшетах розведення тепер готові для перенесення до тестових планшетів, коли тестові планшети відмиті тричі буфером відмивки з використанням ультравідмивки разом з мікротитровою машиною для відмивання планшетів (виставленою при 250 мкл/відмивка, 3 відмивки, без періоду замочування). Після останньої відмивки планшети викладають різьбою на паперовий рушник. Далі вмісти планшетів розведення переносять на тестовий планшет, застосовуючи просту процедуру перенесення. Більш специфічно, починаючи зі смуги Н, 100 мкл/лунка переносять із планшета(ів) розведення на відповідні лунки тестового планшета(ів), застосовуючи метод зворотного дозування. Після кожного перенесення наконечники піпетки міняють. Зі смуги G, 100 мкл/лунка переносять із планшета(ів) розведення на відповідні лунки тестового планшета(ів), застосовуючи метод зворотного дозування. Однакове положення наконечників піпеток може бути використано для перенесення, що залишилось. Для забезпечення гомогенності розчину для перенесення, розчин необхідно набрати в піпетку і випустити назад тричі перед перенесенням. Далі тестовий планшет(и) герметично закривають та інкубують протягом 1,0 годин ± 5 хвилин при 37 °C ± 2,0 °C. Знову переважно планшети не складають один на другого. Планшети потім тричі відмивають буфером відмивки, затосовуючи ультравідмивку разом із мікротитровою машиною для відмивки планшетів (виставленою при 250 мкл/відмивка, 3 відмивки, без періоду замочування). Після останньої відмивки планшети викладають різьбою на паперовий рушник. Використовуючи метод зворотного дозування, 100 мкл визначеного антитіла, розведеного 1:300, або відповідним робочим розведенням, в розчині для розведення додають до всіх лунок тестового планшета(ів) Наприклад, для чотирьох планшетів, буде необхідно 42 мл розчину для розведення з 140 мкл іммобілізованого антитіла. Тестовий планшет(и) потім герметично закривають та інкубують протягом 1,0 години ± 5 хвилин при 37 °C ± 2,0 °C. Знову планшети відмивають тричі буфером відмивки, затосовуючи ультравідмивку разом із мікротитровою машиною для відмивки планшетів (виставленою при 250 мкл/відмивка, 3 відмивки, без періоду замочування). Після останньої відмивки планшети викладають різьбою на паперовий рушник. Потім готують кон'югат розчинника додаванням 1 % нормальної кролячої сироватки до розчинника Наприклад для чотирьох планшетів 420 мкл нормальної кролячої сироватки додають до 42 мл розчинника. Кон'югат антитіла розводять до 1:10,000, або будь-яким відповідним робочим розведенням у свіжо приготовленому розчині кон'югату розчинника до всіх лунок тестового планшета(ів). Застосовуючи метод зворотного дозування, 100 мкл цього розведеного кон'югату антитіла додають до всіх лунок. Тестовий планшет(и) потім герметично закривають та інкубують протягом 45±5 хвилин при 37 °C ± 2,0 °C. Переважно, планшети не складають один на другого. 6 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 Планшети відмивають тричі буфером відмивки, застосовуючи ультравідмивку разом із мікротитровою машиною для відмивки планшетів (виставленою при 250 мкл/відмивка, 3 відмивки, без періоду замочування). Після останньої відмивки планшети викладають різьбою на паперовий рушник. Потім еквівалентні об'єми ТМВ пероксидазного субстрату (Реагент А) з розчином пероксидази В (Реагент В) змішують безпосередньо перед використанням. Кількості для змішування можуть змінюватися в залежності від кількості планшетів, але кожний планшет потребує 10 мл/планшет + 2 мл. Таким чином, для 4 планшетів, необхідно 21 мл Реагента А + 21 мл Реаенту В. Використовуючи метод зворотного дозування, 100 мкл субстрату додають до всіх лунок тестового планшета(ів). Планшети потім інкубують при кімнатній температурі протягом 15 хвилин + 15 секунд. Реакція зупиняється при додаванні 100 мкл IN HCl розчину до всіх лунок, використовуючи метод зворотного дозування. Потім включають планшетний зчитувач ФСІСВ і проходять через його діагностичні фази та фази тестування стандартним чином. Наступний аспект винаходу стосується способу конструювання рекомбінантного вірусного вектора, що містить ДНК ЦВС2 BPЗ2 і експресує ЦВС2 BPЗ2 протеїн у великій кількості, у випадку зараження чутливих клітин. Несподівано відкрили, що рекомбінантний вірусний вектор, що забезпечується даним винаходом, експресує велику кількість, як зазначено вище, ЦВС2 BPЗ2 після зараження чутливих клітин. Таким чином, даний винахід також стосується покращеного способу отримання та/або відновлення ЦВС2 BPЗ2 протеїну, що переважно включає етап: конструювання рекомбінантного вірусного вектора, що містить ДНК ЦВС2 BPЗ2 та експресує ЦВС2 BPЗ2 протеїн. Переважно, вірусний вектор є рекомбінантним бакуловірусом. Деталі способу конструювання рекомбінантних вірусних векторів, що містять ДНК ЦВС2 BPЗ2 та експресують ЦВС2 BPЗ2 протеїн, що забезпечується даним винаходом, описуються далі: в переважних формах рекомбінантний вірусний вектор, що містить ДНК ЦВС2 BPЗ2 та експресує ЦВС2 BPЗ2 протеїн, що використовується для інфікування клітин, отримують трансфекцією вектора трансфекції, що має BPЗ2 ген, клонований у вірусний вектор. Переважно, тільки ділянка вектора трасфектується у вірусний вектор, що містить ДНК BPЗ2. Термін "трансфектований у вірусний вектор" означає та використовується як синонім для "той, що вносить" або "той, що клонує" гетерогенну ДНК у вірусний вектор, а саме, наприклад, у вектор бакуловірусу. Вірусний вектор є переважно, але необов'язково бакуловірусом. Таким чином, відповідно до наступного аспекту даного винаходу, рекомбінантний вірусний вектор отримують шляхом рекомбінації між вектором трансфекції, що містить гетерогенну ДНК ЦВС2 BPЗ2, а також вірусним вектором, переважно, бакуловірусом, навіть переважніше лінеаризованим нездатним до реплікації бакуловірусом, (а саме, Baculo Gold ДНК). "Вектор трансфекції" означає молекулу ДНК, що включає щонайменше одне джерело реплікації, гетерогенний ген, в даному випадку ЦВС2 BPЗ2, та ДНК послідовності, які уможливлюють клонування згаданого гетерогенного гену у вірусний вектор. Переважно послідовності, які уможливлюють клонування гетерогенного гену в вірусний вектор, являють собою гетерогенний ген, що фланкує. Навіть переважніше ці послідовності, що фланкують, є щонайменше гетерогенними в ділянках з послідовностями вірусного вектора. Гомологія послідовності, таким чином, уможливлює рекомбінацію обох молекул, вірусного вектора та вектора трансфекції, для отримання рекомбінантного вірусного вектора, що містить гетерогенний ген. Одним з переважних векторів для трансфекції є pVL1392 вектор (BD Biosciences Pharmingen), який призначений для сумісной трансфекції з BaculoGold ДНК в переважно Sf+ клітинну лінію. Переважно, згаданий вектор трансфекції містить ЦВС2 BPЗ2 ДНК. Даний конструкт сумісно трансфектується з приблизно 10,387 пар основ по довжині. В більш переважних формах способи за даним винаходом будуть починатися з ізоляції ДНК ЦВС2 BPЗ2. Взагалі, це може відбуватися з відомого або невідомого штаму, тому що ДНК BPЗ2 виявляється високо консервативною з щонайменше близько 95 % ідентичністю послідовності між різними ізолятами. Будь-який ЦВС2 BPЗ2 ген, відомий з рівня техніки, може бути використаний для цілей даного винаходу, якщо кожний такий ген може бути експресованим в супернатант. ДНК ЦВС BPЗ2 є переважно ампліфікованою з використанням методів ПЛР, навіть переважніше разом із вставкою 5' консенсусної послідовності Козака, що фланкує (CCGCCAUG) (SEQ ID NO 1) та/або 3' сайтом EcoRl, що фланкує (GAATTC) (SEQ ID NO 2). Така вставка 5' консенсусу Козака переважно видаляє природний стартовий кодон AUG ЦВС2 BPЗ2. Сайт 3' EcoRl вставляється переважно після стоп-кодону ЦВС2 BPЗ2. Переважніше він вставляється після послідовності, що термінує полі А транскрипцію, яка локалізована після стоп-кодону ЦВС2 BPЗ2. Було відкрито, що таке застосування послідовності консенсусу Козака, зокрема, як описано вище, підвищує рівень експресії послідовності ЦВС2 BPЗ2 протеїну. Ампліфіковану ДНК ЦВС2 BPЗ2 з цими додатковими послідовностями, клонують у вектор. Переважним 7 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 вектором для цього ініціального етапу клонування є pGEM-T-Easy Вектор (Promega, Madison, WI). ДНК ЦВС2 BPЗ2, що включає деякі послідовності pGEM вектора (SEQ ID NO: 7) є переважно вирізаною з вектора в сайті рестрикції Notl. Отриману ДНК потім клонують у вектор трансфекції. Таким чином, в одному аспекті даного винаходу забезпечується спосіб для конструювання рекомбінантного вірусного вектора, що містить ЦВС2 BPЗ2 ДНК. Цей спосіб включає етапи: і) клонування рекомбінантного ЦВС2 BPЗ2 в вектор трансфекції; та іі) трансфекцію ділянки вектора трансфекції, що містить рекомбінантний ЦВС2 BPЗ2, у вірусний вектор, для створення рекомбінантного вірусного вектора. Переважно, вектор трансфекції є таким, як описано вище, або конструюється, як описано вище, або як показано прикладом на Фігурі 1. Таким чином відповідно до наступного аспекту, вектор трансфекції, застосований для конструювання рекомбінантного вірусного вектора, як описано тут, містить послідовність SEQ ID NO: 7. Відповідно до наступного аспекту, даний спосіб також містить перед етапом і) наступний етап: ампліфікація ДНК ЦВС2 BPЗ2 in vitro, де фланкуючі послідовності ДНК ЦВС2 BPЗ2, модифікують як описано вище. Способи in vitro ампліфікування ЦВС2 BPЗ2 ДНК та модифікування фланкуючих послідовностей, клонування in vitro ампліфікованих ДНК ЦВС2 BPЗ2 у вектор трансфекції та відповідних векторів трансфекції описаних вище, показано прикладом на Фігурі 1, або вони відомі фахівцю в даній галузі. Таким чином, відповідно до наступного аспекту даний винахід стосується способу конструювання рекомбінантного вірусного вектора, що містить ДНК ЦВС2 BPЗ2 та експресує 1ДВС2 BPЗ2 протеїн, який включає етапи: і) амліфікування ДНК ЦВС2 BPЗ2 in vitro, де модифікують фланкуючі послідовності згаданої ДНК ЦВС2 BPЗ2, іі) клонування ампліфікованої ДНК ЦВС2 BPЗ2 у вектор трансфекції; та ііі) трансфекції вектора трансфекції або його ділянки, що містить рекомбінантну ДНК ЦВС2 BPЗ2 у вірусний вектор для утворення рекомбінантного вірусного вектора. Переважно, модифікацію фланкуючих послідовностей ДНК ІДВС2 BPЗ2 проводять як описано вище, а саме, шляхом вставки 5' послідовності Козака та/або сайта a'EcoR 1, переважно як описано вище. Відповідно до наступного аспект, забезпечується спосіб отримання та/або відновлення рекомбінантного протеїну, експресованого відкритою рамкою зчитування 2 ЦВС2. Спосіб загалом містить етапи: і) клонування рекомбінантного ЦВС2 BPЗ2 у вектор трансфекції; іі) трансфекцію ділянки вектора трансфекції, що містить рекомбінантний ЦВС2 BPЗ2, у вірус; ііі) зараження клітин в середовищі з трансфікованим вірусом; iv) викликання трансфікованим вірусом експресії рекомбінантного протеїну з ЦВС2 BPЗ2; v) сепарація клітин з супернатанту; та vi) відновлення експресованого ЦВС2 BPЗ2 протеїну з супернатанту. Способи клонування рекомбінантної ДНК ЦВС2 BPЗ2 у вектор трансфекції описано вище. Переважно, вектор трансфекції містить послідовність SEQ ID NO:3, SEQ ID N0:4, SEQ ID N0:7. Проте, вектор трансфекції може містити ДНК ЦВС2 BPЗ2, немодифіковану або модифіковану, довжиною як ДНК ЦВС2 BPЗ2, якщо він трансфектується в рекомбінантний вірусний вектор, експресований в клітинній культурі. Переважно, рекомбінантний вірусний вектор містить послідовність SEQ ID N0:8. Крім того, способи інфікування клітини, переважно інфікування клітин комах визначеною кількістю рекомбінантного бакуловірусу, що містить ЦВС2 BPЗ2 ДНК та експресує ЦВС2 BPЗ2 протеїн детально описано вище. Крім того, етапи сепарації клітин з супернатанту, а також етапи відновлення експресованого ЦВС2 BPЗ2 протеїну також детально описано вище. Будь-які специфічні етапи процесу, як описано тут, є ділянкою способу отримання та/або відновлення рекомбінантного протеїну, експресованого відкритою рамкою зчитування 2 ЦВС2, як описано вище. Переважно, клітини являють собою SF+ клітини. Навіть більш переважно, клітинні культури з кількістю клітин близько 0,3-2,0 × 106 клітин/мл, переважніше близько 0,35-1,9 × 106 клітин/мл, також переважніше близько 0,4-1,8 × 106 клітин/мл, навіть переважніше близько 0,451,7 × 106 клітин/мл, та найпереважніше близько 0,5-1,5 × 106 клітин/мл. Переважно, рекомбінантний вірусний вектор, що містить ДНК ЦВС2 BPЗ2, має переважну множинність зараження (МОI) близько 0,03-1,5, більш переважно близько 0,05-1,3, також переважніше близько 0,09-1,1, також переважніше близько 0,1-1,0, і найпереважніше до близько 0,5, якщо використовують для зараження чутливих клітин. Переважно, відновлення ЦВС2 BPЗ2 протеїну в супернатанті клітин, отриманих на 5-8 день після зараження та/або клітинна життєздатність знижується до менш ніж 10 %. Переважно, для отримання ЦВС2 BPЗ2 протеїну, клітини культивують при 25-29 °C. Переважно, етап сепарації являє собою етап центрифугування або фільтрації. Необов'язково, цей спосіб може включати етап ампліфікації ДНК ЦВС2 BPЗ2 зі штаму ЦВС2 перед клонуванням ДНК ЦВС2 BPЗ2 у вектор трансфекції, в переважних формах також можуть додавати 5' послідовність Козака, сайт 3' EcoRl, а також їх комбінацію для ампліфікованої послідовності, переважно перед або протягом ампліфікації. Переважна 5' послідовність Козака містить SEQ ID NO: 1. Переважний сайт 3' EcoRl містить SEQ ID NO: 2. 8 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважна ДНК ЦВС2 BPЗ2 містить нуклеотидну послідовність Genbank Accession (Доступ Генбанку) № AF086834 (SEQ ID NO: 3) і SEQ ID NO: 4. Переважний рекомбінантний ЦВС2 BPЗ2 протеїн містить амінокислотну послідовність SEQ ID NO: 5, яка є протеїном, закодованим SEQ ID NO: 3 (Genbank Accession № AF086834) і SEQ ID No: 6, яка є протеїном, закодованим SEQ ID NO: 4. Переважні середовища містять середовища клітин комах, вільні від сироватки, також переважніше Excell 420 середовища. Якщо проводять необов'язковий етап ампліфікації, преважним є спочатку клонування ампліфікованої відкритої рамки зчитування 2 у перший вектор, вирізання відкритої рамки зчитування 2 із першого вектора, застосування вирізаної відкритої рамки зчитування для клонування у вектор трансфекції. Переважною клітинною лінією для сумісної трансфекції є SF+ клітинна лінія. Переважним вірусом для сумісної трансфекції є бакуловірус. У переважних формах цього способу, трансфікована ділянка вектора трансфекції містить SEQ ID NO: 8. Нарешті, для цього способу, переважним є відновлення протеїну ЦВС2 відкритої рамки зчитування 2 (BPЗ2) в супернатанті культури клітин щонайменше 5 днів після зараження клітин вірусом. Таким чином, наступний аспект винаходу стосується способу отримання та/або відновлення ЦВС2 відкритої рамки зчитування 2, який містить етапи: і) ампліфікація ДНК ЦВС2 BPЗ2 in vitro, переважно додаванням 5' послідовності Козака та/або додаванням рестрикційного сайта 3' EcoRl, ii) клонування ампліфікованої ЦВС2 BPЗ2 у вектор трансфекції; ііі) трансфекція ділянки вектора трансфекції, що містить рекомбінантний ЦВС2 BPЗ2, у вірус; iv) зараження клітин в середовищах з трансфікованим вірусом; v) викликання трансфікованим вірусом експресії рекомбінантного протеїну з ЦВС2 BPЗ2; vi) сепарація клітин з супернатанту; та vii) відновлення експресованого ЦВС2 BPЗ2 протеїну з супернатанту. Наступний аспект даного винаходу стосується способу приготування композиції, що включає ЦВС2 BPЗ2 протеїн, а також інактивований вірусний вектор. Цей спосіб містить етапи: і) клонування ампліфікованої ЦВС2 BPЗ2 у вектор трансфекції; іі) трансфекція ділянки вектора трансфекції, що містить рекомбінантний ЦВС2 BPЗ2 у вірус; ііі) зараження клітин в середовищах з трансфікованим вірусним вектором; iv) викликання трансфікованим вірусним вектором експресії рекомбінантного протеїну з ЦВС2 BPЗ2; v) сепарація клітин з супернатанту; vi) відновлення експресованого ЦВС2 BPЗ2 протеїну з супернатанту; та vii) інактивування рекомбінантного вірусного вектора. Переважно, рекомбінантний вірусний вектор є бакуловірусом, що містить BPЗ2 ДНК, яка кодує послідовності, клітини являють собою SF+ клітини. Переважні етапи сепарації є такими, як описано вище, найбільш переважним є етап фільтрації. Переважними етапами інактивації є такі, як описано вище. Переважно, інактивацію проводять при близько 35-39 °C і в присутності від 2 до 8 мМ БЕІ, також переважніше в присутності близько 5 мМ БЕІ. Несподівано винайшли, що більш високі концентрації БЕІ негативно впливають на ЦВС2 BPЗ2 протеїн, а більш низькі концентрації не є ефективними для інактивації вірусного вектора протягом 24-72 годин інактивації. Переважно, інактивацію проводять протягом щонайменше 24 годин, навіть переважніше протягом 24-72 годин. Відповідно до наступного аспекту, спосіб приготування композиції, що включає ЦВС2 BPЗ2 протеїн, а також інактивований вірусний вектор, як описано вище, також включає етап нейтралізації після етапу vii). Цей етап viii) містить додавання еквівалентної кількості агента для нейтралізації, що нейтралізує агент інактивації в розчин. Переважно, якщо агент інактивації являє собою БЕІ, то переважним є додавання еквівалентної кількості тіосульфонату натрію. Таким чином, відповідно до наступного аспекту, етап viii) включає додавання розчину натрію тіосульфонату до кінцевої концентрації від близько 1 до близько 20 мМ, переважно від близько 2 до близько 10 мМ, також переважніше від близько 2 до близько 8 мМ, також переважніше від близько 3 до близько 7 мМ, найпереважніше від близько 5 мМ, якщо агентом інактивації є БЕІ. Відповідно до наступного аспекту, спосіб приготування композиції, що містить ЦВС2 BPЗ2 протеїн, а також інактивований вірусний вектор, як описано вище, містить перед етапом і) наступний етап: ампліфікація ЦВС2 BPЗ2 ДНК in vitro, де фланкуючі послідовності ДНК ЦВС2 BPЗ2 модифікують як описано вище. In vitro способи ампліфікації ДНК ЦВС2 BPЗ2 та модифікації фланкуючих послідовностей, клонування in vitro ампіфікованої ДНК ЦВС2 BPЗ2 у вектор трансфекції і відповідні вектори трансфекції, що описано вище, показано прикладом на Фігурі 1, або вони є відомими фахівцю в даній галузі. Таким чином, відповідно до наступного аспекту, цей спосіб містить етапи: і) ампліфікація ДНК ЦВС2 BPЗ2 in vitro, де фланкуючі послідовності згаданої ДНК ЦВС2 BPЗ2 модифікують, іі) клонування ампіфікованої ЦВС2 BPЗ2 ДНК у вектор трансфекції; та ііі) трансфекція вектора трансфекції або його ділянки, що містить рекомбінантну ДНК ЦВС2 BPЗ2, у вірусний вектор для отримання рекомбінантного вірусного вектора, iv) зараження клітин в середовищі з трансфікованим вірусом; v) викликання трансфікованим вірусом експресії рекомбінантного 9 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 протеїну з ЦВС2 BPЗ2; vi) сепарація клітини з супернатанту; vii) відновлення експресованого ЦВС2 BPЗ2 протеїну з супернатанту; viii) інактивація рекомбінантного вірусного вектора, переважно в присутності від близько 1 до близько 20 мМ БЕІ, найбільш переважний в присутності від близько 5 мМ БЕІ; та іх) додавання еквівалентної кількості агента, що нейтралізує агент інактивації в розчині, переважно, додавання розчину натрію тіосульфонату до кінцевої концентрації від близько 1 до близько 20 мМ, переважно від близько 5 мМ, якщо агент інактивації являє собою БЕІ. В іншому аспекті даного винаходу забезпечується спосіб приготування композиції, переважно антигенної композиції, такої як, наприклад, вакцина, для викликання імунної відповіді проти ЦВС2. В цілому спосіб включає етапи трансфекції конструкту у вірус, де конструкт містить і) рекомбінантний ДНК з BPЗ2 ЦВС2, іі) зараження клітин в живильних середовищах з трансфікованим вірусом, ііі) викликання вірусом експресії рекомбінантного протеїну з ЦВС2 BPЗ2, iv) відновлення експресованого BPЗ2 протеїну з супернатанту, і v) приготування композиції комбінуванням відновленного протеїну з відповідною допоміжною речовиною та/або іншим фармацевтично прийнятним носієм. Вираз "допоміжні речовини", який використовується в даному описі, може включати алюмінію гідроксид та алюмінію фосфат, сапоніни, а саме, Quil A, QS-21 (Cambridge Biotech Inc., Cambridge MA), GPI-0100 (Galenica Pharmaceuticals, Lac, Birmingham, AL), емульсія вода-в-олії, емульсія олія-у-воді, емульсія вода-в-олії-у-воді. Емульсія може бути на основі, зокрема, легкої рідкой парафінової олії (European Pharmacopea type); ізопреноїдної олії, такої як сквалан або сквален; олії, отриманої в результаті теолігомеризації алкенів, зокрема, ізобутену або декену; естерів кислот або спиртів, що містить лінійну алкільну групу, більш детально, рослинних олій, етилолеату, пропіленгліколь ди-(каприлату/капрату), гліцерил три(каприлату/капрату) або пропіленгліколь діолеату; естерів розгалужених жирних кислот або спиртів, зокрема, естерів ізостераринової кислоти. Для формування емульсії олію використовують в комбінації з емульсифікаторами. Емульсифікаторами є переважно неіонні сурфактанти, зокрема естери сорбітану, маніду (а саме, ангідроманітол олеат), гліколю, полігліцеролу, пропіленкліколю та олеїнової, ізостеаринової, рицинолеїнової або гідроксистеаринової кислоти, які є необов'язково етоксильованими, а також поліоксипропіленполіоксиетилен блок-співполімери, зокрема, плюронилові продукти, особливо L121. Дивись Hunter et al., The Theory і Practical Application of Adjuvantes (Ed.Stewart-Tull, D. E. S.). John Wiley і Sons, NY, pp51-94 (1995) і Todd et al., Vaccine 15:564-570 (1997). Наприклад, можливо використовувати SPT емульсію, описану на сторінці 147 "Vaccine Design, The Subunit і Adjuvant Approach" в редакції M. Powell і М. Newman, Plenum Press, 1995, а також емульсію MF59, описану на сторінці 183 тієї ж книги. Наступним окермим прикладом допоміжної речовини є сполука, вибрана з полімерів акрилової та метакрилової кислоти та співполімерів малеїнового ангидрида та алкенилової похідної. Переважними допоміжними сполуками є поперечнозшиті полімери акрилової або метакрилової кислоти, особливо, з поліалкеніловими етерами цукрів або поліспиртів. Ці сполуки відомі під назвою карбомер (Phameuropa Vol. 8, № 2, June 1996). Фахівці в даній галузі можуть також посилатися на патент США № 2909462, що описує такі полімери, поперечнозшиті з полігідроксильованою сполукою, що має щонайменше 3 гідроксильні групи, переважно не більше, ніж 8, атоми водню щонайменше трьох гідроксилів розташовані на аліфатичних радикалах, які мають щонайменше 2 атоми вуглецю. Переважними радикалами є такі, що містять від 2 до 4 атомів вуглецю, а саме, вініли, аліли та інші етиленові ненасичені групи. Ненасичені радикали можуть самі містити інші замісники, такі як метил. Продукти, що продають під назвою Карбопол; (BF Goodrich, Ohio, USA) є частково придатними. Це поперечнозшиті з алілсахарозою або з алілпентаерититолом. Можна навести три з них Карбопол 974Р, 934Р і 971P. Найбільш переважним є використання Карбополу 971P. Серед співполімерів малеїнового ангідриду і алкенілових похідних існують співполімери ЕМА (Monsanto), які є співполімерами малеїнового ангідриду та етилену. Нерозчинення цих співполімерів у воді приводить до розчинення в кислоті, яку необхідно нейтралізувати, переважно до фізіологічної рН, для отримання допоміжного розчину, в який буде включена імуногенна, імунологічна або вакцинна композиція. Також придатні допоміжні речовини включають RIBI систему допоміжних речовин (Ribi Inc.), блок-співполімери (CytRx, Atlanta GA), SAF-M (Chiron, Emeryville CA), монофосфориловий ліпид А, ліпід-амінова допоміжна речовина арвідин, теплолабільний ентеротоксин з Е. Соlі (рекомбінантний або будь-який), токсин холери, IMS 1314 або мураміловий дипептид серед багатьох інших, але не обмежуються ними. Переважно, допоміжна речовина додається в 10 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 кількості від близько 100 мкг до близько 10 мг на дозу. Навіть переважніше допоміжна речовина додається в кількості від близько 100 мкг до близько 10 мг на дозу. Навіть переважніше допоміжна речовина додається в кількості від близько 500 мкг до близько 5 мг на дозу. Навіть переважніше допоміжна речовина додається в кількості від близько 750 мкг до близько 2,5 мг на дозу. Найбільш переважний допоміжна речовина додається в кількості від близько 1 мг на дозу. Таким чином, відповідно до наступного аспекту, спосіб приготування антигенної композиції, такої як, наприклад, вакцина, для викликання імунної відповіді проти ЦВС2 містить і) приготування та відновлення ЦВС2 BPЗ2 протеїну, та іі) змішування його з придатною допоміжною речовиною. Переважно, допоміжною речовиною є Карбопол 97IP. Навіть більш переважно Карбопол 971P додають в кількості від близько 500 мкг до близько 5 мг на дозу, навіть переважніше в кількості від близько 750 мкг до близько 2,5 мг на дозу та найпереважніше в кількості від близько 1 мг на дозу. Переважно, етап процесу і) включає етапи процесу, що описані для приготування і відновлення ЦВС2 BPЗ2. Наприклад, в переважних формах цього способу конструкт, що містить ЦВС2 BPЗ2 ДНК, отримують у векторі трансфекції. Придатні вектори трансфекції та способи їх приготування описано вище. Необов'язково, спосіб може включати етап ампліфікації BPЗ2 зі штаму ЦВС2 шляхом ПЛР перед клонуванням BPЗ2 у вектор трансфекції. Переважні відкрита рамка зчитування послідовності, послідовності Козака, послідовності сайта 3' EcoRl, послідовності рекомбінантного протеїну, послідовності трансфікованого конструкту, середовища, клітини, а також віруси є такими, як описано в попередніх способах. Інший необов'язковий етап цього способу включає клонування ампліфікованої ЦВС2 BPЗ2 ДНК в перший вектор, вирізання BPЗ2 ДНК з цього першого вектора, та використання цієї вирізаної ЦВС2 BPЗ2 ДНК для клонування у вектор трансфекції. Як і в інших способах, переважним є очікування протягом щонайменше 5 днів після зараження клітин трансфікованим бакуловірусом перед відновленням рекомбінантного BPЗ2 протеїну з супернатанту. Переважно, етап відновлення за цим способом також включає етап сепарації середовища від клітин та клітинних уламків. Це може бути зроблено багатьма способами, але для швидкості та зручності переважним є відфільтрувати клітини, клітинні уламки, а також живильні середовища крізь фільтр з розміром пор від 0,45 мкм до близько 1,0 мкм. Нарешті, для цього способу переважним є включити етап інактивації вірусу перед об'єднанням відновленного рекомбінантного ЦВС2 BPЗ2 протеїну в композицію. Це може бути зроблено різними способами, але переважно при проведення даного винаходу застосовують БЕІ. Таким чином, відповідно до наступного аспекту цей спосіб містить етапи: і) ампліфікація ЦВС2 BPЗ2 ДНК in vitro, де фланкуючі послідовності згаданого ЦВС2 BPЗ2 ДНК модифікують, іі) клонування ампліфікованої ЦВС2 BPЗ2 ДНК в вектор трансфекції; та ііі) трансфекція вектора трансфекції або його ділянки, що містить рекомбінантну ЦВС2 BPЗ2 ДНК у вірусний вектор для отримання рекомбінантного вірусного вектора, iv) зараження клітин в середовищах з трансфікованим вірусом; v) викликання трансфектованим вірусом експресії рекомбінантного протеїну з ЦВС2 BPЗ2; vi) сепарація клітин з супернатанту; vii) відновлення експресованого ЦВС2 BPЗ2 протеїну з супернатанту; viii) інактивація рекомбінантного вірусного вектора, переважно, в присутності від близько 1 до близько 20 мМ БЕІ, найпереважніше в присутності від близько 5 мМ БЕІ; іх) додавання еквівалентної кількості агента, що нейтралізує агент інактивації в розчині, переважно, додавання розчину натрію тіосульфонату до кінцевої концентрації від близько 1 до близько 20 мМ, переважно від близько 5 мМ, якщо агентом інактивації є БЕІ, та х) додавання відповідної кількості допоміжної речовини, переважно додавання Карбополу, переважніше Карбопол 97 IP, навіть більш переважно в кількості, як описано вище (а саме, від близько 500 мкг до близько 5 мг на дозу, навіть переважніше в кількості від близько 750 мкг до близько 2,5 мг на дозу та найпереважніше в кількості від близько 1 мг на дозу). Крім того, композиція може включати один або декілька фармацевтично придатних носіїв. Вислів "фармацевтично придатний носій", що використовується в даному описі включає будьякий розчинник, середовища дисперсії, покриття, агенти, що стабілізують, розріджувачі, консерванти, антибактеріальні та протигрибкові агенти, ізотонічні агенти, агенти, що уповільнюють адсорбцію і подібне. Найбільш переважно, композиція, що забезпечується даним винаходом, містить ЦВС2 BPЗ2 протеїн, відновлений з супернатанту in vitro культивованих клітин, де згадані клітини інфікують рекомбінантним вірусним вектором, що містить ЦВС2 BPЗ2 ДНК та експресує ЦВС2 BPЗ2 протеїн, а також де згадану культуру клітин обробляють для інактивації вірусного вектора, та еквівалентну концентрацію агента нейтралізації, переважно розчину натрію тіосульфонату до кінцевої концентрації від близько 2 до близько 8 мМ, переважно від близько 5 мМ, Карбопол, переважніше Карбопол 97 IP, переважно в кількості від близько 500 мкг до близько 5 мг на дозу, навіть більш переважно в кількості від близько 750 мкг до близько 2,5 мг на дозу та найпереважніше в кількості від близько 1 мг на дозу, а також 11 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 фізіологічний сольовий розчин, переважно в кількості від близько 50 до близько 90 % (об'єм / об'єм), переважніше від близько 60 до 80 % (об'єм / об'єм), також переважніше від близько 70 % (об'єм / об'єм). Таким чином, наступний аспект стосується способу приготування антигенної композиції, такої як, наприклад, вакцина, для викликання імунної відповіді проти ЦВС2, що містить етапи: і) ампліфікація ДНК ЦВС2 BPЗ2 in vitro, де фланкуючі послідовності згаданої ДНК ЦВС2 BPЗ2 модифікують, іі) клонування ампліфікованої ДНК ЦВС2 BPЗ2 у вектор трансфекції; та ііі) тррансфекція вектора трансфекції або його ділянки, що містить рекомбінантну ДНК ЦВС2 BPЗ2 у вірусний вектор для отримання рекомбінантного вірусного вектора, iv) зараження клітин в середовищах з трансфікованим вірусом; v) викликання трансфікованим вірусом експресії рекомбінантного протеїну з ЦВС2 BPЗ2; vi) сепарація клітин з супернатанту; vii) відновлення експресованого ЦВС2 BPЗ2 протеїну супернатанту; viii) інактивація рекомбінантного вірусного вектора, переважно, в присутності від близько 2 до близько 20 мМ БЕІ, найпереважніше в присутності від близько 5 мМ БЕІ; іх) додавання еквівалентної кількості агента, що нейтралізує агент інактивації в розчині, переважно, додавання розчину натрію тіосульфонату до кінцевої концентрації від близько 0,5 до близько 20 мМ, переважно від близько 5 мМ, якщо агентом інактивації є БЕІ, х) додавання відповідної кількості допоміжнихх речовин, переважно додавання Карбополу, переважніше Карбопол 97 IP, також переважніше в кількості, як описано вище (а саме, від близько 500 мкг до близько 5 мг на дозу, навіть переважніше в кількості від близько 750 мкг до близько 2,5 мг на дозу та найпереважніше в кількості від близько 1 мг на дозу); та хі) додавання фізіологічного розчину, переважно в кількості від близько 50 до близько 90 % (об'єм/ об'єм), більш переважно від близько 60 до 80 % (об'єм/ об'єм), також переважніше близько 70 % (об'єм/ об'єм). Необов'язково, цей спосіб може також включати додавання захисної речовини. Захисна речовина, що використовується в даному описі, відноситься до антимікробіологічного активного агента, такого як, наприклад гентаміцин, мертіолат і подібні. Зокрема, додавання захисної речовини є найбільш переважним для приготування композиція багаторазової дози. Ці антимікробіологічні активні агенти додають в концентраціях, ефективних для попередження будь-якого мікобіологічного зараження зазначеної композиції або для інгібування будь-якого мікобіологічного росту в зазначеній композиції. Крім того, цей спосіб може також включати додавання будь-якого агента, що стабілізує, такого як, наприклад, сахариди, треалоза, манітол, сахароза і подібні, для збільшення та/або підтримання тривалості зберігання. Проте, несподівано винайшли, що отримана формуляція має імунологічний ефект вище періоду щонайменше 24 місяців, без додавання будь-якого додаткового агента, що стабілізує. Наступний аспект даного винаходу стосується продуктів, що отримують способами, як описано вище. Зокрема, даний винахід стосується композиції речовин, що містить рекомбінантно експресований ЦВС2 BPЗ2 протеїн. Крім того, даний винахід також стосується композиції речовин, що містить рекомбінантно експресований ЦВС2 BPЗ2 протеїн, відновлений в супернатанті культури клітин комах. Крім того, даний винахід також стосується композиції речовин, що містить рекомбінантно експресований ЦВС2 BPЗ2 протеїн, відновлений в супернатанті культури клітин комах. Переважно, ця композиція речовин також містить агент, придатний для інактивації вірусних векторів. Переважно, згаданий агент інактивації являє собою БЕІ. Крім того, даний винахід також стосується композиції речовин, що містить рекомбінантно експресований ЦВС2 BPЗ2 протеїн, відновлений в супернатанті культури клітин комах, а також містить агент, придатний для інактивації вірусних векторів, переважно БЕІ і агент, що нейтралізує, для нейтралізації агента інактивації. Переважно, цей агент, що нейтралізує, являє собою натрію тіосульфонат, якщо як агент інактивації використовують БЕІ Також в іншому аспекті даного винаходу забезпечується імуногенна композиція, що викликає імунну відповідь і, більш переважно, забезпечує захисний імунітет проти клінічних симптомів інфекції ЦВС2. Композиція загалом містить поліпептид, або його фрагмент, експресований відкритою рамкою зчитування 2 (BPЗ2) ЦВС2, як антигенний компонент композиції. ДНК ЦВС2 BPЗ2 і протеїн, який використовується в данному описі для приготування композицій, а також який використовується в процесах, що забезпечуються даним внаходом, являє собою висококонсенрвативний домен всередині ЦВС2 ізолятів і, таким чином, будь-яка ЦВС2 BPЗ2 бути ефективною в якості джерела для ДНК ЦВС BPЗ2 та/або поліпептиду, як використовується в даному описі. Переважний ЦВС2 BPЗ2 протеїн є протеїн з SEQ ID NO: 11. Переважний ЦВС BPЗ2 поліпептид забезпечується даним описом як SEQ ID NO: 5, але фахівцям в даній галузі зрозуміло, що ця послідовність може змінюватися на 6-10 % в гомології послідовності, при цьому зберігаючи антигенні характеристики, що доводять доцільність її використання в імуногенних композиціях. Антигенні характеристики імунологічної композиції 12 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 можуть бути, наприклад, оцінені в експерименті з контрольним зараженням, передбаченому прикладом 4. Крім того, антигенна характеристика модифікованого антигена зберігається, якщо модифікований агент забезпечує щонайменше 70 %, переважно 80 %, переважніше 90 % захисного імунітету порівняно з ЦВС2 BPЗ2 протеїном, кодований полінуклеотидною послідовністю з SEQ ID NO: 3 або SEQ ID NO: 4. Вираз "імуногенна композиція", що використовується в даному описі, означає ЦВС2 BPЗ2 протеїн, що проявляє "імунологічну відповідь" у хазяїні у виді клітинної та/або викликаної антитілом імунної відповіді на ЦВС2 BPЗ2 протеїн. Переважно, ця імуногенна композиція здатна викликати захисний імунітет проти інфекції ЦВС2, а також клінічних симптомів, пов'язаних з цією інфекцією. В деяких формах імуногенні ділянки ЦВС2 BPЗ2 протеїну використовують в якості антигенного компоненту в композиції. Вираз "імуногенна ділянка", який використовують в даному описі, відноститься до скорочених та/або заміщених форм, або фрагментів ЦВС2 BPЗ2 протеїну та/або полінуклеотиду, відповідно. Переважно, такі скорочені та/або заміщені форми, або фрагменти будуть включати щонайменше 6 суміжних аминокислот з BPЗ2 поліпептиду повної довжини. Більш переважно, скорочені або заміщені форми, або фрагменти будуть мати щонайменше 10, переважніше щонайменше 15, а також переважніше щонайменше 19 суміжних аминокислот з BPЗ2 поліпептиду повної довжини. Дві переважні послідовності в цьому випадку, що забезпечуються даним описом, являють собою SEQ ID NO: 9 і 10, Також зрозуміло, що такі послідовності можуть бути ділянкою більшого фрагменту або скорочених форм. Наступний переважний ЦВС2 BPЗ2 поліпептид, що забезпечується даним винаходом, є кодованими нуклеотидними послідовностями SEQ ID NO: 3 або SEQ ID NO: 4. Але фахівцям в даній галузі зрозуміло, що ця послідовність може змінюватись в діапазоні 6-20 % в гомології послідовності, при цьому зберігаючи антигенні характеристики, що доводять доцільність її використання в імуногенних композиціях. В деяких формах застосовують скорочену або заміщену форму, або фрагмент BPЗ2 в якості антигенного компоненту композиції. Переважно, такі скорочені або заміщені форми, або фрагменти будуть включати щонайменше 18 суміжних нуклеотидів з нуклеотидної послідовності BPЗ2 повної довжини, а саме з SEQ ID NO: 3 або SEQ ID NO: 4. Більш переважно, скорочені або заміщені форми, або фрагменти будуть мати щонайменше 30, переважніше щонайменше 45, а також переважніше щонайменше 57 суміжних нуклеотидів з нуклеотидної послідовності BPЗ2 повної довжини, а саме з SEQ ID NO: 3 або SEQ ID NO: 4. "Ідентичність послідовності", як відомо в даній галузі, відноститься до взаємодії між двома або більше поліпептидними послідовностями або двома або більше полінуклеотидними послідовностями, а саме стандартна послідовність і отримана послідовність, яку порівнюють зі стандартною послідовністю. Ідентичність послідовності визначається шляхом порівняння отриманої послідовності зі стандартною послідовністю після того, як ці послідовності оптимально вирівнюють для отримання подібності послідовності високого ступеня, що визначається порівнянням між ланцюгами таких послідовностей. Під час такого вирівнювання, ідентичність послідовності визначається на основі положення-за-положенням, а саме, послідовності є "ідентичними" в окремому положенні, якщо в цьому положенні нуклеотиди або амінокислотні залишки є ідентичними. Загальна кількість таких ідентичностей положень потім виводиться за допомогою загальної кількості нуклеотидів або залишків у стандартній послідовності, що дає відсоток ідентичності послідовності. Ідентичність послідовності може бути розрахована відомими способами, включаючи описані в Computational Molecular Biology, Lesk, A. N., ed., Oxford University Press, New York (1988), Biocomputing: Informatics і Genome Projects, Smith, D.W., ed., Academic Press, New York (1993); Computer Analysis of Sequence Data, Part I, Griffin, A.M., і Griffin, H. G., eds., Humana Press, New Jersey (1994); Sequence Analysis in Molecular Biology, von Heinge, G., Academic Press (1987); Sequence Analysis Primer, Gribskov, M. і Devereux, J., eds., M. Stockton Press, New York (1991); і Carillo, H, і Lipman, D., SIAM J. Applied Math, 48: 1073 (1988), але не обмежуючись ними, методики з них включені в даний опис посиланням. Переважні способи для визначення ідентичності послідовності розробляються для отримання найбільших сполучень між тестованими послідовностями. Способи визначення ідентичності послідовності систематизовані в публічно доступних комп'ютерних програмах, що визначають ідентичність послідовності між отриманими послідовностями. Приклади таких програм включають, не обмежуючись ними, GCG програмний пакет (Devereux, J, et al. Nucleic Acids Research, 12(1):387 (1984)), BLASTP (інструмент пошуку локального вирівнювання послідовностей), BLASTN і FASTA (Altschul, S. F. et al., J. Molec. Biol., 215:403-410 (1990). Програма BLASTX публічно доступна з NCBI та інших джерел (BLAST Manual, Altschul, S. et al., NCVI NLM NIH Bethesda, MD 20894, Altschul, S. F. et al., J. Molec. Biol., 215:403-410 (1990), методики з яких включені в даний опис посиланням). Ці програми оптимально вирівнюють послідовності із застосуванням ваг розриву, використовуваних за замовчуванням для того, щоб 13 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 отримати найвищий рівень ідентичності послідовності між отриманою та стандартною послідовностями. Як проілюстровано, для полінуклеотиду, що має нуклеотидну послідовність, яка має щонайменше, наприклад, 85 %, переважно 90 %, навіть переважніше 95 % показника "ідентичність послідовності" до стандартної нуклеотидної послідовності, це означає, що нуклеотидна послідовність отриманого полінуклеотиду є ідентичною зі стандартною послідовністю, крім того, що отримана полінуклеотидна послідовність може включати до 15, переважно до 10, навіть переважніше до 5 точкових мутацій на кожні 100 нуклеотидів стандартної нуклеотидної послідовності. Іншими словами, в полінуклеотиді, що має нуклеотидну послідовність, яка має щонайменше, 85 %, переважно 90 %, навіть переважніше 95 % ідентичності по відношенню до стандартної нуклеотидної послідовності, до 15 %, переважно 10 %, навіть переважніше 5 % нуклеотидів у стандартній послідовності можуть бути видалені або заміщені іншим нуклеотидом або декількома нуклеотидуми до 15 %, переважно 10 %, навіть переважніше 5 % загальної кількості нуклеотидів у стандартній послідовності можуть бути вставлені в стандартну послідовність. Ці мутації стандартної послідовність може з'являтися на 5' або 3' термінальних положеннях стандартної нуклеотидної послідовності або будь-де між цими термінальними положеннями, розкиданими як поодиноко серед нуклеотидів у стандартній послідовності або в одній або декількох суміжних групах всередині стандартної послідовності. Аналогічно, для поліпептиду, що має отриману амінокислотну послідовність, яка має щонайменше, наприклад, 85 %, переважно 90 %, навіть переважніше 95 % ідентичність послідовності до стандартної амінокислотної послідовності, це означає, що отримана амінокислотна послідовність поліпептиду є ідентичною до стандартної послідовності, крім того, що отримна поліпептидна послідовність може включати до 15, переважно до 10, навіть переважніше до 5 амінокислотних альтерацій на кожні 100 амінокислот стандартної амінокислотної послідовності. Іншими словами, для одержання отриманої поліпептидної послідовності, що має щонайменше 85 %, переважно 90 %, навіть переважніше 95 % ідентичність послідовності до стандартної амінокислотної послідовності, до 15 %, переважно до 10 %, навіть переважніше до 5 % амінокислотних залишків в стандартній послідовності можуть бути видалені або заміщені іншою амінокислотою, або декілька амінокислот до 15 %, переважно до 10 %, навіть переважніше до 5 % загальної кількості амінокислотних залишків в стандартній послідовності можуть бути всавлені в стандартну послідовність. Ці альтерації стандартної послідовності можуть з'являтися на аміно- або карбокси- термінальних положеннях стандартної амінокислотної послідовності або будь-де між цими термінальними положеннями, розкиданими як поодиноко серед нуклеотидів у стандартній послідовності або в одній або декількох суміжних групах всередині стандартної послідовності. Переважно, положення залишків, що не є ідентичними відрізняються консервативними амінокислотними замінами. Проте, консервативні заміни не включаються як пара, коли визначається ідентичність послідовності. "Гомологія послідовності", що використовується в даному описі, стосується способу визначення зв'язаності двох послідовностей. Для визначення гомології послідовності, дві або більше послідовностей оптимально вирівнюють і, якщо необхідно, вставляють пробіли. Проте, у порівнянні з "ідентичністю послідовності", консервативні амінокислотні заміни рахують як пару, коли визначають гомологію послідовності. Іншими словами, для одержання поліпептиду або полінуклеотиду, що має 95 % гомологію послідовності зі стандартною послідовністю, 85 %, переважно 90 %, навіть переважніше 95 % амінокислотних залишків або нуклеотидів у стандартній послідовності повинні співпадати або включати консервативну заміну з іншою амінокислотою або нуклеотидом, або кількість амінокислот або нуклеотидів до 15 %, переважно до 10 %, навіть переважніше до 5 % загальної кількості амінокислотних залишків або нуклеотидів, не включаючи консервативні заміни, у стандартній послідовності можуть бути вставлені всередину стандартної послідовності. Переважно гомологічна послідовність містить щонайменше проміжок 50, навіть переважніше 100, навіть переважніше 250, навіть переважніше 500 нуклеотидів. "Консервативна заміна" стосується заміни амінокислотного залишку або нуклеотиду на інший амінокислотний залишок або нуклеотид, що має подібні характеристики або властивості, включаючи розмір, гідрофобність, і т.п., таким чином, що загальна функціональність суттєво не змінюється. "Ізольований" означає змінений "руками людини" з його природнього стану, наприклад, якщо він зустрічається у природі, його змінюють або виділяють з його природнього оточення, або і те, й інше. Наприклад, полінуклеотид або поліпептид природньо присутній в живому організмі не є "ізольованим", але той самий полінуклеотид або поліпептид, виділений зі співіснуючих матеріалів з його природнього стану, є "ізольованим", в тому значенні, що використовується в даному описі. 14 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 Таким чином, наступний аспект даного винаходу стосується імуногенної композиції, ефективної для зменшення тяжкості клінічних симптомів, асоційованих з інфекцією ЦВС2, що містить ЦВС2 BPЗ2 протеїн. Переважно, ЦВС2 BPЗ2 протеїн є одним з тих, що описані вище. Переважно, згаданий ЦВС2 BPЗ2 протеїн являє собою і) поліпептид, що містить послідовність SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 9, SEQ ID NO: 10 або SEQ ID NO: 11; ii) будь-який поліпепти, який є щонайменше на 80 % гомологічним до поліпептиду і), ііі) будь-яка імуногенна ділянка поліпептиду і) та/або іі) iv) імуногенна ділянка ііі), що містить щонайменше 10 суміжних амінокислот, включених до послідовностей SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 9, SEQ ID NO: 10 або SEQ ID NO: 11, v) поліпептид, кодований ДНК, що містить послідовність SEQ ID NO: 3 або SEQ ID NO: 4. vi) будь-який поліпептид, кодований полінуклеотидом, який є щонайменше на 80 % гомологічним до полінуклеотиду v), vii) будь-яка імуногенна ділянка поліпептидів, кодованих полінуклеотидом v) та/або vi) viii) імуногенна ділянка vii), де полінуклеотид, що кодує згадану імуногенну ділянку, містить щонайменше 30 суміжних нуклеотидів, включених в послідовності SEQ ID NO: 3, або SEQ ID NO: 4. Переважно будь-чка з цих імуногенних часток, що мають імуногенні характеристики ЦВС2 BPЗ2 протеїну, є кодованими послідовністю SEQ ID NO: 3 бо SEQ ID NO: 4. Відповідно до наступного аспекту, ІДВС2 BPЗ2 протеїн в імуногенній композиції забезпечується на рівні включення антигену, ефективного для викликання бажаної імунної відповіді, а саме зменшення ступеню або зниження тяжкості клінічних симптомів, що проявляються в результаті інфекції ЦВС2. Переважно, рівень включення ЦВС2 BPЗ2 протеїну є щонайменше 0,2 мкг антиген/мл кінцевої імуногенної композиції (мг/мл), переважніше від близько 0,2 до близько 400 мг/мл, також переважніше від близько 0,3 до близько 200 мг/мл, навіть переважніше від близько 0,35 до близько 100 мг/мл, також переважніше від близько 0,4 до близько 50 мг/мл, також переважніше від близько 0,45 до близько 30 мг/мл, також переважніше від близько 0,6 до близько 15 мкг /мл, навіть більш переважно від близько 0,75 до близько 8 мг/мл, навіть більш переважно від близько 1,0 до близько 6 мг/мл, також переважніше від близько 1,3 до близько 3,0 мг/мл, навіть переважніше від близько 1,4 до близько 2,5 мг/мл, навіть переважніше від близько 1,5 до близько 2,0 мг/мл, найпереважніше 1,6 мг/мл. Відповідно до наступного аспекту BPЗ2 рівень включення антигену є щонайменше 0,2 мкг ЦВС2 BPЗ2 протеїну, як описано вище, на дозу кінцевої антигенної композиції (мкг/доза), переважніше від близько 0,2 до близько 400 мкг/доза, також переважніше від близько 0,3 до близько 200 мкг/доза, навіть переважніше від близько 0,35 до близько 100 мкг/доза, також переважніше від близько 0,4 до близько 50 мкг/доза, також переважніше від близько 0,45 до близько 30 мкг/доза, також переважніше від близько 0,6 до близько 15 мкг/доза, навіть переважніше від близько 0,75 до близько 8 мкг/доза, навіть переважніше від близько 1,0 до близько 6 мкг/доза, також переважніше від близько 1,3 до близько 3,0 мкг/доза, навіть переважніше від близько 1,4 до близько 2,5 мкг/доза, навіть переважніше від близько 1,5 до близько 2,0 мкг/доза, і найпереважніше близько 1,6 мкг/доза. ЦВС2 BPЗ2 поліпептид, що використовують в імуногенній композиції відповідно до даного винаходу, може бути отриманий будь-яким способом, включаючи ізоляцію і очищення ЦВС2 BPЗ2, синтез стандартного протеїну, і рекомбінантної методології. Переважні способи одержання ЦВС2 BPЗ2 поліпептиду описані в даному описі вище, а також забезпечуються в заявці на патент США № 11/034797, методика і зміст якої включено в даний опис посиланням. Коротко, чутливі клітини інфікують рекомбінантним вірусним вектором, що містить ЦВС2 BPЗ2 ДНК кодуючі послідовності, ЦВС2 BPЗ2 поліпептид є експресованим рекомбінантним вірусом, а також експресований ІДВС2 BPЗ2 поліпептид відновлюють в супернатанті за допомогою фільтрації та інактивують будь-яким стандартним способом, переважно використовуючи бінарний етиленімід, який потім нейтралізують для зупинки процесу інактивації. Таким чином, відповідно до наступного аспекту імуногенна композиція містить і) будь-який ЦВС2 BPЗ2 протеїн, описаний вище, переважно в концентраціях, описаних вище, та іі) щонайменше частку вірусного вектора, що експресує згаданий ЦВС2 BPЗ2 протеїн, переважно, рекомбінантного бакуловірусу. Крім того, відповідно до наступного аспекту імуногенна композиція містить і) будь-який ЦВС2 BPЗ2 протеїн, що описано вище, переважно в концентраціях, описаних вище, іі) щонайменше частку вірусного вектора, що експресує згаданий ЦВС2 BPЗ2 протеїн, переважно рекомбінантного бакуловірусу, та ііі) частка супернатанту культури клітин. 15 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до одного специфічного застосування одерження та процесу відновлення ЦВС2 BPЗ2 протеїну супернатант культури клітин фільтрують крізь мембрану, що має розмір пор, переважно від близько 0,45 до 1 мкм. Таким чином, наступний аспект стосується імуногенної композиції, що містить і) будь-який ЦВС2 BPЗ2 протеїн, описаний вище, переважно в концентраціях, описаних вище, іі) щонайменше частку вірусного вектора, що експресує згаданий ЦВС2 BPЗ2 протеїн, переважно рекомбінантного бакуловірусу, та ііі) частку клітинної культури; де близько 90 % компонентів має розмі менший, ніж 1 мкм. Відповідно до наступного аспекту даний винахід стосується імуногенної композиції, що містить і) будь-який ЦВС2 BPЗ2 протеїн, описаний вище, переважно в концентраціях, описаних вище, іі) щонайменше частку вірусного вектора, що експресує згаданий ЦВС2 BPЗ2 протеїн, ііі) частку клітинної культури, iv) та агент інактивації для інактивації рекомбінантного вірусного вектора, переважно, БЕІ, де близько 90 % компонентів від і) до ііі) мають розмір менший, ніж 1 мкм. Переважно, БЕІ пррисутній в концентраціях, ефективних для інактивації бакуловірусу. Ефективні концентрації описані вище. Відповідно до наступного аспекту даний винахід стосується імуногенної композиції, що містить і) будь-який ЦВС2 BPЗ2 протеїн, описаний вище, переважно в концентраціях, описаних вище, іі) щонайменше частку вірусного вектора, що експресує згаданий ЦВС2 BPЗ2 протеїн, ііі) частку клітинної культури, iv) агент інактивації для інактивації рекомбінантного вірусного вектора переважно БЕІ, і v) агент нейтралізації для припинення інактивації, опосередкованої агентом інактивації, де близько 90 % компонентів від і) до ііі) мають розмір менший, ніж 1 мкм. Переважно, якщо агентом інактивації є БЕІ, то згадана композиція містить натрію тіосульфонат в еквівалентній кількості порівняно з БЕІ. Поліпептид включають до композиції, що може бути введена тварині, чутливій до інфекції ЦВС2. В переважних формах композиція може також включати компоненти, відомі фахівцям в даній галузі (дивись також Remington's Pharmaceutical Sciences. (1990). 18th ed. Mack PubL, Easton). Додатково, композиція може включати один або кілька ветеринарно придатних носіїв. Вираз "ветеринарно придатний носій", що використовується в даному описі, включає будь-який розчинник, дисперсійні середовища, покриття, допоміжні речовини, агенти, що стабілізують, розріджувачі, захисні агенти, антибактеріальні та протигрибкові агенти, ізотонічні агенти, агенти, що уповільнюють адсорбцію, і подібні. В переважному варіанті здійснення імуногенна композиція містить ЦВС2 BPЗ2 протеїн, що забезпечується даним винаходом, в якості антигенного компоненту, переважно в концентраціях, описаних вище, що змішують з допоміжною речовиною, переважно Карбополом, та фізіологічним сольовим розчином. Фахівці в даній галузі зрозуміють, що композиція, описана тут, може включати відомі фізіологічно прийнятні стерильні розчини для ін'єкції. Для приготування розчину, готового для застосування для парентеральної ін'єкції або інфузії, застосовують водні ізотонічні розчини, такі як, наприклад, сольові або відповідні розчини плазми. Додатково, імуногенні та вакцинні композиції даного винаходу можуть включати розріджувачі, ізотонічні агенти, стабілізатори або допоміжні речовини. Розріджувачі можуть включати воду, сольовий розчин, декстрозу, етанол, гліцерол і подібне. Ізотонічні агенти серед інших можуть включати хлорид натрію, декстрозу, манітол, сорбітол і лактозу. Стабілізатори включають, серед інших, альбумін та алкалінові солі етилендіамінтетраоцтової кислоти. Відповідні допоміжні речовини є такими, як описано вище. Найбільш переважним є використання Карбополу, зокрема, використання Карбополу 97 IP, переважно в кількості, як описано вище (а саме, від близько 500 мкг до близько 5 мг на дозу, навіть переважніше в кількості від близько 750 мкг до близько 2,5 мг на дозу і найпереважніше в кількості від близько 1 мг на дозу). Таким чином, даний винахід також стосується імуногенної композиції, що містить і) будь-які ЦВС2 BPЗ2 протеїни, описані вище, переважно в концентраціях, що описані вище, іі) щонайменше частку вірусного вектора, що експресує згаданий ЦВС2 BPЗ2 протеїн, ііі) частку клітинної культури, iv) агент інактивації для інактивації рекомбінантного вірусного вектора, переважно БЕІ, та v) агент нейтралізації для припинення інактивації, опосередкованої агентом інактивації, переважно натрію тіосульфонат в еквівалентній кількості порівняно з БЕІ; vi) відповідну допоміжну речовину, переважно Карбопол 971 в кількості, зазначеній вище; де близько 90 % компонентів від і) до ііі) мають розмір менший, ніж 1 мкм. Відповідно до наступного аспекту ця імуногенна композиція також містить фармацевтично прийнятну сіль, переважно фосфатну сіль у фізіологічно прийнятних концентраціях. Переважно, рН згаданої імуногенної композиції доводять до фізіологічного рН, що означає близько 6,5-7,5. Таким чином, даний винахід також стосується імуногенної композиції, що містить на один мл і) щонайменше 1,6 мкг ЦВС2 BPЗ2 протеїну, описаного вище, іі) щонайменше частку 16 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 бакуловірусу, що експресує згаданий ЦВС2 BPЗ2 протеїн ііі) частку клітинної культури, iv) близько від 2 до 8 мМ БЕІ, v) натрію тіосульфонат в еквівалентній кількості в порівнянні до БЕІ; vi) близько 1 мг Карбополу 971, а також vii) фосфатну сіль у фізіологічно прийнятній концентрації; де близько 90 % компонентів від і) до ііі) маютьрозмір менший, ніж 1 мкм, а рН згаданої імуногенної композиції доводять до близько 6,5-7,5. Імуногенні композиції можуть також включати один або декілька імуномодуляторних агентів, таких як, наприклад, інтерлейкіни, інтерферони або інші цитокіни. Імуногенні композиції можуть також включати гентаміцин та мертіолат. Тоді як кількість та концентрації допоміжних речовин та добавок, прийнятних для даного винаходу, може визначити кваліфікований молодший фахівець, даний винахід розглядає композиції, що містять від близько 50 мкг до близько 2000 мкг допоміжної речовини і переважно близько 250 мкг/ мл дози вакцинної композиції. В іншому переважному варіанті застосування даний винахід розглядає вакцинні композиції, що містять від близько 1 мкг/мл до близько 60 мкг/мл антибіотиків, і переважніше менше, ніж близько 30 мкг/мл антибіотиків. Таким чином, даний винахід також стосується імуногенної композиції, що містить і) будь-які ЦВС2 BPЗ2 протеїни, описані вище, переважно в концентраціях, описаних вище, іі) щонайменше частку вірусного вектора, що експресує згаданий ЦВС2 BPЗ2 протеїн, ііі) частку клітинної культури, iv) агент інактивації для інактивації рекомбінантного вірусного вектора, переважно БЕІ, та v) агент нейтралізації для припинення інактивації, опосередкованої агентом інактивації, переважно натрію тіосульфонат в еквівалентній кількості порівняно з БЕІ; vi) відповідна допоміжна речовина, переважно Карбопол 971 в кількості, зазначеній вище; vii) фармацевтично прийнятна концентрація фізіологічного буферу, переважно фосфатної солі, та viii) антимікробіологічний активний агент; де близько 90 % компонентів від і) до ііі) мають розмір менший, ніж 1 мкм. Несподівано винайшли, що імуногенна композиція за даним винаходом була високо стабільна протягом 24 місяців. Також винайшли імуногенні композиції за даним винаходом, які містять рекомбінантний ЦВС2 BPЗ2 протеїн, експресований бакуловірусом, за даним винаходом, є дуже ефективними в зменшенні клінічних симптомів, асоційованих з ЦВС2 інфекціями. Несподівано винайшли, що імуногенні композиції, що містять рекомбінантний ЦВС2 BPЗ2 протеїн, експресований бакуловірусом за даним винаходом, є більш ефективними, ніж імуногенна композиція, що містить цілий ЦВС2 вірус в інактивованій формі або ізольований вірусний ЦВС2 BPЗ2 антиген. Зокрема, несподівно винайшли, що рекомбінантний ЦВС2 BPЗ2 протеїн, експресований бакуловірусом, є ефективним в дуже малих концентраціях, що означає в концентраціях до 0,25 мкг/доза. Такий несподіваний високий імуногенний потенціал ЦВС2 BPЗ2 протеїну можна додатково збільшити додаванням Карбополу. Наступний аспект стосується ємності, що містить щонайменше одну дозу імуногенної композиції ЦВС2 BPЗ2 протеїну за даним винаходом, де одна доза містить щонайменше 2 мкг ЦВС2 BPЗ2 протеїну, переважно 2-16 мкг ЦВС2 BPЗ2 протеїну. Згадана ємність може містити 1250 доз імуногенної композиції, переважно вона містить 1, 10, 25, 50, 100, 150, 200, або 250 доз імуногенної композиції ЦВС2 BPЗ2 протеїну. Переважно, кожна з таких ємностей, що містить більш ніж одну дозу імуногенної композиції ЦВС2 BPЗ2 протеїну додатково містить антимікробіологічний активний агент. Такими агентами є, наприклад, антибіотики, включаючи гентаміцин та мертіолат і подібні. Таким чином, один аспект даного винаходу стосується ємності, що містить 1-250 доз імуногенної композиції ЦВС2 BPЗ2 протеїну, де одна доза містить щонайменше 2 мкг ЦВС2 BPЗ2 протеїну, а також гентаміцин та/або мертіолат, переважно від близько 1 мг/мл до близько 60 мг/мл антибіотиків, та переважніше менш ніж близько 30 мг/мл. Наступний аспект стосується набору, що містить будь-яку ємність, описану вище, а також інструкцію про застосування, включаючи інформацію для внутрішньом'язового введення щонайменше однієї дози імуногенної композиції ЦВС2 BPЗ2 протеїну поросятам для зменшення тяжкості клінічних симптомів, асоційованих з ЦВС2 інфекцією. Крім того, відповідно до наступного аспекту, згадана інструкція про застосування містить інформацію про друге і наступне(-і) введення щонайменше однієї дози імуногенної композиції ЦВС2 BPЗ2, де друге введення або будь-яке наступне введення відбувається щонайменше через 14 днів після початкового або будь-якого попереднього введення. Переважно, згадана інструкція про застосування також включає інформацію для забезпечення імунного стимулятору. Переважно, згаданий імунний стимулятор необхідно давати щонайменше двічі. Переважно між першим та другим або будь-яким подальшим введенням імунного стимулятора проходить щонайменше 3, переважніше щонайменше 5, навіть переважніше щонайменше 7 днів. Переважно, імунний стимулятор дають через щонайменше 10 днів, переважно через 15, навіть переважніше через 20, навіть переважніше щонайменше через 22 дні після початково введення імуногенної 17 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 композиції ЦВС2 BPЗ2 протеїну. Переважним імунним стимулятором є, наприклад, гемоціанін морського блюдечка (KLH), також переважно емульсифікований з неповним ад'ювантом Фрейнда (KLH/ICFA). Проте, зрозуміло, що можна використовувати будь-який інший імунний стимулятор, відомий фахівцю в даній галузі. Вираз "імунний стимулятор", що використовується в даному описі, означає будь-який агент або композицію, що може запускати імунну відповідь, переважно без ініціації або збільшення специфічної імунної відповіді, наприклад, імунної відповіді' проти специфічного патогену. Також існують інструкції по введенню імунного стимулятору у відповідній дозі. Крім того, набор може також містити ємність, включаючи щонайменше одну дозу імунного стимулятору, переважно одну дозу KLH, або KLH/ICFA. Крім того, також несподівано винайшли, що імуногенний потенціал імуногенних композицій, що містять рекомбінантний ЦВС2 BPЗ2 протеїн, експресований бакуловірусом, переважно в комбінації з Карбополом, можна додатково збільшити введенням IngelVac PPCC МЖВ (Модифікований Живий Вірус) вакцини (дивись приклад 5). Клінічні симптоми ЦВС2 та проявлення захворювання різко збільшуються, якщо присутня інфекція РРСС. Проте, імуногенні композиції і стратегії вакцинації за даним винаходом суттєво зменшують цей ефект, навіть більш, ніж очікувалось. Іншими словами, спостерігається несподіваний синергічний ефект, якщо тварин, переважно свиней лікують будь-якою ЦВС2 ВРЗ2 імуногенною композицією за даним винаходом, а також вакциною Ingelvac РРСС МЖВ (Boehringer Ihgelheim). Таким чином, наступний аспект даного винаходу стосується набору, як описано вище, що містить імуногенну композицію ЦВС2 ВРЗ2 за даним винаходом, а також інструкцію про застосування, де інструкція про застосування також містить інформацію для введення ЦВС2 ВРЗ2 імуногенної композиції разом з імуногенною композицією, що містить РРСС антиген, переважно добавлений РРСС антиген. Переважно, РРСС антигеном є IngelVac® РРСС МЖВ. Наступний аспект даного винаходу також стосується набору, що містить і) ємність, що містить щонайменше одну дозу імуногенної композиції ЦВС2 BPЗ2 за даним винаходом, а також іі) ємність, що містить імуногенну композицію, що містить РРСС антиген, переважно доданий РРСС антиген. Переважно РРСС антигеном є IngelVac® РРСС МЖВ (Boehringer Ingelheim). Більш переважно, набір додатково містить інструкцію про застосування, включаючи інформацію щодо введення обох фармацевтичних композицій. Переважно, він містить інформацію про те, що ЦВС2 ВРЗ2, який містить композицію вводять безупинно перед композицію, що містить РРСС. Наступний аспект, стосується застосування композицій за даним винаходом в якості медикаменту, переважно в якості ветеринарного медикаменту, навіть переважніше в якості вакцини. Крім того, даний винахід також стосується застосування будь-яких композицій, описаних в даному винаході, для приготування медикаменту для зменшення тяжкості клінічних симптомів, асоційованих з інфекцією ЦВС2. Переважно, медикамент застосовують для запобіання інфекції ЦВС2, навіть переважніше у поросят. Наступний аспект стосується способу для (і) запобігання зараження або повторного зараження ЦВС2 або (іі) зменшення або усунення клінічних симптомів, викликаних в суб'єкті ЦВС2, що включає введення суб'єкту в разі потреби будь-яких імуногенних композицій за даним винаходом. Переважно, суб'єктом є свиня. Переважно, імуногенну композицію вводять внутрішньом'язово. Переважно, вводять одну або дві дози імуногенної композиції, де одна доза переважно містить щонайменше близько 2 мкг ЦВС2 ВРЗ2 протеїну, навіть переважніше близько від 2 до близько 16 мкг, і щонайменше близько від 0,1 до близько 5 мг Карбополу, переважно близько 1 мг Карбополу. Наступний аспект стосується способу лікування, як описано вище, де вводять друге введення імуногенної композиції. Переважно, друге введення виконують тією ж самою імуногенною композицією, що переважно має ту саму кількість ЦВС2 ВРЗ2 протеїну. Переважно друге введення також вводять внутрішньом'язово. Переважно, друге введення виконують щонайменше через 14 днів після початкового введення, навіть переважніше щонайменше через 4 тижні після початкового введеня. Відповідно наступного аспекту, спосіб лікування також містить введення імунного стимулятора. Переважно, згаданий імунний стимулятор вводять щонайменше двічі. Переважно, між першим та другим введенням імунного стимулятору проходить щонайменше 3, переважніше щонайменше 5 днів, навіть переважніше щонайменше 7 днів. Переважно, імунний стимулятор вводять щонайменше через 10 днів, переважно через 15, навіть переважніше через 20, навіть переважніше щонайменше через 22 днів після початкового введення ЦВС2 ВРЗ2 імуногенної композиції. Переважним імунним стимулятором є, наприклад, гемоціанін морського блюдечка (KLH), також переважно емульсифіковиний з неповним ад'ювантом Фрейнда (KLII/ICFA). Проте зрозуміло, що в даному винаход можна застосовувати будь-який інший імунний стимулятор, відомий фахівцю в даній 18 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 галузі. Введення імунного стимулятору у відповідній дозі базується на загальному рівні знань фахівця в даній галузі. Відповідно до наступного аспекту спосіб лікування, описаного вище також містить введення РРСС антигену. Переважно РРСС антигеном є IngelVac® PPCC МЖВ (Boehringer Ingelheim). Переважно, згаданий РРСС антиген вводять безупинно перед введенням імуногенної композиції ЦВС2 ВРЗ2 протеїну. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ Фіг. 1 це блок-схема переважного конструювання ЦВС2 ВРЗ2 рекомбінантного бакуловірусу; та Фіг. 2а та 2b це блок-схема того, як одержати композицію відповідно до даного винаходу. ДЕТАЛЬНИЙ ОПИС ПЕРЕВАЖНИХ ВАРІАНТІВ ЗДІЙСНЕННЯ Наступні приклади поясняють переважні матеріали та процедури відповідно до даного винаходу. Зрозуміло, що ці приклади наводяться тільки в якості ілюстрацій і не повинні розглядатися як ті, що обмежують об'єм даного винаходу. ПРИКЛАД 1 Цей приклад порівнює відносний вихід ВРЗ2 із застосовунням способів даного винаходу та способів, відомих з рівня техніки. В кожні з чотирьох 1000 мл ролерні колби висіяли приблизно 6 1,0 × 10 Sf+ клітин/мл в 300 mL середовищах, вільних від сировотки комах, Excell 420 (JRH Biosciences, Inc., Lenexa, KS). Оригінал культури клітин визначається як SF+ (Spodoptera frugiperda) Master Cell Stock (маточна клітинна культура), пасаж 19, Lot#N112-095W. Клітини, що використовують для формування SF+ маточна клітинна культура були отримані від Protein Sciences Corporation, Inc., Meriden, СТ. Лінія клітин SF+для цього прикладу була обмежена пасажами 19 і 59. Інші пасажи будуть працювати для цілей даного винаходу, але щоб привести процес у відповідність до виготовлення в промисловому масштабі, вірогідно необхідно щонайменше 19 пасажів, і пасажи після 59 можуть впливати на експресію, проте цей факт не досліджувався. Більш детально, початкові SF+ клітинні культури зі сховища в рідкому азоті були вирощені в Excell 420 середовищах в суспензіях в стерильних ролерних колбах з постійним збовтуванням. Культури вирощували в 100 мл - 250 мл ролерних колбах з 25-150 мл Excell 420 середовищ без сироватки. Коли клітини розмножилися до щільності 1,0-8,0 × 106 клітин/мл, їх перелили в нові судини з щільністю посіву 0,5-1,5 × 106 клітин/мл. Відповідні розмножені культури вирощували в ролерних колбах до 36 літрів за розміром або в біореакторах із нержавіючої сталі до 300 літрів за період 2-7 днів при 25-29 °C. Після посіву колби інкубували при 27 °C протягом чотирьох годин. Відповідно, в кожну колбу сіяли рекомбінантний бакуловірус, що містить ЦВС2 BPЗ2 ген (SEQ ID NO: 4). Рекомбінантний бакуловірус, що містить ЦВС2 BPЗ2 ген було отримано наступним шляхом: ЦВС2 BPЗ2 ген з Північно-Американського штаму ЦВС2 був ампліфікований за допомогою ПЛР таким чином, шо містить 5' послідовність Козака (SEQ ID NO: 1) та сайт 3' EcoRl (SEQ ID NO: 2), клонований в pGEM-T-Easy вектор (Promega, Madison, WI). Потім його відповідно вирізають і субклонують у вектор трансфекції pVL1392 (BD Biosciences Pharmingen, San Diego, CA). Сублклонована ділянка представлена в даному описі як SEQ ID NO: 7. Плазмід pVL1392, що містить ЦВС2 BPЗ2 ген, позначають N47-064Y і потім ко-трансфектують з BaculoGold® (BD Biosciences Pharmingen) ДНК бакуловіруса в Sf+ клітинах комах (Protein Sciences, Meriden, CT) для отримання рекомбінантного бакуловірусу, що містить ЦВС2 BPЗ2 ген. Новий конструкт забезпечується даним винаходом як SEQ ID NO: 8. Рекомбінантний бакуловірус, що містить ЦВС2 BPЗ2 ген, очищали від бляшок, Master Seed Virus (маточний вірус для посіву) (MSV) вирощують на SF+ клітинній лінії, відбирали аліквотами і зберігали при -70 °C. MSV позитивно визначають як ЦВС2 BPЗ2 бакуловірус шляхом ПЛР-RFLP, застосовуючи бакуловірусспецифічиі праймери. Клітини комах інфікували ЦВС2 BPЗ2 бакуловірусом для одержання MSV або Working Seed Virus (робочий вірус для посіву) експресує ЦВС2 BPЗ2 антиген, що визначають поліклональною сивораткою в непрямому методі флюоресценції антитіла. Додатково, визначення ЦВС2 BPЗ2 бакуловірусу проводять шляхом N-термінального амінокислотного секвенування. ЦВС2 BPЗ2 бакуловірус MSV також тестували на чистоту у відповідності до 9 C.F.R. 113,27 (с), 113,28, та 113,55. Кожний рекомбінантний бакуловірус, що висіювали в ролерні колби, мав різні множинності зараження (МОІ). В колбу 1 посіяли 7,52 мл 0,088 МОІ посіву; в колбу 2 посіяли 3,01 мл 0,36 МОІ посіву; в колбу 3 посіяли 1,5 мл 0,18 МОІ посіву; і в колбу 4 посіяли 0,75 мл 0,09 МОІ посіву. Блок-схема на Фігурі 1 ілюструє основні етапи, що застосовують для конструювання ЦВС2 BPЗ2 рекомбінантного бакуловірусу за даним винаходом. Після посіву з бакуловірусом, колби інкубували при 27±2 °C протягом 7 днів і також взбовтували при 100 обертів/хвилина протягом цього часу. На колбахз були венлильовані 19 UA 107177 C2 5 10 15 20 25 30 35 кришки для проходження повітря. Зразки з кожної колби забирали кожні 24 години протягом наступних 7 днів. Після екстракції кожний зразок цинтрифугували, і як осад, так і супернатант відділяли і потім мікрофільтрували крізь мембрану з розміром пори 0,45-1,0 мкм. Отримані зразки потім мали кількість вмісту BPЗ2 в них, що рахували методом ФСІСВ. Метод ФСІСВ проводили з іммобілізованим антитілом свині проти-ЦВС2 Pab IgG Prot. G, очищеним (розбавленим 1:250 у PBS), розбавленим до 1:6000 в 0,05 М карбонатного буферу (рН 9,6). 100 мкл антитіла потім помістили у лунки мікротитраційного планшета, герметично закривають та інкубують протягом ночі при 37 °C. Потім планшет відмивають тричі розчином відмивки, що містить 0,5 мл Tween 20 (Sigma, St. Louis, МО), 100 мл 10Х D-PBS (Gibco Invitrogen, Carlsbad, CA) та 899,5 мл дистильованої води. Відповідно, 250 мкл блокуючого розчину (5 г знежиреного сухого молока (Nestle, Glendale, С А) в 10 мл D-PBS QS до 100 мл дистильованої води) додають до кожної лунки. На наступному етапі відмивають тестовий планшет і потім додають попередньо розріджений нерозведений антиген. Попередньо розріджений антиген отримували шляхом додавання 200 мкл розчин розріджувача (0,5 мл Tween 20 в 999,5 мл D-PBS) до кожної лунки на планшет розведення. Зразок потім розводили при співвідношенні 1:240 і співвідношенні 1:480, і 100 мкл кожного з цих розведених зразків потім додавали до однієї з верхніх лунок на планшеті розведення (а саме, одна верхня лунка отримувала 100 мкл розведення 1:240, а інші отримували 100 мкл розведення 1:480). Серійні розведення потім проводили для розподілу залишку планшета шляхом видалення 100 мкл з кожної наступної лунки і їх перенесення в наступну лунку на планшеті. Кожну лунку перемішували перед наступним перенесенням. Відмивка тестового планшета включала відмивку планшета тричі буфером відмивки. Планшет потім герметично закривали і інкубували протягом години при 37 °C перед тим, як відмити тричі буфером відмивки. Для визначення антитіла використовували моноклональне антитіло до ЦВС BPЗ2. Його розводили 1:300 у розчині розріджувача, і 100 мкл розведеного визначеного антитіла потім додавали до лунок. Планшет потім герметично закривали та інкубували протягом години при 37 °C перед тим, як відмити тричі буфером відмивки. Кон'югат розріджувача потім готують додаванням нормальної кролячої сироватки (Jackson внутрішньом'язово Munoresearch, West Grove, PA) до розчину розріджувача до 1 % концентрації. Кон'югат антитіла кози проти (H+1)-HRP миші (Jackson Immunoresearch) розводили в кон'югаті розріджувача до 1:10,000. 100 мкл розведеного кон'югату антитіла потім додають до кожної лунки. Планшет потім герметично закривали та інкубували протягом 45 хвилин при 37 °C перед тим, як відмити тричі буфером відмивки. 100 мкл субстрату (ТМВ Peroxidase Substrate, Kirkgaard i Perry Laboratories (KPL)), змішаний з еквівалентним об'ємом субстрату пероксидази В (KPL) додавали до кожної лунки. Планшет інкубували при кімнатній температурі протягом 15 хвилин. 100 мкл розчину IN HCL потім додавали до всіх лунок для припинення реакції. Планшет потім поміщали у зчитувач ФСІСВ. Результати цього дослідження наведені в Таблиці 1. 20 UA 107177 C2 Таблиця 1 День 3 3 3 3 4 4 4 4 5 5 5 5 6 6 6 6 7 7 7 7 5 10 15 20 25 Колба 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 ВРЗ2 в осаді (мкг) 47,53 57,46 53,44 58,64 43,01 65,61 70,56 64,97 31,74 34,93 47,84 55,14 14,7 18,13 34,78 36,88 6,54 12,09 15,84 15,19 ВРЗ2 в супернатанті (мкг) 12 22 14 12 44 62 32 24 100 142 90 86 158 182 140 146 176 190 158 152 Ці результати показують, що при збільшенні часу інкубації, експресія ВРЗ2 в супернатанті центрифугованих клітин і середовища більше експресії в осаді центрифугованих клітин і середовища. Відповідно, можливість протікання ВРЗ2 експресії протягом щонайменше 5 днів і відновлення з супернатанту, на відміну від можливості протікання експресії протягом менше, ніж 5 днів і відновлення ВРЗ2 з клітини, забезпечує високий вихід ВРЗ2, і значно вдосконалює існуючі способи. ПРИКЛАД 2 Цей приклад приводить дані щодо ефективності заявленого винаходу. В 1000 мл ролерні колби висівали приблизно 1,0 × 106 Sf+ клітин/мл в 300 мл середовищ Excell 420. Потім колбу інкубували при 27 °C і взбовтували при 100 об/хв. Відповідно, в колби висівали 10 мл ЦВС2 ВРЗ2/Вас р+6 (рекомбінантний бакуловірус, що містить ЦВС2 ВРЗ2 ген, пересіяних 6 додаткових разів в Sf9 клітини комах), вірус висівали з 0,1 МОІ після 24 годин інкубації. Колбу потім інкубували при 27 °C загалом протягом 6 днів. Після інкубації колби центрифугували, відбирали три зразки отриманого супернатанту та інактивували. Супернатант інактивували доведенням його до температури 37±2 °C. До першого зразка в супернатант додавали 0,4 М розчин 2-бромоетиленаміну гідроброміду, який був циклізований до 0,2 М бінарного етиленіміну (БЕІ) в 0,3 N NaOH для отримання кінцевої концентрації БЕІ 5мМ. До другого зразка в супернатант додавали 10 мМ БЕІ. До третього зразка в супернатант не додавали БЕІ. Зразки потім постійно перемішували протягом 48 годин. Додавали 1,0 М розчину натрію тіосульфонату для отримання кінцевої мінімальної концентрації 5 мМ для нейтралізації будь-якого залишкового ВЕІ. Потім розраховували кількість ВРЗ2 на кожний зразок із застосуванням такого самого методу аналізу ФСІСВ, що описано в прикладі 1. Результати наведені в Таблиці 2 нижче: Таблиця 2 Зразок 1 2 3 ВРЗ2 в супернатанті (мкг) 78,71 68,75 83,33 Цей приклад показує, що нейтралізація з БЕІ не зміщає або знижує значну кількість рекомбінантного продукту ЦВС2 ВРЗ2 протеїну. Це доводить той факт, що БЕІ або підвищення 21 UA 107177 C2 5 10 температур не приводить до великої втрати ВРЗ2 всупернатанті. Фахівці в даній галузі мзможуть визначити, що відновлена ВРЗ2 є стабільним протеїновим продуктом. ПРИКЛАД 3 Цей приклад показує, що даний винахід нарощує малі масштаби продукції рекомбінантної ЦВС2 ВРЗ2 до великих масштабів продукції рекомбінантної ЦВС2 ВРЗ2. 5,0 × 105 клітин/мл SF+ клітин/мл у 7000 мл середовища ЕхСеІІ 420 поміщають в 20000 мл біореактор Applikon. Ці середовища та клітини потім інкубували при 27 °C та взбовтували при 100 об/хв протягом наступних 68 годин. На 68-ій годині 41,3 мл ЦВС2 ВРЗ2 бакуловірусу MSV+3 додавали до 7000 мл середовища ЕхСеІІ 420. Отриману суміш потім додавали до біореактора. Протягом наступних семи днів суміш інкубували при 27 °C і взбовтували при 100 об/хв. Зразки з біореактору виділяли кожні 24 години, починаючи з дня 4 після зараження, і кожний зразок центрифугували. Супернатант зразків зберігали і кількість ВРЗ2 потім розраховували, використовуючи SDS-PAGE денситометрію. Ці результати представлені на Таблиці 3 нижче: Таблиця 3 День після зараження 4 5 6 7 ВРЗ2 в супернатанті (мкг/мл) 29,33 41,33 31,33 60,67 15 20 ПРИКЛАД 4 Цей приклад тестує ефективність семи ЦВС2 кандидатних вакцин, а також визначає пераметри ефективності після внесення вірулентного штаму ЦВС2. Сто вісім (108) отриманих кесаревим розтином позбавлених молозива (CDCD) поросят, віком 9-14 днів, були випадково розподілені на 9 груп однакового розміру. Таблиця 4 відображає загальну схему дослідження цього прикладу. Таблиця 4 Загальна схема дослідження Гру№ па свиней 1 2 12 3 12 4 12 5 12 6 12 7 12 8 12 9 25 12 12 Лікування ВРЗ2 Вакцина № 1 - (вВРЗ2 16 мкг) BPЗ2 Вакцина № 2 - (вВРЗ2 8 мкг) BPЗ2 Вакцина № 3 - (вВРЗ2 4 мкг) ВРЗ2 Вакцина № 4 - (рВРЗ2 16 мкг) ВРЗ2 Вакцина № 5 - (рВРЗ2 16 мкг) ВРЗ2 Вакцина № 6 - (рВРЗ2 16 мкг) ВРЗ2 Вакцина № 7 - (вбиті всі вірусні клітини) Нічого - Контролі зараження Нічого - Група строгого негативного контролю День KLH/ICFA лікуван- на 21 день і ня 27 день Контрольне Некропсія зараження на 49 вірулентною день ВРЗ2 на 24 день 0 + + + 0 + + + 0 + + + 0 + + + 0 + + + 0 + + + 0 + + + N/A + + + N/A + + вВРЗ2 - це виділена вірусна ВРЗ2; рВРЗ2 - це рекомбінантна експресована бакуловірусом ВРЗ2; убитий вірус - це вірус ЦВС2, вирощений у відповідній клітинній культурі. Сім із цих груп (Групи 1-7) отримували дози ЦВС2 ВРЗ2 поліпептиду, одна группа слугувала в якості контролю конторольного зараження і не отримувала ЦВС2 ВРЗ2, інша група слугувала як група строгого негативного контролю і також не отримувала ІДВС2 BPЗ2. В 0 день, Групи 1-7 22 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 отримували лікування призначеними вакцинами. Поросята в Групі 7 отримали посилене лікування на 14 день. Поросят досліджували щодо побічних ефектів реакцій в місцях ін'єкцій після вакцинації і на 19 день, поросят переводили на місце другого дослідження. На місці другого дослідження, групи 1-8 помістили разом в одну будівлю, тоді як Група 9 була розміщена в окремій будівлі. Всі свині отримували гемоціанін морського блюдечка (КLН)/неповний ад'ювант Фрейнда (ICFA) на 21 день і на 27 день і на 24 день, Групи 1-8 були контрольно заражені вірулентним ЦВС2. Перед і після контрольного зараження були зібрані зразки крові для ЦВС2 серології. Перед і після контрольного зараження були зібрані дані маси тіла для визначення середнього приросту ваги тіла на день (ADWG), а також клінічні симптоми, так само, як і зразки назальних мазків для визначеня назального виділення ЦВС2. На 49 день, всі свині, що вижили, були забиті, легені оцінювали на пошкодження, забрані тканини зберігали у формаліні для імуногістохімії (ІНС), яку проводили пізніше. Матеріали та методи Було проведено частково сліпе дослідження технічної реалізації вакцинації-контрольного зараження, що стосувалося CDCD свиней, віком 9-14 днів на 0 день. Щоб бути включеними у дослідження титри ЦВС2 ІФД свиноматок були 1:1000. Крім того, серологічний статус свиноматок з відомого РРСС- негативного стада. Двадцять вісім (28) свиноматок тестували на ЦВС2 серологічний статус. Чотирнадцять (14) свиноматок мали титр ЦВС2 1000 і були перенесені до сайта першого дослідження. Сто одне порося (ПО) були отримані кесаревим розтином і були наявні для дослідження на день 4. На день 3, 108 CDCD свиней з першого сайта дослідження зважили, позначили вушними бирками, відібрали за вагою та випадково поділили на 1-9 Групи, як показано вище на Таблиці 4. Якщо будь-яку тестову тварину, що відповідала виділеному критерію, включали в дослідження, а потім з будь-яких причин вилучали, дослідник і спостерігач консультувалися для того, щоб визначити використання даних, отриманих від цієї тварини, у кінцевому аналізі. Дані щодо того, яка включена тварина біла вилучена і причину вилучення документували. На початку, жодна свиноматка не була вилучена. Загальна кількість 108 з наявних ПО свиней була випадково розподілені в одну з 9 Груп на день 3. Дві найменші свині (№ 17 та 19) не були розміщені в групу і були наявні в якості додаткових, якщо в таких буде необхідність. Протягом всього дослідження декілька тварин були вилучені. Свиня № 82 (Група 9) на день 1, Свиня № 56 (Група 6) на день 3, Свиня № 53 (Група 9) на день 4, Свиня № 28 (Група 8) на день 8, Свиня № 69 (Група 8) на день 7, а також Свиня № 93 (Група 4) на день 9, що були знайдені мертвими перед контрольним зараженням. Цих шість свиней не включили в кінцеві результати дослідження. Свиню № 17 (одна з додаткових свиней) помістили до Групи 9. Додаткова свиня № 19, що залишилась, була вилучена з дослідження. Кожній групі давали наступні формуляції: Група 1 заплановано отримувала 1 мл вірусного ВРЗ2 (вВРЗ2), що містить 16 мкг ВРЗ2/мл. Це робили змішуванням 10,24 мл вірусного ВРЗ2 (256 мкг/25 мг/мл = 10,24 мл вВРЗ2) з 3,2 мл 0,5 % Карбополу та 2,56 мл фізіологічного розчину на фосфатному буфері при рН 7,4. Таким чином отримували 16 мл формуляції для Групи 1. Група 2 заплановано отримувала 1 мл вВРЗ2, що містить 8 мкг вВРЗ2/мл. Це робили змішуванням 5,12 мл вВРЗ2 (128 мкг/25 мг/мл = 5,12 мл вВРЗ2) з 3,2 мл 0,5 % Карбополу та 7,68 мл фізіологічного розчину на фосфатному буфері при рН 7,4. Таким чином отримували 16 мл формуляції для Групи 2. Група 3 заплановано отримувала 1 мл вBPЗ2, що містить 4 мкг вBPЗ2/мл. Це робили змішуванням 2,56 мл вBPЗ2 (64 мкг/25 мг/мл = 2,56 мл вBPЗ2) з 3,2 мл 0,5 % Карбополу та 10,24 мл фізіологічного розчину на фосфатному буфері при рН 7,4. Таким чином отримували 16 мл формуляції для Групи 3. Група 4 заплановано отримувала 1 мл рекомбінантного BPЗ2 (рBPЗ2), що містить 16 мкг рBPЗ2/мл. Це робили змішуванням 2,23 мл рBPЗ2 (512 мкг/230 мг/мл = 2,23 мл рBPЗ2) з 6,4 мл 0,5 % Карбополу та 23,37 мл фізіологічного розчину на фосфатному буфері при рН 7,4. Таким чином отримували 32 мл формуляції для Групи 4. Група 5 заплановано отримувала 1 мл рBPЗ2, що містить 8 мг рBPЗ2/мл. Це робили змішуванням 1,11 мл рBPЗ2 (256 мкг/230 мг/мл = 1,11 мл рBPЗ2) з 6,4 мл 0,5 % Карбополу та 24,49 мл фізіологічного розчину на фосфатному буфері при рН 7,4. Таким чином отримували 32 мл формуляції для Групи 5. Група 6 заплановано отримувала 1 мл рBPЗ2, що містить 8 мкг рBPЗ2/мл. Це робили змішуванням 0,56 мл рBPЗ2 (128 мкг/230 мг/мл = 0,56 мл рBPЗ2) з 6,4 мл 0,5 % Карбополу та 25,04 мл фізіологічного розчину на фосфатному буфері при рН 7,4. Таким чином отримували 32 мл формуляції для Групи 6. Група 7 заплановано отримувала 2 мл ЦВС2 вакцини повністю убитих клітин (ЦВС2 УВ (убита вакцина)), що містить МАХ ЦВС2 УВ. Це робили змішуванням 56 мл ЦВС2 УВ з 14 мл 0,5 % Карбополу. Таким чином отримували 70 мл формуляції для Групи 7. Нарешті Група 8 заплановоно отримувала KLH (гемоціанін морського блюдечка) при 0,5 мг/мл або 1,0 мг/мл на 2 мл дози. Це робили змішуванням 40,71 мл KLH (7,0 мкг протеїн/мл при 0,5 мг/мл = 570 мл (7,0 мг/мл)(х) = (0,5)(570 ml)), 244,29 мл фізіологічного 23 UA 107177 C2 розчину на фосфатному буфері при рН 7,4, а також 285 мл ад'юванту Фрейнда. Таблиця 5 описує часові рамки для ключових активностей за цим Прикладом. Таблиця 5 Дослідження активностей День дослідження 4,0-49 3 0 0-7 14 14-21 16-19 19 21 24 Дослідження активності Загальне спостереження за всіма нормальними і клінічними симптомами Зважували; Розподілили на групи; Відібрали зразків крові від усіх свиней Спостереження за здоров'ям; Вводили IVP № 1-7 Групам 1-7, відповідно Спостерігали свиней щодо реакцій в місцях ін'єкцій Ревакцинують Групу 7 ЦВС2 вакциною № 7; Зразки крові від усіх свиней Спостерігали Групу 7 щодо реакцій в місцях ін'єкцій Лікували всих свиней антибіотиками (дані відсутні) Свиней транспортували з першого тестового сайта в другий тестовий сайт Давали Групам 1-9 KLH/ICFA (гемоціанін морського блюдечка /неповний ад'ювант Фрейнда) Відбирали зразки крові і назальних мазків від усіх свиней; Зважували усіх свиней; Контрольно заражали Групи 1-8 ЦВС2 матеріалом для контрольного зараження 25, 27, 29, 31, 33, 35, Відбирали зразки назальних мазків від усіх свиней 37, 39, 41, 43, 45, 47 Давали Групам 1-9 KLH/ICFA (гемоціанін морського блюдечка /неповний 27 ад'ювант Фрейнда) 31 Відбирали зразки крові від усіх свиней Відбирали зразки крові і назальних мазків від усіх свиней; Зважували усіх свиней; Робили розтин усіх свиней; Відмічали загальні ураження, 49 приділяючи увагу жовтяниці та виразкам шлунка; Аналізували легені щодо уражень; Зберігали свіжі та зафіксовані формаліном зразки тканини; Завершували прижиттєву фазу дослідження 5 10 15 20 25 30 Після завершення прижиттєвої фази дослідження, зразки тканин, зафіксовані формаліном, аналізували за допомогою імуногистохімії (ІНС) для визначення ЦВС2 антигену патологоанатомом, зразки крові досліджували на ЦВС2 серологію, зразки назальних мазків досліджували на виділення ЦВС2, а також визначали середній приріст ваги тіла на день (ADWG) від 24 до 49 дня. Тварини були поміщені в перший сайт дослідження в індивідуальні клітини в п'яти кімнатах віком приблизно 11 днів (приблизно 0 день дослідження). Кожна кімната була ідентична за плануванням і складалась з набору індивідуальних клітин із нержавіючої сталі з доставкою нагрітого і фільтрованого повітря окремо в кожну ізольовану одиницю. Кожна кімната мала окремий нагрів і вентиляцію, що попереджає взаємне зараження повітря між кімнатами. Тварин розміщували в дві різні будівлі на другому сайті дослідження. Групу 9 (Група строгого негативного контролю) розміщували окремо в перебудовану будівлю для заключного етапу і Групи 1-8 розміщували в будівлю для розплідника. Кожну Групу розміщували в окрему секцію (11-12 свиней на секцію) і кожну сецію забезпечували приблизно 3,0 кв. футів на свиню. Кожна секція була на піднятій платформі з пластиковими щілинними підлогами. Яма ничже кожної секції слугувала в якості сливного баку для екскрементів та відходів. Кожна будівля мала свої власні окремі системи опалення та вентиляції з малою вірогідністю взаємного зараження повітря між будівлями. На першому сайті дослідження, поросят годували спеціально розробленим молочним раціоном від народження до приблизно 3 тижнів від народження. Всі свині отримували твердий, спеціально змішаний раціон до 19 дня (вік приблизно 4 Vi тижнів). На другому сайті дослідження всі свині необмежено отримували зроблений на заказ немедичний комерційний змішаний раціон, прийнятний для цього віку і маси. Вода на обох сайтах дослідження була також необмежено доступною. Всім тестовим свиням давали Вітамін Е на день 2 з ін'єкціями заліза на день 1 і з NAXCEL® (1,0 мл, ІМ, в друге стегно) на день 16, 17, 18 і 19. Додатково, Свиня № 52 (Група 9) отримувала ін'єкцію заліза на день 3, Свиня № 45 (Група 6) отримувала ін'єкцію заліза на день 11, Свиня № 69 (Група 8) отримувала NAXCEL® на день 6, Свиня № 74 (Група 3) отримувала дексаметазон і 24 UA 107177 C2 5 10 15 20 25 30 35 40 45 50 55 60 пеніцилін на день 14, та Свиня № 51 (Група 1) отримувала дексаметазон та пеніцилін на день ® 13 та NAXCEL на день 14 з різний причин стосовно здоров'я. Поки свині були на обох сайтах дослідження, вони були під ветериинарним наглядом. Дослідження здоров'я тварин провели на день 0 і записали в Форму Запису Дослідження Здоров'я. Всі тварини мали добре здоров'я і стан харчування до вакцинації, що було визначено спостереженням на день 0. За всіма тестовими тваринами спостерігали, щоб вони мали добре здоров'я і стан харчування перед контрольним зараженням. Туши і тканини ліквідували за допомогою переробки тваринної сировини. Кінцеву ліквідацію досліджуваних тварин реєстрували в Облік Ліквідації Тварин. На день 0, свині, розподілені в Групи 1-6, отримали 1,0 мл ЦВС2 вакцин 1-6, відповідно, ІМ в ліву ділянку шиї, застосовуючистерильний 3,0 мл шприц з наконечником Люера та стерильну 20 g x ½" голку. Свині, розподілені в Групу 7 отримували 2,0 мл ЦВС2 вакцини № 7 ІМ в ліву ділянку шиї, застосовуючи стерильний 3,0 мл шприц з наконечником Люера та стерильну 20 g x ½" голку. На день 14, свині розподілені в Групу 7 отримували 2,0 мл ЦВС2 вакцини № 7 ІМ в праву ділянку шиї, застосовуючи стерильний 3,0 мл шприц з наконечником Люера та стерильну 20 g x ½" голку. На день 21 всі тестові свині отримали 2,0 мл KLH/ICFA ІМ в праву ділянку стегна, застосовуючи стерильний 3,0 шприц з наконечником Люера та стерильну 20 g х ½" голку. На день 27 всі тестові свині отримали 2,0 мл KLH/ICFA в ліву ділянку стегна, застосовуючи стерильний 3,0 мл шприц з наконечником Люера та стерильну 20 g x ½" голку. На день 24, свині, розподілені в Групи 1-8 отримали 1,0 мл ЦВС2 ISUVDL матеріал для контрольного зараження (5,11 logio ТСID50/мл) внутрішньом'язово в ліву ділянку шиї, застосовуючи стерильний 3,0 мл шприц з наконечником Люера та стерильну 20 g х ½" голку. Додатково 1,0 мл того ж матеріалу вводили інтраназально кожній свині (0,5 мл на ніздрю), застосовуючи стерильний 3,0 мл шприц з наконечником Люера і назальну канюлю. Тестові свині щоденно досліджувалися щодо загального стану здоров'я та небажаних явищ на день 4 і з 0 до 19 дня. Спостереження записували в Облік Клінічних Спостережень. Тестових свиней спостерігали на реакції в місцях ін'єкції з дня 0 до дня 7, і Група 7 додатково спостерігали з дня 14 до 21. Середній приріст ваги тіла на день визначали зважуванням кожної свині на каліброваних вагах в дні 3, 24 та 49, або в день, коли свиня була знайдена мертвою після контрольного зараження. Значення ваги тіла записували в Форму Ваги Тіла. Показники ваги в день 3 застосовували для відбору свиней перед рандомізацією. Показники ваги в день 24 і день 49 застосовували для визначення середнього приросту ваги тіла на день (ADWG) для кожної свині протягом трьох часових точок. Для свиней, що померли після контрольного зараження і до дня 49, ADWG представляв собою ADWG з дня 24 до дня смерті. Для визнячення ЦВС2 серології, цілісну венозну кров збирали з кожного порося з орбітального венозного синусу на день 3 та 14. Для кожного порося кров збирали з орбітального венозного синусу шляхом введення стерильної капілярної трубочки в медіальний кантус в одно з очей і спускали приблизно 3,0 мл цілісної крові в 4,0 мл Пробірку Роздільника Сироватки (SST). В день 24, 31, і 49, венозну цілісну кров відбирали від кожної свині через передню полу вену, використовуючи стерильну 18g х 1 ½" вакуумну голку (Becton Dickinson і Company, Franklin Lakes, New Jersey), тримач вакуумної голки і 13 мл SST. Збирання крові в кожній часовій точці записували в Облік Збирання Зразків. Крові в кожній SST дозволяли згорнутися, кожну SST потім відкручували і потім відбирали сироватку. Відібрану сироватку переносили в стерильну пробірку із затискачем і зберігали при 70±10 °С до моменту тестування пізніше. Зразки сироватки тестували на присутність ЦВС2 антитіл за допомогою BIVI-R&D персоналу. Свиней оглядали один раз на день з дня 20 до дня 49 щодо клінічних симптомів, клінічні спостереження записували в Облік Клінічного Спостереження. Для тестування назального виділення ЦВС2 в дні 24, 25 і потім кожний непарний день дослідження до 49 дня включно, стерильний валик з дакрону вводили інтраназально або в ліву, або в праву ніздрю кожній свині (один валик на свиню) якомога асептично, прокручували декілька секунд і потім витягували. Кожний валик потім поміщали в окрему стерильну пробірку з кришкою з затискачем, що містить 1,0 мл ЕМЕМ середовища з 2 % IFBS, 500 одиниць/мл пеніциліну, 500 мг/мл стрептоміцину і 2,5 мг/мл фунгізону. Валик розбивали в пробірці, пробірку із затискачем герметично закривали і відповідно мітили, відмічаючи номер тварини, номер дослідження, дату забору, дату дослідження і "назальний мазок". Герметично закриті пробірки із затискачем зберігали при -40±10 °C, доки їх транспортували протягом ночі на льоду до BIVI-St. Joseph. Збирання назальних мазків записували у Форму Збирання Зразку Назального Мазку. BIVI-R&D проводили кількісну вірусну ізоляцію (ВІ), аналізуючи ЦВС2 на зразках назальних 25 UA 107177 C2 5 10 15 20 25 30 35 мазків. Результати були виражені в logio значеннях. Значення 1,3 log або менше розглядали як негативне, а будь-яке значення, вище за 1,3 log розглядали як позитивне. Свиней, що вмерли (№№ 28, 52, 56, 69, 82 і 93) на першому сайті дослідження, піддали розтину таким чином, щоб визначити діагноз. Загальні ураження записували і жодну тканину від цих свиней не зберігали. На другому сайті свиней, що померли до дня 49 (№№ 45, 23, 58, 35), свиней, знайдених мертвими на день 49 до евтаназії (№№ 2, 43) і свиней, що евтаназували на день 49, піддали розтину. Будь-які відмічені ураження і відсотки легень з ураженнями записували у Форму Обліку Розтину. Від кожної з 103 свиней, що розтинають на другому сайті дослідження, зразок тканини піднебінної мигдалини, легені, серця, печінки, кишкового лимфовузлу поміщали в окремі ємності з забуференим 10 % формаліном; в той час як інші зразки тканини з тих самих вищезгаданих органів поміщали в Whirl-pak (M-Tech Diagnostics Ltd., Thelwall, UK) і кожний Whirl-pak поміщали у лід. Кожну ємність відповідним чином мітили. Відбори зразків записували до Форми Обліку Розтину. Після цього зразки тканини, зафіксовані у формаліні, а також Форма Діагностичної Вимоги підлягали імуногістохімічному (ІНС) тестуванню. ІНС тестування проводили відповідно до стандарту ISU лабораторних процедур для отримання зразків, приготування зразків і препаратів, і технологій офарблення. Свіжі тканин в Wliirl-pak завантажували з пакетом льоду у прилад для дослідження на зберігання (-70±10 °C) і можливе подальше використання. Зафіксовані у формаліні тканини досліджував патоморфолог для визначення ЦВС2 за допомогою імуногістохімії (ІНС) і оцінював, використовуючи наступну систему оцінювання: 0 = Нічого; 1 = незначне позитивне офарблення, декілька ділянок; 2 = помірне позитивне офарблення, множинні ділянки; і 3 = поширене позитивне офарблення по всій тканині. Через те, що патомоорфолог не міг позитивно диференціювати паховий лімфовузел (LN) від мезентеріального лімфавузла (LN), результати від цих тканин були просто помічені як лимфовузел, і оцінку давали найвищій оцінці для кожної з цих двух тканин для кожної тварини. Результати Результати цього прикладу наведені нижче. Зазначили, що одна свиня з Групи 9 померла на день 0, і також 5 свиней померло після вакцинації (1 свиня з Групи 4; 1 свиня з Групи 6; 2 свині з Групи 8; і 1 свиня з Групи 9). Дослідження після смерті виявили, що всі шість померли від вищезазначених інфекцій, що не були пов'язані з вакцинацією або PMWS. Крім того, ніяких небажаних явищ або реакцій в місці ін'єкції не було виявлено в жодній групі. Результати середнього приросту ваги тіла на день (ADWG) представлені нижче в Таблиція 6. Група 9, група строгого негативного контролю, мала найвищий ADWG (1,06±0,17 фунт/день), далі за нею Група 5 (0,94±0,22 фунт/день), що отримувала одну дозу 8 мкг рBPЗ2. Група 3, що отримувала одну дозу 4 мкг вBPЗ2, мала найнижчий ADWG (0,49±0,21 фунт/день), далі за нею Група 7 (0,50±0,15 фунт/день), що отримувала 2 дози убитої вакцини. Таблиця 6 Сумарні дані середнього приросту ваги тіла на день (ADWG) в групах Група 1 2 3 4 5 6 7 8 9 Лікування № вBPЗ2-16 мкг (1 доза) вBPЗ2-8 мкг (1 доза) вBPЗ2-4 мкг (1 доза) рBPЗ2-16 мкг (1 доза) рBPЗ2-8 мкг (1 доза) рBPЗ2-4 мкг (1 доза) УВ (2 дози) Контрольні зараження Строгий негативний контроль 12 12 12 11 12 11 12 10 11 ADWG-фунт/день (24 49 день) або розрахований для свиней, що померли до 29 дня 0,87±0,29 фунт/день 0,70±0,32 фунт/день 0,49+0,21 фунт/день 0,84±0,30 фунт/день 0,94±0,22 фунт/день 0,72±0,25 фунт/день 0,50±0,15 фунт/день 0,76±0,19 фунт/день 1,06±0,17 фунт/день в BPЗ2 = виділенний вірусний ВРЗ2; рBPЗ2 = рекомбінатний еспресований бакуловірусом BPЗ2; убитий вірус = ЦВС2 вірус, вирощений у відповідній клітинній культурі. 40 Результати ЦВС2 серології представлені нижче в Таблиці 7. Всі дев'ять груп були серонегативні за ЦВС2 на день 3. На день 14, групи, що отримували вBPЗ2 вакцини мали 26 UA 107177 C2 5 10 навищі титри, що були в діапазоні від 187,5 до 529,2. Свині, що отримували вбиту вірусну вакцину мали наступні найвищий титри, далі за групами, що отримували рBPЗ2 вакцини. Групи 8 і 9 залишалися серонегативними весь час. На день 24 і день 31, свині, що отримували вBPЗ2 вакцини продовжували демонструвати сильну серологічну відповідь, йдучи тісно далі за групою, що отримувала дві дози вбитої вірусної вакцини. Свині, що отримували рBPЗ2 вакцини, повільно проявляли серологічну відповідь, а Групи 8 і 9 продовжували залишатися серонегативними. На день 49, свині, що отримували вBPЗ2 вакцини, 2 дози вбитої вірусної вакцини і найнижчу дозу BPЗ2, демонстрували найсильніші серологічні відповіді. Свині, що отримували 16 мкг і 8 мкг рBPЗ2 вакцин, мали трохи вищі ІФД титри, ніж в контролях контрольного зараження. Група 9 на день 49 демонструвала сильну серологічну відповідь. Таблиця 7 Сумарні дані ЦВС2 ІФД титрів у групах Група 1 2 3 4 5 6 7 8 9 Лікування 3 день вBPЗ2-16 мкг (1 доза) 50,0 вBPЗ2-8 мкг (1 доза) 50,0 вBPЗ2-4 мкг (1 доза) 50,0 рBPЗ2-16 мкг (1 доза) 50,0 рBPЗ2-8 мкг (1 доза) 50,0 рBPЗ2-4 мкг (1 доза) 50,0 УВ (2 дози) 50,0 Контрольні зараження 50,0 Строгий негативний 50,0 контроль 14 день 529,2 500,0 187,5 95,5 75,0 50,0 204,2 55,0 24 день 4400,0 3466,7 1133,3 1550,0 887,5 550,0 3087,5 50,0 31 день** 7866,7 6800,0 5733,3 3090,9 2266,7 3118,2 4620,8 50,0 49 день*** 11054,5 10181,8 9333,3 8000,0 7416,7 10570,0 8680,0 5433,3 59,132; 59,1 54,5 6136,4 в BPЗ2 = виділений вірусний ВРЗ2; рBPЗ2 = рекомбінатний еспресований бакуловірусом BPЗ2; убитий вірус = ЦВС2 вірус, вирощений у відповідній клітинній культурі *Для розрахунку, ІФД титр 100 був охарактеризований як титр "50"; ІФД титр 6400 був охарактеризований як титр "12 800" **День контрольного зараження ***День розтину 15 20 25 30 Результати клінічних спостережень після контрольного зараження представлені нижче в Таблиці 8. Це узагальнення результатів включає спостереження ненормальної поведінки, ненормального дихання, кашлю і діареї. Таблиця 9 включає результати сумарних даних загальної частоти виникнення клінічних симптомів у групах, і Таблиця 10 включає результати з сумарних даних показників смертності після контрольного зараження. Найбільш поширеним клінічним симптомом, виявленим в дослідженні, була ненормальна поведінка, що була оцінена як летаргія від помірної до тяжкої. Свині, що отримували 2 нижчі дози вBPЗ2, свині, що отримували 16 мкг рBPЗ2 і свині, що отримували 2 дози УВ вакцини мали показники захворюваності >27,3 %. Свині, що отримували 8 мкг рBPЗ2 і група строгого негативного контролю не мали ненормальної поведінки. Жодна свиня в даному дослідженні не мала ненормального дихання. Кашель відзначався часто в усіх групах (0-25 %), як і діарея (0-20 %). Жоден з відзначених клінічних симптомів не був патогономічним до PMWS. Загальна частота виникнення клінічних симптомів відрізнялася між групами. Групи, що отримували будь-яку з вBPЗ2 вакцин, група, що отримувала 16 мкг рBPЗ2, група, що отримувала 2 дози УВ вакцини і конрольна група контрольного зараження мали найвищу частоту виникненя загальних клінічних симптомів ( 36,4 %). Група строгого негативного контролю, група, що отримувала 8 мкг рBPЗ2 і група, що отримувала 4 мкг рBPЗ2 мали показники загальної частоти виникнення клінічних симптомів 0 %, 8,3 % і 9,1 %, відповідно. Загальні показники смертності між групами також відрізнялися. Група, що отримувала 2 дози УВ вакцини мала найвищий показник смертності (16,7 %); тоді як групи, отримували 4 мкг вBPЗ2, 16 мкг рBPЗ2, або 8 мкг рBPЗ2 і група строгого негативного контролю мали 0 % показники смертності. 35 27 UA 107177 C2 Таблиця 8 Сумарні дані спостереження за ненормальною поведінкою, ненормальним диханням, кашлем та діареєю в групах Група Лікування № Ненормаль на 1 поведінка 1 вBPЗ2-16мкг (1 доза) 12 2/12 (16,7 %) 0/12 (0 %) 2 вBPЗ2-8 мкг (1доза) 12 4/12 (33,3 %) 0/12 (0 %) 3 вBPЗ2-4мкг (1 доза) 12 8/12 (66,7 %) 0/12 (0 %) 4 рBPЗ2-16мкг (1 доза) 11 3/11 (27,3 %) 0/11 (0 %) 5 6 рBPЗ2-8 мкг (1 доза) рBPЗ2-4 мкг (1 доза) 12 11 0/12 (0 %) 1/11 (9,1 %) 0/12 (0 %) 0/11 (0 %) 7 УВ (2 дози) 12 7/12 (58,3 %) 0/12 (0 %) 8 Контрольні зараження Строгий негативний контроль 10 1/10 (10 %) 0/10 (0 %) 2/12 (16,7 %) 1/12 1/12 (8,3 %) (8,3 %) 2/12 1/12 (16,7 %) (8,3 %) 2/11 0/11 (0 %) (18,2 %) 1/12 (0 %) 0/12 (0 %) 0/11 (0 %) 0/12 (0 %) 1/12 0/12 (0 %) (8,3 %) 2/10 (20 %) 2/10 (20 %) 11 0/11 (0 %) 0/11 (0 %) 0/11 (0 %) 0/11 (0 %) 9 Ненормаль на Кашель3 2 поведінка Діарея4 3/12 (25 %) в BPЗ2 = виділений вірусний ВРЗ2; рBPЗ2 = рекомбінатний еспресований бакуловірусом BPЗ2; убитий вірус = ЦВС2 вірус, вирощений у відповідній клітинній культурі. 1 Загальне число свиней в кожній групі, що демонструють будь-яку ненормальну поведінку протягом щонайменше одного дня 2 Загальна кількість свиней в кожній групі, що демонструють будь-яке ненормальне дихання протягом щонайменше одного дня 3 Загальна кількість свиней в кожній групі, що демонструють кашель протягом щонайменше одного дня 4 Загальна кількість свиней в кожній групі, що демонструють діарею протягом щонайменше одного дня Таблиця 9 Сумарні дані загальної частоти виникнення клінічних симптомів і в групах Група Лікування 1 2 3 4 5 6 7 8 9 вBPЗ2-16 мкг (1 доза) вBPЗ2-8 мкг (1доза) вBPЗ2-4 мкг (1 доза) рBPЗ2-16 мкг (1 доза) рBPЗ2-8 мкг (1 доза) рBPЗ2-4 мкг (1 доза) УВ (2 дози) Контрольні зараження Строгий негативний контроль Частота виникнення свиней з клінічними 1 симптомами 5 5 8 4 1 1 7 4 0 № 12 12 12 11 12 11 12 10 11 Показник частоти виникнення 41,7 % 41,7 % 66,7 % 36,4 % 8,3 % 9,1 % 58,3 % 40 % 0% в BPЗ2 = виділений вірусний ВРЗ2; рBPЗ2 = рекомбінатний еспресований бакуловірусом BPЗ2; убитий вірус = ЦВС2 вірус, вирощений у відповідній клітинній культурі 1 Загальна кількість свиней в кожній групі, що демонструють будь-який клінічний симптом протягом щонайменше одного дня. 28
ДивитисяДодаткова інформація
Автори англійськоюEichmeyer Marc, Nitzel Greg, Schaeffer Merrill
Автори російськоюНитзель Грег
МПК / Мітки
МПК: A61P 31/12, A61K 35/76
Мітки: спосіб, приготування, композиція, цвс2, композиції, такої, імуногенна
Код посилання
<a href="https://ua.patents.su/50-107177-imunogenna-kompoziciya-cvs2-ta-sposib-prigotuvannya-tako-kompozici.html" target="_blank" rel="follow" title="База патентів України">Імуногенна композиція цвс2 та спосіб приготування такої композиції</a>
Попередній патент: Електричний інсталяційний прилад з підзарядним пристроєм для мобільного телефону
Наступний патент: Корпус насоса