Нова лактобацила, препарат лактобацили, що активує живі організми, та профілактичний або лікувальний засіб для лікування інфекції живих організмів
Формула / Реферат
1. Штам Lactobacillus casei FERM BP-10059 (FERM P-19443), що має властивості пробіотика.
2. Препарат лактобацили, який мiстить штам Lactobacillus casei FERM BP-10059 (FERM P-19443) за п. 1 як основний активний інгредієнт.
3. Профiлактичний або лiкувальний засiб проти iнфекцiй у людей, тварин та рослин, що мiстить штам Lactobacillus casei FERM BP-10059 (FERM P-19443) за п. 1 як основний активний інгредієнт.
4. Профiлактичний або лiкувальний засiб проти iнфекцiй у людей, тварин та рослин за п. 3, де профiлактичний або лiкувальний засiб проти iнфекцiй у людей, тварин та рослин за п. 3 мiстить антибiотик.
5. Профiлактичний або лiкувальний засiб проти iнфекцiй у людей, тварин та рослин за п. 3 або 4 для лiкування перiодонтального захворювання, де вказаний засіб необхідно наносити на вражену область пiсля дезінфекції ураженої областi бактерицидним дезінфікуючим засобом.
6. Профiлактичний або лiкувальний засiб проти iнфекцiй у людей, тварин та рослин за п. 5, де згаданим бактерицидним дезінфікуючим засобом є бактерицидний дезінфікуючий засiб, що мiстить вiд 500 до 1500 млн-1 iонiв залiза (III), вiд 500 до 2000 млн-1 L-аскорбiнової кислоти та вiд 200 до 2000 млн-1 однiєї або двох кислот, вибраних з сорбiнової кислоти, бензойної кислоти та ефiру параоксибензойної кислоти, як основні компоненти.
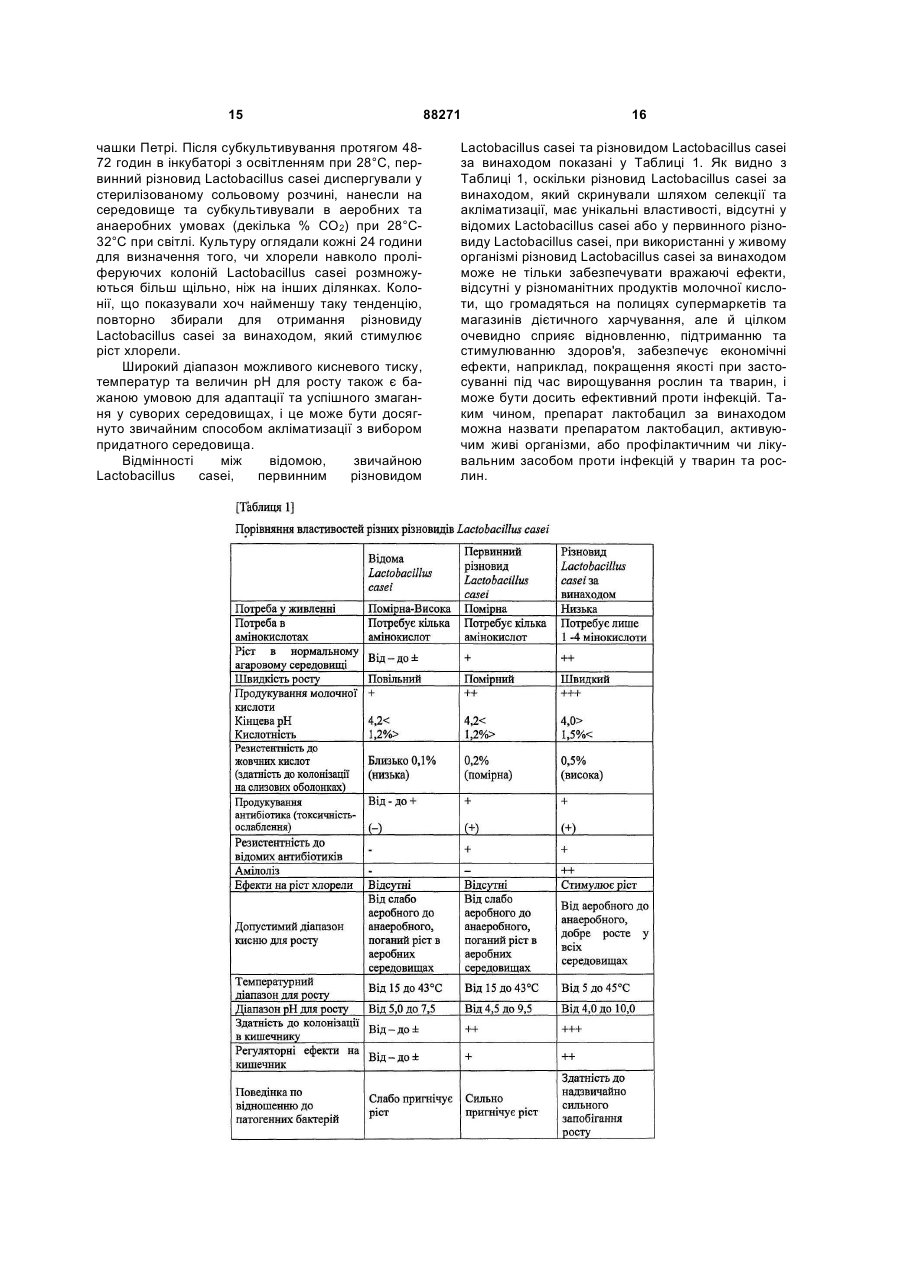
Текст
1. Штам Lactobacillus casei FERM BP-10059 (FERM P-19443), що має властивості пробіотика. 2. Препарат лактобацили, який мiстить штам Lactobacillus casei FERM BP-10059 (FERM P19443) за п. 1 як основний активний інгредієнт. C2 2 88271 1 3 того, останнім часом посилилися фактори, що впливають як на бактерії, так і на їх хазяїв, ускладнюючи обставини хвороби, внаслідок чого інфекції тривають довше або є більш тяжкими та складними для лікування. Перша перемога людей у війні з інфекційними захворюваннями сталася в середині двадцятого сторіччя з винаходом антибіотиків, спочатку пеніциліну. На відміну від попередніх засобів, завдяки його вражаючим ефектам цей засіб отримав назву "магічної кулі": здавалося, що інфекцію вже переможено, і вираз "інфекційне захворювання" незабаром буде забутий. Проте бактерії не так легко перемогти, і надмірне застосування антибіотиків привело до появи та поширення бактерій, стійких до ліків. Виживши та перегрупувавшись, ці бактерії атакують знову. Бактерії, що набули резистентності, здатні передавати цю резистентність усьому виду шляхом кон'югації особливих фрагментів ДНК (генів резистентності), званих R-плазмідами. В результаті стало дійсно здаватися, що медицина знаходиться за крок від поразки, внаслідок переважання та поширення метицилін-резистентних Staphylococcus aureus (MRSA), головної причини шпитальних інфекцій, та інших мультирезистентних бактерій, включаючи ванкоміцин-резистентні Enterococcus (VRE), Pseudomonas aeruginosa, Mycobacterium tuberculosis, Shigellaflexneri та інші. Наприклад, доведено, що 80% дорослих людей страждають на періодонтальні захворювання, при яких оточуючі тканини, що підтримують зуб, включаючи ясна, цементну речовину зуба, періодонтальні зв'язки, альвеолярний відросток тощо, запалюються та поступово руйнуються. Це зумовлено бактеріями, які переважно колонізуються та утворюють бляшку в періодонтальній тканині, зокрема у канавках в області шийки на межі між зубом та яснами. На яснах виникає місцеве запалення через токсини та ферменти, продуковані цими бактеріями, що приводить до гінгівіту та зрештою до утворення ясенних кишень, де ці бляшки накопичуються, зумовлюючи періодонтит. Якщо симптоми посилюються, кишені поглиблюються та розширюються, запалення поширюється на корені зуба та поступово руйнує його, і рано чи пізно він випадає. Зокрема, на початкових стадіях періодонтального захворювання, ясна в області шийки, до якої прикріплюється бляшка, червоніють та набрякають, втрачаючи еластичність та кровоточачи під час чистки зубів. Якщо на це не зважати, бляшка поступово росте та утворює зубний камінь, відкриваючи область шийки з утворенням періодонтальних кишень. Зубний камінь утворює бар'єр, який запобігає вичищенню розташованої під ним бляшки, так що бактерії набувають сили, і їх токсини зумовлюють постійний ріст кишень, а запалення поширюється з ясен на періодонтальну зв'язку та альвеолярний відросток, викликаючи кровотечу та утворення гною з неприємним запахом з рота, при цьому інфекція поширюється на сусідні зуби, один за одним. Якщо запалення кишень стає хронічним, альвеолярний відросток, який підтримує корені зубів, починає руйнуватися з поверхні, що супроводжується набряком ясен, зуби хитаються, тому що вони не мають належної 88271 4 опори, виникає сильний запах з рота та біль при сильному накушуванні. З розвитком захворювання більша частина альвеолярного відростка втрачається, корені зубів оголюються, зуби стають більш розхитаними, пацієнт вже не може їсти тверду їжу, і зрештою зуби випадають один за одним. Тому спеціалісти визнають періодонтальне захворювання класичною моделлю хронічного інфекційного захворювання, що досі важко піддається лікуванню. Інша проблема стосується самих лікарських засобів: лікарські засоби є чужорідними для організму та спричиняють побічні ефекти у тій чи іншій мірі; на думку спеціалістів, чим ефективнішим є лікарський засіб, тим серйозніші його побічні ефекти. Загалом вважається, що у пацієнтів похилого віку ефекти лікарських засобів вдвічі зменшуються, у той час як побічні ефекти подвоюються факт, який не можна ігнорувати, враховуючи старіння суспільства. Все суворіші вимоги суспільства до безпечності та надійності лікарських засобів також не можна ігнорувати. Випадкові смерті від побічних ефектів продовжують траплятися. Антибіотики не є виключенням, бо вони фактично спричиняють набагато сильнішу кров'яну токсичність, ніж інші лікарські засоби, включаючи алергічну реакцію, яку називають "пеніциліновим шоком", а також лейкопенію, анемію тощо, і, в результаті, втрату імунноїсили, що було визнано громадськими установами. Проте, оскільки антибіотики є практично незамінними, досі це не вважалося великою проблемою, за виключенням дійсних випадків серйозних хвороб або смерті. Антибіотики мають ще один побічний ефект, на перший погляд не очевидний: вони вражають кишкову флору, яку іноді називають життєво важливим органом, викликаючи її мікробне заміщення. Тобто, імунна функція додатково пригнічується синергічним ефектом кров'яної токсичності у поєднанні зі зниженням кількості благотворних кишкових бактерій, які є дуже чутливими до антибіотиків, що сприяє хронічним інфекціям і веде до нових вірусних захворювань та інших інфекцій. Фактично, бактерії, що викликають типові хронічні інфекції, такі як періодонтальне захворювання, синусит, геморой тощо, часто є антибіотико-резистентними, і тому лікарський засіб виявляється неефективним, а побічні ефекти накопичуються. Навіть у відсутність резистентності, чим довше застосовується антибіотик, тим більше ризик мутації у резистентні штами. На індивідуальному рівні, постійний вплив токсинів від патогенних бактерій може бути смертельним у поєднанні зі зниженою імунною функцією, у той час як на суспільному рівні резистентні бактерії перетинають національні кордони і спричиняють непередбачену шкоду в усьому світі. У Сполучених Штатах та Європі ідея будування організму, який не хворіє, замість того щоб лікувати його, коли він вже захворів (превентивна медицина) розвивається вже більше десятиріччя, і одним з ефективних засобів для цього, завдяки їх безпечності, були визнані "пробіотики," які надають допомогу благотворним бактеріям. Дослідження лактобацил було розпочато у Франції Пастером, батьком сучасної мікробіології, 5 знайшло розвиток у теорії "подовження життя" росіянина Мечникова та в багатьох наступних клінічних дослідженнях, але й досі не має дійсного практичного застосування. Це зумовлене тим, що результати епідеміологічних досліджень не співпадають з результатами експериментальних пошуків. Проте нещодавні успіхи кишкової бактеріології продемонстрували, що лактобацили виконують такі важливі функції. (1) Нормалізація імунної функції: Нормалізують та посилюють імунну функцію, що є необхідною для підтримання життя. (2) Очищення кишечнику: Врівноважують кишкову флору, пригнічують розмноження шкідливих бактерій та пригнічують надмірну ферментацію та продукування шкідливих бактерій в кишечнику. (3) Очищення крові: очищають кров, що є продовженням функції очистки кишечнику. (4) Сприяння засвоєнню їжі: Сприяють синтезу вітамінів та амінокислот; полегшують абсорбцію поживних речовин через стінки кишок. (5) Запобігання інфікуванню шкідливими бактеріями: Запобігають розмноженню та інфекціям у кишечнику, навіть якщо шкідливі бактерії проникають ззовні. (6) Клітинна нормалізація: Сприяють нормалізації клітинних функцій. Також і в Японії, де старіння суспільства та витрати на охорону здоров'я набувають масштабів національної проблеми, визнано важливість профілактики захворювань, і суспільство в цілому все більше опікується своїм здоров'ям. В результаті постійно росте кількість продуктів, що містять у якості інгредієнта лактобацили, і розробляється все більше так званих "функціональних йогуртів". Проте дійсність полягає в тому, що, якщо робити перерви у вживанні таких продуктів, ефекти, згадані у (1)-(6), та деякі інші ефекти на захворювання будуть нечисленними, а фактична ефективність проти інфекцій - досить примарною. У цих обставинах автори винаходу пропонують застосовувати проти інфекцій бацилу молочної кислоти, що має унікальні властивості, яка була виділена та селекціонована авторами у травні 2000 p., з метою усунення шкідливих ефектів традиційних антибіотиків, таких як поширення резистентних до ліків бактерій, алергії на лікарські препарати, побічні ефекти та проблеми впливу на нормальну бактеріальну флору, і у зв'язку з цим представляють патентну заявку на "Нову бактерію молочної кислоти, ефективну проти інфекційних захворювань, та препарат лактобацили, що містить бактерію молочної кислоти у якості основного інгредієнта" (викладена патентна заявка Японії №2001-333766). Ця заявка стосується бацили молочної кислоти, що є різновидом Lactobacillus саsеі, яка не тільки інгібує рост патогенних бактерій, але також продукує "нові біоактивні речовини", що мають властивість ослабляти токсичність патогенних бактерій, та препарату Lactobacillns для гострих та хронічних інфекцій, який містить цю бактерію у якості основного компонента. Детальніше, з Lactobacillus casei, взятих у природі, ми відібрали лише ті штами, що продукують антибіотик широко 88271 6 го спектра, і тоді скринували на гемолітичні та S-R мутації, з підтвердженням за допомогою тестів на тваринах, для визначення того, чи цей антибіотик ослабляє токсичність патогенних бактерій, і зрештою три штами Lactobacillus casei, які задовольняли цим критеріям, FERM ВР-6771, FERM ВР-6772 та FERM BP-6773, були застосовані проти інфекцій. їм також було надано резистентність до антибіотиків широкого застосування, так щоб вони могли бути використані для лікування у поєднанні з цими антибіотиками. У випадках гострих інфекцій, таких як гострий коліт, гострий цистит, гострий бронхіт тощо, покращенні ефекти лікування були досягнуті шляхом застосування цих Lactobacilli у поєднанні з антибіотиком, порівняно із застосуванням лише самих традиційних антибіотиків, включаючи (і) знижене дозування антибіотика, (іі) скоріше покращення симптомів та скоріше відновлення з меншою кількістю побічних ефектів, і (ііі) менш значне порушення кишкової флори та зниження шкідливих ефектів від лікарського засобу. Проте для виникнення лікувальних ефектів потрібний час, і у випадку хронічних інфекцій, таких як гінгівіт, синусит, бронхіт та геморой, повне вилікування не було досягнуте. Як описано вище, задача складається в культивуванні Lactobacillus casei, здатних утворювати колонії та проліферувати в осередку хронічної інфекції, що чинить опір лікуванню, та забезпеченні потужної очищувальної дії при ліквідації бактерій, які є причиною захворювання. В результаті вичерпного дослідження, спрямованого на вирішення вищезгаданих задач, авторам вдалося досягнути цієї мети завдяки висновкам, зробленим на основі вивчення системи вагінального очищення, яка підтримує це середовище чистим, хоча воно постійно є відкритим для бактеріального зараження. Тобто, винахід стосується різновиду Lactobacillus casei, що має властивості, описані нижче в пп. (1), (2), (3), (4) та (5), переважно різновиду Lactobacillus casei FERM BP-10059 (FERM P19443): (1) Цей різновид може бути вирощений у присутності 1-4 амінокислот у якості джерела азоту, необхідного для росту; (2) Коли культуральне середовище, стимулююче ріст, інокулюють цим різновидом та Escherichia coli в однаковій кількості та піддають анаеробному змішаному культивуванню при 37°С, кінцева кількість лактобацил складає 50% або більше від кількості кишкової палички; (3) Після культивування у відповідному культуральному середовищі кінцева величина рН складає 4,0 або нижче, а найвища кислотність 1,5% або більше; (4) Цей різновид є резистентним до 5% солей жовчних кислот; (5) Цей різновид продукує антибіотик. По-друге, винахід стосується різновиду Lactobacillus casei, який має щонайменше одну з наступних властивостей, на додаток до властивостей, описаних вище, і цей різновид Lactobacillus casei являє собою FERM BP-10059 (FERMP19443): 7 (a) Має резистентність до антибіотиків широкого застосування; (b) Має амілолітичну здатність; (c) Сприяє росту хлорели; (d) Росте при температурах у діапазоні 5°С45°С; (e) Росте при величинах рН у діапазоні 4,010,0; (f) Також може рости при будь-якому кисневому тиску. По-третє, винахід стосується препарату лактобацил, активуючого живі організми, що містить різновид Lactobacillus casei, описаний вище, у якості основного активного інгредієнта, при цьому згаданим різновидом Lactobacillus casei є FERM ВР-10059 (FERM Р-19443). По-четверте, винахід стосується засобу для профілактики або лікування інфекцій живих організмів, який містить різновид Lactobacillus casei, описаний вище, у якості основного активного інгредієнта, що переважно включає антибіотик, і який переважно застосовують в ураженій області при лікуванні періодонтального захворювання після обробки ураженої області бактерицидним дезінфікуючим засобом, при цьому згаданий бактерицидний дезінфікуючий засіб переважно містить 5001500млн-1 іонів заліза(III), 500-2,000млн-1 Lаскорбінової кислоти та 200-2000млн-1 однієї або щонайменше двох кислот, вибраних з сорбінової кислоти, бензойної кислоти та ефіру параоксибензойної кислоти, у якості основних компонентів, і згаданим різновидом Lactobacillus casei переважно є FERM ВР-10059 (FERM Р-19443). Сьогодні суспільство в цілому перш за все цінує безпечність та надійність, і в охороні здоров'я та медицині концепція "пробіотиків" зайняла центральну позицію, зокрема, на заході. Концепція пробіотиків включає застосування бактерій та інших мікроорганізмів, які є симбіотичними організмами, що живуть у кишечнику та є благотворними для організму, і способи активної профілактики та лікування захворювань з використанням таких бактерій, зокрема, внутрішнє застосування лактобацил,в тому числі Lactobacillus bifidus та ін. Автори винаходу скористалися цим для розробки препарату лактобацили за винаходом, що містить різновид Lactobacillus casei, якому було надано унікальні властивості. Займаючи передову позицію серед пробіотиків, цей препарат не тільки спричиняє виразні ефекти відновлення, підтримання та стимулювання здоров'я, але також забезпечують лікувальні ефекти, яких не мають традиційні продукти такого ж типу по відношенню до хронічних випадків інфекцій, що погано лікуються навіть сучасною медициною. Крім того, оскільки лактобацила за винаходом є антибіотикорезистентною, може бути досягнуте прискорене лікування у комбінації з антибіотиками. У цьому випадку мінімальне дозування антибіотика буде достатнім, і різноманітні шкідливі ефекти лікарського засобу, властиві йому, такі як побічні ефекти та поширення резистентних бактерій, можуть бути знижені. Крім того, в контексті збільшення дегенеративних захворювань у старіючому суспільстві та підвищення хронічних інфекцій внаслідок старіння, 88271 8 незважаючи на неминуче зростання медичних витрат, роль препарату лактобацил за винаходом як способу вирішення цих проблем буде набувати у майбутньому все більшої важливості. До відкриття антибіотиків, у світі робилося надто мало зусиль у напрямку лікування періодонтального захворювання. Бактерії в осередках періодонтального захворювання вважалися також причиною серцевого захворювання та інших смертельних хвороб, і через цю гадану небезпеку зуби з каріозними порожнинами або періодонтальним захворюванням видаляли без вагань. Завдяки цій теорії стоматологія довгий час складалася не з лікування захворювань, а з видалення зубів та розвитку технологій протезування. Ця ситуація почала покращуватися з появою антибіотиків, а у 80-х роках XX сторіччя дослідження патогенів періодонтального захворювання дозволило краще зрозуміти механізм розвитку цього захворювання. Це привело до створення фундаментального способу лікування, що складався у видаленні бляшки та зубного каменя, в результаті чого запалення слабшало, зменшувалася глибина періодонтальної кишені, розхитані зуби вирівнювалися та більше не хиталися, а коли це не допомагало, робили хірургічні операції на яснах. Таким чином, розвивалися терапевтичні стратегії захисту зубів. З іншого боку, неподатливість періодонтального захворювання була заново оцінена, коли виявилося, що бактерії, які ховаються всередині ясен, утворюють особливі колективні структури та бар'єри, знижуючи фармацевтичні ефекти антибактеріальних та бактерицидних лікарських засобів, і що звички, умови життя та генетичні особливості пацієнта також впливають на виникнення та розвиток цього захворювання. Тому, мабуть, від відчуття марності, за останнє десятиріччя було зроблено дуже мало кроків у вивченні та лікуванні періодонтального захворювання. В eпоху суспільства довгожителів спеціалісти поступово виявили тісний зв'язок між зубами та фізичним здоров'ям, зрозумівши, що зуби не лише виконують жувальну функцію, а взагалі відіграють важливу роль у житті, і суспільство зрозуміло, що для того, щоб запобігти деменції, раку, інсульту, серцевим захворюванням тощо, щоб надати організму сили природного зцілення та покращити системні функції, зуби необхідно лікувати. Тобто, стало зрозуміло, що зуби є незамінним органом і що завдяки зубам можливо покращити фізичні та психологічні функції, запобігти старінню та підвищити задоволення від життя взагалі. Втрата зубів, каріозні порожнини та імплантація замість природних неякісних штучних зубів може привести до постійної та кумулятивної стресової реакції живого організму. Оскільки останнім часом особлива увага приділяється побічним ефектам та недолікам лікарських засобів, розробка безпечного профілактичного та лікувального засобу за винаходом, який зумовлює мінімальне фізичне, психологічне або фінансове навантаження на лікаря або пацієнта, є багатообіцяючою для революціонізування лікування періодонтального захворювання, яке часто іронічно називають "зачищувальним" лікуванням, має бути доброю новиною для всього людства, 9 оскільки наша мета -суспільство, в якому природно мати свої власні зуби. Замість дезінфікуючих засобів та антибіотиків, що досі широко застосовувалися у лікувальному процесі, препарат лактобацил за винаходом, який має унікальні властивості та високу спорідненість до слизових оболонок, у комбінації з бактерицидним дезінфікуючим засобом (USP 6296881В1), розробленим авторами винаходу, який не впливає на слизові оболонки, але спричиняє сильні ефекти на патогенні бактерії, є прекрасним профілактичним засобом та лікувальним засобом для періодонтального захворювання, здатним забезпечувати майже повне вилікування у випадках періодонтального захворювання, від первинних до пізніх стадій, незалежно від технічних можливостей дантиста, доки зберігається альвеолярний відросток, підтримуючий зуби. Крім того, лікувальний засіб для періодонтального захворювання за винаходом може бути застосований на додаток до традиційних способів лікування періодонтального захворювання. Крім того, застосування препарату лактобацил за винаходом може сприяти росту тварин при розведенні свиней, курей, макрелі, комах та інших тварин, забезпечує покращення якості та профілактику захворювань; препарат показує сильні лікувальні ефекти проти різноманітних захворювань, включаючи водний грибок Saproglenia та виразкове захворювання у золотих рибок. Крім того, може бути прискорений ріст та забезпечена підвищена якість при застосуванні препарату лактобацил за винаходом для рослин, включаючи суниці, шпинат та інші овочеві й трав'янисті рослини. На додаток до профілактики захворювань, він також ефективний у лікуванні захворювань рослин, таких як справжня та несправжня борошниста роса в огірків. Поява препарату лактобацил за винаходом вносить свіжу струю в непорушну традиційну концепцію лікування інфекцій антибіотиками або сільськогосподарськими хімікатами, і має внести значний вклад у майбутнє визнання та розвиток пробіотиків. Лактобацили дуже поширені в природі, починаючи з кишечника, ротової порожнини та інших частин живого організму і закінчуючи листям дерев, травою, злаками, фруктами, ґрунтом та стічними водами, і знаходяться у великій кількості у всіх місцях, де є життя. Тому вони мимоволі використовувалися при обробці та зберіганні їжі з давніх часів, коли люди навіть не здогадувалися про їх існування, тоді як сьогодні важлива роль лактобацил визнана з точки зору наукової перспективи, і вони привертають до себе увагу як пробіотики. Автори зробили крок до отримання лактобацили, що має високу спорідненість до живого організму та надзвичайні очищаючі властивості, які досі не були доступні. Ми показали, що ця бактерія не тільки ефективна для профілактики та лікування захворювань, але й суттєво покращує ріст та якість тварин та рослин. Таким чином, її промислова корисність повинна підвищуватися не тільки по відношенню до базових галузей, але й до індустрії здоров'я в цілому та до косметичної індустрії 88271 10 як окремої галузі індустрії здоров'я, крім того, вона може бути широко застосована у харчовій промисловості і взагалі у всіх галузях, що пов'язані з людським життям. На Фіг.1 показана регенерація шкіри миші після зрізання. На Фіг.2 показана проліферація клітин штаму V-1 нирки мавпи. На Фіг.3 показана проліферація клітин штаму Р815 мастоцитоми миші. На Фіг.4 показана проліферація лімфоцитів СЕА миші. На Фіг.5 показана проліферація хлорели. Різновид Lactobacillus casei за винаходом може мати форму клітинних тіл, отриманих у культурі, рідини культури або дезінфікованого фільтрату культури, в той час як препарат, що містить нову Lactobacillus casei, може являти собою препарат, що містить лише Lactobacillus casei за винаходом або препарат, що містить Lactobacillus casei за винаходом разом з антибіотиком. Різновид Lactobacillus casei за винаходом був отриманий виходячи з існування і механізму дії лактобацил, що звичайно присутні у піхві. Тобто, паличка Дедерлейна, звичайно присутня у піхві, розщеплює глікогени, що виділяються зі стінки піхви, виробляючи молочну кислоту, яка підтримує кислотність та запобігає проліферації гнилісних бактерій, що проникають ззовні, і таким чином відіграє життєво важливу роль у підтриманні чистоти. Ця бактерія дуже схожа на Lactobacillus acidophilus, і коли її ріст пригнічується антибіотиками або подібними засобами, як відомо, починають розмножуватися дріжджі та інші бактерії, що можуть викликати різноманітні запалення. Тобто, в організмі побудована система запобігання інфекції, оплотом якої є лактобацила, що поселяється та розмножується при невеликій кількості живлення у піхві. Ця очищувальна система здається фундаментальною та загальною, з погляду на те, що важковиліковні гемороїдальні вузли зникають природним шляхом, якщо кишкова флора набуває складу, до якого входять головним чином благотворні бактерії. На основі цих спостережень автори вдосконалили винахід, зібравши якнайбільшу кількість засобів для покращення травлення на основі лактобацил та комерційних продуктів на основі лактобацил, і досліджуючи їх штами, в результаті чого вони виявили, що лише ті бактеріальні штами, які відповідають певним умовам, показують 100% своїх первинних явних або прихованих можливостей та здатні суттєво активувати живі організми тварин та рослин, спричиняти економічні ефекти на їхній ріст та якість, а також покращувати імунну систему (природну цілющу здатність) для боротьби із захворюваннями, одночасно усуваючи хвороботворні бактерії у випадках інфекцій. Серед умов, яким повинні відповідати Lactobacillus casei за винаходом, найбільш суттєвою є та, що (1) потреба у живленні повинна бути набагато менше, ніж для звичайних відомих Lactobacillus casei. Тобто, це означає, що цей різновид може вирощуватися у присутності однієї, двох, трьох або чотирьох амінокислот у якості жи 11 вильного джерела азоту. (2) Проліферація в середовищі росту є швидкою. Це означає, що при інокуляції середовища культури, стимулюючого ріст, цим різновидом та Escherichia coli в однаковій кількості та вирощуванні анаеробної змішаної культури при 37°С, кінцева кількість лактобацил складає 50% або більше від кількості кишкової палички. (3) Здатність до продукування молочної кислоти є високою. Це означає, що після вирощування у відповідному середовищі культури кінцева величина рН складає 4,0 або нижче, а найвища кислотність складає 1,5% або більше. (4) Цей різновид має високу резистентність до жовчних кислот. Це означає, що цей різновид є резистентним до 5% солей жовчних кислот. (5) Цей різновид продукує антибіотик та може інгібувати проліферацію інших бактерій. Більш переважно, цей різновид (а) має резистентність до антибіотиків широкого застосування; (b) має амілолітичну здатність; (с) стимулює ріст хлорели; (d) має широкий діапазон температур для росту (росте при температурах у діапазоні 5°С-45°С); (e) має широкий діапазон величин рН для росту (росте при величинах рН у діапазоні рН4,0-10,0); та (f) має широкий діапазон кисневого тиску, при якому він може рости (тобто, він може рости при будь-якому кисневому тиску). Таким чином, автори акліматизували різновиди Lactobacillus casei FERM ВР-6971, FERM BP 6972 та FERM ВР-6973 (тут далі "первинний різновид Lactobacillus casei"), на які вже було представлено патентну заявку, і після значних зусиль, спрямованих на надання вищезгаданих властивостей, отримали бактеріальний штам, що відповідає умовам за винаходом, з FERM BP-6971 способом, описаним нижче. Щоб спричиняти будь-який ефект на живий організм, бактерія повинна адаптуватися до його середовища, переважати у змаганні росту з патогенними бактеріями та в достатній мірі репродукувати себе. Необхідною умовою для цього є продукування антибіотика, що пригнічує ріст інших бактерії, але перш за все, базовий потенціал або, інакше кажучи, проліферативна потужність бактерій повинна бути високою. Загалом, лактобацили мають високу потребу у живильних речовинах; наприклад, середовище MRS, що широко застосовується для вирощування бактерій, складається з 10г м'ясного екстракту, 5г дріжджового екстракту, 10г пептону, 0,2г MgSO4×7H2O, 0,5г MnSO4×5H2O, 5г натрію ацетату, 2г діаммонію цитрату, 2г KН2РО4 та 20г глюкози на літр. Lactobacillus casei за винаходом не є виключенням, але, оскільки це Lactobacillus casei, виділена з природного середовища, властива їй потреба у живильних речовинах є помірною, і вона може проліферувати при відповідних концентраціях амінокислот, вітамінів, придатних цукрів та неорганічних солей, наприклад, у середовищі, що складається з середовища S-W, а також 1г казамінових кислот та 0,1г вітамінів. Середовище S-W містить 1г KН2РО4, 0,7г MgSO4×7H2O, 1г NaCl, 4г (NH4)2HPO4, 0,03г FeSO4×7H2O та 5г глюкози на літр. Середовище пластин готували з таким складом, первинний різновид Lactobacillus casei, диспергований у стерилі 88271 12 зованому розчині хлориду натрію, наносили на пластини та культивували в анаеробних умовах протягом 48-72 годин при 37°С. Відбирали найбільші з отриманих колоній, збирали їх та вирощували знову за тією ж методикою, що описана вище, і після їх зростання знову повторювали операцію відбору та збирання колоній для отримання штаму з найшвидшим ростом та проліферацією в середовищі такого складу. Тоді відбирали штам з хорошим ростом, повторюючу ту саму операцію з половинною концентрацією живильних речовин у середовищі, після чого ідентифікували колонії, які виростали у середовищі з концентрацією живильних речовин, поступово зменшуваною до 1/4, 1/8 та 1/16, для отримання штаму зі здатністю швидко рости та розмножуватися у середовищах з надзвичайно низьким живленням. Звичайні відомі Lactobacillus casei, включаючи первинний різновид Lactobacillus casei, потребують для свого росту різноманітних амінокислот у якості джерел азоту, але різновид Lactobacillus casei за винаходом може рости в присутності однієї амінокислоти або 2, 3 чи 4 амінокислот у якості джерела азоту. Прикладом може служити середовище, що містить неорганічні кислоти, цукор, вітаміни, L(+)-лізину гідрохлорид та L-глутамінову кислоту. При вирощуванні разом з Escherichia coli, яка, як і Lactobacillus casei, є відомою бактерією, що знаходиться всюди в природі та є відомим індикатором забруднення середовища, різновид Lactobacillus casei за винаходом не поступався Escherichia coli у мірі та швидкості росту на початковій та середній стадіях, а кінцева кількість лактобацил склала 50% або більше від кількості кишкової палички. Якщо це співвідношення бактерій складає 30% або менше, бактеріальний штам не зможе спричинити ніякого ефекту на живий організм, які б не були його властивості. Далі, іншою важливою властивістю, необхідною для переважання в змаганні росту з іншими бактеріями, є здатність пригнічувати ріст інших бактерії у середовищі зі зниженою рН. Тобто, це повинен бути бактеріальний штам з високою здатністю до продукування молочної кислоти. Зокрема, молочна кислота, що продукується у системі травлення, захищає організм від вторгнення ззовні та проліферації різних патогенних бактерій, а крім того, сприяє перистальтиці у кишечнику, стимулюючи виділення продуктів життєдіяльності з кишечнику та пригнічення продукування гнилісних речовин. Було експериментально доведено, що кінцева величина рН 4,0 або менше та максимальна кислотність 1,5% або більше є однією з важливих умов для підвищення функцій лактобацил. Проте у випадку найбільш відомих Lactobacillus casei кінцева рН не досягає величини 4,2 або менше, а найвища кислотність складає менш ніж 1,5%. Одним зі способів культивування для підвищення продуктивності молочної кислоти є культивування бактерій в анаеробних умовах протягом 48-72 годин при 37°С в непрозорому середовищі, яке включає додаток 3г СаСО3 до середовища, описаного вище, що містить 10г м'ясного екстракту, 5г дріжджового екстракту, 10г пептону, 0,2г MgSO4×7H2O, 0,5г MnSO4×5H2O, 5г натрію ацетату, 13 2г діаммонію цитрату, 2г KН2РО4 та 20г глюкози на літр, утворення зв'язків між колоніями та повторного селекціонування колоній, що утворюють найширші прозорі кільця навкруги себе. Це є використання того факту, що при продукуванні молочної кислоти непрозорий карбонат кальцію зв'язується з молочною кислотою та перетворюються на лактат кальцію. Травний тракт з'єднаний з навколишнім середовищем лише однією кишкою, і єдиною причиною, чому бактерії, що живуть у суворому оточенні навколишнього світу, не поселяються і не розмножуються у високопоживному, м'якому середовищі кишечнику, є присутність жовчних кислот, що виділяє жовчний міхур. Таким чином, більшість середовищ для виділення та селекції кишкових бактерій включають жовчні кислоти, що додаються у склад середовищ для пригнічення росту інших бактерій. Згідно зі спостереженнями авторів винаходу, якщо концентрація жовчних кислот, наприклад, натрію дезоксихолату, досягає 0,1%, кишкові бактерії продовжують рости, а більшість бактерій, що не живуть у кишечнику, не ростуть. Первинний різновид Lactobacillus casei був здатен рости до концентрації жовчної кислоти 0,2%, але з певних причин було зроблено висновок, що для виявлення активності в організмі бактерії повинні рости при концентрації жовчної кислоти 0,5%. Тому автори культивували звичайним способом бактеріальний штам з резистентністю до солей жовчних кислот. Тобто, ми почали з додання 0,2% жовчних кислот у високопоживне середовище, таке як середовище LBS для селекції на молочну кислоту та середовище для проліферації MRS, і поетапно підвищували концентрацію жовчної кислоти до 0,5% в процесі росту бактерій. Коли резистентний штам був отриманий, було продемонстровано, що він зберігає свою резистентність незалежно від типу середовища, а крім того, в цих дослідах вперше було показано, що резистентність до жовчної кислоти корелює зі спорідненістю до слизових оболонок. Тобто, з підвищенням резистентності до жовчної кислоти, або, інакше кажучи, з підвищенням спорідненості до жовчних кислот, бактерії стають все більше здатними до колонізації на слизових оболонках поза кишечником, наприклад, в ротовій порожнині, носовій слизовій оболонці, піхві тощо. Здатність продукувати антибіотики, що перешкоджають виживанню інших бактерій, також важлива. Первинний штам Lactobacillus casei продукує антибіотик широкого спектра, який не тільки перешкоджає росту інших бактерій, але й, за науковими повідомленнями, ослабляє токсичність патогенних бактерій, і Lactobacillus casei за винаходом зберігає цю здатність. Крім того, Lactobacillus casei за винаходом необхідна резистентність до антибіотиків широкого застосування, але й первинний штам Lactobacillus casei є резистентним до антибіотиків, і Lactobacillus casei за винаходом зберігає цю здатність. Здатність засвоювати крохмалі, що у великій кількості присутні в природному середовищі, у якості джерел енергії, є бажаною для колонізації, виживання та проліферації в живих організмах. Про 88271 14 те більшість Lactobacillus casei не мають амілолітичної активності, або мають лише в незначній мірі. Первинний різновид Lactobacillus casei не є виключенням і не має амілолітичної здатності, але шляхом акліматизації бактеріям можна надати високу амілолітичну здатність без погіршення здатності розщеплювати глюкозу та лактозу, з отриманням Lactobacillus casei за винаходом. Прикладом способу вирощування для покращення амілолітичної здатності є додання 4,5г глюкози та 0,5г крохмалю (10% від цукрів) до низькопоживного середовища з рН7,4, що містить 1г м'ясного екстракту, 1г дріжджового екстракту, 3г пептону, 1г NaCl, 0,5г K2НРО4, 0,5г MgSO4×7H2O, 0,05г MnSO4×5H2O, 1г натрію ацетату, 0,5г діамонію цитрату та 12мл 0,2% ВТВ на літр, і тоді вирощування в анаеробних умовах протягом 48 годин при 37°С. Після цього вирощування субкультури повторюють у середовищі того ж складу, і якщо підтверджується навіть невеликий амілоліз, процент крохмалю підвищують до 20%. У такий спосіб процент крохмалю від цукрів в процесі вирощування субкультури піднімають до 100%, і здатність до розщеплення крохмалю отримують у такий же спосіб, як для глюкози. У будь-якому середовищі, при розщепленні цукрів утворюються кислоти та відповідно знижується рН, і колір середовища змінюється від синього до жовтого. Важливо вирощувати субкультуру доти, доки насиченість жовтого кольору середовища з крохмалем стане такою ж, як для середовища зі 100% глюкози. На щастя, більшість бактерій, що викликають хронічні інфекції, не здатні отримувати енергію від розщеплення крохмалю, тому надання різновиду Lactobacillus casei такої здатності забезпечує особливу ефективність у боротьбі з інфекціями. Хлорела являє собою одноклітинну рослину з високою життєздатністю, яка продовжує здійснювати фотосинтез та продукувати покоління шляхом повторюваного ділення клітин вже більше ніж мільярд років на цій планеті, і вважається попередником сучасних рослин. Тобто, можна сказати, що хлорела є первинною формою та джерелом життя на Землі. Якщо лактобацила стимулює ріст та проліферацію хлорели, це означає, що речовини, які виробляються цією лактобацилою, активують живі клітини та спричиняють відновний ефект, тому, очевидно, вони також повинні бути ефективними для живих організмів, які є сукупністю клітин. Вже протягом десятиріч відомо, що продукти метаболізму хлорели сприяють проліферації лактобацил, але досі не повідомлялося про зворотне що продукти метаболізму лактобацили стимулюють проліферацію хлорели. Тому, у якості прикладу способу вирощування культури з підвищеною здатністю стимулювати ріст хлорели, середовище з рН6,8, що містило 5г пептону, 2г м'ясного екстракту, 5г глюкози, 5г дріжджового екстракту, 2г KNO3, 2г K2НРО4, 0,1г MgSO4×7H2O, 0,1г СаСl2×2Н2О, 0,1г NaCl, 0,01г MnSO4×5H2O, 0,05г ZnSO4×5H2O, 3г СаСО3 та 15г агару на літр, стерилізували під високим тиском протягом 15 хвилин при 120°С та охолодили до ~50°С після стерилізації, додали прийнятну кількість чистої культури хлорели та рівномірно перемішали, після чого суміш налили в 15 чашки Петрі. Після субкультивування протягом 4872 годин в інкубаторі з освітленням при 28°С, первинний різновид Lactobacillus casei диспергували у стерилізованому сольовому розчині, нанесли на середовище та субкультивували в аеробних та анаеробних умовах (декілька % СО2) при 28°С32°С при світлі. Культуру оглядали кожні 24 години для визначення того, чи хлорели навколо проліферуючих колоній Lactobacillus casei розмножуються більш щільно, ніж на інших ділянках. Колонії, що показували хоч найменшу таку тенденцію, повторно збирали для отримання різновиду Lactobacillus casei за винаходом, який стимулює ріст хлорели. Широкий діапазон можливого кисневого тиску, температур та величин рН для росту також є бажаною умовою для адаптації та успішного змагання у суворих середовищах, і це може бути досягнуто звичайним способом акліматизації з вибором придатного середовища. Відмінності між відомою, звичайною Lactobacillus casei, первинним різновидом 88271 16 Lactobacillus casei та різновидом Lactobacillus casei за винаходом показані у Таблиці 1. Як видно з Таблиці 1, оскільки різновид Lactobacillus casei за винаходом, який скринували шляхом селекції та акліматизації, має унікальні властивості, відсутні у відомих Lactobacillus casei або у первинного різновиду Lactobacillus casei, при використанні у живому організмі різновид Lactobacillus casei за винаходом може не тільки забезпечувати вражаючі ефекти, відсутні у різноманітних продуктів молочної кислоти, що громадяться на полицях супермаркетів та магазинів дієтичного харчування, але й цілком очевидно сприяє відновленню, підтриманню та стимулюванню здоров'я, забезпечує економічні ефекти, наприклад, покращення якості при застосуванні під час вирощування рослин та тварин, і може бути досить ефективний проти інфекцій. Таким чином, препарат лактобацил за винаходом можна назвати препаратом лактобацил, активуючим живі організми, або профілактичним чи лікувальним засобом проти інфекцій у тварин та рослин. 17 Бляшка, що є причиною періодонтального захворювання, за науковими повідомленнями, являє собою накопичення близько 400 типів бактерій, з яких найбільш патогенними для періодонтального захворювання виявилися Poryphyromonas gingivalis, Prevotella intermedia та Actinobacillus actinomycetemcomitans, a Walinella recta, Bacteroides forsythus, Eikenella corrodens, Fusobacteria, Treponema та ін. грають допоміжну роль. Специфічність періодонтального захворювання є найскладнішим фактором, що робить це захворювання важковиліковним. Оскільки зуби безпосередньо пов'язані з внутрішніми органами, то, якщо запальна реакція є надто сильною, організм не намагається боротися з періодонтальним захворюванням, а замість цього утворює глибокі канавки на межі між зубами та яснами, руйнуючи тканини, що підтримують зуби та жертвуючи зубами, щоб захистити організм подібно ящірці, що відкидає хвіст. Інакше кажучи, не зовнішній ворог руйнує тканини, що підтримують зуби, а саме запалення, яке є засобом захисту організму від зовнішнього ворога. Корені зубів, заражені бактеріями та їх токсинами й ферментами, вже не впізнаються організмом, який приймає міри для їх усунення як хвороботворних осередків, разом з оточуючими тканинами. Тобто, самозахисна реакція фактично підсилює періодонтальне захворювання. Тому, коли всі зуби, вражені періодонтальним захворюванням, випадають, захворювання повністю припиняється. Інші фактори включають (1) той факт, що ротова порожнина є придатним середовищем для росту та проліферації бактерій і її важко підтримувати чистою, тому бактерії з високою періодонтальною патогенністю міцно прикріпляються до зубів та ясен, продукуючи клейкі глюкани, фруктани та інші нерозчинні полісахариди, речовини, що також служать бар'єром для захисту періодонтальних патогенів, (2) той факт, що, оскільки токсини та ферменти, які вони виробляють, проникають у періодонтальну тканину непомітно, захворювання розвивається з малою кількістю суб'єктивних симптомів; симптоми, що з'являються, нерівномірні і досить різноманітні, в тому числі потемніння навколо зубів, запалення, западання ясен, старіння тощо, при цьому, коли ясенна кишеня вже сформувалася, вона звичайно вже не закривається, що у комбінації з п. (1) веде до рецидивного виникнення, (3) той факт, що дуже небагато дантистів починають лікування із застосуванням відповідних лікарських засобів у взаємодії зі спеціалістами з бактеріології, (4) той факт, що як лікарі, так і пацієнти вважають, що, у крайньому випадку, зуби можна видалити, та (5) той факт, що періодонтальне захворювання є не місцевою проблемою, а системним захворюванням, пов'язаним, наприклад, з діабетом та іншими ендокринними захворюваннями, генетичними розладами, стресом, остеопорозом, розладами кровообігу тощо, і не може бути повністю вилікуване простою симптоматичною терапією. Періодонтальне захворювання включає багато згубних факторів і вважається невиліковним, якщо не розпочати лікування на ранніх стадіях. 88271 18 На сьогодні основною формою ранньої терапії є такі види лікування, як зскрібання та шліфування кореня для видалення бляшки та зубного каменя, які є осередками періодонтального захворювання. Над'ясенний зубний камінь, що прикріпився до поверхонь зубів вище лінії ясен, видалити відносно легко, але під'ясенний камінь, що утворився на поверхнях (коренях) зубів нижче лінії ясен, є щільним та твердим, чорно-зеленим та міцно прикріпленим, і бактерії та їхні токсини не можуть бути видалені простим зчищенням. Тому нещодавно були винайдені методи їх ефективного руйнування за допомогою ультразвуку або лазерів, або розчинення спеціальними хімічними речовинами. Після видалення впорскують дезінфікуючий засіб або антибіотик, який утримується в періодонтальній кишені до зникнення запалення. Проте, якщо місце запалення надто глибоке, і вищеописана терапія не дає позитивних результатів, місце запалення або пошкодження видаляють хірургічним шляхом. Тоді ясна зашивають або реконструюють з використанням штучного матеріалу. Більш сучасні способи включають хірургію методами GTR (керована регенерація тканини) та застосування білка типу Emdogain у якості допоміжного засобу, для того щоб відновити оточення подібно до процесу регенерації зуба, і покращити регенерацію періодонтальної тканини, але ці способи неефективні у всіх випадках запущеного періодонтального захворювання, і їх застосування обмежене. У будь-якому випадку, на цей час базове лікування періодонтального захворювання спрямоване на те, щоб зупинити запалення ясен і розвиток періодонтального захворювання, відновити втрачену періодонтальну тканину, покращити зовнішній вигляд та зберегти відновлену тканину, але, як було згадано вище, періодонтальне захворювання також включає фактори системного ризику, та на жаль сьогодні немає терапії, яка була б досить ефективною, щоб бути переважною, і більшість дантистів вже задоволені, якщо вони можуть хоча б утримувати ситуацію від погіршення. Бактерицидний дезінфікуючий засіб, описаний в цьому винаході (тут далі "цей бактерицидний дезінфікуючий засіб") є бактерицидним дезінфікуючим засобом, що містить 500млн-1-1500млн-1 іонів заліза(ІІІ), 500млн-1-2000млн-1 L-аскорбінової кислоти та 200млн-1-2000млн-1 однієї чи двох кислот, вибраних з сорбінової кислоти, бензойної кислоти та ефіру параоксибензойної кислоти, у якості основних компонентів. Він вже був представлений у патенті США (USP6296881B1), і його компоненти визнані в Японії як харчові добавки. На цей час дезінфікуючі засоби широко застосовуються медичними установами, в тому числі спирти, феноли, галогенові сполуки, четвертинні амонієві солі, бігуанідні сполуки, альдегіди тощо, але жоден з них не відповідає усім умовам задовільної бактерицидної дії, безпечності та низької токсичності, задовільної стійкості при зберіганні та дешевизни. Наприклад, бігуанідна сполука торгової марки "Hibitane" (Хібітан) є відмінним дезінфікуючим засобом, низька токсичність та висока ефективність якого зробили його найбільш популярним засобом в усьому світі за останні кілька десятиріч, але він майже не діє 19 на гриби та на туберкульозні бацили й спори. Деякі загальновідомі бактерії також набули резистентності до нього і є причиною шпитальних інфекцій. З іншого боку, "цей бактерицидний дезінфікуючий засіб," що був розроблений для заповнення прогалин у традиційній медицині, вбиває більшість бактерій та грибів усього за 10 секунд і здатен руйнувати навіть спори за 1-120 хвилин. Проте, незважаючи на його відмінні бактерицидні властивості, його токсичність нижча за токсичність будьяких інших існуючих дезінфікуючих засобів, як показано нижче. (1) Ефекти на шкіру: При нанесенні на задні кінцівки (подушечки лап) мишей двічі на день протягом 6 місяців жодних відхилень від норми не зареєстровано. (2) Ефекти перорального застосування: вводили 1мл/мишу, але ніякої токсичності не було помічено. Ця доза відповідає 1,8л для людини. Розрахована величина LD50 складає 10мл/мишу, що відповідає 18л для людини. (3) Ефекти інтраперитонеального застосування: Величина LD50 складає близько 1мл/мишу. (4) Ефекти на культивовані (тваринні) клітини: 103-кратне розведення концентрації, необхідної для застосування, не інгібувало проліферацію клітин. Це дорівнює 1/10 токсичності Хібітану. (5) Ефекти на людей: a) Дезинфекція рук та пальців: Жодних відхилень від норми не було виявлено навіть після 7 років щоденного застосування, крім легкого почервоніння шкіри. b) Полоскання: Жодних відхилень слизових оболонок від норми не було виявлено за 7 років полоскань кожного ранку та вечора, і ніяких побічних ефектів чи токсичності. Крім того, за цей період не виникло жодної каріозної порожнини і не було необхідності у консультаціях з дантистом. Далі наведені результати численних тестів "цього бактерицидного дезінфікуючого засобу" у зв'язку з періодонтальним захворюванням. "Цей бактерицидний дезінфікуючий засіб" було отримано шляхом приготування водного розчину 3000млн-1 хлориду заліза(ІІІ) гексагідрату 88271 20 (FeCl3×6H2O) у якості джерела іонів Fe3+, водного розчину L-аскорбінової кислоти з концентрацією 3000млн-1 та водного розчину калію сорбату з концентрацією 1500млн-1, та змішування рівних кількостей цих водних розчинів. (Приклад тесту 1) Приготували суспензію (1´109клітин/мл сольового розчину) тестових бактерій, і 2% ваг. "цього бактерицидного дезінфікуючого засобу" накапали в цю клітинну рідину. Клітини зібрали через деякий час однією платиновою петлею, висіяли на середовище бактеріального росту та культивували в оптимальному середовищі; бактерицидні ефекти спостерігали за наявністю або відсутністю проліферації бактерій. Бактерицидний дезінфікуючий засіб, що використовувався в тесті, довели до звичайно застосовуваної концентрації. Результати після 10-60 секунд контакту та результати після 1120 хвилин контакту показані в Таблиці 2. Як видно з Таблиці 2, "цей бактерицидний дезінфікуючий засіб" знищив більшість вказаних видів бактерій в їх активних формах протягом ~10 секунд. Потужні періодонтальні патогени P. gingivalis, P. intermedia та A. actimomycetemconitans не були виключенням. Проте для знищення спор спорулюючих бактерій знадобилося від 1 до 120 хвилин у залежності від стадії їх формування. Згідно зі статистикою, час, необхідний для миття та полоскання рук медичними робітниками та ін., складає 10-15 секунд, і в цьому контексті "цей бактерицидний дезінфікуючий засіб" є високоефективним. Коли цей тест провели з використанням бігуанідної сполуки Хібітану, 3% розчину перекису водню та Акринолу (Acrinol), що є дезінфікуючими засобами, які широко застосовуються у лікарнях та стоматологічних кабінетах, знадобилося 30-60 секунд, і, як згадувалося вище, Хібітан був неефективним проти мікобактерій та спор, у той час як 3% розчин перекису водню проти спор був також неефективний, а мікобактерії знищував за 1 хвилину або більше. Результати для Акринолу були подібні до результатів для 3% розчину перекису водню. 21 (Приклад тесту 2) Загалом відомо, що ефекти дезінфікуючих засобів знижуються при забрудненні органічними речовинами, особливо білками, тому були проведені дослідження бактерицидних ефектів у присутності органічних речовин. Спочатку зняте молоко та дріжджовий екстракт додали до "цього бактерицидного дезінфікуючого засобу" у кількостях 1млн1 , 50млн-1 та 100млн-1, і одночасно 2% ваг. 1´109клітин/мл фізіологічного сольового розчину 88271 22 MRS А або Е. соlі Ο-157 у якості тестової бактерії накапали в ці водні розчини. Час контакту між тестовими бактеріями та "цим бактерицидним дезінфікуючим засобом" складав від 10 секунд до 5 хвилин, після чого 10-мкл зразки змішаної рідини тестових бактерій збирали, висівали у придатне середовище та культивували при 37°С для оцінки бактерицидного ефекту, який визначали за наявністю або відсутністю бактеріального росту. Результати показані у Таблиці 3. Присутність органічної речовини не спричиняла ефекту, коли її концент 23 88271 24 рація складала 1млн’1, але при концентрації органічної речовини 50млн-1 або більше вона спричиняла незначний ефект. Той самий тест був також проведений з бактеріальним видами, відмінними від двох згаданих вище, з подібними результатами. Такий самий тест був проведений і з використанням дезінфікуючих засобів, що широко застосовуються у стоматологічних кабінетах, але при концентраціях вище 50млн-1 бактерії не гинули після 1 хвилини контакту з Хібітаном, а в деяких випадках виживали після 5-хвилинного контакту, в залежності від типу та кількості органічної речовини. Результати, отримані з 3% розчином перекису водню та Акринолом, були подібні результатам для Хібітану. (Приклад тесту 3) Ми провели дослідження, чи зупинить розвиток гнилісного процесу після приготування їжі розпилення на їжу "цього бактерицидного дезінфікуючого засобу", і якою буде міра цього бактерицидного ефекту. Звичайно дезінфікуючі засоби не застосовують для їжі після приготування, але часто залишки їжі попадають у періодонтальну кишеню, утворюючи джерело живлення для бактерій, і оскільки інгредієнтами "цього бактерицидного дезінфікуючого засобу" є сполуки, визнані у якості харчових добавок, важливо оцінити ці ефекти. "Варений рис", "тофу", "шпинат із сезамом" та "смажене м'ясо з овочами" у якості зразків відразу після приготування подрібнили, гомогенізували та залишили при 28°С. Через 5 годин частину зразка відібрали для підрахування живих бактерій, а решту кожного зразка ретельно оббризкали дезінфікуючим засобом. Живі клітини підраховували через 1 годину, 2 години та 24 години після розпилення. У якості контрольного досліду розпилювали воду. Після витримки кожного зразка протягом 24 годин, частину відбирали для підрахування живих клітин, а решту кожного зразка ретельно оббризкували кожним дезінфікуючим засобом. Як і в тому випадку, коли зразки залишали на 5 годин, живі клітини підраховували через 1 годину, 2 години та 24 години після розпилювання. У якості контрольного досліду розпилювали воду. Живі клітини підраховували методом глибинного посіву з використанням 5г кожного зразка, який відбирали та розбавляли звичайними способами. Ступінь гниття звичайно відрізняється у залежності від способу приготування, сировини для приготування та середовища. У випадку вищезгаданих зразків, кількість живих клітин у вареному рисі склала 2´10клітин/г зразка відразу після приготування, 1´103клітин/г зразка через 5 годин, 5´105клітин/г зразка через 24 години та 7´106клітин/г зразка через 48 годин. У випадку тофу початкова кількість живих клітин складала 2´104клітин/г зразка, але виросла до 8´105клітин/г зразка через 5 годин, 9´107клітин/г зразка через 24 години та 1´109клітин/г зразка через 48 годин, з більш високим рівнем гниття. У випадку шпинату з сезамом кількість складала 2´103клітин/г зразка відразу після приготування і виросла до 5´104клітин/г зразка через 5 годин, 3´107клітин/г зразка через 24 годин та 2´108клітин/г зразка через 48 годин. У випадку смаженого м'яса з овочами кількість складала 5´10клітин/г зразка відразу після приготування і виросла до 2´103клітин/г зразка через 5 годин, 2´108клітин/г зразка через 24 годин, коли з'явився слабкий запах гниття, та 3´109клітин/г зразка через 48 годин, коли гниття вже розвилося до більш високого ступеню. 25 Результати тесту показані в Таблиці 4. Через 5 годин після приготування, коли бактерії ще майже не розмножилися, розпилення дезінфікуючого засобу відразу ж знизило кількість клітин до 1/1001/200, з деякими відхиленнями у залежності від типу приготованої їжі. Через 1 годину ця кількість впала до 1/1000-1/5000 від початкової кількості, а через 2 години клітини загинули, при кількості 10клітин/г зразка або менше. Бактерії, що вижили, не розмножилися навіть через 24 години. У м'ясі та інших багатих на білок продуктах 7´102клітин/г зразка (близько 1%) залишилися живими через 2 години після розпилення дезінфікуючого засобу. Через 24 години після приготування кількість клітин складала 107-108, але впала до 1/1000-1/10000 відразу після розпилення дезінфікуючого засобу, до 1/10000-1/500000 через 1 годину та до 1/300000-1/2000000 через 2 години. Кількість клітин у цей час складала близько 102клітин/г зразка. Через 24 години кількість клітин була дещо вищою, ніж через 2 години, але це, очевидно, було викликано не стільки проліферацією бактерій, що 88271 26 вижили, скільки присутністю бактерій, що осідали з повітря. Таким чином, бактерицидна дія була загалом досягнута, хоча повне знищення - ні. Тобто, бактерицидний ефект та ефект пригнічення росту гнилісних бактерій у їжі існує. На додаток до "цього бактерицидного дезінфікуючого засобу", такий самий тест провели з використанням дезінфікуючих засобів, що широко застосовуються у стоматологічних кабінетах; результати тесту показані в Таблиці 4. При розпиленні Хібітану швидкість зниження кількості клітин відразу після розпилення була менше, ніж досягнута за допомогою "цього бактерицидного дезінфікуючого засобу," хоча тенденція була такою самою. Проте цей ефект з часом послабшав, і бактерії знову почали проліферувати. Тобто, хоча ріст гнилісних бактерій у їжі був певною мірою пригнічений, це не був дійсний бактерицидний ефект. Крім того, відразу після розпилення 3% розчину перекису водню більшість бактерій вижили, а через 24 години ця їжа була на межі гниття. 27 Результати для "цього бактерицидного дезінфікуючого засобу" у Прикладах тестів 1-3 дозволяють говорити про його потенціальну можливість виявляти сильний бактерицидний ефект проти періодонтальних патогенів, що ховаються у періодонтальних кишенях. У протилежність йому, дезінфікуючі засоби, що широко застосовуються у стоматології, у деякій мірі ефективні, коли періодонтальні патогени ще не створили бар'єр, але при утворенні бляшки або зубного каменя, а також у присутності джерела живлення, такого як органічна речовина або залишки їжі, їхня ефективність суттєво знижується. На основі результатів наведених вище тестів, ми дослідили ефективність кожного бактерицидного дезінфікуючого засобу з використанням тестової бляшки, що вважається головною причиною періодонтального захворювання. (Приклад тесту 4) Бляшку, що прикріпилася до над'ясенного зубного каменя, зібрали, великі сегменти розрізали на пластинки товщиною 200мкм, а порошкоподібну бляшку подрібнили до розміру частинок 10мкм, занурили в 1мл "цього бактерицидного дезінфікуючого засобу" і через певний час звичайними способами вимірювали кількість живих клітин, що містилися там. Результати показані в Таблиці 5. 88271 28 Кількість живих клітин 4´109, виміряна в 20мг сегментів бляшки, знизилася на 3/4 через 1 хвилину занурення, впала до 1/5000 від початкової кількості через 5 хвилин, а через 10 хвилин усі бактерії загинули. Усі бактерії у порошкоподібній бляшці були усунені за 3 хвилини. Тобто, було показано, що "цей бактерицидний дезінфікуючий засіб" проходить крізь бар'єр, проникає всередину бляшки та спричиняє там бактерицидний ефект на бактерії. У випадку Хібітану (Хібітан-гель), 3% розчину перекису водню та акринолу, що широко застосовуються в стоматології, бактерії на поверхні бляшки були переважно усунені за 3 хвилини, але всередині бляшки навіть через 60 хвилин занурення половина бактерій вижили. Це означає, що ці засоби не можуть остаточно зруйнувати бляшку, яка є скупченням бактерій. Коли той самий тест провели з використанням бляшки, прикріпленої до під'ясенного зубного каменя (щільного та твердого), усі бактерії були усунені приблизно за 15 хвилин у випадку бляшки пластинчастої форми і за 3 хвилини у випадку порошку. Замість цього, при використанні Хібітану і подібних засобів бактерії всередині бляшки зберігалися протягом 60 хвилин занурення і виживали, як описано вище. 29 88271 30 Далі, розглядаючи випадки, коли додаткова органічна речовина може приклеїтися до бляшки, прикріпленої до зубного каменя, ми змішували 20мг бляшки з 20мг дріжджового екстракту та проводили тест способами, описаними вище. Результати показані в Таблиці 6. Органічна речовина спричинила незначний ефект, і кількість клітин впала приблизно до 1/2000 початкової кількості через 5 хвилин занурення, а через 10 хвилин занурення усі бактерії були усунені у випадку пластинчастої бляшки. У випадку порошкоподібної бляшки всі бактерії були усунені через 3 хвилини занурення. У протилежність цьому, при використанні дезінфікуючих засобів широкого застосування дезінфекція поверхні бляшки внаслідок присутності органічної речовини зайняла 10 хвилин, а більшість внутрішніх бактерій вижила. Тобто, було показано, що, якщо не видалити бляшку повністю під час лікування, то, хоча і може спостерігатися тимчасове покращення, але хвороба буде рецидивувати. Як видно з різних тестових результатів, наведених вище у Прикладах тестів 1-4, "цей бактерицидний дезінфікуючий засіб" завдає суттєвої шкоди бактеріям, що виживають в активній формі у різноманітних середовищах. Патогени періодонтального захворювання, що живуть у періодонтальних кишенях та ховаються у бляшці, яку важко видалити, не є виключенням, і було показано, що ін'єкція "цього бактерицидного дезінфікуючого засобу" у таких випадках руйнує бактерії протягом часу від декількох секунд до 10 хвилин, при цьому різниця в часі залежить від стадії росту та типу бляшки. Крім того, слід наголосити, що у тестах на тваринах та експериментах з людьми, подібних описаним вище, виявилося, що "цей бактерицидний дезінфікуючий засіб" практично не спричиняє шкідливого ефекту на клітини та тканини і сприяє відновленню тканин. (Приклад тесту 5) Зрізали близько 1см2 шкіри миші і після цього кожного ранку та вечора наносили на рану різні бактерицидні дезінфікуючі засоби при звичайних концентраціях, використовуючи гігроскопічну вату. У якості контрольного досліду використовували воду. Результати показані в Таблиці 7. У випадку контрольної миші знадобилося 5 діб, для того щоб на рані утворився тонкий шар нової шкіри, 12 діб, щоб шкіра набула початкової товщини, і 35 діб, щоб відросла шерсть, у той час як при нанесенні "цього бактерицидного дезінфікуючого засобу" знадобилося 4 діб, щоб рана закрилася, 10 діб, щоб шкіра набула початкової товщини і лише 30 діб, щоб відросла шерсть. Ці результати відповідають результатам, отриманим при застосуванні настойки йоду, і це означає, що "цей бактерицидний дезінфікуючий засіб" та настойка йоду сприяють регенерації тканини. У протилежність цьому, при нанесенні Хібітан-гелю, 3% розчину перекису водню та акринолу, що широко застосовуються у стоматології, знадобилося 5 діб для утворення тонкої шкіри, 12-15 діб, щоб шкіра набула початкової товщини та 40 діб для відростання шерсті. Тобто, ці дезінфікуючі засоби діють як отруйні речовини, що пригнічують регенерацію тканини. 31 (Приклад тесту 6) При доданні різних концентрацій "цього бактерицидного дезінфікуючого засобу" у середовище, як показано у Таблиці 8, вони стимулюють ріст молочнокислих бацил, що використовуються в цьому винаході. Добре відомо, що росту лактобацил сприяє додання оцтової кислоти, але досить несподівано, що бактерицидний дезінфікуючий засіб з бактерицидною дією може стимулювати ріст, навіть будучи розбавленим. Проте, як показано в Таблиці 9, ріст патогенів періодонтального захворювання та інших патогенних бактерій не стимулюється. Це означає, що, якщо спершу ввести в періодонтальну кишеню "цей бактерицидний дезінфікуючий засіб", а потім промити її водою і заповнити новим різновидом Lactobacillns casei (тут далі "нова лактобацила") за винаходом, що має унікальні властивості, описані нижче, ріст "но 88271 32 вої лактобацили" буде стимулюватися, що покращить терапевтичні ефекти проти періодонтального захворювання. У протилежність цьому, при доданні у середовище дезінфікуючих засобів широкого застосування при різних концентраціях, бактеріальний ріст іноді був пригнічений, але ніколи не стимулювався. Крім того, основний компонент Fe3+ "цього бактерицидного дезінфікуючого засобу" поглинається поверхнями зубів і служить бар'єром для їх захисту проти повторного прикріплення періодонтальних патогенів. Крім того, оскільки він спричиняє в'яжучу дію, секреція рідини у періодонтальній канавці, яка забезпечує джерело живлення для періодонтальних патогенів, тимчасово знижується, що пригнічує ріст та проліферацію за рахунок часткового припинення постачання живлення для періодонтальних патогенів, які ховаються всередині канавок. 33 Приклади Далі винахід буде пояснений більш детально на прикладах, але суть винаходу ними не обмежується. Спосіб виготовлення може бути змінений, і, звичайно, будь-які кількості клітин можуть бути отримані з використанням відомого наповнювача або носія. Препарату може бути надано, разом із придатними носіями, будь-яку форму, наприклад, форму порошку, гранул, капсул тощо. (Приклад виготовлення 1) Lactobacillus casei (FERM BP-10059, FERM Ρ19443) за винаходом висіяли в 10л середовища з рН7,2 що містило 10г пептону, 5г м'ясного екстракту, 5г дріжджового екстракту, 10г лактози, 2г K2НРО4,0,1г MgSO4×7H2O, 1г NaCl, 2г діамонію цитрату, 5г натрію ацетату, 3г СаСО3, 0,3г MnSO4×5H2O, 0,03г FeSO4×7H2O та 1г L-цистеїну на літр, та культивували в анаеробних умовах протягом 72 годин при 37°С. Після завершення культивування рідину культури профільтрували крізь папір для видалення СаСО3 і 3л фільтрату охолодили, а решту рідини центрифугували з отриманням супернатанту та 8,4г бактеріальної маси. Цю масу промили у 420мл фізіологічного сольового розчину і центрифугували двічі. Отриману очищену бактеріальну масу вмістили у розчин, що містив 70г знятого молока, 20г розчинного крохмалю, 0,5г натрію глутамату та 1000мл очищеної води, перемішали збовтуванням та ліофілізували під вакуумом звичайним способом з отриманням 101г бактеріального препарату. Підрахована кількість клітин в цьому бактеріальному препараті склала 2,5´1010клітин/г. Кінцевий препарат складався з 101г ліофілізованих бактеріальних клітин (включаючи консервант), 3000мл рідини культури та 6700мл фільтрату культури (дезінфікована рідина). 88271 34 (Приклад виготовлення 2) Lactobacillus casei (FERM BP-10059, FERM Ρ19443) за винаходом висіяли у 10л середовища з рН6,8, що містило 3г казамінових кислот, 2г дріжджового екстракту, 50мл томатного соку, 2г глюкози, 1г NaCl, 1г KН2РО4, 0,7г MgSO4×7H2O, 1г СаСl2×2Н2О, 0,5мл Tween 80 та 0,5г розчинного крохмалю на літр, і культивували в факультативній анаеробній культурі протягом 96 годин при 30°С. Після завершення культивування 3л рідини культури охолодили, а решту 7л центрифугували з отриманням супернатанту та 5,6г бактеріальної маси. Її промили у 280мл фізіологічного сольового розчину та центрифугували знову. 2,6г отриманої очищеної бактеріальної маси ретельно перемішали з 10,4г картопляного крохмалю та охолодили. Решту 3г очищеної бактеріальної маси вмістили у розчин, що містив 15г знятого молока, 15г розчинного крохмалю, 5г трегалози, 0,2г цистеїну та 500мл очищеної води, перемішали збовтуванням та ліофілізували під вакуумом звичайним способом з отриманням 39г бактеріального препарату. Підрахована кількість клітин в цьому бактеріальному препараті склала 2´1010клітин/г. Кінцевий препарат складався з 39г ліофілізованих бактеріальних клітин (включаючи консервант), 13г вологих бактеріальних клітин (включаючи консервант), 3000мл рідини культури та 6700мл фільтрату культури (дезінфікована рідина). (Приклад виготовлення 3) Lactobacillus casei (FERM BP-10059, FERM Ρ19443) за винаходом висіяли у 5л середовища, що містило 100г знятого молока та 1г трегалози на літр, яке довели до рН6,8, і культивували в факультативній анаеробній культурі протягом 72 годин при 37°С. Тоді 75г трегалози додали до цієї рідини культури (йогурт), ретельно перемішали збовту 35 ванням та ліофІлізували під вакуумом звичайним способом з отриманням 590г бактеріального препарату. Підрахована кількість клітин в цьому бактеріальному препараті склала 5´109клітин/г. Кінцевий бактеріальний препарат містив бактеріальні клітини та продукти ферментації знятого молока. (Приклад виготовлення 4) Для отримання препарату нової лактобацили (FERM BP-10059, FERM P-19443) за винаходом антибіотико-резистентну нову лактобацилу (FERM BP-10059, FERM Ρ-19443) за винаходом висіяли у 10л середовища з рН7,2, що містило 5г пептону, 3г м'ясного екстракту, 2г дріжджового екстракту, 1г CGF, 5г крохмалю, 1г лактози, 2г діамонію цитрату, 3г натрію ацетату, 0,2г MgSO4×7H2O, 0,03г FeSO×7H2O та 1г L-цистеїну на літр, та культивували в анаеробних умовах протягом 3 діб при 37°С. Після завершення культивування рідину культури профільтрували крізь папір для видалення СаСО3 і тоді центрифугували, і 7,8г отриманих бактеріальних клітин диспергували у 370мл фізіологічного сольового розчину та знову центрифугували двічі. Отриману очищену клітинну масу диспергували в 450мл заздалегідь стерилізованого 5% розчин крохмалю та ліофілізували під вакуумом звичайним способом з отриманням 30г препарату нової лактобацили. Вміст живих клітин у цьому бактеріальному препараті склав 1´1011клітин/г. (Приклад виготовлення 5) Очищені клітинні тіла, отримані у Прикладі виготовлення 4, змішали з 15,7мл оливкової олії для виготовлення масляного препарату. Вміст живих клітин у цьому бактеріальному препараті склав 2×1011клітин/г. 10г цього масляного препарату розмішали у 10г гідрофільної мазі для отримання крему лактобацил. Тоді 400мг амоксициліну (АМРС), 100мг еритроміцину (ЕМ), 100мг фрадіоміцину (FRM) та 100мг цефаклору (CCL) у якості антибіотиків змішали з кремом лактобацил для отримання крему лактобацил з вмістом антибіотиків. 88271 36 (Приклад 1) Швидкість та процентне співвідношення S-R мутацій у Е. соlі O-157 внаслідок ефектів ослаблення токсинів, що спричиняють антибіотики, продуковані Lactobacillus casei, коли Ε. соlі O-157 та Lactobacillus casei присутні разом, досліджували за допомогою змішаної культури Е. соlі O-157 та первинного різновиду Lactobacillus casei (FERM ВР6971), а також змішаної культури Е. соlі O-157 та різновиду Lactobacillus casei за винаходом (FERM BP-10059, FERM P-19443). Середовище складалося з 5г м'ясного екстракту, 1г дріжджового екстракту, 5г пептону, 2г NaCl, 1г СаСО3 та 2г глюкози або крохмалю на літр, рН довели до 7,2. Культивування проводили в анаеробних умовах при 37°С, з пересадкою субкультур кожні 72 години, шляхом розбавлення та нанесення кожної субкультури на середовище пластини. Отримані колонії оглянули, підрахували кількість S-типів (початкових) та Rтипів (з ослабленням токсинів) та порівняли процентні кількості. Результати показані в Таблиці 10 та Таблиці 11. Як показано в Таблиці 10, при використанні глюкози у якості цукру, кількість клітин при пересіванні субкультур дуже коливалася, коли Е. соlі O-157 субкультивували разом з первинними Lactobacillus casei (FERM ВР-6971). Приблизно з п'ятої субкультури з'явився R-тип (30%), і процентний вміст R-типу при подальшому субкультивуванні підвищувався, так що у 18-й субкультурі всі бактерії були R-типу. Нові бактерії S-типу при подальшому субкультивуванні не з'являлися. У протилежність цьому, коли Е. соlі субкультивували разом із різновидом Lactobacillus casei за винаходом (FERM BP-10059, FERM P-19443), R-тип з'явився з третьою субкультурою у кількості 5%, що збільшилася до 50% з п'ятою субкультурою, ay 12й субкультурі всі Е. соlі O-157 були R-типу. Тобто, більший вплив на Е. соlі O-157 спричинив різновид Lactobacillus casei за винаходом, порівняно з первинним різновидом Lactobacillus casei. Це зумовлено різницею в проліферативній активності цих двох різновидів Lactobacillus casei. 37 Як показано в Таблиці 11, якщо в якості цукру використовували крохмаль, проліферативна активність Е. соlі O-157 знижувалася, проліферація первинного різновиду Lactobacillus casei знижувалася ще більше, і кінцева кількість клітин склала менш ніж 5´108. Внаслідок цього зниження продуктивності, Е. соlі О-157 повільніше мутували в Rтип, кількість якого склала 10% у 7-й генерації та 50% у 20-й генерації. При подальшому культиву 88271 38 ванні процентний вміст R-типу не досяг 70%. Проте проліферативна активність різновиду Lactobacillus casei за винаходом не відрізнялася від його проліферативної активності при використанні глюкози, і в цьому випадку проліферативна активність Е. соlі Ο-157 знижувалася з кожною субкультурою, при цьому процентний вміст R-типу досяг 15% у третій генерації та 100% у 7-й генерації. 39 88271 40 Крім Ε. coli О-157, подібні тести проводили з використанням Salmonella enteritidis та Shigella flexneri, але, як і у випадку Е. coli О-157, мутація в R-тип була набагато скорішою з використанням різновиду Lactobacillus casei за винаходом, ніж із використанням первинного різновиду Lactobacillus casei, як показано в Таблиці12. При введенні ми шам штаму патогенів, що мутували в R-тип, перорально та інтраперитонеально при смертельній дозі для S-типу, процент смертності дорівнював 0, а зовнішній покрив та поведінка не відрізнялися від цих характеристик для необроблених мишей, що підтверджує, що патогенність була значною мірою усунена. (Приклад 2) Раніше вже був проведений тест, в якому було показано, що щоденне вживання 2г ліофілізованих бактеріальних клітин (5´108клітин/г), виготовлених у Прикладі виготовлення 1 та включаючих первинні Lactobacillns casei, викликає збільшення Lactobacillus та Bifidobacterium, що, як відомо, є благотворними компонентами кишкової флори, і, навпаки, зменшення Clostridium та Veillonella, що, як відомо, є шкідливими бактеріями. В цьому прикладі були отримані результати вживання різновиду Lactobacillus casei за винаходом десятьма здоровими суб'єктами, кількість бактерій вимірювали та порівнювали через З місяці. Результати показані в Таблиці 13. При вживанні первинного Lactobacillus casei (FERM ВР-6971), кількість біфідобактерій за 3 місяці підвищилася приблизно на 90%, а кількість Lactobacillus casei на 150%, у той час як кількість Clostridium знизилася на 50%, a Veillonella на 25%. Проте, при вживанні Lactobacillus casei за винаходом (FERM ВР-10059, FERM P-19443) кількість біфідобактерій за 3 місяці підвищилася на 133%, a Lactobacillus casei на 300%, у той час як кількість Clostridium знизилася на 96%, a Veillonella на 98,4%. Тобто, Lactobacillus casei за винаходом виявляють набагато потужніші ефекти на благотворні та шкідливі бактерії, що складають кишкову флору. Здатність знижувати кількість шкідливих бактерій є особливо вражаючою. 41 88271 42 (Приклад 3) Далі, 2г ліофілізованих бактеріальних клітин Lactobacillus casei, виготовлених у вищезгаданому Прикладі виготовлення 1, давали десятьом інвалідам, кількість бактерій вимірювали та порівнювали через 3 місяці. Результати показані в Таблиці 14. Як видно з Таблиці 13 та 14, до застосування здорові суб'єкти мали приблизно у 2 рази більшу кількість благотворних бактерій у кишковій флорі, ніж інваліди, і лише близько 1/3 кількості шкідливих бактерій. Це означає, що стан кишкової флори відображає існуючий стан здоров'я. В результаті експерименту усі здорові суб'єкти, що приймали участь в тесті, відчували себе ще більш здоровими, а інваліди зазначали більше впевненості у своєму здоров'ї. Конкретні результати включали повідомлення про те, що (1) знизилася втомленість, (2) покращився колір обличчя, (3) зникли проблеми зі стулом, (4) шкіра набула пружності та краси, (5) зменшилася огрядність, (6) високий кров'яний тиск повернувся до нормального та (7) значно зменшилася атопія, і доля таких результатів була набагато більшою серед тих, хто вживав Lactobacillus casei за винаходом. (Приклад 4) Підготували три посадочні пристрої розміром 600мм (ширина) ´200мм (довжина) ´Η 150мм (висота), і заповнили кожний з них нормальною польовою землею, змішаною зі 100г зрілого компосту та 12г хімічного добрива (Nippon Godo Fertilizer Co. Green Map, N: 8%, P: 5%, K: 5%) і розкидали 10г магнієвого вапна (NAC Co., покращувач ґрунту, що містить 5-7% оксиду магнію, змішаного з гашеним вапном). Тоді зробили борозни на глибину 5-8мм і вручну засіяли насінням редиски. Проростання відбулося на п'ятий день, а на наступний день 2г центрифугованої бактеріальної маси, що містила первинні Lactobacillus casei (FERM ВР6971), культивовані в середовищі, описаному в Прикладі виготовлення 2, додали до 200мл, ретельно перемішали збовтуванням та обробили контрольну групу. Тим часом 2г центрифугованої бактеріальної маси, що містила Lactobacillus casei за винаходом (FERM BP-10059, FERM P-19443), культивовані в середовищі, описаному в Прикладі виготовлення 2, додали до 200мл води, ретельно перемішали збовтуванням та обробили тестову групу. Чистою водою оббризкали необроблену групу. Приблизно на 10-й день після появи листя, рослини зібрали через 5-см інтервали, залишивши 30 рослин редиски у кожному пристрої. Суспензії відповідних центрифугованих клітинних мас внесли у контрольну групу та тестову групу разом зі 150мл розведеного у 500 раз добрива, тоді як у необроблену групу внесли лише 150мл розведеного у 500 раз добрива. Тоді редиску поливали необхідним чином, щоб запобігти засиханню, та зібрали на 28-й день. Результати показані в Таблиці 15. Редиска, зібрана у тестовій групі, що була оброблена Lactobacillus casei за винаходом, була кращою не тільки за необроблену редиску, але також за рослини контрольної групи, що була оброблена первинним Lactobacillus casei, за всіма показниками якості, включаючи вагу, блиск, запах, м'ясистість, смак та хрусткість. 43 88271 44 (Приклад 5) Дослідження росту проводили з тестовими групами як у Прикладі 4, шляхом гідропонного вирощування паростків білої редьки. Губчастий матеріал розподілили по дну поліетиленового ящика розміром 100 (ширина) ´100 (довжина) ´180 (висота)мм, просочили водою та повністю засіяли насінням білої редьки. Встановивши температуру 22°С, ящик накрили чорною тканиною на 5 діб, щоб блокувати світло, після чого тканину прибрали та вирощували паростки при природному освітленні. Для контрольної групи 1г ліофілізованих бактеріальних клітин первинного різновиду Lactobacillus casei (FERM BP-6971) додали до 100мл води, ретельно перемішали збовтуванням та нанесли розпилюванням у 3-й та 5-й дні. Для тестової групи 1г ліофілізованих бактеріальних клітин Lactobacillus casei за винаходом (FERM BP10059, FERM Р-19443), виготовлених у Прикладі виготовлення 1, додали до 100мл води, ретельно перемішали збовтуванням та нанесли розпилюванням у 3-й та 5-й дні. До необробленої групи додали лише воду. Як показали результати вирощування, представлені у Таблиці 16, при нанесенні Lactobacillus casei за винаходом були отримані кращі паростки білої редьки, ніж у необробленій групі та контрольній групі. Як видно з Прикладів 1-5, різновид Lactobacillus casei за винаходом, що має певні властивості, набуті завдяки акліматизації, з одночасним збереженням властивостей первинного різновиду Lactobacillus casei, у незліченній мірі покращує життєздатність живого організму і є штамом, що принципово відрізняється від первинного різновиду Lactobacillus casei. (Приклад 6) Щодо токсичності P. gingivalis та P. intermedia, було показано, що якість та кількість утворених токсинів може бути оцінена за результатами тестів на тваринах шляхом спостереження за кольором та запахом чорних колоній, що виростають на кров'яних пластинах та вимірювання міцності адгезії до пластин, тоді як у випадку A. actinomycetemcomitans, якість та кількість продукованих токсинів може бути оцінена шляхом вимірювання адгезивності та гемолітичної активності. Тому ми культивували вищезгадані основні періодонтальні патогени разом із "новою лактобацилою" для дослідження тенденцій та реакцій, що 45 виявляють періодонтальні патогени. З використанням у якості середовища бульйону GAM, модифікованого Nissui, бактерії вирощували в анаеробних умовах при 37°С з пересадкою субкультур кожні 72 години, при цьому культуру розбавляли та наносили звичайними способами на середовище кров'яної пластини, і тоді через певний час вимірювали кількість клітин та спостерігали за станом утворених колоній. Результати показані в Таблиці 17, 18 та 19. Як видно з Таблиці 17, кількість клітин P. gingivalis поступово падала з кожною субкультурою, і у 25-й субкультурі вони були вже відсутні. За цей час токсичність поступово слабшала, починаючи з 5-ї субкультури, і хоча деяка слабка токсичність ще існувала у 15-й субкультурі, у 20-й вона практично зникла. Було підтверджено, що у мишей, періодонтально інфікованих цими бактеріями, періодонтит не розвився. Як видно з Таблиці 18, кількість клітин Р. intermedia у субкультурах поступово знижувалася, і у 15-й суб 88271 46 культурі бактерії остаточно зникли. Відповідно, патогенність також знижувалася і зникла у 12-й субкультурі. Як видно з Таблиці 19, кількість клітин A. actinomycetemcomitans знижувалася з кожною субкультурою, але не так швидко, як для P. gingivalis та P. intermedia. Проте з певного моменту A. actinomycetemcomitans стали швидко зменшуватися і зникли у 18-й субкультурі. У тестах на мишах патогенність повністю зникла у 12-й культурі. Подібні тести на спільне культивування також проводили з іншими бактеріями, що грають певну роль у періодонтальному захворюванні, такими як F. nucleatum, В. forsythus, L. buccalis, E. Corrodens, a також стрептококками, що звичайно присутні у ротовій порожнині, та всі вони були переможені проліферативною активністю та біоактивними речовинами лактобацил за винаходом, при цьому кількість клітин та токсичність знижувалася з кожною субкультурою. 47 (Приклад 7) При культивуванні "нової лактобацили" (FERM ВР-10059, FERM Р-19443) штрихом в анаеробних умовах протягом 72 годин при 37°С у центрі пластини діаметром 90мм, та культивуванні штрихом суміжно з нею різних періодонтальних патогенів, розвиток періодонтальних патогенів поблизу ділянок, зайнятих FERM ВР-10059 (FERM P-19443) затримується завдяки ефекту антибіотикоподібних біоактивних речовин, що продукує FERM ВР-10059 (FERM Ρ-19443). Тому ми досліджували, як зміниться область росту, якщо періодонтальні патогени, які ростуть з того краю, де розвиток було затримано, багатократно витягувати та культиву 88271 48 вати штрихом на пластинах росту FERM ВР-10059 (FERM Ρ-19443). В цьому прикладі FERM ВР10059 (FERM P-19443) не змішували з періодонтальними патогенами, як у Прикладі 5. На пластинах використовували модифіковане середовище GAM. Результати показані в Таблиці 20. Область затримки росту внаслідок дії FERM BP-10059 (FERM P19443) після декількох субкультур була приблизно такою самою, як у початковій культурі, але з певного моменту область затримки швидко збільшилася, і у 13-й -15-й субкультурах патогени були усунені з чашки Петрі. Разом з цим поступово знижувалася токсичність, яка зрештою зникла. 49 88271 50 43> Культивували з розмазуванням матеріалу по середовищу, але росту не було У тесті на чутливість із використанням існуючих антибіотиків область затримки у» всіх випадках поступово скорочувалася з кожним пасажем, і зрештою була досягнута резистентність. Тобто, з'явилися антибіотико-резистентні штами, і бактеріальні токсини або лишалися незмінними, або часто ставали сильнішими. Добре відомо, що виникнення та поширення MRSA, VRE та мультирезистентних М. tuberculosis, Ps. aeruginosa є серйозною проблемою в усьому світі. Приклади 6 та 7 свідчать про те, що періодонтальні патогени не набувають резистентності завдяки сильним ефектам FERM ВР-10059 (FERM Р-19443), незалежно від того, чи контактують вони безпосередньо, тому що їхня здатність рости та розмножуватися з часом пригнічується і токсичність повністю усувається. (Приклад 8) Для вимірювання адгезивності "нової лактобацили" (FERM ВР-10059, FERM P-19443) у періодонтальній кишені розчин клітин (2´1010/мл), суспендований у фізіологічному розчині, впорскували в кишені еквівалентної глибини, на наступний день в кишені впорскували стерильний фізіологічний роз чин, і через 5 хвилин впорскнутий розчин аспірували з кишень і кожного дня протягом тижня спостерігали за підвищенням та зниженням кількості FERM ВР-10059 (FERM Ρ-19443). Слиз L. acidophilus, що колонізуються на слизових оболонках, підготували у якості контрольного досліду, і його та високоадгезивні В. natto впорскували окремо в такій самій кількості і спостерігали за розвитком. Результати показані в Таблиці 21. При ін'єкції 2´1010/мл FERM BP-10059 (FERM Ρ-19443) більшість клітин (90%-95%) було вимито, але бактерії, що залишилися, вижили приблизно протягом тижня, причому міра колонізації була і тим вищою, чим глибше кишеня. Це означає, що FERM BP10059 (FERM Р-19443) здатні рости з використанням рідини періодонтальної канавки у якості основного джерела живлення, і можуть бути більш активними при більш прогресуючому періодонтальному захворюванні. У протилежність цьому, L. acidophilus не було виявлено з четвертого дня, а В. natto зникли з третього дня. Тобто, ці бактерії не можуть поселятися та розмножуватися у періодонтальних кишенях. 51 88271 52 (Приклад 9) Спостерігали підвищення та зниження кількості клітин при ін'єкціях "нової лактобацили" (FERM ВР-10059, FERM Р-19443) у періодонтальні кишені кожного дня та при ін'єкціях через день. Як показано в Таблиці 22, при ін'єкціях бактерій кожного дня кількість клітин у кишенях поступово зростала, причому колонізація та проліферація були кращі у більш глибоких кишенях, а при ін'єкціях бактерій через день колонізація та проліферація бактерій були дещо нижчі, ніж у випадку щоденних ін'єкцій, але кількість клітин також поступово зростала. З цього можна зробити висновок, що ін'єкції бактерій через день можуть бути достатніми. "Нова лактобацила" (FERM BP-10059, FERM Ρ-19443) не тільки ефективна дроти всіх видів гострих та хронічних інфекцій, але також ефективно забезпечує покращення при системних хронічних станах, таких як діабет, що є факторами, пов'язаними з періодонтальним захворюванням. Тобто, введення нової лактобацили за винаходом підвищує природні цілющі сили організму, а отже, його вітальність. Вітальність - це здатність організму підтримувати ріст та регенерувати тканини. (Приклад 10) 45 золотих рибок (Wakin) середньої довжини 4,2см, що виявляли початкові симптоми захворювання водним грибком Saproglenia, поділили на три групи -необроблену групу, контрольну групу та тестову групу, і досліджували протягом 2 місяців у 9 резервуарах з водою (загальною кількістю) при трьох температурах води для кожної групи: 15°С, 20°С та 25°С. У кожному резервуарі утримували п'ять золотих рибок у 5 літрах води. 1г ліофілізованих бактеріальних клітин (5´106клітин/мл води у резервуарі) первинного різновиду Lactobacillns casei (FERM ВР-6971) ввели у контрольну групу. 1г ліофілізованих бактеріальних клітин (5´106клітин/мл води у резервуарі) різновиду Lactobacillus casei за винаходом (FERM BP-10059, FERM Ρ-19443), отриманого у Прикладі виготовлення 1, ввели у тестову групу. Золотих рибок у необробленій групі утримували без будь-якої обробки. Результати показані в Таблиці 23. Як показано в Таблиці 23, у необробленій групі всі золоті рибки загинули менш ніж за місяць незалежно від температури води, при середньому часі виживання 18 діб. У контрольній групі, що отримала первинний різновид Lactobacillus casei, усі золоті рибки загинули менш ніж за місяць у резервуарі з температурою 25°С, при середньому часі виживання 23 доби, але у резервуарах з температурою 15°С та 25°С грибок ріс повільніше, і золоті рибки вижили довше, при цьому 2 з них загинули через місяць, а ще дві 2 - через 2 місяці при 15°С, з коефіцієнтом смертності 80%. При 20°С 2 рибки загинули через місяць, і решта через 2 місяці, з коефіцієнтом смертності 100%. У протилежність цьому, при використанні різновиду Lactobacillus casei за винаходом 1 золота рибка загинула на 45 день розведення при 20°С, а при 25°С 1 золота рибка загинула на 25-й день і 1 золота рибка - на 50-й день, при цьому всі інші рибки були здорові, а кількість грибка, що приклеївся до поверхонь їхніх тіл, знижувалася, доки він не став майже непомітним. Швидкість росту була такою ж, як для здорових золотих рибок. Це означає, що різновид Lactobacillns casei за винаходом, що був акліматизований до низьких температур, ефективний навіть при низькій температурі 15°С. 53 (Приклад 11) Дослід із вирощуванням рибок виконували в резервуарах з тами ж умовами, що й у Прикладі 10, з використанням груп з 5 золотих рибок (Wakin), що страждали на виразкове захворювання золотих рибок. У цих рибок бактерії Aeromona проникли крізь рани та розчинили оточуючі тканини, що у тяжких випадках привело до оголення внутрішніх органів. Симптоми виразкового захворювання золотих рибок коливалися від легких до помірних; золотих рибок вирощували протягом 2 місяців, при цьому симптоми між резервуарами були збалансовані. Результати показані в Таблиці 24. Як видно з Таблиці 24, симптоми у золотих рибок необробленої групи прогресували незалеж 88271 54 но від температури води, за 2 місяці органи оголилися і всі рибки загинули. У контрольній групі, що отримувала первинний різновид Lactobacillus casei (FERM ВР-6971), рибки з легкими симптомами зберігали такий стан при низькій температурі води, але при високій температурі води симптоми повільно прогресували, і за 2 місяці 60% - 80% рибок загинули. У протилежність цьому, у тестовій групі, що отримувала різновид Lactobacillus casei за винаходом (FERM ВР-10059, FERM P-19443), більшість рибок з легкими симптомами видужали незалежно від температури води. Навіть у випадку помірних симптомів, рани поступово гоїлися, і жодна рибка не загинула навіть через 2 місяці. 55 (Приклад 12) Зрізали близько 1см2 шкіри миші, після чого на рани тварин у необробленій групі двічі на день (вранці та ввечері) наносили воду, а в групах бактеріальної обробки наносили центрифуговані клітини стандартного штаму АТСС 393 L. casei та "нової лактобацили" (FERM ВР-10059, FERM Р19443), тоді спостерігали за розвитком. Як показано на Фіг.1, при нанесенні FERM ВР-10059 (FERM Ρ-19443) знадобилося лише 3 доби для утворення тонкої плівки на поверхні рани, 8 діб для повного відновлення шкіри та 22 доби для повного відростання шерсті. У протилежність цьому, при використанні АТСС 393 для цього знадобилося 4 доби, 10 діб та 28 діб, а при використанні води 5 діб, 12 діб та 35 діб, відповідно. Цей дослід також підтверджує надзвичайні ефекти відновлення тканин "нової лактобацили" (FERM BP-10059, FERM P19443). (Приклад 13) Для дослідження зростання кількості клітин, з використанням різних тваринних та рослинних клітин, стандартний штам АТСС 393 L. case і та "нову лактобацилу" (FERM ВР-10059, FERM Р19443) висіяли у середовище з рН7,2, що містило 3г пептону, 2г триптону, 3г м'ясного екстракту, 1г CGF, 1г дріжджового екстракту, 3г крохмалю, 1г трегалози, 1,5г КН2РО4, 0,7г MgSO4×7H2O, 1г NaCl, 1г діамонію цитрату, 1г (ΝΗ4)ΗΡΟ4, 2г натрію ацетату, 2г СаСО3, 0,2г MnSО4×xH2O, 0,03г FeSO4×7H2O, 0,01г ZnSO4, 0,2г L-цистеїну та 1г таурину на літр, і культивували в анаеробних умовах протягом 72 годин при 37°С; клітини нирки мавпи (V-1), клітини мастоцитоми миші Р815 та лімфоцити миші СЕА змішали у кількості 2´105клітин/мл з рідиною культури, що містила середовище GIT виробництва Japan Pharmaceutical Co. для культур тваринних клітин, з доданням або без додання 5% центрифугованого супернатанту з культур лактобацил, і через 48 88271 56 годин підрахували живі клітини. Результати показані на Фіг.2, 3 та 4. Як видно з цих діаграм, при доданні до рідини культури 5% фільтрату культури лактобацил, тваринні клітини ставали більш плодючими, при цьому їх збільшення складало від 10 до 15% при використанні стандартного штаму АТСС393 і від 40 до 50% при використанні FERM ВР-10059 (FERM P-19443). Це означає, що речовини, продуковані лактобацилами (біоактивні речовини) стимулюють та прискорюють проліферацію (ділення клітин), а підвищення проліферації лімфоцитів говорить про певний внесок у зміцнення імунної системи. Крім того, як показано на Фіг.5, у подібному тесті з використанням рослинних клітин хлорели швидкість проліферації також підвищилася, хоча й не так сильно, як у випадку тваринних клітин. Періодонтальні патогени мають безліч патогенних факторів, що прямо чи опосереднено завдають шкоди періодонтальним тканинам, включаючи фактори, і пов'язані з адгезією, протеїнази та токсини, речовини, що діють як токсини, продукти метаболізму тощо. Конкретні приклади включають ендотоксини (LPSI), колагенази, трипсиноподібні ферменти, ферменти, що пригнічують фібробласти, та інші деструктивні ферменти, лейкоцитотоксини, стрептолізин, сульфід водню, жирні кислоти та інші клітинні токсини, а також фізичну адгезію за допомогою довгих війок до слизового епітелію, червоних кров'яних клітин та інших бактерій. Особливо численні ефекти мають ендотоксини, включаючи активізацію остеокластів (стимуляцію абсорбції альвеолярного відростка), пошкодження фібробластів та стимуляцію імунопатологічних реакцій (порушення кровообігу у періодонтальних тканинах). "Нова лактобацила" (FERM ВР-10059, FERM Р-19443) не тільки блокує проліферацію періодонтальних патогенів та ослабляє їхню патогенність, але також перетворює та 57 детоксифікує деякі токсини, що продукуються періодонтальними патогенами. (Приклад 14) Клітини періодонтальних патогенів культивували протягом 120 годин в анаеробних умовах при 37°С у модифікованому бульйоні GAM, зібрали шляхом центрифугування, флотували у фізіологічному розчині та тричі промили шляхом центрифугування. Тоді їх рівномірно флотували у п'ятикратній кількості води та охолодили до 0°С, додали таку саму кількість льодяного водного розчину 0,5 N трихлороцтової кислоти та залишили на 3 години при 0°С. Залишок клітинних тіл видалили шляхом центрифугування, до супернатанту додали 2 об'ємних еквіваленти охолодженого етанолу і осадок центрифугували. Осадок промили малою кількістю етанолу, а потім ефіром, в результаті чого отримали ендотоксин у вигляді білого порошку. Диск просочили 5мг цього ендотоксину та висушили, отримавши диск чутливості. Тоді стандартний штам L. casei АТСС393 та "нову лактобацилу" (FERM BP-10059, FERM P-19443) нанесли на середовище пластини ВСР, що містило 2,5г дріжджового екстракту, 5г пептону, 1г глюкози, 0,1г Lцистеїну, 1г Полісорбату 80 та 0,06г ВСР на літр, підготований диск чутливості вмістили у центрі середовища та культивували бактерії в анаеробних умовах протягом 48 годин при 37°С. В результаті ріст АТСС393 було блоковано на відрізку 12мм від краю диска, тоді як FERM BP-10059 (FERM Ρ-19443) проліферативно росли на краю диска. Це показує, що FERM BP-10059 (FERM P19443) вбудували ці ендотоксини в свої клітини у якості вітаміноподібних факторів. Крім того, "нова лактобацила" (FERM BP-10059, FERM Ρ-19443) має здатність агресивно пригнічувати сірчані сполуки із сильним запахом, такі як жирні кислоти та сульфід водню, і її проліферація стимулюється при доданні цих речовин. (Приклад 15) 88271 58 Три групи з 15 пацієнтів, що страждали відповідно на гострий коліт, гострий цистит та кон'юнктивіт, захворювання, що викликаються подібними бактеріями та мають подібні симптоми, розділили на 3 підгрупи у кожній групі, по 5 пацієнтів у підгрупі. У кожній групі підгрупа А отримувала протягом 5 днів 1000мг/день антибіотика, підгрупа В отримувала протягом 5 днів 500мг/день антибіотика та протягом 10 днів 2г/день (5´1010клітин/день) ліофілізованих клітин антибіотик-резистентного різновиду Lactobacillus casei за винаходом (FERM BP-10059, FERM P-19443), що був отриманий способом, описаним у Прикладі виготовлення 1, а підгрупа С спочатку отримувала 1000мг/день тільки антибіотика, а після усунення гострих симптомів застосування антибіотика припинили (звичайно 23 дні) і тоді групу лікували, як підгрупу В, 2г/день ліофілізованих бактеріальних клітин протягом 7 днів. Середні ефекти лікування для кожної групи за 10 днів показані в Таблиці 25. Як видно з Таблиці 25, застосування препарату лактобацил за винаходом у поєднанні зі звичайним антибіотиком для лікування гострих інфекцій або застосування препарату лактобацил за винаходом після застосування антибіотиків має великі переваги, особливо у світлі проблем резистентності до лікарських засобів, з якими стикається традиційна терапія, що використовує тільки антибіотики, в тому числі (а) можливість зменшити дозу антибіотика наполовину, (b) можливість суттєво знизити навантаження на пацієнтів за рахунок скорочення часу, необхідного для зменшення, полегшення та усунення симптомів, при практичній відсутності побічних ефектів, та (с) усунення таких проблем, як порушення кишкової флори та мікробне заміщення. Для гострих інфекцій результати подібні (з деякими відмінностями у патогенах та симптомах) до результатів лікування, отриманих з первинним різновидом Lactobacillus casei у Прикладі порівняння 1, наведеному нижче. 59 88271 60 1) ++ Різке падіння загальної кількості кишкових бактерій, тимчасовий, але значний розрив у конкурентному балансі між бактеріями, що утворюють кишкову флору + Суттєве зменшення кишкової флори, деякий тимчасовий розрив у конкурентному балансі між бактеріями, що утворюють кишкову флору ± Деякі зміни, але без суттєвого ефекту - Без особливих змін (Приклад порівняння 1) Як у Прикладі 15, три групи з 15 пацієнтів, що страждали відповідно на гострий коліт, гострий цистит та кон'юнктивіт, захворювання, захворювання, що викликаються подібними бактеріями та мають подібні симптоми, розділили на 3 підгрупи у кожній групі, по 5 пацієнтів у підгрупі. У коленій групі підгрупа А отримувала протягом 5 днів 1000мг/день антибіотика, підгрупа В отримувала протягом 5 днів 500мг/день антибіотика та протягом 10 днів 2г/день (5´109клітин/день) ліофілізованих клітин FERM ВР-6972, одного з антибіотик резистентних первинних різновидів Lactobacillus casei, що був отриманий способом, описаним у Прикладі виготовлення 1, а підгрупа С спочатку отримувала 1000мг/день тільки антибіотика, а після покращення симптомів застосування антибіотика припинили (звичайно 2-3 дні) тоді групу лікували, як підгрупу В, 2г/день ліофілізованих бактеріальних клітин протягом 7 днів. Середні ефекти лікування для кожної групи за 10 днів показані в Таблиці 26. Цей Приклад порівняння відповідає Прикладу тесту 1 (Таблиця 6) викладеної патентної заявки Японії №2001-333766.
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel lactobacillus, the preparation of lactobacillus, activating living organisms, and phylactic or therapeutic agent for treatment of infection of living organisms
Автори англійськоюHATA TADAYO, TOSHIMORI HITOSHI, MARUOKA TOSHIYUKI
Назва патенту російськоюНовая лактобацилла, препарат лактобациллы, который активирует живые огранизмы, и профилактическое или лечебное средство для лечения инфекций живых организмов
Автори російськоюХата Тадайо, Тошимори Хитоши, Маруока Тошиюки
МПК / Мітки
МПК: A61K 35/74, A61P 31/04, A01N 63/02, C12N 1/20
Мітки: лікувальний, живих, живі, організмів, лактобацили, засіб, інфекції, організмі, препарат, лікування, лактобацила, профілактичний, активує, нова
Код посилання
<a href="https://ua.patents.su/53-88271-nova-laktobacila-preparat-laktobacili-shho-aktivueh-zhivi-organizmi-ta-profilaktichnijj-abo-likuvalnijj-zasib-dlya-likuvannya-infekci-zhivikh-organizmiv.html" target="_blank" rel="follow" title="База патентів України">Нова лактобацила, препарат лактобацили, що активує живі організми, та профілактичний або лікувальний засіб для лікування інфекції живих організмів</a>
Попередній патент: Фармацевтичний препарат і його застосування для профілактики удару, діабету
Наступний патент: Застосування поліпептидів сімейства купредоксину в лікуванні раку
Випадковий патент: Аустенітна корозійностійка сталь