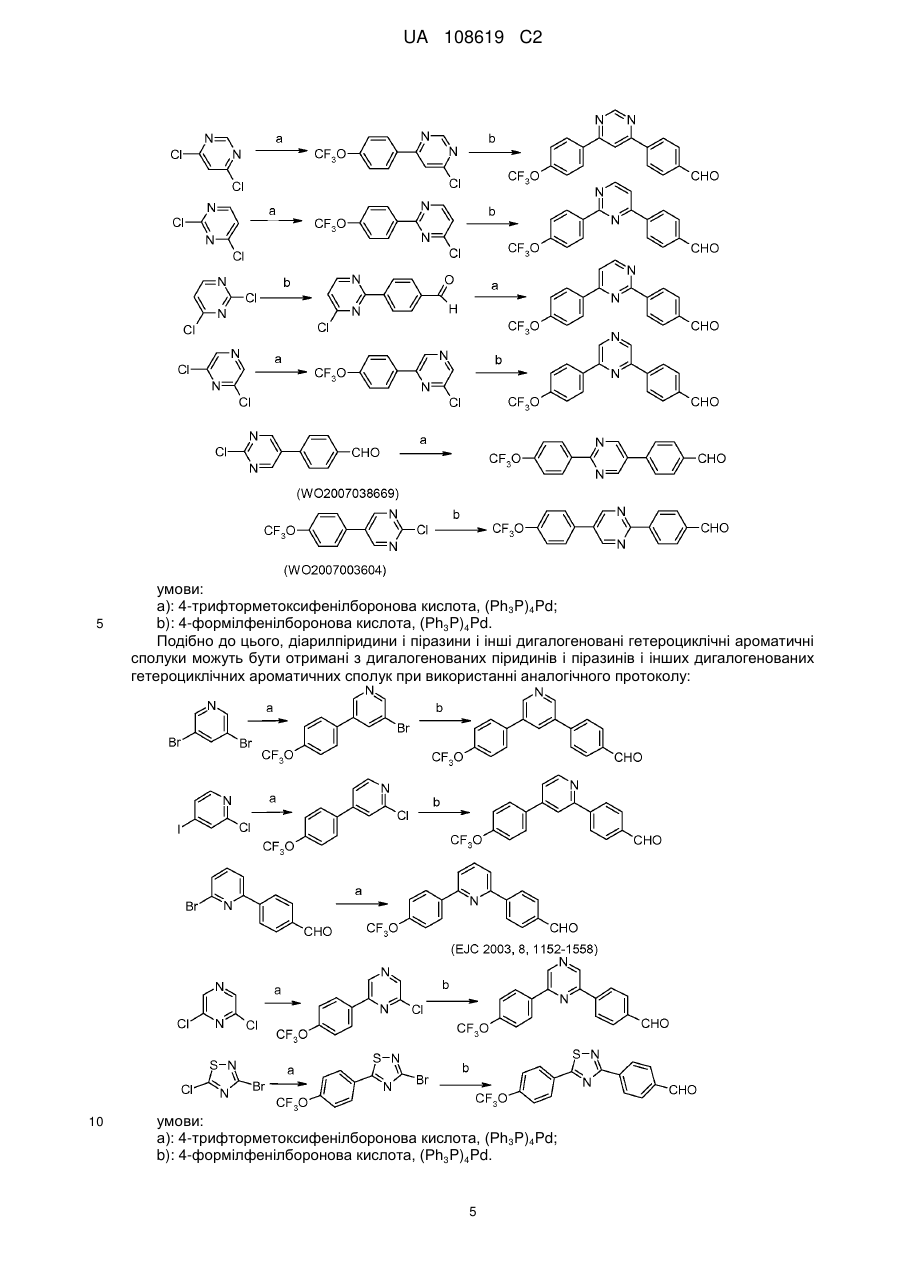
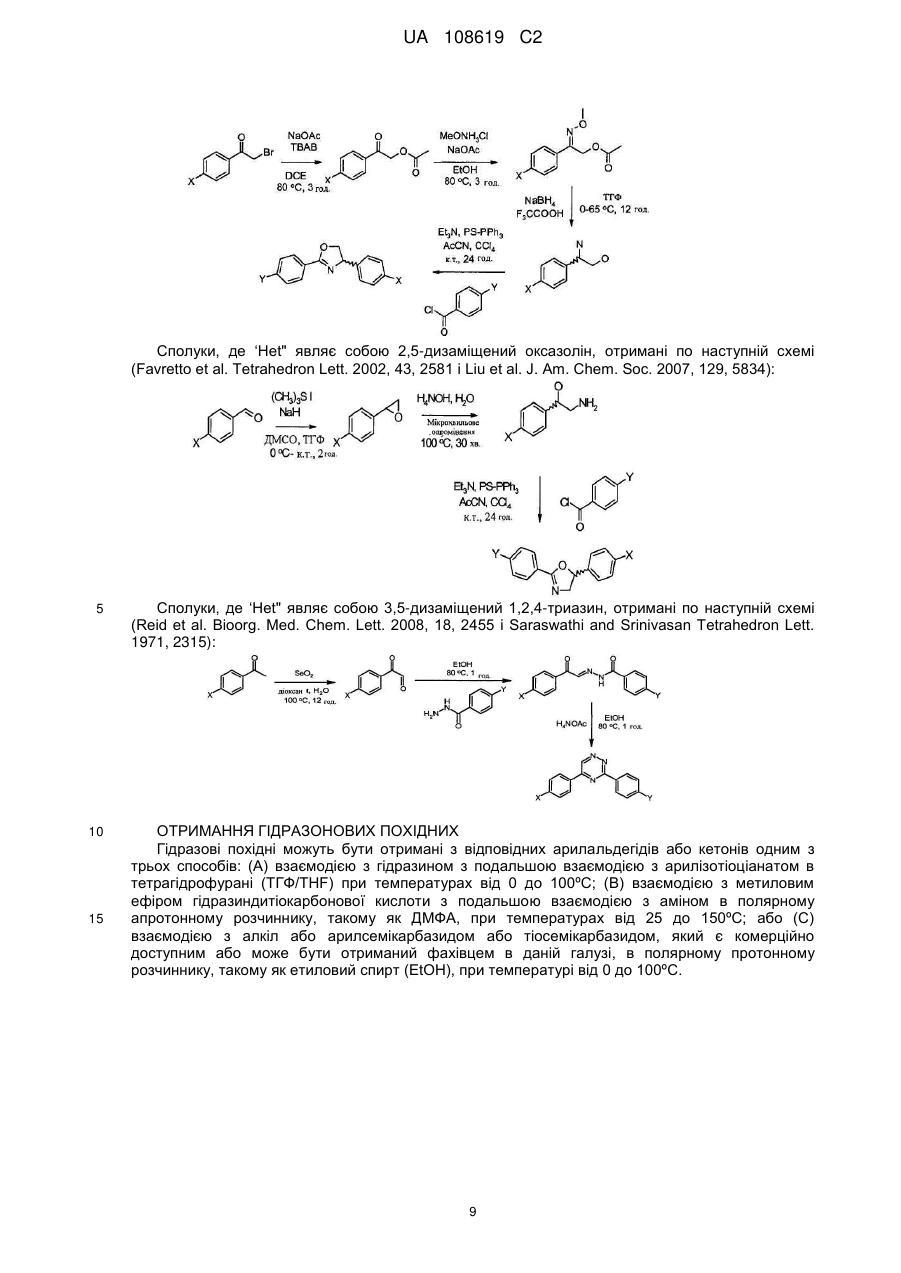
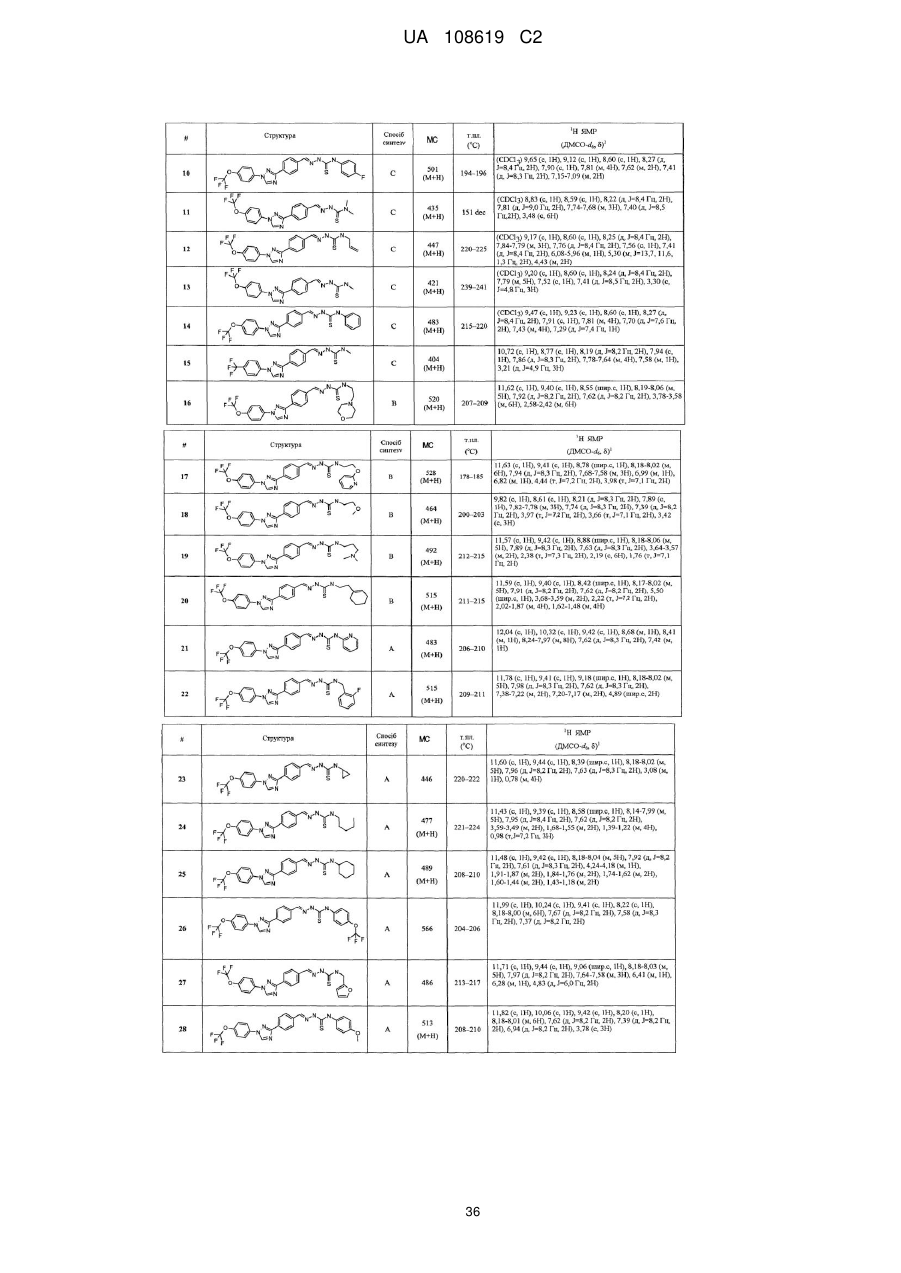
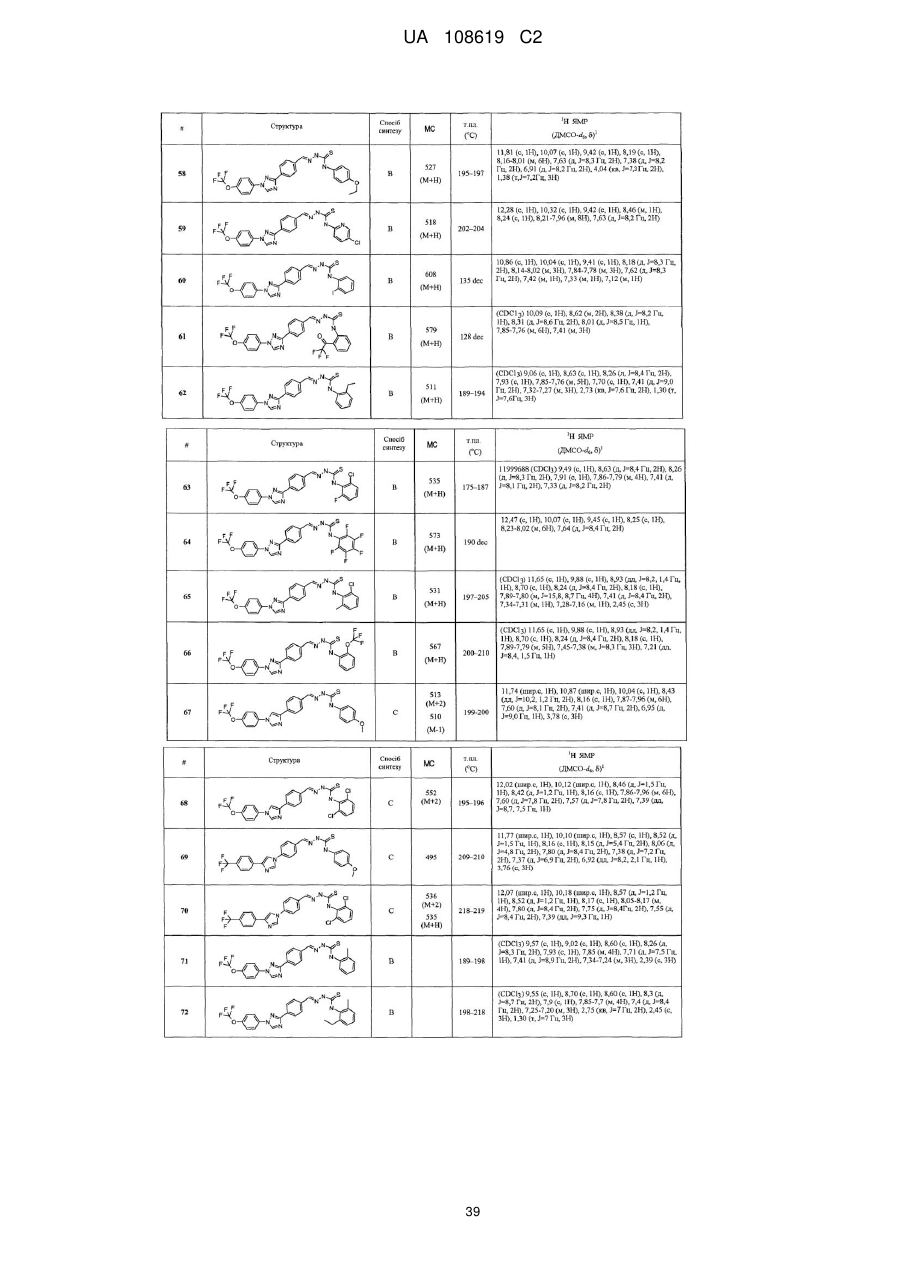
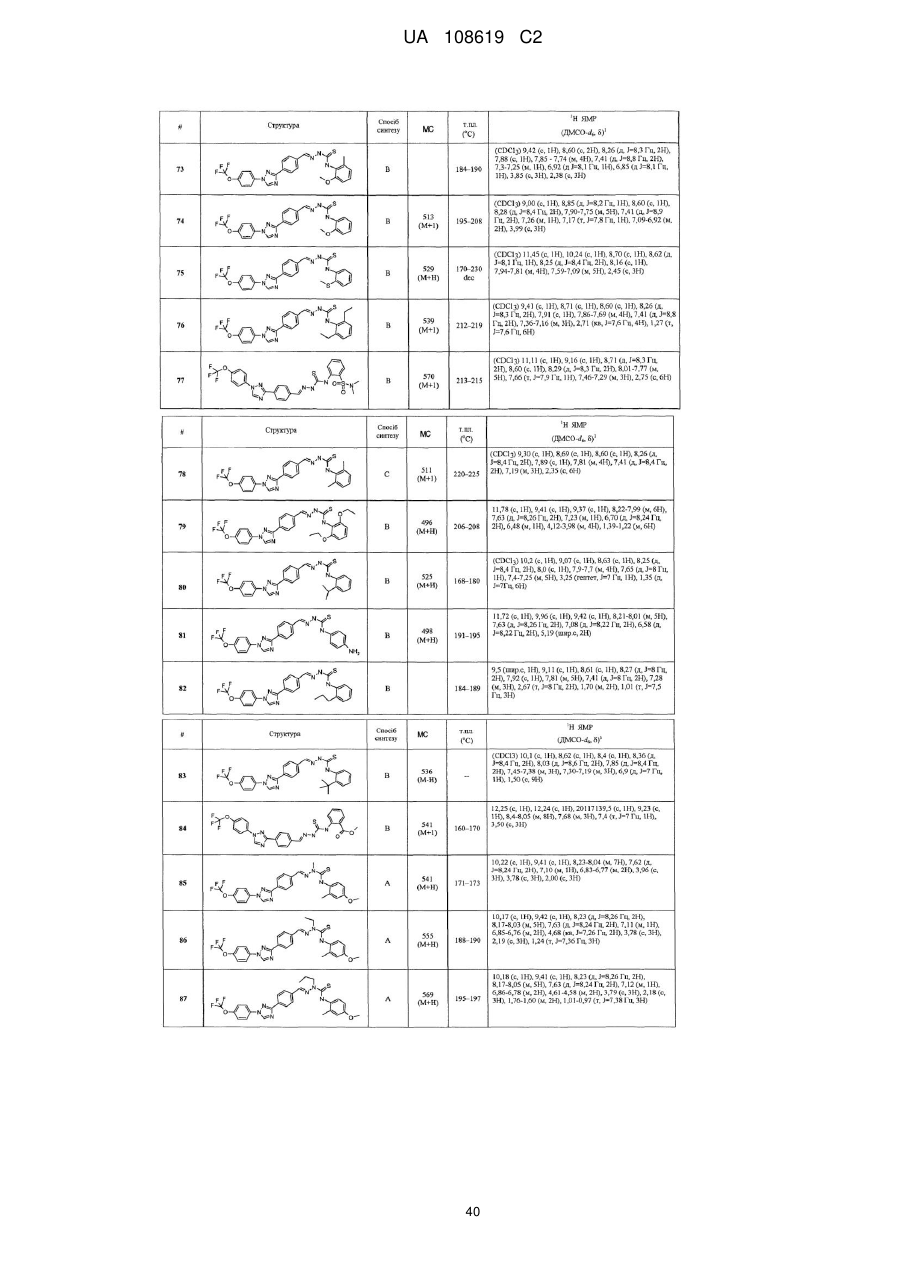
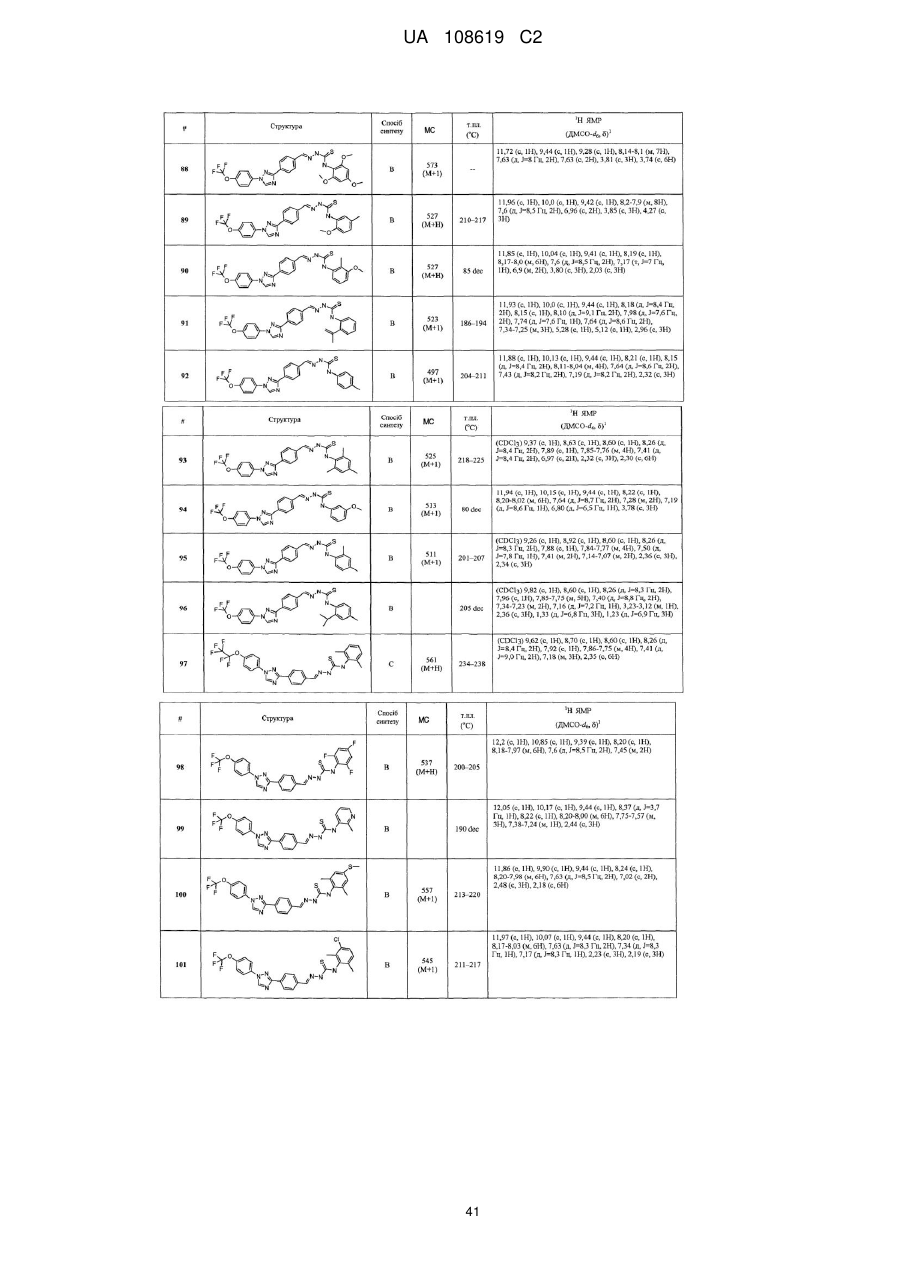
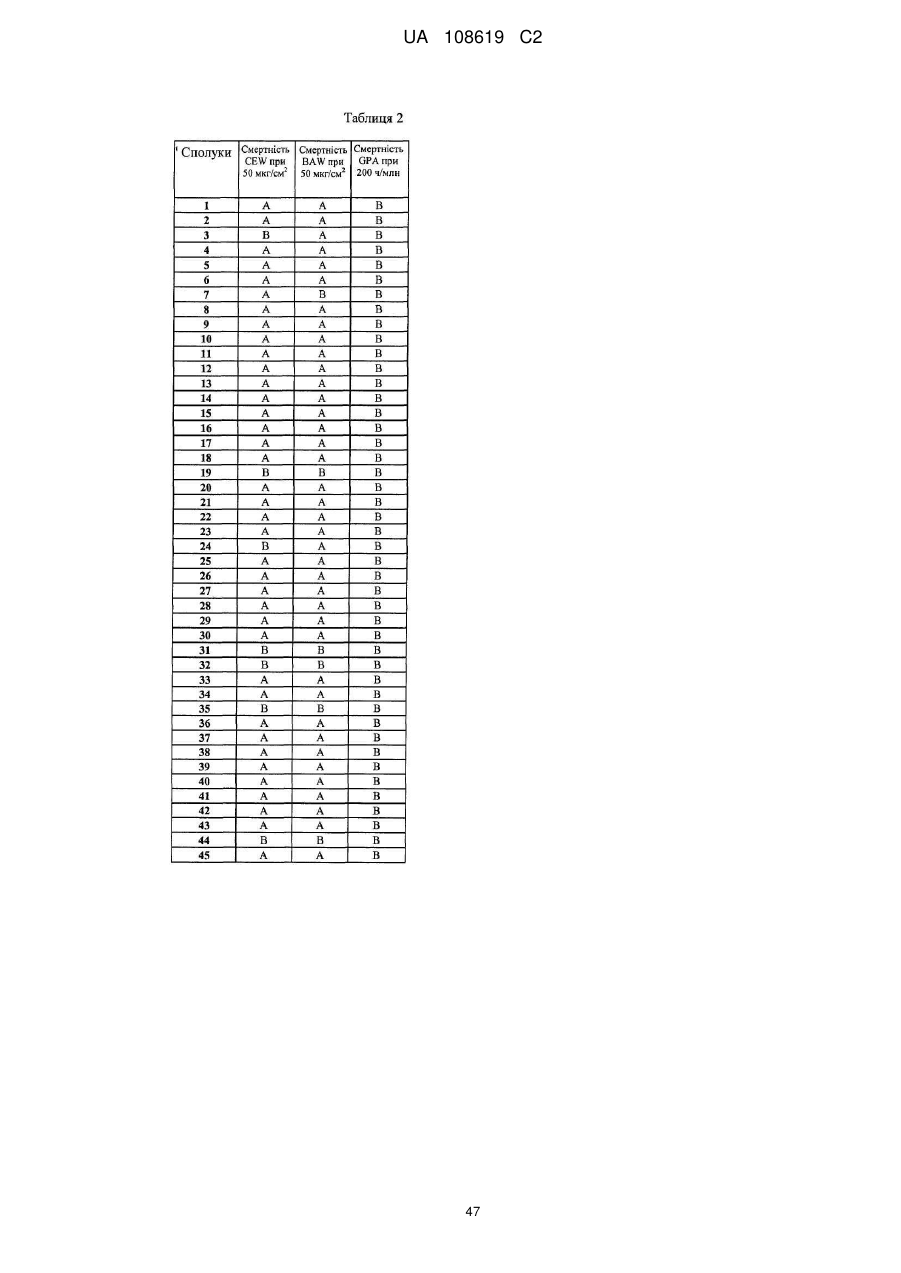
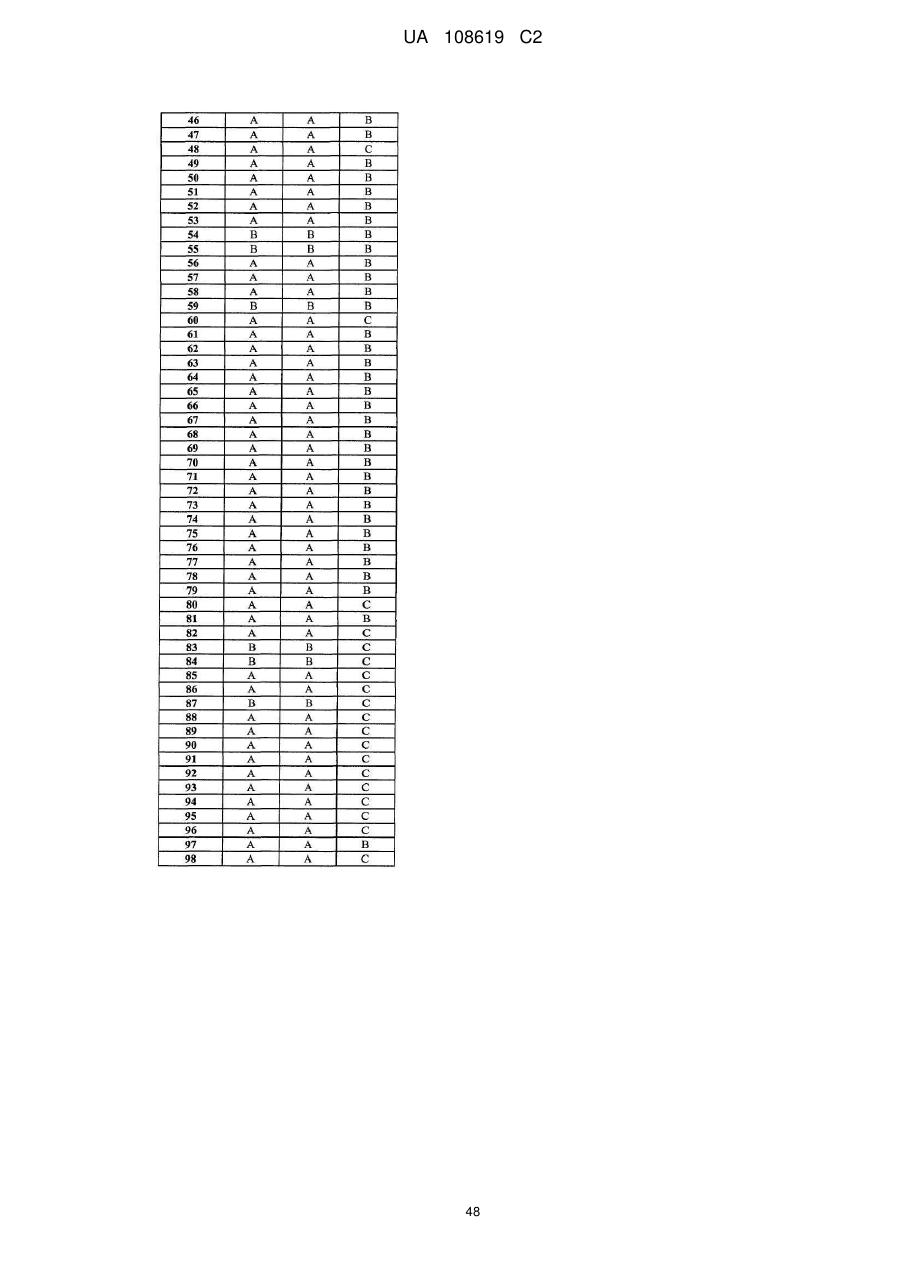
Пестицидні композиції
Номер патенту: 108619
Опубліковано: 25.05.2015
Автори: Ламберт Уілльям, Ніяз Ноормохамед, Рігсбі Емілі, Браун Аннетт, Маклауд КаСандра, Спаркс Томас, Крауз Гарі
Формула / Реферат
1. Молекула наступної формули:
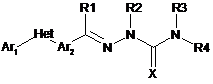 ,
,
в якій:
(a) Аr1 являє собою заміщений феніл, де вказаний заміщений феніл має один або декілька замісників, які незалежно вибираються з С1-С6алкілу, С1-С6галогеналкілу і С1-С6галогеналкокси;
(b) Het являє собою триазоліл, імідазоліл, піроліл або піразоліл;
(c) Аr2 являє собою феніл;
за умови, що Аr1 і Аr2 не знаходяться в ортоположенні один до одного;
(d) X являє собою О або S;
(e) R1 вибраний із замісників: Н або С1-С6алкіл;
(f) R2 вибраний з Н або С1-С6алкілу, R3 являє собою Н і R4 являє собою С1-С6алкіл, феніл, С1-С6алкілфеніл або Het-1,
де Het-1 являє собою 5- або 6-членне насичене або ненасичене гетероциклічне кільце, що містить один або декілька гетероатомів, які вибрані з азоту, сірки або кисню;
де кожний необов'язково заміщений одним або декількома замісниками, незалежно вибраними з наступних: F, Сl, Br, I, CN, NO2, NRxRy, С1-С6алкіл, С1-С6галогеналкіл, С1-С6алкокси, С1-С6галогеналкокси, С3-С6-циклоалкеніл, S(=О)n(С1-С6алкіл), S(=О)n(С1-С6галогеналкіл), S(=O)2N(С1-С6алкіл)2, C(=O)(С1-С6алкіл), С(=О)О(С1-С6алкіл), С(=О)(С1-С6галогеналкіл), (С1-С6-алкіл)О(С1-С6-алкіл) і феніл;
(g) n=0, 1 або 2;
(h) Rx і Ry незалежно вибрані із Н, С1-С6алкілу і С(=О)(С1-С6алкіл).
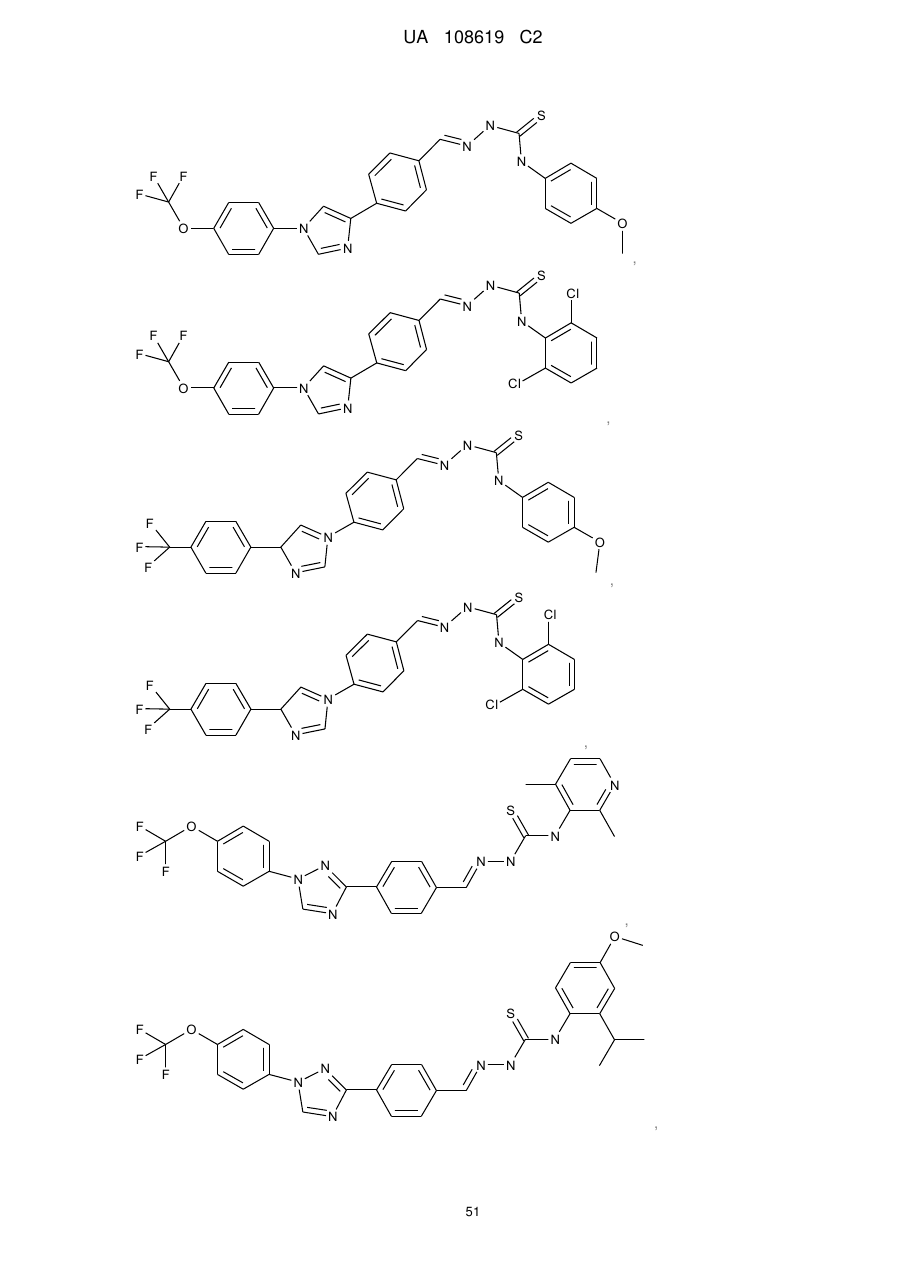
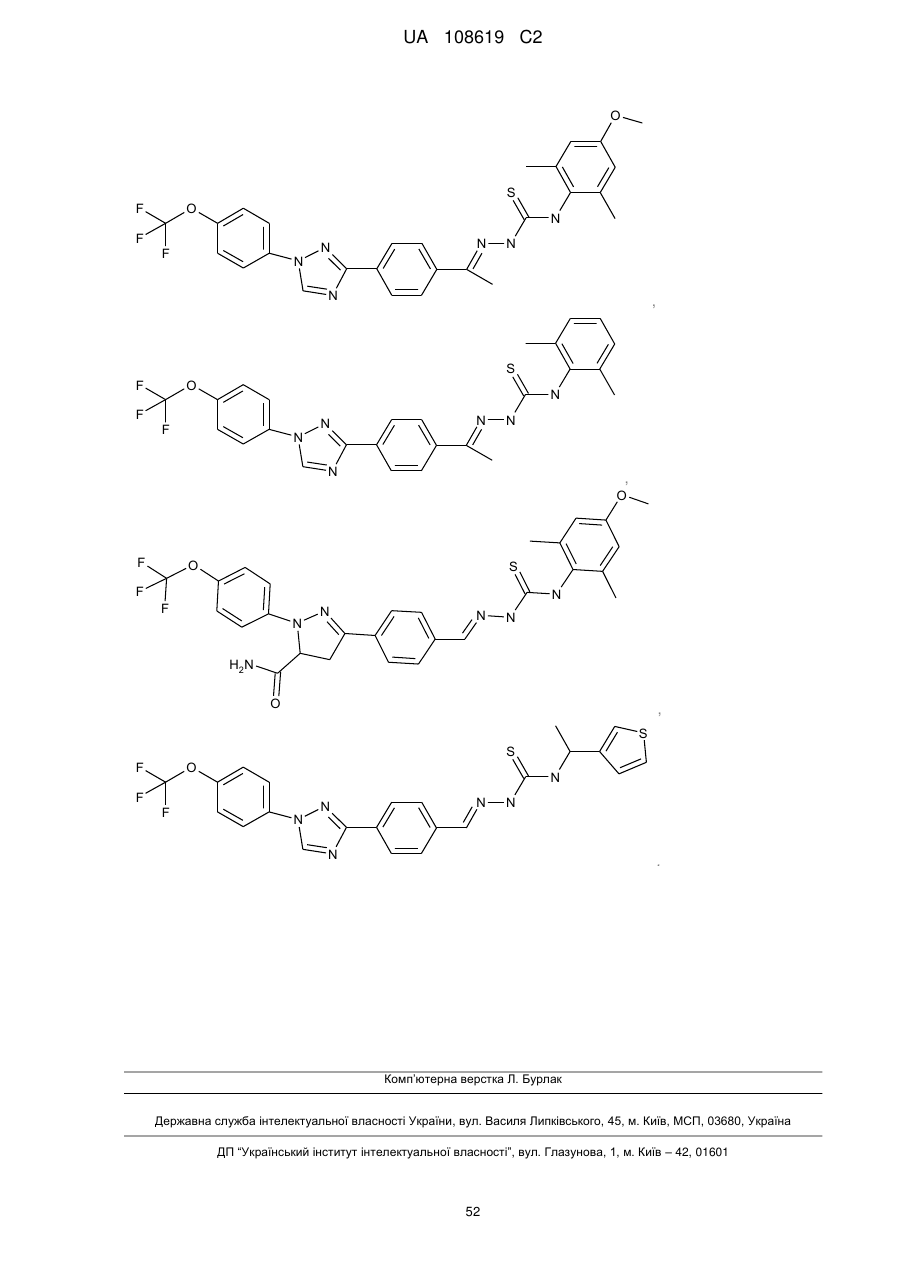
2. Молекула, яка має одну з наступних структур:





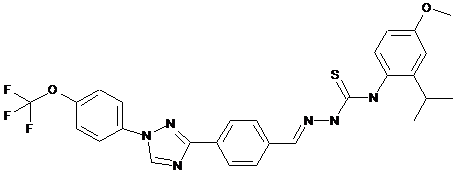
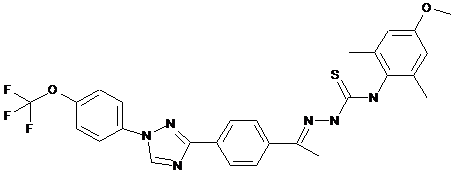

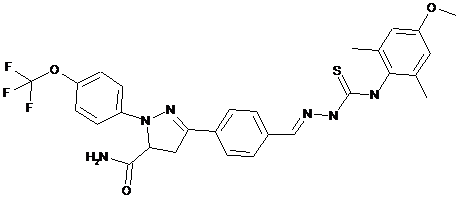
 .
.
Текст
Реферат: Даний винахід стосується нових гетероарил-N-арилтіосемікарбазонів і їх застосування для контролю сільськогосподарських шкідників як інсектицидів і акарицидів. Даний винахід також включає приготування пестицидних композицій, що містять дані сполуки, і способи для контролю комах при використанні сполук. UA 108619 C2 (12) UA 108619 C2 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 55 ОПИС ГАЛУЗЬ ТЕХНІКИ, ЯКОЇ СТОСУЄТЬСЯ ВИНАХІД Дана заявка вимагає пріоритет Попередньої Заявки США з серійним номером 61/232152, поданої 7 серпня 2009 року, повний зміст якої даним включений посиланням. Винахід, розкритий в даному документі, стосується галузі пестицидів і їх застосування для контролю шкідників. РІВЕНЬ ВИНАХОДУ Шкідники кожний рік викликають у всьому світі мільйони людських смертей. Крім того, є більше десяти тисяч видів сільськогосподарських шкідників, які викликають втрати в сільському господарстві. Дані сільськогосподарські втрати кожний рік складають мільярди доларів США. Терміти наносять пошкодження різним структурам, таким як будинки. Дані втрати від пошкодження термітами кожний рік складають мільярди доларів США. І, нарешті, багато які шкідники продуктів харчування, що зберігаються, поїдають і псують продукти харчування, які зберігаються. Такі втрати, пов'язані з втратами харчових продуктів, що зберігаються, складають мільярди доларів США щорічно, але що більш важливо, позбавляють людей необхідних харчових продуктів. Існує гостра потреба в нових пестицидах. Комахи розвивають стійкість до пестицидів, що застосовуються в цей час. Сотні видів комах є стійкими до одного або декількох пестицидів. Розвиток стійкості до деяких з більш старих пестицидів, таких як ДДТ, карбамати і органічні фосфати, добре відомий. Але стійкість навіть розвинулася до деяких з більш нових пестицидів. Тому, існує потреба в нових пестицидах і особливо в пестицидах, які мають нові механізми дії. ЗАМІСНИКИ (НЕПОВНИЙ ПЕРЕЛІК) Приклади, приведені для замісників, є неповними (крім галогену) і не повинні розглядатися як обмеження винаходу, розкритого в даному документі. "Алкеніл" означає ациклічний, ненасичений (що містить щонайменше один вуглецьвуглецевий подвійний зв'язок), розгалужений або нерозгалужений замісник, що складається з вуглецю і водню, наприклад, вініл, аліл, бутеніл, пентеніл, гексеніл, гептеніл, октеніл, ноненіл і деценіл. "Алкенілокси" означає алкеніл, що додатково містить одинарний вуглець-кисневий зв'язок, наприклад, алілокси, бутенілокси, пентенілокси, гексенілокси, гептенілокси, октенілокси, ноненілокси і деценілокси. "Алкокси" означає алкіл, що додатково містить одинарний вуглець-кисневий зв'язок, наприклад, метокси, етокси, пропокси, ізопропокси, 1-бутокси, 2-бутокси, ізобутокси, третбутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси і декокси. "Алкіл" означає ациклічний, насичений, розгалужений або нерозгалужений замісник, що складається з вуглецю і водню, наприклад, метил, етил, пропіл, ізопропіл, 1-бутил, 2-бутил, ізобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропіл, гексил, гептил, октил, ноніл і децил. "Алкініл" означає ациклічний, ненасичений (що містить щонайменше один вуглецьвуглецевий потрійний зв'язок і будь-які подвійні зв'язки), розгалужений або нерозгалужений замісник, що складається з вуглецю і водню, наприклад, етиніл, пропаргіл, бутиніл, пентиніл, гексиніл, гептиніл, октиніл, нонініл і дециніл. "Алкінілокси" означає алкініл, що додатково містить одинарний вуглець-кисневий зв'язок, наприклад, пентинілокси, гексинілокси, гептинілокси, октинілокси, нонінілокси і децинілокси. "Арил" означає циклічний, ароматичний замісник, що складається з водню і вуглецю, наприклад, феніл, нафтил і біфеніл. "Циклоалкеніл" означає моноциклічний або поліциклічний, ненасичений (що містить щонайменше один подвійний вуглець-вуглецевий зв'язок) замісник, що складається з вуглецю і водню, наприклад, циклобутеніл, циклопентеніл, циклогексеніл, циклогептеніл, циклооктеніл, циклодеценіл, норборненіл, біцикло[2.2.2]октеніл, тетрагідронафтил, гексагідронафтил і октагідронафтил. "Циклоалкенілокси" означає циклоалкеніл, що додатково містить одинарний вуглецькисневий зв'язок, наприклад, циклобутенілокси, циклопентенілокси, циклогексенілокси, циклогептенілокси, циклооктенілокси, циклодеценілокси, норборненілокси і біцикло[2.2.2]октенілокси. "Циклоалкіл" означає моноциклічний або поліциклічний, насичений замісник, що складається з вуглецю і водню, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборніл, біцикло[2.2.2]октил, декагідронафтил. 1 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 "Циклоалкокси" означає циклоалкіл, що додатково містить одинарний вуглець-кисневий зв'язок, наприклад, циклопропілокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси, циклооктилокси, циклодецилокси, норборнілокси і біцикло[2.2.2]октилокси. "Галоген" означає фтор, хлор, бром і йод. "Галогеналкіл" означає алкіл, що додатково складається з одного до максимального можливого числа, однакових або різних галогенів, наприклад, фторметил, дифторметил, трифторметил, 1-фторметил, 2-фторетил, 2,2,2-трифторетил, хлорметил, трихлорметил і 1,1,2,2-тетрафторетил. "Гетероцикліл" означає циклічний замісник, який може бути повністю заміщеним, частково незаміщеним або повністю незаміщеним, де циклічна структура містить щонайменше один вуглець і щонайменше один гетероатом, де згаданий гетероатом являє собою азот, сірку або кисень, наприклад, бензофураніл, бензоізотіазоліл, бензоізоксазоліл, бензоксазоліл, бензотієніл, бензотіазоліл, цинолініл, фураніл, індазоліл, індоліл, імідазоліл, ізоіндоліл, ізохінолініл, ізотіазоліл, ізоксазоліл, 1,3,4-оксадіазоліл, оксазолініл, оксазоліл, фталазиніл, піразиніл, піразолініл, піразоліл, піридазиніл, піридил, піримідиніл, піроліл, хіназолініл, хінолініл, хіноксалініл, 1,2,3,4-тетразоліл, тіазолініл, тіазоліл, тієніл, 1,2,3-триазиніл, 1,2,4-триазиніл, 1,3,5триазиніл, 1,2,3-триазоліл і 1,2,4-триазоліл. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Сполуки даного винаходу мають наступну формулу: в якій: (а) Ar1 являє собою (1) фураніл, феніл, піридазиніл, піридил, піримідиніл, тієніл або (2) заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл, або заміщений тієніл, де вказаний заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл і заміщений тієніл мають один або декілька замісників, які незалежно вибираються з наступних: Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, С1-С6галогеналкіл, С3С6циклоалкіл, С3-С6галогенциклоалкіл, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1С6алкокси, С1-С6галогеналкокси, С2-С6алкеніл, С2-С6алкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1С6галогеналкіл), OSO2(С1-С6алкіл), OSO2(С1-С6галогеналкіл), С(=О)NRxRy, (C1-C6алкіл)NRxRy, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)O(C1-C6галогеналкіл), С(=О)(C3-C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1-С6алкіл)O(C1-C6алкіл), (C1-С6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл), феніл, фенокси, заміщений феніл і заміщений фенокси, де такий заміщений феніл і заміщений фенокси мають один або декілька замісників, які незалежно вибираються з наступних: Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, С1-С6галогеналкіл, С3С6циклоалкіл, С3-С6галогенциклоалкіл, С3-С6циклоалкокси, С3-С6-галогенциклоалкокси, С1С6алкокси, С1-С6галогеналкокси, С2-С6алкеніл, С2-С6алкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1С6галогеналкіл), OSO2(С1-С6алкіл), OSO2(С1-С6галогеналкіл), С(=О)NRxRy, (C1-C6алкіл)NRxRy, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)O(C1-C6галогеналкіл), С(=О)(C3-C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1-С6алкіл)O(C1-C6алкіл), (C1-С6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл), феніл і фенокси; (b) Het являє собою 5- або 6-членне, насичене або ненасичене, гетероциклічне кільце, що містить один або декілька гетероатомів, які незалежно вибираються з азоту, сірки або кисню, і де Ar1 і Ar2 не знаходяться в ортоположенні один відносно одного (але можуть бути в мета- або параположенні, а саме, для п'ятичленного кільця вони знаходяться в 1,3-положенні і для 6членного кільця вони знаходяться або в 1,3- або в 1,4-положеннях), і де вказане гетероциклічне кільце може бути також заміщене одним або декількома замісниками, незалежно вибираними з наступних: Н, ОН, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкіл, С1-С6галогеналкіл, С3-С6циклоалкіл, С3С6галогенциклоалкіл, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1С6галогеналкокси, С2-С6алкеніл, С2-С6алкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1-С6галогеналкіл), OSO2(С1-С6алкіл), OSO2(С1-С6галогеналкіл), С(=О)NRxRy, (C1-C6алкіл)NRxRy, С(=О)(C1-C6алкіл), 2 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 55 60 С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)O(C1-C6галогеналкіл), С(=О)(C3C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1-С6алкіл)O(C1-C6алкіл), (C1-С6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл), феніл, фенокси, заміщений феніл і заміщений фенокси, де такий заміщений феніл і заміщений фенокси мають один або декілька замісників, які незалежно вибираються з наступних: Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, С1-С6галогеналкіл, С3С6циклоалкіл, С3-С6галогенциклоалкіл, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1С6алкокси, С1-С6галогеналкокси, С2-С6алкеніл, С2-С6алкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1С6галогеналкіл), OSO2(С1-С6алкіл), OSO2(С1-С6галогеналкіл), С(=О)Н, С(=О)NR xRy, (C1C6алкіл)NRxRy, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)O(C1C6галогеналкіл), С(=О)(C3-C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1-С6алкіл)O(C1-C6алкіл), (C1-С6алкіл)S(C1-C6алкіл), С(=О)(C1C6алкіл)С(=О)O(C1-C6алкіл), феніл і фенокси; (c) Ar2 являє собою (1) фураніл, феніл, піридазиніл, піридил, піримідиніл, тієніл або (2) заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл або заміщений тієніл, де згаданий заміщений фураніл, заміщений феніл, заміщений піридазиніл, заміщений піридил, заміщений піримідиніл і заміщений тієніл мають один або декілька замісників, які незалежно вибираються з наступних: Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, С1-С6галогеналкіл, С3С6циклоалкіл, С3-С6галогенциклоалкіл, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1С6алкокси, С1-С6галогеналкокси, С2-С6алкеніл, С2-С6алкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1С6галогеналкіл), OSO2(С1-С6алкіл), OSO2(С1-С6галогеналкіл), С(=О)NRxRy, (C1-C6алкіл)NRxRy, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)O(C1-C6галогеналкіл), С(=О)(C3-C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1-С6алкіл)O(C1-C6алкіл), (C1-С6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл), феніл, фенокси, заміщений феніл і заміщений фенокси, де такий заміщений феніл і заміщений фенокси мають один або декілька замісників, які незалежно вибираються з наступних: Н, F, Cl, Br, I, CN, NO 2, C1-C6алкіл, С1-С6галогеналкіл, С3С6циклоалкіл, С3-С6галогенциклоалкіл, С3-С6гідроксициклоалкіл, С3-С6циклоалкокси, С3С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкеніл, С2-С6алкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1-С6галогеналкіл), OSO2(С1-С6алкіл), OSO2(С1-С6галогеналкіл), С(=О)Н, С(=О)NRxRy, (C1-C6алкіл)NRxRy, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1C6галогеналкіл), С(=О)O(C1-C6галогеналкіл), С(=О)(C3-C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=ОС1-С6галогеналкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1-С6алкіл)O(C1-C6алкіл), (C1-С6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл), феніл і фенокси; (d) Х являє собою О або S; (е) R1 вибраний із замісників: Н, CN, C1-C6алкіл, С1-С6галогеналкіл, С3-С6циклоалкіл, С3С6галогенциклоалкіл, С3-С6циклоалкокси, С3-С6галогенциклоалкокси, С1-С6алкокси, С1С6галогеналкокси, С2-С6алкеніл, С2-С6алкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1-С6галогеналкіл), OSO2(С1-С6алкіл), OSO2(С1-С6галогеналкіл), С(=О)NRxRy, (C1-C6алкіл)NRxRy, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)O(C1-C6галогеналкіл), С(=О)(C3C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1С6алкіл)O(C1-C6алкіл), (C1-С6алкіл)S(C1-C6-алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл), феніл, фенокси; (f) R2, R3 і R4 вибрані із замісників: Н, C1-C6алкіл, С3-С6циклоалкіл, С2-С6алкеніл, С2С6алкініл, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C3-C6циклоалкіл), С(=О)O(C3C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1-С6алкіл)O(C1-C6алкіл), (C1С6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл), С(=О)феніл, феніл, С1С6алкілфеніл, С1-С6алкілфенокси, інданіл, С(=О)Het-1, Het-1, (C1-C6алкіл)Het-1 або С1-С6алкілО-Het-1, де кожний алкіл, циклоалкіл, циклоалкокси, галогенциклоалкокси, алкокси, галогеналкокси, алкеніл, алкініл, С1-С6алкілфеніл, феніл, фенокси і Het-1 необов'язково заміщені одним або декількома замісниками, незалежно вибираними з наступних: F, Cl, Br, I, CN, NO 2, NRxRy, C1C6алкіл, С1-С6галогеналкіл, С3-С6циклоалкіл, С3-С6галогенциклоалкіл, С3-С6циклоалкокси, С3С6галогенциклоалкокси, С1-С6алкокси, С1-С6галогеналкокси, С2-С6алкеніл, C3-C6-циклоалкеніл, С2-С6-алкініл, С3-С6-циклоалкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1-С6галогеналкіл), S(=О)2N(C1C6алкіл)2, OSO2(С1-С6-алкіл), OSO2(С1-С6-галогеналкіл), С(=О)Н, С(=О)NRxRy, (C1-C6алкіл)NRxRy, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)O(C1-C6галогеналкіл), С(=О)(C3-C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6-алкеніл), 3 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 55 60 (C1-С6-алкіл)O(C1-C6-алкіл), (C1-С6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл), феніл, фенокси, О-Het-1 і Het-1, де Het-1 являє собою 5- або 6-членне, насичене або ненасичене, гетероциклічне кільце, що містить один або декілька гетероатомів, які вибираються з азоту, сірки і кисню; де R3 і R4 разом необов'язково можуть утворювати 3-8-членну насичену або ненасичену циклічну групу, яка може містити один або декілька гетероатомів, які вибираються з азоту, сірки і кисню; (g) n=0, 1 або 2; (h) Rx і Ry незалежно вибрані із замісників: Н, C1-C6алкіл, С1-С6галогеналкіл, С3С6циклоалкіл, С3-С6галогенциклоалкіл, С2-С6алкеніл, С2-С6алкініл, S(=О)n(С1-С6алкіл), S(=О)n(С1С6галогеналкіл), OSO2(С1-С6алкіл), OSO2(С1-С6галогеналкіл), С(=О)Н, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), С(=О)O(C1-C6галогеналкіл), С(=О)(C3C6циклоалкіл), С(=О)O(C3-C6циклоалкіл), С(=О)(C2-C6алкеніл), С(=О)O(C2-C6алкеніл), (C1С6алкіл)O(C1-C6алкіл), (C1-С6алкіл)S(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)O(C1-C6алкіл) і феніл. У іншому варіанті здійснення Ar1 являє собою заміщений феніл, де вказаний заміщений феніл має один або декілька замісників, які незалежно вибираються з С 1-С6алкілу, С1С6галогеналкілу і С1-С6галогеналкокси. У більш переважному варіанті здійснення Ar 1 являє собою заміщений феніл, де вказаний заміщений феніл має один або декілька замісників, які незалежно вибираються з ОCF3, OCF2CF3, CF3. У іншому варіанті здійснення Het являє собою триазоліл, імідазоліл, піроліл або піразоліл. У іншому варіанті здійснення Het являє собою заміщений піразоліл, де вказаний заміщений піразоліл має один або декілька замісників, які незалежно вибираються з Н, С(=О)O(С 1-С6алкіл) або С(=О)NRxRy. У іншому варіанті здійснення Ar2 являє собою феніл. У іншому варіанті здійснення R1 являє собою Н або С1-С6алкіл. У іншому варіанті здійснення R2 являє собою Н або С1-С6-алкіл. У іншому варіанті здійснення R3 являє собою Н. У іншому варіанті здійснення Х являє собою S. У іншому варіанті здійснення R4 являє собою С1-С6алкіл, С3-С6циклоалкіл, С2-С6алкеніл, С(=О)феніл, С1-С6алкілфеніл, Het-1 або (C1-C6алкіл)Het-1. У іншому варіанті здійснення R4 являє собою С 1-С6алкіл, С1-С6алкілфеніл, феніл або Het-1, де кожний заміщений одним або декількома замісниками, незалежно вибираними з наступних: F, Cl, Br, I, CN, NO2, NRxRy, C1-C6алкіл, С1-С6галогеналкіл, С1-С6алкокси, С1-С6галогеналкокси, C3-C6циклоалкеніл, S(=О)n(С1-С6алкіл), S(=О)n(С1-С6галогеналкіл), S(=О)2N(C1-C6алкіл)2, С(=О)(C1-C6алкіл), С(=О)O(C1-C6алкіл), С(=О)(C1-C6галогеналкіл), (C1-С6алкіл)O(C1-C6алкіл), феніл, О-Het-1 і Het-1. Хоч були представлені дані варіанти здійснення, можливі інші варіанти здійснення і комбінації даних показаних варіантів здійснення і інших варіантів здійснення. ОТРИМАННЯ ТРИАРИЛЬНИХ ПРОМПКНИХ ПРОДУКТІВ Сполуки даного винаходу можуть бути отримані приготуванням триарильного проміжного продукту, Ar1-Het-Ar2, і потім приєднанням його до необхідного проміжного продукту для утворення цільової сполуки. Велика різноманітність триарильних проміжних продуктів може бути використана для отримання сполук даного винаходу за умови, що такі триарильні проміжні продукти містять прийнятну функціональну групу на Ar 2, до якої може бути приєднаний залишок цільового проміжного продукту. Прийнятні функціональні групи включають оксоалкільну або формільну групу. Дані триарильні проміжні продукти можуть бути отримані способами, раніше описаними в хімічній літературі. Деякі з даних способів описані нижче. Проміжні продукти, в яких "Het' являє собою дизаміщений піридин, піримідин, піразин або піридизин, можуть бути отримані зв'язуванням галоген- або алкілтіозаміщеного піридину, піримідину або піразину з арилбороновою кислотою або боратним складним ефіром, в умовах арилування Сузукі. Див., наприклад, наступне. Для піридинів: Couve-Bonnaire et al. Tetrahedron 2003, 59, 2793 і Puglisi et al. Eur. J. Org. Chem. 2003, 1552. Для піразинів: Schultheiss and Bosch Heterocycles 2003, 60, 1891. Для піримідинів: Qing et al. J. Fluorine Chem. 2003, 120, 21 і Ceide and Montalban Tetrahedron Lett. 2006, 47, 4415. Для 2,4-діарилпіримідинів: Schomaker and Delia, J. Org. Chem. 2001, 66, 7125. Таким чином, успішні арилування, які каталізуються паладієм, з використанням 4формілфенілборонової кислоти і 4-трифторметоксифенілборонової кислоти, можуть приводити до фактично конкретних зразків заміщення, як показано на схемі нижче: 4 UA 108619 C2 5 10 умови: а): 4-трифторметоксифенілборонова кислота, (Ph3P)4Pd; b): 4-формілфенілборонова кислота, (Ph3P)4Pd. Подібно до цього, діарилпіридини і піразини і інші дигалогеновані гетероциклічні ароматичні сполуки можуть бути отримані з дигалогенованих піридинів і піразинів і інших дигалогенованих гетероциклічних ароматичних сполук при використанні аналогічного протоколу: умови: а): 4-трифторметоксифенілборонова кислота, (Ph3P)4Pd; b): 4-формілфенілборонова кислота, (Ph3P)4Pd. 5 UA 108619 C2 5 10 Галоген- або алкілтіопіримідинові і піридинові попередники є комерційно доступними або можуть бути синтезовані способами, описаними в літературі (Rorig and Wagner U.S. Patent 3149109, 1964; Kreutzberger and Tesch Arzneim.-Forsch. 1978, 28, 235). Проміжні сполуки, в яких "Het' являє собою 1,3-дизаміщений 1,2,4-триазол, можуть бути отримані по одній з наступних схем. Шлях А: 1,3-Діарил-1,2,4-триазоли були отримані з відповідних –NH-3-арил-1,2,4-триазолів по опублікованому способу для N-арилування імідазолів (Lin et al. J. Org. Chem. 1979, 44, 4160). Зв'язування 1,2,4-триазолів з арилгалогенідами було проведене при термальних умовах або, переважно, в умовах мікрохвильового опромінення (Antilla et al. J. Org. Chem. 2004, 69, 5578), (DIBAL являє собою гідрид діізобутилалюмінію). Шлях В: Бромування гідразонів з подальшою обробкою бромгідразону тетразолом приводить до утворення 1,3-діарил-1,2,4-триазолу (Butler and Fitzgerald J. Chem. Soc., Perkin Trans. 1 1988, 1587). 15 20 25 Сполуки, де ‘Het' являє собою імідазол, можуть бути отримані по одній з наступних схем: Шлях А (Стадія 1: Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030. Стадія 2: Liu et al. J. Chem. Soc. 2005, 70, 10135): Шлях В. Для галогенарильних груп, які також містять активуючу групу, таку як нітро або ціано, заміщення арилгалогеніду імідазолом при використанні основи, такої як карбонат калію, в полярному апротонному розчиннику, такому як N, N-диметилформамід (ДМФА) або диметилсульфоксид (ДМСО/DMSO), може бути виконане наступним способом (Bouchet et al. Tetrahedron 1979, 35, 1331): Шлях С: По процедурі, уперше описаній Porretta et al. (Farmaco, Edizione Scientifica 1985, 40, 404), N-фенациланілін оброблений тіоціанатом калію в кислому середовищі (HСl), і 2меркаптоімідазол, що утворився, потім перетворений в десульфурований діарилімідазол обробкою азотною кислотою в оцтовій кислоті. 6 UA 108619 C2 5 Шлях D. N-Арилування 4-бромімідазолу в умовах мікрохвильового опромінення (шлях А, стадія 2) приводило до проміжного продукту, 1-арил-4-бромімідазолу, який був перетворений в триарильні проміжні продукти обробкою арилбороновими кислотами в умовах, які каталізуються паладієм. Сполуки, де ‘Het' являє собою 1,4-дизаміщений 1,2,3-триазол, можуть бути отримані по наступній схемі (Feldman et al. Org. Lett. 2004, 6, 3897): 10 Сполуки, де "Het' являє собою 3,5-дизаміщений 1,2,4-триазол, можуть бути отримані по наступній схемі (Yeung et al. Tetrahedron Lett. 2005, 46, 3429). 15 Сполуки, де ‘Het' являє собою 1,3-дизаміщений 1,2,4-триазолін-5-он, можуть бути отримані по наступній схемі (Pirrung and Tepper J. Org. Chem. 1995, 60, 2461 і Lyga Synth. Commun. 1986, 16, 163). (DPPA являє собою дифенілфосфорилазид): 20 Сполуки, де ‘Het' являє собою 1,3-діарилпіразолін, можуть бути отримані по наступній схемі. Моногідразон терефтальальдегіду обробляють N-хлорсукцинімідом (NCS) в ізопропіловому спирті (ізо-PrOH), і хлоргідразоновий проміжний продукт, що утворився, обробляють безпосередньо основою і заміщеним олефіном для утворення піразоліну: 7 UA 108619 C2 Сполуки, де ‘Het' являє собою 3,5-дизаміщений ізоксазол, можуть бути отримані по наступній схемі: 5 10 15 20 Сполуки, де ‘Het" являє собою 1,3-дизаміщений піразол, можуть бути отримані по наступній схемі. Зв'язування піразолу з галогенованою ароматикою виконували при використанні умов мікрохвильового опромінення, описаних Liu et al., шлях А, вищенаведена стадія 2. (DMA являє собою диметилацеталь). Сполуки, де ‘Het" являє собою 1,4-дизаміщений піразол, можуть бути отримані по наступній схемі. 4-Бромпіразол спочатку зв'язують з йодфенільним аналогом і 1-арил-4-бромпіразол, що утворився, потім зв'язують з фенілбороновою кислотою при використанні умов, описаних раніше для арилування імідазолів. Сполуки, де ‘Het" являє собою 2,4-дизаміщений тіазол, отримані конденсацією тіоаміду з αгалогенацетофеноном в протонному розчиннику, такому як етанол (наприклад, Potts and Marshall J. Org. Chem. 1976, 41, 129). Сполуки, де ‘Het" являє собою 2,4-дизаміщений оксазолін, отримані, виходячи з αбромацетофенону по наступній схемі (Periasamy et al. Synthesis 2003, 1965 і Liu et al. J. Am. Chem. Soc. 2007, 129, 5834). 8 UA 108619 C2 Сполуки, де ‘Het" являє собою 2,5-дизаміщений оксазолін, отримані по наступній схемі (Favretto et al. Tetrahedron Lett. 2002, 43, 2581 і Liu et al. J. Am. Chem. Soc. 2007, 129, 5834): 5 Сполуки, де ‘Het" являє собою 3,5-дизаміщений 1,2,4-триазин, отримані по наступній схемі (Reid et al. Bioorg. Med. Chem. Lett. 2008, 18, 2455 і Saraswathi and Srinivasan Tetrahedron Lett. 1971, 2315): 10 ОТРИМАННЯ ГІДРАЗОНОВИХ ПОХІДНИХ Гідразові похідні можуть бути отримані з відповідних арилальдегідів або кетонів одним з трьох способів: (А) взаємодією з гідразином з подальшою взаємодією з арилізотіоціанатом в тетрагідрофурані (ТГФ/THF) при температурах від 0 до 100ºC; (В) взаємодією з метиловим ефіром гідразиндитіокарбонової кислоти з подальшою взаємодією з аміном в полярному апротонному розчиннику, такому як ДМФА, при температурах від 25 до 150ºC; або (С) взаємодією з алкіл або арилсемікарбазидом або тіосемікарбазидом, який є комерційно доступним або може бути отриманий фахівцем в даній галузі, в полярному протонному розчиннику, такому як етиловий спирт (EtOH), при температурі від 0 до 100ºC. 15 9 UA 108619 C2 5 10 15 20 25 30 35 40 ПРИКЛАДИ Приклади даються для цілей ілюстрації і не повинні розглядатися як обмеження даного винаходу, описаного в цьому документі, тільки до варіантів здійснення, розкритих в даних прикладах. Вихідні продукти, реагенти і розчинники, які були отримані від комерційних джерел, використовували без додаткового очищення. Безводні розчинники були придбані у вигляді Sure/Seal™ від Aldrich і були використані як загальноприйнято. Температури плавлення були отримані на капілярному приладі Thomas Hoover для визначення температури плавлення або в автоматизованій системі для визначення температури плавлення OptiMelt Automated Melting Point System від Sanford Research Systems і не відкориговані. Приклад 1: Отримання 4-[1-(4-трифторметоксифеніл)-1Н-пірол-3-іл]-бензальдегіду Стадія 1. 1-(4-Трифторметоксифеніл)-1Н-пірол. Дану сполуку отримували по Colotta et al. J. Am. Med. Chem. 2006, 49, 6015. Розчин 4-трифторметоксифеніламіну (500 міліграмів (мг), 2,82 мілімолів (ммоль), 1,00 еквівалент (екв.)) і 2,5-діетокситетрагідрофурану (452 мг, 2,82 ммоль, 1,00 екв.) в крижаній оцтовій кислоті (20 мілілітрів (мл)) нагрівали при 90ºC протягом 1 години (год.), перед сушінням на силікагелі. Залишок потім суспендували в гексані при кип'ятінні зі зворотним холодильником, відфільтровували і концентрували досуха, з отриманням цільового проміжного продукту (519 мг, 81 %). Стадія 2. 3-Бром-1-(4-трифторметоксифеніл)-1Н-пірол. Сполуку отримували по Bray et al. J. Org. Chem. 1990, 55, 6317. До розчину 1-(4-трифторметоксифеніл)-1Н-піролу (519 мг, 2,29 ммоль, 1,00 екв.) в ТГФ (250 мл) при -78ºC додавали 0,05 М розчин N-бромсукциніміду (NBS; 408 мг, 2,29 ммоль, 1,00 екв.) в ТГФ протягом 45 хвилин (хв.). Посудину повільно нагрівали до кімнатної температури перед концентруванням для отримання сирого бромпіролу, який, як показано за допомогою ГХ-МС, складається з 55 % цільового проміжного продукту. Продукт використовували на подальшій стадії без додаткового очищення. Стадія 3. 4-[1-(4-Трифторметоксифеніл)-1Н-пірол-3-іл]-бензальдегід. Суспензію сирого 3бром-1-(4-трифторметоксифеніл)-1Н-піролу (356 мг, 1,26 ммоль, 1,00 екв.), 4формілфенілборонової кислоти (283 мг, 1,89 ммоль, 1,50 екв.), дихлориду біс(трифенілфосфін)паладію(II) (27 мг, 0,04 ммоль, 0,03 екв.), 2 М Na 2CO3 (водн.) (1,26 мл, 2,52 ммоль, 2,0 екв.) і 1,4-діоксану (5 мл) нагрівали при 150ºC в реакційній посудині з мікрохвильовим опроміненням протягом 45 хв. Охолоджений розчин потім розбавляли за допомогою EtOAc (20 мл), фільтрували через целіт®, концентрували досуха і очищали хроматографією (2:2:1, гексан:EtOAc:ацетон) з отриманням цільового проміжного продукту (79 мг, 21 %). 10 UA 108619 C2 Приклад бензальдегіду 2: Отримання 4-[1-(4-трифторметоксифеніл)-4,5-дигідро-1Н-піразол-3-іл] 5 10 15 20 25 30 35 40 45 50 Стадія 1. 1-(4-Трифторметоксифеніл)-піразолідин-3-он: Дану сполуку отримували по Rees and Tsoi Chem. Commun. 2000, 415. Суспензію гідрохлориду (4-трифторметоксифеніл)гідразину (300 мг, 1,32 ммоль, 1,00 екв.), 3-хлорпропіонілхлориду (167 мг, 1,32 ммоль, 1,00 екв.) і PS-DIEA (1,30 грам (г), 5,28 ммоль, 4,00 екв.) в ТГФ (20 мл) перемішували при температурі навколишнього середовища протягом 12 год. Розчин потім фільтрували, концентрували досуха і очищали хроматографією (2:2:1, гексан:EtOAc:ацетон) з отриманням цільового проміжного продукту (120 мг, 37 %). Стадія 2. 3-Хлор-1-(4-трифторметоксифеніл)-4,5-дигідро-1Н-піразол: Загальну процедуру використовували по Wang et al. Tetrahedron Lett. 2005, 46, 2631. До розчину 1-(4трифторметоксифеніл)піразолідин-3-ону (120 мг, 0,49 ммоль, 1,00 екв.) в толуолі (20 мл) повільно додавали фосфорилхлорид (22,5 мг, 1,47 ммоль, 3,00 екв.). Суміш потім нагрівали при 80ºC протягом 1 год. перед охолоджуванням до кімнатної температури і гасінням за допомогою Н2О (10 мл). Вміст посудини потім перемішували в атмосфері азоту (N 2) протягом 8 год. перед тим, як продукт екстрагували в EtOAc (200 мл), сушили (MgSO 4) і концентрували при зниженому тиску. ГХ-МС давала 88 % утворення цільового проміжного продукту, який використовували в подальших реакціях без додаткового очищення. Стадія 3. 4-[1-(4-Трифторметоксифеніл)-4,5-дигідро-1Н-піразол-3-іл]-бензальдегід: Суспензію 3-хлор-1-(4-трифторметоксифеніл)-4,5-дигідро-1Н-піразолу (114 мг, 0,43 ммоль, 1,00 екв.), 4-формілфенілборонової кислоти (97 мг, 0,65 ммоль, 1,50 екв.), дихлориду біс(трифенілфосфін)паладію(II) (10 мг, 0,01 ммоль, 0,03 екв.), 2 М Na 2CO3 (водн.) (0,43 мл, 0,86 ммоль, 2,0 екв.) і 1,4-діоксану (5 мл) нагрівали при 150ºC в реакційній посудині з мікрохвильовим опроміненням протягом 45 хв. Охолоджений розчин потім розбавляли за допомогою EtOAc (20 мл), фільтрували через целіт®, концентрували досуха і очищали хроматографією (2:2:1, гексан:EtOAc:ацетон) з отриманням цільового проміжного продукту (50 мг, 0,15 ммоль, 31 %). Приклад 3: Отримання 4-[1-(4-трифторметоксифеніл)-1Н-піразол-4-іл]-бензальдегіду Стадія 1. 4- Бром-1-(4-трифторметоксифеніл)-1Н-піразол. 4-Бромпіразол (1,5 г, 10 ммоль) і 4-йодтрифторметоксибензол (3,0 г, 10,3 ммоль) перемішували в ДМФА (8 мл) і обробляли фосфатом калію (6,3 г, 30 ммоль) і CuI (0,5 г, 2,6 ммоль). Розчин перемішували і нагрівали до 130ºC протягом 30 хв., потім його охолоджували при температурі навколишнього середовища і виливали в 1 н NH4OH (50 мл). Твердий осад виділяли фільтруванням, розчиняли в простому ефірі, фільтрували і концентрували до жовтувато-коричневої твердої речовини. Перекристалізація з EtOH давала не зовсім білу тверду речовину (2,1 г): т. пл. 63-65ºC; РХМС 308,6 (М+1). Стадія 2. 4-[1-(4-Трифторметоксифеніл)-1Н-піразол-4-іл]-бензальдегід. Суспензію бромпіразолу (0,31 г, 1 ммоль) і 4-формілборонової кислоти (0,15 г, 1 ммоль), 2 М водного розчину карбонату калію (1 мл) і тетракіс(трифенілфосфін)паладію(0) (35 мг, каталітичний) в діоксані (6 мл) нагрівали до 150ºC в реакторі з мікрохвильовим опроміненням. Залишок потім концентрували у вакуумі і очищали хроматографією (0-100 % EtOAc-гексани) з отриманням вказаної у заголовку сполуки (175 мг) у вигляді жовтувато-коричневої твердої речовини: т. пл. 107-109ºC; РХМС 332,8 (М+1). Приклад 4: Отримання 4-[5-(4-пропілфеніл)ізоксазол-3-іл]-бензальдегіду 11 UA 108619 C2 5 10 15 Стадія 1. 4-(Гідроксіімінометил)бензонітрил. Дану сполуку отримували по Biasotti et al. Bioorg. Med. Chem. 2003, 11, 2247. Суспензію 4-формілбензонітрилу (500 мг, 3,81 ммоль, 1,00 екв.), гідрохлориду гідроксиламіну (290 мг, 4,19 ммоль, 1,10 екв.) і ацетату натрію (1,56 г, 19,05 ммоль, 5,00 екв.) в МеОН (50 мл) нагрівали при 70ºC протягом 4 год. перед концентруванням досуха. Залишок потім суспендували в Et2O, фільтрували і концентрували з отриманням цільового проміжного продукту (496 мг, 3,39 ммоль, 89 %). Стадія 2. 4-(Гідроксіімінобромметил)бензонітрил. Дану сполуку отримували по Tanaka et al. Bull. Chem. Soc. Jpn. 1984, 57, 2184. 0,05 М розчин N-бромсукциніміду (724 мг, 4,07 ммоль, 1,20 екв.) в СН2Сl2 додавали по краплях при 0ºC до розчину 4-(гідроксіімінометил)бензонітрилу (496 мг, 3,39 ммоль, 1,00 екв.) в СН2Сl2 (50 мл). Розчин нагрівали до кімнатної температури перед розподілом по об'єму між двома різними реакційними посудинами. Вміст кожної посудини потім концентрували і сирі залишки використовували без додаткового очищення. Стадія 3. 4-[5-(4-Пропілфеніл)ізоксазол-3-іл]-бензонітрил. Розчин 4(гідроксіімінобромметил)бензонітрилу (381 мг, 1,7 ммоль), триетиламіну (0,71 мл, 5,10 ммоль, 3,0 екв.) і 1-етиніл-4-пропілбензолу (1,24 г, 8,50 ммоль, 5,0 екв.) в толуолі (20 мл) нагрівали при 100ºC протягом 1 год. перед концентруванням досуха. Очищення хроматографією з нормальною фазою давало цільовий проміжний продукт (108 мг, 22 %). Відновлення нітрилу до відповідного альдегіду виконували по методиці з використанням DIBAL, описаній раніше. Приклад 5: Отримання 4-{1-[4-(1-гідроксипропіл)феніл]-1H-піразол-3-іл}-бензальдегіду 20 25 30 35 40 45 50 Стадія 1. 3-(4-Ціанофеніл)піразол. У круглодонну колбу, забезпечену механічною мішалкою і парціальним конденсатором гарячого зрошування додавали п-ціаноацетофенон (5 г, 34,44 ммоль) і диметилформамід-диметилацеталь (ДМФА-DMA; 40 мл). Суміш перемішували при кип'ятінні зі зворотним холодильником протягом 5 год. перед концентруванням при зниженому тиску з отриманням сирого проміжного продукту, диметиламіноакрилоилбензонітрилу. Залишок потім суспендували в мінімальному об'ємі EtOH (20 мл), завантажували моногідратом гідразину (1,67 мл, 34,4 ммоль) і нагрівали при 80ºC протягом 30 хв. перед концентруванням. Сирий продукт, 3-(4-ціанофеніл)піразол (5,59 г, 33 ммоль, 96 %), який виділяли, був достатньої чистоти для використання в наступній реакції. Стадія 2. 4-[1-(4-Пропіонілфеніл)-1H-піразол-3-іл]бензонітрил. 4-(1Н-піразол-3іл)бензонітрил (100 мг, 0,59 ммоль), 1-(4-бромфеніл)пропан-1-он (126 мг, 0,591 ммоль), Cs2CO3 (770 мг, 2,364 ммоль), CuI (4 мг, 0,018 ммоль), 8-гідроксихінолін (3 мг, 0,018 ммоль) і ДМФА/Н2О (2 мл; розчин при співвідношенні 10:1) об'єднували в 10 мл CEM реакційній посудині з мікрохвильовим опроміненням, забезпеченій магнітній мішалкою, і піддавали мікрохвильовому опроміненню при 150ºC протягом 30 хв. Потім вміст фільтрували і концентрували досуха з отриманням нітрилу (158 мг, 0,508 ммоль, 86 %). Відновлення нітрилу до відповідного альдегіду виконували по методиці з використанням DIBAL, описаній раніше. Приклад 6: Отримання діетилового складного ефіру 5-(4-формілфеніл)-2-(4трифторметоксифеніл)-3,4-дигідро-2Н-піразол-3,4-дикарбонової кислоти Стадія 1. Отримання 4-[(4-трифторметоксифеніл)гідразонометил]бензальдегіду. Дану сполуку отримували по Paulvannan et al. Tetrahedron 2000, 56, 8071. До перемішуваного розчину бензол-1,4-дикарбальдегіду (1,50 г, 11,2 ммоль, 1,0 екв.) в ізо-РrOH (250 мл) додавали порціями гідрохлорид 4-трифторметоксифенілгідразину (2,55 г, 11,2 ммоль, 1,0 екв.) протягом 5 хв. Розчин перемішували при температурі навколишнього середовища протягом 1 год. перед концентруванням досуха і очищенням хроматографією (2:2:1 гексан:EtOAc:ацетон) з отриманням проміжного продукту (2,48 г, 72 %). Стадія 2. Синтез хлоргідразону. Даний проміжний продукт отримували по Lokanatha Rai and Hassner Synth. Commun. 1989, 19, 2799. Розчин 4-[(4 12 UA 108619 C2 5 10 15 20 25 30 35 40 45 трифторметоксифеніл)гідразонометил]бензальдегіду (2,48 г, 8,05 ммоль, 1,0 екв.) і Nхлорсукциніміду (1,61 г, 12,08 ммоль, 1,5 екв.) в ізо-РrOH (100 мл) нагрівали при 80ºC протягом 1 год. Потім розчин охолоджували і розподіляли по об'єму рівномірно між шістьма різними реакційними посудинами із вмістом в кожній 1,34 ммоля проміжного продукту. Стадія 3. Піразоліновий синтез. Дані сполуки отримували по Paulvannan et al. Tetrahedron 2000, 56, 8071. У кожну реакційну посудину додавали триетиламін (0,56 мл, 4,02 ммоль, 3,00 екв.) і відповідні акрилати (6,70 ммоль, 5,00 екв.). Реакційну суміш потім нагрівали при 70ºC протягом 90 хв. перед концентруванням досуха і очищенням хроматографією (2:2:1, гексан:EtOAc:ацетон). Відновлення нітрилів до відповідних альдегідів виконували по методиці з використанням DIBAL, описаній раніше. Приклад 7: Отримання 4-{1-[4-(2,2,2-трифторетокси)феніл]-1Н-імідазол-4-іл}бензальдегіду 4-(2-Бромацетил)бензонітрил (58 мг, 0,21 ммоль) і 4-(2,2,2-трифторетокси)феніламін (50 мг, 0,21 ммоль) об'єднували в 100 мл колбі Ерленмейера, забезпеченій магнітною мішалкою. Вміст розчиняли в EtOH (1 мл) і перемішували при температурі навколишнього середовища протягом 2 год. Сирий проміжний продукт потім переносили в 100 мл круглодонну колбу, що містить KSCN (21 мг, 0,21 ммоль) і конц. HCl (18 мкл, 0,21 ммоль). Посудину нагрівали при 80ºC протягом 1 год., перш ніж її вміст виливали в розчин 1:1 Н 2О/NH4OH (5 мл). Розчин витримували при стоянні протягом 24 год., і потім тверду речовину фільтрували і промивали простим ефіром з отриманням проміжного імідазолтіолу (32 мг, 0,086 ммоль, 33 %). Потім до суспензії імідазолтіолу в оцтовій кислоті (2 мл) додавали по краплях водний розчин HNO 3 (1,35 мл, 0,837 ммоль) і KNO3 (1 мг, 0,003 ммоль) протягом 10 хв. Після перемішування протягом 2 год. при температурі навколишнього середовища розчин виливали в подрібнений лід і нейтралізували (рН=7) 0,1 Н гідроксидом натрію (NaOH, водн.). Проміжний нітрил виділяли фільтруванням у вакуумі і сушили у вакуумній печі при 45ºC протягом 12 год. (23 мг, 78 %), т. пл. 179ºC. Відновлення до відповідного альдегіду виконували з використанням DIBAL в умовах, описаних раніше. Приклад 8: Отримання 4-[1-(4-пропілфеніл)-1Н-імідазол-4-іл]бензальдегіду 4-Пропіланілін (2,70 г, 20 ммоль) додавали по краплях до розчину 4-ціанофенацилброміду (2,20 г, 10 ммоль) в ДМФА (5 мл). Даний розчин потім додавали до нагрітого (180ºС) формаміду (20 мл) протягом 5 хв., і об'єднаному розчину дозволяли перемішуватися при 180ºC протягом 2 год. Охолоджений розчин потім виливали в крижану воду (100 мл) і екстрагували простим ефіром (2×75 мл). Після сушіння і концентрування темне масло, що утворилося, очищали хроматографією (3:1:2, гексани:EtOAc:CH2Cl2). Перший продукт ідентифікували як 4-(5-пропіл1Н-індол-3-іл)бензонітрил, т. пл. 140ºC. Другу фракцію (275 мг) ідентифікували як цільовий 1 імідазол: т. пл. 133ºC; H ЯМР (400 МГц, CDCl3) δ 7,95 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,70 (д, J=6 Гц, 2H), 7,68 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Гц, 2H), 1,68 (м, 2H), 0,98 (т, J=7,5 Гц, 3H); ESIMC m/z 288,1 (М+Н). Відновлення до відповідного альдегіду виконували з використанням DIBAL, в умовах, 1 описаних раніше: т. пл. 97ºC; H ЯМР (300 МГц, CDCl3) δ 10,02 (с, 1H), 8,03 (д, J=6 Гц, 2H), 7,92 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,72 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Гц, 2H), 1,68 (м, 2H), 0,98 (т, J=7,5 Гц, 3H); ESIMC m/z 291,1 (М+Н). Приклад 9. Отримання 4-[1-(4-трифторметоксифеніл)-1Н-імідазол-4-іл]бензальдегіду 50 13 UA 108619 C2 5 10 4-Трифторметоксианілін (2,20 г, 12,4 ммоль) додавали по краплях до розчину 4ціанофенацилброміду (1,50 г, 6,7 ммоль) в ДМФА (5 мл). Даний розчин потім додавали до нагрітого (180ºС) формаміду (20 мл) протягом 5 хв., і об'єднаному розчину дозволяли перемішуватися при 180ºC протягом 2 год. Охолоджений розчин потім виливали в крижану воду (100 мл) і екстрагували простим ефіром (2×75 мл). Після сушіння і концентрування напівтверду речовину, що утворилася, кристалізували з МеОН/Н2О. Друга перекристалізація з МеОН/Н2О видаляла сліди домішки форманіліду і давала чистий продукт (200 мг): т. пл. 155ºC. Обчислено для С17Н10F3N3O: C, 62,01; H, 3,06; N, 12,76. Знайдено: C, 61,53; H, 3,13; N, 12,55. Відновлення до відповідного альдегіду виконували з використанням DIBAL в умовах, описаних раніше: т. пл. 1 112ºC; H ЯМР (300 МГц, CDCl3) δ 10,0 (с, 1H), 8,05-7,90 (м, 5H), 7,70 (с, 1H), 7,50 (д, J=6 Гц, 2H), 7,42 (д, J=6 Гц, 2H); ESIMC m/z 333,0 (М+Н). Приклад 10. Отримання 4-[4-(4-трифторметилфеніл)-1Н-імідазол-1-іл]бензальдегіду 15 20 25 4-Трифторметилфенілімідазол (4,0 г, 19 ммоль), 4-фторбензонітрил (1,2 г, 8,5 ммоль) і карбонат калію (1,5 г, 10,9 ммоль) об'єднували в ДМСО (15 мл) і нагрівали при 100ºC протягом 6 год. Охолоджений розчин потім виливали у воду (Н 2О; 100 мл) і тверду речовину, що утворилася, фільтрували і сушили на повітрі з отриманням імідазолнітрилу (4,65 г) у вигляді 1 білої твердої речовини: т. пл. 252ºC; H ЯМР (300 МГц, CDCl3) δ 8,05 (с, 1H), 7,95 (д, J=8 Гц, 2H), 7,85 (д, J=8 Гц, 2H), 7,72 (с, 1H), 7,72 (д, J=8 Гц, 2H), 7,62 (д, J=8 Гц, 2H); ESI-MС m/z 314,1 (М+Н). Обчислено для С16Н10F3N3O2: C, 65,18; H, 3,22; N, 13,41.Знайдено: C, 64,49; H, 3,23; N, 13,08. Частину нітрилу (3,8 г) відновлювали з використанням DIBAL в умовах, описаних раніше, 1 з отриманням відповідного альдегіду (2,41 г): т. пл. 141ºC; H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,10 (д, J=8 Гц, 2H), 8,05 (с, 1H), 7,95 (д, J=8 Гц, 2H), 7,75 (с, 1H), 7,7 (м, 4H); ESIMC m/z 317,1 (М+Н). Приклад 11. Отримання 4-бром-1-(4-трифторметоксифеніл)-1Н-імідазолу 30 35 40 45 50 У круглодонну колбу вміщували 4-бромімідазол (1,15 г, 7,81 ммоль), СuI (0,07 г, 0,36 ммоль), 8-гідроксихінолін (0,05 г, 0,36 ммоль), карбонат цезію (3,39 г, 10,4 ммоль) і 4трифторметоксійодбензол (1,50 г, 5,21 ммоль). До реакційної суміші додавали 10:1 суміш ДМФА (15 мл) і Н2О (1,5 мл), і розчин нагрівали при 130ºC протягом 4 год. Реакційну суміш потім розбавляли EtOAc і промивали послідовно Н2О, хлоридом амонію (NH4Cl, насичений), Н2О і бікарбонатом натрію (NaHCO3). Органіку сушили над MgSO4, фільтрували і очищали колонковою хроматографією з оберненою фазою з отриманням імідазолу (820 мг) у вигляді білої твердої речовини: т. пл. 139-141ºC; ESI-МС m/z 308,0 (M+Н). Приклад 12. Отримання 4-метокси-2-[1-(4-трифторметоксифеніл)-1Н-імідазол-4іл]бензальдегіду 4-Бром-1-(4-трифторметоксифеніл)-1Н-імідазол (100 мг, 0,326 ммоль), 2-форміл-5метоксифенілборонову кислоту (73 мг, 0,41 ммоль), дихлорид біс(трифенілфосфін)паладію (2 мг, 0,003 ммоль), NaHCO3 (49 мг, 0,59 ммоль) і 1:1 DME/H2О (8:8 мл) об'єднували і додавали в ємність з мікрохвильовим опроміненням. Реакційну суміш нагрівали при мікрохвильовому опроміненні з перемішуванням при 100ºC протягом 12 хв. Мікрохвильове опромінення продовжувалося 5 хв. для досягнення 100ºC, потім зберігалося при 100ºC протягом 12 хв. і потім було охолоджування. ТШХ (1:1 EtOAc:циклогексан) показала присутність вихідних продуктів, тому зразок нагрівали до 100ºC протягом додаткових 8 хв. При охолоджуванні 14 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 утворився осад, його фільтрували і промивали за допомогою Н 2О, отримуючи сіру тверду речовину (86 мг): ESI-МС m/z 363,0 (M+Н). Наступні проміжні продукти також отримували при використанні даної процедури: Приклад 13. Отримання 2-фтор-4-[1-(4-трифторметоксифеніл)-1Н-імідазол-4іл]бензальдегіду ESI-МС m/z 351,0 (M+Н). Приклад 14. Отримання іл]феніл}етанону 1-{4-фтор-3-[1-(4-трифторметоксифеніл)-1Н-імідазол-4 4-Бром-1-(4-трифторметоксифеніл)-1Н-імідазол (200 мг, 0,651 ммоль), 5-ацетил-2фторфенілборонову кислоту (178 мг, 0,977 ммоль), тетракіс(трифенілфосфін)паладій(0) (7 мг, 0,007 ммоль), 2 н водний розчин карбонату калію (0,651 мл) і діоксан (8 мл) об'єднували і додавали в ємність з мікрохвильовим опроміненням. Реакційну суміш нагрівали при мікрохвильовому опроміненні з перемішуванням при 150ºC протягом 20 хв. РХ-МС показала 88 % очікуваного продукту; ТШХ (1:1 гексани:EtOAc) показала присутність вихідного продукту плюс 3 інших продукти. У реакційну суміш додавали EtOAc і Н 2О. Водний шар екстрагували за допомогою EtOAс, і органічні екстракти промивали насиченим сольовим розчином, сушили над MgSO4 і концентрували у вакуумі. Сирий продукт очищали хроматографією з градієнтним елююванням (100 % гексани до 100 % EtOAc), отримуючи не зовсім білу тверду речовину (90 мг): т. пл. 129ºC; ESI-МС m/z 265,0 (M+Н). Приклад 15. Отримання 4-[1-(4-трифторметоксифеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегіду Стадія 1. 4-(1Н-[1,2,4]Триазол-3-іл)бензонітрил. Використовували загальну процедуру, позначену Lin et al. (J. Org. Chem. 1979, 44, 4163), для отримання 3-(4-нітрофеніл)-1Н[1,2,4]триазолу. 4-Ціанобензамід (21,63 г, 0,148 моль) розчиняли в ДМФА-DMA (100 мл) і перемішували при кип'ятінні зі зворотним холодильником в атмосфері N 2 протягом 8 год. Суміш концентрували досуха і суспендували в AcOH (50 мл). У посудину потім вміщували моногідрат гідразину (7,18 мл, 0,148 ммоль) і перемішували при кип'ятінні зі зворотним холодильником протягом 1 год. перед концентруванням. Цільовий 4-(1Н-[1,2,4]триазол-3-іл)бензонітрил отримували з 98 % чистотою розтиранням в порошок з Et2O з подальшим фільтруванням (12,17 г, 0,072 моль, 48 %). Стадія 2. 4-[1-(4-Трифторметоксифеніл)-1Н-[1,2,4]триазол-3-іл]бензонітрил. Триазол (70 мг, 0,41 ммоль), 1-йод-4-трифторметоксибензол (142 мг, 0,493 ммоль), Cs 2CO3 (535 мг, 1,644 ммоль), CuI (3 мг, 0,012 ммоль), 8-гідроксихінолін (2 мг, 0,012 ммоль) і ДМФА/Н2О (2 мл; 10:1 розчин) об'єднували в 10 мл CEM мікрохвильовій реакційній посудині, забезпеченій магнітною мішалкою, і піддавали мікрохвильовому опроміненню при 150ºC протягом 30 хв. Потім вміст фільтрували і концентрували досуха з отриманням 1,3-дифенитриазольного проміжного продукту, (18 мг, 13 %). Стадія 3. 4-[1-(4-Трифторметоксифеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегід. Нітрил 1 відновлювали з використанням DIBAL в умовах, описаних раніше: т. пл. 137-140ºC; H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,61 (с, 1H), 8,37 (д, J=9 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,8 (д, J=9 Гц, 2H), 7,4 (д, J=8,4 Гц, 2H); ESI-MC m/z 334,2 (М+Н). Приклад 16: Отримання 4-[1-(4-пентафторетилсульфанілфеніл)-1Н-[1,2,4]триазол-3іл]бензальдегіду 15 UA 108619 C2 5 10 15 Стадія 1. 1- Бром-4-пентафторетилсульфанілбензол. Вказану в заголовку сполуку отримували, застосовуючи умови перфторалкілування, спочатку описані Popov et al. J. Fluorine Chem. 1982, 21, 365. У розчин 4-бромбензолтіолу (500 мг, 2,64 ммодь, 1,0 екв.) і хлориду триетилбензиламонію (60 мг, 0,26 ммоль, 0,10 екв.) в 10 мл 1:1 Et 2O/NaOH (25 % водн.) при 0ºC барботували газ 1,1,1,2,2-пентафтор-2-йодетану протягом 30 хв. (>5 екв.). Протягом даного часу на реакційну посудину направляли УФ-лампу, хоча температуру підтримували нижче 10ºC періодичним використанням крижаної бані. Вміст потім нагрівали до кімнатної температури, екстрагували в Et2O (300 мл), сушили (MgSO4) і концентрували при зниженому тиску. Частину даного сирого продукту використовували для подальших реакцій без додаткового очищення (залишок 200 мг: 120 мг продукту, 0,39 ммоль, 1,2 екв.). Стадія 2. 4-[1-(4-Пентафторетилсульфанілфеніл)-1Н-[1,2,4]триазол-3-іл]бензонітрил. Зв'язування з 4-(1Н-[1,2,4]триазол-3-іл)бензонітрилом, як описано вище, давало 4-[1-(4пентафторетилсульфанілфеніл)-1Н-[1,2,4]триазол-3-іл]бензонітрил (70 мг, 46 %). Відновлення за допомогою DIBAL, як описано раніше, давало відповідний альдегід. Приклад 17: Отримання 4-[1-(4-пентафторетилоксифеніл)-1Н-[1,2,4]триазол-3іл]бензальдегіду 20 25 30 35 40 45 Стадія 1. Розчин 3-п-толіл-1Н-[1,2,4]триазолу (4,85 г, 30,5 ммоль), 4бромфенілпентафторетилового простого ефіру (10 г, 34,4 ммоль), Cs 2CO3 (25 мг, 77 ммоль), CuI (1,25 г, 6,5 ммоль) і 8-гідроксихіноліну (0,35 г, 2,4 ммоль) в 9:1 ДМФА/Н2О (50 мл) інтенсивно перемішували і нагрівали до 130ºC (внутрішня температура) протягом 20 год. Розчин потім охолоджували, виливали в Н2О і підкислювали за допомогою 2 н HCl до рН 2. Потім додавали простий ефір (250 мл) і розчин струшували і фільтрували перед розділенням шарів. Органічний шар сушили і концентрували, і в'язку тверду речовину, що утворилася, нагрівали з гексанами (100 мл). Теплий гексановий шар декантували від нерозчинного залишку, розчин, що утворився, охолоджували до 0ºC і осаджену тверду речовину фільтрували і сушили на повітрі з отриманням 1-(4-пентафторетилоксифеніл)-3-п-толіл-1Н-[1,2,4]триазолу (7,0 г, 61 % в розрахунку на вихідний триазол) у вигляді не зовсім білої твердої речовини: т. пл. 130-132ºC; ESI-МС m/z 370,8 (M+Н). Стадія 2. Продукт зі стадії 1 (7,0 г, 18,7 ммоль) розчиняли в ацетонітрилі (200 мл) і перемішували при температурі навколишнього середовища, в той час як додавали порціями нітрат амонію церію (32 г, 58 ммоль) в Н2О (60 мл) протягом 10 хв. Потім розчин нагрівали при кип'ятінні зі зворотним холодильником протягом 4 год., охолоджували і розбавляли за допомогою Н2О (200 мл). Розчин екстрагували простим ефіром (2×200 мл), і об'єднаний органічний шар сушили і концентрували з отриманням оранжевого масла. Даний продукт розчиняли в діоксані (40 мл) і обробляли розчином гідроксиду калію (КОН; 5 г, 90 ммоль) в Н 2О (20 мл). Розчин нагрівали при кип'ятінні зі зворотним холодильником протягом 2 год., потім охолоджували і розбавляли за допомогою Н 2О (100 мл). Осаджувався альдегід і його збирали фільтруванням. Перекристалізація з МеОН/Н2О давала чистий альдегід у вигляді білої твердої 1 речовини (2,2 г, 30 %): т. пл. 137-144ºC; H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H); ESI-MC m/z 384,2 (М+Н). Приклад 18: Отримання 4-[1-(4-бутилфеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегіду 50 Стадія 1. 4-[1-(4-Бутилфеніл)-1Н-[1,2,4]триазол-3-іл]бензонітрил. Розчин 4-нбутилфенілгідразину (1,0 г, 5 ммоль) і 4-ціанобензальдегіду (0,8 г, 6,0 ммоль) в ізо-PrOH (15 мл) нагрівали на паровій бані протягом 2 год. і потім охолоджували і розбавляли за допомогою Н 2О 16 UA 108619 C2 5 10 15 (5 мл). Оранжеву тверду речовину, що утворилася, фільтрували і сушили на повітрі з отриманням гідразону (1,30 г) у вигляді жовтої твердої речовини, т. пл. 107ºC. Розчин даного гідразону (1,1 г, 4,0 ммоль) і NCS (0,67 г, 5 ммоль) в ізо-PrOH (20 мл) перемішували в атмосфері азоту при температурі навколишнього середовища протягом 2 год., протягом даного часу вихідну тверда речовина розчинялася і утворювалася нова тверда речовина. Отриманий оранжевий розчин потім обробляли тетразолом (0,45 г, 6,4 ммоль) і триетиламіном (960 мкл, 7,0 ммоль). Оранжево-коричневий розчин нагрівали при кип'ятінні зі зворотним холодильником протягом 2 год. Потім розчин охолоджували, розбавляли за допомогою Н 2О (250 мл), екстрагували за допомогою EtOAc, сушили, концентрували і очищали хроматографією (Biotage, 4:1 гексан:EtOAc) з отриманням триазолу (0,42 г, 35 %) у вигляді не зовсім білої твердої 1 речовини: т. пл. 124ºC; H ЯМР (300 МГц, CDCl3) δ 8,58 (с, 1H), 8,33 (д, J=8 Гц, 2H), 7,78 (д, J=8 Гц, 2H), 7,64 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (м, 2H), 1,38 (м, 2H), 0,95 (т, J=7,5 Гц, 3H); ESI-MC m/z 303,1. Стадія 2. 4-[1-(4-Бутилфеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегід. Відновлення з 1 використанням DIBAL, як описано раніше, давало відповідний альдегід: т. пл. 124ºC; H ЯМР (300 МГц, CDCl3) δ 10,08 (с, 1H), 8,58 (с, 1H), 8,37 (д, J=8 Гц, 2H), 7,98 (д, J=8 Гц, 2H), 7,62 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (м, 2H), 1,38 (м, 2H), 0,95 (т, J=7,5 Гц, 3H); ESI-MC m/z 306,1. Приклад 19: Отримання 4-[1-(4-пентафторетилфеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегіду 20 25 30 35 40 45 Стадія 1. 1-(4-Пентафторетилфеніл)-3-п-толіл-1Н-[1,2,4]триазол. Пентафторетилйодид (521 мг, 2,12 ммоль) піддавали конденсації в посудині, що містить 1-бром-4-йодбензол (300 мг, 1,06 ммоль), порошок міді(0) (135 мг, 2,12 ммоль) і ДМСО (5 мл). Посудину потім герметизували і піддавали мікрохвильовому опроміненню при 150ºC протягом 60 хв. ГХ-МС контролювала споживання вихідного продукту, що приводить як до 1-бром-4-пентафторетилбензольного так і до 1-йод-4-пентафторетилбензольного проміжних продуктів. Суміш (1,06 ммоль) переносили в 250 мл круглодонну колбу і додавали 3-п-толіл-1Н-[1,2,4]триазол (169 мг, 1,06 ммоль), Cs2CO3 (1,38 г, 4,24 ммоль), CuI (202 мг, 1,06 ммоль), 8-гідроксихінолін (2 мг, 0,011 ммоль) і ДМФА/Н2О (12 мл; розчин 10:1). Розчин перемішували при кип'ятінні зі зворотним холодильником при 160ºC протягом 6 год. Після завершення охолоджений вміст виливали в Н 2О і залишали для осадження на 1 год. Осад збирали фільтруванням у вакуумі і сушили протягом ночі у вакуумній печі при 45ºC. Сирий проміжний продукт, 1-(4-пентафторетилфеніл)-3-п-толіл-1Н-[1,2,4]триазол, використовували на стадії 2 без додаткового очищення. Стадія 2. Окислення до альдегіду. Нітрат амонію церію(IV) (3,32 г, 4,24 ммоль) і проміжний продукт зі стадії 1 об'єднували в круглодонній колбі з ацетонітрилом і Н 2О (20 мл; 1:1). Розчин перемішували при кип'ятінні зі зворотним холодильником при 110ºC протягом 4 год., отримуючи суміш проміжних продуктів, 3-(4-нітрооксиметилфеніл-1-(4-пентафторетилфеніл)-1Н[1,2,4]триазолу і 4-[1-(4-пентафторетилфеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегіду. Ацетонітрил видаляли у вакуумі і сирі осади проміжних продуктів збирали фільтруванням. Продукт потім об'єднували з порошкоподібним КОН (178 мг, 3,18 ммоль) в діоксані і Н 2О (10 мл; 1:1) і перемішували при кип'ятінні зі зворотним холодильником при 105ºC протягом 90 хв., перед тим як діоксан видаляли у вакуумі з наданням можливості для звільнення проміжного продукту від Н2О. Проміжний продукт, 4-[1-(4-пентафторетилфеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегід, збирали фільтруванням (35 мг, 0,095 ммоль, 9 % сумарно від 4-толілтриазолу). Приклад 20: Отримання складного 4-[3-(4-формілфеніл)[1,2,4]триазол-1-іл]фенілового ефіру трифторметансульфонової кислоти 50 Стадія 1. 1-(4-Метоксифеніл)-3-п-толіл-1Н-[1,2,4]триазол отримували конденсацією 3-птоліл-1Н-[1,2,4]триазолц з 4-йоданізолом в умовах, описаних для стадії 1 попереднього прикладу. Даний продукт потім деметилували при використанні умов, описаних Hitchcock et al. Synlett 2006, 2625. Трибромід бору (1 М розчин в гексанах; 1,67 мл, 1,67 ммоль) додавали по 17 UA 108619 C2 5 10 15 краплях до розчину 1-(4-метоксифеніл)-3-п-толіл-1Н-[1,2,4]триазолу (300 мг, 1,28 ммоль) в СН2Сl2 (10 мл) при 0ºC в атмосфері N2. Після завершення додавання посудину нагрівали до температури навколишнього середовища перед кип'ятінням зі зворотним холодильником при 40ºC протягом 6 год. Охолоджений вміст потім гасили за допомогою Н 2О перед видаленням СН2Сl2 і розподілом між EtOAc і Н2О. Органічний шар збирали, промивали насиченим сольовим розчином, сушили (MgSO4), концентрували і очищали хроматографією (3:1:1, гексани:EtOAc:ацетон) з отриманням проміжного продукту, 4-(3-п-толіл[1,2,4]триазол-1іл)фенолу (219 мг, 0,872 ммоль, 68 %). Ангідрид трифторметансульфонової кислоти (0,16 мл, 0,96 ммоль) додавали по краплях до розчину фенолу і 4-трет-бутил-2,6-диметилпіридину (142 мг, 0,872 ммоль) в СН2Сl2 (10 мл) при 0ºC в атмосфері N2. Посудину нагрівали до температури навколишнього середовища перед тим як розчинник видаляли при зниженому тиску і залишок очищали хроматографією (2:2:1, гексани:EtOAc:ацетон), отримуючи проміжний продукт, складний 4-(3-п-толіл[1,2,4]триазол-1-іла)феніловий ефір трифторметансульфонової кислоти (304 мг, 0,794 ммоль, 91 %). Стадія 2. Окислення 4-метильного проміжного продукту, приведеного вище, до відповідного альдегіду проводили, використовуючи нітрат амонію церію(IV) в умовах, описаних на стадії 2 попереднього прикладу. Приклад 21: Отримання 4-[5-(4-трифторметилфеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегіду 20 25 30 35 40 45 50 Терефталонітрил (115 мг, 0,90 ммоль), гідразид 4-трифторметилбензойної кислоти (92 мг, 0,450 ммоль), К2СО3 (31 мг, 0,225 ммоль) і н-бутиловий спирт (2 мл об'єднували в 10 мл CEM реакційній посудині з мікрохвильовим опроміненням, забезпеченій магнітною стрижневою мішалкою, і піддавали мікрохвильовому опроміненню при 150ºC протягом 30 хв. Потім вміст фільтрували і концентрували досуха. Хроматографія (3:1 гексани/EtOAc) давала 1,2,4триазолнітрил(72 мг, 0,230 ммоль, 51 %). Відновлення з використанням DIBAL потім приводило до відповідного альдегіду. Приклад 22: Отримання 4-[1-(3,4-дихлорфеніл)-5-оксо-4,5-дигідро-1Н-[1,2,4]триазол-3іл]бензальдегіду Стадія 1. 4-Ціанофенілоксооцтова кислота. У круглодонну колбу, забезпечену механічною мішалкою і парціальним конденсатором гарячого зрошування, вміщували п-ціаноацетофенон (5 г, 34,44 моль), діоксид селену (SeO2; 9,55 г, 86,1 ммоль) і піридин (~100 мл). Суміш перемішували при кип'ятінні зі зворотним холодильником протягом 6 год., перед тим як осади видаляли фільтруванням і в фільтрат завантажували 10 % HCl (водн.) (20 мл). Фільтрат екстрагували в EtOAc (3×50 мл) і об'єднані органічні шари додатково екстрагували в майже насичений розчин NaHCO3. Водний шар потім обережно підкислювали (рН=1) конц. HCl з отриманням невеликого виходу цільового продукту. Залишок оксооцтової кислоти отримували екстракцією в EtOAc, сушкою (MgSO4) і концентруванням (1,69 г, 28 %). Стадія 2. 4-[1-(3,4-Дихлорфеніл)-5-оксо-4,5-дигідро-1Н-[1,2,4]триазол-3-іл]бензонітрил. Суспензію 4-ціанофенілоксооцтової кислоти (100 мг, 0,571 ммоль), гідрохлориду (3,4дихлорфеніл)гідразину (122 мг, 0,571 ммоль), 12,1 н HCl (5 мкл, 0,057 ммоль) і Н 2О (~10 мл) в 25 мл реакційній посудині інтенсивно перемішували при температурі навколишнього середовища протягом 24 год. Гідразон отримували фільтруванням у вакуумі і вміщували в 100 мл круглодонну колбу з магнітною стрижневою мішалкою. Потім колбу заповнювали триетиламіном (0,08 мл, 0,571 ммоль), дифенілфосфорилазидом (157 мг, 0,571 ммоль) і толуолом (20 мл) перед нагріванням при 110ºC протягом 1 год. Після охолоджування вміст гасили за допомогою 10 % NaOH (водн.) і підкислювали (рН=1) конц. HCl. Протягом 15 хв. надавали можливість для осадження перед тим як отримати проміжний продукт фільтруванням у вакуумі і сушили протягом ночі у вакуумній печі при 45ºC (16 мг, 8 %). Нітрил відновлювали до альдегіду із застосуванням DIBAL в умовах, описаних раніше. 18 UA 108619 C2 Приклад 23: Отримання 4-[1-(4-хлорфеніл)-1Н-[1,2,3]триазол-4-іл]бензальдегіду 5 10 По процедурі, опублікованій Feldman et al. (Org. Lett. 2004, 6, 3897), суспензію 4етинилбензонітрилу (50 мг, 0,393 ммоль), 1-хлор-4-йодбензолу (94 мг, 0,393 ммоль), L-проліну (9 мг, 0,079 ммоль), аскорбінової кислоти (7 мг, 0,039 ммоль), NaN3 (31 мг, 0,472 ммоль), CuSO4 (3 мг, 0,020 ммоль) і Na2SO4 (11 мг, 0,079 ммоль) в ДМСО (1,5 мл) нагрівали при 65ºC протягом 24 год. Після охолоджування суміш розбавляли за допомогою Н 2О і перемішували протягом 30 хв. при температурі навколишнього середовища. Проміжний 4-[1-(4-хлорфеніл)-1Н[1,2,3]триазол-4-іл]бензонітрил (54 мг, 48 %) потім отримували фільтруванням у вакуумі після промивання великими об'ємами Н2О і 20 % NH4OH (~20 мл). Потім проводили відновлення до альдегіду в умовах, описаних раніше. Приклад 24: Отримання 4-[5-(4-трифторметилфеніл)тетразол-2-іл]бензальдегіду 15 20 25 30 35 40 45 Даний альдегід отримували з 4-трифторметилбензальдегіду способом, описаним Roppe et al. J. Med. Chem. 2004, 47, 4645. Приклад 25: Отримання 4-[5-(4-трифторметоксифеніл)піридин-3-іл]бензальдегіду Стадія 1. 1,3-Дибромпіридин (4,4 ммоль), 4-трифторметоксифенілборонову кислоту (5,1 ммоль), тетракіс(трифенілфосфін)паладій(0) (0,04 ммоль), 2 М карбонат калію (8,44 ммоль) і діоксан (21 мл) об'єднували в посудині і нагрівали при мікрохвильовому опроміненні протягом 10 хв. при 150ºC. Реакційну суміш екстрагували простим ефіром і промивали насиченим сольовим розчином. Ефірний шар сушили над сульфатом магнію, фільтрували і розчинник видаляли у вакуумі. Сиру суміш очищали хроматографією з силікагелем з отриманням 3-бром1 5-(4-трифторметоксифеніл)піридину (130 мг) у вигляді жовтої твердої речовини: H ЯМР (400 МГц, CDCl3) δ 8,71 (м, 2H), 8,00 (т, J=2,1 Гц, 1H), 7,58 (д, J=8,8 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H); EI+ MC m/z 317 (М ). Стадія 2. Сполуку отримували арилуванням, каталізованим паладієм, продукту зі стадії 1 4формілфенілбороновою кислотою. Приклад 26: Отримання 4-[4-(4-трифторметоксифеніл)піридин-2-іл]бензальдегіду Стадія 1. Сполуку отримували арилуванням, каталізованим паладієм, 2-хлор-4-фодпіридину з 4-трифторметоксифенілбороновою кислотою. Стадія 2. 2- Хлор-4-(4-трифторметоксифеніл)піридин (0,55 ммоль), що походить від 2-хлор4-йодпіридину, 4-формілфенілборонову кислоту (0,82 ммоль), тетракіс(трифенілфосфін)паладій(0) (0,005 ммоль), 2 М карбонат калію (0,55 мл) і діоксан (3 мл) об'єднували в посудині і нагрівали при мікрохвильовому опромінюванні протягом 15 хв. при 150ºC. Реакційну суміш поглинали в EtOAc і промивали насиченим сольовим розчином. Органічний шар сушили над сульфатом магнію, фільтрували і розчинник видаляли у вакуумі. Очищення хроматографією з силікагелем (EtOAc/гексани) давало продукт (120 мг) у вигляді не 1 зовсім білої твердої речовини: H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,81 (д, J=4,8 Гц, 1H), 19 UA 108619 C2 8,24 (д, J=8,7 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,96 (м, 1H), 7,73 (д, J=9,0 Гц, 2H), 7,49 (дд, J=5,3, + 1,8 Гц, 1H), 7,37 (д, J=8,1 Гц, 2H); EIMC m/z 343 (М ). Приклад 27: Отримання 4-[6-(4-трифторметоксифеніл)піридин-2-іл]бензальдегіду 5 10 15 Стадія 1. 4-(6-Бромпіридин-2-іл)бензальдегід (0,31 ммоль) отримували по Puglisi et al. Eur. J. Org. Chem. 2003, 8, 1552-1558. Стадія 2. 4-[6-(4-Трифторметоксифеніл)піридин-2-іл]бензальдегід. 4-(6-Бромпіридин-2іл)бензальдегід (0,31 ммоль), 4-трифторметоксифенілборонову кислоту (0,46 ммоль), тетракіс(трифенілфосфін)паладій(0) (0,003 ммоль), 2 М карбонат калію (0,31 мл) і діоксан (2 мл) об'єднували в посудині і нагрівали при мікрохвильовому опромінюванні протягом 10 хв. при 150ºC. Реакційну суміш поглинали в простий ефір і промивали насиченим сольовим розчином. Органічний шар сушили над сульфатом магнію, фільтрували і розчинник видаляли у вакуумі. Очищення хроматографією з силікагелем (EtOAc/гексани) давало продукт (80 мг) у вигляді не 1 зовсім білої твердої речовини: т. пл. 109-112ºC; H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,32 (д, J=8,5 Гц, 2H), 8,19 (д, J=8,1 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,89 (т, J=7,9 Гц, 1H), 7,79 (д, J=7,7 Гц, + 1H), 7,74 (д, J=8,0 Гц, 1H), 7,35 (д, J=8,3 Гц, 2H); EIMC m/z 343 (М ). Приклад 28: Отримання 4-[6-(4-трифторметоксифеніл)піримідин-4-іл]бензальдегіду 20 25 30 35 40 Стадія 1. 4-Хлор-6-(4-трифторметоксифеніл)піримідин отримували арилуванням, 1 каталізованим паладієм, 4,6-дихлорпіримідину і 4-трифторметоксифенілборонової кислоти: H ЯМР (400 МГц, CDCl3) δ 9,05 (с, 1H), 8,14 (д, J=9,8 Гц, 2H), 7,74 (м, 1H), 7,36 (д, J=8,4 Гц, 2H); + EIMC m/z 274 (М ). Стадія 2. Сполуку отримували арилуванням, каталізованим паладієм, продукту зі стадії 1 з 1 4-формілфенілбороновою кислотою: H ЯМР (400 МГц, CDCl3) δ 10,15 (с, 1H), 9,38 (д, J=0,9 Гц, 1H), 8,33 (д, J=8,4 Гц, 2H), 8,23 (д, J=8,5 Гц, 2H), 8,16 (д, J=0,8 Гц, 1H), 8,08 (д, J=8,8 Гц, 2H), + 7,40 (д, J=8,1 Гц, 2H); EIMC m/z 344 (М ). Приклад 29: Отримання 4-[2-(4-трифторметоксифеніл)піримідин-4-іл]бензальдегіду Стадія 1. 4-Хлор-2-(4-трифторметоксифеніл)піримідин. Вказану в заголовку сполуку отримували арилуванням, каталізованим паладієм, 2,4-дихлорпіримідину і 41 трифторметоксифенілборонової кислоти: т. пл. 70-73ºC; Н ЯМР (400 МГц, CDCl3) δ 8,68 (д, J=5,6 Гц, 1H), 8,16 (д, J=9,1 Гц, 2H), 7,65 (д, J=5,3 Гц, 1H), 7,36 (дд, J=9,2, 0,9 Гц, 2H); EIMC m/z + 274 (М ). Стадія 2. Сполуку отримували арилуванням, каталізованим паладієм, продукту зі стадії 1 з 1 4-формілфенілбороновою кислотою: H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 8,91 (д, J=4,8 Гц, 1H), 8,74 (д, J=8,5 Гц, 2H), 8,28 (д, J=8,4 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,65 (д, J=5,3 Гц, 1H), + 7,39 (д, J=8,6 Гц, 2H); EIMC m/z 344 (М ). Приклад 30: Отримання 4-[4-(4-трифторметоксифеніл)піримідин-2-іл]бензальдегіду 45 20 UA 108619 C2 5 Стадія 1. 4-(4-Хлорпіримідин-2-іл)бензальдегід. Дану сполуку отримували арилуванням, 1 каталізованим паладієм, 2,4-дихлорпіримідину і 4-формілфенілборонової кислоти: Н ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 8,74 (д, J=5,0 Гц, 1H), 8,27 (д, J=7,8 Гц, 2H), 8,04 (д, J=7,9 Гц, 2H), + 7,74 (м, 1H); EIMC m/z 218 (М ). Стадія 2. Сполуку отримували арилуванням, каталізованим паладієм, продукту зі стадії 1 з 1 4-трифторметоксифенілбороновою кислотою: H ЯМР (400 МГц, CDCl3) δ 10,14 (с, 1H), 8,91 (д, J=4,2 Гц, 1H), 8,63 (д, J=8,5 Гц, 2H), 8,37 (д, J=8,4 Гц, 2H), 8,06 (д, J=8,8 Гц, 2H), 7,67 (д, J=5,4 + Гц, 1H), 7,35 (д, J=8,7 Гц, 2H); EIMC m/z 344 (М ). Приклад 31: Отримання 4-[6-(4-трифторметоксифеніл)піразин-2-іл]бензальдегіду 10 15 20 25 30 35 40 45 50 Стадія 1. 2-Хлор-6-(4-трифторметоксифеніл)піразин. Дану сполуку отримували арилуванням, каталізованим паладієм, 2,6-дихлорпіразину і 4-трифторметоксифенілборонової 1 кислоти: т. пл. 58-60ºC; H ЯМР (400 МГц, CDCl3) δ 8,94 (с, 1H), 8,57 (с, 1H), 8,10 (д, J=9,0 Гц, + 2H), 7,37 (д, J=8,4 Гц, 2H); EIMC m/z 274 (М ). Стадія 2. Сполуку отримували арилуванням, каталізованим паладієм, продукту зі стадії 1 з 1 4-формілфенілбороновою кислотою: H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 9,07 (с, 1H), 9,03 (с, 1H), 8,33 (д, J=8,1 Гц, 2H), 8,21 (д, J=8,7 Гц, 2H), 8,07 (д, J=7,6 Гц, 2H), 7,40 (д, J=8,3 Гц, 2H); + EIMC m/z 344 (М ). Приклад 32: Отримання 4-[2-(4-трифторметоксифеніл)піримідин-5-іл]бензальдегіду Стадія 1. 4-(2-Хлорпіримідин-5-іл)бензальдегід. Дану сполуку отримували арилуванням, каталізованим паладієм, 2,5-дихлорпіримідину і 4-формілфенілборонової кислоти. Стадія 2. 4-(2-Хлорпіримідин-5-іл)бензальдегід (0,92 ммоль), 4трифторметоксифенілборонову кислоту (1,10 ммоль), дихлорбіс(трифенілфосфін)паладій(0) (0,01 ммоль), 2 М карбонат калію (0,92 мл) і діоксан (5 мл) об'єднували в посудині і нагрівали при мікрохвильовому опромінюванні протягом 10 хв. при 150ºC. Органічний шар з реакційної суміші вміщували безпосередньо на силікагель і сушили у вакуумі. Очищення хроматографією з 1 силікагелем (EtOAc/гексани) давало продукт (140 мг) у вигляді білої твердої речовини: H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 9,07 (с, 2H), 8,57 (д, J=9,0 Гц, 2H), 8,07 (д, J=8,5 Гц, 2H), 7,82 (д, + J=8,3 Гц, 2H), 7,35 (д, J=8,3 Гц, 2H); EIMC m/z 344 (М ). Приклад 33: Отримання 4-[5-(4-трифторметоксифеніл)піримідин-2-іл]бензальдегіду Стадія 1. 2-Хлор-5-(4-трифторметоксифеніл)піримідин. Дану сполуку отримували арилуванням, каталізованим паладієм, 2,5-дихлорпіримідину з 4трифторметоксифенілбороновою кислотою. Стадія 2. 2-Хлор-5-(4-трифторметоксифеніл)піримідин (4,22 ммоль), 4формілфенілборонову кислоту (5,1 ммоль), дихлорбіс(трифенілфосфін)паладій(II) (0,05 ммоль), 2 М карбонат калію (4,2 мл) і діоксан (21 мл) об'єднували в посудині і нагрівали при мікрохвильовому опромінюванні протягом 20 хв. при 150ºC. Органічний шар з реакційної суміші вміщували безпосередньо на силікагель і сушили у вакуумі. Очищення хроматографією з 1 силікагелем (EtOAc/гексани) давало продукт (75 мг) у вигляді білої твердої речовини: H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 9,06 (с, 2H), 8,68 (д, J=8,8 Гц, 2H), 8,03 (д, J=8,3 Гц, 2H), 7,68 (д, + J=8,8 Гц, 2H), 7,40 (д, J=8,7 Гц, 2H); EIMC m/z 344 (М ). Приклад 34: Отримання (Е)-N-(4-диметиламіно)феніл)-2-(4-(1-(4-(трифторметокси)феніл)1Н-1,2,4-триазол-3-іл)бензилиден)гідразинкарботіоаміду (сполука 1) [спосіб синтезу А] 21 UA 108619 C2 5 10 15 20 Стадія 1. (Е)-3-(4-Гідразонометил)феніл)-1-(4-(трифторметокси)феніл)-1Н-1,2,4-триазол. У 250 мл круглодонну колбу, що містить гідрат гідразину (64 % водн. розчин; 7,27 мл, 15,0 ммоль) в EtOH (100 мл), при 80ºC додавали порціями 4-[1-(4-трифторметоксифеніл)-1Н-[1,2,4]триазол3-іл]бензальдегід (5,00 г, 1,50 ммоль) протягом 5 хв. Розчин перемішували при кип'ятінні зі зворотним холодильником протягом додаткових 3 год. перед розбавленням Н 2О (300 мл) і охолоджували до 0ºC. Продукт, що випав в осад, збирали фільтруванням у вакуумі у вигляді 1 білої твердої речовини (4,89 г, 93 %), т. пл. 222-226ºC; H ЯМР (400 МГц, ДМСО-d6) δ 8,59 (с, 1H), 8,22 (д, J=8,2 Гц, 2H), 7,84-7,79 (м, 2H), 7,66 (д, J=8,3 Гц, 2H), 7,41 (д, J=8,2 Гц, 2H), 7,29 (с, 1H), 5,63 (шир.с, 2H); ESIMC m/z 348 (М+Н). Стадія 2. У 25 мл круглодонну колбу, що містить (Е)-3-(4-(гідразонометил)феніл)-1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол (250 мг, 0,720 ммоль) в ТГФ (10 мл), додавали 4ізотіоціанато-N, N-диметиланілін (385 мг, 2,16 ммоль). Вміст нагрівали при 65ºC з перемішуванням протягом 2 год. перед тим як видаляли розчинник при зниженому тиску. Залишок суспендували в CH2Cl2 (10 мл), що приводило до осадження продукту. Цільовий продукт отримували у вигляді жовтої твердої речовини шляхом фільтрування у вакуумі (350 мг, 1 93 %): т. пл. 205-208ºC; H ЯМР (400 МГц, ДМСО-d6) δ 11,78 (с, 1H), 10,02 (с, 1H), 9,42 (с, 1H), 8,19-7,99 (м, 6H), 7,64 (д, J=8,3 Гц, 2H), 7,28 (д, J=8,3 Гц, 2H), 7,73 (д, J=8,3 Гц, 2H), 2,92 (с, 6H); ESIMC m/z 526 (М+Н). Приклад 35: Отримання N-(3-(диметиламіно)феніл)-2-(4-(1-(4-(трифторметокси)феніл)-1Н1,2,4-триазол-3-іл)бензилиден)гідразинкарботіоаміду (сполука 2) [спосіб синтезу В] 25 45 Стадія 1. (Е)-Метил 2-(4-(1-(4-(трифторметокси)феніл)-1Н-1,2,4-триазол-3іл)бензиліден)гідразинкарбодитіоат. У 250 мл круглодонну колбу, що містить метиловий складний ефір гідразиндитіокарбонової кислоти (2,38 г, 1,95 ммоль) в EtOH (100 мл), додавали 4-[1-(4-трифторметоксифеніл)-1Н-[1,2,4]триазол-3-іл]бензальдегід (5,00 г, 1,50 ммоль). Посудину нагрівали при 80ºC протягом 3 год. перед розбавленням Н 2О (300 мл) і охолоджували до 0ºC. Продукт, що випав в осад, збирали фільтруванням у вакуумі у вигляді не зовсім білої 1 твердої речовини (6,13 г, 93 %), т. пл. 204-206ºC; H ЯМР (400 МГц, ДМСО-d6) δ 13,39 (с, 1H), 9,43 (с, 1H), 8,38 (с, 1H), 8,21 (д, J=8,3 Гц, 2H), 8,09 (д, J=8,4 Гц, 2H), 7,88 (д, J=8,4 Гц, 2H), 7,62 (д, J=8,3 Гц, 2H), 2,57 (с, 3H); ESIMC m/z 438 (М+Н). Стадія 2. У 50 мл круглодонну колбу, яка містить (Е)-метил 2-(4-(1-(4(трифторметокси)феніл)-1Н-1,2,4-триазол-3-іл)бензиліден)гідразинкарбодитіоат (250 мг, 0,571 ммоль) в ДМФА (3 мл), додавали N1, N1-диметилбензол-1,3-діамін (195 мг, 1,43 ммоль). Вміст нагрівали при 150ºC з перемішуванням протягом 5 год. перед тим як розчину надавали можливість охолоджуватися протягом ночі. Суміш фільтрували, і фільтрат очищали через ОФВЕРХ з отриманням цільового продукту (235 мг, 78 %) у вигляді не зовсім білої твердої 1 речовини: т. пл. 192-194ºC; H ЯМР (400 МГц, ДМСО-d6) δ 11,82 (с, 1H), 10,04 (с, 1H), 9,41 (с, 1H), 8,19 (с, 1H), 8,16-7,99 (м, 6H), 7,61 (д, J=8,3 Гц, 2H), 7,16 (т, J=7,2 Гц, 1H), 7,01 (м, 1H), 6,87 + (м, 1H), 6,58 (м, 1H), 2,88 (с, 6H); ESIMC m/z 526 ([M+H] ). Приклад 36: Отримання N-бензил-2-(4-(1-(4-(трифторметокси)феніл)-1Н-1,2,4-триазол-3іл)бензиліден)гідразинкарботіоаміду (сполука 3) [спосіб синтезу С] 50 У 50 мл круглодонну колбу, що містить 4-[1-[4-(трифторметокси)феніл]-1,2,4-триазол-3іл]бензальдегід (500 мг, 1,5 ммоль) в EtOH (3 мл), додавали 4-бензилтіосемікарбазид (650 мг, 30 35 40 22 UA 108619 C2 5 3,6 ммоль). Реакційну суміш нагрівали при 80ºC протягом ночі. Після завершення реакції додавали Н2О і сирий продукт виділяли фільтруванням у вакуумі. Вказану в заголовку сполуку виділяли через ОФ-ВЕРХ у вигляді білої твердої речовини (390 мг, вихід 52 %), т. пл. 220-224ºC; 1 H ЯМР (400 МГц, CDCl3) δ 9,29 (с, 1H), 8,59 (с, 1H), 8,21 (д, J=8,4 Гц, 2H), 7,85-7,79 (м, 3H), 7,71 (д, J=8,4 Гц, 2H), 7,46-7,30 (м, 8H), 5,01 (д, J=5,8 Гц, 2H); ESIMC 497,2 (М+Н). Сполуку 4-159 в таблиці 1 були синтезовані відповідно до прикладів, приведених вище. Сполуки були перевірені проти совки малої і совки бавовняної при використанні методик, описаних в наступних прикладах, і представлені в таблиці 2. У кожному випадку, представленому в Таблиці 2, шкала оцінки є наступною: 10 % контролю (або смертності) 50-100 менше ніж 50 не випробувана 15 20 25 30 Оцінка А В С Приклад 37: Дослідження інсектицидної активності на совці малій (Spodoptera exigua) Біоаналізи на совці малій (BAW; Spodoptera exigua: Lepidoptera) проводили, використовуючи аналіз на 128-ямковом планшеті з кормом. Від трьох до п'яти личинок BAW на другій віковій стадії вміщували в кожну ямку (3 мл) на планшеті з кормом, який попередньо був заповнений 1 2 мл штучного корму, до якого було додано 50 мкг/см випробуваної сполуки (розчиненої в 50 мкл суміші ацетон-вода 90:10) (в кожну з восьми ямок) і потім надавали можливість для сушіння. Планшети покривали прозорим самоприклеюваним покриттям і витримували при 25ºC, в умовах світло-темрява 14:10 протягом шести діб. Реєстрували процент смертності для личинок в кожній ямці, потім усереднювали активність у восьми ямках. Результати для обох біоаналізів показані в таблиці 2. Приклад 38: Дослідження інсектицидної активності на совці бавовняній (Helicoverpa zea) Біоанализи на совці бавовняній (CEW; Helicoverpa zea: Lepidoptera) проводили, використовуючи аналіз на 128-ямковому планшеті з кормом. Від трьох до п'яти личинок CEW на другій віковій стадії вміщували в кожну ямку (3 мл) на планшеті з кормом, який попередньо був 2 заповнений 1 мл штучного корму, до якого було додано 50 мкг/см випробуваної сполуки (розчиненої в 50 мкл суміші ацетон-вода 90:10) (в кожну з восьми ямок) і потім надавали можливість для сушіння. Планшети покривали прозорим самоприклеюваним покриттям і витримували при 25ºC, в умовах світло-темрява 14:10 протягом шести діб. Реєстрували процент смертності для личинок в кожній ямці, потім усереднювали активність у восьми ямках. Результати для обох біоаналізів показані в таблиці 2. Сполуки були також перевірені проти тлі персикової зеленої при використанні процедури, описаної в наступному прикладі, і представлені в таблиці 2. У кожному випадку, представленому в Таблиці 2, шкала оцінки є наступною: 35 % контролю (або смертності) 80-100 менше ніж 80 не випробувана 40 45 50 Оцінка А В С Приклад 39: Дослідження інсектицидної активності на тлі персиковій зеленій (Myzus persicae) в аналізі з листяним обприскуванням Розсаду капусти, вирощену в 7,5-см горщечках, з 2-3-маленьким (3-5 см) справжнім листям, використовували як тест-субстрат. Розсаду заражали 20-50 особнями персикової зеленої тлі (безкрилі дорослі особні і німфи) за 1 день до застосування хімічних речовин. Чотири горщики з індивідуальною розсадою використовували для кожної обробки. Сполуки (2 мг) розчиняли в 2 мл сумішевого розчинника ацетон/метанол (1:1), що утворює вихідні розчини з концентрацією 1000 ч/млн. Вихідні розчини розбавляли 5 × 0,025 % розчином Tween 20 в H2O з отриманням тест-розчину з концентрацією діючої речовини 200 ч/млн Для застосування розчинів обприскуванням з обох сторін листя капусти до стікання розчину використовували ручний обприскувач типу Devilbiss. Контрольні рослини (перевірка розчинника) обприскували тільки розчинником. Оброблені рослини витримували в приміщенні протягом трьох діб при температурі приблизно 25ºC і відносній вологості (RH) 40 % до реєстрації. Оцінку проводили підрахунком кількості живих особнів тлі на кожній рослині під мікроскопом. Дані по інсектицидній активності, визначені з використанням скоригованої формули Ебботта, представлені в таблиці 2: 23 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 55 60 Скоригований % контролю = 100*(X-Y)/X, де Х = кількість живих особнів тлі на контрольних рослинах, оброблених розчинником; Y = кількість живих особнів тлі на рослинах, оброблених сполуками. КИСЛОТИ І СОЛЬОВІ ПОХІДНІ І СОЛЬВАТИ Сполуки, розкриті в даному винаході, можуть бути представлені в формі пестицидно прийнятних кислотно-адитивних солей. Наприклад, але без обмеження, амінна функція може утворювати солі з хлористоводневою, бромистоводневою, сірчаною, фосфорною, оцтовою, бензойною, лимонною, малоновою, саліциловою, яблучною, фумаровою, щавлевою, янтарною, винною, молочною, глюконовою, аскорбіновою, малеїновою, аспаргіновою, бензолсульфоновою, метансульфоновою, етансульфоновою, гідроксиметансульфоновою і гідроксіетансульфоновою кислотами. Як додатковий приклад, але без обмеження, кислотна функція може утворювати солі, включаючи солі лужних або лужноземельних металів, а також солі амонію і амінні солі. Приклади переважних катіонів включають катіони натрію, калію, магнію і амінію. Солі отримують контактуванням сполуки в формі вільної основи з кількістю бажаної кислоти, якої достатньо для отримання солі. Форми вільної основи можуть регенеруватися обробкою солі прийнятним розбавленим водним розчином основи, таким як розбавлений водний розчин NaOH, карбонату калію, аміаку і бікарбонату натрію. У деяких випадках пестицид перетворюють в більш розчинну форму: наприклад, диметиламінна сіль 2,4-дихлорфеноксіоцтової кислоти є більш розчинною формою 2,4-дихлорфеноксіоцтової кислоти, яка є добре відомим гербіцидом. Сполуки, розкриті в даному винаході, можуть також утворювати стабільні комплекси з молекулами розчинника, які залишаються інтактними після видалення зі сполук молекул розчинника, що не входять до складу комплексу. Вказані комплекси часто називають "сольватами". СТЕРЕОІЗОМЕРИ Деякі сполуки, розкриті в даному винаході, можуть існувати у вигляді одного або декількох стереоізомерів. Різні стереоізомери включають геометричні ізомери, діастереомери і енантіомери. Таким чином, сполуки, розкриті в даному винаході, включають рацемічні суміші, окремі стереоізомери і оптично активні суміші. Фахівцеві в даній галузі техніки буде зрозуміло, що один стереоізомер може бути більш активним, ніж інші. Окремі стереоізомери і оптично активні суміші можуть бути отримані відповідно до методик селективного синтезу, звичайних методів синтезу з використанням розділених вихідних речовин або за допомогою стандартних методик розділення. СІЛЬСЬКОГОСПОДАРСЬКІ ШКІДНИКИ У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю сільськогосподарських шкідників. У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю шкідників, які належать до типу Нематоди (Phylum Nematoda). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю шкідників, які належать до типу Членистоногі (Phylum Arthropoda). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю шкідників, які належать до підтипу Хеліцерові (Subphylum Chelicerata). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю шкідників, які належать до класу Арахніди (Class Arachnida). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю шкідників, які належать до підкласу Багатоніжки (Subphylum Myriapoda). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю шкідників, які належать до класу Симфіли (Сlass Symphyla). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю шкідників, які належать до підкласу Шестиногі (Subphylum Hexapoda). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю шкідників, які належать до класу Комахи (Сlass Insecta). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Жорсткокрилі (Coleoptera) (жуки). Неповний перелік цих шкідників включає, але без обмеження, Acanthoscelides spp. (довгоносики), Acanthoscelides obtectus (зернівка квасоляна), Agrilus planipennis (златка вузькотіла), Agriotes spp. (дротяники), Anoplophora glabripennis (вусань азіатський), Anthonomus spp. (довгоносики), Anthonomus grandis (довгоносик бавовняний), Aphidius spp. (тлі), Apion spp. (апіони), Apogonia spp. (триби), Ataenius spretulus (жук чорний кореневий роду Ataenius), Atomaria linearis (крихітка бурякова), Aulacophore spp., Bothynoderes punctiventris (довгоносик буряковий звичайний), Bruchus spp. 24 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 55 60 (зернівки), Bruchus pisorum (зернівка горохова), Cacoesia spp., Callosobruchus maculatus (зернівка плямиста), Carpophilus hemipteras (плодоїд короткокрилий), Cassida vittata (щитоноска кропив'яна), Cerosterna spp., Cerotoma spp. (листоїди), Cerotoma trifurcata (листоїд квасоляний), Ceutorhynchus spp. (прихованохоботники), Ceutorhynchus assimilis (прихованохоботник капустяний стручковий), Ceutorhynchus napi (прихованохоботник ріпаковий стебловий), Chaetocnema spp. (листоїди), Colaspis spp. (жуки ґрунтові), Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar (довгоносик плодорий), Cotinus nitidis (хрущ блискучий зелений), Crioceris asparagi (тріщалка спаржева), Cryptolestes ferrugineus (борошноїд рудий коротковусий), Cryptolestes pusillus (борошноїд малий), Cryptolestes turcicus (Turkish grain beetle/жук турецький), Ctenicera spp. (ковалики), Curculio spp. (довгоносики), Cyclocephala spp. (личинки червоподібні), Cylindrocоpturus adspersus (sunflower stem weevil/довгоносик), Deporaus marginatus (довгоносик манговий), Dermestes lardarius (шкіроїд шинковий), Dermestes maculates (шкіроїд плямистий), Diabrotica spp. (жуки діабротика, листоїди), Epilachna varivestis (мексиканське сонечко), Faustinus cubae, Hylobius pales (жук-довгоносик), Hypera spp. (довгоносики), Hypera postica (довгоносик люцерновий), Hyperdoes spp. (Hyperodes weevil/довгоносик), Hypothenemus hampei (жук кавовий), Ips spp. (заболонники), Lasioderma serricorne (жук тютюновий), Leptinotarsa decemlineata (жук колорадський), Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus (довгоносик рисовий водяний), Lyctus spp. (деревні жуки/деревогризи), Maecolaspis joliveti, Megascelis spp., Melanotus communis, Meligethes spp., Meligethes aeneus (квіткоїд ріпаковий), Melolontha melolontha (хрущ травневий західний), Oberea brevis, Oberea linearis, Oryctes rhinoceros (жук-носоріг пальмовий), Oryzaephilus mercator (борошноїд псевдосуринамський), Oryzaephilus surinamensis (рисоїд суринамський), Otiorhynchus spp. (плосконоси), Oulema melanopus (листоїд-п'явиця), Oulema oryzae, Pantomorus spp. (жуки-довгоносики), Phyllophaga spp. (жук травневий/червневий), Phyllophaga cuyabana, Phyllotreta spp. (листоїди), Phynchites spp., Popillia japonica (хрущик японський), Prostephanus truncates (точильник зерновий великий), Rhizopertha dominica (точильник зерновий), Rhizotrogus spp. (хрущі), Rhynchophorus spp. (довгоносики), Scolytus spp. (жуки деревні), Shenophorus spp. (довгоносики), Sitona lineatus (слоник гороховий смугастий), Sitophilus spp. (довгоносики зернові), Sitophilus granaries (довгоносик комірний), Sitophilus oryzae (довгоносик рисовий), Stegobium paniceum (точильник хлібний), Tribolium spp. (хрущаки борошняні), Tribolium castaneum (хрущак каштановий), Tribolium confusum (хрущак борошняний малий), Trogoderma variabile (трогодерма мінлива) і Zabrus tenebioides. У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Шкірястокрилі Dermaptera (вуховертки). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Dictyoptera (таргани). Неповний перелік цих шкідників включає, але без обмеження, Blattella germanica (тарган рудий), Blatta orientalis (тарган чорний), Parcoblatta pennylvanica, Periplaneta americana (тарган американський), Periplaneta australoasiae (тарган австралійський), Periplaneta brunnea (тарган коричневий), Periplaneta fuliginosa (тарган димчасто-коричневий), Pyncoselus suninamensis (тарган суринамський) і Supella longipalpa (тарган з коричневими смугами). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Двокрилі (Diptera) (мухи справжні). Неповний перелік цих шкідників включає, але без обмеження, Aedes spp. (комарі), Agromyza frontella (молі-перстянки люцернові), Agromyza spp. (мінуючі мушки), Anastrepha spp. (мушки плодові), Anastrepha suspensa (мушка плодова карибська), Anopheles spp. (комарі), Batrocera spp. (мушки плодові), Bactrocera cucurbitae (муха динна), Bactrocera dorsalis (муха східна плодова), Ceratitis spp. (мухи плодові), Ceratitis capitata (муха середземноморська плодова), Chrysops spp. (мухи оленячі), Cochliomyia spp. (личинки м'ясної мухи), Contarinia spp. (галиці), Culex spp. (комарі), Dasineura spp. (галиці), Dasineura brassicae (галиця капустяна), Delia spp., Delia platura (личинка мухи паросткової), Drosophila spp. (дрозофіли), Fannia spp. (мухи кімнатні), Fannia canicularis (муха кімнатна мала), Fannia scalaris (муха сходова), Gasterophilus intestinalis (овід-гачок), Gracillia perseae, Haematobia irritans (жигалка коров'яча мала), Hylemyia spp. (личинки мух справжніх), Hypoderma lineatum (личинка овода бичачого смугастого), Liriomyza spp. (мінуючі мушки), Liriomyza brassica (муха мінуюча змієподібна), Melophagus ovinus (вовноїд овечий), Musca spp. (мухи справжні), Musca autumnalis (муха осіння), Musca domestica (муха кімнатна), Oestrus ovis (овід овечий), Oscinella frit (мушка шведська), Pegomyia betae (муха бурякова), Phorbia spp., Psila rosae (муха морквяна), Rhagoletis cerasi (муха вишнева), Rhagoletis pomonella (муха яблунева), Sitodiplosis mosellana (галиця оранжева зернова), Stomoxys calcitrans (жигалка осіння), Tabanus spp. (мухи кінські) і Tipula spp. (довгоніжки). 25 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Напівжорсткокрилі (Hemiptera) (клопи). Неповний перелік цих шкідників включає, але без обмеження, Acrosternum hilare (клоп-щитник), Blissus leucopterus (клоп-черепашка), Calocoris norvegicus (клопик картопляний), Cimex hemipterus (клоп тропічний постільний), Cimex lectularius (клоп постільний), Dagbertus fasciatus, Dichelops furcatus, Dysdercus suturellus (червоноклоп бавовняний), Edessa meditabunda, Eurygaster maura (клопчерепашка маврська), Euschistus heros, Euschistus servus (клоп коричневий смердючий), Helopeltis antonii, Helopeltis theivora (сліпняк чайний індійський), Lagynotomus spp. (клопи смердючі), Leptocorisa oratorius, Leptocorisa varicornis, Lygus spp. (сліпняки, клопи), Lygus hesperus (сліпняк західний матовий), Maconellicoccus hirsutus, Neurocolpus longirostris, Nezara viridula (клоп овочевий зелений), Phytocoris spp. (сліпняки), Phytocoris californicus, Phytocoris relativus, Piezodorus guildingi, Poecilocapsus lineatus (сліпняк чотирисмужковий), Psallus vaccinicola, Pseudacysta perseae, Scaptocoris castanea і Triatoma spp. (клопи триатомові: клопи кровосисні/триатоміди). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників Homoptera (тлі, щитівки, білокрилки, цикадки). Неповний перелік цих шкідників включає, але без обмеження, Acrythosiphon pisum (тля горохова), Adelges spp. (хермеси), Aleurodes proletella (білокрилка капустяна), Aleurodicus disperses, Aleurothrixus floccosus (білокрилка вовниста), Aluacaspis spp., Amrasca bigutella bigutella, Aphrophora spp. (кобилочки), Aonidiella aurantii (щитівка червона померанцева), Aphis spp. (тлі), Aphis gossypii (тля бавовняна), Aphis pomi (тля яблунева), Aulacorthum solani (тля картопляна), Bemisia spp. (білокрилки), Bemisia argentifolii, Bemisia tabaci (білокрилка тютюнова), Brachycolus noxius (тля ячмінна), Brachycorynella asparagi (тля аспарагусова), Brevennia rehi, Brevicoryne brassicae (тля капустяна), Ceroplastes spp. (щитівки), Ceroplastes rubens (псевдощитівка рубінова), Chionaspis spp. (щитівки), Chrysomphalus spp. (щитівки), Coccus spp. (щитівки), Dysaphis plantaginea (тля рожева яблунева), Empoasca spp. (цикадки), Eriosoma lanigerum (тля кров'яна яблунева), Icerya purchasi (червчик австралійський жолобчатий), Idioscopus nitidulus (цикадка мангова), Laodelphax striatellus (цикадка темна мала), Lepidosaphes spp., Macrosiphum spp., Macrosiphum euphorbiae (тля картопляна), Macrosiphum granarium (тля зернова), Macrosiphum rosae (тля розова зелена), Macrosteles quadrilineatus (цикадка астрова), Mahanarva frimbiolata, Metopolophium dirhodum (тля розанно-злакова), Mictis longicornis, Myzus persicae (тля персикова), Nephotettix spp. (цикадки), Nephotettix cinctipes (цикадка зелена), Nilaparvata lugens (цикадка коричнева), Parlatoria pergandii (щитівка солом'яна), Parlatoria ziziphi (щитівка чорна грушовидна), Peregrinus maidis (дельфацида кукурудзяна), Philaenus spp. (пінниці), Phylloxera vitifoliae (філоксера виноградна), Physokermes piceae (псевдощитівка ялинова), Planococcus spp. (червчики борошнисті), Pseudococcus spp. (червчики борошнисті), Pseudococcus brevipes (червчик борошнистий ананасовий), Quadraspidiotus perniciosus (щитівка каліфорнійська), Rhapalosiphum spp. (тлі), Rhapalosiphum maida (тля кукурудзяна листова), Rhapalosiphum padi (тля черемхова), Saissetia spp. (щитівки), Saissetia oleae (псевдощитівка маслинова), Schizaphis graminum (тля звичайна злакова), Sitobion avenae (тля велика злакова), Sogatella furcifera (цикадка білоспинна), Therioaphis spp. (тлі), Toumeyella spp. (червчики), Toxoptera spp. (тлі), Trialeurodes spp. (білокрилки), Trialeurodes vaporariorum (білокрилка теплична), Trialeurodes abutiloneus (білокрилка зі смугастими крилами), Unaspis spp. (щитівки), Unaspis yanonensis (щитівка східна цитрусова) і Zulia entreriana. У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Перетинчастокрилі (Hymenoptera) (мурашки, оси і бджоли). Неповний перелік цих шкідників включає, але без обмеження, Acromyrrmex spp., Athalia rosae, Atta spp. (мурашки-листорізи), Camponotus spp. (мурашки-червиці), Diprion spp. (пильщики), Formica spp. (мурашки), Iridomyrmex humilis (мурашка аргентинська), Monomorium sрp., Monomorium minumum (мурашка маленька чорна), Monomorium pharaonis (мурашка фараонів), Neodiprion spp. (пильщики), Pogonomyrmex spp. (мурашки-жнеці американські), Polistes spp. (оси паперові), Solenopsis spp. (мурашки вогненні), Tapoinoma sessile (мурашка домашня пахуча), Tetranomorium spp. (мурашки дернові), Vespula spp. (оси) і Xylocopa spp. (бджоли-теслярі). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Однаковокрилі (Isoptera) (терміти). Неповний перелік цих шкідників включає, але без обмеження, Coptotermes spp., Coptotermes curvignathus, Coptotermes frenchii, Coptotermes formosanus (терміт тайванський підземний), Cornitermes spp. (термітисолдати з рострумом), Cryptotermes spp. (терміти деревоїдні), Heterotermes spp. (підземні терміти пустелі), Heterotermes aureus, Kalotermes spp. (терміти деревоїдні), Incistitermes spp. (терміти деревоїдні), Macrotermes spp. (терміти "грибних садів"), Marginitermes spp. (терміти 26 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 55 деревоїдні), Microcerotermes spp. (терміти урожаю), Microtermes obesi, Procornitermes spp., Reticulitermes spp. (терміти підземні), Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes (терміт жовтоногий), Reticulitermes hageni, Reticulitermes hesperus (терміт західний підземний), Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis, Reticulitermes virginicus, Schedorhinotermes spp. і Zootermopsis spp. (терміти гнилої деревини). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Лускокрилі (Lepidoptera) (молі і метелики). Неповний перелік цих шкідників включає, але без обмеження, Achoea janata, Adoxophyes spp., Adoxophyes orana, Agrotis spp. (гусениці озимої совки), Agrotis ipsilon (совка іпсилон), Alabama argillacea (гусениця совки бавовняної американської), Amorbia cuneana, Amyelosis transitella (міль цитрусова), Anacamptodes defectaria, Anarsia lineatella (міль фруктова смугаста), Anomis sabulifera (jute looper/совка), Anticarsia gemmatalis (совка), Archips argyrospila (листовійка плодових дерев), Archips rosana (листовійка розова), Argyrotaenia spp. (листовійки), Argyrotaenia citrana (листовійка цитрусова), Autographa gamma, Bonagota cranaodes, Borbo cinnara (вогнівка рисова), Bucculatrix thurberiella (міль кривовуса турберії), Caloptilia spp. (молі-мінери), Capua reticulana, Carposina niponensis (плодожерка персикова), Chilo spp., Chlumetia transversa (mango shoot borer/точильник манговий), Choristoneura rosaceana (oblique banded leafroller/листовійка), Chrysodeixis spp., Cnaphalocerus medinalis (grass leafroller/листовійка), Colias spp., Conpomorpha cramerella, Cossus cossus (червиця), Crambus spp. (метелики лугові), Cydia funebrana (плодожерка сливова), Cydia molesta (плодожерка східна), Cydia nignicana (листовійка горохова), Cydia pomonella (плодожерка яблунева), Darna diducta, Diaphania spp. (точильники стовбурові), Diatraea spp. (точильники стебла), Diatraea saccharalis (точильник стебла цукрової тростини), Diatraea graniosella (вогнівка кукурудзяна південно-західна), Earias spp. (коробочні черв'яки), Earias insulata (черв'як шипуватий), Earias vittella (rough northern boll worm/коробочний черв'як бавовнику), Ecdytopopha aurantianum, Elasmopalpus lignosellus (точильник зерновий), Epiphysias postruttana (light brown apple moth/листовійка), Ephestia spp. (вогнівки млинові), Ephestia cautella (вогнівка сухофруктова), Ephestia elutella (вогнівка тютюнова), Ephestia kuehniella (вогнівка млинова), Epimeces spp., Epinotia aporema, Erionota thrax (banana skipper/товстоголівка), Eupoecilia ambiguella (листовійка дворічна), Euxoa auxiliaris (совка), Feltia spp. (совки), Gortyna spp. (точильники стеблові), Grapholita molesta (плодожерка східна), Hedylepta indicata (метелик соєвий), Helicoverpa spp. (совки), Helicoverpa armigera (совка бавовняна), Helicoverpa zea (совка бавовняна/черв'як коробочний), Heliothis spp. (совки), Heliothis verescent (гусениця совки тютюнової), Hellula undalis (гусениця вогнівки капустяної), Indarbela spp. (точильники кореневі), Keiferia lycopersicella (міль виїмчастокрила), Leucinodes orbonalis (точильник плодів баклажана), Leucoptera malifoliella, Lithocollectis spp., Lobesia botrana (листовійка гронова), Loxagrotis spp. (совки), Loxagrotis albicosta (гусениця совки бобової), Lymantria dispar (шовкопряд непарний), Lyonetia clerkella (міль-крихітка яблунева біла), Mahasena corbetti (oil palm bagworm/мішечниця), Malacosoma spp. (гусениці коконопрядів, що будують спільні павутинні гнізда), Mamestra brassicae (гусениця совки капустяної), Maruca testulalis (вогнівка бобова), Metisa plana (мішечниця), Mythimna unipuncta (гусениця совки однокрапкової), Neoleucinodes elegantalis (small tomato borer/точильник), Nymphula depunctalis (rice caseworm/лялечка), Operophthera brumata (п'ядун зимовий), Ostrinia nubilalis (метелик стебловий), Oxydia vesulia, Pandemis cerasana (листовійка кривовуса смородинова), Pandemis heparana (листовійка кривовуса вербова), Papilio demodocus, Pectinophora gossypiella (міль бавовняна), Peridroma spp. (гусениці), Peridroma saucia (совка маргариткова або совка бруднобура земляна), Perileucoptera coffeella (міль біла кавова), Phthorimaea operculella (міль картопляна мінуюча), Phyllocnisitis citrella, Phyllonorycter spp. (молі-мінери), Pieris rapae (гусениця ріпниці), Plathypena scabra, Plodia interpunctella (вогнівка амбарна), Plutella xylostella (міль серпокрила капустяна), Polychrosis viteana (листовійка виноградна), Prays endocarpa, Prays oleae (міль маслинова), Pseudaletia spp. (совки), Pseudaletia unipunctata (ратний черв'як совки лугової), Pseudoplusia includens (soybean looper/п'ядун), Rachiplusia nu, Scirpophaga incertulas, Sesamia spp. (точильники стеблові), Sesamia inferens (точильник стебловий рожевий), Sesamia nonagrioides, Setora nitens, Sitotroga cerealella (міль зернова амбарна), Sparganothis pilleriana, Spodoptera spp. (черв'яки "ратні"), Spodoptera exigua (карадрина - совка наземна мала), Spodoptera fugiperda (точильник рожевий стебловий), Spodoptera еridania (совка південна), Synanthedon spp. (точильники кореневі), Thecla basilides, Thermisia gemmatalis, Tineola bisselliella (міль платтяна), Trichoplusia ni (капустяна металовидка, совка ні), Tuta absoluta, Yponomeuta spp., Zeuzera coffeae (red branch borer/червиця) і Zeuzera pyrina (червиця в'їдлива). 27 UA 108619 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Пухоїди (Mallophaga). Неповний перелік цих шкідників включає, але без обмеження, Bovicola ovis (волосоїд), Menacanthus stramineus (пухоїд пташиний) і Menopon gallinea (пухоїд курячий). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Прямокрилі (Orthoptera) (кобилки, цикадки і цвіркуни). Неповний перелік цих шкідників включає, але без обмеження, Anabrus simplex (коник-мормон безкрилий), Gryllotalpidae (капустянки), Locusta migratoria, Melanoplus spp. (коники), Microcentrum retinerve (коник вузькокрилий), Pterophylla spp. (коники північноамериканські), Сhistocerca gregaria, Scudderia furcata (коник вилохвостий) і Valanga nigricorni. У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Phthiraptera (воші). Неповний перелік цих шкідників включає, але без обмеження, Haematopinus spp. (родовики бичача і свиняча), Linognathus ovillus (воша овеча), Pediculus humanus capitis (воша людська головна), Pediculus humanus humanus (воша людська платтяна) і Pthirus pubis (воша лобкова). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Siphonaptera (блохи). Неповний перелік цих шкідників включає, але без обмеження, Ctenocephalides canis (блоха собача), Ctenocephalides felis (блоха котяча) і Pulex irritans (блоха людська). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Thysanoptera (трипси). Неповний перелік цих шкідників включає, але без обмеження, Frankliniella fusca (трипс тютюновий), Frankliniella occidentalis (трипс квітковий західний), Frankliniella shultzei, Frankliniella williamsi (трипс кукурудзяний), Heliothrips haemorrhaidalis (трипс тепличний), Riphiphorothrips cruentatus, Scirtothrips spp., Scirtothrips citri (трипс цитрусовий), Scirtothrips dorsalis (трипс жовтий чайний), Taeniothrips rhopalantennalis і Thrips spp. У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Thysanura (щетинохвостки). Неповний перелік вказаних шкідників включає, але без обмеження, Lepisma spp. (лускокрилки) і Thermobia spp. (термобії). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників загону Павукоподібні (Acarina) (кліщі). Неповний перелік цих шкідників включає, але без обмеження, Acarapsis woodi (трахеальний кліщ робочих бджіл), Acarus spp. (кліщі комірні), Acarus siro (кліщ борошняний), Aceria mangiferae (кліщик манговий), Aculops spp., Aculops lycopersici (кліщ іржавий), Aculops pelekasi, Aculus pelekassi, Aculus schlechtendali (кліщ іржавий яблуневий), Amblyomma americanum (кліщ самотньої зірки або зіркоподібний кліщ), Boophilus spp. (кліщі кільчасті), Brevipalpus obovatus (плоскотілка оранжерейна), Brevipalpus phoenicis (кліщ червоно-чорний плоский), Demodex spp. (кліщі підшкірні), Dermacentor spp. (кліщі тверді іксодові), Dermacentor variabilis (кліщ іксодовий мінливий), Dermatophagoides pteronyssinus (кліщ домашнього пилу), Eotetranycus spp., Eotetranychus carpini (кліщ жовтий грабовий павутинний), Epitimerus spp., Eriophyes spp., Ixodes spp. (кліщі іксодові), Metatetranycus spp., Notoedres cati, Oligonychus spp., Oligonychus coffee, Oligonychus ilicus (кліщ плодовий бурий павутинний), Panonychus spp., Panonychus citri (кліщ цитрусовий червоний), Panonychus ulmi (кліщ плодовий червоний), Phyllocoptruta oleivora (кліщик цитрусовий іржавий), Polyphagotarsonemun latus (кліщ оранжерейний прозорий), Rhipicephalus sanguineus (кліщ собачий бурий), Rhizoglyphus spp. (кліщі цибулинні), Sarcoptes scabiei (кліщ коростяний), Tegolophus perseaflorae, Tetranychus spp., Tetranychus urticae (кліщ двоплямистий павутинний) і Varroa destructor (вератозний кліщ робочої бджоли). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників класу Nematoda (нематоди). Неповний перелік цих шкідників включає, але без обмеження, Aphelenchoides spp. (стеблові і листові і соснові деревні нематоди), Belonolaimus spp. (нематоди жалячі), Criconemella spp. (нематоди кільцеві), Dirofilaria immitis (черв'як серцевий), Ditylenchus spp. (нематоди стеблові і цибулинні), Heterodera spp. (гетеродериди), Heterodera zeae (нематода цистоутворювальна), Hirschmanniella spp. (нематоди кореневі), Hoplolaimus spp. (нематоди ланцетовидні), Meloidogyne spp. (нематоди кореневі галоутворювальні), Meloidogyne incognita (нематода південна коренева галова), Onchocerca volvulus (онхоцерка), Pratylenchus spp. (нематоди кореневі або лугові), Radopholus spp. (струнці або нематоди, які точать) і Rotylenchus reniformis (нематода брунькоподібна). У іншому варіанті здійснення винахід, розкритий в даному описі, може застосовуватися для контролю представників класу Symphyla (багатоніжки). Неповний перелік вказаних шкідників включає, але без обмеження, Scutigerella immaculata. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPesticidal compositions
Автори англійськоюBrown, Annette, Crouse, Gary, Sparks, Thomas, McLeod, CaSandra, Rigsbee, Emily, Lambert, William, Niyaz, Noormohamed
Автори російськоюБраун Аннетт, Крауз Гари, Спаркс Томас, МакЛауд КаСандра, Ригсби Эмили, Ламберт Уилльям, Нияз Ноормохамед
МПК / Мітки
МПК: A01N 43/64, A01N 47/34, A01P 7/00
Мітки: пестицидні, композиції
Код посилання
<a href="https://ua.patents.su/54-108619-pesticidni-kompozici.html" target="_blank" rel="follow" title="База патентів України">Пестицидні композиції</a>
Попередній патент: Застосування c-met-модуляторів в комбінації з темозоломідом та/або променевою терапією для лікування раку
Наступний патент: Машина для будівельних робіт
Випадковий патент: Пристрій для запису та зчитування інформації