Пестицидні композиції
Номер патенту: 107791
Опубліковано: 25.02.2015
Автори: Брайан Крісті, Траллінгер Тоні, Хантер Рікі, Джонсон Пітер, Паркер Маршалл, Чжан Юй, Яп Моріс, Ніяз Ноормохамед, Еккельбарджер Джозеф, Чжу Юаньмін, Джонсон Тімоті, Маклауд КаСандра, Байсс Енн, Деамікіс Карл, Росс Рональд, Гаріці Негар, Перніх Ден
Формула / Реферат
1. Сполука, яка має наступну формулу:
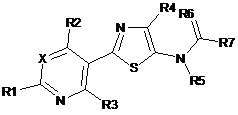 , Формула І
, Формула І
де:
(a) X являє собою CR8;
(b) R1 являє собою H;
(c) R2 являє собою Н;
(d) R3 являє собою H;
(e) R4 являє собою Сl;
(f) R5 являє собою незаміщений С1-С6алкіл;
(g) R6 являє собою О;
(h) R7 являє собою незаміщений С1-C6алкіл-S(O)n(незаміщений C1-С6алкіл);
(i) R8 являє собою Η, F;
(k) n дорівнює 0, 1 або 2.
2. Сполука за п. 1, яка має наступну структуру:
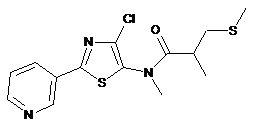 .
.
3. Сполука за п. 1, яка має наступну структуру:
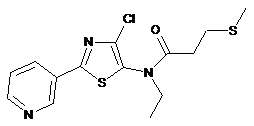 .
.
4. Сполука за п. 1, яка має наступну структуру:
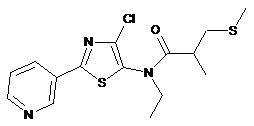 .
.
5. Сполука за п. 1 у вигляді пестицидно прийнятної кислотно-адитивної солі, похідного солі або сольвату.
6. Сполука за п. 1, що містить щонайменше один 2H.
7. Сполука за п. 1, що містить щонайменше один 14С.
8. Сполука за п. 1, яка являє собою окремий стереоізомер.
9. Композиція, яка містить сполуку за п. 1 і щонайменше один агент з групи інсектицидів, групи акарицидів, групи нематоцидів, групи фунгіцидів або групи гербіцидів.
10. Композиція, яка містить сполуку за п. 1 і щонайменше один біопестицид.
11. Композиція, яка містить сполуку за п. 1 і щонайменше одну з наступних сполук:
(a) 3-(4-хлор-2,6-диметилфеніл)-4-гідроксі-8-окса-1-азаспіро[4,5]дец-3-ен-2-он;
(b) 3-(4′-хлор-2,4-диметил[1,1′-біфеніл]-3-іл)-4-гідроксі-8-окса-1-азаспіро[4,5]дец-3-ен-2-он;
(c) 4-[[(6-хлор-3-піридиніл)метил]метиламіно]-2(5H)-фуранон;
(d) 4-[[(6-хлор-3-піридиніл)метил]циклопропіламіно]-2(5H)-фуранон;
(e) 3-хлор-N2-[(1S)-1-метил-2-(метилсульфоніл)етил]-N1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)етил]феніл]-1,2-бензолдикарбоксамід;
(f) 2-ціано-N-етил-4-фтор-3-метоксибензолсульфонамід;
(g) 2-ціано-N-етил-3-метоксибензолсульфонамід;
(h) 2-ціано-3-дифторметоксі-N-етил-4-фторбензолсульфонамід;
(i) 2-ціано-3-фторметоксі-N-етилбензолсульфонамід;
(j) 2-ціано-6-фтор-3-метокси-N,N-диметилбензолсульфонамід;
(k) 2-ціано-N-етил-6-фтор-3-метокси-N-метилбензолсульфонамід;
(l) 2-ціано-3-дифторметокси-N,N-диметилбензолсульфонамід;
(m) 3-дифторметил-N-[2-(3,3-диметилбутил)феніл]-1-метил-1H-піразол-4-карбоксамід;
(n) N-етил-2,2-диметилпропіонамід-2-(2,6-дихлор-α,α,α-трифтор-п-толіл)гідразон;
(o) гідразон N-етил-2,2-дихлор-1-метилциклопропанкарбоксамід-2-(2,6-дихлор-α,α,α-трифтор-п-толіл)нікотину;
(p) O-{(E-)-[2-(4-хлорфеніл)-2-ціано-1-(2-трифторметилфеніл)вініл]} S-метилтіокарбонат;
(q) (E)-N1-[(2-хлор-1,3-тіазол-5-ілметил)]-N2-ціано-N1-метилацетамідин;
(r) 1-(6-хлорпіридин-3-ілметил)-7-метил-8-нітро-1,2,3,5,6,7-гексагідроімідазо[1,2-a]піридин-5-ол;
(s) мезилат 4-[4-хлорфеніл-(2-бутиліденгідразоно)метил]фенілу або
(t) N-етил-2,2-дихлор-1-метилциклопропанкарбоксамід-2-(2,6-дихлор-α,α,α-трифтор-п-толіл)гідразон.
12. Спосіб для боротьби зі шкідниками, що включає нанесення на ділянку сполуки за п. 1 в кількості, достатній для знищення комах-шкідників.
13. Насіння, яке оброблене сполукою за п. 1.
14. Насіння за п. 13, де сполука вибрана із:
227
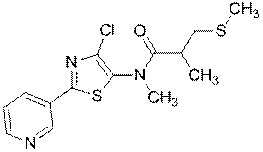
230
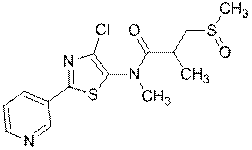
247
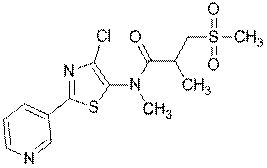
262
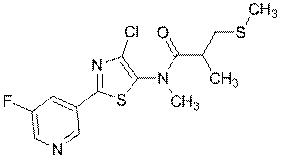
270
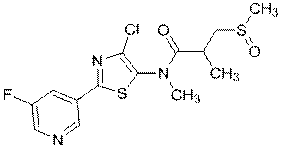
272
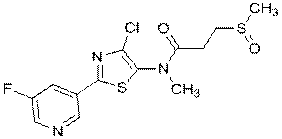
313
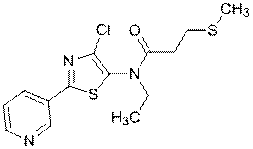
314
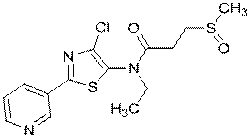
316
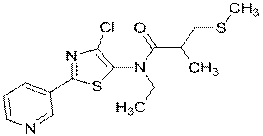
348
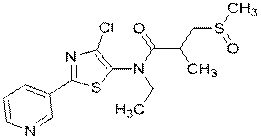 .
.
Текст
Реферат: Описані сполуки, що мають наступну формулу: R2 R4 R6 N R7 X R1 S N R3 N R5 Формула І. (72) Винахідник(и): Траллінгер Тоні (US), Хантер Рікі (US), Гаріці Негар (US), Яп Моріс (US), Байсс Енн (US), Перніх Ден (US), Джонсон Тімоті (US), Брайан Крісті (US), Деамікіс Карл (US), Чжан Юй (US), Ніяз Ноормохамед (US), Маклауд КаСандра (US), Росс Рональд (US), Чжу Юаньмін (US), Джонсон Пітер (US), Еккельбарджер Джозеф (US), Паркер Маршалл (US) (73) Власник(и): ДАУ АГРОСАЙЄНСІЗ ЕЛЕЛСІ, 9330 Zionsville Road, Indianapolis, IN 462681054, United States of America (US) (74) Представник: Мошинська Ніна Миколаївна, реєстр. №115 (56) Перелік документів, взятих до уваги експертизою: JP 2003212864 A, 30.07.2003 WO 2008090382 A1, 31.07.2008 UA 107791 C2 (12) UA 107791 C2 UA 107791 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПЕРЕХРЕСНІ ПОСИЛАННЯ НА СПОРІДНЕНІ ЗАЯВКИ По даній заявці вимагається пріоритет відповідно до попередньої заявки США 61/175659, поданої 5 травня 2009 року. Повний зміст вказаної попередньої заявки включений в дану заявку як посилання. ГАЛУЗЬ ВИНАХОДУ Винахід, розкритий в даному документі, стосується способів отримання сполук, що використовуються як пестициди (наприклад, акарициди, інсектициди, молюскициди і нематоциди), самих сполук, а також способів застосування вказаних сполук для знищення шкідливих комах. ПЕРЕДУМОВИ ВИНАХОДУ Щорічно причиною мільйонів випадків смертей людей в світі є шкідливі комахи. Більш того, існують більше за тисячу видів шкідливих комах, які викликають втрати в сільському господарстві. Щорічні світові втрати в сільському господарстві оцінюються в мільярди доларів США. Терміти викликають пошкодження всіх видів приватних і суспільних будов. Щорічні світові втрати від пошкоджень, викликаних термітами, оцінюються в мільярди доларів США. Комахи-шкідники складованих продуктів харчування поїдають і псують ці харчові продукти. Щорічні світові втрати харчових продуктів оцінюються в мільярди доларів США, але, що більш важливо, позбавляють людей необхідних продуктів живлення. Існує гостра необхідність в нових пестицидах. У цей час у деяких комах-шкідників розвинулася стійкість до пестицидів. Сотні видів комах-шкідників виробили стійкість до одного або декільком пестицидам. Добре відомим фактом є придбана стійкість до деяких пестицидів, що давно випускаються, таких як ДДТ, карбамати і органофосфати. Однак стійкість виробляється навіть до деяких більш нових пестицидів. Таким чином, з багатьох причин, включаючи вищезгадані, існує потреба в розробці нових пестицидів. ВИЗНАЧЕННЯ Приклади, дані у визначеннях, загалом не є вичерпними і не повинні розглядатися як такі, що обмежують винахід, розкритий в цьому документі. Потрібно врахувати, що замісник повинен відповідати умовам хімічного зв'язування і просторовій сумісності, що пред'являються до структури того конкретної сполуки, до якого він приєднується. "Акарицидна група" вказується під назвою "АКАРИЦИДИ". "AI Група" визначена в тій частині даного документа, яка йде після визначення "гербіцидна група". "Алкеніл" означає ациклічний ненасичений (щонайменше один вуглець-вуглецевий подвійний зв'язок), розгалужений або нерозгалужений замісник, що складається з вуглецю і водню, наприклад, вініл, аліл, бутеніл, пентеніл, гексеніл, гептеніл, октеніл, ноненіл і деценіл. "Алкенілокси" означає алкеніл, що додатково містить вуглець-кисневий одинарний зв'язок, наприклад, алілокси, бутенілокси, пентенілокси, гексенілокси, гептенілокси, октенілокси, ноненілокси і деценілокси. "Алкокси" означає алкіл, що додатково містить вуглець-кисневий одинарний зв'язок, наприклад, метокси, етокси, пропокси, ізопропокси, 1-бутокси, 2-бутокси, ізобутокси, третбутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексокси, гептокси, октокси, нонокси і децокси. "Алкіл" означає ациклічний насичений, розгалужений або нерозгалужений замісник, що складається з вуглецю і водню, наприклад, метил, етил, пропіл, ізопропіл, 1-бутил, 2-бутил, ізобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропіл, гексил, гептил, октил, ноніл і децил. "Алкініл" означає ациклічний ненасичений (щонайменше один вуглець-вуглецевий потрійний зв'язок, і можливі подвійні зв'язки), розгалужений або нерозгалужений замісник, що складається з вуглецю і водню, наприклад, етиніл, пропаргіл, бутиніл, пентиніл, гексиніл, гептиніл, октиніл, нонініл і дециніл. "Алкінілокси" означає алкініл, що додатково містить вуглець-кисневий одинарний зв'язок, наприклад, пентинілокси, гексинілокси, гептинілокси, октинілокси, нонинілокси і децинілокси. "Арил" означає циклічний ароматичний замісник, що складається з водню і вуглецю, наприклад, феніл, нафтил і біфеніл. "Циклоалкеніл" означає моноциклічний або поліциклічний ненасичений (щонайменше один вуглець-вуглецевий подвійний зв'язок) замісник, що складається з вуглецю і водню, наприклад, циклобутеніл, циклопентеніл, циклогексеніл, циклогептеніл, циклооктеніл, циклодеценіл, норборненіл, біцикло[2.2.2]октеніл, тетрагідронафтил, гексагідронафтил і октагідронафтил. 1 UA 107791 C2 5 10 15 20 25 30 "Циклоалкенілокси" означає циклоалкеніл, що додатково містить вуглець-кисневий одинарний зв'язок, наприклад, циклобутенілокси, циклопентенілокси, циклогексенілокси, циклогептенілокси, циклооктенілокси, циклодеценілокси, норборненілокси і біцикло[2.2.2]октенілокси. "Циклоалкіл" означає моноциклічний або поліциклічний насичений замісник, що складається з вуглецю і водню, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборніл, біцикло[2.2.2]октил і декагідронафтил. "Циклоалкокси" означає циклоалкіл, що додатково містить вуглець-кисневий одинарний зв'язок, наприклад, циклопропілокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси, циклооктилокси, циклодецилокси, норборнілокси і біцикло[2.2.2]октилокси. "Циклогалогеналкіл" означає моноциклічний або поліциклічний насичений замісник, що складається з вуглецю, галогену і водню, наприклад, 1-хлорциклопропіл, 1-хлорциклобутил і 1дихлорциклопентил. "Фунгіцидна група" вказується під назвою "ФУНГІЦИДИ". "Галоген" означає фтор, хлор, бром і йод. "Галогеналкіл" означає алкіл, що додатково містить від одного до максимально можливого числа однакових або різних атомів галогену, наприклад, фторметил, дифторметил, трифторметил, 1-фторетил, 2-фторетил, 2,2,2-трифторетил, хлорметил, трихлорметил і 1,1,2,2тетрафторетил. "Гербіцидна група" вказується під назвою "ГЕРБІЦИДИ". "Гетероцикліл" означає циклічний замісник, який може бути повністю насиченим, частково ненасиченим або повністю ненасиченим, де циклічна структура містить щонайменше один атом вуглецю і щонайменше один гетероатом, де вказаний гетероатом являє собою азот, сірку або кисень, наприклад, бензофураніл, бензоізотіазоліл, бензоізоксазоліл, бензоксазоліл, бензотієніл, бензотіазолілциннолініл, фураніл, індазоліл, індоліл, імідазоліл, ізоіндоліл, ізохінолініл, ізотіазоліл, ізоксазоліл, 1,3,4-оксадіазоліл, оксазолініл, оксазоліл, фталазиніл, піразиніл, піразолініл, піразоліл, піридазиніл, піридил, піримідиніл, піроліл, хіназолініл, хінолініл, хіноксалініл, 1,2,3,4-тетразоліл, тіазолініл, тіазоліл, тієніл, 1,2,3-триазиніл, 1,2,4-триазиніл, 1,3,5триазиніл, 1,2,3-триазоліл і 1,2,4-триазоліл. "Інсектицидна група" вказується під назвою "ІНСЕКТИЦИДИ". "Нематоцидна група" вказується під назвою "НЕМАТОЦИДИ". "Синергетична група" вказується під назвою "СИНЕРГЕТИЧНІ СУМІШІ І СИНЕРГЕТИКИ". ДОКЛАДНИЙ ОПИС ВИНАХОДУ У цьому документі описані сполуки, які мають наступну формулу ("формула I"): 35 Формула I 40 45 50 де: (a) X являє собою N або CR8; (b) R1 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, заміщений або незаміщений C1-C20гетероцикліл, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9) 2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний з вказаних R1, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О) nOR9, C6-C20арилу або C1C20гетероциклілу (кожний з них, має замісник, необов'язково може бути заміщений R9); (с) R2 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, 2 UA 107791 C2 5 10 15 20 25 30 35 40 45 50 55 60 заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, заміщений або незаміщений C1-C20гетероцикліл, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9) 2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний з вказаних R2, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О)nOR9, C6-C20арилу або C1C20гетероциклілу (кожний з них, має замісник, необов'язково може бути заміщений R9); (d) R3 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, заміщений або незаміщений C1-C20гетероцикліл, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9) 2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний з вказаних R3, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О)nOR9, C6-C20арилу або C1C20гетероциклілу (кожний з них, має замісник, необов'язково може бути заміщений R9); (е) R4 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, заміщений або незаміщений C1-C20гетероцикліл, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний з вказаних R4, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О)nOR9, C6-C20арилу або C1C20гетероциклілу (кожний з них, має замісник, необов'язково може бути заміщений R9); (f) R5 являє собою Н, заміщений або незаміщений C 1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3C10циклоалкеніл, заміщений або незаміщений C 6-C20арил, заміщений або незаміщений C1C20гетероцикліл, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9) 2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nOR9, R9S(О)nR9, C1-C6алкіл C6-C20арил (де алкіл і арил, незалежно, можуть бути заміщеними або незаміщеними), С(=X2)R9, С(=X1)X2R9, R9 × 2C(=X1)R9, R9 × 2R9, С(=О)(C 1C6алкіл)S(О)n(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)О(C1-C6алкіл), (C1-C6алкіл)OC(=О)(C6C20арил), (C1-C6алкіл)OC(=О)(C1-C6алкіл), C1-C6алкіл-(C3-C10циклогалогеналкіл), або (C1C6алкеніл)С(=О)О(C1-C6алкіл) або R9 × 2C(=X1)X2R9; де кожний з вказаних R5, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О)nOR9, C6-C20арилу або C1C20гетероциклілу, R9 арил (кожний з них, має замісник, необов'язково може бути заміщений R9), необов'язково, R5 і R7 можуть бути сполучені з утворенням циклічної системи, де, необов'язково, така система може мати один або декілька гетероатомів, вибраних з О, S або N, в циклічній структурі, яка зв'язує R5 і R7; (g) R6 являє собою О, S, NR9 або NOR9; (h) R7 являє собою заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3C10циклоалкеніл, заміщений або незаміщений C 6-C20арил, заміщений або незаміщений C1C20гетероцикліл, OR9, OR9S(О) nR9, С(=X1)R9, С(=X1)OR9, R9C(=X1)OR9, R9 × 2C(=X1)R9 × 2R9, С(=X1)N(R9)2, N(R9)2, N(R9)(R9S(О)nR9), N(R9)С(=X1)R9, SR9, S(О)nOR9, R9S(О)nR9, C1C6алкілOC(=О)C1-C6алкіл, OC1-C6алкіл C1-C20гетероцикліл, C1-C6алкілC1-C20гетероцикліл, C1C6алкілS(=N-CN)(C1-C6алкіл), C1-C6алкілS(О)(=N-CN)(C1-C6алкіл), C1-C6алкілS(О)n(C1-C6алкілC1C20гетероцикліл), C1-C6алкілS(О)(=N-CN)(C1-C6алкіл-C1-C20гетероцикліл), C1C6алкілNH(С(=О)OC1-C6алкіл), C1-C6алкілС(=О)OC1-C6алкіл, C1-C6алкіл(C6C20арил)NH(С(=О)OC1-C6алкіл), C1-C6алкіл(S-C1-C6алкіл)NH(С(=О)OC1-C6алкіл), C1-C6алкіл(S 3 UA 107791 C2 5 10 15 20 25 30 35 40 45 50 55 C1-C6алкіл-C6-C20арил)NH(С(=О)OC1-C6алкіл), C1-C6алкіл(NHC(=О)OC1-C6алкілC6C20арил)NH(С(=О)OC1-C6алкіл), C1-C6алкіл(OC1-C6алкілC6-C20арил)NH(С(=О)OC1-C6алкіл), C1C6алкілN(C1-C6алкіл)(С(=О)OC1-C6алкіл), C1-C6алкілNH(C1-C6алкіл), C6-C20арилSC1C6галогеналкіл, C1-C6алкіл-N(C1-C6алкіл)(С(=О)C1-C6алкілC6-C20арил), C1-C6алкілN(C1C6алкіл)(C1-C6алкіл), C1-C6алкілN(C1-C6алкіл)(S(О)nC1-C6алкіл), C1-C6алкілN(C1-C6алкіл)(S(О)nC1C6алкенілC6-C20арил), C1-C6алкілN(C1-C6алкіл)(С(=О)C1-C20гетероцикліл), C1-C6алкілN(C1C6алкіл)(С(=О)OC1-C6алкілC6-C20арил), NH(C1-C6алкілS(О)nC1-C6алкіл), NH(C1-C6алкілS(О)nC6C20арил), C1-C6алкіл(S(О)nC1-C6алкіл)(С(=О)C1-C6алкілS(О)n(C1-C6алкіл) або R9S(О)n(NZ)R9, де кожний з вказаних R7, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О)nOR9, C6-C20арилу або C1C20гетероциклілу (кожний з них, має замісник, необов'язково може бути заміщений R9), С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, =X2, N(R9)2, S(=X2)nR9, R9S(О)nR9, S(О)nN(R9)2; (i) R8 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, заміщений або незаміщений C1-C20гетероцикліл, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nR9, S(О)nOR9 або R9S(О)nR9, де кожний з вказаних R8, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О) nOR9, C6-C20арилу або C1C20гетероциклілу (кожний з них, має замісник, необов'язково може бути заміщений R9); (j) R9 (кожний, незалежно) являє собою Н, CN, заміщений або незаміщений C 1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, заміщений або незаміщений C1-C20гетероцикліл, S(О)nC1-C6алкіл, N(C1-C6алкіл)2, де кожний з вказаних R9, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OC1-C6алкілу, OC1-C6галогеналкілу, S(О)nC1-C6алкілу, S(О)nOC1-C6алкілу, C6-C20арилу або C1-C20гетероциклілу; (k) n дорівнює 0, 1 або 2; (l) X1 являє собою (кожний, незалежно) О або S; (m) X2 являє собою (кожний, незалежно) О, S, =NR9 або =NOR9; і (n) Z являє собою CN, NO2, C1-C6алкіл(R9), С(=X1)N(R9)2. У іншому варіанті здійснення даного винаходу: (a) X являє собою N або CR8; (b) R1 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний з вказаних R1, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О) nOR9 або C6-C20арилу, (кожний з них, має замісник, необов'язково може бути заміщений R9); (с) R2 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний з вказаних R2, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3 4 UA 107791 C2 5 10 15 20 25 30 35 40 45 50 55 C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О) nOR9 або C6-C20арилу, (кожний з них, має замісник, необов'язково може бути заміщений R9); (d) R3 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О) nOR9 або R9S(О)nR9, де кожний з вказаних R3, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О)nOR9 або C6-C20арилу, (кожний з них, має замісник, необов'язково може бути заміщений R9); (е) R4 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний з вказаних R4, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О) nOR9 або C6-C20арилу, (кожний з них, має замісник, необов'язково може бути заміщений R9); (f) R5 являє собою Н, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3C10циклоалкеніл, заміщений або незаміщений C6-C20арил, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О) nOR9, R9S(О)nR9, C1-C6алкіл C6-C20арил (де алкіл і арил, незалежно, може бути заміщеним або незаміщеним), С(=X2)R9, С(=X1)X2R9, R9 × 2C(=X1)R9, R9 × 2R9 або R9 × 2C(=X1)X2R9; де кожний з вказаних R5, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкіл, C2-C6алкеніл, C1-C6галогеналкіл, C2-C6галогеналкеніл, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкіл, C3-C10циклоалкеніл, C3C10галогенциклоалкіл, C3-C10галогенциклоалкеніл, OR9, S(О) nOR9, або C6-C20арил, R9 арил (кожний з них, має замісник, необов'язково може бути заміщений R9) необов'язково, R5 і R7 можуть бути сполучені з утворенням циклічної структури, де, необов'язково, така структура може містити один або декілька гетероатомів, вибраних з О, S або N, в циклічній структурі, що з'єднує R5 і R7; (g) R6 являє собою О, S, NR9 або NOR9; (h) R7 являє собою заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3C10циклоалкеніл, заміщений або незаміщений C6-C20арил, OR9, OR9S(О)nR9, С(=X1)R9, С(=X1)OR9, R9C(=X1)OR9, R9 × 2C(=X1)R9 × 2R9, С(=X1)N(R9) 2, N(R9)2, N(R9)(R9S(О)nR9), N(R9)С(=X1)R9, SR9, S(О)nOR9, R9S(О)nR9 або R9S(О)n(NZ)R9, де кожний з вказаних R7, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О) nOR9 або C6-C20арилу, (кожний з них, має замісник, необов'язково може бути заміщений R9), (i) R8 являє собою Н, F, Cl, Br, I, CN, NO2, заміщений або незаміщений C1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, OR9, С(=X1)R9, С(=X1)OR9, С(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(О) nOR9 або R9S(О)nR9, де кожний з вказаних R8, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OR9, S(О) nOR9 або C6-C20арилу (кожний з них, має замісник, необов'язково може бути заміщений R9); 5 UA 107791 C2 5 10 15 20 25 30 35 40 45 50 55 (j) R9 (кожний, незалежно) являє собою Н, CN, заміщений або незаміщений C 1-C6алкіл, заміщений або незаміщений C2-C6алкеніл, заміщений або незаміщений C1-C6алкокси, заміщений або незаміщений C2-C6алкенілокси, заміщений або незаміщений C3-C10циклоалкіл, заміщений або незаміщений C3-C10циклоалкеніл, заміщений або незаміщений C6-C20арил, де кожний з вказаних R9, який є заміщеним, містить один або декілька замісників, вибраних з F, Cl, Br, I, CN, NO2, C1-C6алкілу, C2-C6алкенілу, C1-C6галогеналкілу, C2-C6галогеналкенілу, C1C6галогеналкілокси, C2-C6галогеналкенілокси, C3-C10циклоалкілу, C3-C10циклоалкенілу, C3C10галогенциклоалкілу, C3-C10галогенциклоалкенілу, OC1-C6алкілу, OC1-C6галогеналкілу, S(О)nOC1-C6алкілу, C6-C20арилу; (k) n дорівнює 0, 1 або 2; (l) X1 являє собою (кожний, незалежно) О або S; (m) X2 являє собою (кожний, незалежно) О, S, =NR9 або =NOR9; і (n) Z являє собою CN, NO2, C1-C6алкіл(R9), С(=X1)N(R9)2. У іншому варіанті здійснення винаходу X являє собою, переважно, CR8. У іншому варіанті здійснення даного винаходу R1 являє собою, переважно, Н, F, Cl або C 1C6алкокси. У іншому варіанті здійснення даного винаходу R1 являє собою, більш переважно, Н, F, Cl або OCH3. У іншому варіанті здійснення даного винаходу R1 являє собою, навіть більш переважно, Н. У іншому варіанті здійснення даного винаходу R2 і R3 являють собою, переважно, Н. У іншому варіанті здійснення даного винаходу R4 являє собою Н, F, Cl, Br, I, CN, C 1-C6алкіл, C1-C6галогеналкіл, C2-C6алкеніл, C6-C20арил, С(=О)О(C1-C6алкіл) або S(C1-C6алкіл). У іншому варіанті здійснення даного винаходу R4 являє собою, переважно, Н, Cl, CF 3, CH3, CH2CH3, CH(CH3)2, SCH3, С(=О)OCH2CH3 або феніл. У іншому варіанті здійснення даного винаходу R4 являє собою, більш переважно, Н, Cl або CH3. У іншому варіанті здійснення даного винаходу R4 являє собою, навіть більш переважно, Cl. У іншому варіанті здійснення даного винаходу R5 являє собою, переважно, С(=О)(C1C6алкіл)S(О)n(C1-C6алкіл), С(=О)(C1-C6алкіл)С(=О)О(C1-C6алкіл), (C1-C6алкіл)OC(=О)(C6C20арил), (C1-C6алкіл)OC(=О)(C1-C6алкіл), C1-C6алкіл-(C3-C10циклогалогеналкіл) або (C1C6алкеніл)С(=О)О(C1-C6алкіл). У іншому варіанті здійснення даного винаходу R5 являє собою, більш переважно, С(=О)CH(CH3)CH2SCH3, С(=О)CH2CH2SCH3, С(=О)CH2CH2C(О)OCH3, С(=О)С(CH3)2CH2SCH3, CH2 °C(=О)-феніл, CH2 °C(=О)CH2CH2CH3, С(=О)CH(CH3)SCH3, CH2(2,2-дифторциклопропіл) або CH2CH=CHC(=О)OCH3. У іншому варіанті здійснення даного винаходу R5 являє собою, переважно, Н, C 1-C6алкіл, C1-C6алкіл-C6-C20арил, C2-C6алкеніл, С(=О)(C1-C6алкіл), (C1-C6алкіл)О(C1-C6алкіл), (C1C6алкіл)О(C1-C6алкіл)(C6-C20арил), С(=О)О(C1-C6алкіл), С(=О)(C2-C6алкеніл), C1C6алкіл(заміщений C6-C20арил), C1-C6галогеналкіл, C1-C6алкіл-(C3-C10циклоалкіл), (C3C10циклоалкіл)О(C1-C6алкіл) або (C1-C6алкіл)S(О)n(C1-C6алкіл). У іншому варіанті здійснення даного винаходу R5 являє собою, більш переважно, Н, CH 3, CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH2-феніл, С(=О)CH(CH3)2, С(=О)OC(CH3)3, С(=О)CH3, CH2OCH3, С(О)CH=CH2, CH2-феніл-OCH3, CH2OCH2-феніл, CH2CH2CH3, CH2CH2F, CH2CH=CH2, CH2CH2OCH3, CH2циклопропіл, CH2CH=CHCH3, циклопропіл-O-CH2CH3, CH2CH2SCH3 або CH2CH2S(О)2CH3. У іншому варіанті здійснення даного винаходу R5 являє собою, навіть більш переважно, Н, CH3, CH2CH3, CH(CH3)2, CH2CH(CH3)2 або CH2CH2CH3. У іншому варіанті здійснення даного винаходу R6 являє собою, переважно, О, S або N(C 1C6алкіл). У іншому варіанті здійснення даного винаходу R6 являє собою, більш переважно, О, S або NCH2CH3. У іншому варіанті здійснення даного винаходу R6 являє собою, навіть більш переважно, О. У іншому варіанті здійснення даного винаходу R7 являє собою фурил. У іншому варіанті здійснення даного винаходу R7 являє собою заміщений фурил, де заміщений фурил містить один або декілька замісників, вибраних з С(=О)C 1-C6алкілу, (C1-C6алкіл)-S(О)n-(C1-C6алкіл), і тетрагідрофурану. У іншому варіанті здійснення даного винаходу R7 являє собою оксазоліл. У іншому варіанті здійснення даного винаходу R7 являє собою заміщений оксазоліл, де заміщений оксазоліл містить один або декілька C1-C6алкілів. 6 UA 107791 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому варіанті здійснення даного винаходу R7 являє собою піперидиніл. У іншому варіанті здійснення даного винаходу R7 являє собою заміщений піперидиніл, де вказаний заміщений піперидиніл містить один або декілька замісників, вибраних з C 1-C6алкілу, С(=О)OC1C6алкілу, С(=S)NH(C3-C10циклоалкіл), С(=О)C1-C6галогеналкілу, С(О)OC1-C6алкілOC1-C6алкілу, S(О)n(C1-C6алкіл) і С(=О)C1-C6алкілу. У іншому варіанті здійснення даного винаходу R7 являє собою піразоліл. У іншому варіанті здійснення даного винаходу R7 являє собою заміщений піразоліл, де вказаний заміщений піразоліл містить один або декілька замісників, вибраних з C 1-C6алкілу, C6-C20арилу, C1C6галогеналкілу і S(О)nN(C1-C6алкіл)2. У іншому варіанті здійснення даного винаходу R7 являє собою піридазиніл. У іншому варіанті здійснення даного винаходу R7 являє собою заміщений піридазиніл, де вказаний заміщений піридазиніл містить один або декілька замісників, вибраних з (=О) і C1-C6алкілу. У іншому варіанті здійснення даного винаходу R7 являє собою піридил. У іншому варіанті здійснення даного винаходу R7 являє собою заміщений піридил, де вказаний заміщений піридил містить один або декілька C1-C6алкілів. У іншому варіанті здійснення даного винаходу R7 являє собою піролідиніл. У іншому варіанті здійснення даного винаходу R7 являє собою заміщений піролідиніл, де вказаний заміщений піролідиніл містить один або декілька С(=О)OC(CH 3)3. У іншому варіанті здійснення даного винаходу R7 являє собою тіазоліл. У іншому варіанті здійснення даного винаходу R7 являє собою заміщений тіазоліл, де вказаний заміщений тіазоліл містить один або декілька замісників, вибраних з C1-C6алкілу і C1-C6галогеналкілу. У іншому варіанті здійснення даного винаходу R7 являє собою тієніл. У іншому варіанті здійснення даного винаходу R7 являє собою, переважно, тетрагідротієніл, тієнілС(=О)(C 1C6алкіл) або тетрагідротієніл-1-оксид. У іншому варіанті здійснення даного винаходу R7 являє собою, більш переважно, тієнілС(=О)CH3. У іншому варіанті здійснення даного винаходу, R7 являє собою C 1-C6алкілOC(=О)C1-C6алкіл, OC1-C6алкілC1-C20гетероцикліл, C1-C6алкілC1-C20гетероцикліл, C1-C6алкілS(=N-CN)(C1-C6алкіл), C1-C6алкілS(О)(=N-CN)(C1-C6алкіл), C1-C6алкілS(О)n(C1-C6алкіл-C1-C20гетероцикліл), C1C6алкілS(О)(=N-CN)(C1-C6алкілC1-C20гетероцикліл), C1-C6алкілNH(С(=О)OC1-C6алкіл), C1C6алкілC(=О)OC1-C6алкіл, C1-C6алкіл(C6-C20арил)NH(С(=О)OC1-C6алкіл), C1-C6алкіл(SC1C6алкіл)NH(С(=О)OC1-C6алкіл), C1-C6алкіл(SC1-C6алкілC6-C20арил)NH(С(=О)OC1-C6алкіл), C1C6алкіл(NHC(=О)OC1-C6алкіл-C6-C20арил)NH(С(=О)OC1-C6алкіл), C1-C6алкіл(O-C1-C6алкілC6C20арил)NH(С(=О)OC1-C6алкіл), C1-C6алкілN(C1-C6алкіл)(С(=О)OC1-C6алкіл), C1-C6алкілNH(C1C6алкіл), C6-C20арилSC1-C6галогеналкіл, C1-C6алкілN(C1-C6алкіл)(С(=О)C1-C6алкілC6-C20арил), C1-C6алкілN(C1-C6алкіл)(C1-C6алкіл), C1-C6алкілN(C1-C6алкіл)(S(О)nC1-C6алкіл), C1-C6алкілN(C1C6алкіл)(S(О)nC1-C6алкенілC6-C20арил), C1-C6алкілN(C1-C6алкіл)(С(=О)C1-C20гетерoарил), C1C6алкілN(C1-C6алкіл)(С(=О)OC1-C6алкілC6-C20арил), NH(C1-C6алкілS(О)nC1-C6алкіл), NH(C1C6алкілS(О)nC6-C20арил) або C1-C6алкіл(S(О)nC1-C6алкіл)(С(=О)C1-C6алкілS(О)n(C1-C6алкіл).) У іншому варіанті здійснення даного винаходу, R7 являє собою, більш переважно, CH(CH3)CH2S(=N-CN)CH3, CH(CH3)CH2S(О)(=N-CN)CH3, CH(CH3)CH2SCH2(хлорпіридил), CH(CH3)CH2S(О)(=N-CN)CH2(хлорпіридил), CH(CH3)NHC(=О)OC(CH3)3, CH2CH2C(=О)OCH3, CH2NHC(=О)OC(CH3)3, CH(CH2-феніл)NHC(=О)OC(CH3)3, CH(CH2CH2SCH3)NHC(=О)OC(CH3)3, CH(CH3)NHC(=О)OC(CH3)3, CH(CH2CH2CH3)NHC(=О)OC(CH3)3, CH(CH2SCH2феніл)NHC(=О)OC(CH3)3, CH(CH2CH2CH2CH2NHC(=О)OCH2-феніл)NHC(=О)OC(CH3)3, CH(CH(CH3)OCH2-феніл)NHC(=О)OC(CH3)3, CH2(CH3)N(CH3)С(=О)OC(CH3)3, CH2(CH3)NH(CH3), феніл-S-CHF2, CH2N(CH3)С(=О)CH(CH3)піразоліл, CH2N(CH3)(S(О)2CH3), CH2N(CH3)(CH3), CH2N(CH3)(S(О)2CH=СН-феніл), CH2N(CH3)(С(=О)тієніл), CH(CH3)N(CH3)(С(О)OCH2-феніл), NHCH2CH2SCH3, NHCH2CH2S(хлорфеніл), CH2тієніл або CH(CH3)CH2(3,5-диметилтриазоліл). У іншому варіанті здійснення даного винаходу R7 являє собою, переважно, C1-C6алкіл, C1C6галогеналкіл, C1-C6алкеніл, О(C1-C6алкіл), (C1-C6алкіл)S(О)n(C1-C6алкіл), (C1-C6алкіл)S(О)n(C1C6алкіл(C6-C20арил)), (C1-C6алкіл)С(=О)О(C1-C6алкіл), Об(C1-C6алкіл)S(О)n(C1-C6алкіл), NH(C1C6алкіл)S(О)n(C1-C6алкіл), N(C1-C6алкіл)(C1-C6алкіл-S(О)nC1-C6алкіл, (C1-C6алкіл)S(О)n(C1C6алкеніл), О(C1-C6галогеналкіл), N(незаміщений C1-C6алкіл)(незаміщений C1-C6алкіл), C1C6алкілS(О)n(C1-C6алкеніл), О(C3-C10циклоалкіл), О(C1-C6алкіл)О(C1-C6алкіл), C1-C6алкіл-(C6C20арил), (незаміщений C1-C6алкіл)S(О)n(незаміщений C6-C20арил), NH(арил), C3-C10циклоалкіл, NH(C1-C6алкіл) або (C6-C20арил)S(О)n(C1-C6алкіл). У іншому варіанті здійснення даного винаходу R7 являє собою, більш переважно, CH 3, CF3, °C(CH3)3, CH(CH3)CH2SCH3, С(CH3)2CH2SCH3, CH2CH2SCH3, CH(CH3)2, С(CH3)3, CH2CF3, CH2CH2C(=О)OCH3, OCH2CH2SCH3, OCH2CH3, CH2CH2S(О)CH3, CH(CH3)CH2S(О)CH3, С(CH3)2CH2S(О)CH3, NHCH2CH2S(О)CH3, N(CH3)(CH2CH2S(О)CH3), OCH2CH2S(О)CH3, 7 UA 107791 C2 5 10 15 20 25 30 35 40 45 50 55 60 С(CH3)2CH2S(О)CH3, CH(CH3)CH2S(О)CH3, CH2CH2S(О)CH3, CH2CH2S(О)2CH3, С(CH3)2CH2S(О)2CH3, CH(CH3)CH2S(О)2CH3, NHCH(CH3)CH2CH3, NHCH2CH2SCH3, N(CH3)CH2CH2SCH3, CH(CH3)CH2SCH2CH=CH2, CH(CH3)CH2SCH2феніл, °C(CH3)2CF3, °C(CH3)2CH2CH2CH3, О(метилциклогексил), °C(CH3)2CH2OCH3, OCH2-феніл, OCH3, CH=CH2, CH2CH2CH2Cl, CH2C(CH3)2SCH3, CH(CH3)CH(CH3)SCH3, циклопропіл-SCH3, CH2CH(CH3)SCH3, CH(CH3)CH2S(О)nCH2CH=CH2, CH(CH3)С(=О)OCH2CH3, CH2CH(CH3)S(О)CH3, °C(CH3)2CH2OCH3, CH2CH2SCH2-феніл, CH2CH2SCH2-феніл, CH2CH2SCH2CH3, CH2CH2SCH(CH3)2, CH(CH3)SCH3, О-циклогексил, OCH(CH3)CH2CH2CH3, OCH(CH3)CF3, OCH2CH2OCH3, NHCH(CH3)2, NHCH2CH2CH3, CH2CH2циклопропіл, CH2циклопропіл, CH2CH2CH=CHCH3, CH2CH2CH=CHCH3, C4F9, NHCH2CH3, SCH2CH2CH2CH3, OCH(CH3)CH2CH2CH3, OCH2CH2CH2CH3, CH2CF3, NHциклопропіл, CH=CH2CH3, CH(CH3)(хлорфеніл), С(CH3)CH2S(О)CH3, С(CH3)CH2SCH3, CH(=CH2)CH2CH3, CH2CH2C(=О)OCH3, CH2SCH2CH3, CH2SCH3, CH2CH2CH2SCH3, OCH2CF3, NH-(хлорфеніл), феніл-S(О)-CH3, CH2C(CH3)2(SCH3), CH(CH3)CHOCH3, CH2CH(CH3)SCH3, CH2CH(CH3)2SCH3, CH2CH2CH2CH3, CH(CH3)CH2CH3, 1-метил-2,2-дихлорциклопропіл, CH(CH2CH3)CH2SCH3, CH(CH2CH3)CH2S(О)CH3 або CH(CH3)CH(CH3)S(О)CH3. У іншому варіанті здійснення даного винаходу R7 являє собою, навіть більш переважно, CH(CH3)CH2SCH3, С(CH3)2CH2SCH3, CH2CH2SCH3, CH(CH3)2, С(CH3)3, CH2CH2S(О)CH3, С(CH3)2CH2S(О)CH3, CH(CH3)CH2S(О)CH3, CH2CH2S(О)2CH3, С(CH3)2CH2S(О)2CH3, CH(CH3)CH2S(О)2CH3, CH(CH3)CH2SCH2CH=CH2, CH2C(CH3)2SCH3, CH(CH3)CH(CH3)SCH3, CH2CH(CH3)SCH3, CH(CH3)CH2S(О)nCH2CH=CH2, CH2CH(CH3)S(О)CH3, CH2CH2SCH2CH3, CH2CH2SCH(CH3)2, CH(CH3)SCH3, CH2SCH2CH3, CH2SCH3, CH2CH2CH2SCH3, CH2CH(CH3)SCH3, CH2CH(CH3)2SCH3, CH(CH2CH3)CH2SCH3, CH(CH2CH3)CH2S(О)CH3 або CH(CH3)CH(CH3)S(О)CH3. У іншому варіанті здійснення даного винаходу R8 являє собою Н, F, Cl, Br, CN, C 1-C6алкіл, C1-C6алкокси, С(=О)О(C1-C6алкіл) або S(О)n(C1-C6алкіл). У іншому варіанті здійснення даного винаходу R8 являє собою, переважно, Н, F, Cl, Br, CN, CH 3, OCH3, S(О)2CH3 або С(=О)OCH2CH3. У іншому варіанті здійснення даного винаходу R8 являє собою, навіть більш переважно, Н або F. У іншому варіанті здійснення даного винаходу: (a) X являє собою CR8; (b) R1 являє собою Н; (с) R2 являє собою Н; (d) R3 являє собою Н; (е) R4 являє собою Cl або CH3; (f) R5 являє собою Н або незаміщений C1-C6алкіл; (g) R6 являє собою О; (h) R7 являє собою (незаміщений C 1-C6алкіл)S(О)n(незаміщений C1-C6алкіл), (незаміщений C1-C6алкіл)S(О)n(незаміщений C1-C6алкеніл), О(незаміщений C1-C6алкіл), (C1-C6алкіл); (i) R8 являє собою Н або F; і (k) n дорівнює 0, 1 або 2. У іншому варіанті здійснення даного винаходу: (a) X являє собою CR8; (b) R1 являє собою Н; (с) R2 являє собою Н; (d) R3 являє собою Н; (е) R4 являє собою Cl; (f) R5 являє собою незаміщений C1-C6алкіл; (g) R6 являє собою О; (h) R7 являє собою (незаміщений C1-C6алкіл)S(О)n(незаміщений C1-C6алкіл); (i) R8 являє собою Н або F; і (k) n дорівнює 0, 1 або 2. Незважаючи на представлені варіанти здійснення винаходу, можливі інші варіанти здійснення винаходу і комбінації вказаних представлених варіантів здійснення винаходу і інших варіантів здійснення винаходу. На наступній схемі проілюстрований підхід до отримання амінотіазолів. На стадії а схеми I, обробка карбонової кислоти формули IIa, такої як нікотинова кислота, де R1, R2, R3 і X мають значення, вказані вище, оксалілхлоридом в присутності каталітичної кількості N, Nдиметилформаміду (ДМФ) в полярному апротонному розчиннику, такому як 1,2-дихлоретан 8 UA 107791 C2 5 10 15 20 25 30 (ДХЕ), дає відповідний хлорангідрид кислоти формули IIb. На стадії b схеми I, комерційно доступна карбонова кислота формули IIa, така як нікотинова кислота, може бути оброблена складним ефіром амінокислоти формули III (R4=Н), таким як гідрохлорид метилового ефіру гліцину, в присутності п-толуолсульфоніл хлориду, каталітичної кількості бензилтриетиламоній хлориду і неорганічної основи, такої як карбонат калію, в розчиннику, такому як хлороформ, з отриманням складного ефіру аміду формули IVa. Альтернативно, складний ефір аміду IVa може бути отриманий таким же чином, як на стадії с схеми I, де хлорангідрид кислоти формули IIb піддають взаємодії зі складним ефіром амінокислоти формули III (R4=Н, CH 3, феніл або ізопропіл), таким як гідрохлорид метилового ефіру гліцину або (±)-аланіну, в присутності основи третинного аміну, такої як триетиламін, і в полярному апротонному розчиннику, такому як ДХЕ або ацетонітрил. На стадії d схеми I і у випадку, коли R3 являє собою галоген і R1, R2, R4 і X мають значення, вказані вище, галоген може бути видалений шляхом відновлення з використанням водню в присутності каталізатора, такого як гідроксид паладію на вуглеці, в полярному протонному розчиннику, такому як метанол, з отриманням сполуки формули IVb, де R3 являє собою H. На стадії е схеми I, взаємодія складного ефіру амідів формули IVa і IVb, де R1, R2, R3, R4 і X мають значення, вказані вище, з аміном, таким як метиламін, в полярному протонному розчиннику, подібним етиловому спирту, дає діаміди формули V, які при обробці пентасульфідом фосфору (стадія g) або реактивом Лавессона (стадія h), можуть приводити до отримання амінотіазолів формули VIIa. У випадку, коли X являє собою CR8 і R4 являє собою Н, діамід формули V при обробці реактивом Лавессона може давати біс-тіоамід формули VI таким же чином, як на стадії i схеми I. Циклізацію з отриманням амінотіазолу формули VIIb здійснюють в дві стадії, шляхом взаємодії біс-тіоаміду формули VI з ангідридом трифтороцтової кислоти, таким же чином, як на стадії j, потім піддають гідролізу гідроксидом натрію в полярному протонному розчиннику, такому як метиловий спирт, таким же чином, як на стадії k схеми I. Альтернативно, циклізацію з отриманням амінотіазолу формули VIIc, де R4=Cl здійснюють в три стадії шляхом взаємодії біс-тіоаміду формули VI з ангідридом трифтороцтової кислоти, таким же чином, як на стадії j, потім хлоруючи хлоруючим агентом, таким як N-хлорсукцинімід, в полярному апротонному розчиннику, такому як ацетонітрил, таким же чином, як на стадії l, і піддаючи гідролізу з карбонатом калію в полярному протонному розчиннику, такому як метиловий спирт, таким же чином, як на стадії m схеми I. Схема I 9 UA 107791 C2 5 10 15 Інший підхід до отримання заміщених амінотіазолів проілюстрований на схемі II. На стадії а складний ефір тіазолу формули Xa утвориться в одну стадію шляхом взаємодії комерційно доступного тіоаміду формули VIIIa, де R1, R2, R3 і X мають значення, вказані вище, з βкетоефіром формули IXa, таким як етиловий ефір 2-хлор-4,4,4-трифтор-3-оксобутанової кислоти, де R4 має значення, вказані вище, в умовах мікрохвильового опромінення в присутності основи, такої як триетиламін, і в розчиннику, такому як етиловий спирт. Омилення складного ефіру може бути здійснено таким же чином, як на стадії b схеми II, використовуючи основу, таку як гідроксид натрію, в розчиннику, такому як водний метиловий спирт, з отриманням кислоти формули XIa. На стадії с схеми II трет-бутилкарбамат (показаний) або іншої карбамат формули XIIa утвориться шляхом взаємодії кислоти формули XIa з дифенілфосфорилазидом (DPPA) і відповідним спиртом при нагріванні. Алкілування карбаматного азоту за допомогою алкілгалогеніду, такого як йодметан, в присутності основи, такої як гідрид натрію, і в полярному апротонному розчиннику, такому як N, N-диметилформамід (ДМФ), може приводити до отримання сполуки формули XIIIa, як показано на стадії d схеми II. Нарешті, на стадії е схеми II видалення захисту у аміну в присутності кислоти, такий як трифтороцтова кислота (ТФО), може давати амінотіазол формули VIId. Схема II 20 25 30 35 Ще один спосіб отримання амінотіазолів полягає в зв'язуванні бажаного амінозахищеного тіазолу і гетероциклу, як показаний на схемі III. На стадії а етиловий ефір 2-галоген-4-заміщеної тіазол-5-карбонової кислоти формули XIVa, де R4 має значення, вказані вище, піддають гідролізу в основних умовах, таких як в присутності гідрату гідроксиду літію, всистемі розчинника, такого як водний тетрагідрофуран (ТГФ), з отриманням відповідної кислоти формули XVa. Сполуки формули XVa перетворюють в ацил азид формули XVIa шляхом взаємодії з дифенілфосфорилазидом, таким же чином, як на стадії b схеми III. На стадії с схеми III перегрупування Курциуса, потім взаємодія отриманого ізоціанату з трет-бутиловим спиртом дає трет-бутилоксикарбоніл (Boc) захищений 5-амінотіазол формули XVIIa, де R4 має значення, вказані вище. Алкілування функціональних груп карбамату за допомогою алкілгалогеніду, такого як йодметан, в присутності основи, такої як гідрид натрію, і в полярному апротонному розчиннику, такому як ДМФ, приводить до отримання алкілкарбамату формули XVIIIa, як показано на стадії d схеми III. На стадії е схеми III сполуки формули XVIIa або XVIIIa, де R4 і R5 мають значення, вказані вище, можуть бути піддані взаємодії в умовах реакції зв'язування Сузукі з борною кислотою формули XIXa, де X, R1, R2 і R3 мають значення, вказані вище, з отриманням гетероциклзв'язаного тіазолу формули XIIIb. У випадку, коли R5 не являє собою Н, 10 UA 107791 C2 5 10 Вос-група може бути видалена в середовищі кислоти, такому як трифтороцтова кислота (ТФО), в апротонному розчиннику, подібному дихлорметану, з отриманням сполуки формули VIIe таким же чином, як на стадії f схеми III. Коли R5 являє собою Н, Вос-група може бути видалена в середовищі кислоти, такому як хлористоводнева кислота в метанолі, з отриманням сполуки формули VIIf таким же чином, як на стадії g схеми III. На стадії h, коли R4 являє собою Н, сполуки формули XVIIIb можуть бути перетворені в сполуки формули XVIIIa, де R4, зокрема, являє собою галоген. Це перетворення може бути здійснене шляхом обробки XVIIIb галогенуючим агентом, таким як N-хлорсукцинімід або N-бромсукцинімід, в полярному апротонному розчиннику, такому як ацетонітрил, з отриманням 4-галоген-тіазолу формули XVIIIa. Схема III 15 20 25 На стадії а схеми IV, сполуки формули XVIIIc, де R4 має значення, вказані вище, і R5 являє собою Н, можуть бути оброблені хлорангідридом кислоти формули XXa, де R6 являє собою О і R7 має значення, вказані вище, в присутності основи, такої як триетиламін, в полярному апротонному розчиннику, такому як дихлоретан (ДХЕ), з отриманням сполуки формули XXI. На стадії b схеми IV група Boc може бути видалена в середовищі кислоти, такому як трифтороцтова кислота, в полярному апротонному розчиннику, такому як дихлорметан (ДХМ), з отриманням сполуки формули XXII. Хлорангідриди кислот, що використовуються тут в реакціях ацилування, є комерційно доступними або можуть бути синтезовані фахівцями в даній області. На стадії с схеми IV сполуки формули XXII можуть бути піддані алкілуванню за допомогою алкілгалогеніду, такого як йодметан, в присутності основи, такої як гідрид натрію або карбонат калію, і в полярному апротонному розчиннику, такому як N, N-диметилформамід (ДМФ), з отриманням алкілованої сполуки формули XXIII. На стадії d схеми IV, сполуки формули XXII або XXIII, де R4, R5, R6 і R7 мають значення, вказані вище, можуть бути піддані взаємодії в умовах реакції зв'язування Сузукі з борною кислотою формули XIXb, де X, R1, R2 і R3 мають значення, вказані вище, з отриманням гетероцикл-зв'язаного тіазолу формули Ia. 30 11 UA 107791 C2 Схема IV 5 На стадії а схеми V, сполуки формули VIIa-k, де X, R1, R2, R3, R4 і R5 мають значення, вказані вище, можуть бути оброблені хлорангідридом кислоти формули XXb, де R6 являє собою О і R7 має значення, вказані вище, в присутності основи, такої як триетиламін, в полярному апротонному розчиннику, такому як дихлоретан (ДХЕ), з отриманням сполуки формули Ib. Схема V 10 15 На стадії а схеми VI сечовини і карбамати отримують виходячи з амінотіазолів формули VIIa-k. Сполуки формули VIIa-k, де X, R1, R2, R3, R4 і R5 мають значення, вказані вище, піддають взаємодії з фосгеном з отриманням проміжного карбамоїлхлориду. На стадіях b і с схеми VI карбамоїлхлорид обробляють аміном або спиртом, відповідно, з отриманням сечовини формули Ic або карбамату формули Id, відповідно. Алкілування азоту сечовини в сполуці формули Ic за допомогою алкілгалогеніду, такого як йодметан, в присутності основи, такої як гідрид натрію, і в полярному апротонному розчиннику, такому як N, N-диметилформамід (ДМФ), приводить до отримання сполуки формули Ie, як показано на стадії d схеми VI. 20 12 UA 107791 C2 Схема VI 5 10 Окиснення сульфіду до сульфоксиду або сульфону здійснюють, як показано на схемі VII, де (~) може бути будь-яким числом атомів і зв'язків, як указано вище, входить в об'єм даного винаходу. Сульфід формули If, де X, R1, R2, R3, R4 і R5 мають значення, вказані вище, обробляють окислювачем, таким як тетрагідрат перборату натрію, в полярному протонному розчиннику, такому як крижана оцтова кислота, з отриманням сульфоксиду формули Ig таким же чином, як на стадії а схеми VII. Сульфоксид формули Ig може бути потім окислений до сульфону формули Ih за допомогою тетрагідрату перборату натрію в полярному протонному розчиннику, такому як крижана оцтова кислота, таким же чином, як на стадії b схеми VII. Альтернативно, сульфон формули Ih може бути синтезований одностадійним способом, виходячи з сульфіду формули If із застосуванням вищезгаданих умов з >2 еквівалентами тетрагідрату перборату натрію, таким же чином, як на стадії с схеми VII. 15 Схема VII 13 UA 107791 C2 5 10 На стадії а схеми VIII, сполуки формули XIIb, де X, R1, R2, R3 і R4 мають значення, вказані вище, можуть бути оброблені хлорангідридом кислоти формули XXc, де R6 являє собою О і R7 має значення, вказані вище, в присутності основи, такої як триетиламін, в полярному апротонному розчиннику, такому як дихлоретан (ДХЕ), з отриманням сполуки формули XXIV. На стадії b схеми VIII група Boc в XXIV може бути видалена в середовищі кислоти, такому як трифтороцтова кислота (ТФО), в полярному апротонному розчиннику, такому як дихлорметан, з отриманням сполуки формули Ii. Алкілування функціональних аміногруп за допомогою алкілгалогеніду, такого як хлорметиловий ефір бензойної кислоти, в присутності основи, такої як гідрид натрію, і в полярному апротонному розчиннику, такому як N, N-диметилформамід (ДМФ), приводить до отримання алкіламіду формули Ij, як показано на стадії сі схеми VIII. Схема VIII 15 20 25 На стадії а схеми IX сполуки формули XIIIc, де X, R1, R2, R3 і R5 мають значення, вказані вище, можуть бути оброблені електрофільним джерелом галогенів, таким як N-бромсукцинімід або N-йодсукцинімід, в полярному апротонному розчиннику, такому як ацетонітрил, з отриманням сполуки формули XIIId, де значення R4 обмежені галогенами. Каталізовані паладієм реакції поперечного зв'язування, такі як конденсація Стілля (Stille), сполук формули XIIId можуть бути здійснені таким же чином, як на стадії b, використовуючи паладієвий каталізатор, такий як біс(трифенілфосфін)паладій(II)хлорид, в полярному апротонному розчиннику, такому як діоксан, з отриманням карбаматів формули XXV. Крім того, сполуки формули XIIIe, де R4 являє собою ціано групу, можуть бути отримані обробкою сполуки формули XIIId за допомогою CuCN в розчиннику, такому як N, N-диметилформамід (ДМФ), при відповідній температурі таким же чином, як на стадії с. Схема IX 14 UA 107791 C2 5 10 15 20 На стадії а схеми X сполуки формули XVIIb, де R4 являє собою Н, може бути оброблено ВОС-ангідридом в присутності основи, такої як триетиламін, в полярному апротонному розчиннику, такому як тетрагідрофуран (ТГФ), з отриманням сполуки формули XXV. Потім, таким же чином, як на стадії b, сполуки формули XXV можуть бути піддані взаємодії в умовах реакції зв'язування Сузукі з борною кислотою формули XIXc, де X, R1, R2, R3 і R4 мають значення, вказані вище, з отриманням гетероцикл-зв'язаного тіазолу формули XXVI. На стадії с сполуки формули XXVI можуть бути оброблені електрофільним джерелом галогенів, таким як Selectfluor™, в суміші полярних апротонних розчинників, таких як ацетонітрил і N, Nдиметилформамід (ДМФ), з отриманням сполуки формули XXVII, де значення R4 обмежені галогенами. Нарешті, одна з груп BOC може бути видалена в середовищі кислоти, такому як трифтороцтова кислота (ТФО), в полярному апротонному розчиннику, такому як дихлорметан (ДХМ), з отриманням сполуки формули XIIc таким же чином, як на стадії d схеми X, де R1, R2, R3 і R4 мають значення, вказані вище. Схема X Окиснення сульфіду до сульфоксіміну здійснюють, як показано на схемі XI. Сульфід формули Ik, де X, R1, R2, R3, R4 і R5 мають значення, вказані вище, окисляють таким же чином, як на стадії a, йодбензолдіацетатом в присутності ціанаміду в полярному апротонному розчиннику, такому як метиленхлорид (ДХМ), з отриманням сульфіліміну формули Im. Сульфілімін формули Im може бути далі окислений до сульфоксіміну формули In з mCPBA в присутності основи, такої як карбонат калію, в системі протонних полярних розчинників, таких як етанол і вода, таким же чином, як на стадії b схеми XI. 25 15 UA 107791 C2 Схема XI 5 10 На стадії а схеми XII, сполуки формули VIIIb, де X, R1, R2 і R3 мають значення, вказані вище, можуть бути оброблені етилбромпіруватом в полярному протонному розчиннику, такому як етанол, з отриманням сполуки формули XXVIII. На стадії b схеми XII, 5-бромтіазол формули XXIX утворюється шляхом взаємодії тіазолового ефіру формули XXVIII з основою, такою як калій біс(триметилсиліл)амід і N-бромсукцинімід, в полярному апротонному розчиннику, такому як ТГФ. На стадії с, бром замінює на азид натрію всистемі розчинника, такого як N, Nдиметилформамід (ДМФ)/H2O. Отриманий азид термічно відновлюють (75 °C) з отриманням 5амінотіазолу формули XXX, як показано на схемі XII. Схема XII 15 На стадії а схеми XIII, тіоамід Iq отримують виходячи з аміду формули Ip. Сполуки формули Ip, де X, R1, R2, R3, R4, R5 і R7 мають значення, вказані вище, піддають взаємодії в умовах мікрохвильового опромінення з реактивом Лавессона в розчиннику, такому як діоксан, з отриманням тіоаміду формули Iq, як показано на схемі XIII. 20 16 UA 107791 C2 Схема XIII 5 На стадії а схеми XIV, сполуки формули VIIg, де X, R1, R2, R3, R4, і R5 мають значення, вказані вище, можуть бути оброблені заміщеними ізотіоціанатами формули XXXI, де R9 має значення, вказані вище, в киплячому діоксані з отриманням сполук формули Ir. На стадії b схеми XIV, S-алкілування псевдотіосечовини формули Is можуть бути утворені шляхом обробки тіосечовин формули Ir алкілуючими агентами в киплячому етанолі в основних умовах, де кожний R9 може бути однаковим або різним. 10 Схема XIV 15 20 25 На стадії а схеми XV, сполуки формули XXXV, де R4 має значення, вказані вище, може бути піддано взаємодії в умовах реакції зв'язування Сузукі з борною кислотою формули XIXd, де R1, R2, R3 і X мають значення, вказані раніше, з отриманням гетероцикл-зв'язаного тіазолу формули XXII. На стадії b схеми XV, сполуки формули XXXII, де R1, R2, R3, R4 і X мають значення, вказані раніше, можуть бути перетворені в сполуки формули XXXIIIa, де R1, R2, R3, R4 і X мають значення, вказані вище, шляхом обробки нітруючим агентом, таким як суміш киплячої азотної кислоти і концентрованої сірчаної кислоти, при відповідній температурі. На стадії с сполуки формули XXXIIIa, де R1, R2, R3 і X мають значення, вказані раніше, і R4 являє собою групу, що видаляється, таку як хлор, можуть бути оброблені нуклеофілом, таким як тіометоксид натрію, з отриманням сполуки формули XXXIIIb, де R1, R2, R3 і X мають значення, вказані раніше, і R4 являє собою тіоалкіл. На стадії d, сполуки формули XXXIIIb можуть бути перетворені в сполуки формули VIIh, де R1, R2, R3, R4 і X мають значення, вказані раніше, і R5 являє собою Н, шляхом обробки молекулярним воднем в присутності каталізатора, такого як Pd на С, і кислоти, такої як оцтова кислота, в розчиннику, такому як етилацетат. 17 UA 107791 C2 Схема XV 5 На стадії а схеми XVI, сполуки формули VIIi, де X, R1, R2, R3, R4 і R5 мають значення, вказані вище, можуть бути оброблені кислотою формули XXXIV, де R6 являє собою О і R7 має значення, вказані вище, в присутності зв'язувального агента, такого як гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодііміду (EDC·HCl), і основи, такої як N, N-диметиламінопіридин (DMAP), в полярному апротонному розчиннику, такому як дихлоретан (ДХЕ), з отриманням сполуки формули It. 10 Схема XVI 15 20 Інший підхід до отримання заміщених амінотіазолів проілюстрований на схемі XVII. На стадії а складний ефір тіазолу формули Xb утвориться в одну стадію шляхом взаємодії комерційно доступного тіоаміду формули VIIIb, де R1, R2, R3 і X мають значення, вказані вище, з βкетоефіром формули IXb, таким як етил 2-хлор-3-оксобутаноат, де R4 має значення, вказані вище, і нагріванням при температурі 70-80 °C в розчиннику, такому як етиловий спирт. Омилення складного ефіру може бути здійснено таким же чином, як на стадії b схеми XVII, використовуючи основу, таку як гідроксид літію, в розчиннику, такому як тетрагідрофуран (ТГФ), з отриманням кислоти формули XIb. На стадії с схеми XVII, трет-бутилкарбамат формули XIIc утвориться шляхом взаємодії кислоти формули XIb з хлоруючим агентом, таким як тіонілхлорид, з отриманням хлорангідриду кислоти, обробкою хлорангідриду кислоти азидом 18 UA 107791 C2 5 натрію в двофазному розчині, такому як розчин дихлоретану (ДХЕ) і води, з отриманням азида кислоти, і потім нагріванням азиду кислоти в трет-бутанолі як розчинник. Алкілування карбаматного азоту за допомогою алкілгалогеніду, такого як йодметан, в присутності основи, такої як гідрид натрію, і в полярному апротонному розчиннику, такому як N, N-диметилформамід (ДМФ), може приводити до отримання сполуки формули XIIIf, як показано на стадії d схеми XVII. Нарешті, на стадії е схеми XVII, видалення захисту у аміну в присутності кислоти, такий як 4M HCl в діоксані, дає амінотіазол у вигляді HCl солі як показано формулою VIIj. Схема XVII 10 15 20 25 Інший підхід до отримання амінотіазолів полягає в зв'язуванні бажаного амінозахищеного тіазолу і гетероциклу, як показаний на схемі XVIII. На стадії а етиловий ефір 2-галоген-4заміщеної тіазол-5-карбонової кислоти формули XIVb, де R4 має значення, вказані вище, піддають гідролізу в середовищі основи, такої як гідрат гідроксиду літію, в системі розчинника, такого як водний тетрагідрофуран (ТГФ), з отриманням відповідної кислоти формули XVb. Сполуки формули XVb перетворюють в трет-бутилкарбамат формули XVIIc шляхом взаємодії з дифенілфосфорилазидом в трет-бутанолі як розчиннику в присутності основи, такої як триетиламін, таким же чином, як на стадії b схеми XVIII. Алкілування функціональних груп карбамату за допомогою алкілгалогеніду, такого як йодметан, в присутності основи, такої як гідрид натрію, і в полярному апротонному розчиннику, такому як N, N-диметилформамід (ДМФ), приводить до отримання алкіл карбамату формули XVIIId, як показано на стадії с схеми XVIII. На стадії d схеми XVIII сполуки формули XVIIc або XVIIId, де R4 і R5 мають значення, вказані вище, можуть бути піддані взаємодії в умовах реакції зв'язування Сузукі з борною кислотою формули XIXe, де X, R1, R2 і R3 мають значення, вказані вище, з отриманням гетероциклзв'язаного тіазолу формули XIIIg. У випадку, коли R5 має значення, вказані вище, Вос-група може бути видалена в середовищі кислоти, такому як 4M HCl, в діоксані з отриманням сполуки формули VIIk таким же чином, як на стадії е схеми XVIII. 30 19 UA 107791 C2 Схема XVIII 5 10 15 20 На стадії а схеми XIX сполуки формули VIIa-k, де X, R1, R2, R3, R4 і R5 мають значення, вказані вище, можуть бути оброблені хлорангідридом кислоти формули XXd, де R6 являє собою О і R7 має значення, вказані вище, в присутності каталізатора, такого як N, Nдиметиламінопіридин (DMAP), і основи, такої як піридин, в полярному апротонному розчиннику, такому як дихлорметан (ДХМ), з отриманням сполуки формули Iv. Схема XIX На стадії а схеми XX, сполуки формули XXXVI можуть бути оброблені електрофільним джерелом галогенів, таким як N-хлорсукцинімід, в полярному апротонному розчиннику, такому як ацетонітрил, з отриманням сполуки формули XXXVII. Вос-група в сполуці формули XXXVII може бути видалена в середовищі кислоти, такому як трифтороцтова кислота (ТФО), в полярному апротонному розчиннику, такому як дихлорметан, таким же чином, як на стадії b з отриманням сполуки формули XXXVIII. На стадії с сполуки формули XXXVIII можуть бути оброблені 3-метилсульфанілпропіонілхлоридом в присутності основи, такої як N, Nдиметиламінопіридин, в полярному апротонному розчиннику, такому як дихлоретан (ДХЕ), з отриманням сполуки формули XXXIX. На стадії d сполуки формули XXXVIII можуть бути оброблені 2-метил-3-метилсульфанілпропіонілхлоридом в присутності основи, такої як N, Nдиметиламінопіридин, в полярному апротонному розчиннику, такому як дихлоретан (ДХЕ), з отриманням сполуки формули XXXX. 25 20 UA 107791 C2 Схема XX 5 10 15 На стадії а схеми XXI, сполуки формули XXXI можуть бути оброблені електрофільним джерелом галогенів, таким як N-хлорсукцинімід, в полярному апротонному розчиннику, такому як ацетонітрил, з отриманням сполуки формули XXXXII. Група Boc в сполуках формули XXXXII може бути видалена в середовищі кислоти, такому як трифтороцтова кислота (ТФО), в полярному апротонному розчиннику, такому як дихлорметан (ДХМ), таким же чином, як на стадії b, з отриманням сполуки формули XXXXIII. На стадії с сполуки формули XXXXIII можуть бути оброблені 3-метилсульфанілпропіонілхлоридом в присутності основи, такої як N, Nдиметиламінопіридин, в полярному апротонному розчиннику, такому як дихлоретан (ДХЕ), з отриманням сполуки формули XXXXIV. На стадії d сполуки формули XXXXIII можуть бути оброблені 2-метил-3-метилсульфанілпропіонілхлоридом в присутності основи, такої як N, Nдиметиламінопіридин, в полярному апротонному розчиннику, такому як дихлоретан (ДХЕ), з отриманням сполуки формули XXXXV. Схема XXI 20 ПРИКЛАДИ 21 UA 107791 C2 5 10 15 20 25 30 35 40 Приклади представлені в ілюстративних цілях і не повинні розглядатися як такі, що обмежують винахід, розкритий в даному документі, тільки варіантами здійснення, описаними в цих прикладах. Вихідні продукти, реагенти і розчинники, які були отримані з комерційних джерел, використовувалися без додаткового очищення. Безводні розчинники постачалися фірмою Aldrich під торговою маркою Sure/Seal™ і використовувалися в тому вигляді, як отримані. Точки плавлення визначали на капілярному апараті по визначенню точок плавлення фірми Thomas Hoover Unimelt або за допомогою системи автоматичного визначення точок плавлення OptiMelt фірми Stanford Research Systems і не коректувалися. Сполуки подані під їх відомими найменуваннями, даними відповідно до програм найменувань ISIS Draw, ChemDraw або ACD Name Pro. Якщо такі програми не дозволяють назвати сполуку, сполуку називають, використовуючи загальновідомі правила номенклатури. Всі дані ЯМР представлені в м. ч. (δ) і визначалися при 300, 400 або 600 МГц, якщо не указано іншого. Приклад 1: Отримання метилового ефіру [(піридин-3-карбоніл)аміно]оцтової кислоти Спосіб А Крижану суспензію гідрохлоридної солі нікотиноїлхлориду (5 грам (г), 28 мілімолів (ммоль)) в дихлоретані (ДХЕ, 150 мілілітрів (мл)) обробляли гідрохлоридом метилового ефіру гліцину (3,7 г, 29 ммоль) порціями, потім по краплях додавали триетиламін (Et3N, 15,6 мл, 0,111 молів (моль)) за допомогою шприца. Реакційній суміші давали досягнути кімнатної температури в атмосфері азоту протягом 14 годин (год.), промивали водою (2×100 мл), насиченим сольовим розчином (100 мл), сушили над сульфатом магнію (MgSO4) і очищали за допомогою хроматографії на силікагелі (градієнт етилацетат/гексан) з отриманням твердого продукту оранжевого кольору (1,8 г, 33 %). Водні промивки сирої реакційної суміші насичували хлоридом натрію (NaCl), екстрагували дихлорметаном (CH2Cl2) і очищали за допомогою хроматографії на силікагелі (градієнт етилацетат/гексан) з отриманням твердого продукту жовтого кольору (1,6 г, 1 29 %; загальний вихід 3,4 г, 62 %): т. пл. 66-68 °C; H ЯМР (300 МГц, CDCl3) δ 9,04 (д, J=2,2 Гц, 1H), 8,76 (дд, J=4,8, 1,5 Гц, 1H), 8,15 (дт, J=8,1, 1,8 Гц, 1H), 7,42 (дд, J=8,1, 4,8 Гц, 1H), 6,84 (ушир.с, 1H), 4,28 (д, J=5,2 Гц, 2H), 3,82 (с, 3H); ESIMS m/z 195 (M+1). Спосіб В Суміш нікотинової кислоти (10 г, 81 ммоль), п-толуолсульфонілхлориду (17 г, 89 ммоль), бензилтриетиламоній хлориду (1,85 г, 8,1 ммоль) і карбонату калію (K 2CO3, 44,9 г, 320 ммоль) в хлороформі (CHCl3, 500 мл) перемішували за допомогою механічної мішалки при температурі 40 °C протягом 1 год. Потім додавали гідрохлорид метилового ефіру гліцину (10,2 г, 81 ммоль) і K2CO3 (11,2 г, 80 ммоль) і перемішували при температурі 50 °C протягом 90 хвилин (хв.). Реакційну суміш фільтрували через целіт® і фільтрат концентрували при зниженому тиску. Сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (2 % метанол/етилацетат) з отриманням бажаного продукту у вигляді смоли оранжевого кольору, яка 1 твердне при стоянні при кімнатній температурі (4,7 г, 30 %): H ЯМР (400 МГц, CDCl3) δ 9,04 (д, J=2,2 Гц, 1H), 8,76 (дд, J=4,8, 1,5 Гц, 1H), 8,15 (дт, J=8,1, 1,8 Гц, 1H), 7,42 (дд, J=8,1, 4,8 Гц, 1H), 6,84 (ушир.с, 1H), 4,28 (д, J=5,2 Гц, 2H), 3,87 (с, 3H); ESIMS m/z 195 (M+1). Приклад 2: Отримання метилового ефіру 2-[(піридин-3-карбоніл)аміно]пропіонової кислоти 45 50 Гідрохлоридну сіль метилового ефіру (±)-аланіну (35,2 г, 280 ммоль) і Et3N (58,5 мл, 420 ммоль) послідовно додавали до перемішуваного розчину нікотиноїлхлориду (19,8 г, 140 ммоль) в ацетонітрилі (800 мл) і перемішували при кімнатній температурі протягом 10 хв. і потім при 80 °C протягом 2 год. Реакційну суміш виливали в ділильну лійку, що містить насичений сольовий розчин і етилацетат. Двофазну суміш розділяли, і органічний шар промивали один раз 22 UA 107791 C2 5 насиченим сольовим розчином, сушили над MgSO 4, фільтрували і упарювали досуха. Сирий продукт розтирали в суміші 80 % етилацетат/гексан протягом ночі при кімнатній температурі. Тверді продукти видаляли за допомогою фільтрації через целіт® і фільтрат концентрували у вакуумі з отриманням бажаного продукту у вигляді прозорого масла коричневого кольору (20 г, 1 69 %): H ЯМР (300 МГц, CDCl3) δ 9,04 (д, J=2,2 Гц, 1H), 8,75 (дд, J=4,9, 1,4 Гц, 1H), 8,13 (дт, J=7,7, 1,9 Гц, 1H), 7,40 (дд, J=8,0, 4,9 Гц, 1H), 6,92 (ушир.с, 1H), 4,82 (м, 1H), 3,81 (с, 3H), 1,55 (д, J=7,1 Гц, 3H); ESIMS m/z 209 (M+1), m/z 207 (M-1). Приклад 3: Отримання метилового ефіру [(2-хлор-5-фторпіридин-3-карбоніл) аміно]оцтової кислоти 10 15 20 25 30 35 40 45 До розчину 2-хлор-5-фторнікотинової кислоти (21,9 г, 124 ммоль) в ДХЕ (300 мл) додавали оксалілхлорид (21,5 мл, 249 ммоль) і потім краплю N, N-диметилформаміду (ДМФ). Після того, як інтенсивне виділення пухирців сповільнювалося (близько 5 хв.), реакційну суміш нагрівали при 65 °C протягом 1 год. Реакційні розчинники видаляли у вакуумі з отриманням хлорангідриду кислоти у вигляді масла жовтого кольору, яке напряму використовували на наступній стадії. Свіжоприготований хлорангідрид кислоти розчиняли в 1,4-діоксані (300 мл) і розчин охолоджували до температури 0 °C на крижаній бані. Додавали гідрохлорид метилового ефіру гліцину (16,3 г, 130 ммоль) і потім Et3N (50 мл, 370 ммоль). Після перемішування протягом 10 хв. розчину давали нагрітися до температури навколишнього середовища і потім кип'ятили із зворотним холодильником протягом 1,5 год. LC-MS аналіз погашених аліквот (вода/етилацетат) показував неповне перетворення бажаного продукту, тому додавали додаткову кількість гідрохлориду метилового ефіру гліцину (15 г, 130 ммоль), Et 3N (20 мл, 143 ммоль) і 1,4-діоксану (200 мл), і реакційну суміш нагрівали при кипінні протягом ночі. LC-MS аналіз придушених аліквот (вода/етилацетат) показував відсутність вихідних продуктів і наявність 74 % бажаного продукту. Реакційну суміш охолоджували і потім вміщували в ділильну лійку, що містить воду і етилацетат. Після розділення шарів, органічний шар промивали водою і насиченим сольовим розчином. У вихідний водний шар додавали сіль і потім етилацетат. Після розділення органічний шар промивали водою і насиченим сольовим розчином. Об'єднані органічні шари сушили над MgSO4, фільтрували і упарювали у вакуумі. Сирий продукт очищали за допомогою хроматографії на силікагелі (від 40 % до 70 % етилацетат/гексан) з отриманням масла 1 коричневого кольору (20,5 г, 67 %): H ЯМР (300 МГц, CDCl3) δ 8,36 (д, J=3,0 Гц, 1H), 7,92 (дд, J=7,7, 3,0 Гц, 1H), 7,32 (ушир.с, 1H), 4,27 (д, J=5,2 Гц, 2H), 3,82 (с, 3H); ESIMS m/z 247 (M+1), m/z 245 (M-1). Приклад 4: Отримання метилового ефіру [(5-фторпіридин-3-карбоніл) аміно]оцтової кислоти До розчину метилового ефіру [(2-хлор-5-фторпіридин-3-карбоніл)аміно]оцтової кислоти (4,65 г, 18,9 ммоль) в метанолі (200 мл) в апараті Парра додавали Et3N (3,15 мл, 22,6 ммоль) і гідроксид паладію на вуглеці (1,5 г, 20 мас. % Pd, вологість 60 %). Повітря з посудини відкачували і потім вміщували в атмосферу водню (початковий тиск 42 фунт/кв. дюйм). Через 5 хв. тиск водню був 14 фунт/кв. дюйм. Каталізатор видаляли шляхом фільтрації з підсосом через целіт® і потім фільтрат концентрували. Очищення за допомогою хроматографії на силікагелі (від 0 до 100 % етилацетат/гексан) давало твердий продукт світло-жовтого кольору (3,83 г, 1 95 %): т. пл. 80-82 °C; H ЯМР (300 МГц, CDCl3) δ 8,84 (с, 1H), 8,62 (д, J=2,7 Гц, 1H), 7,87 (м, 1H), 7,00 (ушир.с, 1H), 4,27 (д, J=5,3 Гц, 2H), 3,82 (с, 3H); ESIMS m/z 213 (M+1). Приклад 5: Отримання N-метилкарбамоїлметилнікотинаміду 50 23 UA 107791 C2 5 10 15 20 Суспензію метилового ефіру [(піридин-3-карбоніл)аміно]оцтової кислоти (1,5 г, 7,7 ммоль) і метиламіну (33 мас. % в абсолютному етанолі, 3,86 мл, 38,6 ммоль) в етанолі (8 мл) нагрівали при температурі 55 °C в апараті Парра протягом 6 год. Суміш охолоджували і потім упарювали при зниженому тиску з отриманням продукту у вигляді райдужних пластинок бежевого кольору 1 (1,41 г, 94 %): H ЯМР (300 МГц, ДМСО-d6) δ 9,05 (д, J=2,2 Гц, 1H), 9,00 (т, J=5,8 Гц, 1H), 8,77 (д, J=4,0 Гц, 1H), 8,23 (ушир.д, J=8,1 Гц, 1H), 7,90 (кв, J=4,1 Гц, 1H), 7,53 (дд, J=7,7, 4,7 Гц, 1H), 3,86 -1 (д, J=5,8 Гц, 2H), 2,61 (д, J=4,4 Гц, 3H); ІЧ (KBr) 3314, 1641 см ; ESIMS m/z 194 (M+1). Приклад 6: Отримання N-(1-метилкарбамоїлетил)нікотинаміду До розчину метилового ефіру 2-[(піридин-3-карбоніл)аміно]пропіонової кислоти (10,4 г, 50 ммоль) в етанолі (50 мл) додавали метиламін (24 г, 33 мас. % розчин в етанолі, 250 ммоль). Реакційну суміш нагрівали при температурі 55 °C протягом 45 хв. Розчинники видаляли у вакуумі і залишок перекристалізовували з гарячої суміші етилацетату і гексану. Отриманим таким чином кристали жовтого кольору промивали холодним етилацетатом і сушили з 1 отриманням бажаного продукту (5,2 г, 50 %): H ЯМР (300 МГц, ДМСО-d6) δ 9,05 (ушир.с, 1H), 8,77-8,70 (м, 2H), 8,24 (м, 2H), 7,89 (ушир.с, 1H), 7,50 (м, 1H), 2,59 (д, J=4,7 Гц, 3H), 1,33 (д, J=7,4 Гц, 3H); ESIMS m/z 208,1 (M+1), m/z 206,1 (M-1). Приклад 7: Отримання 5-фтор-N-метилкарбамоїлметилнікотинаміду 25 30 35 40 До розчину метилового ефіру [(5-фторпіридин-3-карбоніл)аміно]оцтової кислоти (2,96 г, 14,0 ммоль) в етанолі (15 мл) додавали метиламін (1,5 г, 33 мас. % розчин в етанолі, 70 ммоль). Даний прозорий розчин потім негайно вміщували в колбонагрівник при 55 °C протягом 10 хв., при цій температурі продукт виділявся у вигляді осаду з розчину. Суміш фільтрували у вакуумі і осад промивали етанолом. Фільтрат концентрували і перекристалізовували з гарячого етанолу. Даний спосіб повторювали знову з отриманням крихкого твердого продукту білого кольору (2,11 1 г, 72 %): т. пл. 201-202 °C; H ЯМР (300 МГц, ДМСО-d6) δ 9,10 (м, 1H), 8,93 (с, 1H), 8,76 (д, J=2,5 Гц, 1H), 8,10 (м, 1H), 7,95 (ушир.с, 1H), 3,86 (д, J=5,8 Гц, 2H), 2,61 (д, J=4,4 Гц, 3H); ESIMS m/z 212 (M+1), m/z 210 (M-1). Приклад 8: Отримання метил(2-піридин-3-ілтіазол-5-іл)аміну Суспензію пентасульфіду фосфору (1,73 г, 7,8 ммоль) і Nметилкарбамоїлметилнікотинаміду (1 г, 5 ммоль) в сухому толуолі (10 мл) перемішували при кипінні в атмосфері азоту протягом 16 год. Суміш охолоджували до кімнатної температури і потім додавали сухий піридин (4 мл). Суміш перемішували при кипінні в атмосфері азоту протягом 8 год., потім охолоджували до кімнатної температури і органічний шар видаляли. Залишок темного кольору обробляли гарячим насиченим розчином бікарбонату натрію (Na 2CO3, 24 UA 107791 C2 5 40 мл) і водний шар екстрагували етилацетатом (2×50 мл). Об'єднані органічні екстракти промивали насиченим сольовим розчином (50 мл), сушили над сульфатом магнію (MgSO 4) і очищали за допомогою хроматографії на силікагелі (1 % метанол в дихлорметані) з отриманням 1 аморфного твердого продукту коричневого кольору (0,22 г, 22 %): т. пл. 141-146 °C; H ЯМР (300 МГц, CDCl3) δ 8,97 (д, J=2,4 Гц, 1H), 8,53 (дд, J=5,0, 1,8 Гц, 1H), 8,06 (ддд, J=7,2, 3,3, 0,6 Гц, 1H), 7,31 (ддд, J=5,5, 4,7, 0,5 Гц, 1H), 6,96 (с, 1H), 2,97 (д, J=5,0 Гц, 3H); ESIMS m/z 192 (M+1). Приклад 9: Отримання метил(4-метил-2-піридин-3-ілтіазол-5-іл)аміну 10 15 20 У 10 мл-ову посудину для мікрохвильової печі, яка містить ДХЕ (5 мл), додавали N-(1метилкарбамоїлетил)нікотинамід (207 мг, 1,0 ммоль), потім реактив Лавессона (Lawesson) (2,4біс-(4-метоксифеніл)-1,3-дитіа-2,4-дифосфетан 2,4-дисульфід, 404 мг, 1,0 ммоль), однією порцією. Гетерогенну суміш нагрівали в мікрохвильовій печі протягом 5 хв. при температурі 130 °C. Реакційну суміш розподіляли між CH2Cl2 і насиченим водним розчином бікарбонату натрію (NaHCO3). Шари розділяли, і органічний шар промивали один раз насиченим сольовим розчином. Розчин сушили над MgSO4, фільтрували і упарювали у вакуумі. Сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (етилацетат) з отриманням бажаного продукту у вигляді твердої речовини оранжевого кольору (141 мг, 68 %): т. пл. 841 87 °C; H ЯМР (300 МГц, CDCl3) δ 8,98 (д, J=1,7 Гц, 1H), 8,51 (дд, J=4,9, 1,7 Гц, 1H), 8,08 (дт, J=8,0, 1,7 Гц, 1H), 7,29 (м, 1H), 3,00 (с, 3H), 2,30 (с, 3H); ESIMS m/z 206,4 (M+1), m/z 204,2 (M-1). Приклад 10: Отримання 2,2,2-трифтор-N-[2-(5-фторпіридин-3-іл)тіазол-5-іл]-Nметилацетаміду (сполука 1) 25 30 35 40 У 10 мл-ову пробірку для мікрохвильової печі додавали 5-фтор-Nметилкарбамоїлметилнікотинамід (211 мг, 1,00 ммоль), молекулярні сита 4 Å (100 мг, сфери), реактив Лавессона (404 мг, 1,00 ммоль) і потім толуол (5 мл). Пробірку закупорювали і нагрівали при температурі 130 °C протягом 30 секунд при мікрохвильовому опроміненні. Отриманий розчин оранжевого кольору розбавляли CH2Cl2 і фільтрували для видалення сит. Даний розчин концентрували у вакуумі до напівтвердого стану. До цього сирого продукту додавали CH2Cl2 (2 мл) і ангідрид трифтороцтової кислоти (2 мл). Відразу спостерігалося виділення газу. Після перемішування протягом 2 год. при кімнатній температурі розчинники видаляли у вакуумі. Залишок розподіляли між CH2Cl2 і буфером з pH 7,0. Шари розділяли, і буфер екстрагували за допомогою CH2Cl2. Об'єднані органічні екстракти сушили над MgSO 4, фільтрували і упарювали у вакуумі. Очищення за допомогою хроматографії на силікагелі (від 0 до 100 % етилацетат/гексан) давало продукт у вигляді твердої речовини білого кольору (282 мг, 1 92 %): т. пл. 168-170 °C; H ЯМР (300 МГц, CDCl3) суміш ізомерів δ 8,98 і 8,95 (2 ушир.с, 1H), 8,55 і 8,54 (м і приблизно д, J=2,4 Гц, 1H), (дт, J=9,0 Гц, 2,2 Гц, 1H), 7,80 (с, 1H), 3,75 і 3,47 (2 с, 3H); ESIMS m/z 306 (M+1). Наступні сполуки були отримані способами, описаними в попередніх прикладах. 2,2,2-Трифтор-N-метил-N-(2-піридин-3-ілтіазол-5-іл)ацетамід (сполука 2) 45 25 UA 107791 C2 Очищення за допомогою хроматографії на силікагелі (від 0 до 100 % етилацетат/гексан) давало продукт у вигляді твердої речовини оранжевого кольору (1,13 г, 65 %): т. пл. 154-158 °C; ESIMS m/z 306,4 (M+1). N-(4-Етил-2-піридин-3-ілтіазол-5-іл)-2,2,2-трифтор-N-метилацетамід (сполука 3) 5 10 15 Сполука було виділена після очищення за допомогою хроматографії на силікагелі, елююючи за допомогою градієнта етилацетат/гексан, з отриманням янтарної смоли (0,98 г, 63 %): ІЧ -1 (тонка пластинка) 1717 см ; ESIMS m/z 318,21 (M+3). 2,2,2-Трифтор-N-метил-N-(4-феніл-2-піридин-3-ілтіазол-5-іл)ацетамід (сполука 4) Сполука була виділена після очищення за допомогою хроматографії на силікагелі, елююючи за допомогою градієнта етилацетату-гексан з отриманням аморфного твердого продукту -1 жовтого кольору (0,17 г, 31 %): ІЧ (тонка плівка) 1674 см ; ESIMS m/z 365,4 (M+2). N-Етил-2,2,2-трифтор-N-(4-феніл-2-піридин-3-ілтіазол-5-іл)ацетамід (сполука 5) 20 25 30 Сполука була виділена після очищення за допомогою хроматографії на силікагелі (етилацетат в гексані) з отриманням твердого продукту жовтого кольору (0,89 г, 75 %): т. пл. 81-1 92 °C; ІЧ (KBr) 1713 см ; ESIMS m/z 379,4 (M+2). Приклад 11: N-(4-Хлор-2-піридин-3-ілтіазол-5-іл)-2,2,2-трифтор-N-метилацетамід (сполука 6) Суспензію 2,2,2-трифтор-N-метил-N-(2-піридин-3-ілтіазол-5-іл)ацетаміду (1,0 г, 3,5 ммоль) і N-хлорсукциніміду (0,557 г, 4,2 ммоль) в ацетонітрилі (30 мл) нагрівали до 63 °C в атмосфері азоту протягом 3 год. Реакційну суміш охолоджували до кімнатної температури і обробляли додатковою кількістю N-хлорсукциніміду (0,557 г, 4,2 ммоль) і нагрівали при температурі 35 °C в атмосфері азоту протягом 2 год. Реакційну суміш охолоджували і упарювали при зниженому тиску. Залишок знову розчиняли в дихлорметані (80 мл) і промивали водою (70 мл). Водний шар 26 UA 107791 C2 5 повторно екстрагували метиленхлоридом (100 мл). Об'єднані органічні шари промивали водою (50 мл) і насиченим сольовим розчином (50 мл), сушили над сульфатом натрію, фільтрували, упарювали при зниженому тиску і очищали, використовуючи хроматографію із оберненою фазою. Продукт елюювали за допомогою градієнта ацетонітрил у воді. Бажаний продукт був 1 виділений у вигляді густої смоли коричневого кольору (0,337 г, 30 %): H ЯМР (400 МГц, CDCl3) 19 δ 9,12 (шир., 1H), 8,75 (шир., 1H), 8,22 (д, J=7,9 Гц, 1H), 7,28 (шир., 1H), 3,40 (с, 3H); F ЯМР -1 (376 МГц, CDCl3) δ -69,3; ESIMS m/z 324,3 (M+2); ІЧ (тонка плівка) 1772 см . Приклад 12: Синтез (4-хлор-2-піридин-3-ілтіазол-5-іл)метиламіну 10 15 20 Розчин N-(4-хлор-2-піридин-3-ілтіазол-5-іл)-2,2,2-трифтор-N-метилацетаміду (0,337 г, 1 ммоль) в крижаному метанолі (18 мл) обробляли карбонатом калію (0,434 г, 3,1 ммоль) і перемішували в атмосфері азоту протягом 20 хв. Тверді продукти видаляли за допомогою фільтрації, і фільтрат концентрували при зниженому тиску і адсорбували на силікагелі. Очищення за допомогою хроматографії на силікагелі, елююючи за допомогою градієнта етилацетату в гексані давала тверду речовину яскраво-жовтого кольору (0,195 г, 82 %): т. пл. 1 79 °C (розкл.); H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,1 Гц, 1H), 8,55 (дд, J=4,8, J=1,5 Гц, 1H), 8,08 (ддд, J=8,1, 2,0, 2,0 Гц, 1H), 7,32 (дд, J=8,1, 4,8 Гц, 1H), 4,07 (ушир.м, 1H), 3,03 (д, J=5,3 Гц, -1 3H); ESIMS m/z 228,23 (M+2); ІЧ 1540 см . Приклад 13: Отримання етилового ефіру 2-піридин-3-іл-4-трифторметилтіазол-5-карбонової кислоти 25 30 35 У 20 мл-ову пробірку для мікрохвильової печі додавали тіонікотинамід (0,552 г, 4,0 ммоль), етанол (15 мл) і етиловий ефір 2-хлор-4,4,4-трифтор-3-оксобутанової кислоти (1,75 г, 8 ммоль). Пробірку закупорювали і нагрівали в мікрохвильовій печі при температурі 150 °C протягом 10 хв. Реакційну суміш охолоджували до температури навколишнього середовища і додавали Et 3N (1,7 мл, 12 ммоль). Пробірку закупорювали і нагрівали в мікрохвильовій печі при температурі 130 °C протягом 1 хв. Після охолоджування до температури навколишнього середовища розчинник упарювали і сиру реакційну суміш відразу піддавали хроматографії на силікагелі (від 0 до 100 % етилацетат/гексан) з отриманням бажаного продукту у вигляді масла оранжевого -1 1 кольору, яке потім тверднуло (0,885 г, 73 %): ІЧ (KBr) 2988, 1737, 1712 см ; H ЯМР (300 МГц, CDCl3) δ 9,21 (дд, J=2,5, 0,8 Гц, 1H), 8,77 (дд, J=5,0, 1,7 Гц, 1H), 8,33 (дт, J=8,0, 2,2 Гц, 1H), 7,47 (ддд, J=11,8, 4,7, 0,8 Гц, 1H), 4,45 (кв, J=14,3, 7,1 Гц, 2H), 1,44 (т, J=7,1 Гц, 3H); ESIMS m/z 303 (M+1). Приклад 14: Отримання 2-піридин-3-іл-4-трифторметилтіазол-5-карбонової кислоти 40 27 UA 107791 C2 5 10 15 20 25 30 До розчину етилового ефіру 2-піридин-3-іл-4-трифторметилтіазол-5-карбонової кислоти (13,9 г, 46 ммоль, прибл. 85 %-на чистота) в метанолі (150 мл) додавали водний розчин гідроксиду натрію (загальний об'єм 75 мл, 140 ммоль), і суміш перемішували протягом 40 хв. Після додавання 2н HCl (70 мл, прибл. pH=3) в реакційну суміш утворювався осад. Потім додавали воду (300 мл) і гетерогенну суміш фільтрували при зниженому тиску. Осад промивали далі водою і сушили у вакуумі з отриманням бажаного продукту у вигляді твердої речовини не 1 зовсім білого кольору (7,37 г, 58 %): т. пл. 209 °C; H ЯМР (300 МГц, ДМСО-d6) δ 9,21 (д, J=2,5 Гц, 1H), 8,77 (дд, J=4,9, 1,7 Гц, 1H), 8,41 (дт, J=8,0, 1,7 Гц, 1H), 7,60 (дд, J=8,0, 4,9 Гц, 1H), 3,4 (ушир.с, 1H); ESIMS m/z 276,2 (M+1). Приклад 15: Отримання трет-бутилового ефіру (2-піридин-3-іл-4-трифторметилтіазол-5іл)карбамінової кислоти (сполука 7) До 2-піридин-3-іл-4-трифторметилтіазол-5-карбонової кислоти (6,33 г, 23,1 ммоль) в суміші толуол/трет-бутиловий спирт (100 мл кожного) додавали Et3N (3,21 мл, 23,1 ммоль) і дифенілфосфорилазид (5 мл, 23,1 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 5 хв. і потім нагрівали при температурі 95 °C протягом 4 год. Суміш охолоджували до кімнатної температури і розчинники видаляли при зниженому тиску. Сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (від 0 до 100 % етилацетат/гексан) з отриманням бажаного продукту у вигляді твердої речовини білого кольору 1 (4,7 г, 59 %): т. пл. 145-147 °C; H ЯМР (300 МГц, CDCl3) δ 9,11 (дд, J=2,5, 0,8 Гц, 1H), 8,67 (дд, J=5,0, 1,7 Гц, 1H), 8,22 (ддд, J=8,0, 2,5, 1,7 Гц, 1H), 7,58 (ушир.с, 1H), 7,39 (ддд, J=8,0, 4,7, 0,8 Гц, 1H), 1,59 (с, 9H); ESIMS m/z 346,5 (M+1), m/z 344,2 (M-1). Наступні сполуки були отримані способами, описаними в попередніх прикладах. трет-Бутиловий ефір (4-метил-2-піримідин-5-ілтіазол-5-іл)карбамінової кислоти (сполука 8) Сполука була виділена після очищення за допомогою колонкової хроматографії на силікагелі (від 0 до 100 % етилацетат/гексан) з виділенням бажаного продукту у вигляді твердої речовини жовтого кольору (0,25 г, 86 %): т. пл. 155 °C; ESIMS m/z 292,83 (M+1). трет-Бутиловий ефір (4-метил-2-піридин-3-ілтіазол-5-іла)карбамінової кислоти (сполука 9) 35 40 Сполука була виділена після очищення за допомогою колонкової хроматографії на силікагелі (від 0 до 100 % етилацетат/гексан) з отриманням твердого продукту жовтого кольору (4,15 г, 61 %): т. пл. 146-148 °C; ESIMS m/z 292,5 (M+1). Приклад 16: Отримання трет-бутилового ефіру метил-(2-піридин-3-іл-4-трифторметилтіазол5-іл)карбамінової кислоти (сполука 10) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPesticidal compositions
Автори англійськоюTrullinger, Tony, Hunter, Ricky, Garizi, Negar, Yap, Maurice, Buysse, Ann, Pernich, Dan, Johnson, Timothy, Bryan, Kristy, Deamicis, Carl, Zhang, Yu, Niyaz, Noormohamed, McLeod, CaSandra, Ross, Ronald, Zhu, Yuanming, Johnson, Peter, Eckelbarger, Joseph, Parker, Marshall
Автори російськоюТраллингер Тони, Хантер Рики, Гарици Негар, Яп Морис, Байсс Энн, Перних Дэн, Джонсон Тимоти, Брайан Кристи, Деамикис Карл, Чжан Юй, Нияз Ноормохамед, МакЛауд КаСандра, Росс Рональд, Чжу Юаньмин, Джонсон Питер, Эккельбарджер Джозеф, Паркер Маршалл
МПК / Мітки
МПК: C07D 417/14, C07D 417/04, A61K 31/44
Мітки: пестицидні, композиції
Код посилання
<a href="https://ua.patents.su/141-107791-pesticidni-kompozici.html" target="_blank" rel="follow" title="База патентів України">Пестицидні композиції</a>
Попередній патент: Напівнавісний плуг із удосконаленим пристроєм очищення колеса
Наступний патент: Спосіб затирання для виробництва квасного сусла
Випадковий патент: Початкове виявлення мережі зі сприянням і визначення системи












