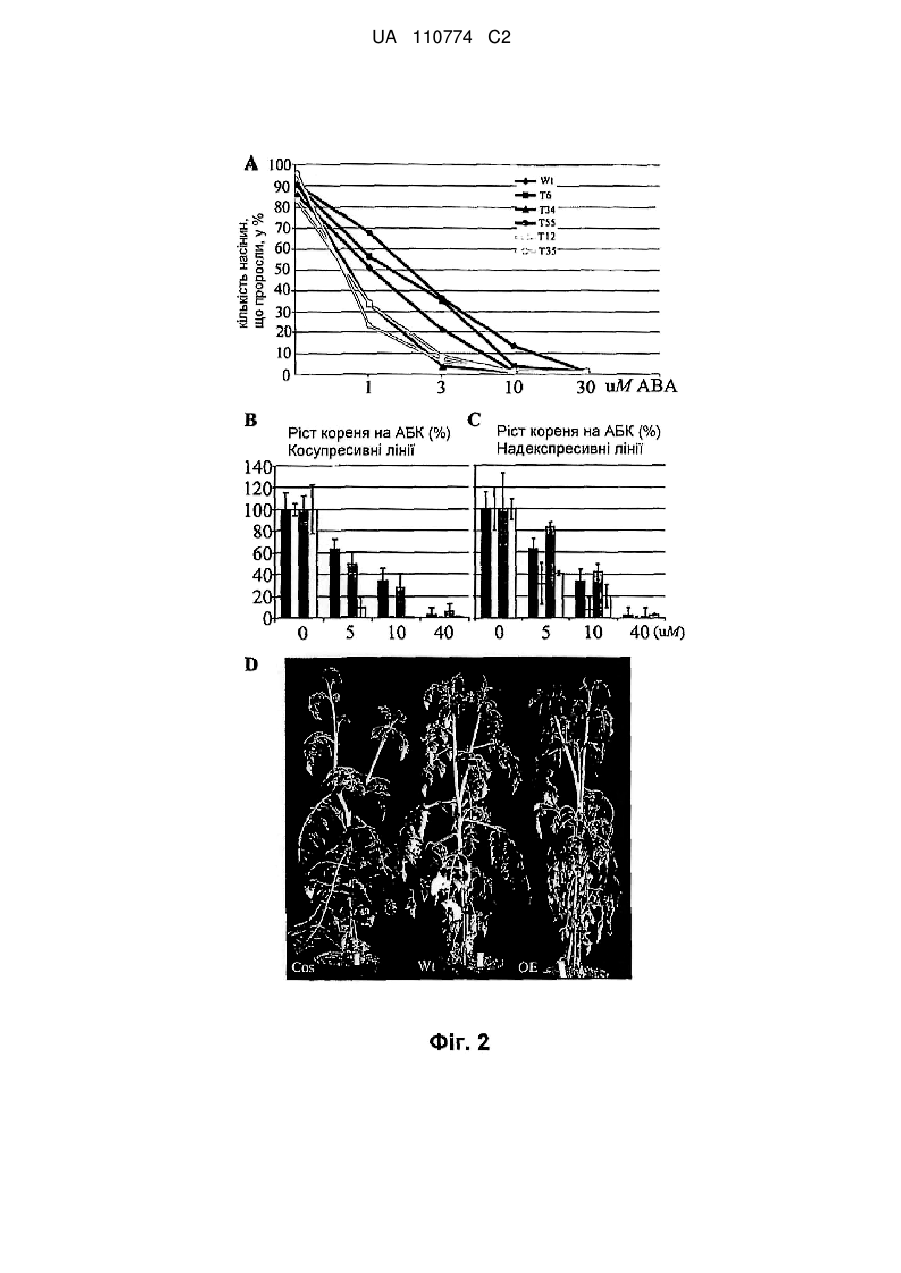
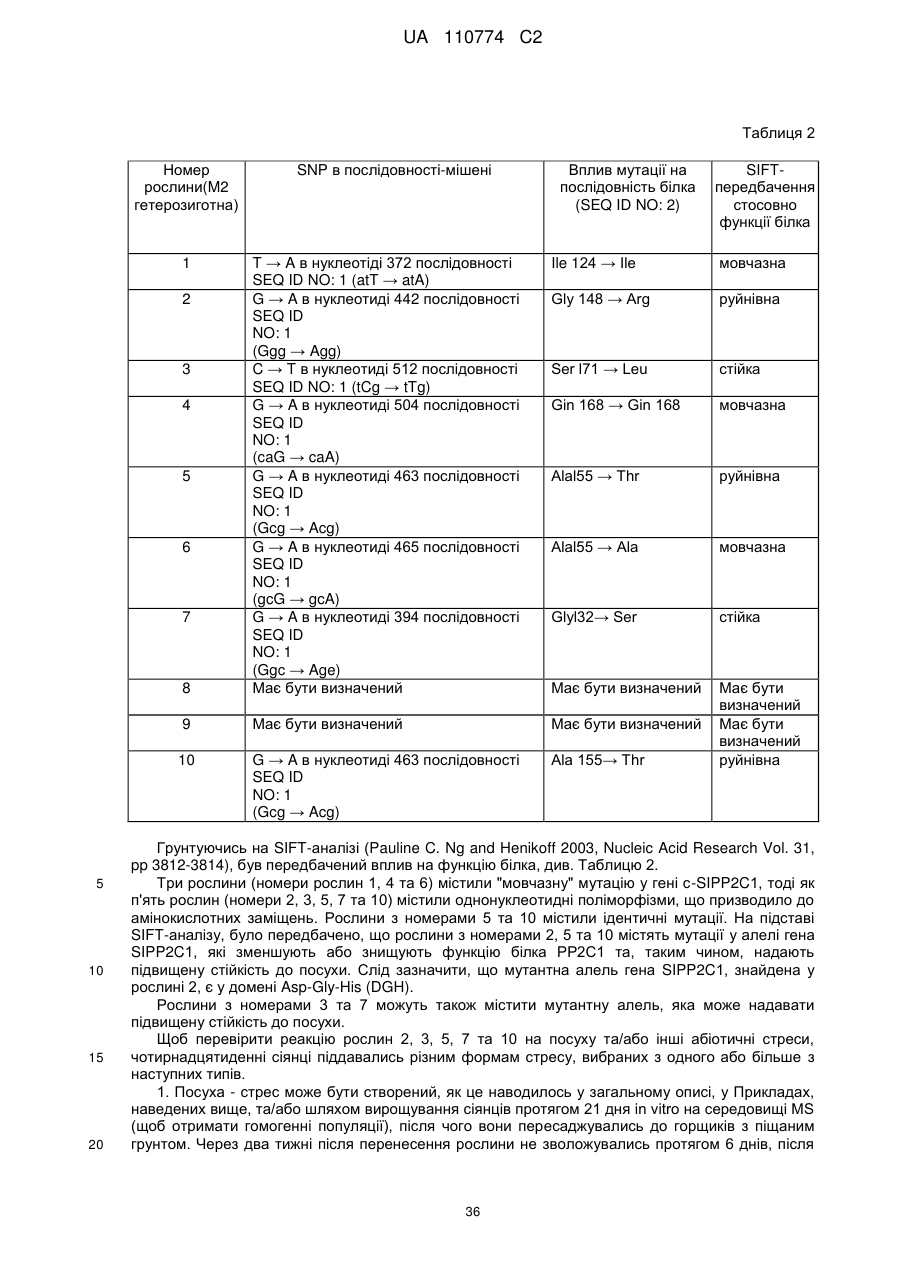
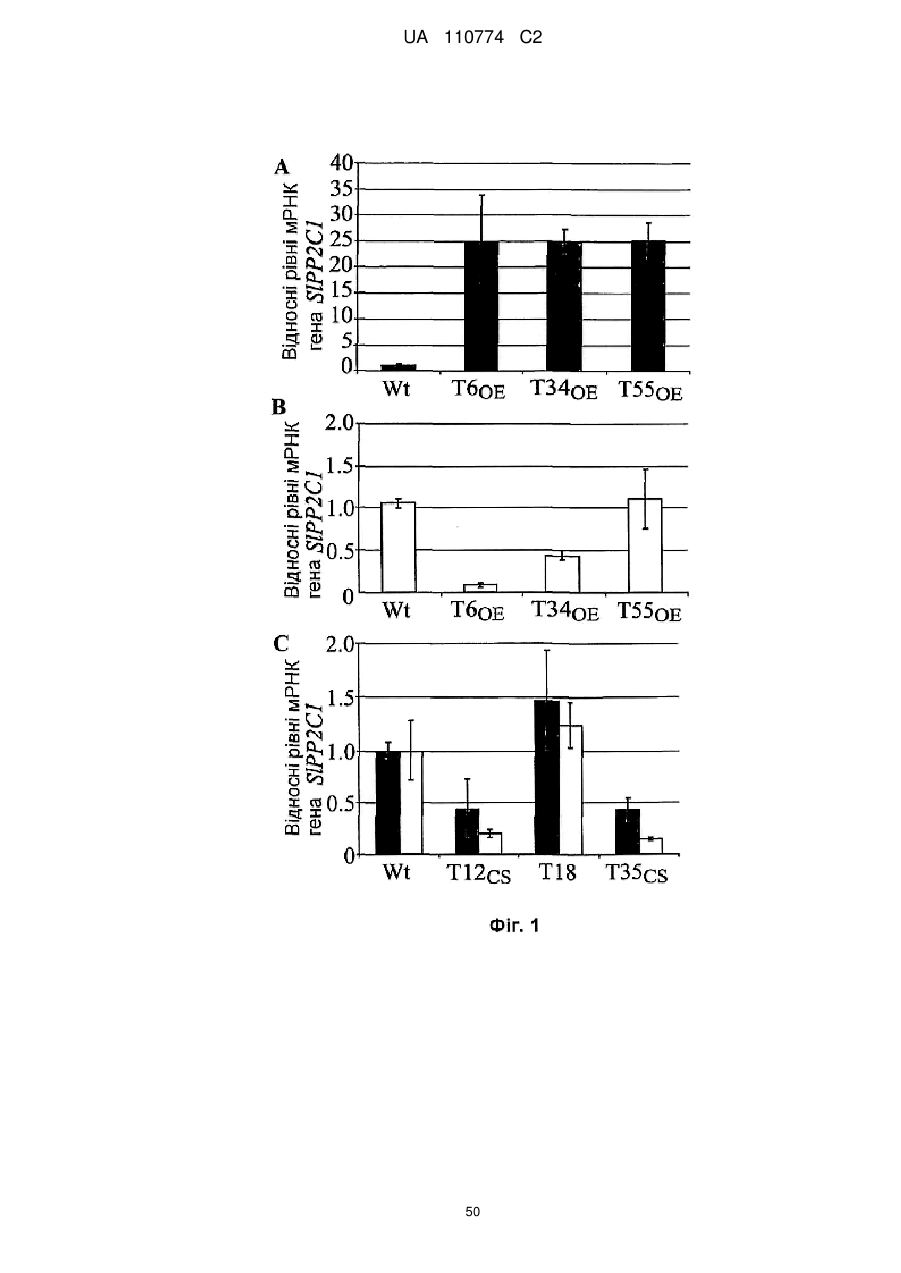
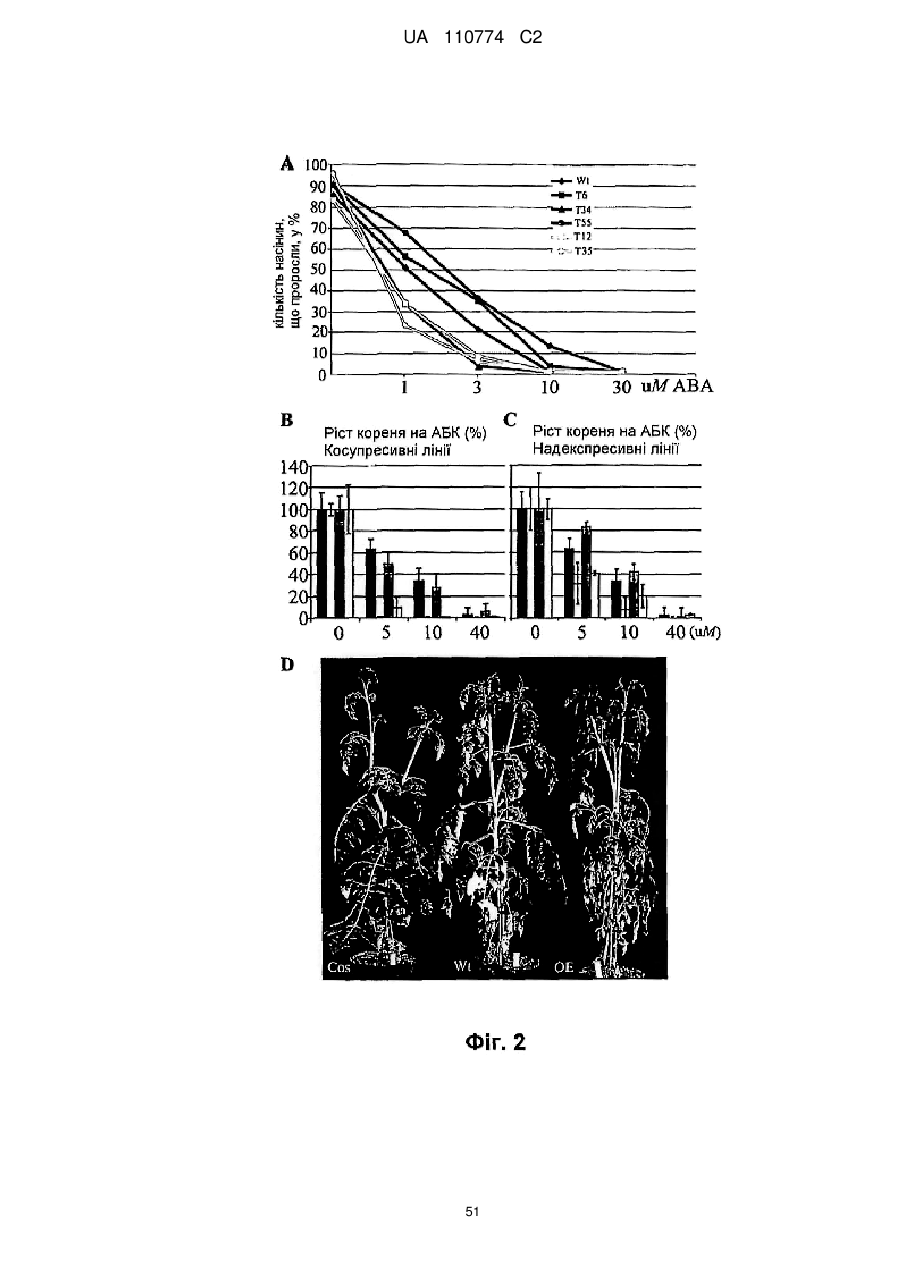
Нетрансгенна стійка до посухи рослина
Формула / Реферат
1. Нетрансгенна рослина, що містить алель Solanum lycopersicum PP2C1 (SIPP2C1) у своєму геномі, де алель SIPP2C1 - це алель, що кодує білок, який виявляє, щонайменше 90 % амінокислотної послідовності, ідентичної до послідовності SEQ ID NO: 2, яка відрізняється тим, що зазначений алель SIPP2C1 містить одну або більше мутацій у своїй нуклеотидній послідовності та, завдяки цьому, як результат зазначених однієї або більше мутацій, рослина, що містить зазначений мутантний алель у своєму геномі, має значно підвищену стійкість до посухи, у порівнянні з рослиною, що містить алель SIPP2C1 дикого типу у своєму геномі; при цьому нетрансгенна рослина є різновидом Solanum lycopersicum.
2. Нетрансгенна рослина за п. 1, яка відрізняється тим, що зазначена одна або більше мутацій обумовлюють втрату функції або зменшення функції закодованого білка SIPP2C1.
3. Нетрансгенна рослина за п. 1 або п. 2, в якій зазначений мутантний алель SIPP2C1 представлений в гомозиготній формі.
4. Нетрансгенна рослина за будь-яким із попередніх пунктів, в якій симптоми в′янення листка зазначеної рослини зменшені принаймні на 10 % у порівнянні з симптомами в′янення листка рослини, що містить алель SIPP2C1 дикого типу у своєму геномі, коли рослини зазнавали впливу того самого стресу на посуху.
5. Нетрансгенна рослина за будь-яким із попередніх пунктів, де рослина є гібридною рослиною.
6. Плід або насіння або частина рослини за будь-яким із попередніх пунктів.
7. Застосування послідовності нуклеїнової кислоти, що кодує білок SIPP2C1, який містить щонайменше 90 % амінокислотної послідовності, ідентичної до послідовності SEQ ID NO: 2 для одержання нетрансгенних рослин з підвищеною стійкістю до посухи.
8. Нетрансгенна, стійка до посухи рослина томатів або насіння, нащадки або плоди томатів з неї, причому зазначена рослина, будучи одержаною за допомогою методу TILLING, містить мутантний алель SIPP2C1 у своєму геномі, яка відрізняється тим, що зазначений мутантний алель кодує білок SIPP2C1, що має понижену або втрачену функцію, у порівнянні з білком дикого типу SIPP2C1.
9. Нетрансгенна, стійка до посухи рослина томатів або насіння, нащадки або плоди томатів за п. 8, де зазначений білок SIPP2C1 містить амінокислотне заміщення в Gly148, Ser171, Ala155 або Gly132.
10. Послідовність нуклеїнової кислоти, яка кодує мутантний білок SIPP2C1, що містить амінокислотну послідовність SEQ ID NO: 2 або її варіанти, що мають 90 % амінокислотної послідовності, ідентичної послідовності SEQ ID NO: 2, та містить одну або більше місенс-мутацій в амінокислотах Gly148, Ser171, Ala155 або Gly132 послідовності SEQ ID NO: 2, або еквівалент амінокислоти у варіанті білка SIPP2C1.
11. Мутантна рослина, насіння або частина рослини, що містить послідовність нуклеїнової кислоти за п. 10 та має підвищену стійкість до посухи.
12. Застосування послідовності нуклеїнової кислоти, яка кодує білок SIPP2C1, що містить щонайменше 90 % амінокислотної послідовності, ідентичної SEQ ID NO: 2, та містить амінокислотне заміщення в Gly148, Ser171, Ala155 або Gly132 для одержання нетрансгенних рослин з підвищеною стійкістю до посухи.
13. Насіння томатів, яке містить мутантний алель SIPP2C1 у своєму геномі, яке відрізняється тим, що зазначений мутантний алель кодує білок SIPP2C1, що має понижену або втрачену функцію, у порівнянні з білком дикого типу SIPP2C1; та де зазначений білок SIPP2C1 містить амінокислотне заміщення в Gly148, Ser171, Ala155 або Gly132.
Текст
Реферат: Винахід описує трансгенні та нетрансгенні рослини, які мають нові фенотипи. Забезпечується білок серин/треонін протеїнфосфатаза 2С (SIPP2C1) Solanum lycopersicum і послідовність нуклеїнової кислоти, що його кодує, які використовуються для надання рослинам нових фенотипових ознак, зокрема стійкості до посухи. UA 110774 C2 (12) UA 110774 C2 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОБЛАСТЬ ВИНАХОДУ Цей винахід належить до галузі біотехнології рослин і селекції рослин. Передбачувані рослини є стійкими до посухи, насамперед стійкі до посухи види овочевих культур, такі як томати (Solarium lycopersicum), і методи отримання генетично модифікованих або мутантних рослин, стійких до посухи. Винахід забезпечує новий ген, названий SlPP2C1, який кодує SlPP2C білок, що є негативним регулятором реакції-відповіді абсцизової кислоти (АБК). Даун-регуляція, нокаут або сайленсинг SlPP2C1 гена призводять до істотного підвищення стійкості рослин до посухи. Також забезпечуються рослини, насіння, плоди і частини рослин, які включають мутантну алель SlPP2C1 в їх геномі і мають значно вищу стійкість до посухи. В іншому втіленні забезпечуються способи отримання посухостійких рослин, що несуть одну або більше мутантних алелів SlPP2C1 в їх геномі. ПЕРЕДУМОВИ ВИНАХОДУ Природний регулятор росту (фітогормон) абсцизова кислота (AБК) є важливим для регулювання реакції-відповіді рослин на абіотичний стрес (такий як посуха, засолення, холодовий шок, ушкодження, враження патогенами) і розвиток насіння та спокою. Пошуки мутантів зі зміненою реакцією на дію абіотичного стресу або спокою насіння часто використовуються і призводять до ідентифікації генів, важливих для біосинтезу АБК і сигнальної трансдукції АБК. Шляхом такого скринінгу були ідентифіковані нечутливі до дії АБК мутанти Arabidopsis-abi1-1 і abi2-l − (Koornneef et al. 1984, Physiol Plantarum 61: 377-383). Клонування і характеристика гена AtABI1 виявили, що він кодує серин/треонін протеїнфосфатазу типу 2C (PP2C, Leung et al. 1994, Science 264: 1448-1452; Meyer et al. 1994, Science 264: 1452-1455). AtABI2 також кодує протеїнфосфатазу типу 2C. Мутанти abi1-1 і abi2-l несуть мутації і AtABI1 і AtABI2 генах, що призводить до ідентичних замін Глі-на-Асп в аналогічних положеннях (Leung et al. 1997, Plant Cell 9: 759-771). Було показано, що обидва мутанти мають знижену активність фосфатази (Bertauche et al. 1996, Eur J Biochem 241: 193200; Leung et al. 1997, supra), що дає підставу припустити, що AtABI1 і AtABI2 є позитивними регуляторами чутливості до АБК. Однак, конститутивна надекспресія AtABI1 інгібувала дію АБК в протопласті кукурудзи, і було показано, що мутанти AtABI1 та AtABI2 зі зниженою функцією відрізняються гіперчутливістю до АБК (Scheen 1998, PNAS 95:975-980; Gosti et al. 1999, Plant Cell 11: 1897-1909; Merlot et al. 2001, Plant J. 25:295-303). Загалом, було зроблено висновок, що AtABI1 і AtABI2 є негативними регуляторами АБК відповіді. Точний механізм, за допомогою якого мутації abi1-1 і abi2-1 індукують нечутливість до АБК, ще не з'ясований, однак, він може бути пов'язаний з переважним накопиченням мутантних білків в ядрі (Moes et al. 2008, Plant J 54: 806-819). AtABI1 і AtABI2 є важливими для розвитку спокою насіння, а також для росту сіянців і регулювання розміру продихової щілини, на підставі чого може бути висловлене припущення, що ці білки діють на основні акцепторні точки сплайсингу, які контролюють шлях тканиноспецифічного АБК сигналингу (Leung et al. 1997, supra). Було ідентифіковано сімдесят шість PP2C у Arabidopsis, серед яких PP2C-A є однією з підгруп, що включає дев'ять генів, пов'язаних з сигнальною трансдукцією АБК (Schweighofer et al. 2004, Trends in Plant Science Vol 9: 236-243). Було також виявлено, що декілька генів Arabidopsis, що належать до цієї групи, кодують негативні регулятори АБК реакції-відповіді. Наприклад, AtP2C-HA (Rodriguez et al. 1998, Plant Mol Biol 38: 879-883) (названі також AtHAB1, Saez et al. 2004, Plant J 37: 354-369) є репресором сигнального шляху АБК, який регулює численні АБК реакції-відповіді, такі як закриття продихів, проростання насіння і гальмування вегетативного росту. HAB2, очевидно, також відіграє подібну регуляторну роль. AtPP2CA (Kuhn et al. 2006, Plant Physiol 140:127-139) також був описаний як негативний регулятор АБК, причому мутант виявляв гіперчутливість до АБК. Становить інтерес те, що мутант з перериванням гена виявив реакцію надчутливості закриття продихів до АБК, в той час як швидкість транспірації (втрати води) мутанта не відрізнялась від такої у рослин "дикого" типу. Yoshida et al. (2006, Plant Physiology 140: 115-126) також дослідили місенс-мутацію з втратою функції в AtPP2CA, який мав 1/100 активності протеїнфосфатази порівняно з "диким" типом, внаслідок чого мутантні рослини Arabidopsis виявили гіперчутливість протягом стадії проростання насіння, однак мутантні рослини не виявили жодних змін щодо посухостійкості порівняно з "диким" типом (сторінка124, LH Column, останній параграф). ABI1 і ABI2 є репресорами сигнального шляху АБК, що регулює багато реакцій АБК, таких як закриття продихів, осмотичну проникність плазматичних мембран для води, посухостійкість і ризогенез, реакцію на глюкозу, світловий стрес, проростання насіння і уповільнення вегетативного росту. AHG1 (At5g51760) є негативним регулятором АБК протягом проростання насіння (Nishimura et al. 2007, Plant J 50: 935-949), а AHG3 (At3gll410) є негативним регулятором АБК протягом проростання насіння і акліматизації до холоду. Три інші, At5g9220, At2g29380 і 1 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 Atlg07430, можуть, в кінцевому результаті, не бути залучені до сигналінгу АБК, оскільки незначні мутації не виявили будь-якого впливу на чутливість до АБК (Yoshida et al, 2006: Plant Physiology 140:115-126). Біосинтез і сигналінг АБК є, таким чином, надзвичайно складним, і хоча різні гени були ідентифіковані у Arabidopsis, які, очевидно, були залучені (група PP2C-A), їх роль у АБКзалежних відповідях, таких як абіотичний стрес, спокій насіння і ріст сіянців значною мірою залишається нез'ясованою. Крім того, послідовності білків виявляють низьку консервативність і амінокислотні послідовності мають незначну ідентичність послідовностей. Гени, згруповані разом в процесі філогенезу, базуючись на білкових доменах (або мотивах), таких як каталітичний домен (типу протеїн серин/треонінфосфатази), що, як правило, локалізовані на Cтермінальних ділянках білків. N-термінальні ділянки істотно варіюють і можуть відігравати роль у зв'язуванні з субстратом або забезпечувати специфічні сайти прикріплення до сигнальних комплексів. Крім того, функції in vivo залишаються нез'ясованими, також небагато відомо про субклітинну локалізацію, субстрати та специфічність ензимів або щодо того, як ці мономерні ензими регулюються in vivo. WO2007/088234 описує, що об'єднана інактивація ABI1 і HAB1, що посилює реакціювідповідь до АБК призводить до утворення рослин Arabidopsis, стійких до засолення та водного стресу. Ортологи ABI1 томатів (SGN-U231558) і HAB1 (SGN-U217609) представлені на Фіг. 6 і 7. Див. також Saez et al. 2006, Plant Physiol 141:1389-1399. Незважаючи на те, що подвійні мутанти abi1 hab1 призвели до розвитку стійкості до посухи у Arabidopsis thaliana, залишається актуальним пошук генів, прийнятних для розвитку стійкості до посухи у хлібних злаків, насамперед польових культур (наприклад, рис, кукурудза, соя, пшениця, ячмінь, жито, сорго, капуста тощо) і овочевих культур (напр., томати, огірки, цибуля, морква, капуста білокачанна, капуста цвітна, брокколі, кавун, диня, салат, цибуля-порей, шпинат, редис, картопля, артишок, валеріанелла (салатна кукурудза), гарбуз столовий, боби, горох, перець тощо). У овочевих культур однією з вважливих проблем є, передусім, нестача води (водний дефіцит), оскільки корені багатьох культур поверхневі і оскільки ці продукти переважно продаються у свіжому вигляді, втрата вмісту води може призвести до зниження якості овочів та зменшення врожаю. Плоди і насіння овочевих культур, таких як томати, є чутливими до нестачі води протягом цвітіння та розвитку плодів і насіння. Зав'язування плодів істотно може бути зменшене через нестачу води протягом розвитку плодів. Традиційною практикою, якщо існує потенційна можливість водного стресу, є застосування зволоження культур і/або вирощування культиварів або різновидів рослин, що мають стійкість до посухи, якщо такі рослини є наявними. Також може застосовуватись мульчування або укриття міжрядь. Незважаючи на спроби селекції, томати залишаються чутливими до посухи і жодного комерційного культивару, стійкого до посухи, не існує. Даний винахід забезпечує нові гени, які називаються SlPP2C1, прийнятні для отримання посухостійких рослин, насамперед, рослин томатів та інших овочевих рослини. Цей винахід також забезпечує способи отримання посухостійких рослин. Також забезпечуються посухостійкі рослини, насіння і частини рослин (зібрані плоди, тощо). ЗАГАЛЬНІ ВИЗНАЧЕННЯ Термін "послідовність нуклеїнової кислоти" (або молекула нуклеїнової кислоти) стосується молекули ДНК або РНК у одноланцюговій або двохланцюговій формі, зокрема, ДНК, що кодує білок або фрагмент білка відповідно до даного винаходу. "Ізольована послідовність нуклеїнової кислоти" стосується послідовності нуклеїнової кислоти, яка не існує у природному середовищі, з якого вона ізолюється, наприклад, послідовність нуклеїнової кислоти в бактеріальній клітинігосподарі або в рослинному ядрі або пластидному геномі. Терміни "білок" або "поліпептид" використовуються поперемінно і стосуються молекул, які включають амінокислотні ланцюги, без посилання на специфічний спосіб дії, розмір, тривимірну структуру або походження. "Фрагмент" або "частина" SlPP2C1 білка може, таким чином, ще називатись як "білок". Термін "ізольований білок " застосовується щодо білка, який не існує в його природному середовищі, наприклад, in vitro або в рекомбінантній бактеріальній клітині або клітині рослини-господаря. Термін "ген" означає послідовність ДНК, яка включає ділянку (транскрибовану ділянку), яка транскрибується в молекулу РНК (наприклад, мРНК) в клітині, функціонально зв'язану з прийнятними регуляторними ділянками (напр., промотором). Ген може, таким чином, включати кілька функціонально зв'язаних послідовностей, таких як промотор, 5' лідерну послідовність, напр., послідовності, включені в трансляцію ініціації, (білок) кодуючи ділянку (кДНК або геномну ДНК) і 3'-нетрансльовану послідовність, яка включає, напр., сайти термінації транскрипції. 2 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Химерний ген" (або рекомбінантний ген) стосується будь-якого гена, який зазвичай не виявляється в природі видів, зокрема, гена, в якому представлені одна або кілька частин послідовності нуклеїнової кислоти, які не пов'язані одна з одною в природі. Наприклад, промотор, не пов'язаний в природі з частиною або всією транскрибованою ділянкою або з іншою регуляторною ділянкою. Термін "химерний ген" тлумачиться як такий, що включає конструкції експресії, в яких промотор або регуляторна послідовність транскрипції функціонально пов'язана з однією або більшим числом кодуючих послідовностей або антисмисловою (зворотний комплемент смислового ланцюга) або інвертованим повтором (смислова або антисмислова, в результаті чого РНК-транскрипт утворює двохланцюгову РНК після транскрипції). "Цис-ген" являє собою химерний ген, в якому, переважно, всі генні послідовності, або, щонайменше, транскрибована послідовність, походить від виду рослин, які статево сумісні з видом, в який цей ген вводиться. "Експресія гена" стосується процесу, де ділянка ДНК, що функціонально пов'язана з відповідними регуляторними ділянками, зокрема, промотором, транскрибується в РНК, що є біологічно активною, тобто є здатною до трансляції в біологічно активний білок або пептид (або активний фрагмент пептиду), або який сам є біологічно активним (напр., в посттранскрипційному сайленсингу генів або інтерферуючих РНК (RNAi). Кодуюча послідовність може мати смислову орієнтацію і кодувати бажаний біологічно активний білок або пептид, або фрагмент активного пептиду. При підході, що ґрунтується на генному сайленсингу, послідовність ДНК переважно присутня у формі антисмислової ДНК або інвертованого повтору ДНК, яка включає коротку послідовність гена-мішені в антисмисловій або в смисловій та антисмисловій орієнтації (інвертований повтор). "Ектотопічна експресія" стосується експресії в тканині, в якій ген зазвичай не експресується. "Активний білок" або "функціональний білок" - білок, який має білкову активність, що може бути визначена in vitro, напр., за допомогою тестування активності in vitro, і/або in vivo, напр., фенотипових проявів білка. Білок "дикого типу" - це цілковито функціональний білок, який має місце у рослини природного ("дикого") типу. "Мутантний білок" – це білок, що містить одну або більше мутацій в послідовності нуклеїнової кислоти, що кодує білок, внаслідок чого мутація призводить (кодуюча молекула мутантної нуклеїнової кислоти) до "зменшеної функції" або "втрати функції " білка, як, напр., може бути визначено шляхом активності білка in vitro порівняно з активністю білка дикого типу, напр., шляхом кількісного аналізу активності, і/або in vivo, напр., фенотипового прояву мутантного алеля. "Мутація" в молекулі нуклеїнової кислоти, яка кодує білок, - це зміна одного або більшої кількості нуклеотидів порівняно з послідовністю дикого типу, напр., шляхом заміщення, делеції або інерції одного або більшої кількості нуклеотидів. "Точкова мутація " - це заміщення одного нуклеотида, або інерція або делеція одного нуклеотида. "Несмислова" мутація - це (точкова) мутація в послідовності нуклеїнової кислоти, що кодує білок, внаслідок чого відбувається зміна кодона на стоп-кодон. Це призводить до передчасної термінації транскрипції, що представлена матричною РНК (mRNA) і до утворення усіченого білка. Усічений білок може мати знижену функцію або характеризуватись втратою функції. "Безсмислова" мутація - це (точкова) мутація в послідовності нуклеїнової кислоти, що кодує білок, внаслідок чого кодон змінюється і кодує іншу амінокислоту. Отриманий внаслідок цього білок може мати знижену функцію або характеризуватись втратою функції. Мутація "сайта сплайсингу"- це мутація в послідовності нуклеїнової кислоти, що кодує білок, внаслідок чого сплайсинг пре-мРНК змінюється, що призводить до утворення мРНК, що має іншу нуклеотидну послідовність, а білок має іншу амінокислотну послідовність, ніж білок дикого типу. Отриманий внаслідок цього білок може мати знижену функцію або характеризуватись втратою функції. Мутація "зсуву рамки" - це мутація в послідовності нуклеїнової кислоти, що кодує білок, внаслідок чого змінюється рамка зчитування мРНК, що призводить до іншої амінокислотної послідовності. Отриманий внаслідок цього білок може мати знижену функцію або характеризуватись втратою функції. Мутація в регуляторній послідовності, напр., в промоторі гена, - це зміна одного або більшої кількості нуклеотидів порівняно з послідовністю дикого типу, напр., шляхом заміщення, делеції або інерції одного або більшої кількості нуклеотидів, що призводить до зменшення або відсутності транскриптів мРНК гену, який створюється. Термін "сайленсинг" стосується даун-регуляції або повного інгібування експресії гена або родини генів. "Ген-мішень" у підході, що ґрунтується на генному сайленсингу, - це ген або родина генів (або одна або більше специфічних алелів гена), серед яких експресія ендогенного гена перебуває під даун-регуляцією або повністю інгібується (сайленсується), якщо сайленсинг 3 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 химерного гена (або РНКi химерного гена') експресується і, наприклад, відбувається сайленсинг транскрипта РНК (напр., двохланцюгової РНК (dsRNA) або коротких РНК, що утворюють "шпильки" (hairpinRNA), здатних до сайленсингу експресії ендогенного гена-мішені). При підході, що ґрунтується на мутагенезі, ген-мішень, який підлягає мутації, є ендогенним геном, що призводить до зміни (зменшення або втрати) експресії гена або зміни (зменшення або втрати) функції закодованого білка. "Смисловий" РНК-транскрипт переважно утворюється шляхом функціонального зв'язування промотора з двохланцюговою молекулою ДНК, в який смисловий ланцюг (кодуючий ланцюг) молекули ДНК знаходиться в 5'-3' орієнтації, так що транскрибується смислова РНК, який повинен бути ідентичним нуклеотидній послідовності ланцюга смислової ДНК (за винятком того, що в РНК відбувається заміна нуклеотида T на У). "Антисмисловий" РНК транскрипт, як правило, утворений внаслідок функціонального зв'язування промотора з комплементарним ланцюгом (антисмисловий ланцюг) смислової ДНК, у такий спосіб, що відбувається транскрипція антисмислової РНК. "Регуляторна послідовність транскрипції" визначається тут як послідовність нуклеїнової кислоти, що здатна регулювати швидкість транскрипції (кодуючої) послідовності, функціонально зв'язаної з послідовністю регуляції транскрипції. Регуляторна послідовність транскрипції, як тут визначено, таким чином, буде включати всі елементи послідовності, необхідні для ініціації транскрипції (елементи промотора), для підтримання і регуляції транскрипції, включаючи, напр., атенюатори або енхансери. Незважаючи на те, що переважна більшість послідовностей стосується регуляції транскрипції кодуючої послідовності "вгору" (5'), також виявлені регуляторні послідовності "вниз" (3'), які також охоплені цим визначенням. Як тут використовується, термін "промотор" стосується фрагмента нуклеїнової кислоти, функція якого полягає в тому, щоб контролювати транскрипцію одного або більше генів, розташованих "вгору" стосовно напрямку транскрипції сайта ініціації транскрипції гена, і структурно ідентифікується наявністю сайта зв'язування для ДНК-залежної РНК-полімерази, сайтів ініціації транскрипції і будь-яких інших послідовностей ДНК, які включають, але не обмежуються сайтами зв'язування факторів транскрипції, сайтами зв'язування репресора і активатора білка, та будь-якими іншими послідовностями нуклеотидів, що відомі фахівцю в цій галузі, і впливають безпосередньо або опосередковано на регуляцію транскрипції промотора. "Конститутивний" промотор - це промотор, який активний у більшості тканин за більшості фізіологічних умов та умов розвитку. "Індуцибельний" промотор - це промотор, який регулюється фізіологічно (напр., шляхом зовнішнього застосування певних сполук) або у процесі розвитку. "Тканиноспецифічний" промотор є активним лише в тканинах або клітинах специфічних типів. Як тут використовується, термін "функціонально зв'язаний" стосується зв'язку полінуклеотидних елементів у функціональний взаємозв'язок. Нуклеїнова кислота є "функціонально зв'язана", якщо вона перебуває у функціональному взаємозв'язку з іншою нуклеотидною послідовністю. Наприклад, промотор, або краще, послідовність регуляції транскрипції, функціонально зв'язана з кодуючою послідовністю, якщо вона впливає на транскрипцію кодуючої послідовності. Тут "функціонально зв'язана" означає, що послідовності ДНК, будучи зв'язаними, є переважно, прилеглими (суміжними) і, де це необхідно, з'єднують дві ділянки, які кодують білки, суміжні в рамці зчитування, таким чином, що продукують "химерний білок". "Химерний білок" або "гібридний білок", є білок, утворений різними білковими "доменами" (або мотивами), які не виявляються у природі, однак які, з'єднуючись, утворюють функціональний білок, який виявляє функціональні властивості об'єднаних доменій. Химерний білок може також бути гібридним білком двох або більшої кількості білків, які зустрічаються в природі. Термін "домен", як тут використовується, означає будь-яку частину(и) або домен (и) білка, що має специфічну структуру або функцію, яка може бути передана іншому білку, для того, щоб забезпечити новий гібридний білок, що має, принаймні, функціональну характеристику домена. Специфічні домени можуть також бути використані для ідентифікації білків, які належать до SlPP2C1 групи білків, таких як SlPP2C1 ортологи з інших видів рослин. Приклади доменів, виявлені серед SlPP2C1 білків, є серин/треонінфосфатаза 2C (PP2C або PP2C-подібні), каталітичний домен, який включає амінокислоти 84-391 послідовності SEQ ID NO: 2 або Nтермінальну ділянку SlPP2C білка (амінокислоти 1-83 послідовності SEQ ID No: 2). Терміни "пептид-мішень" стосується амінокислотних послідовностей, які спрямовують білок до внутрішньоклітинних органел, таких як пластиди, здебільшого хлоропласти, мітохондрії, або екстрацелюлярний простір (секреція сигнального пептиду). Послідовність нуклеїнової кислоти, 4 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 яка кодує пептид-мішень, може бути гібридизованою (в рамці) з послідовністю нуклеїнової кислоти, яка кодує амінотермінальний кінець (N-термінальний кінець) білка. "Конструкція нуклеїнової кислоти " або "вектор" тут означає отриману людиною молекулу нуклеїнової кислоти шляхом застосування технології рекомбінантних ДНК і яка застосовується для того, щоб доставити екзогенну ДНК в клітину-господар. Каркас вектора може, наприклад, бути бінарним або супербінарним вектором (див., напр., US5591616, US2002138879 і WO9506722), або асоційованим вектором або T-ДНК вектором, як відомо в галузі і як описано в цій заявці, в який химерний ген інтегрується або, якщо прийнятна послідовність регуляції транскрипції вже існує, лише бажана послідовність нуклеїнової кислоти (напр., кодуюча послідовність, антисмислова або інвертований повтор послідовності) інтегрується в нижньому напрямку послідовності регуляції транскрипції. Вектори переважно включають наступні генетичні елементи, для того щоб зробити можливим їх використання у молекулярному клонуванні, такі як, напр., селективні маркери, (множинні сайти клонування) тощо (див. нижче). "Клітина-господар" або "рекомбінантна клітина-господар" або "трансформована клітина" - це терміни, що стосуються нових окремих клітин (або організмів), що походять, щонайменше, від однієї молекули нуклеїнової кислоти і, головним чином, включають химерний ген, що кодує бажаний білок або послідовність нуклеїнової кислоти, які внаслідок транскрипції дають антисмислову РНК або інвертований повтор РНК (або "шпильку" РНК) для сайленсингу гена/родини генів, які повинні бути введені у вказану клітину. Клітина-господар переважно є рослинною або бактеріальною клітиною. Клітина-господар може нести конструкцію нуклеїнової кислоти у вигляді екстрахромосомної (епісомної) молекули, здатної до реплікації), або, переважно, включає химерний ген, інтегрований в ядерний або пластидний геном клітинигосподаря. Термін "селективний маркер" - це термін, відомий кожному фахівцю зі звичайним досвідом роботи в цій галузі і використовується для того, щоб описати будь-яку генетичну структуру, яка після експресії може бути використана для відбору клітин або клітин, що містять селективний маркер. Продукти селективного маркерного гена надають, наприклад, резистентність до антибіотиків або, переважно, резистентність до гербіцидів або інші селективні особливості, такі як характерні фенотипові особливості (напр., зміну пігментації) або потреб щодо живлення. Термін "репортер" головним чином використовується щодо візуальних маркерів, таких як зелений флуоресцентний білок (GFP), так званий удосконалений зелений флуоресцентний білок (eGFP), люцифераза, ген-маркер b-глюкоронідази (GUS та ін.). Термін "ортолог" гена або білка стосується тут гомологічного гена або білка, виявлених у іншого виду, що виконують ті ж функції, що й ген або білок, однак (зазвичай) дивергували в послідовності з часової точки, коли відбувалась диверегенція видів, які включають цей ген (тобто гени еволюціонували від спільного предка в процесі видоутворення). Ортологи гена томатів SlPP2C1 можуть, таким чином, бути ідентифіковані у інших видів рослин, ґрунтуючись як на порівнянні послідовностей (напр., виходячи з ідентичності послідовності (у відсотках від усієї послідовності і /або специфічних доменів), так і/або функціональному аналізі. Терміни "гомологічний" і "гетерологічний" стосуються взаємозв'язку між послідовністю нуклеїнової кислоти і амінокислоти та їх клітини-господаря або організму, передусім в контексті трансгенних організмів. Гомологічна послідовність, таким чином, була виявлена в природі у видів-господарів (напр., рослини томатів, трансформовані з використанням гена томатів), тоді як гетерологічна послідовність не виявляється в природі у клітин-господарів (напр., рослини томатів, трансформовані з використанням послідовності з рослин картоплі). Залежно від контексту, термін "гомолог" або "гомологічний" може альтернативно стосуватись послідовностей, які походять від спільної послідовності анцестора (напр., вони можуть бути ортологами). "Чіткі умови гібридизації" можуть використовуватись для того щоб ідентифікувати нуклеотидні послідовності, які істотно ідентичні даній нуклеотидній послідовності. Чіткі умови залежать від послідовності та будуть різними за різних обставин. Здебільшого, приймається, що чіткі умови повинні бути приблизно на 5 °C нижчими, ніж точка плавлення (Tm) для специфічних послідовностей при визначеній іонній силі та pH. Tm - це температура (при визначеній іонній силі і pH), при якій 50 % послідовності-мішені гібридизується з ідеально підібраним зондом. У типовому випадку повинні бути обрані чіткі умови, за яких концентрація солі становить, приблизно, 0.02 моль при pH 7 і температурі, щонайменше, 60 °C. Зниження концентрації солі і/або підвищення температури робить умови більш строгими. Чіткі умови для РНК-ДНК гібридизації (Нозерн-блот з використанням зонду, напр., l00 нуклеотидів), являють собою, наприклад, такі умови, що включають, принаймні, одне промивання в 0.2X SSC при 63 °C протягом 20 хв, або аналогічні умови. Чіткі умови для ДНК-ДНК гібридизації (Саузерн-блот з 5 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 використанням зонду, напр., l00 нуклеотидів) являють собою, наприклад, такі умови, що включають, принаймні, одне промивання (здебільшого 2) в 0.2X SSC при температурі, щонайменше, 50 °C, здебільшого при 55 °C, протягом 20 хв, або аналогічні умови. Див. також Sambrook et al. (1989) і Sambrook and Russell (2001). "Ідентичність послідовності" і "подібність послідовності" можуть бути визначені за допомогою вирівнювання двох пептидів або двох нуклеотидних послідовностей з використанням алгоритмів глобального або локального вирівнювання. Послідовності тоді можуть бути названі як "істотно ідентичні" або "істотно подібні", коли вони (коли оптимально вирівняні за допомогою, наприклад, програм GAP, BESTFIT або Emboss program "Needle" (використовуючи параметри за замовчуванням, див. нижче) розділяють, щонайменше, певну мінімальну частку (у %) ідентичності послідовності (як визначено далі нижче). Ці програми використовують алгоритм глобального вирівнювання Needleman і Wunsch, для того щоб вирівняти дві послідовності уздовж всієї їх довжини, максимізуючи число відповідностей і мінімізуючи кількість розривів (гепів). Як правило, використовуються параметри за замовчуванням, зі штрафом початку розриву (gap creation penalty) = 10 і штраф межі поширення розриву (gap extension penalty) = 0,5 (обидва для вирівнювання нуклеотидів і білка). Для нуклеотидів використовується матриця скорингу за замовчуванням - nwsgapdna, а для білків - матриця скорингу по замовчуванню Blosum62 (Henikoff & Henikoff, 1992, PNAS 89, 915-919). Вирівнювання послідовностей і підрахунок частки (у %) ідентичності послідовності можуть, наприклад, бути визначені за допомогою комп'ютерних програм, таких як GCG Wisconsin Package, Version 10.3, доступних з Accelrys Inc., 9685 Scranton Road, San Diego, CA 92121-3752 USA або EMBOSS (http://www.ebi.ac.uk/Tools/webservices/services/ emboss). У альтернативному випадку відсоток подібності або ідентичності може бути визначений шляхом пошуку в базах даних, таких як FASTA, BLAST, тощо, але хіти повинні бути знайдені і вирівняні попарно для того, щоб порівняти ідентичність послідовностей. В цьому документі та у формулі винаходу дієслово "включати" та його словосполучення використовується в необмежуючому його значеіння сенсі та означає, що окремий елемент, після якого йде це слово, включається, але елементи, що спеціально не згадуються, не виключаються. Крім того, посилання на елемент за допомогою невизначеного артикля "a" або "an" не виключає можливість, що має місце більше, ніж один елемент, якщо з контексту чітко не випливає, що цей елемент один і лише один. Таким чином, невизначений артикль "a" або "an" переважно означає "щонайменше один". Крім того, зрозуміло, що при посиланні тут на "послідовності", як правило, це стосується дійсний фізичних молекул з певною послідовністю субодиниць (наприклад, амінокислот). Як тут використовується, термін "рослина" включає цілу рослину або будь-яку частину або її похідні, такі як органи рослини (наприклад, зібрані або не зібрані запасаючі органи, цибулини, бульби, плоди, листки та ін.), рослинні клітини, рослинні протопласти, культури рослинних клітин, з яких ціла рослина може бути регенерована, рослинні калуси, скупчення рослинних клітин, та інтактні рослинні клітини, або частини рослин, такі як зародки, пилок, насіннєві зачатки, плоди (напр., зібрані тканини або органи, такі як зібрані томати тощо), бульби (напр., картопля), квітки, листки, насіння, бульби, клонально розмножені рослини, корені, підщепи, стебла, кореневі кінчики та ін. Також включаються різні стадії розвитку, такі як сіянці, іматурні та дорослі рослини тощо. "Різновидність рослин" - це група рослин в межах одного й того ж ботанічного таксону найнижчої відомої градації, яка (незалежно від того, враховані або ні права селекціонерів рослин) може бути ідентифікована на основі проявів ознак, що визначаються певним генотипом або комбінацією генотипів, можуть бути відокремлені від іншої групи рослин за проявом принаймні однієї з цих ознак, і можуть розглядатись як об'єкт, що може бути розмножений без будь-яких змін. Відповідно, термін "різновидність рослин" не може бути використаний для позначення групи рослин, навіть у тому випадку, якщо вони того ж виду, якщо вони всі характеризуються наявністю одного локуса або гена (або низки фенотипових характерних особливостей завдяки цьому єдиному локусу або гену), однак які можуть за інших обставин надзвичайно відрізнятись один від одного, наче інші локуси та гени. "F1, F2 тощо" стосується послідовних споріднених поколінь, отриманих внаслідок схрещування між двома батьківськими рослинами або батьківськими лініями. Рослини, вирощені з насіння отриманого від схрещування двох рослин або ліній, називаються F1 покоління. Самозапилення рослин F1 призводить до отримання рослин покоління F2 тощо. Рослина "гібриду F1" (або насіння F1) - це покоління, отримане внаслідок схрещування двох інбредних батьківських ліній. "Популяція M1" - це сукупність насіння / рослин певної рослинної лінії або культивару, отриманих внаслідок мутагенезу. "M1, M2, M3, M4 тощо" стосуються 6 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовних поколінь, отриманих внаслідок самозапилення рослин, отриманих з насіння/рослин, що спочатку зазнало мутагенезу (M1). Термін "алель(і)" стосується будь-якої однієї або більшої кількості альтернативних форм гена у певному локусі, серед яких всі стосуються однієї характерної особливості або ознаки у специфічному локусі. У диплоїдних клітинах оргнізму, алелі даного гена локалізовані у певному положенні, або локусі (множина - локуси) на хромосомі. Один алель присутній на кожній хромосомі пари гомологічних хромосом. Вид диплоїдних рослин може включати велику кількість різних алелів в конкретному локусі. Це можуть бути ідентичні алелі гена (гомозиготні) або два різні алелі (гетерозиготні). Термін "локус" (множина - локуси) означає специфічне місце або місця на хромосомі, де виявлені, наприклад, ген або генетичний маркер. SlPP2C1 локус є, таким чином, положенням у геномі, де виявлений ген SlPP2C1. "Алель дикого типу" (ДТ) стосується тут версії гена, що кодує функціональний білок (білок дикого типу). Алель дикого типу SlPP2C1, наприклад, представлений на SEQ ID NO: 1. "Мутантна алель" стосується тут алеля, що включає одну або більше мутацій у кодуючій послідовності (мРНК або кДНК) або геномній послідовності порівняно з алелем дикого типу. Така мутація(ії) (напр., інсерція, інверсія, делеція і/або заміщення одного або більше нуклеотидів) може призвести до утворення білка, що має зменшену in vitro і/або in vivo функціональну здатність (знижену функцію) або характеризується відсутністю in vitro і/або in vivo функціональної здатності (втрата функції), напр., у зв'язку з тим, що білок, напр., усічений, має амінокислотну послідовність, в якій одна або більше амінокислот видалені, вставлені або заміщені. Такі зміни можуть призвести до утворення білка, що має відмінну 3D-конформацію, і спрямованого на різні субклітинні компартменти, мають модифікований каталітичний домен, мають модифіковану спорідненість до субстрату і/або специфічність, і т.д. "Стійкість до посухи" або "істотно підвищена стійкість до посухи" або "посухостійкі рослини" стосується тут (в середньому) істотно посиленої здатності рослинної лінії, культивару або різновидності витримувати нестачу води (водний дефіцит)/водний стрес/посуху у порівнянні з прийнятними контрольними рослинами (напр., рослинами дикого типу), тобто симптоми, пов'язані з водним стресом (напр., в'янення листків) є (статистично) істотно зменшеними у посухостійких рослин у порівнянні з контрольними рослинами за тих же умов водного стресу і/або (в середньому) швидкість відновлення і/або виживання і/або зібраного врожаю рослини після заподіяного водного дефіциту / водного стресу / посушливих умов є істотно вищими порівняно з контрольними рослинами, такими як рослини дикого типу. Існують різні методи визначення, або є рослина посухостійкою, як цьому буде дано тут пояснення. Переважно посухостійкі рослини мають значно вищу стійкість до посухи протягом всіх етапів розвитку: на стадії дорослих рослин, протягом цвітіння, протягом періоду зав'язування і розвитку плодів, протягом розвитку насіння, протягом дозрівання плодів. Крім того, рослини, переважно, мають також стійкість до посухи на стадії насіння і/або протягом стадії сіянця до (і включаючи) стадії дорослої рослини. "Рослина дикого типу" стосується тут рослини, що включає алель дикого типу (ДТ) SlPP2C1, що кодує функціональний білок (напр., на противагу "мутантній рослині", яка включає мутантний алель SlPP2C1). Такі рослини є прийнятними для використання у контролі при оцінці фенотипу. Переважно, рослини дикого типу і/або мутантні рослини - "культивовані рослини", тобто різновидності, селекційні лінії або культивари видів, що культивуються людиною і мають хороші агрономічні характеристики; переважно, такі рослини не є "дикими рослинами", тобто, рослини, які переважно є менш урожайними і мають нижчі агрономічні характеристики, ніж культивовані рослини і, напр., ростуть в природних популяціях. "Дикі рослини" включають, напр., екотипи, інтродуковані лінії, раси або надходження з природи або дикі родичі видів, або так звані "heirloom" різновиди або культивари, тобто різновидності або культивари, що зазвичай вирощувались протягом ранніх періодів історії людства, однак які не використовуються в сучасному сільському господарстві. "Посуха" стосується, переважно, як короткочасної нестачі води або стресу (штучного, напр., жодного зволоження грунту і/або природного, напр., не випадає жодного дощу), що становить, наприклад, 30 днів, 20 днів, 15 днів, 14 днів, 10 днів, 9, 8, 7, 6, 5 днів, або менше і/або тривалішого терміну нестачі води (водного дефіциту) або стресу (штучного, напр., жодного зволоження грунту і/або природного, напр., не випадає жодного дощу), напр., що становить або перевищує 31 день, 35 днів, 40 днів, 45 днів, 50 днів, 60 днів, 70 днів, 80 днів, 90 днів або більше. "Варіанти" гена SlPP2C1 або білка включають як природні алельні варіанти, виявлені в межах виду S. lycopersicum, так і ортологи, виявлені у інших видів рослин, таких як інші види дводольних або однодольних рослин. 7 UA 110774 C2 5 10 15 20 25 ДОКЛАДНИЙ ОПИС ВИНАХОДУ Цей винахід присвячений дослідженню генів, які диференційно експресуються протягом періоду зав'язування плодів томатів, шляхом здійснення транскриптомного аналізу (cДНК-AFLP) запилених зав'язей і зав'язей, оброблених гібереловою кислотою (GA3) (Vriezen et al. 2008, New Phytologist 177:60-76). Один ген, для якого характерний відносно високий рівень експресії в незапліднених зав'язях і дещо нижчий - в запліднених, корелюючий з рівнями АБК (абсцизової кислоти) (високим у незапилених зав'язях і низьким після запилення) характеризується далі утворенням трансгенних рослин, для того щоб дослідити роль цього гена в АБК сигналингу. Ген томатів було названо SlPP2C1 (Solanum lycopersicum PP2C1), оскільки він кодує білок, утворений 397 амінокислотами, який включає каталітичний домен серин/треонінфосфатази 2C в C-термінальній ділянці між, приблизно, 84 і 391 амінокислотами (як було визначено із застосуванням InterProScan). Було виявлено, що ген SlPP2C1 включений в АБК сигналинг, і що надекспресія цього гена під контролем CaMV 35S промотора призводить до розвитку рослин, які є менш чутливими до дії фітогормона АБК, ніж рослини дикого типу, разом з тим рослини, у яких цей ген косупресується (що має значно нижчий рівень SlPP2C1 транскрипта в, принаймні, тканині листка, ніж рослини дикого типу), мали вищу чутливість до АБК (див. Приклади). Знижені рівні білка SlPP2C1 (дикого типу), таким чином, посилюють чутливість до АБК, що свідчить про те, що SlPP2C1 білок є негативним регулятором АБК сигналингу. Крім того, слід відзначити, що було виявлено, що рослини томатів, у яких рівні транскрипту SlPP2C1 були значно нижчими у порівнянні з рослинами дикого типу, не виявили жодних ознак в'янення після 9 днів вирощування за умов водного дефіциту, в той час як рослини дикого типу мали зів'ялі листки, а рослини з надекспресією SlPP2C1 виявляли значні ознаки в'янення. Це є тим більше цікавим, оскільки ген SlPP2C1 і білок SlPP2C1 не мають будь-якої суттєвої ідентичної послідовності з будь-яким відомим негативним регулятором чутливості до АБК, який відіграє певну роль у посухостійкості у Arabidopsis, таким як ABU і HAB1, або з будь-яким білком групи A, див. Таблицю 1 нижче. Таблиця 1 Ідентичність послідовності між білками Arabidopsis (очікувана), залученими до АБК сигналингу (Schweigerhofer et al. 2004, supra, див. Фігуру 1, група A) і SlPP2C1 білка. Білок SlPP2C1 (%ідентичності послідовності) Arabidopsis PP2C підгрупаA At5g51760 (AHG1) At3gl 1410 (AtPP2CA, 38,8 At5g59220 38,6 Atlg07430(AIPl) 37,5 At2g29380 39,8 Atlgl7550(HAB2) 33,5 Atlg72770(HABl) 32,0 At4g26080 (ABU) 36,0 At5g57050 (ABI2) 30 32,3 37,6 Ідентичність послідовності визначається шляхом попарного порівняння уздовж всієї довжини з використанням програм Needle (Emboss), Blossum 62 matrix, зі штрафом початку розриву = 10, зі штрафом розширення межі розриву = 0,5 Ідентичність послідовності SlPP2C1 білка до Arabidopsis PP2C, підгрупа A, є, таким чином, низькою. Слід зазначити, що нульові мутації (T-ДНК інсерції, внаслідок чого мРНК не 8 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначаються за допомогою полімеразно-ланцюгової реакції зі зворотною транскрипцією - ЗТПЛР (RT-PCR) в білку, до якого була виявлена найвища подібність, At2g29380, не виявляють жодних змін в чутливості Arabidopsis до АБК (Yoshida et al, 2006, Plant Physiology 140:115-126). Крім того, цей ген експресується в коренях і стручках Arabidopsis, але не в листках і суцвіттях (див. Фіг. 5 Xue et al. 2008. BMC Genomics 9:550). Дані про те, що SlPP2C1 залучений до розвитку посухостійкості у томатів, може бути використаний для отримання трансгенних і/або нетрансгенних рослин з підвищеною стійкістю до посухи і, переважно, бажаними агрономічними характеристиками. Різні втілення винаходу описані тут нижче і в необмежуючих Прикладах. Рослини, описані тут, які застосовуються при трансгенному підході, як правило, також використовуються і при нетрансгенному підході і vice versa, якщо інше не обумовлено. В одному втіленні забезпечуються трансгенні рослини, в яких ендогенна експресія SlPP2C1 даун-регулюється або сайленсується, принаймні, в листковій тканині, і які є посухостійкими. В іншому втіленні забезпечуються нетрансгенні рослини, які включають одну або дві мутантні алелі SlPP2C1 (в гомозиготній або гетерозиготній формі) і де вказаний мутантний алель(лі) кодує (ють) SlPPC1 білок, що має знижену функціональну здатність in vitro і/або in vivo у порівнянні з білком дикого типу, або взагалі функціональність відсутня, і, таким чином, мутація призводить до утворення рослин (мутантної лінії або її потомства), які мають істотно піідвищену стійккість до посухи у порівнянні з рослинами, що втратили мутантний алель (лі) (рослини дикого типу). Такі нетрансгенні, посухостійкі рослини є в одному втіленні винаходу, отримані за допомогою TILLING або Eco-TILLING, однак також можуть бути отримані з використанням інших відомих методів мутагенезу у поєднанні з селекційними методами. Таким чином, в одному втіленні мутантний алель SlPP2C1 індукується та ідентифікується людиною, за допомогою методик мутагенезу ("індукований мутант"), тоді як в іншому втіленні винаходу мутантний алель SlPP2C1 є "природним мутантом", означаючи, що він був виявлений в природних рослинних популяціях. "Індуковані мутанти", переважно, отримують, використовуючи гермплазму культивованих рослин і, таким чином, вони безпосередньо присутні у лініях, що становлять інтерес з агрономічної точки зору. З іншого боку, "природні мутанти" або "спонтанні мутанти" або "природні варіанти" або "природні варіанти/варіації алелів" грунтуються на природному варіюванні (поліморфізмі/мутаціях), виявленому у виді, і є, таким чином, очевидно присутні у рослинному матеріалі високої агрономічної якості, який не культивується в сучасному сільському господарстві, напр., дикі (природні) рослини. У такому випадку існує потреба у перенесенні таких алелів в культивовані рослини, що мають хороші агрономічні характеристики, що є втіленням винаходу. Стрес, обумовлений посухою, або дегідратаційний стрес є одним із найбільш серйозних видів абіотичного стресу, від якого рослини потерпають у всьому світі. Чотири десятих світових земель, що використовуються у сільському господарстві, лежать у аридних і напіваридних регіонах. Крім цього, рослини, що вирощуються в областях з відносно високим рівнем опадів, можуть страждати від посухи протягом сезону росту. Багато аграрних районів мають низький рівень опадів і залежать від зрошення, для того щоб підтримувати високі рівні врожаю та якість продуктів. Забезпечення або підвищення стійкості сільськогосподарських рослин до тривалої та короткочасної посухи і зменшення потреби у воді цих культур, що вирощуються на зрошуваних землях, є надзвичайно важливим. Рослини, що забезпечуються даним винаходом, мають нижчі потреби до зволоження і/або вищий урожай і/або вищий відсоток виживання при вирощуванні у регіонах, що зазнають короткочасного або тривалого періоду посухи. Послідовності нуклеїнових кислот і білки згідно винаходу В одному втіленні винаходу забезпечуються послідовності нуклеїнової кислоти і амінокислотні послідовності SlPPC1, а також способи для виділення або ідентифікації їх "варіантів", наприклад, варантів алелів в межах виду (Solanum lycopersicum) або в межах роду Solanum, або ортологів SlPP2C1 у інших видів рослин, таких як види овочевих або зернових культур. Білок дикого типу SlPP2C1 (походить від культивару томатів Moneymaker) зображений на послідовності SEQ ID NO: 2. Це білок, що складається з 397 амінокислот, які включають (очікуваний) серин/треонінфосфатазу 2C каталітичний домен в C-термінальній ділянці між, приблизно, 84 і 391 амінокислотами. Зокрема, домен включає амінокислоти Аспарагін-XaaФеніл-Лейцин-Ізолейцин-Лейцин-Аланін-Серин-Аспарагін-Гліцин-Лейцин-Триптофан-АспарагінВалін (причому Xaa може бути будь-якою амінокислотою, але, переважно, Glu, див. амінокислоти 307-320 послідовності SEQ ID NO: 2). Існує також (очікуваний) сайт зв'язування марганець/магній аспартат) від амінокислоти 147 до 149 (DGH або Asp-Gly-His, де Asp зв'язує магній або марганець). В альтернативному випадку, домен, який включає або складається з 9 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислот від 144 до 150, напр., GVXDGHG (де X - це будь-яка амінокислота, пеереважно Y), може бути включений у взаємодію з протеїнкіназами. "SlPP2C1 білок" (включаючи його "варіанти", такі як білки, що кодуються алельними варіантами гена або ортологами гена) може бути визначений як їх амінокислотна послідовність, ідентична SEQ ID NO: 2 по всій довжині, тобто білки, що мають ідентичність послідовності, щонайменше, близько 47 %, 48 %, 49 %, 50 % або більше (так як, але не обмежена, 55 %, 60 %, 70 %, 80 %, 85 %, 90 %, 95 %, 98 %, 99 % або більше) до послідовності SEQ ID NO: 2 (як визначено шляхом попарного вирівнювання за допомогою програм Emboss "Needle", матриці Blossum 62, зі штрафом початку розриву =10, зі штрафом розширення межі розриву = 0.5) і виявляють in vivo функцію, яка надзвичайно подібна до такої, що виявляє SlPP2C1. Також тут включені мутанти з втратою функції білків SlPP2C1 дикого типу (або їх варіанти, як визначено вище) або мутанти зі зниженою функцією білків SlPP2C1 дикого типу (або їх варіанти), як описано в іншому місці, а також рослини або частини рослин, які включають один або більше нуклеотидів, що кодують такі мутанти і мають підвищену посухостійкість порівняно з рослинами, що включають послідовність нуклеїнової кислоти, що кодує білок дикого типу. Переважно, білок SlPP2C1 згідно з винаходом, також включає, щонайменше, один каталітичний серин/треонінфосфатазний домен в C-термінальній ділянці, тобто домен, який складає, щонайменше, 60 %, 70 %, 80 %, 90 % або, переважно, щонайменше, 95 %, 98 %, 99 % або більше ідентичності амінокислотних послідовностей амінокислотам від 84 до 391 послідовності SEQ ID NO: 2 (як визначено шляхом попарного вирівнювання за допомогою програм Emboss "Needle", матриці Blossum 62, зі штрафом початку розриву = 10, штраф розширення межі розриву = 0,5). В одному втіленні SlPP2C1 білок згідно з винаходом включає послідовність Аспарагін-Xaa-Феніл-Лейцин-Ізолейцин-Лейцин-Аланін-Серин-Аспарагін-ГліцинЛейцин-Триптофан-Аспарагін-Валін (причому Xaa - може бути будь-яка амінокислота, але, переважно, глутамінова кислота) або послідовність, що має 90 % або 95 % або 98 % або більше ідентичності послідовності до цієї послідовності (як визначено шляхом попарного вирівнювання за допомогою програм Emboss "Needle", матриці Blossum 62, зі штрафом початку розриву =10, штраф розширення межі розриву = 0,5). Крім того, переважно, SlPP2C1 білок включає, щонайменше, один DGH мотив, тобто, щонайменше, одну DGH послідовність або GVXDGHG послідовність (де X - будь-яка амінокислота, переважно Y). "Функція, яка суттєво подібна до функції SlPP2C1" стосується тут білка, що має доведену функцію щодо чутливості/стійкості до водного стресу і/або у визначенні чутливості рослинної тканини до АБК. Рослини, що надекспресують SlPP2C1, або їх варіанти, принаймні у тканині листка, є значно більш сприйнятливі до водного стресу, ніж рослини дикого типу і/або мають значно зменшену чутливість до АБК у порівнянні з контролем (напр., рослини дикого типу або рослини, трансформовані пустим вектором). Vice versa, рослини зі зниженим рівнем повністю функціонального (дикого типу) SlPP2C1 білка, або його варіанту, принаймні у тканині листка, є значно менше сприйнятливими до водного стресу, ніж рослини дикого типу і/або мають значно вищу чутливість до АБК порівняно з контролем. Таким чином, функція (очікувана) SlPP2C1 білка може бути протестована за допомогою цілої низки відомих методів, переважно шляхом порівняння фенотипу трансформованих рослин, що конститутивно експресують білок, що тестується, з фенотипом трансформованих рослин того ж виду-господаря (і різновиду), які надекспресують SlPP2C1 (переважно, включаючи химерний ген, що кодує SlPP2C1, стійко інтегрований в геном рослини-господаря), що дає змогу здійснювати безпосереднє порівняння функціонального впливу на фенотип трансормантів. Аналогічно, трансформанти, у яких ген SlPP2C1 (або варіант) сайленсується або підлягає даун-регуляції (напр., мРНК SlPP2C1 суттєво знижена, принаймні, у тканині листка, порівняно з контрольними рослинами дикого типу або трансформованими рослинами), можуть бути використані для визначення функції. "Суттєве зменшення" мРНК транскрипту SlPP2C1 стосується досліджуваної мРНК, яка представлена на рівні, меншому ніж, або дорівнювати 90 %, 80 %, 70 %, 60 %, 50 % 40 %, 30 %, 20 % або меншому (10 %, 5 % або 0 %) рівню цього транскрипту, виявленому у контрольних рослин дикого типу або у трансформованих рослин (напр., трансформованих пустим вектором). Зрозуміло, що в будь-яких експериментах, пов'язаних з трансформацією, має місце певний ступінь зміни фенотипу трансформантів, як правило, завдяки впливу положення в геномі і/або завдяки кількості копій. Досвідчена особа знає, як порівнювати трансформанти один з одним, напр., шляхом відбору кількості проявів окремої копії і аналізуючи їх фенотипи. Інші методи визначення або підтвердження in vivo функції ген/білок включає отримання нокаутних мутантів або мутантів зі зниженою функцією або дослідження тимчасової експресії. Дослідження експресії репортерного гена і промоторної 10 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності може також забезпечити інформацію як щодо часово-просторового типу експресії, так і ролі білка. Конститутивна (над)експресія SlPP2C1 гена, або гена, що кодує його варіант, повинна призводити до однієї або більшого числа наступних фенотипових змін порівняно з рослиною дикого типу або контрольними трансформантами: - істотне підвищення чутливості до водного стресу (тобто, істотне зменшення стійкості до посухи) і/або - істотне зниження чутливості до АБК. "Істотно підвищена чутливість до водного стресу" або "істотно знижена стійкість до посухи" стосується середнього, статистично вірогідного зростання симптомів скручування листків сукупності рослин, що несуть алель SlPP2C1, щонайменше, на 10 % порівняно з контрольними рівнями і можуть, наприклад, бути протестовані, як описано в Прикладах або аналогічних експериментах. Якщо стисло, то сукупність (напр., щонайменше, 10, 15, 20 або більше трансгенних ліній) трансформованих рослин і контрольних рослин того ж віку (напр., дорослі рослини) насичуються водою на початку експерименту, після чого не зволожуться протягом тривалого проміжку часу, напр., щонайменше, приблизно 7, 8, 9, 10, 11, 12, 13, 14 днів або більше, напр., 3 тижні або 4 тижні або більше (залежно від виду рослин). Коли контрольні рослини розпочинають виявляти ознаки в'янення листків ("легке в'янення" або "помірне в'янення"), проводиться візуальна оцінка всіх рослин щодо наявності ознак в'янення листків. Симптоми в'янення листків можуть, наприклад, бути обчислені за шкалою від 4 до 1, зокрема "сильно/серйозно зів'ялі" (4), "помірно зів'ялі" (3), "дещо зів'ялі" (2) або "в'янення відсутнє" (1). Вважають, що рослини мають істотно знижену стійкість до посухи, якщо (в середньому) в'янення підвищується, щонайменше, на 10 %, переважно, щонайменше, на 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % або 100 % порівняно з контрольними рослинами дикого типу (або рослинами, трансформованими пустим вектором). Альтернативно або як доповнення, можуть бути проведені польові випробування, для того, щоб протестувати, або /або підтвердити, помітна або ні істотно знижена стійкість до посухи у рослин, які зазнали впливу водного стресу. Звичайно, можуть бути використані інші методи аналізу. Наприклад, за періодом зневоднення може йти період відновлення (зволоження) і може бути здійснена оцінка виживання рослин (у відсотках), див., напр., Zheng et al. (2009, Biochemical and Biophysical Research Communications 379: 986, LH Column). Вважають, що рослини мають істотно знижену стійкість до посухи, якщо відсоток виживання зменшується, щонайменше, 10 %, переважно, щонайменше, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % або 100 % у порівнянні з контрольними рослинами дикого типу (або рослинами, трансформованими пустим вектором). Див. також Xiong et al. 2006 (Plant Physiology 142: 1065-1074) і Yu et al. 2008 (The Plant Cell 20: 1134-1151). "Істотно знижена чутливість до АБК" може бути перевірена, як описано в Прикладах, шляхом тестування відсотка проростання насіння на одній або більше різних концентраціях АБК і/або подовження коренів на одній або більше різних концентраціях АБК. В результаті, проростання насіння на середовищі, яке містить АБК, становить, щонайменше, 5 %, 10 %, 20 %, 30 %, 40 %, 50 % або більше, вище для трансформанта, який надекспресує SlPP2C1, ніж для контрольного насіння на тій же концентрації АБК. Наприклад, на 1 або 3 мкM АБК, 50 % насіння дикого типу проростає, тоді як насіння трансформанта, який надекспресує SlPP2C1, проростає 55 %, 60 % або більше. Таким чином, проростання насіння трансформантів, для яких характерна надекспресія, менше інгібується АБК. Ріст коренів/подовження у трансформованих рослин, для яких характерна надекспресія, також менше інгібується АБК. Даун-регуляція або сайленсинг SlPP2C1 гена, або ген, що кодує певний варіант, повинні призводити до однієї або більшого числа наступних фенотипових змін порівняно з рослиною дикого типу або контрольними трансформантами: - істотне зниження чутливості до водного стресу (тобто істотне підвищення стійкості до посухи) і/або - істотно підвищена чутливість до АБК. "Істотно знижена чутливість до водного стресу" або "істотно підвищена стійкість до посухи" стосується середнього, статистично вірогідного зменшення симптомів в'янення листка рослин, у яких SlPP2C1 ген зазнає даун-регуляції або сайленсингу, до, щонайменше, 10 % порівняно з контрольними рівнями (напр., у рослин дикого типу або рослин, трансформованих пустим вектором) і може, наприклад, бути протестована, як описано в Прикладах або за допомогою аналогічних методів. Стисло, сукупність трансформованих рослин (напр., щонайменше, 10, 15, 20 або більше трансгенних ліній) і контрольні рослини цього ж віку насичуються водою на початку експерименту, після чого не поливаються протягом тривалого періоду, напр., 11 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше, близько 7, 8, 9, 10, 11, 12, 13, 14 днів або більше, напр., 3 тижнів або 4 тижнів або більше (залежно від виду рослин). Коли контрольні рослини розпочинають виявляти ознаки в'янення листків ("слабке в'янення" або "помірне в'янення"), всі рослини оцінюються щодо проявів в'янення листків використовуючи, напр., візуальну оцінку. Симптоми в'янення листків можуть, наприклад, бути підраховані за шкалою від 1 до 4, як "сильно/серйозно зів'ялі " (4), "помірно зів'ялі" (3), "дещо зів'язі" (2) або "не зів'ялі" (1). Ввадають, що рослини мають істотно посилену стійкість до посухи, якщо (в середньому) в'янення зменшується до, щонайменше, 10 %, переважно, щонайменше, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % або 100 % у порівнянні з контрольними рослинами. На доповнення до цього і як альтернативний варіант можуть бути проведені польові випробовування, для того щоб з'ясувати, або пов'язана істотно підвищена стійкість до посухи з даун-регуляцією або сайленсингом ендогенного SlPP2C1 гена(ів). Звичайно, можуть бути використані інші способи оцінки. Зокрема, після періоду зневоднення може йти період відновлення вмісту води (зволоження) і може бути оцінений відсоток виживання рослин, див., напр., Zheng et al. (2009, Biochemical and Biophysical Research Communications 379: 986, LH Column). Зазначені рослини мають істотно підвищену стійкість до посухи, якщо відсоток виживання підвищується на, щонайменше, 10 %, переважно, щонайменше, на 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % або 100 % у порівнянні з контрольними рослинами дикого типу (або з рослинами, трансформованими "пустим" вектором). Див. також Xiong et al. 2006 (Plant Physiology 142: 1065-1074) і Yu et al. 2008 (The Plant Cell 20: 1134-1151). Зазначені вище методи оцінки, або аналогічні методи кількісного аналізу, можуть також бути використані для того щоб визначити, або має рослина, що несе мутантний алель SlPP2C1 (напр., мутант з втраченою або зниженою функцією) істотно підвищену стійкість до посухи, як буде описано далі нижче. "Значно підвищена чутливість до АБК" може також бути протестована, як описано в Прикладах. Таким чином, середнє значення проростання насіння на середовищіі, що містить АБК, становить, щонайменше, 10 %, 20 %, 30 %, 40 %, 50 % або більше, нижче для трансформованих рослин, для яких характерна даун-регуляція або сайленсинг SlPP2C1, ніж для контрольних рослин (напр., дикого типу) на середовищі з тією ж концентрацією АБК. Наприклад, при концентрації АБК 1 або 3 мкM, проростає 50 % насіння дикого типу, в той час як насіння трансформованих рослин (з сайленсингом SlPP2C1) проростає менше, ніж 40 %, 35 %, 30 % або менше. Таким чином, проростання насіння трансформантів з даун-регуляцією або сайленсингом SlPP2C1 більше інгібується АБК. Ріст коренів трансформантів з даун-регуляцією або сайленсингом також більше інгібується АБК. Точні методи, що можуть бути використані, дуже різноманітні, залежно від виду рослин. Методики кількісної оцінки для визначення стійкості до посухи і/або чутливості до АБК у видів овочевих рослин або польових культур відомі з рівня техніки. Також зрозуміло, що для оцінки фенотипів існують альтернативні методи. Такими методами володіє досвідчений фахівець у цій галузі. Зазначені вище методи можуть бути використані, для того щоб з'ясувати, або є будь-який очікуваний ген SlPP2C1, такий як алель природного виду томатів або культивованих рослин томатів, або з селекційної лінії томатів або лінії інтродукованих рослин, або з різних видів (напр., тютюну або інших видів овочевих рослин або видів польових культур), дійсно варіантом SlPP2C1, який надалі може бути використаний для отримання трансгенних і/або нетрансгенних рослин, що мають (значно) підвищену посухостійкість у порівнянні з відповідними контрольними рослинами, такими як рослини дикого типу. Зрозуміло, що дослідні трансгенні рослини, переважно рослини, які мають хороші агрономічні характеристики трансформуються і регенеруються, тобто культивовані рослини (наприклад, високоурожайні культивари або селекційні лінії) і що переважна більшість прийнятних контрольних рослин - це рослини тієї ж лінії, трансформовані пустим вектором, або сукупність рослин нетрансформованої лінії. Крім того, для оцінки активності/функціональної здатності білка може бути проведений тест in vitro на активність фосфатази, див. напр., Gosti et al. 1999, Plant Cell 11: 1897-1910, Material and Methods-PP2C Activities, page 1907, де білок експресується у E. coli, а ферментативна 32 активність визначається за допомогою міченого P казеїну як субстрату. Такі методи оцінки активності також прийнятні для визначення, або зберігають білки специфічних типів мутанта SlPP2C1 (напр., отриманого за допомогою TILLING або інших методів, див. повсюди у цьому тексті) або химерні білки всю або часткову функціональну здатність. Див. також Bertauche et al., 1996, Eur. J. Biochem 241: стор. 195 для дослідження фосфатів, а стор. 194 - для експресії у E. coli. 12 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 Білок SlPP2C1 має "знижену функціональну здатність in vitro", якщо відсоток 32 дефосфориляції P-казеїну мутантним білком дорівнює або менший, ніж 70 % порівняно з білком дикого типу (за тих же експериментальних умов, напр., 1 або 2 мкг білка інкубується з 32 ° P-казеїном протягом 2 годин при 30 С в присутності 20 мM ацетату магнію, і в присутності окадаїкової кислоти), переважно, дорівнює або менший, ніж, приблизно, 60 %, 50 %, 40 %, 30 %, 20 %, 10 % ("редукція функції") або приблизно 0 % білка дикого типу (тобто повна "втрата функції "). Якщо білок має знижену функцію in vitro, це може свідчити про те, що цей білок має також "знижену функцію або ця функція відсутня in vivo", тобто in planta, напр., щонайменше, у тканині листка і/або тканині плода. Наприклад, рослина, що включає одну (гетерозиготна) або дві (гомозиготна) алелі, що кодують мутантний білок, який має знижену функцію або характеризується її відсутністю in vitro, призводить до утворення рослин з істотно підвищеною стійкістю до посухи (у порівнянні з рослинами, у яких відсутній мутантний алель / мають алелі дикого типу) і, відповідно, також знижену функцію або відсутність цієї функції in vivo. Зниження функції або втрата функції білка in vivo підтверджується шляхом аналізу посухостійкості (напр., у польових умовах або як описано у Прикладах) рослин, гомозиготних або гетерозиготних за мутантним алелем. Інші очікувані SlPP2C1 гени/білки можуть бути ідентифіковані in silico, напр., шляхом ідентифікації послідовностей нуклеїнових кислот або білкових послідовностей в існуючих базах даних нуклеїнових кислот або білків (напр., GENBANK, SWISSPROT, TrEMBL), а також із використанням стандартного програмного забезпечення аналізу послідовностей, таких як засоби пошуку подібності у послідовностях (BLASTN, BLASTP, BLASTX, TBLAST, FASTA, та ін.). Очікувані амінокислотні послідовності або послідовності нуклеїнової кислоти, які включають або кодують білок SlPP2C1 (як було визначено вище) відбираються, клонуються або синтезуються de novo і досліджуються щодо функціональної здатності in vivo із застосуванням, напр., надекспресії або сайленсингу в клітині господаря. Слід зазначити, що позначення SlPP2C1 тут використовується також для білків, що походять з видів, інших ніж Solanum lycopersicum, тобто префікс Sl не означає, що білок походить з конкретного виду. Один очікуваний ортолог гену томатів SlPP2C1 і білок є білком картоплі SEQ ID NO: 15 (StPP2Cl), закодований кДНК послідовності SEQ ID NO: 14 (StPP2Cl). Білок StPP2Cl має 89,1 % ідентичності амінокислотної послідовності з SlPP2C1 і 91,5 % ідентичності амінокислотної послідовності з SlPP2C1 (використовуючи Emboss-Needle, зі штрафом початку розриву = 10,0, штраф розширення межі розриву = 0,5, і Blosum62 для білків або dnafull - для нуклеїнових кислот). Білки SlPP2C1, згідно з цим винаходом, можуть бути ізольовані з природних джерел, синтезовані de novo шляхом хімічного синтезу (за допомогою синтезатора пептидів, які постачаються Applied Biosystems) або отримані за допомогою рекомбінантних клітин-господарів (напр., E. coli). SlPP2C1 білки, згідно з винаходом, можуть бути використані для отриманнія моно- або поліклональних антитіл, які можуть бути використані, наприклад, для визначення SlPP2C1 білків в зразках тканини, таких як листки (метод імунохімічного аналізу та за допомогою набору для аналізу). В одному втіленні забезпечуються мутанти зі зменшеною функцією або втратою функції білків SlPP2C1, також рослини і частини рослин, які містять один або більше алелів SlPP2C1, які кодують мутанти зі зменшеною функцією або втратою функції. Мутація будь-якого типу може призвести до редукції функції або втрати функції закодованого білка, напр., інсерція, делеція або заміщення одного або більшого числа нуклеотидів в послідовності кДНК (SEQ ID NO: 1, або варіанти) або у відповідній геномній послідовності SlPP2C1 (SEQ ID NO: 11 або варіанти). "Відповідна геномна послідовність" - це послідовність ендогенної ДНК (зображена в послідовності SEQ ID NO: 11, або її варіантах), серед яких SEQ ID NO: 1 мРНК (кДНК), або транскрибується варіант мРНК. Ділянка геному дикого типу, яка транскрибується в мРНК, включає нуклеотиди від 2591 до 5050, які включають 5' UTR (нуклеотиди 2591-2675 послідовності SEQ ID NO: 11), два інтрони і 3' UTR (нуклеотиди 4976-5050 послідовності SEQ ID NO: 11). Функції таких білків in vitro і/або in vivo може бути протестована, як описано вище. Рослини, які включають послідовність нуклеїнової кислоти, що кодує такі білки з редукованою або втраченою функцією, і мають підвищену стійкість до посухи, можуть, наприклад, бути отримані за допомогою TILLING або ідентифіковані з використанням EcoTILLING, як буде описано нижче. В одному втіленні винаходу (кДНК або геномна) послідовності нуклеїнових кислот, що кодують такі мутантні білки, включають одну або більше несмислових і/або місенс-мутації, напр., заміни (заміщення пурину іншим пурином (A ↔ G) або піримідину іншим піримідином (C ↔ T)) або трансверсії (заміщення пурину піримідином, або vice versa (C/T ↔ A/G). В одному 13 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 втіленні несмислова і/або місенс-мутація (ї) є в нуклеотидній послідовності, що кодує Cтермінальну ділянку, переважно в (очікуваному) каталітичному домені амінокислоти від 84 до 391 послідовності SEQ ID NO: 2 (або в суттєво подібному домені варіанту SlPP2C1 білка, тобто в домені, що має амінокислотну ідентичність, щонайменше, 80 %, 90 %, 95 %, 98 %, 99 % до цього домену). В іншому втіленні несмислова (нонсенс) і/або місенс-мутація(ї) є в послідовності нуклеїнової кислоти, що кодує амінокислотну послідовність 307-320 SEQ ID NO: 2 (або її варіант). В іншому втіленні несмислова (нонсенс) і/або місенс-мутація(ї) є послідовність нуклеїнової кислоти, що кодує очікуваний сайт зв'язування магнію, тобто Asp-Gly-His (амінокислоти 147-149 послідовності SEQ ID NO:2 або їх варіант) і/або в послідовності нуклеїнової кислоти, що кодує очікуваний домен білок-кіназної взаємодії (амінокислоти 144-150 послідовності SEQ ID NO: 2 або суттєво подібний домен в варіанті SlPP2C1 білка). У специфічному втіленні послідовності нуклеїнової кислоти, що кодують такі мутантні білки, несуть одну або більше місенс-мутацій в амінокислотах Glyl48, Serl71, Alal55, Glyl32 послідовності SEQ ID NO: 2 (або аналогічних амінокислотах у варіанті білка SlPP2C1). Також тут охоплені мутантні рослини, насіння і частини рослин, що несуть одну або більше з вище названих місенс-мутацій і відрізняються значно підвищеною стійкістю до стресу, насамперед, стійкістю до посухи. У специфічному втеленні винаходу також забезпечуються посухостійкі рослини, які включають мутантні алелі SlPP2C1, пов'язані з втратою функції або редукцією функції, наприклад, внаслідок чого мутантні алелі включають місенс-мутацію в нуклеотидній послідовності, що кодує GVXDGHG (причому X є будь-якою амінокислотою, переважно Y), або суттєво подібну послідовність (виявляє, щонайменше, 80 %, 90 %, 95 %, 98 %, 99 % амінокислотної ідентичності до цього домену), що призводить до того, що, принаймні, одна амінокислота заміщується, утворюючи, наприклад, DVXDGHG або GVXDGHD, або DVXDGHD, або GVXDDHG. Функція специфічних доменів, таких як N-термінальний або каталітичний домен магнійзв'язуючий домен і/або домен білок-кіназної взаємодії, може бути проаналізована шляхом видалення всього або частини домену (ів) в SlPP2C1 білку або введення однієї або більшої кількості мутацій в домен, аналізуючи виявлений вплив на функцію SlPP2C1 білка. Аналогічним чином, рослини зі спонтанними або індукованими мутаціями (напр., отриманими з використанням TILLING або ідентифікованими із застосуванням EcoTILLING) можуть бути проаналізовані щодо наявності мутацій і фенотипу рослини, яка несе мутацію, зокрема, стійкість до посухи. В одному втіленні, SlPP2C1 білок з втраченою функцією або редукованою функцією є усічений білок, тобто фрагмент будь-якого білка серед SlPP2C1 білків, визначених вище (включаючи його варіанти). Загалом EMS (етилметансульфонат) індукує заміни гуаніну/цитозину на аденін/тіамін. У випадку з глутаміном (Gin або Q, закодований нуклеотидами CAA або CAG) або аргініном (Arg або R, закодований нуклеотидами CGA) кодон, заміна цитозину на тіамін може призвести до введення стоп-кодону в рамку зчитування (наприклад, CAA/CAG/CGA to TAA/TAG/TGA), а, отже, до утворення усіченого білка. Усічений білок може, наприклад, включати амінокислоти від однієї до будь-якої з Gin (закодованої CAA або CAG) або Arg амінокислот (закодованих CGA) справа від старт-кодону послідовності SEQ ID NO: 2, або варіанту послідовності SEQ ID NO: 2. У альтернативному випадку, усічений білок може, наприклад, включати або складатись з амінокислот 1-5, 1-1-20, 1-28, 1-33. 1-35, 1-36, 140, 1-43, 1-44, 1-46, 1-48, 1-49, 1-5-. 1-51, 1-54, 1-57, 1-66, 1-70, 1-71, 1-72, 1-73, 1-83 °F SEQ ID NO: 2, або 1-85, 1-88, 1-91, 1-93, 1-94, 1-97, 1-104, 1-106, 1-110, 1-120 1-130, 1-141, 1-149, 1-151, 1-160, 1-170, 1-200, 1-301, 1-302, 1-305, 1-307, або інші усічені білки SlPP2C1 (SEQ ID NO: 2), або їх варіанти. Також забезпечуються послідовності нуклеїнової кислоти (геномна ДНК, кДНК, РНК), що кодують SlPP2C1 білки, такі як, наприклад, SlPP2C1, зображені в послідовності SEQ ID NO:2 або їх варіанти, як визначено вище (включаючи будь-які описані химерні або гібридні білки або мутовані білки або усічені білки), або будь-який SlPP2C1 білок іншого виду. Через виродження генетичного коду різні послідовності нуклеїнової кислоти можуть кодувати одну й ту ж амінокислотну послідовність. Будь-яка послідовність нуклеїнової кислоти, що кодує SlPP2C1 білок (як визначено вище, включаючи його варіанти), називається тут як SlPP2C1. Забезпечені послідовності нуклеїнової кислоти включають існуючі в природі, штучні або синтезовані послідовності нуклеїнової кислоти. Послідовності нуклеїнової кислоти, що кодують SlPP2C1, забезпечуються в послідовності SEQ ID NO: 1 (кДНК послідовність з томатів) і послідовності SEQ ID NO: 11 (геномна ДНК з томатів, що кодує SlPP2C1 білок дикого типу). Відповідна геномна послідовність може бути ізольована за допомогою загальновідомих методів, таких як 14 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 полімеразно-ланцюгова реакція (ПЛР) з використанням специфічних і дегенеративних праймерів, виходячи з послідовності SEQ ID NO: 1 або послідовності SEQ ID NO: 11. Зрозуміло, що коли послідовності представлені як ДНК послідовності, в той час як РНК стосується дійсної послідовності основ молекули РНК, то вони є ідентичними з тією лише різницею, що тіамін (T) заміщується урацилом (У). Також забезпечуються послідовності нуклеїнової кислоти (геномної ДНК, кДНК, РНК), що кодують мутантні SlPP2C1 білки, тобто білки SlPP2C1 з редукованою або втраченою функцією, як описано вище. Наприклад, SlPP2C1 послідовності нуклеїнової кислоти, що несуть одну або більше несмислових і/або місенс-мутацій в кодуючій послідовності білка SlPP2C1 дикого типу, що призводить до утворення закодованого нефункціонального білка або білка, що має редуковану функцію in vivo і/або in vitro. Також забезпечуються послідовності з іншими мутаціями, такими як мутанти сайта сплайсингу, тобто мутації в геномній послідовності SlPP2C1, що призводить до аберантного сплайсингу пре-мРНК, і/або мутацій зі "зсувом рамки", і/або інсерцій і/або делецій однієї або більшого числа нуклеїнових кислот. Також включені варіанти і фрагменти послідовності нуклеїнової кислоти SlPP2C1 та такі послідовності нуклеїнової кислоти, які гібридизуються з послідовності нуклеїнової кислоти SlPP2C1, напр., до SEQ ID NO: 1, за строгих умов гібридизації, як було визначено. Також включені варіанти SlPP2C1 послідовності нуклеїнової кислоти, які мають ідентичність послідовності до послідовності SEQ ID NO: 1 або послідовності SEQ ID NO: 11 (нуклеотиди 2676-4975), щонайменше, 50 % або більше, переважно, щонайменше, 55 %, 60 %, 70 %, 80 %, 85 %, 90 %, 95 %, 98 %, 99 % або більше (як визначено за допомогою Emboss "needle" з використанням параметрів за замовчуванням, тобто штраф початку розриву = 10, штраф поширення межі розриву = 0,5, матриця скорингу nwsgapdna). Очевидно, що може бути використано багато методів, для того щоб ідентифікувати, синтезувати або ізолювати варіанти або фрагменти послідовності нуклеїнової кислоти SlPP2Cl, такі як гібридизація нуклеїнової кислоти, ПЛР- технологія, аналіз in silico і синтез нуклеїнової кислоти, і т.п.. Варіанти послідовності SEQ ID NO: 1 або послідовності SEQ ID NO: 11 (нуклеотиди 2676-4975) можуть або кодувати функціональні SlPP2C1 білки дикого типу (напр., алелі з інших різновидів томатів або селекційних ліній або з надходжень з природи, або ортологи з інших, ніж томати, видів), або вони можуть кодувати мутантні алелі редукованої функції або втрати функції будь-якого з них, як, наприклад, розроблені або ідентифіковані за допомогою методів, таких як TILLING або EcoTILLING, або інших методів. Фрагменти включають частини будь-яких вищевказаних послідовностей нуклеїнової кислоти SlPP2C1 (або варіанти), які можуть, наприклад, бути використані як праймери або зонди або конструкції у генному сайленсингу. Частини можуть бути суміжними фрагментами секвенування, що мають, щонайменше, приблизно 10, 15, 19, 20, 21, 22, 23, 25, 50, 60, 100, 200, 300, 450, 500, 600, 700, 800, 900, або більше нуклеотидів у довжину, або кодуючого ланцюга (смислового ланцюга) або комплементарного ланцюга (антисмислового ланцюга). Також тут включені, відповідно, фрагменти послідовностей нуклеїнової кислоти SlPP2C1, відповідно до чого фрагмент, щонайменше, близько 20, 30, 40, 50, 60, 100, 150, 200 300, 450, 500, 600, 700, 800, 900 нуклеотидів у довжину несе, щонаайменше, 50, 60, 70, 75 %, або більше, переважно, щоанйменше, 80, 90, 95, 98, 99 % або більше (100 %) ідентичності послідовності нуклеїнової кислоти до іншого фрагменту послідовності нуклеїнової кислоти SlPP2C1, що має, приблизно, таку ж довжину (як визначено шляхом попарного вирівнювання за допомогою Emboss "needle" з використанням параметрів за замовчуванням, тобто штраф початку розриву = 10, штраф розширення межі розриву = 0,5, матриця скорингу nwsgapdna). Пара праймерів, які можуть бути використані для ПЛР-ампліфікації SlPP2C1 транскрипта (мРНК або відповідної кДНК) з рослинної тканини зразка ДНК, наприклад, зображені на послідовності SEQ ID NO: 3 і 4 і в парі праймерів послідовності SEQ ID NO: 9 і 10. Такі пари праймерів можуть бути використані для визначення і кількісної оцінки експресії SlPP2C1 в рослинній тканині, напр., в тканині листка томатів. Подібним чином інші специфічні або дегенеративні праймери можуть бути сконстpуйовані, базуючись на послідовностях SEQ ID NO: 1 або SEQ ID NO: 11 (нуклеотиди 2676-4975) та використані для ампліфікації варіантів алелі SlPP2C1 з інших, ніж томати, ліній, або з інших видів. Якщо специфічні мутантні алелі SlPP2C1 отримані і/або ідентифіковані (напр., за допомогою TILLING або EcoTILLING), можуть також бути сконструйовані праймери або зонди, специфічні щодо мутантних алелів, і тест може бути розроблений для визначення присутності і/або відсутності мутантнго алеля у рослини або частини рослини (використовуючи методи детекції специфічного алеля). Аналіз за допомогою молекулярних маркерів для виявлення і/або перенесення (напр., за допомогою MAS, маркеропосередкованої селекції) мутантнго алеля 15 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 можуть бути розроблені, напр., аналіз детекції однонуклеотидних поліморфізмів (SNP) або може бути розроблений CAPS маркер, який виявить присутність мутантної послідовності нуклеїнової кислоти SlPP2C1 в ДНК рослини і/або який може бути використаний для перенесення алеля в інші рослини. В одному втіленні забезпечуються послідовності мутантних нуклеїнових кислот, в результаті чого послідовність нуклеїнової кислоти SlPP2C1 включає одну або дві мутації, що призводять або до втрати функції мутанта SlPP2C1 білка або до зменшення функції мутанта SlPP2C1 білка. Цей аспект винаходу буде описаний докладніше в іншому місці. Можуть також бути ідентифіковані або отримані рослини (напр., шляхом гомологічної рекомбінації, або внаслідок виникнення інсерцій, делецій або заміщення одного або більшого числа нуклеотидів, та ін.), які мають одну або більше мутацій в регуляторній ділянці(ках) SlPP2C1, напр., промоторі, в результаті чого експресія гена SlPP2C1, тобто рівні мРНК (SEQ ID NO: 1 або варіанти) є значно нижчими в рослині порівняно з диким типом, внаслідок чого рослина має значно підвищену стійкість до посухи. Послідовність нуклеїнової кислоти, описана вище, або їх фрагменти, зокрема, послідовність ДНК, що кодує SlPP2C1 білки цього винаходу (або їх варіанти), може бути вставлена в експресуючі вектори (грунтуючись на косупресії) або в вектори генного сайленсингу, для надання рослинам посухостійкості. В одному втіленні винаходу експресія гена SlPP2C1 зазнає даун-регуляції в клітинігосподарі, рослині або специфічній тканині (тканинах), шляхом, напр., підходів інтерферуючих РНК (RNAi approaches), як описано далі. В іншому втіленні забезпечуються рослини, що містять одну або більше мутантних алелів SlPP2C1, в результаті чого мутація(ії) надає підвищену стійкість до посухи рослин у порівнянні з рослинами, у яких мутантний алель(і) відсутнфй. Мутантні алелі переважно отримуються шляхом мутагенезу рослин або насіння та ідентифікації цих рослин або насіння, які несуть одну або більше мутацій в досліджуваних PP2C1 алелі (ях) і внаслідок чого мутація призводить до відміни транскрипції або трансляції (так що жоден SlPP2C1 білок не утворюється), або трансляції SlPP2C1 білка з редукованою або втраченою функцією. Редукція функціонального SlPP2C1 білка дикого типу, щонайменше, в тканині листка, забезпечує стійкість до посухи рослин, частин рослин або насіння. В іншому втіленні винаходу забезпечуються ПЛР-праймери і/або зонди і набір для визначення послідовності ДНК SlPP2C1. Пари дегенеративних або специфічних ПЛР-праймерів для ампліфікації ДНК SlPP2C1 зі зразків можуть бути синтезовані, виходячи з послідовностяей SEQ ID NO: 1 або SEQ ID NO: 11 (напр., на основі нуклеотидів 2676-4975 або 2591-5050), як відомо з рівня техніки (див. Dieffenbach and Dveksler (1995) PCR Primer: A Laboratory Manual, Cold Spring Harbor Laboratory Press, and McPherson at al. (2000) PCR-Basics: From Background to Bench, First Edition, Springer Verlag, Germany). Аналогічно, фрагменти ДНК послідовності SEQ ID NO: 1 або SEQ ID NO: 11 (або їх варіанти) можуть бути використані як гібридизаційні зонди. Набір реактивів для детекції SlPP2C1 може включати або специфічні праймери SlPP2C1 і/або специфічні зонди SlPP2C1, а також відповідний протокол для використання праймерів або зондів для визначення ДНК SlPP2C1 у зразку. Такі набори для детекції можуть, наприклад, бути використані для того щоб визначити, або була рослина трансформована геном SlPP2C1 (або його частиною) винаходу і або включає рослина одну або більше мутантних алелів SlPP2C1. Через виродженість генетичного коду деякі амінокислотні кодони можуть бути заміщені іншими без зміни амінокислотної послідовності білка. В іншому втіленні, згідно з винаходом, забезпечуються антитіла, які специфічно зв'язуються з SlPP2C1 білком, або мутантним SlPP2C1 білком. Зокрема, тут охоплені моноклональні або поліклональні антитіла, які зв'язуються з SlPP2C1, або його варіантами або фрагментами (напр., мутантними білками). Антитіло може бути отримане за допомогою SlPP2C1 білка згідно з винаходом як антиген в тварині з використанням загальновідомих методів, як, напр., описаних у Harlow and Lane "Using Antibodies: A laboratory manual"(New York: Cold Spring Harbor Press 1998) і у Liddell and Cryer "A Practical Guide to Monoclonal Antibodies" (Wiley and Sons, 1991). Антитіла можуть надалі бути використані, для того щоб ізолювати, ідентифікувати, характеризувати або очистити SlPP2C1 білок, з яким вони зв'язуються, наприклад, визначити SlPP2C1 білок в зразку, що призводить до утворення імунокомплексу і визначення присутності імунокомплексу за допомогою, напр., ELISA-тесту (імуноферментний аналіз) або імуноблоттингу. Також забезпечується імунологічний набір, корисний для визначення SlPP2C1 білків, фрагментів білків або епітопів у зразку. Зразками можуть бути клітини, клітинні супернатанти, клітинні суспензії, тканини тощо. Такі набори включають, щонайменше, антитіло, яке зв'язується з SlPP2C1 білком і один або більше реактивів для імунодетекції. Антитіла можуть також бути використані, для 16 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 того щоб ізолювати /ідентифікувати інші SlPP2C1 білки, наприклад, за допомогою методу імуноферментного аналізу ELISA або Вестерн-блоттингу. Очевидно, що багато методів можуть бути використані, для того щоб ідентифікувати, синтезувати або ізолювати варіанти або фрагменти послідовностей нуклеїнової кислоти SlPP2C1, такі як методи гібридизації нуклеїнових кислот, ПЛР- технології, аналіз in silico і синтезу нуклеїнової кислоти, і т.п.. Таким чином, SlPP2C1-білок, що кодує послідовність нуклеїнової кислоти, може бути послідовністю, яка хімічно синтезується або яка клонується з будь-якого виду рослин. Трансгенні посухостійкі рослини Забезпечуються трансгенні рослини, насіння і частини рослин, у яких SlPP2C1 сайленсується, переважно, щонайменше, у листковій або повітряній тканинах, і які мають підвищену стійкість до посухи у порівнянні з контрольними (нетрансгенними) рослинами дикого типу або іншими контрольними рослинами (напр., рослинами, трансформованими пустим вектором). В одному втіленні винаходу, гомологічна або гетерологічна послідовність нуклеїнової кислоти використовується, для того щоб сайленсингувати ген(и) ендогенної SlPP2C1 видугосподаря, який потрібно трансформувати. Наприклад, ген картоплі SlPP2C1, такий як StPP2Cl послідовності SEQ ID NO: 14 (або його варіант або фрагмент) можуть бути використані для сайленсингу генної експресії SlPP2C1 в трансгенних томатах або баклажанах. Альтернативно, можуть бути використані гомологічні SlPP2C1 послідовності нуклеїнової кислоти. Наприклад, послідовність, що походить з певного виду рослин (напр., з томатів), є реінтродукованою у вказаний вид (томати). Таким чином, в одному втіленні, ДНК SlPP2C1 відповідає, або є модифікацією /варіантом ендогенної ДНК SlPP2C1 виду, який використовується як вид-господар у трансформації. Таким чином, кДНК SlPP2C1 томатів або геномна ДНК (або її варіант або фрагмент) переважно використовуються для трансформації рослин томатів. Крім того (з точки зору правового регулювання та сприйняття громадськістю), гомологічна або гетерологічна послідовність нуклеїнової кислоти може бути функціонально зв'язана з послідовністю регуляції транскрипції, насамперед промотором, який також походить від виду рослин або навіть тієї ж самої рослини, що трансформується. Для того щоб отримати рослини, які несуть химерний ген, що після експресії призводить до сайленсингу експресії ендогенного SlPP2C1 гена або родини генів, можуть бути використані методи, відомі з рівня техніки. "Сайленсинг гена" стосується даун-регуляції або повного інгібування експресії гена одного або більшої кількості генів-мішеней, напр., SlPP2C1 генів, в клітині-господарі або в тканині. Зрозуміло, що в будь-яких експериментах, пов'язаних з трансформацією, має місце певний ступінь варіювання фенотипу трансформантів, як правило, у зв'язку з положенням у геномі і/або у зв'язку з кількістю копій. Зазвичай, розрізняють "слабкий" і "сильний" генний сайленсинг рослини (всі з-поміж яких є втіленнями винаходу), де випадки "слабкого" генного сайленсингу (інтерферуючі РНК - RNAi) стосуються рослин або частин рослин, де ендогенна експресія генамішені редукується до, приблизно, 15, 20 або 30 % у порівнянні з контрольною тканиною, тоді як випадки "сильного" генного сайленсингу (інтерферуючі РНК - RNAi) стосуються рослин або частин рослин, де ендогенна експресія гена-мішені редукується до, щонайменше, приблизно, 50, 60, 70, 80, 90 % або більше порівняно з контрольною тканиною (напр., дикого типу). Кількісна оцінка сайленсингу може бути здійснена за допомогою, наприклад, кількісної оцінки рівня транскрипції гена-мішені (напр., з використанням кількісного методу ЗТ-ПЛР) і/або шляхом визначення і, необов'язково, кількісної оцінки ферментативної активності білка-мішені SlPP2C1 і/або аналізу і, необов'язково, кількісної оцінки отриманого фенотипу (підвищена стійкість до посухи і/або підвищена чутивість до АБК). Не обмежуючи межі застосування винаходу, можуть бути відібрані рослини, що мають оптимальний рівень сайленсингу, в результаті чого рослини мають істотно підвищену стійкість до посухи за кліматичних умов, яких вони зазнають в польових умовах, маючи, разом з тим, мінімальні побічні ефекти, такі як знижений урожай, зменшена кількість плодів тощо у порівнянні з контрольними рослинами. Переважно виживання і/або врожаї зростають у посухостійких рослин. Застосування інгібіторної РНК, для того щоб зменшити генну експресію є згальновідомим у цій галузі та є предметом декількох оглядів (напр., Baulcombe 1996, Plant Cell 8(2):179-188; Depicker and Van Montagu, 1997, Curr. Opin. Cell Biol. 9(3): 373-82). Існує ціла низка доступних технологічних підходів для досягнення генного сайленсингу в рослинах, такі як химерні гени, які продукують антисмислову РНК всіх частин гена-мішені (див., напр., EP 0140308 Bl, EP 0240208 17 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 Bl and EP 0223399 Bl), або які продукують смислову РНК гена-мішені (також має назву "косупресії"), див. EP 0465572 Bl. Однак, найбільш плідним підходом є отримання як смислової, так і антисмислової РНК генамішені ("інвертовані повтори"), які утворюють двохланцюгові РНК (dsRNA) або структури у вигляді петлі (hairpin RNA, hpRNA) в клітинах і сайленсують ген(и)-мішені після транскрипції вгору від промотора. Методи і вектори для отримання dsRNA і hpRNA і генного сайленсингу описані в EP 1068311, EP 983370 Al, EP 1042462 Al, EP 1071762 Al і EP 1080208 Al. Химерний ген для трансформації рослини може, відповідно, включати ділянку регуляції транскрипції, яка є активною в рослинних клітинах, оперативно зв'язану з фрагментами смислової і/або антисмислової ДНК (або повною послідовністю нуклеїнової кислоти), або комплементарної або істотно подібної до гена-мішені SlPP2C1 або родини генів. Переважно достатніми є короткі (смислові та антисмислові) фрагменти секвенування послідовності гена-мішені, такі як ті, що утворені 17, 18, 19, 20, 21, 22, 23, 24, 25 або 26 нуклеотидами кодуючої і/або некодуючої послідовності гена-мішені також можуть бути використані довші послідовності, такі як ті, що утворені, щонайменше, приблизно, 50, 100, 200, 250, 500, 1000 або більше нуклеотидами. Навіть ДНК, що відповідає або є комплементарною до повного транскрипту РНК або мРНК, можуть бути використані для отримання смислової і/або антисмислової конструкції. Переважно, смислові і антисмислові фрагменти/послідовності розподіляються за допомогою спайсерної послідовності, такої як інтрон, які утворюють петлю (або "шпильку") після утворення дволанцюгової РНК (dsRNA). Загалом, мішенню може бути обраний будь-який SlPP2C1 ген або родина генів. Один або декілька специфічних SlPP2C1 алелів можуть бути сайленсовані шляхом обрання ділянки нуклеїнової кислоти первинних або мРНК транскриптів, специфічних щодо цих алелів (див. Byzova et al. Plant 2004 218: 379-387 для сайленсингу специфічного алеля у органоспецифічний спосіб). Аналогічно, для сайленсингу може бути обрана ціла родина генів шляхом обрання однієї або декількох консервативних ділянок транскриптів для отримання конструкції, що має зазнати сайленсингу. Як згадувалось вище, що ділянка ДНК, яка використовується у смисловій і/або антисмисловій орієнтації, може не бути частиною кодуючої ділянки, але може також відповідати або бути комплементарною частинам первинного транскрипту (включаючи 5' і 3' нетрансльовану послідовність і інтрони, представлену нуклеотидами 2591-5050 послідовності SEQ ID NO: 11) або частинами мРНК транскрипту (де будь-які інтрони видалені, а додається поліаденільний хвіст (polyA). Зрозуміло, що в послідовності ДНК, яка відповідає послідовності РНК, нуклеотид У заміщується на Т. Слід зазначити, що в химерному гені, який транскрибує дволанцюгові РНК (dsRNA) або РНК із щіткоподібними РНК (hpRNA) спрямованими на здатні до сайленсингу експресії SlPP2C1 гена після транскрипції в клітині-господарі, смислові і антисмислові ділянки не повинні мати однакову довжину і одна ділянка може бути довша, ніж інша. Таким чином, наприклад, послідовність SEQ ID NO: 1 або її варіанти, як описано вище, або фрагменти будь-якої з них, або геномна послідовність або послідовність первинного транскрипту послідовності SEQ ID NO: 1 (як зображено в послідовності SEQ ID NO: 11 від 2591 до 5050 нуклеотиду), можуть бути використані для отримання сайленсингу SlPP2C1 гена і вектора, і трансгенна рослина, в якій один або більше SlPP2C1 генів сайленсуються у всіх або деяких тканинах або оргаанах, або це відбувається після індукції (див. напр., Wielopolska et al. Plant Biotechnol J. 2005 6:583-90). Традиційний шлях отримання щіткоподібних конструкцій полягає у використанні генеруючих векторів, таких як pHANNIBAL, pHELLSGATE, pSTARGATE, що базуються на Gateway® технології (див. Wesley et al. 2004, Methods Mol Biol. 265:117-30; Wesley et al. 2003, Methods Mol Biol. 236:273-86 і Helliwell & Waterhouse 2003, Methods 30(4):28995.), включені тут у вигляді посилань. Див. також http://www.pi.csiro.au/rnai/ для інших векторів, що обумовлюють генний сайленсинг, таких як індуцибельні вектори сайленсингу і векторів для сайленсингу множинних генів-мішеней і для програми MatchPoint, що можуть бути використані, для того щоб виявити найкращу послідовність для використання сайленсингу гена-мішені. Шляхом обрання консервативних послідовностей і нуклеїнової кислоти можуть бути сайленсовані всі члени родини генів SlPP2C1. Сайленсинг всіх членів родини рослинигосподаря є специфічним втіленням цього винаходу. В одному втіленні промотор, який функціонально зв'язується зі смисловою і/або антисмисловою послідовністю нуклеїнової кислоти (для того щоб здійснити сайленсинг химерного гена обирається конститутивний промотор, індукований промотор (напр., такий, що індукується стресом, світлом або хімічними речовинами тощо), промотор, що індукується гормонами (напр., етилен- або АБК-індукований тощо), листковий специфічний промотор або промотор, активний в повітряній тканині. Також тут охоплені промотори ранньої відповіді на 18 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 дегідратацію, такі як RD2, а також інші промотори, що індукуються стресом, такий як RD29 (Yamaguchi-Shinozaki and Shinozaki 1993, Mol Gen Genet 236: 331-340). У певному втіленні може бути прийнятним специфічний промотор плодів. Також може бути використаний промотор власне SlPP2C гена при підході, що грунтується на сайленсингу. Промотор з томатів міститься в SEQ ID NO: 11 від 1-2675 нуклеотидів, а саме промотор складається з приблизно 2000 нуклеотидів вгору від старт-кодону ATG трансляції в положенні 2676-2679 послідовності SEQ ID NO: 11) або його функціональних фрагментів (напр., 1500bp, 10000bp або менше вправо від ATG). Факультативно 3' UTR може бути функціонально зв'язаний з 3' кінцем химерного гена, так що функціонально зв'язані елементи ДНК включають промотор SlPP2C1 RNAi-3'UTR. Кращі конститутивні промотори включають: сильні конститутивні промотори 35S або покращені 35S промотори ("35S промотори") вірусу мозаїки цвітної капусти (CaMV) ізолятів CM 1841 (Gardner et al, 1981, Nucleic Acids Research 9, 2871-2887), CabbB-S (Franck et al, 1980, Cell 21, 285-294) і CabbB-JI (Hull and Howell, 1987, Virology 86,482-493); 35S промотор, описаний Odell et al. (1985, Nature 313, 810-812) або в US5164316, промотори з родини убіквітину (напр., промотор рису у Christensen et al, 1992, Plant Mol. Biol. 18,675-689, EP 0 342 926, див. також Cornejo et al. 1993, Plant Mol.Biol. 23, 567-581), gos2 промотор (de Pater et al, 1992 Plant J. 2, 834844), промотор emu (Last et al, 1990, Theor. Appl. Genet. 81,581-588), промотор актину Arabidopsis, такий як промотор, описаний An et al. (1996, Plant J. 10, 107.), промотори актину рису, описані Zhang et al.(1991, The Plant Cell 3, 1155-1165) і промотор, описаний в US 5,641,876 або промотор актину рису 2, як описаний в WO070067; промотори вірусу мозаїки жилок Cassava (WO 97/48819, Verdaguer et al. 1998, Plant Mol. Biol. 37,1055-1067), pPLEX серії промоторів з вірусу карликовості конюшини підземної (WO 96/06932, зокрема, S7 промотор), промотор алькогольдегідрогенази, напр., pAdhlS (GenBank accession numbers X04049, X00581), TR1' промотор і TR2' промотор ("TR1'промотор" і "TR2'промотор", відповідно), які спрямовують експресію генів 1' і 2', відповідно, T-ДНК (Velten et al, 1984, EMBO J 3, 2723-2730), промотор вірусу мозаїки ранника шишкуватого, описаний в US6051753 і в EP426641, промотори генів гістонів, такі як Ph4a748 промотор з Arabidopsis (PMB 8: 179-191), та інші. Альтернативно, може бути використаний промотор, який не є конститутивним, а специфічним щодо однієї або більше тканини або органів рослини (тканиноспецифічний, включаючи промотори, що регулюються в процесі розвитку). Наприклад, може бути використаний промотор, активний в листковій тканині або у повітряних частинах листка, або специфічні епідермальні промотори або специфічні промотори замикаючих клітин. Специфічні епідермальні промотори, такі, як, наприклад, промотор LTP1 Arabidopsis (Thoma et al., 1994, Plant Physiol. 105(l):35-45.), CER1 промотор (Aarts et al. 1995. Plant Cell. 7:2115-27), і CER6 промотор (Hooker et al 2002, Plant Physiol 129:1568-80.), а також ортолог томатів LeCER6 (Vogg et al., 2004, J. Exp Bot. 55: 1401-10), забезпечують специфічну експресію в епідермальних поверхнях надземних органів рослин. Також є прийнятними специфічні промотори фотосинтетичної тканини, такі як індукований світлом промотор малої субодиниці рибулозо-1,5-бісфосфаткарбоксилази (Pssu) з Arabidopsis, як описано в US5034322, або з соняшника, гороху (US 5254799), або з Zea mays; промотор STLSI картоплі, які є стебло- та листкоспецифічними (Stockhaus et al. 1987, Nucleic Acids Res.l5(8):3479-91); промотор білка, який зв'язує хлорофіли a/b (CAB). Можуть бути використані специфічні промотори замикаючих клітин, такі як DGP1 промотор (Li et al., Sci China C Life Sci. 2005 48(2): 181-6), або індуцибельні промотори посухостійкості типу RD29 (Yamaguchi-Shinozaki and Shinozaki 1993, supra), що є активними майже у всіх органах і тканинах вегетативної частини рослин протягом дії водного дефіциту. Досвідчений фахівець може легко випробувати різні промотори щодо їх специфічності і прийнятності для використання в методах згідно з винаходом. Крім того, специфічність промоторів може бути модифікована за допомогою видалення, додавання або заміщення частин промоторної послідовності. Такі модифіковані промотори можуть бути функціонально зв'язані з репортерними генами, для того щоб перевірити їх часово-просторову активність в трансгенних рослинах. Іншою альтернативою є використання промоторів, експресія яких є індукованою. Прикладами індукованих промоторів є хімічні індуковані промотори, такі як дексаметазон, як описано у Aoyama and Chua (1997, Plant Journal 11: 605-612) і в US6063985, або ті, що індукуються тетрацикліном (TOPFREE або TOP 10 промотор, див. Gatz, 1997, Annu. Rev. Plant Physiol.; Plant Mol. Biol. 48: 89-108 і Love et al. 2000, Plant J. 21: 579-88). Інші індуковані промотори включають ті промотори, що індукуються зміною температури, такі як промотор, описаний в US 5,447, 858, анаеробними умовами (напр., ADH1S промотор кукурудзи), світлом 19 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 (US6455760), патогенами (напр., EP759085 або EP309862) або старінням (SAG12 і SAG13, див. US5689042) або посухою (див. вище). Очевидно, існує ціла низка інших доступних промоторів. Прикладами інших індукованих промоторів є Adhl промотор, який індукується гіпоксією або холодовим стресом, Hsp70 промотор, який індукується тепловим стресом, і PPDK промотор, який індукується світлом. Одним з кращих промоторів є промоторна система, індукована етанолом, як описано у Ait-ali et al. (2001, Plant Biotechnology Journal 1, 337-343), де обробка етанолом активує alcR, який в кінцевому результаті індукує експресію alc:35S промотора. Див. також Deveaux et al. (2003), The ethanol switch: a tool for tissue-specific ген induction during plant development. Plant J. 36, 918-930). За вибором, RNAi промотора SlPP2C1 гена можуть, крім того, включати 3'-кінцеві сигнали регуляції транскрипції ("3'" або "3' UTR") (тобто сигнали утворення транскрипта і поліаденілювання). Сигнали поліаденілювання і утворення транскрипта включають ген нопалінсинтази ("3' nos") (Depicker et al., 1982 J. Molec. Appl. Genetics 1, 561-573.), ген октопінсинтази ("3'ocs") (Gielen et al., 1984, EMBO J 3, 835-845) і T-ДНК ген 7 ("3' ген 7") (Velten and Schell, 1985, Nucleic Acids Research 13, 6981-6998), які діють як 3'-нетрансльовані послідовності ДНК в трансформованих рослинних клітинах, та інші. Сайленсинг химерного гена SlPP2C1 (тобто промотор функціонально зв'язаний з послідовністю нуклеїнової кислоти, яка після транскрипції в рослинній клітині здатна виявляти сайленсинг експресії ендогенного SlPP2C1 гена) може бути стійко вбудована традиційним способом в ядерний геном єдиної рослинної клітини, і, трансформована такими чином рослинна клітина може бути використана у традиційний спосіб, для того щоб продукувати трансформовані рослини, що мають змінений фенотип завдяки сайленсингу SlPP2C1 в деяких клітинах у певний час. У цьому відношенні, T-ДНК vector, який несе промотор, функціонально зв'язаний зі смисловою і/або антисмисловою послідовністю SlPP2C1 (і, необов'язково, 3'UTR), може бути введений в Agrobacterium tumefaciens і використаний для отримання рослинних клітин, і, відповідно, трансформовані рослини можуть бути регенеровані з трансформованої рослинної клітини за допомогою методик, описаних, наприклад, в EP 0 116 718, EP 0 270 822, PCT publication WO84/02913 і в опублікованій European Patent application EP 0 242 246 і у Gould et al. (1991, Plant Physiol. 95,426-434). Конструювання T-ДНК вектора для трансформації рослин за допомогою Agrobacterium є загальновідомим з рівня техніки. T-ДНК вектор може бути або бінарним вектором, як описано в EP 0 120 561 і EP 0 120 515, або асоційованим вектором, який може вбудовуватись в Ti-плазміду Agrobacterium шляхом гомологічної рекомбінації, як описано в EP 0 116 718. Кожен з кращих T-ДНК векторів включає промотор, функціонально зв'язаний з сайленсингом SlPP2C1 гена між бордерними послідовностями T-ДНК, або, щонайменше, розташований ліворуч від правого краю послідовності бордерної послідовності. Бордерні послідовності описані у Gielen et al. (1984, EMBO J 3,835-845). Звичайно, інші типи векторів можуть бути використані для трансформації рослинної клітини, використовуючи методики, такі як пряме перенесення гена (як описано, наприклад, в EP 0 223 247), трансформація, опосередкована пилком (як описано, наприклад, в EP 0 270 356 і WO85/01856), трансформація протопласту як, наприклад, описано в US 4,684, 611, трансформація рослинної РНК за допомогою віруса (як описано, наприклад, в EP 0 067 553 і US 4,407, 956), ліпосомна трансформація (як описано, наприклад, в US 4,536, 475), та інші методи, такі як ті методи, що описуються для трансформація певних ліній кукурудзи (напр., US 6,140, 553; Fromm et al., 1990, Bio/Technology 8, 833-839; Gordon-Kamm et al., 1990, The Plant Cell 2, 603-618) і рису (Shimamoto et al., 1989, Nature 338, 274-276; Datta et al. 1990, Bio/Technology 8, 736-740), а також методи для трансформації загалом однодольних рослин (PCT publication WO92/09696). Для трансформації бавовнику див. також WO 00/71733, а для трансформації рису див. також методи, описані в W092/09696, W094/00977 і W095/06722. Для трансформації сорго див. напр., Jeoung JM et al. 2002, Hereditas 137: 20-8 or Zhao ZY et al. 2000, Plant Mol Biol.44:789-98). Для трансформації томатів та тютюну див. також An G. et al., 1986, Plant Physiol. 81: 301-305; Horsch R.B. et al, 1988, In: Plant Molecular Biology Manual A5, Dordrecht, Netherlands, Kluwer Academic Publishers, pp 1-9; Koornneef M. et al., 1986, In: Nevins D.J. and R.A. Jones, eds. Tomato Biotechnology, New York, NY, USA, Alan R. Liss, Inc. pp 169-178). Для трансформації картоплі див., напр., Sherman and Bevan (1988, Plant Cell Rep. 7: 13-16). Трансформація та регенерація томатів може бути здійснена відповідно до De Jong et al. (2008) Plant Journal 57:160-170 and Sun et al. (2006) Plant Cell Physiol. 47: 426-431. Аналогічно, селекція і регенерація трансформованих рослин з-поміж трансформованих клітин добре відома з рівня техніки. Очевидно, для різних видів і навіть для ріізних різновидів або культиварів єдиного виду, протоколи спеціально адаптуються для регенерації трансформованих рослин з високою частотою. 20 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім трансформації ядерного геному, у винахід включена також трансформація пластидного геному, переважно хлоропластного геному. Однією з переваг трансформації пластидного геному є те, що ризик поширення трансгену (нів) може бути знижений. Трансформація пластидного геному може бути виконана, як відомо з рівня техніки, див., напр., Sidorov VA et al. 1999, Plant J.19: 209-216 або Lutz KA et al. 2004, Plant J. 37(6):906-13. Прийнятними господарями можуть бути інші рослини, такі як однодольні рослини або дводольні рослини, однак, найчастіше до рослин, що матимуть користь від посухостійкості, належать, але не обмежується ними: томати, перець, огірок, баклажан, салат, артишок, цибуляпорей, диня, кавун, морква, капуста (B. oleracea, B. napus, B. juncea), цибуля, салат, картопля, шпинат, виноград, горох, боби, соя та багато інших. Кращими господарями є представники родини Solanaceae, такі як види роду Solanum, напр., томати (S. lycopersicum), томатне дерево (S. betaceum, син. Cyphomandra betaceae) та інші види Solanum, такі як баклажан (Solanum melongena), картопля (Solanum tuberosum), пепіно (S. muricatum), кокона (S. sessiliflorum) і наранхілла (S. quitoense). Родина Solanaceae також включає види перцю (Capsicum annuum, Capsicum frutescens). В кращих втіленнях винаходу господарем є представник родини Solanaceae. В ще кращому втіленні господарем є один з представників роду Solanum. В навіть ще кращому втіленні господарем є вид S. lycopersicum. Переважно, господар - це культивовані томати виду S. lycopersicum, тобто лінія або високоурожайна різновидність, така, у якої середня вага плодів становить, щонайменше, 50 г або більше, напр., щонайменше, приблизно 80 г, 90 г, l00 г, 200 г, 300 г, або навіть до 600 г (типи біф-томатів). Охоплені також томати з дрібними плодами, такі як черрі або коктейль ні томати, а також з виповненим м'якушем, такі як різновидність Nunhems Intense, напр., у яких в насіннєвих порожнинах відсутній слиз. Рослина-господар томатів може бути визначена або невизначена, з плодами різного розміру і форми, такі як тип-Рома, китицеподібні, круглі. Це можуть бути томати для переробки, або призначені для споживання у свіжому вигляді. Тут охоплені як рослини від відкритого запилення, так і гібриди. В одному втіленні посухостійкі рослини томатів є рослинами гібриду F1, вирощеними з F1 гібридного насіння. Для того щоб отримати насіння гібриду F1 трансгенних рослин, згідно з винаходом, можуть бути отримані дві інбредні батьківські лінії, кожна з яких несе копію трансгена у своєму геномі. Коли ці рослини перехресно запилюються, збирають F1 насіння, з якого отримують трансгенні рослини гібридів F1 з високою врожайністю і стійкістю до посухи завдяки наявності трансгена. Втілення, описані тут для рослини-"господаря" застосовуються також щодо нетрансгенних мутантних рослин, описаних тут в іншому місці, у яких, на відміну від трансгенних рослин, мутантна SlPP2C1 алель представлена ендогенно. Іншими прийнятними господарями є інші види овочевих рослин і різні види, рослини яких мають соковиті плоди (виноград, персик, сливи, полуниця, манго, папайя та ін.). Прийнятними господарями є також представники родини Cucurbitaceae, такі як диня (Citrullus lanatus, Cucumis melo) і огірок (Cucumis sativus), гарбуз і кабачок (Cucurbita). Прийнятними господарями є також представники родини Rosaceae, такі як яблуня, груша, слива тощо. Згідно з винаходом забезпечуються польові культури з підвищеною посухостійкістю. Наприклад, кукурудза/зерно (види Zea, напр., Z. mays, Z. diploperennis (chapule), Zea luxurians (теосінте мексиканська), Zea mays subsp. huehuetenangensis (теосінте San Antonio Huista), Z. mays subsp. mexicana (теосінте мексиканська), Z. mays subsp. parviglumis ("Balsas" теосінте), Z. perennis (багаторічне теосінте)) і Z. ramosa), пшениця (види Triticum), ячмінь (напр., Hordeum vulgare), овес (напр., Avena sativa), сорго (Sorghum tricolor), жито (Secale cereale), соя (Glycine spp, напр., G. max), бавовник (види Gossypium, напр., G. hirsutum, G. barbadense), Brassica spp. (напр., B. napus, B. juncea, B. oleracea, B. rapa, та ін.), соняшник (Helianthus annus), тютюн (види Nicotiana), люцерна (Medicago sativa), рис (види Oryza, напр., культивар групи O. sativa indica або групи japonica), фуражні трави, просо (Pennisetum spp. напр., P. glaucum). Інші рослини-"господарі" включають декоративні види (напр., Rose, Petunia, Chrysanthemum, Lilium, види Gerbera), деревні рослини (напр., види Populus, Salix, Quercus, Eucalyptus), види волокнистих рослин, напр., бавовник, льон (Linum usitatissimum) і конопля (Cannabis sativa). По суті, прийнятні будь-які види сільськогосподарських культур. Польові рослини або культивовані рослини стосуються тут видів рослин, які культивуються і схрещуються людиною і виключають бур'яни, такі як Arabidopsis thaliana, або дикі родичі, так як родичі томатів Solanum pennellii, Solanum chilense, Solanum chmielewskii, Solanum habrochaites, Solanum pimpinellifolium та інші (хоча мутантні алелі SlPP2C1 можуть походити від таких рослин і переноситись в культивовані томати за допомогою методів схрещування, див. далі нижче). Польові рослини можуть культивуватись з метою отримання харчових продуктів (напр., овочеві культури або 21 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 зернові культури), або з декоративною метою (напр., вирощування квіток для зрізу, газонних трав тощо). Польові рослини, як тут визначено, включають також рослини, з яких отримують нехарчові продукти, такі як олія для пального, пластикових полімерів, фармацевтичних продуктів, кори, волокна і тому подібних. Таким чином, в одному втіленні винаходу трансгенні рослини, які містять елемент регуляції транскрипції (насамперед промотор, як описано вище), оперативно зв'язані з молекулою нуклеїнової кислоти, які після транскрипції здатні до сайленсингу експресії ендогенного гену SlPP2C1 в клітинах-господарях. Конструювання химерних генів і векторів для, переважно, стійкого введення SlPP2C1 сайленсуючого гена в геном клітин-господарів є загальновідомими. Для того щоб отримати химерний ген, смислова і/або антисмислова послідовність SlPP2C функціонально зв'язуються з промоторною послідовністю, прийнятною для експресії в клітинах-господарях, з використанням стандартних молекулярно-біологічних методик. Послідовність промотора вже може бути присутня в векторі, так що послідовність нуклеїнової кислоти просто вставляється у вектор вищевказаної послідовності промотора. Після цього вектор використовується для трансформації клітин-господарів, химерний ген вставляється в ядерний геном або пластидний, мітохондріальний або хлоропластний геном і експресується там за допомогою прийнятного промотора (напр., Mc Bride et al., 1995 Bio/Technology 13, 362; US 5,693, 507). Отримані внаслідок цього трансформовані рослини можуть бути використані у традиційній селекційній схемі, для того щоб отримати більшу кількість трансформованих рослин з тими ж характерними особливостями, або для того щоб ввести частину гена в інші різновидності того ж або спорідненого виду рослин. Може бути відібраний "елітний випадок" (elite event), що є результатом трансформації, і має трансген, вбудований у певному положенні в геномі, що призводить до належної експресії бажаного фенотипу (напр., оптимальний рівень сайленсингу і стійкість до посухи). В одному втіленні винаходу бажано посилити втрату води, тобто знизити стійкість до посухи певних тканин і/або знизити чутливість певних тканин до АБК, наприклад, плодів, за допомогою надекспресії SlPP2C1 в, щонайменше, таких тканинах. Наприклад, для того щоб отримати плоди (напр., томатів) з нижчим вмістом води і, відповідно, з більш твердим м'якушем плодів і/або посиленим смаком, прийнятний специфічний або кращий промотор плодів, функціонально зв'язаний з послідовністю нуклеїнової кислоти, що кодує функціональний білок SlPP2C (SEQ ID NO: 2 або її варіант). Для того щоб забезпечити експресію у плодах, можуть бути використані промотори плодів томатів і специфічний промотор шкірочки напр., бета-галактозидази II (Smith et al., 1998, Plant Physiol 117: 417-23) або промотор епікутикулярного воску томатів LeCER6 (Vogg et al, 2004, supra). Або промотор шкірочки плода або епідермальний промотор може бути ідентифікований і виділений досвідченим фахівцем в галузі, за допомогою мікрочіпів і підтвердження трансформації злиття репортерного гена з промоторною ділянкою. Такі промотори також можуть бути використані для сайленсингу SlPP2C1 у специфічних тканинах, таких як плоди. Трансгенні рослини або їх частини, в яких SlPP2C1 сайленсується, мають істотно підвищену стійкість до посухи. Істотно підвищена стійкість до посухи (як описано вище) використовується тут стосовно підвищеної здатності трансформантів (у порівнянні з рослинами дикого типу або контрольними трансформантами) витримувати один або більше посушливих періодів (водний дефіцит / нестача води призводять до напр., візуальних симптомів в'янення листка у контрольних рослин), як описано вище. Переважно, рослини надалі здатні відновлювати свій стан, що, таким чином призводить до зменшення втрати загального врожаю, оскільки більше 2 рослин на м виживає і/або врожай тих рослин, що вижили, істотно не зменшується. Істотно підвищена стійкість до посухи може бути оцінена в контрольованих умовах (оранжерея або ростові камери), як описано вище або з використанням аналогічних методів. Наприклад, альтернативний метод полягає в наступному: щонайменше близько 10 трансформантів на випадок трансформації і щонайменше 10 контрольних рослин поміщались протягом різного проміжку часу (варіює від декількох годин до 1-4 тижнів і більше) в середовище без зволоження, до появи в'янення листків або втрати тургору у контрольних рослин, поливаючи рослини після цього знову протягом, напр., щонайменше, 1 тижня, 2 тижнів або довше, до відновлення його фенотипових ознак. Трансформанти з підвищеною стійкістю до посухи виживають, щонайменше, 2, 3, 4, 5, 6, 7 днів, переважно, щонайменше, на 2-5 днів довше без води, ніж контрольні рослини-трансформанти (напр., трансформовані пустим вектором) або рослини дикого типу за тих же умов, і які виявляють незворотні ушкодження тканин. У альтернативному випадку, % виживання може бути підрахований в певній часовій точці, відповідно до чого посухостійкі рослини мають % виживання, який, щонайменше, на 10 %, 22 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 20 %, 30 %, або більше вищий, ніж в контролі. Цей альтернативний метод може також бути використаний для визначення, або мають мутантні рослини (тобто нетрансгенні рослини, які включають один або більше мутантних алелів SlPP2C1), істотно підвищену стійкість до посухи. Зрозуміло, що, коли мутантні рослини аналізуються за їхнім фенотипом, контрольні рослини є переважно біля ізогенної лінії мутанта, який включає алель(лі) дикого типу. Період водного дефіциту / стресу і період вдновлення може варіювати залежно від виду рослин. Наприклад, на рис. 9.5 годин водного стресу з наступним 10-денним відновленням (зволоженням) є прийнятним для визначення, або має рослинна лінія або рослина, отримана в результаті трансформації, підвищену стійкість до посухи у порівнянні з контрольнми рослинами, оскільки відсоток виживання є істотно підвищеним у рослин посухостійкої лінії (див. напр., Zheng et al. Biochemical and Biophysical Research Communications 2009, 985-989). В кінцевому результаті, можуть бути використані польові дослідження, для того щоб показати, що трансформанти (або мутантні рослини, описані нижче) мають істотно підвищену стійкість до посухи у порівнянні з рослинами дикого типу. Як вже згадувалось, трансформанти, що мають оптимальний рівень сайленсингу, можуть бути відібрані за допомогою, напр., аналізу кількості копій (Саузерн-блот аналіз), рівня мРНК транскрипта (напр., RT-PCR за допомогою пар праймерів SlPP2C1) або аналізуючи наявність і/або рівень SlPP2C1 білка в різних тканинах (напр., SDS-PAGE; ELISA-тести тощо). Після цього оптимальні трансгенні варіанти використовуються далі для схрещування / зворотного схрещування / самозапилення до того часу, поки не буде отримане "хіти" (high performing elite event) зі стабільним трансгеном. В одному втіленні забезпечується саме трансгенне насіння, що походить від таких рослин, що можуть бути реалізовані як такі, що є "стійкими до посухи". Трансформанти, які експресують один або більше генів SlPP2C1 згідно з винаходом, можуть також включати інші трансгени, такі як гени, що відповідають за стійкість до посухи або обумовлюють стійкість до інших біотичних або абіотичних стресів. Для того щоб отримати такі рослини з "пакетованими" трансгенами, інші трансгени можуть або бути введені шляхом інтрогресії в SlPP2C1 трансформанти, або трансформанти можуть бути трансформовані далі одним або більшою кількістю інших генів, або, альтернативно, декілька химерних генів можуть бути використані для трансформації рослинної лінії або різновидності. Наприклад, декілька химерних генів можуть бути присутні на одному векторі, або можуть бути представлені на різних векторах, які разом трансформуються. В одному втіленні наступні гени комбінуються з SlPP2C1 сайленсингом згідно з винаходом: гени, що кодують інші фактори транскрипції AP2/EREBP типу, переважно ті гени, що відіграють роль у відповіді рослини на зовнішніх стреси, такі як, наприклад, CBF1, CBF2, CBF3 і/або CBF4, що кодують гени з Arabidopsis (Jaglo-Ottosen et al. 1998, Science 280, 104-106, 1998; Kasuga et al. 1999 Nat. Biotechnol. 17, 287-291) або їх ортологи з інших видів (Dubouzet et al 2003, Plant J. 33: 751), зі стійкими до комах генами, такими як гени токсину Bacillus thuringiensis гени (що кодують інсектицидні білки, такі як cry- гени, vip-гени, та ін. Перелік доступних генів можна знайти на сайті http://www.biols.susx.ac.uk/home/), гени резистентності до грибів, гени резистентності до гербіцидів, або інші гени. Трансформовані рослини з "пакетованими" генами можуть, таким чином, мати навіть ширшу толерантність до зовнішнього стресу, наприклад, до засолення, холодового стресу, резистентність до комах, резистентність до патогенів, теплового стресу, водного стресу тощо. Цілі рослини, насіння, клітини, тканини і потомство (таке як F1, F2 насіння/рослини тощо) будь-якої трансформованої рослини, описані тут вище, охоплені і можуть бути ідентифіковані за наявністю трансгена в ДНК, наприклад, за допомогою ПЛР (полімеразно-ланцюгового аналізу PCR). Також може бути розроблений діагностичний ПЛР метод для виявлення "специфічного результату", де ПЛР праймери базуються на фланківній ДНК рослини, вставленій в химерний ген, див. US6563026. Аналогічно, специфічні AFLP-фінгерпринти або RFLP-фінгерпринти можуть бути розроблені для ідентифікації трансгенної рослини або будь-якої рослини, насіння, тканини або клітин, що походять від них. Зрозуміло, що трансгенні рослини, згідно з винаходом, переважно не виявляють небажаних фенотипових змін, таких як зниження врожаю, зменшення кіількості плодів на рослину, підвищення сприйнятливості до захворювань або небажані архітектурні зміни (карликовість, деформації тощо) і, якщо такі фенотипові ознаки виявлені у первинних трансформантів, вони можуть бути видалені за допомогою звичайного схрещування та селекційних методів (схрещування / зворотне схрещування / самозапилення, тощо). Будь-які описані тут трансгенні рослини можуть бути гомозиготними або гетерозиготними за цим трансгеном. Нетрансгенні посухостійкі рослини та способи їх отримання 23 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одним з втілень винаходу є застосування нетрансгенних методів, напр., мутантну генерацію-мішень і ідентифікаційних систем, таких як TILLING (Targeting Induced Local Lesions IN Genomics; McCallum et al., 2000, Nat Biotech 18:455, і McCallum et al. 2000, Plant Physiol. 123, 439-442, Henikoff et al. 2004, Plant Physiol. 135: 630-636, включених тут у вигляді посилань) і селекція для отримання рослинних ліній, які включають щонайменше одну мутацію в алелі ендогенного SlPP2C1, в результаті чого рослини, що несуть мутантну SlPP2C1 алель у гетерозиготній або гомозиготній формі мають істотно підвищену стійкість до посухи і/або істотно підвищену чутливість до АБК у порівнянні з рослинами, які втратили мутантний алель (мають алель(і) дикого типу в локусі SlPP2C1). Таким чином, в одному втіленні винаходу забезпечуються рослини, які включають один або більше мутантних SlPP2C1 алелі в геномі і мають істотно підвищену стійкість до посухи у порівнянні з рослинами, що втратили вказаний мутантний алель(і), але натомість містять алелі дикого типу, а також частини рослин (напр., зібрані плоди, зібрані листки, тощо), насіння, клонально розмножені такі рослини, потомство таких рослин, що включає мутантний алель. "Істотно знижена чутливість до водного стресу" або "істотно підвищена стійкість до посухи" стосується (статистично достовірних) знижених симптомів в'янення листків сукупності рослин, що несуть мутантний алель (лі), щонайменше, на 10 % у порівнянні з контрольними рівнями (напр., ті ж рослини, у яких мутантний алель відсутній, такі як немутовані рослини) і може, наприклад, бути протестована, як тут описано для трансгенних рослин або з використанням аналогічних методів. Стисло, сукупність мутантних рослин (переважно, щонайменше, 10, 15, 20 або більше рослин на лінію, що несе конкретну мутацію в алелі SlPP2C1) і контрольних рослин того ж віку насичувались водою на початку експерименту і після цього не поливали протягом тривалого проміжку часу, напр., 7, 8, 9, 10, 11, 12, 13, 14, 15 днів або більше. Коли контрольні рослини розпочинають виявляти ознаки в'янення листків ("легке в'янення" або "помірне в'янення"), проводилась візуальна оцінка всіх рослин щодо наявності ознак в'янення листків. Симптоми в'янення листків можуть, наприклад, бути обчислені за шкалою від 4 до 1, зокрема "сильно/серйозно зів'ялі" (4), "помірно зів'ялі" (3), "дещо зів'ялі" (2) або "в'янення відсутнє" (1), наприклад, вважають, що мутантні рослини мають істотно піідвищену стійкість до посухи, якщо в'янення зменшується до, щонайменше, 10 %, переважно, щонайменше, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % або 100 % у порівнянні з контрольними рослинами дикого типу. Наприклад, якщо оцінка симптомів в'янення (в) проводиться на 10 рослинах однієї лінії, контрольне значення, у середньому, може становити: в = 40/10=4,0, в той час як посухостійка лінія може мати в середньому в = 36/10=3,6 або менше, напр., в= 3,4, 3,2, 2,0, 1,4, або 1,0. Альтернативно або додатково можуть бути проведені польові випробування, для того щоб визначити, або передається лінії рослин істотно підвищена стійкість до посухи мутантним алелем SlPP2C1. Наприклад, сукупність рослин, які несуть конкретний мутантний алель SlPP2C1 (переважно, щонайменше, 10, 20, 30 або більше рослин однієї лінії), висаджуються в польових умовах разом з контрольними рослинами і не поливаються протягом тривалого періоду часу, який становить 1, 2, 3, 4 тижні або більше. Коли контрольні рослини виявляють ознаки в'янення, симптоми в'янення можуть бути оцінені, як описано вище. У альтернативному випадку, оцінка % відновлення і/або % виживання може бути визначена після відновлення поливу. Якщо в'янення листка або втрата тургору виявляється на контрольних рослинах, остпнні знову поливають (напр., протягом 1 тижня, 2 тижнів або більше), і після відновлення аналізують фенотип. Мутанти з підвищеною стійкістю до посухи виживають, щонайменше, на 2, 3, 4, 5, 6, 7 днів, переважно, щонайменше, 2-5 днів довше без води, ніж контрольні рослини (напр., рослини дикого типу або близької ізогенної лінії) за тих же умов, і які виявляють незворотні ушкодження тканини. Аналогічно, може бути підрахований % виживання, причому вважають, що мутантна лінія рослин є посухостійкою, якщо (в середньому) % виживання зростає до, щонайменше, 10 %, 20 %, 30 %, або більше порівняно з виживанням контрольних рослин. Як вже згадувалось раніше, можуть бути використані інші методи кількісного аналізу стійкості рослин до посухи. Найбільш прийнятні методи аналізу можуть відрізнятись для різних видів зернових культур, тобто для рослин томатів можуть бути прийнятними інші методи, ніж для салату або рису. Наприклад, статистично достовірне підвищення у рослин (що несуть мутантний алель) відновлення після впливу водного стресу може бути виміряне і/або істотно знижене відмирання рослин після періоду впливу посухи у порівнянні з рослинами, у яких вона відсутня. Див., напр., методи, описані у Zheng et al. (2009, supra), Yu et al. (2008, supra) або Xiong et al. 2006 (supra). "Істотно підвищена чутливість до АБК" може також бути протестована, як описано в Прикладах для трансгенних рослин. Підсумовуючи отримані результати, в середньому 24 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 проростання насіння на середовищі, що містить АБК, є, щонайменше, на 10 %, 20 %, 30 %, 40 %, 50 % або більше, нижче для рослин, що несуть мутантну алель SlPP2C1, ніж для контрольних рослин при тій же концентрації АБК. Наприклад, при 1 або 3 мкM АБК, 50 % насіння рослин дикого типу проростає, тоді як проростання мутантного насіння становить менше, ніж 40 %, 35 %, 30 %, або менше. Таким чином, проростання насіння рослин, що несуть мутантну алель, більше інгібується АБК. Ріст кореня рослини, що несе мутантний алель, також більше інгібується АБК. Переважно рослини при фенотипуванні щодо стійкості до посухи і/або чутливості до АБК, як описується вище, є гомозиготними за мутантним SlPP2C1 алелем, хоча можуть також бути фенотиповані гетерозиготні рослини, які можуть також виявляти підвищену стійкість до посухи і/або підвищену чутливість до АБК. Для того, щоб отримати рослини, що несуть мутантний алель у гомозиготній формі, може бути використане самозапилення, за бажанням поєднане з генотипуванням (виявлення присутності мутантного алеля, напр., за допомогою ПЛР з використанням специфічних праймерів і/або секвенування). Якщо використовуються TILLINGпопуляції, мутантні рослини (Ml) переважно самозапилюються один або більше разів, для того щоб отримати, наприклад, M2 популяції або, переважно, M3 або M4 популяції для фенотипування. В M2 популяціях мутантний алель присутній у співвідношенні 1 (гомозиготна за мутантним алелем): 2 (гетерозиготна за мутантним алелем): 1 (гомозиготна за алелем дикого типу). Сегрегація стійкості до посухи повинна корелювати з сегрегацією мутантного алеля. Рослиною, яка несе мутантний SlPP2C1 алель або її варіант, і має підвищену стійкість до посухи, може бути будь-яким видом рослин, оскільки послідовності томатів, забезпечені тут, можуть бути використані для отримання і ідентифікації рослин, що містять імітації у гомологах і ортологах гена, як це описано нижче. Може бути ідентифікована послідовність нуклеїнової кислоти ендогенного варіанту SlPP2C1 у рослині, яка після цього може бути використана як генмішень при отриманні і/або ідентифікації рослин, що містять мутантний алель SlPP2C1 варіанту. Таким чином, мутантні, стійкі до посухи, рослини можуть бути видом з класу дводольних або однодольних рослин. Переважно рослина - це культивована рослина, хоча одне з втілень тут полягає в ідентифікації мутантних алелів у диких рослинах або некультивованих рослинах і їх перенесенні у культивовані рослини за допомогою гібридизаційних методик. У одному втіленні, рослина, яка містить, щонайменше, один мутантний SlPP2C1 алель (у гомозиготній або гетерозиготній формі) і має істотно підвищену стійкість до посухи (і/або істотно підвищену чутливість до АБК), є представником родини Solanaceae, тобто охоплює роди Solanum, Capsicum, Nicotiana та інші. В іншому втіленні рослина є представником роду Solanum, напр., охоплюючи культивовані томати, картоплю, баклажани та інші. В одному втіленні, посухостійка рослина томатів включає мутантний SlPP2C1 алель (напр., StPP2Cl послідовності SEQ ID NO: 14 або її варіанту), що кодує редукцію функції або втрату функції білка (напр., редукцію функції або втрату функції StPP2Cl білка послідовності SEQ ID NO: 15 або її варіанту). У специфічному втіленні рослина належить до виду S. lycopersicum. Будь-який S. lycopersicum може бути отриманий і/або ідентифікований, маючи, щонайменше, один мутантний SlPP2C1 алель в своєму геномі і та властивості посухостійкості. Рослина томатів, таким чином, може бути культивованими томатами, будь-якою комерційною різновидністю, будь-якою селекційною лінією або іншою рослиною, вона може бути визначеною або невизначеною, відкрито запилюваною або гібридною, і утворювати плоди будь-якої форми та розміру. Мутантний алель генерується і/або ідентифікується у конкретної рослини томатів, або у статево сумісних споріднених видів, які можуть бути або просто перенесені в іншу рослину томатів шляхом гібридизації (схрещування з рослиною, яка несе мутантний алель, а після цього здійснюювати відбір потомства з мутантним алелем). Рослина може бути будь-яким видом родини Solanaceae або роду Solanum, види якого зазнають мутагенезу для отримання мутантного алеля (напр., за допомогою TILLING) або у яких ідентифікуються одна або більше природних або спонтанних мутацій в SlPP2C1 гені (або його варіанті), напр., за допомогою EcoTILLING. В одному втіленні мутантний алель отримано або ідентифіковано у культивованої рослини, один також може бути отриманий і/або ідентифікований у рослини дикого виду або у некультивованої рослини, а після цього перенесений в культивовану рослину за допомогою напр., схрещування і селекції (у альтертативному випадку застосовуються міжвидові схрещування з, напр., видаленням зародка для перенесення мутантного алеля). Таким чином, мутантний алель SlPP2C1 може бути створений (індукована людиною мутація за допомогою методик мутагенезу, щоб викликати мутацію гена-мішені SlPP2C1 або його варіанту) і/або 25 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 ідентифікований (самодовільна або природна варіація алеля) в інших видах Solanum, включаючи, наприклад, S. cheesmanii, S. chilense, S. habrochaites, S. chmielewskii, S. lycopersicum x S. peruvianum, S. glandulosum, S. hirsutum, S. minutum, S. parviflorum, S. pennellii, S. peruvianum, S. peruvianum var. humifusum і S. pimpinellifolium, після чого перенесена в культивовані рослини Solanum, напр., Solanum lycopersicum з використанням традиційних методик схрещування. Термін "традиційні селекційні методи" охоплює тут схрещування, самозапилення, селекцію, утворення подвійних гаплоїдів, "рятування зародка" (embryo rescue), злиття протопластів тощо, що відомі селекціонеру, тобто методи, що відрізняються від генетичної модифікації, але за допомогою яких можуть бути перенесені алелі. Переважно мутація(ї) в SlPP2C1 алелі призводить до утворення рослини, що має істотно підвищену стійкість до посухи і/або істотно підвищену чутливість до АБК у порівнянні з рослинами, у яких мутантний алель(і) відсутній(і) (тобто вони несуть SlPP2C1 алелі дикого типу), як описано вище. Не обмежуючи винахід, мутація в SlPP2C1 (SEQ ID NO: 1, або її варіанти, або у відповідній геномній послідовності, напр., SEQ ID NO: 11 від нуклеотидів 2676 до 4975, або її варіантах), обумовлює зниження функціональної здатності або втрату функції SlPP2C1 білка, наприклад, через переміщення поодиноких основ, місенс- або нонсенс-мутації, або інсерцію або делецію однієї або більше амінокислот або зсуву рамки в кодуючій послідовності, що в кінцевому результаті призводить до зміни фенотипу. Наявність і тип мутації(й) може бути проаналізований шляхом секвенування гена з використанням SlPP2C1-специфічних праймерів. "Значна редукція" функціональної здатності білків SlPP2C1 визначається переважно опосередковано in vivo за фенотипом (тобто через підвищену стійкість до посухи) у гетерозиготних рослин або, переважно, гомозиготних за мутантним алелем. Стійкий до посухи фенотип свідчить про наявність мутантного алеля. Однак, "істотна редукція" функціональної здатності білка може також бути визначена in vitro за допомогою тесту на протеїнфосфатазу, внаслідок чого фосфатазна активність мутантного SlPP2C1 білка зменшується, щонайменше, до 10, 20, 30, 40, 50, 60, 70, 80, 90 (знижена функція) або 100 % (мутація втрати функції). Для того щоб це здійснити, мутантний алель клонується і експресується, напр., в E. coli, після чого проводиться тест на фосфатазну активність in vitro, як, наприклад, описано, Gosti et al. 1999, Plant Cell 11: 1897-1910, Material and Methods-PP2C Activities, page 1907. В одному втіленні винаходу забезпечується рослина (переважно рослина томатів), яка включає одну або більше мутацій в послідовностях SEQ ID NO:l або SEQ ID NO: 11 (від нуклеотидів 2676 до 4975), або в послідовності нуклеїнової кислоти, яка виявляє, щонайменше, близько 45 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 98 %, 99 % або більше ідентичності послідовності до SEQ ID NO: 1 (як визначено) або до послідовності SEQ ID NO: 11 (від 2676 до 4975 нуклеотиду), або в відповідній геномній послідовності будь-якої з них, в результаті чого мутація призводить до закодованого SlPP2C1 білка (або варіанта), що має знижену активність (у порівнянні з функціональним білком дикого типу) або не виявляє ніякої активності in vivo і/або in vitro і де вказана рослина виявляє істотно підвищену стійкість до посухи у порівнянні з рослиною (переважно томатами), яка включає послідовність нуклеїнової кислоти, що кодує SlPP2C1 білок дикого типу (або варіант). В одному втіленні забезпечується рослина (переважно рослина томатів), яка включає одну або більше мутацій в нуклеотидній послідовності, що кодує білок за послідовністю SEQ ID NO: 2, або білок, що включає, щонайменше, 45 %, 50 %, 60 %, 70 %, 80 %, 85 %, 90 %, 95 %, 98 %, 99 % або більше ідентичності до послідовності SEQ ID NO: 2 (як визначено), і де рослина (томати) виявляє істотно підвищену стійкість до посухи у порівнянні з рослиною (томатами), у яких відсутні зазначені одна або більше мутацій. В одному втіленні забезпечується посухостійка рослина (переважно рослина томатів), що несе мутантний SlPP2C1 алель, для якого характерною є мутація, що полягає у втраті функції або редукції функції закодованого SlPP2C1 білка, і вказаний білок - це білок, що має, щонайменше, 45 %, 48 %, 49 %, 50 %, 60 %, 70 %, 80 %, 85 %, 90 %, 95 %, 98 %, 99 % або більше ідентичності амінокислотної послідовності до послідовності SEQ ID NO: 2. Рослина (напр., рослина томатів) є переважно гомозиготною за мутантним алелем SlPP2C1. Мутантні рослини можна відрізнити від немутантних за допомогою молекулярних методів, таких як наявність мутації(ій) в геномній ДНК SlPP2C1 або мРНК (кДНК), рівні білка SlPP2C1 і/або активності білка та ін., а також через модифіковані фенотипові характеристики у порівнянні з диким типом. Мутантний алель може бути перенесений в інші рослини, які статево сумісні з мутантною рослиною при застосуванні традиційного схрещування і селекції. Таким чином, мутантний алель може бути використаний для отримання посухостійких різновидів томатів 26 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 будь-якого типу, напр., різновидностей відкрито запилюваних, гібридних різновидностей, F1 гібридів, типу Рома, типу черрі, визначених або невизначених типів тощо. В одном втіленні рослина (переважно S. lycopersicum), яка включає мутантний SlPP2C1 алель і має підвищену стійкість до посухи, є гібридною рослиною покоління F1 або F1 насінням, з якого вирощуються F1 гібридні рослини. Інбредні батьківські лінії, що використовуються для отримання F гібридів, переважно, обидві включають той же мутантний SlPP2C1 алель у їх геномі в гомозиготній формі. В іншому втіленні, рослина, що несе мутантний алель SlPP2C1 (напр., томати) схрещується з іншою рослиною цього ж виду або близько спорідненого виду для отримання гібридної рослини (гібридного насіння), яка несе мутантний алель SlPP2C1. Такі гібридні рослини є також втіленням винаходу. Також забезпечується метод для перенесення мутантного алеля SlPP2C1 іншій рослині, який полягає у забезпеченні рослини, яка несе мутантний SlPP2C1 aлель у своєму геномі, схрещуванням вказаної рослини з іншою рослиною і отриманні насіння від вказаного схрещування. Необов'язково рослини, отримані з цього насіння, можуть далі бути самозапилені і/або перехресно запилені, після чого відбирається потомство, яке несе мутантний алель і має підвищену стійкість до посухи. В одному втіленні батьківські лінії, використані для отримання гібриду F1, включають різні мутантні SlPP2C1 алелі в гомозиготній формі, так що гібрид включає два різні мутантні SlPP2C1 алелі. Наприклад, батьківська форма 1 може включати мутантний алель, що обумовлює втрату функції, тоді як бтьківська форма 2 включає мутантний алель, що обумовлює редукцію функції. Після цього F1 гібрид несе один алель від кожної батьківської форми. Таким чином, також тут забезпечуються рослини томатів, які включають два різні мутантні SlPP2C1 алелі в тому ж локусі SlPP2C1 і мають підвищену стійкість до посухи. Рослини, які несуть мутантний SlPP2C1 алель, що кодує втрату або редукцію функції білка (напр., утворення усіченого білка в результаті наявності несмислової мутації, а білок з модифікованою амінокислотною послідовністю, призводить, напр., до модифікованого каталітичного сайта, модифікованої конфігурації білка тощо, наприклад, через місенс-мутацію, мутацію "зсуву рамки" і/або мутацію сайта сплайсингу), можуть бути отримані і/або ідентифіковані за допомогою методів мутагенезу або шляхом скринінгу природних популяцій на наявності природних варіантів SlPP2C1 алеля. В одному втіленні винаходу TILLING використовується для отримання таких рослин і/або ідентифікації мутацій, індукованих таким мутагенезом і/або EcoTILLING використовується для ідентифікації рослин, таких як рослини дикого типу або некультивовані рослини, що несуть природні (спонтанні) мутації SlPP2C1 гена, які надалі можуть бути перенесені в культивовані рослини за допомогою традиційних селекційних методик. Однак, може бути використаний будь-який метод, пов'язаний з мутагенезом, тому цілком зрозуміло, що тут охоплені як індуковані людиною за допомогою ультрафіолетового або рентгенівського випромінювання, хімічних мутагенів мутанти, так і спонтанні мутанти SlPP2C1 гена, отримані або пренесені в культивовані рослини або сільськогосподарські рослини з використанням традиційних селекційних методів. В одному специфічному втіленні згідно з цим винаходом посухостійка мутантна рослина - це рослина іншого, ніж томати, виду, напр., культивована рослина з класу однодольних рослин, переважно рис, кукуурудза, пшениця або ячмінь, які несуть мутантний SlPP2C1 алель в своєму геномі. При використанні таких методів, як TILLING, ампліфікація фрагмента гена-мішені може базуватись на послідовності SEQ ID NO: 1, або її фрагментах (напр., за допомогою специфічних або дегенеративних праймерів, наприклад, сконструйованих на основі одного або більшої кількості консервативних доменів SlPP2C1), або спочатку може бути ізольований ортолог SlPP2C1 і сконструйований праймер на ортологічній послідовності. TILLING (Targeting Induced Local Lesions IN Genomes) - це загальна зворотна генетична методика, яка використовує традиційні методи хімічного мутагенезу для створення бібліотек особин, що зазнали мутагенезу, які надалі підлягають високопродуктивному скринінгу для виявлення мутацій. TILLING поєднує хімічний мутагенез зі скринінгом мутації в пулі продуктів ПЛР, що призводить до виділення місенс- і нонсенс-мутантних алелів генів-мішеней. Таким чином, TILLING використовує традиційний хімічний мутагенез (напр., EMS або MNU мутагенез) або інші методи мутагенезу (напр., радіації, зокрема, ультрафіолетове опромінення) з наступним високопродуктивним скринінгом на наявність мутацій у специфічних генах-мішенях, таких як SlPP2C1, згідно з винаходом. SI-нуклеази, такі як CEL1 або ENDOl, використовуються, для того щоб розщепити гетеродуплекси мутантної ДНК і ДНК-мішені дикого типу і детекція продуктів розщеплення з використанням, напр., електрофорезу, такого як система гельаналізатора LI-COR (gel analyzer system), див. напр., Henikoff et al. Plant Physiology 2004, 135: 630-636. TILLING застосовується для багатьох рослин, таких як томати (див. 27 UA 110774 C2 5 10 15 20 25 30 35 40 45 50 55 60 http://tilling.ucdavis.edu/index.php/Tomato_Tilling), рис (Till et al. 2007, BMC Plant Biol 7: 19), Arabidopsis (Till et al. 2006, Methods Mol Biol 323: 127-35), Brassica, кукурудза (Till et al. 2004, BMC Plant Biol 4: 12), тощо. Також широко застосовується EcoTILLING, за допомогою чого виявляються мутанти в природних популяціях, див. Till et al. 2006 (Nat Protoc 1: 2465-77) і Comai et al. 2004 (Plant J 37: 778-86). В одному втіленні класичний TILLING модифікується і замість використання виявлення мутантів з використанням ферментів (ферментативне розщеплення за допомогою одноланцюгової специфічної нуклеази і електрофорезу високого розділення в поліакриламідногому гелі), можуть бути використані дві різні високопродуктивні системи детекції, які раніше використовувались лише для людини. Ці протоколи детекції є адаптованими версіями CSCE (Капілярний електрофорез, чутливий до конформацій), див. Rozycka et al. 2000, Genomics 70, 34-40) або методу HRM (плавлення з високим розділенням - High Resolution Melting, див. Clin Chem 49, 853-860). Див. також Приклади. Таким чином, тут охоплені нетрансгенні рослини, насіння і тканини, що містять мутантний алель SlPP2C1 в одній або більше тканин і містять одну або більше характерних фенотипових особливостей, обумовлених білком SlPP2C1 з ослабленою та втраченою функцією, згідно з винаходом (напр., посилена стійкість до посухи, як описано вище) і способи отримання та ідентифікації таких рослин. Також забезпечується метод для отримання і/або ідентифікації мутантного SlPP2C1 aлеля, прийнятного для отримання посухостійких рослин і/або метод для отримання рослин, які відрізняються підвищеною стійкістю до посухи, які включають такі етапи: (a) мутагенез насіння рослини (напр., за допомогою EMS-мутагенезу) для отримання M1 популяції або забезпечення мутагенізованого насіння рослин або забезпечення рослин, що включають природну варіацію, (b) необов'язкове самозапилення рослин (a) один або більше разів для того, щоб отримати родини M2, M3 або M4, (c) отримання ДНК рослини (a)або (b) і групування ДНК особин, (d) ПЛР-ампліфікація усього або частини гена-мішені SlPP2C1 (геномної або кДНК), або їх варіантів, з пулів ДНК, (e) детектування присутності мутантного SlPP2C1 алеля (лів) в продуктах ПЛР-ампліфікації і, відповідно, в пулах ДНК, (f) відбір відповідної особини рослини, яка включає мутантний алель(і) SlPP2C1, (g) необов'язково, секвенування мутантного SlPP2C1 алеля рослини; (h) фенотипування рослини (f), або її потомства щодо стійкості до посухи і/або чутливості до АБК, і (i) відбір посухостійких рослин, і, необов'язково, (j) схрещування з рослиною (i) для отримання культивованої посухостійкої рослини, що має якісні агрономічні характеристики. Етап (a) може також бути спрощений, забезпечуючи такі рослини. На етапі (c), альтернативно, може бути зібрана рослинна тканина і виділена ДНК із зібраних тканинних зразків, для того щоб забезпечити пул ДНК різних особин. На етапі (d) праймери, які ампліфікують весь або частину гена-мішені SlPP2C1 (SEQ ID NO: 1) або його варіант, конструюються за допомогою стандартних методик, таких як CODDLE (http://www.proweb.org/doddle). Праймери можуть бути призначені для ампліфікації фрагментів, напр., щонайменше, приблизно 100, 200, 250, 300, 400, 500, 600, 800 bp або, щонайменше, приблизно 1000 bp або більше гена-мішені, тобто послідовності SEQ ID NO: 1, або варіанту SEQ ID NO: 1, або геномної послідовності SEQ ID NO: 1 (тобто, крім того, включає інтрони, напр., для томатів SEQ ID NO: 11 від нуклеотидів 2676-4975). Геномна послідовність може легко бути виділена, а її поослідовність визначена, як описано в Прикладах. Переважно фрагмент, що несе частину консервативного домену SlPP2C1 білка, ампліфікується праймером, напр., Cтермінальний домен або очікуваний описаний домен зв'язування магнію. Для видів рослин, інших, ніж томати, може бути бажаним насамперед ідентифікувати послідовність ендогенного SlPP2C1 гена, для того щоб мати можливість сконструювати хороші послідовності праймерів. Послідовність може бути ідентифікована in silico або, наприклад, шляхом конструювання дегенеративних ПЛР-праймерів і ампліфікації всіх частин варіанту SlPP2C1 гена (ортолога SlPP2C1 гена томатів) з геному виду рослин. Після цього послідовність ендогенного SlPP2C1 гена переважно використовується для конструювання прийнятних праймерів для TILLING. Етап (е) може містит використання S1 нуклеази, такі як CEL1, для виявлення невідповідностей між ПЛР продуктами ампліфікації, тобто між ПЛР продуктом SlPP2C1 дикого типу і ПЛР продуктом мутантного SlPP2C1, який утворює гетеродуплекси. Альтернативно, на 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDrought tolerant plants
Автори англійськоюVriezen, Willem Hendrik, Nitsch, Lisette
Автори російськоюВризен Виллем Хендрик, Нитс Лисетт
МПК / Мітки
МПК: A01H 5/00, C12N 15/82, C12N 15/55, A01H 5/08, A01H 1/06
Мітки: рослина, посухи, стійка, нетрансгенна
Код посилання
<a href="https://ua.patents.su/54-110774-netransgenna-stijjka-do-posukhi-roslina.html" target="_blank" rel="follow" title="База патентів України">Нетрансгенна стійка до посухи рослина</a>
Попередній патент: Спосіб одержання порошків, що містять нано- і мікрочастинки
Наступний патент: Пристрій і спосіб виробництва дрібнозернистого палива з твердої або пастоподібної сировини за допомогою обпалення та подрібнення
Випадковий патент: Спосіб буріння багатоярусних горизонтальних і вертикальних нафтових та газових свердловин