Аптамер проти мідкайну і його застосування
Номер патенту: 100847
Опубліковано: 11.02.2013
Автори: Накамура Йошіказу, Сакума Садатоші, Міяква Шін, Мацуі Такаші, Фуджівара Масатоші
Формула / Реферат
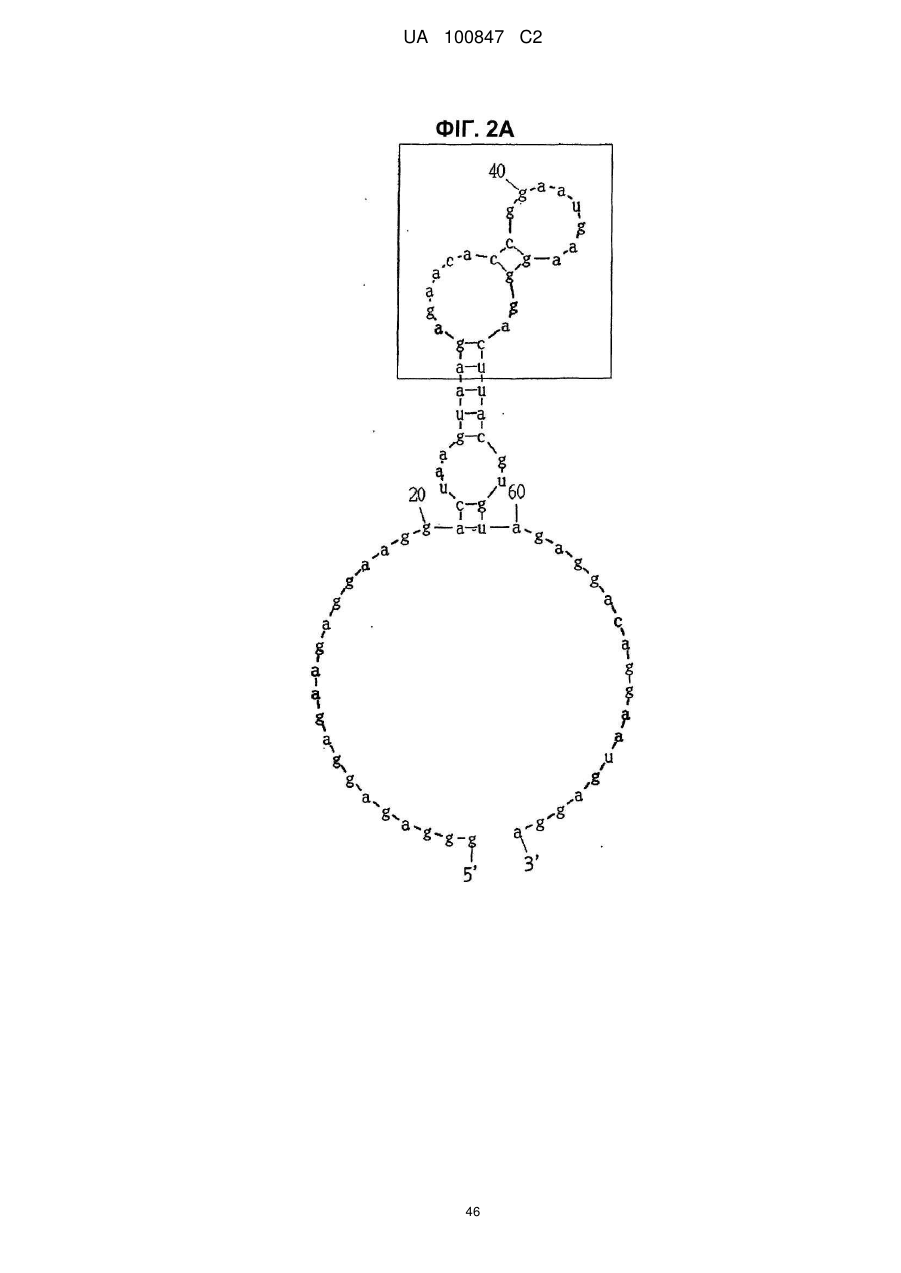
1. Аптамер, що має інгібувальну активність проти мідкайну, який вибирають з групи, що містить:
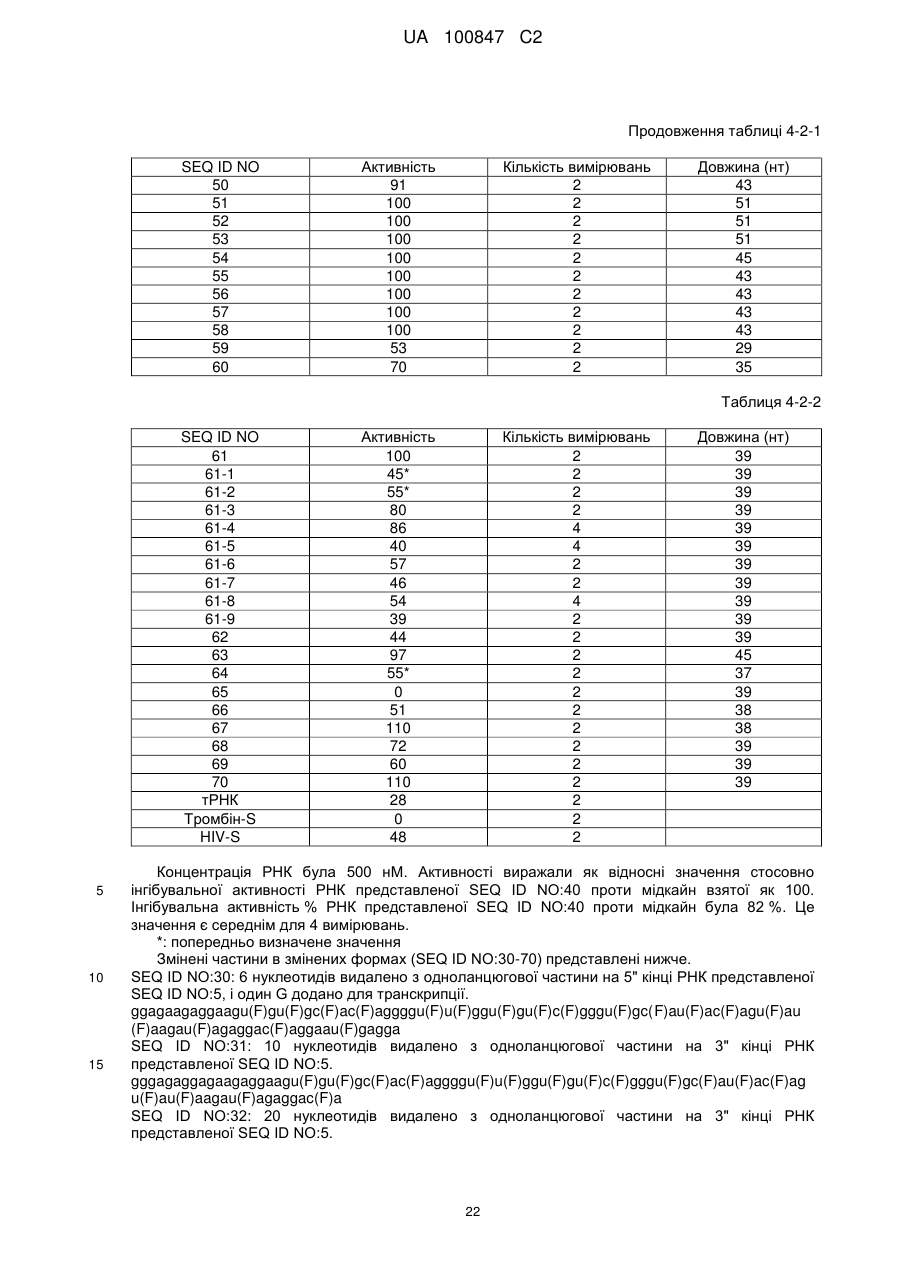
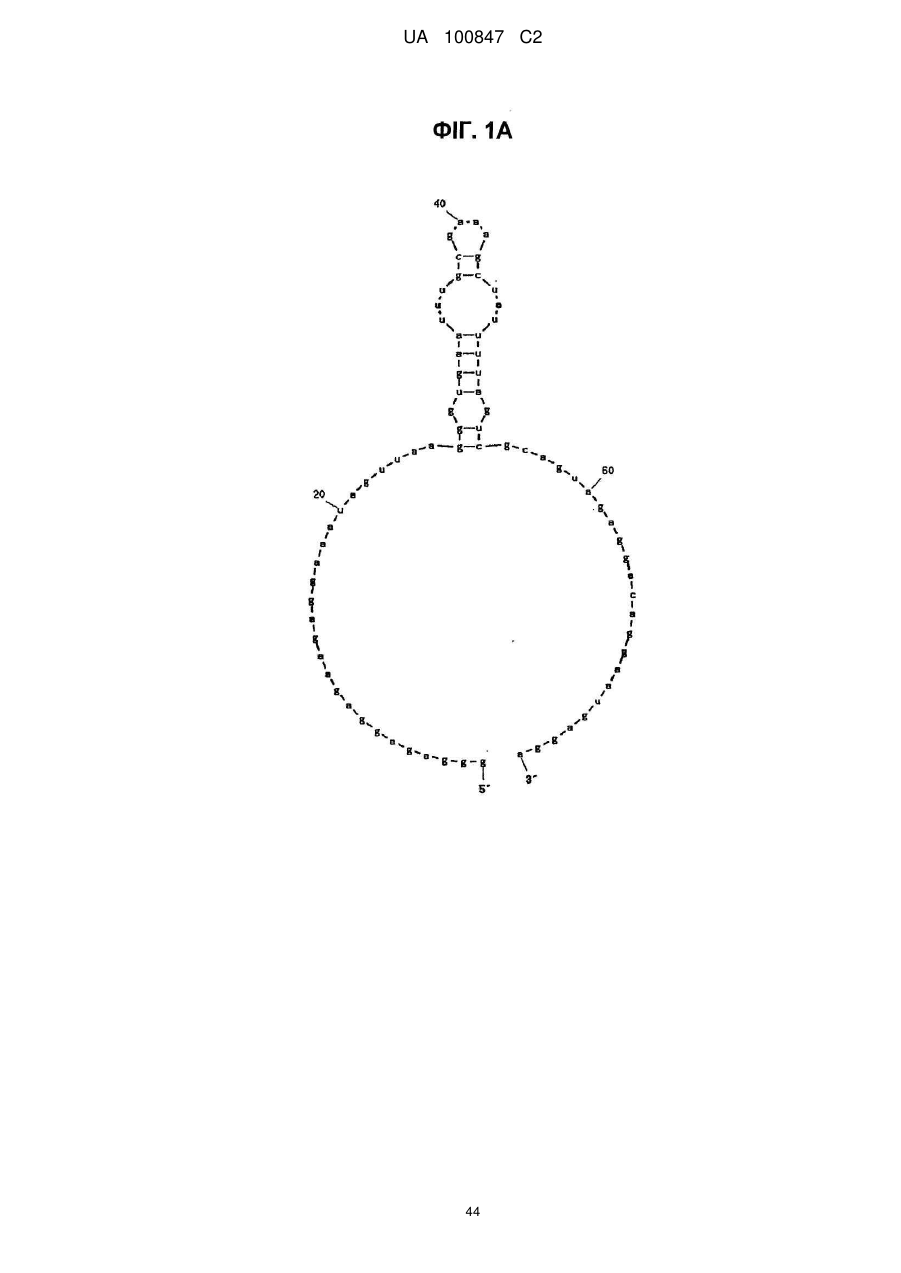
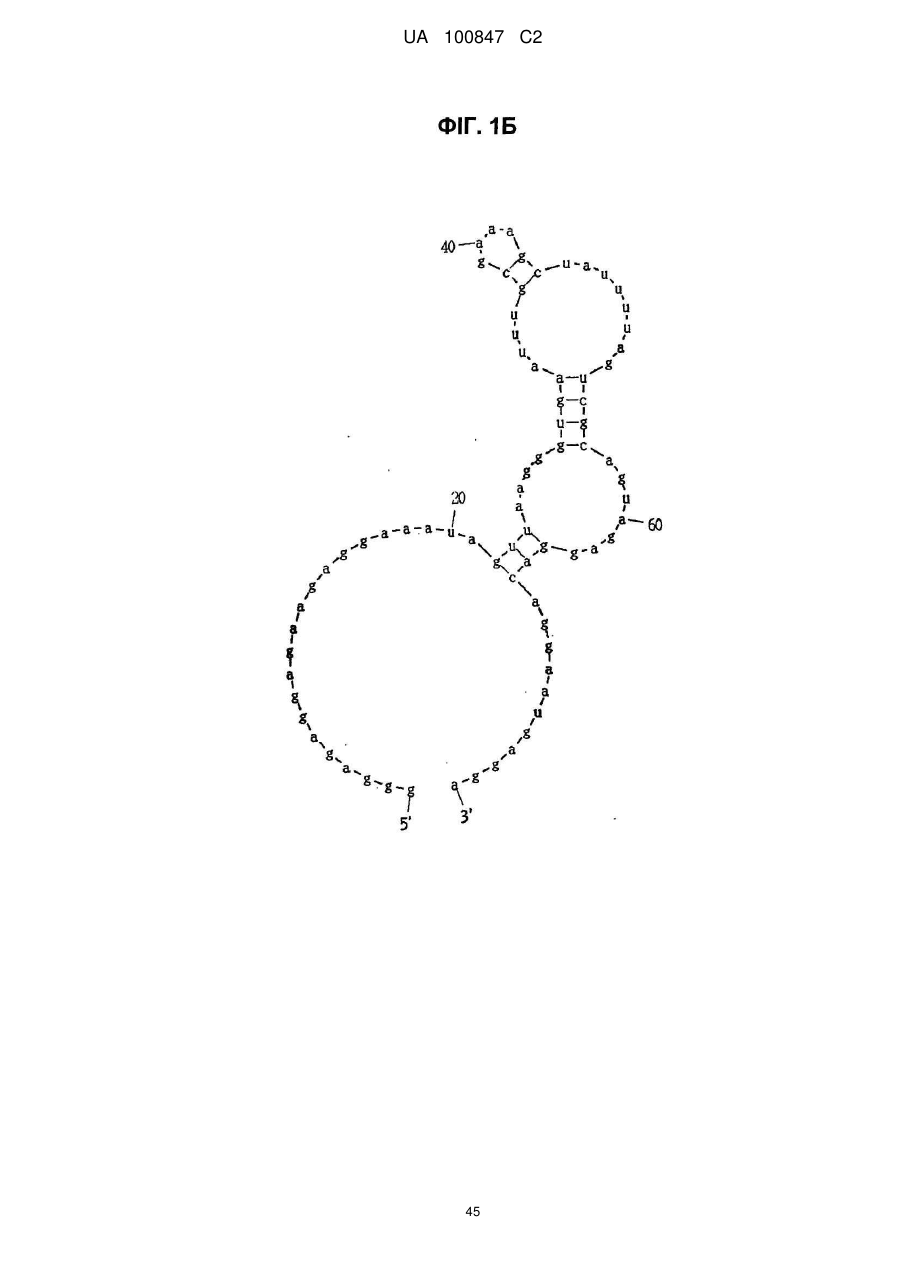
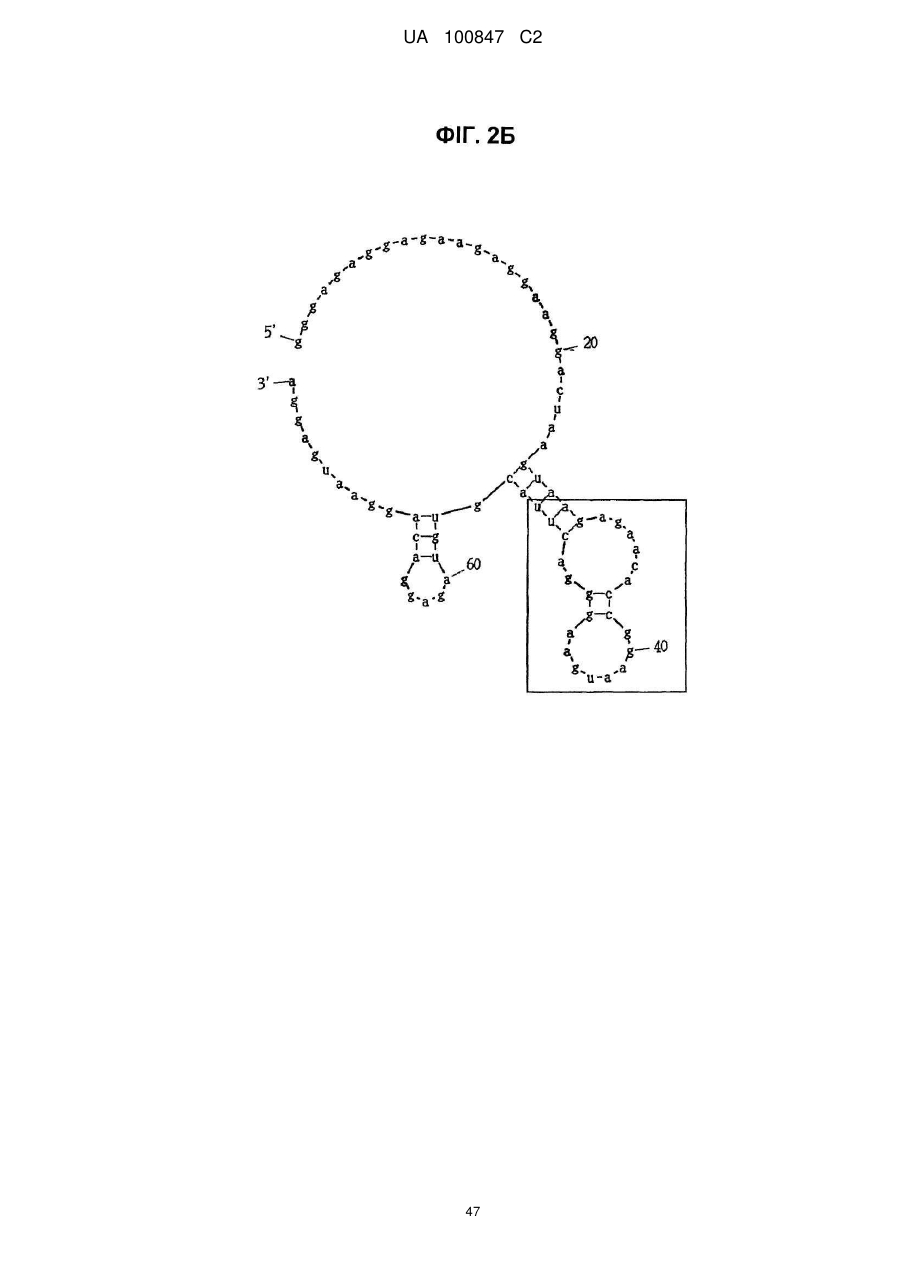
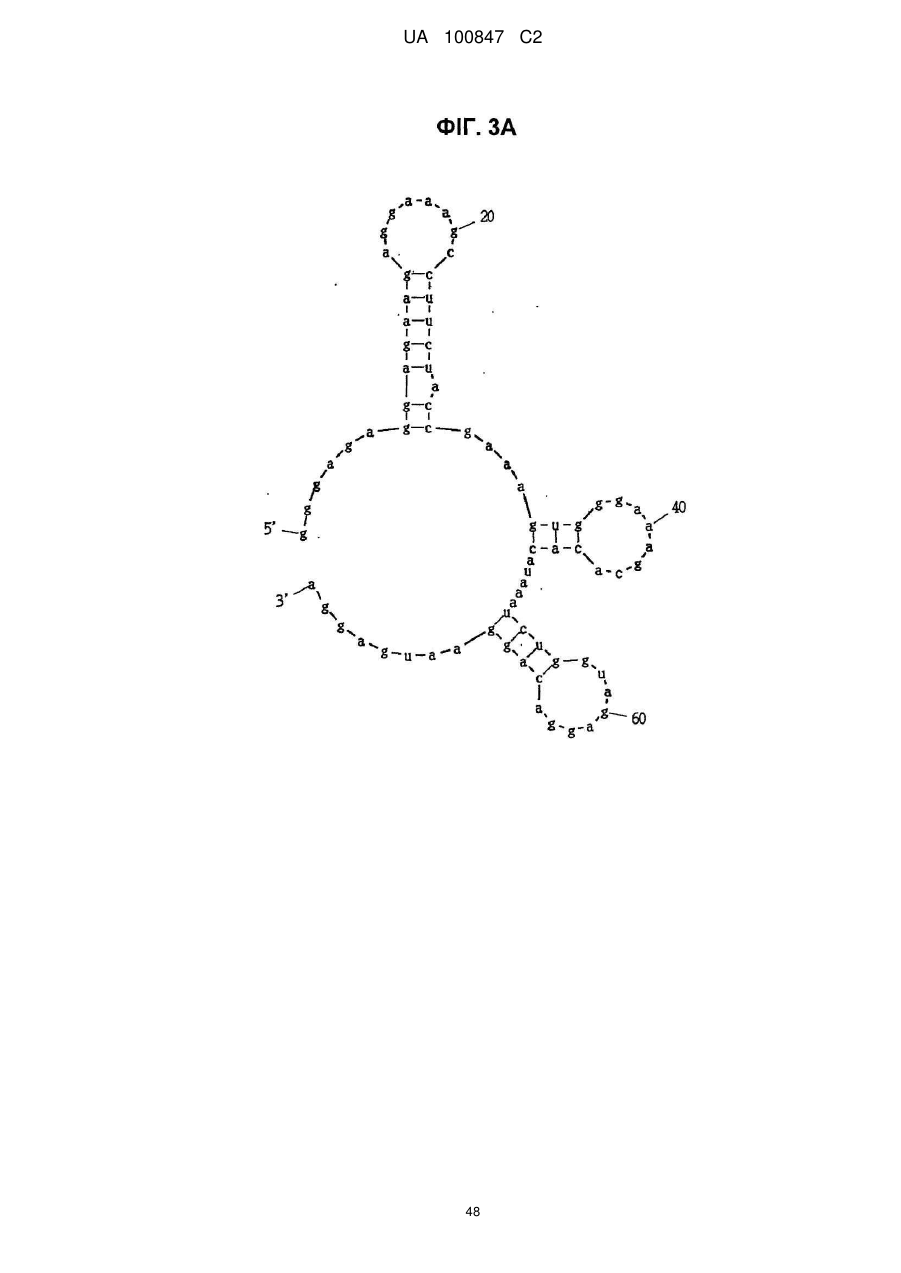
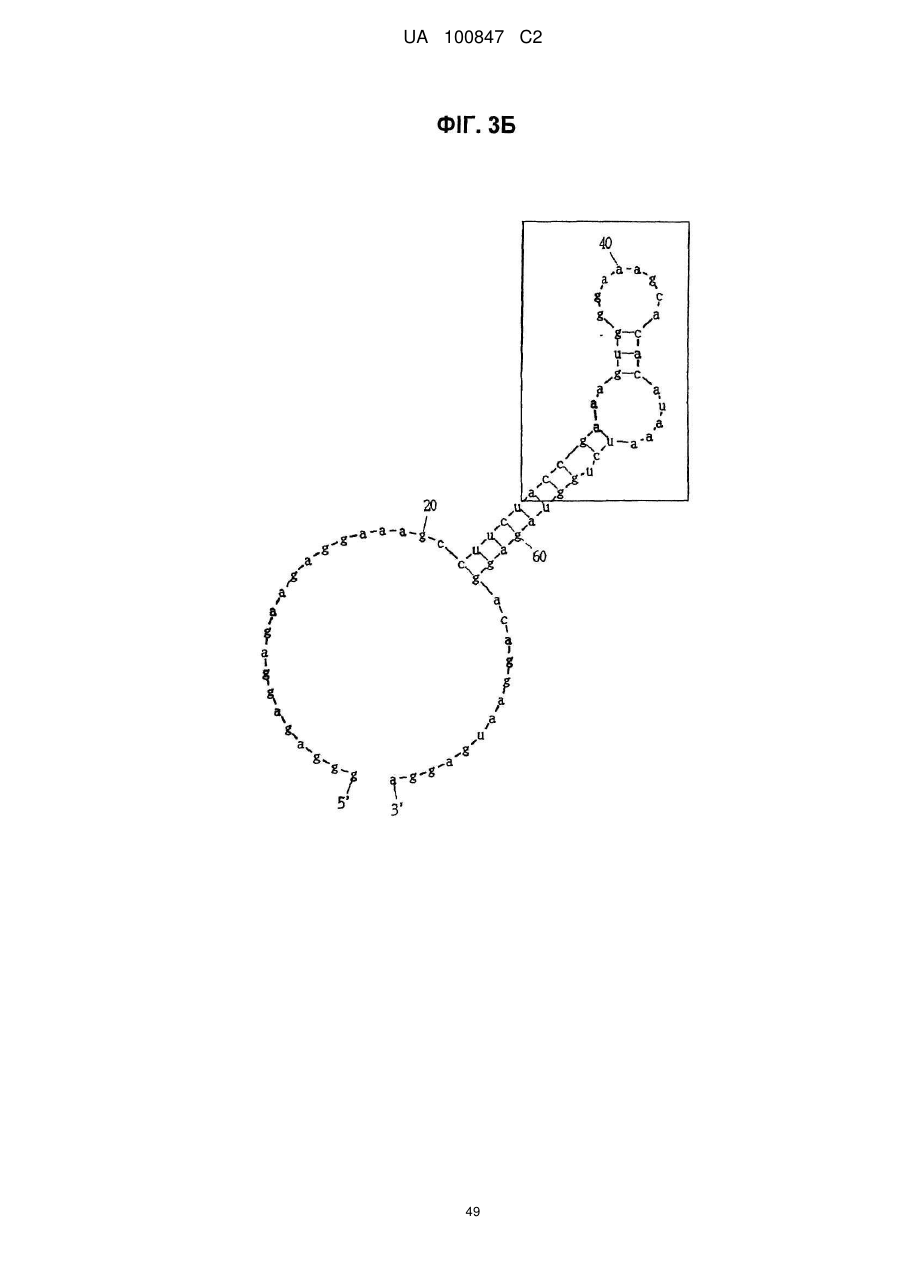
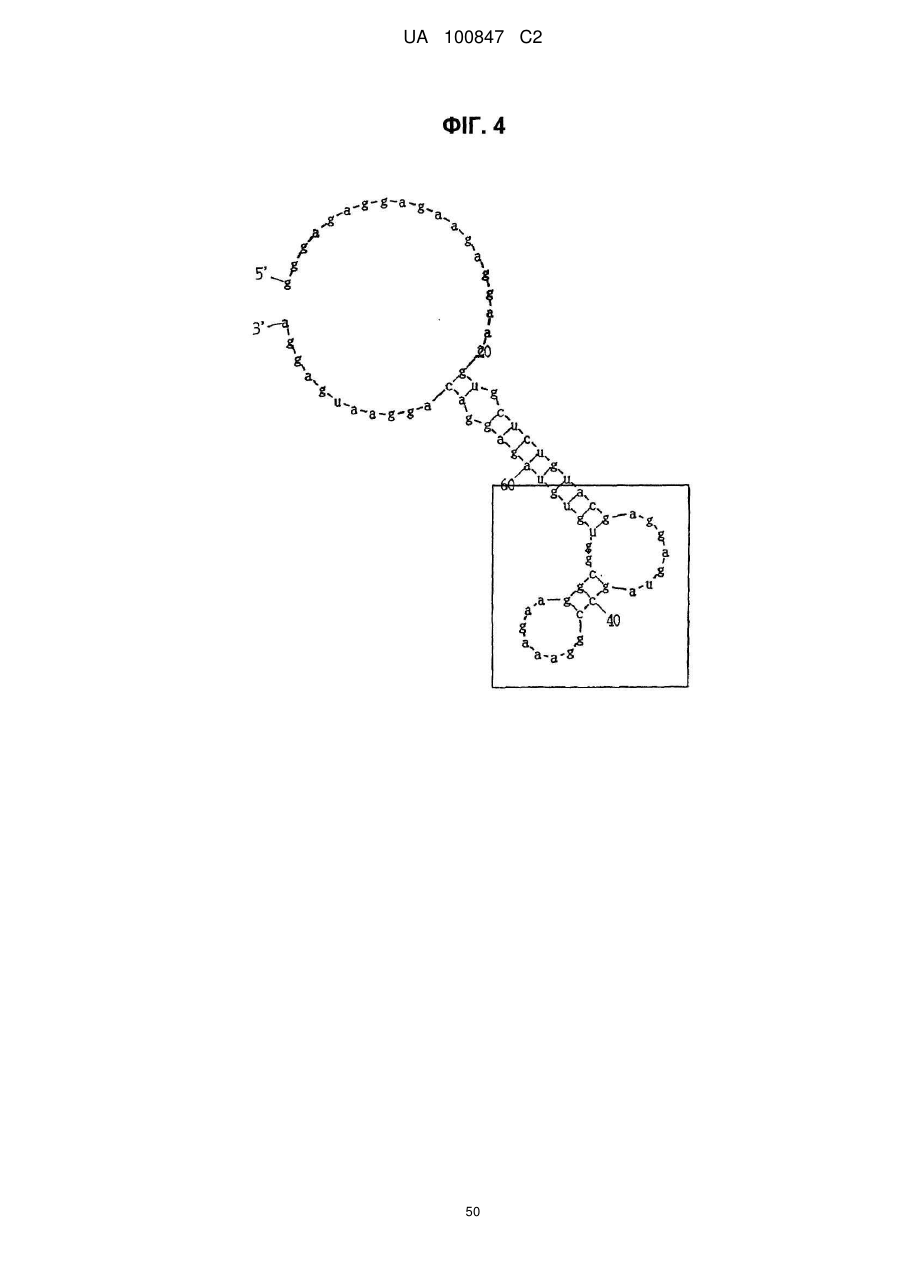
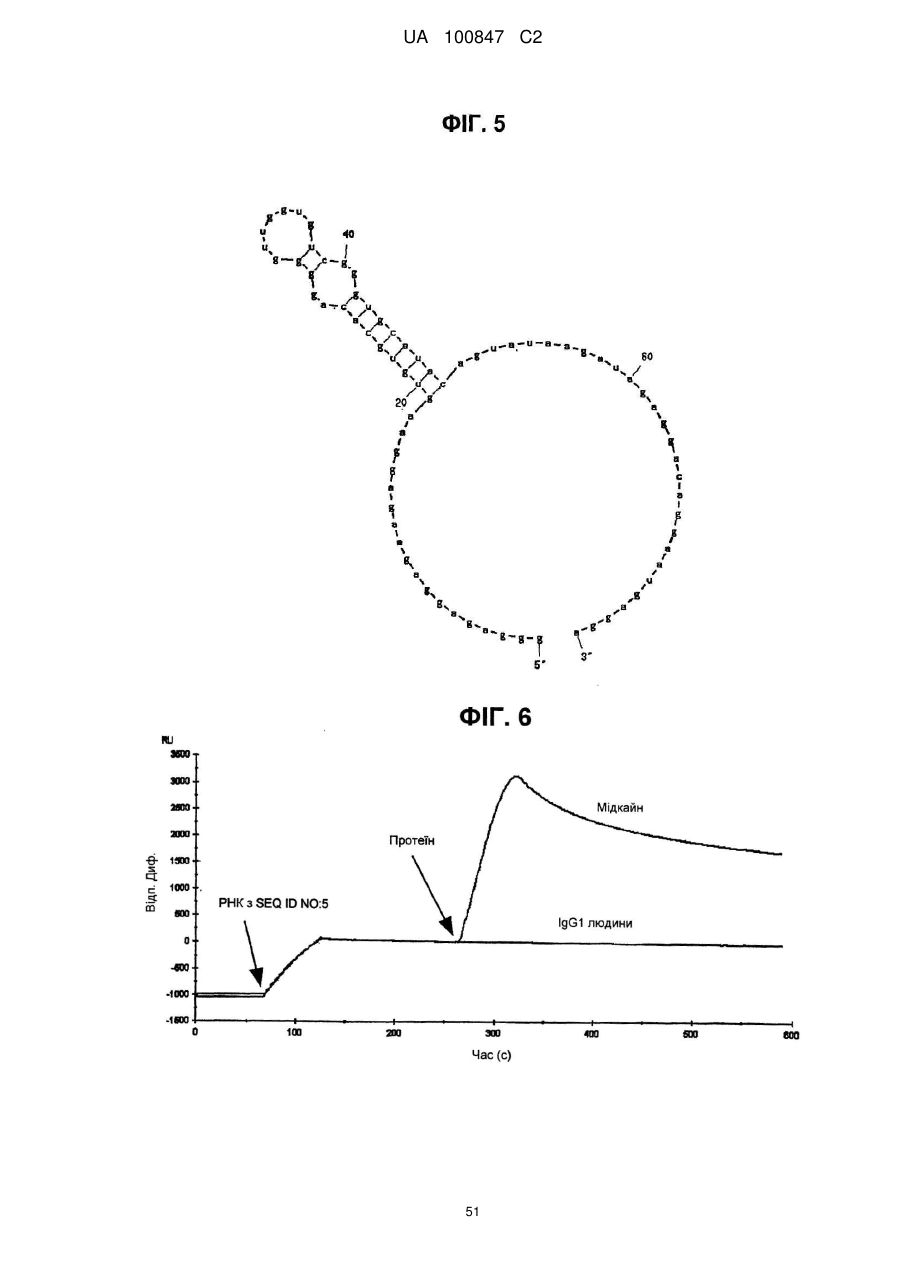
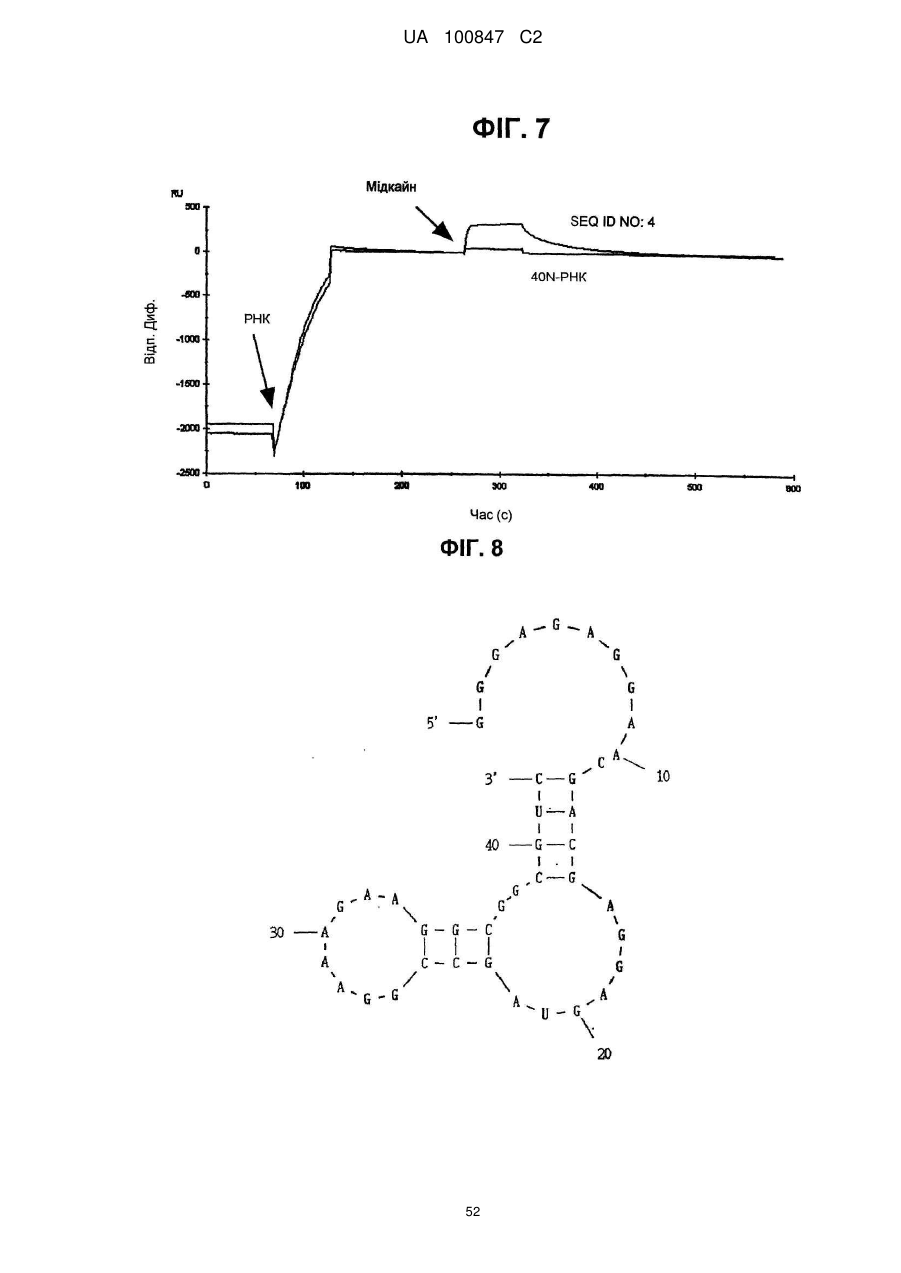
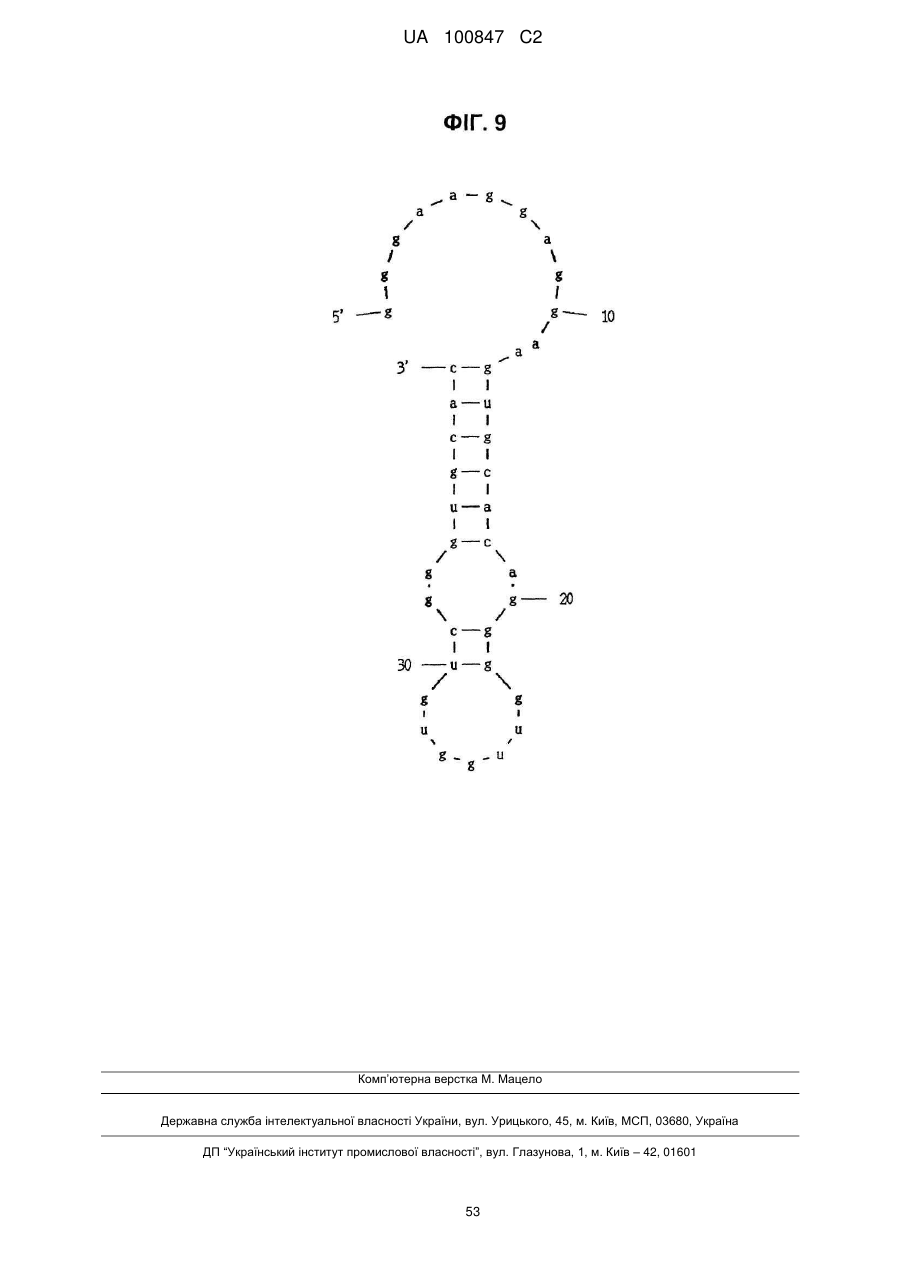
(a) аптамер, що включає нуклеотидну послідовність, вибрану з поміж SEQ ID NO: 1, 2, 4-20, 22-33, 35, 36, 39-64 та 66-70 (за умови, що урацил може бути тиміном), де нуклеотиди, що містяться в аптамері, є такими, що,
(i) 2'-положення піримідинових нуклеотидів або ідентичні, або різні і є атомами фтору або заміщені атомами або групами, що вибирають з групи, яка містить атоми водню, гідроксигрупи і метоксигрупи, і
(ii) 2'-положення пуринових нуклеотидів або ідентичні, або різні і є гідроксигрупами або заміщені атомами або групами, що вибирають з групи, яка містить атоми водню, метоксигрупи і атоми фтору; або
(б) аптамер, що включає нуклеотидну послідовність, вибрану з поміж SEQ ID NO: 1, 2, 4-20, 22-33, 35, 36, 39-64 та 66-70 (за умови, що урацил може бути тиміном), де один або декілька нуклеотидів є заміненими, видаленими, вставленими або доданими, де нуклеотиди, що містяться в аптамері, є такими, що,
(i) 2'-положення піримідинових нуклеотидів або ідентичні, або різні і є атомами фтору або заміщені атомами або групами, що вибирають з групи, яка містить атоми водню, гідроксигрупи і метоксигрупи, і
(ii) 2'-положення пуринових нуклеотидів або ідентичні, або різні і є гідроксигрупами або заміщені атомами або групами, що вибирають з групи, що містить атоми водню, метоксигрупи і атоми фтору.
2. Аптамер за пунктом 1, де нуклеотид, що міститься в аптамері, є модифікованим.
3. Комплекс, що складається з аптамеру за пунктом 1 або 2 і функціональної речовини, яка є афінною речовиною, речовиною для мічення, ферментом, розріджувачем для вивільнення лікарського засобу або лікарським засобом.
4. Фармацевтичний засіб, що містить аптамер за пунктом 1 або 2 або комплекс за пунктом 3.
5. Інгібітор міграції клітин, що містить аптамер за пунктом 1 або 2 або комплекс за пунктом 3.
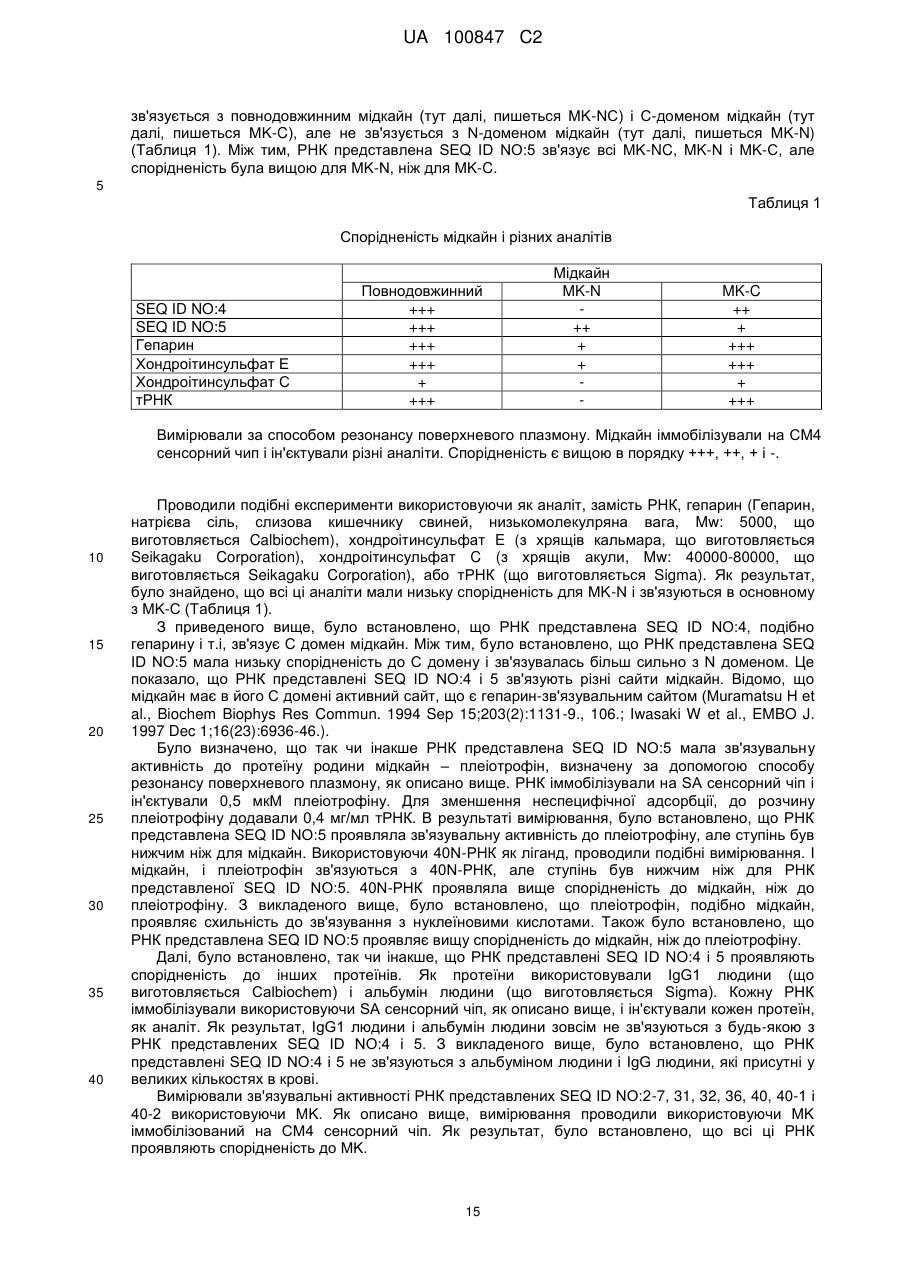
6. Діагностичний засіб, що містить аптамер за пунктом 1 або 2 або комплекс за пунктом 3.
7. Агент для мічення, що містить аптамер за пунктом 1 або 2 або комплекс за пунктом 3.
8. Застосування аптамеру за пунктом 1 або 2 для детектування мідкайну.
9. Застосування комплексу за пунктом 3 для детектування мідкайну.
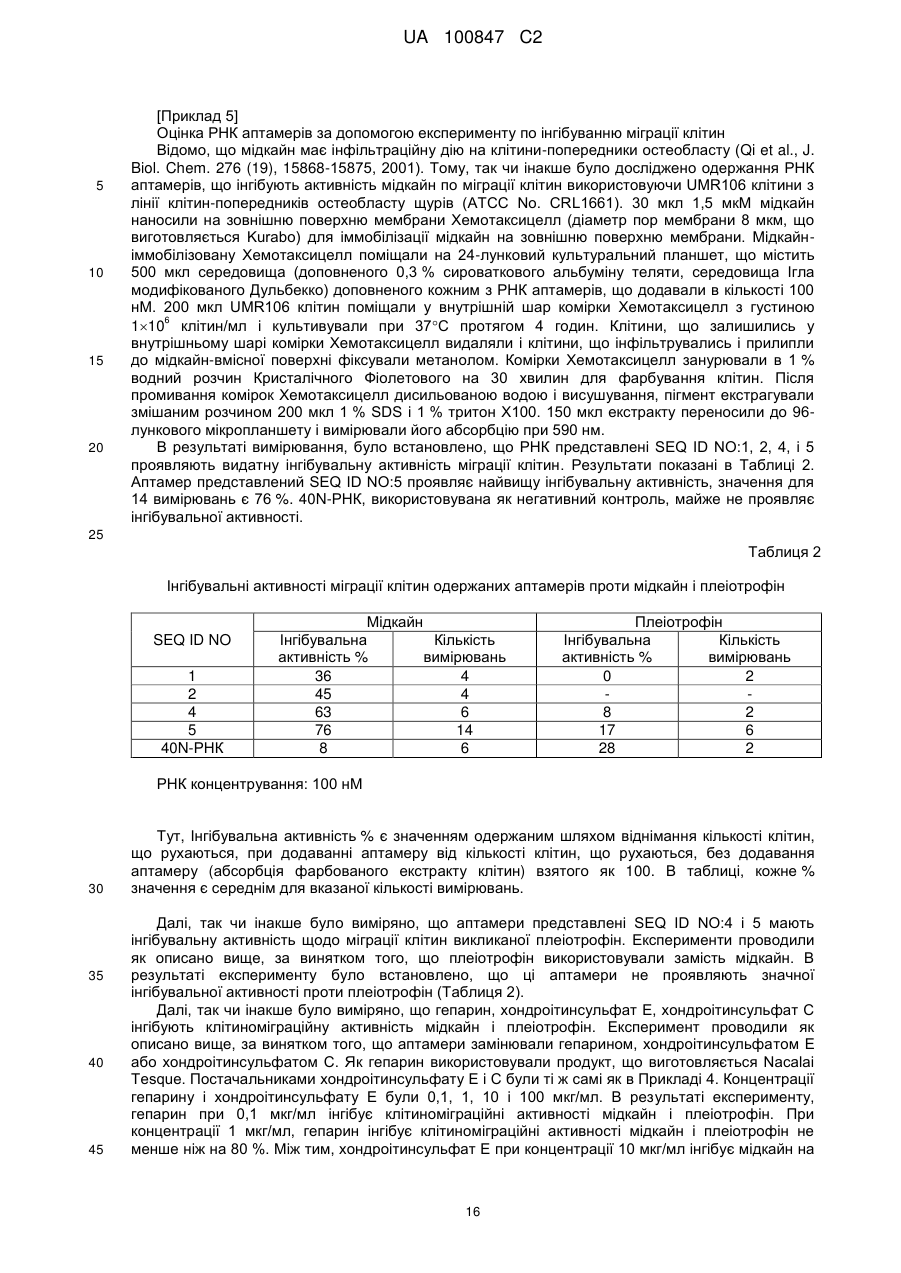
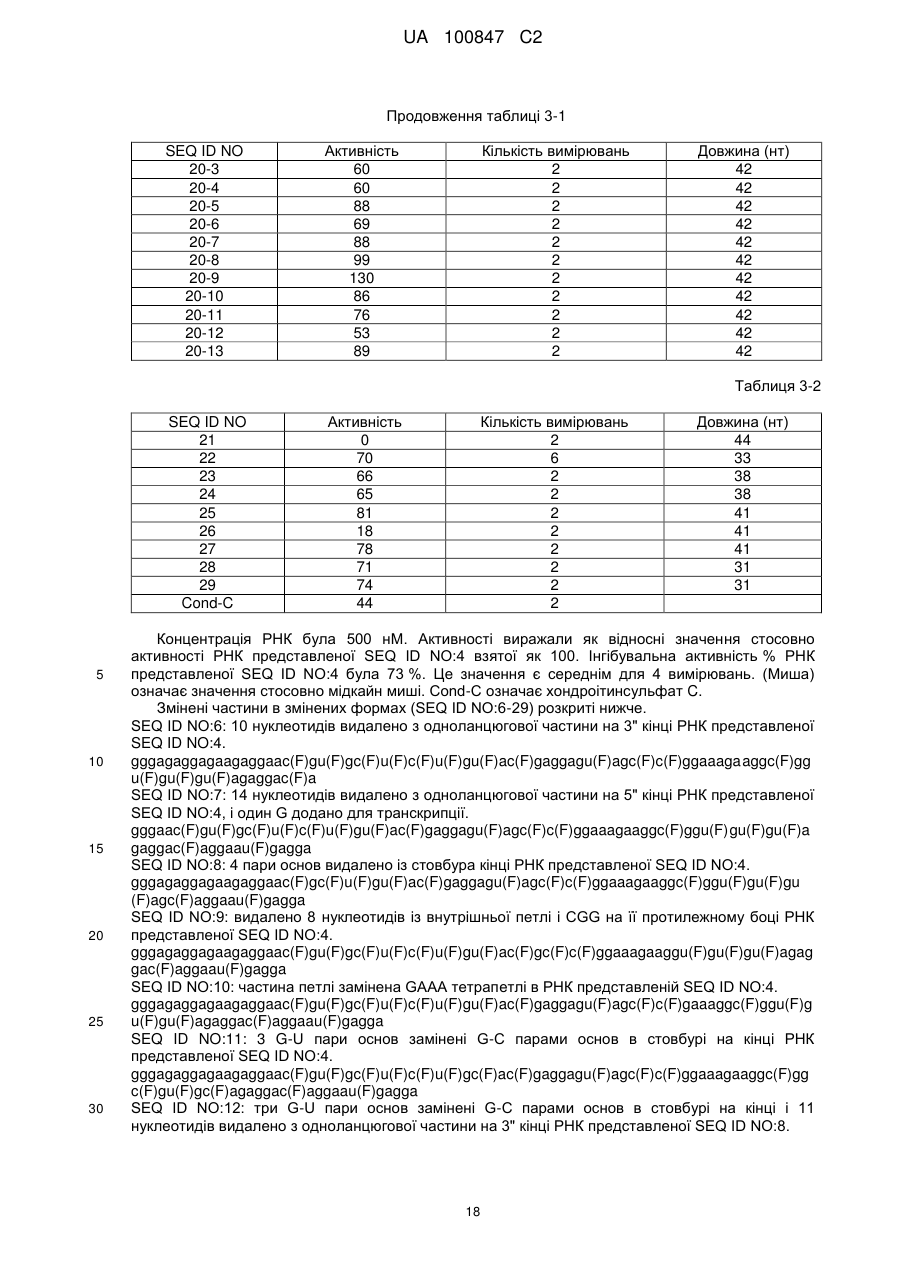
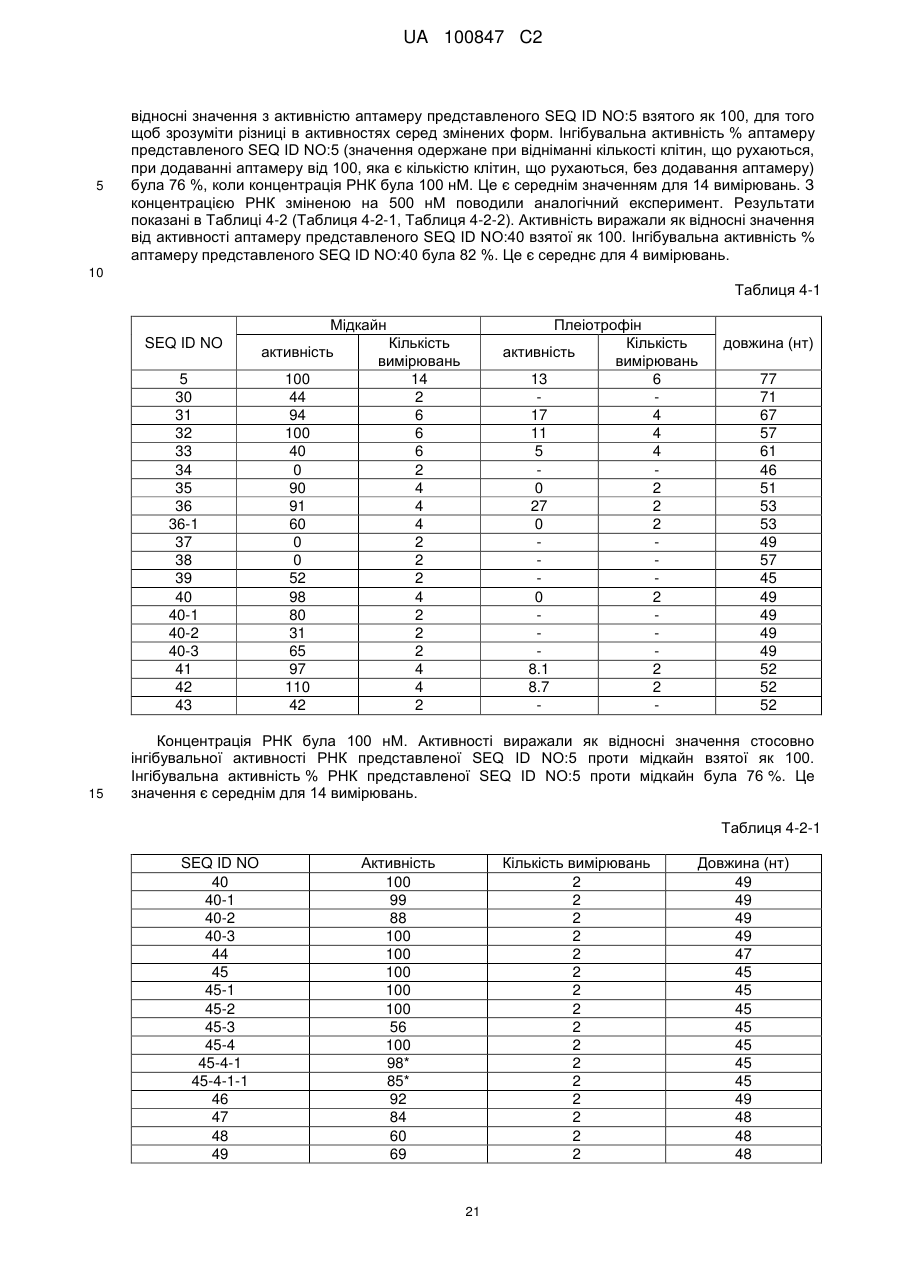
Текст
Реферат: Винахід належить до аптамеру, що має інгібувальну активність проти мідкайну; комплексу, що містить аптамер, що має зв'язувальну активність або інгібувальну активність проти мідкайну, і функціональну речовину (наприклад, афінні речовини, речовини для мічення, ферменти, розріджувачі для вивільнення лікарського засобу, лікарські засоби і т. ін.); фармацевтичного агенту, інгібітора міграції клітин, діагностичного реагенту, агента для мічення, що містять зазначений аптамер. UA 100847 C2 [Галузь винаходу] Представлений винахід стосується аптамеру проти мідкайну, способу його використання і т.і. 5 10 15 20 25 30 35 40 45 50 55 [Передумови створення винаходу] Мідкайн (тут далі, коли необхідно, використовується абревіатура "MK") є фактором росту/диференціації, що вперше був відкритий як короткочастно експресований генний продукт в процесі індукції диференціації клітин пухлини ембріону (EC) ретиноєвою кислотою, і є поліпептидом, що має молекулярну вагу 13 кДа, багатий основними амінокислотами і цистеїном (дивіться, наприклад, непатентний документ 1 і непатентний документ 2). За допомогою ЯМР була визначена і розкрита стерична структура MK (дивіться, наприклад, непатентний документ 3). Коли характеризується структурно, MK в основному скомпонований з двох доменів. Специфічно, MK складається з фрагменту на N-термінальному кінці якого присутні амінокислотні залишки 1-52 (тут далі згадується як "N-термінальний фрагмент"), фрагменту на C-термінальному кінці якого присутні амінокислотні залишки 62-121 (тут далі згадується як "C-термінальний фрагмент") і петлі, що з'єднує фрагменти (амінокислотні залишки 53-61). Зв'язування із зовнішнім боком кожного домену відбувається завдяки хвосту, що збагачений основними амінокислотами. В MK молекулі і N-термінальний фрагмент, і Cтермінальний фрагмент мають стеричну структуру, що складається головним чином з трьох обернених пластинчатих структур (тут далі згадується як "домени"; домен, що складається з амінокислотних залишків 15-52 в N-термінальному фрагменті згадується як "N-домен", домен, що складається з амінокислотних залишків 62-104 в C-термінальному фрагменті згадується як "C-домен"), і структури, що вільно рухаються, і не приймають певної структури (тут далі згадується як "хвости"; хвіст, що складається з амінокислотних залишків 1-14 в N-термінальному фрагменті, згадується як "N-хвіст", і хвіст, що складається з амінокислотних залишків 105-121 в C-термінальному фрагменті згадується як "C-хвіст"). Відомі рецептори MK включають тирозин фосфатазу рецепторного тиру (PTP), LRP (рецептор-залежний ліпопротеїн низької густини), ALK (кіназа анапластичної лейкемії), інтегрин і сіндекан і т.і. MK є високо позитивно зарядженим протеїном, що містить велику кількість основних амінокислот - лізину (K) і аргініну (R). Він має гепаринзв'язуючий сайт в його C–домені, і відомий по сильному зв'язуванню з негативно зарядженими молекулами, такими як гепарин і хондроітинсульфат E. Внаслідок аналізу мутагенезу і ЯМР аналізу, вважають, що кластер I, скомпонований з K79, R81 і K102, і кластер II, скомпонований з K86, K87 і R89, є важливими для зв'язування з гепарином. Між тим, повідомлялось, що тільки кластер I є важливим у зв'язуванні з доступним хондроітинсульфатом E. Коли R81 кластеру I замінений A, зв'язувальна активність із гепарином зменшується. Як результат, зниження зв'язувальної активності з PTP і пригнічується MK-індукована елонгація нейриту і рухливість нервових клітин. Деякі фактори росту, такі як фактор росту фібробласту (bFGF) і фактор росту ендотелію судин (VEGF), мають гепарин-зв'язувальний сайт. Ці фактори росту, як вважають, зв'язують гепаринсульфатпротеоглікан, зовнішньоклітинний матрикс, залишаючись в прийнятних положеннях, і вивільнюючись коли необхідно. Те ж саме також відомо стосовно зв'язування з гепаринсульфатом, що експресується в нервових клітинах і васкулярних ендотеліальних клітинах для сприяння елонгації нейриту і оцінки фібринолітичної активності. Коли в чашці Петрі висівають MK і нервові клітини ембріону миші, нейрити розтягуються. В цій ситуації, розщеплення нервових клітин гепаритиназою пригнічує розтягування нейриту. Між тим, коли васкулярні ендотеліальні клітини культивуються і додається MK, підвищується плазміноген активаторна активність клітин. В цьому випадку також пригнічується розщеплення клітин гепаритиназою підвищуючи активність плазміногену. Як вважають, MK зв'язується з PTP в двох сайтах. Один сайт включає високоспоріднений зв'язок з хондроітинсульфатом (Kd=0,58 нM). Цей зв'язок зникає при обробці хондроітиназою. Інший сайт включає зв'язок з протеїном і є низькоафінним зв'язком, що залишається після обробки хондроітиназою (Kd=3 нM). MK промотує міграцію ембріональних нервових клітин, що експресують PTP; обробка нервових клітин хондроітиназою ABC пригнічує міграцію. Остеобласт-подібні UMR106 клітини, що експресують PTP і відомі як такі, що мають MKзалежну міграцію, пригнічуються шляхом обробки хондроітиназом ABC. MK-залежна міграція макрофагу також пригнічується обробкою хондроітиназом ABC, хондроітиназом B або гепариназою. Оскільки макрофаг, як припускають, не експресує PTP, вважають, що в це втягнутий інший рецептор. Будь-які негативно заряджені частки не зв'язуються з гепарин-зв'язувальним сайтом MK. Коли MK був іммобілізований за допомогою аміноконденсування і підданий поверхневому 1 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 плазмонрезонансному аналізу, одержані результати показали, що хондроітинсульфат E і гепарин сильно зв'язують з MK, тоді як хондроітинсульфат A, B, C, і D не зв'язують його. MK відомий завдяки широкому переліку біологічних активностей. Наприклад, відомо, що в ракових клітинах людини підвищена експресія MK. Ця підвищена експресія спостерігається в широкому переліку видів раку, включаючи езофагеальний рак, рак щитовидної залози, рак сечового міхура, колоректальний рак, рак шлунку, панкреатичний рак, рак грудини, рак печінки, рак легені, рак грудей, нейробластома, гліобластома, рак матки, рак яічників, і пухлина Вілмса (дивіться, наприклад, патентний документ 1 і непатентний документ 4). Також вважають, що MK промотує виживання і рухливість ракових клітин і сприяє неоваскуляризації, що допомагає розвитку раку. MK також відомий як одна з молекул, що відіграє центральну роль в процесі розвитку запалення. Наприклад, відомо, що утворення інтими після пошкодження кровоносної судини і нападу нефриту при ішемічному пошкодженні пом'якшується у нокаут мишей позбавлених MK гену. Також відомо, що в моделі ревматизму, постопераційна адгезія також значно зменшена у MK нокаут мишей (дивіться, наприклад, патентний документ 2, патентний документ 3 і патентний документ 4). Однак, відомо, що MK включений в запальні захворювання, такі як артрит, аутоімунні захворювання, ревматичний артрит (ревматоїдний артрит (RA), остеоартрит (OA)), розсіяний склероз, постопераційна адгезія, запальні коліти, псоріаз, вовчак, астма і ненормальне функціонування нейтрофілу. Крім того, відомо, що MK промотує рухливість (міграцію) запальних клітин, таких як макрофаг і нейтрофіли. Оскільки ця рухливість необхідна для розвитку запалення, вважають, що коли недостатньо мідкайну, малоімовірно, що будуть мати місце запальні захворювання. (дивіться, наприклад, патентний документ 5). Оскільки рівні MK підвищуються в перітонеальній рідині самиць з розвинутим ендометріозом, а також оскільки MK стимулює проліферацію культивованих ендометріальних інтерстиціальних клітин, відомо, що MK включений у виникнення і розвиток ендометріозу (дивіться, наприклад, патентний документ 6). Крім того, проявляючи васкулярноінтимальну утовщуючу дію, відомо, що MK включений у васкулярні обструктивні захворювання, такі як рестеноз після операції по реконструкції судин, обструктивне захворювання коронарної артерії, обструктивне захворювання судин мозку, обструктивне захворювання судин нирок, обструктивне захворювання периферійних судин, артеріосклероз і інфаркт головного мозку (дивіться, наприклад, патентний документ 2). Відомо, що міграція клітин є важливою для механізмів інфільтрації/метастазу ракових клітин, інтимального потовщення в артеріосклеротичному фокусі, неоваскуляризації і т.і. Також відомо, що міграція запальних клітин сильно пов'язана з кардіоваскулярними захворюваннями, такими як стенокардія, інфаркт міокарда, церебральний інфаркт, внутрішньомозковий крововилив і гіпертензія. Плеіотрофін (PTN або HB-GAM) є тільки протеїном родини MK, що має приблизно 50 % гомологію з MK. І MK, і PTN є протеїнами, що містять велику кількість цистеїну і основних залишків. Всі 10 цистеїнові залишки є консервативними в MK і PTN, і структурно, обидва можуть бути розділені на N-домен і C-домен. Завдяки ЯМР аналізу, відомо, що ці дві молекули мають дуже подібні тривимірні структури. Кожен домен містить три пластини, з'єднані через гнучкий лінкерний регіон. K79, R81 і K102, розглядаються як важливі для зв'язування з хондроітинсульфатом і гепарином, є консервативними для двох протеїнів. K79 і R81 присутні на тій же самій пластині, в той час як K102 присутній на іншій пластині. Коли MK і PTN утворюють стеричну структуру, ці основні залишки знаходяться в близькості до поверхні протеїну. В останні роки, заявниками було приділено особливу увагу РНК аптамерам для терапевтичних лікарських засобів, діагностичних реагентів і тестуванню реагентів; деякі РНК аптамери вже знаходяться на стадії клінічних досліджень або на стадії практичного дослідження. У грудні 2004, був схвалений перший світовий лікарський РНК аптамер, Макуген, як терапевтичних лікарський засіб для вікозалежної макулярної дегенерації в США. РНК аптамер відноситься до РНК, що специфічно зв'язується з цільовою речовиною, такою як протеїн, і може бути одержаний використовуючи метод SELEX (Системна оцінка лігандів за експоненціальним збагаченням) (непатентні документи 5, 6). Метод SELEX є способом, за допомогою якого вибирається РНК, що специфічно зв'язується з цільовою речовиною, з 14 приблизно 10 РНК пулів, що мають різні нуклеотидні послідовності. Використовувана РНК має структуру, в якій випадкова послідовність з приблизно 40 залишків складається за допомогою праймерних послідовностей. Ці РНК пули дозволяють поєднання з цільовою речовиною, і тільки РНК, що мають зв'язок з цільовою речовиною, виділяються використовуючи фільтр і т.і. Виділена РНК ампліфікується за допомогою ЗТ-ПЛР, і використовується як матриця для 2 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 наступної стадії. При повторенні цієї операції приблизно 10 разів, може бути іноді одержаний РНК аптамер, що специфічно зв'язується з цільовою речовиною. [патентний документ 1] JP-A-6-172218 [патентний документ 2] WO2000/10608 [патентний документ 3] WO2004/078210 [патентний документ 4] WO2004/085642 [патентний документ 5] WO1999/03493 [патентний документ 6] WO2006/016571 [непатентний документ 1] Kadomatsu, K. et al., Biochem. Biophys. Res. Commun., 151:p.13121318 [непатентний документ 2] Tomokura, M. et al.,: J.Biol. Chem, 265: p.10765-10770 [непатентний документ 3] Iwasaki, W. et al., (1997) EMBO J. 16, p, 6936-6946 [непатентний документ 4] Muramatsu, T., (2002) J. Biochem. 132, p, 359-371 [непатентний документ 5] Ellington et al., (1990) Nature, 346, 818-822 [непатентний документ 6] Tuerk et al., (1990) Science, 249, 505-510 [Опис винаходу] [Проблеми, що вирішуються винаходом] Представлений винахід стосується одержання аптамеру для мідкайн і способу його використання і т.і. [Засоби вирішення проблем] Винахідники ретельно шукали вирішення описаної вище проблеми, і, як результат, змогли одержати аптамер з доброю спорідненістю до мідкайн, що дозволило створити представлений винахід. Відповідно, представлений винахід забезпечує наступне: [1] аптамер, що має інгібувальну активність проти мідкайн, [2] аптамер за [1], де аптамер не проявляє інгібувальної активності проти плеіотрофін, [3] аптамер за [1], що має зв'язувальну активність стосовно N-термінального фрагменту мідкайн, [4] аптамер за [1], що має зв'язувальну активність стосовно C-термінального фрагменту мідкайн, [5] аптамер за [2], що має зв'язувальну активність стосовно N-термінального фрагменту мідкайн, [6] аптамер за [2], що має зв'язувальну активність стосовно C-термінального фрагменту мідкайн, [7] аптамер, що проявляє інгібувальну активність проти мідкайн шляхом інгібування зв'язування мідкайн і PTP, [8] аптамер за [1], який є або (a), або (б) нижче: (a) аптамер, що включає нуклеотидну послідовність вибрану з поміж SEQ ID NO:1-70 (за умови, що урацил може бути тиміном), де нуклеотиди, що містяться в аптамері є такими що (i) 2’-положення піримідинових нуклеотидів, або ідентичні, або різні, є атомами фтору або заміщені атомами або групами, що вибирають з групи, яка містить атоми водню, гідроксигрупи і метоксигрупи, і (ii) 2’-положення пуринових нуклеотидів, або ідентичні, або різні, є гідроксигрупами або заміщені атомами або групами, що вибирають з групи, яка містить атоми водню, метоксигрупи і атоми фтору; (б) аптамер, що включає нуклеотидну послідовність вибрану з поміж SEQ ID NO:1-70 (за умови, що урацил може бути тиміном), де один або декілька нуклеотидів є заміненими, видаленими, вставленими або доданими, де нуклеотиди, що містяться в аптамері є такими що (i) 2’-положення піримідинових нуклеотидів, або ідентичні, або різні, є атомами фтору або заміщені атомами або групами, що вибирають з групи, яка містить атоми водню, гідроксигрупи і метоксигрупи, і (ii) 2’-положення пуринових нуклеотидів, або ідентичні, або різні, є гідроксигрупами або заміщені атомами або групами, що вибирають з групи, яка містить атоми водню, метоксигрупи і атоми фтору, [9] аптамер за будь-яким одним з [1] - [8], де нуклеотид, що міститься в аптамері, є модифікованим, [10] комплекс, що містить аптамер за будь-яким одним з [1] - [9] і функціональну речовину, [11] комплекс за [10], де функціональною речовиною є афінна речовина, речовина для мічення, фермент, розбавник для вивільнення лікарського засобу або лікарський засіб. 3 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 [12] фармацевтичний агент, що містить аптамер за будь-яким одним з [1] - [9] або комплекс за [10] або [11], [13] інгібітор міграції клітин, що містить аптамер за будь-яким одним з [1] - [9] або комплекс за [10] або [11], [14] діагностичний агент, що містить аптамер за будь-яким одним з [1] - [9] або комплекс за [10] або [11], [15] агент для мічення, що містить аптамер за будь-яким одним з [1] - [9] або комплекс за [10 або [11], і [16] спосіб детектування аптамеру за будь-яким одним з [1] - [9] або комплекс за [10] або [11]. [Користь від винаходу] Аптамер або комплекс представленого винаходу можуть бути корисні як фармацевтичні лікарські засоби або реагенти, такі як діагностичні реагенти для різних захворювань, таких як аутоімунні захворювання, рак, постопераційна адгезія і ендометріоз. Аптамер або комплекс представленого винаходу також може бути корисний при очищенні і концентруванні MK і детектуванні і кількісному визначенні MK. [Короткий опис малюнків] На Фіг. 1A показана одна з двох вторинних структур РНК представлена SEQ ID NO:1 розрахована за допомогою MFOLD програми. На Фіг. 1Б показана інша вторинна структура РНК представлена SEQ ID NO:1 розрахована за допомогою MFOLD програми. На Фіг. 2A показана одна з двох вторинних структур РНК представлена SEQ ID NO:2 розрахована за допомогою MFOLD програми, де частина поміщена в квадрат представляє консенсусний регіон. На Фіг. 2Б показана інша вторинна структура РНК представлена SEQ ID NO:2 розрахована за допомогою MFOLD програми, де частина поміщена в квадрат представляє консенсусний регіон. На Фіг. 3A показана одна з двох вторинних структур РНК представлена SEQ ID NO:3 розрахована за допомогою MFOLD програми. На Фіг. 3Б показана інша вторинна структура РНК представлена SEQ ID NO:3 розрахована за допомогою MFOLD програми, де частина поміщена в квадрат представляє консенсусний регіон. На Фіг. 4 показана вторинна структура РНК представлена SEQ ID NO:4 розрахована за допомогою MFOLD програми, де частина поміщена в квадрат представляє консенсусний регіон. На Фіг. 5 показана вторинна структура РНК представлена SEQ ID NO:5 розрахована за допомогою MFOLD програми. На Фіг. 6 показані взаємодії між РНК представленою SEQ ID NO:5 і мідкайн, і між РНК і IgG1 людини (сенсограма одержана використовуючи BIAcore 2000). На Фіг. 7 показана взаємодія між РНК представленою SEQ ID NO:4 і мідкайн (сенсограма одержана використовуючи BIAcore 2000). На Фіг. 8 показана вторинна структура РНК представлена SEQ ID NO:20 розрахована за допомогою MFOLD програми. На Фіг. 9 показана вторинна структура РНК представлена SEQ ID NO:61 розрахована за допомогою MFOLD програми. [Найкращі способи втілення винаходу] Представлений винахід забезпечує аптамер, що має зв'язувальну активність щодо мідкайн (MK). Аптамери представленого винаходу здатні інгібувати активність MK. Аптамер відноситься до молекули нуклеїнової кислоти, що має зв'язувальну спорідненість до певної цільової молекули. Аптамер також може інгібувати активність певної цільової молекули шляхом зв'язування певної цільової молекули. Аптамером представленого винаходу може бути РНК, ДНК, модифікована нуклеїнова кислота або їх суміш. Аптамер представленого винаходу також може бути в лінійній або циркулярній формі. Інгібувальна активність проти MK означає інгібування будь-якої біологічної активності MK. Як приклад біологічної активності MK можна згадати клітиноміграційну активність (наприклад, макрофаги, нейтрофіли, еозинофіли, клітини гладких м'язів судин, клітини пухлини, остеобласти, нервові клітини і їх клітини попередники) (Takada et al., 1997, J. Biochem. 122, 453458, Horiba et al., 2000, J. Clin. Invest. 105, 489-495, Maeda et al., 1999, J. Biol. Chem. 274, 1247412479, Qi et al., 2001, J. Biol. Chem. 276, 15868-15875), промотування проліферації і диференціації клітин (наприклад, клітини пухлин, фібробласти, кератиноцити, нервові клітини, хондроцити і їх клітини попередники) (Muramatsu and Muramatsu, 1991, Biochem. Biophys. Res. 4 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 Commun. 177, 652-658, Muramatsu et al., 1993, Dev. Biol. 159, 392-402, Takei et al., 2001, Cancer Res. 61, 8486-8491), інгібування проліферації і функцій регулювання T клітин, промотування елонгації нейритів нервових клітин, інгібування апоптозу клітин (наприклад, клітини пухлин, нервові клітини), індукування неоваскуляризації клітин (наприклад, клітини пухлин), індукування утворення синапсу для міобластів, промотування фібринолітичної системи для васкулярних ендотеліальних клітин, промотування продукування IL-8 клітин гладких м'язів судин і т.і. Крім того, як приклади інгібувальної активності проти MK можна згадати інгібування цієї активності. Аптамер представленого винаходу може проявляти інгібувальну активність проти MK, що походять від будь-яких ссавців. Як приклади таких ссавців можна згадати приматів (наприклад, люди, мавпи), гризунів (наприклад, миші, щури, морські свинки), також як і супутні тварини, домашні тварини і робочі тварини (наприклад, собаки, коти, коні, корови, кози, вівці, свині). Аптамери представленого винаходу спеціально не обмежуються, доки вони здатні зв'язувати необов'язково вибрану частину MK інгібуючи його активність; наприклад, шляхом зв'язування N-термінального фрагменту або C-термінального фрагменту MK, аптамери представленого винаходу здатні інгібувати активність MK. Амінокислотна послідовність MK людини представлена інвентарним номером GenBank BC011704, секреторний протеїн складається з 121 амінокислотних залишків від лізину 23 до аспарагінової кислоти 143. Загалом, залишок лізину 23 позначений амінокислотним залишком в положенні 1. MK людини включає Nтермінальний фрагмент, що складається з амінокислотних залишків 1-52, C-термінальний фрагмент складається з амінокислотних залишків 62-121 і петлі, що з'єднує фрагменти, але межа N-термінального фрагменту і C-термінального фрагменту може бути будь-якої частиною петлі MK (53-61), і не може бути чітко визначена. Довжина аптамеру представленого винаходу не обмежується і може звичайно бути від приблизно 15 до приблизно 200 нуклеотидів, і може бути, наприклад, не більше ніж приблизно 100 нуклеотидів, переважно не більше ніж приблизно 80 нуклеотидів, більш переважно не більше ніж приблизно 60 нуклеотидів, найбільш переважно не більше ніж приблизно 45 нуклеотидів. Довжина аптамеру представленого винаходу може бути, наприклад, не менше ніж приблизно 18, 20 або 25 нуклеотидів. Якщо загальна кількість нуклеотидів є меншою, хімічний синтез і масове виробництво буде полегшене, і це буде основою перевагою з точки зору вартості. Також вважають, що хімічна модифікація є легкою, стабільність в тілі є вищою і токсичність є нижчою. Кожен з нуклеотидів, що міститься в аптамері представленого винаходу, або ідентичні, або різні, може бути нуклеотидом, що містить гідроксильну групу в 2" положенні рибози (наприклад, рибоза піримідинового нуклеотиду) (тобто, незаміщений нуклеотид) або нуклеотид, що має гідроксильну групу, що заміщує необов'язково вибраний атом або групу в 2" положенні рибози. Як приклади такого необов'язково вибраного атому або групи можна згадати нуклеотид заміщений атомом водню, атомом фтору або -O-алкільною групою (наприклад, -O-Me група), O-ацильною групою (наприклад, -O-CHO група), або аміногрупою (наприклад, -NH2 група). Аптамером представленого винаходу також може бути аптамер, в якому міститься принаймні один вид (наприклад, 1, 2, 3 або 4 види) нуклеотиду, що містить гідроксильну групу, або описаний вище необов'язково вибраний атом або групу, наприклад, принаймні два види (наприклад, 2, 3 або 4 види) груп, що вибирають з групи, яка містить атом водню, атом фтору, гідроксильну групу і -O-Me групу, в 2" положенні рибози. В аптамерах представленого винаходу, всі нуклеотиди можуть бути нуклеотидами, що містять гідроксильну групу, або необов'язково вибраний атом або групу описану вище, наприклад, групу, що вибирають з групи, яка містить атом водню, атом фтору, гідроксильну групу і -O-Me групу, в 2’-положенні рибози. Приклад аптамеру представленого винаходу може мати можливу вторинну структуру, що містить один або більше регіонів, що вибирають з групи, яка містить одноланцюгові регіони (наприклад, gggagaggaac), перші стовбурні регіони (наприклад, gacg і комплементарні йому ланцюги), внутрішні петлі (наприклад, aggagua і gg), другі стовбурні регіони (наприклад, gcc і комплементарні йому ланцюги) і внутрішні петлі (наприклад, ggaaagaa). Інший приклад аптамеру представленого винаходу може мати можливу вторинну структуру, що включає один або більше регіонів, що вибирають з групи, яка містить одноланцюгові регіони (наприклад, gggaaggaggaa), перші стовбурні регіони (наприклад, gugcac і комплементарні йому ланцюги), внутрішні петлі (наприклад, ag і gg), другі стовбурні регіони (наприклад, gg і комплементарні йому ланцюги), і внутрішні петлі (наприклад, guuggug). Як тут використовується, "можлива вторинна структура" стосується вторинної структури здатної мати стабільність за фізіологічних умов; наприклад, так чи інакше можлива вторинна структура може бути визначена використовуючи програми визначення структури описані в Прикладах. Стовбурний регіон стосується частини, де подвійний ланцюг утворюється парою 5 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 основ з двох або більше послідовних нуклеотидів (наприклад, G-C, A-U, A-T). Внутрішня петля стосується нестовбурного регіону утвореного двома різними стовбурними регіонами. Петля шпильки стосується частини структури утвореної одним стовбурним регіоном і є петлею утвореною на протилежному боці до 5" кінця і 3" кінця ланцюга аптамеру. Одноланцюговий регіон стосується термінальної частини полінуклеотидного ланцюгу і є регіоном, що не відповідає згаданому вище стовбурному регіону, внутрішній петлі або петлі шпильки. Аптамери представленого винаходу також можуть мати здатність зв'язувати N-термінальний фрагмент і/або C-термінальний фрагмент MK. Аптамер представлений SEQ ID NO:39 і його змінені форми, подібні гепарину і хондроітинсульфату E, проявляють високу зв'язувальну активність для C-термінального фрагменту. Гепарин, як вважають, зв'язується з Cтермінальним фрагментом по кластеру I і кластеру II. Хондроітинсульфат E, як вважають, зв'язується з C-термінальним фрагментом по кластеру I. Відомо, що MK взаємодіє з PTP, який містить хондроітинсульфат, як його складову молекулу. PTP експресується в нервових клітинах плоду і остеобласт-подібних клітинах і в присутності MK промотується міграція цих клітин. В представленому винаході, аптамер здатний зв'язуватись з C-термінальним фрагментом інгібує міграцію клітини і аптамер, що зв'язується в основному з N-термінальним фрагментом, забезпечує інгібування міграції клітини. Аптамери представленого винаходу також здатні інгібувати активність MK (наприклад, активність MK по міграції клітин) і можуть мати властивість, що полягає у нездатності інгібувати активність PTN (наприклад, активність PTN по міграції клітин). PTN є тільки протеїному родини MK, що має гомологію 50 %, вони мають дуже подібні тривимірні структури і законсервовані амінокислотні залишки важливі для зв'язування з хондроітинсульфатом і гепарином. Аптамером представленого винаходу також може бути (a) аптамер, що включає нуклеотидну послідовність, яку вибирають з SEQ ID NO:1-70 (але урацил може бути тиміном), (б) аптамер, що включає нуклеотидну послідовність, яку вибирають з SEQ ID NO:1-70 (але урацил може бути тиміном), який має один або більше заміщених, видалених, вставлених або доданих нуклеотидів, або (c) кон'югат, що вибирають з групи, яка містить кон'югат з множини аптамерів з (a) вище, кон'югат з множини аптамерів (б) вище, і кон'югат з множини аптамерів (a) і (б) вище. В (б) вище, кількість заміщених, видалених, вставлених або доданих нуклеотидів спеціально не обмежується, доки вона становить деяку кількість, і кількість нуклеотидів може бути, наприклад, не більше ніж приблизно 30, переважно не більше ніж приблизно 20, більш переважно не більше ніж приблизно 10, ще більш переважно не більше ніж 5, найбільш переважно 4, 3, 2 або 1. В (c) вище, кон'югат може бути одержаний шляхом послідовного зв'язування. При кон'югуванні може використовуватись лінкер. Як лінкер можна згадати нуклеотидні ланцюги (наприклад, від 1 до приблизно 20 нуклеотидів) і ненуклеотидні ланцюги (наприклад, -(CH2)n- лінкер, -(CH2CH2O)n- лінкер, гексаетиленгліколевий лінкер, TEG лінкер, пептидвмісний лінкер, -S-S- зв'язок-вмісний лінкер, -CONH- зв'язок-вмісний лінкер, -OPO3зв'язок-вмісний лінкер). Множина, як згадано в описаній вище множині кон'югатів, спеціально не обмежується, доки вона є два або більше, і множина може бути, наприклад, 2, 3 або 4. Кожен з нуклеотидів в (a) - (c) вище, або ідентичні, або різні, може бути нуклеотидом, що містить гідроксильну групу в 2" положенні рибози, або нуклеотидом, що має гідроксильну групу замінену необов'язково вибраною групою (наприклад, атом водню, атом фтору або -O-Me група) в 2" положенні рибози (наприклад, рибоза піримідинового нуклеотиду). В особливому аспекті, аптамери представленого винаходу розподіляються загалом на три види згідно з їх структурами. Першим аптамером є аптамер, що включає нуклеотидну послідовність представлену SEQ ID NO:61 або її мутант. Аптамер, що включає нуклеотидну послідовність представлену SEQ ID NO:61, коли її вторинна структура розрахована за допомогою MFOLD програми, має потенційну вторинну структуру показана на ФІГ. 9, і складається з одноланцюгового регіону, першого стовбурного регіону, внутрішньої петлі, другого стовбурного регіону і петлі шпильки. В цьому аптамері, заміщення, делеція, вставка і/або додавання декількох нуклеотидів є прийнятним в одноланцюговому регіоні, першому стовбурному регіоні, внутрішній петлі, другому стовбурному регіоні і петлі шпильки. Наприклад, в цьому аптамері прийнятними є вставка декількох нуклеотидів в одноланцюговому регіоні, вставка декількох нуклеотидів в перший стовбурний регіон і додавання декількох нуклеотидів до 3" кінця одноланцюгового регіону (наприклад, SEQ ID NO:5). Такий аптамер зв'язується більш сильно з N-термінальним фрагментом ніж з C-термінальним фрагментом MK. Другим аптамером є аптамер, що включає нуклеотидну послідовність представлену SEQ ID NO:20 або її мутант. Аптамер, що включає нуклеотидну послідовність представлену SEQ ID NO:20, вторинна структура якого розрахована за допомогою MFOLD програми, має потенційну вторинну структуру показану на ФІГ. 8, і складається з одноланцюгового регіону, першого 6 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 стовбурного регіону, внутрішньої петлі, другого стовбурного регіону і петлі шпильки. В цьому аптамері, заміщення, делеція, вставка і/або додавання декількох нуклеотидів є прийнятним в одноланцюговому регіоні, першому стовбурному регіоні, внутрішній петлі, другому стовбурному регіоні і петлі шпильки. Наприклад, в цьому аптамері прийнятними є додавання декількох нуклеотидів до одноланцюгового регіону, першого стовбурного регіону і/або 3" кінця (наприклад, SEQ ID NO:4). Такий аптамер майже не проявляє спорідненості до N-термінального фрагменту MK і сильно зв'язується з C-термінальним фрагментом. Третім аптамером може бути аптамер, що включає нуклеотидну послідовність представлену SEQ ID NO:1 або її мутант. Аптамером представленого винаходу може бути аптамер, в якому цукровий залишок (наприклад, рибоза) кожного нуклеотиду модифікований для підвищення зв'язувальної активності стосовно MK, стабільності, виведення лікарського засобу і т.і. Як приклад сайту для модифікування в цукровому залишку можна згадати заміну атому кисню в 2’-положенні, 3’положенні і/або 4’-положенні залишку цукру іншим атомом, і т.і. Як приклади модифікації можна згадати фторування, O-алкілування (наприклад, O-метилювання, O-етилювання), Oарилювання, S-алкілування (наприклад, S-метилювання, S-етилювання), S-арилювання і амінування (наприклад, -NH2). Такі зміни в залишку цукру можна провести за методами відомими по суті (дивіться, наприклад, Sproat et al., (1991) Nucle. Acid. Res. 19, 733-738; Cotton et al., (1991) Nucl. Acid. Res. 19, 2629-2635; Hobbs et al., (1973) Biochemistry 12, 5138-5145). Аптамер представленого винаходу також може мати змінену нуклеїнову кислоту (наприклад, пурин або піримідин) (наприклад, хімічне заміщення) для збільшення MK зв'язувальної активності і т.і. Як приклади таких змін можна згадати зміну 5-положення піримідину, зміну 6і/або 8-положення пурину, зміну з використанням екстрациклічного аміну, заміщення 4тіоуридином і заміщення 5-бром або 5-йод-урацилом. Фосфатна група, що міститься в аптамері представленого винаходу може бути змінена для забезпечення стійкості до нуклеази і гідролізу. Наприклад, P(O)O група може бути замінена на P(O)S (тіоат), P(S)S (дітіоат), P(O)NR2 (амідат), P(O)R, R(O)OR", CO або CH2 (формацетил) або 3’-амін (-NH-CH2-CH2-) [де кожен з R або R" є незалежно H або заміщений або незаміщений алкіл (наприклад, метил, етил)]. Зв'язувальною групою є, наприклад, -O-, -N- або -S-, і нуклеотиди можуть зв'язуватись із прилеглим нуклеотидом через ці зв'язувальні групи. Зміни також можуть включати зміни, такі як кепування 3" і 5" кінців. Модифікація також може бути проведена шляхом приєднання до кінця поліетиленгліколю, амінокислоти, пептиду, інвертованого dT, нуклеїнової кислоти, гуклеозидів, Міристоїлу, Літоколік-олеїлу, Докозанілу, Лауроїлу, Стеароїлу, Пальмітоїлу, Олеоїлу, Лінолеоїлу, інші ліпіди, стероїди, холестерол, кофеїн, вітаміни, пігменти, флуоресцентні речовини, протираковий агент, токсин, ферменти, радіоактивну речовину, біотин і т.і. Для таких змін, дивіться, наприклад, патенти US 5,660,985 і 5,756,703. Аптамери представленого винаходу можуть бути синтезовані хімічно за допомогою методик описаних тут і способів відомих безпосередньо в цій галузі. Аптамер зв'язує цільову речовину використовуючи широкий перелік способів зв'язування, таких як іонні зв'язки, що базується на негативному заряді фосфатної групи, гідрофобні зв'язки і водні зв'язки, що базуються на рибозі, і водні зв'язки і стекінг-зв'язки, на основі основ нуклеїнових кислот. Зокрема, сильними є іонні зв'язки на основі негативного заряду фосфатної групи, які присутні в такій же самій кількості як і кількість складових нуклеотидів, і зв'язок з лізином і аргініном присутній на поверхні позитивно зарядженого протеїну. З цієї причини, можуть бути замінені нуклеїнові основи не включені в безпосереднє зв'язування з цільовою речовиною. Зокрема, оскільки регіон стовбура має вже сформовані пари основ і грані внутрішньої подвійної спіралі, нуклеїнові основи малоімовірно зв'язуються безпосередньо з цільовою речовиною. Крім того, навіть коли пара основ замінена іншою парою основ, активність аптамеру часто не зменшується. В структурах, в яких не сформовані пари основ, такі як петлі, за умови, що нуклеїнова основа не втягнута в безпосереднє зв'язування з цільовою молекулою, можливе замінення основи. Стосовно модифікацій 2’-положення рибози, функціональна група в 2’-положенні рибози рідко взаємодіє безпосередньо з цільовою молекулою, але в більшості випадків, вона незначуща, і може бути замінена іншою модифікованою молекулою. Однак, аптамер, якщо функціональна група, що не втягнута в безпосереднє зв'язування з цільовою молекулою, є замінена або видалена, часто зберігає його активнісь. Також важливо, щоб загальна просторова структура не змінювалась досить сильно. Аптамер можна одержати використовуючи метод SELEX або його удосконалену версію (наприклад, Ellington et al., (1990) Nature, 346, 818-822; Tuerk et al., (1990) Science, 249, 505-510). В методі SELEX, при збільшенні кількості циклів або використовуючи конкурентну речовину, 7 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 аптамер, що проявляє найсильнішу силу зв'язування цільової молекули, концентрують і виділяють. Однак, при регулюванні кількості циклів SELEX, і/або зміні конкурентних умов в таких випадках можна одержати аптамери з різними силами зв'язування, аптамери з різними способами зв'язування і аптамери з такою ж самою силою зв'язування і способом зв'язування, але з різними послідовностями основ. Метод SELEX включає процес ампліфікації за допомогою ПЛР; при викликанні мутації використовуючи іони марганцю і т.і в процесі, можливо провести SELEX з вищим різноманіттям. Аптамери одержані з використанням SELEX є нуклеїновими кислотами, що проявляють вищу спорідненість до цільової речовини, і це не означає їх зв'язування з активним сайтом цільової речовини. Крім того, аптамери одержані з використанням SELEX не завжди впливають на функцію цільової речовини. MK має лізин-збагачений регіон в хвостовому регіоні і N кінця, і C кінця, з яким нуклеїнова кислота, як вважають, зв'язується неспецифічно. Ця хвостова частина не розглядається як важлива при зв'язуванні гепарину або хондроітинсульфату. Нелегко одержати аптамер, що ефективно інгібує активність MK в такому оточенні. Насправді, в представленому винаході, досліджували інгібувальну активність міграції клітин 23 видів аптамерів і тільки 4 види аптамерів зберігають не менше ніж 50 % активності. Таким чином вибрані аптамери з активністю можуть бути одержані навіть з вищою характеристикою при використанні оптимізованої методики SELEX. Оптимізована SELEX стосується способу, в якому SELEX проводять знову після одержання матриці, в якій аптамер з деякою фіксованою послідовністю є частково зміненим для включення випадкових послідовностей або матриці, що містить від приблизно 10 до 30 % випадкових послідовностей. Аптамер одержаний за допомогою SELEX має довжину приблизно 80 нуклеотидів і це ускладнює одержання його як фармацевтичного агенту. Однак, необхідне повторення cпроб та помилок з одержанням коротшого аптамеру з довжиною приблизно 50 нуклеотидів або менше забезпечується легким хімічним синтезом. В залежності від будови праймеру для аптамеру одержаного SELEX, легко надалі мінімізувати операційні зміни. Якщо тільки праймер спроектований успішно, подальшйи розвиток буде неможливим навіть якщо аптамер з активністю вибирається за допомогою SELEX. Аптамери легко змінювані оскільки вони дозволені хімічним синтезом. Для аптамерів, при визначенні вторинної структури використовуючи MFOLD програму, або визначаючи просторову структуру за допомогою рентгеноструктурного аналізу або ЯМР аналізу, можна передбачити з деяким ступенем, який нуклеотид може бути замінений або видалений, і де вставлений новий нуклеотид. Можна легко використовуючи хімічні методи сиснтезувати аптамер з передбачуваною новою послідовністю і можна визначити чи буде аптамер зберігати активність використовуючи існуючі системи дослідження. Якщо регіон, що відповідає за зв'язування аптамеру одержаний з цільової речовини ідентифікується за допомогою повторення cпроб та помилок як описано вище, активність залишається незмінюваною в багатьох випадках навіть коли додається нова послідовність до обох кінців послідовності. Довжина нової послідовності спеціально не обмежується. Модифікації, подібних послідовностей, забезпечують широкий перелік конструкцій або змін. Як вказано вище, аптамери дозволяють широкий перелік конструкцій або змін. Представлений винахід також забезпечує спосіб одержання аптамеру, що забезпечує широкий перелік конструкцій або змін аптамеру, що включає специфічну послідовність (наприклад, послідовність, що відповідає частині вибраній з поміж стовбурного регіону, внутрішніх петель, петель шпильки і одноланцюгових регіонів: тут далі, згадуються як фіксовані послідовності, коли необхідно). Наприклад, спосіб одержання такого аптамеру включає одержання аптамеру, що містить фіксовану послідовність, використовуючи один вид молекули нуклеїнової кислоти або множину видів молекул нуклеїнової кислоти (наприклад, бібліотеку молекул нуклеїнової кислоти з різним числами для "a" або "b"), що включає нуклеотидну послідовність представлену формулою: Послідовність праймера (i) –(N)a–фіксована послідовність–(N)b- Послідовність праймера (ii) [де (N)a представляє нуклеотидний ланцюг, що включає "a" ланок N; (N)b представляє нуклеотидний ланцюг, що включає "b" ланок N; кожна з ланок N, або ідентичні, або різні, і є нуклеотидом, що вибирають з групи, яка містить A, G, C, U і T (переважно, A, G, C і U). Кожен з "a" і "b", або ідентичні, або різні, можуть бути необов'язково вибраним числом, і можуть бути, наприклад, від 1 до приблизно 100, переважно від 1 до приблизно 50, більш переважно від 1 до приблизно 30, ще більш переважно від 1 до приблизно 20 або від 1 до приблизно 10], і пари праймеру, що відповідають послідовностям праймера (i) і (ii), відповідно. 8 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 Представлений винахід також забезпечує комплекс, що містить аптамер представленого винаходу і функціональну речовину зв'язану з ним. Зв'язок між аптамером і функціональною речовиною в комплексі представленого винаходу може бути ковалентним зв'язком або нековалентним зв'язком. Комплексом представленого винаходу може бути комплекс, в якому аптамер представленого винаходу і одна або більше (наприклад, 2 або 3) функціональних речовин однакового виду або різних видів зв'язані разом. Функціональна речовина спеціально не обмежується, оскільки вона надає деякі нові функції аптамеру представленого винаходу, або здатна змінювати (наприклад, покращувати) деякі характеристики, які може мати аптамер представленого винаходу. Як приклади функціональної речовини можна згадати протеїни, пептиди, амінокислоти, ліпіди, цукри, моносахариди, полінуклеотиди і нуклеотиди. Як приклади функціональної речовини можна згадати афінні речовини (наприклад, біотин, стрептавідин, полінуклеотиди, що надають спорідненості цільовій комплементарній послідовності, антитіла, глутатіонсефароза, гістидин), речовини для мічення (наприклад, флуоресцентні речовини, люмінісцентні речовини, радіоізотопи), ферменти (наприклад, пероксидаза хріну, лужна фосфатаза), носії для вивільнення лікарського засобу (наприклад, ліпосома, мікросфери, пептиди, поліетиленгліколі), лікарські засоби (наприклад, використовувані в стартове лікування, таке як калікеаміцин і дуокарміцин; аналоги азотистого іприту, такі як циклофосфамід, мелфалан, іфосфамід або трофосфамід; етилені міни, такі як тіотепа; нітрозо сечовини, такі як кармустин; алкілувальні агенти, такі як темозоломід або дакарбазин; фолат-подібні метаболічні анатгоністи, такі як метотрексат або ралтітрексед; аналоги пурину, такі як тіогуанін, кладрибін або флударабін; аналоги піримідину, такі як фторурацил, тегафур або гемцитабін; алкалоїди барвінку, такі як вінбластин, вінкристин або вінорелбін і їх аналоги; похідні подофіллотоксину, такі як етопозид, таксани, доцетаксель або паклітаксель; антрацикліни, такі як доксорубіцин, епірубіцин, ідарубіцин і мітоксантрон і їх аналоги; інші цитотоксичні анатибіотики, такі як блеоміцин і мітоміцин; сполуки платини, такі як цисплатин, карбоплатин і оксаліплатин; пентостатин, мілтефозин, естрамустин, топотекан, іринотекан і бікалутамід) і токсини (наприклад, рицин, ліатоксин і Веротоксин). Ці функціональну молекули є такими, що добре видаляються в дяеких випадках. Крім того, молекули можуть бути пептидами, що можуть розпізнаватись і відщеплюватись ферментами, такими як тромбін, матриксна металопротеаза (MMP) і Фактор X, полінуклеотиди, що можуть відщеплюватись нуклеазами або рестрекційною ендонуклеазою. Аптамер або комплекс представленого винаходу може бути використаний як, наприклад, фармацевтичний агент або реагент (наприклад, діагностичні реагенти, реагенти для тестування (включаючи експериментальні реагенти)). Наприклад, аптамери або комплекс представленого винаходу може бути використаний як інгібітори міграції клітини, промотори регуляції проліферації T клітин, промотори регуляції суспресивної функції T клітин, пригнічувачи інгібування апоптозу, інгібітори проліферації клітин, інгібітори диференціації клітин, носії для вивільнення лікарського засобу, зонди для in vivo візуалізації, зонди для вимірювання концентрацій в крові MK, зонди для фарбування тканини, зонди для ELISA і ліганди для виідлення і очищення MK. Аптамери або комплекс представленого винаходу також може бути використаний при профілактиці або лікуванні різних захворювань, таких як аутоімунні захворювання (наприклад, розсіяний склероз, системний ериматозний вовчак (SLE), хвороба Сьогрена, поліміозит (PM), дерматоміозит (DM), ревматичний артрит (ревматоїдний артрит (RA), остеоартрит (OA)), запальний ентерит (хвороба Крона і т.і), системна склеродермія (PSS), нодозний панартериіт (PN), захворювання щитовидної залози (хвороба Базедова і т.і), синдром Джулліана-Барра, первинний біліарний цироз печінки (PBC), ідіопатична тромботична пурпура, аутоімунна гемолітична анемія, міастенія гравіс (MG), аміотрофічний латеральний склероз (ALS), діабет типу I, псоріаз, астма, ненормальне функціонування нейтрофілу), рак (наприклад, езофагіальний рак, рак щитовидної залози, рак сечового міхура, колоректальний рак, рак шлунку, панкреатичний рак, рак грудини, рак печінки, рак легені, рак грудей, нейробластома, гліобластома, рак матки, рак яічників, пухлина Вілмса, рак простати), постопераційна адгезія, ендометріоз, відторгнення при трансплантації, алергія, рестеноз після хірургічної реконструкції судин, обструктивне захворювання коронарної артерії, обструктивне захворювання судин мозку, обструктивне захворювання судин нирок, обструктивне захворювання периферійних судин, артеріосклероз і інфаркт головного мозку. Зокрема, аптамери представленого винаходу інгібують активність MK по міграції клітин і, крім того, є корисними при профілактиці або лікуванні розсіяного склерозу, постопераційної адгезії, ендометріозу, ревматоїдного артриту і васкулярного стенозу. 9 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтичний агент представленого винаходу може бути сформульований з фармацевтично прийнятним носієм. Як приклади фармацевтично прийнятного носія можна згадати екціпієнти, такі як цукроза, крохмаль, маніт, сорбіт, лактоза, глюкоза, целюлоза, тальк, фосфат кальцію і карбонат кальцію; зв'язувальні агенти, такі як целюлоза, метилцелюлоза, гідроксипропілцелюлоза, поліпропілпіролідон, желатин, гуміарабік, поліетиленгліколь, цукроза і крохмаль; дезінтегранти, такі як крохмаль, карбоксиметилцелюлоза, гідроксилпропілкрохмаль, натрій крохмальгліколят, гідрокарбонат натрію, фосфат кальцію і цитрат кальцію; змащувальні агенти, такі як стеарат магнію, Аеросил, тальк і лаурилсульфат натрію; ароматизатори, такі як лимонна кислота, ментол, гліциризин-амонієва сіль, гліцин і порошок помаранчів; консерванти, такі як бензоат натрію, гідросульфіт натрію, метилпарабен і пропілпарабен; стабілізатори, такі як лимонна кислота, цитрат натрію і оцтова кислота; суспендувальні агенти, такі як метилцелюлоза, полівінілпіролідон і стеарат алюмінію; диспергувальні агенти, такі як поверхнево-активні речовини; розчинник, такі як вода, фізіологічний салін і апельсиновий сік; воски для основ, такі як масло какао, поліетиленгліколь і керосин; і т.і., але цей перелік не є обмежуючим. Рецептурами придатними для перорального введення є рідка рецептура одержана шляхом розчинення ефективної кількості ліганду в розчиннику, таку як вода, фізіологічний салін або апельсиновий сік; капсули, саше або таблетки, що містять ефективну кількість ліганду в твердій або гранульованій формі; суспензія одержана шляхом суспендування ефективної кількості активного інгредієнту в прийнятному диспергаторі; емульсія одержана шляхом диспергування і емульсифікування розчину ефективної кількості активного інгредієнту в прийнятному диспергаторі і т.і. Фармацевтичний агент представленого винаходу може мати покриття нанесене за допомогою способу відомого безпосередньо з ціллю маскування смаку, розчинення в кишечнику, тривалого вивільнення і т.і., коли це необхідно. Як приклади агентів для покриття, що використовуються, можна згадати гідроксипропілметилцелюлоза, етилцелюлоза, гідроксиметилцелюлоза, гідроксипропілцелюлоза, поліоксиетиленгліколь, Твін 80, Плуронік F68, ацетат фталат целюлози, фталат гідроксипропілметилцелюлози, ацетат сукцинат гідроксиметилцелюлози, Еуградіт (виготовляється Rohm, Germany, співполімер метакрилової кислоти/акрилової кислоти), пігменти (наприклад, червоний оксид заліза, діоксид титану і т.і) і т.і. Фармацевтичний агент може бути швидковивільнюваною рецептурою або рецептурою тривалого вивільнення. Як приклади можна згадати основні матеріали уповільненого вивільнення, ліпосоми, атероколаген, желатин, гідроксиапатит, PLGA і т.і. Як рецептури придатні для парентерального введення (наприклад, внутрішньовенного введення, підшкірного введення, внутрішньом'язового введення, місцевого введення, внутрішньоочеревенного введення, інтраназального введення, пульмонарного введення і т.і) доступні водні і неводні ізотонічні стерильні рідини для ін'єктування, які можуть містити антиоксидант, буферний розчин, бактеріостатичний агент, ізотонічний агент і т.і. також можна згадати водні і неводні стерильні суспензії, які можуть містити суспендувальний агент, солюбілізатор, загусник, стабілізатор, антисептик і т.і. Рецептура може бути поміщена в контейнер, такий як ампула або пляшечка в одиничному дозованому об'ємі або в декількох розподілених дозах. Активний інгредієнт і фармацевтично прийнятний носій також можуть бути висушені заморожуванням і зберігатись в стані, що може бути розчинений або суспендований в прийнятному стерильному розчиннику тільки перед використанням. Крім того, на додаток до рідин для ін'єктування, також можливі інгалянти і мазі. У випадку інгалянту, активний інгредієнт висушений заморожуванням подрібнюють і вводять за допомогою інгаляції використовуючи прийнятний пристрій для інгаляції. Інгалянт можна сформулювати як прийнятно використовуючи поверхнево-активну речовину, олію, приправи, циклодекстрин або його похідні і т.і., коли необхідно. Тут, як приклади поверхнево-активної речовини можуть бути згадані олеїнова кислота, лецитин, діетиленгліколь діолеат, тетрагідрофурфурилолеат, етилолеат, ізопропілміристат, гліцерилтриолеат, гліцерилмонолаурат, гліцерилмоноолеат, гліцерилмоностеарат, гліцерилмонолізиноат, цетиловий спирт, стеариловий спирт, поліетиленгліколь 400, цетилпіридинію хлорид, триолеату сорбіт (торгова назва Span 85), моноолеату сорбіт (торгова назва Span 80), монолаурату сорбіт (торгова назва Span 20), поліоксиетилен отверджена касторова олія (торгова назва HCO-60), поліоксиетилен (20) монолаурат сорбіту (торгова назва Tween 20), поліоксиетилен (20) моноолеату сорбіт (торгова назва Tween 80), лецитин з природного джерела (торгова назва EPICLON), олеїлполіоксиетиленовий (2) етер (торгова назва Brij 92), стеарилполіоксиетиленовий (2) етер (торгова назва Brij 72), лаурилполіоксиетиленовий (4) етер (торгова назва Brij 30), олеоїлполіоксиетиленовий (2) етер 10 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 (торгова назва Genapol 0-020), блокспівполімер оксиетилену і оксипропілену (торгова назва Synperonic) і т.і. Як приклади олії можна згадати кукурудзяну олію, оливкову олію, олію з насіння бавовнику, соняшникову олію і т.і. У випадку мазі, прийнятну фармацевтично прийнятну основу (жовтий вазелін, білий вазелін, парафін, пластибейс, силікон, біла мазь, бджолиний віск, лярд, рослинні олії, гідрофільні мазі, гідрофільний вазелін, очищений ланолін, гідролізований ланолін, водо-адсорбуючі мазі, гідрофільний пластибейс, макроголь і т.і) змішують з активний інгредієнтом і використовують як рецептуру. Інгалянт може бути одержаний згідно із звичaйною методикою. Специфічно, інгалянт може бути одержаний шляхом тонкого подрібнення або розплавлення описаного вище аптамеру або комплексу представленого винаходу, змішування його в інгаляційному пропеланті і/або носії, і наповнення ним прийнятної інгаляційної посудини. Коли описаний вище аптамер або комплекс представленого винаходу є порошком, можуть бути використані звичайні механічні порошкові інгалятори; у випадку рідини, може бути використаний інгалятор, такий як розпилювач. Тут, як пропелант можуть бути згадані загально відомі пропеланти, що широко використовуються, такі як хлорфторвуглецеві сполуки, такі як хлорфторвуглець-11, хлорфторвуглець-12, хлорфторвуглець-21, хлорфторвуглець-22, хлорфторвуглець-113, хлорфторвуглець-114, хлорфторвуглець-123, хлорфторвуглець-142c, хлорфторвуглець-134a, хлорфторвуглець-227, хлорфторвуглець-C318, і 1,1,1,2-тетрафторетан, вуглеводні, такі як пропан, ізобутан і н-бутан, етери, такі як діетиловий етер, гази під тиском, такі як азот і діоксид вуглецю і т.і. Доза фармацевтичного агенту представленого винаходу змінюється в залежності від виду і активності активного інгредієнту, складності захворювання, виду тварини, що піддається введенню, переносимість лікарського засобу суб'єктом, ваги тіла, віку і т.і, і звичпйна доза, що базується на кількості активного інгредієнту на день дорослому, може бути від приблизно 0,0001 до приблизно 100 мг/кг, наприклад, від приблизно 0,0001 до приблизно 10 мг/кг, переважно від приблизно 0,005 до приблизно 1 мг/кг. Представлений винахід також забезпечує твердофазний носій, що має аптамер і/або комплекс представленого винаходу імобілізований в ньому. Як приклади твердофазного носія можуть бути згадані субстрат, смола, планшет (наприклад, багатолунковий планшет), фільтр, картридж, колонка і пористий матеріал. Субстратом може бути субстрат використовуваний в ДНК чипах, протеїнових чипах і т.і; наприклад, можна згадати нікель-PTFE (політетрафторетилен) субстрати, скляні субстрати, апатитні субстрати, силіконові субстрати, глиноземні субстрати і т.і, і субстрати одержані шляхом нанесення полімерного покриття на ці субстрати і т.і. Як приклади смоли можуть бути згадані агарозні часточки, кремнієві часточки, співполімер акриламіду і N, N’-метиленбісакриламіду, часточки полістиролу-перехресно зв'язані дивінілбензолом, часточки дестрану перехресно зв'язані епіхлоргідрином, волокна целюлози, перехресно зв'язані полімери арилдекстрану і N, N’-метиленбісакриламіду, монодисперговані синтетичні полімери, монодисперговані гідрофільні полімери, Сефароза, Тойоперл і т.і, а також включені смоли одержані шляхом зв'язування різних функціональних груп з цими смолами. Твердофазний носій представленого винаходу може бути корисний при, наприклад, очищенні, детектуванні і кількісному визначенні MK. Аптамер і/або комплекс представленого винаходу може бути іммобілізований на твердофазний носій за способом відомим безпосередньо. Наприклад, може бути згаданий спосіб, що включає афінну речовина (наприклад, речовини описані вище) або попередньо визначену функціональну групу в аптамер і/або комплекс представленого винаходу, і наступну іммобілізацію аптамеру або комплексу на твердофазний носій через афінну речовину або попередньо визначену функціональну групу. Представлений винахід також забезпечує такі способи. Попередньо визначеною функціональною групою може бути функціональна група, що може бути піддана реакції конденсування; наприклад, може бути згадана аміногрупа, тіогрупа, гідроксильна групу і карбоксильна група. Представлений винахід також забезпечує аптамер, що має таку функціональну групу введеного в нього. Представлений винахід також забезпечує спосіб очищення і концентрування MK. Спосіб очищення і концентрування представленого винаходу може включати адсорбування MK на твердофазний носій представленого винаходу і елюювання адсорбованого MK елюентом. Адсорбування MK на твердофазний носій представленого винаходу може бути здійснено за способом відомим безпосередньо. Наприклад, MK-вмісний зразок (наприклад, бактеріальна культура або культура клітин або надосадкова рідина, кров) вводять в твердофазний носій представленого винаходу або композицію, що його містить. Елюювання MK можна проводити використовуючи елюент, такий як нейтральний розчин. Нейтральний елюент спеціально не обмежується і може мати pH, наприклад, від приблизно 6 до приблизно 9, переважно від приблизно 6,5 до приблизно 8,5, і більш переважно від приблизно 7 до приблизно 8. 11 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 Нейтральним розчином також може бути розчин, що містить, наприклад, сіль калію (наприклад, NaCl, KCl), сіль магнію (наприклад, MgCl2), поверхнево-активну речовину (наприклад, Твін 20, Тритон, NP40) або гліцерин. Спосіб очищення і концентрування представленого винаходу також може включати промивання твердофазного носія використовуючи промивний розчин після адсорбції MK. Як приклади промивного розчину можна згадати розчини, що містять сечовину, хелатуючий агент (наприклад, EDTA), Tris, кислоту або основу і т.і. Спосіб очищення і концентрування представленого винаходу також може включати нагрівання твердофазного носія. Ця стадія забезпечує регенерування і стерилізацію твердофазного носія. Представлений винахід також забезпечує спосіб детектування і кількісного визначення MK. Спосіб детектування і кількісного визначення представленого винаходу може включати вимірювання MK використовуючи аптамер представленого винаходу (наприклад, при використанні комплексу і твердофазного носія представленого винаходу). Спосіб детектування і кількісного визначення MK може бути проведений таким же самим чином як імунологічний спосіб, за винятком того, що аптамер представленого винаходу використовується замість антитіла. Крім того, при використанні аптамеру представленого винаходу замість антитіла, може бути проведено детектування і кількісне визначення таким же самим чином, в таких способах, як імуноферментний аналіз (EIA) (наприклад, безпосередньо конкурентний ELISA, небезпосередньо конкурентний ELISA, сендвічний ELISA), радіоімунодослідження (RIA), флуоресцентне імунодослідження (FIA), Вестерн-блот методика (наприклад, використовується як заміна для вторинного антитіла в Вестерн-блот методиці), спосіб імуногістохімічного фарбування і спосіб сортування клітин. Ці способи можуть бути корисні при, наприклад, вимірюванні вмісту MK в живому організмі або біологічному зразку, і діагностуванні MKзалежних захворювань. Опис всіх публікацій згаданих тут, включаючи патенти і заявки на патенти, включений в представлений винахід як посилання в об'ємі, що всі з них чітко ідентифікуються. Представлений винахід описується далі більш детально за допомогою наступних Прикладів, які, однак, ніяким чином не обмежують рамок винаходу. [Приклад 1] Одержання нуклеїнових кислот, що специфічно зв'язують мідкайн 1 Нуклеїнові кислоти, що специфічно зв'язують мідкайн, одержували використовуючи спосіб SELEX. SELEX проводили використовуючи покращення за способом Ellington et al. (Ellington and Szostak, Nature 346, 818-822, 1990) і способом Tuerk et al. (Tuerk and Gold, Science 249, 505-510, 1990). Як цільову речовину, одержували мідкайн людини використовуючи дріжджі з посиланням на спосіб Murasugi et al. (Murasugi and Tohma-Aiba, Protein Expression and Purification 27, 244252, 2003). Тут далі, якщо не вказано інше, мідкайн означає мідкайн людини. Мідкайн іммобілізували на агарозну смолу (NHS-активовану Сефарозу, що виготовляється Amersham Bioscience) шляхом аміноконденсування. Аміноконденсування проводили як показано в описі Amersham Bioscience. Підтверджували іммобілізовану кількість шляхом визначення мідкайну у розчині безпосередньо перед іммобілізацією і надосадковій рідині безпосередньо після іммобілізації SDS-PAGE. Як результат SDS-PAGE, недетектували незв'язаного мідкайн в надосадковій рідині; це було підтвердженням, що майже весь мідкайн був використаний для зв'язування. Це означає, що приблизно 175 мкг мідкайн іммобілізували на приблизно 70 мкл смоли. РНК використовувану в першому раунді (40N-РНК) одержували шляхом транскрибування TM хімічно синтезованої ДНК використовуючи DuraScribe T7 Transcription Kit (що виготовляється Epicentre). РНК одержану в цьому способі має фтор-заміщене 2’-положення рибози піримідинового нуклеотиду. ДНК довжиною 94 нуклеотиди показана нижче, що має послідовність праймера на кожному кінці з 40-нуклеотидів випадкової послідовності, використовували як ДНК матрицю. ДНК матрици і праймери одержували за допомогою хімічного синтезу (що виготовляється Operon). ДНК матриця: 5’-tcctcattcctgtcctcta-40N-ttcctcttctcctctccc-3" (SEQ ID NO:71) Праймер Fwd: 5’-taatacgactcactatagggagaggagaagaggaa-3" (SEQ ID NO:72) Праймер Rev: 5’-tcctcattcctgtcctcta-3" (SEQ ID NO:73) N представляє будь-який один з A, G, C і T. Праймер Fwd включає промоторну послідовність з T7 РНК полімерази. Варіації РНК пулу використовуваного в першому раунді були теоретично 14 10 . РНК пул додавали до мідкайн-іммобілізованої смоли і залишали стояти при кімнатній температурі протягом 30 хвилин. Через 30 хвилин, для видалення РНК незв'язаного з мідкайн, смолу промивали розчином A. Тут, розчин A був сумішшю розчину 145 мM хлориду натрію, 5,4 мM хлориду калію, 1,8 мM хлориду кальцію, 0,8 мM хлориду магнію і 20 мM Tris (pH7,6). 12 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 Мідкайн-зв'язану РНК виділяли шляхом нагрівання при 95C протягом 10 хвилин з додаванням елюенту. Як елюент, використовували змішаний розчин 7 M сечовини, 3 мM EDTA і 100 мM TRIS, доведений до pH 6,6. Виділену РНК ампліфікували ЗТ-ПЛР і транскрибували TM використовуючи DuraScribe T7 Transcription Kit, і використовували як пул для наступного циклу. Використовуючи методику як в 1 циклі, проводили ті ж самі операції 7 разів (циклів). Після завершення SELEX, ЛПР продукт клонували в вектор pGEM-T Easy (що виготовляється Promega), і за допомогою нього трансформували Escherichia coli штам DH5α (що виготовляється Toyobo). Після екстрагування плазміди з окремої колонії, визначали послідовність 48 клонів використовуючи ДНК секвінатор (ABI PRISM 3100, що виготовляється ABI). Після проведення 7 циклів SELEX, досліджували послідовності; послідовності, що проявляють конвергенцію. Присутні двадцять копій послідовності представленої SEQ ID NO:1 і присутня одна копія форми з 2-заміженою основою. Присутні дві копії послідовності представленої SEQ ID NO:2. Присутня одна копія кожної з послідовностей представлених SEQ ID NO:3-5. Вторинні структури РНК представлених SEQ ID NO:1-5 оцінювали використовуючи програму MFOLD (M. Zuker, Nucleic acids Res. 31 (13), 3406-3415, 2003). Як результат, було видно, що структури внутрішня петля-стовбур-петля шпильки морфологічно подібні до РНК представленої SEQ ID NO:2, 3, і 4 (ФІГ. 1-5). Всі петлі шпильки складались з восьми нуклеотидів; 2 і 3 були 1-заміщеними основами порівняно з SEQ ID NO:4. Стосовно стовбурів, SEQ ID NO:2 складається з двох пар основ і SEQ ID NO:3 і 4 складалась з трьох пар основ. Кожна нуклеотидна послідовність показана далі. Круглі дужки в кожному нуклеотиді показують модифікації в 2’-положенні і F є атом фтору (тут далі те ж саме). SEQ ID NO:1: gggagaggagaagaggaaau(F)agu(F)u(F)aagggu(F)gaau(F)u(F)u(F)gc(F)gaaagc(F)u(F)au(F)u(F)u(F)u (F)agu(F)c(F)gc(F)agu(F)agaggac(F)aggaau(F)gagga SEQ ID NO:2: gggagaggagaagaggaaggac(F)u(F)aagu(F)aagagaac(F)ac(F)c(F)ggaau(F)gaagggac(F)u(F)u(F)ac(F)g u(F)gu(F)agaggac(F)aggaau(F)gagga SEQ ID NO:3: gggagaggagaagaggaaagc(F)c(F)u(F)u(F)c(F)u(F)ac(F)c(F)gaaagu(F)gggaaagc(F)ac(F)ac(F)au(F)aaa u(F)c(F)u(F)ggu(F)agaggac(F)aggaau(F)gaga SEQ ID NO:4: gggagaggagaagaggaac(F)gu(F)gc(F)u(F)c(F)u(F)gu(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)gg u(F)gu(F)gu(F)agaggac(F)aggaau(F)gaga SEQ ID NO:5: gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)ag u(F)au(F)aagau(F)agaggac(F)aggaau(F)gaga послідовність петлі шпильки SEQ ID NO:2-ggaaugaaSEQ ID NO:3-ggaaagcaSEQ ID NO:4-ggaaagaa[Приклад 2] Одержання нуклеїнових кислот, що специфічно зв'язують мідкайн 2 Для одержання аптамерів, що зв'язують мідкайн, але не зв'язують плеіотрофін, протеїн родини мідкайн, проводили SELEX, що включає попередню субстракцію використовуючи плеіотрофін. Спочатку, як з мідкайн, плеіотрофін іммобілізували на агарозну смолу за допомогою аміноконденсування. Далі, РНК пул додавали до плеіотрофін-зв'язаної смоли і залишали стояти при кімнатній температурі протягом 30 хвилин. Після цього, виділяли тільки надосадкову рідину. Теоретично, ця надосадкова рідина не повинна містити РНК, що зв'язує плеіотрофін. Цю надосадкову рідину додавали до мідкайн-зв'язаної смоли і проводили SELEX таким же самим чином як в Прикладі 1. Використовуваний плеіотрофін експресували в дріжджах за способом Murasugi et al. (Murasugi, Kido, Kumai, and Asami, Biosci. Biotech. Biochem. 67 (10), 2288-2290, 2003). Використовувані ДНК матриця і праймери були такими ж самими як ті що використовувались в Прикладі 1. Після завершення 7 циклів, перевіряли послідовності 48 клонів; в послідовностях спостерігалась конвергенція. Серед них, присутні десять копій з такою ж самою послідовністю як SEQ ID NO:3 одержаною в Прикладі 1 і присутня одна копія з 1-заміщеною основою. Присутні шість копій з такою ж самою послідовністю як SEQ ID NO:2 і присутньо дві копії з 1-заміщеною основою. Крім того, присутня одна копія з такою ж самою послідовністю як SEQ ID NO:5. [Приклад 3] 13 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержання нуклеїнових кислот, що специфічно зв'язують мідкайн 3 Коли мідкайн іммобілізується аміноконденсуванням, важливі частини можуть руйнуватись в залежності від сайту аміноконденсування. Тому, проводили зв'язування фільтром SELEX використовуючи нітроцелюлозну мембрану, яка не зачіпає іммобілізацію до носія. Це призначено для відокремлення нуклеїнових кислот, що зв'язують цільовий протеїн, і нуклеїнових кислот, що не зв'язують, що базується на факті, що протеїни є підходящими для зв'язування з нітроцелюлозними мембранами, в той час як нуклеїнові кислоти не зв'язуються. Змішували РНК пул і мідкайн, залишали стояти 30 хвилин при кімнатній температурі і потім суміш фільтрували використовуючи нітроцелюлозну мембрану. Після доброго промивання нітроцелюлозної мембрани розчином A, нітроцелюлозну мембрану занурювали в елюент B і нагрівали при 90C протягом 5 хвилин. Потім, таким же самим чином як в Прикладs 1, РНК виділяли осадженням етанолом, ампліфікували за допомогою ЗТ-ПЛР і транскрибували у РНК пул для наступного циклу. ДНК матрицю і праймери використовували таким же самим чином як в Прикладі 1. Елюент B є сумішшю рідкого 50 % фенолу і 6 M сечовини. Після проведення шести циклів, перевіряли послідовності 48 клонів; одержували недостатню конвергенцію. Тому, SELEX проводили на тричі більше циклів; після завершення дев'яти циклів, перевіряли послідовності 48 клонів; спостерігалась достатня конвергенція. Серед послідовностей, присутні 21 копія з тією ж самою послідовністю як SEQ ID NO:2, і присутні чотири копії з 1-заміщеною формою основи. Присутні десять копій з тією ж самою послідовністю як SEQ ID NO:4. Було відкрито три нові послідовності, жодна з яких не проявляла конвергенції. [Приклад 4] Оцінка зв'язувальних активностей за способом резонансу поверхневого плазмону Досліджували зв'язувальні активності РНК представлених SEQ ID NO:1-5 для мідкайн за способом резонансу поверхневого плазмону. Вимірювання проводили використовуючи BIAcore2000, що виготовляється BIAcore. Використовуваним сенсорним чипом був SA чіп, який мав іммобілізований на ньому стрептавідин. Зв'язок, до того ж, був приблизно 1000 RU 16нуклеотид Poly dT з біотином зв'язаним з його 5" кінцем. РНК лігандом, що має 16-нуклеотид Poly A доданий до його 3" кінця і іммобілізований до SA чипу через зв'язок між dT і A. Кількість іммобілізованого була приблизно 1000 RU. Ін'єктували 70 мкл мідкайн для аналіту, одержаного при 0,5 мкM. Буфером для прогону використовуваним для BIAcore був розчин A. В результаті вимірювань, було встановлено, що всі РНК представлені SEQ ID NO:1-5 зв'язують мідкайн (ФІГ. 6). Для негативного контролю, проводили подібне вимірювання використовуючи іммобілізовану 40N-РНК, яка включає 40-нуклеотидну випадкову послідовність. Як результат, було встановлено, що 40N-РНК також проявляє спорідненість для мідкайн. Ступінь був вищим при подібних рівнях для спорідненостей РНК представлених SEQ ID NO:1-5. Оскільки мідкайн містить велику кількість основних амінокислот, таких як лізин, очікується неспецифічне зв'язування з негативно зарядженими нуклеїновими кислотами. Тому, проводили вимірювання використовуючи як буфер для прогону для BIAcore буфер з високою концентрацією солі (розчин B), одержаний шляхом зміни концентрації хлориду натрію в розчині A до 500 мM. Очікувалось, що при використанні буферу з високою концентрацією солі, може зменшуватись неспецифічна адсорбція завдяки іонному зв'язуванню. В результаті вимірювань, було знайдено, що 40N-РНК важко зв'язується з мідкайн. Між тим, РНК представлені SEQ ID NO:2-5 зв'язують мідкайн з вищими ступенями, ніж з 40N-РНК (ФІГ. 7). Факт зв'язування при високих концентраціях солі означає, що зв'язування імовірно відбувається завдяки гідрофобному зв'язку. Це вказує на те, що ці РНК не можуть неспецифічно зв'язуватись з лізиновою частиною, але специфічно розпізнають мідкайн. Далі, проводили експеримент, в якому мідкайн іммобілізували до CM4 сенсорного січа за допомогою аміноконденсування, і ін'єктували РНК представлені SEQ ID NO:4 або 5, як аналіт, і визначали спорідненість РНК і мідкайн. Іммобілізацію мідкайн забезпечували використовуючи N-гідроксисукцинімід (NHS, 11 мг/л) і N-етил-N'-(3-диметиламінопропіл)карбодііміду гідрохлорид (EDC, 75 мг/л) за рекомендаціями BIAcore. Мідкайн розводили HBS-EP буфером (що виготовляється BIAcore) і використовували при концентрації 20 мкг/мл. Для блокування використовували 1 M гідрохлорид етаноламіну (pH 8,5). MK (1-59, MK-N, що виготовляється Peptide Institute, Inc.) іммобілізували на проточну кювету 2 одного сенсорного чипу, MK (60-121, MK-C, що виготовляється Peptide Institute, Inc.) іммобілізували проточну кювету 3 і повнодовжинний мідкайн (MK-NC) іммобілізували на проточну кювету 4. Проточну кювету 1 використовували як контролюну кювету. При іммобілізації 3 видів мідкайн і фрагменту мідкайн на один сенсорний чіп як описано вище, одночасно можна виміряти спорідненість для 3 видів лігандів. В результаті вимірювання, було встановлено, що РНК представлена SEQ ID NO:4 14 UA 100847 C2 зв'язується з повнодовжинним мідкайн (тут далі, пишеться MK-NC) і C-доменом мідкайн (тут далі, пишеться MK-C), але не зв'язується з N-доменом мідкайн (тут далі, пишеться MK-N) (Таблиця 1). Між тим, РНК представлена SEQ ID NO:5 зв'язує всі MK-NC, MK-N і MK-C, але спорідненість була вищою для MK-N, ніж для MK-C. 5 Таблиця 1 Спорідненість мідкайн і різних аналітів SEQ ID NO:4 SEQ ID NO:5 Гепарин Хондроітинсульфат E Хондроітинсульфат C тРНК Повнодовжинний +++ +++ +++ +++ + +++ Мідкайн MK-N ++ + + MK-C ++ + +++ +++ + +++ Вимірювали за способом резонансу поверхневого плазмону. Мідкайн іммобілізували на CM4 сенсорний чип і ін'єктували різні аналіти. Спорідненість є вищою в порядку +++, ++, + і -. 10 15 20 25 30 35 40 Проводили подібні експерименти використовуючи як аналіт, замість РНК, гепарин (Гепарин, натрієва сіль, слизова кишечнику свиней, низькомолекулряна вага, Mw: 5000, що виготовляється Calbiochem), хондроітинсульфат E (з хрящів кальмара, що виготовляється Seikagaku Corporation), хондроітинсульфат C (з хрящів акули, Mw: 40000-80000, що виготовляється Seikagaku Corporation), або тРНК (що виготовляється Sigma). Як результат, було знайдено, що всі ці аналіти мали низьку спорідненість для MK-N і зв'язуються в основному з MK-C (Таблиця 1). З приведеного вище, було встановлено, що РНК представлена SEQ ID NO:4, подібно гепарину і т.і, зв'язує C домен мідкайн. Між тим, було встановлено, що РНК представлена SEQ ID NO:5 мала низьку спорідненість до C домену і зв'язувалась більш сильно з N доменом. Це показало, що РНК представлені SEQ ID NO:4 і 5 зв'язують різні сайти мідкайн. Відомо, що мідкайн має в його C домені активний сайт, що є гепарин-зв'язувальним сайтом (Muramatsu H et al., Biochem Biophys Res Commun. 1994 Sep 15;203(2):1131-9., 106.; Iwasaki W et al., EMBO J. 1997 Dec 1;16(23):6936-46.). Було визначено, що так чи інакше РНК представлена SEQ ID NO:5 мала зв'язувальну активність до протеїну родини мідкайн – плеіотрофін, визначену за допомогою способу резонансу поверхневого плазмону, як описано вище. РНК іммобілізували на SA сенсорний чіп і ін'єктували 0,5 мкM плеіотрофіну. Для зменшення неспецифічної адсорбції, до розчину плеіотрофіну додавали 0,4 мг/мл тРНК. В результаті вимірювання, було встановлено, що РНК представлена SEQ ID NO:5 проявляла зв'язувальну активність до плеіотрофіну, але ступінь був нижчим ніж для мідкайн. Використовуючи 40N-РНК як ліганд, проводили подібні вимірювання. І мідкайн, і плеіотрофін зв'язуються з 40N-РНК, але ступінь був нижчим ніж для РНК представленої SEQ ID NO:5. 40N-РНК проявляла вище спорідненість до мідкайн, ніж до плеіотрофіну. З викладеного вище, було встановлено, що плеіотрофін, подібно мідкайн, проявляє схильність до зв'язування з нуклеїновими кислотами. Також було встановлено, що РНК представлена SEQ ID NO:5 проявляє вищу спорідненість до мідкайн, ніж до плеіотрофіну. Далі, було встановлено, так чи інакше, що РНК представлені SEQ ID NO:4 і 5 проявляють спорідненість до інших протеїнів. Як протеїни використовували IgG1 людини (що виготовляється Calbiochem) і альбумін людини (що виготовляється Sigma). Кожну РНК іммобілізували використовуючи SA сенсорний чіп, як описано вище, і ін'єктували кожен протеїн, як аналіт. Як результат, IgG1 людини і альбумін людини зовсім не зв'язуються з будь-якою з РНК представлених SEQ ID NO:4 і 5. З викладеного вище, було встановлено, що РНК представлені SEQ ID NO:4 і 5 не зв'язуються з альбуміном людини і IgG людини, які присутні у великих кількостях в крові. Вимірювали зв'язувальні активності РНК представлених SEQ ID NO:2-7, 31, 32, 36, 40, 40-1 і 40-2 використовуючи MK. Як описано вище, вимірювання проводили використовуючи MK іммобілізований на CM4 сенсорний чіп. Як результат, було встановлено, що всі ці РНК проявляють спорідненість до MK. 15 UA 100847 C2 5 10 15 20 [Приклад 5] Оцінка РНК аптамерів за допомогою експерименту по інгібуванню міграції клітин Відомо, що мідкайн має інфільтраційну дію на клітини-попередники остеобласту (Qi et al., J. Biol. Chem. 276 (19), 15868-15875, 2001). Тому, так чи інакше було досліджено одержання РНК аптамерів, що інгібують активність мідкайн по міграції клітин використовуючи UMR106 клітини з лінії клітин-попередників остеобласту щурів (ATCC No. CRL1661). 30 мкл 1,5 мкM мідкайн наносили на зовнішню поверхню мембрани Хемотаксицелл (діаметр пор мембрани 8 мкм, що виготовляється Kurabo) для іммобілізації мідкайн на зовнішню поверхню мембрани. Мідкайніммобілізовану Хемотаксицелл поміщали на 24-лунковий культуральний планшет, що містить 500 мкл середовища (доповненого 0,3 % сироваткового альбуміну теляти, середовища Ігла модифікованого Дульбекко) доповненого кожним з РНК аптамерів, що додавали в кількості 100 нM. 200 мкл UMR106 клітин поміщали у внутрішній шар комірки Хемотаксицелл з густиною 6 110 клітин/мл і культивували при 37C протягом 4 годин. Клітини, що залишились у внутрішньому шарі комірки Хемотаксицелл видаляли і клітини, що інфільтрувались і прилипли до мідкайн-вмісної поверхні фіксували метанолом. Комірки Хемотаксицелл занурювали в 1 % водний розчин Кристалічного Фіолетового на 30 хвилин для фарбування клітин. Після промивання комірок Хемотаксицелл дисильованою водою і висушування, пігмент екстрагували змішаним розчином 200 мкл 1 % SDS і 1 % тритон X100. 150 мкл екстракту переносили до 96лункового мікропланшету і вимірювали його абсорбцію при 590 нм. В результаті вимірювання, було встановлено, що РНК представлені SEQ ID NO:1, 2, 4, і 5 проявляють видатну інгібувальну активність міграції клітин. Результати показані в Таблиці 2. Аптамер представлений SEQ ID NO:5 проявляє найвищу інгібувальну активність, значення для 14 вимірювань є 76 %. 40N-РНК, використовувана як негативний контроль, майже не проявляє інгібувальної активності. 25 Таблиця 2 Інгібувальні активності міграції клітин одержаних аптамерів проти мідкайн і плеіотрофін SEQ ID NO 1 2 4 5 40N-РНК Мідкайн Інгібувальна Кількість активність % вимірювань 36 4 45 4 63 6 76 14 8 6 Плеіотрофін Інгібувальна Кількість активність % вимірювань 0 2 8 2 17 6 28 2 РНК концентрування: 100 нM 30 35 40 45 Тут, Інгібувальна активність % є значенням одержаним шляхом віднімання кількості клітин, що рухаються, при додаванні аптамеру від кількості клітин, що рухаються, без додавання аптамеру (абсорбція фарбованого екстракту клітин) взятого як 100. В таблиці, кожне % значення є середнім для вказаної кількості вимірювань. Далі, так чи інакше було виміряно, що аптамери представлені SEQ ID NO:4 і 5 мають інгібувальну активність щодо міграції клітин викликаної плеіотрофін. Експерименти проводили як описано вище, за винятком того, що плеіотрофін використовували замість мідкайн. В результаті експерименту було встановлено, що ці аптамери не проявляють значної інгібувальної активності проти плеіотрофін (Таблиця 2). Далі, так чи інакше було виміряно, що гепарин, хондроітинсульфат E, хондроітинсульфат C інгібують клітиноміграційну активність мідкайн і плеіотрофін. Експеримент проводили як описано вище, за винятком того, що аптамери замінювали гепарином, хондроітинсульфатом E або хондроітинсульфатом C. Як гепарин використовували продукт, що виготовляється Nacalai Tesque. Постачальниками хондроітинсульфату E і C були ті ж самі як в Прикладі 4. Концентрації гепарину і хондроітинсульфату E були 0,1, 1, 10 і 100 мкг/мл. В результаті експерименту, гепарин при 0,1 мкг/мл інгібує клітиноміграційні активності мідкайн і плеіотрофін. При концентрації 1 мкг/мл, гепарин інгібує клітиноміграційні активності мідкайн і плеіотрофін не менше ніж на 80 %. Між тим, хондроітинсульфат E при концентрації 10 мкг/мл інгібує мідкайн на 16 UA 100847 C2 5 10 15 20 25 30 49 % і плеіотрофін на 69 %. Якщо молекулярна маса хондроітинсульфату C є 40000, експеримент проводили при 500 нM (20 мкг/мл). Як результат, коли Інгібувальна активність аптамеру представленого SEQ ID NO:4 (500 нM) була взята як 100, інгібувальна активність хондроітинсульфату C була 44. З викладеного вище, було встановлено, що аптамери представлені SEQ ID NO:1, 2, 4, і 5 специфічно зв'язуються з мідкайн інгібуючи його клітиноміграційну активність. 40N-РНК неспецифічно електростатично адсорбує мідкайн, але не інгібує клітиноміграційну активність. Це показує, що РНК, що були одержані за допомогою SELEX, не властива неспецифічна адсорбція, але зв'язуються з важливим сайтом пов'язаним з клітиноміграційною активністю. Гепарин і хондроітинсульфат E еквівалентно інгібують клітиноміграційну активність без відмінностей між мідкайн і плеіотрофін. Між тим, аптамери представлені SEQ ID NO:4 і 5 інгібують тільки активність мідкайн. Оскільки мідкайн і плеіотрофін мають гомологію 50 %, а також оскільки гепарин-зв'язувлаьний сайт є висококонсервативним, високі специфічності аптамерів є незрозумілими. [Приклад 6] Мініатюризація і стабілізація аптамеру представленого SEQ ID NO:4 Аптамер представлений SEQ ID NO:4 має довжину в 77 нуклеотидів і має 2" положення рибози піримідинового нуклеотиду заміщене фтором. Для можливості хімічного синтезу, для зменшення токсичності і для покращення стабільності в крові, проводили мініатюризацію і стабілізацію цього аптамеру. Операції по мініатюризації і стабілізації проводили на основі вторинної структури визначеною за допомогою MFOLD програми і оцінювали активність в експерименті по інгібуванню міграції клітин. В експерименті по інгібуванню міграції клітин, концентрація РНК була 100 нM або 500 нM. Оскільки в експериментальних результатах мають місце деякі помилки в залежності від стану клітин, в кожний експеримент включали попередньо досліджений зразок як позитивний контроль. Одержувані інгібувальні активності, коли концентрація РНК була 500 нM, показані в Таблиці 3 (Таблиці 3-1 і 3-2). Інібувальні активності виражали як відносні значення з активністю аптамеру представленого SEQ ID NO:4 взятого як 100, для того щоб зрозуміти різниці в активностях серед змінених форм. Інгібувальна активність % аптамеру представленого SEQ ID NO:4 (значення одержане при відніманні кількості клітин, що рухаються, при додаванні аптамеру від 100, яка є кількістю клітин, що рухаються, без додавання аптамеру) була 73 %, коли концентрація РНК була 500 нM. Це є середнім значенням для 4 вимірювань. Середнє для 6 вимірювань інгібувальної активності % було 63 %, коли концентрація РНК була 100 нM. Таблиця 3-1 Інгібувальні активності міграції клітин змінених форм РНК представленої SEQ ID NO:4 проти мідкайн SEQ ID NO 4 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 20-1 20-2 Активність 100 57 (миша) 110 91 100 57 81 100 100 100 100 75 61 68 88 94 97 109 84 Кількість вимірювань 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 35 17 Довжина (нт) 77 67 64 69 66 73 77 58 50 54 56 57 46 37 44 42 42 42 UA 100847 C2 Продовження таблиці 3-1 SEQ ID NO 20-3 20-4 20-5 20-6 20-7 20-8 20-9 20-10 20-11 20-12 20-13 Активність 60 60 88 69 88 99 130 86 76 53 89 Кількість вимірювань 2 2 2 2 2 2 2 2 2 2 2 Довжина (нт) 42 42 42 42 42 42 42 42 42 42 42 Таблиця 3-2 SEQ ID NO 21 22 23 24 25 26 27 28 29 Cond-C 5 10 15 20 25 30 Активність 0 70 66 65 81 18 78 71 74 44 Кількість вимірювань 2 6 2 2 2 2 2 2 2 2 Довжина (нт) 44 33 38 38 41 41 41 31 31 Концентрація РНК була 500 нM. Активності виражали як відносні значення стосовно активності РНК представленої SEQ ID NO:4 взятої як 100. Інгібувальна активність % РНК представленої SEQ ID NO:4 була 73 %. Це значення є середнім для 4 вимірювань. (Миша) означає значення стосовно мідкайн миші. Cond-C означає хондроітинсульфат C. Змінені частини в змінених формах (SEQ ID NO:6-29) розкриті нижче. SEQ ID NO:6: 10 нуклеотидів видалено з одноланцюгової частини на 3" кінці РНК представленої SEQ ID NO:4. gggagaggagaagaggaac(F)gu(F)gc(F)u(F)c(F)u(F)gu(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)gg u(F)gu(F)gu(F)agaggac(F)a SEQ ID NO:7: 14 нуклеотидів видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:4, і один G додано для транскрипції. gggaac(F)gu(F)gc(F)u(F)c(F)u(F)gu(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggu(F)gu(F)gu(F)a gaggac(F)aggaau(F)gagga SEQ ID NO:8: 4 пари основ видалено із стовбура кінці РНК представленої SEQ ID NO:4. gggagaggagaagaggaac(F)gc(F)u(F)gu(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggu(F)gu(F)gu (F)agc(F)aggaau(F)gagga SEQ ID NO:9: видалено 8 нуклеотидів із внутрішньої петлі і CGG на її протилежному боці РНК представленої SEQ ID NO:4. gggagaggagaagaggaac(F)gu(F)gc(F)u(F)c(F)u(F)gu(F)ac(F)gc(F)c(F)ggaaagaaggu(F)gu(F)gu(F)agag gac(F)aggaau(F)gagga SEQ ID NO:10: частина петлі замінена GAAA тетрапетлі в РНК представленій SEQ ID NO:4. gggagaggagaagaggaac(F)gu(F)gc(F)u(F)c(F)u(F)gu(F)ac(F)gaggagu(F)agc(F)c(F)gaaaggc(F)ggu(F)g u(F)gu(F)agaggac(F)aggaau(F)gagga SEQ ID NO:11: 3 G-U пари основ замінені G-C парами основ в стовбурі на кінці РНК представленої SEQ ID NO:4. gggagaggagaagaggaac(F)gu(F)gc(F)u(F)c(F)u(F)gc(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)gg c(F)gu(F)gc(F)agaggac(F)aggaau(F)gagga SEQ ID NO:12: три G-U пари основ замінені G-C парами основ в стовбурі на кінці і 11 нуклеотидів видалено з одноланцюгової частини на 3" кінці РНК представленої SEQ ID NO:8. 18 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 gggagaggagaagaggaac(F)gc(F)u(F)gc(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)gc (F)agc(F) SEQ ID NO:13: 11 нуклеотидів видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:12, і GGG додано до неї для транскрипції. gggagaggaac(F)gc(F)u(F)gc(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)gc(F)agc(F) SEQ ID NO:14: одна G-C пара основ і одна C-G пара основ видалена із стовбура на кінці РНК представленої SEQ ID NO:12. gggagaggagaagaggaac(F)gc(F)u(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)agc(F) SEQ ID NO:15: A36 і A37 видалено з частини петлі РНК представленої SEQ ID NO:12. gggagaggagaagaggaac(F)gc(F)u(F)gc(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagggc(F)ggc(F)gu(F)gc(F)a gc(F) SEQ ID NO:16: A23 видалено з внутрішньої петлі частини РНК представленої SEQ ID NO:12. gggagaggagaagaggaac(F)gc(F)u(F)gc(F)ac(F)gagggu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)gc(F) agc(F) SEQ ID NO:17: одна G-C пара основ і одна C-G пара основ видалена із стовбура на кінці РНК представленої SEQ ID NO:13. gggagaggaac(F)gc(F)u(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)agc(F) SEQ ID NO:18: 11 нуклеотидів видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:17, і GG додано до неї для транскрипції. gggc(F)u(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)agc(F) SEQ ID NO:19: одна C-G пара основ видалена із стовбурної частини на кінці РНК представленої SEQ ID NO:17. gggagaggaac(F)gu(F)ac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)ac(F) SEQ ID NO:20: одна C-G пара основ і одна U-A пара основ видалена із стовбурної частини на кінці РНК представленої SEQ ID NO:17. gggagaggaac(F)gac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)c(F) SEQ ID NO:20-1: одноланцюговій частині РНК представленої SEQ ID NO:20 була повністю модифікована OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)gac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc (F)gu(F)c(F) SEQ ID NO:20-2: перший стовбур в РНК представленій SEQ ID NO:20 був модифікований OMe. gggagaggaac(F)g(M)a(M)c(F)g(M)aggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)g(M)u(F)c(F) SEQ ID NO:20-3: другий стовбур в РНК представленій SEQ ID NO:20 був модифікований OMe. gggagaggaac(F)gac(F)gaggagu(F)ag(M)c(F)c(F)ggaaagaag(M)g(M)c(F)ggc(F)gu(F)c(F) SEQ ID NO:20-4: G в петльовій частині РНК представленій SEQ ID NO:20 замінений OMe. gggagaggaac(F)gac(F)gaggagu(F)agc(F)c(F)g(M)g(M)aaag(M)aaggc(F)ggc(F)gu(F)c(F) SEQ ID NO:20-5: A в петльовій частині РНК представленої SEQ ID NO:20-1 замінений OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)gac(F)ga(M)gga(M)gu(F)a(M)gc(F)c(F)ggaaagaagg c(F)ggc(F)gu(F)c(F) SEQ ID NO:20-6: G в петльовій частині РНК представленої SEQ ID NO:20-1 замінений OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)gac(F)gag(M)g(M)ag(M)u(F)agc(F)c(F)ggaaagaagg c(F)ggc(F)gu(F)c(F) SEQ ID NO:20-7: A в петльовій частині РНК представленої SEQ ID NO:20-1 був модифікований OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)gac(F)gaggagu(F)agc(F)c(F)gga(M)aa(M)gaaggc (F)ggc(F)gu(F)c(F) SEQ ID NO:20-8: A в петльовій частині РНК представленої SEQ ID NO:20-5 був модифікований OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)gac(F)ga(M)gga(M)gu(F)a(M)gc(F)c(F)gga(M)aa (M)gaaggc(F)ggc(F)gu(F)c(F) SEQ ID NO:20-9: перший стовбур в РНК представленій SEQ ID NO:20-5 був модифікований OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)g(M)a(M)c(F)ga(M)gga(M)gu(F)a(M)gc(F)c(F)ggaa agaaggc(F)ggc(F)g(M)u(F)c(F) SEQ ID NO:20-10: деякі частини РНК представленої SEQ ID NO:20-5 були модифіковані OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)gac(F)ga(M)gga(M)gu(F)a(M)gc(F)c(F)ggaaagaagg c(F)g(M)g(M)c(F)gu(F)c(F) SEQ ID NO:20-11: деякі частини РНК представленої SEQ ID NO:20-5 були модифіковані OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)g(M)a(M)c(F)ga(M)gga(M)gu(F)a(M)gc(F)c(F)gga (M)aa(M)gaaggc(F)g(M)g(M)c(F)g(M)u(F)c(F) 19 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO:20-12: деякі частини РНК представленої SEQ ID NO:20-5 були модифіковані OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)g(M)a(M)c(F)ga(M)gga(M)gu(F)a(M)gc(F)c(F)gga (M)aa(M)g(M)aaggc(F)ggc(F)g(M)u(F)c(F) SEQ ID NO:20-13: деякі частини РНК представленої SEQ ID NO:20-5 були модифіковані OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)c(F)g(M)a(M)c(F)ga(M)gga(M)gu(F)a(M)gc(F)c(F)gga (M)aa(M)gaag(M)gc(F)ggc(F)g(M)u(F)c(F) SEQ ID NO:21: одна G-C пара основ видалена із стовбурної частини з боку петлі РНК представленої SEQ ID NO:17. gggagaggaac(F)gc(F)u(F)ac(F)gaggagu(F)agc(F)ggaaagaagc(F)ggc(F)gu(F)agc(F) SEQ ID NO:22: 11 нуклеотидів видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:20, і два G додано для транскрипції. gggac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)c(F) SEQ ID NO:23: частина петлі замінена GAAA тетрапетлі в РНК представленій SEQ ID NO:20. gggagaggaac(F)gac(F)gaggagu(F)agc(F)c(F)gaaaggc(F)ggc(F)gu(F)c(F) SEQ ID NO:24: частина петлі замінена UUCG тетрапетлі в РНК представленій SEQ ID NO:20. gggagaggaac(F)gac(F)gaggagu(F)agc(F)c(F)u(F)u(F)c(F)gggc(F)ggc(F)gu(F)c(F) SEQ ID NO:25: частина внутрішньої петлі в РНК представленій SEQ ID NO:20 замінена внутрішньою петлею аптамеру представленого SEQ ID NO:2. gggagaggaac(F)gac(F)gagaac(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)c(F) SEQ ID NO:26: G18 внутрішньої петлі РНК представленої SEQ ID NO:20 був видалений. gggagaggaac(F)gac(F)gagagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)c(F) SEQ ID NO:27: A19 внутрішньої петлі РНК представленої SEQ ID NO:20 був видалений. gggagaggaac(F)gac(F)gagggu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)c(F) SEQ ID NO:28: два G були видалені з 5" кінця і друга пара основ A-U була змінена на G-C в РНК представленій SEQ ID NO:22. ggc(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gc(F)c(F) SEQ ID NO:29: два G були видалені з 5" кінця РНК представленої SEQ ID NO:22. gac(F)gaggagu(F)agc(F)c(F)ggaaagaaggc(F)ggc(F)gu(F)c(F) Досліджували інгібувальну активність міграції клітин аптамеру представленого SEQ ID NO:4 проти мідкайн. Методика експерименту була такою ж самою як та, що була описана вище для мідкайн людини. В результату експерименту, інгібувальна активність % цього аптамеру була 50 %. Це є еквівалентно приблизно 57 відносно інгібувальної активності цього аптамеру проти мідкайн людини взятого як 100; активність безсумнівно менша, порівняно з інгібувальною активністю проти мідкайн людини. Таким чином, було знайдено, що цей аптамер проявляє вище інгібувальну активність проти мідкайн людини. Як показано в Таблиці 3, аптамер представлений SEQ ID NO:4, який мав оригінальну довжину 77 нуклеотидів, може бути мініатюризований до 31 нуклеотидів, без суттєвого зменшення активності (SEQ ID NO:28, 29). Одержувана петля шпильки цього аптамеру не завжди є GGAAAGAA; аптамер зберігає активність навіть, коли петля шпильки була GAAA або UUCG тетрапетля (SEQ ID NO:23, 24). Навіть коли частина внутрішньої петлі замінена частиною внутрішньої петлі аптамеру представленого SEQ ID NO:2, активність зберігалась (SEQ ID NO:25). Навіть коли A19 був видалений, активність зберігалась, але коли G18 був видалений, активність зменшувалась суттєво (SEQ ID NO:26, 27). Між тим, було встановлено, що коли була видалена пара основ C-G стовбуру з боку петлі, вторинна структура значно змінювалась і інгібувальна активність втрачалась (SEQ ID NO:21). З викладеного вище, було встановлено, що 42-нуклеотидний аптамер представлений SEQ ID NO:20 (ФІГ. 8) зберігає активність навіть після замінення декількох нуклеотидів іншими нуклеотидами або видалення, за умови, що його основна структура значно не змінюється. [Приклад 7] Мініатюризація і стабілізація аптамеру представленого SEQ ID NO:5 Аптамер представлений SEQ ID NO:5 має довжину в 77 нуклеотидів і має 2" положення рибози піримідинового нуклеотиду заміщене фтором. Для можливості хімічного синтезу, для зменшення токсичності і для покращення стабільності в крові, проводили мініатюризацію і стабілізацію цього аптамеру. Операції по мініатюризації і стабілізації проводили на основі вторинної структури визначеною за допомогою MFOLD програми і оцінювали активність в експерименті по інгібуванню міграції клітин. В експерименті по інгібуванню міграції клітин, концентрація РНК була 100 нM або 500 нM. Оскільки в експериментальних результатах мають місце деякі помилки в залежності від стану клітин, в кожний експеримент включали попередньо досліджений зразок як позитивний контроль. Одержувані інгібувальні активності, коли концентрація РНК була 100 нM, показані в Таблиці 3-1. Інібувальні активності виражали як 20 UA 100847 C2 5 відносні значення з активністю аптамеру представленого SEQ ID NO:5 взятого як 100, для того щоб зрозуміти різниці в активностях серед змінених форм. Інгібувальна активність % аптамеру представленого SEQ ID NO:5 (значення одержане при відніманні кількості клітин, що рухаються, при додаванні аптамеру від 100, яка є кількістю клітин, що рухаються, без додавання аптамеру) була 76 %, коли концентрація РНК була 100 нM. Це є середнім значенням для 14 вимірювань. З концентрацією РНК зміненою на 500 нМ поводили аналогічний експеримент. Результати показані в Таблиці 4-2 (Таблиця 4-2-1, Таблиця 4-2-2). Активність виражали як відносні значення від активності аптамеру представленого SEQ ID NO:40 взятої як 100. Інгібувальна активність % аптамеру представленого SEQ ID NO:40 була 82 %. Це є середнє для 4 вимірювань. 10 Таблиця 4-1 Мідкайн SEQ ID NO 5 30 31 32 33 34 35 36 36-1 37 38 39 40 40-1 40-2 40-3 41 42 43 15 активність 100 44 94 100 40 0 90 91 60 0 0 52 98 80 31 65 97 110 42 Плеіотрофін Кількість активність вимірювань 13 6 17 4 11 4 5 4 0 2 27 2 0 2 0 2 8.1 2 8.7 2 Кількість вимірювань 14 2 6 6 6 2 4 4 4 2 2 2 4 2 2 2 4 4 2 довжина (нт) 77 71 67 57 61 46 51 53 53 49 57 45 49 49 49 49 52 52 52 Концентрація РНК була 100 нM. Активності виражали як відносні значення стосовно інгібувальної активності РНК представленої SEQ ID NO:5 проти мідкайн взятої як 100. Інгібувальна активність % РНК представленої SEQ ID NO:5 проти мідкайн була 76 %. Це значення є середнім для 14 вимірювань. Таблиця 4-2-1 SEQ ID NO 40 40-1 40-2 40-3 44 45 45-1 45-2 45-345-4 45-4-1 45-4-1-1 46 47 48 49 Активність 100 99 88 100 100 100 100 100 56 100 98* 85* 92 84 60 69 Кількість вимірювань 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 21 Довжина (нт) 49 49 49 49 47 45 45 45 45 45 45 45 49 48 48 48 UA 100847 C2 Продовження таблиці 4-2-1 SEQ ID NO 50 51 52 53 54 55 56 57 58 59 60 Активність 91 100 100 100 100 100 100 100 100 53 70 Кількість вимірювань 2 2 2 2 2 2 2 2 2 2 2 Довжина (нт) 43 51 51 51 45 43 43 43 43 29 35 Таблиця 4-2-2 SEQ ID NO 61 61-1 61-2 61-3 61-4 61-5 61-6 61-7 61-8 61-9 62 63 64 65 66 67 68 69 70 тРНК Тромбін-S HIV-S 5 10 15 Активність 100 45* 55* 80 86 40 57 46 54 39 44 97 55* 0 51 110 72 60 110 28 0 48 Кількість вимірювань 2 2 2 2 4 4 2 2 4 2 2 2 2 2 2 2 2 2 2 2 2 2 Довжина (нт) 39 39 39 39 39 39 39 39 39 39 39 45 37 39 38 38 39 39 39 Концентрація РНК була 500 нM. Активності виражали як відносні значення стосовно інгібувальної активності РНК представленої SEQ ID NO:40 проти мідкайн взятої як 100. Інгібувальна активність % РНК представленої SEQ ID NO:40 проти мідкайн була 82 %. Це значення є середнім для 4 вимірювань. *: попередньо визначене значення Змінені частини в змінених формах (SEQ ID NO:30-70) представлені нижче. SEQ ID NO:30: 6 нуклеотидів видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:5, і один G додано для транскрипції. ggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)agu(F)au (F)aagau(F)agaggac(F)aggaau(F)gagga SEQ ID NO:31: 10 нуклеотидів видалено з одноланцюгової частини на 3" кінці РНК представленої SEQ ID NO:5. gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)ag u(F)au(F)aagau(F)agaggac(F)a SEQ ID NO:32: 20 нуклеотидів видалено з одноланцюгової частини на 3" кінці РНК представленої SEQ ID NO:5. 22 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)ag u(F)au(F)aag SEQ ID NO:33: 6 нуклеотидів видалено з одноланцюгової частини на 5" кінці і 10 нуклеотидів видалено з одноланцюгової частини на 3" кінці РНК представленої SEQ ID NO:5. ggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)agu(F)au (F)aagau(F)agaggac(F)a SEQ ID NO:34: 12 нуклеотидів видалено з одноланцюгової частини на 5" кінці і 20 нуклеотидів видалено з одноланцюгової частини на 3" кінці РНК представленої SEQ ID NO:5. ggaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)agu(F)au(F)aag SEQ ID NO:35: 6 нуклеотидів видалено з одноланцюгової частини на 3" кінці РНК представленої SEQ ID NO:32. gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)ag SEQ ID NO:36: дві пари основ видалено із стовбура на кінці РНК представленої SEQ ID NO:32. gggagaggagaagaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F)agu(F)au(F)a ag SEQ ID NO:36-1: одноланцюговій частині на 5" кінці РНК представленої SEQ ID NO:36 була повністю модифікована OMe. g(M)g(M)g(M)a(M)g(M)a(M)g(M)g(M)a(M)g(M)a(M)a(M)g(M)a(M)g(M)g(M)a(M)a(M)gu(F)gc(F)ac(F)ag gggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F)agu(F)au(F)aag SEQ ID NO:37: чотири пари основи видалено із стовбура на кінці РНК представленої SEQ ID NO:32. gggagaggagaagaggaagc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)agu(F)au(F)aag SEQ ID NO:38: одноланцюговій частині на 5" кінці РНК представленої SEQ ID NO:32 була замінена на полі U, де U представляє фторовану по 2’-положенню рибозу. gggu(F)u(F)u(F)u(F)u(F)u(F)u(F)u(F)u(F)u(F)u(F)u(F)u(F)u(F)u(F)gu(F)gu(F)gc(F)ac(F)aggggu(F)u(F) ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)agu(F)au(F)aag SEQ ID NO:39: 6 нуклеотидів видалено з одноланцюгової частини на 3" кінці і одна пара основ була видалена із стовбура на кінці РНК представленої SEQ ID NO:36. gggagaggagaagaggaaggc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)c(F)ag SEQ ID NO:40: 8 нуклеотидів видалено з одноланцюгової частини на 3" кінці РНК представленої SEQ ID NO:36. gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F) SEQ ID NO:40-1: поліетиленгліколь з молекулярною вагою 2000 додавали до 5" кінця через C12 лінкер і idT додавали до 3" кінця РНК представленої SEQ ID NO:40. PEG2000-C12gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F)idT SEQ ID NO:40-2: Всі G в одноланцюговій частині на 5" кінці РНК представленої SEQ ID NO:40 було модифіковано OMe. g(M)g(M)g(M)ag(M)ag(M)g(M)ag(M)aag(M)ag(M)g(M)aagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu (F)c(F)gggu(F)gc(F)au(F)ac(F) SEQ ID NO:40-3: Всі A в одноланцюговій частині на 5" кінці РНК представленої SEQ ID NO:40 було повністю модифіковано OMe. ggga(M)ga(M)gga(M)ga(M)a(M)ga(M)gga(M)a(M)gu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F) gggu(F)gc(F)au(F)ac(F) SEQ ID NO:41: G5 був видалений з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:36. gggaaggagaagaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F)agu(F)au(F)aa g SEQ ID NO:42: A11 був видалений з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:36. gggagaggagagaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F)agu(F)au(F)aa g SEQ ID NO:43: A17 був видалений з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:36. gggagaggagaagaggagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F)agu(F)au(F)aa g SEQ ID NO:44: одна пара основ була видалене із стовбура на кінці РНК представленої SEQ ID NO:40. gggagaggagaagaggaagu(F)u(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)aac(F) 23 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO:45: дві пари основ видалено із стовбура на кінці РНК представленої SEQ ID NO:40. gggagaggagaagaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:45-1: поліетиленгліколь з молекулярною вагою 2000 додавали до 5" кінця через C12 лінкер і idT додавали до 3" кінця РНК представленої SEQ ID NO:45. PEG2000-C12ggga(M)ga(M)gga(M)ga(M)a(M)ga(M)gga(M)a(M)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu (F)gc(F)ac(F)-idT SEQ ID NO:45-2: всі A в одноланцюговій частині і всі G в петльовій частині на5" кінці РНК представленої SEQ ID NO:45 були повністю модифіковані OMe. ggga(M)ga(M)gga(M)ga(M)a(M)ga(M)gga(M)a(M)gu(F)gc(F)ac(F)agggg(M)u(F)u(F)g(M)g(M)u(F)g(M) u(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:45-3: всі A в одноланцюговій частині і всі A і G у внутрішній петлі на 5" кінці РНК представленої SEQ ID NO:45 були повністю модифіковані OMe. ggga(M)ga(M)gga(M)ga(M)a(M)ga(M)gga(M)a(M)gu(F)gc(F)ac(F)a(M)g(M)gggu(F)u(F)ggu(F)gu(F)c (F)g(M)g(M)gu(F)gc(F)ac(F) SEQ ID NO:45-4: всі A в одноланцюговій частині на 5" кінці і всі A і G в стовбурній частині на кінці РНК представленої SEQ ID NO:45 були повністю модифіковані OMe. ggga(M)ga(M)gga(M)ga(M)a(M)ga(M)gga(M)a(M)gu(F)g(M)c(F)a(M)c(F)aggggu(F)u(F)ggu(F)gu(F)c (F)gggu(F)g(M)c(F)a(M)c(F) SEQ ID NO:45-4-1: всі G в петльовій частині РНК представленої SEQ ID NO:45-4 були повністю модифіковані OMe. ggga(M)ga(M)gga(M)ga(M)a(M)ga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)u(F)u(F)g(M) g(M)u(F)g(M)u(F)c(F)gggu(F)g(M)c(F)a(M)c(F) SEQ ID NO:45-4-1-1: C24 РНК представленої SEQ ID NO:45-4-1 було змінено на РНК нуклеотид. ggga(M)ga(M)gga(M)ga(M)a(M)ga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)caggg(M)g(M)u(F)u(F)g(M)g (M)u(F)g(M)u(F)c(F)gggu(F)g(M)c(F)a(M)c(F) SEQ ID NO:46: пара основ A-U замінена парою основ G-C в стовбурі на кінці РНК представленої SEQ ID NO:40. gggagaggagaagaggaagu(F)gc(F)gc(F)gc(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggc(F)gc(F)gu(F)ac(F) SEQ ID NO:47: U32 видалено з петлі РНК представленої SEQ ID NO:40. gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)ggu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F) SEQ ID NO:48: G34 видалено з петлі РНК представленої SEQ ID NO:40. gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)gu(F)gu(F)c(F)gggu(F)gc(F)au(F)ac(F) SEQ ID NO:49: U36 видалено з петлі РНК представленої SEQ ID NO:40. gggagaggagaagaggaagu(F)gu(F)gc(F)ac(F)aggggu(F)u(F)gggu(F)c(F)gggu(F)gc(F)au(F)ac(F) SEQ ID NO:50: G4 і G10 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:45. gggaaggaaagaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:51: G5 і A11 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:36. gggaaggagagaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F)agu(F)au(F)aag SEQ ID NO:52: G1 і G5 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:36. ggaaggagaagaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F)agu(F)au(F)aag SEQ ID NO:53: G5 і G10 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:36. gggaaggaaagaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F)agu(F)au(F)aag SEQ ID NO:54: всі G було модифіковано F і всі A було модифіковано OMe в одноланцюговій частині на 5" кінці РНК представленої SEQ ID NO:45. g(F)g(F)g(F)a(M)g(F)a(M)g(F)g(F)a(M)g(F)a(M)a(M)g(F)a(M)g(F)g(F)a(M)a(M)gu(F)gc(F)ac(F)aggggu (F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:55: A11 і A12 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:45. gggagaggaggaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:56: G13 і A14 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:45. gggagaggagaaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:57: G15 і G16 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:45. gggagaggagaagaaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) 24 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO:58: A17 і A18 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:45. gggagaggagaagagggu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:59: 18 нуклеотидів видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:45, і два G було додано для транскрипції. gggu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:60: одноланцюгова частина на 5" кінці РНК представленої SEQ ID NO:45 була замінена на GGGAAGGA. gggaaggagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:61: G5, G10, A11, A12, G13 і A14 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:45. gggaaggaggaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:61-1: G був модифікований ДНК нуклеотидом і A був модифікований OMe в одноланцюговій частині, і G в петльовій частині був модифікований OMe на 5" кінці РНК представленої SEQ ID NO:61. g(H)g(H)g(H)a(M)a(M)g(H)g(H)a(M)g(H)g(H)a(M)a(M)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)g ggu(F)gc(F)ac(F) SEQ ID NO:61-2: G і A в одноланцюговій частині і G в петльовій частині на 5" кінці РНК представленої SEQ ID NO:61 були модифіковані OMe. g(M)g(M)g(M)a(M)a(M)g(M)g(M)a(M)g(M)g(M)a(M)a(M)gu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c (F)gggu(F)gc(F)ac(F) SEQ ID NO:61-3: декілька частин РНК представленої SEQ ID NO:61 були модифіковані F і OMe. g(F)g(F)g(F)a(M)a(M)g(F)g(F)a(M)g(F)g(F)a(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)a(M)g(F)g(M)g(M)g(M) u(F)u(F)g(M)g(M)u(F)g(M)u(F)c(F)g(F)g(F)g(M)u(F)g(M)c(F)a(M)c(F) SEQ ID NO:61-4: декілька частин РНК представленої SEQ ID NO:61 були модифіковані OMe. ggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)u(F)u(F)g(M)g(M)u(F)g(M)u(F) c(F)gggu(F)g(M)c(F)a(M)c(F) SEQ ID NO:61-5: розгалужений 40 кДa поліетиленглікольний ланцюг додавали до 5" кінця і idT додавали до 3" кінця РНК представленої SEQ ID NO:61-4. PEG40kggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)u(F)u(F)g(M)g(M)u(F)g(M)u(F) c(F)gggu(F)g(M)c(F)a(M)c(F)-idT SEQ ID NO:61-6: 30 кДa поліетиленглікольний ланцюг додавали до обох кінців РНК представленої SEQ ID NO:61-5. PEG30kggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)u(F)u(F)g(M)g(M)u(F)g(M)u(F) c(F)gggu(F)g(M)c(F)a(M)c(F)-PEG30k SEQ ID NO:61-7: декілька частин РНК представленої SEQ ID NO:61 були модифіковані OMe. ggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)u(F)u(F)g(M)g(M)u(F)g(M)u(F) c(F)g(M)g(M)gu(F)g(M)c(F)a(M)c(F) SEQ ID NO:61-8: декілька частин РНК представленої SEQ ID NO:61 були модифіковані OMe. ggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)a(M)g(M)gg(M)g(M)u(F)u(F)g(M)g(M)u(F)g (M)u(F)c(F)gggu(F)g(M)c(F)a(M)c(F) SEQ ID NO:61-9: декілька частин РНК представленої SEQ ID NO:61 були модифіковані OMe і 2 кДa поліетиленгліколь додавали до 5" кінця. PEG2000ggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)a(M)gg(M)g(M)g(M)u(F)u(F)g(M)g(M)u(F)g (M)u(F)c(F)ggg(M)u(F)g(M)c(F)a(M)c(F) SEQ ID NO:62: G13, A14, G15, G16, A17 і A18 видалено з одноланцюгової частини на 5" кінці РНК представленої SEQ ID NO:45. gggagaggagaagu(F)gc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:63: A25 і G26 в РНК представленій SEQ ID NO:45 були змінені на C роблячі внутрішню петлю як стовбур. gggagaggagaagaggaagu(F)gc(F)ac(F)c(F)c(F)gggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:64: U-A видалено із стовбура на 5" кінці РНК представленої SEQ ID NO:61. gggaaggaggaaggc(F)ac(F)aggggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)c(F) SEQ ID NO:65: A19 і G20 у внітрішній петлі РНК представленої SEQ ID NO:61 замінені C. gggaaggaggaagu(F)gc(F)ac(F)c(F)c(F)gggu(F)u(F)ggu(F)gu(F)c(F)gggu(F)gc(F)ac(F) SEQ ID NO:66: декілька частин РНК представленої SEQ ID NO:61 були модифіковані OMe і G був модифікований F. 25 UA 100847 C2 5 10 15 20 25 30 35 40 45 50 55 60 g(F)g(F)a(M)a(M)g(F)g(F)a(M)g(F)g(F)a(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)a(M)gg(M)g(M)g(M)u(F)u (F)g(M)g(M)u(F)g(M)u(F)c(F)g(F)g(F)g(M)u(F)g(M)c(F)a(M)c(F) SEQ ID NO:67: модифікація РНК представленої SEQ ID NO:66 була змінена. gga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)u(F)u(F)g(M)g(M)u(F)g(M)u(F)c (F)gggu(F)g(M)c(F)a(M)c(F) SEQ ID NO:68: декілька частин РНК представленої SEQ ID NO:61 були модифіковані OMe і U28 замінена A(M). ggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)u(F)u(F)g(M)g(M)a(M)g(M)u (F)c(F)gggu(F)g(M)c(F)a(M)c(F) SEQ ID NO:69: декілька частин РНК представленої SEQ ID NO:61 були модифіковані OMe і U25 замінена A(M). ggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)u(F)a(M)g(M)g(M)u(F)g(M)u (F)c(F)gggu(F)g(M)c(F)a(M)c(F) SEQ ID NO:70: декілька частин РНК представленої SEQ ID NO:61 були модифіковані OMe і U24 замінена A(M). ggga(M)a(M)gga(M)gga(M)a(M)g(M)u(F)g(M)c(F)a(M)c(F)aggg(M)g(M)a(M)u(F)g(M)g(M)u(F)g(M)u (F)c(F)gggu(F)g(M)c(F)a(M)c(F) Тут, n(M) означає рибозу модифіковану OMe по 2'-положенню, n(F) означає рибозу модифіковану F по 2’-положенню, n(H) означає деоксирибозу, PEG2000 означає 2000-Да поліетиленгліколь, PEG40k означає розгалужений 40 кДa поліетиленгліколь, PEG30k означає 30 кДa поліетиленгліколь, C12 означає C12 лінкер і idT означає інвертований dT. Проводили експеримент по інгібуванню міграції клітин для плеіотрофіну використовуючи аптамер представлений SEQ ID NO:5 і його змінені форми. Експериментальний спосіб був таикм як описано вище, за винятком того, що плеіотрофін використовували замість мідкайн. Концентрація аптамеру була 100 нM і інгібувальну активність аптамеру представленого SEQ ID NO:5 проти мідкайн приймали за 100. В результаті експерименту, інгібувальна активність стосовно плеіотрофіну була 13 (Таблиця 4-1). Це є середнім значенням для 6 вимірювань. Для змінених форм, не спостерігалось визначна інгібувальна активність стосовно плеіотрофіну. Досліджували клітиноміграційну інгібувальну активність аптамеру представленого SEQ ID NO:35 стосовно мідкайнм миші. Експеримент проводили таким же самим чином як в описаному вище експерименті використовуючи мідкайн людини. В результаті експерименту, Інгібувальна активність % цього аптамеру була 84 %. Таким чином, було встановлено, що цей аптамер має активність проти мідкайн миші еквівалентну інгібувальній активності проти мідкайн людини. Використовуючи тРНК (що виготовляється Sigma), Тромбін-S і HIV-S, які майже специфічно не зв'язуються з мідкайн, замість аптамерів, проводили експеримент по інгібуванню міграції клітин для мідкайн людини як описано вище. Тут, Тромбін-S є аптамером ДНК t'ggttggtgtggttgg'taaaaaaaaaaaaaaaa (SEQ ID NO:74), і HIV-S є аптамером ДНК g'tggtgggtgggtggg't (SEQ ID NO:75). Кожен “'” представляє фосторотіоатний зв'язок. Фосфоротіоатні зв'язки вводили для того щоб підвищити стікість до нуклеази. Ці РНК використовували в концентрації 500 нM. Коли інгібувальну активність аптамеру представленого SEQ ID NO:45 проти мідкайн людини прийняти за 100, визначена активність тРНК була 28, Тромбін-S була 0 і HIV-S була 48. Тому, було припущено, що аптамери одержані в представленому дослідженні можуть специфічно зв'язувати важливі сайти пов'язані з клітиноміграційною активністю мідкайн. Аптамер представлений SEQ ID NO:5, який мав довжину 77 нуклеотидів, може бути мініатюризований до 39 нуклеотидів, без значного зменшення активності (SEQ ID NO:61). Одноланцюгова частина на 5' кінці не може бути повністю видалена; це обумовлено тим, що ця одноланцюгова частина втягнута в утворення стеричної структури аптамеру. Хоча G цієї одноланцюгової частини може бути F-модифікованим нуклеотидом, було встановлено, що активність зменшується у випадку OMe-модифікації нуклеотидів (SEQ ID NO:40-2, 54, 61-2). Між тим, навіть коли A був OMe-модифікованим нуклеотидом, активність залишається незмінною (SEQ ID NO:40-3). Навіть, коли декілька пар основ A-U замінені парою основ G-C в стовбурі на 5" кінці, це не так сильно впивало на активність (SEQ ID NO:46). Навіть коли A і G цього стовбуру замінені OMe-модифікованим нуклеотидом, активність зберігалась (SEQ ID NO:45-4). Навіть коли частина внутрішньої петлі замінена стовбурною структурою G-C використовуючи нуклеотидне заміщення, активність незмінювалась (SEQ ID NO:63); однак, коли одноланцюгова частина вкорочувалась, активність зменшувалась (SEQ ID NO:59). Коли G і A внутрішньої петлі замінювали OMe-модифікованим нуклеотидом, активність зменшувалась (SEQ ID NO:45-3). Коли частину петлі позбавляли 1 нуклеотиду, активність зменшувалась (SEQ ID NO:47-49). Навіть коли G частини петлі замінювали OMe-модифікованим нуклеотидом, активність зберігалась (SEQ ID NO:45-2). 26 UA 100847 C2 5 10 15 20 25 30 35 40 45 З викладеного вище, було встановлено, що активність цього одержаного аптамеру не змінюється навіть при заміщенні декількох основ або зміні модифікації. Також було знайдено, що цей аптамер специфічно зв'язує мідкайн інгібуючи клітиноміграційну активність. Між тим, було встановлено, що цей аптамер також зв'язує протеїн родини - плеіотрофін, але не проявляє значної клітиноміграційної інгібувальної активності. [Приклад 8] Інгібіторна дія аптамеру на адгезію органу використовуючи мишачу модель постопераційної адгезії Відкривають живіт нормальної миші і очеревину розсікають хірургічним ножем і т.і, після чого внутрішні органи сушать і потім лапаротомізовану частину зшивають; протягом 5 днів після цього спостерігають адгезію органу (Am J Obstet Gynecol 179, 438-443, 1998). Повідомлялось, що коли мідкайн нокаут мишей обробляли використовуючи цей спосіб для провокування постопераційної адгезії органу, постопераційна адгезія органу не відбувалась (Biochemical and Biophysical Research Communication, 317, 108-113, 2004). Тому, використовуючи мишачу модель постопераційної адгезії, досліджували попереджувальну дію аптамеру представленого SEQ ID NO:76 на постопераційну адгезію органу. При анестезії, проводили лапаротомію мишей C57BL/6 (самиці) віком 8 тижнів, після чого очеревину витирали гігроскопічною ватою. Після цього, робили приблизно 2 см бороздки в очеревині в п'яти положеннях використовуючи ножиці. Після гемостазу використовуючи гігроскопічну вату протягом 10 хвилин, рану зашивали використовуючи шовну голку і нитку. Після пробудження, інтраперітонеально вводили аптамер представлений SEQ ID NO:76 в дозі 1 мг/25 мл/кг. Для контрольної групи, інтраперітонеально вводили салін, що містить 1 мM MgCl2 в дозі 25 мл/кг таким же самим чином. Введення мало місце один раз на день, загалом три рази, постопераційний день 0, день 1 і день 2, після чого тварин лапаротомізували під анестезією на 3 день і оцінювали ступінь адгезії органу до рани використовуючи приведені далі критерії. 0: відсутня адгезія 1: адгезія, легка адгезія (легка) 2: адгезія, помірна адгезія (помірна) 3: адгезія, сильна адгезія, що не може бути відокремлена навіть при відтягуванні органу від приклеєної частини (сильна) Результати показують як середні і стандартні похибки оцінок ступеня адгезії для 9-10 тварин в кожній групі (Таблиця 5). Як результат, ступінь був 3 у всіх тварин в групі, що одержувала фізіологічний салін, в той час як середній ступінь групи, що одержувала аптамер представлений SEQ ID NO:76 був 2,4. В групі, що одержувала аптамер представлений SEQ ID NO:76, які порівнювали з групою, що одержувала фізіологічний салін, спостерігалась статистично значущі відмінності (p
ДивитисяДодаткова інформація
Назва патенту англійськоюAptamer against midkain and its using
Автори англійськоюMiyakawa, Shin, Fujiwara, Masatoshi, Nakamura, Yoshikazu, Matsui, Takashi, Sakuma, Sadatochi
Назва патенту російськоюАптамер против мидкайна и его применение
Автори російськоюМияква Шин, Фудживара Масатоши, Накамура Йошиказу, Мацуи Такаши, Сакума Садатоши
МПК / Мітки
МПК: A61P 35/00, G01N 33/53, G01N 33/566, A61P 43/00, C12N 15/09, A61K 38/03, A61P 9/00, A61K 31/7088
Мітки: застосування, аптамер, мідкайну
Код посилання
<a href="https://ua.patents.su/55-100847-aptamer-proti-midkajjnu-i-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Аптамер проти мідкайну і його застосування</a>
Попередній патент: Сполуки та композиція як інгібітори протеїнкінази
Наступний патент: Спосіб зарядки електрохімічного конденсатора з подвійним електричним шаром (варіанти)
Випадковий патент: Спосіб біологічного захисту багаторічних дерев'янистих насаджень від американського білого метелика (hyphantria cunea druru.)