Сполуки та композиція як інгібітори протеїнкінази
Номер патенту: 100846
Опубліковано: 11.02.2013
Автори: Чен Бей, Джіанг Тао, Марсіл'є Томас Х., Джін Юнхо, Уно Тетсуо, Мішелі П'єр-Ів, Пей Уей, Лу Уеншуо
Формула / Реферат
1. Сполука, що має Формулу (2):
 , (2)
, (2)
або її фармацевтично прийнятні солі,
у якій
R1 являє собою атом галогену або С1-6алкіл;
R2 являє собою Н;
R3 являє собою (CR2)0-2SO2R12, (CR2)0-2SO2NRR12, (CR2)0-2C(O)O0-1R12, (CR2)0-2CONRR12, CO2NH2 або ціаногрупу;
R4 являєсобою С1-6алкіл, С2-6алкеніл або С2-6алкініл, OR12, NR(R12), галогрупу, нітрогрупу, SO2R12, (CR2)рR13 або X; або R4 являє собою Н;
R6 являє собою ізопропокси або метоксигрупу;
один з R8 та R9 являє собою (CR2)qY та інший являє собою С1-6алкіл, ціаногрупу, C(O)O0-1R12, CONR(R12) або CONR(CR2)рNR(R12);
X являє собою (CR2)qY, ціаногрупу, C(O)O0-1R12, CONR(R12), CONR(CR2)рNR(R12), CONR(CR2)pOR12,CONR(CR2)pSR12, CONR(CR2)рS(O)1-2R12 або (CR2)1-6NR(CR2)pOR12;
Y являє собою піролідиніл, піперидиніл або азетидиніл, кожен з яких прикріплений до фенільного кільця через атом вуглецю;
R12 та R13 незалежно являють собою 3-7-членне насичене або частково ненасичене карбоциклічне кільце або 5-7-членне гетероциклічне кільце, що включає N, О та/або S; арил або гетероарил; або R12 являє собою Н або С1-6алкіл;
R являє собою Н або С1-6алкіл; та
n приймає значення 0-1;
р приймає значення 0-4; та
q приймає значення 0.
2. Сполука за п. 1, у якій R3 являє собою SO2R12, SO2NH2, SO2NRR12, CO2NH2, CONRR12, C(O)O0-1R12, або ціаногрупу; та
R12 являє собою С1-6алкіл, С3-7циклоалкіл, С3-7циклоалкеніл, пiролідиніл, піперазиніл, піперидиніл або морфолiніл.
3. Сполука за п. 1, у якій один з R8 та R9 являє собою (CR2)qY та інший являє собою С1-6алкіл; та n приймає значення 0.
4. Сполука за п. 1, яка вибрана з групи, що включає такі як:
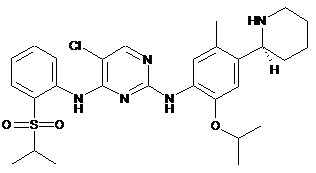
(S)-5-хлор-N2-(2-ізопропокси-5-метил-4-(піперидин-2-іл)феніл)-N4-(2-(ізопропілсульфоніл)феніл)піримідин-2,4-діамін;
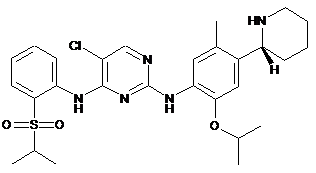
(R)-5-xлop-N2-(2-iзoпpoпoкcи-5-мeтил-4-(пiпepидин-2-iл)фeнiл)-N4-(2-(ізопропілсульфоніл)феніл)піримідин-2,4-діамін;
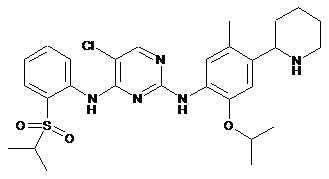
5-хлор-N2-(2-ізопропокси-5-метил-4-(піперидин-2-іл)феніл)-N4-(2-(ізопропілсульфоніл)феніл)піримідин-2,4-діамін;
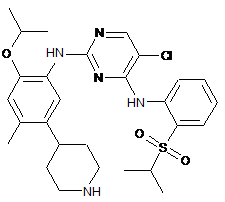
5-хлор-N2-(2-ізопропокси-4-метил-5-(піперидин-4-іл)феніл)-N4-(2-(ізопропілсульфоніл)феніл)піримідин-2,4-діамін;
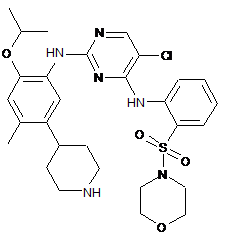
5-хлор-N2-(2-ізопропокси-4-метил-5-(піперидин-4-іл)феніл)-N4-(2-(морфоліносульфонамідо)феніл)піримідин-2,4-діамін;
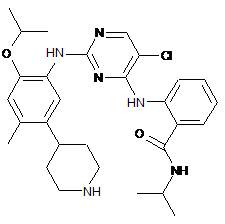
2-(2-(2-ізопропокси-4-метил-5-(піперидин-4-іл)феніламіно)-5-хлорпіримідин-4-іламіно)-N-ізопропілбензамід;
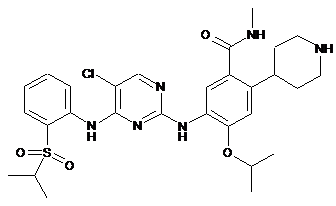
5-(4-(2-(ізопропілсульфоніл)феніламіно)-5-хлорпіримідин-2-іламіно)-4-ізопропокси-N-метил-2-(піперидин-4-іл)бензамід;
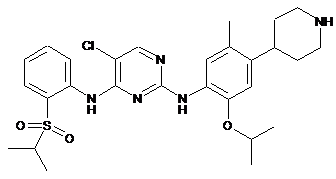
5-хлор-N2-(2-ізопропокси-5-метил-4-(піперидин-4-іл)феніл)-N4-[2-(пропан-2-сульфоніл)-феніл]-піримідин-2,4-діамін та
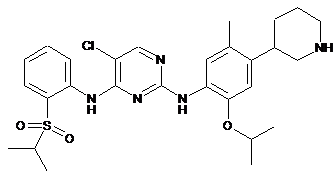
5-хлор-N2-(2-ізопропокси-5-метил-4-(піперидин-3-іл)феніл)-N4-(2-(ізопропілсульфоніл)феніл)піримідин-2,4-діамін
або її фармацевтично прийнятні солі.
5. Сполука за п. 1, де сполука являє собою 5-хлор-N2-(2-ізопропокси-5-метил-4-(піперидин-4-іл)феніл)-N4-[2-(пропан-2-сульфоніл)-феніл]-піримідин-2,4-діамін або її фармацевтично прийнятні солі.
6. Сполука за п. 1, де сполука являє собою 2-(2-(2-ізопропокси-4-метил-5-(піперидин-4-іл)феніламіно)-5-хлорпіримідин-4-іламіно)-N-ізопропілбензамід або її фармацевтично прийнятні солі.
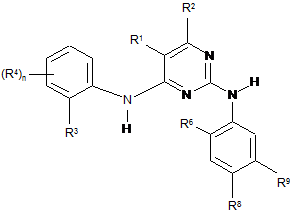
7. Сполука, що має Формулу (1):
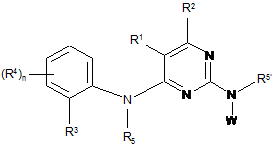 , (1)
, (1)
або її фармацевтично прийнятні солі,
у якій
W являє собою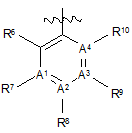 ;
;
А1 та А4 незалежно являють собою С;
кожен з А2 та А3 являє собою С;
R1 являє собою атом галогену або С1-6алкіл;
R2 являє собою Н;
R3 являє собою (CR2)0-2SO2R12, (CR2)0-2SО2NRR12, (CR2)0-2CO1-2R12, (CR2)0-2CONRR12,
CO2NH2 або ціаногрупу;
R4 являє собою Н, С1-6алкіл, С2-6алкеніл або С2-6алкініл, OR12, NR(R12), галогрупу, нітрогрупу, SO2R12, (CR2)рR13 або X;
R5, R5', R7 та R10 являють собою Н;
R6 являє собою С1-6алкіл, С2-6алкеніл або С2-6алкініл, OR12, NR(R12), галогрупу, нітрогрупу, SO2R12, (CR2)рR13 або X;
R8 та R9 незалежно являють собою С1-6алкіл, С2-6алкеніл, С2-6алкініл, галогрупу або X; та за умови, що один з R8 та R9 являє собою X;
R являє собою Н або С1-6алкіл;
X являє собою (CR2)qY;
Y являє собою піперидиніл, незаміщений або заміщений за допомогою С1-6алкілу, гідроксилС1-С8алкіл, С1-С8алкоксіС1-С8алкіл або 5-12-членне гетероциклічне кільце, що містить N, Ота/або S; та де Y приєднаний до А2 або А3 або обох через атом вуглецю зазначеного піперидинілу, якщо q в (CR2)qY являє собою 0;
R12 та R13 незалежно являють собою 3-7-членне насичене або частково ненасичене карбоциклічне кільце або 5-7-членне гетероциклічне кільце, що включає N, О та/або S; арил або гетероарил; або R12 являє собою Н, С1-6алкіл;
р приймає значення 0-4; та
n та q приймають значення 0.
8. Сполука за п. 7, у якій R3 являє собою SO2R12, SO2NH2, SO2NRR12, CO2NH2, CONRR12, CO1-2R12 або ціаногрупу; та
R12 являє собою С1-6алкіл, С3-7циклоалкіл, С3-7циклоалкеніл, піролідиніл, піперазиніл, піперидиніл або морфолініл.
9. Сполука за п. 7, у якій R6 являє собою галогрупу або OR12, де R12 являє собою С1-6алкіл.
10. Сполука за п. 7, яка вибрана з групи, що включає такі як:
1
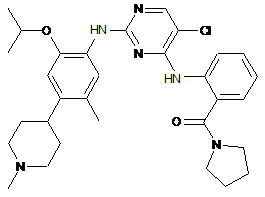
(2-(5-хлор-2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)піримідин-4-іламіно)феніл)(піролідин-1-іл)метанон
2
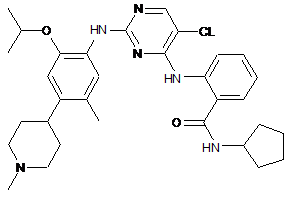
2-(5-хлор-2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)піримідин-4-іламіно)-N-циклопентилбензамід
7
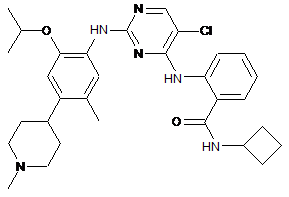
2-(5-хлор-2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)піримідин-4-іламіно)-N-циклобутилбензамід
13
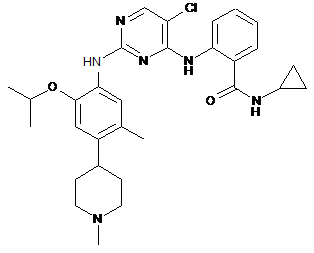
2-(5-хлор-2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)піримідин-4-іламіно)-N-циклопропілбензамід
14
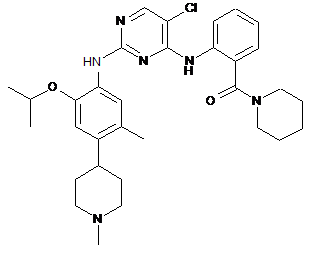
(2-(5-хлор-2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)піримідин-4-іламіно)феніл)(піперидин-1-іл)метанон
67
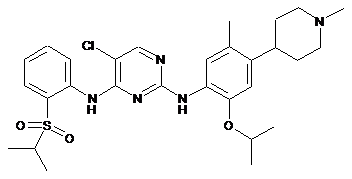
5-хлор-N2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніл)-N4-[2-(пропан-2-сульфоніл)феніл]-піримідин-2,4-діамін
69

5-хлор-N2-(2-ізопропокси-5-метил-4-(1-(1-метилпіперидин-4-іл)піперидин-4-іл)феніл)-N4-(2-(ізопропілсульфоніл)феніл)піримідин-2,4-діамін
71
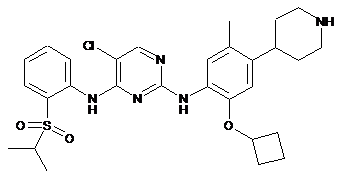
5-хлор-N2-(2-циклобутокси-5-метил-4-(піперидин-4-іл)феніл)-N4-(2-(ізопропілсульфоніл)феніл)піримідин-2,4-діамін
72
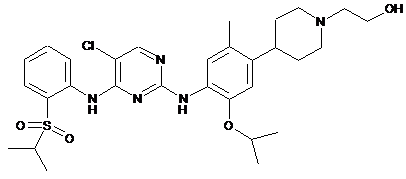
2-[4-(4-{5-хлор-4-[2-(пропан-2-сульфоніл)-феніламіно]-піримідин-2-іламіно}-5-ізопропокси-2-метилфеніл)-піперидин-1-іл]-етанол
73
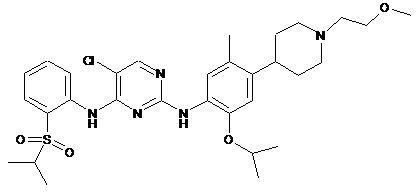
5-хлор-N2-(2-ізопропокси-4-(1-(2-метоксіетил)піперидин-4-іл)-5-метилфеніл)-N4-(2-(ізопропілсульфоніл)феніл)піримідин-2,4-діамін
74

N2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніл)-N4-(2-(ізопропілсульфоніл)феніл)-5-метилпіримідин-2,4-діамін
75
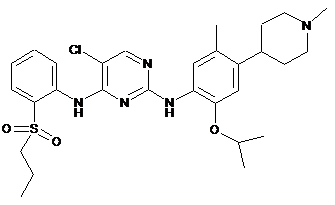
5-хлор-N2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніл)-N4-(2-(пропілсульфоніл)феніл)піримідин-2,4-діамін
76

2-(5-хлор-2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)піримідин-4-іламіно)-N,N-диметилбензолсульфонамід
77
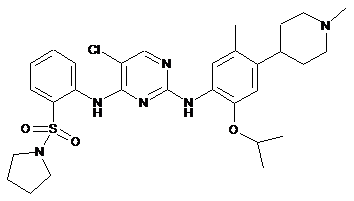
5-хлор-N2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніл)-N4-(2-(піролідин-1-ілсульфоніл)феніл)піримідин-2,4-діамін
78
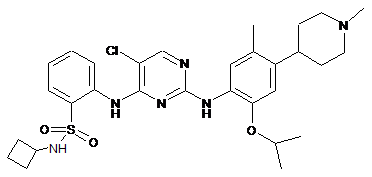
5-хлор-N4-(2-(циклобутиламіносульфоніл)феніл)-N2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніл)піримідин-2,4-діамін
79
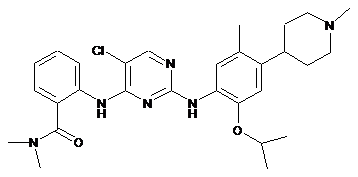
2-(2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)-5-хлорпіримідин-4-іламіно)-N,N-диметилбензамід
80
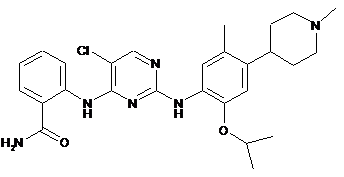
2-(2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)-5-хлорпіримідин-4-іламіно)бензамід
81
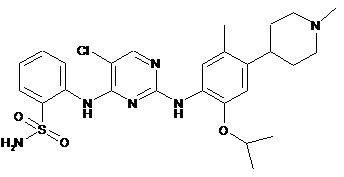
5-хлор-N2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніл)-N4-(2-(аміносульфоніл)феніл)піримідин-2,4-діамін
82
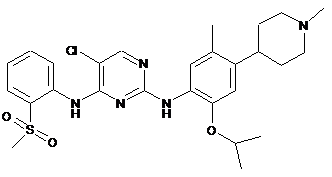
5-хлор-N2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніл)-N4-(2-(метилсульфоніл)феніл)піримідин-2,4-діамін
83

5-хлор-N2-(2-фтор-5-метил-4-(1-метилпіперидин-4-іл)феніл)-N4-(2-(аміносульфоніл)феніл)піримідин-2,4-діамін
84
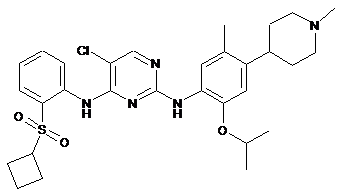
5-хлор-N4-(2-(циклобутилсульфоніл)феніл)-N2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніл)піримідин-2,4-діамін
132
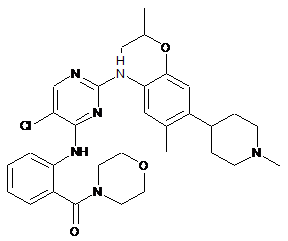
(2-(5-хлор-2-(2-ізопропокси-5-метил-4-(1-метилпіперидин-4-іл)феніламіно)піримідин-4-іламіно)феніл)(морфоліно)метанон
або її фармацевтично прийнятні солі.
11. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-10 та фармацевтично прийнятний носій.
12. Сполука за будь-яким з пп. 1-10 або її фармацевтично прийнятні солі для застосування у способі інгібування кінази анапластичної лімфоми.
13. Комбінація, що містить сполуку за будь-яким з пп. 1-10 або її фармацевтично прийнятні солі та хіміотерапевтичний агент.
14. Комбінація за п. 13 для лікування клітинного проліферативного розладу, де клітинний проліферативний розлад являє собою лімфому, остеосаркому, меланому або пухлину молочної залози, нирки, передміхурової залози, колоректальної області, щитовидної залози, яєчника, підшлункової залози, нервових клітин, легені, матки або шлунково-кишкового тракту, недрібноклітинний рак легені або нейробластому.
15. Застосування сполуки за будь-яким з пп. 1-10 або її фармацевтичної композиції для виробництва лікарського засобу для лікування стану, опосередкованого кіназою анапластичної лімфоми, та необов'язково у комбінації з другим терапевтичним агентом, де зазначений стан являє собою аутоімунну хворобу, реакцію "трансплантат проти хазяїна", інфекційну хворобу або клітинний проліферативний розлад.
16. Застосування сполуки за будь-яким з пп. 1-10 або її фармацевтичної композиції для виробництва лікарського засобу для лікування клітинного проліферативного розладу та необов'язково у комбінації з другим терапевтичним агентом, де зазначений клітинний проліферативний розлад являє собою лімфому, остеосаркому, меланому або пухлину молочної залози, нирки, передміхурової залози, колоректальної області, щитовидної залози, яєчника, підшлункової залози, нервових клітин, легені, матки або шлунково-кишкового тракту, недрібноклітинний рак легені або нейробластому.
17. Застосування за п. 16, у якому зазначений клітинний проліферативний розлад являє собою недрібноклітинний рак легені.
18. Застосування за п. 16, у якому зазначений клітинний проліферативний розлад являє собою нейробластому.
19. Застосування за п. 16, у якому зазначений другий терапевтичний агент являє собою хіміотерапевтичний агент.
Текст
Реферат: Даний винахід описує нові похідні піримідину та піридину, їх фармацевтичні композиції та застосування таких сполук. UA 100846 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 100846 C2 Наприклад, похідні піримідину та піридину даного винаходу можуть бути використані для лікування, полегшення симптомів або профілактики стану, який чутливий до інгібування активності кінази анапластичної лімфоми (ALK), кінази місцевої адгезії (FAK), дзеталанцюгзв'язаної протеїнкінази 70 (ZAP-70), інсуліноподібного фактора росту (IGF-1R) або їх комбінації. R2 R1 N (R4)n R 3 N R5 N N W R5' UA 100846 C2 5 10 15 20 25 30 35 40 Перехресні посилання до зв'язаних заявок Дана заявка заявляє пріоритет до попередньої заявки США серійний номер 60/869,299, поданої 8 грудня 2006 року, яка включена у даний опис шляхом посилання у її повноті. Галузь винаходу Даний винахід відноситься до інгібіторів протеїнкінази, більш особливо до нових похідних піримідину та піридину та їх фармацевтичних композицій, та їх застосування як фармацевтичні засоби. Передумови створення винаходу Кіназа анапластичної лімфоми (ALK), член суперсімейства рецепторів інсуліну рецепторних тирозин-кіназ, залучена у онкогенез у гематопоетичних та негематопоетичних пухлинах. Аберантна експресія непроцессованих ALK рецепторних білків описана у нейробластомах та гліобластомах; та ALK білки злиття зустрічаються у анапластичній велико-клітинній лімфомі. Дослідження ALK білків злиття також збільшило можливість нових терапевтичних лікувань для пацієнтів з ALK-позитивними злоякісними утвореннями. (Pulford et al., Cell. Mol. Life Sci. 61: 2939-2953 (2004)). Кіназа місцевої адгезії (FAK) являє собою ключовий фермент у опосередкованому інтегрином ззовні-всередину сигнальному каскаді (D. Schlaepfer et al., Prog Biophys Mol Biol 1999, 71, 43578). Пусковим механізмом у каскаді сигнальної трансдукції є аутофосфорилювання Y397. Фосфорильований Y397 являє собою SH2 місце приєднання для Src сімейства тирозинкіназ; прикріплення c-Src кінази фосфорилює інші тирозинові залишки у FAK. Серед них, фосфорильований Y925 стає місцем зв'язування для SH2 місця Grb2 невеликого сполучного білку. Це пряме прикріплення Grb2 до FAK являє собою одну з ключових стадій для активації низхідних цілей, таких як Ras-ERK2/MAP кіназний каскад. Дзета-ланцюг-зв'язана протеїнкіназа 70 (ZAP-70), член протеїн-тирозин-кіназного сімейства, має потенційну прогностичну важливість при хронічному лімфолейкозі (CLL). ZAP-70, відома своєю важливістю у T та NK клітинному сигналюванні, але відсутня у нормальних периферичних B клітинах, експресується при більшості поганих прогнозів немутованого CLL та відсутня у більшості випадків з мутованими IgVH генами. ZAP-70 також експресується у меншій кількості інших B клітинних пухлин. (Orchard et al., Leuk. limphoma 46: 1689-98 (2005)). Сигналювання інсуліно-подібного фактору росту (IGF-1) сильно залучене у рак, з IGF-1 рецептором (IGF-1R) як домінуючим фактором. IGR-1R є важливим для пухлинного перетворення та виживання злоякісних клітин, але тільки частково залучений у нормальний ріст клітин. Передбачають, що націлювання на IGF-1R є багатообіцяючим варіантом для терапії раку. (Larsson et al., Br. J. Cancer 92: 2097-2101 (2005)). Через пов'язані з хворобами ролі ALK, FAK, ZAP-70 та IGF-1R, існує постійна необхідність у сполуках, які можуть бути корисними для лікування та профілактики хвороби, яка чутлива до інгібування ALK, FAK, ZAP-70 та/або IGF-1R. Розкриття даного винаходу Даний винахід відноситься до нових похідних піримідину та піридину та до їх фармацевтичних композицій та до їх застосування як фармацевтичні засоби. У одному аспекті, даний винахід забезпечує сполуку, що має Формулу (1): R2 R1 N (R4)n R3 N R5 N N R5' (1) W або її фармацевтично прийнятні солі; у якій 1 UA 100846 C2 R6 R 6 R7 5 10 15 20 25 30 35 40 4 R 10 A A 1 R 7 4 A A R6 1 B 3 A2 A R10 R9 4 R10 A 1 C R7 A Z3 1 2 Z Z R8 W являє собою , або ; 1 4 A та A незалежно являють собою C або N; 2 3 2 3 6 7 кожен A та A являє собою C, або один з A та A являє собою N, коли R та R утворюють кільце; B та C незалежно являють собою необов'язково заміщене 5-7 членне карбоциклічне кільце, арил, гетероарил або гетероциклічне кільце, що містить N, O або S; 1 2 3 11 12 Z , Z та Z незалежно являють собою NR , C=O, CR-OR, (CR2)1-2 або =C-R ; 1 2 12 12 12 R та R незалежно являють собою гало групу, OR , NR(R ), SR , або необов'язково 1 2 заміщений C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл; або один з R та R являє собою H; 3 12 12 12 12 R являє собою (CR2)0-2SO2R , (CR2)0-2SO2NRR , (CR2)0-2CO1-2R , (CR2)0-2CONRR або ціано групу; 4 6 7 10 R , R , R та R незалежно являють собою необов'язково заміщений C1-6 алкіл, C2-6 алкеніл 12 12 12 13 4 7 10 або C2-6 алкініл; OR , NR(R ), гало групу, нітро групу, SO2R , (CR2)pR або X; або R , R та R незалежно являють собою H; 5 5" R, R та R незалежно являють собою H або C1-6 алкіл; 8 9 R та R незалежно являють собою C1-6 алкіл, C2-6 алкеніл, C2-6 алкініл, гало групу або X, або 8 9 1 2 8 9 один з R та R являє собою H, коли R та R утворюють кільце; та за умови, що один з R та R являє собою X; 1 2 6 7 7 8 9 10 альтернативно, R та R , або R та R , R та R , або R та R , при приєднанні до атому вуглецю можуть утворювати необов'язково заміщене 5-7 членне моноциклічне або сконденсоване карбоциклічне кільце, арил, або гетероарил або гетероциклічне кільце, що 7 8 9 10 включає N, O та/або S; або R , R , R та R являють собою відсутні члени при приєднанні до N; 11 13 12 R являє собою H, C1-6 алкіл, C2-6 алкеніл, (CR2)pCO1-2R, (CR2)pOR, (CR2)pR , (CR2)pNRR , 12 12 (CR2)pCONRR або (CR2)pSO1-2R ; 12 13 R та R незалежно являють собою необов'язково заміщене 3-7 членне насичене або частково ненасичене карбоциклічне кільце, або 5-7-членне гетероциклічне кільце, що включає 12 N, O та/або S; арил або гетероарил; або R являє собою H, C1-6 алкіл; 12 12 12 X являє собою (CR2)qY, ціано групу, CO1-2R , CONR(R ), CONR(CR2)pNR(R ), 12 12 12 12 CONR(CR2)pOR , CONR(CR2)pSR , CONR(CR2)pS(O)1-2R або (CR2)1-6NR(CR2)pOR ; Y являє собою необов'язково заміщене 3-12-членне карбоциклічне кільце, 5-12-членний арил, або 5-12-членний гетероарил або гетероциклічне кільце, що включає N, O та/або S, та 2 3 прикріплений до A або A або обох через атом вуглецю зазначеного гетероарилу або гетероциклічного кільця, коли q у (CR2)qY являє собою 0; та n, p та q незалежно являють собою 0-4. 1 2 У представленій вище Формулі (1), R може являти собою гало групу або C1-6 алкіл; R являє 1 2 собою H або NH2; або R та R разом утворюють необов'язково заміщений 5-6 членний арил або 3 гетероарил або гетероциклічне кільце, що включає 1-3 атоми азоту. У інших прикладах, R у 12 12 12 12 Формулі (1) може являти собою SO2R , SO2NH2, SO2NRR , CO2NH2, CONRR , CO1-2R , або 12 ціано групу; та R являє собою C1-6 алкіл, необов'язково заміщений C3-7 циклоалкіл, C3-7 циклоалкеніл, піролідиніл, піперазиніл, піперидиніл, морфолініл або азетидиніл. У інших 5 5" 7 10 додаткових прикладах, R , R , R та R у Формулі (1) незалежно являють собою H, та n являє 6 12 12 собою 0. У інших прикладах, R у Формулі (1) може являти собою гало групу або OR , та R являє собою C1-6 алкіл. У одному варіанті втілення, даний винахід забезпечує сполуки, що мають Формулу (2): 45 2 UA 100846 C2 R2 R1 N 4 (R )n R 3 N N H H N (2) R6 R9 R8 , 1 5 10 15 20 у якій R являє собою гало групу або C1-6 алкіл; 2 R являє собою H; або 1 2 R та R разом утворюють необов'язково заміщене 5-6 членне гетероарильне або гетероциклічне кільце, що включає один або два атоми азоту; 6 R являє собою ізопропокси або метокси групу; 8 9 12 один з R та R являє собою (CR2)qY та інший являє собою C1-6 алкіл, ціано групу, CO1-2R , 12 12 CONR(R ) або CONR(CR2)pNR(R ); Y являє собою необов'язково заміщений C3-7 циклоалкіл, C3-7 циклоалкеніл, або феніл; або Y являє собою піридил, піразоліл, ізоксазоліл, імідазоліл, тіазоліл, бензімідазоліл, піролідиніл, піперазиніл, піперидиніл, морфолініл, азетидиніл, гептаметиленімін або октаметиленімін, кожен з яких прикріплений до фенільного кільця через атом вуглецю, коли q у (CR2)qY являє собою 0; n являє собою 0-1; та q являє собою 0-4. 8 9 У представленій вище Формулі (2), один з R та R може являти собою (CR2)qY та інший являє собою C1-6 алкіл; та n та q незалежно являють собою 0. У деяких прикладах, Y являє 1 собою піролідиніл, піперидиніл, азетидиніл. У інших прикладах, R являє собою гало групу або 2 C1-6 алкіл; та R являє собою H. У іншому варіанті втілення, даний винахід забезпечує сполуки, що мають Формулу (3A) або (3B): R2 R1 N 4 (R )n R3 N N H N H R6 (3A) B C . R2 R1 N (R4)n R3 N H N N H (3B) R6 Z3 . Z1 Z2 у якій B та C разом утворюють 3 UA 100846 C2 O N R R N N N R11 ; або Z , Z та Z разом утворюють R 1 2 3 , , , , або , ; , 5 10 15 або їх таутомери; 1 R являє собою гало групу або C1-6 алкіл; 2 R являє собою H; або 1 2 R та R разом утворюють необов'язково заміщене 5-7 членне карбоциклічне кільце, арил, або гетероарил або гетероциклічне кільце, що включає N, O та/або S; та 6 R являє собою ізопропокси або метокси групу. 11 У представленій вище Формулі (3A) або (3B), кожен R може являти собою (CR2)pCO1-2R, 13 12 12 (CR2)pOR, (CR2)pR , (CR2)pNRR або (CR2)pCONRR ; 12 R та R незалежно являють собою H або C1-6 алкіл; та 13 R являє собою необов'язково заміщений піперидиніл, азетидііл, тетрагідропіраніл, циклогексил, морфолініл, піролідиніл, гептаметиленімін, октаметиленімін, біциклічну амінну або діамінну похідну, хінуклідин-3-іл, 8-метил-8-аза-біцикло[3.2.1]окт-6-ил], або 9-метил-9-азабіцикло[4.2.1]нонан-7-іл. У ще одному іншому варіанті втілення, даний винахід забезпечує сполуки, що мають Формулу (4A) або Формулу (4B): R2 R1 N (R4)n N R3 N H N (4A) H B2 A2 R9 R8 4 UA 100846 C2 R2 R1 N 4 (R )n N R3 H H N R6 N (4B) B3 R8 1 5 у якій R являє собою гало групу або C1-6 алкіл; 2 R являє собою H; або 1 2 R та R разом утворюють необов'язково заміщене 5-7 членне карбоциклічне кільце, арил, або гетероарил або гетероциклічне кільце, що включає N, O та/або S; 6 R являє собою ізопропокси або метокси групу; та 2 3 B та B незалежно являють собою необов'язково заміщений 5-6 членний арил або гетероарил, що містить N, O або S. У іншому аспекті, даний винахід забезпечує сполуки, що мають Формулу (5): 10 R2 R1 N (R4)n R3 N N 5 (5) R5' W R або їх фармацевтично прийнятні солі; у якій R6 R 6 R7 15 20 25 30 4 R 10 A A1 A2 A3 R 7 4 R10 A A R6 1 B R9 4 R10 A 1 C R7 A Z3 1 2 Z Z R8 W являє собою , або ; 1 4 A та A незалежно являють собою C або N; 2 3 2 3 6 7 кожен A та A являє собою C, або один з A та A являє собою N, коли R та R утворюють кільце; B та C незалежно являють собою необов'язково заміщене 5-7 членне карбоциклічне кільце, арил, гетероарил або гетероциклічне кільце, що містить N, O або S; 1 2 3 11 12 Z , Z та Z незалежно являють собою NR , C=O, CR-OR, (CR2)1-2 або =C-R ; 1 2 12 12 12 R та R незалежно являють собою гало групу, OR , NR(R ), SR , або необов'язково 1 2 заміщений C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл; або один з R та R являє собою H; 3 12 12 12 12 R являє собою (CR2)0-2SO2R , (CR2)0-2SO2NRR , (CR2)0-2CO1-2R , (CR2)0-2CONRR або ціано групу; 4 6 7 10 R , R , та R та R , коли прикріплені до атому вуглецю, незалежно являють собою H, 12 12 необов'язково заміщений C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл; OR , NR(R ), гало групу, нітро 12 13 6 7 групу, SO2R , (CR2)pR або X; за умови, що R та R обидва не являють собою H; 5 5" R, R та R незалежно являють собою H або C1-6 алкіл; 8 9 R та R незалежно являють собою C1-6 алкіл, C2-6 алкеніл, C2-6 алкініл, гало групу або X, або 8 9 8 9 один з R та R являє собою H; та за умови, що один з R та R являє собою X; 1 2 6 7 7 8 9 10 альтернативно, R та R , або R та R , R та R , або R та R , при приєднанні до атому вуглецю, можуть утворювати необов'язково заміщене 5-7 членне моноциклічне або сконденсоване карбоциклічне кільце, арил, або гетероарил або гетероциклічне кільце, що 7 8 9 10 включає N, O та/або S; або R , R , R та R являють собою відсутні члени при приєднанні до N; 5 UA 100846 C2 11 5 10 15 20 25 30 35 40 45 50 55 60 13 12 R являє собою H, C1-6 алкіл, C2-6 алкеніл, (CR2)pCO1-2R, (CR2)pOR, (CR2)pR , (CR2)pNRR , 12 12 (CR2)pCONRR або (CR2)pSO1-2R ; 12 13 R та R незалежно являють собою необов'язково заміщене 3-7 членне насичене або частково ненасичене карбоциклічне кільце, або 5-7-членне гетероциклічне кільце, що включає 12 N, O та/або S; арил або гетероарил; або R являє собою H, C1-6 алкіл; 12 12 12 X являє собою (CR2)qY, ціано групу, CO1-2R , CONR(R ), CONR(CR2)pNR(R ), 12 12 12 12 CONR(CR2)pOR , CONR(CR2)pSR , CONR(CR2)pS(O)1-2R або (CR2)1-6NR(CR2)pOR ; Y являє собою необов'язково заміщене 3-12-членне карбоциклічне кільце, 5-12-членний арил, або 5-12-членний гетероарил або гетероциклічне кільце, що включає N, O та/або S, та 2 3 прикріплений до A або A або обох через атом вуглецю зазначеного гетероарилу або гетероциклічного кільця, коли q у (CR2)qY являє собою 0; та n, p та q незалежно являють собою 0-4. У ще одному іншому аспекті, даний винахід забезпечує фармацевтичні композиції, що включають сполуку, яка має Формулу (1), (2), (3A), (3B), (4A), (4B) або (5), та фармацевтично прийнятний наповнювач. У ще одному іншому аспекті, даний винахід забезпечує способи модулювання ALK, FAK, ZAP-70 та/або IGF-1R, що включають введення у систему або суб'єкт, якому це необхідно, терапевтично ефективної кількості сполуки, що має Формулу (1), (2), (3A), (3B), (4A), (4B) або (5), або її фармацевтично прийнятних солей або фармацевтичної композиції, таким чином, модулюючи зазначені ALK, FAK, ZAP-70 та/або IGF-1R. Даний винахід також забезпечує способи лікування, полегшення або запобігання стану, який реагує на інгібування ALK, FAK, ZAP-70 та/або IGF-1R, що включають введення у систему або суб'єкт, якому це необхідно, терапевтично ефективної кількості сполуки, що має Формулу (1), (2), (3A), (3B), (4A), (4B) або (5), або її фармацевтично прийнятних солей або фармацевтичної композиції, та необов'язково у комбінації з другим терапевтичним агентом, за допомогою якого лікують зазначений стан. Альтернативно, даний винахід забезпечує застосування сполуки, що має Формулу (1), (2), (3A), (3B), (4A), (4B) або (5) у виробництві лікарського засобу для лікування стану, опосередкованого ALK, FAK, ZAP-70 та/або IGF-1R. У певних варіантах втілення, сполуки даного винаходу можуть бути використані окремо або у комбінації з другим терапевтичним агентом для лікування стану, опосередкованого ALK, де зазначений стан являє собою аутоімунну хворобу, реакцію "трансплантат проти хазяїна", інфекційну хворобу або клітинний проліферативний розлад. Більш того, даний винахід забезпечує способи лікування клітинного проліферативного розладу, що включають введення у систему або суб'єкт, якому необхідне таке лікування, ефективної кількості сполуки, що має Формулу (1), (2), (3A), (3B), (4A), (4B) або (5), або її фармацевтично прийнятних солей або фармацевтичних композицій, та необов'язково у комбінації з другим терапевтичним агентом, за допомогою якого лікують зазначений стан. Альтернативно, даний винахід забезпечує застосування сполуки, що має Формулу (1), (2), (3A), (3B), (4A), (4B) або (5), у виробництві лікарського засобу для лікування клітинного проліферативного розладу. У певних прикладах, сполуки даного винаходу можуть бути використані окремо або у комбінації з хіміотерапевтичним агентом для лікування клітинного проліферативного розладу, включаючи, не обмежуючись наведеними, такі як: лімфома, остеосаркома, меланома, або пухлина молочної залози, нирки, передміхурової залози, колоректальної області, щитовидної залози, яєчнику, підшлункової залози, нервових клітин, легені, матки або шлунково-кишкового тракту. У описаних вище способах для застосування сполук даного винаходу, сполука, що має Формулу (1), (2), (3A), (3B), (4A), (4B) або (5), може бути введена у систему, що включає клітини або тканини, або ссавцевому суб'єкту, такому як людина або тварина. Визначення "Алкіл" відноситься до залишку та як структурний елемент інших груп, наприклад, галозаміщений-алкіл та алкокси група, та може бути лінійно-ланцюговим або розгалуженим. Необов'язково заміщений алкіл, алкеніл або алкініл, як використано у цьому описі, може бути необов'язково галогенований (наприклад, CF3), або може мати один або більшу кількість вуглеців, які є заміщеними або заміненими гетероатомом, таким як NR, O або S (наприклад, – OCH2CH2O–, алкілтіоли, тіоалкокси, алкіламіни, тощо). "Арил" відноситься до моноциклічного або сконденсованого біциклічного ароматичного кільця, що містить вуглецеві атоми. "Арилен" являє собою двовалентний радикал, одержаний з арильної групи. Наприклад, арильна група може являти собою феніл, інденіл, інданіл, нафтил, або 1,2,3,4-тетрагідронафталеніл, який може бути необов'язково заміщений у орто, мета або пара положенні. "Гетероарил", як використано у цьому описі, визначається як описано вище для арилу, де 6 UA 100846 C2 5 10 15 20 25 30 35 40 один або більша кількість кільцевих членів являє собою гетероатом. Приклади гетероарилів включають, не обмежуючись наведеними, піридил, піразиніл, індоліл, індазоліл, хіноксалініл, хінолініл, бензофураніл, бензопіраніл, бензотіопіраніл, бензо[1,3]діоксол, імідазоліл, бензоімідазоліл, піримідиніл, фураніл, оксазоліл, ізоксазоліл, триазоліл, бензотриазоліл, тетразоліл, піразоліл, тієніл, піроліл, ізохінолініл, пуриніл, тіазоліл, тетразиніл, бензотіазоліл, оксадіазоліл, бензоксадіазоліл, тощо. "Карбоциклічне кільце", як використано у цьому описі, відноситься до насиченого або частково ненасиченого, моноциклічного, сконденсованого біциклічного або місткового поліциклічного кільця, що містить атоми вуглецю, які можуть бути необов'язково заміщені, наприклад, за допомогою =O. Приклади карбоциклічних кілець включають, не обмежуючись наведеними, циклопропіл, циклобутил, циклопентил, циклогексил, циклопропілен, циклогексанон, тощо. "Гетероциклічне кільце", як використано у цьому описі, визначається як описано вище для карбоциклічного кільця, де один або більша кількість кільцевих атомів вуглецю являють собою гетероатом. Наприклад, гетероциклічне кільце може містити N, O, S, -N=, -S-, -S(O), -S(O)2-, або -NR-, де R може являти собою водень, C1-4алкіл або захисну групу. Приклади гетероциклічних кілець включають, не обмежуючись наведеними, морфоліно, піролідиніл, піролідиніл-2-он, піперазиніл, піперидиніл, піперидинілон, 1,4-діокса-8-аза-спіро[4.5]дец-8-ил, 1,2,3,4тетрагідрохінолініл тощо. Гетероциклічні кільця, як використано у цьому описі, можуть включати біциклічні аміни та біциклічні діаміни. Вважають, що терміни "спів-введення" або "комбіноване введення" або подібні, як використано у цьому описі, включають введення вибраних терапевтичних агентів одному пацієнту, та, як передбачають, включають лікувальні режими, у яких агенти не обов'язково вводять тим же самим шляхом введення або у той самий час. Термін "фармацевтична комбінація", як використано у цьому описі, означає продукт, який одержують після змішування або об'єднання активних інгредієнтів та включає як фіксовані, так і нефіксовані комбінації активних інгредієнтів. Термін "фіксована комбінація" означає, що активні інгредієнти, наприклад, сполуку Формули (1) та спів-агент, обидва вводять пацієнту одночасно у формі однієї одиниці або дози. Термін "нефіксована комбінація" означає, що активні інгредієнти, наприклад, сполуку Формули (1) та спів-агент, обидва вводять пацієнту як окремі одиниці або одночасно, паралельно або послідовно без специфічних обмежень часу, де таке введення забезпечує терапевтично ефективні рівні активних інгредієнтів у організмі пацієнта. Останню також застосовують для лікування сумішами, наприклад, введення трьох або більшої кількості активних інгредієнтів. Термін "терапевтично ефективна кількість" означає кількість заданої сполуки, яка буде викликати біологічну або медичну реакцію у клітині, тканині, органі, системі, тварині або людині, яку шукають дослідники, ветеринари, лікарі або інші клініцисти. Термін "вводити" або "введення" заданої сполуки означає забезпечення сполуки даного винаходу та її проліків суб'єкту, який потребує лікування. Способи здійснення даного винаходу Даний винахід забезпечує нові похідні піримідину та піридину та їх фармацевтичні композиції, та способи застосування таких сполук. У одному аспекті, даний винахід забезпечує сполуку, що має Формулу (1): R2 R1 N 4 (R )n R 3 N R5 N N R5' (1) W 45 або її фармацевтично прийнятні солі; де 7 UA 100846 C2 R6 R 6 R7 5 10 15 20 25 30 35 R 4 10 A A 1 R 7 4 A A R6 1 B 3 A2 A R10 R9 4 R10 A 1 C R7 A Z3 1 2 Z Z R8 W являє собою , або ; 1 4 A та A незалежно являють собою C або N; 2 3 2 3 6 7 кожен A та A являє собою C, або один з A та A являє собою N, коли R та R утворюють кільце; B та C незалежно являють собою необов'язково заміщене 5-7-членне карбоциклічне кільце, арил, гетероарил або гетероциклічне кільце, що містить N, O або S; 1 2 3 11 12 Z , Z та Z незалежно являють собою NR , C=O, CR-OR, (CR2)1-2 або =C-R ; 1 2 12 12 12 R та R незалежно являють собою гало групу, OR , NR(R ), SR , або необов'язково 1 2 заміщений C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл; або один з R та R являє собою H; 3 12 12 12 12 R являє собою (CR2)0-2SO2R , (CR2)0-2SO2NRR , (CR2)0-2CO1-2R , (CR2)0-2CONRR або ціано групу; 4 6 7 10 R , R , R та R незалежно являють собою необов'язково заміщений C1-6 алкіл, C2-6 алкеніл 12 12 12 13 4 7 10 або C2-6 алкініл; OR , NR(R ), гало групу, нітро групу, SO2R , (CR2)pR або X; або R , R та R незалежно являють собою H; 5 5" R, R та R незалежно являють собою H або C1-6 алкіл; 8 9 R та R незалежно являють собою C1-6 алкіл, C2-6 алкеніл, C2-6 алкініл, гало групу або X, або 8 9 1 2 8 9 один з R та R являє собою H, коли R та R утворюють кільце; та за умови, що один з R та R являє собою X; 1 2 6 7 7 8 9 10 альтернативно, R та R , або R та R , R та R , або R та R , при приєднанні до атому вуглецю можуть утворювати необов'язково заміщене 5-7 членне моноциклічне або сконденсоване карбоциклічне кільце, арил, або гетероарил або гетероциклічне кільце, що 7 8 9 10 включає N, O та/або S; або R , R , R та R являють собою відсутні члени при приєднанні до N; 11 13 12 R являє собою H, C1-6 алкіл, C2-6 алкеніл, (CR2)pCO1-2R, (CR2)pOR, (CR2)pR , (CR2)pNRR , 12 12 (CR2)pCONRR або (CR2)pSO1-2R ; 12 13 R та R незалежно являють собою необов'язково заміщене 3-7 членне насичене або частково ненасичене карбоциклічне кільце, або 5-7-членне гетероциклічне кільце, що включає 12 N, O та/або S; арил або гетероарил; або R являє собою H, C1-6 алкіл; 12 12 12 X являє собою (CR2)qY, ціано групу, CO1-2R , CONR(R ), CONR(CR2)pNR(R ), 12 12 12 12 CONR(CR2)pOR , CONR(CR2)pSR , CONR(CR2)pS(O)1-2R або (CR2)1-6NR(CR2)pOR ; Y являє собою необов'язково заміщене 3-12 -членне карбоциклічне кільце, 5-12-членний арил, або 5-12-членний гетероарил або гетероциклічне кільце, що включає N, O та/або S, та 2 3 прикріплений до A або A або обох через атом вуглецю зазначеного гетероарилу або гетероциклічного кільця, коли q у (CR2)qY являє собою 0; та n, p та q незалежно являють собою 0-4. У одному варіанті втілення, даний винахід забезпечує сполуки, що мають Формулу (2): R2 R1 N (R4)n R3 N H N N H (2) R6 R9 R8 1 40 у якій R являє собою гало групу або C1-6 алкіл; 2 R являє собою H; або 1 2 R та R разом утворюють необов'язково заміщене 5-6 членне гетероарильне або 8 UA 100846 C2 5 10 гетероциклічне кільце, що включає один або два атоми азоту; 6 R являє собою ізопропокси або метокси групу; 8 9 12 один з R та R являє собою (CR2)qY та інший являє собою C1-6 алкіл, ціано групу, CO1-2R , 12 12 CONR(R ) або CONR(CR2)pNR(R ); Y являє собою необов'язково заміщений C3-7 циклоалкіл, C3-7 циклоалкеніл, або феніл; або Y являє собою піридил, піразоліл, ізоксазоліл, імідазоліл, тіазоліл, бензімідазоліл, піролідиніл, піперазиніл, піперидиніл, морфолініл, азетидиніл, гептаметиленімін або октаметиленімін, кожен з яких прикріплений до фенільного кільця через атом вуглецю, коли q у (CR2)qY являє собою 0; n являє собою 0-1; та q являє собою 0-4. У іншому варіанті втілення, даний винахід забезпечує сполуки, що мають Формулу (3A) або (3B): R2 R1 N 4 (R )n R3 N N H N H R6 (3A) B C , R2 R1 N (R4)n R3 N N H N H (3B) R6 Z3 Z1 Z2 , 15 у якій B та C разом утворюють O N N R R або 1 2 3 Z , Z та Z разом утворюють R N N R11 ; 9 UA 100846 C2 O , O O N , , 11 R O N O , R 11 N R 11 , або HO O OH ; , або їх таутомери; R являє собою гало групу або C1-6 алкіл; 2 R являє собою H; або 1 2 R та R разом утворюють необов'язково заміщене 5-7 членне карбоциклічне кільце, арил, або гетероарил або гетероциклічне кільце, що включає N, O та/або S; та 6 R являє собою ізопропокси або метокси групу. У ще одному іншому варіанті втілення, даний винахід забезпечує сполуки, що мають Формулу (4A) або Формулу (4B): 1 5 R2 R1 N (R4)n N R3 H N N (4A) H B2 A2 R9 R8 10 R2 R1 N 4 (R )n N R3 N H H R6 N (4B) B3 R8 1 15 у якій R являє собою гало групу або C1-6 алкіл; 2 R являє собою H; або 1 2 R та R разом утворюють необов'язково заміщене 5-7 членне карбоциклічне кільце, арил, або гетероарил або гетероциклічне кільце, що включає N, O та/або S; 6 R являє собою ізопропокси або метокси групу; та 2 3 B та B незалежно являють собою необов'язково заміщений 5-6 членний арил або гетероарил, що містить N, O або S. У іншому аспекті, даний винахід забезпечує сполуки, що мають Формулу (5): 20 10 UA 100846 C2 R2 R1 N (R4)n R3 N N 5 (5) R5' W R або їх фармацевтично прийнятні солі; де R6 R 6 R7 5 10 15 20 25 30 35 40 4 R10 A A 1 R 7 4 A A A R6 1 B 3 A2 R10 R9 4 R10 A 1 C R7 A Z3 1 2 Z Z R8 W являє собою , або ; 1 4 A та A незалежно являють собою C або N; 2 3 2 3 6 7 кожен A та A являє собою C, або один з A та A являє собою N, коли R та R утворюють кільце; B та C незалежно являють собою необов'язково заміщене 5-7 членне карбоциклічне кільце, арил, гетероарил або гетероциклічне кільце, що містить N, O або S; 1 2 3 11 12 Z , Z та Z незалежно являють собою NR , C=O, CR-OR, (CR2)1-2 або =C-R ; 1 2 12 12 12 R та R незалежно являють собою гало групу, OR , NR(R ), SR , або необов'язково 1 2 заміщений C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл; або один з R та R являє собою H; 3 12 12 12 12 R являє собою (CR2)0-2SO2R , (CR2)0-2SO2NRR , (CR2)0-2CO1-2R , (CR2)0-2CONRR або ціано групу; 4 6 7 10 R , R , та R та R , коли прикріплені до атому вуглецю, незалежно являють собою H, 12 12 необов'язково заміщений C1-6 алкіл, C2-6 алкеніл або C2-6 алкініл; OR , NR(R ), гало групу, нітро 12 13 6 7 групу, SO2R , (CR2)pR або X; за умови, що R та R обидва не являють собою H; 5 5" R, R та R незалежно являють собою H або C1-6 алкіл; 8 9 R та R незалежно являють собою C1-6 алкіл, C2-6 алкеніл, C2-6 алкініл, гало групу або X, або 8 9 8 9 один з R та R являє собою H; та за умови, що один з R та R являє собою X; 1 2 6 7 7 8 9 10 альтернативно, R та R , або R та R , R та R , або R та R , при приєднанні до атому вуглецю, можуть утворювати необов'язково заміщене 5-7 членне моноциклічне або сконденсоване карбоциклічне кільце, арил, або гетероарил або гетероциклічне кільце, що 7 8 9 10 включає N, O та/або S; або R , R , R та R являють собою відсутні члени при приєднанні до N; 11 13 12 R являє собою H, C1-6 алкіл, C2-6 алкеніл, (CR2)pCO1-2R, (CR2)pOR, (CR2)pR , (CR2)pNRR , 12 12 (CR2)pCONRR або (CR2)pSO1-2R ; 12 13 R та R незалежно являють собою необов'язково заміщене 3-7 членне насичене або частково ненасичене карбоциклічне кільце, або 5-7-членне гетероциклічне кільце, що включає 12 N, O та/або S; арил або гетероарил; або R являє собою H, C1-6 алкіл; 12 12 12 X являє собою (CR2)qY, ціано групу, CO1-2R , CONR(R ), CONR(CR2)pNR(R ), 12 12 12 12 CONR(CR2)pOR , CONR(CR2)pSR , CONR(CR2)pS(O)1-2R або (CR2)1-6NR(CR2)pOR ; Y являє собою необов'язково заміщене 3-12 -членне карбоциклічне кільце, 5-12-членний арил, або 5-12-членний гетеро арил або гетероциклічне кільце, що включає N, O та/або S, та 2 3 прикріплений до A або A або обох через атом вуглецю зазначеного гетероарилу або гетероциклічного кільця, коли q у (CR2)qY являє собою 0; та n, p та q незалежно являють собою 0-4. 13 У кожній з описаних вище формул, Y або R незалежно являють собою гетероциклічні кільця, які можуть являти собою біциклічний амін або біциклічний діамін. Приклади біциклічного аміну та біциклічних діамінів включають, не обмежуючись наведеними, такі як: необов'язково заміщений гексанметиленімін; гептаметиленімін; хінуклідин; 3-азабіцикло(3,3,0)октан; 3,8діазабіцикло[3,2,1]октан; октагідро-1H-піридо[3,4-C]азепін; октагідропіролізин; 6азабіцикло[3,2,1]октан; 3-азабіцикло[3,2,1]октан; 2,5-діазабіцикло[2,2,1]гептан; 1азабіцикло[2,2,1]гептан; 2-азабіцикло[2,2,1]гептан; 1,4-діазабіцикло[4,4,0]декан; 1,4діазабіцикло[4,3,0]нонан; 1-азабіцикло[3,2,1]октан; 3-азабіцикло[3,3,0]октан; 8азабіцикло[3,2,1]октан; 3,9-діазабіцикло[4,2,1]нонан; октагідропіроло[3,4-C]пірол; 11 UA 100846 C2 5 10 15 20 25 30 35 40 45 50 55 60 октагідропіроло[3,4-B]пірол; гексагідропіроло[3,2-B]пірол; гексагідропіроло[3,2-C]пірол; 1,4діазациклооктан; 1,5-діазациклооктан; 3,7-діазабіцикло[4,2,0]октан; 3,7-діазабіцикло[3,3,1]нонан; октагідропіроло[3,4-C]піридин; октагідропіроло[3,4-B]піридин; октагідроциклопента[C]піролідин; гексагідроциклопента[C]піролідин; 8-азабіцикло[3,2,1]октан; декагідрохінолін; декагідроізохінолін; декагідропіридо[3,4-B]азепін; декагідропіридо[4,3-B]азепін; 9азабіцикло[3,3,1]нонан; біспідин; 3-азабіцикло[3,1,0]гексан; 8-азабіцикло[3,2,1]октан; 2азабіцикло[3.3.1]нонан; тетрагідрохінолін; тетрагідроізохінолін; 2,5-діазабіцикло[2,2,2]октан; декагідро-2,7-нафтиридин; 1,4-діазепан; азонан; октагідро-1H-індол; октагідро-1H-ізоіндол; 2азабіцикло[3,3,0]октан; 6-азабіцикло[3,2,1]октан; 7-аза-біцикло[2.2.1]гептан; декагідропіразино[1,2-a]азепін; 3,8-діаза-біцикло[3,2,1]октан; 3-азабіцикло[3,2,1]октан; 3-азатрицикло[4,2,1,0(2,5)]нонан; 2,6-діазаспіро[3,5]нонан; 6-азабіцикло[2,1,0]гексан, тощо. У кожній з описаних вище формул, будь-які асиметричні атоми вуглецю можуть бути присутніми у (R)-, (S)- або (R, S)-конфігурації. Таким чином, сполуки можуть бути присутніми у вигляді сумішей ізомерів або у вигляді чистих ізомерів, наприклад, як чисті енантіомери або діастереомери. Даний винахід додатково включає можливі таутомери сполук за винаходом. У кожній з описаних вище формул, кожен необов'язково заміщений залишок може бути заміщений за допомогою C1-6 алкілу, C2-6 алкенілу або C3-6 алкінілу, кожен з яких може бути необов'язково галогенований або що необов'язково має вуглець, який може бути замінений або заміщений за допомогою таких як: N, S, O, або їх комбінації (наприклад, гідроксилC 1-C8алкіл, C1C8алкоксиC1-C8алкіл); гало група, аміно група, амідино група, C 1-6 алкокси група; гідроксил, метилендіокси група, карбокси група; C1-8 алкілкарбоніл, C1-8 алкоксикарбоніл, карбамоїл, C1-8 алкілкарбамоїл, сульфамоїл, ціано група, оксо група, нітро група, або необов'язково заміщене карбоциклічне кільце, гетероциклічне кільце, арил або гетероарил, як описано вище. Фармакологія та застосування Сполуки даного винаходу та їх фармацевтично прийнятні солі показують цінні фармакологічні властивості при дослідженні in vitro у вільних від клітин кіназних дослідженнях та у клітинних дослідженнях, та, тому, є корисними як фармацевтичні засоби. У одному аспекті, сполуки Формули (1), (2), (3A), (3B), (4A), (4B) або (5) можуть інгібувати тирозин-кіназну активність кінази анапластичої лімфоми (ALK) та білку злиття NPM-ALK. Ця протеїн-тирозин-кіназа походить з генного злиття нуклеофозміну (NPM) та ALK, роблячи протеїн-тирозин-кіназну активність незалежною від ALK ліганду. NPM-ALK відіграє ключову роль у передачі сигналу у цілому ряді гематопоетичних та інших клітин людини, що веде до гематологічних та непластичних хвороб, наприклад, у анапластичній великоклітинній лімфомі (ALCL) та неходжкінівських лімфомах (NHL), особливо при ALK+NHL або Alkomas, у запальних міофібробластичних пухлинах (IMT) та нейробластомах. (Duyster et al. 2001 Oncogene 20, 56235637). Окрім NPM-ALK, інші генні злиття були знайдені у гематологічних та непластичних хворобах людини; наприклад, TPM3-ALK (злиття нем'язового тропоміозину з ALK). Інгібування ALK тирозин-кіназної активності може бути продемонстровано, використовуючи відомі способи, наприклад, використовуючи рекомбінантний кіназний домен ALK по аналогії до VEGF-R кіназного дослідження, описаного у J. Wood et al. Cancer Res. 60, 2178-2189 (2000). Загалом, in vitro ферментативні дослідження, використовуючи GST-ALK протеїн-тирозин-кіназу, проводять у 96-лункових планшетах як спосіб зв'язування на фільтрах у 20 мM Tris HCl, pH=7,5, 33 3 мM MgCl2, 10 мM MnCl2, 1 мM DTT, 0,1 мкКi/дослідж. (=30 мкл) [γ- P]-ATP, 2 мкM ATP, 3 мкг/мл полі (Glu, Tyr 4:1) Poly-EY (Sigma P-0275), 1 % ДМСО, 25 нг ALK ферменту. Дослідні планшети інкубують впродовж 10 хвилин при кімнатній температурі. Реакції закінчують додаванням 50 мкл 125 мM EDTA, та реакційну суміш переносять на MAIP Multiscreen планшет (Millipore, Bedford, MA, USA), попередньо зволожений метанолом, та регідрований впродовж 5 хвилин за допомогою H2O. Після промивання (0,5 % H3PO4), планшети зчитують у рідинному сцинтиляційному лічильнику. IC50 значення розраховують за допомогою аналізу лінійної регресії відсотку інгібування. Сполуки Формули (1), (2), (3A), (3B), (4A), (4B) або (5) можуть сильно інгібувати ріст людських NPM-ALK надекспресуючих мишиних BaF3 клітин (DSMZ Deutsche Sammiung von Mikroorganismen und Zelikulturen GmbH, Germany). Експресія NPM-ALK може бути досягнута TM трансфікуванням BaF3 клітинної лінії з вектором експресії pClneo (Promega Corp., Madison WI, USA), кодуючи NPM-ALK, та наступним вибором G418 стійких клітин. Не-трансфектовані BaF3 клітини залежать від IL-3 для виживання клітини. На противагу, NPM-ALK експресуючі BaF3 клітини (що нижче називають BaF3-NPM-ALK) можуть проліферувати за відсутності IL-3, так як вони одержують проліферативний сигнал через NPM-ALK кіназу. Тому, передбачувані інгібітори NPM-ALK кінази анулюють сигнал росту та можуть приводити до антипроліферативної активності. Антипроліферативна активність передбачуваних інгібіторів NPM-ALK кінази, однак, 12 UA 100846 C2 5 10 15 20 25 30 35 40 45 50 55 60 може перемогти додаванням IL-3, що забезпечує сигнали росту через NPM-ALK незалежний механізм. Аналогічна клітинна система, використовуючи FLT3 кіназу також була описана (дивись, E Weisberg et al. Cancer Cell; 1, 433-443 (2002)). Інгібіторна активність сполук даного винаходу може бути визначена наступним чином. Загалом, BaF3-NPM-ALK клітини (15,000/лунку мікротитрового планшету) переносять у 96лункові мікротитрові планшети. Тестові сполуки, розчинені у диметил-сульфоксиді (ДМСО), додають серіями концентрацій (серійне розведення) таким способом, що кінцева концентрація ДМСО є не більшою ніж 1 % (об'єм/об'єм). Після додавання, планшети інкубують впродовж двох днів, протягом яких контрольні культури без тестової сполуки можуть піддаватися двом циклам TM клітинного ділення. Ріст BaF3-NPM-ALK клітин вимірюють за допомогою YOPRO забарвлення [T Idziorek et al. J. Immunol. Methods; 185: 249-258 (1995)]: 25 мкл лізисного буферу, що включає 20 мM цитрат натрію, pH 4,0, 26,8 мM хлорид натрію, 0,4 % NP40, 20 мM EDTA та 20 мM, додають до кожної лунки. Клітинний лізис закінчують впродовж 60 хвилин при кімнатній TM температурі та загальну кількість YOPRO , прикріпленого до ДНК, визначають вимірюванням, використовуючи Cytofluor II 96-лунковий рідер (PerSeptive Biosystems) з наступними параметрами настроювання: збудження (нм) 485/20 та випромінювання (нм) 530/25. IC50 значення можуть бути визначені за допомогою комп'ютерної системи, використовуючи формулу: IC50 = [(ABSтест-ABSпочатк.)/(ABSконтроль-ABSпочатк.)] x 100. (ABS = абсорбція) IC50 значення у цих експериментах представляють як ту концентрацію тестової сполуки, що розглядають, що приводить до кількості клітин, яка є на 50 % нижчою, ніж кількість клітин, отримана, використовуючи контроль без інгібітору. Сполуки даного винаходу у вільній формі або у формі фармацевтично прийнятної солі, можуть показувати цінні фармакологічні властивості, наприклад, як показано in vitro дослідженнями, розкритими у цьому описі. Загалом, сполуки даного винаходу мають IC50 значення від 1 нM до 10 мкM. У деяких прикладах, сполуки даного винаходу мають IC50 значення від 0,01 мкM до 5 мкM. У інших прикладах, сполуки даного винаходу мають IC50 значення від 0,01 мкM до 1 мкM, або більш особливо від 1 нM до 1 мкM. У інших додаткових прикладах, сполуки даного винаходу мають IC50 значення менше ніж 1 нM або більше ніж 10 мкM. Сполуки даного винаходу можуть показувати відсоток інгібування більше ніж 50 %, або у інших варіантах втілення, можуть показувати відсоток інгібування, більше ніж приблизно 70 %, проти ALK при 10 мкM. Антипроліферативна дія сполук даного винаходу також може бути визначена у KARPAS-299 клітинній лінії лімфоми (DSMZ Deutsche Sammiung von Mikroorganismen und Zelikulturen GmbH, Braunschweig, Germany, описано у WG Dirks et al. Int. J. Cancer 100, 49-56 (2002)), використовуючи ту ж саму методологію, що описана вище для BaF3-NPM-ALK клітинної лінії. У деяких варіантах втілення, сполуки даного винаходу можуть показувати інгібіторну активність з IC50 у інтервалі від приблизно 0,01 до 1 мкM. Дія сполук даного винаходу на аутофосфорилювання ALK може бути визначена у людській KARPAS-299 клітинній лінії лімфоми за допомогою імуноблоту, як описано у WG Dirks et al. Int. J. Cancer 100, 49-56 (2002). У іншому аспекті, сполуки даного винаходу можуть інгібувати Кіназу місцевої адгезії (FAK), та можуть бути корисними як фармацевтичні засоби для лікування станів, спричинених дисфункцією сигнальних каскадів, зв'язаних з FAK, наприклад, як при лікуванні певних пухлин. Інгібування ендогенного FAK сигналювання приводить до зниженої рухливості, та у деяких випадках викликає смерть клітин. З іншого боку, посилення FAK сигналювання екзогенною експресією підвищує рухливість клітин. Крім того, FAK надекспресується у інвазивному та метастатичному епітеліальному, мезенхімному раку, раку щитовидної залози та передміхурової залози. Отже, інгібітор FAK також повинен являти собою лікарський засіб проти росту та метастазування пухлин. Таким чином, сполуки даного винаходу можуть бути ефективними для профілактики та/або лікування хребетної тварини та більш особливо ссавця, що страждає на пухлинну хворобу, зокрема пухлину молочної залози, рак кишок (кишечнику та прямої кишки), рак шлунку та рак яєчнику та передміхурової залози, недрібноклітинний рак легені, дрібноклітинний рак легені, рак печінки, меланому, пухлину сечового міхура та рак голови та шиї. Залежність між FAK інгібуванням та імунною системою описана, наприклад, у G.A. van Seventer et al., Eur. J. Immunol. 2001, 31, 1417-1427. Отже, сполуки даного винаходу, наприклад, є корисними для профілактики та/або лікування хребетної тварини та більш особливо ссавця, що страждає на розлади, такі як: хвороби імунної системи або розлади, опосередковані T лімфоцитами, B лімфоцитами, мастоцитами та/або еозинофілами, наприклад, такі як гостре або хронічне відторгнення органного або тканинного ало- або ксенотрансплантатів, атеросклероз, оклюзія судини через ураження судини, таке як ангіопластика, рестеноз, гіпертензія, серцева 13 UA 100846 C2 5 10 15 20 25 30 35 40 45 50 55 60 недостатність, хронічна обструктивна легенева хвороба, хвороба ЦНС, така як хвороба Альцгеймера або бічний аміотрофічний склероз; рак; інфекційна хвороба, така як СНІД; септичний шок або респіраторний дистрес-синдром у дорослих, ішемічне/реперфузійне ураження, наприклад, інфаркт міокарда, інсульт, кишкова ішемія, ниркова недостатність або геморагічний шок, або травматичний шок. У ще одному іншому аспекті, сполуки даного винаходу можуть інгібувати дзета-ланцюгзв'язаний білок 70 (ZAP-70). ZAP-70 протеїн-тирозин-кіназна взаємодія агентів даного винаходу може бути продемонстрована, наприклад, їх здатністю попереджати фосфорилювання LAT-11 (лінкер для активації T клітини) людською ZAP-70 протеїн-тирозин-кіназою у водному розчині. Тому, сполуки даного винаходу можуть бути корисними для профілактики або лікування розладів або хвороб, у яких грає роль ZAP-70 інгібування. Сполуки даного винаходу також можуть інгібувати рецептор інсуліноподібного фактору росту 1 (IGF-1R), та можуть бути корисними у лікуванні IGF-1R опосередкованих хвороб. Приклади IGF-1R опосередкованих хвороб включають, не обмежуючись наведеними, проліферативні хвороби, такі як пухлини, наприклад, молочної залози, нирки, передміхурової залози, колоректальної області, щитовидної залози, яєчнику, підшлункової залози, нервових клітин, легені, матки та шлунково-кишкового тракту, а також остеосаркоми та меланоми. Ефективність сполук даного винаходу як інгібіторів активності IGF-1R тирозин-кінази може бути показано, використовуючи спосіб клітинного захоплення ELISA. У цьому дослідженні визначають активність сполук даного винаходу проти (IGF-1)-викликаного аутофосфорилювання IGF-1R. Сполуки даного винаходу також можуть бути корисними при лікуванні та/або профілактиці таких хвороб як: гострі або хронічні запальні хвороби або розлади або аутоімунні хвороби, наприклад, такі як ревматоїдний артрит, остеоартрит, системний червоний вовчак, хронічний лімфоматозний тиреоідит Хасімото, розсіяний склероз, міастенія, діабет (типу I та II) та розлади, пов'язані з ним, респіраторні хвороби, такі як астма, або запальне ураження печінки, запальне гломерулярне ураження, шкірні прояви імунологічно-зв'язаних хвороб або захворювань, запальні та гіперпроліферативні хвороби шкіри (такі як псоріаз, атопічний дерматит, алергічний контактний дерматит, подразнюючий контактний дерматит та подальший екзематозний дерматит, себорейний дерматит), запальні хвороби ока, наприклад, синдром Гужеро - Шегрена, кератоконьюнктивіт або увеіт, запальна хвороба кишок, хвороба Крона або виразковий коліт. Відповідно до описаного вище, даний винахід забезпечує: (1) сполуку даного винаходу для застосування як фармацевтичний засіб; (2) сполуку даного винаходу для застосування як ALK інгібітор, FAK інгібітор, ZAP-70 інгібітор та/або IGF-1R інгібітор, наприклад, для застосування при будь-яких певних показаннях, розкритих у цьому описі вище; (3) фармацевтичну композицію, наприклад, для застосування при будь-яких певних показаннях, розкритих у цьому описі вище, що включає сполуку даного винаходу як активний інгредієнт разом з одним або декількома фармацевтично прийнятними розріджувачами або носіями; (4) спосіб для лікування будь-якого певного показання, розкритого у цьому описі вище, у суб'єкта, якому це необхідно, що включає введення ефективної кількості сполуки даного винаходу або фармацевтичної композиції, що включає її; (5) застосування сполуки даного винаходу для виробництва лікарського засобу для лікування або профілактики хвороби або стану, у яких ALK, FAK, ZAP-70 та/або IGF-1R активація грає роль або залучена; (6) спосіб, як визначено вище у (4), що включає спів-введення, наприклад, супутньо або послідовно, терапевтично ефективної кількості сполуки даного винаходу та однієї або декількох додаткових лікарських речовин, де зазначена додаткова лікарська речовина є корисною при будь-якому з певних показань, розкритих у цьому описі вище; (7) комбінацію, що включає терапевтично ефективну кількість сполуки даного винаходу та одну або декілька додаткових лікарських речовин, де зазначена додаткова лікарська речовина є корисною при будь-якому з певних показань, розкритих у цьому описі вище; (8) застосування сполуки даного винаходу для виробництва лікарського засобу для лікування або профілактики хвороби, яка чутлива до інгібування кінази анапластичної лімфоми; (9) застосування за (8), у якому хворобу, яку необхідно лікувати, вибирають з анапластичної великоклітинної лімфоми, неходжкінівських лімфом, запальних міофібробластичних пухлин, нейробластом та непластичних хвороб; (10) застосування за (8) або (9), у якому сполука являє собою фармацевтично прийнятну 14 UA 100846 C2 5 10 15 20 25 30 35 40 45 50 55 60 сіль будь-якого одного з прикладів; (11) спосіб лікування хвороби, яка чутлива до інгібування кінази анапластичної лімфоми, особливо хвороби, що вибирають з анапластичної великоклітинної лімфоми, неходжкінівських лімфом, запальних міофібробластичних пухлин, нейробластом та непластичних хвороб, що включає введення ефективної кількості сполуки даного винаходу або її фармацевтично прийнятної солі. Введення та фармацевтичні композиції Загалом, сполуки даного винаходу будуть вводитися у терапевтично ефективних кількостях через будь-який із звичайних та прийнятних способів, відомих у даній галузі техніки, або окремо або у комбінації з одним або більшою кількістю терапевтичних агентів. Терапевтично ефективна кількість може змінюватися у широких межах в залежності від серйозності хвороби, віку та відносного стану здоров'я суб'єкта, ефективності використовуваної сполуки та інших факторів. Загалом, показано, що задовільні результати отримують систематично при щоденних дозах від приблизно 0,03 до 2,5 мг/кг маси тіла. Показана щоденна доза у великого ссавця, наприклад, людей, знаходиться у інтервалі від приблизно 0,5 мг до приблизно 100 мг, при зручному введенні, наприклад, у розділених дозах до чотирьох разів на день або у формі уповільненого вивільнення. Прийнятні одиничні лікарські форми для перорального введення включають від приблизно 1 до 50 мг активного інгредієнта. Введення та фармацевтичні композиції Загалом, сполуки даного винаходу будуть вводитися у терапевтично ефективних кількостях через будь-який із звичайних та прийнятних способів, відомих у даній галузі техніки, або окремо або у комбінації з одним або більшою кількістю терапевтичних агентів. Терапевтично ефективна кількість може змінюватися у широких межах в залежності від серйозності хвороби, віку та відносного стану здоров'я суб'єкта, ефективності використовуваної сполуки та інших факторів, відомих спеціалістам, звичайно кваліфікованим у даній галузі техніки. Наприклад, для лікування неопластичних хвороб та розладів імунної системи, необхідна доза буде також змінюватися в залежності від способу введення, певного стану, який необхідно лікувати, та бажаного ефекту. Загалом, показано, що задовільні результати отримують систематично при щоденних дозах від приблизно 0,01 до 100 мг/кг маси тіла, або особливо від приблизно 0,03 до 2,5 мг/кг маси тіла. Показана щоденна доза у великого ссавця, наприклад, людей, знаходиться у інтервалі від приблизно 0,5 мг до приблизно 2000 мг, або більш особливо, від приблизно 0,5 мг до приблизно 100 мг, при зручному введенні, наприклад, у розділених дозах до чотирьох разів на день або у формі уповільненого вивільнення. Прийнятні одиничні лікарські форми для перорального введення включають від приблизно 1 до 50 мг активного інгредієнту. Сполуки даного винаходу можуть бути введені як фармацевтичні композиції будь-яким зручним шляхом, зокрема ентерально, наприклад, перорально, наприклад, у формі таблеток або капсул, або парентерально, наприклад, у формі ін'єкційних розчинів або суспензій, місцево, наприклад, у формі лосьйонів, гелів, мазей або кремів, або у назальній формі або у формі супозиторію. Фармацевтичні композиції, що включають сполуку даного винаходу у вільній формі або у формі фармацевтично прийнятної солі у поєднанні з щонайменше одним фармацевтично прийнятним носієм або розріджувачем, можуть бути вироблені звичайним способом шляхом змішування, гранулювання, нанесення покриття, розчинення або ліофілізування. Наприклад, фармацевтичні композиції, що включають сполуку даного винаходу у поєднанні з щонайменше одним фармацевтично прийнятним носієм або розріджувачем, можуть бути вироблені звичайним способом шляхом змішування з фармацевтично прийнятним носієм або розріджувачем. Одиничні лікарські форми для перорального введення містять, наприклад, від приблизно 0,1 мг до приблизно 500 мг активної речовини. У одному варіанті втілення, фармацевтичні композиції являють собою розчини активного інгредієнту, включаючи суспензії або дисперсії, такі як ізотонічні водні розчини. У випадку ліофілізованих композицій, що включають активний інгредієнт окремо або разом з носієм, таким як маніт, дисперсії або суспензії можуть бути одержані безпосередньо перед застосуванням. Фармацевтичні композиції можуть бути стерилізовані та/або містять допоміжні речовини, такі як консерванти, стабілізатори, зволожуючі або емульгуючи агенти, прискорювачі розчинення, солі для регулювання осмотичного тиску та/або буфери. Прийнятні консерванти включають, не обмежуючись наведеними, антиоксиданти, такі як аскорбінова кислота, або бактерицидні засоби, такі як сорбінова кислота або бензойна кислота. Розчини або суспензії можуть додатково включати підвищуючи в'язкість агенти, включаючи, не обмежуючись наведеними, карбоксиметилцелюлозу натрію, карбоксиметилцелюлозу, декстран, полівінілпіролідон, желатини, або солюбілізатори, наприклад, Твін 80 (поліоксиетилен(20)сорбіту моно-олеат). 15 UA 100846 C2 5 10 15 20 25 30 35 40 45 50 55 60 Суспензії у маслі можуть включати як масляний компонент рослинні, синтетичні або напівсинтетичні масла, звичайні для ін'єкційних цілей. Приклад включають рідкі складні ефіри жирних кислот, які містять як кислий компонент довголанцюгову жирну кислоту, що має від 8 до 22 атомів вуглецю, або у деяких варіантах втілення, від 12 до 22 атомів вуглецю. Прийнятні складні ефіри жирних кислот включають, не обмежуючись наведеними, лауринову кислоту, тридецилову кислоту, міристилову кислоту, пентадецилову кислоту, пальмітинову кислоту, маргаринову кислоту, стеаринову кислоту, арахідонову кислоту, бегенову кислоту або відповідні ненасичені кислоти, наприклад, такі як олеїнова кислота, елаідинова кислота, ерукова кислота, брассидинова кислота та лінолева кислота, та при бажанні, можуть містити антиксиданти, наприклад, вітамін E, 3-каротин або 3,5-ди-трет-бутил-гідрокситолуол. Спиртовий компонент цих складних ефірів жирних кислот може мати шість атомів вуглецю та може бути моновалентним або полівалентним, наприклад, моно-, ди- або тривалентний спирт. Прийнятні спиртові компоненти включають, не обмежуючись наведеними, метанол, етанол, пропанол, бутанол або пентанол або їх ізомери; гліколь та гліцерин. Інші прийнятні складні ефіри жирних кислот включають, не обмежуючись наведеними, етилолеат, ізопропіл-міристат, ізопропіл-пальмітат, LABRAFIL® M 2375, (поліоксиетиленгліцерин), LABRAFIL® M 1944 CS (ненасичені поліглікозильовані гліцериди, одержані спиртовим гідролізом кісточкового абрикосового масла, та що включають гліцериди та складний ефір TM поліетиленгліколю), LABRASOL (насичені поліглікозильовані гліцериди, одержані спиртовим гідролізом TCM, та що включають гліцериди та складний ефір поліетиленгліколю; всі доступні з GaKefosse, France), та/або MIGLYOL® 812 (тригліцерид насичених жирних кислот з довжиною ланцюга C8-C12 від Hüls AG, Germany), та рослинні масла, такі як бавовняна олія, мигдалева олія, оливкова олія, касторова олія, сезамова олія, соєва олія або арахісове масло. Фармацевтичні композиції для перорального введення можуть бути одержані, наприклад, шляхом об'єднання активного інгредієнта з одним або декількома твердими носіями, та при бажанні, гранулювання отриманої суміші, та обробки зазначеної суміші або гранул включенням додаткових наповнювачів, з утворенням таблеток або ядер таблеток. Прийнятні носії включають, не обмежуючись наведеними, наповнювачі, такі як цукри, такі як лактоза, сахароза, маніт або сорбіт, целюлозні препарати, та/або фосфати кальцію, наприклад, трикальцію фосфат або гідрофосфат кальцію, та також зв'язуючі речовини, такі як крохмалі, наприклад, кукурудзяний, пшеничний, рисовий або картопляний крохмаль, метилцелюлоза, гідроксипропіл-метилцелюлоза, натрію карбоксиметилцелюлоза, та/або полівінілпіролідон, та/або, при бажанні, дезінтегратори, такі як описані вище крохмалі, карбоксиметил-крохмаль, перехресно-зв'язаний полівінілпіролідон, альгінова кислота або її солі, такі як альгінат натрію. Додаткові наповнювачі включають регулятори потоку та любриканти, наприклад, кремнієва кислота, тальк, стеаринова кислота або її солі, такі як стеарат магнію або кальцію, та/або поліетиленгліколь, або їх похідні. Ядра таблеток можуть бути одержані з прийнятними, необов'язково ентеросолюбільними, покриттями шляхом застосування, серед інших, концентрованих цукрових розчинів, які можуть включати гуміарабік, тальк, полівінілпіролідон, поліетиленгліколь та/або діоксид титану, або покриваючих розчинів у прийнятних органічних розчинниках або сумішах розчинників, або, для одержання ентеросолюбільних покриттів, розчини прийнятних целюлозних препаратів, таких як фталат ацетилцелюлози або фталат гідроксипропілметилцелюлози. Барвники або пігменти можуть бути додані до таблеток або покриттів таблеток, наприклад, з метою ідентифікації або для показання різних доз активного інгредієнту. Фармацевтичні композиції для перорального введення також можуть включати тверді капсули, що містять желатин, або м'які капсули, що містять желатин та пластифікатор, такий як гліцерин або сорбіт. Тверді капсули можуть містити активний інгредієнт у формі гранул, наприклад, у суміші з такими як: наповнювачі, такі як кукурудзяний крохмаль, зв'язуючі речовини, та/або гліданти, такі як тальк або стеарат магнію, та необов'язково стабілізатори. У м'яких капсулах, активний інгредієнт може бути розчинений або суспендований у прийнятних рідких наповнювачах, таких як жирні масла, керосин або рідкі поліетилен-гліколі або складні ефіри жирних кислот етилен або пропілен-гліколю, до яких можуть бути додані стабілізатори та детергенти, наприклад, типу складних ефірів поліоксиетилен-сорбіту та жирних кислот. Фармацевтичні композиції, прийнятні для ректального застосування, являють собою, наприклад, супозиторії, що включають комбінацію активного інгредієнту та основи для супозиторію. Прийнятні основи для супозиторію являють собою, наприклад, природні або синтетичні тригліцериди, метанові вуглеводні, поліетилен-гліколі або вищі алканоли. Фармацевтичні композиції, прийнятні для парентерального введення, можуть включати водні розчини активного інгредієнту у водорозчинній формі, наприклад, водорозчинній солі, або 16 UA 100846 C2 5 10 15 20 25 30 водні ін'єкційні суспензії, які містять речовини, що підвищують в'язкість, наприклад, карбоксиметилцелюлоза натрію, сорбіт та/або декстран, та, при бажанні, стабілізатори. Активний інгредієнт, необов'язково разом із наповнювачами, також може бути у формі ліофілізату та може бути переведений у розчин перед парентеральним застосуванням шляхом додавання прийнятних розчинників. Розчини, які використовують, наприклад, для парентерального введення, також можуть бути використані як інфузійні розчини. Вироблення ін'єкційних препаратів зазвичай проводять за стерильних умов, наприклад, наповнення, наприклад, у ампули або склянки, та запечатування контейнерів. Сполуки даного винаходу можуть бути введені як єдиний активний інгредієнт, або разом з іншими лікарськими засобами, корисними проти непластичних хвороб або корисними у імуномоделюючих режимах. Наприклад, сполуки даного винаходу можуть бути використані відповідно до винаходу у комбінації з фармацевтичними композиціями, ефективними при різних хворобах, як описано вище, наприклад, з такими як: циклофосфамід, 5-фторурацил, флударабін, гемцитабін, цисплатинум, карбоплатин, вінкристин, вінбластин, етопозид, іринотекан, паклітаксел, доцетаксел, ритуксан, доксорубіцин, гефітиніб або іматиніб; або також з такими як: циклоспорини, рапаміцини, аскоміцини або їх імунопригнічуючі аналоги, наприклад, циклоспорин A, циклоспорин G, FK-506, сіролімус або еверолімус, кортикостероїди, наприклад, преднізон, циклофосфамід, азатіопрен, метотрексат, солі золота, сульфасалазин, протималярійні засоби, бреквінар, лефлуномід, мізорибін, мікофенольна кислота, мікофнолят, мофетил, 15-деоксиспергуалін, імунопригнічуючі моноклональні антитіла, наприклад, моноклональні антитіла до рецепторів лейкоцитів, наприклад, MHC, CD2, CD3, CD4, CD7, CD25, CD28, I CD40, CD45, CD58, CD80, CD86, CD152, CD137, CD154, ICOS, LFA-1, VLA-4 або їх лігандів, або інші імуномоделюючі сполуки, наприклад CTLA41g. Даний винахід також забезпечує фармацевтичні комбінації, наприклад, набір, що включає a) перший агент, який являє собою сполуку даного винаходу як розкрито у цьому описі, у вільній формі або у формі фармацевтично прийнятної солі, та b) щонайменше один спів-агент. Зазначений набір може включати інструкції для його введення. Способи одержання сполук даного винаходу Сполуки Формули (1) можуть бути одержані, слідуючи Схемі реакції I, у якій кожен замісник приймає значення, визначені у Короткому описі даного винаходу: (6) (1) Схема реакції I 35 40 45 Сполука Формули (1) може бути синтезована шляхом введення у реакцію сполуки Формули (6) зі сполукою Формули (7) у присутності паладієвого каталізатору (наприклад, ацетат паладію та подібні), ліганду (наприклад, ксантфос та подібні) та основи (наприклад, карбонат цезію та подібні) у прийнятному розчиннику (наприклад, ТГФ, та подібні). Реакція протікає у температурному інтервалі від приблизно 70 °C до приблизно 180 °C та може займати від 10 хвил. до 8 годин до закінчення. Альтернативно, сполука Формули (1) може бути синтезована шляхом введення у реакцію сполуки Формули (6) зі сполукою Формули (7) у присутності кислоти (наприклад HCl, TsOH та подібні), у прийнятному розчиннику (наприклад, 2-пропанол, та подібні). Реакція протікає у температурному інтервалі від приблизно 70 °C до приблизно 150 °C та може займати до 12 годин до закінчення. Додаткові способи одержання сполук даного винаходу Сполуки даного винаходу, включаючи їх солі, також можуть бути одержані у формі гідратів, або їх кристали можуть включати, наприклад, розчинник, що використовують для кристалізації (у цьому описі - сольвати). Солі, як правило, можуть бути перетворені у сполуки у вільній формі, наприклад, шляхом обробки з прийнятними основними агентами, наприклад, з карбонатами 17 UA 100846 C2 5 10 15 20 25 30 35 40 45 50 55 60 лужних металів, гідрокарбонатами лужних металів, або гідроксидами лужних металів, такими як карбонат калію або гідроксид натрію. Приймаючи до уваги тісний зв'язок між новими сполуками у вільній формі та сполуками у формі їх солей, включаючи ті солі, які можуть бути використані як проміжні сполуки, наприклад, у очищенні або ідентифікації нових сполук, будь-яке посилання на вільні сполуки у цьому описі вище та нижче слід розуміти як посилання також на відповідні солі, якщо прийнятно. Солі сполук даного винаходу з солеутворюючими групами можуть бути одержані за способом, відомим per se. Солі приєднання кислоти сполук Формули (1), (2), (3A), (3B), (4A), (4B) або (5), таким чином, можуть бути одержані шляхом обробки кислотою або прийнятним аніонообмінним реагентом. Фармацевтично прийнятні солі сполук даного винаходу можуть бути утворені, наприклад, як солі приєднання кислоти, з органічними або неорганічними кислотами, зі сполук Формули (1), (2), (3A), (3B), (4A), (4B) або (5) з основним атомом азоту. Прийнятні неорганічні кислоти включають, не обмежуючись наведеними, галогенові кислоти, такі як соляна кислота, сірчана кислота, або фосфорна кислота. Прийнятні органічні кислоти включають, не обмежуючись наведеними, такі як карбонова, фосфорна, сульфонова або сульфамінова кислоти, наприклад, оцтова кислота, пропіонова кислота, каприлова кислота, капринова кислота, додеканова кислота, гліколева кислота, молочна кислота, фумарова кислота, бурштинова кислота, адипінова кислота, пімелінова кислота, суберинова кислота, азелаїнова кислота, яблучна кислота, винна кислота, лимонна кислота, аміно кислоти, такі як глутамінова кислота або аспарагінова кислота, малеїнова кислота, гідроксималеїнова кислота, метилмалеїнова кислота, циклогексанкарбонова кислота, адамантанкарбонова кислота, бензойна кислота, саліцилова кислота, 4-аміносаліцилова кислота, фталева кислота, фенілоцтова кислота, мигдальна кислота, корична кислота, метан- або еатн-сульфонова кислота, 2-гідроксиетансульфонова кислота, етан-1,2-дисульфонова кислота, бензолсульфонова кислота, 2-нафталінсульфонова кислота, 1,5-нафталін-дисульфонова кислота, 2-, 3- або 4 метилбензолсульфонова кислота, метилсірчана кислота, етилсірчана кислота, додецилсірчана кислота, N-циклогексилсульфамінова кислота, N-метил-, N-етил- або N-пропіл-сульфамінова кислота, або інші органічні протонні кислоти, такі як аскорбінова кислота. Для виділення та очищення, також можна використовувати фармацевтично неприйнятні солі, наприклад, пікрати або перхлорати. Для терапевтичного застосування використовують тільки фармацевтично прийнятні солі або вільні сполуки (де прийнятно у формі фармацевтичних препаратів). Сполуки даного винаходу у неокисленій формі можуть бути одержані з N-оксидів сполук даного винаходу шляхом обробки відновлюючим агентом (наприклад, таким як сірка, діоксид сірки, трифеніл-фосфін, боргідрид літію, боргідрид натрію, фосфору трихлорид, трибромід, або подібні) у прийнятному інертному органічному розчиннику (наприклад, ацетонітрил, етанол, водний діоксан, або подібні) при 0-80 °C. Похідні проліків сполук даного винаходу можуть бути одержані за способами, відомими спеціалістам, кваліфікованим у даній галузі техніки (наприклад, для більш детального опису дивись Saulnier et al., (1994), Bioorganic and Medicinal Chemistry Letters, том 4, стор. 1985). Наприклад, відповідні пролікарські засоби можуть бути одержані шляхом введення у реакцію недериватизованої сполуки даного винаходу з прийнятним карбамілізуючим агентом (наприклад, 1,1-ацилоксиалкіл-карбано-хлоридат, пара-нітрофеніл карбонат, або подібні). Захищені похідні сполук даного винаходу можуть бути одержані за допомогою засобів, відомих спеціалістам, кваліфікованим у даній галузі техніки. Детальний опис технологій, застосовних для створення захисних груп та їх видалення, може бути знайдений у T. W. Greene, тє "Protecting Groups in Organic Chemistry", 3 видання, John Wiley and Sons, Inc., 1999. Сполуки даного винаходу можуть бути одержані у вигляді їх окремих стереоізомерів шляхом введення у реакцію рацемічної суміші сполуки з оптично активним розділюючим агентом з утворенням пари діастереоізомерних сполук, розділення діастереоізомерів та відновлення оптично чистих енантіомерів. Розділення енантіомерів може бути виконане, використовуючи ковалентні діастереомерні похідні сполук даного винаходу або комплекси, що дисоціюються (наприклад, кристалічні діастереомерні солі). Діастереомери мають відмінні фізичні властивості (наприклад, точки плавлення, точки кипіння, розчинності, реакційну здатність, тощо) та можуть бути легко розділені, приймаючи до уваги перевагу цих відмінностей. Діастереомери можуть бути розділені за допомогою фракційної кристалізації, хроматографії, або переважно, за допомогою розділення/відділення технологій, основаних на різницях у розчинності. Оптично чистий енантіомер потім відновлюють, з відновлюючим агентом, шляхом будь-яких практичних засобів, які не будуть приводити до рацемізації. Більш детальний опис технологій, застосовний 18 UA 100846 C2 5 10 15 20 25 для розділення стереоізомерів сполук з їх рацемічної суміші, може бути знайдений у Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates and Resolutions", John Wiley and Sons, Inc., 1981. Коротко, сполуки Формули I можуть бути одержані за способом, який включає: (a) спосіб реакційної схеми I, та (b) необов'язково перетворення сполуки даного винаходу у фармацевтично прийнятну сіль; (c) необов'язково перетворення сольової форми сполуки даного винаходу у не-сольову форму; (d) необов'язково перетворення неокисленої форми сполуки даного винаходу у фармацевтично прийнятний N-оксид; (e) необов'язково перетворення N-оксидної форми сполуки даного винаходу у її неокислену форму; (f) необов'язково відділення окремого ізомеру сполуки даного винаходу від суміші ізомерів; (g) необов'язково перетворення недериватизованої сполуки даного винаходу у фармацевтично прийнятну пролікарську похідну; та (h) необов'язково перетворення пролікарської похідної сполуки даного винаходу у її недериватизовану форму. Оскільки вироблення вихідних матеріалів особливо не описане, сполуки є відомими або можуть бути одержані аналогічно до способів, відомих у даній галузі техніки або як розкрито у Прикладах, представлених нижче. Спеціаліст, кваліфікований у даній галузі техніки, зрозуміє, що описані вище перетворення є тільки типовими прикладами способів для одержання сполук даного винаходу, та що інші добре відомі способи можуть бути використані аналогічно. Даний винахід додатково описаний, але не обмежується, наступним та Прикладами, які ілюструють одержання сполук даного винаходу. Одержання проміжних сполук Проміжна сполука 1 2-хлор-N-(2-(ізо-пропілсульфоніл)-феніл)-5-метилпіримідин-4-амін N N H 30 35 40 45 N Cl S O O До суспензії 730 мг NaH у суміші ДМФА/ДМСО (25/2,5 мл) додають краплинним способом при 0 °C, 2,53 г (12,69 ммоль) 2-(ізо-пропілсульфоніл)бензоламін у суміші ДМФА/ДМСО (10 мл, співвідношення 9/1). Зазначений розчин перемішують 30 хвилин при 0 °C та краплинним способом додають 4,11 г (25,3 ммоль, 2 екв.) 2,4-дихлор-5-метилпіримідину, розведеного у 10 мл суміші ДМФА/ДМСО (співвідношення: 9/1). Зазначений розчин нагрівають до кімнатної температури та перемішують впродовж ночі. Після обробки, сирий продукт безпосередньо кристалізують з холодного CH3CN у декілька партій, що приводить до одержання 2-хлор-N-(2(ізо-пропілсульфоніл)-феніл)-5-метилпіримідин-4-аміну у вигляді блідо-кремових кристалів: + ESMS m/z 326,1 (M+H ). Проміжна сполука 2 Синтез 2,5-дихлор-N-(2-(ізо-пропілсульфоніл)-феніл)піримідин-4-аміну Cl N N N Cl H S O O Використовуючи ту саму процедуру, що описана для синтезу 2-хлор-N-(2-(ізопропілсульфоніл)-феніл)-5-метилпіримідин-4-аміну, 2,5-дихлор-N-(2-(ізо-пропіл-сульфоніл)+ феніл)піримідин-4-амін виділяють у вигляді кремової твердої речовини: ESMS m/z 346,0 (M+H ). Проміжна сполука 3 2-хлор-4-фтор-5-нітротолуол NO2 F Cl 19 UA 100846 C2 5 10 15 До розчину 100 г (0,7 моль) 2-хлор-4-фтортолуолу у 250 мл концентрованої H2SO4 додають частинами 85 г (0,875 моль) KNO3 при 0 °C (додавання всієї кількості KNO3 закінчують приблизно через 1 годину). Червонувату суміш повільно нагрівають при кімнатній температурі впродовж ночі та гасять подрібненим льодом та екстрагують за допомогою EtOAc. Органічні шари об'єднують, сушать над MgSO4 та концентрують. Сире масло потім очищують на великому силікагелевому фільтрі (елюент: 97/3 гексани/EtOAc), що приводить до одержання 21 хлор-4-фтор-5-нітротолуолу у вигляді блідо-жовтого масла, яке отвердіває при стоянні. H ЯМР (CDCl3, 400 МГц): 7,97 (d, J=8,0 Гц, 1H), 7,32 (d, J=10,4 Гц, 1H), 2,43 (s, 3H). Проміжна сполука 4 2-хлор-4-ізопропокси-5-нітротолуол NO2 O Cl До розчину 25 г (0,131 моль) 2-хлор-4-фтор-5-нітротолуолу у 250 мл 2-пропанолу додають 208 г (0,659 моль, 5 екв.) Cs2CO3. Зазначену суміш перемішують при 60 °C впродовж ночі та більшість 2-пропанолу випарюють при зниженому тиску. Додають воду та розчин екстрагують за допомогою EtOAc. Органічні шари об'єднують, сушать над MgSO 4, концентрують та сирий продукт фільтрують через силікагелевий фільтр (елюент: 95/5 гексани/EtOAc), що приводить до одержання 2-хлор-4-ізопропокси-5-нітротолуолу у вигляді блідо-жовтої пухкої речовини. Проміжна сполука 5 2-метил-4-нітро-5-ізопропокси-фенілборної кислоти пінаколовий складний ефір NO2 O O 20 25 30 B O Суміш 5,09 г 2-хлор-4-ізопропокси-5-нітротолуолу (0,02216 моль), 6,20 г (0,02437 моль) пінакол диборану, 595 мг (0,00212 моль) PCy3, 1,014 г (0,00108 моль) Pd2dba3 та 3,16 г (0,0322 моль) KOAc у 100 мл сухого діоксану нагрівають до 100 °C впродовж ночі. Після охолодження до КТ, темний розчин фільтрують через Целіт та розчинник випарюють при зниженому тиску. Сире масло очищують за допомогою силікагелевої колонкової хроматографії (елюент: 95/5 гексани/EtOAc), що приводить до одержання 2-метил-4-нітро-5-ізопропокси-фенілборної 1 кислоти пінаколового складного ефіру у вигляді масла, яке отвердіває при стоянні. H ЯМР (CDCl3, 400 МГц): 7,51 (s, 1H), 7,44 (s, 1H), 4,70 (m, 1H), 2,48 (s, 3H), 1,36 (d, J = 7,6 Гц, 6H), 1,35 (s, 12H). Проміжна сполука 6 4-Трифторметансульфонілокси-3,6-дигідро-2H-піридин-1-карбонової кислоти третбутиловий складний ефір O O S F3C O N O 35 40 O Розчин N-трет-бутоксикарбоніл-4-піперидону (10,17 г, 0,05 моль) у ТГФ (100 мл) додають краплинним способом у охолоджений (-78 °C), енергійно перемішуваний розчин LDA (40 мл 1,5 M розчин у циклогексанах, 0,06 моль) у ТГФ (100 мл), у атмосфері N 2. Реакційну суміш залишають при -78 °C впродовж 30 хвилин перед додаванням розчину фенілтрифторсульфоніміду (19,85 г, 0,055 моль) у ТГФ (50 мл). Потім реакційну суміш нагрівають до кімнатної температури та перемішують впродовж 3 годин. Реакцію гасять при 0 °C за допомогою 100 мл насиченого водного розчину NH4Cl та фільтрують через Целіт. Фільтрат 20 UA 100846 C2 5 додають до 100 мл EtOAc та шари розділяють. Органічний шар промивають за допомогою H 2O, сушать над MgSO4 та концентрують. Сирий продукт очищують за допомогою силікагелевої флеш колонкової хроматографії (0-30 % EtOAc у гексанах як елюенті та перевіряють за допомогою ТШХ, що проявляють за допомогою 2 % KMnO4 у EtOH), що приводить до одержання 4-трифторметансульфонілокси-3,6-дигідро-2H-піридин-1-карбонової кислоти третбутилового складного ефіру у вигляді жовтого масла. Проміжна сполука 7 4-(5-Ізопропокси-2-метил-4-нітро-феніл)-3,6-дигідро-2H-піридин-1-карбонової кислоти третбутиловий складний ефір NO2 O N 10 15 20 O O До розчину 2-метил-4-нітро-5-ізопропокси-фенілборної кислоти пінаколового складного ефіру (2,04 г, 6,4 ммоль) та 4-трифторметансульфонілокси-3,6-дигідро-2H-піридин-1-карбонової кислоти трет-бутилового складного ефіру (3,2 г, 9,6 ммоль) у 110 мл DME/H 2O (10:1 об'єм/ об'єм) додають Pd(PPh3)4 (365 мг, 0,32 ммоль) та Cs2CO3 (4,2 г, 12,8 ммоль). Реакційну суміш нагрівають у атмосфері N2 при 80 °C впродовж ночі. Після охолодження до кімнатної температури, реакційну суміш фільтрують через Целіт та фільтрат розбавляють за допомогою 100 мл EtOAc, далі промивають H2O, сольовим розчином, та нарешті концентрують у вакуумі. Сирий продукт очищують за допомогою силікагелевої флеш хроматографії (5 % - 15 % EtOAc у гексанах як елюенті), що приводить до одержання 4-(5-ізопропокси-2-метил-4-нітро-феніл)-3,6дигідро-2H-піридин-1-карбонової кислоти трет-бутилового складного ефіру у вигляді жовтого 1 масла. H ЯМР (CD3OD, 400 МГц): 7,59 (s, 1H), 6,96 (s, 1H), 5,67 (шир. s, 1H), 4,73 (m, 1H), 4,06 (m, 2H), 3,65 (m, 2H), 2,37 (m, 2H), 2,25 (s, 3H), 1,50 (s, 9H), 1,33 (d, J = 6,0 Гц, 6H). Проміжна сполука 8 2-Хлор-4-ізопропокси-5-нітро-бензойна кислота O O2 N OH O 25 30 Cl Суміш 2-хлор-4-фтор-5-нітро-бензойної кислоти (5,0 г, 22,8 ммоль) та карбонату цезію (29,7 г, 91,1 ммоль) у 2-пропанолі (100 мл) нагрівають при 50 °C впродовж ночі. Розчинник видаляють у вакуумі та додають 100 мл води. Концентрований водний розчин HCl додають краплинним способом до зазначеного розчину при 0 °C до pH=2. Осад продукту, що утворюється, виділяють фільтруванням, промивають водою та сушать у вакуумі, що приводить до одержання 2-хлор-4ізопропокси-5-нітро-бензойної кислоти. Приклад 1 6-{5-Хлор-4-[2-(пропан-2-сульфоніл)-феніламіно]-піримідин-2-іламіно}-5-ізопропокси-2піперидин-4-іл-2,3-дигідро-ізоіндол-1-он (178) NH O Cl 35 N OH S O N N N N H O Стадії 1 та 2: 4-(2-Хлор-4-ізопропокси-5-нітро-бензоїламіно)-піперидин-1-карбонової кислоти 21 UA 100846 C2 трет-бутиловий складний ефір Boc O N O2N N H O Cl 5 10 15 20 25 30 До розчину 2-хлор-4-ізопропокси-5-нітро-бензойної кислоти (Проміжна сполука 8, 10 г, 38,5 ммоль) у DCM (200 мл) та ДМФА (1 мл), повільно додають тіонілхлорид (9,17 г, 77 ммоль) через шприц. Зазначену суміш перемішують впродовж 3 годин, та потім концентрують досуха. Отриману білу тверду речовину, 2-хлор-4-ізопропокси-5-нітро-бензоїл хлорид, сушать у вакуумі. До суміші 4-аміно-піперидин-1-карбонової кислоти трет-бутилового складного ефіру (1,44 г, 7,2 ммоль) та триетиламіну (3 мл, 21,6 ммоль) у DCM (100 мл), повільно додають 2-хлор-4ізопропокси-5-нітро-бензоїл-хлорид (2 г, 7,2 ммоль), розчинений у DCM (10 мл), через шприц. Зазначену суміш перемішують при кімнатній температурі впродовж 3 годин, та потім концентрують. Отриману тверду речовину розчиняють у етилацетаті та промивають за допомогою води та сольовим розчином відповідно. Після випарювання розчиннику, заголовну сполуку одержують у вигляді світло-жовтої твердої речовини, та безпосередньо використовують у наступній стадії без додаткового очищення. Стадія 3: 4-(4-Ізопропокси-5-нітро-2-вініл-бензоїламіно)-піперидин-1-карбонової кислоти трет-бутиловий складний ефір Boc O N O2N N H O До суміші 4-(2-хлор-4-ізопропокси-5-нітро-бензоїламіно)-піперидин-1-карбонової кислоти трет-бутилового складного ефіру (7,2 ммоль), отриманого у попередній стадії, вінілборної кислоти дибутиловий складний ефір (1,72 г, 9,4 ммоль) та карбонат натрію (5,34 г, 50,4 ммоль) у ТГФ/H2O (100/25 мл) додають дихлорбіс(трифенілфосфін)-паладій (II) (442 мг, 5 % ммоль). Зазначену суміш барботують N2 впродовж 3 хвилин та нагрівають при 90 °C у атмосфері N2 впродовж ночі у круглодонній колбі, оснащеній холодильником. Зазначену суміш охолоджують до кімнатної температури та виливають у насичений водний розчин хлориду амонію. Зазначену суміш екстрагують за допомогою етилацетату (3 × 100 мл). Органічні екстракти об'єднують, промивають сольовим розчином та концентрують. Сирий продукт очищують за допомогою силікагелевої колонкової хроматографії (40 % етилацетат у гексанах), що приводить до одержання 4-(4-ізопропокси-5-нітро-2-вініл-бензоїламіно)-піперидин-1-карбонової кислоти третбутилового складного ефіру у вигляді білої твердої речовини. Стадії 4, 5 та 6: 4-(5-Ізопропокси-6-нітро-1-оксо-1,3-дигідро-ізоіндол-2-іл)-піперидин-1карбонової кислоти трет-бутиловий складний ефір Boc N O N O2 N O 35 4-(4-Ізопропокси-5-нітро-2-вініл-бензоїламіно)-піперидин-1-карбонової кислоти третбутиловий складний ефір, отриманий у попередній стадії (1,9 г, 4,38 ммоль) розчиняють у DCM (100 мл) та охолоджують до -78 °C. O3 (г.) барботують у цей розчин, поки колір розчину не стане блакитним/сірим. Потім розчин обробляють N2 (г.), поки блакитний колір не зникне. Зазначений розчин нагрівають до кімнатної температури та обробляють трифенілфосфіновим полімером (5 г), попередньо розбухлим у DCM (100 мл). Через 30 хвилин, цю суміш фільтрують, фільтрат концентрують, та отриманий залишок розчиняють у суміші DCM/TFA (100 мл / 25 мл). До цієї 22 UA 100846 C2 5 10 15 20 25 30 35 40 суміші додають три етил-силан (4,6 мл, 17,5 ммоль). Отриману суміш перемішують при кімнатній температурі впродовж ночі. Реакційну суміш концентрують та знову розчиняють у DCM. DCM розчин промивають за допомогою 1N водного розчину HCl (3 × 20 мл). Об'єднаний водний шар обробляють конц. водним розчином NaOH до pH=12. Водний шар екстрагують за допомогою етилацетату (3 × 30 мл). Об'єднані органічні шари промивають сольовим розчином, та сушать над сульфатом натрію. Світло-жовту тверду речовину одержують після випарювання органічного розчиннику. Тверду речовину розчиняють у суміші метанолу та триетиламіну (100 мл, 9:1 об'єм/ об'єм). До цієї суміші додають ди-трет-бутил-дикарбонат (680 мг, 3,1 ммоль). Після перемішування при 50 °C впродовж 30 хвилин, зазначену суміш концентрують та очищують за допомогою силікагелевої флеш колонкової хроматографії (елюент: 40~50 % етилацетат у гексанах), що приводить до одержання 4-(5-ізопропокси-6-нітро-1-оксо-1,3-дигідро-ізоіндол-2-іл)-піперидин-11 карбонової кислоти трет-бутилового складного ефіру у вигляді білої твердої речовини. H ЯМР (400 МГц, CDCl3) δ 8,19 (s, 1H), 7,11 (s, 1H), 4,74 (q, 1H), 4,45-4,38 (m, 1H), 4,35 (s, 2H), 2,902,80 (m, 2H), 1,85-1,81 (m, 2H), 1,66-1,63 (m, 2H), 1,48 (s, 9H), 1,42 (d, 6H). Стадії 7, 8 та 9 До розчину 4-(5-ізопропокси-6-нітро-1-оксо-1,3-дигідро-ізоіндол-2-іл)-піперидин-1-карбонової кислоти трет-бутилового складного ефіру з попередньої стадії (850 мг, 2 ммоль) у метанолі, додають Pd/C (10 % на вугіллі, 100 мг). Зазначену суміш гідрогенують при 1 атм. газу водню. Через 4 години, суміш фільтрують та концентрують. Отриманий анілін, у вигляді жовтої твердої речовини, використовують у наступній стадії без додаткового очищення. До суміші сирого продукту (2 ммоль) з попередньої стадії, (2,5-дихлор-піримідин-4-іл)-[2-(пропан-2-сульфоніл)феніл]-аміну (Проміжна сполука 2, 770 мг, 2,2 ммоль), карбонату цезію (1,3 г, 4 ммоль), та ксантфосу (115 мг, 0,2 ммоль) у ТГФ (20 мл), додають ацетат паладію (22 мг, 5 % ммоль) у мікрохвильовій пробірці. У суміш пропускають N2 впродовж 3 хвилин. Запаяну пробірку нагрівають при 150 °C впродовж 20 хвилин при мікрохвильовому опроміненні. Зазначену суміш охолоджують, фільтрують та концентрують. Залишок очищують за допомогою силікагелевої флеш колонкової хроматографії (елюент: 65 % етилацетат у гексанах), що приводить до одержання жовтої твердої речовини. Тверду речовину обробляють за допомогою суміші DCM/TFA (1/1, 10 мл) впродовж 1 години, що супроводжують концентруванням у вакуумі. Кінцеве очищення, використовуючи препаративну RP LC-MS, забезпечує одержання 6-{5-хлор4-[2-(пропан-2-сульфоніл)-феніламіно]-піримідин-2-іламіно}-5-ізопропокси-2-піперидин-4-іл-2,31 дигідро-ізоіндол-1-ону (178) у вигляді білої твердої речовини. H ЯМР (400 МГц, CDCl3) 10,38 (s, 1H), 10,13 (s, 1H), 9,60-9,50 (br, 1H), 9,34-9,21 (br, 1H), 8,46 (d, 1H), 8,26 (s, 1H), 8,08 (s, 1H), 7,91 (dd, 1H), 7,71 (m, 1H), 7,34 (t, 1H), 7,03 (s, 1H), 4,30 (m, 1H), 4,53 (m, 1H), 4,33 (s, 2H), 3,62 (m, 2H), 3,21-3,09 (m, 3H), 2,31-2,21 (m, 2H), 2,09-2,05 (m, 2H), 1,41 (d, 6H), 2,30 (d, 6H); ESMS + m/z 599,2 (M+H ). Приклад 2 6-{5-Хлор-4-[2-(пропан-2-сульфоніл)-феніламіно]-піримідин-2-іламіно}-5-ізопропокси-2-(1метил-піперидин-4-іл)-2,3-дигідро-ізоіндол-1-он (181) N O Cl N OH S O N N N N H O Стадія 1: 5-Ізопропокси-2-(1-метил-піперидин-4-іл)-6-нітро-індан-1-он 23 UA 100846 C2 N O O2N O 5 10 15 20 До розчину 5-ізопропокси-6-нітро-2-піперидин-4-іл-індан-1-ону (Приклад 1, Стадія 5) у ТГФ (5 мл) та метанолі (5 мл) додають формальдегід (104,2 мкл, 1,39 ммоль) та 10 крапель AcOH послідовно. Реакційну суміш перемішують при кімнатній температурі впродовж 1 години, потім однією частиною додають ціаноборгідрид натрію (175,1 мг, 2,78 ммоль), та реакційну суміш перемішують впродовж ще 30 хвилин. Реакцію гасять насиченим водним розчином NH 4Cl та концентрують у вакуумі, що приводить до одержання маслянистого залишку. Це масло розподіляють між EtOAc та сольовим розчином, органічний екстракт сушать над Na 2SO4, фільтрують та концентрують у вакуумі. Силікагелева хроматографія (5 % MeOH у DCM) забезпечує одержання 5-ізопропокси-2-(1-метил-піперидин-4-іл)-6-нітро-індан-1-ону; MS m/z 333,2 (M+1). Стадії 2 та 3 Слідуючи процедурам, описаним вище (Приклад 1, Стадії 7 та 8), використовуючи продукт зі Стадії 1, одержують заголовну сполуку 6-{5-Хлор-4-[2-(пропан-2-сульфоніл)-феніламіно]піримідин-2-іламіно}-5-ізопропокси-2-(1-метил-піперидин-4-іл)-2,3-дигідро-ізоіндол-1-он (181) у 1 вигляді білої твердої речовини. H ЯМР 400 МГц (ДМСО-d6 зі слідовими кількостями D2O) δ 8,46 (d, 1H), 8,35 (s, 1H), 8,09 (s, 1H), 7,82 (d, 1H), 7,74 (t, 1H), 7,36 (t, 1H), 7,33 (s, 1H), 4,75 (m, 1H), 4,41 (s, 2H), 4,29 (m, 1H), 3,65 (m, 2H), 3,44 (m, 1H), 3,17 (t, 2H), 2,79 (s, 3H), 2,07 (m, 2H), 1,98 (d, 2H), 1,28 (d, 6H), 1,14 (d, 6H); MS m/z 613 (M+1). Приклад 3 2 4 5-Метил-N -[4-метил-5-(1-метил-1H-піразол-4-іл)-2-(піперидин-4-ілокси)-феніл]-N -[2(пропан-2-сульфоніл)-феніл]-піримідин-2,4-діамін (35) H N N NH N N O S OH O N N 25 Стадія 1: 4-(4-Хлор-5-метил-2-нітро-фенокси)-піперидин-1-карбонової бутиловий складний ефір Cl кислоти трет O2 N O N 30 Boc До суміші 4-хлор-5-метил-2-нітро-фенолу (3,752 г, 20,0 ммоль), 4-гідрокси-піперидин-1карбонової кислоти трет-бутилового складного ефіру (4,83 г, 24 ммоль), та трифенілфосфіну (6,23 г, 24 ммоль) у 75 мл ТГФ додають діізопропіл-азодикарбоксилат (4,73 мл, 245 ммоль) декількома частинами при 22 °C впродовж 1 години. Реакційну суміш перемішують при тій же температурі впродовж ще 2 годин. Реакційну суміш концентрують у вакуумі. Залишок переносять у 50 мл ефіру, та залишають стояти при 22 °C впродовж 14 годин. Отримані кристали видаляють фільтруванням. Фільтрат концентрують у вакуумі, та залишок очищують на 24 UA 100846 C2 5 330 г SiO2 колонці (ISCO), використовуючи градієнт 20-40 % етилацетату у гексанах як елюент, що забезпечує одержання 4-(4-хлор-5-метил-2-нітро-фенокси)-піперидин-1-карбонової кислоти трет-бутилового складного ефіру у вигляді темно-жовтого в'язкого масла. MS (ES+); 315,1 (MH+ + - C4H8), 393,1 (MNa ). Стадія 2: 4-[5-Метил-4-(1-метил-1H-піразол-4-іл)-2-нітро-фенокси]-піперидин-1-карбонової кислоти трет-бутиловий складний ефір N N O2N O N 10 15 20 Boc Суміш 4-(4-хлор-5-метил-2-нітро-фенокси)-піперидин-1-карбонової кислоти трет-бутилового складного ефіру з попередньої стадії (375,8 мг, 1,01 ммоль), 1-метил-4-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1H-піразолу (Boron Molecular, 224,4 мг 1,08 ммоль), калію фосфату триосновного моногідрату (392 мг), Pd2(dba)3 (45 мг), та дициклофосфінобіфенілу (43 мг) у 4 мл 1,4-діоксану/H2O (3/1) нагрівають у запаяній пробірці при 150 °C впродовж 20 хвилин при мікрохвильовому опроміненні. Реакційну суміш фільтрують через невеликий фільтр з Целіту, сушать над Na2SO4 та концентрують. Залишок очищують, використовуючи SiO 2 колонку (ISCO), що забезпечує одержання 4-[5-метил-4-(1-метил-1H-піразол-4-іл)-2-нітро-фенокси]-піперидин-1+ + карбонової кислоти трет-бутилового складного ефіру. MS (ES+); 417,3 (MH ), 439,2 (MNa ). Стадії 3, 4 та 5 Використовуючи ту саму процедуру, що описана у синтезі Прикладу 1 (Стадії 7, 8 та 9), та 2 кінцеве очищення, використовуючи препаративну RP LC-MS, одержують 5-метил-N -[4-метил-54 (1-метил-1H-піразол-4-іл)-2-(піперидин-4-ілокси)-феніл]-N -[2-(пропан-2-сульфоніл)-феніл]+ піримідин-2,4-діамін (35). MS (ES+): 576,3 (MH ). Приклад 4 1-(5-{5-Хлор-4-[2-(пропан-2-сульфоніл)-феніламіно]-піримідин-2-іламіно}-4-ізопропокси-2метил-феніл)-етанон (36) Cl N N H O S O 25 N NH O O Стадія 1: 2-(4-Ізопропокси-2-метил-5-нітро-феніл)-2-метил-[1,3]діоксолан NO2 O O O 30 35 Суміш 1-(4-ізопропокси-2-метил-5-нітро-феніл)-етанону (0,788 г, 3,32 ммоль), етиленгліколю (1,8 мл), та п-толуолсульфонової кислоти моногідрату (6,3 мг) у 60 мл бензолу нагрівають при зрошенні з уловлювачем Діна-Старка впродовж 18 годин. Реакційну суміш розбавляють з 100 мл етилацетату та послідовно промивають за допомогою водного насиченого розчину NaHCO 3, H2O, та насиченого сольового розчину по 100 мл кожного. Органічну фазу сушать над безводним Na2SO4, фільтрують та концентрують у вакуумі, що забезпечує одержання 2-(4ізопропокси-2-метил-5-нітро-феніл)-2-метил-[1,3]діоксолану у вигляді жовтих кристалів. MS + (ES+): 282,2 (MH ). Стадії 2 та 3: 5-Хлор-N2-[2-ізопропокси-4-метил-5-(2-метил-[1,3]діоксолан-2-іл)-феніл]-N4-[2(пропан-2-сульфоніл)-феніл]-піримідин-2,4-діамін 25 UA 100846 C2 Cl N O O O 5 10 15 NH N N O S OH Використовуючи ту саму процедуру, що описана у синтезі Прикладу 1 (Стадії 7 та 8), застосовуючи 2-(4-ізопропокси-2-метил-5-нітро-феніл)-2-метил-[1,3]діоксолан з попередньої стадії як вихідний матеріал та очищення, використовуючи силікагелеву хроматографію (градієнт 2 % - 20 % EtOAc у гексанах), одержують 5-хлор-N2-[2-ізопропокси-4-метил-5-(2-метил[1,3]діоксолан-2-іл)-феніл]-N4-[2-(пропан-2-сульфоніл)-феніл]-піримідин-2,4-діамін у вигляді + + білої твердої речовини. MS (ES ): 561,2 (MH ). Стадія 4 Розчин 5-Хлор-N2-[2-ізопропокси-4-метил-5-(2-метил-[1,3]діоксолан-2-іл)-феніл]-N4-[2(пропан-2-сульфоніл)-феніл]-піримідин-2,4-діаміну з попередньої стадії (84 мг, 0,15 ммоль) у 5 мл 1,4-діоксану обробляють за допомогою 1 мл водного розчину 1N HCl при 22 °C впродовж 2 годин. Реакційну суміш обробляють та це забезпечує одержання 1-(5-{5-хлор-4-[2-(пропан-2сульфоніл)-феніламіно]-піримідин-2-іламіно}-4-ізопропокси-2-метил-феніл)-етанону (36). MS + + (ES ): 517,2 (MH ). Приклад 5 2 4 N -{2-Ізопропокси-4-метил-5-[1-(2-морфолін-4-іл-етил)-1H-піразол-4-іл]-феніл}-5-метил-N -[2(пропан-2-сульфоніл)-феніл]-піримідин-2,4-діамін (37) O N N N N N O S OH N N H O Стадія 1: 4-Бром-5-метил-2-нітро-фенол NO2 OH Br 20 25 4-Бром-3-метил-фенол (1,122 г, 6,00 ммоль) та Yb(CF3SO3)3 (372 мг) у 30 мл дихлорметану обробляють за допомогою 0,38 мл конц. HNO 3 при 22 °C. Після перемішування при тій же температурі впродовж 1 години, додають додаткові 0,1 мл конц. HNO 3, та реакційну суміш перемішують впродовж ще однієї години. Реакційну суміш промивають за допомогою H 2O, сушать над безводним сульфатом натрію, фільтрують та концентрують. Залишок очищують, використовуючи SiO2 колонку (ISCO), що забезпечує одержання суміші 4-бром-5-метил-2-нітрофенолу у вигляді жовтих кристалів та його регіоізомерного побічного продукту у вигляді помаранчевих кристалів. Стадія 2: 1-Бром-4-ізопропокси-2-метил-5-нітро-бензол NO2 O Br 30 До суміші 4-бром-5-метил-2-нітро-фенолу з попередньої стадії (0,66 г, 2,84 ммоль), 2пропанолу (0,262 мл), та трифенілфосфіну (894 мг) у 10 мл ТГФ додають діізопропіл 26 UA 100846 C2 азодикарбоксилат (0,671 мл) при 22 °C. Реакційну суміш концентрують у вакуумі. Залишок очищують, використовуючи SiO2 колонку (ISCO), що забезпечує одержання 1-бром-4ізопропокси-2-метил-5-нітро-бензолу у вигляді світло-жовтої твердої речовини. Стадія 3: 5-Бром-2-ізопропокси-4-метил-феніламін NH2 O Br 5 10 15 До 1-бром-4-ізопропокси-2-метил-5-нітро-бензолу з попередньої стадії (0,734 г, 2,68 ммоль) та заліза (порошок, 325 меш, 1,05 г) у 20 мл етанолу додають 1 мл 1N водного розчину HCl при охолоджені у льодяній бані. Після цього додавання, реакційну суміш нагрівають при зрошенні впродовж 2 годин. Потім додають додаткові 0,5 г заліза та реакційну суміш нагрівають при зрошенні впродовж додаткових 2 годин. Реакційну суміш охолоджують та фільтрують через фільтр з Целіту. Фільтрат концентрують у вакуумі, що забезпечує одержання 5-бром-2ізопропокси-4-метил-феніламіну у вигляді помаранчевого масла. Зазначений продукт використовують у наступній стадії без додаткового очищення. Стадія 4: N2-(5-Бром-2-ізопропокси-4-метил-феніл)-5-метил-N4-[2-(пропан-2-сульфоніл)феніл]-піримідин-2,4-діамін Br N N O S OH 20 25 30 35 N H N O 5-Бром-2-ізопропокси-4-метил-феніламін з попередньої стадії (537 мг, 2,20 ммоль) та 2хлор-N-(2-(ізо-пропілсульфоніл)-феніл)-5-метилпіримідин-4-амін (Проміжна сполука 1, 652 мг, 2,00 ммоль) у присутності метансульфонової кислоти (0,143 мл) у 4 мл 2-пропанолу конденсують при 140 °C впродовж 30 хвилин у запаяній пробірці при мікрохвильовому опроміненні. Після обробки одержують N2-(5-бром-2-ізопропокси-4-метил-феніл)-5-метил-N4-[2+ (пропан-2-сульфоніл)-феніл]-піримідин-2,4-діамін. MS (ES+): 535,1 (MH ). Стадія 5 Суміш N2-(5-бром-2-ізопропокси-4-метил-феніл)-5-метил-N4-[2-(пропан-2-сульфоніл)-феніл]піримідин-2,4-діаміну з попередньої стадії (53 мг, 0,099 ммоль), 4-{2-[4-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-піразол-1-іл]-етил}-морфоліну (Boron Molecular, 61 мг 0,20 ммоль), K3PO4 (58 мг), Pd2(dba)3 (10 мг), та трициклогексилфосфіну (8 мг) у 1 мл суміші 1,4-діоксан/H2O (3/1 об'єм/об'єм) нагрівають у запечатаній пробірці при 150 °C впродовж 20 хвилин при мікрохвильовому опроміненні. Реакційну суміш фільтрують через невеликий фільтр з Целіту та концентрують. Кінцеве очищення, використовуючи препаративну RP LC-MS, забезпечує одержання N2-{2-ізопропокси-4-метил-5-[1-(2-морфолін-4-іл-етил)-1H-піразол-4-іл]-феніл}-5+ + метил-N4-[2-(пропан-2-сульфоніл)-феніл]-піримідин-2,4-діаміну (37). MS (ES ): 634,3 (MH ). Приклад 6 5-Хлор-N2-(2-ізопропокси-5-метил-4-морфолін-4-ілметил-феніл)-N4-[2-(пропан-2-сульфоніл)феніл]-піримідин-2,4-діамін (60) Cl OHN O S N N N N H O O Стадії 1 та 2: 1-Хлор-5-ізопропокси-2-метил-4-нітро-бензол 27 UA 100846 C2 CHO O2N O 5 10 15 20 До суміші 1-хлор-2-метил-4-нітро-5-ізопропокси-бензолу (Проміжна сполука 4, 870 мг, 3,77 ммоль), вінілборної кислоти дибутилового складного ефіру (1,24 мл, 5,6 ммоль), та карбонату натрію (2,8 г, 26,4 ммоль) у суміші ТГФ/H2O (20/5 мл) додають дихлорбіс(трифенілфосфін) паладій (II) (132 мг, 5 % ммоль). Реакційну пробірку закривають, цю суміш обробляють N 2 впродовж 3 хвилин та потім нагрівають при 90 °C у атмосфері N2 впродовж ночі. Реакційну суміш охолоджують до кімнатної температури та виливають у насичений водний розчин хлориду амонію. Сиру реакційну суміш екстрагують за допомогою етилацетату (3 × 100 мл). Органічні екстракти об'єднують, промивають сольовим розчином та концентрують. Сирий продукт очищують за допомогою силікагелевої колонкової хроматографії (10 % етилацетат у гексанах), що приводить до одержання 1-метил-5-нітро-4-пропокси-2-вініл-бензолу у вигляді жовтої твердої речовини. 1-Метил-5-нітро-4-пропокси-2-вініл-бензол, отриманий у попередній стадії (360 мг, 1,63 ммоль), розчиняють у DCM (20 мл) та охолоджують до -78 °C. O3 (г.) барботують у зазначений розчин, поки колір розчину не стане блакитним/сірим. Потім розчин знову барботують N2 (г.), поки блакитний колір не зникне. Зазначений розчин нагрівають до кімнатної температури та обробляють трифенілфосфіновим полімером (2 г), попередньо розбухлим у DCM (30 мл). Через 30 хвилин, зазначену суміш фільтрують, та фільтрат концентрують, що приводить до одержання 2-метил-4-нітро-5-пропокси-бензальдегіду у вигляді жовтої твердої речовини. Стадії 3 та 4: 2-Ізопропокси-5-метил-4-морфолін-4-ілметил-феніламін N O H2N O 25 30 35 40 45 До розчину 2-метил-4-нітро-5-пропокси-бензальдегіду отриманого у попередній стадії (34 мг, 0,152 ммоль) у суміші MeOH/ТГФ (0,5/0,5 мл), додають оцтову кислоту (5 крапель). Зазначену суміш перемішують при кімнатній температурі впродовж 1 години. Потім додають ціаноборгідрид натрію (20 мг, 0,30 ммоль). Після перемішування впродовж 30 хвилин, реакцію гасять додаванням насиченого водного розчину хлориду амонію. Реакційну суміш екстрагують за допомогою етилацетату (3 × 5 мл). Органічні фази об'єднують та концентрують, що приводить до одержання амінного продукту у вигляді жовтого масла, яке безпосередньо використовують у наступній стадії без додаткового очищення. До розчину продукту, отриманого у попередній стадії, у метанолі (5 мл), додають Pd/C (10 % на вугіллі, 2 мг). Зазначену суміш гідрогенують при 1 атм. водню. Через 4 години, суміш фільтрують та концентрують. Отриманий аніліновий продукт (жовта тверда речовина) використовують у наступній стадії без додаткового очищення. Стадія 5 До суміші анілінового продукту, отриманого у попередній стадії, (0,152 ммоль), (2,5-дихлорпіримідин-4-іл)-[2-(пропан-2-сульфоніл)-феніл]-аміну (Проміжна сполука 2, 52 мг, 0,152 ммоль), карбонату цезію (99 мг, 0,30 ммоль) та ксантфосу (8 мг, 0,02 ммоль) у ТГФ (2 мл), додають ацетат паладію (2 мг, 5 % ммоль) у мікрохвильовій пробірці. Зазначену суміш барботують N 2 впродовж 3 хвилин та потім закриту пробірку нагрівають при 150 °C впродовж 20 хвил. при мікрохвильовому опроміненні. Реакційну суміш фільтрують, концентрують, та очищують за допомогою мас-тригерної препаративної RP LC-MS, що приводить до одержання заголовної 2 4 сполуки 5-хлор-N -(2-ізопропокси-5-метил-4-морфолін-4-ілметил-феніл)-N -[2-(пропан-21 сульфоніл)-феніл]-піримідин-2,4-діаміну (60) у вигляді жовтої твердої речовини: H ЯМР (400 МГц, CDCl3) δ 10,35 (s, 1H), 8,38 (d, 1H0, 7,93 (d, 1H), 7,59 (m, 2H), 7,41-7,36 (m, 2H), 4,70-4,63 (br, 1H), 4,30-4,18 (br, 2H), 4,15-4,10 (br, 2H), 4,00-3,97 (br, 2H), 3,52-3,46 (br, 2H), 3,20 (m, 1H), + 2,95-2,84 (br, 2H), 2,24 (s, 3H), 1,31 (d, 12H); ESMS m/z 574,2 (M+H ). Приклад 7 2 4 5-Хлор-N -(2-ізопропокси-5-метил-4-піперидин-4-іл-феніл)-N -[2-(пропан-2-сульфоніл) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds and compositions as protein kinase inhibitors
Автори англійськоюMichellys, Pierre-Yves, Pei, Wei, Marsilje, Thomas H., Lu, Wenshuo, Chen, Bei, Uno, Tetsuo, Jin, Yunho, Jiang, Tao
Назва патенту російськоюСоединения и композиция как ингибиторы протеинкиназы
Автори російськоюМишеле Пьер-Ив, Пей Уэй, Марсилье Томас Х., Лу Уэншуо, Чен Бей, Уно Тетсуо, Джин Юнхо, Джианг Тао
МПК / Мітки
МПК: C07D 239/48, C07D 403/14, C07D 239/95, C07D 403/12, C07D 453/02, C07D 417/12, C07D 487/08, C07D 401/12, C07D 451/02, C07D 213/74, C07D 471/04, C07D 401/14, C07D 473/16, C07D 413/12, C07D 487/04
Мітки: композиція, сполуки, інгібітори, протеїнкінази
Код посилання
<a href="https://ua.patents.su/119-100846-spoluki-ta-kompoziciya-yak-ingibitori-protenkinazi.html" target="_blank" rel="follow" title="База патентів України">Сполуки та композиція як інгібітори протеїнкінази</a>
Попередній патент: Сільськогосподарська збиральна машина та спосіб встановлення підбарабання у секції молотильного апарата сільськогосподарської машини
Наступний патент: Аптамер проти мідкайну і його застосування
Випадковий патент: Бочка сталева