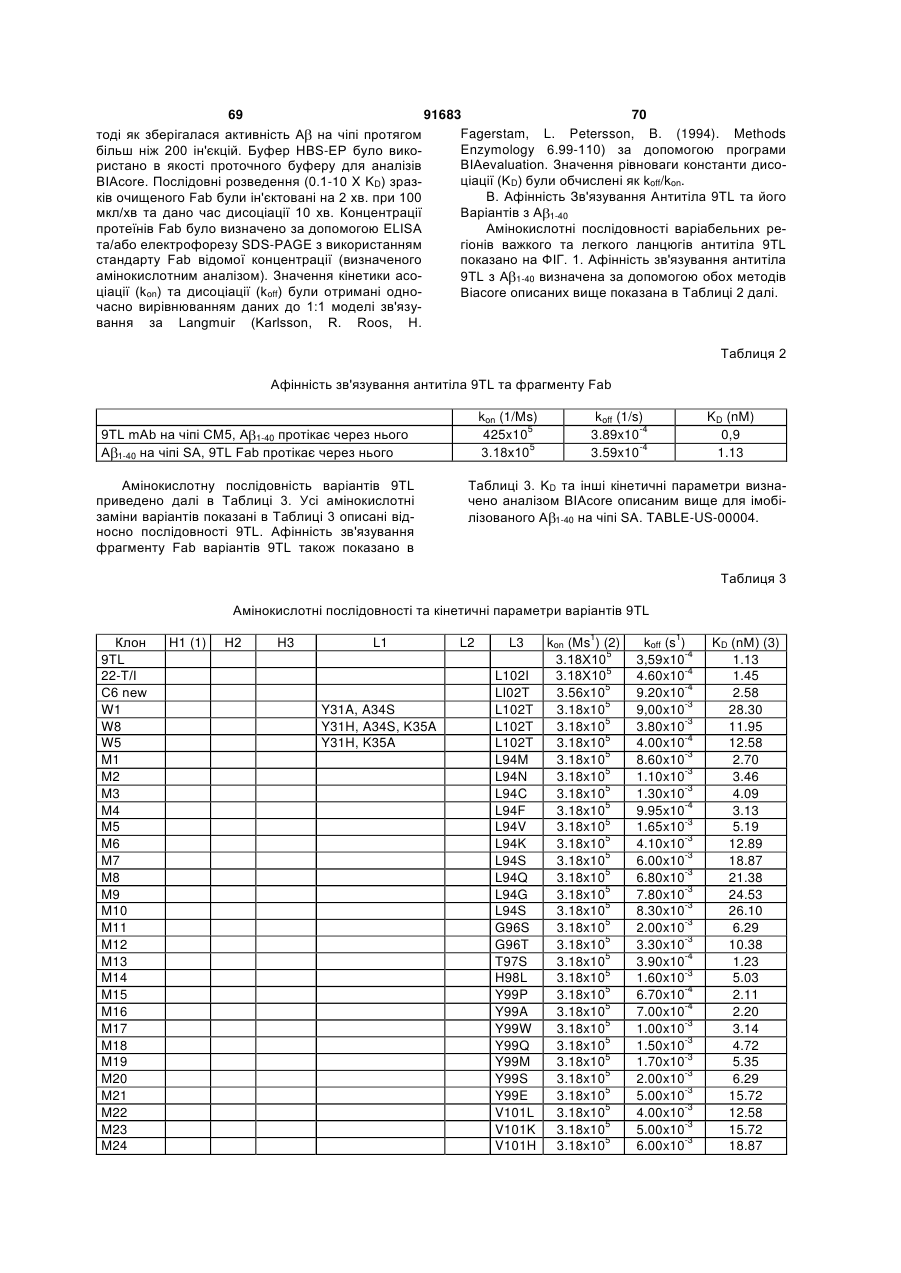
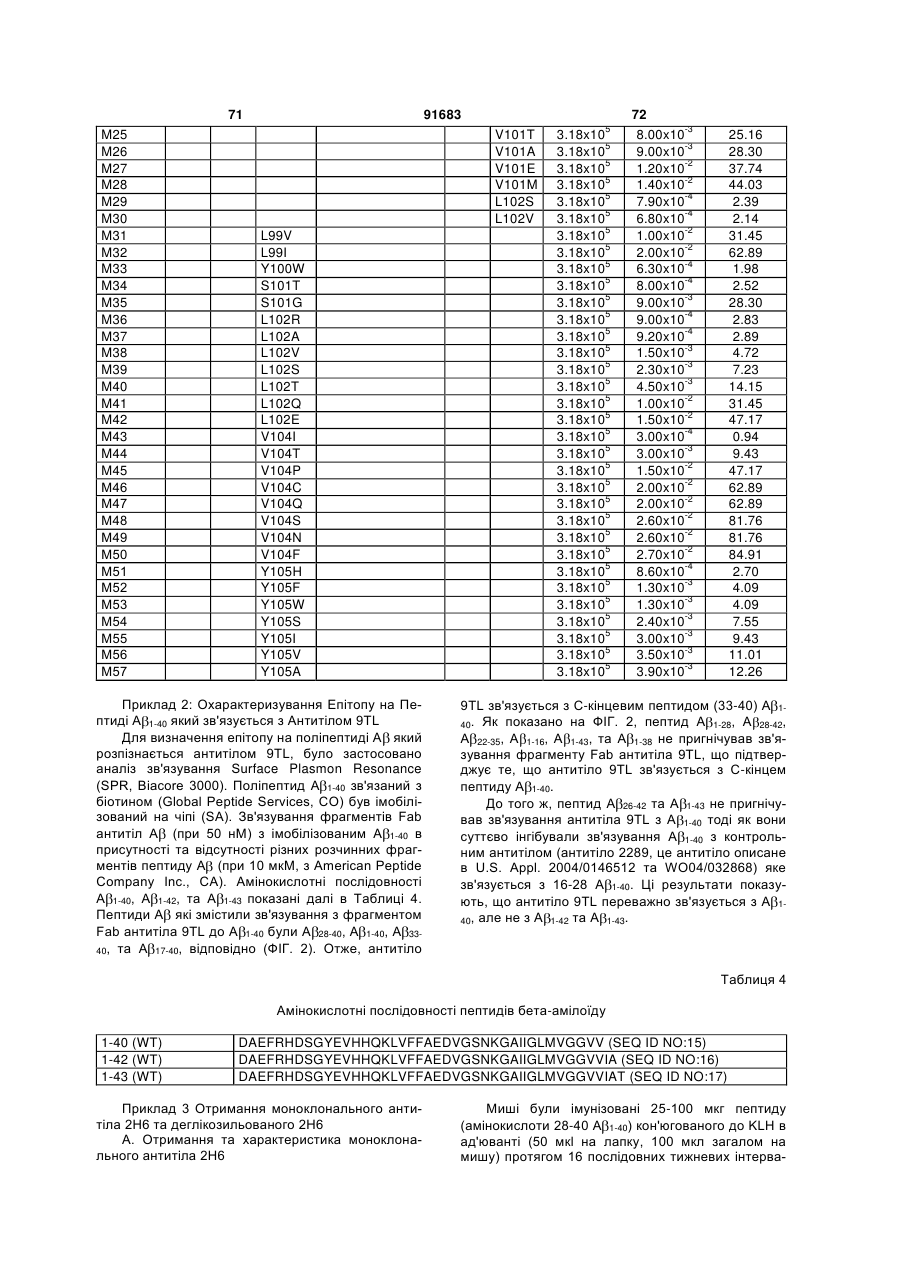
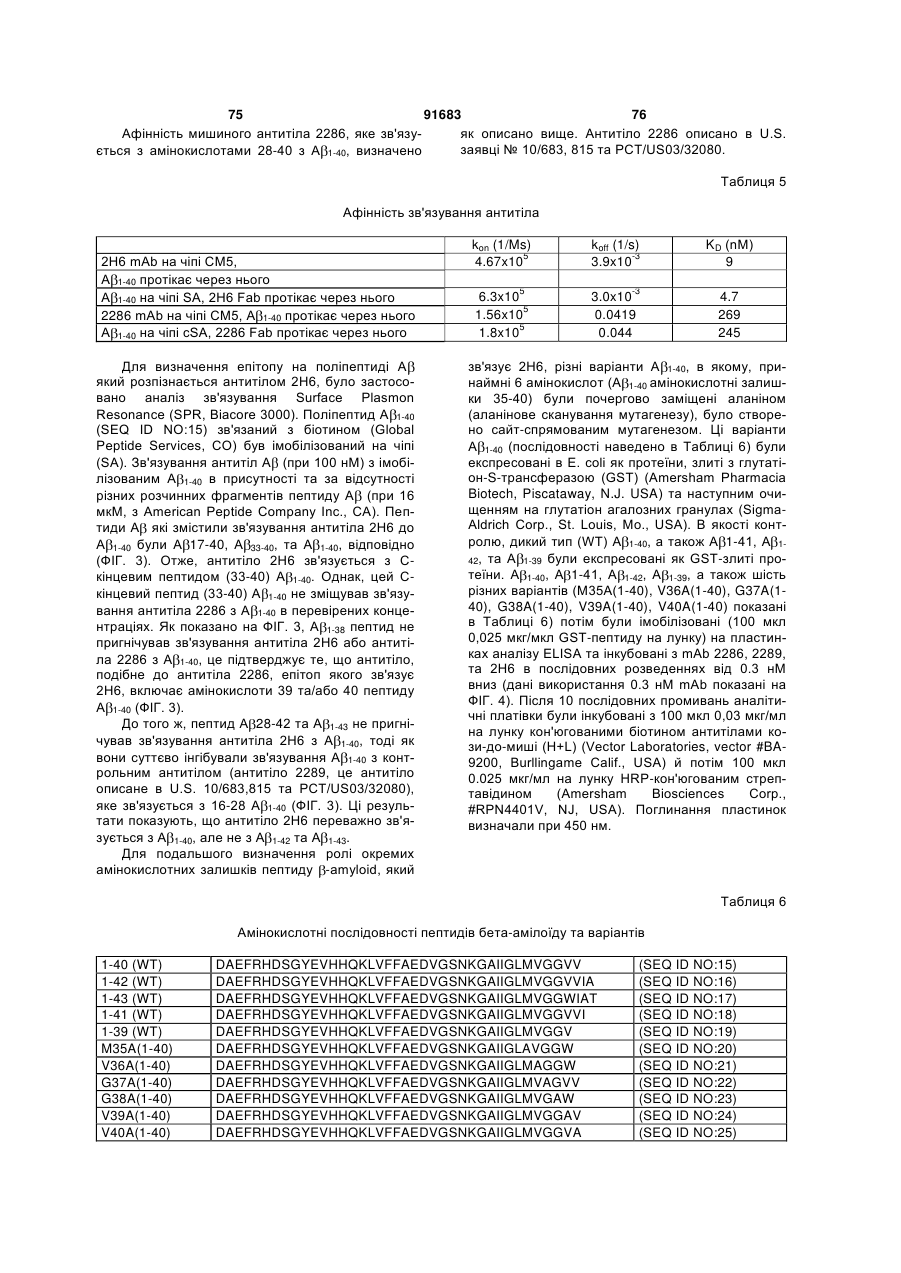
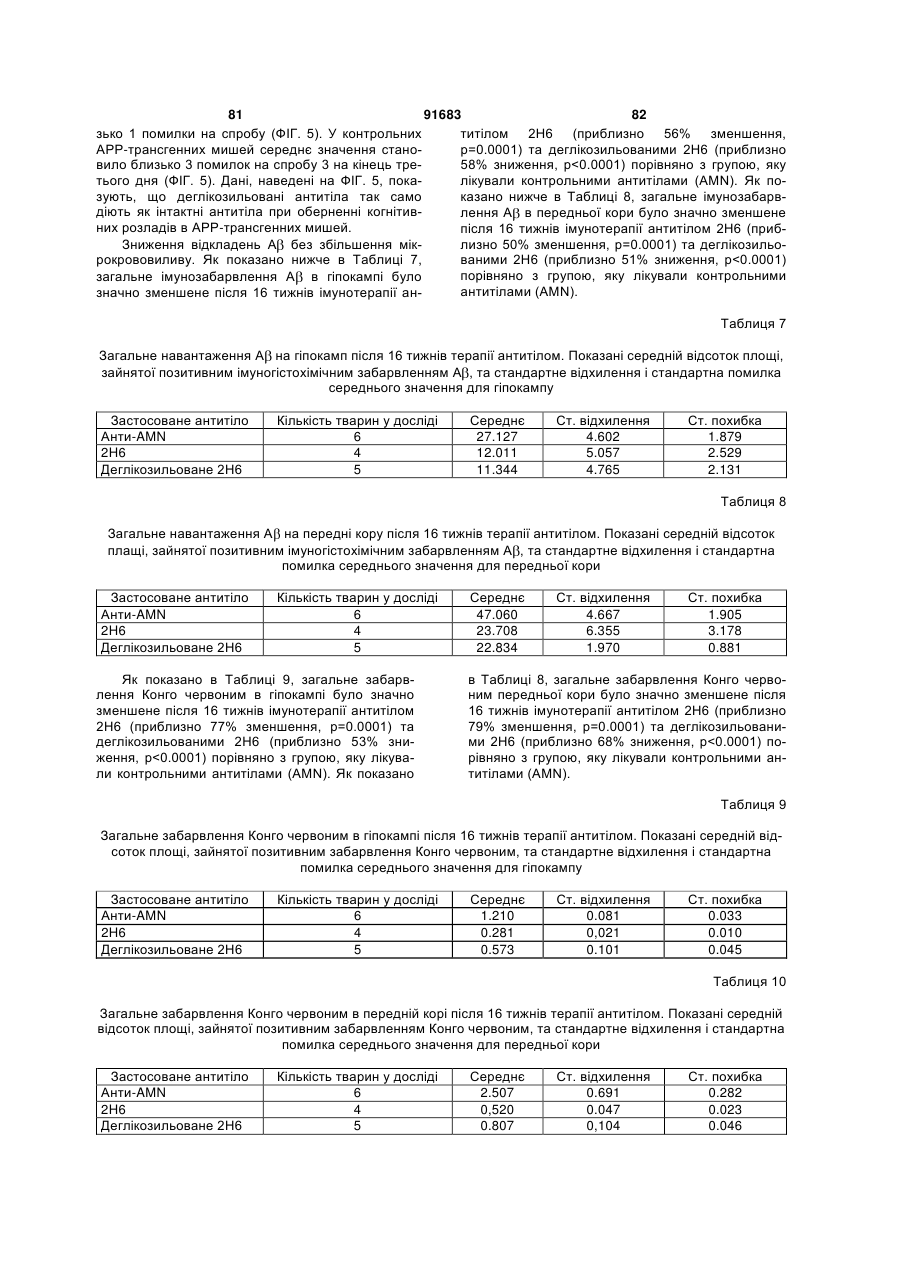
Антитіла, спрямовані проти бета-амілоїдного пептиду, та способи їх застосування
Номер патенту: 91683
Опубліковано: 25.08.2010
Автори: Понс Яуме, Грімм Ян Маркус, Хо Вей-Хсієн, Розенталь Арнон
Формула / Реферат
1. Спосіб лікування захворювання, що полягає в порушеному відкладанні β-амілоїду в особи, який включає введення особі ефективної кількості антитіл, які специфічно зв’язуються з пептидом β-амілоїду або агрегованою формою пептиду β-амілоїду, причому антитіло містить
варіабельний регіон важкого ланцюга, що включає:
(a) CDR1 регіон, показаний на SEQ ID NO:3;
(b) CDR2 регіон, показаний на SEQ ID NO:4; і
(c) CDR3 регіон, показаний на SEQ ID NO:5; і
варіабельний регіон легкого ланцюга, що включає:
(d) CDR1 регіон, показаний на SEQ ID NO:6;
(e) CDR2 регіон, показаний на SEQ ID NO:7; і
(f) CDR3 регіон, показаний на SEQ ID NO:8.
2. Спосіб за пунктом 1, де особою є людина.
3. Спосіб за пунктом 1, де хвороба є хворобою Альцгеймера.
4. Спосіб за пунктом 1, де хвороба є синдромом Дауна.
5. Спосіб за пунктом 1, де хвороба є церебральною амілоїдною ангіопатією.
6. Спосіб за пунктом 1, де антитіло є моноклональним антитілом.
7. Спосіб за пунктом 1, де антитіло є гуманізованим антитілом.
8. Спосіб за пунктом 1, де антитіло є антитілом людини.
9. Спосіб за пунктом 1, де антитіло зв’язується з пептидом Aβ із KD, приблизно, 100 нМ або менше.
10. Спосіб за пунктом 1, де антитіло зв’язується з пептидом Aβ із KD, приблизно, 20 нМ або менше.
11. Спосіб за пунктом 1, де антитіло зв’язується з пептидом Aβ із KD, приблизно, 2 нМ або менше.
12. Спосіб за пунктом 1, де антитіло зв’язується з С-кінцем пептиду Aβ.
13. Спосіб за пунктом 1, де антитіло специфічно зв’язується з епітопом в межах залишків 28-40 в Aβ1-40, 28-42 в Aβ1-42 або 28-43 в Aβ1-43.
14. Спосіб за пунктом 1, де антитіло специфічно зв’язується з С-кінцем пептиду Aβ вибраного з групи, яка включає Aβ1-36, Aβ1-37, Aβ1-38, Aβ1-39, Aβ1-40, Aβ1-42 та Aβ1-43.
15. Спосіб за пунктом 1, де антитіло специфічно зв’язується з епітопом Aβ1-40, який включає амінокислоти 39 та/або 40.
16. Спосіб за пунктом 15, де антитіло містить варіабельний регіон важкого ланцюга, який включає амінокислотну послідовність, наведену в SEQ ID NO: 1, та варіабельний регіон легкого ланцюга, який включає амінокислотну послідовність, наведену в SEQ ID NO:2.
17. Спосіб за пунктом 1, де антитіло зв’язується з пептидом Aβ1-40 з афінністю, вищою ніж з Aβ1-42 або Aβ1-43.
18. Спосіб за пунктом 16, де антитіло містить варіабельний регіон важкого ланцюга, який включає амінокислотну послідовність SEQ ID NO:11, та варіабельний регіон легкого ланцюга, який включає амінокислотну послідовність SEQ ID NO:12.
19. Спосіб за пунктом 1, де антитіло містить Fc регіон, що має погіршене функціонування ефектора.
20. Спосіб за пунктом 1, де антитіло специфічно зв’язується з епітопом в межах залишків 16-28 пептиду Aβ.
21. Спосіб за пунктом 20, де регіон Fc антитіла не є N-глікозильованим або має фрагменти N-глікозилювання, які змінені порівняно із природним регіоном Fc.
22. Спосіб за пунктом 20, де регіон Fc антитіла має мутацію в послідовності розпізнавання фрагменту N-глікозилювання, причому регіон Fc не є N-глікозильованим.
23. Спосіб за пунктом 20, де регіон Fc антитіла є регіоном Fc важкого ланцюга IgG2a людини, який має амінокислотну мутацію з аланіну на серин в положенні 330 та з проліну на серин в положенні 331, де амінокислотні положення обчислюються за Kabat відносно послідовності дикого типу IgG2a людини.
24. Спосіб за пунктом 1, де антитіло містить регіон Fc, який має змінену форму природного регіону Fc, де зміни призводять до погіршеного функціонування ефектора.
25. Спосіб за пунктом 24, де введення антитіла зі змінами в регіоні Fc спричиняє менший мозковий мікрокрововиток, ніж застосування антитіла без змін.
26. Спосіб за пунктом 24, де особою є людина.
27. Спосіб за пунктом 24, де хвороба є хворобою Альцгеймера.
28. Спосіб за пунктом 24, де антитіло є моноклональним антитілом.
29. Спосіб за пунктом 24, де антитіло є гуманізованим антитілом.
30. Спосіб за пунктом 24, де антитіло є антитілом людини.
31. Спосіб за пунктом 24, де антитіло зв’язується з пептидом Aβ із KD, приблизно, 100 нМ або менше.
32. Спосіб за пунктом 24, де антитіло зв’язується з пептидом Aβ із KD, приблизно, 20 нМ або менше.
33. Спосіб за пунктом 24, де антитіло зв’язується з пептидом Aβ із KD, приблизно, 2 нМ або менше.
34. Спосіб за пунктом 24, де антитіло специфічно зв’язується з епітопом в межах залишків 28-40 в Aβ1-40, 28-42 в Aβ1-42, або 28-43 в Aβ1-43.
35. Спосіб за пунктом 24, де антитіло специфічно зв’язується з С-кінцем пептиду Aβ, вибраного з групи, яка включає Aβ1-36, Aβ1-37, Aβ1-38, Aβ1-39, Aβ1-40, Aβ1-42 та Aβ1-43.
36. Спосіб за пунктом 24, де антитіло специфічно зв’язується з епітопом Aβ1-40, який включає амінокислоти 39 та/або 40.
37. Спосіб за пунктом 36, де антитіло містить варіабельний регіон важкого ланцюга, який включає амінокислотну послідовність SEQ ID NO:1, та варіабельний регіон легкого ланцюга, який включає амінокислотну послідовність SEQ ID NO:2.
38. Спосіб за пунктом 24, де антитіло зв’язується з пептидом Aβ1-40 з вищою афінністю ніж до Aβ1-42 або Aβ1-43.
39. Спосіб за пунктом 37, де антитіло містить важкий ланцюг, що включає амінокислотну послідовність SEQ ID NO:11, та легкий ланцюг, що включає амінокислотну послідовність SEQ ID NO:12.
40. Спосіб за пунктом 39, де антитіло містить варіабельний регіон важкого ланцюга, який включає амінокислотну послідовність SEQ ID NO:1, та варіабельний регіон легкого ланцюга, який включає амінокислотну послідовність SEQ ID NO:2.
41. Спосіб за пунктом 24, де регіон Fc антитіла не є N-глікозильованим або має фрагмент N-глікозилювання, змінений порівняно із природним регіоном Fc.
42. Спосіб за пунктом 24, де регіон Fc антитіла має мутацію в послідовності розпізнавання фрагменту N-глікозилювання, причому регіон Fc не є N-глікозильованим.
43. Спосіб за пунктом 24, де регіон Fc антитіла є регіоном Fc важкого ланцюга IgG2a людини, який має амінокислотну мутацію з аланіну на серин в положенні 330 та з проліну на серин в положенні 331, де амінокислотні положення обчислюються за Kabat відносно послідовності дикого типу IgG2a людини.
44. Антитіло, що специфічно зв’язує β-амілоїдний пептид, де антитіло включає:
варіабельний регіон важкого ланцюга, який містить:
(a) регіон CDR1, наведений в SEQ ID NO:3;
(b) регіон CDR2, наведений в SEQ ID NO:4; та
(c) регіон CDR3, наведений в SEQ ID NO:5, де L1 є L, V або I; де Y2 є Y або W; де S3 є S, T або G; де L4 є L, R, A, V, S, T, Q або E; де V6 є V, I, T, P, C, Q, S, N або F; та де Y7 є Y, H, F, W, S, I, V або A,
варіабельний регіон легкого ланцюга, який містить:
(d) регіон CDR1, наведений в SEQ ID NO:6, де Y8 є Y, A або H; де A11 є A або S; та де K12 є K або A;
(e) регіон CDR2, наведений в SEQ ID NO:7; та
(f) регіон CDR3, наведений в SEQ ID NO:8, де L1 є L, M, N, C, F, V, K, S, Q, G, S; де G3 є G, S або T; де T4 є T або S; де H5 є H або L; де Y6 є Y, P, A, W, Q, M, S або E; де V8 є V, L, K, H, T, A, E або M; та де L9 є L, I, T, S або V.
45. Антитіло за пунктом 44, де згаданий варіабельний регіон важкого ланцюга містить:
(a) регіон CDR1, наведений в SEQ ID NO:3;
(b) регіон CDR2, наведений в SEQ ID NO:4; та
(c) регіон CDR3, наведений в SEQ ID NO:5.
46. Антитіло за пунктом 44, де згаданий варіабельний регіон легкого ланцюга включає:
(d) регіон CDR1, наведений в SEQ ID NO:6;
(e) регіон CDR2, наведений в SEQ ID NO:7; та
(f) регіон CDR3, наведений в SEQ ID NO:8;
47. Антитіло за пунктом 44, де антитіло є гуманізованим антитілом.
48. Антитіло за пунктом 45, де згаданий варіабельний регіон важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO:1;
49. Антитіло за пунктом 46, де згаданий варіабельний регіон легкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO:2;
50. Антитіло за пунктом 44, де згаданий варіабельний регіон важкого ланцюга містить амінокислотну послідовність, наведену в SEQ ID NO:11; та легкий ланцюг містить амінокислотну послідовність, наведену в SEQ ID NO:12.
51. Антитіло за будь-яким з пунктів 44-50,де антитіло містить регіон Fc, що має погіршене функціонування ефектора.
52. Антитіло за пунктом 51, де регіон Fc антитіла не є N-глікозильованим або має фрагменти N-глікозилювання, змінені порівняно із природним регіоном Fc.
53. Антитіло за пунктом 51, де регіон Fc антитіла має мутацію в послідовності розпізнавання фрагменту N-глікозилювання, причому регіон Fc не є N-глікозильованим.
54. Антитіло за пунктом 51, де регіон Fc антитіла є регіоном Fc важкого ланцюга IgG2a людини, який має амінокислотну мутацію з аланіну на серин в положенні 330 та з проліну на серин в положенні 331, де амінокислотні положення обчислюються за Kabat відносно послідовності дикого типу IgG2a людини.
55. Антитіло, що специфічно зв’язує β-амілоїдний пептид, де антитіло містить:
варіабельний регіон важкого ланцюга, що включає:
(a) CDR1регіон, показаний на SEQ ID NO:3;
(b) CDR2 регіон, показаний на SEQ ID NO:4; і
(c) CDR3регіон, показаний на SEQ ID NO:5; і
варіабельний регіон легкого ланцюга, що включає:
(d) CDR1 регіон, показаний на SEQ ID NO:6;
(e) CDR2 регіон, показаний на SEQ ID NO:7; і
(f) CDR3 регіон, показаний на SEQ ID NO:8.
56. Антитіло за пунктом 55, де антитіло включає регіон Fc, що має погіршене функціонування ефектора.
57. Антитіло за пунктом 55, де регіон Fc антитіла має мутацію в послідовності розпізнавання фрагменту N-глікозилювання, причому регіон Fc не є N-глікозильованим.
58. Антитіло за пунктом 55, де регіон Fc антитіла є регіоном Fc важкого ланцюга IgG2a людини, який має амінокислотну мутацію з аланіну на серин в положенні 330 та з проліну на серин в положенні 331, де амінокислотні положення обчислюються за Kabat, відносно послідовності дикого типу IgG2a людини.
59. Полінуклеотид, який містить послідовність, що кодує антитіло за будь-яким з пунктів 44-58.
60. Вектор, який містить полінуклеотид за пунктом 59.
61. Клітина-хазяїн, яка містить полінуклеотид за пунктом 59.
62. Фармацевтична композиція, яка містить (a) антитіло за будь-яким з пунктів 44-58 та (b) фармацевтично прийнятний наповнювач.
63. Набір, який містить антитіло за будь-яким з пунктів 44-58.
64. Спосіб одержання антитіла, яке специфічно зв’язується з пептидом Aβ, де згаданий спосіб включає культивування клітини-хазяїна, яка містить полінуклеотид згідно пункту 59, в умовах продукування антитіла.
65. Спосіб за пунктом 64, де спосіб додатково включає виділення отриманого антитіла.
Текст
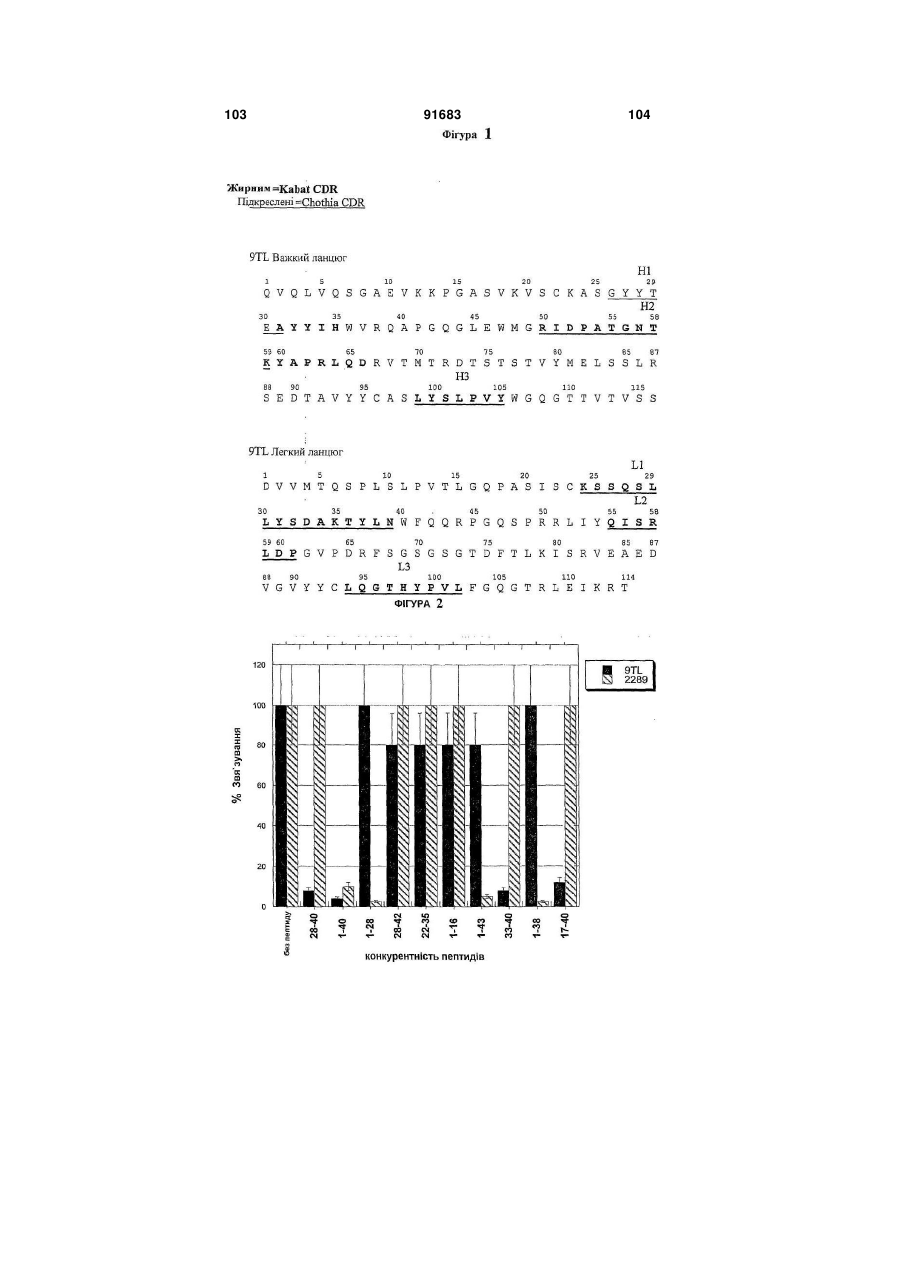
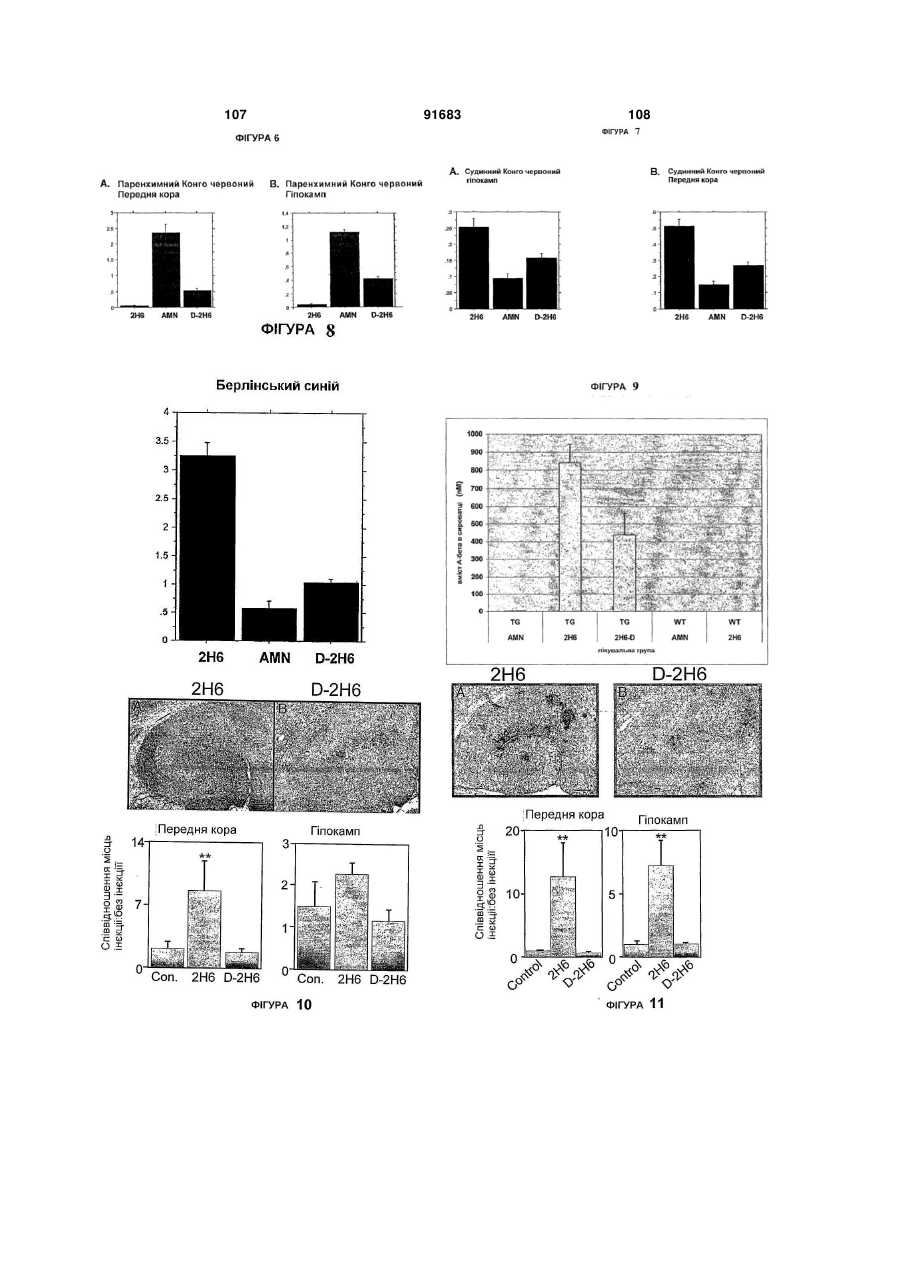
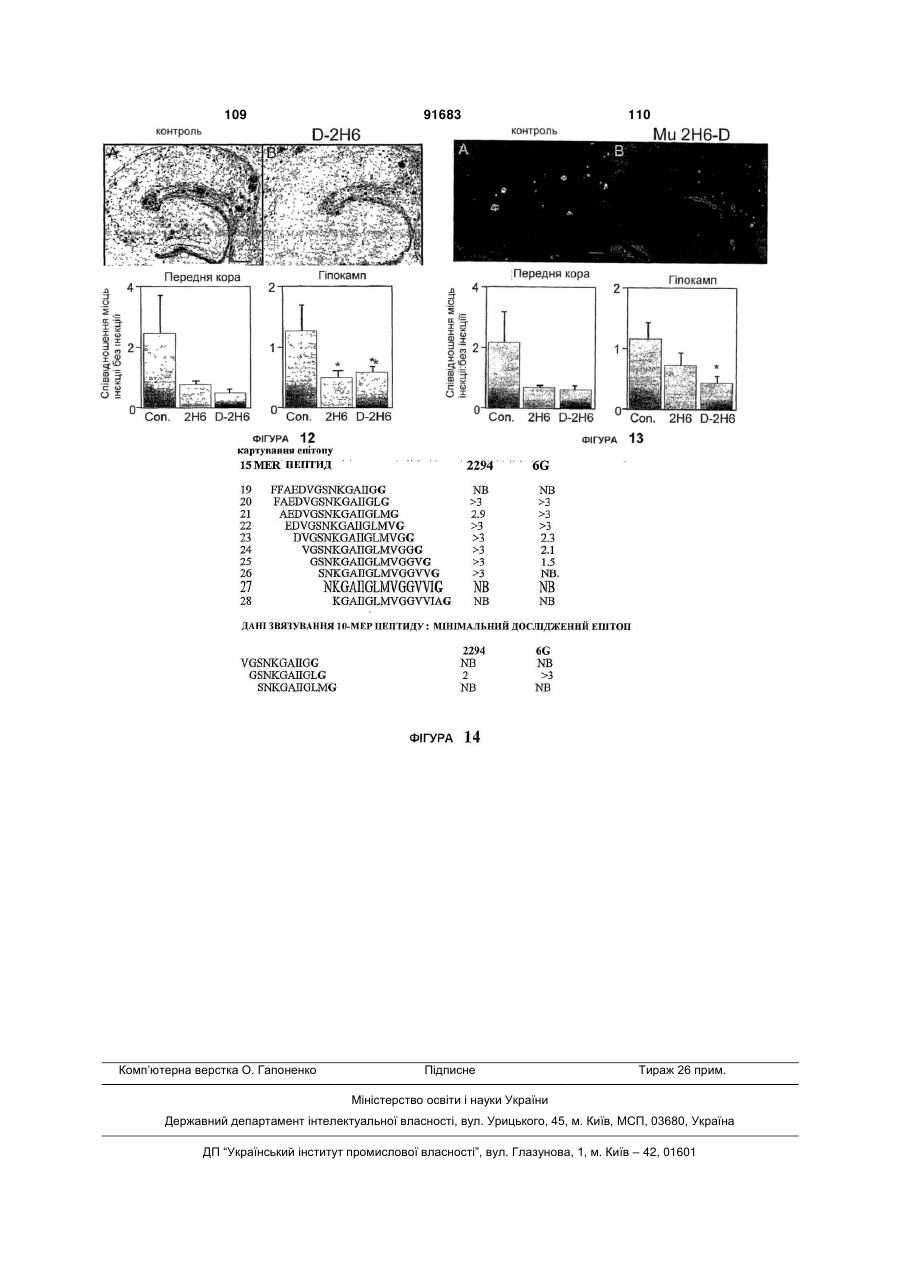
1. Спосіб лікування захворювання, що полягає в порушеному відкладанні β-амілоїду в особи, який включає введення особі ефективної кількості антитіл, які специфічно зв’язуються з пептидом βамілоїду або агрегованою формою пептиду βамілоїду, причому антитіло містить варіабельний регіон важкого ланцюга, що включає: (a) CDR1 регіон, показаний на SEQ ID NO:3; (b) CDR2 регіон, показаний на SEQ ID NO:4; і (c) CDR3 регіон, показаний на SEQ ID NO:5; і варіабельний регіон легкого ланцюга, що включає: (d) CDR1 регіон, показаний на SEQ ID NO:6; (e) CDR2 регіон, показаний на SEQ ID NO:7; і (f) CDR3 регіон, показаний на SEQ ID NO:8. 2. Спосіб за пунктом 1, де особою є людина. 3. Спосіб за пунктом 1, де хвороба є хворобою Альцгеймера. 4. Спосіб за пунктом 1, де хвороба є синдромом Дауна. 5. Спосіб за пунктом 1, де хвороба є церебральною амілоїдною ангіопатією. 6. Спосіб за пунктом 1, де антитіло є моноклональним антитілом. 2 (19) 1 3 91683 4 22. Спосіб за пунктом 20, де регіон Fc антитіла має 42. Спосіб за пунктом 24, де регіон Fc антитіла має мутацію в послідовності розпізнавання фрагменту мутацію в послідовності розпізнавання фрагменту N-глікозилювання, причому регіон Fc не є NN-глікозилювання, причому регіон Fc не є Nглікозильованим. глікозильованим. 23. Спосіб за пунктом 20, де регіон Fc антитіла є 43. Спосіб за пунктом 24, де регіон Fc антитіла є регіоном Fc важкого ланцюга IgG2a людини, який регіоном Fc важкого ланцюга IgG2a людини, який має амінокислотну мутацію з аланіну на серин в має амінокислотну мутацію з аланіну на серин в положенні 330 та з проліну на серин в положенні положенні 330 та з проліну на серин в положенні 331, де амінокислотні положення обчислюються за 331, де амінокислотні положення обчислюються за Kabat відносно послідовності дикого типу IgG2a Kabat відносно послідовності дикого типу IgG2a людини. людини. 24. Спосіб за пунктом 1, де антитіло містить регіон 44. Антитіло, що специфічно зв’язує β-амілоїдний Fc, який має змінену форму природного регіону Fc, пептид, де антитіло включає: де зміни призводять до погіршеного функціонуваріабельний регіон важкого ланцюга, який місвання ефектора. тить: 25. Спосіб за пунктом 24, де введення антитіла зі (a) регіон CDR1, наведений в SEQ ID NO:3; змінами в регіоні Fc спричиняє менший мозковий (b) регіон CDR2, наведений в SEQ ID NO:4; та мікрокрововиток, ніж застосування антитіла без (c) регіон CDR3, наведений в SEQ ID NO:5, де L1 є змін. L, V або I; де Y2 є Y або W; де S3 є S, T або G; де 26. Спосіб за пунктом 24, де особою є людина. L4 є L, R, A, V, S, T, Q або E; де V6 є V, I, T, P, C, 27. Спосіб за пунктом 24, де хвороба є хворобою Q, S, N або F; та де Y7 є Y, H, F, W, S, I, V або A, Альцгеймера. варіабельний регіон легкого ланцюга, який містить: 28. Спосіб за пунктом 24, де антитіло є монокло(d) регіон CDR1, наведений в SEQ ID NO:6, де Y8 нальним антитілом. є Y, A або H; де A11 є A або S; та де K12 є K або 29. Спосіб за пунктом 24, де антитіло є гуманізоA; ваним антитілом. (e) регіон CDR2, наведений в SEQ ID NO:7; та 30. Спосіб за пунктом 24, де антитіло є антитілом (f) регіон CDR3, наведений в SEQ ID NO:8, де L1 є людини. L, M, N, C, F, V, K, S, Q, G, S; де G3 є G, S або T; 31. Спосіб за пунктом 24, де антитіло зв’язується з де T4 є T або S; де H5 є H або L; де Y6 є Y, P, A, пептидом Aβ із KD, приблизно, 100 нМ або менше. W, Q, M, S або E; де V8 є V, L, K, H, T, A, E або M; 32. Спосіб за пунктом 24, де антитіло зв’язується з та де L9 є L, I, T, S або V. пептидом Aβ із KD, приблизно, 20 нМ або менше. 45. Антитіло за пунктом 44, де згаданий варіабе33. Спосіб за пунктом 24, де антитіло зв’язується з льний регіон важкого ланцюга містить: пептидом Aβ із KD, приблизно, 2 нМ або менше. (a) регіон CDR1, наведений в SEQ ID NO:3; 34. Спосіб за пунктом 24, де антитіло специфічно (b) регіон CDR2, наведений в SEQ ID NO:4; та зв’язується з епітопом в межах залишків 28-40 в (c) регіон CDR3, наведений в SEQ ID NO:5. Aβ1-40, 28-42 в Aβ1-42, або 28-43 в Aβ1-43. 46. Антитіло за пунктом 44, де згаданий варіабе35. Спосіб за пунктом 24, де антитіло специфічно льний регіон легкого ланцюга включає: зв’язується з С-кінцем пептиду Aβ, вибраного з (d) регіон CDR1, наведений в SEQ ID NO:6; групи, яка включає Aβ1-36, Aβ1-37, Aβ1-38, Aβ1-39, Aβ1(e) регіон CDR2, наведений в SEQ ID NO:7; та (f) регіон CDR3, наведений в SEQ ID NO:8. 40, Aβ1-42 та Aβ1-43. 36. Спосіб за пунктом 24, де антитіло специфічно 47. Антитіло за пунктом 44, де антитіло є гуманізозв’язується з епітопом Aβ1-40, який включає амінованим антитілом. кислоти 39 та/або 40. 48. Антитіло за пунктом 45, де згаданий варіабе37. Спосіб за пунктом 36, де антитіло містить варільний регіон важкого ланцюга містить амінокислоабельний регіон важкого ланцюга, який включає тну послідовність, наведену в SEQ ID NO:1. амінокислотну послідовність SEQ ID NO:1, та варі49. Антитіло за пунктом 46, де згаданий варіабеабельний регіон легкого ланцюга, який включає льний регіон легкого ланцюга містить амінокислоамінокислотну послідовність SEQ ID NO:2. тну послідовність, наведену в SEQ ID NO:2. 38. Спосіб за пунктом 24, де антитіло зв’язується з 50. Антитіло за пунктом 44, де згаданий варіабепептидом Aβ1-40 з вищою афінністю ніж до Aβ1-42 льний регіон важкого ланцюга містить амінокислоабо Aβ1-43. тну послідовність, наведену в SEQ ID NO:11; та 39. Спосіб за пунктом 37, де антитіло містить важлегкий ланцюг містить амінокислотну послідовкий ланцюг, що включає амінокислотну послідовність, наведену в SEQ ID NO:12. ність SEQ ID NO:11, та легкий ланцюг, що включає 51. Антитіло за будь-яким з пунктів 44-50, де антиамінокислотну послідовність SEQ ID NO:12. тіло містить регіон Fc, що має погіршене функціо40. Спосіб за пунктом 39, де антитіло містить варінування ефектора. абельний регіон важкого ланцюга, який включає 52. Антитіло за пунктом 51, де регіон Fc антитіла амінокислотну послідовність SEQ ID NO:1, та варіне є N-глікозильованим або має фрагменти Nабельний регіон легкого ланцюга, який включає глікозилювання, змінені порівняно із природним амінокислотну послідовність SEQ ID NO:2. регіоном Fc. 41. Спосіб за пунктом 24, де регіон Fc антитіла не 53. Антитіло за пунктом 51, де регіон Fc антитіла є N-глікозильованим або має фрагмент Nмає мутацію в послідовності розпізнавання фрагглікозилювання, змінений порівняно із природним менту N-глікозилювання, причому регіон Fc не є Nрегіоном Fc. глікозильованим. 5 91683 6 54. Антитіло за пунктом 51, де регіон Fc антитіла є 58. Антитіло за пунктом 55, де регіон Fc антитіла є регіоном Fc важкого ланцюга IgG2a людини, який регіоном Fc важкого ланцюга IgG2a людини, який має амінокислотну мутацію з аланіну на серин в має амінокислотну мутацію з аланіну на серин в положенні 330 та з проліну на серин в положенні положенні 330 та з проліну на серин в положенні 331, де амінокислотні положення обчислюються за 331, де амінокислотні положення обчислюються за Kabat відносно послідовності дикого типу IgG2a Kabat, відносно послідовності дикого типу IgG2a людини. людини. 55. Антитіло, що специфічно зв’язує β-амілоїдний 59. Полінуклеотид, який містить послідовність, що пептид, де антитіло містить: кодує антитіло за будь-яким з пунктів 44-58. варіабельний регіон важкого ланцюга, що вклю60. Вектор, який містить полінуклеотид за пунктом чає: 59. (a) CDR1регіон, показаний на SEQ ID NO:3; 61. Клітина-хазяїн, яка містить полінуклеотид за (b) CDR2 регіон, показаний на SEQ ID NO:4; і пунктом 59. (c) CDR3регіон, показаний на SEQ ID NO:5; і 62. Фармацевтична композиція, яка містить (a) варіабельний регіон легкого ланцюга, що включає: антитіло за будь-яким з пунктів 44-58 та (b) фар(d) CDR1 регіон, показаний на SEQ ID NO:6; мацевтично прийнятний наповнювач. (e) CDR2 регіон, показаний на SEQ ID NO:7; і 63. Набір, який містить антитіло за будь-яким з (f) CDR3 регіон, показаний на SEQ ID NO:8. пунктів 44-58. 56. Антитіло за пунктом 55, де антитіло включає 64. Спосіб одержання антитіла, яке специфічно регіон Fc, що має погіршене функціонування ефезв’язується з пептидом Aβ, де згаданий спосіб ктора. включає культивування клітини-хазяїна, яка міс57. Антитіло за пунктом 55, де регіон Fc антитіла тить полінуклеотид згідно пункту 59, в умовах промає мутацію в послідовності розпізнавання фрагдукування антитіла. менту N-глікозилювання, причому регіон Fc не є N65. Спосіб за пунктом 64, де спосіб додатково глікозильованим. включає виділення отриманого антитіла. Посилання на пріоритетні заявки Ця заявка посилається на право пріоритету тимчасової заявки U.S. 60/592, 494, поданої 30 липня 2004; 60/653, 197, поданої 14 лютого 2005; та 60/676, 093, поданої 29 квітня 2005; усі з яких повністю включені сюди через посилання на них. Галузь винаходу Винахід стосується антитіл до пептидів бетаамілоїду. Винахід, також стосується застосування цих антитіл в лікуванні та/або попередженні хвороб, таких як хвороба Альцгеймера. Зауваження стосовно федерально спонсованих досліджень або розробок Не зазначено Передумови створення винаходу Хвороба Альцгеймера (ХА, AD) - є дегенеративним розладом мозку, який клінічно характеризується прогресуючою недостатністю пам'яті, замішанням, поступовим погіршенням фізичного стану та, в результаті, смертю. В усьому світі, приблизно, 15 мільйонів людей уражено хворобою Альцгеймера, й ця кількість посилено зростатиме зі зростанням тривалості життя. За гістологією, захворювання характеризується нейритними бляшками, які переважно знаходяться в асоціативній зоні, лімбічній системі та базальних гангліях. Основним компонентом цих бляшок є бетаамілоїдний пептид (Α ), який є продуктом розщеплення попередника бета-амілоїдного протеїну ( ΑΡΡ або АРР). АРР є трансмембранним глікопротеїном І типу, який містить великий ектопічний N-кінцевий домен, трансмембранний домен, та невеликий цитоплазматичний С-кінцевий хвіст. Альтернативний сплайсинг транскрипту одиничного гену АРР в 21 хромосомі в результаті дав декілька ізоформ, які відрізняються декількома амінокислотами. Виявляється, що Α відіграє центральну роль в нейропатології хвороби Альцгеймера. Сімейні форми хвороби пов'язані з мутаціями в генах АРР та презениліну (Tanzi et al., 1996, Neurobiol. Dis. 3:159-168; Hardy, 1996, Ann. Med. 28:255-258). Мутації пов'язані з цими генами призводять до підвищеного вироблення 42-амінокислотної форми Α , домінуючу форму якого знайдену в амілоїдних бляшках. Більш того, імунізація трансгенних мишей, які надекспресували мутантну форму АРР з Α людини, знижує навантаженість бляшками та пов'язані з цим патології (Schenk et al., 1999, Nature 400:173-177; WO 99/27944), й периферичне застосування антитіл спрямованих до Α , також знижує навантаженість бляшками в мозку (Bard et al., 2000, Nature Medicine 6(8):916-919; WO 2004/032868; WO 00/72880). Було показано, що фагоцитоз мікрогліальними клітинами опосередковане Fc є важливим для звільнення від бляшок in vivo. Bard et al., Proc. Natl. Acad. Sci. USA 100, 2023-2028 (2003). Однак, було повідомлено про те, що в звільнення від бетаамілоїду залучені механізми не опосередковані Fc при імунотерапії in vivo. Bacskai et al., J. Neurosci. 22:7873-7878 (2002); Das et al., J. Neurosci. 23:8532-8538 (2003). Таким чином, лікування антитілами пропонує перспективний підхід до лікування та хвороби Альцгеймера. Однак, клінічні випробування на людях вакцини, що містить Α 1-42, були призупинені із-за менінгоенцефаліту в певної частини пацієнтів. Orgogozo et al., Neruology 61:7-8 (2003); Ferrer et al., Brain Pathol. 14:11-20 (2004). Також було повідомлено, що пасивна імунізація N-кінцево специфічними антитілами до Α вела до значного зниження переважно дифузного амілоїду, але ви 7 91683 8 кликала збільшення церебрального мікрокрововино зв'язуються з пептидом -амілоїду або агреготоку у трансгенних мишей, які мали залежний від ваною формою пептиду -амілоїду або полінуклевіку розвиток амілоїдних бляшок та нейродегенеотидом, який кодує дане антитіло, причому антитірації, а також церебральної амілоїдної ангіопатії ло має погіршене функціонування ефектора. У (САА) подібної до такої, що спостерігалася в мозку деяких реалізаціях, амілоїдні бляшки знаходяться людей з ХА. Pfeifer et al., Science 298:1379 (2002). в мозку (мозковій тканині) пацієнта. У деяких реаБуло припущено, що загострення у АРРлізаціях, амілоїдні бляшки знаходяться в церебротрансгенних мишей мікрокрововиливу пов'язаного васкулярній системі. У деяких реалізаціях, амілоїз церебральною амілоїдною ангіопатією (САА) дні накопичення знаходяться в серцево-судинній пасивною імунізацією антитілами спрямованими системі. до бета-амілоїду залежить від розпізнавання антиВинаходом також пропонуються способи зметілами депонованих форм бета-амілоїду. Racke et ншення амілоїдних бляшок та/або амілоїдних наal., J. Neurosci. 25:629-636 (2005). Для зниження копичень у пацієнта, які включають введення паціризику запалення було перевірено припущення, єнту ефективної дози фармацевтичної композиції, про пасивну імунізацію антитілами до пептидного яка містить антитіла, які специфічно зв'язуються з компоненту амілоїдних відкладень, антитілами пептидом -амілоїду або агрегованою формою позбавленими ділянок Fc. WO 03/086310. Залипептиду -амілоїду або полінуклеотидом, який шалася ще потреба в антитілах та інших імунотекодує дане антитіло, причому антитіло має погіррапевтичних засобах спрямованих проти Α , які шене функціонування ефектора. У деяких реалімають покращену ефективність та показники беззаціях, амілоїдні бляшки знаходяться в мозку (мопеки, та які придатні для застосування на людях. зковій тканині) пацієнта. У деяких реалізаціях, На протязі цієї заявки, робляться посилання амілоїдні бляшки знаходяться в цереброна різноманітні публікації (включаючи патенти та васкулярній системі. У деяких реалізаціях, амілоїпатентні заявки). Описи цих публікацій повністю дні накопичення знаходяться в серцево-судинній включено сюди через посилання. системі. Стисле викладення винаходу Винаходом також пропонуються способи виРозділ І далення або вичищення амілоїдних бляшок та/або Даним винаходом пропонуються способи лікуамілоїдних накопичень у пацієнта, які включають вання захворювання, яке характеризується порувведення пацієнту ефективної дози фармацевтичшеним відкладанням протеїну в мозку пацієнта. Ці ної композиції, яка містить антитіла, які специфічспособи включають введення пацієнту ефективної но зв'язуються з пептидом -амілоїду або агрегокількості антитіл, які специфічно зв'язуються з прованою формою пептиду -амілоїду або теїном або протеїновими відкладеннями або поліполінуклеотидом, який кодує дане антитіло, принуклеотид, який кодує дане антитіло, причому анчому антитіло має погіршене функціонування ефетитіло має погіршене функціонування ефектора. ктора. У деяких реалізаціях, амілоїдні бляшки знаВинаходом також пропонуються способи лікуходяться в мозку (мозковій тканині) пацієнта. У вання або попередження захворювань пов'язаних деяких реалізаціях, амілоїдні бляшки знаходяться з амілоїдним відкладенням Α у пацієнта (наприв церебро-васкулярній системі. У деяких реалізаклад, відкладенням в мозковій тканині та цереброціях, амілоїдні накопичення знаходяться в серцеваскулярній системі), таких як хвороба Альцгейво-судинній системі. мера, синдром Дауна, мультиінфарктна деменція, Винаходом також пропонуються способи приглегкий когнітивний розлад та церебральна амілоїнічення накопичень пептиду -амілоїду в тканині, дна ангіопатія. Цей спосіб включає введення паціякий включає контактування тканини з антитілами єнту ефективної кількості фармацевтичної компоякі специфічно зв'язуються з пептидом -амілоїду зиції, яка містить антитіла, які специфічно або агрегованою формою пептиду -амілоїду, зв'язуються з пептидом -амілоїду або агреговапричому антитіло має погіршене функціонування ною формою пептиду -амілоїду або полінуклеоефектора. тидом, який кодує дане антитіло, причому антитіло Винаходом також пропонуються способи змемає погіршене функціонування ефектора. ншення пептиду Α (таких форм як розчинна, оліВинаходом також пропонуються способи загомерна та відкладена) у пацієнта, які включають тримки розвитку симптому, пов'язаного із захвовведення пацієнту ефективної кількості антитіл, які рюваннями, пов'язаними із амілоїдним відкладанспецифічно зв'язуються з пептидом -амілоїду або ням Α у пацієнта, такими як, хвороба агрегованою формою пептиду -амілоїду або поАльцгеймера, які включають введення пацієнту лінуклеотидом, який кодує дане антитіло, причому ефективної дози фармацевтичної композиції, яка антитіло має погіршене функціонування ефектора. містить антитіла, які специфічно зв'язуються з пепУ деяких реалізаціях, накопичення пептиду Α тидом -амілоїду або агрегованою формою пептипригнічується та/або знижується в мозку. У деяких ду -амілоїду або полінуклеотидом, який кодує реалізаціях, токсичний вплив пептиду Α пригнічудане антитіло, причому антитіло має погіршене ється та/або знижується. Таким чином, спосіб дафункціонування ефектора. ного винаходу може бути застосований для лікуВинаходом також пропонуються способи пригвання будь-якого захворювання при якому має нічення утворювання амілоїдних бляшок та/або місце або може бути накопичення пептиду Α , таамілоїдних накопичень у пацієнта, які включають ких як хвороба Альцгеймера, хвороба Паркінсона, введення пацієнту ефективної дози фармацевтичмультиінфарктна деменція. ної композиції, яка містить антитіла, які специфіч 9 91683 10 Винаходом також пропонуються способи покУ деяких реалізаціях, антитіло або поліпептид ращення розпізнавання або обернення когнітивних специфічно зв'язується з епітопом в межах залишвідхилень пов'язаних із захворюваннями пов'язаків 1-16 пептиду Α . У деяких реалізаціях, антитіло ними із амілоїдним відкладанням Α у пацієнта, або поліпептид специфічно зв'язується з N-кінцем такими як хвороба Альцгеймера, які включають пептиду Α . У деяких реалізаціях, антитіло або введення пацієнту ефективної дози фармацевтичполіпептид специфічно зв'язується з епітопом в ної композиції, яка містить антитіла, які специфічмежах залишків 16-28 пептиду Α . У деяких реаліно зв'язуються з пептидом -амілоїду або агрегозаціях, антитіло специфічно зв'язується з епітопом ваною формою пептиду -амілоїду або на С-кінцевому боці пептиду Α , таким чином, що полінуклеотидом, який кодує дане антитіло, приепітоп починається з 25 амінокислоти або пізніше. чому антитіло має погіршене функціонування ефеАнтитіло може специфічно зв'язуватися з вільною ктора. С-кінцевою амінокислотою С-кінцево вкороченого Винаходом також пропонуються способи лікупептиду Α , наприклад, Α 1-37, 1-38, 1-39, 1-40, 1вання або попередження захворювань пов'язаних 41, 1-42, 1-43. У деяких реалізаціях, антитіло або з відкладанням -амілоїду, який включає введення поліпептид специфічно зв'язується з епітопом в пацієнту ефективної дози фармацевтичної компомежах залишків 28-40 пептиду Α 1-40. У деяких зиції антитіл, яка містить антитіла, які специфічно реалізаціях, антитіло або поліпептид специфічно зв'язуються з пептидом -амілоїду або агреговазв'язується з епітопом в межах залишків 28-42 ною формою пептиду -амілоїду, причому антитіло пептиду Α 1-42. У деяких реалізаціях, антитіло або містить регіон Fc який має змінену форму природполіпептид специфічно зв'язується з епітопом в ного регіону Fc, де зміни призводять до погіршеномежах залишків 28-43 пептиду Αβ1-43. У деяких го функціонування ефектора. У деяких реалізаціреалізаціях, антитіло або поліпептид специфічно ях, введення антитіла спричиняє менше мозкового зв'язується з пептидом Α без зв'язування із немікрокрововитоку ніж застосування антитіла без процесингованим попередником амілоїдного прозмін. теїну (АРР). У деяких реалізаціях, антитіло або Також, в описаних тут методах можуть бути поліпептид специфічно зв'язується агрегованою застосовані поліпептиди, які специфічно зв'язуформою Α без зв'язування із розчинною формою. ються з пептидом Α або агрегованою формою У деяких реалізаціях, антитіло або поліпептид пептиду Α й містять константний регіон важкого специфічно зв'язується розчинною формою Α без ланцюга, який має погіршене функціонування зв'язування з агрегованою формою. У деяких реаефектора. У деяких реалізаціях, поліпептид міслізаціях, антитіло або поліпептид специфічно зв'ятить послідовність (наприклад, один або більше зується як із агрегованою так і з розчинною форCDR) отриманих з антитіла 9TL або його варіантів мою Α . приведених у Таблиці 3. У деяких реалізаціях, поУ деяких реалізаціях, антитіло або поліпептид ліпептид містить послідовність (наприклад, один специфічно зв'язується з С-кінцевим пептидом 38або більше CDR) отриманих з антитіла 6G. 40 пептиду Α 1-40. У деяких реалізаціях, антитіло Антитіло та поліпептид використані в способі або поліпептид специфічно зв'язується з епітопом даного винаходу специфічно зв'язуються з пептив Α 1-40 який включає амінокислоти 35-40. У деяких дом Α або агрегованою формою пептиду Α , але реалізаціях, антитіло або поліпептид специфічно має погіршене функціонування ефектора. У деяких зв'язується з епітопом в Α 1-40 який включає амінореалізаціях, антитіло або поліпептид не є фрагмекислоти 36-40. У деяких реалізаціях, антитіло або нтом F(ab')2. У деяких реалізаціях, антитіло або поліпептид специфічно зв'язується з епітопом в поліпептид не є фрагментом Fab. У деяких реаліΑ 1-40 який включає амінокислоти 39 та/або 40. У заціях, антитіло або поліпептид не є одноланцюгодеяких реалізаціях, антитіло або поліпептид спевим антитілом scFv. цифічно зв'язується з епітопом в Α 1-40 але специУ деяких реалізаціях, антитіло або поліпептид фічно не зв'язується з Α 1-42 та/або Α 1-43. У деяких містить константний регіон важкого ланцюга, який реалізаціях, антитіло включає варіабельний регіон має погіршене функціонування ефектора, де консантитіла 9TL або похідного антитіла від 9TL опитантний регіон важкого ланцюга включає регіон Fc. саного тут. У деяких реалізаціях, антитіло або поУ деяких реалізаціях, видалено N-глікозилювання ліпептид конкурентно інгібує зв'язування антитіла в регіоні Fc. У деяких реалізаціях, регіон Fc антиті9TL та/або антитіла або поліпептид похідних від ла має мутацію в послідовності розпізнавання 9TL до Α 1-40. фрагменту N-глікозилювання, причому регіон Fc У деяких реалізаціях, антитіло або поліпептид антитіла або поліпептиду не є N-глікозильованим. зв'язується з Α 1-40 з вищою афінності ніж із Α 1-42 У деяких реалізаціях, регіон Fc є ПЕПльованим. У та/або Α 1-43. У деяких реалізаціях, антитіло зв'ядеяких реалізаціях, константний регіон важкого зується з епітопом в Α 1-40 який включає амінокисланцюга антитіла або поліпептиду константним лоти 25-34 та 40. У деяких реалізаціях, антитіло регіоном важкого ланцюга lgG2a людини який має включає варіабельний регіон антитіла 6G або понаступні мутації: А330Р331 на S330S331 (нумерахідного антитіла від 6G описаного тут. У деяких ція амінокислот за послідовністю дикого типу реалізаціях, антитіло або поліпептид конкурентно lgG2a). У деяких реалізаціях, антитіло або поліпеінгібує зв'язування антитіла 6G та/або антитіла або птид містить константний регіон lgG4 важкого ланполіпептид похідних від 6G до Α . цюга, який має наступні мутації: E233F234L235 на Застосування антитіла або поліпептиду, які P233V234A235. специфічно зв'язуються з Α й мають погіршене 11 91683 12 функціонування ефектора може бути виконане регіонів з легкого та/або тяжкого ланцюгів антитіла будь-яким відомим способом, включаючи: внутрі9TL. В наступній реалізації, фрагмент містить один шньовенно, підшкірно, інгаляцією, внутрішньоарабо більше варіабельних регіонів з легкого та/або теріально, внутрішьомязево, внутрішньосерцево, тяжкого ланцюгів показаних на ФІГ. 1. В наступній інтравентрикулярно, парентерально, внутрішньоореалізації, фрагмент містить один або більше CDR болонково, та внутрішньочеревинно. Застосування з легкого та/або тяжкого ланцюгів антитіла 9TL. може бути системне, наприклад, внутрішньовенно, В іншому аспекті, винаходом пропонуються або місцевим. Це взагалі може бути застосовано поліпептиди (які можуть бути або не бути антитідо поліпептидів та полінуклеотидів даного винахолом) які включають один або більше з наступного: ду. а) один або більше CDR(s) антитіла 9TL або його Винаходом також пропонується фармацевтичваріантів показаних на Таблиці 3; b) CDR H3 з на композиція, яка включає ефективну кількість важкого ланцюга антитіла 9TL або його варіантів будь-якого з антитіл та поліпептидів, які специфічпоказаних на Таблиці 3; с) CDR L3 з легкого ланцюга антитіла 9TL або його варіантів показаних на но зв'язуються з пептидом Α або агрегованою Таблиці 3; d) три CDR з легкого ланцюга антитіла формою пептиду Α , та має погіршене функціону9TL або його варіантів показаних на Таблиці 3; e) вання ефектора або полінуклеотиди які кодують три CDR з важкого ланцюга антитіла 9TL або його антитіла та поліпептиди, та фармацевтично приваріантів показаних на Таблиці 3; f) три CDR з легйнятний наповнювач. кого ланцюга антитіла CDR з важкого ланцюга Винаходом також пропонується набір та комантитіла 9TL або його варіантів показаних на Табпозиція, яка включає одну або більше композицій, лиці 3. Винаходом також пропонуються поліпептиякі включають ефективну кількість будь-якого з ди (які можуть бути або не бути антитілом) які антитіл та поліпептидів, які специфічно зв'язуютьвключають один або більше з наступного: а) один ся з пептидом Α або агрегованою формою пептиабо більше (один, два, три, чотири, п'ять або ду Α , та має погіршене функціонування ефектора шість) CDR(s), що походять з антитіла 9TL або або полінуклеотиди, які кодують антитіла та полійого варіантів показаних на Таблиці 3; b) CDR, що пептиди. Ці набори, зазвичай знаходяться у відпопоходять з CDR H3, що походять з важкого ланцювідній упаковці та супроводжуються відповідними га антитіла 9TL; та/або с) CDR, що походять з CDR інструкціями, також є придатними для будь-якого L3, що походять з легкого ланцюга антитіла 9TL. В описаного тут способу. одній з реалізацій, CDR є CDR показаним на ФІГ. Винаходом також пропонується спосіб отри1. У деяких реалізаціях, один або більше CDR, що мування терапевтичних гуманізованих антитіл для походять з антитіла 9TL або його варіантів показалікування захворювання, пов'язаного з амілоїдниних на Таблиці 3 мають принаймні, приблизно, ми відкладеннями пептиду Α в мозку пацієнта, 85%, принаймні, приблизно, 86%, принаймні, приякий включає відбір первинних гуманізованих анблизно, 87%, принаймні, приблизно, 88%, принайтитіл які специфічно зв'язуються з пептидом Α ; та мні, приблизно, 89%, принаймні, приблизно, 90%, змінювання в антитілі регіону Fc для створення принаймні, приблизно, 91%, принаймні, приблизтерапевтичного гуманізованого антитіла, яке має но, 92%, принаймні, приблизно, 93%, принаймні, погіршене функціонування ефектора порівняно з приблизно, 94%, принаймні, приблизно, 95%, припервинним гуманізованим антитілом. наймні, приблизно, 96%, принаймні, приблизно, Розділ II 97%, принаймні, приблизно, 98%, або принаймні, Описаний тут винахід стосується антитіл, які приблизно, 99% ідентичності принаймні до одного, зв'язуються з С-кінцем пептиду Α 1-40 (SEQ ID принаймні до двох, принаймні до трьох, принаймні NO:15 показано на Таблиці 4). Відповідно, одним з до чотирьох, принаймні до п'ятьох, або принаймні аспектів винаходу є антитіло 9TL (яке також назидо шести CDR з 9TL або його варіантів. вають "9TL") яке виробляється експресуванням У деяких реалізаціях, CDR є Kabat CDR. У інвекторів які мають АТСС Nos.PTA-6124 та РТАших реалізаціях, CDR є Chothia CDR. У інших реа6125. Амінокислотні послідовності варіабельних лізаціях, CDR є поєднанням Kabat та Chothia CDR регіонів важкого та легкого ланцюгів 9TL показано (які також називаються "комбінованим CDR" або на ФІГ. 1. Частини гіперваріабельного регіону "розширеним CDR"). Іншими словами, для будь(CDR) антитіла 9TL (включаючи Chothia та Kabat якої даної реалізації, що містить один або більше CDR) також приведено на ФІГ. 1. Зрозуміло, що CDR, CDR може бути як Kabat, так і Chothia, та/або посилання на будь-яку частину або цілий регіон їхньою комбінацією. 9TL, охоплюється послідовностями отриманими У деяких реалізаціях, поліпептид (такий як, анекспресуванням векторів які мають АТСС титіло) включає амінокислотну послідовність покаNos.PTA-6124 та РТА-6125 та/або приведені на зану на SEQ ID NO:5, де L1 є L, V, або І; де Y2 є Υ ФІГ. 1. або W; де S3 є S, Т, або G; де L4 є L, R, А, V, S, Т, В іншому аспекті, винаходом пропонуються Q, або Е; де V6 є V, І, Т, Р, С, Q, S, N, або F; та де варіанти антитіла 9TL, в яких амінокислотні посліΥ7 є Υ, Η, F, W, S, І, V, або А. У деяких реалізаціях, довності є наведеними в Таблиці 3. амінокислотна послідовність є CDR3 у варіабельВ іншому аспекті, винаходом є антитіло, яке ному регіоні важкого ланцюга. Для зручності завключає фрагмент або регіон антитіла 9TL або стосування, "є" в цьому контексті або зазначенні його варіанти приведені в Таблиці 3. В одній з реамінокислоти вказує на вибір з поміж амінокисалізацій, фрагмент є легким ланцюгом антитіла лот(и) для даного положення із зазначенням по9TL. В наступній реалізації, фрагмент є важким ложення в SEQ ID. Наприклад, "L1 є L, V, або І" ланцюгом антитіла 9TL. В наступній реалізації, вказує, що амінокислота L знаходиться в полофрагмент містить один або більше варіабельних 13 91683 14 женні І в SEQ ID NO:5 може бути замінена на V Immunol.(1999) 29:2613-2624. У деяких реалізаціабо І. ях, антитіло містить константний регіон lgG4, який У деяких реалізаціях, поліпептид (такий як, анмає наступні мутації: E233F234L235 на титіло) включає амінокислотну послідовність покаP233V234A235. В інших реалізаціях, константний зану на SEQ ID NO:6, де Y8 є Y, А, або Н; та де регіон є аглікозильованим для N-зв'язаного глікоА11 є А або S; та де K12 є K або А. У деяких реазилювання. У деяких реалізаціях, константний релізаціях, амінокислотна послідовність є CDR1 у гіон є аглікозильованим для N-зв'язаного глікозиваріабельному регіоні легкого ланцюга. лювання мутуванням олігосахаридної частини У деяких реалізаціях, поліпептид (такий як, анзалишку (такої як Asn297) та/або фланкуванням титіло) включає амінокислотну послідовність показалишків, які є частиною послідовності розпізназану на SEQ ID NO:8, де L1 є L, Μ, Ν, С, F, V, K, S, вання N-глікозилювання в константному регіоні. В Q, G, S; де G3 є G, S, або Т; де Т4 є Τ або S; де Н5 деяких реалізаціях, константний регіон є аглікозиє Η або L; де Υ6 є Υ, Р, A, W, Q, М, S, або Е; де V8 льованим для N-зв'язаного глікозилювання. Консє V, L, K, Н, Т, А, Е, або М; та де L9 є L, І, Т, S, або тантний регіон може бути аглікозильованим при NV. У деяких реалізаціях, амінокислотна послідовглікозильованому ферментативно або експресуність є CDR3 у варіабельному регіоні легкого ланванням в клітині хазяїні дефектній за глікозилюцюга. ванням. У деяких реалізаціях, поліпептид (такий як, анВ іншому аспекті, винаходом пропонується потитіло) включає варіабельний регіон важкого ланлінуклеотид є антитіло, яке включає полінуклеоцюга який включає (a) CDR1 регіон показаний на тид, який кодує фрагмент або регіон антитіла 9TL SEQ ID NO:3; (b) a CDR2 регіон показаний на SEQ або його варіанти приведені в Таблиці 3. В одній з ID NO:4; та (с) a CDR3 регіон показаний на SEQ ID реалізацій, фрагмент є легким ланцюгом антитіла NO:5, де L1 є L, V, або І; де Y2 є Υ або W; де S3 є 9TL В наступній реалізації, фрагмент є важким S, Т, або G; де L4 є L, R, А, V, S, Т, Q, або Е; де V6 ланцюгом антитіла 9TL. В наступній реалізації, є V, І, Т, Р, С, Q, S, N, або F; та де Υ7 є Υ, Н, F, W, фрагмент містить один або більше варіабельних S, І, V, або А. регіонів з легкого та/або тяжкого ланцюгів антитіла У деяких реалізаціях, поліпептид (такий як, ан9TL. В наступній реалізації, фрагмент містить один титіло) включає варіабельний регіон важкого ланабо більше (а саме, один, два, три, чотири, п'ять, цюга який включає (a) CDR1 регіон показаний на шість) гіперваріабельних регіонів (CDR) з легкого SEQ ID NO:6, де Y8 є Y, А, або Н; та де А11 є А та/або тяжкого ланцюгів антитіла 9TL. або S; та де K12 є K або A; (b) CDR2 регіон покаВ іншому аспекті, винаходом є полінуклеотид заний на SEQ ID NO:7; та (с) CDR3 регіон показа(який може бути виділений), який включає полінукний на SEQ ID NO:8, де L1 є L, Μ, Ν, С, F, V, K, S, леотид, який кодує фрагмент або регіон антитіла Q, G, S; де G3 є G, S, або Т; де Т4 є Τ або S; де Н5 9TL або його варіанти приведені в Таблиці 3. У є Η або L; де Υ6 є Υ, Р, A, W, Q, М, S, або Е; де V8 деяких реалізаціях, полінуклеотид містить один з є V, L, K, Н, Т, А, Е, або М; та де L9 є L, І, Т, S, або або обидва полінуклеотиди приведені в SEQ ID V. NO:9 та SEQ ID NO:10. У деяких реалізаціях, антитіло винаходу є анВ іншому аспекті, винаходом пропонуються титілом людини. У інших реалізаціях, антитіло виполінуклеотиди, які кодують будь-яке з описаних находу є гуманізованим антитілом. У деяких реалітут антитіл (включаючи фрагменти антитіл) або заціях, антитіло є моноклональним. У деяких поліпептидів. реалізаціях, антитіло (або поліпептид) є виділеВ іншому аспекті, винаходом пропонуються ним. У деяких реалізаціях, антитіло (або поліпепвектори (включаючи експресійні або клонувальні тид) є значною мірою очищеним. вектори) та клітини хазяїни які містять будь-який з Константний регіон важкого ланцюга антитіл описаних тут полінуклеотидів. У деяких реалізаціможе походити з різних типів константних регіонів, ях, вектор є pDb.9TL.hFc2a, який має АТСС No. таких як IgG, IgM, IgD, IgA, та IgE; та походити з PTA-6124. В інших реалізаціях, вектор є будь-яких ізотипів, таких як lgG1, lgG2, lgG3, та pEb.9TL.hK, який має АТСС No. PTA-6125. lgG4. В іншому аспекті, винаходом є клітина-хазяїн У деяких реалізаціях, антитіло включає модияка містить полінуклеотид який кодує будь-яке з фікований константний регіон, такий, що константантитіл описаними тут. ний регіон є імунологічно інертним (який містить В іншому аспекті, винаходом є комплекс Αβ^ο частково імунологічно інертний, й взаємозамінно зв'язаного антитілом 9TL або його варіанти привевживається з терміном "який має погіршене функдені в Таблиці 3. ціонування ефектора"), наприклад, не запускає В іншому аспекті, винаходом є комплекс Αβ-,^ο лізис опосередкований комплементом, не стимузв'язаного будь-яким з антитіл або поліпептидів лює цитотоксичність опосередковану антитілоописаними тут. залежними клітинами (ADCC), або не активує мікВ іншому аспекті, винаходом є фармацевтична роглію. У деяких реалізаціях, константний регіон композиція, яка включає ефективну кількість будьмодифіковано як показано в Eur. J. Immunol. (1999) якого з описаних тут поліпептидів (включаючи ан29:2613-2624; заявка PCT/GB99/01441; та/або патитіла, такі як антитіла, що містять один або більтентна заявка UK 9809951.8. В інших реалізаціях, ше CDR антитіла 9TL) або полінуклеотидів, та фаантитіла містять константний регіон важкого ланрмацевтично прийнятний наповнювач. цюга lgG2a людини який має наступні мутації: В іншому аспекті, винаходом є спосіб одержуА330Р331 на S330S331 (нумерація амінокислот за вання антитіла 9TL, який включає культивування послідовністю дикого типу lgG2a). Eur.J. клітини хазяїна або потомства за умов, які дозво 15 91683 16 ляють отримувати антитіло 9TL, де клітина хазяїн мозку (мозковій тканині) пацієнта. У деяких реалімістить експресійний вектор який кодує антитіло заціях, амілоїдні бляшки знаходяться в церебро9TL; та в деяких реалізаціях, очищення антитіла васкулярній системі. У інших реалізаціях, амілоїдні 9TL. В деяких реалізаціях, експресійний вектор накопичення знаходяться в серцево-судинній сисвключає одну з або обидві полінуклеотидні послітемі. довності показані на SEQ ID NO:9 та SEQ ID Крім того, винаходом пропонується спосіб приNO:10. гнічення накопичень пептиду Α в тканині, який В іншому аспекті, винаходом пропонуються включає контактування тканини з антитілом або способи отримування таких антитіл або поліпепполіпептидом даного винаходу. тидів, як описано тут, експресуванням одного або Винаходом також пропонуються способи змебільше полінуклеотидів, які кодують антитіло (які ншення пептиду Α (таких форм як розчинна, оліможуть експресуватися окремо як легкий або важгомерна та відкладена) в мозку пацієнта, який кий ланцюг, або разом легкий та важкий ланцюг включає введення пацієнту ефективної кількості експресується з одного вектора) або поліпептид в антитіла або поліпептиду даного винаходу. У депридатній клітині, в загальному випадку отримуяких реалізаціях, накопичення пептиду Α пригніванням та/або виділенням антитіла або поліпептичується та/або знижується в мозку. У деяких реаду, що представляє інтерес. лізаціях, токсичний вплив пептиду Α Винаходом також пропонується спосіб попепригнічується та/або знижується. Таким чином, редження, лікування, пригнічування або затримки спосіб даного винаходу може бути застосований розвитку хворобою Альцгеймера або іншими задля лікування будь-якого захворювання при якому хворюваннями пов'язаними із зміненим Α або має місце або може бути накопичення пептиду Α , експресією ΑΡΡ, накопичуванням Α у пацієнта, таких як хвороба Альцгеймера, синдром Дауна, такі як синдром Дауна, хвороба Паркінсона, мульмультиінфарктна деменція, легкий когнітивний тиінфарктна деменція, легкий когнітивний розлад, розлад та церебральна амілоїдна ангіопатія. церебральна амілоїдна ангіопатія та СНІД. Спосіб Винаходом також пропонуються способи поквключає введення пацієнту ефективної дози фарращення розпізнавання або обернення когнітивних мацевтичної композиції, яка містить антитіло, повідхилень пов'язаних із захворюваннями пов'язаліпептид, полінуклеотид даного винаходу. ними із амілоїдним відкладанням Α в мозку паціВинаходом також пропонується спосіб затримєнта, такими як хвороба Альцгеймера, які включаки розвитку симптому пов'язаного із хворобою ють застосування ефективної дози Альцгеймера або іншими захворюваннями пов'яфармацевтичної композиції, яка містить антитіло, заними із амілоїдними відкладаннями Α у пацієнполіпептид або полінуклеотид даного винаходу. та, який включає застосування до пацієнта ефекБудь-які антитіла, поліпептиди або полінуклетивної дози фармацевтичної композиції, яка отиди описані тут можуть бути використаними в містить антитіло, поліпептид, полінуклеотид данометодах даного винаходу. У деяких реалізаціях, го винаходу. антитіло є антитілом 9TL. Винаходом також пропонується спосіб пригніАнтитіла та поліпептиди даного винаходу тачення утворювання амілоїдних бляшок та/або амікож можуть використовуватися для визначення, лоїдних накопичень у пацієнта, який включає задіагностування та моніторингу хвороби Альцгейстосування до пацієнта ефективної дози мера та інших захворювань із зміненим Α або фармацевтичної композиції, яка містить антитіло, експресією ΑΡΡ, таких як синдром Дауна та СНIД. поліпептид, полінуклеотид даного винаходу. У деСпосіб включає контактування зразка пацієнта, яких реалізаціях, амілоїдні бляшки знаходяться в стосовно якого маються підозри щодо змінень Α мозку (мозковій тканині) пацієнта. У деяких реаліабо експресії ΑΡΡ з антитілами даного винаходу заціях, амілоїдні бляшки знаходяться в цереброта визначення рівня Α або ΑΡΡ, який відрізняваскулярній системі. У інших реалізаціях, амілоїдні ється від такого у контролі або порівняльному зранакопичення знаходяться в серцево-судинній сисзку. У деяких реалізаціях, рівень Α у сироватці темі. визначається перед та після введення антитіл до Винаходом також пропонується спосіб зменΑ ; й визначається збільшення рівня Α у сировашення амілоїдних бляшок та/або амілоїдних накотці. пичень у пацієнта, який включає застосування до Застосування антитіла або поліпептиду даного пацієнта ефективної дози фармацевтичної комповинаходу, може бути виконане будь-яким відомим зиції, яка містить антитіло, поліпептид, полінуклеоспособом, включаючи: внутрішньовенно, підшкіртид даного винаходу. У деяких реалізаціях, амілоно, інгаляцією, внутрішньоартеріально, внутріїдні бляшки знаходяться в мозку (мозковій тканині) шьомязево, внутрішньосерцево, інтравентрикуляпацієнта. У деяких реалізаціях, амілоїдні бляшки рно, парентерально, внутрішньооболонково, та знаходяться в церебро-васкулярній системі. У інвнутрішньочеревинно. Застосування може бути ших реалізаціях, амілоїдні накопичення знахосистемне, наприклад, внутрішньовенно, або місдяться в серцево-судинній системі. цевим. Це взагалі застосовується до поліпептидів Винаходом також пропонується спосіб видата полінуклеотидів даного винаходу. лення або вичищення амілоїдних бляшок та/або В іншому аспекті, винаходом пропонуються амілоїдних накопичень у пацієнта, який включає набори та композиції, які включають одну або бізастосування до пацієнта ефективної дози фарльше описані тут композиції. Ці набори, зазвичай мацевтичної композиції, яка містить антитіло, познаходяться у відповідній упаковці та супроволіпептид, полінуклеотид даного винаходу. У деяких реалізаціях, амілоїдні бляшки знаходяться в 17 91683 18 джуються відповідними інструкціями, також є причервоним. Вісі X на ФІГ. 6А та 6В показують тип датними для будь-якого описаного тут способу. введених антитіл. Стислий опис деяких фігур(и) На ФІГ. 7А та 7В діаграми на яких показано На ФІГ. 1 показано амінокислотну послідовсудинний бета-амілоїдний пептид пофарбований ність варіабельного регіону важкого ланцюга (SEQ Конго червоним в гіпокампі (ФІГ. 7В) та лобній корі ID NO:1) варіабельного регіону легкого ланцюга (ФІГ. 6А) через 16 тижнів лікування антитілами (SEQ ID NO:2) антитіла 9TL. Kabat CDR показано 2Н6, ΑΜΝ (значеними як ΑΜΝ), та деглікозильоважирним шрифтом, Chothia CDR підкреслені. Аміними 2Н6 (позначеними як D-2H6). Вісі Υ на ФІГ. нокислотні залишки варіабельних регіонів важкого 7А та 7В показують середній відсоток плошці пота легкого ланцюгів пронумеровано послідовно. зитивної до забарвлення Конго червоним. Вісі X на На ФІГ. 2 показане епітопне картування антиФІГ. 7А та 7В показують тип введених антитіл. ФІГ. 8 діаграма показує кількість профілів які тіла 9TL пептидною конкуренцією. Пептид Α 1-40 мають позитивне забарвлення берлінським синім був (мобілізований на чіпі SA. Моноклональне анчерез 16 тижнів лікування антитілами 2Н6, ΑΜΝ титіло 2289 та Fab фрагмент 9TL (50 нМ кожного), (позначеними як ΑΜΝ), та деглікозильованими 2Н6 кожне було попередньо інкубоване протягом 1 (позначеними як D-2H6). На вісі Υ показано кільгодини із 10 мкМ різних пептидів (амінокислоти 28кість позитивних профілів на зріз. Вісь X показує 40, 1-40, 1-28, 28-42, 22-35, 1-16, 1-43, 33-40, 1-38, тип введених антитіл. або 17-40 з Α ) або без пептиду, та було нанесено ФІГ. 9 діаграма показує рівень пептиду Α в на чіп. Було визначено зв'язування Fab фрагменту сироватці після введення антитіл до ΑΜΝ (познаантитіла з імобілізованим пептидом Α 1-40. ченими як ΑΜΝ), антитіл 2Н6 (позначеними як На ФІГ. 3 показана епітопне картування анти2Н6), деглікозильованими 2Н6 (позначеними як тіла 2Н6 пептидною конкуренцією. Пептид Α 1-40 2H6-D) мишам АРР Тg2576 та після введення анбув імобілізований на чіпі SA. Моноклональне антитіл до ΑΜΝ, антитіл 2Н6 (позначеними як D-2H6) титіло 2289, 2286 та 2Н6 (100 нМ кожного), кожне мишам дикого типу (WT). було попередньо інкубоване протягом 1 години із На ФІГ. 10 показано імунозабарвлення CD45 в 10 мкМ різних пептидів (амінокислоти 28-40, 1-40, гіпокампі мишей після внутрішньочерепного вве1-28, 28-42, 22-35, 1-16, 1-43, 33-40, 1-38, або 17дення антитіл 2Н6 (А) та деглікозильованих анти40 з Α ) або без пептиду, було нанесено на чіп. тіл 2Н6 (В). Внизу показано, що співвідношення Було визначено зв'язування антитіла з імобілізосередньої площі зайнятої позитивним забарвленваним пептидом Α 1-40. ням CD45 ін'єктованої частини відносно неін'єктоНа ФІГ. 4 показано схему зв'язування антитіла ваної в передній корі та гіпокампі після введення 2Н6, 2286, та 2289 з різними С-кінцевими варіанконтрольних антитіл, антитіл 2Н6 та деглікозильотами пептиду Α . Варіанти GST-Αβ (М35А, V36A, ваних антитіл 2Н6. "**" позначено Р
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies directed against amyloid-beta peptide and methods using same
Автори англійськоюRosenthal Arnon, Pons Jaume, Ho Wei-Hsien, Grimm Jan Markus
Назва патенту російськоюАнтитела, направленные против бета-амилоидного пептида, и способы их применения
Автори російськоюРозенталь Арнон, Понс Яуме, Хо Вей-Хиен, Гримм Ян Маркус
МПК / Мітки
МПК: C07K 16/18, A61P 25/00
Мітки: бета-амілоїдного, спрямовані, пептиду, антитіла, застосування, способи
Код посилання
<a href="https://ua.patents.su/55-91683-antitila-spryamovani-proti-beta-amilodnogo-peptidu-ta-sposobi-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антитіла, спрямовані проти бета-амілоїдного пептиду, та способи їх застосування</a>