Спосіб одержання трансгенної сої
Номер патенту: 90860
Опубліковано: 10.06.2010
Автори: Прайс Сара, Бьорнел Ліббі, Олхофт Паула, Ханг Хайпінг, Еріес Діана, Гріст Леслі
Формула / Реферат
1. Спосіб одержання трансгенної рослини сої, який включає етапи:
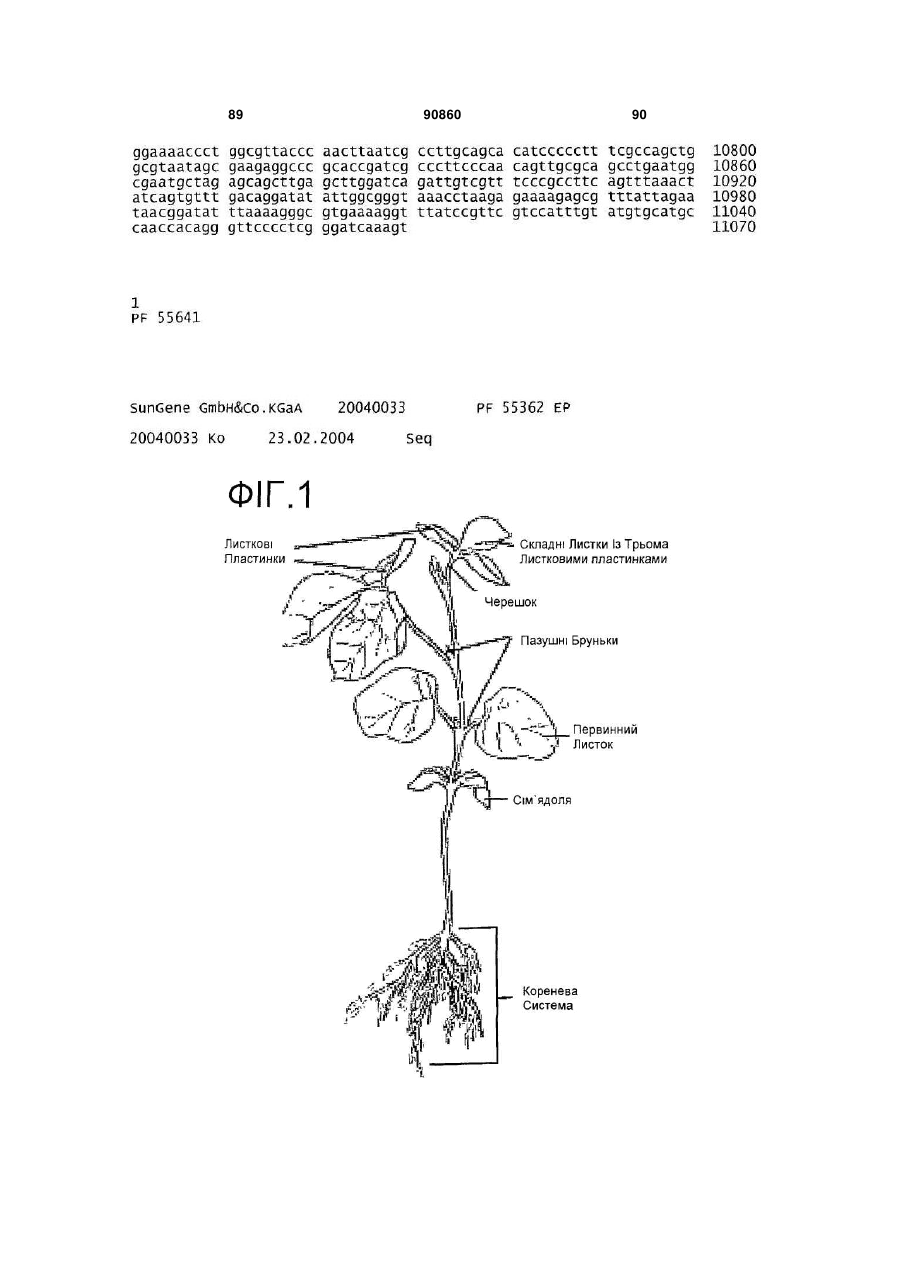
(a) забезпечення пазушної меристемної тканини первинного або вищого листкового вузла проростка сої, та
(b) сумісне культивування згаданої пазушної меристемної тканини із Agrobacterium, яка містить трансгенну Т-ДНК, де згадана трансгенна Т-ДНК включає принаймні одну рослинну експресійну касету агрономічно цінної ознаки та, за необхідності, один або більше селективних маркерних генів, та
(c) перенесення згаданої сумісно культивованої пазушної меристемної тканини на середовище, яке індукує пагони, яке включає
(і) принаймні один рослинний фактор росту в концентрації, придатній для індукування утворення пагонів de novo зі згаданої пазушної меристемної тканини, та
(іі) за необхідності, одну або більше селектуючих сполук, які в комбінації з селективним маркерним геном згідно з (b) дозволяють ідентифікувати та/або селектувати рослинну клітину, тканину або рослину, яка має селективний маркерний ген, та/або
(ііі) за необхідності, один або більше антибіотиків, придатних для інгібування росту Agrobacterium, та культивування згаданої сумісно культивованої пазушної меристемної тканини до індукування пагонів та їхнього розвитку та виділення згаданих пагонів, та
(d) перенесення згаданих виділених пагонів на середовище для укорінення та культивування згаданих пагонів на згаданому середовищі для укорінення до формування вказаними пагонами коріння, та подальше регенерування одержаних таким чином рослин до зрілих рослин, які мають вставлену в свій геном Т-ДНК, яка містить принаймні одну рослинну експресійну касету агрономічно цінної ознаки та, за необхідності, принаймні один селективний маркерний ген.
2. Спосіб згідно з пунктом 1, де згаданий спосіб включає один або більше додаткових етапів, вибраних з групи:
(а1) ушкодження рослини перед, під час або безпосередньо після сумісного культивування, та
(b1) перенесення згаданої сумісно культивованої пазушної меристемної тканини після етапу (b) на середовище, яке містить принаймні один антибіотик, придатний для інгібування росту Agrobacterium, та, за необхідності, принаймні один рослинний фактор росту, де згадане середовище переважно не містить селективної сполуки, яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген, та
(b2) подальше інкубування згаданої пазушної меристемної тканини після етапу (b) та, за необхідності, (b1) - на середовищі, яке індукує пагони (SIM) та містить принаймні один рослинний фактор росту, де згадане середовище, яке індукує пагони, переважно, не містить селективної сполуки, яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген, та
(с1) перенесення згаданих пагонів після етапу (с) на середовище для елонгації, яке включає
(і) принаймні один рослинний фактор росту в концентрації, придатній для видовження пагонів, та
(іі) за необхідності, одну або більше селектуючих сполук, які в комбінації з селективним маркерним геном за (b) дозволяють ідентифікувати та/або селектувати рослинну клітину, тканину або рослину, яка має селективний маркерний ген, та культивування вказаних перенесених пагонів на вказане середовище для елонгації до видовження вказаних пагонів до довжини принаймні приблизно 2 см.
3. Спосіб згідно з пунктом 1 або 2, де пазушна меристемна тканина першого або вищих вузлів може бути надана в різних формах вибраних з групи:
a) пазушна меристема проростків, представлена в значній мірі цілими проростками, та
b) пазушна меристема листків, представлена видаленням першого або вищих листків, таким чином, що пазушна меристемна тканина залишається при листкових черешках, та
c) розведена пазушна меристема.
4. Спосіб згідно з пунктом 3, де значною мірою цілий сіянець вибрано з наступної групи матеріалів, яка складається з:
a) цілого сіянцю та
b) сіянцю, в якого видалено корінь, та
c) сіянцю з видаленою однією або обома сім'ядолями, та
d) сіянцю з видаленим коренем або одним або обома сім'ядолями, та
e) сіянцю з видаленими коренями, обома сім'ядолями та частиною епікотиля, зі збереженою пазушною меристемою, приєднаною до частини епікотиля.
5. Спосіб згідно з будь-яким з пунктів 1-4, в якому сіянці сої дозрівають 4-10 днів перед отримуванням експлантів.
6. Спосіб згідно з будь-яким з пунктів 1-5, в якому середовища, принаймні одного з етапів (b), (b1), (b2) та/або (с), містять цитокінін.
7. Спосіб згідно з пунктом 6, в якому цитокінін є 6-бензиламінопурином в концентрації між приблизно 1 мкМ та приблизно 10 мкМ.
8. Спосіб згідно з будь-яким з пунктів 1-7, в якому середовища, принаймні на одному з етапів (b), (b1), (b2), (с) та/або (с1), переважно на принаймні (b) та (с1), містять від приблизно 0,1 мкМ до приблизно 2 мкМ гіберелінової кислоти (GA3).
9. Спосіб згідно з будь-яким з пунктів 1-8, в якому середовища, принаймні одного з етапів (b), (b1), (b2) та (с), містять принаймні одну тіольну сполуку.
10. Спосіб згідно з пунктом 9, в якому тіольною сполукою є L-цистеїн в концентрації між близько 1 мкМ та 10 мкМ, дитіотриетол в концентрації між близько 0,1 мМ та 5 мМ, та/або тіосульфат натрію в концентрації між близько 0,1 мМ та 5 мМ.
11. Спосіб згідно з будь-яким з пунктів 1-10, в якому середовища, принаймні на одному з етапів (с1) та/або (d), містять від близько 0,01 мг/л до близько 1 мг/л індолоцтової кислоти (ІОК), та/або від близько 0,1 мкМ до близько 4 мкМ гіберелінової кислоти (GA3), та/або від близько 0,5 мкМ до близько 6 мкМ зеатинрибозидної кислоти.
12. Спосіб згідно з будь-яким з пунктів 1-11, в якому Agrobacterium є штамом, вибраним з групи, яка включає знешкоджені штами Agrobacterium tumefaciens та Agrobacterium rhizogenes.
13. Спосіб згідно з пунктом 12, в якому штам Agrobacterium є знешкодженим штамом Agrobacterium rhizogenes K599.
Текст
1. Спосіб одержання трансгенної рослини сої, який включає етапи: (a) забезпечення пазушної меристемної тканини первинного або вищого листкового вузла проростка сої, та (b) сумісне культивування згаданої пазушної меристемної тканини із Agrobacterium, яка містить трансгенну Т-ДНК, де згадана трансгенна Т-ДНК включає принаймні одну рослинну експресійну касету агрономічно цінної ознаки та, за необхідності, один або більше селективних маркерних генів, та (c) перенесення згаданої сумісно культивованої пазушної меристемної тканини на середовище, яке індукує пагони, яке включає (і) принаймні один рослинний фактор росту в концентрації, придатній для індукування утворення пагонів de novo зі згаданої пазушної меристемної тканини, та 2 (19) 1 3 90860 4 (с1) перенесення згаданих пагонів після етапу (с) на середовище для елонгації, яке включає (і) принаймні один рослинний фактор росту в концентрації, придатній для видовження пагонів, та (іі) за необхідності, одну або більше селектуючих сполук, які в комбінації з селективним маркерним геном за (b) дозволяють ідентифікувати та/або селектувати рослинну клітину, тканину або рослину, яка має селективний маркерний ген, та культивування вказаних перенесених пагонів на вказане середовище для елонгації до видовження вказаних пагонів до довжини принаймні приблизно 2см. 3. Спосіб згідно з пунктом 1 або 2, де пазушна меристемна тканина першого або вищих вузлів може бути надана в різних формах вибраних з групи: a) пазушна меристема проростків, представлена в значній мірі цілими проростками, та b) пазушна меристема листків, представлена видаленням першого або вищих листків, таким чином, що пазушна меристемна тканина залишається при листкових черешках, та c) розведена пазушна меристема. 4. Спосіб згідно з пунктом 3, де значною мірою цілий сіянець вибрано з наступної групи матеріалів, яка складається з: a) цілого сіянцю та b) сіянцю, в якого видалено корінь, та c) сіянцю з видаленою однією або обома сім'ядолями, та d) сіянцю з видаленим коренем або одним або обома сім'ядолями, та e) сіянцю з видаленими коренями, обома сім'ядолями та частиною епікотиля, зі збереженою пазушною меристемою, приєднаною до частини епікотиля. 5. Спосіб згідно з будь-яким з пунктів 1-4, в якому сіянці сої дозрівають 4-10 днів перед отримуванням експлантів. 6. Спосіб згідно з будь-яким з пунктів 1-5, в якому середовища, принаймні одного з етапів (b), (b1), (b2) та/або (с), містять цитокінін. 7. Спосіб згідно з пунктом 6, в якому цитокінін є 6бензиламінопурином в концентрації між приблизно 1мкМ та приблизно 10мкМ. 8. Спосіб згідно з будь-яким з пунктів 1-7, в якому середовища, принаймні на одному з етапів (b), (b1), (b2), (с) та/або (с1), переважно на принаймні (b) та (с1), містять від приблизно 0,1 мкМ до приблизно 2мкМ гіберелінової кислоти (GA3). 9. Спосіб згідно з будь-яким з пунктів 1-8, в якому середовища, принаймні одного з етапів (b), (b1), (b2) та (с), містять принаймні одну тіольну сполуку. 10. Спосіб згідно з пунктом 9, в якому тіольною сполукою є L-цистеїн в концентрації між близько 1мкМ та 10мкМ, дитіотриетол в концентрації між близько 0,1мМ та 5мМ, та/або тіосульфат натрію в концентрації між близько 0,1мМ та 5мМ. 11. Спосіб згідно з будь-яким з пунктів 1-10, в якому середовища, принаймні на одному з етапів (с1) та/або (d), містять від близько 0,01мг/л до близько 1мг/л індолоцтової кислоти (ІОК), та/або від близько 0,1мкМ до близько 4мкМ гіберелінової кислоти (GA3), та/або від близько 0,5мкМ до близько 6мкМ зеатинрибозидної кислоти. 12. Спосіб згідно з будь-яким з пунктів 1-11, в якому Agrobacterium є штамом, вибраним з групи, яка включає знешкоджені штами Agrobacterium tumefaciens та Agrobacterium rhizogenes. 13. Спосіб згідно з пунктом 12, в якому штам Agrobacterium є знешкодженим штамом Agrobacterium rhizogenes K599. Даний винахід належить до поліпшених методів включення ДНК в геном рослини сої (Glycine max) з використанням меристемних клітин першого або вищих листкових вузлів в якості цільової тканини, за допомогою трансформації опосередкованої Agrobacterium й наступної регенерації трансформованих клітин в цілу рослину. Соя (Glycine max) належить до сімейства Fabaceae (Leguminosae). Це сімейство рослин називається так, оскільки їхнє насіння знаходиться в стручку (плід бобових). Вважається, що соя походить з Китаю. Дикі різновиди сої мають лозисте стебло, що може бути головною причиною того, що соя була вперше розмножена в Сполучених Штатах, як сінна культура. Ввезення її з Китаю, Маньчжурії, Кореї та Японії мало велике значення для розвитку сортів у Сполучених Штатах. Сучасне селекціонування намагається покращити агрономічні характеристики, такі як більш рівний ріст, зменшення полягання та збільшення розміру насіння, що є основними факторами, що сприятимуть поширенню культури сої у всесвітньому масштабі. Посівні площі та питома частина у врожаї зернових культур постійно зростає, й тепер соя є важливим аграрно-сировинним товаром. Культивована соя має важливе комерційне значення в усьому світі. В усьому світі щорічно більше 50 мільйонів гектарів використовується для вирощування сої при врожайності у 100 тон й оціночною вартістю 20 мільярдів доларів. Таким чином, розвиток наукових методів придатних для поліпшення кількості та якості цієї культури має велике комерційне значення. Соя широко застосовується як джерело протеїнів, олій, приправ та хімічних кормових добавок. Значні зусилля були докладені для поліпшення якості сортів культивованої сої звичайними методами селекції, й досягнуто значних успіхів. Методи традиційної селекції рослин мали обмеження, зокрема, у перенесенні генів та ознак від одного різновиду сої до іншого. Сучасні біотехнологічні дослідження та розробки пропонують способи поліпшення сільськогосподарських товарів за допомогою генної інженерії. Генна інженерія рослин включає перенесення потрібного гену або генів у спадкову клітинну лінію рослин, таким чином, що ці гени можуть бути пе 5 редані до або між елітними різновидами використовуваними в сучасному сільському господарстві. Методики переносу генів дозволяють розробляти нові класи різновидів елітних культур з покращеною стійкістю до хвороб, толерантністю до гербіцидів та покращеною харчовою цінністю. Було розроблено багато методів перенесення генів в рослинні тканини, включаючи високошвидкісну мікропроекцію, мікро ін'єкцію, електропорацію, пряме поглинання ДНК та трансформацію генів опосередковану Agrobacterium. Трансформація генів опосередкована Agrobacterium є найбільш широко застосовуваною методикою переносу генів у рослинах. Ця методика використовує перевагу патогенності ґрунтової бактерії Agrobacterium tumefaciens. Agrobacterium tumefaciens має природну здатність до перенесення частини ДНК, названої Т-ДНК, в геном клітин рослини, індукуючи ці клітин до продукування метаболітів корисних для бактеріального харчування. Трансформація опосередкована Agrobacterium використовує перевагу цієї концепції, заміщуючи Т-ДНК Agrobacterium на чужорідний набір генів, роблячи таким чином, бактерію вектором здатним переносити чужорідні гени в геном рослинної клітини. Звичайно, чужорідний конструкт, який переноситься в рослинну клітину включає певний потрібний ген, який потрібно ввести в зародкову лінію рослини, зв'язаний із селективним маркером, який несе в рослинну клітину резистентність до селектуючої хімічної сполуки. Звичайно, перенос генів опосередкований Agrobacterium відбувається в недиференційовані клітини, які культивуються в тканинній культурі, відомій як калусна культура, або трансфер проводиться в диференційовану рослинну клітину з листка або пагона, яка потім індукується до перетворення у недиференційовану калусної культури. Розробка методу введення чужорідних генів у види сої значно збільшили перелік ознак, які можуть бути введені в сою. Для одержання системи придатної для введення в сою, потрібно подолати багато складнощів. Це включає оптимізацію регенерації в цілі рослини цільових тканин, визначення умов (таких як, часу, концентрації бактерій, та середовищ) сумісного культивування клітин сої з клітинами Agrobacterium та визначення відповідного протоколу селектування. Однак, введення ДНК в сою за допомогою бомбардування частинками, електропорацією або введення опосередковане Agrobacterium були визнані складними. Частково, це внаслідок того, що у сої мала кількість клітин які можуть бути тотипотентними (Trick et al. (1997) Plant Tissue Cult Biotechnol 3:9-26). Методи, які застосовують Agrobacterium tumefaciens для введення ДНК, мають додаткові складнощі з подоланням несумісності між експлантами сої та Agrobacterium. Два методи, які звичайно використовуються це метод націлювання на пазушну вузлову меристему сім'ядолі за допомогою Agrobacterium (Hinchee et al. (1988) Bio/Technology 6:915-922) та методі з використанням бомбардування зрілих зиготичних ембріонів (Finer and McMullen (1991) In Vitro Cell Dev Biol 27P:175-182). 90860 6 Описані методи основані на соматичному ембріогенезі: Ембріони індукуються з незрілих сім'ядолей сої поміщенням експлантів у високі концентрації 2,4-D (40mg/L), та ембріогенні тканини потім проліферують на індукційному середовищі (Finer (1988) Plant Cell Rep 7:238-241) або рідкій суспензійній культурі (Finer and Nagasawa (1988) Plant Cell Tissue Organ Cult 15:125-136). Описані далі методи основані на трансформації незрілих зиготичних сім'ядолей опосередкованій Agrobacterium (Parrott et al. (1989) Plant Cell Rep 7:615-617; Yan et al. (2000) Plant Cell Rep 19:1090-1097; Kо et al. (2003) Theor Appl Genet 107:439-447). Однак, в Parrott et al. три одержані рослини були химерними, мали багатоклітинне походження, й не передавали трансген в наступне покоління. Yan et al. (2000) Plant Cell Rep 19:10901097 повідомили про низьку частоту трансформації яка становила 0.03%. Одержані рослини передавали трансген в наступне покоління, можливо завдяки постійному селектуванню трансформованих первинних ембріонів для одержання вторинних ембріонів, що призводило до отримання нехимерних рослин. Нещодавно, Kо et al. (2003) Theor Appl Genet 107:439-447 повідомили про вирощування трансгенної рослини із частотою трансформації 1.7%, хоча, метод був оснований на використанні частково знешкодженого (онкогенного) штаму Agrobacterium, pKYRT, із функціональною послідовністю ТР-ДНК для стимулювання ембріогенезу (Kо et al. (2004) Planta 218:536-541). Ці методи використовують незрілі сім'ядолі в якості тканини-мішені із наступною проліферацією та селекцією на твердому середовищі. Інші методи трансформації сої основані на трансформації бомбардуванням частками проліферативних ембріогенних культур. Фертильні трансгенні рослини сої були одержані за допомогою бомбардування частками (Finer and McMullen (1991) In Vitro Cell Dev Biol 27P: 175-182; Sato et al. (1993) Plant Cell Rep 12:408-413; Parrott et al. (1994) In Vitro Cell Dev Biol 30P:144 -149; Hadi et al. (1996) Plant Cell Rep 15:500-505; Stewart et al. (1995) Plant Physiol 112:121-129; Maughan et al. (1999) In Vitro Cell Dev Biol-Plant 35:334-349). В цих методах, проліферативні ембріогенні культури, як із рідких так і з твердих середовищ використані для бомбардування частками та наступного селектування, яке відбувалося одразу на рідких або твердих середовищах. Описані вище методи основані на ембріогенних культурах мають один або більше наступні недоліки: 1. Постійне постачання парникових рослин потрібне для забезпечення незрілими сім'ядолями до започаткування ембріогенних культур та індукування ембріогенезу. 2. При мікрочастковому бомбардуванні, індукування соматичних ембріонів відбувається протягом принаймні 90 днів на твердому або рідкому середовищі перед бомбардуванням. Після бомбардування, ембріони переносяться на селекційне середовище на 4 тижні, або до видовження ембріонів. Ембріогенні кластери, що вижили, були перенесені на середовище для дозрівання, як мінімум 7 на 4 тижні. Зрілі ембріони потім були відсічені на 2-7 день й покладені на гермінаційне середовище на 3-4 тижні. Після того як ембріони розвинули погони та корені, вони були перенесені у горщечки Magenta на 2-3 тижні перед перенесенням до оранжереї. Процес тривав приблизно від 9 місяців до року. 3. Для інфікування Agrobacterium, були використані незрілі сім'ядолі в якості матеріалу-мішені, й таким чином було скорочено час на 3 місяці. Однак, для одержання нехимерних рослин, для індукування проростання рослин перед вирізанням було необхідно отримати вторинні ембріони з трансгенних первинних ембріонів. 4. Було складно забезпечити стерильність при соматичному ембріогенезі та бомбардуванні частками (Samoylov et al. (1998) Plant Cell Rep 18:4954). Переважно, це було наслідком тривалого часу культивування (дивись вище). 5. Індукування соматичних ембріонів та формування проліферативних ембріогенних культур, значною мірою залежали від генотипу (Bailey et al. (1993) In Vitro Cell Dev Biol 29P: 102-108; Bailey et al. (1993) Crop Sci 34:514-519; Simmonds and Donaldson (2000) Plant Cell Rep 19:485-490). Інші методи трансформації сої використовували ембріональну вісь в якості тканини-мішені. Методи трансформації бомбардуванням частинками незрілих ембріональних осей описані в (McCabe et al. (1988) Bio/Technology 6:923-926; Aragao et al. (2000) Theor Appl Genet 101:1-6). Ембріони незрілих, стерильних насінин відсікали, й апікальну меристему оголювали видаленням первинних листків. Після бомбардування апікальної меристеми, експланти були перенесені на середовище, що індукує пагони на ніч, й експланти були перенесені на відновлювальне плюс селекційне середовище на термін 2 тижні до появи видовження пагонів. Після 3-4 тижнів додаткові пагони регенерували. В цілому від 5 до 7 пагонів регенерували повністю, тоді як в Aragao et al. (2000), регенерували лише 10% з цих пагонів. Ефективність трансформації становила від 0.1 до 20.1%. Ця група використовувала anas (синтазу ацетогідроксикислот) для селектування трансгенних клітин, тоді як за протоколом McCabe et al. (1988) Bio/Technology 6:923-926 селектування не застосовувалося. Трансформація незрілих ембріональних осей опосередкована Agrobacterium докладніше описана в US 20030046733 та US 6,384,301 з ефективністю трансформації від 1 до 3%. Протокол подібний до описаного вище, де замість бомбардування, застосовується Agrobacterium й включено етап сумісного культивування. Також, заявлено попередню обробку насіння гормонами. Інші методи належать до трансформації сім'ядольного вузла, наприклад, за допомогою бомбардування частками (US 5,322,783). Сім'ядольний вузол береться після відсікання меристеми від просякнутого насіння, попередньої обробки цитокінами протягом 1 дня, та попереднього культивування на сахарозному середовищі протягом ще одного дня. В цьому патенті трансформовані рослини не представлено. Ймовірно, цей метод може бути складним для досягнення клітин бомбарду 90860 8 ванням частками. Було повідомлено про рослини, трансформовані за допомогою інфекції Agrobacterium tumefaciens сім'ядольного вузла (Hinchee et al. (1988) Bio/Technology 6:915-922; Zhang et al. (1999) Plant Cell Tissue Organ Cult 56:37-46; Olhoft and Somers (2001) Plant Cell Rep 20:706-711; Olhoft et al. (2003) Planta 216:723-735). Експланти отримані з 5-денних рослин були експоновані Agrobacterium tumefaciens. Після сумісного культивування, пагони індукувалися протягом 4 тижнів із селектуванням. Видовження трансформованих пагонів починалося на 4-6 тиждень на елонгаційному середовищі й тривало 6 місяців. Трансформовані пагони вкорінювалися на вкорінювальному середовищі протягом 5-7 днів перед перенесенням до оранжереї. Хоча були подолані деякі з проблем пов'язаних з трансформуванням сої за допомогою методів описаних в літературі, ще була нагальна потреба в поліпшенні, оскільки досі відомі методи мали рівень трансформації, зокрема ефективності регенерації, від низького до середнього. Хоча було зроблено значний поступ в галузі методів трансформації, опосередкованих Agrobacterium, все ще існувала потреба в покращенні методів для забезпечення легкості, швидкості та ефективності цих методів трансформації рослин сої. Отже, метою даного винаходу є забезпечення поліпшеного методу, що має вищу загальну ефективність процесу створення трансгенних рослин сої. Ця мета досягнута даним винаходом. Цей винахід використовує Agrobacterium, включаючи Agrobacterium tumefaciens, для введення Т-ДНК в меристематичні клітини, розташовані переважно в першому листковому вузлі, усіх інших вищих листкових вузлах, та регенерування в зрілі трансгенні рослини. Ці тканини мішені безпосередньо інфіковані на стадії саджання бактерією Agrobacterium. Згідно першої реалізації, винахід стосується способу отримання трансгенної рослини сої який включає наступні етапи: (a) забезпечення пазушної меристемної тканини первинного або вищого листкового вузла проростка сої, та (b) сумісне культивування згаданої меристемної тканини із Agrobacterium, яка містить трансгенну Т-ДНК, де згадана трансгенна Т-ДНК включає, принаймні одну рослинну експресійну касету агрономічно цінної ознаки, та можливо, один або більше селективних маркерних генів, та (c) перенесення, згаданої сумісно культивованої пазушної меристемної тканини на середовище, яке індукує пагони, яке включає (і) принаймні один рослинний фактор росту в концентрації придатній для індукування утворення пагонів de novo зі згаданої пазушної меристемної тканини, та (іі) можливо, одну або більше селектуючу сполуки, яка в комбінації з селективним маркерним геном згідно (b) дозволяє ідентифікувати та/або селектувати рослинну клітину, тканину або рослину, яка має селективний маркерний ген, та/або (ііі) можливо, один або більше антибіотики придатні для інгібування росту Agrobacterium, 9 та культивування, згаданої сумісно культивованої пазушної меристемної тканини до індукування пагонів та їхнього розвитку та виділення згаданих пагонів, та (d) перенесення згаданих виділених пагонів на вкорінювальне середовище та культивування згаданих пагонів на згаданому вкорінювальному середовищі доки вказані пагони не сформують коріння, та подальше регенерування одержаних таким чином рослин до зрілих рослин, які мають вставлену в свій геном Т-ДНК, яка містить, принаймні, одну рослинну експресійну касету агрономічно цінної ознаки, та можливо, принаймні, один селективний маркерний ген. Переважно, спосіб даного винаходу включає один або більше, етап вибраний з наступної групи: (а1) ушкодження рослини перед, підчас або безпосередньо після сумісного культивування та, (b1) перенесення, згаданої сумісно культивованої пазушної меристемної тканини після етапу (b) на середовище яке містить, принаймні, один антибіотик придатний для інгібування росту Agrobacterium та, можливо, принаймні один рослинний фактор росту, де згадане середовище переважно, не містить селективної сполуки, яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген та, (b2) подальше інкубування згаданої пазушної меристемної тканини після етапу (b) та, можливо, (b1) - на середовище, яке індукує пагони (SIM) яке містить принаймні один рослинний фактор росту, де згадане середовище яке індукує пагони, переважно, не містить селективної сполуки яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген та, (с1) перенесення, згаданих пагонів після етапу (с) на елонгаційне середовище, яке включає (і) принаймні один рослинний фактор росту в концентрації придатній для видовження пагонів, та (іі) можливо, одну або більше селектуючу сполуки, яка в комбінації із селективним маркерним геном за (b) дозволяє ідентифікувати та/або селектувати рослинну клітину, тканину або рослину, яка має селективний маркерний ген, та культивування згаданих перенесених пагонів на згаданому елонгаційному середовищі доки вказані пагони не видовжаться до довжини, принаймні, 2см. Пазушна меристемна тканина первинного або вищого листкового вузла проростка може бути надана в різних формах: a) Метод А: Пазушна меристема саджанців: Може бути використаний цілий сіянець або його значна частина (як наприклад, сіянці без коренів або сіянці без обох сім'ядолей), інокульований Agrobacterium й поміщений на індукційне середовище пагонів (SIM). Переважно значною мірою, цілий сіянець вибрано з наступної групи матеріалів: і) цілий сіянець, та іі) сіянець, в якого видалено корінь, та 90860 10 ііі) сіянець, із видаленою однією або обома сім'ядолями, та iv) сіянець, із видаленим коренем або одним або обома сім'ядолями, та ν) сіянець, із видаленими коренями, обома сім'ядолями та частиною епікотиля, із залишеною меристемою приєднаною до частини епікотиля. b) Метод В: Пазушна меристема листків: Первинний або вищі листки видалено, таким чином, що пазушна меристематична тканина залишається при листкових черешках, занурюється в розчин із Agrobacterium, сумісно культивується в середовищі для сумісного культивування, та поміщується на середовище для індукування пагонів (SIM). c) Метод С: Розмножена пазушна меристема: У пророслих (переважно майже) 7-денних сіянців видалено гіпокотиль та один з половиною або частину обох сім'ядолей видалено з кожного сіянцю. Потім сіянці були поміщені на розмножувальне середовище на 2-4 тижні. Один пагін було одержано з ростової зони головної апікальної бруньки та, можливо, по одному з кожної пазушної бруньки в сім'ядольному вузлі. Для одержування експлантів кожний пагін вирощується приблизно 7см у довжину та має 3-6 вкорочених міжвузля (Фіг.3А). Пазушні вузли були вирізані з першого по четвертий лист. В середньому з кожного сіянцю можуть бути отримані від трьох до чотирьох експлантів. Окрім явно визначених джерел (Метод А, В, С) наведених вище, можуть бути використані інші придатні джерела меристематичної тканини. Ці джерела можуть бути, наприклад, більш обмеженими експлантами отриманими з сіянців сої, таких як лише епікотиль та первинний листковий вузол. Очевидно, що обмежені (тобто, малі) експланти можуть бути отримані не лише з первинного вузла, але й з верхніх вузлів також (наприклад, вторинного або вищих вузлів). Сіянці сої, які знаходяться в джерелі експлантів пазушної меристематичної тканини, переважно дозрівають 4-10 днів перед отримуванням експлантів. Даним винаходом пропонується новий та ефективний метод виконання трансформації зародкової лінії сої, за допомогою трансформації опосередкованої Agrobacterium, безпосередньо на пазушні меристематичні клітини первинного або більш вищого листкового вузла проростка сої. Пряме індукування пагонів з трансформованих пазушних меристематичних клітин, дає в результаті зародкову лінію трансгенних рослин. Увесь процес є швидким та ефективним. Одним значним аспектом даного винаходу є те, що скорочення періоду попередньої обробки насіння сої покращило пагоноутворення в експлантів, що вижили, а також скорочення часу на одержання рослин, які можна перенести в оранжерею. Також, скорочення часу та матеріалів створює систему, яка є економічно вигідною для тих хто її запровадить. Метод даного винаходу не потребує калусної культури, яка відома на практиці як дуже залежна від культивару (особливо на етапі регенерації). Отже, оскільки пазушні меристематичні клітини присутні в усіх культиварах сої та, ймовірно, усі мають подібну здатність до регенерації, спосіб даного вина 11 ходу може бути використаний на будь-якому різновиді або культиварі сої. Можуть бути використані різноманітні штами Agrobacterium. Можуть бути використані штами, як Agrobacterium tumefaciens так і Agrobacterium rhizogenes. В переважній реалізації винаходу використовуються "знешкоджені" штами (тобто, у яких видалено ген, що індукує пухлинний або коренево-волосковий фенотипи). Особливо переважним штамом Agrobacterium rhizogenes є знешкоджений штам Agrobacterium rhizogenes K599 або його похідні. Це такі штами, як ті, що описані в попередній заявці US No.60/606789, поданій 2 вересня, 2004, повністю включеної сюди через посилання на неї. В переважній реалізації винаходу, пазушна меристемна тканина травмується перед інокулюванням Agrobacterium. В іншій переважній реалізації, середовища, принаймні одного з етапів (b), (b1), (b2), та/або (с), містять цитокінін (такий як, наприклад, 6бензиламінопурин (ВАР, БАП)). Переважно концентрація 6-бензиламінопурину становить від приблизно 1мкМ до приблизно 10мкМ (ВАР). Ще більш особливо переважно, щоб середовище, принаймні на одному з етапів (b), (b1), (b2), (с) та/або (с1), переважно на, принаймні (b) та (с1), містить від приблизно 0.1мкМ до приблизно 2мкМ гіберилінової кислоти (GA3). В іншій переважній реалізації, середовища, принаймні одного з етапів (b), (b1), (b2), та (с), переважно на, принаймні (b), містять, принаймні одну тіольну сполуку, переважно вибрану з групи, яка включає тіосульфат натрію, дитіотриетол (ДТТ) та цистеїн. Переважно концентрація становить від приблизно 1мкМ до 10мкМ L-цистеїну, 0,1мкМ до 5мкМ ДТТ, та/або 0,1мкМ до 5мкМ тіосульфату натрію. В іншій переважній реалізації винаходу, середовища, принаймні на одному з етапів (с) та/або (d), містять від приблизно 0.01mg/l до приблизно 2мкМ mg/l індолоцтової кислоти (ІАА, ІУК), та від приблизно, 0.1мкМ до приблизно 4мкМ гіберилінової кислоти (GA3), та/або від приблизно 0.5мкМ до приблизно 6мкМ зеатинрибозидної кислоти. Ці та інші об'єкти, переваги та характерні риси даного винаходу стануть зрозумілими із наступного опису. Скорочення: ВАР - 6-бензиламінопурин; 2,4-D - 2,4-дихлорофеноксиоцтова кислота; MS - середовище Murashige та Skoog (Murashige T and Skoog F (1962) Physiol. Plant. 15, 472-497); NAA - 1нафталеноцтова кислота; MES, 2-(N-морфоліноетансульфонова кислота, ІАА: індолоцтова кислота; ІВА: індолмасляна кислота; Кап: Канаміцин сульфат; GA3 - гіберелова кислота; TimentinTM: двонатрію тікарцилін / клавуланат калію. Має бути зрозуміло, що цей винахід не обмежений певною методологією, протоколами, клітинними лініями, видами або родами рослин, конструктами, та реагентами, як такими. Також має бути зрозуміло, що використана тут для цілей опису конкретних реалізацій термінологія, призначена лише для опису цих реалізацій, а не обмежування даного винаходу, який обмежується лише приве 90860 12 деною формулою винаходу. Має бути зазначено, що використані тут та в приведеній формулі винаходу, застосування форми однини може мати на увазі множину, за виключенням випадків, коли це прямо виключено контекстом. Отже, наприклад, зазначення "вектор" вказує на один або більше векторів та включає їхні еквіваленти відомі спеціалісту в даній галузі, й таке інше. Термін "майже" застосовується тут у значенні, приблизно, округлено, в районі значення. Коли використовується термін "майже" в поєднані з числовим діапазоном, він змінює цей діапазон, розширюючи межі вище та нижче зазначених числових значень. Взагалі, термін "майже" використано тут для зміни чисельного значення вище та нижче зазначених величин на 20 процентів, переважно на 10 процентів, більш переважно на 5 процентів вище або нижче (вгору або вниз). Як вжито тут, слово "або" означає будь-яку кількість з певного переліку, а також включає будьяку комбінацію членів цього переліку. Термін "нуклеїнова кислота" вказує на дезоксирибонуклеотиди або рибонуклеотиди та полімери або їхні гібриди, як одно- так і дволанцюгові, смислові та антисмислові форми. Якщо не зазначено протилежне, певна послідовність нуклеїнової кислоти також неявно охоплює її консервативно модифіковані варіанти (наприклад, вироджені кодонові заміни) та комплементарні послідовності, а також явно зазначені послідовності. Термін "нуклеїнова кислота" вживається тут взаємозамінно із "ген", "кДНК", "мРНК", "олігонуклеотид", "полінуклеотид". Фраза "послідовність нуклеїнової кислоти", як вона вжита тут, вказує на послідовний перелік літер, знаків, слів, якими позначено нуклеотиди. В одній реалізації нуклеїнова кислота може бути зондом, який має відносно невелику довжину, звичайно менш ніж 100 нуклеотидів у довжину. Часто нуклеїновокислотний зонд має довжину від майже 50 нуклеотидів до майже 10 нуклеотидів. "Регіон мішень" нуклеїнової кислоти є частиною нуклеїнової кислоти, яка визначена як така, що викликає зацікавленість. "Кодуюча послідовність" нуклеїнової кислоти є частиною нуклеїнової кислоти, яка транскрибується та транслюється послідовним чином для отримання певного поліпептиду або протеїну, коли поміщена під керування відповідними регуляторними послідовностями. Кодуючий регіон повинен кодувати такий поліпептид або протеїн. Термін "антисмислова" розуміється в значенні нуклеїнової кислоти, яка має послідовність компліментарну до цільової послідовності, наприклад блокуючи експресію послідовності інформаційної РНК (ІРНК), можна ініціювати гібридизацію цільової послідовності. Термін "смислова" розуміється в значенні нуклеїнової кислоти, яка має послідовність гомологічну або ідентичну до цільової послідовності, наприклад, послідовність яка зв'язується з фактором транскрипції протеїну та залучена до експресії певного гену. Згідно переважної реалізації винаходу, нуклеїнова кислота містить ген, що представляє інтерес 13 та елемент, який уможливлює експресію згаданого гену, що представляє інтерес. Термін "ген" вказує на кодуючий регіон, функціонально зв'язаний з відповідними регуляторними послідовностями, здатними певним чином регулювати експресію поліпептиду. Ген включає нетрансльовані регуляторні регіони ДНК (наприклад, промотори, енхансери, репресори, та інші) передуючі (розташовані вище) та замикаючі (розташовані нижче) кодуючий регіон (відкриту рамку зчитування, ВРЗ, ORF), а також, якщо можливо, проміжні послідовності (тобто, інтрони) між окремими кодуючими регіонами (тобто, екзонами). Як використано тут, термін "кодуючий регіон", коли застосовується по відношенню до структурного гену, вказує на нуклеотидні послідовності, які кодують амінокислоти, що знаходяться в поліпептиді, що кодується в результаті, трансляції молекули мРНК. Кодуючий регіон зв'язаний, у еукаріот, на 5'-кінції із нуклеотидним триплетом "ATG" який кодує ініціюючий метіонін та на 3'-кінці одним із трьох триплетів, які означають стоп кодони (тобто, ТАА, TAG, TGA). Також, крім розташованих інтронів, геномні форми гену також можуть включати послідовності розташовані на обох 5'- та 3'-кінцях послідовностей які представлені в транскрипті РНК. Ці послідовності називаються "фланкуючими" послідовностями або регіонами (фланкуючі послідовності розташовані 5' або 3'-ше до нетрансльованих послідовностей представлених транскрипті РНК). 5'-фланкуючий регіон може містити регуляторні послідовності, такі як промотори та енхансери, які керують або впливають на транскрипцію гену. 3'-фланкуючий регіон може містити послідовності які спрямовують термінацію транскрипції, посттранскрипційне розщеплення та поліаденілування. Терміни "поліпептид", "пептид", "олігопептид", "поліпептид", "генний продукт", "продукт експресії", "протеїн" використовуються тут взаємозамінно для зазначення полімеру або олігомеру послідовних амінокислотних залишків. Термін "виділена" використовується тут у значенні, що матеріал видалено з його з природного оточення. Наприклад, полінуклеотид або поліпептид, який природно присутній в живій тварині не є виділеним, але такий самий полінуклеотид або поліпептид відокремлений від співіснуючих матеріалів у їхньому природному стані є виділеним. Такі полінуклеотиди можуть бути частинами вектору та/або такі полінуклеотиди або поліпептиди можуть бути частиною композиції, та можуть бути виділені таким чином, що вектор або композиція не є частиною свого природного оточення. Термін "дикий тип", "природний" або "природного походження" по відношенню до організму, означає поліпептид або послідовність нуклеїнової кислоти, які природно зустрічаються в даному організмі або доступні в, принаймні, одному природному організмі, який незмінено, немутовано, або іншим методом не вплинуто людиною. Термін "трансгенний" або "рекомбінантний" як використано тут (наприклад, по відношенню до клітини сої або рослини) повинен вказувати на клітини та/або рослини які включають екзогенні 90860 14 гени або послідовності ДНК, включаючи але не обмежуючи генами або послідовностями ДНК, які можливо звичайно не присутні, гени звичайно не транскрибовані та трансльовані ("експресовані") в даному типі клітин, або будь-які інші гени або послідовності ДНК, які бажано ввести в нетрансформовану клітину та/або рослину, такі як гени котрі можуть нормально бути представлені в нетрансформованих клітинах та/або рослинах, але які повинні змінити експресію. Переважно термін "рекомбінантний" по відношенню до нуклеїнових кислот використовується тут в значенні, що нуклеїнова кислота ковалентно з'єднана та розташована поруч із нуклеїновою кислотою з якою вона не є наближеною в природному оточенні. "Рекомбінантні" поліпептиди або протеїни, вказує на поліпептиди або протеїни отримані за допомогою методики рекомбінантної ДНК, тобто отримані з клітин, трансформованих екзогенним конструктом ДНК, що кодує потрібний поліпептид або протеїн. Рекомбінантні нуклеїнові кислоти та поліпептиди також включають молекули, що не існують в природі як такі, але модифіковані, змінені, мутовані або зазнали іншого впливу людини. "Рекомбінантний поліпептид" є таким, що не зустрічається в природі, який відрізняється послідовністю від поліпептиду, що зустрічається в природі, принаймні, одним амінокислотним залишком. Переважні методи одержання зазначених рекомбінантних поліпептидів та/або нуклеїнових кислот можуть включати прямий або непрямий мутагенез, перестановку ДНК або інші методи рекурсивної рекомбінації. Терміни "гетерологічна послідовність нуклеїнової кислоти" або "гетерологічна ДНК" використовуються взаємозамінно по відношенню до нуклеотидної послідовності, яка легована до послідовності нуклеїнової кислоти, до якої вона не легована в природі, або до якої вона легована в природі в іншому місці. Гетерологічна ДНК не є ендогенною по відношенню до клітини в яку вона введена, а є одержаною з іншої клітини. Взагалі, хоча й необов'язково, така гетерологічна ДНК кодує РНК та протеїни, які звичайно не продукуються клітиною в якій вона експресується. "Ефективність трансформації" або "частота трансформації", як вжито тут, може бути визначена за кількістю трансформованих клітин (або трансгенних організмів, вирощених з окремих трансформованих клітин) які вирощено за стандартних експериментальних умов (тобто стандартизованих або нормалізованих відповідно до кількості клітин, які контактують з чужорідною ДНК, кількості введеної ДНК, типу та умов введення ДНК, загальних умов культури та ін.). Наприклад, коли в якості початкового матеріалу для трансформації використовуються відокремлені черешки, частота трансформації може бути виражена як кількість трансгенних пагонів (або отриманих рослинних ліній) отриманих від інокульованих черешків. Термін "клітина" вказує на окрему клітину. Термін "клітини" вказує на популяцію клітин. Популяція може бути чистою популяцією представленою одним типом клітин. Також, популяція може включати більше одного типу клітин. В даному винахо 15 ді, нема обмежень на кількість типів клітин які можуть бути представлені в клітинній популяції. Клітини можуть бути синхронізовані або несинхронізовані, переважно клітини синхронізовані. Термін "хромосомна ДНК" або "хромосомна послідовність ДНК" має розумітися як геномна ДНК клітинного ядра незалежно від положення в клітинному циклі. Тому хромосомна ДНК може, бути організована в хромосоми або хроматиди, вони можуть бути конденсовані або деконденсовані. Вставка в хромосомну ДНК може бути показана та проаналізована за допомогою різноманітних методів, добре відомих з рівня техніки, наприклад, ПЛР, аналіз Southern blot, флуоресцентна гібридизація in situ (FISH), та in situ ПЛР. Термін "структурний ген" використовується тут в значенні, що означає послідовність ДНК, яка транскрибується в мРНК, яка потім транслюється в послідовність амінокислот характерну для певного поліпептиду. Термін "експресія" вказує на біосинтез генного продукту. Наприклад, у випадку структурного гену, експресія включає транскрипцію структурного гену в мРНК та, можливо, наступну трансляцію мРНК в один або більше поліпептидів. Термін "експресійна касета" або "експресійний конструкт" використовується тут у значенні сполучення будь-якої послідовності нуклеїнової кислоти, що має експресуватися в функціональному зв'язку з промоторною послідовністю та, можливо, додатковими елементами (подібними до, наприклад, послідовності термінації та/або поліаденілування), які забезпечують експресію згаданої послідовності нуклеїнової кислоти. Термін "промотор" використовується тут в значенні, що означає послідовність ДНК, яка спрямовує транскрипцію послідовності ДНК (наприклад, структурного гену). Звичайно, промотор розташований в 5'-регіоні гену, ближче до сайту початку транскрипції структурного гену. Якщо промотор є індуцибельним промотором, тоді рівень транскрипції збільшується у відповідь на індукуючий агент. На відміну від цього, рівень транскрипції не регулюється індукуючим агентом, якщо промотор є конститутивним промотором. Також, промотор може регулюватися тканинно-специфічним або тканинно-переважним чином, таким чином, що він активнийлише в транскрипції пов'язаного кодуючого регіону в специфічній тканині(ах), таких як, листя, пагони або меристема. Термін "функціональне зв'язування" або "функціональний зв'язок" має розумітися в значенні, наприклад, послідовного розташування регуляторного елементу (наприклад, промотору) із послідовністю нуклеїнової кислоти, яка має експресуватися, якщо можливо, додаткового регуляторного елементу, (такого як, наприклад, термінатор) таким чином, що кожні регуляторні елементи можуть задовольняти свою функцію уможливлюючи, модифікуючи, полегшуючи або впливаючи іншим чином на експресію згаданої послідовності нуклеїнової кислоти. Результат експресії може залежати від розташування послідовностей нуклеїнової кислоти відносно смислової або антисмислової послідовності РНК. В цьому випадку, прямий зв'язок в 90860 16 хімічному сенсі обов'язково не потрібен. Генетичні регуляторні послідовності, такі як, наприклад, енхансерні послідовності, також спрямовують свою функцію на цільову послідовність з місця, що знаходиться досить далеко або спрямовується з інших молекул ДНК. Переважне розташування є таким, що послідовність нуклеїнової кислоти, котра повинна експресуватися рекомбінантно, розташована після послідовності, що діє як промотор, таким чином, що дві послідовності зв'язані ковалентно між собою. Відстань між промоторною послідовністю та послідовністю нуклеїнової кислоти, що має експресуватися рекомбінантно, переважно менша за 200 пар основ, особливо переважно менша за 100 пар основ, дуже особливо переважно менша за 50 пар основ. Функціональний зв'язок, та експресійна касета, можуть бути створені звичайною рекомбінацією та клонувальними методиками, як описано, наприклад, в Ausubel FM et al.(1987) Current Protocols in Molecular Biology, Greene Publishing Assoc, та Wiley Interscience; Maniatis T, Fritsch EF and Sambrook J (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory, Cold Spring Harbor (NY); Gelvin et al. (Eds) (1990) Plant Molecular Biology Manual; Kluwer Academic Publisher, Dordrecht, The Netherlands; Silhavy TJ, Berman ML and Enquist LW (1984) Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor (NY)). Однак, інші послідовності котрі, наприклад, діють як лінкер із специфічними сайтами розщеплення ферментів рестрикції, або сигнальні пептиди, також можуть бути розташовані між двома послідовностями. Вставка послідовностей може вести також до експресії злитих протеїнів. Переважно, експресійна касета, що складається зі зв'язаних промотору та послідовності нуклеїнової кислоти, що має експресуватися, може бути інтегрованою у вектор та бути вставленою в частину рослинного геному, наприклад, трансформацією. Термін "трансформація" включає введення генетичного матеріалу в рослинні клітини, що переважно призводить до хромосомної інтеграції та стабільного успадковування через мейоз. Трансформація також включає введення генетичного матеріалу в рослинні клітини у формі рослинних вірусних векторів, що включає епісомальну реплікацію та генну експресію яка може проявляти різноманітні властивості відносно мейотичної стабільності. Терміни "меристема" або "меристемні клітини" або "меристемна тканина" можуть застосовуватися взаємозамінно й означати недиференційовану рослинну тканину, яка постійно ділиться, утворюючи нові клітини, як це відбувається не верхівці пагону або кореня. Термін "вузол" або "листковий вузол" означає місце на стеблі де лист приєднується або має приєднуватися. Термін "міжвузля" означає відрізок або частину між двома вузлами на стеблі. Термін "черешок" означає черенок яким лист приєднується до стебла, який також називається ніжка листка. Термін "пазушна брунька" означає маленький пухирець уздовж стебла або гілки, іноді закритий 17 захисними лусками, й містить нерозвинений пагін, лист або квітку; також називається латеральна брунька. Термін "гіпокотиль" означає частину стебла між насіннєвими листками (котиледонами) та коренем. Термін "листкова пазуха" означає кут між листком та стеблом на якому він росте. Пазушна брунька зустрічається у листковій пазусі. Термін "котиледон" означає зародковий лист насінини рослини, який підчас розвитку або залишається в зародку або виходить, збільшується та зеленіє, також називається сім'ядоля. Насіння сої складається з двох насіннєвих половин, які є котиледонами або сім'ялистами. Два котиледони містять запас поживних речовин які харчують проростки доки вони повністю не сформуються. Колір котиледону - зелений в стручку, що розвивається, але в різних видах насіння він стає жовтим при дозріванні. Ембріональна вісь розташована між котиледоном та сполучена з нею біля кінця наближеного до мікропіле. Процес дозрівання ініціюється при перебуванні насіння у сприятливих умовах, включаючи певну температуру, воду та кисень. Корінець, звичайно, є першим органом, який прориває насіннєву оболонку в процесі розвитку сої. Він розвивається у головний корінь рослини сої. Після появи корінця з-під насіннєвої оболонки, він росте переважно вниз й розвивається у стрижневий корінь. Бічні відгалуження коренів розвиваються зі стрижневого кореня. Як тільки насіння сої починає процес розвитку, гіпокотиль [частина стебла між коренем (молодий первинний корінь) та котиледоном] видовжується й тягне розбухлий котиледон в напрямку поверхні землі. Насіннєва оболонка звичайно з часом злущується коли котиледон виходить з землі. Невдовзі після виходу котиледону, гіпокотиль припиняє видовження й гак (котиледонова дуга) випрямляється. Потім котиледон відокремлюється, відкриваючи епікотиль, який починає рости. Спочатку епікотиль складається з двох однолопатевих листків (листків з лише одним листком) та точки росту розташованої між ними. Надземний ріст рослини сої походить з епікотиля. Стебло, яке розвивається з епікотиля, є первинною структурою, що підтримує та сполучає частини рослини. Вузли головного стебла формуються швидко, для формування усіх вузлів потрібно лише 4-5 тижнів. Вузол може бути визначений за присутністю листка або відгалуження від головного стебла. Хоча довжина міжвузля (відрізок між вузлами) контролюється генетично, вона може змінюватися освітленням, водою, живленням та іншими навколишніми факторами. Розгалуження від пазушної бруньки відбувається коли верхівка головного стебла більше не може пригнічувати розвиток бруньки. За виключенням котиледонового та другого вузлів головного стебла, рослина сої має одиничний трилопатевий лист (лист із трьома листочками) на кожному вузлі розташовані на різних боках стебла. Два однолопатевих листка (утворених черешком та одним листком) знаходяться на протилежних боках на другому вузлі. Перший трило 90860 18 патевий лист знаходиться на третьому вузлі. Черешок сполучає лист із головним стеблом або відгалуженням. Пара ланцетоподібних змінених листків (прилистків) розташована в основі черешка при сполученні черешка та стебла. В основі черешка та в основі кожного листочка є велика група клітин, які називаються листовою подушечкою. Зміни у відносній тургорності (вмісті води) листової подушечки примушує черешки та листки повертатися під різними кутами. В кожній пазусі (сполученні стебла та відгалуження або листка) знаходиться пазушна брунька. Брунька може розвинутися у відгалуження, суцвіття, або зовсім не розвинутися, залежно від оточення. Даним винаходом пропонується спосіб прямої генетичної трансформації різновидів сої, Glycine max. Цей метод ґрунтується на введенні гену, опосередкованому Agrobacterium, в окрему клітину сої в пазушній меристемі первинного або вищих вузлів сої, що розвивається. Трансформовані клітини потім індукують для утворення пагонів, які з високою частотою, зародкові лінії трансформантів сої, які культивуються в цілі статево зрілі та фертильні трансгенні рослини сої. Метод не включає етап калусної культури, й отже час потрібний на весь процес від насіння до трансгенного насіння значно скорочується. Згідно першої реалізації, винахід стосується способу отримання трансгенної рослини сої який включає наступні етапи: (a) забезпечення пазушної меристемної тканини первинного або вищого листкового вузла проростка сої, та (b) сумісне культивування згаданої меристемної тканини із Agrobacterium, яка містить трансгенну Т-ДНК, де згадана трансгенна Т-ДНК включає, принаймні одну рослинну експресійну касету агрономічно цінної ознаки, та можливо, один або більше селективних маркерних генів, та (c) перенесення, згаданої сумісно культивованої пазушної меристемної тканини на середовище, яке індукує пагони, яке включає (і) принаймні один рослинний фактор росту в концентрації придатній для індукування утворення пагонів de novo зі згаданої пазушної меристемної тканини, та (іі) можливо, одну або більше селектуючу сполуки, яка в комбінації з селективним маркерним геном згідно (b) дозволяє ідентифікувати та/або селектувати рослинну клітину, тканину або рослину, яка має селективний маркерний ген, та/або (ііі) можливо, один або більше антибіотики придатні для інгібування росту Agrobacterium, та культивування, згаданої сумісно культивованої пазушної меристемної тканини до індукування пагонів та їхнього розвитку та виділення згаданих пагонів, та (d) перенесення згаданих виділених пагонів на вкорінювальне середовище та культивування згаданих пагонів на згаданому вкорінювальному середовищі доки вказані пагони не сформують коріння, та подальше регенерування одержаних таким чином рослин до зрілих рослин, які мають вставлену в свій геном Т-ДНК, яка містить, при 19 наймні, одну рослинну експресійну касету агрономічно цінної ознаки, та можливо, принаймні, один селективний маркерний ген. Описаний тут метод ґрунтується на введенні гену опосередкованому Agrobacterium в ростучі клітини сої в пазушній меристемі первинного або вищих вузлів сої. Описаний тут спосіб не використовує калусну культуру або фазу проліферації. Замість цього, введення гену опосередковане Agrobacterium проводиться в клітини в пазушній меристемі первинного або вищих вузлів сої. Пазушна меристема інокульована Agrobacterium коли міститься в цілому проростку, або може бути приєднаною до експланту, наприклад, відокремленого черешка або листа. Потім зона пазушної меристеми культивується в присутності гормону для індукування прямого утворення пагонів. Переважно, меристема культивується в присутності селективного маркеру (наприклад, гербіциду фосфінотріцину або D-амінокислот таких як, наприклад, Dаланіну або D-серину). Результатом цього етапу є індукція утворення пагонів, які з'являються з малого скупчення клітин, включаючи трансформовані клітини меристеми Час потрібний для виконання цього методу значно скорочений порівняно з іншими протоколами трансформації опосередкованої Agrobacterium. Життєздатні фенотипічно позитивні пагони сої можуть бути зібрані на 4-6 тиждень від початку процедури. Увесь життєвий цикл рослин ТО (первинні трансформанти) не на багато довший ніж це мінімально необхідно для перенесення рослин сої в оранжерею для вирощування. Способом даного винаходу пропонується одна або більше переваг, порівняно з методами описаними в рівні техніки: 1) Для методів пазушної меристеми, потрібні проростки, що досягли приблизно 4-10 днів, переважно приблизно 7 днів. Було дещо спрощено створення культури завдяки методу даного винаходу, порівняно із ембріогенними культурами. 2) Метод більш виграшний у часі: Спосіб даного винаходу базується на продукуванні de novo пагонів методом пазушної меристеми через 2 тижні після інфікування Agrobacterium та трансгенні пагонові зародки можуть бути знайдені через 3 тижні після інфікування Agrobacterium. Процес трансформації пазушної меристеми після інфікування Agrobacterium триває 3-4 тижні на середовищі індукування пагонів, мінімум 2-4 тижні на середовищі видовження пагонів та 7 днів на вкорінювальному середовищі. 3) Рослини отримані за допомогою методів опосередкованих Agrobacterium на відміну від бомбардування часточками має менше проблем з інтегруванням численних або часткових копій ДНК, що вводиться в геном (Hadi et al. (1996) Plant Cell Rep 15:500-505; Trick et al. (1997) Plant Tissue Cult Biotechnol 3:9-26). 4) Спосіб даного винаходу у значній мірі не залежить від генотипу та культивару. Розвиток пазушної меристеми дуже подібний у різних генотипів. Маніпулювання тканинами сої в цьому способі є аналогічним до попередніх способів, виконуваних за допомогою бомбардування частками, 90860 20 які було визнано адаптивними до усіх досліджуваних елітних різновидів сої. Цей метод також може бути адаптований до прямої генної трансформації в елітні культивари сої, отже є можливість уникнути потреби тривалих схрещувань між різновидами. 5) Метод оснований на трансформуванні зародкових рубців дає лише від 3 до 7 пагонів з експланту. Спосіб даного винаходу базується на трансформуванні пазушної меристеми потребує часу майже стільки ж як і вирощування рослини. Перевагою є проліферація великої кількості зародків пагонів (100 - 1,000-ч), що може дати збільшення трансгенних пагонів (збільшується можливість переходу з культури в оранжерею) та збільшується можливість селектувати трансгенні клітини для елонгації пагонів. 6) Спосіб даного винаходу базується на трансформації пазушної меристеми є більш придатним для селектування, завдяки меншій масі тканини калусу/пагону, який утворюється на середовищі для індукування пагонів порівняно із сім'ядольним вузлом. Гіпокотиль та/або епікотиль відповідальні за поглинання селективної речовини може надати поліпшених властивостей для засвоєння порівняно із щільно-тканинним сім'ядольним листком. 7) Завдяки малому розміру тканин листкових експлантів та розмножених експлантів, спосіб даного винаходу не потребує багато середовища, матеріалів та простору для культурального процесу. Для сім'ядольного вузла, лише 5 експлантів можуть бути культивовані на пластинці, хоча у випадку розмножених та листкових експлантів, на одній пластинці можуть культивуватися до 20. 8) Для варіантів основаних на розмноженій пазушній меристемі додатковою перевагою є достатня кількість матеріалу (тобто, численні експланти), який може бути одержаний з матеріалу з 3-4 тижневих проростків. Один пагін було одержано з ростової зони головної апікальної бруньки та, можливо, по одному з кожної пазушної бруньки в сім'ядольному вузлі. Для одержування експлантів кожний пагін вирощується приблизно 7 см у довжину та має 3-6 вкорочених міжвузлів. Малий розмір експлантів позитивно впливає на інфікування Agrobacterium, селектування та регенерацію, та розмножену пазушну меристему, неочікувано виявився високо регенеративним для одержання рослин без проміжної калусної фази. Малий розмір експлантів та потужний ріст має бути сприятливим для селектування трансформованих клітин, що є проблематичним в теперішніх методах трансформації. Початковим матеріалом для процесу трансформації є насіння сої. Насіння спочатку стерилізують та, можливо, замочують для розм'якшення. Насіння занурюють у воду приблизно на 3 хвилини й потім дають розм'якнути на термін до 2 годин. Потім насіння поміщують на проросткове середовище й пророщують протягом від приблизно 4 до 10 днів, переважно від приблизно 5 до 8 днів, більш переважно приблизно 7 днів. Епікотиль має переважно приблизно 0.5см при методах розмноженої меристеми й листкової меристеми та в середньому 0,5-2см при методі пазушної меристеми. 21 Переважно пророщування проводиться за умов високої освітленості (>100мкМ m-2s-1) при 25°С. Тканиною мішенню при трансформації, опосередкованій Agrobacterium, є пазушна меристемна тканина, яка міститься в первинному або вищих листкових вузлах. Першим листковим вузлом є вузол (тобто, місце на стеблі де лист приєднується або має приєднуватися) який іде наступним за сім'ядольним вузлом (тобто, місце на стеблі де сім'ядольний лист приєднується або має приєднуватися), якщо рухатися в напрямі від кореня до листя. Вищими листковими вузлами є всі вузли після первинного вузла, наприклад, другий, третій, четвертий і т.д. листкові вузли. Переважною є пазушна меристемна тканина першого вузла. Пазушна меристемна тканина першого або вищого листкового вузла проростка може бути надана та використана в різних формах в наступному етапі сумісного культивування з Agrobacterium: а) Метод А: Пазушна меристема саджанців: Може бути використаний цілий сіянець або його значна частина (як наприклад, сіянці без коренів або сіянці без обох сім'ядолей), інокульований Agrobacterium й поміщений на індукційне середовище пагонів (SIM). Переважно значною мірою, цілий сіянець вибрано з наступної групи матеріалів: і) цілий сіянець, та іі) сіянець, в якого видалено корінь, та ііі) сіянець, із видаленою однією або обома сім'ядолями, та iv) сіянець, із видаленим коренем або одним або обома сім'ядолями, та ν) сіянець, із видаленими коренями, обома сім'ядолями та частиною епікотиля, із залишеною меристемою приєднаною до частини епікотиля. b) Метод В: Пазушна меристема листків: Перший або вищі листки видалено, таким чином, що пазушна меристематична тканина залишається при листкових черешках, занурюється в розчин із (інокулюється) Agrobactehum, сумісно культивується в середовищі для сумісного культивування, та поміщується на середовище для індукування пагонів (SIM). Малий розмір експлантівта потужний ріст має бути сприятливим для селектування трансформованих клітин, що є проблематичним в теперішніх методах трансформації. c) Метод С: Розмножена пазушна меристема: У пророслих (переважно майже) 7-денних сіянців видалено гіпокотиль та один з половиною або частину обох сім'ядолей видалено з кожного сіянцю. Потім сіянці були поміщені на розмножувальне середовище на 2-4 тижні. Проростки давали декілька розгалужених пагонів, з яких можна було отримати експланти (Фіг.3А). Пазушні вузли були вирізані з першого по четвертий лист. В середньому з кожного сіянцю можуть бути отримані від трьох до чотирьох експлантів. Окрім явно визначених джерел (Метод А, В, С) наведених вище, можуть бути використані інші придатні джерела меристематичної тканини. Ці джерела можуть бути, наприклад, більш обмеженими експлантами отриманими з сіянців сої, таких як лише епікотиль та первинний листковий вузол. 90860 22 Очевидно, що обмежені (тобто, малі) експланти можуть бути отримані не лише з первинного вузла, але й з верхніх вузлів також (наприклад, вторинного або вищих вузлів). Переважно, спосіб даного винаходу включає один або більше, етап вибраний з наступної групи: (а1) ушкодження рослини перед, підчас або безпосередньо після сумісного культивування та, (b1) перенесення, згаданої сумісно культивованої пазушної меристемної тканини після етапу (b) на середовище яке містить, принаймні, один антибіотик придатний для інгібування росту Agrobacterium та, можливо, принаймні один рослинний фактор росту, де згадане середовище переважно, не містить селективної сполуки, яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген та, (b2) подальше інкубування згаданої пазушної меристемної тканини після етапу (b) та, можливо, (b1) - на середовище, яке індукує пагони (SIM) яке містить принаймні один рослинний фактор росту, де згадане середовище яке індукує пагони, переважно, не містить селективної сполуки яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген та, (с1) перенесення, згаданих пагонів після етапу (с) на елонгаційне середовище, яке включає (і) принаймні один рослинний фактор росту в концентрації придатній для видовження пагонів, та (іі) можливо, одну або більше селектуючу сполуки, яка в комбінації із селективним маркерним геном за (b) дозволяє ідентифікувати та/або селектувати рослинну клітину, тканину або рослину, яка має селективний маркерний ген, та культивування згаданих перенесених пагонів на згаданому елонгаційному середовищі доки вказані пагони не видовжаться до довжини, принаймні, 2см. В переважній реалізації винаходу, пазушна меристемна тканина травмується (етап (а1)). Травмування може мати, принаймні два стимулюючі ефекти для способу даного винаходу: (і) травмування полегшує інфікування Agrobacterium й ефективність переносу гену, (іі) травмування посилює ефективність індукування пагонів de novo, можливо завдяки ушкодженню сполучення меристемної тканини значно збільшуючи кількість пагонів, що розвиваються з тканини експланту. Травмування може бути перед інокуляцією (сумісним культивуванням), підчас інокуляції або після інокуляції Agrobacterium. Для досягнення обох ефектів від травмування, воно має проводитися перед або підчас сумісного культивування, більш переважно перед сумісним культивуванням. Можуть застосовуватися багато методів травмування, наприклад, різання, тертя, проколювання, шуровка, проникання дрібними часточками або стисненими рідинами, плазмове травмування, застосування гіпербаричного тиску або соніфікація. Травмування може бути виконане за допомогою таких предметів як, але не обмежуючись ними, 23 скальпелів, ножиць, голок, абразивних матеріалів, аерографом, частинками, електричними генними гарматами та звуковими хвилями. Іншою альтернативою для підвищення ефективності етапу сумісного культивування є вакуумна інфільтрація (Bechtold, et al. (1998) Meth. Моl. Biol. 82, 259-266; Trieu, et al. (2000) The Plant Journal 22(6), 531541)). Т-ДНК вводиться в сою за допомогою переносу ДНК, опосередкованого Agrobacterium. Термін "Agrobacterium" використовується тут у значенні всіх видів сімейства Agrobacterium (включаючи Agrobacterium tumefaciens та Agrobacterium rhizogenes). Переважно, трансформація виконується за допомогою штамів Agrobacterium tumefaciens або Agrobacterium rhizogenes. Принципи трансформації рослин за допомогою переносу ДНК опосередкованого Agrobacterium є добре відомими з літератури (Horsch RB et al. (1985) Science 225: 1229рр). Штам Agrobacterium буде включати конструкт ДНК (наприклад, плазміду), яка включає Т-ДНК яка містить, принаймні один селективний маркерний ген, та можливо, одну рослинну експресійну касету для агрономічно цінної ознаки. В результаті переносу генів, опосередкованого Agrobacterium, згадана Т-ДНК буде присутня в усіх або в значній частині клітин рослинної тканини після трансформації та регенерації. Agrobacterium tumefaciens та A. rhizogenes є ґрунтовими бактеріями патогенами рослин, які генетично трансформують рослини. Ті- та Ri- плазміди A. tumefaciens та A. rhizogenes, відповідно, несуть гени, що відповідають за генетичну трансформацію рослини (Kado (1991) Crit Rev Plant Sci 10:1). Вектори основані на Ті- та Ri- плазмідах Agrobacterium й застосовують природну систему для переносу ДНК в рослинний геном. Як частина цього високо розвиненого паразитизму Agrobacterium переносить певну частину своєї генетичної інформації (Т-ДНК; фланкована, приблизно 25bр повторами, названими правою та лівою межею) в хромосомну ДНК рослинної клітини (Zupan et al. (2000) Plant J 23(1):11-28). Згаданий перенос Т-ДНК опосередковується сумісною дією так званих vir-генів (частина природних Тіплазмід). Для використання цієї природної системи, були створені Ті-плазміди які не містили звичайних генів, що викликають пухлини ("знешкоджені вектори"). В подальшому вдосконаленні, так звані "бінарні векторні системи", Т-ДНК фізично відокремлюються від інших функціональних елементів Ті-плазмід (наприклад, vir-генів), які інкорпоровані в човниковий вектор, що дозволяє легко оперувати ними (ЕР-А 120 516; US 4.940.838). Ці бінарні вектори містять (крім знешкодженої Т-ДНК зі своїми граничними послідовностями), прокаріотичні послідовності для реплікації в Agrobacterium та Е. соlі. Це є перевагою трансформації опосередкованої Agrobacterium, що взагалі лише ДНК, фланкована граничними послідовностями, переноситься в геном й переважно вставляється одна її копія. Векторні системи та методи переносу генів опосередкованих Agrobacterium є добре відомими з літератури (Gruber et al. (1993) "Vectors for Plant 90860 24 Transformation," in METHODS IN PLANT MOLECULAR BIOLOGY AND BIOTECHNOLOGY; pp.89-119.; Miki et al. (1993) "Procedures for Introducing Foreign DNA into Plants" in METHODS IN PLANT MOLECULAR BIOLOGY AND BIOTECHNOLOGY; pp.67-88; Moloney et al. (1989) Plant Cell Reports 8: 238). Отже, для генної трансформації опосередкованої Agrobacterium, склад генів (наприклад, такий що міститься в експресійній касеті) інтегрується в специфічні плазміди, або в човниковий або проміжний вектор або в бінарний вектор. Якщо для трансформації буде використана Ті або Ri плазміда, принаймні її права межа, а в більшості випадків і права і ліва межа Ті або Ri плазміди, Т-ДНК буде зв'язана з експресійною касетою, що буде вводитися, для утворення фланкуючого регіону. Переважно використовуються бінарні вектори. Бінарні вектори здатні реплікуватися як в Е. соlі так і в Agrobacterium. Вони можуть включати селективний маркерний ген та лінкер або полілінкер (для вставки, наприклад, експресійна касета, що переноситься) фланкований правою та лівою граничними послідовностями Т-ДНК. Вони можуть бути прямо перенесені в Agrobacterium (Holsters et al. (1978) Моl Gen Genet 163:181-187). Селективний маркерний ген дозволяє селектувати трансформовані Agrobacteria та є представленим, наприклад, nptlll геном, який несе резистентність до канаміцину. Agrobacterium, який виступає в цьому випадку організмом хазяїном, повинен мати плазміду з virрегіоном. Останній потрібен для переносу Т-ДНК в рослинну клітину. Трансформований таким чином Agrobacterium може використовуватися для трансформації рослинних клітин. Застосування Т-ДНК для трансформування рослинних клітин є докладно дослідженим й описаним (ЕР 120 516; Hoekema (1985) In: The Binary Plant Vector System, Offsetdrukkerij Kanters B.V., Alblasserdam, Chapter V; An et al. (1985) EMBO J 4:277-287). Звичайні бінарні вектори основані на плазмідах "широкого кругу хазяїнів", таких як pRK252, (Bevan et al. (1984) Nucl Acid Res 12:8711-8720) або pTJS75 (Watson et al. (1985) EMBO J 4(2):277284) отриманих з плазміди Р-тиру RK2. Більшість цих векторів є похідними з pBIN19 (Bevan et al. (1984) Nucl Acid Res 12:8711-8720). Відомо багато бінарних векторів, деякі з них постачаються комерційно, такі як, наприклад, рВІ101.2 або pBIN19 (Clontech Laboratories, Inc. USA). Також вектори були вдосконалені відносно розміру та можливості оперування ними (наприклад, pPZP; Hajdukiewicz et al. (1994) Plant Моl Biol 25:989-994). Поліпшені векторні системи також описані в WO 02/00900. Можуть бути використані різноманітні штами Agrobacterium. Можуть бути використані штами, як Agrobacterium tumefaciens так і Agrobacterium rhizogenes. В переважній реалізації винаходу використовуються "знешкоджені" штами (тобто, у яких видалено ген, що індукує пухлинний або коренево-волосковий фенотипи). Особливо переважним штамом Agrobacterium rhizogenes є знешкоджений штам К599 Agrobacterium rhizogenes. Це такі штами, як ті, що описані в попередній заявці US No. 60/606789, поданій 2 вересня, 2004, повні 25 стю включеної сюди через посилання на неї. Переважні штами Agrobacterium, що застосовуються в методі даного винаходу можуть включати, але не обмежуватися, октопінові штами, наприклад, LBA4404 або агропінові штами, наприклад, ЕНА101 або ЕНА105. Придатними штамами A. tumefaciens для переносу ДНК є, наприклад, ЕНА101[рЕНА101] (Hood et al. (1986) J Bacteriol 168:1291-1301), EHA105[pEHA105] (Li (1992) Plant Моl Biol 20:1037-1048), LBA4404[pAL4404] (Hoekema et al. (1983) Nature 303:179-181), C58C1[pMP90] (Koncz & Schell (1986) МоI Gen Genet 204:383-396), та C58C1[pGV2260] (Deblaere et al. (1985) Nucl Acids Res 13:4777-4788). Іншими придатними штамами є Agrobacterium tumefaciens C58, нопаліновий штам. Іншими придатними штамами є A. tumefaciens C58C1 (Van Laerebeke et al. (1974) Nature 252,169-170), A136 (Watson et al. (1975) J. Bacteriol 123, 255-264) або LBA4011 (Klapwijk et al. (1980) J. Bacteriol., 141,128-136). Штам Agrobacterium може містити Ті-плазміду октопінового типу, переважно знешкоджену, таку як рАL4404. Взагалі, при використанні Ті-плазмід октопінового типу або допоміжних плазмід, бажано щоб ген virF було видалено або дезактивовано (Jarchow et al. (1991) Proc. Natl. Acad. Sci. USA 88:10426-10430). Іншими придатними штамами є C58C1[pGV2260] та С58С1[рМР90]. Штам C58C1[pGV2260] є штамом "октопінового типу", тоді як С58С1[рМР90] є штамом "нопалінового типу". Генетичною основою обох є штам Agrobacterium C58. С58 є також генетичною основою для штаму GV3101. Спосіб даного винаходу також може, для подальшого підвищення ефективності трансформації, застосовуватися в поєднанні із певними штамами Agrobacterium, такими як штами Agrobacterium в яких експресія vir-гену та/або його індукцію за рахунок присутності мутантних або химерних генів virA або virG (наприклад, Hansen et al. (1994) Proc. Natl. Acad. Sci. USA 91:7603-7607; Chen and Winans (1991) J. Bacteriol. 173: 11391144; Scheeren-Groot et al. (1994) J. Bacteriol 176: 6418-6426). Також можливі й інші комбінації штамів Agrobacterium (наприклад, LBA4404; Hiei et al. (1994) Plant J 6: 271-282) із супер-вірулентними плазмідами (наприклад, векторами на основі рТОК246; Ishida Y et al. (1996) Nature Biotech 745750), так званими супер-вірулентними штамами. Прикладом супер-вірулентного штаму є сукцинамопіновий штам ЕНА105. Бінарний вектор або будь-який інший вектор може бути модифікований звичайним методом рекомбінантної ДНК, розмножений в Е. соlі, та уведений в Agrobacterium за допомогою, наприклад, електропорації, або іншої трансформаційної методики (Mozo and Hooykaas (1991) Plant МоI Biol 16:917-918). Agrobacteria вирощуються добре відомими фахівцям у даній галузі методами. Вектор, що містить штам Agrobacterium, наприклад, може бути вирощений за 3 дні на середовищі YEP (дивись Приклад 2) із додаванням відповідного антибіотику (наприклад, 50mg/l стрептоміцину). Бактерії були зібрані за допомогою петлі з твердого середовища 90860 26 й ресуспендовані. В переважній реалізації винаходу, культури Agrobacterium створюються з аліквот заморожених при -80°С. Для обробки Agrobacterium різних меристемних пазушних тканинних експлантів сої, бактерії переважно ресуспендують в середовищі для сумісного культивування (ССМ). Концентрація Agrobacterium, яка застосовуватиметься для інфікування та сумісного культивування за потреби може бути змінена. Таким чином, взагалі може використовуватися діапазон концентрацій Agrobacterium від OD600 0,1 до 3,0 й діапазон періодів культивування може бути від кількох годин до 7 днів. Переважно до експлантів пазушної меристемної тканини можуть застосовуватись наступні концентрації суспензії Agrobacterium: a) Спосіб А (пазушна меристема проростків): Від приблизно OD600=0,5 до приблизно 3, переважно від приблизно OD600=1 до 2. b) Спосіб В (листова меристема проростків): Від приблизно OD600=0,1 до приблизно 1, переважно від приблизно OD600=0,125 до 0,5. c) Спосіб С (розмножена меристема проростків): Від приблизно OD600=0,2 до приблизно 1,5, переважно від приблизно OD600=0,5 до 0,8. Сумісне культивування Agrobacterium із різними пазушними меристемними тканинними експлантами сої в загальному випадку проводиться протягом, приблизно, від 1 до приблизно 6 днів, переважно, приблизно від 3 до, приблизно, 5 днів для штамів Agrobacterium tumefaciens, та приблизно від 2 до приблизно 3 днів для штамів Agrobacterium rhizogenes. Потім експланти інокулюються культурою Agrobacterium протягом від декількох хвилин до декількох годин, звичайно від приблизно 10 хвилин до 3 годин, переважно приблизно від 0.5 години до 1 години. Надлишок середовища видаляється й Agrobacterium залишається сумісно культивуватися із меристемною тканиною протягом декількох днів, звичайно від трьох до п'яти днів у темряві. На цьому етапі Agrobacterium переносить чужорідний генний конструкт в деякі клітини пазушної меристеми сої. Звичайно, на цьому етапі селектуючі сполуки відсутні. Можливо, хоча не обов'язково, використовувати одну або більше фенольну сполуку в середовищі перед або підчас сумісного культивування з Agrobacterium. "Рослинні фенольні сполуки" або "рослинні феноли" придатні для даного винаходу ті, що є виділеними заміщеними фенольними молекулами, які здатні викликати хемотаксичну відповідь, зокрема ті, що здатні індукувати підвищену експресію vir-гену в Ті-плазміді, що міститься в Agrobacterium sp., зокрема Ті-плазміда, що міститься в Agrobacterium tumefaciens. Переважним є ацетосирінгон. Більш того, певні сполуки, такі як осмопротектори (наприклад, L-пролін переважно в концентрації приблизно 700мг/л бетаїну), фітогормони (серед інших ΝΑΑ(ΗΥΚ)), опіни, або цукри, можуть діяти синергічно коли додаються в комбінації із рослинними фенольними сполуками. Рослинні фенольні сполуки, зокрема, ацетосирінгон, можуть додаватися в середовище перед контактуванням різноманітних тканинних експлантів пазу 27 шної меристеми із Agrobacteria (наприклад, від декількох годин до одного дня). Можливі концентрації в середовищі рослинних фенольних сполук знаходяться в інтервалі від 25мкМ до 700мкМ. Певні придатні індукційні умови для Agrobacterium tumefaciens були описані в (Vernade et al. (1988) J. Bacteriol. 170:5822-5829). Ефективність трансформації за допомогою Agrobacterium може бути підвищена іншими методами, відомими з рівня техніки, як наприклад, вакуумна інфільтрація (WO 00/58484), тепловий шок та/абоцентрифугування, додавання нітрату срібла, соніфікація, та інше. Додавання в середовище для сумісного культивування антиоксидантів (наприклад, дитіотриетол), або тіолових сполук (наприклад, L-цистеїн, Olhoft PM & DA Somers (2001) Plants Cell Reports 20:706-711; US2001034888), які можуть посилювати некроз тканин завдяки захисній відповіді рослин, (подібно до фенольного окислення) можуть додатково поліпшити ефективність трансформації опосередкованої Agrobacterium. Після описаного вище сумісного культивування з бактеріями (наприклад, на етапі промивання). Середовище використовується після етапу сумісного культивування (наприклад, середовище яке використовується на етапі (b1) (с), та/або (с1)) переважно містить бактеріоцид (антибіотик). Цей етап призначений для припинення або принаймні, уповільнення росту нетрансформованих клітин та знищення залишку клітин Agrobacterium. Відповідно, спосіб даного винаходу включає переважно, наступний етап: (b1) перенесення, згаданої сумісно культивованої пазушної меристемної тканини після етапу (b) на середовище яке містить, принаймні, один антибіотик придатний для інгібування росту Agrobacterium та, можливо, принаймні один рослинний фактор росту, де згадане середовище переважно, не містить селективної сполуки, яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген та, Переважними антибіотиками, які застосовуються є, наприклад, карбеніцилін (500мг/л або переважно 100мг/л) або TimentinTM (GlaxoSmithKline; використовується переважно в концентрації приблизно 250-500мг/л; TimentinTM є сумішшю двонатрію тікарцилін та клавуланату калію; 0.8г TimentinTM містить 50мг клавуланової кислоти із 750мг тікарциліну. Хімічно, двонатрію тікарцилін є двонатрієвою сіллю N-(2-карбокси-3,3диметил-7-оксо-4-тіа-1-азабіцикло[3.2.0]гепт-6-ил)3-тіо-фенемалонамової кислоти. Хімічно, клавуланат калію є (Z)-(2R,5R)-3-(2-гідроксиетилендієн)-7оксо-4-окса-1-азабіцикло[3.2.0] гептан-2карбоксилатом натрію. Після етапу сумісного культивування, сумісно культивовані експланти інкубуються на середовищі для індукування пагонів, яке містить, принаймні, один рослинний фактор росту. Згадане інкубування на середовищі для індукування пагонів може бути розпочате одразу після етапу сумісного культивування (тобто паралельно з етапом (b1) для пригнічування росту Agrobacteria) або одразу після 90860 28 проміжних етапів, таких як (b1) (пригнічення росту Agrobacteria) та/або (b2) (регенерація без селектуючих сполук; дивись нижче). Ці середовища, також можуть містити, принаймні одну сполуку, яка разом із селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини (наприклад, селектуючі речовини). Однак, бажано, щоб експланти інкубувалися певний час від приблизно 4 до приблизно 7 днів після етапу сумісного культивування (b) на середовищі, яке не містить селективної сполуки, яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген. Створення певного рівня резистентності до згаданих селектуючих сполук потребує певного часу для попередження випадкового ушкодження селектуючими сполуками, навіть трансформованих клітин та тканин. Відповідно, спосіб даного винаходу включає етап між сумісним культивуванням та селектуванням, яке проводиться без селектуючої сполуки. Цей етап може бути (b1) та/або певним додатковим етапом: (b2) подальше інкубування згаданої пазушної меристемної тканини після етапу (b) та, можливо, (b1) - на середовище, яке індукує пагони (SIM) яке містить принаймні один рослинний фактор росту, де згадане середовище яке індукує пагони, переважно, не містить селективної сполуки яка в поєднанні з селективним маркерним геном (b) дозволяє ідентифікувати та/або селектувати рослинні клітини, органи або рослини, які мають селективний маркерний ген. Середовище використане у способі даного винаходу для індукування пагонів (та/або видовження пагонів) необов'язково може містити один або більше регулятор росту рослин, такий як наприклад, цитокінинові сполуки (наприклад, 6бензиламінопурин) та/або ауксинові сполуки (наприклад, 2,4-D). Термін "регулятор росту рослин" (PGR) використовується тут в значенні природних або синтетичних (таких, що не зустрічаються в природі) сполук, які можуть регулювати ріст рослин та розвиток. PGR можуть діяти окремо або разом з однією іншою або з іншими сполуками (наприклад, цукри, амінокислоти). Термін "ауксин" або "ауксинові сполуки" включає сполуки, які стимулюють видовження та поділ клітин, диференціацію васкулярної тканини, розвиток плодів, формування додаткових коренів, вироблення етилену та, у великих концентраціях, індукування дедиференціації (утворення калусу). Найбільш розповсюдженим природним ауксином є індолілоцтова кислота (ІОК, ІАА), яка транспортується полярно в коренях та пагонах. В сучасному сільському господарстві широко застосовуються синтетичні ауксини. Синтетичні ауксинові сполуки включають індоліл-3-масляну кислоту (ІБК, ІВА), нафтилоцтову кислоту (НОК, NAA), та 2,4дихлорфеноксиоцтову кислоту (2,4-D). Сполуки, що індукують утворення коренів, але не обмежуються ними, ІОК, НОК, ІБК, цитокініни, ауксини, кінетини, гліфосат та тіадіазурон. 29 Термін "цитокінін" або "цитокінінова сполука" включає сполуки, які стимулюють поділ клітин, збільшення сім'ядолей та ріст латеральних бруньок. Вони уповільнюють старіння відокремленого листя, та в поєднанні з ауксинами (наприклад, ІОК), можуть впливати на утворення коренів та пагонів. Цитокінінові сполуки включають, наприклад, 6-ізопентеніладенін (ІПА, ІРА) та 6бензиладенін/6-бензиламінопурин (БАП, ВАР). В іншій переважній реалізації, середовища, принаймні одного з етапів (b), (b1), (b2), та/або (с), містять цитокінін (такий як, наприклад, 6бензиламінопурин (ВАР, БАП)). Переважно концентрація 6-бензиламінопурину становить від приблизно 1мкМ до приблизно 10мкМ (ВАР). Для середовища, що індукує пагони концентрація БАП переважно становить приблизно від 1 до приблизно 3мкМ. Переважно концентрація БАП не вища за 5мкМ. Ще більш особливо переважно, щоб середовище, принаймні на одному з етапів (b), (b1), (b2), (с) та/або (с1), переважно на, принаймні (b) та (с1), містить від приблизно 0.1мкМ до приблизно 2мкМ гіберилінової кислоти (GA3). В іншій переважній реалізації, середовища, принаймні одного з етапів (b), (b1), (b2), та (с), містять, принаймні одну тіольну сполуку, переважно вибрану з групи, яка включає тіосульфат натрію, дитіотриетол (ДТТ) та цистеїн. Переважно концентрація становить від приблизно 1мкМ до 10мкМ Lцистеїну, 0,1мкМ до 5мкМ ДТТ, та/або 0,1мкМ до 5мкМ тіосульфату натрію. Експланти інкубуються на згаданому середовищі для індукування пагонів, доки не розвинуться пагони. Зародки пагонів, що утворилися звичайно мають розмір не більше 0.3см. Формування пагоневих зародків триває приблизно 1 тиждень на середовищі, що індукує пагони, та в середньому таке ініціювання пагонів триває протягом приблизно 3-4 тижнів до досягнення максимальних розмірів. Відповідно, сумісно культивовані експланти інкубуються на згаданому середовищі для індукування пагонів протягом приблизно 2-6 тижнів, переважно приблизно 3-4 тижнів. Методики опосередковані Agrobacterium звичайно можуть давати в результаті введення гену в обмежену кількість клітин в тканині мішені. Отже, в переважній реалізації даного винаходу, селекційні сполуки додаються пострансформаційно для знищення усіх клітин в тканині мішені, які не трансформувалися або для ідентифікації трансформованих клітин за селектуючою ознакою. Тривалість культури залежить, частково, від токсичності селективної сполуки по відношенню до нетрансформованих клітин. Селективний маркерний ген та відповідна селектуюча сполука використана в даному селектуванні або скринінгу може бути будь-яким різновидом добре відомих селектуючих сполук, таких як антибіотики, гербіциди, D-амінокислоти (деталі дивись далі). Тривалість етапу культивування може змінюватися (залежно від селектуючої сполуки та її концентрації, селективного маркерного гену), триваючи від одного дня до майже 180 днів. 90860 30 Вставка селективного та/або скринінгового маркерного гену охоплюється змістом способу даного винаходу. В подальшому може виявитись корисним, наприклад, використання ознаки резистентності до гербіциду. Різноманітні селективні маркерні та відповідні селективні сполуки є добре відомими фахівцям у даній галузі. Також, репортерні гени можуть використовуватися для забезпечення візуального скринінгу, який може потребувати або ні, (залежно від типу репортерного гену) додавання субстрату в якості селективної сполуки. Для різних селективних маркерних генів можуть застосовуватися різні часові схеми. У випадку генів резистентності (наприклад, проти гербіцидів або D-амінокислот) селектування проводиться при індукуванні пагонів протягом приблизно 4 тижнів та принаймні 4 тижнів від елонгації пагонів. Така селекційна схема може бути застосована для всіх селекційних режимів, включаючи канаміцин. Також можливо (хоча не особливо переважно) продовжувати селектування також протягом усієї схеми регенерації включаючи вкорінення. Наприклад, у випадку гену канаміцинової резистентності (неоміцинова трансфераза, NPTII) у якості селективного маркеру канаміцин може бути включений до складу середовища в концентрації від приблизно 3 до 200мг/л. Звичайна концентрація для селекції становить від 5 до 50мг/л. Тканина вирощується на цьому середовищі протягом від приблизно 1 до приблизно 4 тижнів, переважно, приблизно 7 днів до розвинення пагонів. Утворення пагонів починається приблизно з 1 по 2 тижні залежно від обробки та умов сумісного культивування. Наприклад, у випадку гену фосфінотріцинової резистентності (bar) у якості селективного маркеру фосфінотріцин може бути включений в склад середовища в концентрації від приблизно 1 до 50мг/л. Звичайна концентрація для селекції становить від 1 до 15мг/л. Тканина вирощується на цьому середовищі протягом від приблизно 1 до приблизно 4 тижнів, переважно, приблизно 7 днів до розвинення пагонів. Утворення пагонів починається приблизно з 1 по 2 тижні залежно від обробки та умов сумісного культивування. Наприклад, у випадку гену dao 1 у якості селективного маркеру, в склад середовища може бути включений D-серин або D-аланін в концентрації від приблизно 3 до 100мг/л. Переважно, D-серин використовується в концентрації від приблизно 10 то 70мМ (або від приблизно 1 до 7.5г/л). Звичайна концентрація для селекції становить від 10 до 05мг/л (або від приблизно 1 до 5,3г/л). Тканина вирощується на цьому середовищі протягом від приблизно 1 до приблизно 4 тижнів, переважно, приблизно 7 днів до розвинення пагонів. Утворення пагонів починається приблизно з 1 по 2 тижні залежно від обробки та умов сумісного культивування. В переважній реалізації усі пагони сформовані до трансформації будуть видалені до приблизно 2 тижнів після сумісного культивування для стимулювання нового росту з меристем. Це допомагає зменшити химеризм в первинних трансформантах та збільшити ампліфікацію трансгенних меристем 31 них клітин. У цей час експланти можуть бути, а можуть й ні, розрізані на дрібніші фрагменти (тобто, відділені вузли від експлантів відсіканням епікотиля). Після 2-4 тижнів (або доки не сформується маса пагонів) на середовищі SIM (переважно із селектуванням), експланти будуть перенесені на середовище для видовження пагонів (SEM), яке буде стимулювати видовження пагонів (з зачатків пагонів). Середовище може містити або ні, селектуючі речовини, але переважно містить селектуючі речовини. Частота та довжина пагонів, що видовжуються залежить від рівня гормонів, зокрема БАП в SIM (Приклад 9). В наступній переважній реалізації винаходу, середовища, принаймні на одному з етапів (с) та/або (d), містять від приблизно 0.01mg/l до приблизно 2мкМ mg/l індолоцтової кислоти (ІАА, ІУК), та від приблизно, 0.1мкМ до приблизно 4мкМ гіберилінової кислоти (GA3), та/або від приблизно 0.5мкМ до приблизно 6мкМ трансзеатинрибозидної кислоти. Переважно, через кожні 2-3 тижні експланти переносяться на свіже середовище SEM (бажано із селективною сполукою) після обережного видалення мертвої тканини. Експланти повинні утримуватися разом, не бути фрагментованими й мати здоровий вигляд. Переважно, експланти переноситимуть доки експланти не загинуть або пагони не видовжаться. Видовжені пагони готові до збирання приблизно на 4-8 тиждень після переносу на середовище для видовження пагонів. Пагони оцінюють за фенотиповою правильністю та здоров'ям, й збирають лише пагони зі видовженим стеблом (приблизно дюйм або 2см) та такі, що мають сформовані трилопатеві листки. Зібрані пагони поміщуються на вкорінювальне середовище для індукування коренеутворення. Коренеутворення триває приблизно 1-4 тижні, після чого рослини можуть бути перенесені на ґрунт й рости до повного дозрівання. Вкорінювальне середовище (також, не обов'язково переважно) також може містити селектуючу сполуку. Переважно, видовжені пагони (більше 3см у довжину) видаляються й поміщаються на вкорінювальне середовище (RM) на термін приблизно 1 тиждень (Спосіб В), або приблизно 2-4 тижні, залежно від культивару (Спосіб С), й протягом цього часу починають формуватися корені. У випадку експлантів з коренями, їх переносять безпосередньо в ґрунт. Вкорінені пагони переносять на ґрунт й загартовують в камері протягом 2-3 тижнів перед перенесенням до оранжереї. Регенеровані рослини, отримані за допомогою цього методу є фертильними й продукують приблизно 500 насінин з рослини. Рослини Т0 отримані даним методом є трансгенними рослинами й дають стабільні задовільні врожаї. У способі С, середній час регенерації рослини задопомогою протоколу розмноженої пазушної меристеми становить 14 тижнів від інокуляції експланту. Отже, цей метод має короткий час регенерації до фертильної, здорової рослини сої. 90860 32 Трансформований рослинний матеріал (наприклад, клітини, тканини або проростки), який експресує маркерні гени, здатний розвиватися в присутності відповідних селективних сполук (наприклад, антибіотику або гербіциду) який пригнічує ріст нетрансформованих тканин диких типів. Отримані рослини можуть розводитися й схрещуватися звичайними методами. Для того що впевнитися у стабільній та спадковій геномній інтеграції треба виростити два або більше покоління. Інші важливі аспекти винаходу включають потомство трансгенних рослин, отриманих розкритими тут методами, а також клітини отримані з цього потомства та насіння отримане з цього потомства. Структура Т-ДНК винаходу Як в інших методах опосередкованих Agrobacterium, чужорідний генний конструкт або трансген, який потрібно ввести в геном сої створюється звичайними методами маніпулювання трансгенною ДНК in vitro. Потім генний конструкт трансформується у штам Agrobacterium для доставки у клітини сої. Agrobacterium є неонкогенним, зараз є доступними декілька таких штамів. Переважно, Т-ДНК яка вводиться в геном рослини-мішені сої включає принаймні одну експресійну касету, яка може, наприклад, забезпечувати експресію селективного маркерного гену, гену ознак, антисмислової РНК або дволанцюгової РНК. Переважно, згадані експресійні касети містять промоторну послідовність, функціональну в рослинних клітинах, функціонально зв'язану з послідовністю нуклеїнової кислоти, яка при експресії, вносить бажаний фенотип в трансформовану рослину. Фахівцям відомо багато послідовностей, які можуть бути використані в цьому контексті, наприклад, для підвищення якості продуктів та кормів, для продукування хімічних речовин, складних сполук або ліків (наприклад, вітамінів, олій, вуглеводів; Dunwell (2000) J Exp Bot 51 Spec No:487-96), які несуть стійкість до гербіцидів або несуть чоловічу стерильність. Також, можуть бути покращені ріст, врожайність, стійкість до біотичних та абіотичних стресорних факторів (як наприклад, грибки, віруси або комахи). Корисні ознаки можуть бути введені через надекспресію протеїнів або збільшення експресування ендогенних протеїнів експресуванням відповідних антисмислових (Sheehy et al. (1988) Proc Natl Acad Sci USA 85: 8805-8809; US 4,801,340; МоI JN et al. (1990) FEBS Lett 268(2):427-430) або дволанцюгових РНК (Matzke MA et al. (2000) Plant МоI Biol 43:401-415; Fire A. et al. (1998) Nature 391:806-811; Waterhouse PM et al. (1998) Proc Natl Acad Sci USA 95:13959-13964; WO 99/32619; WO 99/53050; WO 00/68374; WO 00/44914; WO 00/44895; WO 00/49035; WO 00/63364). Для експресування в рослинах є переважними рослинно-специфічні промотори. Термін "рослинно-специфічний промотор" розуміється в значенні, в принципі, як будь-який промотор, здатний спрямовувати експресію генів, зокрема чужорідних генів, в рослинах або частинах рослин, рослинних клітинах, рослинних тканинах або рослинних культурах. В цьому контексті, експресія може бути, 33 наприклад, конститутивною, індуковною або залежною від розвитку. Наступне є переважним: a) Конститутивні промотори "Конститутивні" промотори відносяться до таких промоторів забезпечують експресію у великій кількості, переважно, в усіх тканинах протягом значного періоду розвитку рослини, переважно на всіх стадіях розвитку рослини. Зокрема, переважно застосовується, рослинний промотор або промотор одержаний із рослинного вірусу. Зокрема, переважним є промотор 35S-транскрипт вірусу мозаїки цвітної капусти CaMV (Franck et al.(1980) Cell 21:285-294; Odell et al.(1985) Nature 313:810812; Shewmaker et al.(1985) Virology 140:281-288; Gardner et al.(1986) Plant МоI Biol 6:221- 228) або 19S CaMV промотор (US 5,352,605; WO 84/02913; Benfey et al.(1989) EMBO J 8:2195-2202). Наступним придатним конститутивним промотором є рисовий актиновий промотор (McElroy et al. (1990) Plant Cell 2: 163-171), (SSU) промотор малої субодиниці Rubisco (US 4,962,028), промотор легуміну В (GenBank Ace. No. X03677), промотор нопалінової синтази Agrobacterium, подвійний промотор TR, промотор Agrobacterium OCS (октопін-синтази), промотор убіквітину (Holtorf et al. (1995) Plant МоI Biol 29:637-649), промотор убіквітину 1 (Christensen et al. (1989) Plant Моl. Biol. 12: 619632; Christensen et al. (1992) Plant МоI Biol 18:675689; Bruce et al. (1989) Proc Natl Acad Sci USA 86:9692-9696), Smas промотор, промотор цинаміл агкогольдегідрогенази (US 5,683,439), промотори вакуолярної субодиниці АТФази, промотор pEMU (Last Dl et al. (1991) Theor. Appl. Genet. 81, 581588); MAS промотор (Velten et al. (1984) EMBO J. 3(12): 2723-2730.) та промотор гістону Н3 кукурудзи (Lepetit et al. (1992) МоI Gen Genet 231: 276285; Atanassova et al. (1992) Plant J 2(3): 291-300), промотор гену нітрілази-1 Arabidopsis thaliana (GenBank Ace. No.: U38846, нуклеотиди 3862-5325 або 5342) або промотор збагаченого на пролін протеїну пшениці (WO 91/13991), та інші промотори генів, конститутивна експресія котрих відома. b) Тканинно-специфічні або тканиннопереважні промотори Також переважними є насіннево-специфічні промотори, такі як, наприклад, промотор фазеоліну (US 5,504,200; Bustos et al. (1989) Plant Cell 1(9):839-53; Murai et al., Science 23: 476-482 (1983); Sengupta-Gopalan et al., (1985) Proc. Natl Acad. Sci. USA 82: 3320-3324), промотор гену 2S альбуміну (Joseffson et al. (1987) J Biol Chem 262:1219612201), промотор легуміну (Shirsat et al. (1989) МоI Gen Genet 215:326-331), промотор USP (невідомий промотор насіння) (Baumlein et al. (1991a) МоI Gen Genet 225(3):459-467), промотор гену напіну (US 5,608,152; Stalberg et al. (1996) Planta 199:515519), промотор протеїну зв'язування сахарози (WO 00/26388) або промотор легуміну В4 (LeB4; Baumlein et al. (1991b) МоI Gen Genet 225:121-128; Becker et al. (1992) Plant Моl. Biol. 20: 49), промотор олеозину Arabidopsis (WO 98/45461), та промотор Brassica Bce4 (WO 91/13980). Наступними переважними промоторами є листо-специфічний та світло-специфічний промотор cab або Rubisco 90860 34 (Simpson et al. (1985) EMBO J 4:2723-2729; Timko et al. (1985) Nature 318: 579-582); пильниковоспецифічний промотор такий як LAT52 (Twell et al. (1989b) МоI Gen Genet 217:240-245); пилковоспецифічний промотор такий як Zml3 (Guerrero et al. (1993) МоI Gen Genet 224:161-168); та мікроспоро-специфічний промотор такий як apg (Twell et al. (1983) Sex. Plant Reprod. 6: 217-224). c) Хімічно індуковні промотори Експресійна касета також може включати хімічно індуковні промотори (дивись статтю: Gatz et al. (1997) Annu Rev Plant Physiol Plant МоI Biol 48:89108), за допомогою котрих може керуватися експресія ендогенного гену в рослині в певний момент часу. Такі промотори як, наприклад, промотор PRP1 (Ward et al.(1993) Plant МоI Biol 22:361366), промотор індуковний саліциловою кислотою (WO 95/19443), промотор індуковний бензолсульфонамідом (ЕР 0 388 186), промотор індуковний тетрацикліном (Gatz et al.(1992) Plant J 2:397-404), промотор індуковний абсцизовою кислотою (ЕР 0 335 528) або промотор індуковний етанол- або циклогексаноном (WO 93/21334) можуть використовуватися й подібнім. Також придатним є промотор ген ізоформи II глутатіон-S-трансферази (GSTII-27), який може бути активований застосуванням такого екзогенного запобіжника, як наприклад, N,N-диаліл-2,2-дихлорацетаміду (WO 93/01294) який функціонує у великій кількості тканин як однодольних так і дводольних. Наступним прикладом індуцибельних промоторів, які можуть бути застосованими в даному винаході є ті що походять з системи АСЕ1 які відповідають на мідь (Mett et al. (1993) Proc Natl Acad Sci USA 90: 4567-4571); або промотор Іn2 з кукурудзи який реагує на бензолсульфонамідний гербіцид (Hershey et al. (1991) МоI Gen Genetics 227:229-237; Gatz et al. (1994) МоI Gen Genetics 243:32-38). Можуть використовуватися промотори, які відповідають на індукуючі агенти, на які рослини звичайно не реагують. Прикладом індуцибельного промотора є індуцибельний промотор з гену стероїдного гормону, транскрипційна активність якого індукується глюкокортикостероїдним гормоном (Schena et al. (1991) Proc Natl Acad Sci USA 88:10421). Особливо переважними є конститутивні промотори. Також, інші промотори можуть бути функціонально зв'язані з послідовністю нуклеїнової кислоти, що має експресуватися, котрі промотори роблять можливою експресію в інших тканинах або в інших організмах, таких як бактерія Е.соlі. Придатними рослинними промоторами є, в принципі, усі описані вище промотори. Генетичні компоненти та/або експресійні касети можуть містити додаткові керуючі послідовності додатково до промотора. Термін "послідовності генетичного контролю" розуміється в широкому значенні та вказує також на всі ті послідовності, котрі мають вплив на матеріалізацію або функцію експресійної касети, згідно даного винаходу. Наприклад, послідовності генетичного контролю модифікують транскрипцію та трансляцію в прокаріотичних або еукаріотичних організмах. Переважно, експресійні касети, згідно даного винаходу, охоплюють промотор який функціонує в рослинах, 5' 35 вище послідовності нуклеїнової кислоти для рекомбінантної експресії та 3'-нижче термінальної послідовності, як додаткової послідовності генетичного контролю, якщо можливо, інших додаткових регуляторних елементів, в кожному випадку функціонально зв'язаному до послідовності нуклеїнової кислоти, що має рекомбінантно експресуватися. Послідовності генетичного контролю також охоплюють 5'-нетрансльвні регіони, інтрони або некодуючі 3'-регіони генів, такі як наприклад, інтрон актину-1, або інтрони 1, 2 та 6 Adh1-S (загальний огляд: The Maize Handbook, Chapter 116, Freeling and Walbot, Eds., Springer, New York (1994)). Також було показано, що вони можуть грати важливу роль в регулювання експресії генів. Таким чином, було показано, що 5'-нетрансльовні послідовності можуть посилювати тимчасову експресію гетерологічних генів. Приклади транслювання енхансерів, які маються на увазі є 5'-лідерна послідовність вірусу мозаїки тютюну (Gallie et al. (1987) Nucl Acids Res 15:8693-8711) та подібні. Також вони можуть сприяти специфічності до тканини (Rouster J et al. (1998) Plant J 15:435-440). Експресійна касета переважно може включати одну або більше енхансерних послідовностей, функціонально зв'язаних з промотором, що робить можливим підвищену рекомбінантну експресію послідовності нуклеїнової кислоти. Додатково переважні послідовності, такі як додаткові регуляторні елементи або термінатори, можуть бути вставлені у 3'-кінець послідовності нуклеїнової кислоти, що рекомбінантно експресується. Сигналами поліаденілування, які придатні для керування послідовностями є рослинні сигнали поліаденілування, переважно ті, що суттєво відповідають сигналам поліаденілування з Agrobacterium tumefaciens, зокрема, термінатору OCS (октопінової синтази) та термінатору NOS (нопалінової синтази). Керуючі послідовності також можуть розумітися як такі, що дозволяють видаляти послідовності вставлені в геном. Методи основані на cre/lox (Sauer (1998) Methods 14(4):381-92; Odell et al. (1990) МоI Gen Genet 223:369-378; Dale and Ow (1991) Proc Natl Acad Sci USA 88:10558-10562), FLP/FRT (Lysnik (1993) Nucl Acid Res 21:969-975), або систем Ac/S (Wader et al. (1987) in TOMATO TECHNOLOGY 189-198 (Alan R. Liss, Inc.); US 5,225,341; Baker et al. (1987) EMBO J 6: 1547-1554; Lawson et al. (1994) МоI Gen Genet 245:608-615) дозволяють, якщо можливо тканинно специфічно та/або індуковно, видаляти специфічні послідовності ДНК з геному організму хазяїна. Керуючі послідовності можуть, в цьому контексті, бути фланкуючими послідовностями (наприклад, послідовності Іох), які потім будуть видалені (наприклад, за допомогою рекомбінази еrе). Генетичні компоненти та/або експресійні касети можуть містити додаткові функціональні елементи. Термін функціональний елемент розуміється в широкому значенні та вказує також на всі ті елементи, котрі мають вплив на створення, посилення або функцію генного елементу, експресійних касет або рекомбінантних організмів, згідно даного ви 90860 36 находу. Функціональні елементи можуть включати (але не бути обмеженими до): 1. Селективні Маркерні Гени Селективні маркерні гени є корисними для відокремлення успішно трансформованих або гомологічно рекомбіновані клітини. Переважно, в способі даного винаходу один селективний маркер може використовуватися для селектування в прокаріотичному хазяїні, тоді як інший маркер може використовуватися для селектування в еукаріотичному хазяїні, зокрема в рослинному хазяїні. Маркери можуть бути захистом від біоцидів, таких як антибіотики, токсини, важкі метали й подібне, або мати функцію комплементації, що надає хазяїну прототрофності ауксотрофному хазяїну. Переважні селективні маркерні гени для рослин можуть включати але не бути обмеженими до наступних: 1.1 Негативні Селективні Маркери Негативні селективні маркери несуть резистентність до біоцидних сполук, таких як інгібітори метаболізму (наприклад, 2-дезоксиглюкоза-6фосфат, WO 98/45456), антибіотики (наприклад, канаміцин, G 418, блеоміцин або гігроміцин) або гербіциди (наприклад, фосфінотріцин або гліфосат). Особливо переважними селективними маркерами є такі, що несуть резистентність до гербіцидів. Прикладами таких можуть бути приведені далі: - Фосфінотріцин-ацилтрансферази (PAT; також називають Bialophos- резистентності; bar; De Block et al. (1987) Plant Physiol 91:694-701; EP 0 333 033; US 4,975,374) 5-енолпірувілшикімат-3-фосфат синтаза (EPSPS; US 5,633,435) або ген гліфосатоскиредуктази (US 5,463,175) який несе резистентність до гліфосату (N-(фосфонометил)гліцин) (Shah et al. (1986) Science 233: 478) - Ферменти, що розкладають гліфосат (гліфосат оксиредуктаза; дох), - Дегалогенази, що інактивують далапон (deh) - ацетолактатсинтази які інактивують сульфонілсечовину та імідазолінон (наприклад мутований варіант ALS із, наприклад, S4 та/або Нrа мутацією - нітрилази, що розкладають бромоксиніл (bxn) - Гени резистентності до канаміцину або G418 (NPTII; NPTI) які кодуються, наприклад, неоміциновою фосфотрансферазою (Fraley et al. (1983) Proc Natl Acad Sci USA 80:4803), яка експресує фермент, що несе резистентність до антибіотику канаміцину й схожих антибіотиків неоміцину, пароміцину, гентаміцину та G418, 2-Дезоксиглюкоза-6-фосфат фосфатаза (DOGR1-генний продукт; WO 98/45456; ЕР 0 807 836), яка несе резистентність до 2-дезоксиглюкози (Randez-Gil et al. (1995) Yeast 11:1233-1240) - Гігроміцинова фосфотрансфераза (НРТ), яка опосередковує резистентність до гігроміцину (Vanden Elzen et al.(1985) Plant МоI Biol. 5:299). - Дигідрофолат редуктаза (Eichholtz et al. (1987) Somatic Cell and Molecular Genetics 13: 6776) Наступні негативні селективні маркерні гени бактеріального походження які несуть резистентність до антибіотиків включають, ген aadA, який несе резистентність до антибіотику спектиноміци 37 ну, гентаміцин-ацетилтрансфераза, стрептоміцинфосфотрансфераза (SPT), аміноглікозид-3аденілтрансфераза детермінант блеоміцинової резистентності (Hayford et al. (1988) Plant Physiol. 86:1216; Jones et al. (1987) Моl. Gen. Genet., 210:86; Svab et al.(1990) Plant Моl. Biol. 14:197; Hilleetal. (1986) Plant Моl. Biol. 7:171). Особливо бажаними є негативні селективні маркери, які несуть резистентність до токсичної дії D-амінокислот, таких як наприклад, D-аланін та Dсерин (WO 03/060133). Особливо бажаними є негативні селективні маркери в цьому контексті є ген daol (EC: 1.4. 3.3: GenBank Acc.-No.: U60066) з дріжджів Rhodotorula gracilis (Rhodosporidium toruloides) та ген dsdA з Ε. coli (D-серинова дегідратаза (D-серинова деаміназа) [EC: 4.3. 1.18; GenBank Acc.-No.: J01603). 1.2 Позитивні Селективні Маркери Позитивні селективні маркери надають трансформованим рослинам перевагу в рості порівняно із нетрансформованими. Гени подібні до ізопентеніл трансферази з Agrobacterium tumefaciens (штам:РО22; Genbank Acc.-No.: AB025109) можуть - будучи ключовим ферментом біосинтезу цитокініну - сприяти регенерації трансформованих рослин (наприклад, селектуванням на безцитокініновому середовищі). Відповідні методи селектування описані в (Ebinuma et al. (2000) Proc Natl Acad Sci USA 94:2117-2121; Ebinuma et al. (2000) Selection of Marker-free transgenic plants using the oncogenes (ipt, rol A, B, C) of Agrobacterium as selectable markers, In Molecular Biology of Woody Plants. Kluwer Academic Publishers). Наступні позитивні селективні маркери, які надають трансформованим рослинам перевагу в рості порівняно із нетрансформованими, описані, наприклад, в, ЕР-А 0 601 092. Ростостимулюючі селективні маркери можуть включати (але не бути обмеженими до) сглюкоуронідазу (в комбінації з наприклад, цитокінін глюкоуронідом), маноза-6-фосфат ізомеразу (в комбінації з манозою), УДФ-галактоза-4-епімеразу (в комбінації з наприклад, галактозою), де маноза6-фосфат ізомераза в комбінації з манозою є переважною. 1.3 Контр-селективний маркер Контр-селективні маркери особливо придатні для селектування організмів із певними видаленими послідовностями, які містять зазначений маркер (Koprek et al. (1999) Plant J 19: 719-726). Приклади негативних селективних маркерів включають тимідин-кіназу (ТК), цитозин-деаміназу (Gleave et al. (1999) Plant МоI Biol. 40(2):223-35; Perera et al. (1993) Plant Моl. Biol 23: 793-799; Stougaard (1993) Plant J 3:755-761), протеїни цитохрому Р450 (Koprek et al. (1999) Plant J 19: 719726), галоалкан-дегідрогеназу (Naested (1999) Plant J 18:571-576), генні продукти iaaH (Sundaresan et al. 1995), цитозин-деаміназу codA (Schlaman and Hooykaas (1997) Plant J 11:13771385), або генні продукти tms2 (Fedoroff and Smith (1993) Plant J 3:273-289). 2. Репортерні гени Також, термін селективний маркерний ген може включати інші гени які дозволяють ідентифікувати та/або селектувати трансформовані клітини 90860 38 або організми, такі як репортерні гени, які дозволяють проводити візуальний скринінг та ідентифікацію таких трансформованих клітин (без застосування цитотоксичних речовин). Деякі зі згаданих репортерних генів можуть додатково потребувати субстрату для ідентифікування (такий як ген GUS), тоді як інші функціонують без субстратів(такий як GFP). Репортерні гени кодують протеїни які можуть бути підраховані та, завдяки їхньому кольору та ферментативній активності роблять можливою визначення ефективності трансформації, сайт експресії або час експресії. Особливо переважними в цьому контексті є гени, які кодують репортерні протеїни (Schenborn, Groskreutz (1999) МоI Biotechnol 13(1):29-44) такий як зелений флуоресцентний протеїн (GFP) (Sheen et al.(1995) Plant J 8(5):777-784; Haseloff et al.(1997) Proc Natl Acad Sci USA 94(6):2122-2127; Reichel et al.(1996) Proc Natl Acad Sci USA 93(12):5888-5893; Tian et al. (1997) Plant Cell Rep 16:267-271; WO 97/41228; Chui et al. (1996) Curr Biol 6:325-330; Leffel et al. (1997) Biotechniques 23(5):912-8), протеїни коралових рифів (Wenck et al. (2003) Plant Cell Reporter 22: 241-251), хлорамфенікол-трансферази, люциферази (Ow et al. (1986) Science 234:856-859; Millar et al. (1992) Plant МоI Biol Rep 10:324-414), ген екворіну (Prasher et al. (1985) Biochem Biophys Res Commun 126(3): 1259-1268)), -галактозидази, ген локусу R (який кодує протеїн , що регулює продукування антоцианінових пігментів (червоного забарвлення) в рослинних тканинах, й таким чином робить можливим безпосередній аналіз промоторної активності без додавання додаткових речовин або хромогенних субстратів (Dellaporta et al. (1988) In: Chromosome Structure and Function: Impact of New Concepts, 18th Stadler Genetics Symposium, 11:263-282; Ludwig et al. (1990) Science 247:449), причому особливо переважною є -глюкоуронідаза (GUS) (Jefferson (1987b) Plant Моl. Bio. Rep., 5:387405; Jefferson et al. (1987a) EMBO J 6:3901-3907). Експресія В-глукоуронідази (GUS) визначається за синім кольором при інкубуванні тканини із 5-бром4-хлор-3-індоліл---D-глюкоуронової кислоти, експресія бактеріальної люциферази (LUX) визначається за світінням; експресія світлякової люциферази (LUC) визначається за світінням після інкубування з люциферином; та експресія галактозидази визначається за яскраво синім кольором після обробки тканини 5-бром-4-хлор-3-індоліл-оD-галактопіранозидом. Репортерні гени також можуть використовуватися як рахункові маркери замість маркерів резистентності до антибіотиків. Такі маркери використовуються для визначення присутності або визначення рівня експресії перенесеного гену. Використання рахункових маркерів в рослинах для визначення або позначення модифікованих клітин добре працює коли ефективність модифікування є високою. 3. Місце початку реплікації, яке забезпечує ампліфікацію експресійних касет або векторів згідно даного винаходу, наприклад, в Е. соlі. Прикладами таких можуть бути ORI (початок реплікації ДНК), pBR322 ori або Р15А ori (Maniatis 1989). Також прикладами точок початку реплікації функціо 39 нальних в Е. соlі, є СоІЕ1, pSC101, pACYC184, або подібні. Додатково або замість реплікаційної системи Е. соlі, може бути використаний широкий спектр реплікаційних систем, таких як реплікаційні системи несумісності плазмід Р-1; такі як, pRK290. Ці плазміди, особливо ефективні з активними або знешкодженими Ті-плазмідами для переносу ТДНК в рослинного хазяїна. 4. Елементи необхідні для трансформації опосередковано Agrobacterium, такі як наприклад, права та/або, можливо, ліва межа Т-ДНК virрегіону. У світлі даного винаходу, всі композиції та способи розкриті та заявлені тут, можуть бути виготовлені та виконані без додаткових експериментів. Оскільки склади та способи даного винаходу описані у вигляді переважних реалізацій, для фахівця в даній галузі є зрозумілими, варіації які можна зробити в композиціях, способах та в етапах або послідовності етапів описаного тут способу не виходячи за рамки або замисел даного винаходу. Докладніше, має бути зрозуміло, що певні чинники, які є як хімічні так і фізіологічними можуть бути замінені описаними тут чинниками, тоді як будуть досягнуті ті самі або подібні результати. Усі подібні заміни й модифікації будуть зрозумілі, для досвідченої в даній галузі особи, після вивчення змісту заявки та виконань винаходу розкритих тут та визначених у формулі. Усі публікації та патентні заявки згадані в даному описі вказують на рівень навичок спеціаліста в даній галузі до якої належить цей винахід. Усі публікації та патентні заявки включені сюди через посилання на весь їхній об'єм, оскільки кожна окрема публікація або патентна заявка була окремо зазначена для включення через посилання. Послідовності SEQ ID NO: 1: Нуклеотидна послідовність, яка кодує вектор pBPSEW008 [LBpNOS-bar-NOSt-::pPcUBI-guslNT-NOStRB] SEQ ID NO: 2: Нуклеотидна послідовність, яка кодує вектор pBPSMM192b [LB-pSuper-guslNT-NOSt::AtAhast-AtAhaspAtAhas-RB] SEQ ID NO: 3: Нуклеотидна послідовність, яка кодує вектор pBPSLM003 [LB-OCSt-bar-pMAS::pSuper-guslNT-NOSt-RB] Фіг.1: Схема рослини сої на стадії V2. Показано розташування сім'ядолей, однолопатевого листа, та розташованих вище трилопатевих листків. Пазушні бруньки, які знаходяться в сполученні сім'ядолі та епікотиля й кожний черешок та епікотиль. Фіг.2: Зріла соя культивару Jack приблизно на 7 день розвитку. Фіг.3: Спосіб трансформації сої за допомогою експлантів розмноженої пазушної меристеми; препарування експлантів. Семиденні проростки використані для створення розмножених експлантів шляхом видалення кореня та частини сім'ядолі й поміщенням на ростове середовище з додаванням 5мкМ БАП (А). Експланти були отримані з нових саджанців, які розвинулися зі звичайних проростків сої (В). Після 2-3 тижнів на ростовому середовищі 90860 40 (С), експланти пазушної меристеми були одержані з саджанців відрізанням 0.5-1.0см нижче від пазушного вузла на міжвузлі (D), й кінчик на якому знаходилася пазушна меристема було відрізано скальпелем для індукування росту пагонів de novo та забезпечення доступу до цільових клітин бактеріям Agrobacterium (E). Фіг.4: Спосіб трансформації сої за допомогою експлантів розмноженої пазушної меристеми; регенерація пагонів. Після 3-денного сумісного культивування, експланти були поміщені на середовище, що індукує пагони терміном 35 днів протягом якого формувалися великі фрагменти калусу/пагонів (А, В). GUS позитивні пагони спостерігалися після 4 тижнів на середовищі, що індукує пагони (С). Експланти з багатьма пагонами були перенесені на середовище для видовження пагонів, де вони залишалися, в середньому 57 - 65 днів. Видовжені пагони з цих експлантів (D) були видалені й перенесені на вкорінювальне середовище терміном 1-2 тижні для розвитку коріння, й загартовують в камері протягом 2-3 тижнів перед перенесенням до оранжереї (Е). Фіг.5: Метод оснований на пазушній меристемі саджанців. Семиденні проростки (Фіг.5-1) були отримані для трансформації, шляхом видалення однієї сім'ядолі, коренів (необов'язково), епікотиля вище другого вузла (вузол однолопатевого листка), та трилопатевих листків. Ці експланти сумісно культивувалися з Agrobacterium протягом 5 днів після перенесення на середовище, що індукує пагони. Приклад експланту отриманого на 1 тиждень на середовищі, що індукує пагони показано на (Фіг.5-2). Фіг.6: Транзиторна експресія на експлантах пазушної меристемної тканини після сумісного культивування з Agrobacterium tumefaciens та твердому середовищі для сумісного культивування з додаванням тіолових сполук. Фіг.7: Пагоноутворення de novo на первинному вузлі на експлантах сіянців після 2 тижнів на середовищі, що індукує пагони показано зверху. GUSпозитивні зачатки пагонів, які розвилися на сіянцевих експлантах показано на знизу. Через 4 тижні перебування на середовищі, що індукує утворення пагонів, експланти були перенесені на середовище для видовження пагонів, де пагони видовжувалися протягом 4 тижнів після переносу (показано зліва внизу). Фіг.8: Препарування експлантів листової пазушної меристеми. Сім'ядольна та епікотильна тканина була видалена з гіпокотиля на 2-4мм нижче сім'ядольного вузла (1). Для доступу до листового експланту, було видалено одну сім'ядолю (2) й потім епікотиль відрізають вище сім'ядольного вузла (3). Епікотиль розрізають надвоє для одержання двох симетричних листкових експлантів (4). Для індукування de novo пагоноутворення з пазушних меристемних клітин, усі сформовані пагони обережно видалялися на кінці черешка (5) й регіон між прилисниками, де знаходяться пазушні меристемні клітини, було розрізано гострим скальпелем 3-5 разів (6). Фіг.9: Пагоноутворення de novo відбувалося на основі черешку на експлантах пазушної листкової 41 меристеми через 2 тижні після індукування пагонів, як показано вгорі. Через 3-4 тижні, експланти були перенесені на середовище для видовження пагонів, де значне видовження пагонів спостерігалося лише 18-35 днів (внизу). Фіг.10: Транзиторна GUS-експресія на насіннєвих експлантах пазушної меристеми після 5денного сумісного культивування з Agrobacterium. Фіг.11: Стабільна GUS-експресія на насіннєвих експлантах пазушної меристеми після 4 тижнів на середовищі, що індукує пагони. Новоутворені пагонові зачатки та більші пагони показано GUSпозитивними секторами. Фіг.12: Вплив різних концентрацій кінетину та БАП в середовищі, що індукує пагони, на довжину найдовшого кореня від кожного експланту (А) та кількість пагонів, що видовжилися від кожного експланту (В) на листкових експлантах, які культивувалися протягом 18 днів на середовищі для видовження пагонів. Фіг.13: Вплив різних концентрацій кінетину та БАП в середовищі, що індукує пагони, на довжину найдовшого кореня від кожного експланту та кількість пагонів, що видовжилися від кожного експланту на листкових експлантах, які культивувалися протягом 36 днів на середовищі для видовження пагонів. Фіг.14: Відсоток листкових експлантів в двох повтореннях через 2 тижні на SIM які розвинули калус після інокулювання штамом A. tumefaciens AGL1/pBPSEW008 та різних умов сумісного культивування. (0=0мг/л L-цистеїн; 100=100мг/л Lцистеїн (0.825мМ); 400=400мг/л L-цистеїн (3.3мМ); 1000=1000мг/л L-цистеїн (8.25мМ); NDC=1мМ тіосульфат натрію, 1мМ DTT, 1000мг/л L-цистеїн (8.25мМ)) Фіг.15: Діаграма експлантів розмноженої пазушної меристеми та відповідь на БАП в ПР та ростовому середовищі. Процент експлантів, з яких були отримано видовжені пагони через 4 тижні перебування на середовищі для видовження в яке було додано різні концентрації БАП підчас пророщування та розмноження. Фіг.16: Оцінювання інфекційної здатності трьох різних штамів A. tumefaciens для інфікування експланти РАМ культивару Jack та L00106CN. Кількість експлантів із вогнищами GUS+ на цільовій тканині були підраховані через 10 днів після інфікування. Фіг.17: Спосіб трансформації сої за допомогою експлантів розмноженої пазушної меристеми. Семиденні проростки (А) використані для створення розмножених експлантів шляхом видалення кореня та частини сім'ядолі й поміщенням на ростове середовище з додаванням 5мкМ БАП.Після 2-3 тижнів (В), експланти пазушної меристеми були одержані з саджанців відрізанням листя та поміщенням на обробкою вузлової зони (С), сумісним культивуванням із Agrobacterium протягом 3 днів, й наступним поміщенням на індукційне середовище на 35 днів (D). Експланти з багатьма пагонами (Е, F) були перенесені на середовище для видовження пагонів, де вони залишалися, в середньому 5765 днів. Видовжені пагони з цих експлантів (G) були видалені й перенесені на вкорінювальне се 90860 42 редовище терміном від одного до двох тижнів для розвитку коріння (Н), й загартовані в камері протягом 2-3 тижнів перед перенесенням до оранжереї (І). Приклади Якщо не зазначено інше, усі реактиви одержані від Mallinckrodt Baker, Inc. (Phillipsburg, NJ, USA), Phytotechnology Laboratories (Shawnee Mission, KS, USA), EMD Chemicals, Inc. (Gibbstown, NJ, USA) and Sigma (St. Louis, MO, USA). А. Розчини застосовані в середовищах: 1. В5 макросолі a. 0,25Μ ΚΝΟ3 (нітрат калію) b. 0,01Μ СаСІ2*2Н2О (хлорид кальцію) с. 0,01Μ MgSO4*7H2O (сульфат магнію) d. 0,01Μ (NH4)2SO4 (сульфат амонію) e. 0,01Μ NaH2PO4*H2O (фосфат натрію) 2. B5 мікросолі a. 5мМ Н3ВО3 (борна кислота) b. 10мМ MnSO4*H2O (сульфат магнію) c. 0,7мМ ZnSO4*7H2O (сульфат цинку) d. 0,45мМ KI (йодид калію) e. 0,1мМ Na2MoO4*2H2O (молібденова кислота) f. 0,01мМ CuSO4*5H2O (сульфат міді) g. 0,01мМ СоСІ2*6Н2О (хлорид кобальту) 3. В5 вітаміни a. 0,055Μ міо-інозитол b. 0,8мМ нікотинова кислота с. 0,5мМ піридоксин-НСІ d. 3мМ тіамін-НСІ 4. MS макросолі a. 0,2Μ ΝΗ4ΝΟ3 (нітрат амонію) b. 0,2Μ ΚΝΟ3 (нітрат калію) с. 30мМ СаСІ2*2Н2О (хлорид кальцію) d. 15мМ MgSO4*7H2O (сульфат магнію) e. 12,5мМ KН2РО4 (фосфат калію) 5. MS мікросолі a. 10мМ Н3ВО3 (борна кислота) b. 13мМ MnSO4*H2O (сульфат магнію) с. 3мМ ZnSO4*7H2O (сульфат цинку) d. 0,5мМ KІ (йодид калію) e. 0,1мМ Na2MoO4*2H2O (молібденова кислота) f. 0,01мМ CuSO4*5H2O (сульфат міді) g. 0,01мМ СоСІ2*6Н2О (хлорид кобальту) 6. MSIII залізо a. 10мМ FeSO4*7H2O (сульфат заліза) b. 10мМ C10H14O8Na2N2*2H2O (NaEDTA) В. Склад середовищ Якщо не зазначено інше наступні середовища можуть бути використані для всіх переважних тканинних експлантів для методу даного винаходу. Три способи позначені наступним чином: a) Спосіб А: Пазушна меристема проростків використані цілі проростки. b) Метод В: Пазушна меристема листків: Первинний або вищі листки видалено, таким чином, що пазушна меристематична тканина залишається при листкових черешках. c) Спосіб С: Розмножена меристема проростків (детальніше дивись вище та нижче) 1. Пророщувальне середовище GM (тверде) в 25100мм чашках Петрі або культуральних боксах PlantconTM (Sigma): 43 a. 1Х В5 макросолі, b. 1Х В5 мікросолі, c. 1Х MSIII залізо, d. 2% Сахароза, e. 1Х В5 вітаміни, f. 5мМ БАП (необов'язково), g. 0.8% Очищений Агар (Sigma); h. pH 5.8. 2. Середовище YEP (тверде та рідке) у колбах Erlenmeyer або 15100мм чашках Петрі: a. 10г/л бакто-пептону (Difco; Becton Dickinson & Co., Cockeysville, MD, USA), b. 5г/л дріжджового екстракту (Difco), c. 5г/л NaCI, d. Антибіотики, придатні для селектування, e. 1.2% Гранульований агар (Difco) лише твердий; f. pH7.0. 3. Ростове середовище MODPROP (тверде) в 25100мм чашках Петрі: (СПОСІБ С) a. 1Х MS макросолі, b. 1X MS мікросолі, c. 1Х MSIII залізо, d. 1Х В5 вітаміни, e. 3% сахароза, f. 0.22-1.12мг/л (1мкМ-5мкМ) БАП (переважно приблизно 1мкМ) д. 0.8% очищений агар (Sigma); g. pH5.8 4. Середовище для сумісного культивування ССМ (рідке): a. 1/10 X В5 макросолі, b. 1/10 X В5 мікросолі, с. 1/10 XMSIII залізо, d. 1Χ Β5 вітаміни, e. 3% сахароза, f. 20мМ 2-[М-морфоліно]етансульфонова кислота (МЕС, MES; MW=213.26г/Моль), g. 200мкМ ацетосирінгон (AS), h. 0.72мкМ-1.44мкМ GA3 (гіберелінова кислота; Mw=346.38г/Моль) і. ВАР, БАП (6-бензиламінопурин; MW=225.25г/Моль): 7.5мкМ. j. СПОСІБ С (виключно): 400мг/л L-цистеїн (3.3мМ) (Sigma) k. pH5.4. 5. Середовище для сумісного культивування ССМ (тверде) в 15100мм чашках Петрі: a. 1/10Χ Β5 макросолі, b. 1X 10 В5 мікросолі, c. 1/10Х MSIII залізо, d. 1Х В5 вітаміни, e. 3% сахароза, f. 20мМ 2-[N-морфоліно]етансульфонова кислота (MES) g. 200мкМ ацетосирінгон AS, h. 0.72мкМ -1.44мкМ GA3 (гіберелінова кислота; Mw=346.38г/Моль) і. ВАР, БАП (6-бензиламінопурин; MW=225.25г/Моль): 7.5мкМ. j. Тіолові сполуки, (і). 100-1000г/л L-цистеїн (MW=121.16г/Mol; Sigma); переважно: спосіб В та С: 400мг/л Lцистеїн (3.3мМ); спосіб А: 1г/л (8.25мМ) L-цистеїн (іі). 0-1мМ або 154.2мг/л DTT (Fisher Scientific, Fair Lawn, NJ, USA), 90860 44 (iii). 0-1мМ безводного тіосульфату натрію (158.1мг/л) або п'ятиводного тіосульфату натрію 245мг/л (Mallinckrodt, Paris, KY, USA), спосіб А: 1мМ дитіотриетолу, 1мМ тіосульфату натрію k. 0.5% очищений агар; І. рН5.4. 6. Середовище для промивання Modwash (рідке): (СПОСІБ С) a. 1Х В5 макросолі, b. 1Х В5 мікросолі, c. 1Х MSIII залізо, d. 3% сахароза, e. 1Х В5 вітаміни, f. 30мМ MES, g. 350мг/л тиментин3 h. pH5.6 6. Середовище, яке індукує пагони SIM (рідке):(СПОСІБ А та В) a. 1Х В5 макросолі, b. 1Х В5 мікросолі, c. 1Х MSI 11 залізо, d. 1Х В5 вітаміни, e. 3% сахароза, f. 3мМ MES, g. 2.5мкМ БАП (СПОСІБ В), 1мкМ-7.5мкМ (переважно 1мкМ) БАП (СПОСІБ А) h. 5мМ кінетину (лише СПОСІБ В) і. 250мг/л тиментин j. 0.8% очищений агар; k. рН5.6. 5. Середовище, яке індукує пагони SIM (тверде) в 20100мм чашках Петрі: a. 1Х В5 макросолі, b. 1Х В5 мікросолі, c. 1Х MSIII залізо, d. 1Х В5 вітаміни, e. 3% сахароза, f. 3мМ MES, g. 1мкМ-7.5мкМ (переважно приблизно 1мкМ) БАП (СПОСІБ А); 2.5мкМ БАП (СПОСІБ В), 5.0мкМ БАП (СПОСІБ С) h. 5мкМ кінетину (лише СПОСІБ А та В) і. 250мг/л тиментин j. Селективні сполуки, якщо потрібно, k. 0.8% очищений агар; І. рН5.6. 7. Середовище, яке індукує пагони SEM (тверде) в 20100мм чашках Петрі: a. 1Х MS макросолі, b. 1X MS мікросолі, c. 1Х MSIII залізо, d. 1Х В5 вітаміни, e. 3% сахароза, f. 3мМ MES, g. 50г/л L-аспарагін (0.378мМ), h. 100мг/л L-піроглутамінова кислота (0.775мМ), і. 0.1мг/л ІУК(ІАА) (0.57мкМ), j. 0.5мг/л GA3 (1.44мкМ), k. 1мг/л транс-зеатинрибозид (2.85мкМ), I. 250мг/л тиментин m. Селективні сполуки, якщо потрібно, n. 0.8% очищений агар; о. рН5.6. 45 7. Середовище для укорінення RM (тверде) в 25100мм PYREX культуральних пробірках (Corning Inc., New York, NY, USA): a. ½X B5 макросолі, b. ½X B5 мікросолі, c. 1X MSIII залізо, d. 2% сахароза, e.3мМ MES, f. 1 (5мкМ) індолоцтова кислота (ІВА, Mw=203.24г/Моль) (СПОСІБ А та В), 5мкМ12.5мкМ (переважно, приблизно 5мкМ) ІВА (СПОСІБ С) g. 0.8% очищений агар; СПОСІБ С (виключно): 250мг/л тиментин h. рН5.6. Приклад 1: Стерилізація та дозрівання насіння сої Принципово, будь-яке насіння будь-якого різновиду сої може бути використане у методі даного винаходу. Для трансформації сої є придатним різновиди культивару сої (включаючи Jack, Williams 82, та Resnik). Насіння сої стерилізується в камері із хлором, одержаним додаванням 3.5мл 12Н НСІ краплями у 100мл відбілювача (5.25% гіпохлориту натрію) у ексикаторі з щільною кришкою. Після 2448 годин в камері, насіння виймали і близько 18-20 насінин клали на тверде середовище GM з або без 5мкМ 6-бензиламінопурину (БАП) в 25100мм чашках Петрі. Сіянці без БАП були більш видовженими й розвинули корені, особливо вторинним та бічним коренеутворенням. БАП підсилив сіянці роблячи їх коротшими та приземистими. Семиденні проростки вирощені на світлі (>100мкМ/m2s) при 25°С були використані для експлантації матеріалу трьох типів експлантів (Фіг 2). На цей момент насіннєва оболонка розколювалася й епікотиль та однолопатеві листки виростали як мінімум на довжину сім'ядолі. Щоб позбутися тканини сім'ядольного вузла епікотиль має бути принаймні 0.5см (оскільки культивари сої та різне насіння може різнитися за часом розвитку, опис стадій розвитку є більш точний ніж певний час дозрівання). Для методу С, гіпокотиль та одну з половиною або частину обох сім'ядолей видалено з кожного сіянцю. Потім сіянці були поміщені на розмножувальне середовище на 2-4 тижні. Проростки давали декілька розгалужених пагонів, з яких можна було отримати експланти (Фіг.3А). Більшість експлантів походять з сіянців, які виросли з апікальної бруньки. Ці експланти, переважно використовуються в якості тканини-мішені. Сіянці були вже готові для трансформації для інокулювання цілих сіянців (Спосіб А) або листкових експлантів (Спосіб В) (Фіг.5 та 8). Приклад 2: Вирощування та препарування культури Agrobacterium Культури Agrobacterium були приготовані штриховим розмноженням Agrobacterium (наприклад, A. tumefaciens або A. rhizogenes) введенням потрібного бінарного вектора на тверде ростове середовище YEP при 25°С до появи колоній (приблизно 2 дні). Залежно від селективного маркерного гену присутнього в плазміді Ті або Ri, бінарного вектора, та бактеріальних хромосом, використову 90860 46 валися різні селектуючі сполуки для селектування А. tumefaciens та rhizogenes на твердому та рідкому середовищах YEP. Для способу трансформації могли бути застосовані різні штами Agrobacterium (дивись вище та далі Приклад 7). Приблизно через два дні окрему колонію (стерильною тріскою) знімали й інокулювали 50мл рідкого середовища YEP з антибіотиками та струшували при 175об./хв. (25°С) доки не було досягнена OD600 між 0.8-1.0 (приблизно 2д). Готували робочі гліцерольні розчини (15%) для трансформації й по одномумл розчину Agrobacterium поміщували в 1.5мл пробірки Eppendorf й розміщували для зберігання при -80°С. За день до інокуляції експланту 200мл YEP було інокульовано від 5мкл до 3мл робочого розчину Agrobacterium в 500мл колбах Erlenmeyer. Колби струшувалися протягом ночі при 25°С доки OD600 досягла 0.8-1.0. Перед приготуванням експлантів сої Agrobacteria були ущільнені центрифугуванням протягом 10хв. при 5,500хg при 20°С. Осад ресуспендували в рідкому ССМ до потрібної щільності (OD600 0.5-0.8) й перед застосуванням залишали при кімнатній температурі принаймні на 30хв. Приклад 3: Препарування експлантів та сумісне культивування (інокуляція) 3.1 Спосіб А: Препарування експлантів у день трансформації. Сіянці до цього часу мали видовжені епікотилі, принаймні 0.5см але в середньому від 0.5 до 2см. Успішно були використані епікотилі видовжені до 4см. Експланти були препаровані наступним чином: і) з або без будь-яких коренів, іі) з частиною, одним або обома сім'ядолями, усі сформовані листки були видалені, включаючи апікальну меристему, та вузли розташовані з першими листками були посічені декількома надрізами гострим скальпелем (дивись Фіг.5). Ці надрізи на вузлі не лише індукували інфікування Agrobacterium але також розповсюджували клітини пазушної меристеми та руйнували сформовані пагони. Після ушкодження та препарування, вони були поміщені в чашки Петрі й потім сумісно культивувалися в рідкому середовищі ССМ/Agrobacterium протягом 30 хвилин. Потім експланти видаляли з рідкого середовища й клали на стерильний фільтрувальний папір у 15100мм чашки Петрі з твердим середовищем для сумісного культивування. Ушкоджені цільові тканини були поміщені таким чином, що вони були в прямому контакті з середовищем. 3.2 Модифікований Спосіб А: Препарування епікотильних експлантів Соєві епікотильні сегменти були препаровані з 4-8 денних сіянців і використані як експланти для регенерування та трансформації. Насіння культиварів сої L00106CN, 93-41131 та Jack вирощували на 1/10 MS або подібному композиційному середовищі з або без цитокінінів протягом 4-8 днів. Епікотильні експланти були отримані видаленням сім'ядольного вузла та стеблового вузла зі стеблового фрагменту. Епікотиль був розрізаний на 2-5 сегментів. Особливо бажано, щоб сегменти із пер 47 винним та вищими вузлами містили пазушну меристемну тканину. Експланти були використані для інфікування Agrobacterium. Agrobacterium AGL1 який несе плазміду із маркерним геном GUS та селективними маркерними генами AHAS, bar або dsdA протягом ночі культивувалися в середовищі LB із відповідними антибіотиками, збиралися та були ресуспендовані в інокуляційному середовищі з ацетосирінгоном. Щойно відпрепаровані епікотильні сегменти протягом 30-60хв. просякували суспензією Agrobacterium після чого експланти просушували на фільтрувальному папері. Інокульовані експланти далі протягом 2-4 днів культивувалися на середовищі для сумісного культивування з L-цистеїном та TTD та іншими сполуками, такими як ацетосирінгон, для посилення проникнення Т-ДНК. Інфіковані епікотильні експланти потім були поміщені на середовище, яке індукує пагони із селектуючими агентами, такими як імазапір (для гену AHAS), глюфозинат (для гену bar), або D-серин (для гену dsdA). Регенеровані пагони були субкультивовані на елонгаційному середовищі з селектуючим агентом. Для регенерації трансгенних рослин сегменти культивували на середовищі з цитокінінами такими як БАП, TDZ та/або кінетином для індукування пагонів. Після 4-8 тижнів культивовані тканини були перенесені на середовище зі зниженою концентрацією цитокініну для видовження пагонів. Видовжені пагони були перенесені на середовище з ауксинами для вкорінення та розвитку рослин. Були регенеровано багато пагонів. Отримано багато стабільно трансформованих фрагментів, які проявляли експресію GUS. Рослини сої були регенеровані з епікотильних експлантів. Показано ефективне введення Т-ДНК та стабільно трансформовані фрагменти. 3.3 Спосіб В: Листкові експланти Препарування листкових експлантів показано на Фіг.8. Спочатку, сім'ядолю відокремлювали від гіпокотиля. Сім'ядолі були відокремлені одна від іншої та було видалено епікотиль. Первинні листки, які складалися з пластинки, черешка та прилисника були відокремлені від епікотиля обережним відрізанням в основі приписників, так щоб пазушні меристеми залишилися з експлантом. Для травмування експланту а також стимулювання формування пагонів de novo, були відокремлені сформовані пагони й зона між приписниками була надрізана гострим скальпелем 3-5 разів. Безпосередньо після препарування експланти повністю вкривали або занурювали травмовані кінчики черешків в суспензію Agrobacterium. Після інокулювання, експланти клали на стерильний фільтрувальний папір для видалення надлишку культури Agrobacterium покладенням експлантів травмованою стороною в контакт із 7см папером Whatman, який вкривав тверде середовище ССМ (дивись вище). Цей фільтрувальний папір попереджував розростання A. tumefaciens на експлантах сої. П'ять пластинок були вкриті Parafilm "Μ" (American National Can, Chicago, Illinois, USA) й інкубувалися протягом 3-5 днів в темряві або на світлі при 25°С. 90860 48 3.4 Спосіб С: Розмножена пазушна меристема Препарування експлантів розмноженої пазушної меристеми показано на Фіг.3 (В-Е). За допомогою розмножених 3-4 тижневих проростків, експланти пазушної меристеми були препаровані з першого по четвертий вузли. В середньому з кожного сіянцю можуть бути отримані від трьох до чотирьох експлантів. Експланти були одержані з саджанців відрізанням 0.5-1.0см нижче від пазушного вузла на міжвузлі та відокремленням черешка та листка від експланту. Кінчик на якому знаходилася пазушна меристема було відрізано скальпелем для індукування росту пагонів de novo та забезпечення доступу до цільових клітин бактеріям Agrobacterium (Ε). Отже, 0,5см експланти включали стебло та бруньку. Одразу після відсікання, експланти поміщувалися в суспензію Agrobacterium на 20-30 хвилин. Після інокулювання, експланти були покладені на стерильний фільтрувальний папір для видалення надлишку культури Agrobacterium та покладення експлантів травмованою стороною в контакт із 7см папером Whatman, який вкривав тверде середовище ССМ (дивись вище), залежно від штаму Agrobacterium. Цей фільтрувальний папір попереджував розростання Agrobacterium на експлантах сої. Пластинки були вкриті Parafilm "Μ" (American National Can, Chicago, Illinois, USA) й інкубувалися протягом 2-3 дні в темряві або на світлі при 25°С. Приклад 4: Індукування пагонів Після 3-5 днів сумісного культивування в темряві при 25°С, експланти були прополоскані в рідкому середовищі SIM (для видалення надлишку Agrobacterium) або середовищі Modwash (Спосіб С) та нанесені на стерильний сухий фільтрувальний папір (для попередження ушкоджень, перш за все пластинки) перед поміщенням не тверде середовище SIM. Приблизно 5 експлантів (Спосіб А) або 10-20 (Способи В та С) експлантів були поміщені таким чином, щоб цільові тканини були в прямому контакті з середовищем. Протягом перших 2 тижнів, експланти були культивовані з або без селективного середовища. Переважно експланти були перенесені на SIM без селектування на 1 тиждень. У випадку листових експлантів (Спосіб В), експланти мали поміщуватися в середовище так, щоб бути перпендикулярно до поверхні середовища, з черешками зануреними в середовище й пластинкою поза середовищем. У випадку розмноженої пазушної меристеми (Спосіб С), експланти поміщувалися в середовище так, щоб бути паралельно до поверхні середовища (базипетально), з експлантами частково зануреними в середовище. Пластинки були вкриті Scotch 394 вентильованою стрічкою (3М, St. Paul, Minnesota, USA) й поміщені у ростову камеру терміном до двох тижнів при середній температурі 25°С із періодом 18г світла/6г темряви при 70-100μE/m2s. Для цих експлантів були перевірені різні інтенсивності світла та довжини хвилі, режими селектування, та SIM (Приклад 9). Експланти були залишені на середовищі SIM з або без селекгування до утворення пагонів de 49 novo в цільовій області (наприклад, у пазушних меристемах на першому вузлі вище епікотиля). В цей час може проводитися перенесення на свіже середовище. Експланти були перенесені з SIM з або без селектування на SIM з селектуванням після майже 1 тижня. У цей час було відмічено значне de novo пагоноутворення на черешках листкових експлантів на різних SIM (Спосіб В; Фіг.9), на первинному вузлі проросткових експлантів (Спосіб А; Фіг.7), та на пазушних вузлах розмножених експлантів (Спосіб С; Фіг.4). Переважно, усі пагони сформовані до трансформації будуть видалені через приблизно 2 тижні після сумісного культивування для стимулювання нового росту з меристем. Це допомагає зменшити химеризм в первинних трансформантах та збільшити ампліфікацію трансгенних меристемних клітин. У цей час експланти можуть бути, а можуть й ні, розрізані на дрібніші фрагменти (тобто, відділені вузли від експлантів відсіканням епікотиля). Приклад 5: Видовження пагонів Після 2-4 тижнів (або доки не сформується маса пагонів) на середовищі SIM (переважно із селектуванням), експланти будуть перенесені на середовище для видовження пагонів (SEM), яке буде стимулювати видовження пагонів (з зачатків пагонів). Середовище може містити або ні, селектуючі речовини. Частота та довжина пагонів, що видовжуються залежить від рівня гормонів, зокрема БАП в SIM (Приклад 9). Переважно, через кожні 2-3 тижні експланти переносяться на свіже середовище SEM (бажано із селективною сполукою) після обережного видалення мертвої тканини. Експланти повинні утримуватися разом, не бути фрагментованими й мати здоровий вигляд. Експланти продовжуватимуть переносити доки експланти не загинуть або пагони не видовжаться. Видовжені пагони >3см видаляються й поміщаються на вкорінювальне середовище (RM) на термін приблизно 1 тиждень (Спосіб В), або приблизно 2-4 тижні, залежно від культивару (Спосіб С), й протягом цього часу починають формуватися корені. У випадку експлантів з коренями, їх переносять безпосередньо в ґрунт. Вкорінені пагони переносять на ґрунт й загартовують в камері протягом 2-3 тижнів перед перенесенням до оранжереї. Регенеровані рослини, отримані за допомогою цього методу є фертильними й продукують приблизно 500 насінин з рослини. Транзиторна експресія GUS через 5 днів сумісного культивування Agrobacterium tumefaciens поширюється на експлантах пазушної меристемної тканини в місцях ушкоджень при препарування експлантів (Спосіб А, Фіг.6, 10). Експланти були поміщені на середовище для індукування пагонів без селектування для визначення відповіді первинних вузлів на індукування пагонів та регенерацію. Таким чином, більш ніж 70% експлантів утворили нові пагони в цій зоні (Фіг.7). Експресія гену GUS була стабільною після 14 днів на SIM, вказуючи на інтеграцію Т-ДНК в геном сої. Також, попередні експерименти призвели до утворення GUSпозитивного пагоноутворення після 3 тижнів на SIM (Фіг.7). 90860 50 У способі С, середній час регенерації рослини за допомогою протоколу розмноженої пазушної меристеми становить 14 тижнів від інокуляції експланту. Отже, цей метод має короткий час регенерації до фертильної, здорової рослини сої. Приклад 6: Скринінг генотипів на пагоноутворення на листкових експлантах Насіння та експланти були препаровані як описано вище. Усі з 17 експлантів (9 з Soygenetics та 8 з Dairyland) були проскринінговані на пагоноутворення та регенерацію через 2 тижні на SIM яке містило 5мкМ кінетину та 2.5мкМ БАП.Через 8 днів на GM, були препаровані 20 листкових експлантів 6 різних культиварів. Екеспланти були одразу поміщені на середовище SIM по 10 експлантів на платівку. Експерименти повторювалися тричі. На експлантах визначали через 3 тижні відсоток експлантів які утворили калусну/пагоневу масу. Усі культивари індукували калус/пагони з високою частотою. Діапазон становив від 85% до 100% з усіх експлантів які утворювали калус через 3 тижні. Культивари мали середню частоту регенерації більшу за 95. Це вказує та те, що регенерація калусу/пагонів на черешках листкових експлантів високій мірі незалежна від культивару сої використаного в експерименті. Усі культивари розвинули калус/пагони у більш ніж 85% препарованих експлантів, деякі культивари розвинули калус/пагони в усіх культиварах усіх повторень. Приклад 7: Оцінювання інфекційної здатності A. tumefaciens та A. rhizogenes на листкових експлантах Сприйняття сої до інфекції Agrobacterium є одним з основних етапів у створенні надійної системи трансформації сої. Генотип, стадія розвитку, гормональний баланс та оточуючі умови на час взяття та препарування експлантів разом виплавають на здатність Agrobacterium інфікувати певні тканини сої. Штам A. tumefaciens AGL1 було використано для успішної трансформації у клітини пазушної меристеми в сім'ядольному вузлі (Olhoft & Somers (2001) Plants Cell Reports 20:706-711). Штам A. rhizogenes K599 є дуже ефективним для індукування формування волосових корінців й було показано, що від 54 до 95% інфікованих сім'ядолей з різних культиварів утворювали волоскові корені (Cho et al. (2000) Planta 210:195-204). До дослідження була включана нова знешкоджена версія штаму A. rhizogenes K599. В цьому дослідженні, здатність A. tumefaciens та ризогенів інфікувати листкові експланти оцінювалася за аналізом транзиторної експресії GUS. Були використані два штами Agrobacterium: A. tumefaciens штам AGL1, похідний від AGL0 (recA::bla pTIBo542 Mop+CBR)(Lazo (1991) Bio/Technology 9:963-967), та знешкоджена версія штаму A. rhizogenes K599 (SHA016) (pRi2659)TetR NCPPB 2659 (BASF Plant Sciences LLC, 2004). Обидва штами Agrobacterium містили бінарний вектор pBPSMM192b із геном uidA під контролем посиленого промотора mas (SuperP:plV2GUS:nosT). За день перед інокулюванням експланту, за ніч культури були приготовані наступним чином: 30мл середовища YEP, яке містило відповідні антибіотики, було інокульоване 51 90860 10-80мкл робочого розчину Agrobacterium у Erlenmeyer й струшувано на круговому шейкері на 150об./хв. при 28°С протягом від 10 до 12 годин. Коли культури досягали OD600 від 0.5 до 0.8, клітини були осаджені центрифугуванням при 3,500об./хв. протягом 10 хвилин у 50мл колбах. Клітини були ресуспендовані в рідкому ССМ. Насіння культиварів сої (наприклад, Jack) були стерилізовані й проростки вирощували як показано вище. Листкові експланти були препаровані й занурені на 10-20 секунд в суспензію AgrobacteriumlCCM, покладені на стерильний фільтрувальний папір, й покладені зверху на фільтрувальний папір на твердому ССМ яке містило 400мг/л L-цистеїну (3.3мМ). Після 2 днів сумісного культивування, експланти були прополоскані в рідкому SIM й потім поміщені на тверде SIM яке містило 2.5мкМ БАП та 5.0мкМ кінетину на 3 дні. 52 Після цього, оцінювалася транзиторна експресія GUS та тканинних експлантах. Було проведено 2 експерименти. У першому експерименті, було препаровано дві серії загальною кількістю 30 експлантів й інокульовано AGL1. В другому експерименті, було препаровано одну серію на 40 експлантів й інокульовано AGL1 або SHA016 й визначено експресію GUS через п'ять днів після інокуляції. Перший експеримент визначив здатність AGL1 інфікувати листкові експланти. Усі тканини були піддані дії GUS для транзиторної експреси через п'ять днів після інокуляції. Шістдесят процентів експлантів мали GUS (+) вогнища на зрізаних краях черешка де знаходилася пазушна меристема (Таблиця 1). Також, в інших частинах експлантів, включаючи пластинку, були виявлені GUS+ вогнища. Таблиця 1 Перший проведений експеримент для визначення здатності AGL1 інфікувати листкові пазушні меристеми. Гістохімічне дослідження на GUS проведене через 6 днів після інфікування Rep 1 Rep 2 Загальна кількість інфікованих експлантів 10 20 У другому експерименті, як A.tumefaciens AGL1 так і знешкоджений штам A. rhizogenes К599 (SHA016) були успішними у перенесенні Т-ДНК в черешок листкового експланту. Сорок процентів експлантів інфікованих AGL1 показали GUS (+) вогнища в цільових регіонах, тоді як SHA016 пока GUS (+) вогнища в якості мішеней 6 12 зав 4% GUS(+) вогнищ в цільових регіонах (Таблиця 2). Зниження транзиторної експресії GUS у цих експлантах інфікованих SHA016 переважно було результатом тканинної смерті підчас сумісного культивування. Таблиця 2 Здатність штамів Agrobacterium AGL1 та SHA016 інфікувати листкові експланти Штам Усього інфікованих експлантів AGL1 SH016 40 40 Ці результати вказують на здатність знешкоджених штамів Agrobacterium tumefaciens та rhizogenes результативно вводити Т-ДНК в клітини розташовані в або поблизу цільового регіону листкового експланту. Приклад 8: Оптимізація умов сумісного культивування для регенерування експлантів та інфікування Agrobacterium У методах трансформації опосередкованої Agrobacterium, оптимізація умов сумісного культивування є важливим фактором отримання трансгенних рослин. Має бути досягнуто баланс між сприятливими умовами росту Agrobacterium та здоровими умовами росту рослин. Основні умови, які пройшли дослідження включають: умови освітлення, тривалість інкубування, температура, щільність клітин Agrobacterium, та склад середовищ. В цьому дослідженні розглянуто, умови освітлення, додавання тіольних сполук до ССМ (Olhoft and Somers (2001) Plants Cell Reports 20:706-711), дні інкубування, та метод інокуляції. Експланти із GUS (+) вогнищами в цільових регіонах 17 10 В обох експериментах були використані, культивари сої (наприклад, Jack) та штам Agrobacterium tumefaciens AGL1 який містить плазміду pBPSEW008 (SEQ ID NO: 1). Бінарна плазміда містила nosP-bar-nosT та pUBI-guslNT-nosT. Листкові експланти та Agrobacterium були препаровані як описано вище. Остаточна OD600 Agrobacterium використана в експериментах становила 0.5. У першому експерименті, були проведені дві серії для яких були випробувані наступні умови, (1) додавання однієї з п'яти тіольних сполук до ССМ (відсутність тіолів, 100мг/л L-цистеїну (0.825мМ), 400мг/л L-цистеїну (3.3мМ), 1000мг/л Lцистеїну (8.25мМ), або 1мМ тіосульфат натрію+1мМ DTT+1000мг/л L-цистеїну (8.25мМ)), (2) 3, 4, або 5 днів сумісного культивування при 25°С, та (3) інкубування в темряві або при 100μE/m2s холодного білого світла при режимі 16 світла/8 темряви. 53 90860 Для кожного експерименту було препаровано 10 експлантів. Експланти вирощувалися на середовищі SIM протягом 2 тижнів після чого було записано процент експлантів, які сформували калус/пагони. У другому експерименті, експланти були препаровані та піддані вище згаданій обробці, за виключенням усіх листкових експлантів, які були культивовані протягом 5 днів та цілі експланти були промиті суспензією Agrobacterium/CCM протягом 10 хвилин або зрізані кінці черешків експлантів були занурені. Для кожного експерименту було повністю промито 10 експлантів й 4 експланти були занурені на кожну обробку. Усі експланти були GUS-оброблені одразу після інокулювання. 54 В експерименті 1, регенерація калусу/пагонів була під значним впливом рівня L-цистеїну в ССМ але не залежали від умов освітлення сумісного культивування або днів інкубування (дивись Фіг.14). Від 80 до 100% експлантів сумісно культивованих на ССМ яке містило тіольні сполуки або 100мг/л L-цистеїну (0.825мМ), залежно від досліджуваних факторів, розвинули калус/пагони на сім'ядолях. Хоча, рівні L-цистеїну вищі за 400мг/л (3.3мМ) стабільно призводили до смерті тканин яку спостерігали за знебарвленням пластинки та краю зрізу черешка. В експерименті 2, обробка GUS експлантів за різних умов сумісного культивування показала, що ССМ з тіолами вище 400мг/л L-цистеїну (3.3мМ) придатною для оптимального введення Т-ДНК (дивись Таблицю 3). Таблиця 3 Кількість GUS позитивних фрагментів на черешку експлвнтів для кожної обробки сумісно культивування для експерименту 2 наведено нижче: Обробка тіолом 0мг/л Cys 0мг/л Cys 100мг/л Cys 100мг/л Cys 400мг/л Cys 400мг/л Cys 1000мг/л Cys 1000мг/л Cys NDC1000* NDC1000* Умови освітлення Світло Темрява Світло Темрява Світло Темрява Світло Темрява Світло Темрява Загалом: експлантів із GUS (+) вогнищами 0/10 1/10 6/10 7/10 9/10 9/10 3/10 3/10 9/10 9/10 Dip: експлантів із GUS (+) вогнищами 0/4 0/4 0/4 0/4 1/4 3/4 1/4 0/4 1/4 2/4 *NDC=1мМ тіосульфату натрію/1мМ DTT/8.25мМ (1000мг/л] L-цистеїну Експланти які були оброблені 1000мг/л Lцистеїну пройшли значне відбілювання, що пояснює низьке число GUS (+) вогнищ в цих експлантах. Попередні експерименти також підтверджують те, що умови освітлення не відіграють значної ролі в перенесенні Т-ДНК в клітини сої. Обробка яка головним чином вплинула як на регенерацію так і на GUS-транзиторну експресію в цій серії експериментів, це включення тіолових сполук в ССМ. Інші протестовані умови сумісного культивування не справили великого впливу на регенерацію або GUS-транзиторну експресію у кількостях використаних в цих експериментах. Таким чином, оптимальною концентрацією Lцистеїну була визначена 400мг/л або 3.3мМ. Приклад 9: Дія середовища, що індукує пагони (SIM) на регенерацію пагонів з листкових експлантів Усі культуральні умови включаючи солі, гормони, та якість світла впливали на відповідь рос лин до регенерацію рослин. Досліджування в яких порівнювали вплив основних солей та гормонів під час індукування пагонів на листкових експлантах були проведені на голубиному горошку (Cajanus) (Dayal et al. (2003) Plant Cell Rep. 21:1072-1079). В цій серії експериментів, основні солі MS та В5, рівні цитокінінів БАП та кінетину, та різні параметри світла були проаналізовані, для визначення впливу цих факторів на пагоноутворення та видовження на листкових експлантах. Листкові експланти були препаровані з 7 денних проростків з культиварів Soygenetics 31 (9341131) як показано вище. Експланти були послідовно поміщені в 16 різних середовищ SIM які включали або MS або В5 солі та одну з восьми комбінацій кінетинів та БАП (Базове середовище: MS або В5 солі, В5 вітаміни, MS III залізо, 3мМ MES, 3% сахароза, 0.8% очищений агар, та від 250 до 500мг/л Тиментину). 55 90860 56 Таблиця 4 Листкові експланти були препаровані та перенесені на SIM яке містило солі В5 або MS із змінними концентраціями кінетину та БАП Позначення С1В С2В СЗВ С4В С5В С6В С7В С8В Солі В5 В5 В5 В5 В5 В5 В5 В5 Кінетин (мкМ) 5 5 5 5 5 5 0 0 БАП (мкМ) 0 1 2.5 5 7.5 10 7.5 0 В першому експерименті, було проведено 3 в яких було препаровано 160 експлантів для кожної серії (як описано вище) та по 10 екплантів пройшли кожну 16 різних SIM обробок. Один дослідник проводив усі три серії. Експланти вирощувалися на SIM протягом 2 тижнів перед перенесенням п'яти експлантів з Rep2 та п'яти експлантів з Rep3 на SEM [1X MS макросолей, 1Х MS мікросолей, 1Х MSIII заліза, 1Х В5 вітамінів, 3% сахарози, 3мМ MES, 50мг/л L-аспарагіну (0.378мМ), 100мг/л Lпіроглутамінової кислоти (0.775мМ), 0.1мг/л ІОК (0.57мкМ), 0.5мг/л GA3 (1.44мкМ), 1мг/л ZR (2.85мкМ), 250 до 500мг/л тікарциліну, 0.8% Очищеного Агару; рН5.6] для індукування видовження пагонів. Експланти в цьому експерименті були вирощені в камері Percival при середній температурі 25°С із періодом 18г світла/6г темряви при >100μΕ/m2s використовуючи лампи холодного білого світла. Експеримент 2 складався з 3 серій в яких експланти були препаровані 3 різними дослідниками. Кожний дослідник відрізав 160 експлантів та помістив кожні 10 експлантів на 16 середовищ. Експланти росли два тижні на відповідному SIM Позначення С1М С2М С3М С4М С5М С6М С7М С8М Солі MS MS MS MS MS MS MS MS Кінетин (мкМ) 5 5 5 5 5 5 0 0 БАП (мкМ) 0 1 2.5 5 7.5 10 7.5 0 після чого експланти були перенесені на SEM. Експланти були вирощені в ростовій камері із періодом 16г світла/8г темряви із змішаними холодними білими та лампами GroLux при інтенсивності світла 0.3mm на експлант. Експланти обох донорських рослин містили пазушну меристему (in vitro та тепличної) позитив 60 но реагували на багатократне індукування як БАП так і TDZ (Таблиця 7). Більша здатність до регенерації була виявлена на експлантах пазушної меристеми матеріалу вирощеного in vitro. З використаних цитокінінів, БАП мав більшу здатність до індукування ніж TDZ. З обох донорських матеріалів, експланти, що культивувалися на TDZ дали більшу кількість калусу та малих пагонів. Забруднення також було проблемою експлантів одержаних з рослин вирощених в теплиці. Таблиця 7 Оцінювання здатності до регенерації зон пазушної меристеми від тепличних та in vitro донорних рослин. Результати з трьох серій (n=212) Джерело експланту In vitro Рослина Теплиця рослина Цитокінін БАП (5мМ) TDZ(9.1мкМ) БАП (5мМ) TDZ(9.1мкМ) Середнє # пагонів на експлант (>3мм) 1.97 0.74 0.20 0.32 Експлантні матеріали для способу трансформації розмноженої пазушної меристеми має більший потенціал індукування пагонів якщо вони беруться з рослин вирощених in vitro та оброблених БАП при індукуванні пагонів. Приклад 11: Фактори, які впливають на потенціал індукування пагонів на експлантах з рослин вирощених in vitro 11.1. Вплив типу культуральної ємкості на регенеративність пазушної меристеми сої Оцінювання проводилося для визначення впливу різних культуральних ємкостей на регенерацію експлантів пазушної меристеми отриманих з проростків in vitro. Wright et al. (1987) Показали, що тканини сої культивовані в пластикових чашках Петрі або скляних культуральних пробірках за однакових умов вирощувального середовища призводили до відмінностей в регенерації пагонів та фенотипових проявах. Насіння культивару Jack було поверхнево простерилізовано промиванням спочатку в 70% (об./об.) етанолі протягом 6хв. Потім насіння було занурено в розчин який містив 25% комерційного відбілювача (NaOCI) та 0.1% Tween 20, збовтане при 200об./хв. протягом 20хв. Насіння було промито 4 в стерильній подвійно дистильованій воді. Дозрівання проводилося на світлі (40-70 4М m-2 s1) при фотоперіоді 16/8 годин (світла/темряви). Стерильне насіння було розподілене між трьома різними культуральними судинами які пророщувальне середовище, (1) чашки Петрі (15020мм), (2) здвоєні бокси magenta, та (3) PlantconTM (SIGMA). Через три тижні на пророщувальному середовищі, експланти пазушної меристеми були препаровані як показано вище, потім поміщені базипетально на середовище, що індукує пагони, яке містило повний набір солей MS та вітаміни В5 Gamborg із додаванням 5мкМ БАП.Регенераційну здатність визначали за середньою кількістю пагонів >0.3mm на експлант, яке проведено через чотири тижні на середовищі, що індукує пагони. Експланти пазушної меристеми з проростків, що виросли на трьох різних культуральних ємкос ± ± ± ± SE 0.026 0.012 0.05 0.033 тях мали різні регенераційні потенціали. Найвища регенераційна здатність була виявлена в експлантах пазушної меристеми які пророщувалися у пластикових чашках Петрі; у середньому 0.3 пагони на експлант проросло на здвоєних чашках боксах Magenta, 0.81 у пластикових чашках Петрі, та 0.1 в Plantcons. Також, експланти отримані зі здвоєних magenta та PlantconTM (SIGMA) було більш складно відокремлювати від проростків й травмувати, ймовірно із-за підвищеного вмісту лігніну. 11.2. Вплив концентрації БАП в пророщувальному середовищі та/або середовищі, що індукує пагони на індукування пагонів на розмножених пазушних меристемах. Ідеальна донорська рослина має здатність продукувати високо регенеруючі експланти пазушної меристеми та розвивати велику кількість експлантів з одного проростка. Це спостерігалося що, підчас вирощування насіння на безгормональному середовищі та пряму використанні для експлантного матеріалу, було препаровано декілька експлантів пазушних меристем. Також, проліферативний ріст коріння в цих ємкостях дещо обмежувався в просторі та живленні для формування рослин. Отже, ми дослідили здатність експлантів регенерувати пагони після додавання етапу розмноження та додавання БАП до пророщувального середовища для зменшення росту коріння. Оскільки БАП також відомий своєю дією на потенціал регенерування пагонів, експерименти були побудовані таким чином щоб визначити здатність регенерувати експланти під дією різних концентрацій БАП під час проростання та розмноження. Насіння пророщувалося як зазначено вище із концентраціями БАП 0, 0.36, 1.25, 2.5 або 5мкМ. Після 7 днів, корінь, гіпокотиль, та одна сім'ядоля були видалені й залишені тканини поміщені ростове середовище (MS солі, 3% сахароза, В5 вітаміни, 0.8% фітоагар, плюс відповідний ВАР) розлите в чашки Петрі (15020мм). Сіянці з кожної концентрації БАП були перенесені на всі 5 концентрацій підчас росту. Через 4 тижні, експланти пазушної
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for obtainment of transgenic soybean
Автори англійськоюPAULA OLHOFT, LESLIE GRIST, LIBBY BERNAL, SARA PRICE, DIANA ARIAS, HAIPING HONG
Назва патенту російськоюСпособ получения трансгенной сои
Автори російськоюОлхофт Паула, Грист Лесли, Бернел Либби, Прайс Сара, Эриэс Диана, Ханг Хайпинг
МПК / Мітки
МПК: C12N 15/82
Мітки: сої, спосіб, трансгенної, одержання
Код посилання
<a href="https://ua.patents.su/58-90860-sposib-oderzhannya-transgenno-so.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання трансгенної сої</a>
Попередній патент: Спосіб виготовлення плоского комутатора і заготовки провідників для такого комутатора
Наступний патент: Зменшення службових сигналів протокольного блока даних у системі бездротового зв’язку
Випадковий патент: Радіопрозорий керамічний матеріал