Стереоселективний метод синтезу фосфорильованих алкенів
Номер патенту: 111025
Опубліковано: 10.03.2016
Автори: Колодяжна Анастасія Олегівна, Колодяжна Ольга Олегівна, Колодяжний Олег Іванович
Формула / Реферат
Спосіб одержання фосфорильованих алкенів формули 1, у якому забезпечують взаємодію триметилсилілалкілфосфонітів з карбонільними сполуками, що проводять у розчині чотирихлористого вуглецю
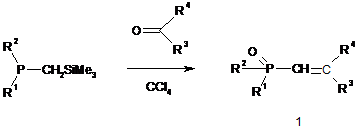 , де
, де
R1=EtO, PrO, i-PrO, Et2N, Pr2N; R2=EtO, PrO, i-PrO, Et2N, Pr2N; t-Bu;
R3=Ph, C6H4Br, C6H4F, C6H4CH=O, C6H5CH=CH; R4=H, CF3.
Текст
Реферат: Спосіб одержання фосфорильованих алкенів, у якому забезпечують взаємодію відповідних триметилсилілалкілфосфонітів з карбонільними сполуками, що проводять у розчині чотирихлористого вуглецю. UA 111025 C2 (12) UA 111025 C2 4 R 2 R O 3 R P CS e HM i 3 2 1 R 4 R O R P C C H 2 C4 C l 3 1 R R 1 UA 111025 C2 5 10 15 20 Запропонований винахід належить до галузі органічного синтезу, а саме створенню методу синтезу фосфорильованих алкенів реакцією триметилсилілалкілфосфінів або фосфонітів з карбонільними сполуками, що стереоселективно приводить до утворення трансфосфорильованих алкенів. Найбільш близькою за сукупністю ознак є реакція С-літійзаміщених біс-фосфонатів з карбонільними сполуками, яка також у деяких випадках приводить до утворення фосфорильованих алкенів [1]. Недоліком цього методу є необхідність застосування бутиллітію, і досить низькі виходи продуктів реакції. Крім того, цей метод не забезпечує високої чистоти продуктів та високих виходів продуктів реакції. Ще один спосіб одержання фосфорильованих алкенів використовує реакцію ацетиленів з діалкілфосфітами у присутності каталізатора цирконію. [2]. Реакція [(діетоксивініл)метил]трифенілфосфоній трифлату з карбонільними сполуками: а також арилювання діетил вінілфосфонату арилбромідами, що каталізується паладієм, утворюють 2-арилвінілфосфонати. [3, 4]. Запропоновано також синтез діетил 2(арил)вінілфосфонатів реакцією Хека, що каталізується комплексами паладію (циклічні комплекси Хермана і каталізатори Нолана) [5]. Але всі ці методи не є стереоселективними і дають суміші цис- і трансізомерів, а також потребують досить дорогих і важкодоступних каталізаторів комплексів паладію або платини. В основу запропонованого винаходу поставлено задачу створення простого стереоселективного методу фосфонілювання карбонільних сполук, який забезпечив би можливість одержання фосфорильованих алкенів різноманітної будови з високими виходами і високою хімічною чистотою. Поставлена задача вирішується тим, що реакцію третинних триметилсилілалкілфосфонітів з карбонільними сполуками, проводять у розчині чотирихлористого вуглецю. R R R O 2 P 1 4 R 3 R O R CH2SiMe3 CCl4 2 P R CH 1 25 30 35 40 45 50 C R 1 4 3 , де R =EtO, PrO, i-PrO, Et2N, Pr2N; R =EtO, PrO, i-PrO, Et2N, Pr2N; t-Bu; 3 4 R =Ph, C6H4Br, C6H4F, C6H4CH=O, C6H4CH=CH; R =H, CF3 Неочікуваним виявилося, що третинні фосфіни і фосфоніти можуть реагувати у середовищі чотирихлористого вуглецю з утворенням фосфорильованих алкенів. Введення в реакційне середовище чотирихлористого вуглецю, а також сполуки тривалентного фосфору та карбонільної сполуки забезпечує енергійну реакцію між реагентами, яка завершується утворенням відповідного фосфорильованого алкену з високим хімічним виходом і високою чистотою. В такій сукупності та послідовності запропоновані вище операції не використовувалися. На основі цього вважаємо, що запропоноване нами технічне рішення відповідає критерію "рівень корисної моделі". Суть запропонованого винаходу пояснюємо конкретними прикладами. Приклад 1. Біс(діетиламідо) (E)-стирилфосфонат (IIа). Тетраетилдіаміно триметилсилілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 15 хв, додали бензальдегід (0.015 моля), підвищили температуру до кімнатної і перемішували 14 г. Випарили реакційну суміш у вакуумі при +20 °C, а потім залишок витримали протягом 15 хв у вакуумі (0.05 мм рт. ст.) при 100 °C для видалення надлишку бензальдегіду. Залишок перекристалізували з 1 3 гексану. Вихід 80 %, т. пл. 103.5 °C. Спектр ЯМР Н (CDCl3), δ, м. ч. (J, Гц): 1.38 т, JНН 7 (12Н, 3 3 3 3 СН3СН2); 3.10·д.к ( JНН 7, Jpн 11, 8Н, CH2N); 6.60 д. д ( JНН 17.2, JPН 18, 1H, РСН=С); 7.75 д. д 3 3 13 ( JНН 17.5, JРН 19, 1H, С=СН); 7.65 м (5Н, С6Н5). Спектр ЯМР С (C6D6), δ, м. ч. (J, Гц): 13.70; 1 2 3 41.85; 114.50, д, ( JPC 152.0, РСН=С); 128.70; 131.66 д ( JPC 24.0, РС=С), 144.17, 161.90 (д, JPC 31 30). Спектр ЯМР Р (CDCl3), δP, м. ч.: δP+24.50. Приклад 2. Біс(дипропіламідо)(Е)-стирилфосфонат (IIа). Тетрапропілдіаміно триметилсилілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 15 хв, додали бензальдегід (0.015 моля), підвищили температуру до кімнатної і перемішували 14 г. Випарили реакційну суміш у вакуумі при +20 °C, а потім залишок витримали протягом 15 хв у вакуумі (0.05 1 мм рт. ст.) при 100 °C для видалення надлишку бензальдегіду. Вихід 90 %, Спектр ЯМР Н 3 3 3 (CDCl3), δ, м. ч. (J, Гц): 1.10 т, JНН 7 (12Н, СН3СН2); 1.58·м (8Н, СН2); 3.30·д.к ( JНН 7, JРН 11, 8Н, 1 2 1 UA 111025 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 3 3 CH2N); 6.30 д. д ( JНН 17.2, JPH 18, 1Н, PCH=C); 7.15 д. д ( JHH 17.5, JРН 19, 1H, C=CH); 7.65 м 31 (5H, C6H5). Спектр ЯМР P (CDCl3), P, м. ч.: P+24.00. Приклад 3. Діетил (E)-стирилфосфонат (IIб). Діетил триметилсилілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 2 г, додали бензальдегід (0.015 моля), підвищили температуру до кімнатної і перемішували 14 г. Випарили реакційну суміш у вакуумі при +20 °C, а потім залишок 1 перегнали у вакуумі. Вихід 60 %, т. кип. 122 °C (0.06 мм рт. ст.), літ. дані [6-8]. Спектр ЯМР Н 3 3 3 3 (CDCl3), м.д., J, Гц: δН 1.28 т ( JНН 7.0, 3Н); 1.30 т ( JНН 7.0. 3Н, СН3); 4.15 д.к ( JНН 7.0, JPH 11.0, 3 2 3 3 4Н, ОСН2), 6.30 д.д ( JНН 17.2, JРН 17.2, 1Н, СH=С), 7.10 (дд, JНН 17.2, JPH 22, 1Н, С=СН), 7.1013 2 1 7.40 (м, 5Н, С6Н5). Спектр ЯМР С (CDCl3), δ, м. ч. (J, Гц): δ 16.30, 61.6 д ( JCP 6), 110.70 д ( JСР 2 31 190, СН), 128.00, 129.00, 131.10, 136.10. 149.20 д ( JCP 6.1, СН). Спектр ЯМР Р (CDCl3), P, м. ч.: +18.00. Приклад 4. Діізопропіл (E)-стирилфосфонат (IIв). Діізопропілтриметил-силілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 2.5 г, додали бензальдегід (0.015 моля), підвищили температуру до кімнатної і перемішували 14 год. Випарили реакційну суміш у вакуумі при +20 °C, залишок перегнали у вакуумі. Вихід 60 %, т. кип. 122 °C (0.06 мм рт. ст.) [6]. Спектр ЯМР 1 3 3 Н (CDCl3), δ, м. ч., J, Гц: Н 1.24 д.д ( JНН 6.0, JPH 2.5, 12Н, СН3С); 4.33 м (2Н, ОСН); 6.10 д.д 3 2 3 3 JНН (17.5, JРН 18, 1H, РСН=С); 7.70 д.д, ( JНН 17.5, JРН 19, 1H, РС=СН); 7.10 м (5Н, С6Н5). 13 2 1 Спектр ЯМР С (C6D6), δ, м. ч. (J, Гц): 23.60, 23.80; 70.21 д ( JСР 6, ОСН), 120.80 д ( JPC 180, СН), 2 31 128.35, 129.00, 131.10, 136.10, 149.20 (д, JPC=6.1, СН). Спектр ЯМР Р (CDCl3), P, м. ч.: + 16.00. Приклад 5. Діетил (E)-2-бромстирилфосфонат (IIг). Діетил триметилсилілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 2 г, додали 2-бромбензальдегід (0.015 моля), підвищили температуру до кімнатної і перемішували 10 год. Випарили реакційну суміш у вакуумі при +20 °C, а потім залишок перегнали у вакуумі і перекристалізували з гексану. (IIа). Вихід 1 3 75 %, т. топ. 82 °C. (літ. [31]. т. пл. 82 °C). Спектр ЯМР H (CDCl3), δ, м. ч., J, Гц: Н 1.29 т ( JНН 3 3 2 3 7.0, 6Н, СН3). 4.07 м ( JНН 7.5, 4Н, CH2O); 6.18 д.д ( JНН 17.5, JРН 17.0, 1Н, РСН=С); 7.30 д ( JHH 3 3 3 8.5, 2Н, С6Н4); 7.37 д.д ( JHH 17.5, JРН 18.2, 1Н, РС=СН); 7.46 д ( JНН 8.5, 2Н, o-BrC6H4). Спектр 13 2 2 ЯМР С (C6D6), δ, м. ч. (J, Гц): 16.40, д (JPC 7.0, СН3); 61.90 д ( JPC 5.6, СН2О); 114.80 д ( JРН 3 2 192.0, РС=С); 124.40; 128.50; 132.60; 133.70 д ( JPC 24.0), 147.30 д ( JPC 6.9, РС=С). Спектр ЯМР 31 Р (CDCl3), P, м. ч.: +19.06. Приклад 6. Біс(діетиламід) (E)-2-о-фторфенілетенілфосфонат (IIд). Діетил триметилсилілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 2 г, додали бензальдегід (0.015 моля), підвищили температуру до кімнатної і перемішували 14 год. Випарили реакційну суміш у вакуумі при 120 °C, а потім залишок перегнали у вакуумі і додатково перекристалізували з гексану. Вихід 60 %, т. кип. 130 °C (0.1 мм рт ст), т. пл. 114 °C. Спектр 1 3 3 ЯМР Н (CDCl3), δ, м. ч., J, Гц: Н 1.08 т ( JНН 7.0, 6Н, СН3). 3.08 м ( JНН 7.5, 4Н, CH2N); 6.25 д.д 3 2 3 3 ( JНН 17.5, JНР 17.0, 1Н, РСН=С); 7.03 м (2Н, С6Н4); 7.40 д.д ( J 17.5, JНР 18.0, 1Н, РС=СН); 7.46 3 13 2 д ( J 8.5, 2Н, С6Н4). Спектр ЯМР С (C6D6), δ, м. ч. (J, Гц): 13.77; 37.9; 114.50, 118.10 (д, JPC 2 31 152.0, Р-СН=С); 128.70; 131.66 д (J 24.0, РС=С), 144.17, 161.90 д ( JСF 247.5). Спектр ЯМР Р (CDCl3), P, м. ч.: +119.06. Приклад 7. Біс(діетиламід) (E)-2-(1,3-бензодіоксол-5-іл) вінілфосфонат (IIе). Діетил триметилсилілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 15 хв, додали піперональ (0.015 моля), підвищили температуру до кімнатної і перемішували 14 год. Випарили реакційну суміш у вакуумі при 1-20 °C, а потім залишок перегнали у вакуумі. Продукт 1 перекристалізували з гептану при охолоджені до -20 °C. Спектр ЯМР Н (CDCl3), δ, м. ч. (J, Гц): 3 3 2 1.08 т ( JНН 7,12Н, СН3); 3.07 м (4Н, CH2N); 5.96 с (2Н, ОСН2О); 6.14 дд ( JНН 17, JРН 17.5, 1H, 13 РСН=С); 6.78-7.32 м (6Н, РС=СН + С6Н5). Спектр ЯМР С (CDCl3), δ, м. ч. (J, Гц): δС 13.86; 38.00, 100.94; 105.63, 107.97; 115.39, 116.63; 122.69, 129.93, 130.03; 145.00, 147.76, 148.32. 31 Спектр ЯМР Р (CDCl3), P, м. ч.: 24.00. Знайдено %: С 60.66; Н 8.21; Р 9.05. C17H27N2O3P. Обчислено, % С 60.34; Н 8.04; Р 9.15. Приклад 8. Біс(діетиламід) 4-феніл-(1E, 3E)-бутадієнілфосфонової кислоти. До 0.02 моля біс(діетиламіно) триметилсилілметилфосфоніту (Iв) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 15 хв, додали цинамоновий альдегід (0.015 моля), підвищили температуру до кімнатної і перемішували 14 год. Випарили реакційну суміш у вакуумі при +20 °C, а потім 2 UA 111025 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 залишок перегнали у вакуумі. Вихід 70 %, т. кип. 170-175 °C (0.06 мм рт. ст.). Спектр ЯМР Н 3 3 (СDСl3), δ, м. ч. (J, Гц): 1.4 т ( JHH 7, 12Н, СН3); 3.30 д.к ( JPH 10, 8Н, CH2N); 6.30 м; 7.30 м (4Н, 31 СН=СН); 7.80 м (5H, С6Н5). Спектр ЯМР Р (CDCl3), P, м. ч.: + 23.30. Знайдено %: С 67.77; Н 9.20; Р 9.66. C18H29N2OP. Обчислено, % С 67.47; Н 9.12; Р 9.67. Приклад 9. Біс(діетиламід)-4-формілфеніл-(E)-вінілфосфонат (V). До 0.02 моля діетиламіно триметилсилілметилфосфоніту (Iв) в 10 мол діетилового ефіру при -70 °C додали 0.03 моля тетрахлорметану, підвищили температуру до 0- +5 °C і через 15 хв додали 0.02 моля терефталевого альдегіду. Залишили на ніч. Наступного дня випарили розчинник у вакуумі (10 мм рт. ст.). Залишок перекристалізували із суміші ефіру з пентаном при 0 °C. Вихід 50 %, т. пл. 1 92.5-94 °C. Після повторної кристалізації з гексану, т. пл. 98 °C. Спектр ЯМР Н (CDCl3), δ, м. ч. 3 3 3 (J, Гц): 1.40 т, JНН 7 (12Н, СН3СН, ); 3.41 д. д ( JНН 7, JРН 10.5, 8Н, CH2N); 8.10 д.д (4Н, С6Н4); 2 2 3 3 6.80 д.д ( JHH 17.5, JРН 17.5, 1Н, РСН=С); 7.85, д. д ( JРН 17.5, JPH 19, 1H, C=CH); 8.00 д; 8.10 д, 4 13 31 JHH 9 (4H, C6H4); 10.30 с (1H, C(O)H). Спектр ЯМР C (CDCl3), δ, м. ч. (J, Гц): Спектр ЯМР Р (CDCl3), P, м. ч.: 23.7. Знайдено %: С 63.13; М 8.41; Р 9.52. C17H27N2O2P. Обчислено, % С 63.34; Н 8.44; Р 9.61. Приклад 10. Біс(діетиламід) 3,3,3-трифтор-2-фенілпропенфосфонат (ХIб). 0.02 моля біс(діетиламіно) триметилсилілметилфосфоніту (Iв) додали при -70 °C до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 15 хв, додали трифторацетофенон (0.015 моля), підвищили температуру до кімнатної і перемішували 14 год. Випарили реакційну суміш у вакуумі при +20 °C, а потім 1 перегнали у вакуумі. Вихід 70 %, т. кип. 150 °C (0.07 мм рт. ст.). Спектр ЯМР Н (CDCl3), δ, м. ч. 3 3 2 4 (J, Гц): 1.38 т (12Н, JНН 7, СН3); 3.27 дк ( JРН 10, 8Н, CH2N); 6.80 д.к ( JPH 12, JHF 1.5, 1Н, С=СН); 19 31 7.60 м (5Н, С6Н5). Спектр ЯМР F (CDCl3), δF-68.11 м. ч. Спектр ЯМР Р (CDCl3), P, м. ч.: 23.50; 16.20. Знайдено, %: С 56.35; Н 7.23; Р 8.55. C17H26F3N2OP. Обчислено, % С 56.35; H 7.23; Р 8.55. Приклад 11. Діізопропіл 2-феніл-3,3,3-трифторпропеніл-1-фосфонат (ХІа). Діізопропіл триметилсилілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 2.5 год., додали трифторацетофенон (0.015 моля), підвищили температуру до кімнатної і перемішували 14 год. Випарили реакційну суміш у вакуумі при +20 °C, а потім 1 3 залишок перегнали у вакуумі. Спектр ЯМР Н CDCl3), δ, м. ч. (J, Гц): Н 1.03 д ( JНН 6.4, СН3С); 3 4 2 1.12 д ( JHH 6.2, СН3С); 4.45 м (ОСН); 6.44 д. к ( JFH 1.5, JPC 12.0, РСН=С); 7.30 м (С6Н5). 1 3 3 (Z-ізомер): спектр ЯМР Н (CDCl3), δ, м. ч. (J, Гц): Н 1.28 д ( JНН 6.5, СН3С); 1.32 д ( JHH 6, 2 31 СН3С); 4.75 м (ОСН); 6.20 д ( JPH 8.8, C=СН); 7.30 м (С6Н5). Спектр ЯМР Р (CDCl3), P, м. ч.: 9.3 і 7.68. (співвідношення 7:1). Знайдено, %: С 53.57; Н 5.99; Р 9.21. C15H20F3O3P. Обчислено, % С 53.57; H 5.99; Р 9.21. Приклад 12. Діетиламіно-третбутилстирилфосфін оксид. Діетиламіно-третбутилтриметилсилілметилфосфін (0.01 моль) при -70 °C додали до 5 мл чотирихлористого вуглецю, потім підвищили температуру реакційної суміші до 0 °C і перемішували 15 хв, додали бензальдегід (0.015 моля), підвищили температуру до кімнатної і перемішували 6 год. Випарили реакційну суміш у вакуумі при +20 °C, а потім залишок витримали протягом 15 хв у вакуумі (0:05 мм рт. ст.) при 100 °C для видалення надлишку бензальдегіду. Залишок перекристалізували з 1 3 гексану. Вихід 80 %, т. пл. 106 °C. ЯМР Н (CDCl3), δ, м. ч. (J, Гп): Н 1.35 т, JНН 7 (6Н, СН3СН, ); 3 3 3 3 3 1.37 д, JPH, 14.5 (9Н, СН3С); 3.35 д. к, JНН 7, JРН 8 (4Н, CH2N); 6.75 д. д. JНН 22.5, JPH 17 (1Н. 3 PCH=C); 7.5 д. д, JНН 22.5; 7.45 м (6Н, C=СН + С6Н5). Знайдено %: N 5.12; Р 10.97. C16H26NOP. Обчислено, % N 5.01; P 11.09. Приведені приклади 1-10 свідчать, що запропонований метод дає можливість одержувати фосфорильовані алкени різноманітної будови з високими виходами і високою стереосективністю продуктів транс-конфігурації в м'яких умовах, зменшити затрати реагентів на проведення і спрощення процесу. Одержані фосфорильовані алкени є потенційно біологічно активними речовинами, багато представників яких використовуються як антибіотики, антибактеріальні препарати, біорегулятори, гербіциди, фунгіциди та ін. Вони також можуть використовуватись як мономери, або антипірени [9-11]. Перелік посилань [1] Rambauda M.; del Vecchioa A.; Villierasa J. Synth. Commun., 14(9), 833-841 (1984). [2] Zhonga P.; Xionga Z. X.; Huang X. Synth. Commun., 30(2), 273-278 (2000). [3] Xu, Y.; Flavin, M. T. and Xu, Z. Q. J. Org. Chem., 1996, 151, 7697. [4] Xu, Y.; Jin, X.; Huang, G. Huang, Y. Synthesis, 1983, 556. [5] Al-Maksoud W., Mesnager J., Jaber F., Pinel C., Djakovitch L. J. Organomet. Chem. 694 (2009)3222-3231. 3 UA 111025 C2 5 [6] Zhong P., Xiong Z. X., Huani X. // Synth. Commun. 2000. Vol.30. N 2. P. 273. [7] Xu Y., Flavin M. Т., Xu Z.-Q. // J. Org. Chem. 1996. Vol.61. N 21. P. 7697. [8] Blaszczyk R., Gajda T. // Heteroatom Chem. 2007. Vol.18. No 7. P. 732. [9] Lennon P. J. Пат. 5,434,288 (1995) США. [10] Пат. 2102427 (1983). Великобританія; С.А. 1983. Vol. 99, P. 88368d. [11] Jin J.I. Пат 4031054 (1977) США; С.А. 1977. Vol. 87. P. 54500. ФОРМУЛА ВИНАХОДУ 10 Спосіб одержання фосфорильованих алкенів формули 1, у якому забезпечують взаємодію триметилсилілалкілфосфонітів з карбонільними сполуками, що проводять у розчині чотирихлористого вуглецю R R R O 2 P 1 4 R 3 R O R CH2SiMe3 CCl4 2 P R CH 1 4 C R 3 1 , де R =EtO, PrO, i-PrO, Et2N, Pr2N; R =EtO, PrO, i-PrO, Et2N, Pr2N; t-Bu; 3 4 R =Ph, C6H4Br, C6H4F, C6H4CH=O, C6H5CH=CH; R =H, CF3. 1 15 2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Автори англійськоюKolodiazhnyi Oleh Ivanovych, Kolodiazhna Olha Olehivna, Kolodiazhna Anastasia Olehivna
Автори російськоюКолодяжный Олег Иванович, Колодяжная Ольга Олеговна, Колодяжная Анастасия Олеговна
МПК / Мітки
МПК: C07F 9/02, C07F 9/40, C07F 7/08, C07F 9/44, C07C 1/34
Мітки: метод, фосфорильованих, стереоселективний, синтезу, алкенів
Код посилання
<a href="https://ua.patents.su/6-111025-stereoselektivnijj-metod-sintezu-fosforilovanikh-alkeniv.html" target="_blank" rel="follow" title="База патентів України">Стереоселективний метод синтезу фосфорильованих алкенів</a>
Попередній патент: Композиція для виготовлення рулонного матеріалу для гідроізоляції та ремонту
Наступний патент: Спосіб виготовлення біметалевого подового електрода










