Спосіб синтезу природної речовини “hefs”
Формула / Реферат
Спосіб синтезу природної речовини 5-етил-2-гексилфуран-3-сульфокислоти, загальної формули C12H20O4S,
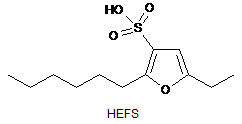
з використанням сульфуючого реагенту, який відрізняється тим, що на ключовій стадії як сульфуючий реагент використовують 1 еквівалент комплексу триметиламін-оксид сірки(VІ) в абсолютному тетрагідрофурані в кріогенних умовах протягом 12-24 годин.
Текст
Реферат: UA 104402 U UA 104402 U 5 10 15 20 Корисна модель належить до синтетичної органічної хімії і стосується способу синтезу природної речовини 5-етил-2-гексилфуран-3-сульфокислоти "HEFS" (І), яка належить до гетероциклічних сполук фуранового ряду. Фурани є одними із найбільш важливих гетероциклів, вони є ключовою структурною одиницею багатьох природних сполук та терапевтичних агентів [1]. "HEFS" уперше виділено у 1988 році із земляних черв'яків виду Eisenia veneta [2], але досі не було синтезовано в лабораторії. Ця кислота виконує функцію природного регулятора згортання крові, інгібітора агрегації тромбоцитів та інгібітора вазоконстрикції у хребетних [3], вона є унікальним метаболітом, який захищає земляних черв'яків, один з найважливіших компонентів біомаси нашої планети, від згубної дії рослинних поліфенолів [4]. Розробка методів синтезу "HEFS" та її синтетичних аналогів є надзвичайно важливим завданням, яке відкриває широкі перспективи для цільового отримання цих біологічно-активних речовин та детального вивчення їх біологічних властивостей в подальшому. Найбільш близьким до об'єкта, що заявляється (прототип), є відомий спосіб синтезу 2,5діалкілфуран-3-сульфокислот з використанням як сульфуючого реагенту комплексу піридиноксид сірки(VІ) [5]. Значним недоліком цього способу синтезу є межі застосування реакції, оскільки за її допомогою можна отримати тільки симетрично заміщені фурансульфокислоти. Також, жорсткі умови сульфування (температура 100 °C) призводять до отримання дисульфокислот, що не завжди є бажаним результатом. В основу цієї корисної моделі поставлено задачу розробки ефективного способу синтезу 5етил-2-гексилфуран-3-сульфокислоти "HEFS" (І). Поставлена задача вирішується розробленим способом синтезу 5-етил-2-гексилфуран-3сульфокислоти "HEFS" (І), загальної формули C12H20O4S, O HO O S O HEFS 25 30 з використанням сульфуючого реагенту, який полягає у виборі як сульфуючого реагенту 1 еквіваленту комплексу триметиламін-оксид сірки(VІ) в абсолютному тетрагідрофурані в кріогенних умовах протягом 12-24 годин. Методика синтезу "HEFS" (І) включає реакцію Гриньяра між гептаналем (II) та етинілмагнійбромідом в тетрагідрофурані (перша стадія), далі конденсація отриманого продукту (III) з вайнреб-амідом призводить до кетоспирту (IV) (друга стадія), циклізація останнього в присутності надлишку бромоводневої кислоти в середовищі метилбензен-вода дає бромофуран (V) (третя стадія), на останній, ключовій стадії, відбувається обмін галогену на сульфогрупу під дією комплексу триметиламін-оксид сірки(VІ) в кріогенних умовах. O H II 1) n-BuLi (2.2 екв.) OH MgBr O THF-DMSO o THF, 0 C OH O III 80% 2) 3) H2O IV, 30% N O PhMe-H2O, 10 екв. HBr 65 o C, 12 год. 79% SO3H Br 1) n-BuLi (1 екв.), THF, -78 O o C, 2 год. O 2) Me3N-SO3(1 екв.), THF І (HEFS) від -78 o V С до к.т. 3) Іонообмінна смола 31% 1 UA 104402 U 5 10 15 20 25 30 35 40 45 50 55 60 Приклад синтезу. Перша стадія. Нон-1-ін-3-ол (III). В 250 мл колбу додали 50 мл абсолютного ТГФ та охолодили розчин до 0 °C, додали розчин етинілмагнійброміду (0.5 М в ТГФ, 66 мл, 33 ммоль), через 10 хвилин поступово додали гептаналь-1 (3.42 г, 4.19 мл, 30 ммоль). Отриману реакційну суміш перемішували протягом 1 години при 0 °C, далі нагріли до 20 °C і перемішували 12 годин. До охолодженої до 0 °C суміші додали 35 мл насиченого водного розчину хлориду амонію та 10 мл води, продукт екстрагували діетиловим етером (375 мл). Екстракт відфільтровували через силікагель (1 см), висушували сульфатом натрію та випаровували у вакуумі (30 °C, 20 Тоrr). Очистка отриманого продукту на колонці з силікагелем (діетиловий етер-петролейний етер 1:10→1:4, SiO2 40-63μm, 30×120 мм) призводить до продукту (III) у вигляді безбарвної рідини 1 (3.36 г, 80 %), Rf0.42 (діетиловий етер-петролейний етер 1:3). Спектр ЯМР Н (400 МГц, CDCl3), δ, м.ч.: 0.88 (3Н, т, СН3), 1.25-1.36 (6Н, м, 3СН2), 1.42-1.49 (2Н, м, СН2), 1.65-1.78 (2Н, м, СН2), 13 1.85 (1Н, уш.с, ОН), 2.46 (1Н, д, J2.1Гц, ССН), 4.37 (1Н, кв, СНОН). Спектр ЯМР С (100 МГц, 9 8 7 6 5 CDCl3), δ, м.ч.: 14.2 (С , СН3), 22.7 (С , СН2), 25.1 (С , СН2), 29.0 (С , СН2), 31.9 (С , СН2), 37.8 4 3 1 2 (С , СН2), 62.5 (С , СНОН), 73.0 (С , -ССН), 85.2 (С , -ССН). Друга стадія. 6-Гідроксидодец-4-ін-3-он (IV). До розчину алкінолу (III) (1.317 г, 9.39 ммоль) в 20 мл абсолютного ТГФ охолодженого до -78 °C додавали н-бутиллітій (2.5М в гексані, 8.02 мл, 20.06 ммоль) по краплинах протягом 10 хвилин. Реакційну масу розігріли до 0 °C і перемішували 1 годину, заново охолодили до - 60 °C і додали вайнреб-амід (1.00 г, 8.54 ммоль) розчинений в 10 мл абсолютного ДМСО протягом 10 хвилин. Отриману гетерогенну реакційну масу перемішували та повільно нагрівали до 0 °C (4 години), додали 40 мл 1М НСl та екстрагували продукт діетиловим етером (3100 мл). Об'єднані органічні шари промивали солоною водою, висушували сульфатом натрію та випаровували у вакуумі (25 °C, 3 Тоrr). Очистка отриманого продукту на колонці з силікагелем (діетиловий етер-петролейний етер 1:8→1:1, SiO2 40-63μm, 30×100 мм) призводить до продукту (IV) у вигляді безбарвної рідини (0.496 г, 30 %, друга фракція) та 0.527 г вихідного алкінолу (III) (40 %, перша фракція). Rf0.57 -1 (діетиловий етер-петролейний етер 1:1), ІЧ-спектр νmax/cм (плівка): 3402, 2928, 2209, 1677, 1 1459, 1164, 1049. Спектр ЯМР Н (400 МГц, CDCl3), δ, м.ч.: 0.88 (3Н, т, J 6.8Гц, СН(ОН)(СН2)5СНз), 1.14 (3Н, т, J 7.4Гц, С(О)СН2СН3), 1.24-1.36 (6Н, м, СН(ОН)СН2СН2СН2СH2СН2СН3), 1.41-1.49 (2Н, м, СН(ОН)СН2СН2СН2СН2СН2СН3), 1.71-1.81 (2Н, м, СН(ОН)СН2СН2СН2СН2СН2СН3), 2.13 (1Н, д, J 5.7Гц, ОН), 2.59 (2Н, кв, J 7.4Гц, С(О)СН2СН3), 13 4.52 (1Н, кв, J 6.4Гц, СН(ОН)(СН2)5СН3). Спектр ЯМР С (100 МГц, CDCl3), δ, м.ч.: 8.0 (С(О)СН2СН3), 14.2 (СН(ОН)(СН2)5СН3), 22.7 (СН(ОН)СН2СН2СН2СН2СН2СН3), 25.1 (СН(ОН)СН2СН2СН2СН2СН2СН3), 29.0 (СН(ОН)СН2СН2СН2СН2СН2СН3), 31.8 (СН(ОН)СН2СН2СН2СН2СН2СН3), 37.1 (СН(ОН)СН2СН2СН2СН2СН2СН3), 38.9 (С(О)СН2СН3), 62.4 4 5 4 5 + (СН(ОН)), 83.5 (С С ), 92.4 (C C ), 188.5 (C(0)). HRMS (FI ) Знайдено: 219.1361; C12H20NaO2 + (MNa ) обчислено 219.1356. Третя стадія. 3-Бромо-5-етил-2-гексилфуран (V). До розчину 6-гідроксидодец-4-ін-3-ону (IV) (510 мг, 2.60 ммоль) в 10 мл метилбензену додали водний 4.4М розчин бромоводневої кислоти (5.9 мл, 26 ммоль) та нагрівали реакційну суміш при перемішуванні та температурі 65 °C протягом 12 годин. Після охолодження продукт екстрагували діетиловим етером (350 мл), органічні шари промивали солоною водою, висушували сульфатом натрію та випаровували у вакуумі (25 °C, 3 Тоrr). Очистка отриманого продукту на колонці з силікагелем (петролейний етер, SiO2 40-63μm, 30×100 мм) призводить до продукту (V) у вигляді безбарвної рідини (580 мг, -1 79 %). Rf 0.85 (петролейний етер), ІЧ-спектр νmax/см (плівка): 2939, 1606, 1576, 1462, 1379, 1 1322, 1220, 1061, 1000, 939, 720. Спектр ЯМР Н (400 МГц, CDCl3), 5, мл.: 0.88 (3Н, т, J 7.0Гц, СН3 гексильної групи), 1.19 (3Н, т, J 7.6Гц, СН3 етильної групи), 1.25-1.35 (6Н, м, 3СН2 гексильної групи), 1.56-1.64 (2Н, м, СН2 гексильної групи), 2.58 (2Н, т, J 7.4Гц, СН2 гексильної Аr 13 групи), 2.58 (2Н, кв.д, J 7.6, 0.9Гц, СН2 етильної групи), 5.93 (1Н, т, J 0.9Гц, Н ). Спектр ЯМР С (100 МГц, CDCl3), δ, м.ч.: 12.1 (СН3 етильної групи), 14.2 (СН3 гексильної групи), 21.6 (СН2 етильної групи), 22.7 (СН2 гексильної групи), 26.2 (СН2 гексильної групи), 28.0 (СН2 гексильної 3 4 2 групи), 28.8 (СН2 гексильної групи), 31.6 (СН2 гексильної групи), 95.9 (С ), 107.8 (С ), 151.3 (С ), 5 + + 156.2 (С ). HRMS (FI ) Знайдено: 258.0617, 260.0607; С12Н19ВrО (М ) обчислено 258.0619, 260.0600. Четверта стадія. 5-Етил-2-гексилфуран-3-сульфокислота "HEFS" (І). До розчину 3-бромо-5етил-2-гексилфурану (V) (250 мг, 0.97 ммоль) в 2 мл абсолютного ТГФ охолодженого до -78 °C додавали н-бутиллітій (2.5М в гексані, 0.39 мл, 0.97 ммоль) по краплинах протягом 1 хвилини. Отриманий літій-фуранат перемішували при -78 °C 2 години і потім додали його до суспензії SO3·NMe3 (135 мг, 0.97 ммоль) в 3 мл абсолютного ТГФ (5 хвилин). Реакційну суміш перемішували при -78 °C ще 2 години і дуже повільно розігріли до 0 °C за період в 14 годин, 2 UA 104402 U 5 10 15 20 25 30 35 40 45 потім додали 50 мл води і 50 мл діетилового етеру. 3-Бромо-5-етил-2-гексилфуран (V), який не прореагував, екстрагували діетиловим етером (3×50 мл), екстракт висушували сульфатом натрію та випаровували у вакуумі (25 °C, 3 Тоrr). При цьому виділено 38 % (94 мг) вихідної сполуки (V). Водний шар випаровували (40 °C, 10 Тоrr) до утворення жовтого твердого залишку (~250 мг). Продукт промивали ацетонітрилом з декантацією (4×4 мл) для очищення від комплексу SO3·NMe3, при цьому виділено літієву сіль "HEFS" масою 50 мг (31 %), т.пл. >360 °C (добре розчинна у воді, нерозчинна в ацетонітрилі, диметилсульфоксиді та диметилкетоні), Rf -1 старт (діетиловий етер), ІЧ-спектр νmax/см (твердий зразок): 3459, 1613, 1421, 1098, 1007, 634, 1 610. Спектр ЯМР Н (200 МГц, D2O), δ, м.ч.: 0.82 (3Н, м, СН3 гексильної групи), 1.10-1.33 (7Н, м, СН3 етильної групи + 2СН2 гексильної групи), 1.55 (2Н, м, СН2 гексильної групи), 2.13 (2Н, м, СН2 гексильної групи), 2.56 (2Н, м, СН2 гексильної групи), 2.83 (2Н, м, СН2 етильної групи), 6.13 4 + (1Н, с, Н ). HRMS (негативні іони) Знайдено: 259.1002; C12H19O4S [(М-Н )] обчислено 259.1010. Для отримання 5-етил-2-гексилфуран-3-сульфокислоти "HEFS" (І) її літієву сіль пропускали -1 через іонообмінну смолу за стандартною процедурою. ІЧ-спектр νmax/см (твердий зразок): 1 3425, 1369. Спектр ЯМР Н (400 МГц, CD3OD), δ, м.ч.: 0.90 (3Н, т, J7.5 Гц), 1.20 (3Н, т, J7.5 Гц), 1.26-1.40 (6Н, м), 1.65 (2Н, кв, J 7.5 Гц), 2.57 (2Н, кв.д, J7.5, 1.0 Гц), 2.87 (2Н, т, J7.5 Гц), 6.14 (1Н, 13 т, J 1.0 Гц). Спектр ЯМР С (100 MHz, CD3OD), δ, м.ч.: 12.5, 14.4, 22.0, 23.7, 27.6, 29.4, 30.1, + 32.8, 105.3, 126.3, 154.8, 156.0. HRMS (негативні іони) Знайдено 259.1009; C12H19O4S [(М-Н )] обчислено 259.1010. Проведення останньої реакції на протязі 12 годин призводить до значної втрати продукту (вихід менше 30 %), а продовження сульфування 24 години і більше створює умови для руйнування отриманого продукту, що також знижує практичний вихід. 1 Спектри ЯМР Н реєстрували на радіоспектрометрі Bruker AVN 400 (робоча частота 1 13 генератора 400 МГц для ядер Н та 100 МГц для ядер С) для розчинів сполук в дейтерохлороформі, важкій воді та дейтерометанолі. Проходження реакцій та чистоту синтезованих сполук контролювали методом ТШХ на пластинах Silufol UV-254, проявник розчин марганцевокислого калію. До значної переваги запропонованого способу синтезу належить його синтетична універсальність, що значно розширяє можливості синтетичних підходів до несиметричних та симетричних 2,5-діалкілфурансульфокислот. Джерела інформації: 1. Wong H.N.C., Hou X.L., Yeung K.S., Huang H., in Five-Membered Heterocycles: Furan, eds. J. Alvarez-Builla, J. J. Vaquero, J. Barluenga, Wiley-VCH: Weinheim, 2011. - Vol. 1.-P. 533-692. 2. Japanese patent JP63005088 (1988) Isolation of 2-ethyl-5-hexylfuran-3-sulfonic acid from earthworms as a pharmaceutical / Yoneda T, Soeda M, Suzuki Y, Moriyama S, Hiroyuki S, Mihara H., Japanese Patent Office, Tokyo, Japan. 3. Metabonomic assessment of toxicity of 4-fluoroaniline, 3,5-difluoroaniline and 2-fluoro-4methylaniline to the earthworm Eisenia veneta (Rosa): identification of new endogenous biomarkers / Bundy J.G., Lenz E.M., Bailey N.J., Gavaghan C.L., Svendsen C, Spurgeon D., Hankard P.K., Osborn D., Weeks J.M., Trauger S.A., Speir P., Sanders I., Lindon J.C., Nicholson J.K., Tang H. // Environ. Toxicol. Chem.-2002. - Vol. 21, № 9.-P. 1966-1972. 4. Unique metabolites protect earthworms against plant polyphenols / Liebeke M., Strittmatter N., Fearn S., Morgan A.J., Kille P., Fuchser J., Wallis D., Palchykov V., Robertson J., Lahive E., Spurgeon D.J., McPhail D., Takats Z., Bundy J.G. // Nature Commun.-2015. - Vol. 6, accepted paper. 5. The sulfonation of furan and furan homologs. Preparation of furansulfonamides / Scully J.F., Brown E.V. // J. Org. Chem.-1954. - Vol. 19, № 6. - P. 894-901. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 50 Спосіб синтезу природної речовини 5-етил-2-гексилфуран-3-сульфокислоти, загальної формули C12H20O4S, O HO O S O HEFS 3 UA 104402 U з використанням сульфуючого реагенту, який відрізняється тим, що на ключовій стадії як сульфуючий реагент використовують 1 еквівалент комплексу триметиламін-оксид сірки(VІ) в абсолютному тетрагідрофурані в кріогенних умовах протягом 12-24 годин. Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 307/00
Мітки: синтезу, природної, hefs, спосіб, речовини
Код посилання
<a href="https://ua.patents.su/6-104402-sposib-sintezu-prirodno-rechovini-hefs.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу природної речовини “hefs”</a>
Попередній патент: Спосіб переміщення тягово-транспортної системи
Наступний патент: Бічна рама триелементного візка з діагональними зв’язками
Випадковий патент: Спосіб протипожежного захисту резервуара для транспортування та(або) зберігання вогненебезпечної рідини










