2-(фтороалкіл)циклопропанаміни
Номер патенту: 116013
Опубліковано: 25.01.2018
Автори: Клюковський Денис Вікторович, Онисько Петро Петрович, Пустовіт Юрій Митрофанович, Бездудний Андрій Васильович
Формула / Реферат
(2-(Фтороалкіл)циклопропіламіни (1) загальної формули:
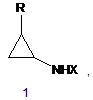
де
R=CHF2, CH2F;
Х= Н, COOBu-t, COOCH2Ph, COCF3.
Текст
Реферат: Винахід належить до органічної хімії, а саме (фтороалкіл)циклопропіламінів (1) загальної формули: до раніше невідомих 2 R NHX , 1 де R=CHF2, CH2F; Х=H, COOBu-t, COOCH2Ph, COCF3. Виходячи з комерційно доступного етил-2-нітроциклопропілкарбоксилату у результаті три- або чотиристадійного перетворення одержано 2-(фторометил)та 2(дифторометил)циклопропіламіни та їх похідні. UA 116013 C2 ОПИС ДО ПАТЕНТУ НА ВИНАХІД (12) UA 116013 C2 R NHX , 1 UA 116013 C2 Винахід належить до органічної хімії, а (фтороалкіл)циклопропанамінів загальної формули 1: саме до нових перспективних 2 R NHX , 1 5 10 15 20 25 30 35 40 45 50 де R-CHF2, CH2F; Х= Н, COOBu-t, COOCH2Ph, COCF3. Вказані сполуки, їх властивості і застосування у літературі та патентних виданнях не описані. Речовини даного типу поєднують у своїй структурі амінофункцію, фтороалкільну групу та циклопропанове ядро і можуть знайти застосування в органічному синтезі та дизайні нових ефективних біомедичних препаратів. Аміноциклопропани широко використовуються в органічному синтезі як реакційноздатні будівельні блоки для одержання різноманітних сполук та у дизайні нових ефективних біологічно активних речовин. Фрагмент аміноциклопропану є складовою частиною цілого ряду біомедичних препаратів, в тому числі - антибіотиків (ципрофлоксацин), антибактеріальних та антимікробних засобів (моксифлоксацин, геміфлоксацин), селективних інгібіторів ВІЛ-протеази (абакавір), засобів захисту рослин (циромазин), тощо [1, 2]. Відомо, що заміна в молекулі одного або декількох атомів водню на фтор або введення трифторометильної групи замість метальної приводить, як правило, до покращення фармакодинамічних та фармакокінетичних характеристик з одночасною зміною електронних, стеричних та ліпофільних параметрів, а також підвищує стійкість до метаболізму [3, 4]. З цієї причини синтез селективно фторованих аналогів біологічно активних сполук є одним із перспективних сучасних підходів до пошуку ефективних біомедичних препаратів. Таким чином, синтез нових аміноциклопропанів з фтороалкільними групами відкриває широкі можливості для одержання високоефективних діючих речовин. Найближчим аналогом сполуки, що заявляється, є синтезований раніше (2трифторометил)циклопропіламін [5], який використовується для синтезу БАС. (2-Дифторометил) та (2-фторометил)циклопропіламіни у патентній та науковій літературі не зустрічаються, властивості їх не відомі. Задачею винаходу є пошук нових похідних та зручних і ефективних способів одержання 2(поліфторометил)циклопропіламінів (1). Одержання зазначених сполук досягається у результаті тристадійного (для 1b) чи чотиристадійного (1а) синтезу. На першій стадії одержання 1а комерційно доступний етил-2нітроциклопропілкарбоксилат відновлюють боргідридом натрію у присутності хлориду алюмінію з утворенням (2-нітроциклопропіл)метанолу. Останній піддають окисненню за методом Сверна (оксалілхлорид, диметисульфоксид) з утворенням 2-нітроциклопропілкарбальдегіду. На третій стадії синтезований альдегід взаємодією з діетиламініносірки трифторидом перетворюють у 1(дифторометил)-2-нітроциклопропан, який відновлюють у атмосфері водню за присутності каталітичної кількості 10 % паладію на вуглеці. У випадку монофторпохідних (Іb) (2нітроциклопропіл)метанол обробляють діетиламініносірки трифторидом з подальшим відновленням у атмосфері водню за присутності каталітичної кількості 10 % паладію на вуглеці та 95 % надлишку Вос-ангідриду. Загальний вихід цільових продукту у чотиристадійному синтезі складає 28-30 %, а його чистота перевищує 95 %. Одержані результати не є заздалегідь передбачуваними, оскільки, по перше, селективне відновлення карбетоксильної групи сполуки до спиртової у присутності електроноакцепторної нітрогрупи часто є малоефективним; по друге, неочевидним було збереження циклопропанового циклу при каталітичному гідруванні; по третє, фторування карбонільної та спиртової груп 2-нітроциклопропанів було раніше невідомим. Насправді ж в запропонованій схемі процеси відновлення естерної функції до спиртової групи, наступне окиснення останньої до відповідного циклопррпілальдегіду та його фторування здійснюються хемоселективно і приводять з високим виходом до цільового продукту. Склад та будова одержаних речовин підтверджена даними елементного аналізу та спектрами ЯМР. Винахід ілюструється схемою хімічних перетворень та прикладами одержання цільових (2дифторометил)- (Іа) та (2-фторометил)циклопропіламінів (Іb). 1 UA 116013 C2 NO2 NO2 O NO2 NaBH4, AlCl3 NO2 (COCl)2, DMSO O O Et2NSF3 F O F H2, Pd/C(10%) Et2NSF3 NO2 H2, Pd/C(10%), Boc2O HN boc NH2 F F F F Ib Ia Cхема 1 5 10 15 20 25 30 35 Синтез 2-(дифторометил)циклопропіламіну (la) Приклад 1. (2-Нітроциклопропіл)метанол Етил-2-нітроциклопропілкарбоксилат 1 (29,4 г, 0,203 моль) розчиняли у 400 мл безводного диметоксиетану. Хлорид алюмінію (22,97 г, 0,172 моль) додавали до утвореного розчину за кімнатної температури протягом 30 хв. Боргідрид натрію (18,81 г, 0,495 моль) додавали порційно так, щоб температура реакційної суміші не перевищувала 30 °C. Суміш перемішували при кімнатній температурі ніч, після чого повільно додавали 15 % розчин хлориду натрію (100 мл). Витримували при кімнатній температурі 3 год. Осад, що утворюється, відфільтровували та промивали ефіром (200 мл). Об'єднаний фільтрат випарювали за зниженого тиску. Залишок екстрагували ефіром. Органічний шар сушили над Na 2SO4, розчинник видаляли за зниженого тиску, залишок переганяли у вакуумі масляного насосу. Одержали 15,9 г (2нітроциклопропіл)метанолу [6] (вихід 67 %). Т. кип. 57-59 °C (0,12 мм рт. ст.). Приклад 2. 2-Нітроциклопропанкарбальдегід Реакцію проводили у атмосфері аргону. Розчин безводного диметилсульфоксиду (17,83 г, 228,5 ммоль) у 80 мл абсолютного хлористого метилену повільно додавали до розчину оксалілхлориду (15,35 г, 121,8 ммоль) у сухому хлористому метилені (200 мл) при -80 - -90 °C. Розчин нітроспирту (9,2 г, 78,6 ммоль) у 200 мл метиленхлориду повільно додавали до реакційної суміші при температурі -60-70 °C. Суміш перемішували протягом 1 год., поступово підвищували температуру, після чого при -40 °C повільно, протягом 15 хв. додавали триетиламін (32 г, 316,8 ммоль) Реакційну суміш відігрівали до кімнатної температури та додавали 80 мл дистильованої води. Органічний шар промивали 15 % НСl (2×80 мл), водою (5×100 мл), сушили над Na2SO4, розчинники видаляли за зниженого тиску. Залишок переганяли у вакуумі водоструминного насосу. Одержали 6,8 г (вихід 75 %) 2нітроциклопропанкарбальдегіду, Т. кип. 104-106 °C (16 мм рт. ст.). 1 HNMR(300 MHz, CDCl3): 1,78 (q, 1H, СHН); 2,16 (m, 1H, СHН); 3.10 (m, 1H, СHСНО); 4,66 3 (m, 1H, СHNО2); 9,71 (d, 1H, СHО, JHH=1,8 Hz). Приклад 3. 1-(Дифторометил)-2-нітроциклопропан Нітроальдегід (1,67 г, 14 ммоль) розчиняли у 20 мл безводного хлористого метилену. Розчин охолоджували до -20 °C та повільно, по краплях, додавали розчин 4,56 г діетиламініносірки трифториду (28 ммоль, 2 екв.) у 20 мл хлористого метилену. Суміш відігрівали до кімнатної температури та залишали на ніч. Реакційну масу обробляли насиченим розчином NaHCO 3 (50 мл). Органічний шар промивали водою (3×50 мл), ропою (50 мл), висушували над Na 2SO4, розчинники видаляли за зниженого тиску. Залишок переганяли у вакуумі водострумінного насосу. Одержали 1,13 г (вихід 59 %), Т. кип. 56-58 °C (14 мм рт. ст.). 1 Н NMR (500 MHz, CDC13, TMS), , ppm: 1,40 (m, 1Н, СHН); 1,93 (m, 1H, СHН); 2,51 (m, 1H, 2 3 СHСF2Н); 4,46 (m, 1H, CHNO2); 4,97 (dt, JHF=56,6 Hz, JHH=2,3Hz, 1H, CF2H) 2 UA 116013 C2 19 2 F NMR (188 MHz, CDCl3), d, ppm: -120,51 (d, JFH=-57 Hz) 3 2 C NMR (125,8 MHz, CDCl3) : 12,54 (t, JCF=5 Hz, CH2); 25,36 (t, JCF=27 Hz, CHCH2F); 54,84 1 (s CHNO2); 111,20 (t, JCF=241 Hz, CHO). Приклад 4. 2-(Дифторометил)циклопропіламіну гідрохлорид 1,1 г 1-(дифторометил)-2-нітроциклопропану (8 ммоль) розчиняли у 25 мл сухого метанолу та додавали 0,3 г 10 % паладію на вугіллі. З системи для відновлення видаляли повітря та перемішували у атмосфері водню (1,1 атм) 12 год. Видаляли залишки водню, каталізатор відфільтровували, промивали його 5 мл метанолу. Об'єднані фільтрати насичували безводним хлороводнем. Метанол випарювали, залишок кристалізували з ацетонітрилу. 1 Н NMR (300 MHz, CDCl3) : 1,02 (m, 1H, СНСH2СН); 1,21 (m, 1H, СНСH2СН); 2,79 (m, 1H; 2 3 CHCHF2); 3,44 (m, 1H, CHNH2*HCl); 5,89 (td, 1H, JHF=56 Hz, JHH=5 Hz, 1H, CHF2). 19 F NMR (188 MHz, CDCl3) : - 113,26 (ABX) 13 2 C NMR (125 MHz, CDC13) : 6,62 (m, CH2); 19,09 (t, JCF=28 Hz, CHCF2H); + 2 24,78 (m, CHNH3 ); 116,44 (t, JCF=236 Hz, CF2H). Синтез 2-(фторометил)циклопропіламіну (16) Приклад 5. 1-(Фторометил)-2-нітроциклопропан (2-Нітроциклопропіл)метанол 8,76 г (0,075 моль) розчиняли у 100 мл безводного хлористого метилену. Розчин охолоджували до -20 °C та повільно додавали 13.6 г діетиламініносірки трифториду (0,09 моль, 1,2 екв.). Суміш перемішували при кімнатній температурі ніч, охолоджували до 0 °C та обробляли насиченим розчином NaHCO3 (200 мл) при інтенсивному перемішуванні. Органічний шар відділяли, промивали водою (3*100 мл), розсолом (100 мл), сушили над Na2SO4 після чого розчинники видаляли за зниженого тиску. Після перегонки у вакуумі водоструминного насосу одержали 5,7 г 1-(фторометил)-2-нітроциклопропан (Вихід 64 %). Т. кип. 68-70 °C(14 мм рт. ст.) 1 Н NMR (300 MHz, CDCI3) : 1,34 (m, 1Н, ); 1,56 (m, 1Н, СHН); 1,92 (m, 1H, СНH); 2,40 (m, 1Н, 1 1 19 1 СHСН2F), 4,36 (АВ system, JFH=86,9 Hz; JHH F NMR (188 MHz, CDCl3) : - 221,46 (td, JFH=47 2 13 3 2 Hz, JFH=11 Hz) C NMR (125,8 MHz, CDCl3) : 14,59 (d, JCF=7 Hz, CH2CHNO2); 24,12 (d, JCF=34 3 1 Hz, CHCH2F); 57,28 (d, JCF=5Hz, CHNO2); 81,34 (d, JCF=170 Hz) Приклад 6. m-Бутил[2-(фторометил)циклопропіл]карбамат Розчин 1-(фторометил)-2-нітроциклопропану (0,476 г, 4 ммоль) та Вос2О (1,04 г, 7,8 ммоль, 1,95 екв) в 20 мл сухого метанолу перемішували у атмосфері водню у присутності каталітичної кількості 10 % Pd/C (0,2 г) протягом 24 год. до моменту поглинання розрахованої кількості водню. Каталізатор відфільтровували, розчинник видаляли за зниженого тиску при температурі не вище 30 °С. Залишок хроматографували. (ЕtO Ас/гексан 1:4, Rf 0,17-0,37) Вихід 66 %, Т. топ. 57-59 °C. 1 Н NMR (300 MHz, CDCl3) : 0,90 (q, 1Н, СHН); 1,17 (m, 1Н, СHН); 1,50 (s, 9Н, t-Bu); 1,63 (m, 1 1 1Н, СHСН2Р); 2,76 (m, 1Н, CHN); 4,33 (dd, JHF=48 Hz, JHF=6,8 Hz, CH2F); 8,12 (br s, 1H, NOH) 19 1 2 F NMR (188 MHz, CDCl3) : - 216,59 (td, JFH=51 Hz, JFH=8 Hz) 13 3 2 C NMR (125,8 MHz, CDCl3) : 11,13 (d, JCF=6 Hz, CH2CHN); 20,67 (d, JCF=25 Hz, CHCH2F); 3 1 27,86 (s, CH3), 35,86 (d, JCF=9 Hz, CHN); 81,75 (s, C(CH3)3); 83,93 (d, JCF=168 Hz); 157,55 (s, C=O). 13 5 10 15 20 25 30 35 40 45 50 55 Джерела інформації:: 1. Яковлев В. П. Ципрофлоксацин - высокоэффективный препарат из групы фторхинолонов // Антибиотики и химиотерапия, 1997, № 11, С. 69-71. 2. Daluge S.M, Good S.S, Faletto M.B et al. 1592U89, a novel carbocyclic nucleoside analog with potent, selective anti-human immunodeficiency virus activity. Antimicrob Agents Chemother., 1998, 41, P. 1082-93. 3. M€uller K, Faeh C, Diederich F. Fluorine in pharmaceuticals: looking beyond intuition. Science, 2007, 317, P.1881. 4. J. P. Be'gue', D. Bonnet-Delpon, Bioorganic and Medicinal Chemistry of Fluorine, Wiley, Hoboken, NJ, 2008. 5. Bezdudny, A.V., Klukovsky, D., Simurova, N. at al. Multigram synthesis of trans-2(trifluoromethyl)cyclo-propanamine. Synthesis, 2011, 1, P. 0119-0122. 6. Sohn, Stephanie S.; Bode, Jeffrey W. N-Heterocyclic Carbene Catalyzed C-C Bond Cleavage in Redox Esteri-fications of Chiral Formylcyclopropanes. Angew. Chem. (Intern. Edit.), 2006, 45, P. 6021-6024. 3 UA 116013 C2 ФОРМУЛА ВИНАХОДУ 2-(Фтороалкіл)циклопропіламіни (1) загальної формули: 5 R NHX , 1 де R=CHF2, CH2F; Х=Н, COOBu-t, COOCH2Ph, COCF3. 10 Комп’ютерна верстка В. Мацело Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07C 13/04, C07C 211/35, C07C 211/34, C07C 13/28, C07C 211/33
Мітки: 2-(фтороалкіл)циклопропанаміни
Код посилання
<a href="https://ua.patents.su/6-116013-2-ftoroalkilciklopropanamini.html" target="_blank" rel="follow" title="База патентів України">2-(фтороалкіл)циклопропанаміни</a>
Попередній патент: N-, c-дизаміщені азоли для боротьби з нематодними шкідниками
Наступний патент: Гербіцидні композиції, які містять 4-аміно-3-хлор-5-фтор-6-(4-хлор-2-фтор-3-метоксифеніл)піридин-2-карбонову кислоту або її похідне і фунгіциди
Випадковий патент: Спосіб діагностики розвитку остеопорозу








