Спосіб моделювання дозованої опікової рани шкіри ііі ступеня лабораторним щурам
Номер патенту: 118592
Опубліковано: 10.08.2017
Автори: Олешко Тетяна Миколаївна, Курганська Вікторія Олександрівна, Гапченко Андрій Валерійович, Погорєлов Максим Володимирович, Олешко Олександр Миколайович, Ткаченко Юлія Олександрівна, Дейнека Володимир Миколайович
Формула / Реферат
1. Спосіб моделювання дозованої опікової рани шкіри III ступеня лабораторним щурам, що включає знеболювання експериментальної тварини шляхом дії ін'єкційного кетамінового наркозу кількістю 10 мг на 1 кг маси тварини з наступною підготовкою та формуванням попередньо поголеної ділянки шкіри потрібної площі в міжлопатковій зоні тварини, фіксацію тварини до предметного столика, оснащеного штативом з насадженою на нього пластинкою з сформованим отвором для додаткової фіксації тварини, проведення опусканням пластинки, що вільно ковзає по осі штативу, додаткової фіксації потрібної ділянки шкіри тварини, оброблення попередньо поголеної шкіри тварини 40 % розчином етилового спирту та створення опікової рани ділянки шкіри, який відрізняється тим, що опікову рану ділянки шкіри створюють шляхом нанесення на підготовлену поголену шкіру тварини хімічного опіку, для чого використовують одноразовий шприц з голкою, заповнений 10 % азотною кислотою, де циліндр шприца фіксують в верхній частині штативу предметного столика за допомогою тримача, з наступним накладанням на шкіру тварини через отвір пластини додаткової фіксації ватного диска, і для контакту голки шприца та ватного диска, площа якого дорівнює площі для хімічного опіку, здійснюють опускання тримача, що фіксує циліндр шприца, виконують натискання на поршень шприца з витисканням 0,5 мл азотної кислоти через голку шприца на ватний диск для забезпечення безпосереднього контакту діючої речовини на шкіру тварини і протягом 5 секунд витримують ватний диск на шкірі тварини.
2. Спосіб за п. 1, який відрізняється тим, що пластину з попередньо сформованим отвором для додаткової фіксації ділянки шкіри тварини виконують товщиною 5 мм.
Текст
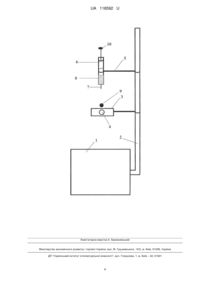
Реферат: Спосіб моделювання дозованої опікової рани шкіри III ступеня лабораторним щурам включає знеболювання експериментальної тварини шляхом дії ін'єкційного кетамінового наркозу кількістю 10 мг на 1 кг маси тварини з наступною підготовкою та формуванням попередньо поголеної ділянки шкіри потрібної площі в міжлопатковій зоні тварини, фіксацію тварини до предметного столика, оснащеного штативом з насадженою на нього пластинкою з сформованим отвором для додаткової фіксації тварини, проведення опусканням пластинки, що вільно ковзає по осі штативу, додаткової фіксації потрібної ділянки шкіри тварини, оброблення попередньо поголеної шкіри тварини 40 % розчином етилового спирту та створення опікової рани ділянки шкіри. Опікову рану ділянки шкіри створюють шляхом нанесення на підготовлену поголену шкіру тварини хімічного опіку, для чого використовують одноразовий шприц з голкою, заповнений 10 % азотною кислотою, де циліндр шприца фіксують в верхній частині штативу предметного столика за допомогою тримача, з наступним накладанням на шкіру тварини через отвір пластини додаткової фіксації ватного диска, і для контакту голки шприца та ватного диска, площа якого дорівнює площі для хімічного опіку. Здійснюють опускання тримача, що фіксує циліндр шприца, виконують натискання на поршень шприца з витисканням 0,5 мл азотної кислоти через голку шприца на ватний диск для забезпечення безпосереднього контакту діючої речовини на шкіру тварини і протягом 5 секунд витримують ватний диск на шкірі тварини. UA 118592 U (12) UA 118592 U UA 118592 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до експериментальної медицини та біології, зокрема нормальної та патологічної анатомії, фізіології, експериментальної хірургії, гістології, та може бути використана для моделювання хімічних опіків шкіри III ступеня в умовах експерименту на лабораторних тваринах та для розробки способів лікування хімічних опіків шкіри. Опіки є найбільш поширеними ушкодженнями в практиці невідкладних станів. Їх частота становить від 5,6 до 12 % у структурі всіх видів травм. Поширеність опіків різної етіології - від 1:10 000 до 1:1000 серед популяції, смертність від цього виду ушкоджень становить від 1,5 до 5,9 %. Хімічні речовини викликають від 2 до 11 % всіх опіків і спричиняють як мінімум 30 % опікових смертей, пов'язаних з ними [1]. Хімічні опіки можуть бути викликані більш ніж 25 000 речовинами, більшість з яких є сильнодіючими лугами (55 %) або кислотами (26 %). Найбільш уразливими при цьому є діти до 14 років та особи старше 55 років. В Україні частота опіків у дітей становить 14,0 на 10 000 дитячого населення. При цьому через незрілість тканинних структур та недосконалість репаративних механізмів навіть незначні за площею опіки можуть призводити до тяжких ускладнень. Подібні наслідки мають опіки і у хворих похилого віку через зменшення регенераторного потенціалу шкіри. Тому розроблення нових біосумісних матеріалів для використання під час лікування хімічних ушкоджень шкіри та їх дослідження на експериментальних моделях є актуальними медикобіологічними проблемами. Відомий спосіб моделювання хімічного опіку трубчатого органа, що реалізується за допомогою пристрою для експериментального моделювання хімічного опіку стравоходу, який містить дві телескопічні трубки та два роздувних балони, які на них розташовані, один з балонів розташовано на дистальному кінці внутрішньої трубки, відповідно до корисної моделі, другий балон розташовано на дистальному кінці зовнішньої трубки, при цьому внутрішня трубка заглушена і на її циліндричній поверхні виконана перфорація [2]. Недоліком даного способу моделювання опіку є неможливість створення опіку шкіри. Відомий спосіб моделювання опікової травми шкіри IIIб ст. шляхом моделювання термічного опіку на заздалегідь підготовлену ділянку шкіри тварини після її знеболення [3]. При цьому експеримент на лабораторних тваринах реалізується під контролем тепловізора, де на певну 2 ділянку шкіри накладають мідну пластинку площею 400 мм і товщиною 1 мм, з якою виконується безпосередній контакт світловода лазера з довжиною хвилі 1064 нм та потужністю випромінення на торці 8 Вт при постійному режимі нагріву 220 °C протягом 2 с. Недоліком даного способу є лазерна дія на шкіру лабораторного щура, економічна недоцільність використання цінної лазерної установки та тепловізора, а також небезпека для здоров'я людини при роботі з лазерними пристроями. Іншим, сучасним способом моделювання опікової рани шкіри IIIб ст., є використання електричного паяльника, жало якого закінчується мідною пластинкою, що нагріта до температури 250 °C та контактно впливає на шкіру протягом 2 секунд [4], що дозволяє швидко відтворити опікову рану точно заданої площі і глибини ураження шкіри експериментальної тварини. Даний спосіб є найбільш близьким до того, що заявляється, за технічною суттю та результатом, який може бути досягнутим, тому його вибрано за прототип. Недоліком даного способу є обмежене моделювання опіків шкіри, що не дозволяє стандартизувати експеримент, чітко дотримуючись при цьому заданих критеріїв площі та глибини опіку для зменшення тяжкості травми з метою продовження періоду життя тварин для нагляду за перебігом процесу опіку шкіри. Все це негативно сприяє розробці нових методів при лікування цього захворювання. В основу корисної моделі поставлена задача підвищення ефективності моделювання опікової рани, а саме хімічного опіку, шляхом дотримання заданих критеріїв площі та глибини ранових дефектів, що значно підвищить період життя дослідних тварин, та сприятиме за рахунок нагляду за перебігом процесу хімічного опіку шкіри тварин розробці нових методів лікування цього захворювання. Поставлена задача вирішується тим, що у відомому способі моделювання дозованої опікової рани шкіри III ступеня лабораторним щурам, що включає знеболювання експериментальної тварини шляхом дії ін'єкційного кетамінового наркозу у кількості 10 мг на 1 кг маси тварини з наступною підготовкою та формуванням попередньо голеної ділянки шкіри потрібної площі в міжлопатковій зоні тварин, фіксацію тварини до предметного столика, оснащеного штативом з насадженою на нього пластиною з сформованим отвором для додаткової фіксації тварини, проведення опусканням пластини, що вільно ковзає по осі штативу, додаткової фіксації потрібної ділянки шкіри тварини, оброблення попередньо голеної шкіри 40 % розчином етилового спирту та створенням опікової рани ділянки шкіри, згідно з корисною моделлю опікову рану ділянки шкіри створюють шляхом нанесення на підготовлену 1 UA 118592 U 5 10 15 20 25 30 35 40 45 50 55 60 поголену шкіру тварини хімічного опіку, для чого використовують одноразовий шприц з голкою, заповнений 10 % азотною кислотою, де циліндр шприца фіксують у верхній частині штативу предметного столика за допомогою тримача, з наступним накладанням на шкіру тварини через отвір пластини додаткової фіксації ватного диска, і для контакту голки шприца та ватного диска, площа якого дорівнює площі для хімічного опіку, здійснюють опускання тримача, що фіксує циліндр шприца, виконують натискання на поршень шприца з витисканням 0,5 мл азотної кислоти через голку шприца на ватний диск для забезпечення безпосереднього контакту діючої речовини на шкіру тварини і протягом 5 секунд витримують ватний диск на шкірі тварини. Окрім цього пластину, з попередньо сформованим отвором для додаткової фіксації ділянки шкіри тварини, виконують товщиною 5 мм. Використання способу, що заявляється, з усіма суттєвими ознаками, включаючи відмінні, дозволяє проводити моделювання хімічної травми шкіри лабораторним тваринам в короткі строки та зменшити тяжкість травми з метою продовження періоду життя тварин для нагляду за перебігом репаративних процесів, а також стандартизувати моделювання хімічних опіків згідно заданих критеріїв площі та глибини ранових дефектів. Таким чином, спосіб що заявляється, дозволяє вирішити поставлені задачі. Графічна частина способу пояснює суть корисної моделі, де на кресленні показаний комплекс для моделювання хімічного опіку шкіри. Комплекс включає: предметний столик 1 зі штативом 2, на який насаджується пластинка 3 додаткової фіксації з отвором 4 та тримач 5, в якому фіксується циліндр одноразового шприца 6 з голкою 7. Циліндр одноразового шприца заповнений 10 % азотною кислотою 8, що через голку 7 витискається на ватний диск 9, котрий безпосередньо контактує з шкірою тварини, шляхом натискання на поршень 10 одноразового шприца 6. Проведення моделювання дозованого хімічного опіку шкіри лабораторним щурам з урахуванням вимог стандартизації й дотриманням заданих критеріїв площі та глибини ранових дефектів здійснюються наступним чином. Під дією ін'єкційного кетамінового наркозу (10 мг на 1 кг маси тварини) лабораторну тварину 2 (щур) голять на спині в міжлопатковій зоні, формуючи квадратну ділянку площею 9 см , фіксують до предметного столика 1 за чотири кінцівки. Додаткову фіксацію потрібної ділянки шкіри забезпечують шляхом опускання пластинки 3 (товщина - 0,5 см), що вільно ковзає по осі 2 штативу 2 (висота - 60 см), площею 20 см (4 × 5 см) та масою 0,5 кг, в якій попередньо був сформований отвір 4 діаметром 1,6 см. Далі, як видно зі схеми, попередньо поголену шкіру обробляють 40 % розчином етилового спирту з метою профілактики бактеріальної контамінації. Контактно впливаючи на шкіру 10 % азотною кислотою 8, що знаходиться в циліндрі одноразового шприца 6, який зафіксовано на штативі 2 за допомогою тримача 5, після 2 накладання ватного диску 9 площею 1,76 см (діаметр 1,5 см) і товщиною 0,1 см на шкіру тварини через отвір 4 пластинки додаткової фіксації 3, тримач, що фіксує циліндр шприца, опускають і здійснюють таким чином контакт голки 7 шприца та ватного диска, шляхом натискання на поршень 10 шприца витискають 0,5 мл соляної кислоти через голку шприца на ватний диск, забезпечуючи безпосередній контакт діючої речовини та шкіри тварини, витримують ватний диск на шкірі тварини протягом 5 секунд. У результаті даної експозиції створюється хімічний опік всіх шарів шкіри до підшкірної клітковини (опік III ступеня) з площею, яка дорівнює площі ватного диска та в залежності від мети дослідження може бути змінена. Діюча речовина та її концентрація, а також експозиція підібрані експериментально. Контроль глибини ураження здійснюється гістологічно в день виведення тварини з експерименту. Хімічний опік шкіри отриманий вище описаним способом, супроводжується розвитком сухого коагуляційного некрозу шкіри без загибелі поверхневого шару м'язів. Чітка межа некрозу починає простежуватися з 5 доби. Шкіра в ділянках некрозу повністю втрачає свою структуру, колагенові волокна, зібрані у великі пласти, фарбуються основними барвниками [5]. Волосяні цибулини частково збережені, а загиблі являють собою безструктурні маси, забарвлені основними барвниками (гематоксилін). Поверхневі м'язи зберігають структуру і характерне для них забарвлення, чітко видно ядра міосимпластів. Отримана гістологічна картина дозволяє віднести хімічний опік до III ступеня, який у лабораторних щурів загоюється самостійно за допомогою крайової та спонтанної епітелізації [6]. Запропонований спосіб є детальним та точним, дозволяє зменшити тяжкість травми та продовжити період життя тварин для нагляду за перебігом репаративних процесів, ліквідувати дію сторонніх чинників, як додаткового навантаження на організм лабораторної тварини (дія лазера), а також стандартизувати моделювання хімічних опіків, згідно із заданими критеріями площі та глибини ранових дефектів. 2 UA 118592 U 5 10 15 20 25 30 Таким чином, запропонований спосіб моделювання хімічних опіків простий у технічному виконанні, економічно доцільний і доступний, ліквідує лазерну дію на шкіру лабораторної тварини, дозволяє стандартизувати експеримент, чітко дотримуватись заданих критеріїв площі та глибини опіку і може застосовуватися в експериментальній медицині та біології, зокрема нормальній та патологічній анатомії, фізіології, експериментальній хірургії, гістології та для моделювання хімічних опіків шкіри різного ступеня та площі в умовах експерименту на лабораторних тваринах з метою розробки нових способів лікування хімічних опіків шкіри. За допомогою запропонованого способу проведено експеримент на 60 білих лабораторних щурах самцях, отриманих з віварію Медичного інституту Сумського державного університету. Джерела інформації: 1. Hardwicke, J; Hunter, T; Staruch, R; Moiemen, N (2012 May). Chemical bums-an historical comparison and review of the literature… Burns: journal of the International Society for Burn Injuries 38 (3). - С. 383-7. 2. Пат. № 42792 Україна, МПК А61В 17/00 (2006.01). Пристрій для експериментального моделювання хімічного опіку трубчатого органа / Бойко В. В., Савві С. О., Субота Є. О [та ін.]; патентовласник Державна установа "ІНСТИТУТ ЗАГАЛЬНОЇ ТА НЕВІДКЛАДНОЇ ХІРУРГІЇ АКАДЕМІЇ МЕДИЧНИХ НАУК УКРАЇНИ". - № u 200815301 (22) 30.12.2008; заявл. 27.07.2009; опубл. 27.07.2009, Бюл. № 14. 3. Ф.Е. Шин, П.И. Стрельников, Е.Ф. Странадко. Фото динамическая терапия экспериментальных ожоговых ран//Лазерная медицина. - 2009. - № 13. - С. 55-60. 4. Пат. № 89985 Україна, МПК G09B 23/28 (2006.01). Спосіб моделювання дозованого термічного опіку шкіри лабораторним щурам / Олешко О.М., Корнієнко В.В., Ткаченко Ю.А. [та ін.]; патентовласник Сумський державний університет. - № u 2013 13489; заявл. 20.11.13; опубл. 12.05.14, Бюл. № 9. 5. И.П. Богатова, А.М. Паничев, В.П. Кокшарова. Структура эндотелиоцитов лимфатических капилляров кожи в условиях коррекции раневого процесса при термическом ожоге // Бюллетень СО РАМН. - 2005. - № 1(115). - С.37-42. 6. В.В. Болтовская. Патоморфология раневого процесса в зоне глубокого ожога кожи в условиях применения низкоинтенсивного электромагнитного излучения // Автореф. дис. канд. мед наук. - Саратов. - 2006. - 14 с. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 35 40 45 50 1. Спосіб моделювання дозованої опікової рани шкіри III ступеня лабораторним щурам, що включає знеболювання експериментальної тварини шляхом дії ін'єкційного кетамінового наркозу кількістю 10 мг на 1 кг маси тварини з наступною підготовкою та формуванням попередньо поголеної ділянки шкіри потрібної площі в міжлопатковій зоні тварини, фіксацію тварини до предметного столика, оснащеного штативом з насадженою на нього пластинкою з сформованим отвором для додаткової фіксації тварини, проведення опусканням пластинки, що вільно ковзає по осі штативу, додаткової фіксації потрібної ділянки шкіри тварини, оброблення попередньо поголеної шкіри тварини 40 % розчином етилового спирту та створення опікової рани ділянки шкіри, який відрізняється тим, що опікову рану ділянки шкіри створюють шляхом нанесення на підготовлену поголену шкіру тварини хімічного опіку, для чого використовують одноразовий шприц з голкою, заповнений 10 % азотною кислотою, де циліндр шприца фіксують в верхній частині штативу предметного столика за допомогою тримача, з наступним накладанням на шкіру тварини через отвір пластини додаткової фіксації ватного диска, і для контакту голки шприца та ватного диска, площа якого дорівнює площі для хімічного опіку, здійснюють опускання тримача, що фіксує циліндр шприца, виконують натискання на поршень шприца з витисканням 0,5 мл азотної кислоти через голку шприца на ватний диск для забезпечення безпосереднього контакту діючої речовини на шкіру тварини і протягом 5 секунд витримують ватний диск на шкірі тварини. 2. Спосіб за п. 1, який відрізняється тим, що пластину з попередньо сформованим отвором для додаткової фіксації ділянки шкіри тварини виконують товщиною 5 мм. 3 UA 118592 U Комп’ютерна верстка А. Крижанівський Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G09B 23/28
Мітки: щурам, лабораторним, спосіб, опікової, моделювання, ступеня, шкіри, рані, дозованої, ііі
Код посилання
<a href="https://ua.patents.su/6-118592-sposib-modelyuvannya-dozovano-opikovo-rani-shkiri-iii-stupenya-laboratornim-shhuram.html" target="_blank" rel="follow" title="База патентів України">Спосіб моделювання дозованої опікової рани шкіри ііі ступеня лабораторним щурам</a>
Попередній патент: Спосіб прогнозування перебігу есенціальної артеріальної гіпертензії
Наступний патент: Автобалансир шпиндельного вузла верстата
Випадковий патент: Спосіб прогнозування розвитку остеопенії у вагітних з перинатальним інфікуванням