Спосіб безперервного одержання суміші циклоалканону, циклоалканолу та циклоалкілгідропероксиду
Номер патенту: 35602
Опубліковано: 16.04.2001
Автори: Хоусманс Йоханнес Герардус Хубертус Марія, Крагтен Убалдус Францискус
Формула / Реферат
1. Способ непрерывного получения смеси циклоалканола, циклоалканола и циклоалкилгидропероксида, согласно которому соответствующий циклоалкан, содержащий от 5 до 20 атомов углерода, подвергают окислению в непрерывном процессе под воздействием воздуха или кислородсодержащего газа при температуре от 130 до 200°С, отличающийся тем, что окисление, по крайней мере частично, проводят в присутствии 0,002 - 2 ммоль фенольного соединения в расчете на 1 кг реакционной смеси (ммоль/кг).
2. Способ по п.1, отличающийся тем, что используют фенольное соединение, содержащее одну или несколько групп, согласно формулы (1)
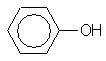
и растворимое в циклоалкане в условиях проведения реакции.
3. Способ по п.2, отличающийся тем, что используют фенольное соединение с молекулярным весом менее 1000 и содержащее 1-5 ароматических колец.
4. Способ по п.3, отличающийся тем, что используют фенольное соединение формулы (2)
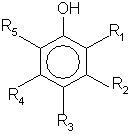
где группы от R1 до R2 могут независимо друг от друга представлять собой группу -O-R6 или группу R7, где группы R6 и R7, могут независимо представлять собой Η или органические группы с числом атомов углерода от 1 до 30, замещенные или незамещенные простой эфирной, карбонильной, гидроксильной, аминовой, амидной или сложноэфирной группами, и/или где группы R1 и R2, или R2 и R3, или группы R3 и R4 или группы R4 и r5 могут совместно образовывать алифатическое или ароматическое кольцо с числом атомов углерода 5, 6, 7, 8, 10 или 12.
5. Способ по любому из п п.1-4, отличающийся тем, что процесс проводят при концентрации фенольного соединения в реакционной смеси от 0,01 до 1 ммоль/кг.
6. Способ по любому из п.п.1-5, отличающийся тем, что процесс проводят при концентрации фенольного соединения менее 0,9 ммоль/кг.
7. Способ по любому из п п.1-6, отличающийся тем, что используют циклический алкан, который имеет от 5 до 20 атомов углерода.
8. Способ по п. 7, отличающийся тем, что используют циклический алкан, представляющий собой циклогексан.
9. Способ по п. 8, отличающийся тем, что в качестве фенольного соединения используют фенол.
10. Способ по любому из п п .1-9, отличающийся тем, что температуру при окислении поддерживают от 160 до 190°С.
11. Способ по любому из п п.1-10, отличающийся тем, что давление при окислении поддерживают от 0,1 до 5 Мпа.
Текст
1. Способ непрерывного получения смеси циклоалканона, циклоалканола и циклоалкилгидропероксида, согласно которому соответствующий циклоалкан, содержащий от 5 до 20 атомов углерода, подвергают окислению в непрерывном процессе под воздействием воздуха или кислородсодержащего газа при температуре от 130 до 200°С, отличающийся тем, что окисление, по крайней мере частично, проводят в присутствии 0,0022 ммоль фенольного соединения в расчете на 1 кг реакционной смеси (ммоль/кг). 2. Способ по п. 1, отличающийся тем, что используют фенольное соединение, содержащее одну или несколько групп, согласно формуле (1): 35602 воздействием кислородсодержащего газа без металлического катализатора при температуре в области от 130 до 200°С. Такой способ получения смеси циклогексанона, циклогексанола и циклогексилгидропероксида в непрерывном процессе описан в патенте ЕР-А0092867. Недостаток этого известного способа состоит в том, что избирательность реакции окисления в отношении образования требуемых продуктов (циклогексанона, циклогексанола и циклогексилгидропероксида) является сравнительно низкой из-за образования значительного количества побочных продуктов. Цель этого изобретения состоит в том, чтобы предложить способ, в котором избирательность реакции окисления циклоалкана в отношении образования требуемых продуктов является более высокой. В частности, целью изобретения является способ, у которого более высокой оказывается избирательность в отношении образования циклоалкилгидропероксида. Эта цель достигается тем, что окисление, по крайней мере частично, проводится в присутствии фенольного соединения, содержащегося в количестве от 0,002 до 2 ммолей в расчете на 1 кг реакционной смеси (ммоль/кг). Установлено, что при использовании способа, отвечающего изобретению, избирательность реакции окисления в отношении образования циклоалканона, циклоалканола и, в частности, циклоалкилгидропероксида является более высокой, без снижения скорости по сравнению со способом, в котором не используется фенольное соединение. В патенте SU-A-686329 раскрыт способ получения циклододецилгидропероксида окислением циклододекана в присутствии 0,01-30% по весу фенольного соединения. Эксперименты проводились с использованием по весу 1% (1170 ммоль/кг) фенола, 2,5% (230 ммоль/кг) крезола и 0,2% (18 ммоль/кг) резорцина. Поразительным является то, что значительно меньшее количество фенольного соединения, чем раскрытое в этих экспериментах, оказывает благоприятный эффект на избирательность в отношении образования циклоалканона, циклоалканола и циклоалкилгидропероксида и, в частности, циклогексанона, циклогексанола и циклогексилгидропероксида. В статье, опубликованной в журнале «Кинетика и катализ», СССР (I960, 1(1), 46-62), упоминаются фенол и a-нафтол, используемые в качестве ингибиторов в катализируемой реакции окисления н-декана. Неожиданным, следовательно, является то, что реакция окисления циклоалкана согласно изобретению практически не замедляется при добавлении фенольного соединения. Использование фенольного или дигидроксибензолпроизводного соединений при проведении окисления циклогексанона с целью повышения избирательности описано в патенте SU-A-197555. В противоположность способу, отвечающему изобретению, реакцию окисления катализируют металлическим катализатором при температуре в области от 200 до 250°С и получают смесь циклогексанола и циклогексанона. Кроме того, согласно примерам, приведенным в патенте SU-A-197555, используют большое количество фенольного со единения в расчете на 1 кг реакционной смеси (90 и 140 ммоль/кг). Представляется, следовательно, неожиданным, что добавление небольших количеств фенольного соединения к некатализируемой реакции окисления и осуществление этого способа при пониженной температуре оказывают положительный эффект на избирательность при той же степени превращения. Использование фенольного соединения при проведении некатализируемого окисления циклододекана описано в статье, опубликованной в журнале «Нефтехимия», СССР (1964, 3(4), 295301). В этой статье описано исследование механизма реакции окисления циклододекана. Фенольное соединение вводят в периодически проводимый процесс уже после того, как окислилась часть циклододекана. В статье не говорится, что введение такого фенольного соединения в непрерывный процесс может сопровождаться ростом избирательности. Фенольное соединение содержит одну или несколько групп в соответствии с формулой (1): OH (1) и растворяется в циклоалкане в условиях проведения реакции. Таким фенольным соединением предпочтительно является органическое соединение с молекулярным весом менее примерно 1000 и с числом ароматических колец от 1 до 5. Приемлемая группа фенольных соединений может быть представлена формулой (2): OH R5 R1 (2) R4 R2 R3 где группы от R1 до R 5 могут независимо представлять собой группу -0-R6 или группу R7, где группы R6 и R7 могут независимо представлять собой Н или органические группы с числом атомов углерода от 1 до 30, замещенные или незамещенные простой эфирной, карбонильной, гидроксильной, аминовой, амидной или сложноэфирной группами, и/или где группы R1 и R2 , или R2 и R3, или группы R3 и R4 или группы R4 и R5 могут совместно образовывать алифатическое или ароматическое кольцо с числом атомов углерода 5, 6, 7, 8, 10 или 12. Примерами фенольных соединений, замещенных или незамещенных, является фенол, 2,6ди-трет-бутилфенол, 2,6-ди-трет-бутил-4-метилфенол, м-крезол, бисфенол-А, бифенол, n-третбутилфенол,2-гидроксинафталин, 2,6-диметилфенол, 2,4-ди-трет-бутилфенол, 2,4,6-три-трет-бутилфенол, 2,4-диметил-6-трет-бутилфенол, 1-гидроксинафталин, гидрохинон, пирокатехин, резорцин, n-феноксифенол и о-фенилфенол. 2 35602 Предпочтительно используют м-крезол, 2,4ди-трет-бутилфенол, 2,6-ди-трет-бутилфенол и фенол. Могут быть также использованы смеси упомянуты х выше соединений. Могут быть с успехом использованы смеси фенольных соединений, получаемых при приготовлении какого-то конкретного фенольного соединения, поскольку тогда отпадает необходимость проводить дальнейшую очистку. Концентрация фенольного соединения обычно составляет менее 2 ммоль/кг, предпочтительно менее 1 ммоль/кг и, в частности, менее 0,9 ммоль/кг. Концентрация фенольного соединения обычно превышает 0,002 ммоль/кг, предпочтительно превышает 0,01 ммоль/кг и, в частности, выше 0,05 ммоль/кг. Изобретение также касается способа, в котором концентрация фенольного соединения составляет по весу менее 0,01% от веса реакционной смеси. Упомянутые выше концентрации представляют собой концентрации, основанные на количестве фенольного соединения, вводимого в реакционную смесь. Фактическая средняя концентрация при протекании реакции окисления будет ниже упомянутой выше концентрации, поскольку часть фенольного соединения будет исчезать при окислении. В целом изобретение касается окисления циклических алканов с числом атомов углерода от 5 до 20. В частности, изобретение касается окисления циклоалканов с числом атомов углерода от 6 до 12. Примерами подходящих циклических алканов являются циклогексан, циклооктан и циклододекан. В частности, изобретение касается окисления циклогексана, поскольку продукты окисления, такие как циклогексанол, циклогексанон и циклогексилгидропероксид, взятые раздельно или в смеси, находят широкое применение. Точнее, изобретение, в частности, касается окисления циклогексана, в котором используют фенол в качестве фенольного соединения, поскольку фенол может быть легко получен. Циклогексилгидропероксид может быть, например, использован в качестве окислителя при приготовлении алканового эпоксидного соединения из соответствующего алкена. Циклогексилгидропероксид, находящийся в смеси, может быть также подвергнут разложению с получением смеси циклогексанона и циклогексанола. Эта так называемая К/А-смесь представляет собой продукт, который используют как таковой при приготовлении, например, адипиновой кислоты. Разложение циклогексилгидропероксида обычно происходит после охлаждения смеси в присутствии катализатора переходного металла, таким как кобальт или хром. Разложение циклогексилгидропероксида предпочтительно следует вести с добавлением по способу, описанному в патенте ЕР-А-004105 или патенте ЕР-А-092867. Температура, при которой проводят окисление, обычно находится в области от 130 до 200°С. Целесообразно, чтобы температура превышала 160°С. Температура, предпочтительно, не должна превышать 190°С. Давление, при котором проводят окисление, обычно находится в области от 0,1 до 5 МПа. Целесообразно, чтобы давление превышало 0,4 МПа. Давление, предпочтительно, не должно превышать 2,5 МПа. В случае проведения окисления циклогексана давление обычно устанавливают выше 0,6 МПа, но ниже 2,0 МПа. Окисление ведут в непрерывном режиме и предпочтительно осуществляют в системе реакторов, соединенных последовательно, или в секционированном трубчатом реакторе. Реакцию обычно ведут автотермически или с регулированием температуры. Температуру обычно регулируют изменением тепла реакции потоком газа, промежуточным охлаждением или иным способом, известным специалистам этой области техники. Чтобы была уверенность, что переходные металлы (которые вызывают разложение циклоалкидгидропероксида) не попадут в окисляемую смесь, целесообразно выбирать реакторы с инертной внутренней стенкой. С этой целью могут быть, например, использованы реакторы с внутренней стенкой из пассивированной стали, алюминия, тантала, стекла или эмали. Сказанное представляется особенно важным при малых производственных мощностях, когда оказывается неблагоприятным соотношение поверхности стенки с жидкостным объемом. При больших мощностях специальное придание инертных свойств стенке не является абсолютно необходимым. Следует понимать, что при попадании в окисляемую смесь незначительного количества металлических ионов, которые не оказывают существенного влияния на реакцию, можно тогда говорить о проведении в рамках настоящего изобретения некатализируемого окисления циклоалкана. В противоположность некатализируемому окислению циклоалкана катализируемое окисление, которое обычно включает добавление металла, такого как кобальт и хром, дает реакционную смесь с относительно низким содержанием циклоалкилгидропероксида в сравнении с суммарным содержанием циклоалканона и циклоалканола. Обычно продукт некатализируемого окисления циклогексана содержит, по крайней мере, количество циклогексилгидропероксида (выраженное в весовых процентах), которое является сопоставимым с суммарным количеством циклогексанола и циклогексанона (выраженным в весовых процентах). Часто после взаимодействия содержание циклогексилгидропероксида в смеси оказывается более, чем двухкратно, превышающим суммарное содержание циклогексанола и циклогексанона. В противоположность сказанному, катализируемое окисление дает смесь, которая содержит менее 50% циклогексилгидропероксида в сравнении с суммарным количеством циклогексанола и циклогексанона (выраженным в весовых процентах). Часто количество пероксида оказывается даже менее 40% в сравнении с суммарным количеством циклогексанола и циклогексанона (выраженным в весовых процентах). Концентрация циклоалкилгидропероксида в реакционной смеси, покидающей (последний) реактор окисления, обычно находится в области от 0,1 до 8,0% по весу. Концентрация циклоалканона в этой смеси обычно находится в области от 0,1 до 10% по весу. Концентрация циклоалканола в этой смеси обычно находится в области от 0,1 до 15% по весу. Степень превращения циклоалкана относительно этой реакционной смеси обычно 3 35602 находится в области от 0,5 до 25%. Степень превращения циклогексана обычно находится в области от 2 до 6%. При использовании последовательности соединенных реакторов или секционированного трубчато го реактора фенольное соединение можно подавать раздельно в каждый реактор (или секцию). Установлено, что концентрацию фенольного соединения в первых реакторах целесообразно делать относительно низкой в сравнении с концентрацией в последнем реакторе или реакторах. Может оказаться также преимущественным подавать фенольное соединение только в один или несколько реакторов, а не во все реакторы. В качестве кислородсодержащего газа может быть выбран кислород в чистом виде, воздух с повышенным или пониженным содержанием кислорода, или кислород, смешанный с азотом или другим инертным газом. Предпочтительным является воздух, однако воздух может быть смешан с дополнительным количеством инертного газа для устранения риска возникновения взрывов. В общем случае, для устранения риска возникновения взрывов в реакторы подают такое количество кислородсодержащего газа и таким образом, чтобы концентрация кислорода в отходящем газе оставалась ниже предела взрываемости. Подаваемое количество кислорода (рассчитанное по чистому кислороду) обычно находится в области от 0,1 до 50 Мл в расчете на 1 л циклоалкана. Это количество зависит от скорости реакции, и целесообразно, чтобы кислород присутствовал в небольшом избытке, однако сказанное не носит критический характер, поскольку количество кислорода обычно не является ограниченным. Изобретение далее будет пояснено следующими не ограничивающими его примерами. Пример I В стеклянный реактор с двойной стенкой (с объемом, вмещающим жидкость, образованную из 270 г циклододекана (при 170°С)), снабженный четырьмя отбойными перегородками, турбинной мешалкой, холодильниками, термометром и двумя питающими трубками, через одну из питающих трубок вводили расплавленный циклододекан, делая это насосом со скоростью 732 г/ч, и через другую тр убку - раствор добавки к расплавленному циклододекану, делая это вторым насосом со скоростью 90 г/ч. Время пребывания в этом случае составляло 20 мин. В качестве добавки использовали 2,6-ди-трет-бутилфенол. Скорость подачи добавки устанавливали такой, чтобы концентрация в реакторе составляла 0,96 ммоль/кг. Продукт выпускали из реактора через сливную трубку, используя регулировочный клапан. Температура реакции составляла 170°С. Скорость у мешалки составляла 2000 об/мин. Воздух подавали через дно реактора через газораспределительную систему со скоростью 30 Nл/ч. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 73,4, 4,4 и 15,2% мольных (суммарно 93 мол.%) при степени превращения циклододекана 4,4 мол.%. Пример II Пример I повторяли. Скорость ввода добавки регулировали так, чтобы концентрация в ректоре составляла 0,094 ммоль/кг. Из анализа истекающей из реактора жидкости следует, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 61,6, 12,1 и 18,4 мол.% (суммарное количество 92,1 мол.%) при степени превращения циклододекана 4,4 мол.%. Пример III Пример I повторяли. Скорость ввода добавки устанавливали такой, чтобы концентрация в реакторе составляла 0,48 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 68,0, 4,3 и 18,1 мол.% (суммарно 90,4 мол.%) при степени превращения циклододекана 5,0 мол.%. Сравнительные эксперименты А и В Пример I повторяли, но добавку не добавляли. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляют 54,6, 13,3 и 18,8 мол.% при степени превращения циклододекана 4,67 мол.%. Этот эксперимент повторяли. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 51,7 15,3 и 19,5 мол.% (суммарно 86,5 мол.%) при степени превращения циклододекана 4,7 мол.%. Пример IV Пример I повторяли, в качестве добавки использовали фенол. Скорость ввода добавки устанавливали такой, чтобы концентрация в реакторе составляла 1,0 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 59,6, 14,8 и 18,7 мол.% (суммарно 93,1 мол.%) при степени превращения циклододекана 4,4 мол.%. Пример V Пример IV повторяли, скорость ввода добавки устанавливали такой, чтобы концентрация в реакторе составляла 0,8 ммоль/кг, и поступление циклододекана понижали до такой величины, при которой степень превращения циклододекана составляет 4,7 мол.%. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 58,0, 12,5 и 17,8 мол.% (суммарно 92,0 мол.%). Пример VI Пример V повторяли, скорость ввода добавки устанавливали такой, при которой концентрация в реакторе составляет 0,48 ммоль/кг, и превращение циклододекана составляет 5,1 мол.%. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и 4 35602 циклододеканона соответственно составляет 61,4, 6,3 и 15,3 мол.% (суммарно 91,1 мол.%). Сравнительный эксперимент С Пример VI повторяли, но добавку не добавляли. Степень превращения циклододекана составляла 5,1 мол.%, как и в случае примера VI. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 48,6, 11,7 и 17,4 мол.% (суммарно 77,6 мол.%). Пример VII Пример I повторяли, в качестве добавки использовали 2,6-ди-трет-бутил-4-метилфенол. Скорость подвода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 0,94 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 59,2, 13,2 и 18,5 мол.% (суммарно 91,9 мол.%) при степени превращения циклододекана 4,5 мол.%. Пример VIII Пример VII повторяли. Скорость подвода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,9 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 63,1, 8,6 и 17,0 мол.% (суммарно 88,7 мол.%) при степени превращения циклододекана 4,6 мол.%. Пример IX Пример I повторяли, в качестве добавки использовали м-крезол. Скорость подвода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,1 нмоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона, соответственно, составляет 65,0, 8,1 и 18,5 мол.% (суммарно 91,6 мол.%) при степени превращения циклододекана 4,3 мол.%. Пример X Пример I повторяли, в качестве добавки использовали 4-метокcифенол. Скорость подвода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,0 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 60,7, 13,2 и 17,8 мол.% (суммарно 91,7 мол.%) при степени превращения циклододекана 4,4 мол.%. Пример XI Пример I повторяли, в качестве добавки использовали 2,4,6-три-трет-бутилфенол. Скорость подвода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,0 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 65,7, 9,9 и 16,4 мол.% (суммарно 92,0 мол.%) при степени превращения циклододекана 4,5 мол.%. Пример XII Пример I повторяли, в качестве добавки использовали 2,4-ди-трет-бутилфенол. Скорость подвода добавки устанавливали такой, при которой ее концентрация в реакторе составляет 1,1 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклододецилгидропероксида, циклододеканола и циклододеканона соответственно составляет 67,4, 5,4 и 18,3 мол.% (суммарно 91,1 мол.%) при степени превращения циклододекана 4,5 мол.%. Пример XIII Эксперимент с циклогексаном проводили в устройстве, приспособленном для проведения опытов под давлением и аналогичном устройству, описанному в примере І. В качестве добавки использовали 2,6-дибутил-трет-4-метилфенол. Скорость подвода добавки устанавливали такой, при которой ее концентрация в реакторе составляла 1,25 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклогексилгидропероксида, циклогексанола и циклогексанона составляет 92,3 мол.% при степени превращения циклогексана 3,5 мол.%. Пример XIV Повторяли пример XII, в качестве добавки использовали фенол. Скорость подачи добавки делали такой, при которой ее концентрация в реакторе составляет 0,6 ммоль/кг. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклогексилгидропероксида, циклогексанола и циклогексанона соcтавляет 91,5 мол.% при степени превращения циклогексана 3,4 мол.%. Пример ХV Пример XIV повторяли. Концентрация фенола составляла 0,3 ммоль/кг, и суммарная избирательность была 91,9 мол.% при степени превращения циклогексана 3,5 мол.%. Сравнительный эксперимент D Повторяли пример XII, но без добавки. Анализ истекающей из реактора жидкости показал, что избирательность в отношении образования циклогексилгидропероксида, циклогексанола и циклогексаноа составляет 89,4 мол.% при степени превращения циклогексана 3,4 мол.%. 5 35602 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 6
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for continuous preparing a mixture of cycloalkanone, cycloalkanol and cycloalkyl hydroperoxide
Автори англійськоюHousmans Johannes Gerardus Hubertus Maria, Kragten Ubaldus Franciscus
Назва патенту російськоюСпособ непрерывного получения смеси циклоалканона, циклоалканола и циклоалкилгидропероксида
Автори російськоюХоусманс Йоханнес Герардус Хубертус Мария, Крагтен Убалдус Францискус
МПК / Мітки
МПК: C07C 29/50, C07C 45/33, C07C 407/00, C07C 49/385, C07C 35/00, C07C 409/00, C07C 27/00, C07C 29/48
Мітки: циклоалкілгідропероксиду, спосіб, циклоалканону, одержання, безперервного, суміші, циклоалканолу
Код посилання
<a href="https://ua.patents.su/6-35602-sposib-bezperervnogo-oderzhannya-sumishi-cikloalkanonu-cikloalkanolu-ta-cikloalkilgidroperoksidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб безперервного одержання суміші циклоалканону, циклоалканолу та циклоалкілгідропероксиду</a>
Попередній патент: Спосіб перенесення відбитків з основи на нижній шар та обладнання для його здійснення
Наступний патент: Спосіб виробництва прямошовних електрозварних труб
Випадковий патент: Зразок для випробування листових матеріалів на міцність у трансверсальному напрямку










