3-аміно-7-нітро-2н-1,2-бензотіазін-1,1-діоксиди, що мають протимікробну активність та спосіб їх одержання
Номер патенту: 5659
Опубліковано: 28.12.1994
Автори: Бабичев Федір Семенович, Воловенко Юліан Михайлович, Нещадименко Володимир Віталійович, Немазаний Олексій Георгійович
Формула / Реферат
(57) 1. 3-Амино-7-нитро-2Н-12-бензотиазин-1,1-диоксиды - формулы І
где R1 - н-бутил, фенип или бензин и R2 - цианогруппа или R1 - метил и R2 - 3.4-диметоксифенил. пиридин-2-ил или I - метилбензимидазол-2-ил, или R1 - пиридин-4-ил и R2 - пиридин-2-ил, обладающие противомикробной активностью.
2. Способ получения 3-амино-7-нитро-2Н-1,2-бензотиазин-1.1-диоксидов формулы I
, где R1, Н-бутил, фенил или бензил и R2 - цианогруппа, или R1 - метил и R2 - 3,4-диметоксифенил, пиридин-2-ил или 1-метилбензимидазол-2-ил, или R1 - пиридин-4-ил и R2 - пиридин-2-ил, отличающийся тем, что N-R1 - (5-нитро-2-хлор)бензолсульфамид формулы II
где R1 имеет указанные значения подвергают взаимодействию с замещенным ацетонитрилом формулы III
где R2 имеет указанные знамения в присутствии карбоната щелочного металла при нагревании в кипящем органическом растворителе.
Текст
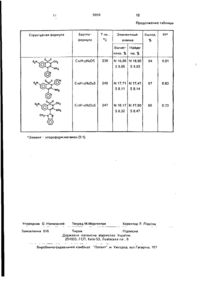
1. 3-Амино-7-нитро-2Н-1 2-бензотиазин-1,1-диоксиды - формулы І ЩО МАЮТЬ ПРОТИМІКРОБНУ пиридин-2-ил, обладающие противомикробной активностью 2 Способ получения З-амино-7-нитро2Н-1,2-бензотиазин-1.1-диоксидов формуПЫ|. о * W, где Ri. Н-бутил, фенил или бензил и R2 цианогруппа, илиЯі -метили R2 - 3 4-диметоксифенил, пиридин-2-ил или 1-метил5енэимидазол~2-ил. или Ri - пиридин-4-ил и R 2 пиридин-2-ил, о т л и ч а ю щ и й с я тем. что N-Ri - (5-нитро-2-хлор)бензолсульфамид формулы II QZN •4 С1 где Ri - н-бутил, феиип или бензин и R2 цианогруппа или Ri - метил и R2 - 3.4-дичетоксифенил. пиридин-2-ил или I - метилбензимидазол-2-ил, или Ri - пиридин-4-ил и U2 Изобретение относится к области биоорганической химии, в нем предлагаются биологически акті$ваде_соединения общей формулы I. О»), где Ri имеет указанные значения подвергают взаимодействию с замещенным ацето нитрилом формулы M J R2-CH2CN ОН). где R2 имеет указанные знамения в присутствии карбоната щелочного металла при нагревании в кипящем органическом растворителе 02М ь чалв 5659 3-Амино-7-нитро-2Н-1,2-6ензотиаэин-1,1диоксиды, содержащие заместители в 4-ом и 7-ом положениях неизвестны. Известен трехстадийный способ получения 2-Р-3,4-дигидро-3-имино-2Н-1,2-бензотиазин-1,1-диоксидов, заключающийся в диэзотировании хлоргидрата о-аминофенилацетонитрила с последующей обработкой СигСІг в уксусной кислоте, насыщенной ЗОг - на первой стадии; обработка полученного о-цианметилбензолсульфохлорида аминами - на второй стадии с последующим выдерживанием сульфамида в H2SO4 в течении 16 часов, что приводит к образованию 15 целевого продукта с общим выходом около 30% [3]. где R1 = СНз, CiHg, Cel *5. Сі ІгСбНд. пиридин4-ил, R2 « СП, 3,4 (ОСНз)гСбНз. пиридин-2-ил, = 1-метилбензимидазоп-2-ит, которые проявляют противомикробную активность. Данные вещества можно использовать в медицинской практике для лечения ряда инфекционных заболеваний. Известны S-диокиси 1,2-бензотиазина и, о частности S-диокись 2-Р-3.4-дигидро-3- 10 имино-2Н-1,2-&ензотиазмна [1,2] строения II, не содержащая заместителей в бензольном ядре, противомпкробнзя активность которой не описана. Q Q II СНгСЫ НС1 неї 2 СНгСіг $огсн3согн 16 1 ? Недостатками известного способа явгде R - н-бутил, фенил или бензил и R ляются: низкий суммарный выход и узкий цианогруппа, или R - метил и R -3,4-димеассортимент целевых продуктов, длительтоксифенил, пиридин-2-ил, или 1-метилбенность и многостадийность прохождения процесса, значительная трудоемкость, за- 35 зимизол-2-ил; или R - пиридин-4-ил и R пиридин-2-ил, обладающие противомикробключающэяся в необходимости использованой активностью. ния раствооа SO2, большие затраты времени Поставленная задача решается спосона проведение синтеза (не менее 20-25 чабом получения 3-амино-7-нитро-2Н-1,2-бенсов). зотиазин-1,1-диоксидов формулы I В основу изобретения поставлена задача АО О, О создания 3-амино-7-нитро-2Н-1,2-бензотиаОгЫ зин-1,1-диоксидов, обладающих противоми.кробной активностью. Поставлена задача создания способа получения 3-амино-2Н-1,2-бензотиазин- 45 в2 , 1,1-диоксидов, в котором реэлизуется^взаигде R - н-бутил, фенил или бензил и R2 модействие N-R-(5-HHTpo-2-xn о р)бе и золциа и о груп па; или R - метил и R - 3,4-димесульфамидов, формулы II, где R имеет укатоксифенил, пиридин-2-ил, или 1-метилбензанные значения с замещенными ацетонитзимидазол-2-ил; или R - пиридин-4-ил и 2 рилами формулы 111, где R - имеет 50 R - пиридин-2-ил, отличающийся тем. что указанные значения, в присутствии уэрбоN-R -(5-нитро-2-хлор)бензолсульфэмид форнэта щелочного металла при нагревании в мулы кипящем органическом растворителе. л к, ._ I Поставленная задала решается 3-ами3 ^ 0 , KHR но-7-ні-тро-2Н-1,2-бензотиазин-1,1-диокси- 55 дзми формулы' О ,0 *г V где R имеет указанные значения, подвергают взаимодействию с замещенными ацетонитрилом формулы 5659 где R2 имеет указанные значения, в присутствии карбоната щелочного металла при нагревании о кипящем органическом рас- 5 творителе. 3-Амино-7-нитро-2Н-1,2-6ензотиззин-1, 1-диоксиды общей формулы I, образуются при в з а и м о д е й с т в и и N-R ( 5 - н и т р о - 2 хлор)бензолсульфамидов общей формули 1 1 1 с замещенными ацетонитрилзми общей формулы IY в присутствии карбонатов щелочных металлов при нагревании в кипящем органическом растворителе с последующим выделением целевых продуктов известными приемами, согласно приведенной схеме О, О 1 т? с н CL 'V її} R = СНз. С4Н9, СеН5, СНгСоНб, пиридин4-ил; R2 = СП. 3,4-(ОСНз)2СбНз, пиридин-2-ил, 1-метил бензимидазол-2-ил. Предлагаемые соединения синтезиро- 20 ваны впервые и по величине противомикробного действия в целом превосходят применяемый в медицине препарат диоксидин. Авторы не обнаружили в литературе способ получения соединений такого ряда 25 со сходными структурными признаками. Таким образом, предлагаемое изобретение отвечает критериям "существенные отличия" и "новизна". Изобретение иллюстрируется следую- 30 щими примерами: П р и м е р 1. Получение З-амино-2-бутил7-нитро-4-циэно-2Н-бензотиозин-1,1 -диоксида (соединение 1). К смеси 1,46 г (0,005 моль) ІМ-бутил-(5- 35 нитро-2-хлор)бензолсульфзмида (0,005 моль) динитрила малоновой кислоты и 70 мл диметилформамида прибавляют 1.38 г(0,01 моль) поташа и нагревают при температуре 153°С в течение 30 мин. Растворитель упаривают в 40 вакууме, остаток обрабатывают 80 мл воды, подкисляют уксусной кислотой до рН 7. отфильтровывают выпавший осадок, промывают водой, сушат и перекристаллизовывают издиоксана. 45 ПМР-спектр в DMCO-сІб/стандарт внутренний, ТМС/: 8.49 м.д. (1Н); 8,47 м.д. (2Н, -NH 2 ): 8,41 м.д. (1Н); 7.59 м.д. (1Н); 4,00 м.д. (2Н, -СН2-); 1,48 м.д. (2Н, -СН2-); 1.06 м.д. (2Н, -СН2-): 0,79 м.д. (ЗН, -СНз). ИК-спектр (см"1, 50 КВг. табл.): 3350 ср., 2210 с . 1640 с , 1600 с , 1520 с , 1470 с , 1340 с , 1180 ср , 1130 ср., 930 ел., 850 ел., 755 ел. № Государственной регистрации в НИИлекередств 9734590 от 23.04. 90 г. 55 П р и м е р 2. Получение З-амино-7-нитро-2-фенил-4-циано-2Н-1,2-бензотиазин-1, 1-диоксида (соединение 2). К смеси 1,56 г (0,005 моль) П-фенмл-{5нитро-2-хлор)бензолсульфамида, 0,33 г см Тої .0 1 N NH (0,005 моль) динитрила малоновой киг р '>ты и 100 мл диоксэна прибавляют 1,38 г (0,01 моль) поташа и нагревают при температуре 100°С в течение 3 часов. Растворитель удаляют в вакууме, остаток обрабатывают 100 мл воды, подкисляют уксусной кислотой до рН 7, отфильтровывают выпавший осадок, промывают водой, сушат и перекристаллизозывают из диоксана. ПМР-спектр в DMCO-de/стандарт внутренний, ТМС/: 8,55 м.д. (1Н); 8,43 м.д. (1Н); 8,17 м.д. (2Н. -NH 2 ); 7,68 м.д. (1Н); 7,56-7,24 м.д. (5Н). ИК-спектр ( с м 1 , КВг, табл.): 3180 ср.,2185 ср.. 1615с, 1590с, 1520 с , 1500ср., 1475 ср., 1360 ср., 1305 с , 1290 с . 1165 с , 1105 ср., 1050 ел.. 910 ел., 885 ср., 805 сл.( 745 ср. N? Государственной регистрации в НИИлекередств 9734790 от 23.04.90 г. П р и м е р З . Получение З-амино-2-бензил-7-нитро-4-циано-2Н-1,2-бензотиазин-1, 1-диоксида (соединение 3). К смеси 1,63 г (0,005 моль) ІМ-бензил-(5нитро-2-хлор)бензолсульфамида, 0,33 г (0,005 моль) динитрила малоновой кислоты и 70 мл диметилформамида прибавляют 1.38 г (0,01 моль) поташа и нагревают при температуре 153°С в течение 1 часа. Растворитель удаляют в вакууме, остатокобрабатываюг70 мл воды, подкисляют уксусной кислотой до рН 7, отфильтровывают выпавший осадок, промывают водой, сушат и кристаллизуют из нитрометзна. ПМР-спектр в ОМСО-гіб/стандарт внутренний, ТМС/: 8,48 м.д. (2Н, -МНг); 8,44 м.д. (1Н): 7.55 м.д. (1Н); 7,29-6.95 м.д. (5Н). 5.28 м.д. (2Н, -СН2-). ИК-спектр (см*1, КВг табл.): 3200 ср., 2180 с , 1610с. 1580 с , 1505 с . 1480 ср., 1365 с , 1330 с . 1210 ср.. 1190 ср., 1130ср , 905 ел., 900 ср., 865 ср., 775 ср., 760 ср. N? Государственной регистрации в НИИлекередств 9734890 от 23.04.90 г. П р и м е р 4. Получение 3-эмино-4-{3,4диметоксифенил)-2-метил-7-нілтро-2Н-1.2бензотиазин- 1,1-диоксидэ (соединение 4). 8 5659 К смеси 1,25 г (0,005 моль) П-метил-(5нитро-2-хлор)6еиэолсульфамида, 0,89 г {0,005 моль) 3,4-диметоксифенилацетонитрила и 70 мл диметилформзмида прибавляют 1,38 г{0.01 моль)поташа и нагревают при 5 температуре 153°С в течение 1 часа, Растворитель упаривают в вакууме, остаток обрабатывают 80 мл воды, подкисляют уксусной кислотой до рН 7, выпавшее масло отделяют, промывают водой, сушат и кристаллизу- 10 ют из толуола. ПМР-спектр в DMCO-de/стандарт внутренний, ТМС/: 8.33 м.д. (1Н): 8,07 м.д. {1Н); 7,11 м.д. (1Н); 6,71-6.64 м.д. (ЗН); 6,57 м.д. (2Н, -NH 2 ); 3.80 м.д. (ЗН, -СНз); 3,73 м.д. (ЗН. 15 -СНз); 3.33 м.д. (ЗН, -СНз). ИК-слектр (см 1 , КВг.табл): 3280 ср.. 1635 ср.. 1605 ср., 1575 ср.. 1525 ср.. 1480 ср.. 1365 с, 1180 ср.. 1110 ср.. 1020 ср., 905 ел., 875 ср.. 805 ср , 770 ел.. 755 ел. 20 № Государственной регистрации в НИИлекередств 9735090 от 23.04.90 г. П р и м е р 5. Получение З-амино-2-метил-7-нитро-4-(пиридин-2-ил)-2Н-1,2-бензотиазин-1,1 -диоксида (соединение 5). 25 К смеси 2,50 ґ (0.01 моль) !Ч-СНз-(5-нитро-2-хлор)бензолсульфамида, 1,18г(0,01 моль) 2-пиридилэцетонитрила и 70 мл диметилформамида прибавляют 2,76 г (0,02 моль) поташа и нагревают при 153°С в течение 1 30 часа. Растворитель удаляют в вакууме, остаток обрабатывают водой (140 мл), подкисляют уксусной кислотой до рН 7. отделяют выпавшее масло, промывают водой, сушат и кристаллизуют из о-ксилола. 35 ПМР-спектр в ОМСО-сіб/стандарт внутренний, ТМС/: 8.66 м.д. (1Н); 8,48 м.д. (1Н); 8,38 м.д, (2Н, -NH2), 8,18 м.д. (1Н); 7,49 м.д. (1Н); 7,42-7,38 м.д. (1Н); 7,29 м.д. (1Н); 3,36 м.д. (ЗН, -СНз). ИК-спектр (см"1, КВг, тзбл,): 40 3280 ср.. 1615 ср., 1595 с, 1490 с , 1460 ср., 1340 с , 1315 с , 1205 ср., 1170 ср.. 1105 ср., 900 ср., 760 ср., 720 ел. l\fe Государственной регистрации в НИИлекередств 9734690 от 23.04.90 г. 45 ПМР-спектр в DMCO сіє/стандарт внутренний. ТМС/: 8,95 м.д. (2Н, -ЫНг); 8,46 м.д. (1Н); 8,37 м.д. (1Н); 8,26 м.д. (1Н); 8,17-7,54 мд. (8Н), ИК-спектр ( с м 1 , КВг, табл.): 3270 ср., 1610 ср., 1590 с , 1495 ср., 1475 с , 1450 ср.. 1360 ср., 1325 с , 1280 ср., 1160 ср.. 1115 ср., 890 ел.. 835 ср.. 770 ел., 745 ср. N? Государственномрегистрации в НИИлекередств 9735190 от 23 04.90 г, П р и м е р 7. Получение 3-амино-4-(1-метилбензимидэзол-2-ил)-2-метил-7-нитро-2Н1.2-бензотиазин- 1,1-диоксида (соединение п К смеси 1.25 г (0,005 моль) Ы-метил-(5нитро-2-хлор)бензолсульфамида, 0,85 г (0,005 моль) 1-метил-2-бензимидазолилацетонитрила и 80 мл диметилформамида прибавляют 3,26 г (0,01 моль) карбоната цезия и нагревают при температуре 153°С в течении 30 мин. Растворитель удаляют в вакууме, остаток обрабатывают 120 мл воды, подкисляют уксусной кислотой до рН 7, отфильтровывзют выпавший осадок, промывают водой, сушат и кристаллизуют из нитрометзна. ПМР-спектр в DMCO-de/стандарт внутренний, ТМС/: 8.44 м.д. (1Н); 8,21 м.д. (1Н); 7,77 м.д. (2Н, -NH 2 ); 7,72-7,24 м.д. (4Н); 7,07 м.д. (1Н); 3,27 м.д. {ЗН, -СНз). ИК-спектр (см"1, КВг, табл.): 3240 ср.. 1595 ср., 1585 с . 1480 с , 1430 ср., 1325 с , 1290 с . 1160 ср., 1105 ср., 970 ел., 900 ел., 830 ел., 740 ел. N? Государственной регистрации в НИИлекередств 9734990 от 23.04.90 г. Константы и выходы полученных соединений представлены в таблице 1. П р и м е р в . Испытание противомикробной активности 3-амино-7-нитро-2Н-1,2бензотиазин-1,1-диоксидов (соединения 1-7). Противомикробную активность заявляемых соединений ~3-амино-7-нитро-2Н-1,2бензотиазин-1,1-диоксидов (соединения 1-7) изучали по общепринятой в микробиологической практике методике серийных разведений в жидкой питательной среде по П р и м е р 6. Получение З-амино-7-нитотношению к возбудителям наиболее расро-2-(пиридин-4-ил)-4-(пиридин-2-ил)-2Н-1, пространенных бактериальных и грибковых 2-бензотиазин- 1,1-диоксида(соединение инфекций человека и животных, а также по 6). 50 отношению к грибам, разрушающим проК смеси 3,13 г (0,01 моль) Г\1-{пиридин-4мышленные материалы [4. Методы экспериил)-5-нитро-2-хлорбензолсульфамида, 1,18 г ментальной х и м и о т е р а п и и / / П о д ред. (0,01 моль) 2-пиридилацетонитрилэ и 80 мл Г.Н.Першина, М.. Медицина, 1971 г., с. 100, диоксана прибавляют 2,76 г(0.01 моль) пота318]. Микробная нагрузка в опытах состэвша и нагревают при температуре 100°С в 55 ляпа 1-2-10 колониеобразующих единиц в течение 4 часов. Растворитель удаляют в ва1 мл. кууме, остаток обрабатывают 120 мл воды, Изучение противомикробных свойств подкисляют уксусной кислотой до рН 7, отзаявляемых соединений проводили в сравделяют выпавшее масло, промывают водой, нении с эталоном, применяемым в медицисушат и кристаллизует из о-ксилола. не, диоксидином. 10 5659 оксидов противомикробнзя активность, коРезультаты исследований противомикторых ранее была неизвестна Любое предробной активности заявляемых соединений приятие химфармпромышлеиности иожет (соединения 1-7) в сравнении с эталоном легко освоить производство заявляемых представлены в таблице 2 Как видно из приведенных эксперимен- 5 соединений так, как способ их получения прост, технологичен и основывается на отетальных данных исследований противомикчественном сырье. робной активности заявляемые соединения Контроль за ходом реакции и чистотой обладают в целом более высокой противоконечных продуктов осуществлялся метомикробной активностью в сравнении с эта10 дом ТСХ на "Sllufo! UV-254" элюент - хлоролонным препаратом - диоксидином форм метанол (9'1) и бензол этанол (9 1). Заявляемые соединения мало токсичны, Спектры ПМР записаны на фурье-спектих ЛД50- 300-400 мг/кг. рометре "Bruker WP-100". Таким образом, найдены новые соедиИК-спектры сняты на приборе "Pay нения обладающие противомикробной активностью в целом превосходящей по 15 Unicam SP3-300". Температура плавления заявляемых сосвоему действию эталонный препарат - диединений была измерена на приборе типа оксидин и являющиеся производными 3ПТП. амино-7-нитро-2Н-1,2-бенэотиазин-1,1-ди Константы и выходы полученных соединений Структурная формула Брутто Т пл., Элементный Выход, формула °С анализ % 183 Найде лено. % C13H14N4O4S Вычис Rf* но, % N 17,38 N 17,10 S9.95 82 0,87 79 0,71 S 10,13 см C15H10N4O4S 245 N 16,37 N 16,30 S9.37 S9.46 CN ° г М ^с!г С Н Л Н 5 C16H12N4O4S 178 N 15,17 N 15,40 S 9.0 S8J0 80 0,90 C17H17N3O6S 250 N 10,74 N 10,70 S8.24 S8.19 67 0 86 с ы X СН 1° І! осні 1 12 5659 Продолжение таблицы Структурная формула Бруттоформула Т пл , °С Элементный анализ Выход, Rf* Вычис- Найделено, % но, % C14H12N4OS 230 N 16,86 N 16,90 S9,65 S9,63 64 0,81 C16H13N5O4S 249 N 17,71 N 17,47 S8.11 S8.14 67 0,93 C17H15N5O4S 247 N 18,17 N 17,90 66 0,73 S8.32 S8,47 *Элюент - хлороформ:метанол (9:1). Упорядник О. Намазаний Замовлення 616 Техред М.Моргентал Коректор Л Ліврінц Тираж Підписне Державне патентне відомство України, 254655. ГСП, Київ-53, Львівська пл , 8 Виробничо-Сидавничий комбінат "Патент", м Ужгород, вул.Ґагаріна. 101
ДивитисяДодаткова інформація
Назва патенту англійською3-amino-7-nitro-2н-1,2-benzothiazin-1,1-dioxides, having antimicrobial activity and process for preparation thereof
Автори англійськоюBabychev Fedir Semenovych, Volovenko Yulian Mykhailovych, Volovenko Yulian Mykchaylovich
Назва патенту російською3-амино-7-нитро-2н-1,2-бензотиазин-1,1-диоксиды, облаждающие противомикробной активностью и способ их получения
Автори російськоюБабичев Федор Семенович, Воловенко Юлиан Михайлович
МПК / Мітки
МПК: C07D 279/00, A61K 31/54, A61P 31/04
Мітки: спосіб, активність, протимікробну, одержання, мають, 3-аміно-7-нітро-2н-1,2-бензотіазін-1,1-діоксиди
Код посилання
<a href="https://ua.patents.su/6-5659-3-amino-7-nitro-2n-12-benzotiazin-11-dioksidi-shho-mayut-protimikrobnu-aktivnist-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">3-аміно-7-нітро-2н-1,2-бензотіазін-1,1-діоксиди, що мають протимікробну активність та спосіб їх одержання</a>
Попередній патент: Спосіб одержання метанолу
Наступний патент: Спосіб стабілізації рідких комплексних добрив
Випадковий патент: Електронний курильний виріб