Сіль гідрохлориду 5-[4-[2-(n-метил-n-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону, спосіб її одержання та фармацевтична композиція
Формула / Реферат
1. Гідрохлоридна сіль 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону, що характеризується:
(і) спектром поглинання інфрачервоного випромінювання, в основному, відповідно до фіг. 1; і/або
(іі) спектром комбінаційного розсіювання, в основному, відповідно до фіг. 2; і/або
(ііі) порошковою рентгенограмою (XRPD), в основному, відповідно до фіг. 3; і
(iv) спектром 13С ЯМР твердого стану, в основному, відповідно до фіг. 4.
2. Сполука за п. 1, що характеризується двома або більше з:
(і) спектром поглинання інфрачервоного випромінювання, в основному, відповідно до фіг. 1;
(іі) спектром комбінаційного розсіювання, в основному, відповідно до фіг. 2;
(ііі) порошковою рентгенограмою (XRPD), в основному, відповідно до фіг. 3;
(iv) спектром 13С ЯМР твердого стану, в основному, відповідно до фіг. 4; і
(v) температурою плавлення в інтервалі від 160 до 168°С.
3. Сполука за п. 1 або п. 2 в очищеному виді.
4. Сполука за п. 1 або п. 2 у виді твердої лікарської форми.
5. Сполука за п. 1 або п. 2 у фармацевтично прийнятній формі, яку можна здрібнити, або в здрібненому виді.
6. Сполука за п. 1 або п. 2 у фармацевтично прийнятній формі, що має гарні реологічні властивості.
7. Сполука за п. 1, яка є придатною як активна терапевтична речовина.
8. Сполука за п. 1 для одержання лікарського засобу для лікування і/або профілактики цукрового діабету, станів, пов'язаних з цукровим діабетом, і деяких його ускладнень.
9. Спосіб одержання гідрохлориду за п. 1, який відрізняється тим, що 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діон (сполука І) або його сіль, переважно дисперговані або розчинені в придатному розчиннику, вводять у взаємодію з джерелом іона хлору з наступним виділенням гідрохлориду.
10. Фармацевтична композиція, що містить гідрохлорид за п. 1, і придатний для нього фармацевтично прийнятний носій.
Текст
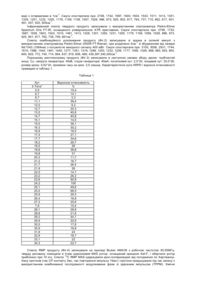
Цей винахід відноситься до нового лікарського засобу, до способу одержання даного лікарського засобу і до застосування даного лікарського засобу в медицині. Європейська патентна заявка, номер публікації 0306228, відноситься до деяких похідних тіазолідиндіону, що описані як такі, що володіють гіпоглікемічною і гіполіпідемічною активністю. Сполука приклада 30 ЕР 0306228 являє собою 5-[4-[2-(N-метил-N-(2-тридил)аміно)етокси]бензил]тіазолідин-2,4-діон (надалі називається «сполука І»). У міжнародній патентній заявці, номер публікації W094/05696, описані деякі солі сполуки ЕР 0306228 і, зокрема, сіль малеїнової кислоти. На цей час було знайдено, що сполука І утворює нову гідрохлоридну сіль (називану надалі «гідрохлорид»), що надзвичайно стійка і, отже, підходить для великомасштабного одержання й обробки. Крім того, гідрохлорид має високу температуру плавлення, виявляє гарну розчинність у воді і має гарні реологічні властивості в масі. Тому гідрохлорид зненацька піддається фармацевтичній обробці у великих масштабах і, особливо, великомасштабному здрібнюванню. Нову форму можна одержати ефективним, економічним і відтворюваним способом, що особливо підходить для великомасштабного одержання. Новий гідрохлорид має, крім того, корисні фармацевтичні властивості і, зокрема, показано, що він придатний для лікування і/або профілактики цукрового діабету і деяких його ускладнень. Відповідно, у цьому винаході представлений гідрохлорид 5-[4-[2-(N-метил-N-(2піридил)аміно)етокси]бензил]тіазолідин-2,4-діону, який характеризується: (і) інфрачервоним спектром поглинання, в основному, відповідно до Фіг.1; і/або (іі) спектром комбінаційного розсіювання, в основному, відповідно до Фіг.2; і/або (ііі) порошковою рентгенограмою (XRPD), в основному, відповідно до Фіг.3; і (iv) спектром 13С ЯМР твердого тіла, в основному, відповідно до Фіг.4. В одному з переважних аспектів гідрохлорид має інфрачервоний спектр поглинання, в основному, відповідно до Фіг.1. В наступному аспекті гідрохлорид має спектр комбінаційного розсіювання, в основному, відповідно до Фіг.2. В одному з переважних аспектів гідрохлорид має порошкову рентгенограму (XRPD), в основному, відповідно до Фіг.3. В одному з переважних аспектів гідрохлорид має спектр 13С ЯМР твердого тіла, в основному, відповідно до Фіг.4. Крім того, гідрохлорид має температуру плавлення в інтервалі від 160 до 168°С, таку як від 163°С до 167°С, наприклад, 167°С. Даний винахід містить в собі гідрохлорид, виділений в чистому виді, чи у виді суміші з іншими речовинами. Таким чином, в одному з аспектів гідрохлорид наданий у виділеній формі. У наступному аспекті гідрохлорид наданий в очищеному виді. У ще одному аспекті гідрохлорид наданий у кристалічному виді. У винаході наданий також гідрохлорид у виді твердої фармацевтично прийнятної форми, такої як тверда лікарська форма, особливо, придатної для перорального введення. Крім того, винахід відноситься також до гідрохлориду у фармацевтично прийнятній формі, особливо, у виді насипної форми, при цьому така форма надзвичайно здатна до здрібнювання. Тому винахід також відноситься до гідрохлориду в здрібненій формі. Крім того, винахід відноситься також до гідрохлориду у фармацевтично прийнятній формі, особливо, у виді насипної форми, при цьому така форма має гарні реологічні властивості, особливо, гарні реологічні властивостями в масі. Винахід відноситься також до способу одержання гідрохлориду, що полягає в тому, що 5-[4-[2-(N-метилN-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діон (сполука І) чи його сіль, переважно дисперговані чи розчинені в придатному розчиннику, вводять у взаємодію з джерелом іона хлору; з наступним виділенням гідрохлориду. Підходящим чином в реакції використовують сполуку (І), особливо в протонованій формі. Підходящим чином в реакції використовують сіль сполуки (І). Сполука (І), переважно, знаходиться в протонированной формі. Підходящим розчинником є алканол, наприклад, пропан-2-ол, вуглеводень, такий як толуол, кетон, такий як ацетон, складний ефір, такий як етилацетат, простий ефір, такий як тетра-гідрофуран, нітрил, такий як ацетонітрил, вуглеводень, що містить галоген, такий як хлористий метилен, органічна кислота, така як оцтова кислота, або вода, або їх суміш. Зручно, щоб джерелом іона хлору був розчин хлористого водню у відповідному розчиннику, наприклад, пропан-2-олі. Альтернативно, джерелом іона хлору може бути водяний розчин хлористого водню, такий як концентрована хлористоводнева кислота. Альтернативним джерелом іона хлору для одержання солі сполуки (І) є сіль хлористоводневої кислоти з основою, наприклад, хлорид амонію, чи сіль хлористоводневої кислоти з аміном, наприклад, етиламіном чи діетиламіном. Концентрація сполуки (І), переважно, знаходиться в інтервалі від 3 до 25% маса/об'єм, більш переважно, в інтервалі від 5 до 20%. Концентрація розчинів хлористоводневої кислоти, переважно, знаходиться в інтервалі від 3 до 50% маса/об'єм. Реакцію звичайно проводять при температурі навколишнього середовища, чи при підвищеній температурі, хоча можна використовувати будь-яку зручну температуру, що забезпечує необхідний продукт. Переважна температура знаходиться в інтервалі від 20-120°С, така як від 40°С до 90°С, наприклад, 70°С. Виділення необхідної сполуки, як правило, містить в собі кристалізацію з відповідного розчинника, зручно, щоб з розчинника реакції, звичайно шляхом охолодження до температури в інтервалі від 0°С до 40°С, наприклад, 20°С. Наприклад, гідрохлорид можна кристалізувати зі спирту, такого як пропан-2-ол, нітрилу, такого як ацетонітрил, чи простого ефіру, такого як те-трагідрофуран. В одній із переважних форм виділення містить в собі початкову кристалізацію при підвищеній температурі, такій як від 50°С до 90°С, переважно, від 65°С до 75°С, а потім охолодження до другої температури підходящим чином в інтервалі від 0°С до 40°С для повної кристалізації. Кристалізацію можна також ініціювати за допомогою затравки за допомогою кристалів гідрохлориду, але це не є необхідним. Сполуку (І) одержують по відомих методиках, таких як методики, описані в ЕР 0306228 і W094/05659. Описи ЕР 0306228 і W094/05659 включені тут як посилання. Використаний тут термін «Тпочаток» звичайно визначається диференціальною скануючою калориметрією і має значення, звичайно зрозуміле в даній галузі, таке, наприклад, як викладене в «Pharmaceutical Thermal Analysis, Techniques and Applications», Ford and Timmims, 1989, як «температура, що відповідає перетинанню предперехідної базисної лінії з екстрапольованим переднім фронтом переходу». Використаний тут у відношенні деяких сполук термін «гарні реологічні властивості» характеризується тим, що зазначена сполука має співвідношення Хауснера, менше чи рівне 1,5, особливо, менше чи рівне 1,25. «Співвідношення Хауснера» є термін, прийнятий в даній галузі. Використаний тут термін «профілактика станів, пов'язаних з цукровим діабетом», містить в собі лікування станів, таких як стійкість до інсуліну, знижена переносимість глюкози, гіперінсулінемія і гестаційний діабет. Цукровий діабет, переважно, означає цукровий діабет II типу. Стани, пов'язані з діабетом, містять в собі гіперглікемію і стійкість до інсуліну й ожиріння. Інші стани, пов'язані з діабетом, містять в собі гіпертензію, серцево-судинне захворювання, особливо, атеросклероз, деякі порушення при прийнятті їжі, зокрема, регулювання апетиту і прийому їжі суб'єктом, що страждає розладами, пов'язаними з недоїданням, такими як нервова анорексія, і розладами, пов'язаними з переїданням, такими як ожиріння й анорексія булімія. Інші стани, пов'язані з діабетом, містять в собі синдром полікистоза яєчників і викликану стероїдами стійкість до інсуліну. Ускладнення станів, пов'язаних з цукровим діабетом, зазначені тут, містять в собі захворювання нирок, особливе захворювання нирок, пов'язане з розвитком діабету II типу, включаючи діабетичну нефропатію, гломеролунефрит, гломеролусклероз, нефротичний синдром, гі-пертензивний склероз нирок і останню стадію захворювання нирок. Як зазначено вище, сполука відповідно до винаходу має корисні терапевтичні властивості. Відповідно, цей винахід відноситься до гідрохлориду, що використований як активна терапевтична сполука. Більш конкретно, цей винахід відноситься до гідрохлориду, придатному при лікуванні і/або профілактиці цукрового діабету, станів, пов'язаних з цукровими діабетом, і деяких його ускладнень. Гідрохлорид можна вводити сам по собі чи, переважно, у виді фармацевтичної композиції, що містить також фармацевтично прийнятний носій. Склад гідрохлориду звичайно такий, як описаний для сполуки (І) у згаданих вище публікаціях. Відповідно, в цьому винаході надана також фармацевтична композиція, що містить гідрохлорид і фармацевтично прийнятний носій для нього. Звичайно гідрохлорид вводять у виді дозованої лікарської форми. Активну сполуку можна вводити будь-яким придатним способом, але звичайно, перо-ральним чи парентеральным шляхами. Для подібного використання сполуку звичайно будуть застосовувати у виді фармацевтичної композиції в сполученні з фармацевтичним носієм, розріджувачем і/або ексципієнтом, хоча точна форма даної композиції буде, природно, залежати від способу введення. Композиції одержують шляхом змішання і підходящим чином застосовують для перорального, парентерального чи місцевого введення, і, в якості таких, вони можуть знаходитися у формі таблеток, капсул, рідких сполук для перорального введення, порошків, гранул, коржів, пастилок, порошків, що розбавляються , чи розчинів суспензій для ін'єкцій та вливань, супозиториїв і чрезшкірних пристроїв. Переважними є композиції, що вводяться перорально, зокрема, сформульовані пероральні композиції, оскільки вони зручніші для загального використання. Таблетки і капсули для перорального введення звичайно представлені у формі разової дози і містять звичайні ексципієнти, такі як зв'язувальні речовини, наповнювачі, розріджувачі, таблетируючі речовини, речовини, що змазують, розпушувачі, барвники, ароматизуючи речовини і змочувальні речовини. Таблетки можуть бути покриті оболонкою відповідно до добре відомих в даній галузі способів. Придатні для використання наповнювачі містять в собі целюлозу, манит, лактозу та інші аналогічні агенти. Підходящі розпушувачі містять в собі крохмаль, полівінілпіролідон і похідні крохмалю, такі як гліколят натрієвого крохмалю. Придатні змазуючи речовини містять в собі, наприклад, стеарат магнію. Підходящі фармацевтично прийнятні змочувальні агенти містять в собі лаурилсульфат натрію. Тверді пероральні композиції можна приготувати звичайними способами змішування, наповнення, таблетування та т.п. Для розподілу активного агента в таких композиціях можна використовувати повторні операції змішування з використанням великих кількостей наповнювачів. Подібні операції, природно, звичайні в даній галузі. Пероральні рідкі препарати можуть бути у формі, наприклад, суспензій у воді або олії, розчинів, емульсій, сиропів або еліксирів, чи можуть являти собою сухий продукт для розведення водою чи іншим придатним носієм перед використанням. Подібні рідкі препарати можуть містити додаткові добавки, такі як суспендуючі агенти, наприклад, сорбіт, сироп, метилцелюлозу, желатин, гідроксиетилцелюлозу, карбоксиметилцелюлозу, гель стеарата алюмінію або гідровані харчові жири, емульгатори, наприклад, лецитин, сорбітмоноолеат або аравійську камедь; неводні носії (які можуть містити в собі харчові олії), наприклад, мигдальна олія, фракціонована кокосова олія, жирні складні ефіри, такі як складні ефіри гліцерину, пропіленгліколя чи етилового спирту; консерванти, наприклад, метил або пропил nгідроксибензоат або сорбінову кислоту, і, при бажанні, звичайні ароматизуючі або фарбуючі агенти. Для парентерального введення готують рідкі дозовані лікарські форми, що містять сполуки цього винаходу і стерильний носій. Сполука, в залежності від носія і концентрації, може бути або суспендована, або розчинена. Парентеральні розчини звичайно готують шляхом розчинення діючої речовини в носії і стерилізацією фільтруванням перед поміщенням у відповідну ампулу і герметизацією. Переважно, допоміжні речовини, такі як місцева знеболююча речовина, консерванти і буферні агенти також розчиняють у носії. Для підвищення стійкості композицію можна заморозити у вакуумі після заповнення ампули і видалення води. Парентеральні суспензії готують в основному таким же чином, за винятком того, що активний агент суспендують у носії замість того, щоб розчиняти його, і стерилізують, піддаючи дії оксиду етилену перед суспендуванням у стерильному носії. Переважно, для полегшення рівномірного розподілу активного агента в композицію включають поверхнево-активну речовину чи змочувальну речовину. Як загальноприйнято, композиції звичайно будуть супроводжуватися написаними або надрукованими інструкціями для застосування при розглянутому лікуванні. Використаний тут термін «фармацевтично прийнятний» містить в собі сполуки, композиції та інгредієнти для використання як для людей, так і у ветеринарії: наприклад, термін «фармацевтично прийнятна сіль» містить в собі прийнятну у ветеринарії сіль. Крім того, цей винахід відноситься до способу лікування і/або профілактики цукрового діабету, станів, пов'язаних з цукровим діабетом і деякими його ускладненнями, у ссавця - людини, чи не людини, - який містить в собі введення ссавцю - людині, чи не людині, яка потребує це, ефективної нетоксичної кількості гідрохлориду. Композиції складають відповідно до звичайних способів, таких як способи, описані в стандартних еталонних посібниках, наприклад, British and US Pharmacopoeias, Remington's Pharmaceutical Sciences (Mack Publishing Co.), Martindale The Complete Drag Reference (London, The Pharmaceutical Press) і Harry's Cosmeticology (Leonard Hill Books). Активний агент зручно вводити у виді визначеної вище фармацевтичної композиції, і це складає особливий аспект цього винаходу. У наступному аспекті цього винаходу представлене використання гідрохлориду для одержання лікарського засобу для лікування і/або профілактики цукрового діабету, станів, пов'язаних з цукровим діабетом, і деяких його ускладнень. При лікуванні і/або профілактиці цукрового діабету, станів, пов'язаних з цукровим діабетом, і деяких його ускладнень, гідрохлорид можна приймати в таких кількостях, щоб забезпечити сполуку І в придатних дозах, таких як дози, описані в ЕР 0306228 і W094/05659. Для сполук згідно з винаходом не виявлено несприятливих токсикологічних ефектів при зазначених вище лікуваннях. Наступні приклади ілюструють винахід, але ніяким чином його не обмежують. Приклад 1. Гідрохлорид 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону Суміш 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону (9,0г) і пропан-2-ола (180мл) перемішували і нагрівали до 75°С. Додавали розчин хлористого водню в пропан-2-оле (7,5мл, 5-6н) і перемішували суміш протягом 1 години при 75°С, а потім охолоджували до 21°С. Продукт виділяли фільтруванням, промивали пропан-2-олом (25мл) і сушили у вакуумі над п'ятиокисом фосфору протягом 16 годин, одержуючи зазначене в заголовку сполуку (9,8г) у виді білої кристалічної твердої речовини. Вміст іонного хлору: 8,7% маса/маса Вміст води (Карл-Фішер): 0,3% маса/маса 1 Н ЯМР (ДМСО-d6): відповідає гідрохлориду 5-[4-[2-(N-метил-N-(2піридил)аміно)етокси]бензил]тіазолідин-2,4-діону, що містить пропан-2-ол у кількості 2,1% маса/маса. Приклад 2. Гідрохлорид 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону Суміш 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону (6,0г) і пропан-2-она (120мл) нагрівали до 50°С перед додаванням розчину хлористого водню в пропан-2-олз (5,0мл, 5-6н). Температуру реакції підвищували до 70°С і продовжували перемішування при цій температурі протягом 2 годин, під час яких було помічено початок кристалізації. Після охолодження до 21°С продукт виділяли фільтруванням, промивали пропан-2-олом (20мл) і сушили у вакуумі над п'ятиокисом фосфору, одержуючи гідрохлорид 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону (6,31г) у виді білої кристалічної твердої речовини. Приклад 3. Гідрохлорид 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону Суміш 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону (6,0г) і ацетонітрила (120мл) перемішували і нагрівали до 50°С і додавали розчин хлористого водню в пропан-2-олі (5,0мл, 5-6н). Реакційну суміш нагрівали до 70°С і перемішували при цій температурі 60 хвилин, протягом яких було помічено початок кристалізації. Після охолодження до 21°С продукт виділяли фільтруванням, промивали ацетонітрилом (20мол), а потім сушили у вакуумі над п'ятиокисом фосфору, одержуючи гідрохлорид 5-[4-[2(Ν-метил-Ν-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону (5,7г) у виді білої кристалічної твердої речовини. Приклад 4. Гідрохлорид 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону Суміш 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону (6,0г) і тетрагідрофурана (120мл) перемішували і нагрівали до 65°С. Додавали розчин хлористого водню в пропан-2-олі (5,0мл, 5-6 н) і перемішували реакційну суміш при 65°С протягом 2 годин, а потім охолоджували до 21°С. Продукт виділяли фільтруванням, промивали тетрагідрофураном (20мл) і сушили у вакуумі над п'ятиокисом фосфору, одержуючи гідрохлорид 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону (6,25г) у виді білої кристалічної твердої речовини. Приклад 5. Гідрохлорид 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону До розчину, що перемішується, 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону (3,0г) у пропан-2-олі (90мл) при кип'ятінні додавали концентровану хлористоводневу кислоту (0,85мл). Розчин витримували при кипінні протягом 15 хвилин, а потім охолоджували до 0°С, при цьому спостерігали випадання олії. Після цього суміш нагрівали до 50°С для одержання прозорого розчину перед тим, як остудити до 50°С, щоб викликати кристалізацію. Суміш охолоджували ще до 21°С і виділяли осад фільтруванням, одержуючи гідрохлорид 5-[4-[2-(N-метил-N-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4діону (2,61г) у виді білої кристалічної твердої речовини. Характеристики, що одержані для продукту приклада 1 Спектр поглинання інфрачервоного випромінювання дисперсії продукту у вазеліновій олії одержували з використанням спектрометра Nicolet 710 FT-IR при розділенні 2см-1 (Фіг.1). Дані представляли в цифровому виді з інтервалами в 1см-1. Смуги спостерігали при: 2748, 1742, 1697, 1640, 1604, 1543, 1511, 1413, 1351, 1329, 1251, 1232, 1205, 1179, 1159, 1108, 1057, 1028, 996, 973, 925, 902, 817, 764, 737, 710, 662, 617, 601, 591, 557, 525, 505см-1. Інфрачервоний спектр твердого продукту записували з використанням спектрометра Perkin-Elmer Spectrum One FT-IR, оснащеного універсальною ATR приставкою. Смуги спостерігали при: 2748, 1742, 1687, 1639, 1603, 1543, 1510, 1461, 1413, 1328, 1301, 1250, 1231, 1205, 1179, 1156, 1056, 1028, 996, 973, 925, 901, 817, 762, 738, 709, 661см-1. Спектр комбінаційного розсіювання продукту (Фіг.2) записували зі зразка в скляній ампулі з використанням спектрометра Perkin-Elmer 2000R FT-Raman, при розділенні 4см-1 зі збудженням від лазера Nd:YAG (1064нм) з потужністю вихідного сигналу 400 мВт. Смуги спостерігали при: 3100, 3056, 2931, 1744, 1610, 1586, 1544, 1461, 1440, 1377, 1351, 1319, 1289, 1253, 1232, 1208, 1177, 1095, 1028, 998, 980, 925, 900, 840, 825, 772, 740, 714, 664, 637, 619, 606, 469, 430,397,340,300см-1. Порошкову рентгенограму продукту (Фіг.3) записували в наступних умовах збору даних: трубчастий анод: Сu, напруга генератора: 40кВ, струм генератора: 40мА, початковий кут: 2,0°2q, кінцевий кут: 35,0°26, розмір кроку: 0,02°2q, проміжок часу на крок: 2,5 секунд. Характеристичні кути XRPD і відносні інтенсивності приведені в таблиці 1. Таблиця 1 Кут 2-Тета° 5,5 6,7 8,7 11,1 12,0 12,7 13,5 14,7 15,1 15,5 16,3 16,8 17,4 17,7 18,2 18,5 18,8 19,8 20,3 21,2 21,7 21,9 22,5 23,2 23,6 24,2 25,1 25,5 25,9 26,4 27,3 7,8 28,1 28,8 29,3 29,9 30,5 30,9 31,8 32,9 33,1 34,3 Відносна інтенсивність % 15,4 14,1 3,3 39,4 9,2 20,3 40,8 40,8 14,5 38,1 30,2 18,5 27,1 34,6 26,7 26 38,8 31 11,7 16,7 26,4 26 14,7 26,2 90,8 100 49,6 68,5 29,3 16,8 25,6 15,4 28,8 21,6 44,1 20,9 17,8 16,8 24 18,7 22 22,7 Спектр ЯМР продукту (Фіг.4) записували на приладі Bruker AMX36 з робочою частотою 90,55МГц: тверду речовину поміщали в 4-мм цирконієвий MAS ротор, оснащений кришкою Kel-F, і обертали ротор приблизно при 10 кгц. Спектр 13С ЯМР MAS одержували крос-поляризацією від погоджених по ХартманнуХану протонів (час СР контакту 3мс, час повторення імпульсу 15мс) і протони придушували під час запису з використанням комбінованої послідовності модулювання фази зі здвоєним імпульсом (ТРРМ). Хімічні зрушення відносили по зовнішньому стандарті карбоксилатного сигналу гліцину при 176,4м.д. відносно ТМС і спостерігали при: 39,0, 52,5, 54,9, 64,1, 67,3, 11,6, 114,4, 131,0, 137,0, 144,2, 151,3, 156,4, 158,5, 171,6, 175,5, 177,9м.д. Властивості гідрохлориду, відзначені для продукту приклада 1 Стійкість гідрохлориду у твердому стані Стійкість лікарської речовини у твердому стані визначали шляхом збереження приблизно 1,0г речовини в скляній судині при а) 40°С/75%-ній відносній вологості (ВВ), у відкритому стані, протягом 1 місяця і b) при 50°С, у закритому стані, протягом 1 місяця. Речовину аналізували методом ВЭЖХ на предмет кінцевого змісту і продуктів розкладення в обох випадках. a) 40°С/75%-на ВВ: істотного розкладання не спостерігалося (по аналізу методом ВЭЖХ 100% початкового). b) 50°С: істотного розкладання не спостерігалося (по аналізу методом ВЭЖХ 101% початкового). Розчинність гідрохлориду Розчинність речовини визначали, додаючи воду у виді аліквот від 1 до 1000мл приблизно до 100мг лікарської речовини до розчинення порошку. Візуальну розчинність підтверджували ВЭЖХ аналізом насиченого розчину. Розчинність: 25мг/мл. Температура плавлення гідрохлориду Температуру плавлення гідрохлориду визначали методом, описаним у U.S. Pharmacopoeia, USP 23, 1995, «Melting range of temperature, Procedure for Class la», з використанням апарата для плавлення Buchi 545. Т. пл.: 167°С. Тпочаток гідрохлориду Тпочаток лікарської речовини визначали методом диференційної скануючої калориметрії за допомогою приладу Perkin-Elmer DSC. Продукт приклада 1: Тпочаток (10°С/хвилину, відкрита кювета): 165°С Продукт приклада 2: Тпочаток (10°С/хвилину, відкрита кювета): 163°С
ДивитисяДодаткова інформація
Назва патенту англійськоюHydrochloride salt of 5-[4-[2-(n-methyl-n-(2-pyridyl)amino)ethoxy]benzyl]thiazolidine-2,4-dione, a process for preparing thereof and a pharmaceutical composition
Назва патенту російськоюСоль гидрохлорида 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, способ ее получения и фармацевтическая композиция
МПК / Мітки
МПК: A61P 1/14, A61P 3/10, A61P 13/12, C07D 417/12, A61P 3/04, A61P 9/10, A61P 5/50, A61P 25/00, A61K 31/4439, A61P 9/12, A61P 3/00
Мітки: спосіб, гідрохлориду, фармацевтична, 5-[4-[2-(n-метил-n-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону, композиція, одержання, сіль
Код посилання
<a href="https://ua.patents.su/6-74003-sil-gidrokhloridu-5-4-2-n-metil-n-2-piridilaminoetoksibenziltiazolidin-24-dionu-sposib-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Сіль гідрохлориду 5-[4-[2-(n-метил-n-(2-піридил)аміно)етокси]бензил]тіазолідин-2,4-діону, спосіб її одержання та фармацевтична композиція</a>
Попередній патент: Спосіб вилучення сполук сірки з вуглеводневого палива
Наступний патент: Похідні піразоло[1,5-a]піримідину та фармацевтична композиція на їх основі
Випадковий патент: Панелі з цеглою та спосіб їх збирання