Спосіб виробництва нітратної кислоти
Номер патенту: 81946
Опубліковано: 10.07.2013
Автори: Лорія Марина Геннадіївна, Тюльпінов Олександр Дмитрович, Федотов Роман Миколайович, Тюльпінов Костянтин Олександрович, Целіщев Олексій Борисович, Ліщишина Тетяна Павлівна, Захаров Іван Івановіч
Формула / Реферат
Спосіб виробництва нітратної кислоти абсорбцією оксидів нітрогену, який відрізняється тим, що оксиди нітрогену отримують шляхом окиснення азоту повітря в присутності пари нітратної кислоти, яку частково рециркулюють з продукційною азотною кислотою, при опроміненні реакційної суміші світлом з довжиною хвилі 662 нм, суміщеним з абсорбцією оксидів нітрогену розчином перекису водню.
Текст
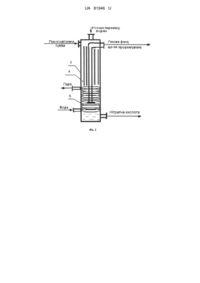
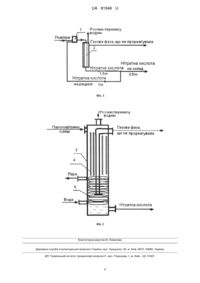
Реферат: Спосіб виробництва нітратної кислоти абсорбцією оксидів нітрогену. Оксиди нітрогену отримують шляхом окиснення азоту повітря в присутності пари нітратної кислоти, яку частково рециркулюють з продукційною азотною кислотою, при опроміненні реакційної суміші світлом з довжиною хвилі 662 нм, суміщеним з абсорбцією оксидів нітрогену розчином перекису водню. UA 81946 U (12) UA 81946 U UA 81946 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі хімічної промисловості, зокрема виробництва нітратної кислоти. Відомий спосіб одержання нітратної кислоти відбувається шляхом окиснення аміаку, охолодження нітрозних газів з утворенням конденсату нітратної кислоти і послідовною подачею нітрозних газів і конденсату на стадію абсорбції, з отриманням концентрованої нітратної кислоти [Атрощенко В.И., Каргин С.И. Технология азотной кислоты - Μ.: Химия, - 1970]. Недоліком способу є: використання як сировини аміаку, який виробляється з дорогого природного газу; необхідність каталітичного очищення вихлопних газів (вміст оксидів нітрогену в газах, що відходять, на виході з абсорбційної колони близько 0,1 %), що обмежує можливість підвищення економічного процесу. Найбільш близьким по технічній суті та результату, що досягається, до способу, що заявляється, є спосіб виробництва нітратної кислоти, що включає такі стадії: каталітичне окиснення аміаку киснем повітря до оксиду нітрогену (II) з утворенням нітрозного газу; охолодження нітрозного газу до температури не більше 290 °C; гомогенне окислення оксиду нітрогену (II) нітрозного газу до оксиду нітрогену (IV); охолодження нітрозного газу до температури не більше 200 °C; охолодження нітрозного газу в холодильниках-конденсаторах до температури не більше 65 °C з конденсацією водяної пари з утворенням нітратної кислоти та абсорбцію оксидів нітрогену водою з одержанням продукційної нітратної кислоти в абсорбційній колоні в присутності нітратної кислоти, утвореної в результаті конденсації водяної пари в холодильниках-конденсаторах [Общая химическая технология, под редакцией проф. И.П. Мухлѐнова. Ч. 2, - М.: Высшая школа, 1977, - С. 61-62]. Недоліком способу також є використання як сировини аміаку, який виробляється з дорогого природного газу, та є необхідність каталітичного очищення вихлопних газів. Нітрозний газ, що містить оксиди (монооксид та діоксид) нітрогену, що необхідні для виробництва нітратної кислоти, одержують у процесі каталітичного окиснення аміаку. У процесі охолодження та до окиснення нітрозного газу здійснюється безперервне окиснення монооксиду нітрогену в діоксид нітрогену по реакції: 2NO+O2=2NO2+112,4 кДж. В абсорбційній колоні діоксид нітрогену взаємодіє з водою з утворенням продукційної нітратної кислоти та вторинного оксиду нітрогену по сумарній реакції: 3NO2+H2O=2HNO3+NO+136,2 кДж. Монооксид нітрогену, що утворюється при взаємодії діоксиду нітрогену з водою, потребує додаткового окиснення. Процес окиснення вторинного оксиду нітрогену протікає в основному в міжтарілчаному просторі в гомогенних умовах. По мірі зниження концентрації оксидів нітрогену по ходу газу, швидкість реакції окиснення вторинного оксиду нітрогену зменшується. Вона далі контролює весь процес кислотоутворення та обумовлює високий вміст оксидів нітрогену в газі, що відходить. Саме в цих умовах складно підвищити ступінь переробки оксидів нітрогену в кислоту, тому що в цій системі, в рідкій фазі, є стійка концентрація нітрітної кислоти, яка легко утворюється в результаті гідролізу двооксиду нітрогену водою в слабкій нітратній кислоті, а в газовій фазі є NO+NO2, які потребують додаткового реакційного об'єму і/або часу для гомогенного окиснення монооксиду нітрогену, швидкість якого контролює весь процес кислотоутворення. Цей спосіб отримання нітратної кислоти взято за прототип. В основу корисної моделі поставлена задача удосконалення способу виробництва нітратної кислоти, в якому шляхом часткової зміни сировини і умов відомого способу, забезпечується можливість отримання нітратної кислоти без використання як сировини природного газу і виключення викиду оксидів нітрогену з виробництва. Поставлена задача досягається тим, що оксиди нітрогену отримують шляхом окиснення азоту повітря в присутності пари нітратної кислоти, яку частково рециркулюють з продукційною азотною кислотою, при опроміненні реакційної суміші світлом з довжиною хвилі 662 нм, суміщеним з абсорбцією оксидів нітрогену розчином перекису водню. У порівнянні з прототипом запропонований спосіб дозволяє: - не використовувати природний газ, - не викидати в атмосферу оксиди нітрогену. Здійснення процесу у виробничих умовах дозволить отримувати оксиди нітрогену з повітря і, таким чином, зменшити витрати на основну сировину порядку 30 %. Витрати на перекис водню, ціна якого приблизно дорівнює ціни на нітратну кислоту, покривається прибутком за рахунок додатково отриманої нітратної кислоти. Крім того будуть відсутні витрати на каталітичне очищення нітрозних газів. Окислювальна здатність нітратної кислоти вважається неперевершеною. Так, п'ятнадцять років тому, російський хімік М.М. Караваєв добився успіхів в окисненні хімічно інертного молекулярного азоту в парах нітратної кислоти при температурі 793-1173 К [Караваєв М.М., 1 UA 81946 U 5 10 15 20 25 30 35 40 45 50 55 60 Матышак В.А. Гетерогенно-каталитическое окиснение азота парами азотной кислоты // Хим. пром.-1998. - № 9. - С. 537-542]. Нами за допомогою методу B3LYP/6-311++G(3df, 3pd) в теорії функціонала щільності (DFT), 2 була проаналізована реакційна здатність збудженого стану триокису азоту ΝΟ 3( Α1) в окислювальних реакціях з N2 і N2O. 3 детальних квантово-хімічних досліджень зроблений * висновок, що NO3 (збуджений стан триокису азоту) і ONNO* (збуджений стан димеру окису нітрогену) є основними учасниками фотохімічного окислення молекулярного азоту і закису нітрогену. На основі отриманих результатів, надано квантово-хімічне обґрунтування "ефекту Караваєва" (приріст оксидів нітрогену NOх до 25-50 % у суміші повітря з парами нітратної кислоти) [Zakharov I.I. Quantum Chemistry of Nitric Acid: Electronic Structure and Reactivity of its Decomposition Products // Advances in Chemistry Research.-2012. - Volume 16. - P. 1-51. Editors: James С. Taylor, N.Y.: Nova Science Publishers (USA)]. Запропоновано новий механізм для розробки спрощеного і ефективного процесу отримання нітратної кислоти: (1) 4HΝΟ3 ↔ 2N2O5+2Н2О, (2) 2N2O5 ↔ 2NO2+2NO3, * (3) 2NO3+hc/λ (λ=662 nm) → 2NO3 * (4) NO3 +N2 → NO2+N2O, * * (5) NO3 +N2O → NO2+ONNO → NO2+2NO, (6) 2NO+O2 → 2NO2, (7) 6NO2+3HOOH → 6HNO3 В ході такого процесу виробництва нітратної кислоти, система репродукує до 50 % від її початкової кількості. Отже, порядку 2/3 нітратної кислоти з вихідного потоку необхідно знову повернути в технологічну схему, а решту (порядку 1/3) вивести як готовий продукт. Цей новий механізм отримання HΝΟ3 принципово відрізняється від діючих промислових способів. Спосіб отримання нітратної кислоти, що заявляється, без використання аміаку (дорогого, токсичного, з внутрішньо властивими йому екологічними проблемами) має економічні і екологічні переваги. Т.М. Нагієв провів успішне окислення молекулярного азоту в парах перекису водню при температурах ~ 800 K [Нагиев Т.М. Сопряженные реакции окисления перекисью водорода // Успехи химии.-1985. - Т. 54, № 10. - С. 1654-1673]. Нами з використанням методу B3LYP/6311++G(3df, 3pd) в теорії DFT доведена можливість взаємодії збудженого стану пероксидного 2 радикалу НОО*( А') з N2, з отриманням N2O - "ефект Нагієва" [Захаров И.И., Лория М.Г., Целищев А.Б. Структура интермедиата HOO-N=N-OOH при активации N2 перекисью водорода. Квантовохимические DFT-расчеты // Журнал структ. химии.-2013. - Т. 54, № 1. - С. 17-24]. Реакція окиснення N2 протікає за таким механізмом: (і) - термічне розкладення перекису водню, з отриманням гідроксильних радикалів; (іі) взаємодія гідроксильного радикалу з перекисом 1 водню; реакція (ііі) димерізації радикалів НО2, з отриманням Н2О2 і О2( Δg); (iv) 1 фотосенсибілізація пероксидного радикалу синглетним киснем O2( Δg); (v) окиснення Ν2 збудженими пероксидними радикалами НОО*: (i) НООН → ОН+ОН, 2 (іі) ΟΗ+ΗΟΟΗ → Η2Ο+ООН( А"), 2 2 1 1 (ііі) HОО( А")+HОO( А") → ΗΟΟΗ( Α1)+O2*( Δg), 1 2 3 2 (iv) Ο2*( Δg)+НОО( А") → О2( Σg)+HОО*( А'), (ν) НОО*+Ν2+НОО* → Н2О+О2+Ν2Ο. Застосування водного розчину перекису водню не забруднює реакційне середовище побічними продуктами. Взаємодія перекису водню з оксидами нітрогену в загальному вигляді може бути наведено брутто - рівняннями: 2ΝΟ+3Н2О2 → 2HNO3+2Н2О 2ΝΟ2+Н2О2 → 2ΗΝΟ3 Запропонований спосіб включає стадію отримання оксидів нітрогену, які отримують шляхом окиснення азоту повітря в присутності пари нітратної кислоти, яку частково рециркулюють з продукційною азотною кислотою, при опроміненні реакційної суміші світлом з довжиною хвилі 662 нм, суміщеним з абсорбцією оксидів нітрогену розчином перекису водню. На підставі квантово-хімічних DFT розрахунків в роботі запропоновано схема і реактор екологічно чистого процесу репродукції нітратної кислоти. Наш спосіб направлений на пошук принципово нового методу зв'язування атмосферного азоту. Він дозволить відмовитися у виробництві нітратної кислоти від окиснення дорогого аміаку, синтез якого на початковій стадії вимагає великої кількості природного газу. Відмітимо також, що основні екологічні проблеми, що притаманні виробництву нітратної кислоти, виникають через використання в ньому саме аміаку. Спосіб, що заявляється, ґрунтується на суміщеному процесі окиснення Ν2 продуктами термічного розкладання нітратної кислоти (ефект Караваєва) і продуктами термічного 2 UA 81946 U 5 10 15 20 25 30 35 40 розкладання перекису водню (ефект Нагієва), з можливістю рециркуляції первинної кількості HNO3. Сировиною є атмосферне повітря і розчин перекису водню. Запропонований спосіб пояснюється фіг. 1 та фіг. 2. На фіг. 1 приведена схема виробництва нітратної кислоти, що складається із з'єднаних між собою випарника-насичувача 1 і реактора синтезу нітратної кислоти 2. На фіг. 2 наведено реактор синтезу нітратної кислоти, який має: - корпус 3, підігрівачвипромінювач 4, теплообмінник 5. Корпус реактора виконано із кварцової труби довжиною 1,5 м із внутрішнім діаметром 70 мм. У підігрівач-випромінювач 1 подають повітря і нітратну кислоту, яку рециркулюють. Пароповітряну суміш, що містить пару нітратної кислоти, через патрубок подають в реактор 2, корпус 3 якого виконано із кварцової труби. Через інший патрубок уприскують розчин перекису водню. Перекис водню випаровується. Газова суміш, що утворилася, проходить через реакційну зону, в якій встановлено підігрівач-випромінювач 4. Газова суміш підігрівається і зазнає хімічних перетворювань. Продукт, що утворився, надходить в зону охолодження, де встановлено теплообмінник 5. У зоні охолодження відбувається конденсація розчину нітратної кислоти і розділення рідкої і газової фаз. Газова фаза (компоненти повітря, що не прореагували) виводиться з реактора у верхній частині реактора. Одержану нітратну кислоту відводять знизу реактора. Частину нітратної кислоти направляють у випарник-насичувач 1, іншу на склад. Запропонований спосіб пояснюється прикладом здійснення способу. Приклад Перед запуском установки випарник-насичувач заповнюють 56 % нітратною кислотою. Потім 3 в випарник-насичувач подають 0,34 м /годину повітря і насосом забезпечують подачу 1,53 літр/година 40 % нітратної кислоти знизу реактора синтезу нітратної кислоти. Паровоповітряну суміш, що містить пару нітратної кислоти, через патрубок подають в реактор 2. Через інший патрубок уприскують 43 % розчин перекису водню у кількості 1,02 літр/година. Опромінення і розігрів реакційної суміші забезпечують розжаренням ніхромової спиралі підігрівачавипромінювача 4 шляхом пропускання електричного струму. В умовах проведених дослідів використовувався ніхромовий дріт діаметром 0,6 мм. Величина електричного струму дорівнювала 5-9 А. Необхідну довжину хвилі світового опромінення (662 нм - рожевий колір) підтримують величиною електричного струму. Температуру в реакційній зоні підтримували в інтервалі 870-1070 К шляхом зміни величини електричного струму. Охолодження реакційних газів і конденсації нітратної кислоти проводили шліхом подачі води в теплообмінник 5 і відводу з нього пари. Одержану нітратну кислоту у кількості 2,29 літр/година відводять знизу реактора. Частину нітратної кислоти в кількості 1,53 літр/година направляють в випарник-насичувач 1, іншу на 3 склад. Газову фазу, що не прореагувала, в кількості 0,264 м /година виводять із реактора у верхній частині реактора. Скидні гази не містять оксидів азоту. Спосіб отримання нітратної кислоти, що заявляється, служить основою економічно ефективної і екологічно чистої технології (без викидів NOх і Ν2Ο) і є перспективним для створення виробництва нітратної кислоти в одну стадію (у одному реакторі). ФОРМУЛА КОРИСНОЇ МОДЕЛІ 45 Спосіб виробництва нітратної кислоти абсорбцією оксидів нітрогену, який відрізняється тим, що оксиди нітрогену отримують шляхом окиснення азоту повітря в присутності пари нітратної кислоти, яку частково рециркулюють з продукційною азотною кислотою, при опроміненні реакційної суміші світлом з довжиною хвилі 662 нм, суміщеним з абсорбцією оксидів нітрогену розчином перекису водню. 3 UA 81946 U Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the production of nitrate acid
Автори англійськоюZakharov Ivan Ivanovych, Tiulpinov Oleksandr Dmytrovych, Tselischev Oleksii Borysovych, Loria Maryna Hennadiivna, Lischyshyna Tetiana Pavlivna, Fedotov Roman Mykolaiovych, Tiulpinov Kostiantyn Oleksandrovych
Назва патенту російськоюСпособ производства нитратной кислоты
Автори російськоюЗахаров Иван Иванович, Тюльпинов Александр Дмитриевич, Целищев Алексей Борисович, Лория Марина Геннадьевна, Лещишина Татьяна Павловна, Федотов Роман Николаевич, Тюльпинов Константин Александрович
МПК / Мітки
МПК: C01B 21/40
Мітки: нітратно, спосіб, кислоти, виробництва
Код посилання
<a href="https://ua.patents.su/6-81946-sposib-virobnictva-nitratno-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб виробництва нітратної кислоти</a>
Попередній патент: Спосіб визначення фальсифікації м’яса забійних тварин та птиці за обробки пероксидом водню
Наступний патент: Спосіб індукції гепатоцелюлярної реорганізації в нащадків експериментальних тварин за умов пренатального програмування
Випадковий патент: Спосіб обробки для інгібування патогенів при виробництві м'ясних продуктів