Спосіб одержання (s)-n-метил-3-(нафтилокси)-3-(2-тієніл)пропіламінгідрохлориду (дулоксетину)
Номер патенту: 94931
Опубліковано: 25.06.2011
Автори: Пласек Лукас, Рідван Людек, Затопкова Моніка, Джарра Камаль, Сінібулк Йозеф
Формула / Реферат
1. Спосіб одержання (S)-N-метил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну формули І
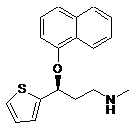 (I)
(I)
або його фармацевтично прийнятних солей, який включає:
a) взаємодію (RS)-N,N-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну формули III
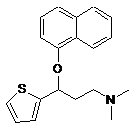 (ІІІ)
(ІІІ)
з оптично активною D-винною кислотою або кислою сіллю, одержаною з D-винної кислоти, з утворенням суміші діастереоізомерних солей N,N-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну та D-винної кислоти (2:1),
b) виділення солі (S)-N,N-диметил-3-(нафтилокси)-3-(2-тієніл)пропіламін/D-тартрату (2:1) із суміші діастереоізомерних солей в органічному розчиннику, воді або їх суміші, та виділення (S)-S,S-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну формули (S)-(III) шляхом дії неорганічної або органічної основи
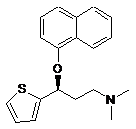 , (S)-III
, (S)-III
c) деметилювання (S)-N,N-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну шляхом дії алкілхлорформіату формули ClCOOR (R=С1-С5-алкіл, або С6-С12-арил або алкіларил), зокрема феніл-, етил- або метилхлороформату, та
d) гідролітичне виділення основи дулоксетину формули І та необов'язкове перетворення основи у сіль придатною кислотою або сіль слабкої основи,
який відрізняється тим, що, як оптично активну речовину, на стадії (а) використовують D-винну кислоту в молярному співвідношенні 1:2 відносно речовини формули III або кислий D-тартрат лужного металу, або тартрат амонію, або, альтеративно, тартрат алкіламонію формули IV
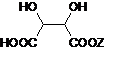 (IV)
(IV)
де Z=H, Li, Na, K, NR3,
R=H, C1-C7,
в молярному співвідношенні 1:1 відносно речовини формули III.
2. Спосіб за п. 1, який відрізняється тим, що реакцію на стадії а) здійснюють у присутності води.
3. Спосіб за п. 2, який відрізняється тим, що реакцію здійснюють в суміші розчинників, яка складається з води та полярного апротонного розчинника у 2-кратному-10-кратному (за об'ємом) надлишку води відносно полярного апротонного розчинника.
4. Спосіб за п. 3, який відрізняється тим, що диметилсульфоксид застосовують як полярний апротонний розчинник.
5. Спосіб за п. 1, який відрізняється тим, що на стадії (b) для виділення солі (S)-N,N-диметил-3-(нафтилокси)-3-(2-тієніл)пропіламін/D-тартрату (2:1) із суміші діастереоізомерних солей використовують розчинник, вибраний з групи аліфатичних та циклічних етерів, С3-С6 кетонів, C3-С3 спиртів та води або їх суміші, та температура становить від 0 до 80 °С.
6. Спосіб за п. 5, який відрізняється тим, що як розчинник використовують водний розчин ТГФ, який містить від 0 до 10 % води.
7. Спосіб за п. 1, який відрізняється тим, що на стадії (d) речовину формули І перетворюють на її гідрохлорид шляхом взаємодії з гідрохлоридною кислотою у середовищі розчинника етилметилкетону, та одержаний гідрохлорид дулоксетину кристалізують із вказаного розчинника.
Текст
1. Спосіб одержання (S)-N-метил-3-(1нафтилокси)-3-(2-тієніл)пропіламіну формули І 2 3 94931 4 5. Спосіб за п. 1, який відрізняється тим, що на стадії (b) для виділення солі (S)-N,N-диметил-3(нафтилокси)-3-(2-тієніл)пропіламін/D-тартрату HOOC COOZ (2:1) із суміші діастереоізомерних солей викорис(IV) товують розчинник, вибраний з групи аліфатичних де Z=H, Li, Na, K, NR3, Z=H, Li, Na, K, NR3 та циклічних етерів, С3-С6 кетонів, C3-С3 спиртів та R=H, C1-C7, води або їх суміші, та температура становить від 0 R=H, C1-C7 в молярному співвідношенні 1:1 відносно речовини до 80 °С. формули III. 6. Спосіб за п. 5, який відрізняється тим, що як 2. Спосіб за п. 1, який відрізняється тим, що реарозчинник використовують водний розчин ТГФ, кцію на стадії а) здійснюють у присутності води. який містить від 0 до 10 % води. 3. Спосіб за п. 2, який відрізняється тим, що реа7. Спосіб за п. 1, який відрізняється тим, що на кцію здійснюють в суміші розчинників, яка складастадії (d) речовину формули І перетворюють на її ється з води та полярного апротонного розчинника гідрохлорид шляхом взаємодії з гідрохлоридною у 2-кратному-10-кратному (за об'ємом) надлишку кислотою у середовищі розчинника етилметилкеводи відносно полярного апротонного розчинника. тону, та одержаний гідрохлорид дулоксетину крис4. Спосіб за п. 3, який відрізняється тим, що диталізують із вказаного розчинника. метилсульфоксид застосовують як полярний апHO OH ротонний розчинник. Галузь винаходу Винахід відноситься до нового способу одержання (S)-N-метил-3-(1-нафтилокси)-3-(2тієніл)пропіламіну формули І, (І) відомого під загальною назвою дулоксетин, та його фармацевтично-прийнятних солей. Передумови винаходу Дулоксетин - це селективний інгібітор зворотного захвату серотоніну та норадреналіну, терапевтично придатний для лікування, наприклад, депресії та сечового нетримання. Одержання дулоксетину та його проміжних продуктів описане, наприклад, у патентах ЕР 0273658, US 5,362,886, WO 2004/005239, US 2003/0225153. Основна використана реакція зображена на наступній схемі 1. Більшість синтезів використовуються для реакції уже оптично активного проміжного продукту формули II, тобто (S)-N,N-диметил-3-гідрокси-3(2-тієніл)пропіламіну. У випадку синтезу багатьох оптично активних речовин, розділення або отримання оптично чистих проміжних продуктів досягається з вищими виходами, ніж при розділенні кінцевих продуктів. Однак, у випадку дулоксетину, виявляється, що при подальшій обробці за Схемою 1, знову має місце рацемізація. Внаслі док цього, кінцевий продукт, отриманий таким шляхом, не є енантіомерно чистим та необхідно перекристалізувати його знову. Безумовно, це знижує продуктивність процесу. Вирішення проблеми небажаної рацемізації у ході реакції за Схемою 1 запропоноване патентною заявкою WO 2004/056795 А1. Автори обрали спосіб одержання рацемічного дулоксетину та його розділення за допомогою придатної хіральної кислоти. Використовуючи цей спосіб, вони, звичайно, запобігають можливій рацемізації; однак, з іншого боку, через переробку також небажаного (R)-енантіомеру до кінцевої стадії, вони збільшують втрати. У цій заявці, ди-п-толуїлвинна кислота представлена як найбільш придатна кислота; в патентній заявці WO 2005/108386 А1, використання одного еквіваленту цієї похідної винної кислоти у розділенні рацемічного дулоксетину, тобто 130 г на 100 г основи, описане у Прикладах. В оригінальних патентах реакція за схемою 1 застосовувалась як каталізатор. Ці основи порівняно дорогі і коли вони використовуються, необхідно уникати вологи, з якою вони можуть вступити в бурхливу реакцію. Заявка WO 2004/056795 також публікує спосіб проведення реакції за схемою 1, де застосування каталізатора міжфазного переносу допустиме для протікання реакції також зі слабкими основами, такими, як гідроксиди лужних металів. Згідно з нашим попереднім винаходом (CZ patent 297560, WO 2006/045255), для одержання (S)-N-метил-3-(1-нафтилокси)-3-(2тієніл)пропіламіну (дулоксетину), прийнятно застосовувати оптично неактивний (RS)-N,Nдиметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламін формули III 5 94931 (III) який розділяють, застосовуючи оптично активну кислоту, переважно D-винну кислоту. Оптично активна кислота застосовується у стехіометричному співвідношенні до речовини формули III. (S)-енантюмер виділяють з подальшим деметилюванням, застосовуючи алкілхлорформіати, внаслідок чого, відбувається гідроліз та речовина формули І виділяється. Одержання солі дулоксетину описане у Прикладі 2 (Спосіб 2) патенту US 5,362,886. Кінцевий продукт одержують шляхом реакції концентрованої гідрохлоридної кислоти з розчином основи дулоксетину у етилацетаті. Затравочний кристал гідрохлориду дулоксетину додають до підкисленої реакційної суміші та суміш розбавляють додатковою кількістю етилацетату; після 30 хвилин перемішування, суміш повторно концентрують до початкового об'єму, а потім перемішують при температурі навколишнього середовища протягом 1 години та при температурі 0°С протягом 1 години. Однак, коли ця процедура була відтворена, виявилось, що одержаний гідрохлорид розділеного дулоксетину не був повністю безбарвним, спочатку шляхом перетворення його на суміш діастереоізомерних солей Ν,Ν-диметил-3(нафтилокси)-3-(2-тієніл)пропіламін/D-тартрату шляхом реакції з оптично активною винною кислотою в молярному співвідношенні 1:2 до речовини формули III, або з оптично активним тартратом лужного металу чи тартратом амонію, або тартра 6 а був злегка рожево-коричнюватим, що може бути наслідком неочищеного продукту. Молекула дулоксетину відносно нестабільна, особливо у кислому середовищі. Зважаючи на те, що гідрохлорид дулоксетину зазвичай одержують шляхом нейтралізації основи гідрохлоридною кислотою, неочищений продукт може містити різні домішки. Внаслідок цього, спосіб кінцевого очищення є дуже важливим для одержання речовини бажаної якості, а також бажаного виходу. Даний винахід забезпечує повне та дуже успішне рішення проблеми одержання дулоксетину. Розкриття винаходу Винахід відноситься до нового способу одержання (S)-N-метил-3-(1-нафтилокси)-3-(2тієніл)пропіламіну формули І (І) та його фармацевтично-прийнятних солей, таких, наприклад, як гідрохлорид, який включає розділення (RS)-N,N-диметил-3-(1-нафтилокси)3-(2-тієніл)пропіламіну формули III, том алкіламонію, формули IV, в молярному співвідношенні 1:1, з наступним виділенням солі (S)N,N-диметил-3-(нафтилокси)-3-(2тієніл)пропіламін/D-тартрату (2:1) (Схема 2) із суміші діастереоізомерних солей в органічному розчиннику, воді або їх суміші. 7 Потім виділяють (S)-N,N-диметил-3-(1нафтилокси)-3-(2-тієніл)пропіламін формули (S)(lll) із солі (S)-N,N-диметил-3-(нафтилокси)-3-(2тієніл)пропіламін/D-тартрату (2:1) шляхом дії неорганічної та органічної основи, з подальшим деметилюванням алкілхлорформіатом формули CICOOR (R = С1-С5 алкіл, або С6-С12 арил або алкіларил) та, врешті-решт, гідролітичним виділенням основи дулоксетину формули І. D-винна кислота, в поєднанні з гідроксидом калію (натрію, літію), гідроксиламіном або відповідним алкіламіном, в еквімолярному співвідношенні до D-винної кислоти, може застосовуватись еквівалентно замість тартрату. Вихідну речовину формули III одержують за Схемою 1 шляхом взаємодії (RS)-N,N-диметил-3гідрокси-3-(2-тієніл)пропіламіну з 1флуорнафталіном у розчині диметилсульфоксиду при 80-150°С в присутності основи, вибраної з карбонатів, гідроксидів або алкоголятів лужних металів. Цей порядок дозволяє каталіз зі слабкими основами без застосування каталізатора міжфазного переносу. Для розділення (RS)-N,N-диметил-3-(1нафтилокси)-3-(2-тієніл)пропіламіну формули III застосовують оптично активну кислоту. Відповідно до даного винаходу можна застосовувати переважно 0,5 еквівалента D-винної кислоти або 1 еквівалент D-тартрату лужного металу, або Dтартрату амонію, або, альтеративно, тартрату алкіламонію формули IV. D-тартрату монокалію надається особлива перевага. Переваги способу одержання відповідно до даного винаходу порівняно із застосуванням 1 еквіваленту D-винної кислоти включають: (1) сіль може бути легко одержана у водному середовищі, особливо у суміші води та полярного апротонного розчинника (наприклад, ДМСО, ДМФ). Згідно з переважним втіленням, полярний апротонний розчинник, наприклад, диметилсуфоксид, вже застосовують як реакційне середовище під час одержання сполуки формули III, та після здійснення реакції, реакційну суміш тільки розбавляють водою (принаймні, подвійною кількістю (за об'ємом) води по відношенню до полярного апротонного розчинника), додають 0,5 еквівалента винної кислоти або 1 еквівалент тартрату монокалію, та після охолодження, осаджену сіль відфільтровують, що дозволяє уникнути складної для виконання екстракції основи органічним розчинником; (2) краща здатність кристалізувати бажану сіль (S)-N,N-диметил-3-(нафтилокси)-3-(2тієніл)пропіламін/D-тартрату (2:1), що приводить до легшого відтворювання розділення, а також до більшої оптичної чистоти одержаної солі; (3) можливість застосування тартрату монокалію, який легше регенерується, або тільки 0,5 еквівалента винної кислоти, що приводить до менших затрат на сировину, а також до меншої кількості відходів, які утворюються під час одержання. Застосування немодифікованої винної кислоти або її кислих солей вигідне з наступних причин: (а) низька молекулярна вага, що приводить до використання меншої кількості порівняно дорогого 94931 8 хірального агента (для 1 молю основи III необхідно, наприклад, 75 г винної кислоти (0,5 еквівалента) або 188 г тартрату монокалію (1 еквівалент), або 424 г ди-п-толуїлвинної кислоти (1 еквівалент)); (b) полегшена регенерація у формі безпосередньо придатного для застосування кислого тартрату (під час регенерації з водних рідин, після додавання 1 еквіваленту мінеральної кислоти, кислий тартрат (наприклад, тартрат монокалію), який дуже погано розчиняється у воді, кристалізується). На противагу, похідні винної кислоти на основі етерів, наприклад, ди-п-толуїлвинна кислота, зазвичай нестабільні в основному водному середовищі (можливість гідролізу); на додачу, під час регенерації з водних рідин зазвичай необхідно після підкислення здійснювати екстракцію органічним розчинником та кристалізацію. Сіль (S)-N,N-диметил-3-(нафтилокси)-3-(2тієніл)пропіламін/D-тартрату (2:1) виділяють із суміші діастереоізомерних солей з розчинника з групи аліфатичних або циклічних етерів, наприклад, тетрагідрофурану або діетилетеру, С3-С6 кетонів, наприклад, ацетону, або нижчих спиртів, наприклад, з С1-С3 спиртів, або води, або суміші цих розчинників в потрібному співвідношенні, при температурі від 0 до 80°С. Перевага надається застосуванню водного розчину ТГФ, який містить від 0 до 10% води. (S)-N,N-диметил-3-(1-нафтилокси)-3-(2тієніл)пропіламін формули (S)-(lll) виділяють із солі (S)-N,N-диметил-3-(нафтилокси)-3-(2тієніл)пропіламін/D-тартрату (2:1) дією неорганічної або органічної основи у водному середовищі та органічного розчинника, який не змішується з водою. Одержаний (S)-N,N-диметил-3-(1нафтилокси)-3-(2-тієніл)пропіламін (S)-(lll) деметилюють на наступному етапі. Деметиляцію здійснюють під дією алкіл- або арилхлороформіату з групи сполук загальної формули CICOOR, де R вибраний з групи С1-С5 алкілів або С6-С12 арилів або алкіларилів, у суміші розчинників толуолу та діізопропілетиламіну, при температурі від 50 до 110°С, з наступним гідролізом гідроксидом лужного металу. Небажаний (R)-N,N-диметил-3-(1-нафтилокси)3-(2-тієніл)пропіламін може бути повернений до процесу одержання після його рацемізації органічною або неорганічною основою, наприклад, mpemбутанолатом калію, в середовищі органічного розчинника, переважно у диметилсульфоксиді. Після завершення реакції, суміш розбавляють водою та вводять в процес як рециклізовану частку разом з вихідною сировиною перед розділенням рацемічного (RS)-N,N-диметил-3-(1-нафтилокси)-3-(2тієніл)пропіламіну формули III на окремі діастереоізомери. Основа дулоксетину може бути перетворена на будь-яку фармацевтино-прийнятну сіль. Гідрохлорид та оксалат були описані раніше, а гідрохлорид зазвичай застосовується для медичних цілей. Спосіб одержання солі гідрохлориду з основи дулоксетину представляє інший аспект даного 9 94931 10 винаходу. Одержання цієї солі зазвичай здійснюмували як другу фракцію з маткового розчину пісють шляхом взаємодії основи дулоксетину з конля його концентрування. У Таблиці подана роздруцентрованою гідрохлоридною кислотою в середокована ВЕРХ-хроматограма (колонка з оберненою вищі етилацетату. Однак, як тепер з'ясувалось, фазою С18, рухома фаза: вода/ацетонітріл, буфезаміна етилацетату нижчим кетоном, таким як, рний фосфатний розчин рН 7,6) та показані ренаприклад, етилметилкетон, приводить до вищих зультати аналізу вихідної речовини, а потім очивиходів більш якісного гідрохлориду дулоксетину, щеної речовини, одержаної після 1 години особливо, коли гідрохлорид дулоксетину одержукип'ятіння зі зворотнім холодильником у шестикрають та виділяють за допомогою способу даного тній кількості розчинника (тобто, 6 мл розчинника винаходу. Для порівняння впливу застосованого на 1 г вихідної речовини), охолодженої до темперозчинника на якість речовини, ми використали ратури навколишнього середовища, профільтрозабруднений гідрохлорид дулоксетину, який отриваної та висушеної. Таблиця 1 Вплив застосованого розчинника на якість речовини Домішка Вихідна речовина RRT 0,28 RRT 0,53 RRT 0,88 RRT 1,05 RRT 1,27 RRT 1,68 RRT 2,24 RRT 2,29 RRT 3,17 Сума домішок 0,26% 0,54% 0,42% 0,40% 0,44% 0,15% 0,08% 0,07% 0,61% 2,97% З Таблиці видно, що вміст всіх домішок нижчий у випадку застосування кетону, а саме етилметилкетону. Тому очевидно, що кетони є більш придатними розчинниками для одержання гідрохлориду дулоксетину, ніж естери, такі як, наприклад, етилацетат, як під час одержання шляхом нейтралізації основи гідрохлоридною кислотою, так і для можливого очищення. Слід очікувати, що кетони будуть більш придатними розчинниками, ніж естери, також для одержання інших фармацевтично-прийнятних солей дулоксетину, таких як, наприклад, гідробромід та гідрогенсульфат. Даний винахід додатково ілюструється наступними прикладами. Приклади Приклад 1: (RS)-N,N-диметил-3-(1нафтилокси)-3-(2-тієніл)пропіламін/D-тартрат Суміш N,N-диметил-3-гідрокси-3-(2тієніл)пропіламіну (185 г, 1 моль), гідроксиду калію (112 г, 2 моль) та 1-флуоронафталіну (146 г, 1 моль) у диметилсульфоксиді (1000 мл) перемішують при температурі 110°С протягом двох годин. Після охолодження до 20°С, суміш фільтрують, розбавляють водою (3:1), додають D-тартрат монокалію (188 г, 1 моль) та суміш перемішують при 80°С впродовж півгодини. Після охолодження, осаджений продукт відсмоктують, промивають водою та сушать. Вихід: 328 г (85%). Приклад 2: (RS)-N,N-диметил-3-(нафтилокси)3-(2-тієніл)пропіламін/D-тартрат Суміш N,N-диметил-3-гідрокси-3-(2тієніл)пропіламіну (185г, 1 моль) гідроксиду калію (112 г, 2 моль) та 1-флуорнафталіну (146 г, 1 моль) у диметилсульфоксиді (1000 мл) перемішу Речовина, очищена в ети- Речовина, очищена в етилацетаті лметилкетоні 0,16% 0,09% 0,42% 0,38% 0,12%
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the preparation of (s)-n-methyl-3-(l-naphthyloxy)-3-(2-thienyl)propylamine hydrochloride (duloxetine)
Автори англійськоюRidvan Ludek, Jarrah Kamal, Cinibulk Josef, Zatopkova Monika, Placek Lukas
Назва патенту російськоюСпособ получения (s)- n-метил-3-(нафтилокси)-3-(2-тиенил)пропиламингидрохлорида (дулоксетина)
Автори російськоюРидван Людек, Джарра Камаль, Синибулк Йозеф, Затопкова Моника, Пласек Лукас
МПК / Мітки
МПК: C07D 333/20
Мітки: s)-n-метил-3-(нафтилокси)-3-(2-тієніл)пропіламінгідрохлориду, одержання, спосіб, дульоксетину
Код посилання
<a href="https://ua.patents.su/6-94931-sposib-oderzhannya-s-n-metil-3-naftiloksi-3-2-tiehnilpropilamingidrokhloridu-duloksetinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання (s)-n-метил-3-(нафтилокси)-3-(2-тієніл)пропіламінгідрохлориду (дулоксетину)</a>
Попередній патент: Керування потужністю з використанням індикацій перешкод на множині швидкостей
Наступний патент: Мінеральна гідравлічна зв’язувальна речовина та спосіб її одержання
Випадковий патент: Курильний виріб










