Спосіб одержання гідрохлориду (s)-n-метил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну (дулоксетину)
Номер патенту: 89652
Опубліковано: 25.02.2010
Автори: Груби Петр, Плацек Лукас, Кухар Мірослав, Рідван Людек
Формула / Реферат
1. Спосіб одержання (5)-N-метил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну формули І
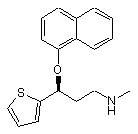 I
I
або його фармацевтично прийнятної солі, який відрізняється тим, що (RS)-N,N-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламін формули III
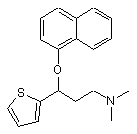 (III)
(III)
піддають взаємодії з оптично активною кислотою, після чого здійснюють кристалізацію, діастереоізомер, який утворюється, піддають реакції з неорганічною або органічною основою, одержуючи (S)-N,N-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламін формули (S)-III
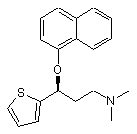 , (S)-III
, (S)-III
який потім деметилюють, використовуючи алкілхлорформіати, з наступним гідролізом і необов'язковим перетворенням сполуки формули І на її сіль.
2. Спосіб за п. 1, який відрізняється тим, що сполуку формули III піддають взаємодії з D-винною кислотою, діастереоізомер (S)-N,N-диметил-3-(нафтилокси)-3-(2-тієніл)пропіламін-D-тартрат кристалізують з розчинника, вибраного з циклічних етерів, С3-С6 кетонів або С1-С3 спиртів і (S)-N,N-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламін формули (S)-III виділяють за допомогою реакції з основою, вибраною з групи гідроксидів або карбонатів лужних металів.
3. Спосіб за п. 2, який відрізняється тим, що кристалізацію бажаного діастереоізомеру здійснюють з розчинника, вибраного з групи, що включає тетрагідрофуран, ацетон, метанол і етанол.
4. Спосіб за будь-яким з пунктів 1-3, який відрізняється тим, що деметилювання (S)-N,N-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну з використанням фенілхлорформіату здійснюють у суміші толуолу і діізопропіламіну при 50-110 °С, з наступним гідролізом за допомогою гідроксиду лужного металу.
5. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що використовують вихідну сполуку формули III, одержану за допомогою реакції (R)-N,N-диметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну з основою, вибраною з групи гідроксидів, гідридів або алкоголятів лужних металів.
6. Спосіб за п. 5, який відрізняється тим, що реакцію здійснюють з трет-бутилатом калію.
7. Спосіб за п. 5, який відрізняється тим, що реакцію здійснюють з метанолатом натрію.
8. Спосіб за п. 5, який відрізняється тим, що реакцію здійснюють з гідроксидом калію.
9. Спосіб за будь-яким з пунктів 6-8, який відрізняється тим, що як розчинник використовують ДМСО і після завершення реакції, надлишок алкоголяту розкладають за допомогою води, після чого продукт екстрагують за допомогою неполярного органічного розчинника, вибраного з ряду С5-С8 аліфатичних, циклічних або ароматичних вуглеводнів.
10. Спосіб за будь-яким з пунктів 1-5, який відрізняється тим, що використовують вихідну сполуку формули III, одержану за допомогою реакції (RS)-N,N-диметил-3-гідрокси-3-(2-тієніл)пропіламіну з 1-фторнафталіном у розчині диметилсульфоксиду при 80-150 °С у присутності основи, вибраної з карбонатів, гідроксидів або алкоголятів лужних металів.
11. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що сполуки формули І потім перетворюють на гідрохлорид за допомогою реакції з хлоридом слабкої основи, переважно з хлоридом амонію.
Текст
1. Спосіб одержання (5)-N-метил-3-(1нафтилокси)-3-(2-тієніл)пропіламіну формули І 2 3 89652 4 гідроксидів, гідридів або алкоголятів лужних металів. 6. Спосіб за п. 5, який відрізняється тим, що реакцію здійснюють з трет-бутилатом калію. 7. Спосіб за п. 5, який відрізняється тим, що реакцію здійснюють з метанолатом натрію. 8. Спосіб за п. 5, який відрізняється тим, що реакцію здійснюють з гідроксидом калію. 9. Спосіб за будь-яким з пунктів 6-8, який відрізняється тим, що як розчинник використовують ДМСО і після завершення реакції, надлишок алкоголяту розкладають за допомогою води, після чого продукт екстрагують за допомогою неполярного органічного розчинника, вибраного з ряду С5-С8 аліфатичних, циклічних або ароматичних вуглеводнів. 10. Спосіб за будь-яким з пунктів 1-5, який відрізняється тим, що використовують вихідну сполуку формули III, одержану за допомогою реакції (RS)N,N-диметил-3-гідрокси-3-(2-тієніл)пропіламіну з 1фторнафталіном у розчині диметилсульфоксиду при 80-150 °С у присутності основи, вибраної з карбонатів, гідроксидів або алкоголятів лужних металів. 11. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що сполуки формули І потім перетворюють на гідрохлорид за допомогою реакції з хлоридом слабкої основи, переважно з хлоридом амонію. Винахід стосується нового способу одержання (S)-N-метил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну, відомому під родовою назвою дулоксетин, формули І Дулоксетин є інгібітором зворотного захоплення серотоніну та норадреналіну і його застосовують при лікуванні депресії та нетримання сечі. Одержання дулоксетину та його проміжних продуктів описано, наприклад, в патентах ЕР 0273 658, США 5,362,886 публікації міжнародної патентної заявки WO 2004/005239, патенті США 2003/0225153. Основна реакція, що використовують, представлена в наступній Схеми 1. В більшості синтезів для цієї реакції використовують вже оптично активний проміжний продукт II, тобто (S)-N,N-диметил-3-гідрокси-3-(2тієніл)пропіламін. Під час синтезу більшості оптично активних сполук, розділення або одержання оптично чистих проміжних сполук здійснюється з кращими виходами ніж розділення кінцевих продуктів. Однак, по відношенню до синтезу дулоксетину виявилося, що під час подальшого процесу відповідно до Схеми 1, знову відбувається рацемізація. Таким чином, одержаний кінцевий продукт не є енантіомерно чистим, його необхідно знову перекристалізовувати. Це природно зменшує вихід процесу. Вирішення проблеми небажаної рацемізації під час реакції відповідно до Схеми 1 пропонується в публікації міжнародної патентної заявки WO 2004/056795 A1. Автори вибирають спосіб одер жання рацемічного дулоксетину і його розділення за допомогою прийнятної хіральної кислоти. Використовуючи цю процедуру, вони дійсно попереджували можливу рацемізацію, але, з іншого боку, це збільшило втрати, оскільки також утворювався небажаний (R)-енантіомер до кінцевої стадії. В вищезгаданих патентах, реакцію відповідно до Схеми 1 здійснювали в присутності каталізатора з сильними основами такими як гідрид натрію або гідрид літію. Ці основи є порівняно дорогими і при їх використанні необхідно уникати вологи, тому що вони можуть з нею енергійно взаємодіяти. В публікації міжнародної патентної заявки WO 2004/056795 також опублікований спосіб здійснення реакції відповідно до Схеми 1, в якому використання каталізатора фазового переходу надає можливість здійснювати реакцію також з більш 5 слабкими основами такими як гідроксиди лужних металів. Одержання сполуки І описано у Прикладі 2 (одержання 2) патенту США 5,362,886. Кінцевий продукт одержували в результаті дії концентрованої хлорводневої кислоти на розчин дулоксетину в етилацетаті. Затравочний кристал сполуки І додавали до підкисленої реакційної суміші і суміш розводили за допомогою великої кількості етилацетату; після перемішування протягом 30 хвилин суміш знову концентрували до первинного об'єму і потім перемішували при кімнатній температурі протягом 1 години і при 0°С протягом 1 години. Однак, під час відтворення цієї процедури, виявилося, розчин починав перетворюватися на червоний під час процесу, в результаті якого отримували забруднений продукт. Крім того, якщо суспензію описану в патенті США 5,362,886 необхідно було одержувати в заданій кількості, було потрібно збільшити тривалість перемішування, що призводило до більшого накопичення домішок. Експерименти з використанням різних кількостей хлорводневої кислоти також не були успішними. Представлений винахід представляє комплексне вирішення одержання дулоксетину, яке усуває або мінімізує всі згадані недоліки. Винахід стосується нового способу одержання (S)-N-метил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну формули І і його фармацевтично прийнятних солей, який включає розділення (RS)-N,N-диметил-3-(1нафтилокси)-3-(2-тієніл)пропіламіну формули III шляхом перетворення на суміш двох діастереоізомерів за допомогою реакції з оптично активною кислотою і кристалізацію, діастереоізомер, який утворюється, піддавали реакції з органічною або неорганічною основою, одержуючи (S)-N,Nдиметил-3-(1-нафтилокси)-3-(2-тієніл)пропіламін, який потім деметилювали, таким чином приводячи до утворення сполуки І. Сполука І може бути перетворена на її солі. Наприклад, був описаний оксалат, але зазвичай для лікування використовували гідрохлорид. Виявилося, що (S)-N,N-диметил-3-(1нафтилокси)-3-(2-тієніл)пропіламін ((S)-lll) не рацемізувався в процесі деметилювання, що надає 89652 6 можливість утворення цієї оптично активної проміжної сполуки. У переважному втіленні винаходу використовували оптично активну D-винну кислоту і діастереоізомер (S)-N,N-диметил-3-(нафтилокси)-3-(2тієніл)пропіламін-D-тартрат кристалізували з циклічних етерів, наприклад, тетрагідрофурану, С3-С6 кетонів, наприклад, ацетону або нижчих спиртів, наприклад, С1-С3, переважно метанолу або етанолу. (S)-N,N-диметил-3-(1-нафтилокси)-3-(2тієніл)пропіламін формули (S)-lll виділяли за допомогою реакції з основою, вибраною з групи гідроксидів або карбонатів лужних металів. Деметилювання саме по собі, під час якого не відбувається рацемізація, здійснювали у суміші розчинників толуолу і діізопропіламіну при 50110°С, з наступним гідролізом за допомогою гідроксиду лужного металу. Інший аспект винаходу включає спосіб одержання вихідної сполуки III відповідно до Схеми 1, тобто за допомогою реакції (RS)-N,N-диметил-3гідрокси-3-(2-тієніл)пропіламіну з 1фторнафталіном у розчині диметилсульфоксиду, при температурі 80-150°С, у присутності основи, вибраної з карбонатів лужних металів, гідроксидів лужних металів або алкоголятів. Ця схема дозволяє каталіз з більш слабкою основою без використання будь-яких каталізаторів фазового переходу. Інший аспект включає одержання сполуки III з небажаного (R)-N,N-диметил-3-(1-нафтилокси)-3(2-тієніл)пропіламіну. Цей спосіб включає реакцію цього енантіомеру з неорганічною або органічною основою, наприклад, tBuOK, метанолатом натрію або гідроксидом калію. Реакцію переважно здійснювали в органічному розчиннику, більш переважно у диметилсульфоксиді. Після завершення реакції, суміш розводили водою для розкладання надлишку алкоголяту і продукт екстрагували за допомогою неполярного розчинника, вибраного з С5-С8 аліфатичних, циклічних або ароматичних вуглеводнів, переважно толуолу. Останній аспект включає перетворення основи на відповідну сіль, яке зазвичай здійснюють за допомогою реакції з відповідною кислотою. Як виявилося, ця процедура не відбувається в випадку найбільш частіше використовуваної солі, гідрохлориду. Згідно з винаходом, цю сіль одержували за допомогою реакції сполуки І з хлоридом слабкої основи, переважно з хлоридом амонію. Винахід надалі проілюстрований в наступних прикладах. Приклади Приклад 1: (R,S)-N,N-диметил-3-(нафтилокси)3-(2-тієніл)пропіламін-D-тартрат. Суміш N,N-диметил-3-гідрокси-3-(2тієніл)пропіламіну (370г), гідроксиду калію (336г) і 1-фторнафталіну (284мл) у диметилсульфоксиді (2л) перемішували при 100°С протягом 2 годин. Суміш потім охолоджували до кімнатної температури, розводили водою (4л) і толуолом (2л). Виділяли органічну фазу, струшували з водою і випаровували. Гарячий розчин D-винної кислоти (252г) у воді (3л) додавали до осаду після випаровування при перемішуванні. Після охолодження, оса 7 89652 джений продукт відсмоктували, промивали водою і сушили. Вихід складав 687г (75%). Приклад 2: (RS)-N,N-диметил-3-(нафтилокси)3-(2-тієніл)пропіламін. Подрібнений КОН (1,2г) додавали до розчину (R)-N,N-диметил-3-(нафтилокси)-3-(2-тієніл)пропіламіну (3,1г) у ДМСО (10мл), барботували помірним потоком азоту і суміш перемішували і нагрівали при 100°С протягом 1 години. Після охолодження до кімнатної температури, суміш розводили водою (30мл) і рацемічний продукт екстрагували за допомогою толуолу. Після випаровування, одержували 2,6г (84%) (RS)-N,N-диметил-3(нафтилокси)-3-(2-тієніл)пропіламіну. Приклад 3: (RS)-N,N-диметил-3-(нафтилокси)3-(2-тієніл)пропіламін. tBuOK (16,8г), і 18-краун-6 (0,25г) додавали до розчину (S)-N,N-дисетил-3-(нафтилокси)-3-(2тієніл)пропіламіну (31г) у сульфолані (100мл), барботували помірним потоком азоту і суміш перемішували і нагрівали при 110°С протягом 2 годин. Після охолодження до кімнатної температури, суміш розводили водою (300мл) і рацемічний продукт екстрагували за допомогою толуолу. Після випаровування, одержували 25г (81%) (RS)-Nметил-3-(нафтилокси)-3-(2-тієніл)пропіламіну. Приклад 4: (RS)-N,N-диметил-3-(нафтилокси)3-(2-тієніл)пропіламін. tBuOK (16,8г) додавали до розчину (R)-N,Nдиметил-3-(нафтилокси)-3-(2-тієніл)пропіламіну (31г) у ДМСО (100мл), барботували за допомогою помірного потоку і суміш перемішували і нагрівали при 110°С протягом 2 годин. Після охолодження до кімнатної температури, суміш розводили водою (300мл) і рацемічний продукт екстрагували за допомогою толуолу. Після випаровування, одержували 25г (84%) (RS)-N-метил-3-(нафтилокси)-3-(2тієніл)пропіламіну Приклад 5: (S)-N,N-диметил-3-(нафтилокси)-3(2-тієніл)пропіламін-D-тартрат. (RS)-N,N-диметил-3-(нафтилокси)-3-(2тієніл)пропіламін-D-тартрат (461г) в гарячому стані розчиняли у тетрагідрофурані (900мл). Після охолодження до кімнатної температури, суміш перемішували протягом 24 годин. Осаджені кристали перекристалізовували з тетрагідрофурану (400мл), ще раз використовуючи ту ж саму процедуру. Вихід складає 117г (25%). Оптична чистота складає 99% ее (СЕ). Комп’ютерна верстка М. Ломалова 8 Приклад 6: (S)-N,N-диметил-3-(нафтилокси)-3(2-тієніл)пропіламін-D-тартрат. (RS)-N,N-диметил-3-(нафтилокси)-3-(2тієніл)пропіламін-D-тартрат (461г) розчиняли у етанолі (700мл) при кипінні. Після поступового охолодження до кімнатної температури, суміш перемішували протягом 164 годин. Осаджені кристали відсмоктували і промивали етанолом. Вихід складає 150г (32%). Оптична чистота складає 98% ее (СЕ). Кристали потім кип'ятили в ацетоні (300мл). Після охолодження до кімнатної температури суміш перемішували протягом 1 години. Кристали відсмоктували і промивали ацетоном. Вихід складає 140г (30%). Оптична чистота складає 99,6% ее (СЕ). Приклад 7: (S)-N,N-диметил-3-(нафтилокси)-3(2-тієніл)пропіламін-гідрохлорид (дулоксетин). Діізопропілетиламін (210мл) додавали до розчину (S)-N,N-диметил-3-(1-нафтилокси)-3-(2тієніл)пропанаміну (311г; 99,6% ее) в толуолі (1200мл) і потім додавали фенілхлорформіат (150мл) при 60°С. Після перемішування при 80°С протягом двох годин суміш охолоджували, струшували з розведеним розчином хлорводневої кислоти, водою і 2% розчином гідрокарбонату натрію. Органічну фазу сушили над сульфатом натрію і випаровували. Осад після випаровування розчиняли у етанолі (300мл) і додавали краплю за краплею 5М розчин гідроксиду калію (400мл) при кип'ятінні. Після кип'ятіння протягом двох годині, суміш випаровували до половини об'єму, розводили водою (1000мл) і екстрагували за допомогою толуолу (300мл). Органічну фазу сушили за допомогою сульфату натрію і випаровували. Осад після випаровування розчиняли у етанолі (300мл), додавали хлорид амонію (80г) і суміш кип'ятили протягом двох годин. Потім суміш випаровували до сухого залишку, додавали толуол (1000мл) і фільтрували суміш в гарячому стані. Після охолодження до кімнатної температури, осаджені світлокоричнюваті кристали відсмоктували. Вихід складає 183г (55%), Температура кипіння 167-169°С. Шляхом кристалізації з етилацетату одержували безбарвний кристалічний дулоксетин, температура кипіння 170-171°С. Оптична чистота складає 99,6% ее (СЕ). Шляхом кристалізації з етилметилкетону одержували безбарвний кристалічний дулоксетин, температура кипіння 170,5-171,5°С. Оптична чистота складає 99,6% ее (СЕ). Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of manufacturing (s)-n-methyl-3-(1-naphthyloxy)-3-(2-thienyl)propylamine hydrochloride (duloxetine)
Автори англійськоюRidvan Ludek, Hruby Petr, Placek Lukas, Kuchar Miroslav
Назва патенту російськоюСпособ получения гидрохлорида (s)-n-метил-3-(1-нафтилокси)-3-( 2-тиенил)пропиламина (дулоксетина)
Автори російськоюРидван Людек, Груби Петр, Плацек Лукас, Кухар Мирослав
МПК / Мітки
МПК: C07D 333/20, A61K 31/38
Мітки: спосіб, дульоксетину, s)-n-метил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну, одержання, гідрохлориду
Код посилання
<a href="https://ua.patents.su/4-89652-sposib-oderzhannya-gidrokhloridu-s-n-metil-3-1-naftiloksi-3-2-tiehnilpropilaminu-duloksetinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання гідрохлориду (s)-n-метил-3-(1-нафтилокси)-3-(2-тієніл)пропіламіну (дулоксетину)</a>
Попередній патент: Спосіб шифрування двійкових блоків даних (варіанти)
Наступний патент: Крильчатка насоса
Випадковий патент: Селективні модулятори андрогенного рецептора








