Спосіб отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти
Номер патенту: 97509
Опубліковано: 27.02.2012
Автори: Лабейш Владімір, Калвіньш Іварс, Чернобровійс Алєксандрс, Трібуловіч Вячеслав
Формула / Реферат
1. Спосіб отримання сполуки формули (І)
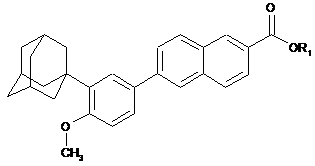 , (I)
, (I)
в якій:
R1 вибирають з групи, яка включає K, Na, Li, H, лінійний С1-С10алкіл, розгалужений С3-С10алкіл або циклічний С3-С10алкіл і СН2ОС1-С5алкіл,
із сполуки формули (II)
 , (II)
, (II)
в якій:
Hal вибирають з групи, що включає Сl, Вr або І, переважно Вr,
яку піддають реакції зі сполукою формули (III)
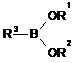 , (III)
, (III)
в якій:
R1 і R2, незалежно один від одного, вибирають з групи, яка включає K, Na, Li, H, арил, лінійний C1-С10алкіл, розгалужений С3-С10алкіл або циклічний С3-С10алкіл, або R1 і R2 разом утворюють групу -(CR4R5)m-(CR6R7)n-, де R4, R5, R6 і R7, незалежно один від одного, вибирають з групи, яка включає арил, Н, лінійний С1-С5алкіл, розгалужений С3-С10алкіл і циклічний С3-С5алкіл; а m і n, незалежно один від одного, становлять 1 або 2,
або R1 і R2 разом утворюють opтoзаміщений арил,
R3 вибирають з групи, яка не містить Н і містить 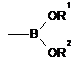 ,
,
в інертному розчиннику в присутності основного агента і каталізатора, вибраного з групи, яка включає паладієвий каталізатор, Pd(O) і лігандний комплекс Рd(О)-фосфін, з подальшою реакцією отриманого у такий спосіб продукту зі сполукою формули (IV)
 , (IV)
, (IV)
в якій:
R9 вибирають з групи, яка містить K, Na, Li, H, арил, лінійний С1-С10алкіл, розгалужений С3-С10алкіл, циклічний С3-С10алкіл, СН2ОС1-С5алкіл;
Hal вибирають з групи, що включає Сl, Вr та І, переважно Вr,
в тій самій реакційній суміші з додаванням неорганічної основи або без такого додавання.
2. Спосіб за пунктом 1, в якому джерело Pd(O) вибирають з групи, що включає паладію ацетат і три(дибензиліденацетон)дипаладію(0).
3. Спосіб за будь-яким з пунктів 2 або 3, в якому фосфінів ліганд вибирають з групи, яка включає 2-дициклогексилфосфін-2',6'-диметоксибіфеніл, 2-дициклогексилфосфін-2'-метилбіфеніл, 2-дициклогексилфосфін-2',6'-диметилбіфеніл, 2-2-дициклогексилфосфінбіфеніл, 2-ди-трет-бутилфосфін-2'-метилбіфеніл, 2-ди-трет-бутилфосфін-2',6'-диметилбіфеніл, 2-ди-трет-бутилфосфінбіфеніл, 2,4,6-триізопропіл-2'-дифенілілфосфінбіфеніл, дифенілфосфінфероцен, трифенілфосфін, трициклогексилфосфін, тpи-трет-бутилфосфін, а краще є 2-дициклогексилфосфін-2',6'-диметоксибіфенілом.
4. Спосіб за будь-яким з пунктів 1 або 3, в якому фосфінів ліганд є один чи більше ніж один, який використовують одночасно.
5. Спосіб за будь-яким з пунктів 1 або 4, в якому основний агент вибирають з групи, що включає N(R10R11R12), де R10, R11 і R12, незалежно один від одного, вибирають з групи, що містить арил, лінійний С1-С10алкіл, розгалужений С3-С10алкіл, циклічний С3-С10алкіл, калію ацетат і натрію ацетат.
6. Спосіб за будь-яким з пунктів 1 або 5, в якому співвідношення основного агента і сполуки формули (II) становить від 1 до 3 моль на моль.
7. Спосіб за будь-яким з пунктів 1 або 6, в якому інертний розчинник вибирають з групи, що включає тетрагідрофуран, трет-бутилметиловий ефір, диметоксіетан, діоксан, бензол, толуол, ксилол, диметилформамід та їх комбінації.
8. Спосіб за будь-яким з пунктів 1 або 7, в якому реакцію здійснюють в присутності органічного розчинника, або суміші органічних розчинників, або суміші органічного розчинника з водою.
9. Спосіб за будь-яким з пунктів 1 або 8, в якому неорганічну основу використовують як додатковий основний агент, який вибирають з групи, що включає карбонати, ацетати і фосфати калію і натрію.
10. Спосіб за будь-яким з пунктів 1 або 9, в якому співвідношення паладієвого каталізатора і сполуки формули (II) становить від 0,005 до 0,2 моль на моль.
11. Спосіб за будь-яким з пунктів 1 або 10, в якому реакцію здійснюють при температурі від приблизно 20 C до приблизно 100 C.
12. Спосіб за будь-яким з пунктів 1 або 11, в якому продукт реакції сполуки формули (II) зі сполукою формули (III) виділяють як індивідуальну речовину.
Текст
1. Спосіб отримання сполуки формули (І) 3 97509 маного у такий спосіб продукту зі сполукою формули (IV) O O R 9 Hal , (IV) в якій: 9 R вибирають з групи, яка містить K, Na, Li, H, арил, лінійний С1-С10алкіл, розгалужений С3С10алкіл, циклічний С3-С10алкіл, СН2ОС1-С5алкіл; Hal вибирають з групи, що включає Сl, Вr та І, переважно Вr, в тій самій реакційній суміші з додаванням неорганічної основи або без такого додавання. 2. Спосіб за пунктом 1, в якому джерело Pd(O) вибирають з групи, що включає паладію ацетат і три(дибензиліденацетон)дипаладію(0). 3. Спосіб за будь-яким з пунктів 2 або 3, в якому фосфінів ліганд вибирають з групи, яка включає 2дициклогексилфосфін-2',6'-диметоксибіфеніл, 2дициклогексилфосфін-2'-метилбіфеніл, 2дициклогексилфосфін-2',6'-диметилбіфеніл, 2-2дициклогексилфосфінбіфеніл, 2-ди-третбутилфосфін-2'-метилбіфеніл, 2-ди-третбутилфосфін-2',6'-диметилбіфеніл, 2-ди-третбутилфосфінбіфеніл, 2,4,6-триізопропіл-2'дифенілілфосфінбіфеніл, дифенілфосфінфероцен, трифенілфосфін, трициклогексилфосфін, тpитрет-бутилфосфін, а краще є 2дициклогексилфосфін-2',6'-диметоксибіфенілом. 4. Спосіб за будь-яким з пунктів 1 або 3, в якому фосфінів ліганд є один чи більше ніж один, який використовують одночасно. Даний винахід стосується способу отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти (адапалену). Адапален використовується для лікування acne vulgaris [Waugh, J.; Noble, S.; Scott, L. Spotlight on adapalene in acne vulgaris. J. Am. J. Clin. Dermatol. 2004, 5 (5), 369-371; Jain, S. Topical tretinoin or adapalene in acne vulgaris: an overview. J. Dermatol. Treat. 2004, 15 (4), 200-207]. Ця речовина володіє також протипухлинною активністю [WO 2001/056563, Galderma Research (USA)]. Отже, було б бажано мати зручний спосіб отримання адапалену. Спосіб отримання 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтойної кислоти є відомим з 1986 p. [Shroot, В.; Eustache, J.; Bernardon, J.-M. ЕР 199636; Bezonaphtalene derivatives and compositions. US 4717720 (1988)]. Це - багатостадійний процес, який включає наступні стадії: а) алкілювання 4-бромфенолу адамантолом-2 з утворенням 2-(1-адамантил)-4-бромфенолу; б) О-алкілювання 2-(1-адамантил)-4бромфенолу з використанням Mel з отриманням 2(1-адамантил)-4-броманізолу; в) приготування реактиву Грин'яра з 2-(1адамантил)-4-броманізолу, його перетворення в 4 5. Спосіб за будь-яким з пунктів 1 або 4, в якому основний агент вибирають з групи, що включає 10 11 12 10 11 12 N(R R R ), де R , R і R , незалежно один від одного, вибирають з групи, що містить арил, лінійний С1-С10алкіл, розгалужений С3-С10алкіл, циклічний С3-С10алкіл, калію ацетат і натрію ацетат. 6. Спосіб за будь-яким з пунктів 1 або 5, в якому співвідношення основного агента і сполуки формули (II) становить від 1 до 3 моль на моль. 7. Спосіб за будь-яким з пунктів 1 або 6, в якому інертний розчинник вибирають з групи, що включає тетрагідрофуран, трет-бутилметиловий ефір, диметоксіетан, діоксан, бензол, толуол, ксилол, диметилформамід та їх комбінації. 8. Спосіб за будь-яким з пунктів 1 або 7, в якому реакцію здійснюють в присутності органічного розчинника або суміші органічних розчинників, або суміші органічного розчинника з водою. 9. Спосіб за будь-яким з пунктів 1 або 8, в якому неорганічну основу використовують як додатковий основний агент, який вибирають з групи, що включає карбонати, ацетати і фосфати калію і натрію. 10. Спосіб за будь-яким з пунктів 1 або 9, в якому співвідношення паладієвого каталізатора і сполуки формули (II) становить від 0,005 до 0,2 моль на моль. 11. Спосіб за будь-яким з пунктів 1 або 10, в якому реакцію здійснюють при температурі від приблизно 20 C до приблизно 100 C. 12. Спосіб за будь-яким з пунктів 1 або 11, в якому продукт реакції сполуки формули (II) зі сполукою формули (III) виділяють як індивідуальну речовину. похідне цинку та його каталізована Ni конденсація метил 6-бром-2-нафтеноатом з утворенням метил6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату; г) гідроліз в лужному середовищі метил-6-[3(1-адамантил)-4-метоксифеніл]-2-нафтеноату з отриманням 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтойної кислоти. Цей процес має низку недоліків: 1) очистка 2-(1-адамантил)-4-броманізолу і метил-6-[3-(1-адамантил)-4-метоксифеніл]-2нафтеноату вимагає використання колонкової хроматографії; 2) приготування реактиву Грин'яра з 2-(1адамантил)-4-броманізолу, його перетворення в похідне цинку та його каталізована Ni конденсація метил 6-бром-2-нафтеноатом з утворенням метил6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату на стадії (в) важко піддаються регуляції в промисловому масштабі і не дають стабільних виходів. В 2006 р. було опубліковано процес (Castaldi, G.; Allegrini, P.; Razezetti, G.; Ercoli, M.; A process for the preparation of adapalene, EP 1707555 А), в якому використовується синтез адапалену за вже відомою (Zim, D.; Lando, V.R.; Dupont, J.; Montiero, A.L. Org. Lett. 2001, 3, 3049) версією реакції Сузукі 5 Міяури для конденсації 3-(1-адамантил)-4метоксифенілборинової кислоти тозилокси-2нафтеноатом: в присутності солі Ni(II) і фосфінових лігандів. Недоліком цього способу є необхідність використання 3-(1-адамантил)-4метоксифенілборинової кислоти, для отримання якої потрібні або реактив Грин'яра, або похідне Li [Sarshar, S. Novel therapeutic agents for the treatment of cancer, metabolic diseases and skin disorders. WO 2005/108338 A1]. Відповідно, метою даного винаходу була розробка на основі реакції Сузукі-Міяури альтернативного процесу отримання 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтойної кислоти, що характеризується стабільними і високими виходами, гнучкою зміною масштабу реакції і придатністю для промислового використання. Оскільки найбільш важливим і важким в приготуванні проміжним продуктом в синтезі 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтойної кислоти є 3-(1-адамантил)-4-метоксифенілборинова кислота, було необхідно розробити процес, в якому вказану боринову кислоту можна було б готувати in situ без використання проміжних продуктів органічного магнію чи органічного літію. Це допомогло б подолати основний недолік існуючих способів отримання похідних 3-(1-адамантил)-4метоксифенілборинової кислоти, а саме - проблеми, пов'язані з використанням металоорганічних сполук в промислових технологічних процесах. Нами було вперше встановлено, що, на відміну від відомих способів, похідні 3-(1-адамантил)-4метоксифенілборинової кислоти можуть бути отримані з 2-(1-адамантил)-4-галоанізолу за допомогою прямої каталітичної реакції гетерофункціоналізації з пінакол бораном, bisпінаколатдибораном чи іншими придатними циклічними алкілборанами в присутності комплексу Рd(О)-фосфін. Отже, у відповідності до даного винаходу, більше немає необхідності готувати, стандартизувати чи зберігати в якості проміжного продукту 4металоорганічне похідне 2-(1-адамантил)анізолу, що завжди створює певну проблему при промисловому масштабі виробництва. Нами також було вперше встановлено, що пінаколовий ефір 3-(1-адамантил)-4метоксифенілборинової кислоти може бути використаний на наступній стадії, тобто в реакції сполучення за Сузукі-Міяурою, без відділення з реак 97509 6 ційної суміші. Ми також тепер встановили, що немає необхідності виділяти ці похідні 3-(1адамантил)-4-метоксифенілборинової кислоти з реакційної суміші, а, натомість, що їх можна вводити в реакцію сполучення з 6-гало-2нафтеноатом в присутності каталітичного комплексу Pd(O)-фосфін за принципом "весь процес в одному котлі". Краще використовувати такий каталізатор, який можна приготувати in situ, наприклад з tris(дибензиліденацетон)дипаладію(О) [Pd2(dba)3] і 2-дициклогексилфосфін-2',6'-диметоксибіфенілу (Sphos). Нами також було встановлено, що придатною для цього процесу є низка різних ациклічних і циклічних боранів, причому кращими з них є легко доступний bis-пінаколатдиборан чи пінакол боран: Отже, є можливість вводити в реакцію сполучення різні похідні 3-(1-адамантил)-4метоксифенілборинової кислоти, генеровані in situ, загальної формули: (IV) 2 3 в якій R і R , разом, утворюють циклоалкіл, заміщений циклоалкіл чи –СН2ОС1-С5алкіл. Відмінні виходи в цій реакції забезпечуються різними каталізаторами, що містять паладій, з Pd(O) з фосфіновими лігандами чи без них, такими як тетракіс(трифенілфосфін)паладій(О). В якості найбільш зручних джерел паладію Pd(O) використовуються паладію ацетат і tris(дибензиліденацетон)дипаладій(O). Наші дослідження показують, що наступні фосфінові ліганди можуть бути використані для прямої каталітичної реакції гетерофункціоналізації при приготуванні похідних 3-(1-адамантил)-4метоксифенілборинової кислоти: 2-дициклогексилфосфіно-2',6'-диметоксибіфеніл, 2дициклогексилфосфін-2'-метилбіфеніл, 2-дициклогексилфосфін-2',6'-диметилбіфеніл, 2-2дициклогексилфосфінбіфеніл, 2-ди-tert-бутилфосфін-2'-метил-біфеніл, 2-ди-tert-бутил-фосфін2',6'-диметилбіфеніл, 2-ди-tert-бутилфосфінбіфеніл, 2,4,6-три-ізо-пропил-2'дифенілілфосфінбіфеніл, дифенілфосфінфероцен, трифенілфосфін, трициклогексилфосфін, а також три-tert-бутилфосфін, хоча найкращі результати досягаються при використанні 2,2'bis(дифенілфосфін)-дифенілового ефіру (DPEphos) у якості такого ліганду. Кількість каталізатору не є постійною і залежить від його структури, коливаючись в межах від 0,0005 до 0,1 молю на моль використаного 3-(1адамантил)-4-галоанізолу. У більшості випадків оптимальна концентрація каталізатору становить біля 0,005 моля на моль похідного анізолу. Ця ре 7 акція здійснюється у відповідному органічному розчиннику, такому як діоксан, або в суміші органічних розчинників. Температура реакції залежить від використаних реагентів і каталізатору і коливається від 20 до 100 °C. Даний винахід пояснюється, але не обмежується, наступними прикладами. Стадія А. 2-(1-адамантил)-4-броманізол Приклад 1 В 1-л колбі, обладнаній мішалкою, зрошувальним конденсатором і крапельною воронкою, приготували суміш з 50 г (0,33 М) 1-адамантанолу, 68 г (45,5 мл; 0,36 М) 4-броманізолу і 500 мл метилену хлориду. Суміш перемішували до розчинення, після чого впродовж 1 години додали 35 г (19 мл; 0,36 М) сірчаної кислоти. Реакційну суміш перемішували впродовж 4 годин, додали 200 мл води, перемішували ще 10 хвилин, перенесли в розділювальну воронку і зібрали органічний шар, який нейтралізували двома 100-мл порціями 10 % розчину натрію карбонату. Метилен хлорид повністю відігнали, а залишок розчинили в 300 мл етилацетату, профільтрували, концентрували до 200 мл і залишили кристалізуватись при 0 °C впродовж 16 годин. Кристали відфільтрували, промили 50 мл холодного етилацетату і висушили при 100 °C впродовж 1 години. Отримали 2-адамантил-4броманізол, 76 г (72 %) з температурою плавлення 140-141 °C. ЯМР (500 МГц, ДМСО D6) : 1,75 (s, 6H); 2,03 (s, 9H); 3,81 (s, 3Н); 6,82 (d, 1Н, J=8 Гц); 7,17 (s, 1H);7,23(d, 1Н, J=8 ГЦ). Збільшення масштабу синтезу в 10 разів не змінило ні виходу, ні якості 2-адамантил-4броманізолу. Стадія В. 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколовий ефір Приклад 2 В 2-л колбу з двома горловинами, обладнану мішалкою, зрошувальним конденсатором і перехідником для впуску газу, ввели 800 мл діоксану, 100 г (0,31 М) 2-(1-адамантил)-4-броманізолу, 94 г (130 мл; 0,93 М) триетиламіну, 3,5 г (0,0155 М; 5 моль%) паладію ацетату і 16,7 г (0,031 М; 10 моль%) 2,2'-bis-(диметилфосфін)дифенілового ефіру (DPEphos). Цей розчин перемішували впродовж 30 хвилин, і під легким струменем аргону додали 60 г (68 мл; 0,47 М) розчину пінаколу борану в 300 мл діоксану. Реакційну суміш переганяли при перемішуванні впродовж 12 годин, розчинник відігнали у вакуумі при температурі водяної ванни 60 °C. Залишок розчинили в 500 мл теплого етилацетату, профільтрували і концентрували до 300 мл. Розчин залишили на 16 годин при температурі біля 0 °C. Осад відфільтрували, промили мінімальним об'ємом холодного етилацетату і висушили при 80 °C. Отримали 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколовий ефір, 71 г (62 %) з температурою плавлення 162-164 °C. ЯМР (500 МГц, ДМСО D6) : 1,30 (s, 12Н); 1,76 (s, 6Н); 2,07 (s, 3Н); 2,09 (s, 6Н); 3,85 (s, 3Н); 6,83 (d, 1H, J=8 Гц); 7,49 (s, 1Н); 7,50 (d, 1Н, J=8 Гц). 97509 8 Використання в якості ліганду 2дициклогексилфосфін-2',6'-диметоксибіфенілу (Sphos) замість DPEphos суттєво не впливає на вихід кінцевого продукту. На вихід не впливає також заміна tris(дибензиліденацетон)дипаладію(О) [Pd2(dba)3] паладію ацетатом в якості джерела паладію. Приклад 3 Реакцію здійснювали як в Прикладі 2. В якості ліганду використали 12,7 г (0,031 М; 10 моль%) 2дициклогексилфосфін-2',6'-диметоксибіфенілу (Sphos), а в якості джерела Pd(O) - 7,1 г (0,007 М; 5 моль%) tris(дибензиліденацетон)дипаладію(O) [Pd2(dba)3]. Отримали 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколовий ефір, 70 г (61 %). Використання в якості каталізатору дихлорпаладію 1,1'-bis(дифенілфосфін)-фероцену [PdCI2(dppf)CH2CI2] приводить до помірного падіння виходу кінцевого продукту. Приклад 4 Реакцію здійснювали, як описано в Прикладі 2. В якості каталізатору використовували дихлорпаладію 1,1'-bis(дифенілфосфін)-фероцен, 12,6 г (5 моль%). Отримали 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколовий ефір, 59 г (52 %). Коли в якості каталізатору використовується свіжо приготований тетракіс(трифенілфосфін)паладій(О) Pd[P(Ph)3]4, вихід кінцевого продукту падає значною мірою. Приклад 5 Реакцію здійснювали, як описано в Прикладі 2. В якості каталізатору використовували свіжо приготований тетракіс(трифенілфосфін)-паладій(О) Pd[P(Ph)3]4. Отримали тільки 9 г (8 %) 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколового ефіру. Збільшення масштабу синтезу в 5 разів при дотриманні оптимальних умов проведення реакції не змінило ні виходу, ні якості кінцевого продукту. 3-(1-адамантил)-4-метоксифенілборинової кислоти пінаколовий ефір можна отримати також, використовуючи bis-пінаколатдиборан. Приклад 6 В 1-л колбу з двома горловинами, обладнану мішалкою, зрошувальним конденсатором і перехідником для впуску газу, ввели 400 мл диметилформаміду, 50 г (0,16 М) 2-(1-адамантил)-4броманізолу, 1,8 г (0,0078 М; 5 моль%) паладію ацетату, 6,4 г (0,0155 М; 10 моль%) 2дициклогексилфосфін-2',6'-диметоксибіфенілу (Sphos) і 51 г (0,2 М) bis-пінаколатдиборану. Розчин перемішували впродовж 30 хвилин під легким струменем сухого аргону, після чого додали 49 г (0,5 М) порошкоподібного безводного калію карбонату. Реакційну суміш перемішували при 90 °C під 9 легким струменем сухого аргону впродовж 10 годин. Після цього розчинник було видалено під вакуумом у водяній бані при 70 °C. Залишок розчинили в 200 мл етилацетату. Розчин профільтрували гарячим, концентрували до 100 мл і залишили на 16 годин при температурі біля 0 °C кристалізуватись. Осад відфільтрували, промили мінімальною кількістю холодного етилацетату і висушили при 80 °C. Отримали 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколовий ефір, 28 г (48 %) з температурою плавлення 162-164 °C. Коли замість паладію ацетату використовується tris(дибензиліденацетон)дипаладію(О) [Pd2(dba)3], суттєвої зміни виходу 3-(1-адамантил)4-метоксифенілборинової кислоти пінаколового ефіру не спостерігається. Приклад 7 Реакцію здійснювали, як описано в Прикладі 6. В якості джерела Pd(O) використовували tris (дибензиліденацетон)дипаладію(О) [Pd2(dba)3]. Отримали 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколовий ефір, 29 г (49,5 %). Використання як ліганду дихлорпаладію 1,1'bis(дифенілфосфін)-фероцену чи 2,2'bis(дифенілфосфін)-дифенілового ефіру (DPEphos) не приводить до зниження виходу кінцевого продукту (за даними газової хроматографії). Приклад 8 Реакцію здійснювали, як описано в Прикладі 6. В якості каталізатору використовували дихлорпаладію 1,1'-bis(дифенілфосфін)-фероцен, 6,3 г (0,0078 М; 5 моль%). Було отримано 28 % 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколового ефіру (за даними газової хроматографії). Приклад 9 Реакцію здійснювали, як описано в Прикладі 6. В якості ліганду використовували 2,2'bis(дифенілфосфін)-дифеніловий ефір (DPEphos), 8,4 г (0,0155 М; 10 моль%). Було отримано 36 % 3-(1-адамантил)-4метоксифенілборинової кислоти пінаколового ефіру (за даними газової хроматографії). Збільшення масштабу синтезу в 10 разів при дотриманні оптимальних умов проведення реакції не змінило ні виходу, ні якості кінцевого продукту. Стадія С. Каталітичне сполучення 3-(1адамантил)-4-метоксифенілборинової кислоти з ефіром 6-бром-2-нафтойної кислоти згідно СузукіМіяури Приклад 10 В 1-л колбу з двома горловинами, обладнану мішалкою, зрошувальним конденсатором і перехідником для впуску газу, ввели 0,25 г (0,5 моль%) tris(дибензиліденацетон) дипаладію(О) [Pd2(dba)3] і розчинили в 500 мл тетрагідрофурану. Потім додали 1 г (1 моль%) 2-дициклогексилфосфін-2',6'диметоксибіфенілу (Sphos), і струшували розчин впродовж 30 хвилин під легким струменем аргону. До реакційної суміші додали 30 г (0,105 М) 3(1-адамантил)-4-метоксифенілборинової кислоти пінаколового ефіру і 25 г (0,094 М) метил-6-бром 97509 10 2-нафтеноату і перемішували, доки всі компоненти не розчинились. Додали розчин 30 г (0,28 М) натрію карбонату в 150 мл води. Щоб завершити реакцію, суміш активно перемішували впродовж 4 годин при кипінні під легким струменем аргону. Після цього реакційну суміш охолодили до кімнатної температури і профільтрували без розділення шарів. Осад становив головну частину продукту. Решту продукту отримали шляхом концентрації органічного шару до ¼, охолодження і відфільтровування осаду, який потім об'єднали з головною частиною. Сирий продукт розчинили в 200 мл диметилацетаміду, профільтрували гарячим, зменшили об'єм приблизно до 150 мл і залишили на 16 годин при кімнатній температурі кристалізуватись. Об'ємисті кристали відфільтрували і висушили при 150-180 °C впродовж 2 годин. Отримали метил 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтеноат, 34 г (85 %) з температурою плавлення 222-225 °C. ЯМР (500 МГц, ДМСО D6) : 1,79 (s, 6Н); 2,10 (s, 3Н); 2,16 (s, 6Н); 3,90 (s, 3Н); 3,94 (s, 3Н); 6,99 (d, 1H, J=8 Гц); 7,51 (s, 1Н); 7,52 (d, 1Н, J=8 Гц); 7,78 (d, 1Н, J=9 Гц); 7,94 (d, 1Н, J=8 Гц); 7,98-8,02 (m, 3Н); 8,55 (s, 1H). Підвищення концентрації каталізатору до 5 моль% скорочує тривалість реакції до 0,5 години, але не впливає на вихід кінцевого продукту. Зменшення кількості каталізатору до 0,05 моль% приводить до зростання тривалості реакції до 16 годин і зниження виходу 6-[3-(1-адамантил)4-метоксифеніл]-2-нафтеноату до 76 %. Збільшення масштабу синтезу в 5 разів при дотриманні оптимальних умов проведення реакції не змінило ні виходу, ні якості кінцевого продукту 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату. Метил 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтеноат можна отримати без виділення і очистки 3-(1-адамантил)-4-метоксифенілборинової кислоти пінаколового ефіру. Приклад 11 В 3-л колбу з двома горловинами, обладнану мішалкою, зрошувальним конденсатором і перехідником для впуску газу, помістили 800 мл діоксану, 100 г (0,31 М) 2-(1-адамантил)-4-броманізолу, 94 г (130 мл; 0,93 М) триетиламіну, 3,5 г (0,0155 М; 5 моль%) паладію ацетату і 12,7 г (0,031 М; 10 моль%) 2-дициклогексилфосфін-2',6'диметоксибіфенілу (Sphos). Розчин перемішували впродовж 30 хвилин під легким струменем аргону, після чого додали 51 г (58 мл; 0,4 М) розчину пінаколу борату в 300 мл діоксану. Суміш перемішували впродовж 12 годин під легким струменем аргону.Реакційну суміш охолодили до кімнатної температури, додали 61 г (0,23 М) метил 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтеноату, а потім попередньо приготовлений розчин 127 г (1,2 М) натрію карбонату в 600 мл води. Процес відбувався впродовж 4 годин при активному перемішуванні і дефлегмації при температурі 80 °C під повільним потоком аргону. Після цього реакційну суміш охолодили до кімнатної температури і профільтрували без розді 11 97509 лення шарів. Осад становив головну частину продукту. Решту продукту отримали шляхом концентрації органічного шару до ¼, охолодження і відфільтрування осаду, який потім об'єднали з головною частиною. Об'єднані частини кінцевого продукту розчинили в 200 мл диметилацетаміду, профільтрували гарячим, зменшили об'єм приблизно до 150 мл і залишили на 16 годин при кімнатній температурі кристалізуватись. Кристали відфільтрували і висушили при 150-180 °C впродовж 2 годин. Отримали метил 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтеноат, вихід 78 г, 59 %, використавши як вихідний матеріал 2-(1-адамантил)4-броманізол. Чистота кінцевого продукту перевищує 99 %. Збільшення масштабу синтезу в 10 разів при дотриманні оптимальних умов проведення реакції не змінило ні виходу, ні якості кінцевого продукту. Приготування метил-6-[3-(1-адамантил)-4метоксифеніл]-2-нафтеноату з 2-(1-адамантил)-4броманізол "в одному котлі" Приклад 12 В 3-л колбу з двома горловинами, обладнану мішалкою, зрошувальним конденсатором і перехідником для впуску газу, помістили 800 мл діоксану, 100 г (0,31 М) 2-(1-адамантил)-4-броманізолу, 94 г (130 мл; 0,93 М) триетиламіну, 3,5 г (0,0155 М; 5 моль%) паладію ацетату і 12,7 г (0,031 М; 10 моль%) 2,2'-bis(дифенілфосфін)-дифеніловий ефір (DPEphos). Розчин перемішували впродовж 30 хвилин під легким струменем аргону, після чого додали 51 г (58 мл; 0,4 М) розчину пінаколу борату в 300 мл діоксану. Суміш переганяли впродовж 12 годин під легким струменем аргону. Реакційну суміш охолодили до кімнатної температури, додали 61 г (0,23 М) метил 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтеноату, а потім розчин 127 г (1,2 М) натрію карбонату в 600 мл води. Реакційну суміш активно перемішували при 80 °C впродовж 4 годин під струменем аргону, охолодили до 20 С, після чого відфільтрували продукт. Фільтрат концентрували до ¼ об'єму і охолодили. Осад відфільтрували, об'єднані частини кінцевого продукту розчинили в 200 мл диметилацетаміду, профільтрували гарячим, концентрували до 150 мл і залишили при кімнатній температурі на 16 годин кристалізуватись. Кристали відфільтрували і висушили при 150180 °C впродовж 2 годин. З 2-(1-адамантил)-4броманізолу отримали 78-112 г метил 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтеноату з чистотою понад 99 % (вихід 59-85 %). 12 Збільшення масштабу синтезу в 3 рази не змінило ні виходу, ні якості кінцевого продукту. Стадія D: Гідроліз метил 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтеноату в лужному середовищі Приклад 13 В 600-мл хімічну склянку помістили 10 г метил 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату, 300 мл етилену гліколю і нагріли майже до кипіння. До отриманого прозорого розчину додали трьома порціями 15 г гідроокису натрію і активно перемішували впродовж 20 хвилин. Гарячу реакційну суміш повільно додали при активному перемішуванні до холодного 5 % водного розчину соляної кислоти. Отриману у такий спосіб суспензію перемішували впродовж 30 хвилин і профільтрували. Осад на фільтрі віджали, промили 3500 мл гарячої води і висушили при 100 °C впродовж 16 годин. Отримали 9,3 г (96 %) 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтойної кислоти з температурою плавлення 320 °C і чистотою понад 97 %. ЯМР (500 МГц, ДМСО D6) : 1,79 (s, 6Н); 2,10 (s, 3Н); 2,16 (s, 6Н); 3,90 (s, 3Н); 6,99 (d, 1H, J=8 Гц); 7,51 (s, 1H); 7,52 (d, 1Н, J=8 Гц); 7,76 (d, 1Н, J=9 Гц); 7,92 (d, 1Н, J=8 Гц); 7,98-8,02 (m, 3Н); 8,55 (s, 1H); 12,7 (s, 1H). Використання 1,2-пропандіолу замість етилену гліколю може забезпечити підвищення концентрації гідролізованого метил 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтеноату в розчині на 50 %. Приклад 14 В 600-мл хімічну склянку помістили 10 г метил 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату, 300 мл 1,2-пропандіолу і нагріли майже до кипіння. До отриманого прозорого розчину додали трьома порціями 15 г гідроокису натрію і активно перемішували впродовж 20 хвилин. Подальші операції по обробці реакційної суміші і відділенню кінцевого продукту є такими ж, як описані в Прикладі 13. Вихід 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтойної кислоти становить 96 %. Збільшення масштабу синтезу при дотриманні оптимальних умов проведення реакції не змінило ні виходу, ні якості кінцевого продукту. Отже, описаний спосіб отримання 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтойної кислоти з 2-(1-адамантил)-4-галоанізолу характеризується стабільним і високим виходом кінцевого продукту, простою технологією типу "все в одному котлі" і може бути легко реалізований у фармацевтичній промисловості. Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the preparation of 6-[3-(1-adamantyl)-4-methoxyphenyl]-2-naphthoic acid
Автори англійськоюKalvinsh, Ivars, Chernobrovijs, Aleksandrs, Tribulovich, Vyacheslav, Labeish, Vladimir
Назва патенту російськоюСпособ получения 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты
Автори російськоюКалвиньш Иварс, Чернобровийс Александрс, Трибулович Вячеслав, Лабейш Владимир
МПК / Мітки
МПК: C07C 67/343, C07C 69/00, C07C 65/00, C07C 51/09, C07F 5/02
Мітки: кислоти, спосіб, 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної, отримання
Код посилання
<a href="https://ua.patents.su/6-97509-sposib-otrimannya-6-3-1-adamantil-4-metoksifenil-2-naftojjno-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти</a>
Попередній патент: Спосіб отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти
Наступний патент: Спосіб функціонування вертикальної розмелювальної машини у режимі безперервного сухого перемелювання та вертикальна розмелювальна машина
Випадковий патент: Спосіб керування температурою в кліматичній камері та кліматичний пристрій










