Спосіб отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти
Номер патенту: 97508
Опубліковано: 27.02.2012
Автори: Трібуловіч Вячеслав, Калвіньш Іварс, Лабейш Владімір, Чернобровійс Алєксандрс
Формула / Реферат
1. Спосіб отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти формули (І)
 (I)
(I)
зі сполуки формули (II)
 , (II)
, (II)
в якій R1 - це K, Na, Li, H, лінійний, розгалужений або циклічний С1-С10алкіл, CH2OR, де R є С1-С5алкілом або -(СН2)0-1С6Н5, який характеризується тим, що спосіб здійснюють шляхом нагрівання вихідної сполуки з гідрооксидом натрію або калію в розчині гліколю, переважно в розчині 1,2-пропіленгліколю, з наступною ацидифікацією органічною кислотою і виділенням кінцевого продукту відомими методами.
2. Спосіб за пунктом 1, в якому сполуку формули (II) отримують зі сполуки формули (III)
 , (III)
, (III)
в якій R1 - це K, Na, Li, H, лінійний С1-С10алкіл, розгалужений С3-С10алкіл або циклічний С3-С10алкіл, CH2OR, де R є С1-С5алкілом або -(СН2)0-1С6Н5, a Hal є Сl, Вr або І, преважно Вr, шляхом реакції зі сполукою формули (IV)
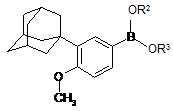 , (IV)
, (IV)
в якій R1 і R2, незалежно один від одного, є K, Na, Li, H, лінійний C1-С10алкіл, розгалужений С3-С10алкіл або циклічний С3-С10алкіл, CH2OR, де R є С1-С5алкілом або -(СН2)0-1С6Н5, в присутності неорганічної основи і паладієвого каталізатора або Pd(O) з фосфіновим лігандом або без нього.
3. Спосіб за пунктом 2, в якому джерело Pd(O) вибирають з групи, що містить паладію ацетат і трис(дибензиліденацетон)дипаладій(O).
4. Спосіб за будь-яким з пунктів 2 або 3, в якому фосфіновий ліганд вибирають з групи, яка містить 2-дициклогексилфосфін-2',6'-диметоксибіфеніл, 2-дициклогексилфосфін-2'-метилбіфеніл, 2-дициклогексилфосфін-2',6'-диметилбіфеніл, 2-2-дициклогексилфосфінбіфеніл, 2-ди-трет-бутилфосфін-2'-метилбіфеніл, 2-ди-трет-бутилфосфін-2',6'-диметилбіфеніл, 2-ди-трет-бутилфосфінбіфеніл, 2,4,6-три-ізопропіл-2'-дифенілілфосфінбіфеніл, дифенілфосфінфероцен, трифенілфосфін, трициклогексилфосфін, три-трет-бутилфосфін, преважно 2-дициклогексилфосфін-2',6'-диметоксибіфеніл.
5. Спосіб за будь-яким з пунктів 2 або 3, в якому паладієвим каталізатором є тетракис(трифенілфосфін)паладій(О).
6. Спосіб за будь-яким з пунктів від 2 до 5, в якому неорганічну основу вибирають з групи, що містить карбонати, ацетати і фосфати літію, натрію, калію і стронцію.
7. Спосіб за будь-яким з пунктів від 2 до 5, в якому реакцію здійснюють в присутності органічного розчинника або суміші органічних розчинників, або суміші органічного розчинника з водою.
8. Спосіб за будь-яким з пунктів від 2 до 7, в якому паладієвий каталізатор або Pd[O] і сполуку формули (IV) використовують у співвідношенні від 0,0005 до 0,1 моль паладієвого каталізатора на один моль сполуки формули (IV), переважно у співвідношенні 0,005 моль на один моль.
9. Спосіб за будь-яким з пунктів від 2 до 8, в якому реакцію здійснюють при температурі від приблизно 20 °С до приблизно 100 °С.
10. Спосіб за пунктом 2, в якому сполуку формули (IV) отримують зі сполуки формули (V)
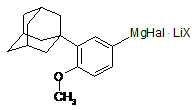 , (V)
, (V)
в якій Hal є Сl, Вr або І, преважно Вr,
X є Сl, Вr, І, SO4, СlO4, BF4, преважно Сl,
шляхом реакції сполуки формули B(OR4)3, де R4 - лінійний С1-С10алкіл, розгалужений С3-С10алкіл або циклічний С3-С10алкіл, преважно СН3.
11. Спосіб за пунктом 10, в якому реакцію здійснюють при температурі від приблизно -70 °С до приблизно +50 °С.
12. Спосіб за пунктом 10 або 11, в якому реакцію здійснюють при температурі від приблизно 0 °С до приблизно +5 °С.
13. Спосіб за пунктом 10, в якому сполуку формули (V) отримують зі сполуки формули (VI)
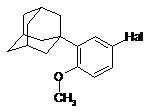 , (VI)
, (VI)
в якій Hal є Сl, Вr або І, преважно Вr,
шляхом реакції з магнієм в апротонному інертному розчиннику в прямій реакції Гриньяра в присутності безводної неорганічної солі літію.
14. Спосіб за пунктом 13, в якому реакцію здійснюють при температурі від приблизно -70 °С до приблизно +80 °С, переважно від приблизно 20 °С до приблизно 70 °С.
15. Спосіб за пунктом 13 або 14, в якому апротонним розчинником в реакції є тетрагідрофуран.
16. Спосіб за будь-яким з пунктів від 13 до 15, в якому безводну неорганічну сіль літію вибирають з групи, що містить хлорид, бромід, йодид, сульфат, перхлорат, тетрафторборат, а переважно є безводним літію хлоридом.
17. Спосіб за будь-яким з пунктів від 13 до 16, в якому безводну неорганічну сіль літію використовують у співвідношенні від 0,1 до 5,0 моль на один моль сполуки формули (VI).
18. Спосіб за будь-яким з пунктів від 13 до 16, в якому безводну неорганічну сіль літію використовують у співвідношенні переважно від 1,2 до 1,5 моль на один моль сполуки формули (VI).
19. Спосіб за будь-яким з пунктів від 2 до 9, в якому сполуку формули (IV), отриману у відповідності до способу за будь-яким пунктом від 10 до 18, використовують без виділення з реакційної суміші і очистки.
Текст
1. Спосіб отримання 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтойної кислоти формули (І) O O OR1 O CH3 , (II) в якій R1 - це K, Na, Li, H, лінійний, розгалужений або циклічний С1-С10алкіл, CH2OR, де R є С1-С5алкілом або -(СН2)0-1С6Н5, який характеризується тим, що спосіб здійснюють шляхом нагрівання вихідної сполуки з гідрооксидом натрію або калію в розчині гліколю, переважно в розчині 1,2пропіленгліколю, з наступною ацидифікацією орга (11) (I) зі сполуки формули (II) UA CH3 , (IV) 1 2 в якій R і R , незалежно один від одного, є K, Na, Li, H, лінійний C1-С10алкіл, розгалужений С3-С10алкіл або циклічний С3-С10алкіл, CH2OR, де R є С1-С5алкілом або -(СН2)0-1С6Н5, в присутності неорганічної основи і паладієвого каталізатора або Pd(O) з фосфіновим лігандом або без нього. 3. Спосіб за пунктом 2, в якому джерело Pd(O) вибирають з групи, що містить паладію ацетат і трис(дибензиліденацетон)дипаладій(O). 4. Спосіб за будь-яким з пунктів 2 або 3, в якому фосфіновий ліганд вибирають з групи, яка містить 2-дициклогексилфосфін-2',6'диметоксибіфеніл, 2-дициклогексилфосфін-2'метилбіфеніл, 2-дициклогексилфосфін-2',6'диметилбіфеніл, 2-2дициклогексилфосфінбіфеніл, 2-ди-третбутилфосфін-2'-метилбіфеніл, 2-ди-третбутилфосфін-2',6'-диметилбіфеніл, 2-ди-третбутилфосфінбіфеніл, 2,4,6-три-ізопропіл-2'дифенілілфосфінбіфеніл, дифенілфосфінферо (19) CH3 O 97508 O 3 97508 цен, трифенілфосфін, трициклогексилфосфін, тритрет-бутилфосфін, преважно 2дициклогексилфосфін-2',6'-диметоксибіфеніл. 5. Спосіб за будь-яким з пунктів 2 або 3, в якому паладієвим каталізатором є тетракис(трифенілфосфін)паладій(О). 6. Спосіб за будь-яким з пунктів від 2 до 5, в якому неорганічну основу вибирають з групи, що містить карбонати, ацетати і фосфати літію, натрію, калію і стронцію. 7. Спосіб за будь-яким з пунктів від 2 до 5, в якому реакцію здійснюють в присутності органічного розчинника або суміші органічних розчинників, або суміші органічного розчинника з водою. 8. Спосіб за будь-яким з пунктів від 2 до 7, в якому паладієвий каталізатор або Pd[O] і сполуку формули (IV) використовують у співвідношенні від 0,0005 до 0,1 моль паладієвого каталізатора на один моль сполуки формули (IV), переважно у співвідношенні 0,005 моль на один моль. 9. Спосіб за будь-яким з пунктів від 2 до 8, в якому реакцію здійснюють при температурі від приблизно 20 °С до приблизно 100 °С. 10. Спосіб за пунктом 2, в якому сполуку формули (IV) отримують зі сполуки формули (V) MgHal . LiX O CH3 , (V) в якій Hal є Сl, Вr або І, преважно Вr, X є Сl, Вr, І, SO4, СlO4, BF4, преважно Сl, 4 4 шляхом реакції сполуки формули B(OR )3, де R лінійний С1-С10алкіл, розгалужений С3-С10алкіл або циклічний С3-С10алкіл, преважно СН3. 11. Спосіб за пунктом 10, в якому реакцію здійснюють при температурі від приблизно -70 °С до приблизно +50 °С. Даний винахід стосується процесу отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти (адапалену). Адапален використовується для лікування acne vulgaris [Waugh, J.; Noble, S.; Scott, L. Spotlight on adapalene in acne vulgaris. J. Am. J. Clin. Dermatol. 2004, 5 (5), 369-371; Jain, S. Topical tretinoin or adapalene in acne vulgaris: an overview. J. Dermatol. Treat. 2004, 15 (4), 200-207.] Ця речовина володіє також протипухлинною активністю [WO 2001/056563, Galderma Research (USA)]. Отже, було б бажано мати зручний процес отримання адапалену. Спосіб отримання 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтойної кислоти є відомим з 1986 p. [Shroot, В.; Eustache, J.; Bernardon, J.-M. ЕР 199636; Bezonaphtalene derivatives and compositions. US 4717720 (1988)]. Це - багатостадійний процес, який включає наступні стадії: 4 12. Спосіб за пунктом 10 або 11, в якому реакцію здійснюють при температурі від приблизно 0 °С до приблизно +5 °С. 13. Спосіб за пунктом 10, в якому сполуку формули (V) отримують зі сполуки формули (VI) Hal O CH3 , (VI) в якій Hal є Сl, Вr або І, преважно Вr, шляхом реакції з магнієм в апротонному інертному розчиннику в прямій реакції Гриньяра в присутності безводної неорганічної солі літію. 14. Спосіб за пунктом 13, в якому реакцію здійснюють при температурі від приблизно -70 °С до приблизно +80 °С, переважно від приблизно 20 °С до приблизно 70 °С. 15. Спосіб за пунктом 13 або 14, в якому апротонним розчинником в реакції є тетрагідрофуран. 16. Спосіб за будь-яким з пунктів від 13 до 15, в якому безводну неорганічну сіль літію вибирають з групи, що містить хлорид, бромід, йодид, сульфат, перхлорат, тетрафторборат, а переважно є безводним літію хлоридом. 17. Спосіб за будь-яким з пунктів від 13 до 16, в якому безводну неорганічну сіль літію використовують у співвідношенні від 0,1 до 5,0 моль на один моль сполуки формули (VI). 18. Спосіб за будь-яким з пунктів від 13 до 16, в якому безводну неорганічну сіль літію використовують у співвідношенні переважно від 1,2 до 1,5 моль на один моль сполуки формули (VI). 19. Спосіб за будь-яким з пунктів від 2 до 9, в якому сполуку формули (IV), отриману у відповідності до способу за будь-яким пунктом від 10 до 18, використовують без виділення з реакційної суміші і очистки. а) алкилювання 4-бромфенолу адамантолом-2 з утворенням 2-(1-адамантил)-4-бромфенолу; б) О-алкилювання 2-(1-адамантил)-4бромфенолу з використанням Mel з отриманням 2(1-адамантил)-4-броманізолу; в) приготування реактиву Грин'яра з 2-(1адамантил)-4-броманізолу, його перетворення в похідне цинку та його каталізована Ni конденсація метил 6-бром-2-нафтеноатом з утворенням метил6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату; г) гідроліз в лужному середовищі метил-6-[3(1-адамантил)-4-метоксифеніл]-2-нафтеноату з отриманням 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтойної кислоти. Цей процес має низку недоліків: 1) очистка 2-(1-адамантил)-4-броманізолу і метил-6-[3-(1-адамантил)-4-метоксифеніл]-2нафтеноату вимагає використання колонкової хроматографії; 5 2) приготування реактиву Грин'яра з 2-(1адамантил)-4-броманізолу, його перетворення в похідне цинку та його каталізована Ni конденсація метил 6-бром-2-нафтеноатом з утворенням метил6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату на стадії (в) важко піддаються регуляції в промисловому масштабі і не дають стабільних виходів. Перспективним способом виготовлення адапалену, вочевидь, є використання реакції СузукіМіяури [Miyaura, N.; Suzuki, A. Palladium-catalyzed cross-coupling of organoboron compounds. Chem. Rev. 1995, 95 (7), 2457-2483; Suzuki, A. Recent advances in the cross-coupling reactions of organoboron derivatives with organic electrophiles, 1995-1998 J. Organomet. Chem. 1999, 576, 147-168; Kotha, S.; Lahiri, K.; Kashinath, D., Recent applications of the Suzuki-Miyaura reaction in organic synthesis. Tetrahedron 2002, 58, 9633-9695]. Використання реакції Сузукі-Міяури в цьому процесі повинне забезпечити ефективне сполучення двох відомих сполук - 3-(1-адамантил)-4метоксифенілборинової кислоти чи її прийнятного похідного з прийнятним похідним метил-6заміщеного 2-нафтеноату. В 2006 р. було опубліковано процес (Castaldi, G.; Allegnni, P.; Razezetti, G.; Ercoli, M.; A process for the preparation of adapalene, EP 1707555 А), в якому використовується синтез адапалену за вже відомою (Zim, D.; Lando, V.R.; Dupont, J.; Montiero, A.L. Org. Lett. 2001, 3, 3049) версією реакції СузукіМіяури для сполучення 3-(1-адамантил)-4метоксифенілборинової кислоти з тозилокси-2нафтеноатом в присутності солі Ni(ll) і фосфінових лігандів: На жаль, у згаданому патенті не описаний ні спосіб приготування З-(і-адамантил)-4метоксифенілборинової кислоти, ні спосіб приготування тозилокси-2-нафтеноату. Відомі процеси для отримання 3-(1-адамантил)-4метоксифенілборинової кислоти не забезпечують недорогого виробництва зі стабільними і достатньо високими виходами. Наші спроби повторити спосіб Castaldi показали, що сполучення, каталізоване комплексом Мі(ІІ)/фосфін, є нестабільним процесом з непостійним попереднім виходом. Відповідно, метою даного винаходу була розробка на основі реакції Сузукі-Міяури альтернативного процесу отримання 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтойної кислоти, що характеризується стабільними і високими виходами, гнучкою зміною масштабу реакції і придатністю для промислового використання. Оскільки найбільш важливим і важким в приготуванні проміжним продуктом в синтезі 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтойної кислоти 97508 6 є 3-(1-адамантил)-4-метоксифенілборинова кислота, перед нами стояло завдання розробити зручний спосіб отримання саме 3-(1-адамантил)-4метоксифенілборинової кислоти. Спосіб синтезу 3-(1-адамантил)-4метоксифенілборинової кислоти, виходячи з 2-(1адамантил)-4-броманізолу і використовуючи відповідне похідне літію, є відомим: [Sarshar, S Novel therapeutic agents for the treatment of cancer, metabolic diseases and skin disorders. WO 2005/108338 A1]. Головним недоліком цього способу є низький вихід кінцевого продукту, що не перевищує 12 %. Важливо відмітити, що і реакція металювання (заміщення металом водню, з'єднаного з атомом вуглецю), і реакція переметалювання (заміна одного залишку, який містить метал, на інший) здійснюються при температурі -78 °C, що значно ускладнює реалізацію цього процесу в промисловому масштабі. Відповідно, було необхідно розробити препаративний спосіб для отримання 3-(1-адамантил)-4метоксифенілборинової кислоти та її похідних, який би підходив для промислового застосування, даючи високі виходи при температурах, що є зручними для промислових процесів. Нами вперше було встановлено, що 3-(1адамантил)-4-метоксифенілборинову кислоту та її похідні, необхідні для синтезу адапалену, можна отримати з 2-(1-адамантил)-4-броманізолу шляхом його перетворення на модифікований реактив Грин'яра отриманий при здійсненні реакції в обраному розчиннику, наприклад тетрагідрофурані, з використанням одночасно двох активаторів реакції літію хлориду і диброметану. Молярне співвідношення LiCI і 2-(1адамантил)-4-броманізолу при приготуванні реактиву Грин'яра може становити від 0,5 до 3,0, але найкращі виходи досягаються за умови надлишку LiCI. Нами було встановлено, що оптимальне співвідношення цих реактивів становить від 1,2 до 7 1 Подальше збільшення долі LiCI до 3:1 не покращує вихід. Для приготування реактиву Грин'яра (V) з 2-(1адамантил)-4-броманізолу можуть бути використані різні солі літію, наприклад LiBr, Lil, Li2SO4, LiCIO4, LiBF4, але найкращі результати досягаються при використанні LiCI. Температура в реакційному середовищі може становити від мінус 70 °C до плюс 65 °C, але більш зручно проводити цей процес при температурі кипіння тетрагідрофурану. Замість 2-(1-адамантил)-4-броманізолу можуть бути використані інші 2-(1-адамантил)-4галоанізоли, наприклад похідні хлору чи йоду Нами було встановлено, що 3-(1-адамантил)4-метоксифенілборинову кислоту можна отримати з вищезгаданого реактиву Грин'яра навіть при температурі від 0 °C до +5 °C. Це було несподіваним і вражаючим відкриттям. Адже відомо, що подібні арилборинові кислоти отримуються при значно нижчих температурах, наприклад при -70 °C [Seaman, W., Jonson, J.R. Derivatives of phenylboric acid, their preparation and action upon bacteria. J. Am. Chem. Soc. 1931, 53 (2), 711-723; Bean, F.R.; Jonson, J.R. Derivatives of phenylboric acid, their preparation and action upon bacteria. II. Hydroxyphenylboric acids. J. Am. Chem. Soc. 1932, 54 (11), 4415-4425; Cladingboel, D.E. A large-scale synthesis of [4-(2-(2H)-tetrahydropyranyloxy)phenyl]boronic acid. Org. Process Res. Dev., 2000, 4 (3), 153-155]. Ще більш несподіваним був той факт, що зниження температури на етапі реакції сполучення не збільшує вихід 3-(1-адамантил)-4метоксифенілборинової кислоти. Згідно з даним винаходом, реактив Грин'яра може бути перетворений на похідне 3-(1адамантил)-4-метоксифенілборинової кислоти шляхом реакції з триалкілборатами, а краще з триметилборатом. Ми встановили, що в цій реакції триметилборат можна замінювати електрофільними триалкілборатами, але звичайно це приводить до знижених виходів 3-(1-адамантил)-4метоксифенілборинової кислоти. 3-(1-адамантил)-4-метоксифенілборинова кислота не є дуже стабільною сполукою. Нестабільність 3-(1-адамантил)-4-метоксифенілборинової кислоти демонструється її ЯМР спектром, в якому спостерігається змінна частка сигналів від її циклічного тримеру (бороксину). Для утворення С-Сзв'язку важливо, щоб один з компонентів сполучення, а саме 3-(1-адамантил)-4метоксифенілрадикал був заміщеним функціональною групою, що містить бор, наприклад: де - це Н, алкільна чи циклоалкільна група. Вивчаючи проблему стабілізації 3-(1адамантил)-4-метоксифенілборинової кислоти, ми синтезували низку алкіл 3-(1-адамантил)-4метоксифенілборатів, які можна було зручно отримати як результат дії реактиву Грин'яра на 97508 8 триалкілборати. Нами також було встановлено, що 3-(1-адамантил)-4-метоксифенілборинову кислоту можна легко перетворити на відповідний циклічний ефір, наприклад пінаколовий ефір, нагріваючи 3(1-адамантил)-4-метоксифенілборинову кислоту з 2,3-диметил-2,3-бутандіолом (пінаколом) в толуолі з видаленням води шляхом азеотропної дистиляції. Подібним чином готуються циклічні ефіри етилен гліколю і 2,2-диметил-1,3-пропандіолу. Отже, ми вперше отримали нові ефіри 3-(1адамантил)-4-метоксифенілборинової кислоти для використання в синтезі адапалену. Синтез адапалену за даним винаходом з такого легко доступного вихідного матеріалу, як2-(1адамантил)-4-броманізол, включає наступні стадії: A) суттєво поліпшений, здатний до відтворення і масштабування спосіб отримання 3-(1адамантил)-4-метоксифенілборинової кислоти з використанням реактиву Грин'яра, який готується з високим виходом з 2-(1-адамантил)-4-броманізолу при температурі 0-5 °C в присутності LiCI та диброметану; B) придатне для промислового застосування каталітичне сполучення 3-(1-адамантил)-4метоксифенілборинової кислоти чи її похідних в реакції Сузукі-Міяури з 6-галонафтойним ефіром з утворенням 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтойного ефіру, його наступним гідролізом у лужному середовищі до 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтойної кислоти в розчині етилен гліколю чи пропан-1,2-діолу, що дозволяє відділити кінцевий продукт відомими методами. В цій реакції сполучення замість метил-6бром-2-нафтеноату можуть бути використані також інші ефіри 6-гало-2-нафтойних кислот, наприклад ефіри 6-хлор-2-нафтойної кислоти чи 6-йод-2нафтойної кислоти. Крім того, вказана 6-гало-2нафтойна кислота може застосовуватись як вільна кислота або як її сіль Li, Na чи К. Згадані 6-гало-2-нафтойні ефіри, що використовуються в реакції сполучення, можуть бути отримані зі спиртів, що містять від 1 до 10 атомів вуглецю, як лінійних, так і розгалужених. Більш того, 6-гало-2-нафтойні ефіри можуть бути отримані також з ациклічних спиртів, що містять 3, 4, 5 чи 6 атомів вуглецю в циклі і факультативно заміщені в кільці. Іншими 6-гало-2нафтойними ефірами для використання в даному способі є алкоксиметилові чи арилоксиметилові ефіри з загальною формулою метилової групи COO-CH2OR, де R означає алкільну групу, наприклад метил-, етил-, пропил-, ізопропил-, бутил-, ізобутил-, пентил- чи розгалужену пентилову групу, а також арил, що містить оксиметилову групу, наприклад феноксиметилову чи бензилоксиметилову групу. Запропоновані проміжні продукти можуть бути представлені наступною загальною формулою: 9 1 в якій R - це Н, К, Na, Li, арил, СГС1О лінійний, розгалужений чи циклічний алкіл, СН2ОСг С5алкіл, a Hal - це СІ, Вг чи І. В якості другого компоненту реакції сполучення процес за цим винаходом передбачає використання різних похідних 3-(1-адамантил)-4метоксифенілборинової кислоти загальної формули: 2 3 в якій R і R , незалежно один від одного, є Н, К, Na, Li, C1-C10 лінійний, розгалужений чи циклічний алкіл або арил. Ми встановили також, що сполучення похідного 3-(1-адамантил)-4-метоксифенілборинової кислоти з 6-гало-2-нафтойним ефіром можна каталізувати різними агентами, включаючи основні агенти, такі як карбонати, ацетати чи фосфати Li, Na, K чи Sr. На відміну від відомого процесу Кастальді, який використовує каталіз солями нікелю і фосфіновими лігандами, ми встановили, що високі і відтворювані виходи в цій реакції забезпечуються каталізаторами, що містять паладій чи Pd(O) із застосуванням чи без застосування фосфінових лігандів, наприклад тетракіс(трифенілфосфін)паладію(0). Найбільш зручними джерелами паладію Pd(O) використовуються паладію ацетат і tris(дибензиліденацетон)дипаладій(О). Наші дослідження показують, що наступні фосфінові ліганди можуть бути використані для каталізу реакції сполучення: 2-дициклогексилфосфіно-2',6'диметоксибіфеніл, 2-дициклогексилфосфін-2'метилбіфеніл, 2-дициклогексилфосфін-2',6'диметилбіфеніл, 2-2дициклогексилфосфінбіфеніл, 2-ди-tertбутилфосфін-2'-метилбіфеніл, 2-ди-tertбутилфосфін-2',6'-диметилбіфеніл, 2-ди-tert бутилфосфінбіфеніл, 2,4,6-три-ізо-пропил-2'дифенілілфосфінбіфеніл, дифенілфосфінфероцен, трифенілфосфін, трициклогексилфосфін, а також три-tert-бутилфосфін, хоча найкращі результати досягаються при використанні в якості 97508 10 ліганду 2,2'-bis(дифенілфосфін)-дифенілового ефіру. Кількість каталізатору залежить від його структури, коливаючись в межах від 0,0005 до 0,1 молю на моль використаного похідного 3-(1-адамантил)4-метоксифенілборинової кислоти. У більшості випадків оптимальна концентрація каталізатору становить біля 0,005 моля на моль похідного боринової кислоти. Ця реакція здійснюється у відповідному органічному розчиннику, або в суміші органічних розчинників, або в суміші органічних розчинників з водою. Температура реакції залежить від використаних компонентів і каталізатору і коливається від 20 до 100 °C. Даний винахід пояснюється, але не обмежується, наступними прикладами. Стадія А. 2-(1-адамантил)-4-броманізол Приклад 1 В 1-л колбі, обладнаній мішалкою, зрошувальним конденсатором і крапельною воронкою, приготували суміш з 50 г (0,33 М) 1-адамантанолу, 68 г (45,5 мл; 0,36 М) 4-броманізолу і 500 мл метилену хлориду. Суміш перемішували до розчинення, після чого впродовж 1 години додали 35 г (19 мл; 0,36 М) сірчаної кислоти. Реакційну суміш перемішували впродовж 4 годин, додали 200 мл води, перемішували ще 10 хвилин, перенесли в розділювальну воронку і зібрали органічний шар, який нейтралізували двома 100-мл порціями 10 % розчину натрію карбонату. Метилен хлорид повністю відігнали, а залишок розчинили в 300 мл етилацетату, профільтрували, концентрували до 200 мл і залишили кристалізуватись при 0 °C впродовж 16 годин. Кристали відфільтрували, промили 50 мл холодного етилацетату і висушили при 100 °C впродовж 1 години. Отримали 2-адамантил-4броманізол, 76 г (72 %) з температурою плавлення 140-141 °C. ЯМР (500 МГц, ДМСО D6) : 1,75 (s, 6Н); 2,03 (s, 9Н); 3,81 (s, ЗН); 6,82 (d, 1Н, J=8 Гц); 7,17 (s, 1Н); 7,23 (d, 1H, J=8 ГЦ). Збільшення масштабу синтезу в 10 разів не змінило ні виходу, ні якості 2-адамантил-4броманізолу. Стадія В. 3-(1-адамантил)-4метоксифенілборинової кислоти Приклад 2 В 1-л колбі, обладнаній мішалкою, зрошувальним конденсатором і крапельною воронкою, змішали 8 г (0,33 М) ошурок магнію і 200 мл сухого тетрагідрофурану. Додали 8 г (0,19 М) порошкоподібного безводного літію хлориду. Повітря в колбі витіснили аргоном і всі подальші операції здійснювали під легким струменем цього інертного газу. При інтенсивному перемішуванні додали 11 г (5 мл; 0,06 М) 1,2-диброметану як одну порцію. Після стихання активної реакції гарячу реакційну суміш обробили розчином 50 г (0,16 М) 2-(1-адамантил)4-броманізолу в 400 мл тетрагідрофурану з такою швидкістю, щоб підтримувався незначний рефлюкс. Після додавання розчину 2-(1-адамантил)-4броманізолу реакційну суміш перемішували і нагрівали до повільного рефлюксу ще 30 хвилин. Потім перемішування припиняли і отриманий у такий спосіб реактив Грин'яра злили із залишко 11 вим магнієм в конічну колбу, попередньо продуту аргоном, закрили притертою пробкою і тримали при 0 °C впродовж 2 годин. В 1-л колбі, обладнаній мішалкою, зрошувальним конденсатором і крапельною воронкою, приготували суміш з 33 г (36 мл; 0,35 М) триметилборату і 100 мл сухого тетрагідрофурану. Отриманий розчин охолодили до 0-5 °C (льодяною водою) і при інтенсивному перемішуванні обробили попередньо приготовленим реактивом Грин'яра в межах 10 хвилин. Реакційну суміш залишили на ніч (16 годин) в холодильнику при 0-5 °C. Для розкладання реакційної суміші було використано розчин 50 мл соляної кислоти в 50 мл води при інтенсивному перемішуванні без зовнішнього охолодження. Суміш перенесли в розділювальну воронку і розділили шари. До водного шару додали 200 мл води і двічі екстрагували, використовуючи 100 мл діетилового ефіру. Об'єднані органічні розчини висушили на безводному натрію сульфаті, розчинники видалили під вакуумом при температурі близько 50 °C у водяній ванні. Залишок обробили 200 мл етилацетату і залишили на ніч в холодильнику. Осад відфільтрували і висушили при 100 °C. Отримали 3-(1-адамантил)-4метоксифенілборинову кислоту, 30 г (68 %) з температурою плавлення ~300 °C. Приклад З Реакція здійснюється, як описано в Прикладі 2, з використанням 81 г (94 мл; 0,35 М) трибутилборату в якості електрофільного агенту. Отримується 3-(1-адамантил)-4-метоксифенілборинова кислота, 28 г (56 %). Приклад 4 Реакція здійснюється, як описано в Прикладі 2, з використанням 66 г (81 мл; 0,35 М) триізопропилборату. Отримується 3-(1-адамантил)-4метоксифенілборинова кислота, 23 г (51 %). Приклад 5 Реакція здійснюється, як описано в Прикладі 2. Реактив Грин'яра отримують з використанням 6,8 г (0,16 М; 1 еквівалент) LiCI. Отримується 3-(1адамантил)-4-метоксифенілборинова кислота, 21,2 г (48 %). Приклад 6 Реакція здійснюється, як описано в Прикладі 2. Реактив Грин'яра отримують при додаванні 0,7 г (0,016 М; 0,1 еквіваленту) LiCI. Отримується 3-(1адамантил)-4-метоксифенілборинова кислота, 3,1 г (7 %). Приклад 7 Реакція здійснюється, як описано в Прикладі 2. Реактив Грин'яра отримують без додавання LiCI. Отримується 3-(1-адамантил)-4метоксифенілборинова кислота, 1,3 г (3 %). Приклад 8 Реакція здійснюється, як описано в Прикладі 2. Реактив Грин'яра отримують при додаванні 13,6 г (0,32 М; 2 еквіваленти) LiCI. Отримується 3-(1адамантил)-4-метоксифенілборинова кислота, 28 г (63 %). Приклад 9 Реакція здійснюється, як описано в Прикладі 2. Реактив Грин'яра отримують при додаванні 20,4 г (0,48 М; 3 еквіваленти) LiCI. Отримується 3-(1 97508 12 адамантил)-4-метоксифенілборинова кислота, 27 г (62 %). Приклад 10 Реакція здійснюється, як описано в Прикладі 2. Взаємодія розчину З-(і-адамантил)-4метоксифенілмагнію броміду з триметилборатом відбувається при температурі -70 °C. Отримується 3-(1-адамантил)-4-метоксифенілборинова кислота, 30,6 г (69 %). Збільшення масштабу синтезу в 6 разів при збереженні оптимальних умов реакції не знижує вихід 3-(1-адамантил)-4-метоксифенілборинової кислоти. Оскільки ЯМР спектр 3-(1-адамантил)-4метоксифенілборинової кислоти демонструє комбіновані спектри кислоти і її циклічного тримеру (бороксину) в різних співвідношеннях, ідентифікацію продукту було здійснено після отримання циклічного ефіру пінаколу. Приклад 11 В 1-л колбу, обладнану насадкою Діна-Старка, помістили 100 г (0,35 М) 3-(1-адамантил)-4метоксифенілборинової кислоти, 45,5 г (0,39 М) 2,3-диметил-2,3-бутандіолу (пінаколу) і 500 мл толуолу. Цю суміш переганяли впродовж 2 годин, доки в насадці Діна-Старка не зібралась теоретична кількість води (~13 мл). Після цього розчинник видалили під вакуумом у водяній ванні при 60 °C. Залишок розчинили в 200 мл етилацетату і залишили на 16 годин при температурі близько 0 °C. Осад відфільтрували, промили мінімальним об'ємом холодного етилацетату і висушили при 80 °C. Отримали пінаколовий ефір 3-(1-адамантил)-4метоксифенілборинової кислоти, 108 г (84 %) з температурою плавлення 162-164 °C. ЯМР (500 МГц, ДМСО D6) : 1,30 (s, 12Н); 1,76 (s, 6Н); 2,07 (s, ЗН); 2,09 (s, 6Н); 3,85 (s, ЗН); 6,83 (d, 1H, J=8 Гц); 7,49 (s, 1Н); 7,50 (d, 1Н, J=8 Гц). При використанні етилену гліколю в якості спирту вихід даного ефіру становив 76 %; вихід 2,2-диметил-1,3-пропандіолового ефіру був 82 %. За даними газової хроматографії вихід ефірів становить 98-100 %. Більш низький препаративний вихід є результатом втрат при рекристалізації. Збільшення масштабу синтезу в 10 разів при дотриманні оптимальних умов проведення реакції не змінило ні виходу, ні якості кінцевого продукту. Стадія С. Каталітичне сполучення похідних 3(1-адамантил)-4-метоксифенілборинової кислоти з ефірами 6-бром-2-нафтойної кислоти згідно Сузукі-Міяури Приклад 12 В 1-л колбі, обладнаній мішалкою і зрошувальним конденсатором, розчинили 0,25 г (0,5 моль%) tris(дибензиліденацетон) дипаладію(О) [Pd2(dba)3] і розчинили в 500 мл тетрагідрофурану. Потім додали 1 г (0,5 моль%) 2дициклогексилфосфін-2',6'-диметоксибіфенілу (Sphos), і перемішували отриманий розчин впродовж 30 хвилин під легким струменем аргону. До реакційної суміші додали 30 г (0,105 М) 3(1-адамантил)-4-метоксифенілборинової кислоти і 25 г (0,094 М) метил-6-бром-2-нафтеноату і перемішували, доки всі компоненти не розчинились. 13 Останнім компонентом був розчин 30 г (0,28 М) натрію карбонату в 150 мл води, приготовлений завчасно, який додали як одну порцію. Процес здійснювався при інтенсивному перемішуванні і рефлюксі під легким струменем аргону. Після завершення реакції реакційну суміш охолодили до кімнатної температури і профільтрували без розділення шарів. Осад становив головну частину продукту. Решту продукту отримали шляхом концентрації органічного шару до %, охолодження і відфільтровування осаду, який потім об'єднали з головною частиною. Сирий продукт розчинили в 200 мл диметилацетаміду, профільтрували гарячим, зменшили об'єм приблизно до 150 мл і залишили на 16 годин при кімнатній температурі кристалізуватись. Об'ємисті кристали відфільтрували і висушили при 150-180 °C впродовж 2 годин. Отримали метил 6-[3-(1-адамантил)4-метоксифеніл]-2-нафтеноат, 35,2-36,8 г (8892 %) з температурою плавлення 222-225 °C. ЯМР (500 МГц, ДМСО D6) : 1,79 (s, 6Н); 2,10 (s, ЗН); 2,16 (s, 6Н); 3,90 (s, ЗН); 3,94 (s, ЗН); 6,99 (d, 1H, J=8 Гц); 7,51 (s, 1Н); 7,52 (d, 1Н, J=8 Гц); 7,78 (d, 1Н, J=9 Гц); 7,94 (d, 1Н, J=8 Гц); 7,98-8,02 (т, ЗН); 8,55 (s, 1H). Заміна 3-(1-адамантил)-4метоксифенілборинової кислоти її пінаколовим чи етиленгліколевим ефіром, або заміна tris(дибензиліденацетон) дипаладію(О) [Pd2(dba)3] паладієм ацетатом [Pd(OAc)2], або використання в якості основного агенту калію карбонату чи калію фосфату суттєво не впливають на вихід метил 6[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату. Приклад 13 Реакція здійснюється, як описано в Прикладі 12. В якості компоненту боринової кислоти використовується етиленгліколевий ефір 3-(1адамантил)-4-метоксифеніл боринової кислоти, 33 г (0,105 М), в якості основного агенту - 41 г (0,3 М) розчину калію карбонату в 200 мл води. Отримується метил 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтеноат, 34,5 г (86 %). Приклад 14 Реакція здійснюється, як описано в Прикладі 12. В якості компоненту боринової кислоти використовується пінаколовий ефір 3-(1-адамантил)-4метоксифеніл боринової кислоти, 39 г (0,105 М), в якості джерела Pd(O) - паладію ацетат, 0,11 г (0,5 моль%). В якості основного агенту використовується розчин 60 г (0,28 М) калію фосфату в 200 мл води. Отримується метил 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтеноат, 35 г (87 %). Поступове збільшення кількості каталізатору до 5 моль% приводить до скорочення тривалості реакції до півгодини, але не впливає на вихід кінцевого продукту. Зменшення кількості каталізатору до 0,05 моль% приводить до зростання тривалості реакції до 16 годин і зменшення виходу 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтеноату до 76 %. Збільшення масштабу синтезу при дотриманні оптимальних умов проведення реакції не змінило виходу кінцевого продукту 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтеноату. 97508 14 Використання в якості каталізатору свіжо приготовленого тетракіс (трифенілфосфін)паладію(О) Pd[P(Ph)3]4 при підтриманні оптимальних умов реакції забезпечує знижений вихід кінцевого продукту, як 3-(1-адамантил)-4-метоксифеніл боринової кислоти, так і пінаколового ефіру 3-(1адамантил)-4-метоксифеніл боринової кислоти. Приклад 15 Реакція здійснюється, як описано в Прикладі 12. В якості каталізатору використовується свіжо приготовлений тетракіс (трифенілфосфін)паладію(О) Pd[P(Ph)3]4, 0,6 г (0,5 моль%). Отримується метил 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтеноат, 27,2 г (68 %). Приклад 16 Реакція здійснюється, як описано в Прикладі 12. В якості компоненту боринової кислоти використовується пінаколовий ефір 3-(1-адамантил)-4метоксифеніл боринової кислоти, 39 г (0,105 М), в якості каталізатору - свіжо приготовлений тетракіс (трифенілфосфін)-паладію(О) Pd[P(Ph)3]4, 0,6 г (0,5 моль%). Отримується метил 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтеноат, 23 г (57 %). Метил 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтеноат може бути отриманий без виділення і очистки 3-(1-адамантил)-4-метоксифеніл боринової кислоти, отриманої на Стадії В. Приклад 17 В 2-л колбу, обладнану мішалкою, зрошувальним конденсатором і крапельною воронкою, помістили 18 г (0,75 М) ошурок магнію і додали 400 мл сухого тетрагідрофурану. Потім додали 17 г (0,4 М) порошкоподібного безводного літію хлориду. Всі операції виконували під легким струменем аргону. При інтенсивному перемішуванні додали 22 г (10 мл; 0,12 М) 1,2-диброметану. Після завершення реакції до реакційної суміші додали 100 г (0,31 М) 2-(1-адамантил)-4-броманізолу, розчиненого в 700 мл сухого тетрагідрофурану, з такою швидкістю, щоб підтримувався незначний рефлюкс реакційної суміші. Після додавання всього розчину 2(1-адамантил)-4-броманізолу реакційну суміш переганяли ще 30 хвилин. Потім перемішування припиняли і отриманий у такий спосіб реактив Грин'яра злили із залишковим магнієм в конічну колбу, попередньо продуту аргоном, і тримали при 0 °C впродовж 2 годин. В 2-л колбі, обладнаній мішалкою, зрошувальним конденсатором і крапельною воронкою, приготували розчин 70 г (76 мл; 0,67 М) триметилборату в 200 мл сухого тетрагідрофурану. Отриманий розчин охолодили до 0-5 °C і при інтенсивному перемішуванні обробили попередньо приготовленим реактивом Грин'яра в межах 10 хвилин. Реакційну суміш залишили на 16 годин в холодильнику при температурі біля 0 °C. Для розкладання реакційної суміші було використано повільне додавання при інтенсивному перемішуванні 120 мл насиченого водного розчину амонію хлориду. Органічний шар злили з неорганічних солей, а залишок промили додатковими 120 мл тетрагідрофурану. В 2-л колбі, обладнаній мішалкою і зрошувальним конденсатором, розчинили 1 г (0,5 моль%) 15 97508 tris(дибензиліденацетон) дипаладію(О) [Pd2(dba)3] в 100 мл тетрагідрофурану, потім додали 2 г (1 моль%) 2-дициклогексилфосфін-2',6'диметоксибіфенілу (Sphos), і перемішували отриманий розчин впродовж 30 хвилин під легким струменем аргону. До реакційної суміші додали розчин 3-(1адамантил)-4-метоксифенілборинової кислоти, отриманий на попередній стадії, і 61 г (0,23 М) метил-6-бром-2-нафтеноату і перемішували, доки всі компоненти не розчинились. В якості останнього компоненту додали як одну порцію приготовлений завчасно розчин 64 г (0,86 М) натрію карбонату в 400 мл води. Цей процес здійснюється при інтенсивному перемішуванні і рефлюксі під легким струменем аргону впродовж 4 годин. Після цього реакційну суміш охолодили до кімнатної температури і профільтрували без розділення шарів. Осад становив головну частину продукту. Решту продукту отримали шляхом концентрації органічного шару до %, охолодження і відфільтровування осаду, який потім об'єднали з головною частиною. Сирий продукт розчинили в 500 мл диметилацетаміду, профільтрували гарячим, зменшили об'єм приблизно до 300 мл і залишили на 16 годин при кімнатній температурі кристалізуватись. Кристали відфільтрували і висушили при 150-180 °C впродовж 2 годин. Отримали метил 6-[3-(1адамантил)-4-метоксифеніл]-2-нафтеноат, 86 г (65 %), з використанням 2-(1-адамантил)-4броманізолу в якості вихідного матеріалу. Чистота продукту перевищує 98 %. Збільшення масштабу синтезу в 5 разів при дотриманні оптимальних умов проведення реакції не змінило виходу кінцевого продукту. Стадія D: Гідроліз метил 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтеноату в лужному середовищі Приклад 18 В 600-мл хімічну склянку помістили 10 г метил 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату, 16 300 мл етилену гліколю і нагріли майже до кипіння. До отриманого прозорого розчину додали трьома порціями 15 г гідроокису натрію і активно перемішували впродовж 20 хвилин. Гарячу реакційну суміш повільно додали при активному перемішуванні до холодного 5 % водного розчину соляної кислоти. Отриману у такий спосіб суспензію перемішували впродовж 30 хвилин і профільтрували. Осад на фільтрі віджали, промили 3500 мл гарячої води і висушили при 100 °C впродовж 16 годин. Отримали 9,3 г (96 %) 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтойної кислоти з температурою плавлення 320 °C і чистотою понад 97 %. ЯМР (500 МГц, ДМСО D6) : 1,79 (s, 6Н); 2,10 (s, ЗН); 2,16 (s, 6Н); 3,90 (s, ЗН); 6,99 (d, 1H, J=8 Гц); 7,51 (s, 1H); 7,52 (d, 1Н, J=8 Гц); 7,76 (d, 1Н, J=9 Гц); 7,92 (d, 1H, J=8 Гц); 7,98-8,02 (m, ЗН); 8,55 (s, 1H); 12,7 (s, 1H). Використання 1,2-пропандіолу замість етилену гліколю може забезпечити підвищення концентрації гідролізованого метил 6-[3-(1-адамантил)-4метоксифеніл]-2-нафтеноату в розчині на 50 %. Приклад 19 В 600-мл хімічну склянку помістили 15 г метил 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтеноату, 300 мл 1,2-пропандіолу і нагріли майже до кипіння. До отриманого прозорого розчину додали трьома порціями 15 г гідроокису натрію і активно перемішували впродовж 20 хвилин. Подальші операції по обробці реакційної суміші і відділенню кінцевого продукту є такими ж, як описані в Прикладі 18. Вихід 6-[3-(1-адамантил)-4-метоксифеніл]-2нафтойної кислоти становить 96 %. Збільшення масштабу синтезу в 10 разів при дотриманні оптимальних умов проведення реакції не змінило ні виходу, ні якості кінцевого продукту. Отже, описаний процес отримання адапалену характеризується високим виходом проміжних і кінцевого продуктів, простою технологією і можливістю нарощування масштабу виробництва. Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 6-[3-(1-adamantyl)-4-methoxyphenyl]-2-naphthoic acid
Автори англійськоюKalvinsh, Ivars, Chernobrovijs, Aleksandrs, Tribulovich, Vyacheslav, Labeish, Vladimir
Назва патенту російськоюСпособ получения 6-[3-(1-адамантил)-4-метоксифенил]-2-нафтойной кислоты
Автори російськоюКалвиньш Иварс, Чернобровийс Александрс, Трибулович Вячеслав, Лабейш Владимир
МПК / Мітки
МПК: C07C 67/343, C07C 65/00, C07C 69/00, C07C 51/09, C07F 5/02
Мітки: кислоти, отримання, 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної, спосіб
Код посилання
<a href="https://ua.patents.su/8-97508-sposib-otrimannya-6-3-1-adamantil-4-metoksifenil-2-naftojjno-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання 6-[3-(1-адамантил)-4-метоксифеніл]-2-нафтойної кислоти</a>












