Iрнк-агент, що опосередковує інгібування експресії альфа-enac
Номер патенту: 97521
Опубліковано: 27.02.2012
Автори: Ван Хеке Джино, Денехей Хенрі Льюк, Тан Памела, Форнлокер Ханс-Петер, Гейк Анке, Хікмен Емма
Формула / Реферат
1. iРНК-агент, що містить перший ланцюг та другий ланцюг, де iРНК-агент націлюється на альфа-EnaC та опосередковує активність siРНК, причому:
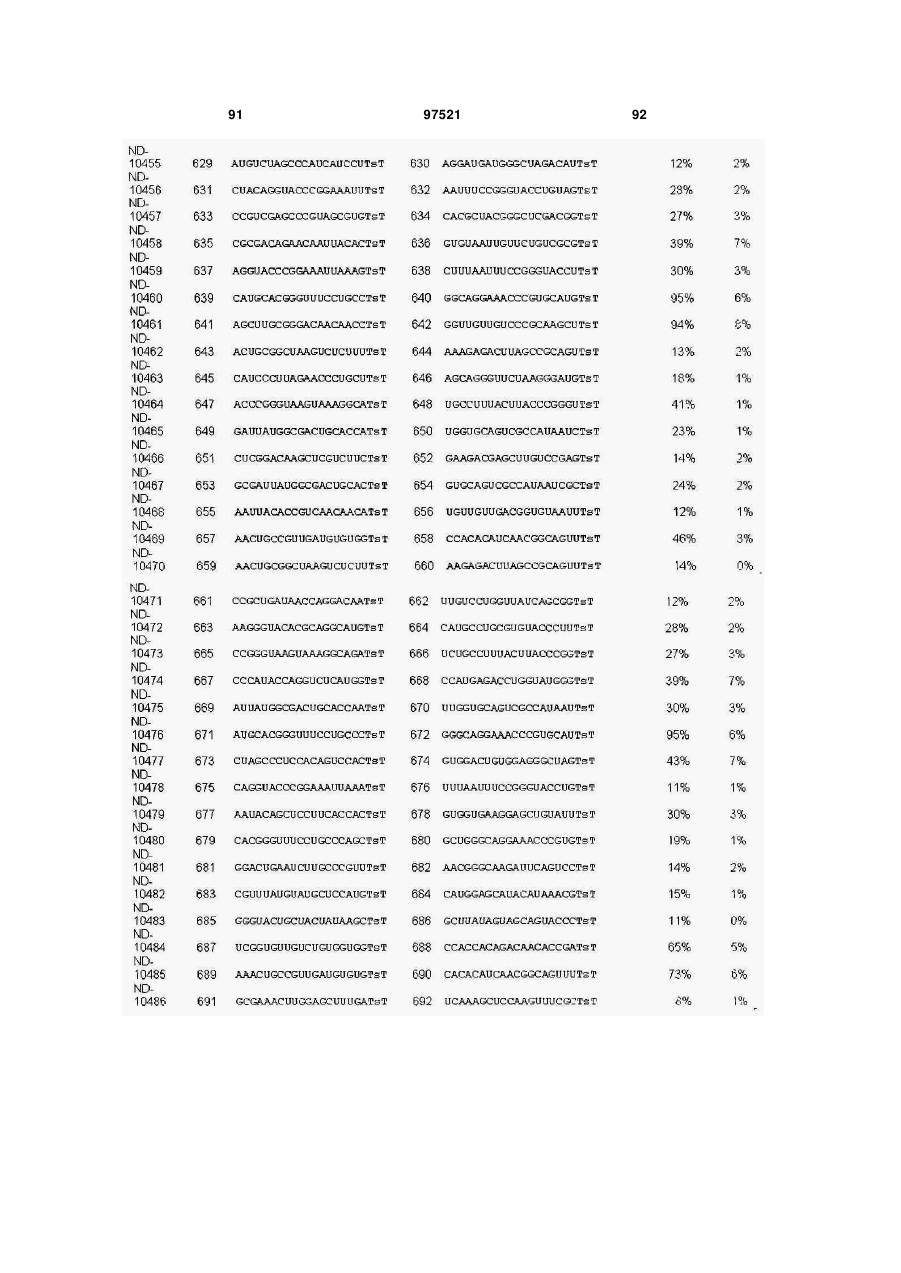
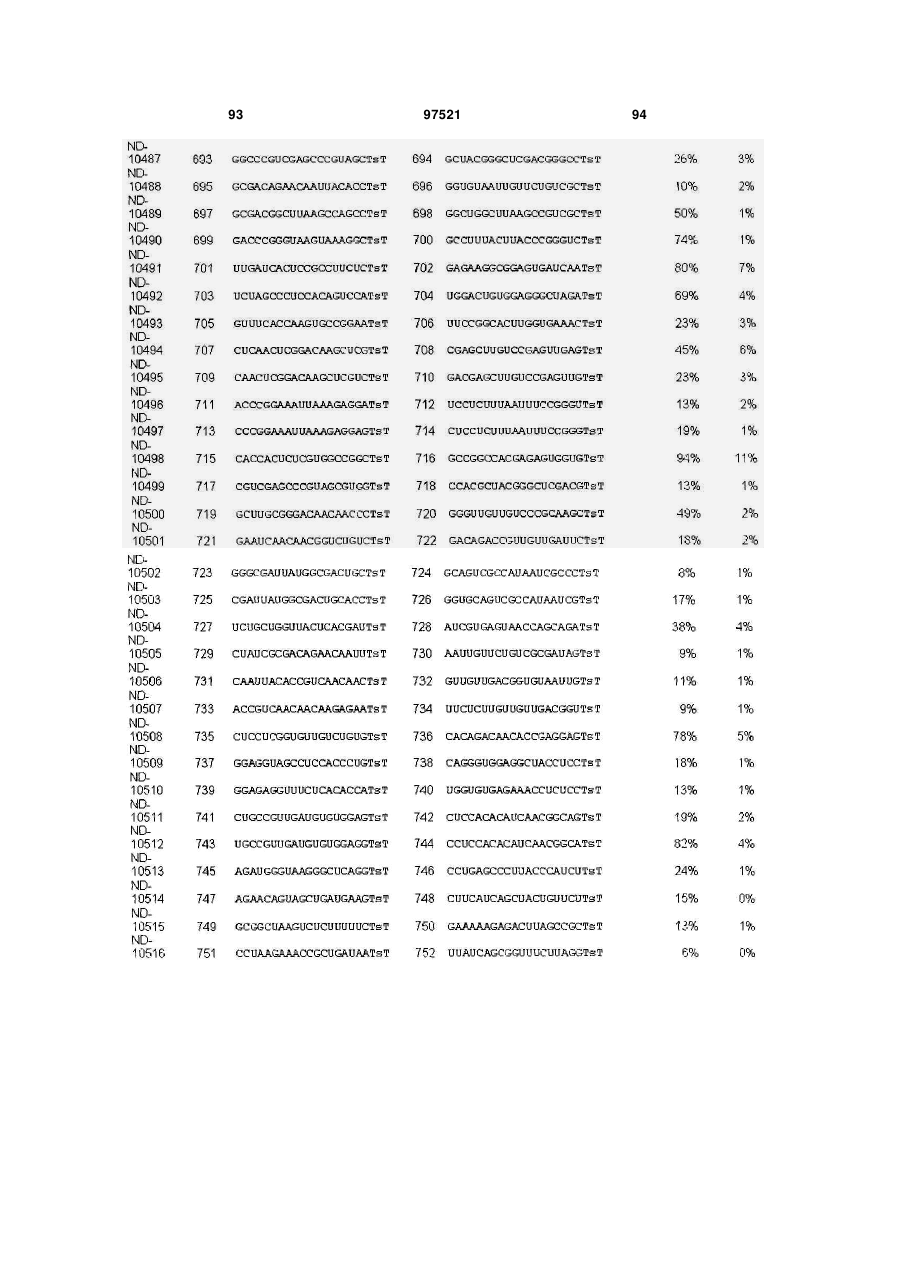
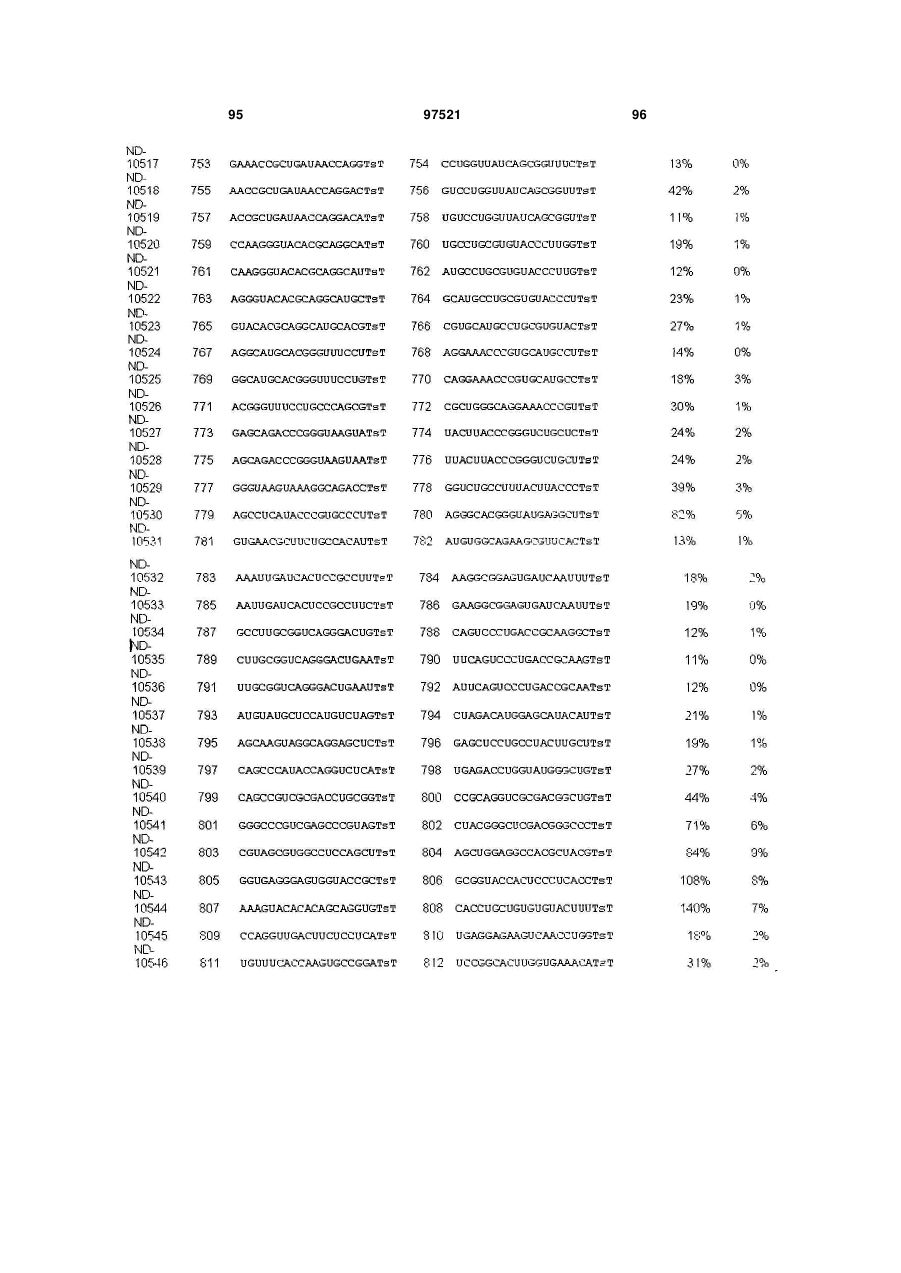
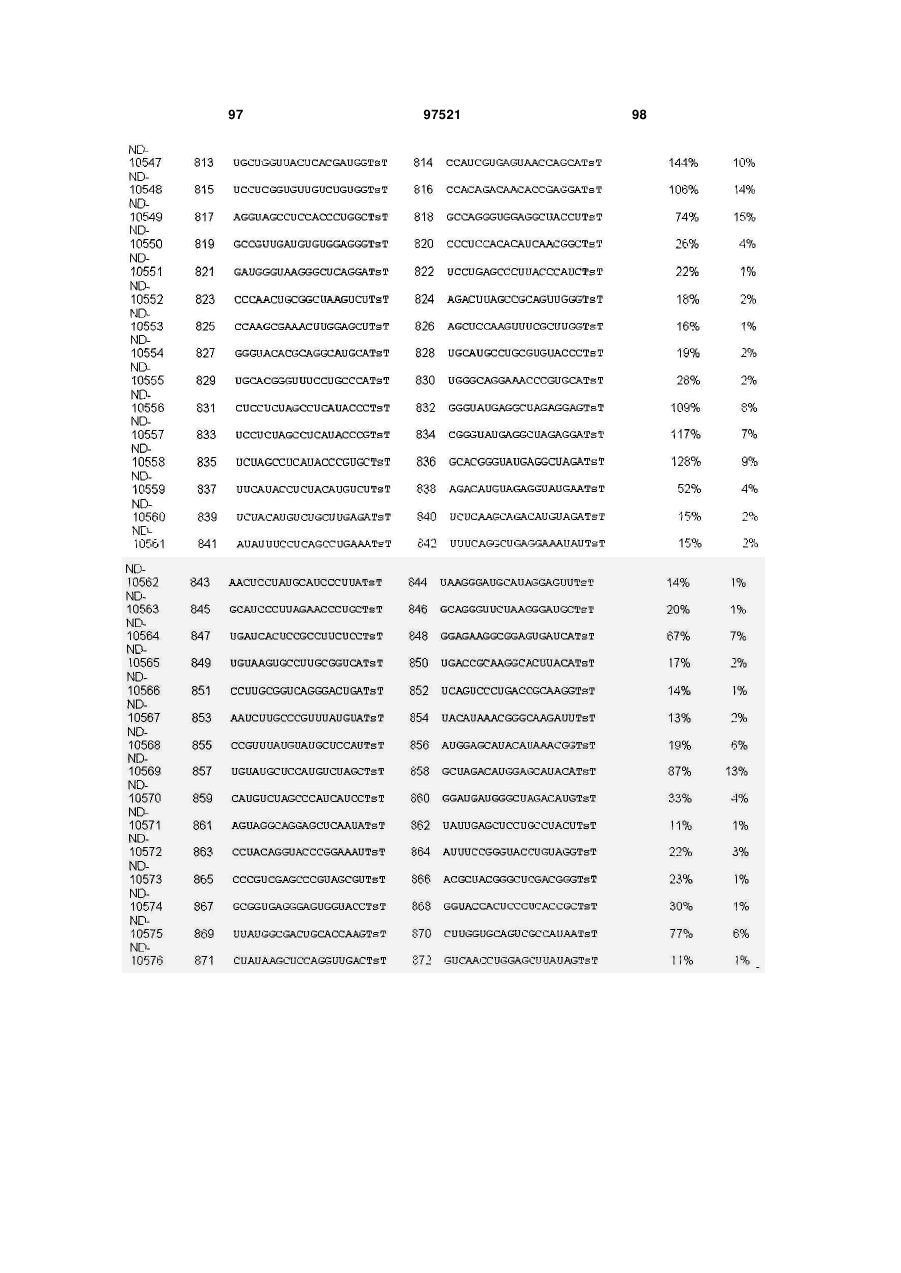
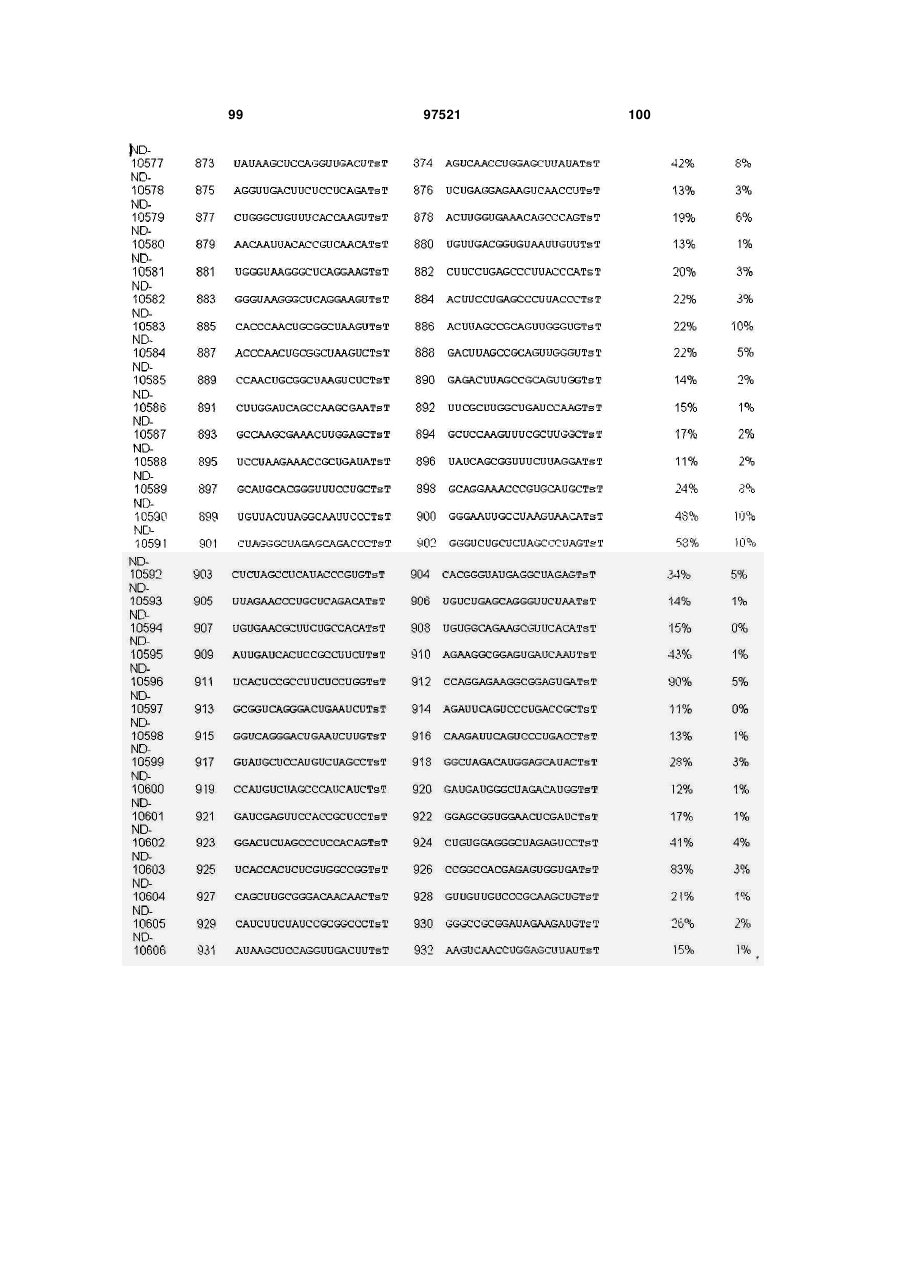
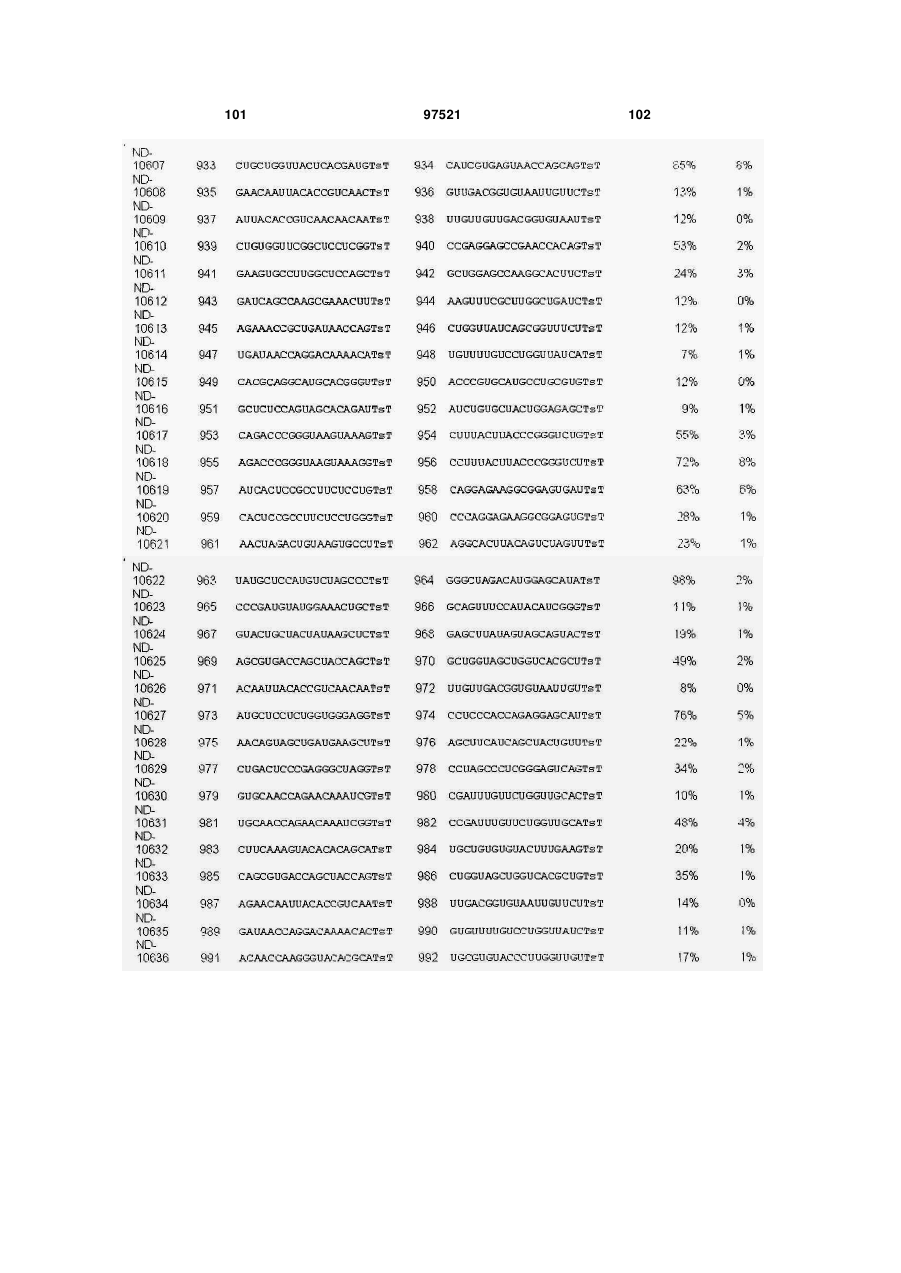
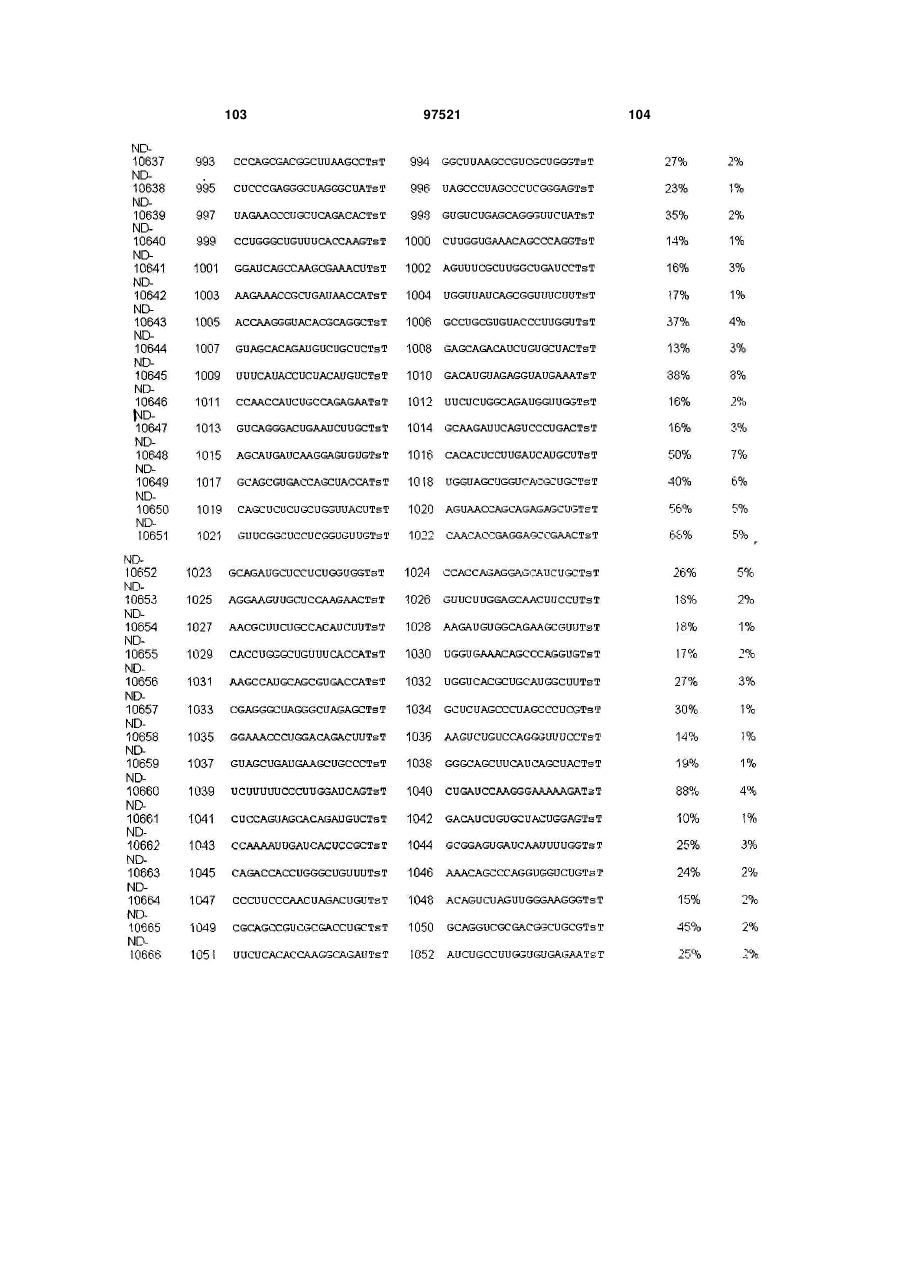
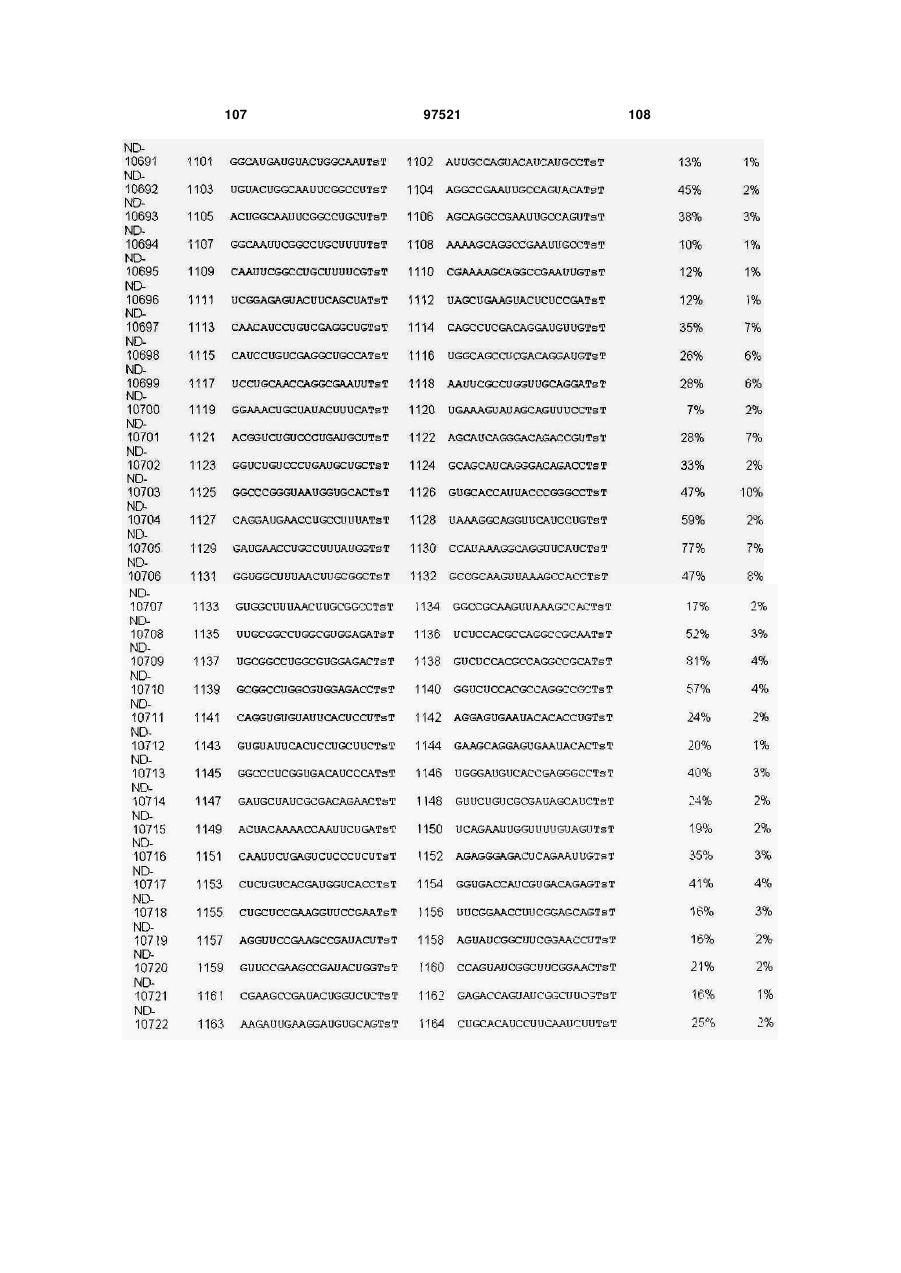
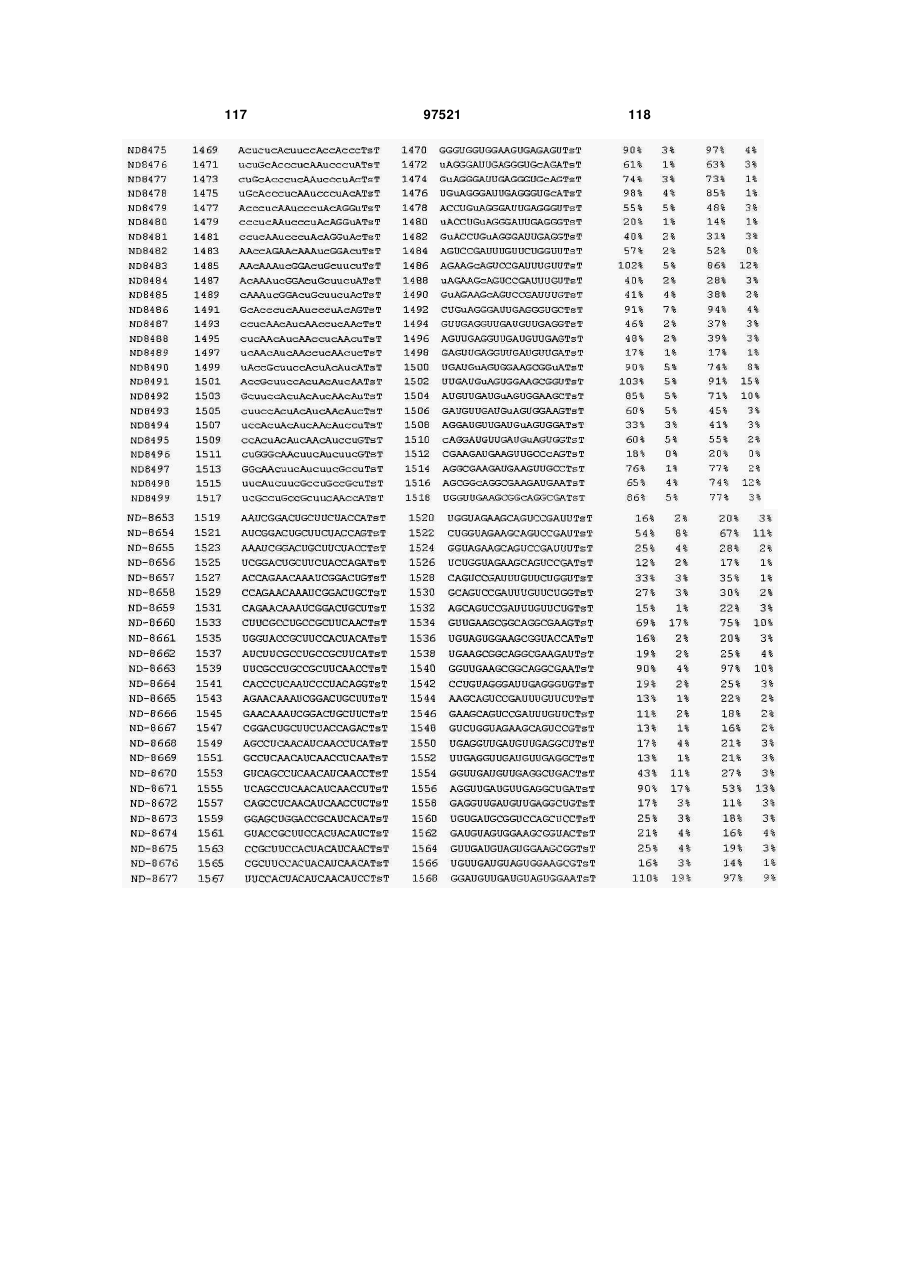
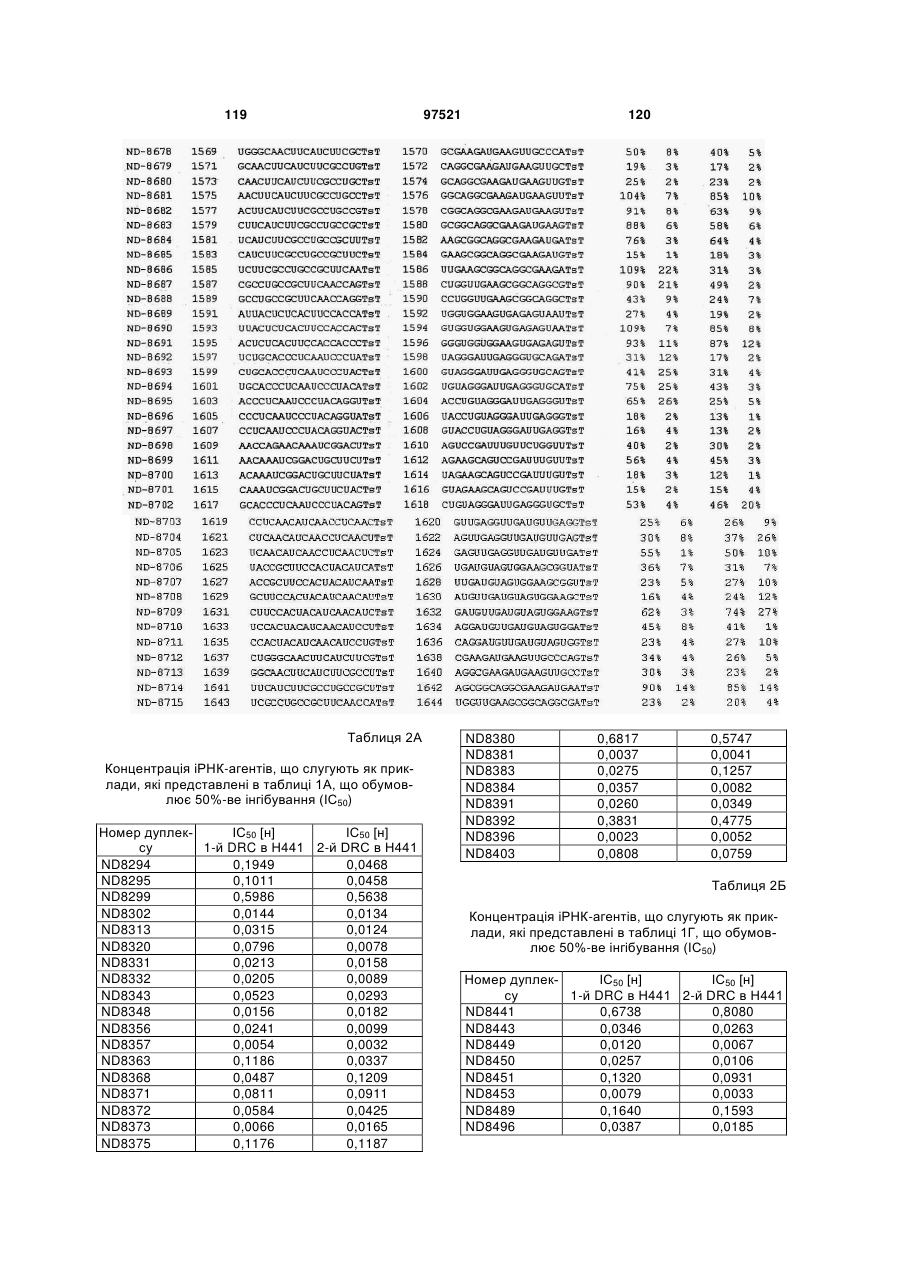
a) послідовність першого ланцюга включає послідовність SEQ ID NO: 1425, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1426, або
b) послідовність першого ланцюга включає послідовність SEQ ID NO: 1297, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1298, або
c) послідовність першого ланцюга включає послідовність SEQ ID NO: 223, а послідовність другого ланцюга включає послідовність SEQ ID NO: 224, або
d) послідовність першого ланцюга включає послідовність SEQ ID NO: 143, а послідовність другого ланцюга включає послідовність SEQ ID NO: 144, або
e) послідовність першого ланцюга включає послідовність SEQ ID NO: 145, а послідовність другого ланцюга включає послідовність SEQ ID NO: 146, або
f) послідовність першого ланцюга включає послідовність SEQ ID NO: 1511, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1512.
2. iРНК-агент за п. 1, у якому антисмисловий РНК ланцюг має 30 або менше нуклеотидів в довжину, а дуплексна область iРНК-агента має 15-30 нуклеотидних пар у довжину.
3. iРНК-агент за п. 1, у якому перший та/або другий ланцюг iРНК-агента не модифіковані.
4. iРНК-агент за п. 1, у якому перший та/або другий ланцюг iРНК-агента має принаймні одну модифікацію.
5. iРНК-агент за п. 1, що містить фосфоротіоат або 2'-модифікований нуклеотид.
6. iРНК-агент за п. 1, що містить принаймні один динуклеотид 5'- уридин-аденін-3' (5'-ua-3'), у якому уридин являє собою 2'-модифікований нуклеотид; принаймні один динуклеотид 5'-уридин-гуанін-3' (5'-ug-3'), у якому 5'-уридин являє собою 2'-модифікований нуклеотид; принаймні один динуклеотид 5'-цитидин-аденін-3' (5'-ca-3'), у якому 5'-цитидин являє собою 2'-модифікований нуклеотид; або принаймні один динуклеотид 5'-уридин-уридин-3' (5'-uu-3'), у якому 5'-уридин являє собою 2'-модифікований нуклеотид.
7. iРНК-агент за п. 1, у якому 2'-модифікація вибрана із групи, що включає: 2'-дезокси, 2'-дезокси-2'-фтор, 2’-O-метил, 2'-O-метоксіетил (2'-O-MOE), 2'-O-амінопропіл (2'-O-AP), 2'-O-диметиламіноетил (2'-O-DMAOE), 2'-O-диметиламінопропіл (2'-O-DMAP), 2'-O-диметиламіноетилоксіетил (2'-O-DMAEOE) та 2'-O-N-метилацетамідо (2'-O-NMA).
8. iРНК-агент за п 1, що містить виступаючу нуклеотидну ділянку, що складається з 1-4 неспарених нуклеотидів.
9. iРНК-агент за п. 8, у якому виступаюча нуклеотидна ділянка складається з 2 або 3 неспарених нуклеотидів.
10. iРНК-агент за п. 8, де виступаюча нуклеотидна ділянка перебуває на 3'-кінці антисмислового ланцюга iРНК-агента.
11. iРНК-агент за п. 1, що містить ліганд епітеліального рецептора.
12. Фармацевтична композиція, що містить:
a. iРНК-агент за п. 1; і
b. фармацевтично прийнятний носій.
13. iРНК-агент, що містить перший ланцюг та другий ланцюг, де iРНК-агент націлюється на альфа-EnaC та опосередковує активність siРНК, причому:
a) послідовність першого ланцюга включає послідовність SEQ ID NO: 1425, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1426, або
b) послідовність першого ланцюга включає послідовність SEQ ID NO: 1297, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1298, або
c) послідовність першого ланцюга включає послідовність SEQ ID NO: 223, а послідовність другого ланцюга включає послідовність SEQ ID NO: 224, або
d) послідовність першого ланцюга включає послідовність SEQ ID NO: 143, а послідовність другого ланцюга включає послідовність SEQ ID NO: 144, або
e) послідовність першого ланцюга включає послідовність SEQ ID NO: 145, а послідовність другого ланцюга включає послідовність SEQ ID NO: 146, або
f) послідовність першого ланцюга включає послідовність SEQ ID NO: 1511, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1512,
який додатково містить ліганд епітеліального рецептора.
Текст
1. iРНК-агент, що містить перший ланцюг та другий ланцюг, де iРНК-агент націлюється на альфа-EnaC та опосередковує активність siРНК, причому: a) послідовність першого ланцюга включає послідовність SEQ ID NO: 1425, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1426, або b) послідовність першого ланцюга включає послідовність SEQ ID NO: 1297, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1298, або c) послідовність першого ланцюга включає послідовність SEQ ID NO: 223, а послідовність другого ланцюга включає послідовність SEQ ID NO: 224, або d) послідовність першого ланцюга включає послідовність SEQ ID NO: 143, а послідовність другого 2 (19) 1 3 97521 4 11. iРНК-агент за п. 1, що містить ліганд епітеліального рецептора. 12. Фармацевтична композиція, що містить: a. iРНК-агент за п. 1; і b. фармацевтично прийнятний носій. 13. iРНК-агент, що містить перший ланцюг та другий ланцюг, де iРНК-агент націлюється на альфаEnaC та опосередковує активність siРНК, причому: a) послідовність першого ланцюга включає послідовність SEQ ID NO: 1425, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1426, або b) послідовність першого ланцюга включає послідовність SEQ ID NO: 1297, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1298, або c) послідовність першого ланцюга включає послідовність SEQ ID NO: 223, а послідовність другого ланцюга включає послідовність SEQ ID NO: 224, або d) послідовність першого ланцюга включає послідовність SEQ ID NO: 143, а послідовність другого ланцюга включає послідовність SEQ ID NO: 144, або e) послідовність першого ланцюга включає послідовність SEQ ID NO: 145, а послідовність другого ланцюга включає послідовність SEQ ID NO: 146, або f) послідовність першого ланцюга включає послідовність SEQ ID NO: 1511, а послідовність другого ланцюга включає послідовність SEQ ID NO: 1512, який додатково містить ліганд епітеліального рецептора. Галузь техніки, до якої відноситься винахід Даний винахід відноситься до опосередковуваного ЕnаС транспорту іонів у дихальних шляхах і композицій і способів модуляції експресії альфаENaC і більш конкретно до негативної регуляції альфа-ENaC олігонуклеотидами за допомогою механізму РНК-інтерференції, які вводять місцево в легені і носовий хід за допомогою інгаляції/введення в ніс, або вводять системно, наприклад, за допомогою внутрішньовенної ін'єкції. Передумови створення винаходу Поняття РНК-інтерференція або «РНКі» уперше було запропоновано Fire зі співавторами для опису того факту, що дволанцюгова РНК (dsPHК) може блокувати експресію генів при інтродукції в хробаків (Fire та ін., Nature, 391, 1998, сс. 806-811). Коротка dsPHК забезпечує генспецифічне посттранскрипційне «мовчання» у багатьох організмів, включаючи хребетних тварин, і являє собою новий інструмент для вивчення функції генів. У цей час дані про цю технологію узагальнені в ряді робіт (див., наприклад, Novina C.D: і Sharp P., Nature, 430, 2004, с. 161; і Sandy P. та ін., Biotechniques, 39, 2005, с. 215, які включені в даний опис як посилання). Слизові поверхні (поверхні слизуватої оболонки) на границі розділу навколишнього середовища і організму в результаті еволюції придбали різні захисні механізми. Основною формою такої вродженої захисної дії є очищення цих поверхонь рідиною. Як правило, рівень рідкого шару на поверхні слизової оболонки залежить від балансу між секрецією епітеліальної рідини, він часто визначається секрецією аніонів (Сl і/або НСО3 ) разом з водою (і катіоном у якості протиіону), і абсорбцією епітеліальної рідини, часто визначається абсорб+ цією Na , часто разом з водою та аніоном як протиіон (Сl і/або НСО3 ). Багато захворювань поверхонь слизових оболонок викликаються занадто малою кількістю захисної рідини на цих поверхнях слизових оболонок у результаті порушення балансу між секрецією (занадто малою) і абсорбцією (відносно занадто великої). Порушення процесів сольового транспорту, які характерні для зазначеної дисфункції слизових оболонок, мають місце в епітеліальному шарі поверхні слизової оболонки. Один з підходів для поповнення захисного рідкого шару на поверхнях слизових оболонок включає відновлення балансу («ребаланс») системи шля+ хом блокади опосередковуваної Na -каналом абсорбції рідини. Епітеліальний білок, що опосеред+ ковує стадію обмеження швидкості абсорбції Na і + рідини, являє собою епітеліальний Na -канал (ENa). Альфа-ENaC розташована на апікальній поверхні епітелію, тобто на границі розділу поверхні слизової оболонки навколишнього середови+ ща. Інгібування опосередковуваної Na абсорбції рідини, що залежить від альфа-EnaC, може знайти застосування в терапії. Таким чином, існує необхідність у розробці ефективних терапій для лікування і попередження захворювань і порушень, у яких бере участь альфа-EnaC, таких, наприклад, як муковісцидоз, у людини і тварин, і насамперед у розробці високоефективних терапій. Однією з передумов високої ефективності є те, що розщеплення діючої речовини у фізіологічному навколишньому середовищі не відбувається занадто швидко. Короткий виклад суті винаходу У даному винаході запропоновані конкретні композиції і способи, які можна застосовувати для зниження рівнів альфа-EnaC в індивідуума, наприклад, у ссавця, такого як людина, наприклад, шляхом введення зазначених агентів за допомогою інгаляції в ніс або внутрішньотрахеально. Даний винахід відноситься, зокрема до іРНКагентів, які складаються, практично складаються або містять щонайменше 15 або більшу кількість послідовно розташованих нуклеотидів з послідовності альфа-EnaC, і більш конкретно до агентів, що містять 15 або більшу кількість послідовно розташованих нуклеотидів кожного з агентів, які мають одну з послідовностей, представлених у таблицях 1А-1Г. іРНК-агент переважно містить у ланцюзі менше 30 нуклеотидів, наприклад, 21-23 нуклеотиди, із числа представлених у таблицях 1А-1Г. Дволанцюговий іРНК-агент може мати або «затуплені» (дефосфорильовані) кінці, або ще краще мати 1-4 нуклеотиди, що виступають на одному або обох 3'-кінцях агента. 5 Крім того, іРНК-агент може або містити рибонуклеотидні субодиниці, що зустрічаються тільки в природних умовах, або його можна синтезувати таким чином, щоб він містив одну або кілька модифікацій, що зачіпають залишок цукру, фосфат або основу в одній або декількох рибонуклеотидних субодиницях, що входять до складу агента. іРНК-агент можна додатково модифікувати таким чином, щоб він був приєднаний до ліганду, відібраного для поліпшення стабільності, розподілу або поглинання клітиною агента, наприклад, холестерину. іРНК-агенти можуть перебувати також у виділеній формі або можуть являти собою частину фармацевтичної композиції, що застосовується в способах, які представлені у даному описі, насамперед фармацевтичної композиції, створеної для введення в легені або в носовий хід, або створеної для парентерального введення. Фармацевтичні композиції можуть містити один або декілька іРНКагентів і в деяких варіантах здійснення винаходу можуть містити два або більшу кількості іРНКагентів, мішенню кожного з яких є різні сегменти гена альфа-ЕnаС. Одним з об'єктів даного винаходу є дволанцюговий олігонуклеотид, що містить щонайменше одну нуклеотидну основу, що не зустрічається в природних умовах. У деяких варіантах здійснення винаходу нуклеотидна основа, що не зустрічається в природних умовах, являє собою дифтортоліл, нітроіндоліл, нітропіроліл або нітроімідазоліл. У кращому варіанті здійснення винаходу нуклеотидна основа, що не зустрічається в природних умовах, являє собою дифтортоліл. У деяких варіантах здійснення винаходу тільки один із двох ланцюгів олігонуклеотиду у випадку дволанцюгових олігонуклеотидів містить нуклеотидну основу, що не зустрічається в природних умовах. У деяких варіантах здійснення винаходу обидва ланцюги олігонуклеотиду у випадку дволанцюгових олігонуклеотидів незалежно один від одного містять нуклеотидну основу, що не зустрічається в природних умовах. Даний винахід відноситься також до способів зниження рівня мРНК альфа-ENaC у клітинах. Зазначені способи включають стадію, на якій вводять один з іРНК-агентів, запропонованих у даному винаході, індивідууму, як буде описано нижче. Способи, запропоновані у даному винаході, засновані на використанні клітинних механізмів, у яких бере участь процес РНК-інтерференції, для виборчого розщеплення РНК-мішені у клітині, і включають стадію, на якій приводять у контакт клітину з одним з іРНК-агентів, запропонованих у даному винаході. Зазначені способи можна здійснювати безпосередньо в клітині або можна здійснювати на ссавці шляхом введення індивідуумові одного/однієї з іРНК-агентів/фармацевтичних композицій, запропонованих у даному винаході. Зниження рівня РНК-мішені в клітині приводить до зниження рівня білка, що кодується, який продукується і присутній в організмі, результатом чого є зменшення різниці потенціалу в епітелії, зменшення абсорбції рідини і підвищення кліренсу, який забезпечується війовим епітелієм. 97521 6 Способи і композиції, запропоновані у винаході, наприклад, способи та композиції, у яких використовують іРНК-агенти, можна застосовувати з використанням будь-якої дози і/або форми, представленої у даному описі, а також за допомогою будь-якого шляху введення, представленого у даному описі. Докладний виклад одного або декількох варіантів здійснення винаходу представлено на прикладених кресленнях і в представленому нижче докладному описі винаходу. Інші особливості, об'єкти і переваги винаходу повинні стати очевидними після ознайомлення з докладним описом винаходу, кресленнями і формулою винаходу. У даний опис включені як посилання всі процитовані документи, патенти і заявки на патент у всій їх повноті і для всіх цілей. На кресленнях показано: на фіг. 1 - рестрикційна карта конструкції рХооn, призначеної для клонування -EnaC макака-крабоїда (яванський макак); на фіг. 2 - білкова послідовність і послідовність ДНК альфа-EnaC макака-крабоїда; на фіг. 3 - дані про клонування передвіщених «off-target» («нецільова» мішень) і «on-target» («цільова» мішень) сайтів розпізнавання в конструкції AY535007 з подвійним люциферазним репортером (подвійна ілюциферазна система виявлення). Фрагменти складаються з 19 нуклеотидів (nt) передвіщеного сайту-мішені і 10 nt фланкуючої послідовності на обох 5'- і 3'-кінцях. Докладний опис деяких кращих варіантів здійснення винаходу Для полегшення розуміння поняття «нуклеотид» або «рибонуклеотид» іноді застосовують при посиланні на одну або декілька мономерних субодиниць РНК-агента. Варто розуміти, що поняття «рибонуклеотид» або «нуклеотид» у контексті даноїго опису можна застосовувати для позначення модифікованої РНК або нуклеотидного замінника (нуклеотидного сурогату), позначеного також як модифікований нуклеотид або сурогатний фрагмент-замісник, в одному або декількох положеннях, що буде додатково описано нижче. Поняття «РНК-агент» у контексті даного опису означає немодифіковану РНК, модифіковану РНК або нуклеозидний замінник, де кожне з понять пояснено у даному описі, або поняття є добре відомим в галузі синтезу РНК. Хоча в науковій літературі описані численні модифіковані РНК і нуклеозидні замінники, їх кращими прикладами є РНК, що мають підвищену стійкість до розщеплення нуклеази у порівнянні з немодифікованими РНК. Кращими прикладами є РНК, що мають модифікацію 2'-цукрові залишки, модифікацію у вигляді одноланцюгової ділянки, що виступає, краще у вигляді одноланцюгової ділянки, що виступає, на 3'-кінці, або, насамперед у випадку одноланцюгової РНК, 5'-модифікацію, яка включає наявність однієї або декількох фосфатних груп або одного або декількох аналогів фосфатної групи. Поняття «іРНК-агент» (скорочення для поняття «інтерферуючий РНК-агент» у контексті даного опису означає РНК-агент, що має здатність здійснювати негативну регуляцію експресії гена-мішені, 7 наприклад, гена ENa SCNN1А. Не вдаючись у теорію, іРНК-агент може проявляти свою дію за допомогою одного або декількох механізмів, включаючи пост-трансляційне розщеплення мРНКмішені, що іноді в даній галузі позначають як РНКі, або претранскрипційні (діючі до стадії транскрипції) або претрансляційні (діючі до стадії трансляції) механізми. Поняття «ds іРНК-агент» (скорочення для поняття «дволанцюговий інтерферуючий РНКагент») у контексті даного опису означає іРНКагент, який містить одну і краще два ланцюги, у яких у результаті гібридизація між ланцюгами може відбуватися утворення області, що має дуплексну структуру. Поняття «ланцюг» у контексті даного опису відноситься до безперервної послідовності нуклеотидів (включаючи нуклеотиди, що не зустрічаються в природних умовах, або модифіковані нуклеотиди). Два або більша кількість ланцюгів можуть являти собою окремі молекули або утворювати частину зазначених молекул, або вони можуть бути ковалентно зв'язані, наприклад, лінкером, наприклад, поліетиленглікольним лінкером, з утворенням однієї молекули. Щонайменше один ланцюг може включати область, яка є в достатньому ступені комплементарною РНК-мішені. Зазначений ланцюг позначають як «антисмисловий ланцюг». Другий ланцюг ds PHК-агента, що містить область, комплементарну антисмисловому ланцюгу, позначають як «смисловий ланцюг». Однак ds іРНК-агент можна одержувати також з однієї молекули РНК, яка щонайменше частково є самокомплементарною, утворюючи, наприклад, структуру типу «шпильки» або «панхендл»структуру (структура типу ручки сковороди), що включає дуплексну область. Останні в контексті даного опису позначають як короткі РНК-шпильки або shPHК. У цьому випадку поняття «ланцюг» відноситься до однієї з областей молекули РНК, яка комлементарна іншій області цієї ж молекули РНК. Хоча в клітинах ссавців довгі ds іРНК-агенти можуть індуціювати вивільнення інтерферонів (інтерферонова відповідь), який часто є шкідливим, короткі ds iPHК-агенти не можуть запускати інтерферонову відповідь, рівень якої щонайменше є шкідливим для клітини і/або хазяїна (Manche та ін., Моl. Cell. Biol. 12, 1992, с. 5238 Lee та ін., Virology 199, 1994, с. 491; Castelli та ін., J. Exp. Med. 186, 1997, с. 967; Zheng та ін., RNA 10, 2004, с. 1934; Heidel та ін., Nature BiotechnoL 22, с. 1579). іРНКагенти, запропоновані у даному винаході, включають молекули, які є в достатньому ступені короткими, щоб не ініціювати шкідливу неспецифічну інтерферонову відповідь у здоровій клітині ссавця. Таким чином, введення індивідуумові композиції, яка містить іРНК-агент (наприклад, у вигляді лікарської форми, представленої у даному описі), можна використовувати для зниження рівня експресії альфа-EnaC в індивідуума, не викликаючи при цьому інтерферонову відповідь. Молекули, які є досить короткими для того, щоб не ініціювати шкідливу інтерферонову відповідь, позначають як siPHК-агенти або siPHК. Поняття «siPHК-агент» або «siPHК» у контексті даного опису відноситься 97521 8 до іРНК-агенту, наприклад ds іРНК-агенту, що є досить коротким, щоб не індуціювати шкідливу інтерферонову відповідь у клітині ссавця і, насамперед людини, наприклад, до агента, який має дуплексну область, що складається менше ніж з 60, але краще менше ніж з 50, 40 або 30 пар нуклеотидів. Виділені іРНК-агенти, запропоновані у даному винаході, включаючи ds іРНК-агенти та siPHКагенти, можуть опосередковувати зниження рівня експресії альфа-ЕnаС, наприклад, шляхом розщеплення РНК. Для зручності таку РНК позначають у контексті даного опису також як «виключена» (що мовчить) РНК. Таку нуклеїнову кислоту позначають також як «РНК-мішень», іноді як «молекула РНК-мішені», або іноді як «ген-мішень». У контексті даного опису фраза «опосередковує РНКі» відноситься до здатності агента приводити до «вимикання» (мовчанню) гена-мішені специфічним для мішені чином. «Вимикання генамішені» означає процес, у результаті якого вміст і/або експресія певного продукту гена-мішені, який є присутнім у клітині, що не перебуває у контакті з агентом, знижується після контакту з агентом щонайменше на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% або 90% у порівнянні з вмістом і/або експресією зазначеного генного продукту в такій же клітині, яку не приводили в контакт із агентом. Зазначений продукт гена-мішені може являти собою, наприклад, матричну РНК (мРНК), білок або регуляторний елемент. У контексті даного опису поняття «комплементарний» застосовують для позначення ступеня комплементарності, достатньої для того, щоб мало місце стабільне і специфічне зв'язування між сполукою, запропонованою у винаході, і молекулою РНК-мішені, наприклад, мРНК альфа-EnaC. Для специфічного зв'язування потрібен достатній ступінь комплементарності, для того, щоб уникнути неспецифічного зв'язування олігомерної сполуки з послідовностями, які не є мішенями, в умовах, за яких є бажаним специфічне зв'язування, тобто у фізіологічних умовах у випадку аналізів in vivo або терапевтичного лікування, або, як у випадку аналізів in vitro, в умовах, у яких здійснюють аналіз. Послідовності, які не є мішенями, як правило, відрізняються від послідовностей-мішеней щонайменше 2, 3 або 4 нуклеотидами. У контексті даного опису іРНК-агент є «у достатньому ступені комплементарним» РНК-мішені, наприклад, мРНК-мішені (наприклад, мРНК альфаEnaC), якщо іРНК-агент знижує в клітині виробництво білка, що кодується РНК-мішенню. іРНК-агент може бути також «строго комплементарним» РНКмішені, наприклад, при відпалюванні РНК-мішені та іРНК-агента, краще відбувається утворення гібрида, у якому в області повної комплементарності основи спарені винятково відповідно до правила Уотсона і Крику. «У достатньому ступені комплементарний» іРНК-агент може включати внутрішню область (що складається наприклад щонайменше з 10 нуклеотидів), яка повністю комплементарна РНК, що є мішенню для альфаЕnаС. Крім того, у деяких варіантах здійснення винаходу іРНК-агент специфічно дискримінує 9 (розпізнає) розходження в одному нуклеотиді. У цьому випадку іРНК-агент опосередковує РНКі тільки в тому випадку, якщо має місце повна комплементарність в області (що складається наприклад з 7 нуклеотидів), яка має розходження в одному нуклеотиді. Кращі іРНК-агенти повинні бути засновані на смислових і антисмислових послідовностях, які представлені в таблицях 1А-1Г, або вони повинні складатися з них, або містити їх. У контексті даного опису поняття «практично ідентичний» при посиланні на першу нуклеотидну послідовність при порівнянні із другою нуклеотидною послідовністю означає, що перша нуклеотидна послідовність ідентична другій нуклеотидній послідовності за винятком аж до 1, 2 або 3 нуклеотидних замін (наприклад, заміна аденозину на урацил). Поняття «практично зберігає здатність інгібувати експресію альфа-ЕnаС у людських клітинах, що культивуються» у контексті даного опису, відноситься до іРНК-агента, який не ідентичний, але виведений з одного з іРНК-агентів, представлених у таблицях 1А-1Г, відрізняючись делецією, додаванням або заміною нуклеотидів, тобто виведений іРНК-агент має інгібуючу активність, що становить не менше 20% від інгібуючої активності іРНК-агента, представленого в таблицях 1А-1Г, з якого він виведений. Наприклад, іРНКагент, виведений з іРНК-агентів, представлених у таблицях 1А-1Г, які знижують рівень мРНК альфаЕnаС у людських клітинах, що культивуються, на 70%, може сам знижувати рівень мРНК, що присутня у людських клітинах, що культивуються, щонайменше на 50%, для того, щоб розглядатися як агент, що зберігає здатність інгібувати реплікацію альфа-ЕnаС у людських клітинах, що культивуються. Необов'язково іРНК-агент, запропонований у винаході, може знижувати рівень мРНК альфаЕnаС, що присутній у людських клітинах, що культивуються, щонайменше на 50%. У контексті даного опису поняття «індивідуум» відноситься до організму ссавця, якого піддають лікуванню порушення, опосередковуваного альфаЕnаС. Індивідуум може являти собою будь-якого ссавця, такого як корова, кінь, миша, пацюк, собака, свиня, коза або примат. У кращому варіанті здійснення винаходу індивідуум являє собою людину. Створення і відбір іРНК-агентів У контексті даного опису поняття «порушення, асоційовані з експресією альфа-ЕnаС» відноситься до будь-якого біологічного або патологічного стану, що (1) опосередковується щонайменше частково присутністю альфа-EnaC і (2) на результат якого можна впливати шляхом зниження присутнього рівня альфа-EnaC. Конкретні порушення, асоційовані з експресією альфа-EnaC, перераховані нижче. Даний винахід відноситься до конструювання, синтезу і одержання іРНК-агентів, мішенню яких є альфа-EnaC, і демонстрації здатності іРНК-агентів викликати мовчання гена альфа-EnaC in vitro у клітинах, що культивуються, і в результаті мати захисну дію у відношенні опосередковуваних альфа-EnaC порушень. 97521 10 Раціональним є створення іРНК-агента на основі інформації про послідовність і необхідні характеристики. Наприклад, можна створювати іРНКагент на основі відносної температури плавлення дуплекса-кандидата. Як правило, температура плавлення 5'-кінця антисмислового ланцюга дуплексу повинна бути нижче, ніж температура плавлення 3'-кінці антисмислового ланцюга. Даний винахід відноситься до композицій, що містять siPHК і/або shPHК, мішенню яких є один або декілька транскриптів альфа-EnaC. Для створення siPHК або shPHК для конкретного обраного гена-мішені, які можна застосовувати згідно із даним винаходом, краще дотримуватися певних керівництв. Крім того, у багатьох випадках агент, який вводять у клітину згідно із даним винаходом, можна піддавати одній або декільком стадіям процесінгу перед тим, як він стає активним гнітючим агентом (див. нижче у даному описі); у таких випадках звичайним фахівцям у даній галузі повинно бути очевидно, що відповідний агент краще варто створювати так, щоб він включав послідовності, які можуть вимагатися для такого процесінгу. Хвороби, опосередковувані дисфункцією епітеліального натрієвого каналу, включають хвороби, які асоційовані з регуляцією об'ємів рідин, що протікають через епітеліальні мембрани. Наприклад, об'єм рідини на поверхні дихальних шляхів є регулятором кліренсу, що має вирішальне значення, який забезпечується роботою війчастого епітелію, і підтримки здоров'я легенів. Блокада епітеліального натрієвого каналу може підсилювати нагромадження рідини на слизовій стороні епітелію дихальних шляхів, тим самим підсилюючи кліренс слизової оболонки і попереджаючи нагромадження слизу та мокротиння в тканинах дихальної системи (включаючи легеневі дихальні шляхи). Зазначені хвороби включають респіраторні хвороби, такі як муковісцидоз, первинну циліарну дискінезію, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астму, інфекції дихальних шляхів (гострі та хронічні; вірусну та бактеріальні) і карцинома легені. Хвороби, опосередковувані блокадою епітеліального натрієвого каналу, включають також хвороби, відмінні від респіраторних, які асоційовані з аномальною регуляцією потоку рідини через епітелій, імовірно, пов'язані з аномальною фізіологією захисних поверхневих рідин, що перебувають на їх поверхні, наприклад, ксеростомію (сухість у роті) або сухий кератокон'юнктивіт (сухість очей). Крім того, блокаду епітеліального натрієвого каналу в нирці можна використовувати для посилення діурезу і тим самим для індукції гіпотензивної дії. Лікування, запропоноване у винаході, може бути симптоматичним або профілактичним. Астма включає як спадкоємну (неалергічну) астму, так і надбану (алергійну) астму, слабку астму, помірну астму, серйозну астму, бронхіальну астму, астму, що індуціюється фізичним навантаженням, професійну астму та астму, що с наслідком бактеріальної інфекції. Лікування астми передбачає також лікування пацієнтів, наприклад, віком 4 або 5 років, для яких характерні симптоми 11 стридору, і такі, які діагностовані або можуть бути діагностовані як «діти зі стридорним симптомом», вони являють собою певну категорію пацієнтів, які мають потребу в першочерговій медичній допомозі, і яких у цей час часто відносять до астматиків із фазою, що починається, або ранньою фазою хвороби. (Для зручності цей конкретний астматичний стан позначають як «синдром дитячого стридору»). Очевидно, що профілактична ефективність лікування астми включає зниження частоти або серйозності симптоматичного нападу, наприклад, гострого астматичного або бронхостенозного нападу, поліпшення легеневої функції або підвищення гіперреактивності дихальних шляхів. Про ефективність може свідчити також зниження потреби в іншій симптоматичній терапії, тобто терапії, призначеній для обмеження або припинення симптоматичного нападу, наприклад, протизапальної терапії (наприклад, з використанням кортикостероїдів) або бронходилатації. Сприятлива профілактична дія при астмі може, зокрема, проявлятися в індивідуумів, схильних до «ранкового спаду». «Ранковий спад» являє собою астматичний синдром, яким страждає певний відсоток астматиків, що характеризується нападом астми, наприклад, приблизно між 4 і 6 годинниками ранку, тобто в проміжку часу, досить віддаленому від часу, коли раніше проводилося яке-небудь симптоматичне лікування астми. Хронічне обструктивне захворювання легенів включає хронічний бронхіт або пов'язану з ним задишку, емфізему, а також загострення гіперреактивності дихальних шляхів після лікування з використанням інших лікарських засобів, зокрема, лікування з використанням інших лікарських засобів, що вводяться шляхом інгаляції. Винахід можна застосовувати також для лікування бронхіту будьякого типу або генезу, наприклад, гострого, арахідного, катарального, крупозного, хронічного або гнійного туберкульозного бронхіту. З обліком представлених у даному описі результатів даний винахід відноситься до іРНКагентів, які знижують експресію альфа-ЕnаС у клітинах, що культивуються, і в організмі індивідуума, наприклад, ссавця, такого як людина. У таблицях 1А-1Γ представлені приклади іРНК-агентів, мішенню яких є альфа-ЕnаС, позначені за допомогою стандартних номенклатурних скорочень, які наведені в таблиці А. У таблиці 1А (Seq Id No.305-608), у таблиці 1Б і в таблиці 1Г (Seq Id No. 1519-1644) представлений перелік siPHК, які не містять нуклеотидних модифікацій за винятком того, що присутній один фосфоротіоатний зв'язок між 3'-кінцем і передостанніми тимідинами. Інші Seq Id у таблицях 1А-1Г відповідають siPHК, у яких всі нуклеотиди, що містять піримідинові основи, являють собою модифіковані 2'-О-метилом (2'-О-метил-модифіковані) нуклеотиди в смисловому ланцюзі, і всі уридини в контексті послідовності 5'-uа-3' (5'-уридин-аденин3'), а також всі цитидини в контексті послідовності 5'-са-3' (5'-цитидин-аденин-3') являють собою модифіковані 2'-О-метилом нуклеотиди в антисмисловому ланцюзі. 97521 12 З обліком представлених у даному описі результатів даний винахід відноситься, зокрема, до іРНК-агента, який включає смисловий ланцюг, що містить щонайменше 15 послідовно розташованих нуклеотидів послідовностей смислових ланцюгів агентів, які представлені в таблицях 1А-1Г, і антисмисловий ланцюг, що містить щонайменше 15 послідовно розташованих нуклеотидів послідовностей антисмислових ланцюгів агентів, які представлені в таблицях 1А-1Г. Представлені в таблицях 1А-1Г іРНК-агенти складаються із двох ланцюгів, що включають 19 нуклеотидів, які комплементарні або ідентичні послідовності-мішені, плюс виступаючий 3'-ТТ. Даний винахід відноситься до агентів, які містять щонайменше 15 або щонайменше 16, 17 або 18, або 19 послідовно розташованих нуклеотидів із цих послідовностей. Однак, хоча зазначена довжина можливо є оптимальною, мається на увазі, що довжина іРНК-агентів не обмежена зазначеною. Фахівцеві в даній галузі повинно бути очевидно, що ще коротші або ще довші іРНК-агенти також можуть мати ефективність, оскільки в певних діапазонах довжин ефективність скоріше є функцією нуклеотидної послідовності, а не довжини ланцюга. Наприклад, Yang та ін., PNAS 99, 2002, сс. 9942-9947 продемонстрували близьку ефективність іРНК-агентів довжиною 21 і 30 пар основ. Інші дослідники виявили ефективність у відношенні «вимикання» (мовчання) генів іРНК-агентами довжиною приблизно 15 пар основ (Byrom та ін., «Inducing RNAi with siRNA Cocktails Generated by RNase III», Tech Notes 10(1), изд-в Ambion, Inc., Austin, TX). Таким чином, представляється можливим, і це підпадає під об'єм даного винаходу, вибирати з послідовностей, представлених у таблицях 1А-1Г, часткову послідовність, що складається з 15-19 нуклеотидів, для створення іРНК-агента, виведеного з однієї з послідовностей, представлених у таблицях 1А-1Г. В альтернативному варіанті можна додавати один або декілька нуклеотидів до однієї з послідовностей, представлених у таблицях 1А-1Г, або до агента, що містить 15 послідовно розташованих нуклеотидів, з одного із зазначених агентів, краще, але не обов'язково, таким чином, щоб додані нуклеотиди були комплементарними відповідній послідовності гена-мішені, наприклад, альфа-ЕnаС. Наприклад, перші 15 нуклеотидів з послідовності одного з агентів можна поєднувати з 8 нуклеотидами, що перебувають на 5'-кінці відносно цієї послідовності в мРНК альфаЕnаС з одержанням агента, що містить 23 нуклеотиди в смисловому та антисмисловому ланцюгах. Всі зазначені виведені іРНК-агенти відносяться до іРНК-агентів, запропонованих у даному винаході, за умови, що вони в основному зберігають здатність інгібувати реплікацію альфа-ЕnаС у людських клітинах, що культивуються. Антисмисловий ланцюг іРНК-агента повинен складатися з, або щонайменше включати 14, 15, 16, 17, 18, 19, 25, 29, 40 або 50 нуклеотидів. Він може складатися з 60, 50, 40 або 30 або меншої кількості нуклеотидів. Кращі діапазони довжин становлять 15-30, 17-25, 19-23 і 19-21 нуклеотидів. 13 Смисловий ланцюг ІРНК-агента повинен містити або щонайменше складатися з 14, 15, 16 17, 18, 19, 25, 29, 40 або 50 нуклеотидів. Він може складатися або 60, 50, 40 або 30 або меншої кількості нуклеотидів. Кращі діапазони довжин становлять 15-30, 17-25, 19-23 і 19-21 нуклеотидів. Дволанцюгова ділянка іРНК-агента повинна містити або щонайменше складатися з 15, 16 17, 18, 19, 20, 21, 22, 23, 24, 25, 29, 40 або 50 пар нуклеотидів. Вона може складатися з 60, 50, 40 або 30 або меншої кількості пар нуклеотидів. Кращі діапазони довжин становлять 15-30, 17-25, 19-23 і 19-21 пар нуклеотидів. У цілому, іРНК-агенти, запропоновані у даному винаході, включають область, яка є в достатньому ступені комплементарною мРНК альфа-EnaC, і має довжину, достатню для того, щоб підпадати під назву нуклеотид, зазначений іРНК-агент або його фрагмент може опосередковувати негативну регуляцію гена альфа-EnaC. Не є необхідним, щоб мала місце точна комплементарність між іРНКагентом і геном-мішенню, але відповідність повинна бути достатньою для того, щоб іРНК-агент або продукт його розщеплення мав здатність забезпечувати специфічне «вимикання» послідовності, наприклад, у результаті розщеплення РНКіагентом мРНК альфа-EnaC. Таким чином, до іРНК-агентів, запропонованих у даному винаході, відносяться агенти, що містять смисловий ланцюг і антисмисловий ланцюг, кожен з яких складається щонайменше з 16, 17 або 18 нуклеотидів і практично ідентичний, як буде описано нижче, одній з послідовностей, представлених у таблицях 1А-1Г, за винятком того, що не більше 1, 2 або 3 нуклеотидів на ланцюг відповідно замінені іншими нуклеотидами (наприклад, аденозин замінений урацилом), практично зберігаючи при цьому здатність інгібувати експресію альфаEnaC у людських клітинах, що культивуються. Таким чином, ці агенти повинні нести щонайменше 15 нуклеотидів, ідентичних одній з послідовностей, представлених у таблицях 1А-1Г, але в які інтродуційовані 1, 2 або 3 невідповідних (помилкових) або стосовно послідовності-мішені альфа-EnaC, або між смисловим і антисмисловим ланцюгом основ. Невідповідні основи стосовно послідовності РНК альфа-EnaC, що є мішенню, насамперед в антисмисловому ланцюзі, є найбільш прийнятними в кінцевих областях і, якщо вони присутні, то краще присутні в кінцевій(их) області або областях, наприклад, зачіпають 6, 5, 4 або 3 нуклеотиди на 5'- і/або 3'-кінці, найкраще 6, 5, 4 або 3 нуклеотиди на 5'-кінці смислового ланцюга або 3'-кінці антисмислового ланцюга. Для цієї мети смисловий ланцюг повинен лише мати достатній ступінь комплементарності з антисмисловим ланцюгом, щоб підтримувати загальну дволанцюгову структуру молекули. Краще смислові та антисмислові ланцюги варто вибирати так, щоб іРНК-агент включав одноланцюгову або неспарену область на одному або обох кінцях молекули. Таким чином, іРНК-агент містить смисловий та антисмисловий ланцюги, краще спарені таким чином, щоб містити виступаючу ділянку, що складається з 2-3 нуклеотидів. 97521 14 наприклад, на одному або двох 5'- або 3'-кінцях, але краще таку, що виступає на 3'-кінці. У більшості варіантів здійснення винаходу вони мають виступаючий 3'-кінець. Кращі siPHК-агенти повинні мати одноланцюгові виступаючі на кінці ділянки, що краще виступають на 3'-кінці ділянки, що складаються з 1-4, або краще з 2 або 3 нуклеотидів, на одному або на обох кінцях іРНК-агента. Виступаючі ділянки можуть бути результатом того, що один ланцюг довший ніж інший, або результатом зиґзаґоподібного розташування двох ланцюгів однакової довжини. Неспарені нуклеотиди, що утворюють виступаючу ділянку, можуть являти собою рибонуклеотиди, або можуть являти собою дезоксирибонуклеотиди, краще тимідин. Краще 5'-кінці є фосфорильованими, або вони можуть бути нефосфорильованими. Краща довжина області, утворює дуплекс, становить 15- 30, найкраще 18, 19, 20, 21, 22 і 23 нуклеотиди, наприклад, довжина siPHК-агента перебуває в зазначеному вище діапазоні. siPHКагенти можуть відповідати за довжиною та структурою продуктам, що зустрічаються в природних умовах, отриманим після обробки рибонуклеазою Dicer з довгих dsPHК. Під об'єм даного винаходу підпадають також варіанти, у яких два ланцюги siPHК-агента зчеплені, наприклад, ковалентно зв'язані. Під об'єм даного винаходу підпадають також структури типу шпильки або інші одноланцюгові структури, які утворюють необхідну дволанцюгову область і краще виступаючий 3'-кінець. Оцінка перспективних іРНК-агентів (агентівкандидатів) Як відзначалося вище, у даному винаході запропонована система ідентифікації siPHК, які можна застосовувати як інгібітори альфа-EnaC. Оскільки, як відзначено вище, shPHК процесуються всередині клітин з утворенням siPHК, які включають дуплексні ділянки, що мають таку ж послідовність, що й «стеблева» структура shPHК, то систему так само можна застосовувати для ідентифікації shPHК, придатних як інгібітори альфа-EnaC. У цьому розділі з метою ілюстрації описані siPHК, хоча система відноситься також до відповідної shPHК. Зокрема, у даному винаході продемонстроване успішне одержання siPHК, призначеним для інгібування активності альфа-EnaC. Методики і реагенти, представлені у даному описі, можна з успіхом застосовувати також для створення нових потенційних siPHК, мішенню яких є інші гени або області генів, і для оцінки активності у відношенні інгібування альфа-EnaC відповідно до способу, представленого у даному описі. У різних варіантах здійснення винаходу потенційні інгібітори альфа-EnaC можна оцінювати відносно придушення ендогенної експресії альфаEnaC шляхом інтродукції siPHК-кандидата(ів) у клітини (наприклад, шляхом екзогенного введення або шляхом інтродукції вектора або конструкції, що/яка забезпечує ендогенний синтез siPHК у клітині) або в лабораторних тварин шляхом легеневого або назального введення. В альтернативному варіанті потенційні інгібітори альфа-EnaC можна оцінювати in vitro шляхом здійснення короткочасної котрансфекції з використанням siPHК 15 кандидата(ів) у сполученні з експресійною плазмідою альфа-EnaC. Потім оцінюють здатність siPHКкандидата(ів) знижувати кількість транскриптумішені і/або інгібувати або придушувати один або кілька видів або характерних рис активності альфа-EnaC, таких як різниця потенціалів в епітелії або абсорбція рідини на поверхні дихальних шляхів. Клітини або лабораторні тварини, оброблені композиціями siPHК, запропонованими у винаході (клітини/тварини, що тестуються), можна порівнювати з такими ж або порівнянними клітинами або лабораторними тваринами, які не оброблені композицією, запропонованою у винаході (контрольні клітини/тварини, наприклад, клітини/тварини, які або не оброблені ніякою siPHК, або оброблені контрольною siPHК, наприклад, siPHК, мішенню якої є неендогенний транскрипт, такий як зелений флуоресцентний білок (GFP)). Фенотип, що відноситься до транспорту іонів, клітин/тварин, що тестуються, можна порівнювати з фенотипом контрольних клітин/тварин, за умови, що послідовність siPHК, запропонованої у винаході, має крос-реактивність з послідовностями типів клітин/видів тварин, що тестуються. Виробництво білка альфа-EnaC і струм у короткому ланцюзі (in vitro або ex vivo) можна порівнювати в клітинах/тваринах, що тестуються, іконтрольних клітинах/тваринах. Іншими показниками активності альфа-EnaC, які також можна порівнювати, є різниця потенціалів в епітелії ex vivo або кліренс in vivo, що забезпечується війовим епітелієм, або візуалізація методом ядерно-магнітного резонансу (ЯМР-томографія) всього організму. У цілому, клітини/тварини, що тестуються, і контрольні клітини/тварини повинні мати походження з однакових видів, а у випадку клітин, із клітин подібного або ідентичного типу. Наприклад, можна порівнювати клітини з однієї і тієї ж лінії клітин. Коли клітина, що тестується, являє собою первинну клітину, як правило, контрольна клітина також повинна являти собою первинну клітину. Наприклад, здатність siPHК-кандидата інгібувати активність альфа-EnaC прийнято визначати шляхом (І) введення siPHК-кандидата в клітини, (II) оцінки рівнів експресії мРНК альфа-EnaC у порівнянні з контрольним геном, що ендогенно експресується, (III) порівняння амілорид-чутливого струму на клітинній моделі in vitro, отриманого в присутності siPHК, з рівнем, отриманим у відсутності siPHК. Останній аналіз можна застосовувати для оцінки siPHК, мішенню яких є будь-який транскрипт-мішень, який може побічно впливати на активність альфа-EnaC, і не обмежений siPHК, мішенню яких є транскрипти, які кодують субодиниці каналу Еnа. Здатність siPHК-кандидата знижувати кількість транскрипта-мішені можна оцінювати, вимірюючи кількість транскрипта-мішені, наприклад, за допомогою Нозерн-блоттінга, аналізів захисту від нуклеаз, гібридизації із зондом, ПЦР зі зворотною транскрипцією (ЗТ)-ПЦР, ЗТ-ПЦР у реальному часі, аналізу з використанням мікромасивів і т.д. Здатність siPHК-кандидата інгібувати виробництво поліпептиду, що кодується транскриптом-мішенню (або на рівні транскрипції, або на пост 97521 16 транскрипційному рівні), можна оцінювати з використанням різних заснованих на застосуванні антитіл підходів, включаючи, але не обмежуючись тільки ними, Вестерн-блоттінг, імуноблоттінг, ELISA, проточну цитометрію, білкові мікромасиви і т.д. У цілому, можна використовувати будь-який метод оцінки кількості або транскрипта-мішені, або поліпептиду, що кодується транскриптом-мішенню. У цілому, певні кращі іРНК-інгібітори альфаEnaC знижують рівень транскрипта щонайменше приблизно в 2 рази, краще щонайменше приблизно в 4 рази, ще краще щонайменше приблизно в 8 разів, щонайменше приблизно в 16 разів, щонайменше приблизно в 64 рази або навіть у ще більшому ступені відносно рівня, наявного у відсутності інгібітору (наприклад, у відповідній контрольній клітині, у якій відсутній інгібітор). У цілому, певні кращі іРНК-інгібітори альфа-EnaC інгібують активність каналу Еnа, у результаті чого активність знижується в клітинах, що містять інгібітор, у порівнянні з контрольною клітиною, що не містить інгібітор, щонайменше приблизно в 2 рази, краще щонайменше приблизно в 4 рази, ще краще щонайменше приблизно в 8 разів, щонайменше приблизно в 16 разів, щонайменше приблизно в 64 рази, щонайменше приблизно в 100 разів, щонайменше приблизно в 200 разів або навіть у ще більшому ступені. Певні кращі іРНК-інгібітори альфа-EnaC інгібують активність каналу Еnа протягом щонайменше 12, щонайменше 24, щонайменше 36, щонайменше 48, щонайменше 60, щонайменше 72, щонайменше 96, щонайменше 120, щонайменше 144 або щонайменше 168 год. після введення siPHК і зараження клітин. Певні кращі інгібітори альфа-EnaC запобігають (тобто знижують до рівнів, що виявляються нижче) або істотно знижують активність альфа-EnaC протягом щонайменше 24, щонайменше 36, щонайменше 48 або щонайменше 60 год. після введення siPHК. Відповідно до різних варіантів здійснення винаходу істотне зниження активності альфа-EnaC являє собою зниження до рівня, що становить менше приблизно 90% від рівня у відсутності siPHК, або зниження до рівня, що становить менше приблизно 75% від рівня у відсутності siPHК, зниження до рівня, що становить менше приблизно 50% від рівня у відсутності siPHК, зниження до рівня, що становить менше приблизно 25% від рівня у відсутності siPHК, або зниження до рівня, що становить менше приблизно 10% від рівня у відсутності siPHК. Зниження активності альфа-EnaC можна оцінювати за допомогою будь-якого прийнятного методу, включаючи, але не обмежуючись тільки ними, оцінку амілорид-чутливого струму в короткому ланцюзі in vitro, визначення різниці потенціалів в епітелії ex vivo або in vivo кліренсу, що забезпечується війовим епітелієм, або ЯМР-томографію всього тіла/легені. Оцінка стабільності, модифікації іРНК-агентів і їх повторне тестування (ретестування) Можна оцінювати іРНК-агенти-кандидати відносно їх стабільності, наприклад, їх чутливості до розщеплення ендонуклеазою або екзонуклеазою, наприклад, при інтродукції іРНК-агента в організм 17 індивідуума. Можна застосовувати методи, придатні для ідентифікації сайтів, чутливих до модифікації, зокрема до розщеплення, наприклад, розщепленню компонентом, що присутній в організмі пацієнта. Зазначені методи включають виділення та ідентифікацію фрагментів, що найбільш часто зустрічаються, які утворилися в результаті розщеплення іРНК-агента-кандидата після його інкубації з виділеними біологічними середовищами in vitro, наприклад, сироваткою, плазмою, мокротинням, спинномозковою рідиною або гомогенатами клітин або тканин, або після контакту індивідуума з іРНКагентом-кандидатом in vivo, ідентифікуючи тим самим схильність сайтів до розщеплення. Зазначені методи являють собою, наприклад, але не обмежуючись тільки ними, методи, описані в публікації міжнародної заявки на патент WO 2005/115481, зареєстрованої 27 травня 2005 р. Після ідентифікації чутливих до розщеплення сайтів можна створювати і/або синтезувати інший іРНК-агент, у якому потенційному сайту розщеплення додана стійкість до розщеплення, наприклад, шляхом інтродукції 2'-модифікації в сайт розщеплення, наприклад, 2'-О-метильної групи. Цей додатковий іРНК-агент можна повторно тестувати відносно стабільності, і цей процес можна повторювати до одержання іРНК-агента, що має необхідну стабільність. Оцінка in vivo Функціональну активність іРНК-агента, у якого виявлена здатність інгібувати експресію гена альфа-EnaC, можна оцінювати in vivo на створеній з використанням тварини моделі (наприклад, з використанням для цього ссавця, такого як миша, пацюк, морська свинка або примат). Наприклад, іРНК-агент можна вводити тварині і оцінювати іРНК-агент у відношенні його біорозподілу, стабільності і його здатності інгібувати експресію альфа-EnaC або модулювати біологічний або патологічний процес, опосередковуваний щонайменше частково альфа-EnaC. іРНК-агент можна вводити безпосередньо в тканину-мішень, наприклад, шляхом ін'єкції, або іРНК-агент можна вводити модельній тварині, що використовується, таким же шляхом, яким варто вводити його людині. Краще іРНК-агент вводять у дихальні шляхи індивідуума, наприклад, інтраназально, шляхом інгаляції або внутрішньотрахеально. Можна також оцінювати розподіл іРНК-агента всередині клітини. Ця оцінка може передбачати визначення того, чи поглинається іРНК-агент клітиною. Оцінка може включати визначення стабільності (наприклад, часу напівжиття) іРНК-агента. Для полегшення оцінки іРНК-агента in vivo можна застосовувати іРНК-агент, кон'югований з маркером, що виявляється (наприклад, флуоресцентним маркером, таким як флуоресцеїн; радіоактив35 32 33 3 ною міткою, такою як S, P, Р або Н; частками золота; або антигеном, що застосовується для імуногістохімії). Можна оцінювати здатність іРНК-агента забезпечувати негативну регуляцію експресії альфаEnaC. Рівні експресії гена альфа-EnaC in vivo можна оцінювати, наприклад, шляхом гібридизації in 97521 18 situ або шляхом виділення РНК із тканини до і після обробки іРНК-агентом. Якщо тварину необхідно умертвляти для одержання тканини, то для порівняння варто використовувати неопрацьовану контрольну тварину. РНК альфа-EnaC можна виявляти за допомогою будь-якого необхідного методу, включаючи, але не обмежуючись тільки ними, ЗТПЦР, Нозерн-блоттінг, аналіз розгалужених ДНК або аналіз захисту від РНКази. В альтернативному або додатковому варіанті можна здійснювати моніторинг експресії гена альфа-EnaC за допомогою аналізу методом Вестерн-блоттінга або імунофарбування екстрактів тканин, оброблених іРНКагентом. Оцінку потенційних інгібіторів альфа-EnaC можна проводити за допомогою кожної з розроблених на тваринах моделей. Можна вводити тварині композиції, що містять sіРНК-кандидат(и), конструкції або вектори, що мають здатність забезпечувати синтез зазначених siPHК у клітиніхазяїні, або клітини, створені або оброблені так, щоб вони містили siPHК-кандидати. Оцінюють здатність композиції придушувати експресію альфаEnaC і/або модифікувати залежні від Еnа фенотипи і/або зменшувати їх вираженість у порівнянні із тваринами, не обробленими потенційним інгібітором альфа-EnaC. Зазначені моделі включають, але не обмежуючись тільки ними, моделі, створені на мишах, пацюках, морських свинках, вівцях і приматах крім людини, призначені для визначення залежного від Еnа фенотипу, які всі є відомими в даній галузі і які застосовують для оцінки ефективності потенційних терапевтичних засобів, що чинять вплив на альфа-EnaC. З використанням розроблених при створенні винаходу систем виявлення siPHК-агентівкандидатів як терапевтичних засобів прийнятні терапевтичні агенти вибирають із дуплексів, що мають ідентифікаційні номери ND-8302, ND-8332, ND-8348, ND-8356, ND-8357, ND-8373, ND-8381, ND-8396, ND-8450 і ND-8453, ще краще вибирають із ND-8356, ND-8357 і ND-8396. Хімічна будова іРНК У даному описі представлені виділені іРНКагенти, наприклад, ds РНК-агенти, які опосередковують РНКі, інгібуючи експресію гена альфа-EnaC. РНК-агенти, представлені у даному описі, включають як немодифіковану РНК, так і РНК, модифіковану, наприклад, для підвищення ефективності, і полімери нуклеозидних аналогів. Поняття «немодифікована РНК» відноситься до молекули, у якій компоненти нуклеїнової кислоти, а саме цукри, основи і фосфатні залишки, є практично такими ж, що й ті, що зустрічаються в природних умовах, що краще зустрічаються в природних умовах в організмі людини. У даній галузі рідкісні або незвичайні, але, такі, що зустрічаються в природних умовах РНК, позначають як модифіковані РНК, див., наприклад, Limbach та ін., Nucleic Acids Res. 22, 1994, сс. 2183-2196). Так рідкісні або незвичайні РНК, які часто позначають як модифіковані РНК (імовірно через те, що вони, як правило, є результатом пост-транскрипційної модифікації), підпадають під поняття «немодифікована РНК» у контексті даного опису. Поняття «модифікована 19 РНК» у контексті даного опису відноситься до молекули, у якій один або декілька з компонентів нуклеїнової кислоти, а саме, цукри, основи і фосфатні залишки, відрізняються від тих, які зустрічаються в природі, краще відрізняються від тих, які зустрічаються в організмі людини. Оскільки РНК, позначені як модифіковані «РНК», містять модифікацію, то до них відносяться також молекули, які не являють собою РНК. Нуклеозидні аналоги являють собою молекули, у яких рибозофосфатний кістяк замінений нерибозофосфатною конструкцією, що дозволяє основам бути присутніми у правильному просторовому взаємозв'язку, у результаті чого гібридизація є практично такою ж, що має місце у випадку рибозофосфатного кістяка, наприклад, у випадку незаряджених імітаторів рибозофосфатного кістяка. Приклади вищевказаних варіантів описані нижче. Представлені у даному описі модифікації можна включати в будь-яку дволанцюгову РНК і РНКподібну молекулу, представлену у даному описі, наприклад, в іРНК-агент. Може виявитися бажаним модифікувати один антисмисловий або смисловий або обидва ланцюги іРНК-агента. Оскільки нуклеїнові кислоти являють собою полімери субодиниць або мономери, то багато описаних нижче модифікацій зустрічаються в положенні, що повторюється в нуклеїновій кислоті, наприклад, модифікація основи, фосфатного залишку або кисню фосфатного залишку, що не входить в лінкер. У деяких випадках модифікація може зустрічатися у всіх положеннях у нуклеїновій кислоті, запропонованої у винаході, але в багатьох, і фактично в більшості випадків, це не має місце. Наприклад, модифікація може зустрічатися тільки в 3'- або 5'кінцевому положенні, може зустрічатися тільки в кінцевому положенні, наприклад, у положенні на кінцевому нуклеотиді або в останніх 2, 3, 4, 5 або 10 нуклеотидах ланцюга. Модифікація може зустрічатися в області дволанцюгового ланцюга, області одноланцюгового ланцюга або в них обох. Наприклад, фосфоротіоатна модифікація в положенні О, що не входить в лінкер, може зустрічатися тільки на одному або обох кінцях, може зустрічатися тільки в кінцевих областях, наприклад, у положенні на кінцевому нуклеотиді або в останніх 2, 3, 4, 5 або 10 нуклеотидах ланцюга, або може зустрічатися в області дволанцюгового ланцюга, області одноланцюгового ланцюга, насамперед на кінцях. Аналогічно цьому, модифікація може зустрічатися в смисловому ланцюзі, антисмисловому ланцюзі або в них обох. У деяких випадках смисловий і антисмисловий ланцюг можуть мати однакові модифікації або модифікації того самого класу, але в інших випадках смисловий і антисмисловий ланцюг можуть мати різні модифікації, наприклад, у деяких випадках може виявитися бажаним модифікувати тільки один ланцюг, наприклад, смисловий ланцюг. Двома основними цілями, пов'язаними з інтродукцією модифікацій в іРНК-агенти, є їх стабілізація відносно розщеплення в біологічних середовищах і поліпшення фармакологічних характеристик, наприклад, фармакодинамічних характеристик, які додатково будуть описані ниж 97521 20 че. Інші прийнятні модифікації цукру, основи або каркасу іРНК-агента описані в заявці РСТ № PCT/US2004/01193, зареєстрованій 16 січня 2004 р. іРНК-агент може включати основу, що не зустрічається вприродних умовах, наприклад, основи, описані в заявці РСТ № PCT/US2004/011822, зареєстрованої 1 квітня 2004 р. іРНК-агент може включати цукор, що не зустрічається в природних умовах, такий як молекула, що представляє собою невуглеводневий циклічний носій. Приклади характеристик цукрів, що не зустрічаються в природних умовах, які можна застосовувати в іРНК-агентах, описані в заявці РСТ № PCT/US2004/11829, зареєстрованій 16 квітня 2003 р. іРНК-агент може включати внутрішньонуклеотидний зв'язок (наприклад, хіральний фосфоротіоатний зв'язок), придатний для підвищення стійкості до нуклеаз. У додатковому або альтернативному варіанті іРНК-агент може включати міметик рибози для підвищення стійкості до нуклеаз. Приклади внутрішньонуклеотидних зв'язків і міметиків рибози, призначених для підвищення стійкості до нуклеаз, описані в заявці РСТ № PCT/US2004/07070, зареєстрованій 8 березня 2004 р. іРНК-агент може включати кон'юговані з лігандом мономерні субодиниці і мономери для олігонуклеотидного синтезу. Приклади мономерів описані в заявці на патент США № 10/916185, зареєстрованій 10 серпня 2004 р. іРНК-агент може мати ZXY-структуру, яка описана в заявці РСТ № PCT/US2004/07070, зареєстрованій 8 березня 2004 р. іРНК-агент може входити до складу комплексу в сполученні з амфіпатичним залишком. Приклади амфіпатичних залишків, які можна застосовувати в сполученні з іРНК-агентами, описані в заявці РСТ № PCT/US2004/07070, зареєстрованій 8 березня 2004 р. В іншому варіанті здійснення винаходу іРНКагент можна включати до складу комплексу з агентом для введення, що має характеристики модульного комплексу. Комплекс може включати носій, зчеплений з одним або декількома (краще із двома або декількома, ще краще з усіма трьома) з наступних компонентів, обраних із групи, яка включає: (а) конденсуючий агент (наприклад, агент, що може притягувати, наприклад, зв'язувати, нуклеїнову кислоту, наприклад, за допомогою іонних або електростатичних взаємодій); (б) фузогенний агент (наприклад, агент, що може зливатися (розчинятися) і/або транспортуватися через клітинну мембрану); і (в) група, що забезпечує направлений перенос, наприклад, агент, що забезпечує направлений перенос у клітину або тканину, наприклад, лектин, глікопротеїн, ліпід або білок, наприклад, антитіло, яке зв'язується зі специфічним клітинним типом. Приклади іРНК-агентів, включених у комплекс із агентом, що забезпечує введення, описані в заявці РСТ №PCT/US2004/07070, зареєстрованій 8 березня 2004 р. іРНК-агент може мати неканонічні спарювання, наприклад, спарювання, що мають місце між смисловою та антисмисловою послідовностями дуплексу іРНК. Приклади особливостей неканонічних іРНК-агентів описані в заявці РСТ № 21 PCT/US2004/07070, зареєстрованій 8 березня 2004 р. Підвищена стійкість до нуклеаз іРНК-агент, наприклад, іРНК-агент, мішенню якого є альфа-EnaC, може мати підвищену стійкість до нуклеаз. Одним зі шляхів підвищення стійкості є ідентифікація сайтів розщеплення та модифікація зазначених сайтів з метою інгібування розщеплення відповідно до методу, описаного в заявці на патент США № 60/559917, зареєстрованій 4 травня 2004 р. Сайтами розщеплення можуть служити, наприклад, динуклеотиди 5'-uа-3', 5'-са-3', 5'-ug-3', 5'-uu-3' або 5'-сс-3'. У деяких варіантах здійснення винаходу всі піримідини іРНК-агента несуть 2'модифікацію або в смисловому ланцюзі, або в антисмисловому ланцюзі, або в обох ланцюгах, і внаслідок цього іРНК-агент має підвищену стійкість до ендонуклеаз. З метою підвищення стійкості до нуклеаз можна модифікувати 5'-нуклеотид, що приводить, наприклад, до утворення щонайменше одного динуклеотиду 5'-уридин-аденін-3' (5'uа-3'), у якому уридин являє собою 2'модифікований нуклеотид; щонайменше одного динуклеотиду 5'-цитидин-аденін-3' (5'-са-3'), у якому 5'-цитидин являє собою 2'-модифікований нуклеотид; щонайменше одного динуклеотиду 5'уридин-гуанін-3' (5'-ug-3'), у якому 5'-уридин являє собою 2'-модифікований нуклеотид; щонайменше одного динуклеотиду 5'- уридин-уридин-3' (5'-uu3'), у якому 5'-уридин являє собою 2'модифікований нуклеотид; або щонайменше одного динуклеотиду 5'-цитидин-цитидин-3' (5'-сс-3'), у якому 5'-цитидин являє собою 2'-модифікований нуклеотид; як описано в міжнародній заявці № PCT/US2005/018931, зареєстрованій 27 травня 2005 р. іРНК-агент може включати щонайменше 2, щонайменше 3, щонайменше 4 або щонайменше 5 зазначених динуклеотидів. У найкращому варіанті здійснення винаходу 5'-нуклеотид у всіх випадках його присутності в мотивах послідовностей 5'-uа-3' і 5'-са-3' або в смисловому ланцюзі, або в антисмисловому ланцюзі, або в обох являє собою модифікований нуклеотид. Краще 5'-нуклеотид у всіх випадках його присутності в мотивах послідовностей 5'-uа-3', 5'-са-3' і 5'-ug-3' або в смисловому ланцюзі, або в антисмисловому ланцюзі, або в обох являє собою модифікований нуклеотид. Ще краще всі піримідинові нуклеотиди в смисловому ланцюзі являють собою модифіковані нуклеотиди і 5' нуклеотид у всіх випадках його присутності в мотивах послідовностей 5'-uа-3' і 5'-ca-3' в антисмисловому ланцюзі являють собою модифіковані нуклеотиди, або, якщо антисмисловий ланцюг не містить ні мотив 5'-uа-3', ні мотив 5'-са-3', то у всіх випадках мотив послідовності являє собою 5'-ug3'. Краще 2'-модифіковані нуклеотиди включають, наприклад, 2'-модифікований рибозний фрагмент, наприклад, 2'-гідроксильну групу (ОН) можна модифікувати або заміняти численними іншими «окси»- або «дезокси»-замісниками. Прикладами «окси»-модифікацій 2' гідроксильної групи є алкокси- або арилокси-замісники (OR, наприклад, R позначає Н, алкіл, циклоалкіл, 97521 22 арил, аралкіл, гстероарил або цукор); поліетиленгліколі (ПЕГ), O(CH2CH2O)nCH2CH2OR; «замкнуті» нуклеїнові кислоти (ЗНК), у яких 2'-гідроксил з'єднаний, наприклад, метиленовим містком, з 4'вуглецем цього ж цукру-рибози; O-AMINE і аміноалкокси-замісники, O(CH2)nAMINE, (наприклад, AMINE позначає NH2; алкіламіногрупу, диалкіламіногрупу, гетероцикламіногрупу, ариламіногрупу, диариламіногрупу, гетероариламіногрупу або дигетероариламіногрупу, етилендиамін, поліаміногрупу). Слід зазначити, що олігонуклеотиди, що містять тільки метоксиетильну групу (MOE), (ОСН2СН2ОСН3, ПЕГ-похідне), мають стабільність у відношенні нуклеаз, порівняну зі стабільністю олігонуклеотидів, модифікованих «сильною» фосфоротіоатною модифікацією. Прикладом «дезокси»-модифікації є водень (тобто цукридезоксирибози, наявність яких, зокрема, доречна у виступаючих ділянках частково дволанцюгових РНК); галоген (наприклад, фтор); аміногрупа (наприклад, NH2; алкіламіногрупа, диалкіламіногрупа, гетероцикліл, ариламіногрупа, диариламіногрупа, гетероариламіногрупа, дигетероариламіногрупа або амінокислота); NH(CH2CH2NH)nCH2CH2AMINE (AMINE позначає NH2; алкіламіногрупу, диалкіламіногрупу, гетероцикламіногрупу, ариламіногрупу, диариламіногрупу, гетероариламіногрупу або дигетероариламіногрупу), -NHC(O)R (R позначає алкіл, циклоалкіл, арил, аралкіл, гетероарил або цукор), ціаногрупа; меркаптогрупа; алкілтіоалкіл; тіоалкоксигрупа; і алкіл, циклоалкіл, арил, алкеніл і алкініл, які необов'язково можуть бути заміщені, наприклад, амінною функцією. Кращими замісниками є 2'-метоксиетил, 2'ОСН3, 2'-О-аліл, 2'-С- аліл і 2'-фтор. Включення цукрів, таких як фуранози, в олігонуклеотидний каркас може також приводити до зниження ендонуклеазного розщеплення. іРНК-агент можна додатково модифікувати шляхом включення 3'катіонної групи або шляхом інвертування нуклеозиду на 3'-кінці 3'-3'-зв'язком. В іншому варіанті 3'кінець можна блокувати аміноалкільною групою, наприклад, 3'-С5-аміноалкіл-дТ. Інші 3'-кон'югати можуть інгібувати 3'-5'-екзонуклеазне розщеплення. Не вдаючись у теорію, 3'-кон'югат, такий як напроксен або ібупрофен, може інгібувати екзонуклеазне розщеплення шляхом стеричної блокади зв'язування екзонуклеази з 3'-кінцем олігонуклеотиду. Навіть невеликі алкільні ланцюги, арильні групи або гетероциклічні кон'югати або модифіковані цукри (D-рибоза, дезоксирибоза, глюкоза і т.д.) можуть блокувати 3'-5'-екзонуклеази. Нуклеазне розщеплення можна інгібувати також шляхом інтродукції фосфатних лінкерних модифікацій, наприклад, фосфоротіоатних зв'язків. Так, кращі іРНК-агенти включають нуклеотидні димери, збагачені або очищені до конкретної хіральної форми модифікованої фосфатної групи, що містить гетероатом у положенні, що несполучено мостиковим зв'язком, у нормі зайнятому киснем. Гетероатом може являти собою S, Sе, Nr2 або Вr3. Коли гетероатом являє собою S, то кращим є збагачений або хірально чистий Sp-зв'язок. Збагачений означає, що вміст кращої форми становить щонайменше 70, 80, 90, 95 або 99%. Модифіковані 23 фосфатні зв'язки найбільш ефективні у відношенні інгібування екзонуклеазного розщеплення при їх інтродукції поблизу 5'-або 3'-кінцевих положень, і краще поблизу 5'-кінцевих положень, іРНК-агента. 5'-3'-екзонуклеазне розщеплення можуть інгібувати також 5'-кон'югати. Не вдаючись у теорію, можна вважати, що 5'-кон'югат, такий як напроксен або ібупрофен, може інгібувати екзонуклеазне розщеплення шляхом стеричної блокади зв'язування екзонуклеази з 5'-кінцем олігонуклеотиду. Навіть невеликі алкільні ланцюги, арильні групи або гетероциклічні кон'югати або модифіковані цукри (D-рибоза, дезоксирибоза, глюкоза і т.д.) можуть блокувати 3'-5'-екзонуклеази. іРНК-агент може мати підвищену стійкість до нуклеаз, коли дуплексний ІРНК-агент включає одноланцюгову нуклеотидну виступаючу ділянку щонайменше на одному кінці. У кращих варіантах здійснення винаходу нуклеотидна виступаюча ділянка включає 1-4, краще 2-3 неспарених нуклеотиди. У кращих варіантах здійснення винаходу неспарений нуклеотид одноланцюгової виступаючої ділянки, яка безпосередньо примикає до кінцевої нуклеотидної пари, містить пуринову основу, і кінцева нуклеотидна пара являє собою пару G-C, або щонайменше дві з останніх чотирьох комплементарних нуклеотидних пари являють собою пари G-C. В інших варіантах здійснення винаходу нуклеотидна виступаюча ділянка може містити 1 або 2 неспарених нуклеотиди, і в наведеному як приклад варіанті здійснення винаходу нуклеотидна виступаюча ділянка являє собою 5'-gc-3'. У кращих варіантах здійснення винаходу нуклеотидні виступаючі кінці являють собою 3'-кінець анти смислового ланцюга. В одному з варіантів здійснення винаходу іРНК-агент включає мотив 5'-сgс-3' на 3'кінці антисмислового ланцюга, такий, щоб утворювалася виступаюча ділянка 5'-gc-3', складається з 2 нуклеотидів. Таким чином, іРНК-агент може включати модифікації, призначені для інгібування розщеплення, наприклад, нуклеази, наприклад, ендонуклеази або екзонуклеази, присутніми в організмі індивідуума. Ці мономери в контексті даного опису позначають як NRM або Nuclease Resistance promoting Monomers (мономери, що підвищують стійкість до нуклеаз), а відповідні модифікації позначають як NRM-модифікації. У багатьох випадках ці модифікації повинні модулювати інші властивості іРНКагента, такі, наприклад, як здатність взаємодіяти з білком, наприклад, транспортним білком, наприклад, сироватковим альбуміном або представником RISC (РНК-індуційований комплекс вимикання гена), або здатність першої і другої послідовностей утворювати дуплекс одна з одною або утворювати дуплекс із іншою послідовністю, наприклад, з молекулою-мішенню. Одну або декілька різних NRM-модифікацій можна інтродуціювати в іРНК-агент або в послідовність іРНК-агента. У послідовності або в іРНКагенті NRM-модифікація може зустрічатися більше одного разу. NRM-модифікації включають певні модифікації, які інтродуціюють тільки на кінці, та інші, які можна інтродуціювати у будь-яке положення. Деякі 97521 24 NRM-модифікації можуть інгібувати гібридизацію, тому їх краще використовувати в кінцевих областях і краще не застосовувати їх у сайті розщеплення або в області розщеплення послідовності, мішенню якої є послідовність, що представляє інтерес, або ген, насамперед в антисмисловому ланцюзі. Їх можна застосовувати також у смисловому ланцюзі, за умови, що підтримується достатній рівень гібридизації між двома ланцюгами dsіРНК-агента. У деяких варіантах здійснення винаходу бажано поміщати NRM у сайт розщеплення або область розщеплення смислового ланцюга, оскільки вона може мінімізувати нецільове («offtarget») мовчання. У більшості випадків NRM-модифікації можуть бути розподілені по-різному залежно від того, чи присутні вони в смисловому або в антисмисловому ланцюзі. У випадку антисмислового ланцюга модифікації, які взаємодіють або інгібують розщеплення ендонуклеази, не можна вбудовувати в область, що піддається RISC-опосередковуваному розщепленню, наприклад, у сайт розщеплення або область розщеплення (як описано в Elbashir та ін., Genes and Dev. 15, 2001, с. 188, публікація включена в даний опис як посилання). Розщеплення мішені має місце приблизно в середині антисмислового ланцюга, що складається з 20 або 21 nt, або приблизно на 10 або 11 нуклеотиді проти ходу транскрипції відносно першого нуклеотиду мРНКмішені, яка комплементарна антисмисловому ланцюзі. У контексті даного опису сайт розщеплення означає нуклеотиди на будь-якій стороні сайту розщеплення в мішені або в ланцюзі іРНК-агента, яка з нею гібридизується. Область розщеплення включає нуклеотиди в межах 1, 2 або 3 нуклеотидів відносно сайту розщеплення у будь-якому напрямку. Зазначені модифікації можна інтродуціювати у кінцеві області, наприклад, у кінцеве положення або в межах 2, 3, 4 або 5 положень на кінці смислового або антисмислового ланцюга. Ліганди, пов'язані з деяким ступенем свободи На характеристики іРНК-агента, включаючи його фармакологічні властивості, можна впливати або змінювати їх, наприклад, шляхом інтродукції лігандів, наприклад, пов'язаних з деяким ступенем свободи лігандів. Крім того, фармакологічні властивості іРНК-агента можна поліпшувати шляхом включення ліганда в препарат іРНК-агента. коли іРНК-агент або включає, або не включає пов'язаний з деяким ступенем свободи ліганд. Широку розмаїтість субстанцій, наприклад, лігандів, можна зв'язувати з деяким ступенем свободи з іРНК-агентом або застосовувати для одержання кон'югата або добавки, наприклад, до носія кон'югованої з лігандом мономерної субодиниці. Їх приклади представлені нижче в контексті кон'югованої з лігандом мономерної субодиниці, але при цьому кращими є субстанції, які можна зшивати з іРНК-агентом в інших точках. Кращими залишками є ліганди, які зшивають, краще ковалентно, або безпосередньо, або побічно, через вбудований зв'язок з носієм, що має певну ступінь свободи. У кращих варіантах здійснення винаходу ліганд приєднують до носія через вбудований зв'язок, що має певну ступінь свободи. 25 Ліганд або пов'язаний з деяким ступенем свободи ліганд може бути присутнім у кон'югованому з лігандом мономері, коли кон'югований з лігандом мономер вбудовують у зростаючий ланцюг. У деяких варіантах здійснення винаходу ліганд можна вбудовувати в кон'юговану з лігандом мономерну субодиницю-«попередник» після того, як кон'югована з лігандом мономерна субодиниця«попередник» вбудована в зростаючий ланцюг. Наприклад, мономер, який має, наприклад, амінокінцевий ступінь зв'язок, що має деяку ступінь свободи, наприклад, TAP-(CH2)nNH2, можна включати в зростаючий смисловий або антисмисловий ланцюг. У наступній операції, тобто після включення мономерної субодиниці-«попередника» у ланцюг, ліганд, що має електрофільну групу, наприклад, складний пентафторфеніловий ефір або альдегідну групу, можна приєднувати потім до кон'югованого з лігандом мономера-попередника шляхом сполучення електрофільної групи ліганда з кінцевою нуклеофільною групою кон'югованою з лігандом мономерної субодиниці-«попередника», що має певний ступінь свободи. У кращих варіантах здійснення винаходу ліганд змінює розподіл, здатність до спрямованого впливу або тривалість життя іРНК-агента, у який він вбудований. У кращих варіантах здійснення винаходу ліганд забезпечує підвищену афінність відносно обраної мішені, наприклад, молекули, клітини або типу клітин, компартменту, наприклад, компартменту клітини або органа, тканини, органа або області організму, наприклад, у порівнянні з варіантами без ліганда. Кращі ліганди можуть підвищувати здатність до транспорту, гібридизацію і специфічність і можуть підвищувати також стійкість до нуклеаз одержаного природного або модифікованого олігорибонуклеотида, або полімерної молекули, що містить будь-яку комбінацію мономерів, представлених у даному описі, і/або природні або модифіковані рибонуклеотиди. Ліганди, як правило, можуть включати модифікатори терапевтичної відповіді, наприклад, призначені для полегшення проникнення; діагностичні сполуки або репортерні групи, наприклад, призначені для моніторингу розподілу; перехреснозшиваючі агенти; фрагменти, що надають стійкість до нуклеаз; і зустрічаються в природних умовах або незвичайні нуклеотидні основи. Репрезентативними прикладами є ліпофільні молекули, ліпіди, лектини, стероїди (наприклад, уваол, гецигенін, діосгенін), терпени (наприклад, тритерпени, наприклад, сарсасапогенін, фріеделін, епіфріеделанол, дериватизована літохолева кислота), вітаміни, вуглеводи (наприклад, декстран, пулулан, хітин, хітозан, синтетичні (наприклад, оліголактат, 15-мірний) і такі, що зустрічаються в природних умовах (наприклад, з низькою і середньою молекулярною масою) полімери, інулін, циклодекстрин або гіалуронова кислота), білки, агенти, що зв'язують білки, молекули, що забезпечують направлений перенос інтегрину, полікатіони, пептиди, поліаміни та міметики пептидів. Іншими прикладами є фолієва кислота або ліганди рецепторів епітеліальних клітин, такі як трансферин. 97521 26 Ліганд може являти собою молекулу, що зустрічається в природних умовах, або рекомбінантну або синтетичну молекулу, таку як синтетичний полімер, наприклад, синтетична поліамінокислота. Прикладами поліамінокислот є полілізин (PLL), полі-L-аспарагінова кислота, полі-L-глутамінова кислота, співполімер стиролу та малеїнового ангідриду, полі(L-лактид-когліколірований) співполімер, співполімер простого дивінілового ефіру та малеїнового ангідриду, N-(2гідроксипропіл)метакриламідний співполімер (ГМПА), поліетиленгліколь (ПЕГ), полівініловий спирт (ПВС), поліуретан, полі(2-етилакрилова кислота), N-ізопропілполіакриламідний полімер або поліфосфазин. Прикладами поліамінів є: поліетиленімін, полілізин (PLL), спермін, спермідин, поліамін, псевдопептид-поліамін, поліамінпептидоміметик, дендримерний поліамін, аргінін, амідин, протамін, катіонні молекули, наприклад, катіонний ліпід, катіонний порфірин, четвертинна сіль поліаміну або пептид з альфа-спіральною структурою. Ліганди можуть включати також групи, що забезпечують направлений перенос, такі, наприклад, як агент, що забезпечує направлений перенос у клітину або тканину, такий, наприклад, як тіротропін, меланотропін, білок А, що має властивості поверхнево-активної речовини, муциновий вуглевод, глікозильована поліамінокислота, трансферин, бісфосфонат, поліглутамат, поліаспартат або пептид Arg-Gly-Asp (RGD) або міметик пептиду RGD. Ліганди можуть являти собою білки, наприклад, глікопротеїни, ліпопротеїни, наприклад, ліпопротеїн низької щільності (ЛПНЩ), або альбуміни, наприклад, людський сироватковий альбумін (ЛСА), або пептиди, наприклад, молекули, що мають специфічну афінність до коліганду, або антитіла, наприклад, антитіло, що зв'язується із клітинами певного типу, такими як ракова клітина, ендотеліальна клітина або кісткова клітина. Ліганди можуть включати також гормони і рецептори гормонів. Вони можуть включати також непептидні субстанції, такі як кофактори, багатовалентна лактоза, багатовалентна галактоза, Nацетилгалактозамін, N-ацетилглюкозамін, багатовалентна маноза або багатовалентна фукоза. Ліганд може являти собою субстанцію, наприклад, лікарський засіб, який може підвищувати поглинання іРНК-агента клітиною, наприклад, шляхом порушення клітинного цитоскелету, наприклад, шляхом порушення клітинних мікротрубок, мікрофіламентів і/або проміжних філаментів. Лікарський засіб може являти собою, наприклад, таксон, вінкристин, вінбластин, цитохалазин, нокодазол, джаплакінолід, латрункулін А, фалоїдин, свинхолід А, інданоцин, міосервін, тетрациклін. В одному з об'єктів винаходу ліганд являє собою ліпід або молекулу, основою якої є ліпід. Такий ліпід або молекула, основою якої є ліпід, краще зв'язується із сироватковим білком, наприклад, людським сироватковим альбуміном (ЛСА). ЛСАєднальний ліганд забезпечує розподіл кон'югата в тканині-мішені наприклад, тканини печінки, включаючи паренхімні клітини печінки. Як ліганди мож 27 на використовувати також і інші молекули, які зв'язуються з ЛСА. Наприклад, можна застосовувати непроксин або аспірин. Ліпід або молекула ліганда, основою якої є ліпід, може (а) підвищувати стійкість кон'югата до розщеплення, (б) підвищувати направлений перенос або транспорт у клітинумішень або клітинну мембрану і/або (в) її можна застосовувати для регулювання зв'язування із сироватковим білком, наприклад, ЛСА. Ліганд, основою якого є ліпід, можна застосовувати для модуляції, наприклад, для контролю зв'язування кон'югата із тканиною-мішенню. Наприклад, ліганд, що представляє собою ліпід або молекулу, основою якої є ліпід, що має більш виражену здатність зв'язуватися з ЛСА, з меншою ймовірністю буде направлено переноситися до нирки і тому з меншою ймовірністю буде вилучений у результаті кліренсу з організму. У кращому варіанті здійснення винаходу ліганд, основою якого є ліпід, зв'язується зі ЛСА. Краще він зв'язує ЛСА з афінністю, достатньою для того, щоб кон'югат мав здатність краще розподілятися в нирці, а не в інших тканинах, що не відносяться до нирки. Однак краще афінність не повинна бути занадто сильною, у результаті чого ЛСА-ліганд втрачав би здатність до оборотного зв'язування. В іншому об'єкті винаходу ліганд являє собою компонент, наприклад, вітамін або живильну речовину, що поглинається клітиною-мішенню, наприклад, проліферуючою клітиною. Вони є найбільш перспективними для лікування порушень, що відрізняються небажаною клітинною проліферацією, наприклад, злоякісного або незлоякісного типу, наприклад, ракових клітин. Прикладами вітамінів є вітамін А, Е і K. Іншими прикладами вітамінів є вітаміни групи В, наприклад, фолієва кислота, В12, рибофлавін, біотин, піридоксал або інші вітаміни або живильні речовини, що поглинаються раковими клітинами. В іншому об'єкті винаходу ліганд являє собою агент, що забезпечує проникнення в клітину, що краще забезпечує проникнення в клітину агента, який має спіральну структуру. Краще агент є амфіпатичним. Прикладом такого агента є пептид, такий як tat або antennapedia. Якщо агент являє собою пептид, то він може бути модифікованим, у тому числі може являти собою пептидильний міметик, містити інвертомери або непептидні або псевдопептидні зв'язки, і передбачати застосування D-амінокислот. Агент, що має спіральну структуру, краще являє собою агент, що має структуру у вигляді альфа-спіралі, який краще має ліпофільну та ліпофобну фазу. Агент, що забезпечує проникнення в клітину, можна ковалентно зв'язувати з іРНК-агентом або він може являти собою частина комплексу іРНК-пептид. 5'-фосфатні модифікації У кращих варіантах здійснення винаходу іРНКагенти є 5'-фосфорильованими або включають фосфорильний аналог на 5'-кінці. 5'-фосфатні модифікації антисмислового ланцюга включають модифікації, порівнянні з опосередковуваним RISC «вимиканням» (замовчуванням) гена. Прийнятні модифікації включають 5'-монофосфат ((НО)2(О)Р 97521 28 О-5'); 5'-дифосфат ((НО)2(О)Р-О-Р(НО)(О)-О-5'); 5'трифосфат ((НО)2(О)Р-О-(НО)(О)Р-О-Р(НО)(О)-О5'); 5'-гуанозиновий кеп (7-метильований або неметильований) (7 G-O-5'-(HO)(O) P-O-(HO)(O) Р-ОР(НО)(О)-0-5'); 5'-аденозиновий кеп (Аррр) і будьяку модифіковану або немодифіковану структуру нуклеотидного кепа (N-О-5'-(HО)(О) Р-О(НО)(О)О(НО)(О)-О'); 5'-монотіофосфат (фосфоротіоат; (HO)2(S) Р-О-5'); 5'-монодитіофосфат (фосфородитіоат; (HO)(HS)(S) Р-О-5'), 5'фосфоротіолат ((НО)2(О) P-S-5'); будь-яку додаткову комбінацію заміщеного киснем/сіркою монофосфату, дифосфату і трифосфатів (наприклад, 5'-альфа-тіотрифосфат, 5'-гама-тіотрифосфат і т.д.), 5'-фосфороамідати ((НО)2(О) P-NH-5', (HO)(NH2)(O) Р-О-5'), 5'-алкілфосфонати (R позначає алкіл, такий як метил, етил, ізопропіл, пропіл і т.д., наприклад, RP(OH)(O)-O-5'-, (ОН)2(О)Р-5'СН2-), 5'-алкілові ефіри фосфонатів (R позначає простий алкіловий ефір, такий як метоксиметиловий ефір (МеОСН2-), етоксиметиловий ефір і т.д., наприклад, RP(OH)(O)-O-5'-). Смисловий ланцюг можна модифікувати для того, щоб інактивувати смисловий ланцюг і попереджати утворення активного RISC, що потенційно повинно знижувати «нецільові» дії. Для цієї мети можна здійснювати модифікацію, яка попереджує 5'-фосфорилювання смислового ланцюга, наприклад, модифікацію за допомогою 5'-Oметильованого рибонуклеотиди (див. Nykanen та ін., ATP requirements and small interfering RNA structure in the RNA interference pathway, Cell 107, 2001, cc. 309-321.) Можна застосовувати також інші модифікації, що перешкоджають фосфорилюванню, наприклад, просту заміну 5'-ОН на Н, а не на О-Ме. В альтернативному варіанті можна додавати групу з великою масою до 5'-фосфату, перетворюючи його у фосфодиефірний зв'язок. Нуклеотидні основи, що не зустрічаються в природних умовах Нітропіроліл і нітроіндоліл являють собою нуклеотидні основи, що не зустрічаються в природних умовах, які є представниками класу сполук, відомих як універсальні основи. Універсальними основами є сполуки, якими можна заміняти кожну із чотирьох основ, що зустрічаються в природних умовах, без впливу на характеристики плавлення або активність олігонуклеотидного дуплексу. На відміну від стабілізуючих взаємодій на основі водневих зв'язків, асоційованих з нуклеотидними основами, що зустрічаються в природних умовах, вважається, що олігонуклеотидні дуплекси, що містять 3-нітропіроліл як нуклеотидну основу, стабілізуються тільки шляхом стекінг-взаємодій. Відсутність виражених взаємодій на основі водневих зв'язків з нітропіролілом як нуклеотидної основи усуває специфічність у відношенні конкретної комплементарної основи. Крім того, у різних дослідженнях підтверджено, що 4-, 5- і 6-нітроіндоліл характеризується дуже невеликою специфічністю у відношенні чотирьох основ, що зустрічаються в природних умовах. Важливо відзначити, що олігонуклеотидний дуплекс, що містить 5-нітроіндоліл, виявився більш стабільним, ніж відповідні олігонуклеотиди, що містять 4-нітроіндоліл і 6 29 нітроіндоліл. Процедури одержання 1-(2'-О-метил-D-рибофуранозил)-5-нітроіндолу описані в Gaubert G., Wengel J., Tetrahedron Letters 45, 2004, с. 5629. Інші універсальні основи, що підпадають під об'єм даного винаходу, включають гіпоксантиніл, ізоінозиніл, 2-азаінозиніл, 7-деазаінозиніл, нітроімідазоліл, нітропіразоліл, нітробензімідазоліл, нітроіндазоліл, аміноіндоліл, піролопіримідиніл і їх структурні похідні. Більш докладний опис, включаючи процеси синтезу, нітропіролілу, нітроіндолілу та інших згаданих вище універсальних основ див. в Vallone та ін., Nucleic Acids Research, 27(17), 1999, cc. 3589-3596; Loakes та ін., J. Mol. Bio., 270, 1997, cc. 426-436; Loakes та ін., Nucleic Acids Research, 22(20), 1994, cc. 4039-4043; Oliver та ін., Organic Letters, т. 3(13), 2001, cc. 1977-1980; Amosova та ін., Nucleic Acids Research, 25(10), 1997, cc. 1930-1934; Loakes та ін., Nucleic Acids Research, 29(12), 2001, cc. 2437-2447; Bergstrom та ін., J. Am. Chera. Soc., 117, 1995, cc. 1201-1209; Franchetti та ін.,, Biorg. Med. Chem. Lett. 11, 2001, cc. 67-69; і Nair та ін., Nucelosides, Nucleotides & Nucleic Acids, 20(4-7), 2001, cc. 735-738. Дифтортоліл являє собою нуклеотидну основу, що не зустрічається в природних умовах, яка функціонує як універсальна основа. Дифтортоліл є ізостером нуклеотидної основи тиміну, що зустрічається в природних умовах. На відміну від тиміну дифтортоліл не характеризується виборчою дією у відношенні будь-яких основ, що зустрічаються в природних умовах. Інші ароматичні сполуки, які функціонують як універсальні основи і які підпадають під об'єм даного винаходу, являють собою 4-фтор-6-метилбензімідазол і 4-метилбензімідазол. Крім того, відносно гідрофобні ізокарбостирилільні похідні 3-метилізокарбостириліл, 5метилізокарбостириліл і 3-метил-7-пропінілізокарбостириліл є універсальними основами, які викликають лише невелику дестабілізацію олігонуклеотидних дуплексів у порівнянні з олігонуклеотидною послідовністю, яка містить основи, що зустрічаються тільки в природних умовах. Інші нуклетидні основи, що не зустрічаються в природних умовах, що підпадають під об'єм даного винаходу, включають 7-азаіндоліл, 6-метил-7азаіндоліл, імідизопіридиніл, 9метилімідизопіридиніл, піролопіризиніл, ізокарбостириліл, 7-пропінілізокарбостириліл, пропініл-7азаіндоліл, 2,4,5-триметилфеніл, 4-метиліндоліл, 4,6-диметиліндоліл, феніл, нафталеніл, антраценіл, фенантраценіл, піреніл, стілбеніл, тетраценіл, пентаценіл і їх стуктурні похідні. Більш докладний опис, включаючи процеси синтезу, дифтортолілу, 4-фтор-6-метилбензімідазолу, 4метилбензімідазолу та інших згаданих вище основ, що не зустрічаються в природних умовах див. в: Schweitzer та ін., J. Org. Chem., 59, 1994, сс. 7238-7242; Berger та ін., Nucleic Acids Research, 28(15), 2000, cc. 2911-2914; Moran та ін., J. Am. Chem. Soc., 119, 1997, cc. 2056-2057; Morales та ін., J. Am. Chem. Soc., 121, 1999, cc. 2323-2324; Guckian та ін., J. Am. Chem. Soc., 118, 1996, cc. 8182-8183; Morales та ін., J. Am. Chem. Soc., 122(6), 2000, cc. 1001-1007; McMinn та ін., J. Am. Chem. Soc., 121, 1999, cc. 11585-11586; Guckian та 97521 30 ін., J. Org. Chem., 63, 1998, cc. 9652-9656; Moran та ін., Proc. Natl. Acad. Sci., 94, 1997, cc. 10506-10511; Das та ін., J. Chem. Soc., Perkin Trans., 1, 2002, cc. 197-206; Shibata та ін., J. Chem. Soc., Perkin Trans., 1, 2001, cc. 1605-1611; Wu та ін., J. Am. Chem. Soc., 122(32), 2000, cc. 7621-7632; O'Neill та ін., J. Org. Chem., 67, 2002, cc. 5869-5875; Chaudhuri та ін., J. Am. Chem. Soc., 117, 1995, cc. 10434-10442 і US №6218108. Транспорт іРНК-агентів у клітини Не вдаючись у яку-небудь теорію, вважається, що хімічна подібність між кон'югованими з холестерином іРНК-агентами та певними представниками ліпопротеїнів (наприклад, холестерин, складні холестерилові ефіри, фосфоліпіди) може приводити до асоціації іРНК-агентів з ліпопротеїнами (наприклад, ЛПНЩ, ЛПВП) у крові і/або до взаємодії іРНК-агента із клітинними компонентами, які мають афінність до холестерину, наприклад, компонентами шляху транспорту холестерину. Ліпопротеїни, а також їх складові поглинаються клітинами і процесуються за допомогою різних механізмів активного та пасивного транспорту, наприклад, але не обмежуючись тільки ними, ендоцитоз ЛПНЩ-рецептора, що зв'язує ЛПНЩ, ендоцитоз окислених або іншим способом модифікованих ЛПНЩ через взаємодію з рецептором«чистильником» А, шляхом опосередковуваного рецептором-«чистильником» В1-поглинання ЛПВП-холестерину в печінці, піноцитоз або транспорт холестерину через мембрани за допомогою білків-транспортерів ABC (АТФ-єднальна касета), наприклад, ABC-A1, ABC-G1 або ABC-G4. Таким чином, кон'юговані з холестерином іРНК-агенти можуть мати здатність ще легше проникати в клітини, які мають зазначені транспортні механізми, наприклад, клітини печінки. У цілому у даному винаході описані результати та загальні методи спрямованого переносу іРНК-агентів у клітини, що експресують певні компоненти клітинної поверхні, наприклад, рецептори, шляхом кон'югації ліганда, що зустрічається в природних умовах, такого компонента (наприклад, холестерину) з іРНК-агентом, або шляхом кон'югації хімічного залишку (наприклад, холестерину) з іРНК-агентом, що асоційований або пов'язаний з, лігандом компонента, що зустрічається в природних умовах (наприклад, ЛПНЩ, ЛПВП). Інші варіанти здійснення винаходу іРНК-агент можна одержувати в клітині in vivo, наприклад, з екзогенних ДНК-матриць, які вводять у клітину. Наприклад, ДНК-матриці можна вбудовувати у вектори і застосовувати як призначені для генної терапії вектори. Призначені для генної терапії вектори можна вводить індивідуумові, наприклад, шляхом внутрішньовенної ін'єкції, місцевого застосування (US № 5328470) або шляхом стереотактичної ін'єкції (див., наприклад, Chen та ін., Proc. Natl. Acad. Sсi. USA 91, 1994, сс. 30543057). Фармацевтичний препарат призначеного для генної терапії вектора включає вектор для генної терапії в прийнятному розріджувачі або може містити матрицю, що забезпечує вповільнене вивільнення, у яку занурений засіб для введення гена. Наприклад, ДНК-матриці можна включати у 31 дві транскрипційні одиниці, з однієї з яких одержують транскрипт, що включає верхній ланцюг іРНКагента, і з іншої одержують транскрипт, що включає нижній ланцюг іРНК-агента. При транскрипції матриць утворюється іРНК-агент і процесується з утворенням фрагментів siPHК-агента, що опосередковує «мовчання» гена. Лікарська форма Даний винахід відноситься також до фармацевтичних композицій і лікарських форм, які включають сполуки у вигляді dsPHК, запропоновані у винаході. Фармацевтичні композиції, запропоновані у даному винаході, можна вводити численними шляхами залежно від того, потрібно місцеве або системне лікування, і від області, що підлягає лікуванню. Застосування може бути місцевим, легеневим, наприклад, шляхом інгаляції або інсуфляції порошків або аерозолів, у тому числі за допомогою розпилювача; внутрішньотрахеальним, внутрішньоназальним, епідермальним і трансдермальним, оральним або парентеральним. Парентеральне введення включає внутрішньовенну, внутрішньоартеріальну, підшкірну, внутрішньочеревинну або внутрішньом'язову ін'єкцію або інфузію; або внутрішньочерепне, наприклад, підоболонкове або внутрішньошлуночкове, введення. Фармацевтичні композиції та лікарські форми для місцевого застосування можуть являти собою трансдермальні пластирі, мазі, лосьйони, креми, гелі, краплі, супозиторії, спреї, рідини та порошки. Може виявитися необхідним або бажаним використовувати загальноприйняті фармацевтичні носії, водні, порошкоподібні або олійні основи, загущувачі і т.п. Можна застосовувати також презервативи і рукавички з нанесеним покриттям і т.п. Кращими лікарськими формам для місцевого застосування є форми, у яких dsPHК, запропоновані у винаході, змішані з агентом для введення, що використовується при місцевому застосуванні, такому як ліпіди, ліпосоми, жирні кислоти, ефіри жирних кислот, стероїди, хелатуючі агенти та поверхнево-активні речовини. Кращі ліпіди і ліпосоми містять нейтральні (наприклад, диолеїлфосфатидилетаноламін (ДОФЕ), диміристоїлфосфатидилхолін (ДМФХ), дистеароїлфосфатидилхолін), негативно заряджені (наприклад, диміристоїлфосфатидилгліцерин (ДМФГ)) і катіонні (наприклад, диолеоїлтетраметиламінопропіл (ДОТАП) і диолеїлфосфатидилетаноламін (ДОТМА)), наприклад, бромід (+/-)-N-(3-амінопропіл)-N,Nдиметил-2,3-біс(додецилокси)-1-пропанамінію (GAP-DLRIE)) сполуки. DsPHК, запропоновані у винаході, можна капсуліювати у ліпосоми або можна включати в комплекс із ліпосомами, зокрема катіонними ліпосомами. В іншому варіанті dsPHК можна включати в комплекс із ліпідами, зокрема катіонними ліпідами. Кращими жирними кислотами та ефірами є, але не обмежуючись тільки ними, арахідонова кислота, олеїнова кислота, ейкозанова кислота, лауринова кислота, каприлова кислота, капринова кислота, міристинова кислота, пальмітинова кислота, стеаринова кислота, лінолева кислота, ліноленова кислота, дикапрат, трикапрат, моноолеїн, дилаурин, гліцерил-1-монокапрат, 1 97521 32 додецилазациклогептан-2-он, ацилкарнітин, ацилхолін або складний С1-С10алкіловий ефір (наприклад, ізопропілміристат (ІПМ), моногліцерид, дигліцерид або їх фармацевтично прийнятна сіль. Лікарські форми для місцевого застосування докладно описані в заявці на патент США, сер. № 09/315298, зареєстрованій 20 травня 1999 p., що повністю включена в даний опис як посилання. Композиції та лікарські форми для орального введення являють собою порошки або гранули, мікрочастинки, наночастинки, суспензії або розчини у водних або неводних середовищах, капсули, гелеві капсули, саше, таблетки або міні таблетки. Може виявитися бажаним застосовувати загущувачі, коригенти, розріджувачі, емульгатори, диспергуючі добавки або зв'язувальні речовини. Кращими оральними лікарськими формами є форми, у яких dsPHК, запропоновані у винаході, вводять у сполученні з одним або декількома речовинами, що полегшують проникнення, поверхневоактивними речовинами і хелаторами. Кращими поверхнево-активними речовинами є жирні кислоти і/або їх ефіри і солі, жовчні кислоти і/або їх солі. Кращими жовчними кислотами/солями є хенодезоксихолева кислота (ХДХК) і урсодезоксихолева кислота (УДХК), холева кислота, дегідрохолева кислота, дезоксихолева кислота, глюхолева кислота, гліхолева кислота, глікодезоксихолева кислота, таурохолева кислота, тауродезоксихолева кислота, тауро-24,25-дигідрофузидат натрію і глікодигідрофузидат натрію. Кращими жирними кислотами є арахідонова кислота, ундеканова кислота, олеїнова кислота, лауринова кислота, каприлова кислота, капринова кислота, міристинова кислота, пальмітинова кислота, стеаринова кислота, лінолева кислота, ліноленова кислота, дикапрат, трикапрат, моноолеїн, дилаурин, гліцерил-1-монокапрат, 1-додецилазациклогептан-2-он, ацилкарнітин, ацилхолін або моногліцерид, дигліцерид або їх фармацевтично прийнятна сіль (наприклад, натрієва сіль). Кращими також є комбінації речовин, що полегшують проникнення, наприклад, жирних кислот/солей у сполученні з жовчними кислотами/солями. Найкращою комбінацією є комбінація натрієвої солі лауринової кислоти, капринової кислоти та УДХК. Іншими речовинами, що полегшують проникнення, є простий поліоксиетилен-9-лауриловий ефір, простий поліоксиетилен-20-цетиловий ефір. dsPHК, запропоновані у винаході, можна вводити орально в гранульованій формі, що включає висушені розпиленням частинки, або у вигляді комплексів, що утворюють мікро- або наночастинки. Агенти, що утворюють комплекси з dsPHК, являють собою поліамінокислоти; полііміни; поліакрилати, поліалкілакрилати, поліоксиетани, поліалкілцианакрилати; катіонізовані желатини, альбуміни, крохмалі, акрилати, поліетиленгліколі (ПЕГ) і крохмалі; поліалкілцанакрилати; ДЕАЕ (диетиламіно)етилцелюлоза)-дериватизовані полііміни, полулани, целюлози і крохмалі. Найкращими комплексоутворюючими агентами є хітозан, Nтриметилхітозан, полі-L-лізин, полігістидин, поліорнітин, полісперміни, протамін, полівінілпіридин, політіодиетиламінометилетилен П(ТДАЕ), поліамі 33 ностирол (наприклад, поліаміно), полі(метилианакрилат), полі(етилцианакрилат), полі(бутилцианакрилат), полі(ізобутилцианакрилат), полі(ізогексилцианакрилат), ДЕАЕ-метакрилат, ДЕАЕ-гексилакрилат, ДЕАЕ-акриламід, ДЕАЕальбумін і ДЕАЕ-декстран, поліметилакрилат, полігексилакрилат. полі(D,L-молочна кислота), співполімер (DL-молочної та гліколевої кислоти (PLGA), альгінат і поліетиленгліколь (ПЕГ). Оральні лікарські форми dsPHК і їх одержання описано докладно в заявках на патент США сер. №. 08/886829 (зареєстрована 1 липня 1997 р.), сер. № 09/108673 (зареєстрована 1 липня 1998 р.), сер. № 09/256515 (зареєстрована 23 лютого 1999 р.), сер. № 09/082624 (зареєстрована 21 травня 1998 р.) і сер. № 09/315298 (зареєстрована 20 травня, 1999 p.), зміст кожної з яких повністю включено в даний опис як посилання. Композиції та лікарські форми для парентерального, підоболонкового або внутрішньошлуночкового введення можуть включати стерильні водяні розчини, які можуть містити також буфери, розріджувачі та інші прийнятні добавки, такі як, але не обмежуючись тільки ними, що полегшують проникнення речовини і сполуки-носії та інші фармацевтично прийнятні носії або ексципієнти. Фармацевтичні композиції, запропоновані у даному винаході, включають, але не обмежуючись тільки ними, розчини, емульсії та лікарські форми, що містять ліпосоми. Такі композиції можна створювати з різноманітних компонентів, включаючи, але не обмежуючись тільки ними, заздалегідь приготовлені рідини, тверді речовини, що самоемульгуються, і напівтверді речовини, що самоемульгуються. Фармацевтичні композиції, запропоновані у даному винаході, які може виявитися зручним приготовляти у формі стандартних доз, можна одержувати відповідно до загальноприйнятих методів, добре відомих у фармацевтичній промисловості. Такі методи включають стадію, на якій діючі речовини поєднують із фармацевтичним(і) носієм(ями) або ексципієнтом(ами). У цілому лікарські форми наготовлюють шляхом ретельного змішання до однорідного стану діючих речовин з рідкими носіями або тонкоподрібненими твердими носіями, або ними обома, і потім при необхідності додання продукту певної форми. Композиції, запропоновані у даному винаході, можна приготовляти у вигляді кожної із численних можливих форм лікарського засобу, таких як, але не обмежуючись тільки ними, таблетки, капсули, рідкі сиропи, м'які гелі, супозиторії і клізми. Композиції, запропоновані у даному винаході, можна приготовляти також у формі суспензій у водних, неводних або змішаних середовищах. Водні суспензії можуть додатково містити субстанції, що підвищують в'язкість суспензії, до них відносяться, наприклад, натрієва сіль карбоксиметилцелюлози, сорбіт і/або декстрин. Суспензії можуть містити також стабілізатори. В одному з варіантів здійснення даного винаходу фармацевтичні композиції можна приготовляти у формі пін. Фармацевтичні піни включають, але не обмежуючись тільки ними, такі лікарські 97521 34 форми, як емульсії, мікроемульсії, креми, гелі і ліпосоми. Будучи в основному подібними за своєю природою, ці лікарські форми можуть розрізнятися компонентами і консистенцією кінцевого продукту. У цілому, методи одержання таких композицій і лікарських форм відомі фахівцям в галузі фармацевтики і приготування лікарських форм, і вони можуть застосовуватися для лікарських форм, що включають композиції, запропоновані у даному винаході. Емульсії Композиції, запропоновані у даному винаході, можна приготовляти і включати в лікарські форми у вигляді емульсій. Емульсії, як правило, являють собою гетерогенні системи однієї рідини, диспергованої в іншій, у формі крапель, діамегр яких зазвичай не перевищує 0,1 мкм (Idson, в: Pharmaceutical Dosage Forms, Lieberman, за ред. Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 199; Rosoff, в Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 245; Block в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 2, 1988, с. 335; Higuchi та ін., в: Remington's Pharmaceutical Sciences, вид-во Mack Publishing Co., Easton, Pa., 1985, с. 301). Емульсії часто являють собою двофазну систему, що містить дві рідкі фази, що не змішуються, ретельно змішані та дисперговані одна в одній. Як правило, емульсії можуть являти собою або емульсії типу вода-в-олії (в/о) або типу олія-в-воді (о/в). Коли водна фаза являє собою тонкоподрібнену і дисперговану у вигляді маленьких крапельок фазу в масі олійної фази, то композицію, що утворилася, позначають як емульсія типу олія-в-воді (о/в). В альтернативному варіанті, коли олійна фаза тонко подрібнена і диспергована у вигляді маленьких крапельок у масі водної фази, то композицію, що утворилася, позначають як емульсія типу вода-волії (в/о). Емульсії можуть містити додаткові компоненти крім диспергованих фаз, і лікарська діюча речовина може бути присутня у вигляді розчину або у водній фазі, або в олійній фазі, або вона сама може бути присутня у вигляді окремої фази. Фармацевтичні ексципієнти, такі як емульгатори, стабілізатори, барвники та антиоксиданти при необхідності можуть бути присутні в емульсіях. Фармацевтичні емульсії можуть являти собою також множинні емульсії, які складаються більш ніж із двох фаз, наприклад, у випадку емульсії типу оліяу-воді-в олії (о/в/о) і вода-в-олії-у-воді (в/о/в). Зазначені складні лікарські форми часто мають перевагу у порівнянні з бінарними емульсіями. Множинні емульсії, у яких окремі олійні краплі емульсії типу о/в включені в маленькі водні краплі, являють собою емульсію типу в/о/в. Аналогічно цьому система, у якій олійні краплі включені в глобули води, стабілізовані в безперервній олійній фазі, являє собою емульсію типу о/в/о. Емульсії відрізняються невеликою термодинамічною стабільністю або в них відсутня термодинамічна стабільність. Часто диспергована або переривчаста фаза емульсії добре диспергована в 35 зовнішній або безперервній фазі і підтримується в цій формі за допомогою емульгаторів або в результаті в'язкості лікарської форми. Кожна з фаз емульсії може бути напівтвердою або твердою, як у випадку мазей, що мають емульсійну основу, і кремів. Інші шляхи стабілізації емульсій передбачають застосування емульгаторів, які можна включати в будь-яку фазу емульсії. Емульгатори в цілому можна підрозділяти на 4 категорії: синтетичні поверхнево-активні речовини, емульгатори, що зустрічаються в природних умовах, основи, що мають абсорбційні властивості, і тонкодисперговані тверді речовини (Idson в: Pharmaceutical Dosage Forms, за ред. Liebermail, Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., т. 1, 1988, с. 199). Синтетичні поверхнево-активні речовини, які позначають також як сурфактанти, знайшли широке застосування при готуванні лікарських форм у вигляді емульсій, і інформація про них узагальнена в літературі (Rieger в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger i Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 285; Idson в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 199). Поверхнево-активні речовини, як правило, є амфіфільними і містять гідрофільний та гідрофобний компонент. Співвідношення гідрофільної та гідрофобної природи поверхнево-активної речовини позначають як гідрофільно/ліпофільний баланс (ГЛБ), і він являє собою придатний засіб класифікації та відбору поверхнево-активних речовин для приготування лікарських форм. Поверхнево-активні речовини можна підрозділяти на різні класи на основі природи гідрофільної групи: неіоногенні, аніоногенні, катіоногенні та амфотерні (Rieger в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger i Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 285). Емульгатори, що зустрічаються в в природних умовах, які застосовуються в емульсійних лікарських формах, являють собою ланолін, бджолиний віск, фосфатиди (фосфоліпіди), лецитин і аравійську камедь. Основи, що мають абсорбційні властивості, мають гідрофільні властивості, завдяки чому вони можуть усмоктувати воду з утворенням емульсій типу в/о, зберігаючи при цьому їх напівтверду консистенцію, як, наприклад, у випадку безводного ланоліну і гідрофільного вазеліну. Тонкоподрібнені тверді речовини також знайшли застосування як гарні емульгатори, насамперед у сполученні з поверхнево-активними речовинами та в'язкими препаратами. Вони включають полярні неорганічні тверді речовини, такі як гідроксиди важких металів, ненабухаючі глини, такі як бентоніт, атапульгіт, гекторит, каолін, монтморілоніт, колоїдний силікат алюмінію і колоїдний силікат магнію та алюмінію, пігменти і непористі тверді речовини, такі як вуглець і гліцерилтристеарат. Широку розмаїтість матеріалів, що не емульгуються, можна включати також в емульсійні лікарські форми, і при цьому зберігати властивості емульсій. До них відносяться жири, олії, воски, жирні кислоти, жирні спирти, жирні ефіри, зволо 97521 36 жувачі, гідрофільні колоїдні сполуки, консерванти і антиоксиданти (Block в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger i Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 335; Idson в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 199). Гідрофільні колоїдні сполуки або гідроколоїди включають камеді, що зустрічаються в природних умовах, і синтетичні полімери, такі як полісахариди (наприклад, аравійська камедь, агар, альгінова кислота, карагінан, гуарова камедь, камедь карайї і трагакант), похідні целюлози (наприклад, карбоксиметилцелюлоза і карбоксипропілцелюлоза) і синтетичні полімери (наприклад, карбомери, прості ефіри целюлози і карбоксивінілові полімери). Вони диспергуються або набухають у воді з утворенням колоїдних розчинів, які стабілізують емульсії шляхом утворення стійких міжфазних мембран навколо крапель диспергованої фази і шляхом підвищення в'язкості зовнішньої фази. Такі емульсії часто містять різні інгредієнти, такі як вуглеводи, білки, стероли і фосфатиди, на яких можуть добре рости мікроби, тому в ці лікарські форми часто включають консерванти. Загальноприйняті консерванти, що входять до складу емульсійних лікарських форм, являють собою метилпарабен, пропілпарабен, четвертинні амонієві солі, бензалконію хлорид, ефіри парагідроксибензойної кислоти і борну кислоту. Як правило, в емульсійні лікарські форми додають також антиоксиданти для попередження псування лікарської форми. Застосовувані антиоксиданти можуть являти собою поглиначі вільних радикалів, такі як токофероли, алкілгалати, бутильований гідроксианізол, бутильований гідрокситолуол, або відновлювачі, такі як аскорбінова кислота і метабісульфіт натрію, а також синергісти антиоксидантів, такі як лимонна кислота, винна кислота і лецитин. Застосування емульсійних лікарських форм дерматологічним, оральним і парентеральним шляхами та методи їх одержання узагальнені в літературі (Idson в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 199). Емульсійні лікарські форми для орального введення дуже широко використовуються через простоту лікарської форми, а також ефективності з позицій абсорбції та біологічної доступності (Rosoff в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger i Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 245; Idson в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 199). Проносні засоби на основі мінеральних олій, жиророзчинні вітаміни і живильні добавки з високим вмістом жиру є прикладами речовин, які, як правило, вводять орально у вигляді емульсій типу о/в. В одному з варіантів здійснення даного винаходу композиції dsPHК і нуклеїнових кислот мають форму мікроемульсій. Мікроемульсію можна визначити як систему, що містить воду, олію та амфіфільну сполуку, яка являє собою єдиний оптично ізотропний і термодинамічно стабільний рідкий 37 розчин (Rosoff, in Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger i Banker, 1988, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, с. 245). Типові мікроемульсії являють собою системи, для приготування яких спочатку одержують дисперсію олії у водяному розчині поверхнево-активної речовини, а потім додають у достатній кількості четвертий компонент, як правило, спирт із середньою довжиною ланцюга, з одержанням прозорої системи. Таким чином, мікроемульсії позначають також як термодинамічно стабільні, ізотропічно прозорі дисперсії двох рідин, що не змішуються, які стабілізовані міжфазними мембранами з активних молекул (Leung і Shah в: Controlled Release of Drugs: Polymers and Aggregate Systems, за ред. Rosoff Μ., вид-во VCH Publishers, New York, 1989, cc. 185-215). Мікроемульсії, як правило, приготовляють із використанням комбінації від трьох до п'яти компонентів, які включають олію, воду, поверхнево-активну речовину, косурфактант і електроліт. При цьому, мікроемульсія відноситься до типу вода-в-олії (в/о) або олія-в-воді (о/в) залежно від властивостей олії, що застосовується, і поверхнево-активної речовини і структури і геометричного упакування полярних «голів» і вуглеводних «хвостів» молекул поверхнево-активної речовини (Schott, в: Remington's Pharmaceutical Sciences, вид-во Mack Publishing Co., Easton, Pa., 1985, с. 271). Феноменологічний підхід, заснований на використанні фазових діаграм, широко застосовувався і дозволив фахівцям у даній галузі одержати вичерпні дані про те, як приготовляти мікроемульсії (Rosoff в: Pharmaceutical Dosage Forms, за ред. Liеberman, Rieger i Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 245; Block в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger і Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 335). У порівнянні із традиційними емульсіями мікроемульсії мають перевагу з погляду солюбілізації нерозчинних у воді лікарських засобів у препаративній формі у вигляді термодинамічно стабільних крапель, які утворюються спонтанно. Поверхнево-активні речовини, що застосовуються для одержання мікроемульсій, включають, але не обмежуючись тільки ними, іоногенні поверхнево-активні речовини, неіоногенні поверхневоактивні речовини, Brij 96, прості олеїлові ефіри поліоксиетилену, ефіри жирних кислот і полігліцерину, тетрагліцеринмонолаурат (ML310), тетрагліцеринмоноолеат (МО310), гексагліцеринмоноолеат (РОЗ 10), гексагліцеринпентаолеат (РО500), декагліцеринмонокапрат (МСА750), декагліцеринмоноолеат (МО750), декагліцеринсеквіолеат (SO750), декагліцериндекаолеат (DAO750), індивідуально або у сполученні з косурфактантами. Косурфактанти, як правило, являють собою спирт із коротким ланцюгом, такий як етанол, 1-пропанол і 1-бутанол, що служить для підвищення міжфазної плинності в результаті проникнення в мембрану з поверхнево-активної речовини і наступного одержання порушеної мембрани через вільний простір, що утворився між молекулами поверхневоактивної речовини. Однак мікроемульсії можна 97521 38 одержувати без застосування косурфактантів, і мікроемульсійні системи, що саморегулюються і не містять спирт, відомі в даній галузі. Водна фаза, як правило, але не обмежуючись тільки ними, може являти собою воду, водяний розчин лікарського засобу, гліцерин, ПЕГ300, ПЕГ400, полігліцерини, пропіленгліколі і похідні етиленгліколя. Олійна фаза може включати, але не обмежуючись тільки ними, такі речовини як Captex 300, Captex 355, Capmul MCM, ефіри жирних кислот, моно-, диі тригліцериди із середньою довжиною ланцюга (C8-C12), поліоксиетильовані гліцерилові ефіри жирних кислот, жирні спирти, полігліколізовані гліцериди, насичені полігліколізовані C 8С10гліцериди, рослинні олії та силіконова олія. Мікроемульсії становлять найбільший інтерес із позицій солюбілізації лікарських засобів і підвищення абсорбції лікарських засобів. Для підвищення біологічної доступності оральних лікарських засобів, включаючи пептиди, запропоновані мікроемульсії, що мають ліпідну основу (як типу о/в, так і типу в/о) (Constantinides та ін., Pharmaceutical Research, 11, 1994, сс. 1385-1390; Ritschel, Meth. Find. Exp. Clin. Pharmacol., 13, 1993, с. 205). Перевагами мікроемульсій є підвищена солюбілізація лікарського засобу, захист лікарського засобу від ферментативного гідролізу, можливе підвищення абсорбції лікарського засобу, пов'язане з індуційованими поверхнево-активною речовиною змінам плинності і проникності мембран, простота приготування, простота орального введення у порівнянні із твердими лікарськими формами, підвищена клінічна ефективність і знижена токсичність (Constantinides та ін., Pharmaceutical Research, 11, 1994, с.1385; Но та ін., J. Pharm. Sсi., 85, 1996, сс. 138-143). Часто мікроемульсії можуть утворюватися спонтанно при приведенні їх компонентів у контакт при температурі навколишнього середовища. Це може мати перевагу насамперед при готуванні форм термолабільних лікарських засобів, пептидів або dsPHК. Мікроемульсії мають ефективність також при трансдермальному введенні діючих речовин, що слугують як для косметичного, так і фармацевтичного застосування. Імовірно, що мікроемульсійні композиції і лікарські форми, запропоновані у даному винаході, повинні полегшувати підвищену системну абсорбцію dsPHК і нуклеїнових кислот зі шлунково-кишкового тракту, а також поліпшувати місцеве клітинне поглинання dsPHК і нуклеїнових кислот у шлунково-кишковому тракті, піхві, присінок рота та інших областей введення. Мікроемульсії, запропоновані у даному винаході, можуть містити додаткові компоненти і добавки, такі як сорбітанмоностеарат (Grill 3), Labrasol і речовин, що полегшують проникнення, призначені для поліпшення властивостей лікарської форми і підвищення абсорбції dsPHК і нуклеїнових кислот, запропонованих у даному винаході. Речовин, що полегшують проникнення, які застосовуються в мікроемульсіях, запропонованих у даному винаході, можна класифікувати, відносячи їх до однієї з п'яти широких категорій, що включають поверхнево-активні речовини, жирні кислоти, жовчні кислоти, хелатуючі агенти і нехелатуючі речовини, які не 39 відносяться до поверхнево-активних речовин (Lee та ін., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, с. 92). Кожний із цих класів описаний вище. Ліпосоми Крім мікроемульсій відомо багато організованих структур поверхнево-активних речовин, які вивчені і застосовуються в препаративних формах лікарських засобів. До них відносяться моношари, міцелі, бішари і пухирці. Пухирці, такі як ліпосоми, привертають велику увагу через їх специфічність і тривалість дії при використанні для введення лікарських засобів. У контексті даного винаходу поняття «ліпосоми» відноситься до пухирця, що складається з амфіфільних ліпідів, організованих у вигляді сферичного(их) бішару або бішарів. Ліпосоми являють собою одношарові або багатошарові пухирці, які мають мембрану, що складається з ліпофільної речовини і водного внутрішнього вмісту. Водний компонент містить композицію, що підлягає введенню. Перевагою катіонних ліпосом є їх здатність зливатися із клітинною оболонкою. Хоча некатіонні ліпосоми не мають такої ж здатності ефективно зливатися із клітинною мембраною, вони поглинаються макрофагами in vivo. Для проникнення крізь неушкоджену шкіру ссавців ліпідні пухирці повинні проникати через серії дрібних пор, кожна діаметром менше 50 нм, під впливом відповідного трансдермального градієнта. Таким чином, бажано застосовувати ліпосому, що може легко деморфуватися і має здатність проникати через зазначені дрібні пори. Інші переваги ліпосом полягають у наступному: ліпосоми, утворені з фосфоліпідів, що зустрічаються в природних умовах, є біосумісними і такими, що біорозкладаються; ліпосоми можуть включати широку розмаїтість розчинних у воді і ліпідах лікарських засобів; ліпосоми можуть захищати капсульовані лікарські засоби, які перебувають у їх внутрішніх компартментах, від метаболізму і розщеплення (Rosoff в: Pharmaceutical Dosage Forms, за ред. Lieberman, Rieger i Banker, вид-во Marcel Dekker, Inc., New York, N.Y., том 1, 1988, с. 245). Важливими факторами, які варто враховувати при готуванні лікарських форм у вигляді ліпосом, є поверхневий заряд ліпіду, розмір пухирця і об'єм водної фракції ліпосом. Ліпосоми застосовують для переносу і введення діючих речовин до місця дії. Оскільки ліпосомна мембрана близька за структурою біологічним мембранам, то коли ліпосоми наносять на тканину, ліпосоми починають зливатися із клітинними мембранами і у міру збільшення злиття ліпосом і клітин вміст ліпосом переходить у клітину, у якій може проявляти активність діюча речовина. Основні дослідження лікарських форм у вигляді ліпосом були сфокусовані на можливості їх застосування як пристрою, призначеного для введення багатьох лікарських засобів. Збільшується кількість даних про те, що при місцевому застосуванні ліпосоми мають кілька переваг у порівнянні з іншими лікарськими формами. Такими перевагами є зниження побічних дій, пов'язаних з високою системною абсорбцією лікарського засобу, що вво 97521 40 диться, підвищення нагромадження лікарського засобу, що вводиться, у необхідній мішені і можливість їх застосування для введення широкої розмаїтості лікарських засобів, як гідрофільних, так і гідрофобних, у шкіру. У деяких дослідженнях деталізована можливість застосування ліпосом для введення високомолекулярної ДНК у шкіру. Введення таких сполук, як анальгетики, антитіла, гормони і високомолекулярні ДНК здійснюють у шкіру. У більшості випадків застосування приводить до спрямованого переносу у верхній шар епідермісу. Ліпосоми підрозділяють на два великих класи. Катіонні ліпосоми являють собою позитивно заряджені ліпосоми, які взаємодіють із негативно зарядженими молекулами ДНК із утворенням стабільного комплексу. Позитивно заряджений комплекс ДНК/ліпосома зв'язується з негативно зарядженою клітинною поверхнею і інтерналізується в ендосому. Через кисле значення pH в ендосомі ліпосоми руйнуються з вивільненням їх вмісту в клітинну цитоплазму (Wang та ін., Biochem. Biophys. Res. Commun., 147, 1987, сс. 980-985). Ліпосоми, які є чутливими до значення pH або негативно зарядженими, скоріше вловлюють ДНК, ніж утворять із нею комплекс. Оскільки ДНК і ліпід заряджені однаково, то скоріше має місце відштовхування, ніж формування комплексу. Однак деякі ДНК уловлюються водним внутрішнім вмістом цих ліпосом. Чутливі до значення pH ліпосоми використовували для введення ДНК, що кодують ген тимідинкінази, у клітинні моношари в культурі. У клітинах-мішенях була виявлена експресія екзогенного гена (Zhou та ін., Journal of Controlled Release, 19, 1992, сс. 269-274). Один з основних типів композиції ліпосом включає фосфоліпіди, відмінні від тих, що зустрічаються в природних умовах, виведених з фосфатидилхоліну. Нейтральні композиції ліпосом, наприклад, можна одержувати з диміристоїлфосфатидилхоліну (ДМФХ) або дипальмітоїлфосфатидилхоліну (ДПФХ). Аніонні композиції ліпосом, як правило, одержують із диміристоїлфосфатидилгліцерину, а аніонні фузогенні ліпосоми одержують насамперед з диолеоїлфосфатидилетаноламіну (ДОФЕ). Інший тип композицій ліпосом одержують із фосфатидилхоліну (ФХ), наприклад, ФХ із сої і ФХ із яєць. Ще один тип одержують із сумішей фосфоліпідів і/або фосфатидилхоліпу і/або холестерину. У декількох дослідженнях вивчене місцеве введення лікарських засобів у препаративних формах у вигляді ліпосом у шкіру. Нанесення ліпосом, що містять інтерферон, на шкіру морських свинок приводило до зниження шкірного герпеса, у той час як введення інтерферону за допомогою інших форм (наприклад, у вигляді розчину або емульсії) виявилося неефективним (Weiner та ін., Journal of Drug Targeting, 2, 1992, сс. 405-410). Крім того, в іншому досвіді оцінювали ефективність інтерферону, що вводиться як компонент лікарської форми у вигляді ліпосом, із введенням інтерферону з використанням водної системи і було встановлено, що лікарська форма у вигляді ліпосом перевершувала за ефективністю введен 41 ня форми у вигляді водної системи (du Plessis та ін., Antiviral Research, 18, 1992, сс. 259-265). Неіонні ліпосомні системи оцінювали також відносно можливості їх використання для введення лікарських засобів у шкіру, зокрема в системах, що містять неіоногенну поверхнево-активну речовину і холестерин. Лікарські форми у вигляді неіоннних ліпосом, що містять Novasome™ (гліцерилдилаурат/холестерин/поліоксиетилен-10-стеариловий ефір) і Novasome™ (гліцерилдистеарат/холестсрин/поліоксиетилен-10-стеариловий ефір), використовували для введення циклоспорину А у дерму мишачої шкіри. Результати свідчать про те, що такі неіонні ліпосомні системи мали ефективність відносно полегшення депонування циклоспорину А у різні шари шкіри (Hu та ін., S.T.P.Pharma. Sсi., 4, 6, 1994, с. 466). Ліпосоми включають також «стерично стабілізовані» ліпосоми, що в контексті даного опису відноситься до ліпосомам, які містять один або кілька спеціалізованих ліпідів, які при включенні в ліпосоми приводять до подовження часу життя в кровотоці у порівнянні з ліпосомами, у яких відсутні такі спеціалізовані ліпіди. Прикладами стерично стабілізованих ліпосом є ліпосоми, у яких частина ліпідної фракції ліпосоми (А), що утворює пухирець, містить один або декілька гліколіпідів, таких як моносиалогангліозид Gm1, або (Б) дериватизований одним або декількома гідрофільними полімерами, такими як поліетиленглікольний (ПЕГ) залишок. Не вдаючись у яку-небудь конкретну теорію, у даній галузі вважається, що щонайменше у випадку стерично стабілізованих ліпосом, що містять гангліозиди, сфінгомієлін або дериватизовані ПЕГ ліпіди, подовжений час життя в кровотоці цих стерично стабілізованих ліпосом обумовлено зниженим поглинанням у клітини ретикулоендотеліальної системи (PEC) (Allen та ін., FEBS Letters, 223, 1987, с. 42; Wu та ін., Cancer Research, 53, 1993, с. 3765). У даній галузі відомі різні ліпосоми, що містять один або декілька гліколіпідів. Papahadjopoulos зі співавторами (Ann. N.Y. Acad. Sсi., 507, 1987, с. 64) описали здатність моносиалогангліозиду Gm1, галактоцереброзидсульфату і фосфатидилінозиту підвищувати час напівжиття в крові ліпосом. Ці результати підтверджені даними, отриманими Gabizon зі співавторами (Proc. Natl. Acad. Sсi. U.S.A., 85, 1988, с. 6949). В US № 4837028 і WO 88/04924, обоє на ім'я Allen зі співавторами, описані ліпосоми, що містять (1) сфінгомієлін і (2) гангліозид Gm1 або ефір галактоцереброзидсульфату. В US № 5543152 (на ім'я Webb зі співавторами) описані ліпосоми, що містять сфінгомієлін. Ліпосоми, що містять 1,2-snдиміристоїлфосфатидилхолін, описані в WO 97/13499 (на ім'я Lim зі співавторами). Ряд ліпосом, що містять ліпіди, дериватизовані одним або декількома гідрофільними полімерами, і методи їх одержання описані в даній галузі. Sunamoto зі співавторами (Bull. Chem. Soc. Jpn., 53, 1980, с. 2778) описали ліпосоми, що містять неіоногенний детергент, 2C1215G, який містить залишок ПЕГ. Illum зі співавторами (FEBS Lett., 167, 1984, с. 79) установили, що гідрофільне покриття 97521 42 полістирольних часток полімерними гліколями приводить до істотного подовження часу напівжиття в крові. Синтетичні фосфоліпіди, модифіковані приєднанням карбоксильних груп поліалкіленгліколей (наприклад, ПЕГ), описані в Sears (US №№ 4426330 і 4534899). Klibanov зі співавторами (FEBS Lett., 268, 1990, с. 235) описали експерименти, що демонструють, що ліпосоми, які містять фосфатидилетаноламін (ФЕ), дериватизований ПЕГ або стеаратом ПЕГ, відрізнялися істотно більш тривалим часом напівжиття в кровотоці. Blume зі співавторами (Biochimica et Biophysica Acta, 1029, 1990, с. 91) підтвердили зазначені дані на інших дериватизованих ПЕГ фосфоліпідах, наприклад, DSPE-ΠΕΓ, отриманих з комбінації дистерароїлфосфатидилетаноламіну (DSPE) і ПЕГ. Ліпосоми, що мають ковалентно зв'язані залишки ПЕГ на їх зовнішній поверхні, описані в європейському патенті № ЕР 0445131В1 і WO 90/04384 на ім'я Fisher. Композиції ліпосом, що містять 1-20 мол.% ФЕ, дериватизованого ПЕГ, і методи їх застосування описані в Woodle зі співавторами (US №№ 5013556 і 5356633) і в Martin зі співавторами (US № 5213804 і в європейському патенті № ЕР 0496813В1). Ліпосоми, що містять ряд інших кон'югатів ліпід-полімер, описані в WO 91/05545 і US № 5225212 (обоє на ім'я Martin зі співавторами) і в WO 94/20073 (на ім'я Zalipsky зі співавторами). Ліпосоми, що містять модифіковані ПЕГ такі ліпіди, як цераміди, описані в WO 96/10391 (на ім'я Choi зі співавторами). В US № 5540935 (на ім'я Miyazaki зі співавторами) і US № 5556948 (на ім'я Tagawa зі співавторами) описані ліпосоми, що містять ПЕГ, які можна додатково дериватизувати за допомогою функціональних фрагментів на їх поверхні. У даній галузі відома обмежена кількість ліпосом, що містять нуклеїнові кислоти. В WO 96/40062 на ім'я Thierry зі співавторами описані методи капсулювання високомолекулярних нуклеїнових кислот у ліпосоми. В US № 5264221 на ім'я Tagawa зі співавторами описані пов'язані з білками ліпосоми і заявлено, що до складу таких ліпосом може входити dsPHК. В US № 5665710 на ім'я Rahman зі співавторами описані конкретні методи капсулювання олігодезоксинуклеотидів у ліпосоми. В WO 97/04787 на ім'я Love зі співавторами описані ліпосоми, що містять dsPHК, мішенню яких є ген raf. Трансферсоми являють собою ще один тип ліпосом, і вони являють собою ліпідні агрегати, що легко піддаються деформації, які є перспективними кандидатами як носії для введення лікарських засобів. Трансферсоми можна охарактеризувати як ліпідні краплі, які настільки легко піддаються деформації, що вони можуть легко проникати через пори, які є занадто малими для краплі. Трансферсоми можна адаптувати до навколишнього середовища, у якому їх використовують, наприклад, вони мають здатність до самооптимізації (адаптуватися до форми пор у шкірі), саморепарації, часто досягають їх мішеней без фрагментації, і часто мають здатність до самозавантаження. Для одержання трансферсом можна додавати активатори, що діють на крайці поверхні, як правило, поверхнево-активні речовини, у стандартну компо 43 зицію ліпосоми. Трансферсоми застосовували для введення сироваткового альбуміну в шкіру. Встановлено, що опосередковане трансферсомою введення сироваткового альбуміну було настільки ж ефективним, як і введення шляхом підшкірної ін'єкції розчину, що містить сироватковий альбумін. Поверхнево-активні речовини знайшли широке застосування в лікарських формах, таких як емульсії (включаючи мікроемульсії) і ліпосоми. Найбільш загальним шляхом класифікації і ранжування властивостей багатьох різних типів поверхневоактивних речовин, як таких, що зустрічаються в природних умовах, так і синтетичних, є застосування гідрофільно/ліпофільного балансу (ГЛБ). Природа гідрофільної групи (яку називають також «голова») є найбільш важливою характеристикою при класифікації різних поверхнево-активних речовин, що застосовують у лікарських формах (Rieger в: Pharmaceutical Dosage Forms, вид-во Marcel Dekker, Inc., New York, N.Y., 1988, с. 285). Якщо молекула поверхнево-активної речовини не іонізована, то її класифікують як неіоногенну поверхнево-активну речовину. Неіоногенні поверхнево-активні речовини знайшли широке застосування у фармацевтичних і косметичних продуктах і їх використовують у широкому діапазоні значень pH. У цілому, значення їх ГЛБ становлять від 2 до приблизно 18 залежно від їх структури. Неіоногенні поверхнево-активні речовини включають неіонні складні ефіри, такі як складні ефіри етиленгліколя, складні ефіри пропіленгліколя, складні гліцерилові ефіри, складні полігліцерилові ефіри, складні сорбітанові ефіри, складні ефіри сахарози і складні етоксильовані ефіри. Неіонні алканоламіди і прості ефіри, такі як етоксилати жирних спиртів, пропоксильованні спирти і етоксильовані/пропоксильовані блокспівполімери також відносяться до цього класу. Поліоксиетиленові поверхнево-активні речовини є найбільш популярними із класу неіоногенних поверхнево-активних речовин. Якщо молекула поверхнево-активної речовини несе негативний заряд, коли вона розчинена або диспергована у воді, то поверхнево-активну речовину класифікують як аніоногенну. Аніоногенні поверхнево-активні речовини включають карбоксилати, такі як мила, ациллактилати, ациламіди амінокислот, ефіри сірчаної кислоти, такі як алкілсульфати і етоксильовані алкілсульфати, сульфонати, такі як алкілбензолсульфонати, ацилизетіонати, ацилтаурати і сульфосукцинати, і фосфати. Найбільш важливими представниками класу аніоногенних поверхнево-активних речовин є алкілсульфати і мила. Якщо молекула поверхнево-активної речовини несе позитивний заряд, коли вона розчинена або диспергована у воді, то поверхнево-активну речовину класифікують як катіоногенну. Катіоногенні поверхнево-активні речовини включають четвертинні солі амонію і етоксильовані аміни. Четвертинні солі амонію є представниками цього класу, що найбільш широко застосовуються. Якщо молекула поверхнево-активної речовини має здатність нести або позитивний, або негатив 97521 44 ний заряд, то поверхнево-активну речовину класифікують як амфотерну. Амфотерні поверхневоактивні речовини включають похідні акрилової кислоти, заміщені алкіламіди, N-алкілбетаїни і фосфатиди. Застосування поверхнево-активних речовин у лікарських продуктах, лікарських формах і в емульсіях узагальнене в Rieger в: Pharmaceutical Dosage Forms, вид-во Marcel Dekker, Inc., New York, N.Y., 1988, с. 285). Речовини, що полегшують проникнення (енхансери) В одному з варіантів здійснення даного винаходу застосовують різні речовини, що полегшують проникнення, для забезпечення ефективного введення нуклеїнових кислот, зокрема dsPHК, у шкіру тварин. Більшість лікарських засобів присутні в розчині як в іонізованій, так і в неіонізованій формі. Однак, як правило, тільки розчинні в ліпідах або ліпофільні лікарські засоби легко проникають через клітинні мембрани. Описано, що навіть неліпофільні лікарські засоби можуть проходити через клітинні мембрани, якщо мембрана, через яку потрібно проникати, оброблена речовиною, що полегшує проникнення. Крім полегшення дифузії неліпофільних лікарських засобів через клітинні мембрани, речовини, що полегшують проникнення, підвищують також здатність до проникнення ліпофільних лікарських засобів. Речовини, що полегшують проникнення, можна класифікувати за їх приналежності до однієї з п'яти великих категорій, тобто поверхнево-активні речовини, жирні кислоти, жовчні солі, хелатуючі агенти і нехелатуючі речовини, що є поверхневоактивними речовинами (Lee та ін., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, с. 92). Кожний із зазначених вище класів речовин, що полегшують проникнення, більш докладно описаний нижче. Поверхнево-активні речовини: У контексті даного винаходу поверхнево-активні речовини (або «сурфактанти») являють собою хімічні субстанції, які при їх розчиненні у водяному розчині знижують поверхневий натяг розчину або міжфазне натягнення між водяним розчином та іншою рідиною, що приводить до того, що підвищується абсорбція dsPHК через слизову оболонку. Крім жовчних солей і жирних кислот, ці речовини, що полегшують проникнення, включають, наприклад, лаурилсульфат натрію, простий поліоксиетилен-9-лауриловий ефір і простий поліоксиетилен-20-цетиловий ефір) (Lee та ін., Critical Reviews in Therapeutic Drag Carrier Systems, 1991, с. 92); і перфторхімічні емульсії, такі як FC-43 (Takahashi та ін., J. Pharm. Pharmacol., 40, 1988, с. 252). Жирні кислоти: Різні жирні кислоти і їх похідні, які діють як речовини, що полегшують проникнення, включають, наприклад, олеїнову кислоту, лауринову кислоту, капринову кислоту (н-деканова кислота), міристинову кислоту, пальмітинову кислоту, стеаринову кислоту, лінолеву кислоту, ліноленову кислоту, дикапрат, трикапрат, моноолеїн (1-моноолеоїл-рац-гліцерин), дилаурин, каприлову кислоту, арахідонову кислоту, гліцерин-1монокапрат, 1-додецилазациклогептан-2-он, ацил 45 карнітини, ацилхоліни, їх С1-С10алкілові ефіри (наприклад, метиловий, ізопопропіловий і третбутиловий) і їх моно- і дигліцериди (тобто олеат, лаурат, капрат, міристат, пальмітат, стеарат, лінолеат та ін.) (Lee та ін., Critical Reviews in Therapeutic Drug Carryier Systems, 1991, с. 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 7, 1990, cc. 1-33; E1 Hariri та ін., J. Pharm. Pharmacol., 44, 1992, cc. 651-654). Жовчні солі: Фізіологічна роль жовчі включає полегшення дисперсії і абсорбції ліпідів і жиророзчинних вітамінів (Brunton, глава 38 в: Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9-е вид., за ред. Hardman та ін., вид-во McGrawHill, New York, 1996, cc. 934-935). Різні жовчні солі, що зустрічається в природних умовах, і їх синтетичні похідні діють як речовини, що полегшують проникнення. Таким чином, поняття «жовчні солі» відноситься до будь-яких компонентів жовчі, що зустрічаються в природних умовах, а також до їх будь-яких синтетичних похідних. Жовчні солі, запропоновані у винаході, включають, наприклад, холеву кислоту (або її фармацевтично прийнятну натрієву сіль, холат натрію), дегідрохолеву кислоту (дегідрохолат натрію), дезоксихолеву кислоту (дезоксихолат натрію), глюхолеву кислоту (глюхолат натрію), гліхолеву кислоту (глікохолат натрію), глікодезоксихолеву кислоту (глікодезоксихолат натрію), таурохолеву кислоту (таурохолат натрію), тауродезоксихолеву кислоту (тауродезоксихолат натрію), хенодезоксихолеву кислоту (хенодезоксихолат натрію), урсодезоксихолеву кислоту (УДХК), тауро-24, 25-дигідрофузидат натрію (STDHF), глікодигідрофузидат натрію і простий поліоксиетилен-9-лауриловий ефір (POE) (Lee та ін., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, с. 92; Swinyard, глава 39 в: Remington's Pharmaceutical Sciences, 18-е вид., за ред. Gennaro та ін., вид-во Mack Publishing Co., Easton, Pa., 1990, cc. 782-783; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 7, 1990, cc. 1-33; Yamamoto та ін., J. Pharm. Exp. Ther., 263, 1992, с. 25; Yamashita та ін., J. Pharm. Sсi., 79, 1990, cc. 579-583). Хелатуючі агенти: Поняття «хелатуючі агенти» у контексті даного винаходу відноситься до сполук, які видаляють іони металів з розчину шляхом утворення комплексів з ними, у результаті абсорбція dsPHК через слизову оболонку зростає. Відносно їх застосування як речовини, що полегшують проникнення, запропонованого у даному винаході, хелатуючі агенти мають додаткову перевагу, оскільки служать також як інгібітори ДНКаз, оскільки для більшості охарактеризованих ДНК-нуклеаз потрібен іон двовалентного металу для каталізу, і тому вони інгібуються хелатуючими агентами (Jarrett J. Chromatogr., 618, 1993, cc. 315-339). Хелатуючі агенти, запропоновані у винаході, включають, але не обмежуючись тільки ними, динатрійетилендиамінтетраацетат (ЕДТА), лимонну кислоту, саліцилати (наприклад, саліцилат, 5метоксисаліцилат і гомованілат натрію), N-ацильні похідні колагену, лаурет-9- і N-аміноацетильні похідні бета-дикетонів (енаміни) (Lee та ін., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, 97521 46 с. 92; Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 7, 1990, cc. 1-33; Buur та ін., J. Control Rel., 14, 1990, cc. 43-51). Нехелатуючі речовини, що не є поверхневоактивними речовинами: У контексті даного опису до нехелатуючих речовин, що не є поверхневоактивними речовинами, які полегшують проникнення, відносяться сполуки, для яких не характерна помітна активність у якості хелатуючих агентів або поверхнево-активних речовин, але які, проте, підвищують абсорбцію dsPHК через аліментарну слизову оболонку (Muranishi, Critical Reviews in Therapeutic Drug Carrier Systems, 7, 1990, cc. 1-33). Цей клас речовин, що полегшують проникнення, включає, наприклад, ненасичені циклічні сечовини, 1-алкіл- і 1-алкенілазациклоалканонові похідні (Lee та ін., Critical Reviews in Therapeutic Drug Carrier Systems, 1991, с. 92); і нестероїдні протизапальні засоби, такі як натрію диклофенак, індометацин і фенілбутазон (Yamashita та ін., J. Pharm. Pharmacol., 39, 1987, cc. 621-626). Агенти, які підвищують поглинання dsPHК на клітинному рівні, можна додавати також у фармацевтичні та інші композиції, запропоновані у даному винаході. Наприклад, відомо також, що катіонні ліпіди, такі як ліпофектин (US № 5705188, на ім'я Junichi та ін.), катіонні гліцеринові похідні і полікатіонні молекули, такі як полілізин (Lollo та ін., заявка РСТ A WO 97/30731), та інші пептиди можуть підвищувати клітинне поглинання dsPHК. Для полегшення проникнення нуклеїнових кислот, що вводяться, можна застосовувати також інші агенти, такі як гліколі, наприклад, етиленгліколь і пропіленгліколь, піроли, такі як 2-пірол, азони і терпени, такі як лімонен і ментон. Носії До складу певних лікарських форм, запропонованих у даному винаході, можуть входити також сполуки-носії. У контексті даного опису «сполуканосій» або «носій» відноситься до нуклеїнової кислоти або її аналогу, який є інертним (тобто не має ніякої біологічної активності per se), але розпізнається як нуклеїнова кислота за допомогою процесів in vivo, які знижують біологічну доступність нуклеїнових кислот, що мають біологічну активність, за допомогою, наприклад, розщеплення біологічно активної нуклеїнової кислоти або прискорення її видалення із кровотоку. Спільне введення нуклеїнової кислоти і сполуки-носія, як правило, при надлишку останньої субстанції, може приводити до значного зниження кількості нуклеїнових кислот, регенерованих у печінці, нирці або інших резервуарах, що перебувають поза кровотоком, імовірно, через конкуренцію між сполукою-носієм і нуклеїновою кислотою за загальний рецептор. Наприклад, регенерація частково фосфоротіоатированою dsPHК у тканинах печінки може знижуватися при її спільному введенні з поліінозиновою кислотою, сульфатом декстрану, поліцитидиловою кислотою або 4-ацетоамідо-4'-ізотіоціанстілбен 2,2'-дисульфоновою кислотою (Міуао та ін., Antisensc Res. Dеv., 5, 1995, сс. 115-121; Takakura та ін., Antisense & Nuc1. Acid Drug Dev., 6, 1996, cc. 177-183. Ексципієнти 47 На відміну від сполуки-носія «фармацевтичний носій» або «ексципієнт» являє собою фармацевтично прийнятний розчинник, суспендуючий агент або будь-який інший фармакологічно інертний наповнювач, призначений для введення однієї або декількох нуклеїнових кислот тварині. Ексципієнт може бути рідким або твердим, і його можна вибирати з урахуванням передбачуваного шляху введення так, щоб забезпечувати необхідний об'єм, консистенцію і т.д. при об'єднанні з нуклеїновою кислотою та іншими компонентами даної фармацевтичної композиції. До типових фармацевтично прийнятних носіїв відносяться, наприклад, але не обмежуючись тільки ними, зв'язувальні речовини (наприклад, прежелатизований кукурудзяний крохмаль, полівінілпіролідон або гідроксипропілметилцелюлоза); наповнювачі (наприклад, лактоза та інші цукри, мікрокристалічна целюлоза, пектин, желатин, сульфат кальцію, етилцелюлоза, поліакрилати або вторинний кислий фосфат кальцію і т.д.); любріканти (наприклад, стеарат магнію, тальк, кремнезем, колоїдний діоксид кремнію, стеаринова кислота, стеарати металів, гідрогенізовані рослинні олії, кукурудзяний крохмаль поліетиленгліколі, бензоат натрію, ацетат натрію і т.д.); розпушувачі (наприклад, крохмаль, натрійгліколят крохмалю і т.д.) і змочувальні агенти (наприклад, лаурилсульфат натрію і т.д.). Фармацевтично прийнятні органічні або неорганічні ексципієнти, придатні для непарентерального введення, які не впливають на нуклеїнові кислоти, можна застосовувати також для приготування композицій, запропонованих у даному винаході. Прийнятними фармацевтичними носіями є, але не обмежуючись тільки ними, вода, сольові розчини, спирти, поліетиленгліколі, желатин, лактоза, амілоза, стеарат магнію, тальк, кремінна кислота, вазелінова олія, гідроксиметилцелюлоза, полівінілпіродидон і т.п. Лікарські форми, призначені для місцевого застосування нуклеїнових кислот, можуть включати стерильні і нестерильні водяні розчини, неводні розчини у звичайних розчинниках, таких як спирти, або розчини нуклеїнових кислот у рідкій або твердій олійній основах. Розчини можуть містити також буфери, розріджувачі та інші прийнятні добавки. Можна застосовувати фармацевтично прийнятні органічні або неорганічні сксципієнти, придатні для непарентерального застосування, які не чинять несприятливий вплив на нуклеїнові кислоти. Придатні фармацевтично прийнятні ексципієнти включають, але не обмежуючись тільки ними, воду, сольові розчини, спирти, поліетиленгліколі, желатин, лактозу, амілозу, стеарат магнію, тальк, кремінну кислоту, вазелінову олію, гідроксиметилцелюлозу, полівінілпіродидон і т.п. Фармацевтичні композиції, призначені для введення в дихальні шляхи Іншим об'єктом винаходу є введення іРНКагентів у дихальні шляхи, насамперед для лікування муковісцидозу. Дихальні шляхи включають верхні дихальні шляхи, включаючи ротову частину глотки і гортань, розташовані за ними нижні дихальні шляхи, включаючи трахеї, які роздвоюючись переходять у бронхи і бронхіоли. Верхній відділ 97521 48 нижніх дихальних шляхів називають провідними дихальними шляхами. Кінцеві бронхіоли далі розділяються на дихальні бронхіоли, утворюючи в результаті дихальну зону, альвеоли, або глибоко розташовані відділи легені. Епітелій провідних шляхів є первинною мішенню інгаляційної терапії з використанням аерозолів, призначених для введення іРНК-агентів, таких як іРНК-агенти, мішенню яких є альфа-ЕnаС. Призначені для легеневого застосування композиції можна вводити пацієнтові шляхом інгаляції дисперсії так, щоб композиція, краще іРНК-агент, у дисперсії могла досягати легені, де вона може, наприклад, легко абсорбуватися через альвеолярну область безпосередньо в кровоток. Легеневе введення може бути ефективним шляхом як системного введення, так і місцевого застосування для лікування хвороб легенів. Для легеневого введення можна застосовувати різні підходи, включаючи застосування таких, що розпорошуються, аерозольних, міцелярних і сухих порошків лікарських форм, що мають форму; введення шляхом інгаляції може бути оральним і/або назальним. Для введення можна застосовувати розпилювачі для рідин, аерозольні інгалятори і пристрої для дисперсій сухих порошків. Кращими є пристрої з дозуючим клапаном (пристрої з дозувальною шкалою). Однією з переваг розпилювача або інгалятора є те, що при їх застосуванні можливість забруднення є мінімальною, оскільки пристрої є замкнутими. Пристрої для дисперсії сухих порошків, наприклад, застосовуть для введення лікарських засобів, які можна легко одержувати у вигляді сухих порошків. Композиція іРНК може зберігати стабільність при зберіганні у вигляді ліофілізованих або висушених розпиленням порошків, які входять до складу композиції індивідуально або у сполученні із прийнятними порошкоподібними носіями. Введення композиції шляхом інгаляції можна здійснювати за допомогою елемента, що забезпечує дозування за часом, який включає таймер, визначник дози, пристрій для вимірювання часу або індикатор часу, що при використанні в пристрої, дозволяє відслідковувати дозу, здійснювати моніторинг дотримання режиму та схеми лікування, і/або запускати виділення дози в процесі застосування пацієнтом медикаментозного засобу у вигляді аерозолю. Приклади фармацевтичних пристроїв для введення за допомогою аерозолю включають інгалятори з дозувальною шкалою (MDI), інгалятори для сухих порошків (DPI) і повітряні струминні розпилювачі. Приклади систем для введення шляхом інгаляції, які легко адаптувати для введення запропонованих у винаході іРНК-агентів, описані, наприклад, в US №№ 5756353; 5858784; і заявках РСТ WO 98/31346; WO 98/10796; WO 00/27359; WO 01/54664; WO 02/060412. Інші лікарські форми у вигляді аерозолів, які можна застосовувати для введення іРНК-агентів, описані в US №№ 6294153; 6344194; 6071497 і заявках РСТ WO 02/066078; WO 02/053190; WO 01/60420; WO 00/66206. Крім того, шляхи введення іРНК-агентів можна адаптувати на основі методів, застосовуваних для введення інших олігонуклеотидів (наприклад, антисмислового олігонуклеотиду) шляхом інгаляції, 49 описані в Templin та ін., Antisеnse Nucleic Acid Drug Dev., 10, 2000, cc. 359-68; Sandrasagra та ін., Expert Opin Biol Thеr, 1, 2001, cc. 979-983; Sandrasagra та ін., Antisense Nucleic Acid Drug Dev., 12, 2002, cc. 177-181. Введення агентів, запропонованих у винаході, можна передбачати також застосування так званих «проліків», тобто лікарських форм або хімічних модифікацій терапевтичної субстанції, яка має потребу в певній формі процесінгу або транспорту за допомогою систем, властивих цільовому організму, для вивільнення терапевтичної субстанції, краще в місці необхідної дії; цей останній варіант здійснення винаходу можна застосовувати в сполученні із введенням у дихальні шляхи, але також у сполученні з іншими варіантами здійснення даного винаходу. Наприклад, людські легені можуть видаляти або швидко розкладати відкладення аерозолів, що гідролітично розщеплюються, протягом періоду часу, що становить від декількох хвилин до декількох годин. У верхніх дихальних шляхах війчастий епітелій бере участь в «екскалації (виведення секрету), пов'язаної з війовим епітелієм», за допомогою якого частинки несуться з дихальних шляхів у ротову порожнину (див. Pavia D., «Lung Micociliary Clearance», в: n Aerosols and the Lung: Clinical and Experimental Aspects, за ред. Clarke S. W. і Pavia D., вид-во Butterworths, London, 1984). У глибоко розташованих відділах легені альвеолярні макрофаги мають здатність здійснювати фагоцитоз часток незабаром після їх відкладення (див. Warheit та ін., Microscopy Res. Tech., 26, 1993, сс. 412-422; і Brain J. D., «Physiology and Pathophysiology of Pulmonary Macrophages», в:The Reticuloendothelial System, за ред. S. Μ. Reichard і J. Filkins, вид-во Plenum, New. York., 1985, cc. 315327). У кращих варіантах здійснення винаходу, насамперед, коли потрібно системне введення іРНКагента, застосовувані у вигляді аерозолів іРНКагенти приготовляють у вигляді мікрочастинок. Мікрочастинки, що мають діаметр 0, 5-10 мкм, можуть проникати в легені, проходячи через більшу частину бар'єрів, що зустрічаються в природних умовах. Діаметр менше 10 мкм потрібен для проходження через гортань; діаметр 0,5 мкм або більше потрібен для того, щоб уникнути видалення в процесі видиху. Інші компоненти Композиції, запропоновані у даному винаході, можуть містити також інші допоміжні компоненти, які зазвичай застосовуть у фармацевтичних композиціях, у прийнятих для даної галузі концентраціях. Так, наприклад, композиції можуть містити додаткові сумісні фармацевтичні діючі речовини, такі, наприклад, як знижуючі сверблячку, в'яжучі засоби, місцеві анестизуючі або протизапальні засоби, або можуть містити додаткові субстанції, які надають необхідні фізичні властивості при приготуванні лікарських форм композицій, запропонованих у даному винаході, такі як барвники, коригенти, консерванти, антиоксиданти, речовини, що обумовлюють непрозорість, загущувачі та стабілізатори. Однак такі субстанції при їх додаванні не повинні робити невідповідного впливу на біологіч 97521 50 ну активність компонентів композицій, запропонованих у даному винаході. Лікарські форми при необхідності можна стерилізувати при необхідності шляхом змішування з допоміжними речовинами, наприклад, любрікантами, консервантами, стабілізаторами, речовинами, що змочують, емульгаторами, солями, що впливають на осмотичний тиск, буферами, пігментами, коригентами і/або ароматизуючими субстанціями і т.п., які не чинять шкідливого впливу на нуклеїнову(і) кислоту(и) у лікарській формі. Водні суспензії можуть додатково містити субстанції, що підвищують в'язкість суспензії, до них відносяться, наприклад, натрієва сіль карбоксиметилцелюлози, сорбіт і/або декстран. Суспензії можуть містити також стабілізатори. Конкретними варіантами здійснення винаходу є фармацевтичні комбінації і композиції, що містять (а) один або декілька dsPHК-агентів і (б) одне або кілька інших терапевтичних засобів, функціональна активність яких не пов'язана з механізмом РНК-інтерференції. Таким чином, винахід відноситься до комбінації, що містить іРНК, запропонованій у даному винаході, у сполученні із протизапальною, бронходилаторною, антигістамінною, протикашльовою лікарською субстанцією, антибіотиком або лікарським засобом, що містить ДНКазу, зазначений блокатор епітеліальних натрієвих каналів і зазначена лікарська субстанція можуть перебувати в одній або в різних фармацевтичних композиціях. Прийнятними антибіотиками є макролідні антибіотики, наприклад, тобраміцин (ТОВІ™). Прийнятними лікарськими засобам, що містять як діючу речовину ДНКазу, є дорназа альфа (Pulmozyme™), високоочищений розчин рекомбінантної людської дезоксирибонуклеази І (rhДНКаза), яка вибірково розщеплює ДНК. Дорназу альфа застосовуть для лікування муковісцидозу. Іншими цінними комбінаціями блокаторів епітеліальних натрієвих каналів і протизапальних лікарських засобів є комбінації, що містять антагоністи хемокінових рецепторів, наприклад, CCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 і CCR10, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, насамперед антагоністи CCR-5, такі як розроблені фірмою Schering-Plough антагоністи SC-351125, SCH-55700 і SCH-D; антагоністи Takeda, такі як хлорид N-[[4-[[[6,7-дигідро-2-(4метилфеніл)-5H-бензоциклогептен-8іл]карбоніл]аміно]феніл]метил]тетрагідро-N,Nдиметил-2H-піран-4-амінію (ТАК-770); і антагоністи ССR, описані в US 6166037 (насамперед у п.п. 18 і 19), WO 00/66558 (насамперед у п. 8), WO 00/66559 (насамперед у п. 9), WO 04/018425 і WO 04/026873. Прийнятними протизапальними лікарськими засобами є стероїди, зокрема глюкокортикостероїди, такі як будесонід, бескламетазону дипропіонат, флутиказону пропіонат, циклесонід або мометазону фуроат, або стероїди, описані в WO 02/88167, WO 02/12266, WO 02/100879, WO 02/00679 (насамперед у прикладах 3, 11, 14, 1 7, 19, 26, 34, 37, 39, 51, 60, 67, 72, 73, 90, 99 і 101), 51 WO 03/35668, WO 03/48181, WO 03/62259, WO 03/64445, WO 03/72592, WO 04/39827 і WO 04/66920; нестероїдні агоністи глюкокортикоїдного рецептора, наприклад, описані в DE 10261874, WO 00/00531, WO 02/10143, WO 03/82280, WO 03/82787, WO 03/86294, WO 03/104195, WO 03/101932, WO 04/05229, WO 04/18429, WO 04/19935 і WO 04/26248; антагоністи LTD4, іакі як монтелукаст і зафірлукаст; інгібітори PDE4, такі як @ циломіласт (Ariflo фірма GlaxoSmithKline), рофлуміласт (фірма Byk Gulden), V-11294A (фірма Napp), ΒAΥ 19-8004 (фірма Bayer), SCH-351591 (фірма Schering-Plough), арофілін (фірма Almirall Prodesfarma), PD189659 / PD168787 (фірма ParkeDavis), AWD-12-281 (фірма Asta Medica), CDC-801 (фірма Celgene), SelCID(TM) CC-10004 (фірма Celgene), VM554/UM565 (фірма Vernalis), T-440 (фірма Tanabe), KW-4490 (фірма Kyowa Hakko Kogyo), і описані в WO 92/19594, WO 93/19749, WO 93/19750, WO 93/19751, WO 98/18796, WO 99/16766, WO 01/13953, WO 03/104204, WO 03/104205, WO 03/39544, WO 04/000814, WO 04/000839, WO 04/005258, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/018431, WO 04/018449, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/019944, WO 04/019945, WO 04/045607 і WO 04/037805; антагоністи рецепторів аденозину А2В, наприклад, описані в WO 02/42298; і агоністи бета2-адреноцептора, такі як албутерол (салбутамол), метапротеренол, тербуталін, салметеролу фенотерол, прокатерол і насамперед формотерол, кармотерол і їх фармацевтично прийнятні солі, і сполуки (у вільній формі або у формі солі або сольвату) формули (І), описані в WO 00/75114, цей документ включений у даний опис як посилання, краще сполуки, наведені в прикладах, насамперед індакатерол і його фармацевтично прийнятні солі, а також сполуки (у вільній формі або у формі солі або сольвату) формули (І) WO 04/16601, а також сполуки, описані в ЕР 1440966, JP 05025045, WO 93/18007, WO 99/64035, US 2002/0055651, WO 01/42193, WO 01/83462, WO 02/66422, WO 02/70490, WO 02/76933, WO 03/24439, WO 03/42160, WO 03/42164, WO 03/72539, WO 03/91204, WO 03/99764, WO 04/16578, WO 04/22547, WO 04/32921, WO 04/33412, WO 04/37768, WO 04/37773. WO 04/37807, WO 04/39762, WO 04/39766, WO 04/45618, WO 04/46083, WO 04/80964, WO 04/108765 і WO 04/108676. Прийнятними бронходилататорними лікарськими засобами є антихолінергічні і антимускаринові агенти, зокрема іпратропію бромід, окситропію бромід, солі тіотропію і CHF 4226 (фірма Chiesi) і глікопіролат, а також сполуки, описані в ЕР 424021, USP 3714357, USP 5171744, WO 01/04118, WO 02/00652, WO 02/51841, WO 02/53564, WO 03/00840, WO 03/33495, WO 03/53966, WO 03/87094, WO 04/018422 і WO 04/05285. Прийнятними лікарськими засобами, що мають подвійну дію, тобто протизапальну і бронходилататорну, є агоністи бета-2адреноцептора/антагоністи мускаринового рецеп 97521 52 тора, що мають подвійну дію, наприклад, описані в USP 2004/0167167, WO 04/74246 і WO 04/74812. Прийнятними антигістамінними лікарськими субстанціями є цетиризину гідрохлорид, ацетамінофен, клемастину фумарат, прометазин, лоратидин, деслоратидин, дифенгідрамін і фексофенадину гідрохлорид, активастин, астемізол, азеластин, ебастин, епінастин, мізоластин і тефенадин, а також сполуки, описані в JP 2004107299, WO 03/099807 і WO 04/026841. Інші коштовні комбінації агентів, запропонованих у винаході, із протизапальними лікарськими засобами є комбінації з антагоністами хемокінових рецепторів, наприклад, CCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 і CCR10, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, насамперед антагоніст CCR-5, такі як розроблені фірмою Schering-Plough антагоністи SC-351125, SCH-55700 і SCH-D; антагоністи Takeda, такі як хлорид N-[[4-[[[6,7-дигідро-2-(4-метилфеніл)-5Hбензоциклогептен-8іл]карбоніл]аміно]феніл]метил]тетрагідро-N,Nдиметил-2H-піран-4-амінію (ТАК-770); і антагоністи ССR, описані в US 6166037 (насамперед у п.п. 18 і 19), WO 00/66558 (насамперед у п. 8), WO 00/66559 (насамперед у п. 9), WO 04/018425 і WO 04/026873. Інші коштовні додаткові терапевтичні агенти можна вибирати із групи, що включає цитокінзв'язуючі молекули, насамперед антитіла до інших цитокінів, насамперед комбінацію з антитілом до IL4, наприклад, описану в РСТ/ЕР 2005/00836, антитілом до Ig, таким як Xolair®, антитілом до IL31, антитілом до IL31R, антитілом до TSLP, антитілом до рецептора TSLP, антитілом до ендогліну, антитілом до IL1b або антитілом до IL13, наприклад, які описані в WO 05/007699. Дві або більшу кількості сполук, що входять у комбінацію, можна застосовувати разом у вигляді однієї лікарської форми, окремо, одночасно або послідовно. Токсичність і терапевтичну ефективність таких сполук можна визначати стандартними фармацевтичними методами з використанням клітинних культур або піддослідних тварин, наприклад, для визначення значень LD50 (доза, що викликає загибель 50% популяції) і ED50 (доза, що має терапевтичну ефективністю для 50% популяції). Співвідношення доз, що мають токсичну і терапевтичну дію, являє собою терапевтичний індекс, і його можна виражати у вигляді співвідношення LD50/ED50. Кращими є сполуки, що мають високі терапевтичні індекси. Дані, отримані в аналізах, проведених на клітинних культурах і на тваринах, можна використовувати для визначення діапазону доз, які можна застосовувати на людині. Доза, що входить до складу такої композиції, краще перебуває в такому діапазоні, щоб при її застосуванні концентрації в кровотоці відповідали значенню ED50, маючи невисоку токсичність або характеризуючись відсутністю токсичності. Доза може змінюватися в зазначеному діапазоні залежно від застосовуваної лікарської форми і шляху введення. Для будь-якої сполуки, що застосовується в способі, запропоно 53 ваному у винаході, терапевтично ефективну дозу спочатку можна визначати за допомогою аналізу з використанням клітинних культур. З використанням піддослідних тварин можна включати в препарат дозу, що забезпечує в плазмі циркулюючої крові такий діапазон концентрацій сполуки або за необхідності поліпептидного продукту послідовності-мішені (наприклад, шляхом досягнення зниженої концентрації поліпептиду), що включає ІС50 (тобто концентрацію сполуки, що тестується, при якій досягається інгібування симптомів, що становить половину від максимального), визначену в аналізі з використанням клітинної культури. Таку інформацію можна використовувати для ще точнішого визначення доз, які можна застосовувати для людини. Рівні в плазмі можна вимірювати, наприклад, методом рідинної хроматографії високої роздільної здатності. Крім їх індивідуального введення або введення у сполученні з декількома субстанціями, як зазначено вище, dsPHК, запропоновані у винаході, можна вводити в комбінації з іншими відомими агентами, для яких встановлена ефективність відносно лікування пов'язаних з ENa порушень. У кожному разі лікуючий лікар, що здійснює введення, може регулювати кількість і графік введення dsPHК на основі результатів, отриманих з використанням стандартних критеріїв ефективності, відомих у даній галузі і представлених у даному описі. Способи лікування і шляхи введення Композицію, що містить іРНК-агент, наприклад, іРНК-агент, мішенню якого с альфа-EnaC, можна вводити індивідуумові різними шляхами для досягнення або місцевої дії в області-мішені, або шляхом системного введення індивідуумові. Прикладами шляхів введення є місцеве нанесення на область, що підлягає лікуванню, таку як легені і носовий хід, а також внутрішньовенне, назальне, оральне і окулярне введення. Кращими шляхами застосування іРНК-агентів, запропонованих у даному винаході, є безпосереднє введення в легені і носовий хід у вигляді рідини, у формі аерозолю або розчину, що розпорошується. Лікарські форми для інгаляційного або парентерального введення добре відомі в даній галузі. Такі лікарські форми можуть являти собою стерильні водяні розчини, які можуть містити буфери, розріджувачі та інші прийнятні добавки. Для внутрішньовенного застосування загальну концентрацію розчинних речовин необхідно контролювати для додання препарату ізотонічності. Діючі речовини, запропоновані у винаході, краще вводять у легеню(і) або носовий хід індивідуума за допомогою будь-яких прийнятних засобів. Діючі речовини можна вводити у формі аерозолю у вигляді суспензії придатних для вдихання часток, що містять діючу речовину або діючі речовини, які індивідуум вдихає. Діюча речовина, що входить до складу аерозолю, може перебувати в різних формах, таких, наприклад, як, але не обмежуючись тільки ними, інгалянти у вигляді сухих порошків, інгалянти, включені в пристрої з дозувальною шкалою, або суспензії типу рідина/рідина. Частинки, що вдихаються, можуть бути рідкими 97521 54 або твердими. Частинки необов'язково можуть містити інші терапевтичні засоби, такі як амілорид, бензаміл або фенаміл, при цьому обрана сполука входить у кількості, ефективній для інгібування реабсорбції води із секретів слизової оболонки дихальних шляхів, як описано в US № 4501729. Конкретну фармацевтичну композицію необов'язково можна поєднувати з носієм, що сприяє диспергуванню або транспорту. Прийнятний носій, такий як цукор (тобто лактоза, сахароза, трегалоза, маніт) можна змішувати з діючою речовиною або речовинами в будь-якому прийнятному співвідношенні (наприклад, у масовому співвідношенні 1:1). Частинки, що містять діючу речовину, призначену для втіленні на практиці даного винаходу, повинні являти собою частинки, що мають розмір, придатних для вдихання, тобто розмір часток повинен бути досить малим, щоб проходити крізь рот або ніс і гортань при інгаляції і у бронхи та альвеоли легенів. Як правило, придатними для вдихання є частинки, розмір яких становить приблизно від 1 до 10 мкм (ще краще розмір повинен становити менше приблизно 5 мкм). Частинки, що входять до складу аерозолю, розмір яких не відповідає вдихувальному розміру, мають тенденцію осаджувати в гортані і набухати, і тому кількість не придатних для вдихання часток в аерозолі краще мінімізують. Для введення в ніс кращими є частинки розміром 10-500 мкм, що гарантує збереження в носовій порожнині. Рідкі фармацевтичні композиції діючої речовини, що застосовуються для одержання аерозолю, можна приготовляти шляхом змішання діючої речовини із прийнятним наповнювачем, таким як стерильна, вільна від пірогенів вода. Гіпертонічні соляні розчини, що застосовуються для втілення на практиці даного винаходу, краще являють собою вільні від пірогенів розчини, що містять від 1 до 15 мас. % фізіологічно прийнятної солі, і ще краще від 3 до 7 мас. % фізіологічно прийнятної солі. Аерозолі рідких частинок, що містять діючу речовину, можна одержувати за допомогою будьяких прийнятних засобів, таких як струминний розпилювач, що знаходиться під тиском, або ультразвуковий розпилювач (див., наприклад, US № 4501729). Розпилювачі являють собою пристрої, що надходять у продаж, за допомогою яких відбувається перетворення розчинів або суспензій діючої речовини в терапевтичний аерозольний туман або за допомогою прискорення стисненого газу, як правило, повітря або кисню, через вузький насадок Вентури, або за допомогою ультразвукового перемішування. Прийнятні для застосування в розпилювачах лікарські форми складаються з діючої речовини в рідкому носії, при цьому діюча речовина перебуває в концентрації аж до 40 мас. % у перерахуванні на лікарську форму, але краще менше 20 мас. %. Носій, як правило, являє собою воду (і найкраще стерильну, вільну від пірогенів воду) або розведений водно-спиртовий розчин, краще доведений до ізотонічності, але може являти собою також гіпертонічний відносно загальної води організму 55 розчин, для одержання якого додають, наприклад, хлорид натрію. Необов'язковими добавками є консерванти, якщо лікарська форма не є стерильною, наприклад, метилгідроксибензоат, антиоксиданти, коригенти, леткі олії, буферні агенти та поверхнево-активні речовини. Аерозолі твердих частинок, що містять діючу речовину, можна приготовляти також за допомогою будь-якого генератора терапевтичного аерозолю, що складається із твердих частинок. Аерозольні генератори для введення терапевтичних засобів у вигляді твердих частинок індивідуумові дозволяють одержувати частинки, які можна вдихати, і створюють об'єм аерозолю, що містить попередньо відміряну дозу терапевтичного засобу, рівень якої є прийнятний для введення людині. Одним з наведених як ілюстрація прикладом аерозольного генератора твердих частинок є інсуфлятор. Прийнятними лікарськими формами для введення шляхом інсуфляції, є тонкоподрібнені порошки, які можна вводити за допомогою інсуфлятора або вводити в носову порожнину шляхом вдихання через ніс. В інсуфляторі порошок (наприклад, його відміряна доза, ефективна для здійснення лікування, як представлено у даному описі) перебуває в капсулах або картриджах, як правило, виготовлених з желатину або пластику, які або перфоровані, або відкриті in situ, і порошок доставляється за допомогою повітря, що протікає через пристрій при інгаляції, або за допомогою ручного насоса. Порошок, що застосовується в інсуфляторі, складається або тільки з діючої речовини, або з порошкоподібної суміші, що містить діючу речовину, прийнятний порошкоподібний розріджувач, такий як лактоза, і необов'язково поверхневоактивну речовину. Діюча речовина, як правило, міститься в концентрації від 0,1 до 100 мас. % у перерахуванні на лікарську форму. Другим типом наведеного як ілюстрація аерозольного генератора є інгалятор з дозувальною шкалою. Інгалятори з дозувальною шкалою являють собою аерозольні диспенсери, що знаходяться під тиском, як правило, такі, що містять суспензію або розчин лікарської форми діючої речовини в зрідженому пропеленті. При використанні такі пристрої здійснюють викид лікарської форми через клапан, пристосований для введення відміряної дози, як правило, від 10 до 200 мкл, з утворенням спрея дрібних частинок, що містять діючу речовину. Прийнятними пропелентами є певні хлорфторвуглецеві похідні, наприклад, дихлордифторметан, трихлорфторметан, дихлортетрафторетан і їх суміші. До складу лікарської форми може входити також один або декілька співрозчинників, наприклад, етанол, поверхнево-активних речовин, таких як олеїнова кислота або сорбітантриолеат, антиоксидант і прийнятні коригенти. іРНК-агент можна включати у фармацевтичні композиції, придатні для введення. Наприклад, композиції можуть включати один або кілька видів іРНК-агентів і фармацевтично прийнятний носій. У контексті даного опису поняття «фармацевтично прийнятний носій» включає будь-який і всі розчинники, дисперсіонні середовища, речовини для нанесення покриттів, антибактеріальні і протигрибкові агенти, що нада 97521 56 ють ізотонічність і сповільнюють абсорбцію речовини і т.п., придатні для фармацевтичного застосування. Використання таких середовищ і агентів для фармацевтичних діючих речовин добре відомо в даній галузі. Всі зазначені речовини можна застосовувати в композиціях за винятком тих випадків, коли які-небудь загальноприйняті середовища або агенти не сумісні з діючими речовинами. У композиції можна включати також і інші діючі речовини. Введення може здійснювати сам пацієнт або будь-яка інша людина, наприклад, що здійснює відхід. Людина, що здійснює відхід, являє собою, наприклад, людину, що працює в лікарні, хоспісі, кабінеті лікаря, в амбулаторній клініці; представника служби охорони здоров'я, такого як лікар, медична сестра або інший фахівець; або чоловіка або опікуна, наприклад, батька. Медикаментозне лікування можна здійснювати з використанням відміряної дози або диспенсера, що забезпечує введення відміряної дози. Поняття «терапевтично ефективна кількість» являє собою кількість, що присутня у композиції, яка є необхідною для забезпечення необхідного рівня лікарського засобу в індивідуума, що підлягає лікуванню, для одержання очікуваної фізіологічної відповіді. Поняття «фізіологічно ефективна кількість» означає кількість, введену пацієнтові, необхідну для одержання необхідної паліативної або лікувальної дії. Поняття «фармацевтично прийнятний носій» означає, що носій може попадати в легені, не чинячи ніяких виражених побічних токсикологічних впливів на легені. Поняття «спільне введення» відноситься до введення індивідуумові двох або більшої кількість агентів і, зокрема, двох або більшої кількості іРНКагентів. Агенти можна поєднувати у вигляді однієї фармацевтичної композиції і застосовувати одночасно, або агенти можуть входити в різні лікарські форми і їх вводять пацієнтові послідовно. У випадку, коли два агенти можна виявити в організмі пацієнта одночасно, вважається, що два агенти введені спільно. До типів фармацевтичних ексципієнтів, які можна застосовувати як носій, відносяться стабілізатори, такі як людський сироватковий альбумін (ЛCA), наповнювачі, такі як вуглеводи, амінокислоти і поліпептиди; регулюючі значення pH агенти або буфери; солі, такі як хлорид натрію; і т.п. Такі носії можуть перебувати в кристалічній або аморфній формі або можуть являти собою суміші обох форм. Кращі наповнювачі являють собою сумісні вуглеводи, поліпептиди, амінокислоти або їх комбінації. Прийнятні ввуглеводи являють собою моносахариди, такі як галактоза, D-маноза, сорбоза і т.п.; дисахариди, такі як лактоза, трегалоаза і т.п.; циклодекстрини, такі як бета-циклодекстрин; і полісахариди, такі як рафіноза, мальтодекстрини, декстрани і т.п.; алдитолі, такі як маніт, ксиліт і т.п. Краща група вуглеводів включає лактозу, трегалозу, рафінозу, мальтодекстрини і маніт. До прийнятних поліпептидів відноситься аспартам. Аміноки 57 слоти включають аланін і гліцин, причому кращим є гліцин. Прийнятними агентами, що регулюють значення pH, або буферами є органічні солі, отримані з органічних кислот і основ, такі як цитрат натрію, аскорбат натрію і т.п.; кращим є цитрат натрію. Дози іРНК-агент можна вводити в стандартній дозі з розрахунку менше приблизно 75 мг на кг ваги тіла або в ще нижчій дозі, що становить приблизно 70, 60, 50, 40, 30, 20, 10, 5, 2, 1, 0,5, 0,1, 0,05, 0,01, 0,005, 0,001 або 0,0005 мг на кг ваги тіла, і менше 200 нмолей іРНК-агента (наприклад, приблизно 16 4,410 копій) на кг ваги тіла, або менше 1500, 750, 300, 150, 75, 15, 7,5, 1,5, 0,75, 0,15, 0,075, 0,015, 0,0075, 0,0015, 0,00075, 0,00015 нмолей іРНК-агента на кг ваги тіла. Стандартну дозу можна вводити, наприклад, шляхом ін'єкції (наприклад, внутрішньовенної або внутрішньом'язової, підоболонкової або безпосередньо в орган), інгаляційної дози або шляхом місцевого нанесення. Доза може включати кількість, ефективну відносно лікування або попередження захворювання або порушення. Її можна вводити в профілактичних цілях або як основне лікування або частини протоколу лікування. В одному з варіантів здійснення винаходу стандартну дозу вводять рідше ніж 1 раз у день, наприклад, рідше ніж кожні 2, 4, 8 або 30 днів. В іншому варіанті здійснення винаходу стандартну дозу вводять рідко (наприклад, з нерегулярною частотою). Наприклад, стандартну дозу можна вводити однократно. Оскільки опосередковуване іРНК-агентом мовчання може зберігатися протягом декількох днів після введення композиції, що містить іРНК-агент, то в багатьох випадках композицію можна вводити рідше ніж 1 раз у день або в деяких випадках тільки одноразово протягом усього курсу лікування. В одному з варіантів здійснення винаходу індивідуумові вводять початкову дозу і одну або кілька підтримуючих доз іРНК-агента, наприклад, дволанцюгового іРНК-агента або siPHК-агента (наприклад, попередник, наприклад, більший іРНКагент, з якого в результаті процесінгу може утворитися siPHК-агент, або ДНК, яка кодує іРНКагент, наприклад, дволанцюговий іРНК-агент або siPHК-агент або його попередник). Підгримуюча доза або дози, як правило, нижче, ніж початкова доза, наприклад, сгановить(лять) половину від початкової дози. Підтримуючий режим може включати лікування індивідуума дозою або дозами, що становлять від 0,01 до 75 мг/кг ваги тіла в день, наприклад, 70, 60, 50, 40, 30, 20, 10, 5, 2, 1, 0,5, 0,1, 0,05, 0,01, 0,005, 0,001 або 0,0005 мг/кг ваги тіла в день. Підтримуючі дози краще вводять не частіше, ніж кожні 5, 10 або 30 днів. Крім того, режим лікування може здійснюватися протягом періоду часу, що значно варіюється залежно від природи конкретного захворювання, його серйозності і загального стану пацієнта. У кращих варіантах здійснення винаходу дозу можна вводити не частіше ніж 1 раз у день, наприклад, не частіше ніж 1 раз в 24, 36, 48 або більше годин, наприклад, не частіше ніж 1 раз кожні 5 або 8 днів. Після лікуван 97521 58 ня пацієнта можна здійснювати моніторинг зміни його стану і полегшення симптомів стану хвороби. Дозу сполуки можна або підвищувати, якщо пацієнт не дає істотної відповіді на застосовувані рівні доз, або дозу можна знижувати, якщо виявлено полегшення симптомів стану хвороби, якщо стан хвороби припинений, або якщо виявлені небажані побічні дії. Ефективну дозу можна вводити у вигляді однієї дози або у вигляді двох або більшої кількості доз, якщо це є бажаним або розглядається як необхідне за конкретних обставин. За необхідності для зниження кількості повторень або частоти інфузій, може бути показана імплантація пристрою для введення, наприклад, насоса, «напівперманентного» (із середньою тривалістю дії) стента (наприклад, внутрішньовенно, внутрішньочеревинно, всередину порожнини або внутрішньокапсульно) або резервуара. Після успішного лікування може виявитися бажаним піддавати пацієнта підтримуючій терапії з метою попередження рецидиву стану хвороби, при цьому сполуку, запропоновану у винаході, вводять у підтримуючих дозах, що становлять від 0,001 до 100 г на кг ваги тіла (див. US № 6107094). Концентрація композиції іРНК-агента являє собою кількість, достатню, щоб мати ефективність відносно лікування або попередження порушення або регулювання фізіологічного стану в людини. Концентрація, що вводиться, або кількість іРНКагента, що вводиться, повинні залежати від параметрів, визначених для агента, і методу введення, наприклад, назального, трансбукального або легеневого. Наприклад, у випадку назальних лікарських форм є тенденція до застосування деяких інгредієнтів в істотно більш низьких концентраціях для того, щоб уникнути подразнення або опіку носових ходів. У деяких випадках бажано розбавляти лікарську форму аж до 10-100 разів для того, щоб одержувати прийнятну для назального введення лікарську форму. Деякі фактори, які можуть впливати на дозу, необхідну для ефективного лікування індивідуума, включають, але не обмежуючись тільки ними, серйозність захворювання або порушення, попереднє лікування, загальний стан здоров'я і/або вік індивідуума та інші присутні хвороби. Очевидно, що ефективну дозу іРНК-агента, такого як siPHК, застосовуваного для лікування, можна підвищувати або знижувати в процесі конкретного лікування. Зміни дози можуть визначатися результатом або стати очевидними з результатів діагностичних аналізів. Наприклад, індивідуума можна піддавати моніторингу після введення композиції іРНКагента. Ґрунтуючись на інформації, отриманій при такому моніторингу, можна вводити додаткову кількість композиції іРНК-агента. Режим введення доз залежить від серйозності і чутливості стану хвороби, що підлягає лікуванню, введення може тривати протягом проміжку часу, що становить від декількох днів до декількох місяців, або до досягнення лікування або зниження хворобливого стану. Оптимальні схеми прийому доз можна розраховувати на основі оцінки нагромадження лікарського засобу в організмі пацієнта. 59 Звичайний фахівець у даній галузі легко може визначати оптимальні дози, методології введення доз і частоту їх повторення. Оптимальні дози можуть варіюватися залежно від відносної ефективності індивідуальних сполук, і їх, як правило, можна оцінювати на основі значень ЕС50, які характеризують ефективність, встановлену in vitro і in vivo на створені на тваринних моделях, як описано вище. іРНК-агенти, запропоновані у даному винаході, як вони представлені у даному описі, можна застосовувати для лікування і (за необхідності) попередження кожного з наступних захворювань/порушень: муковісцидоз, синдром Ліддла, ниркова недостатність, гіпертензія, дисбаланс електролітів. Зокрема, у деяких варіантах здійснення винаходу іРНК-агенти, запропоновані у винаході, можна застосовувати для лікування і/або попередження шкідливих клінічних проявів цих хвороб/порушень. Винахід додатково проілюстрований за допомогою наведених нижче прикладів, які не слід розглядати як такі, що обмежують об'єм винаходу. Приклади Джерело реагентів Якщо в контексті даного опису джерело реагенту не зазначено спеціально, то цей реагент можна одержувати від будь-якого постачальника реагентів для молекулярної біології, якість/чистота якого задовольняє стандартам в галузі молекулярної біології. Приклад 1: Вибір послідовностей Для того щоб ідентифікувати здатність терапевтичних siPHК здійснювати негативну модуляцію експресії альфа-субодиниці епітеліального натрієвого каналу ENa (α-ENa), здійснювали скрининг масивів, визначених на основі біоінформаційного аналізу. Ключовим драйвером при створенні призначеного для скринінгу масиву слугувала передвіщена специфічність siPHК у відношенні транскриптома споріднених видів. Для ідентифікації siPHК, мішенню яких є альфа-EnaC, і ефективної системи введення використовували три специфічних підходи: як піддослідні види для оцінки ефективності мовчання гена in vivo після внутрішньотрахеального введення були обрані пацюки, морські свинки були обрані як організм, на якому моделювали захворювання з метою демонстрації того, що зниження рівня мРНК альфа-ЕnаС приводить до функціональної дії, що піддається вимірюванню. Мішенню терапевтичної молекули siPHК є людський альфа-ЕnаС, а також послідовність альфа-ЕnаС щонайменше одного із близьких за токсикологічними параметрами виду, у цьому випадку макака резус. Первісні аналізи відповідних послідовностей мРНК альфа-ЕnаС показали, що можна ідентифікувати лише небагато послідовностей, які задовольняли б вимогам специфічності і у той же час мішенню яких була б мРНК альфа-ЕnаС у всіх споріднених видах. Тому при створенні винаходу було вирішено створювати незалежні масиви, призначені для скринінгу терапевтичних siPHК і суро 97521 60 гатних молекул для оцінки на відповідній моделі захворювання (таблиці 1А, 1Б, 1У і 1Г). Всі siPHК розпізнають послідовність людського альфа-ЕnаС, оскільки для визначення активності in vitro була обрана система, що включає культуру людських клітин (Н441, див. нижче). Тому всі siPHК можна застосовувати для спрямованого впливу на мРНК людського альфа-ЕnаС у терапевтичних дослідженнях. Для скринінгу терапевтичних агентів створювали масиви, що включають тільки послідовності siPHК, повністю комплементарні послідовностям альфа-ЕnаС людини і макака резус. Створення і селекція методом комп'ютерного моделювання (in silico) siPHК, мішенню яких є альфа-EnaC CSCNN1A) Конструювання siPHК здійснювали для ідентифікації siPHК із використанням визначених раніше 4 масивів (див. вище), а саме: а) «масиву для первісного скринінгу», б) «масиву для розширеного скринінгу», в) «масиву сурогатних молекул для аналізу in vivo на пацюках», г) «масиву сурогатних молекул для аналізу in vivo на морських свинках». Масив для первісного скринінгу Метою селекції in silico масиву для первісного скринінгу була ідентифікація siPHК, специфічною мішенню яких є людський альфа-ЕnаС, а також його ортолог з макака резус. Дані про людську мРНК-мішені (NM_001038.4) завантажували з ресурсу NCBI (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?CMD= search&DB=nucleotide) у процесі процедури повної селекції siPHК. Для ідентифікації ортолога альфаЕnаС з макака резус (Масаса mulatta) при пошуку за допомогою програми blastn, що проводили в Медичному коледжі Baylor (Baylor College of Medicine) (http://www.hgsc.bcm.tmc.edu/blast/?organism=Mmul atta), використовували людську послідовність, яку порівнювали з наборами послідовних фрагментів М. mulatta (10.01.2004 p.). Всі співпадаючі області («хіти») виділяли і поєднували за допомогою призначеної для складання системи CAP (автоматизоване планування) з одержанням першої зібраної послідовності. Потім в UCSC (http://genome.ucsc.edu/cgi-bin/hgBlat?command=start&org=Rhesus&db=rheMac2&hgsid=84859 356) здійснювали пошук за допомогою програми BLAST з використанням людської послідовності, яку порівнювали зі стандартними послідовностями макака резус (12 березня 2005 р.). Завантажували конструкцію («хіт») 84554, що характеризує найбільшим збігом, і застосовували разом з першою зібраною послідовністю в системі САР для одержання кінцевої консенсусної послідовності для альфа-EnaC макака резус. Після виділення всіх 19-мірних послідовностей, що перекриваються, з людської мРНК, ідентифікували консервативні 19-міри, які мали ідентичні послідовності в зібраної консенсусної послідовності макака резус. Ці 19-мірні послідовності позначали як пул siPHК, що дають перехрес
ДивитисяДодаткова інформація
Назва патенту англійськоюI-rna-agent modulating downregulation of alpha-enac expression
Автори англійськоюVan Heeke, Gino, Hickman, Emma, Danahay, Henry Luke, Tan, Pamela, Geick, Anke, Vornlocher, Hans-Peter
Назва патенту російськоюИ-рнк-агент, который опосредует ингибирование экспрессии альфа-enac
Автори російськоюВан Хеке Джино, Хикмен Эмма, Денехей Хенри Льюк, Тан Памела, Гейк Анке, Форнлокер Ханс-Петер
МПК / Мітки
МПК: A61K 31/713, C12N 15/11
Мітки: iрнк-агент, альфа-enac, опосередковує, інгібування, експресії
Код посилання
<a href="https://ua.patents.su/63-97521-irnk-agent-shho-oposeredkovueh-ingibuvannya-ekspresi-alfa-enac.html" target="_blank" rel="follow" title="База патентів України">Iрнк-агент, що опосередковує інгібування експресії альфа-enac</a>
Попередній патент: Спосіб та пристрій для призначення підтвердження висхідної лінії зв’язку
Наступний патент: Кульовий кран
Випадковий патент: Спосіб створення вихідного матеріалу озимої пшениці