Стабільна рідка фармацевтична композиція, що містить антагоністичне моноклональне антитіло до cd40
Номер патенту: 94264
Опубліковано: 26.04.2011
Автори: Окхамафе Аугустус, Арайа Кідісті, Чен Бао-Лу, Лу Сяофен
Формула / Реферат
1. Стабільна рідка фармацевтична композиція, яка містить:
а) антагоністичне моноклональне антитіло до CD40 як компонент, який має терапевтичну або профілактичну активність, де моноклональне антитіло має здатність специфічно зв'язуватися з людським антигеном CD40, який експресується на поверхні людської В-клітини, де моноклональне антитіло не має значної агоністичної активності при зв'язуванні з антигеном CD40, який експресується на поверхні В-клітини;
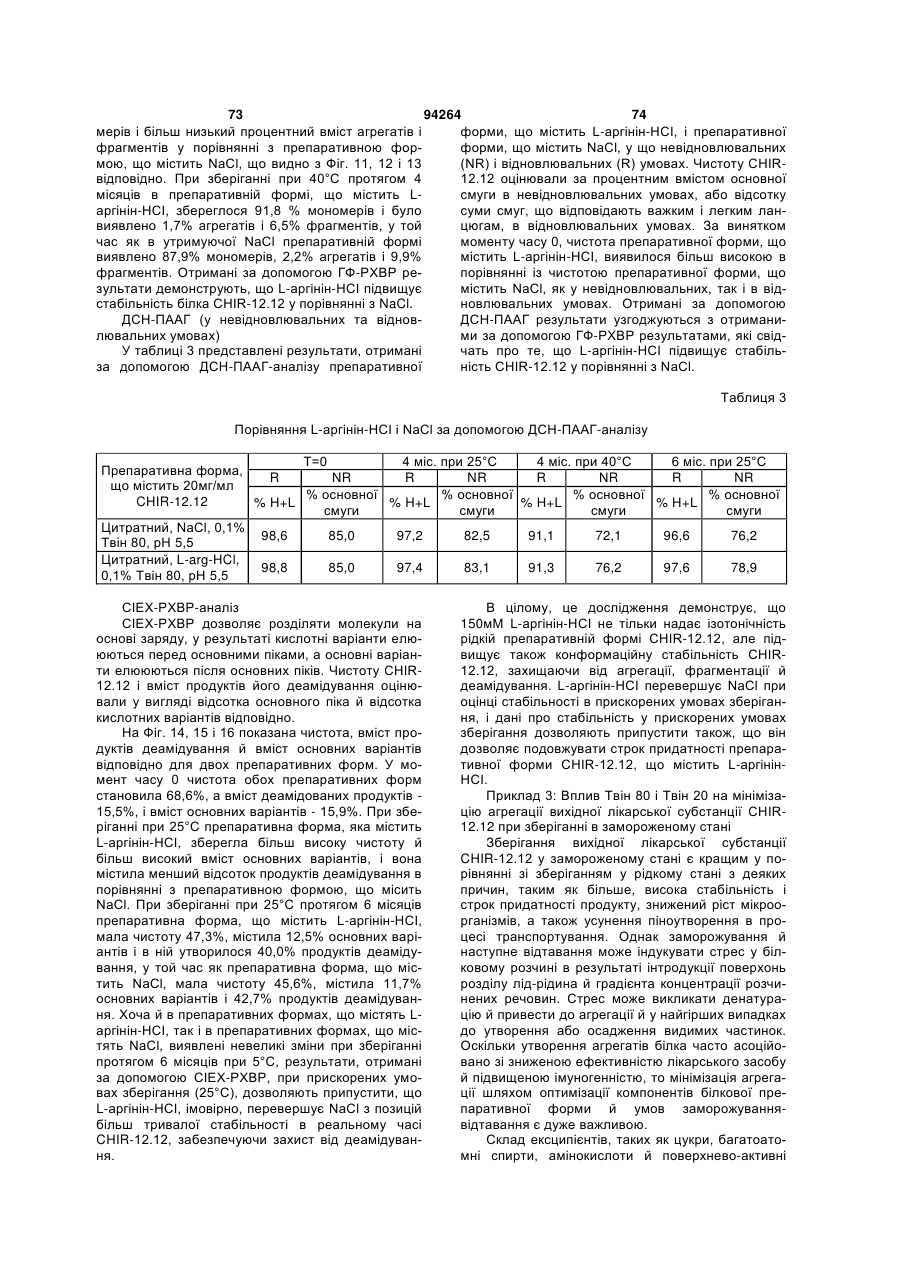
б) аргінін у його кислотній формі (аргінін-НСl) у кількості, достатній для того, щоб зробити композицію практично ізотонічною; і
в) забуферювальний агент для підтримання значення рН композиції на рівні від приблизно 5,0 до приблизно 7,0, де забуферювальний агент являє собою буфер на основі цитрату/лимонної кислоти.
2. Композиція за п. 1, осмоляльність якої становить від приблизно 240 до приблизно 360 ммоль/кг.
3. Композиція за п. 1, у якій концентрація забуферювального агента становить від приблизно 5 до приблизно 100 мМ, від приблизно 5 до приблизно 20 мМ або приблизно 10 мМ.
4. Композиція за будь-яким з пп. 1-3, у якій забуферювальний агент являє собою буфер на основі цитрату натрію/лимонної кислоти.
5. Композиція за п. 4, де композиція має значення рН, що становить приблизно 5,5.
6. Композиція за п. 1, де композиція містить аргінін-НСl у концентрації від приблизно 50 до приблизно 200 мМ, у концентрації від приблизно 100 до приблизно 175 мМ або у концентрації приблизно 150 мМ.
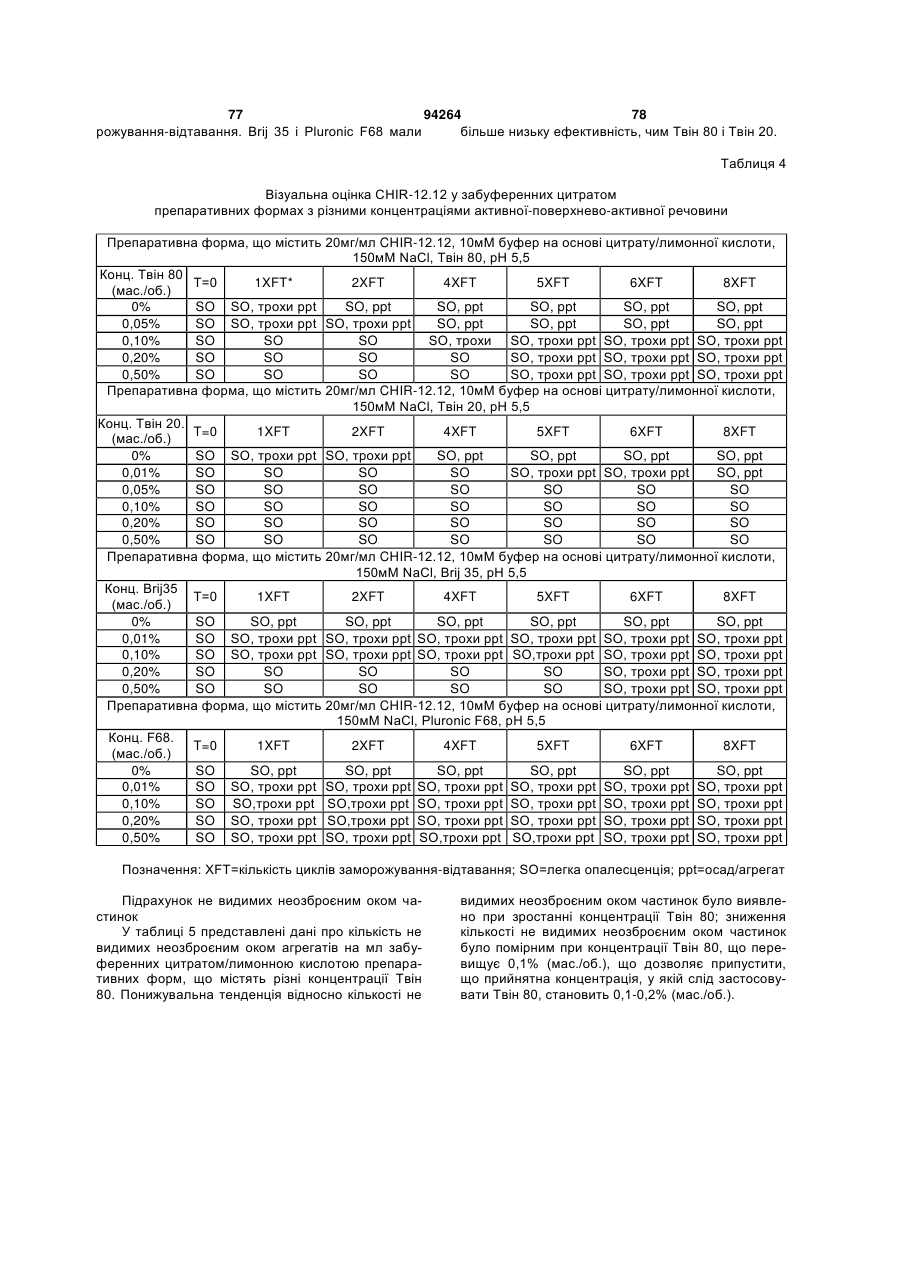
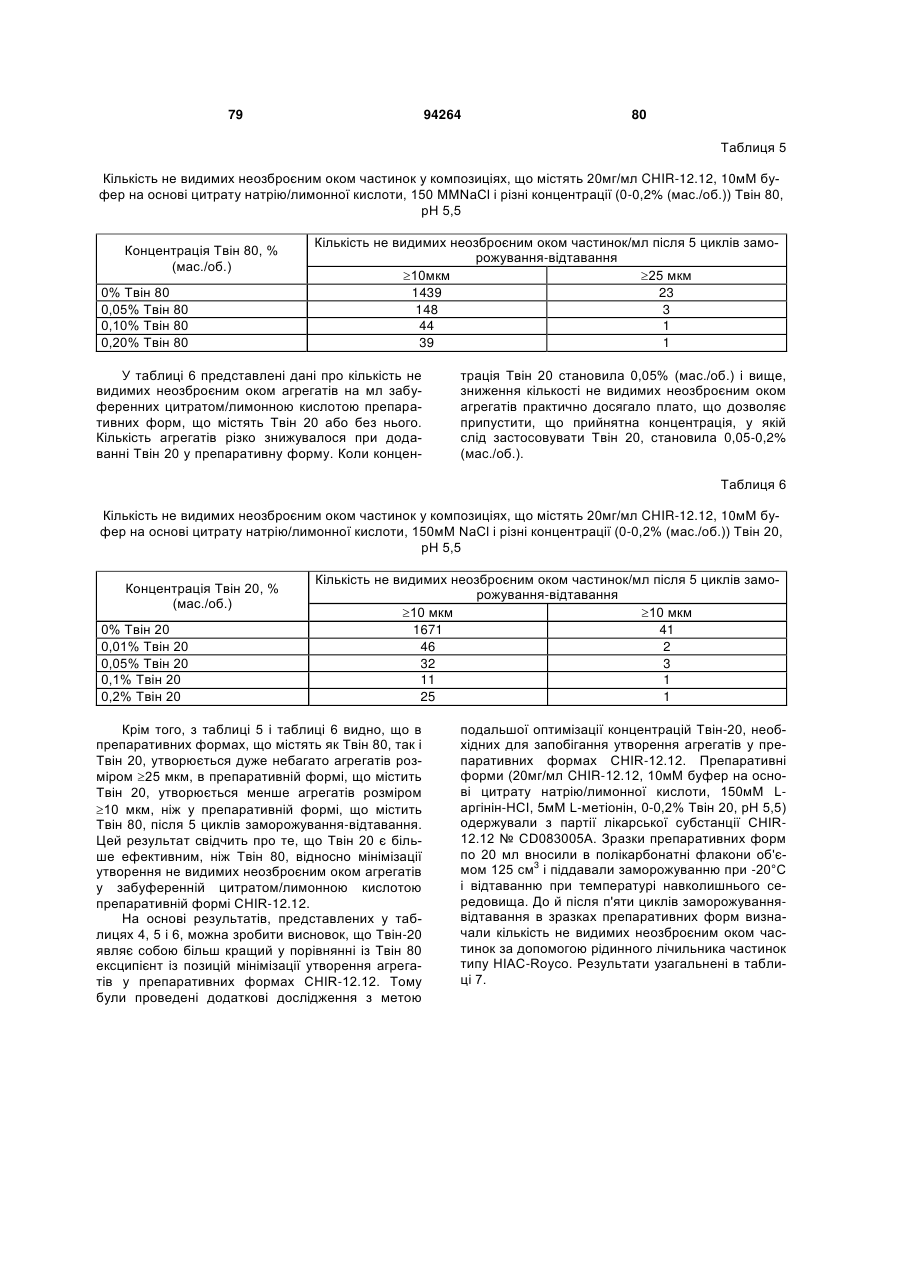
7. Композиція за п. 1, яка додатково містить поверхнево-активну речовину.
8. Композиція за п. 7, у якій поверхнево-активна речовина являє собою полісорбат 20, такий як полісорбат 20 у концентрації від приблизно 0,001 до приблизно 1,0 % (мас./об.) або у концентрації від приблизно 0,025 до приблизно 0,1 % (мас./об.).
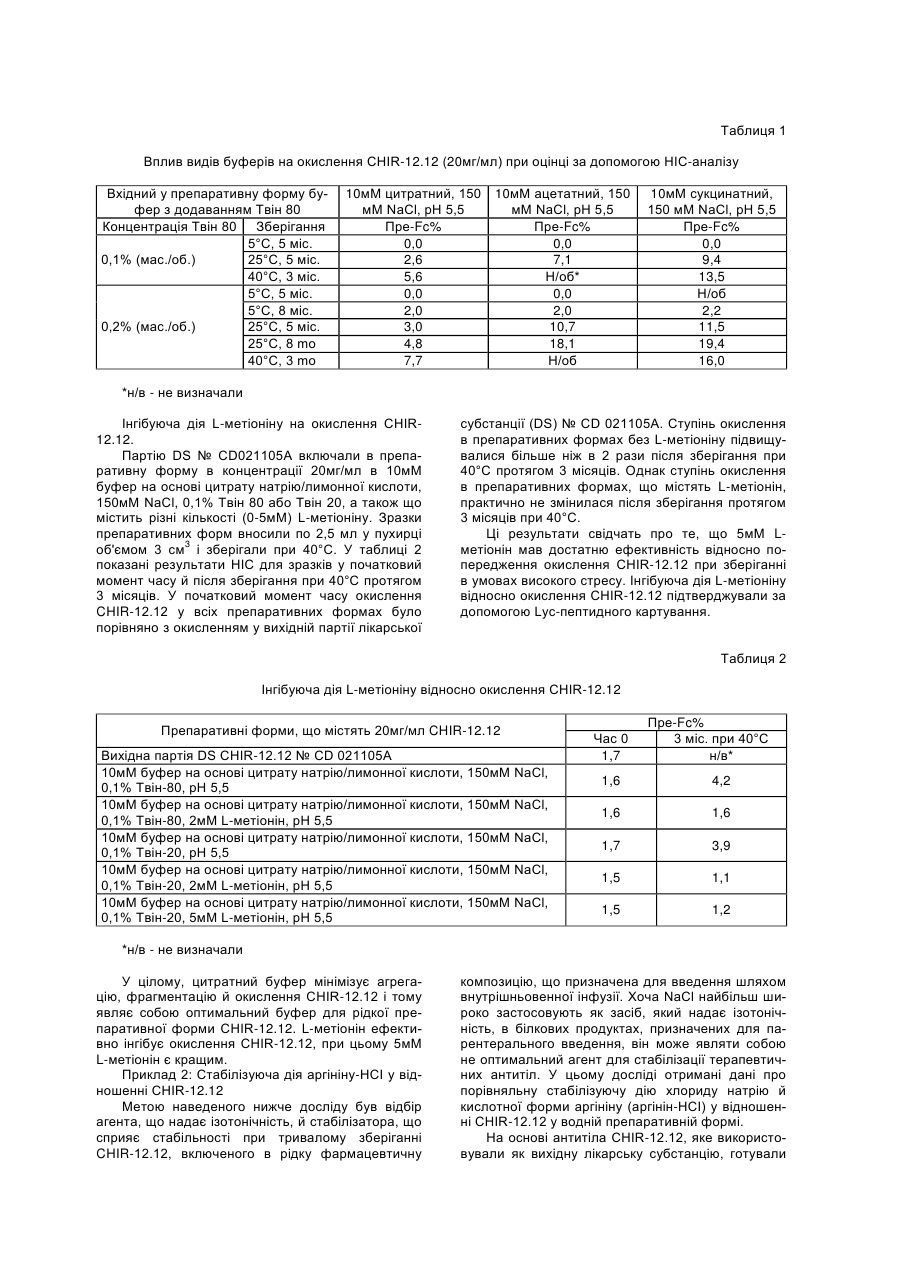
9. Композиція за п. 1 або п. 8, яка додатково містить метіонін у кількості, достатній для інгібування окислення принаймні одного окислювального амінокислотного залишку у моноклональному антитілі до CD40 у процесі зберігання композиції.
10. Композиція за п. 9, де композиція містить метіонін у концентрації від приблизно 0,5 до приблизно 20,0 мМ, у концентрації від приблизно 1,0 до приблизно 20,0 мМ або у концентрації приблизно 5,0 мМ.
11. Композиція за будь-яким з пп. 1-10, у якій антагоністичне моноклональне антитіло до CD40 вибране із групи, яка включає:
а) моноклональне антитіло CHIR-5.9 або CHIR-12.12;
б) моноклональне антитіло, яке продукується лінією клітин гібридоми 5.9 або 12.12;
в) моноклональне антитіло, яке містить амінокислотну послідовність, вибрану із групи, яка включає послідовність, представлену в SEQ ID NO:6, послідовність, представлену в SEQ ID NO:7, послідовність, представлену в SEQ ID NO:8, обидві послідовності, представлені в SEQ ID NO:6 і SEQ ID NO:7, і обидві послідовності, представлені в SEQ ID NO:6 і SEQ ID NO:8;
г) моноклональне антитіло, яке містить амінокислотну послідовність, вибрану із групи, яка включає послідовність, представлену в SEQ ID NO:2, послідовність, представлену в SEQ ID NO:4, послідовність, представлену в SEQ ID NO:5, обидві послідовності, представлені в SEQ ID NO:2 і SEQ ID NO:4, і обидві послідовності, представлені в SEQ ID NO:2 і SEQ ID NO:5;
ґ) моноклональне антитіло, яке має амінокислотну послідовність, кодовану молекулою нуклеїнової кислоти, що має нуклеотидну послідовність, вибрану із групи, яка включає послідовність, представлену в SEQ ID NO:1, послідовність, представлену в SEQ ID NO:3, і обидві послідовності, представлені в SEQ ID NO:1 і SEQ ID NO:3;
д) моноклональне антитіло, яке зв'язується з епітопом, що має здатність до зв'язування з моноклональним антитілом, яке продукується лінією клітин гібридоми 5.9 або 12.12;
е) моноклональне антитіло, яке зв'язується з епітопом, що містить залишки 82-87 послідовності людського CD40, представленої в SEQ ID NO:10 або SEQ ID NO:12;
є) моноклональне антитіло, яке зв'язується з епітопом, що містить залишки 82-89 послідовності людського CD40, представленої в SEQ ID NO:10 або SEQ ID NO:12;
ж) моноклональне антитіло, яке конкурує з моноклональним антитілом CHIR-5.9 або CHIR-12.12 у конкурентному аналізі зв'язування;
з) моноклональне антитіло за попереднім підпунктом а) або моноклональне антитіло за одним з попередніх підпунктів в)-ж), де антитіло отримане методом рекомбінації; і
и) моноклональне антитіло, яке являє собою антигензв'язувальний фрагмент моноклонального антитіла за одним з попередніх підпунктів а)-з), де фрагмент зберігає здатність до специфічного зв'язування з людським антигеном CD40.
12. Композиція за п. 11, у якій фрагмент вибраний із групи, яка включає Fab-фрагмент, F(аb')2-фрагмент, Fv-фрагмент і одно ланцюговий Fv-фрагмент.
13. Композиція за будь-яким з пп. 1-12, у якій антагоністичне моноклональне антитіло до CD40 присутнє у композиції в концентрації від приблизно 0,1 до приблизно 50,0 мг/мл, в концентрації від приблизно 1,0 до приблизно 35,0 мг/мл або в концентрації від приблизно 10,0 до приблизно 35,0 мг/мл.
14. Композиція за п. 1, де композиція має стабільність при зберіганні при температурі від приблизно 2 °С до приблизно 8 °С протягом періоду часу, що становить принаймні 18 місяців або має стабільність при зберіганні при температурі приблизно 25 °С протягом періоду часу, що становить принаймні 3 місяці.
15. Спосіб підвищення стабільності моноклонального антитіла до CD40 у рідкій фармацевтичній композиції, де спосіб полягає в тому, що готують композицію шляхом об'єднання моноклонального антитіла до CD40, аргініну-НСl у кількості, достатній для того, щоб зробити композицію практично ізотонічною, і забуферювального агента для підтримання значення рН композиції на рівні від приблизно 5,0 до приблизно 7,0, де забуферювальний агент являє собою буфер на основі цитрату/лимонної кислоти.
16. Спосіб одержання рідкої фармацевтичної композиції, що містить моноклональне антитіло до CD40, який полягає в тому, що готують композицію шляхом об'єднання моноклонального антитіла до CD40, аргінін у його кислотній формі (аргінін-НСl) у кількості, достатній для того, щоб зробити композицію практично ізотонічною, і забуферювального агента для підтримання значення рН композиції на рівні від приблизно 5,0 до приблизно 7,0, де забуферювальний агент являє собою буфер на основі цитрату/лимонної кислоти.
17. Спосіб лікування індивідуума, що має раковий або передраковий стан, який асоційований із клітинами, що експресують CD40, де спосіб полягає в тому, що вводять у терапевтично ефективній кількості фармацевтичну композицію за будь-яким з пп. 1-14.
18. Спосіб лікування індивідуума, що має запальне захворювання або аутоімунне захворювання, що асоційоване із клітинами, які експресують CD40, де спосіб полягає в тому, що вводять у терапевтично ефективній кількості фармацевтичну композицію за будь-яким з пп. 1-14.
Текст
1. Стабільна рідка фармацевтична композиція, яка містить: а) антагоністичне моноклональне антитіло до CD40 як компонент, який має терапевтичну або профілактичну активність, де моноклональне антитіло має здатність специфічно зв'язуватися з людським антигеном CD40, який експресується на поверхні людської В-клітини, де моноклональне антитіло не має значної агоністичної активності при зв'язуванні з антигеном CD40, який експресується на поверхні В-клітини; б) аргінін у його кислотній формі (аргінін-НСl) у кількості, достатній для того, щоб зробити композицію практично ізотонічною; і в) забуферювальний агент для підтримання значення рН композиції на рівні від приблизно 5,0 до приблизно 7,0, де забуферювальний агент являє собою буфер на основі цитрату/лимонної кислоти. 2. Композиція за п. 1, осмоляльність якої становить від приблизно 240 до приблизно 360мМоль/кг. 3. Композиція за п. 1, у якій концентрація забуферювального агента становить від приблизно 5 до приблизно 100мМ, від приблизно 5 до приблизно 20мМ або приблизно 10мМ. 4. Композиція за будь-яким з пп. 1-3, у якій забуферювальний агент являє собою буфер на основі цитрату натрію/лимонної кислоти. 5. Композиція за п. 4, де композиція має значення рН, що становить приблизно 5,5. UA (21) a200813220 (22) 17.04.2007 (24) 26.04.2011 (86) PCT/US2007/066757, 17.04.2007 (31) 60/794,011 (32) 21.04.2006 (33) US (46) 26.04.2011, Бюл.№ 8, 2011 р. (72) ЛУ СЯОФЕН, CN/US, ЧЕНЬ БАО-ЛУ, US, АРАЙА КІДІСТІ, US, ОКХАМАФЕ АУГУСТУС, US (73) НОВАРТІС АГ, CH, КСОМА ТЕКНОЛОДЖІ ЛТД., US (56) WO A 9937329, 29.07.1999. US A1 2005175611, 11.08.2005. WO A 2006020935, 23.02.2006. WO A 2006125207, 23.11.2006. WO A 2007092772, 16.08.2007. WO A 2005044854, 19.05.2005. ZHENG ET AL: "Influence of pH, buffer species, and storage temperature on physicochemical stability of a humanized monoclonal antibody LA298" INTERNATIONAL JOURNAL OF PHARMACEUTICS, AMSTERDAM, NL, vol. 308, no. 1-2, 3 February 2006 (2006-02-03), pages 46-51, XP005249234 ISSN: 0378-5173. ISHIBASHI M ET AL: "Is arginine a proteindenaturant?" PROTEIN EXPRESSION AND PURIFICATION, ACADEMIC PRESS, SAN DIEGO, CA, US, vol. 42, no. 1, July 2005 (2005-07), pages 16, XP004918440 ISSN: 1046-5928. MAHLER H-C ET AL: "Induction and analysis of aggregates in a liquid IgG1-antibody formulation" EUROPEAN JOURNAL OF PHARMACEUTICS AND BIOPHARMACEUTICS, ELSEVIER SCIENCE PUBLISHERS B.V., AMSTERDAM, NL, vol. 59, no. 3, April 2005 (2005-04), pages 407-417, XP004780138 ISSN: 0939-6411. TSUMOTO KOUHEI ET AL: "Role of arginine in protein refolding, solubilization, and purification" BIOTECHNOLOGY PROGRESS, XX, XX, vol. 20, no. 5, September 2004 (2004-09), pages 1301-1308, XP002383385 ISSN: 8756-7938 (ABSTRACT). 2 (19) 1 3 94264 4 6. Композиція за п. 1, де композиція містить аргіж) моноклональне антитіло, яке конкурує з монокнін-НСl у концентрації від приблизно 50 до приблональним антитілом CHIR-5.9 або CHIR-12.12 у лизно 200мМ, у концентрації від приблизно 100 до конкурентному аналізі зв'язування; приблизно 175мМ або у концентрації приблизно з) моноклональне антитіло за попереднім підпунк150мМ. том а) або моноклональне антитіло за одним з 7. Композиція за п. 1, яка додатково містить повепопередніх підпунктів в)-ж), де антитіло отримане рхнево-активну речовину. методом рекомбінації; і 8. Композиція за п. 7, у якій поверхнево-активна и) моноклональне антитіло, яке являє собою антиречовина являє собою полісорбат 20, такий як гензв'язувальний фрагмент моноклонального анполісорбат 20 у концентрації від приблизно 0,001 титіла за одним з попередніх підпунктів а)-з), де до приблизно 1,0 % (мас./об.) або у концентрації фрагмент зберігає здатність до специфічного зв'явід приблизно 0,025 до приблизно 0,1 % (мас./об.). зування з людським антигеном CD40. 9. Композиція за п. 1 або п. 8, яка додатково міс12. Композиція за п. 11, у якій фрагмент вибраний тить метіонін у кількості, достатній для інгібування із групи, яка включає Fab-фрагмент, F(аb')2окислення принаймні одного окислювального аміфрагмент, Fv-фрагмент і одно ланцюговий Fvнокислотного залишку у моноклональному антитілі фрагмент. до CD40 у процесі зберігання композиції. 13. Композиція за будь-яким з пп. 1-12, у якій анта10. Композиція за п. 9, де композиція містить метігоністичне моноклональне антитіло до CD40 прионін у концентрації від приблизно 0,5 до приблизсутнє у композиції в концентрації від приблизно 0,1 но 20,0мМ, у концентрації від приблизно 1,0 до до приблизно 50,0мг/мл, в концентрації від прибприблизно 20,0мМ або у концентрації приблизно лизно 1,0 до приблизно 35,0мг/мл або в концент5,0мМ. рації від приблизно 10,0 до приблизно 35,0мг/мл. 11. Композиція за будь-яким з пп. 1-10, у якій анта14. Композиція за п. 1, де композиція має стабільгоністичне моноклональне антитіло до CD40 вибність при зберіганні при температурі від приблизно ране із групи, яка включає: 2 °С до приблизно 8 °С протягом періоду часу, що а) моноклональне антитіло CHIR-5.9 або CHIRстановить принаймні 18 місяців або має стабіль12.12; ність при зберіганні при температурі приблизно б) моноклональне антитіло, яке продукується ліні25°С протягом періоду часу, що становить приєю клітин гібридоми 5.9 або 12.12; наймні 3 місяці. в) моноклональне антитіло, яке містить амінокис15. Спосіб підвищення стабільності моноклональлотну послідовність, вибрану із групи, яка включає ного антитіла до CD40 у рідкій фармацевтичній послідовність, представлену в SEQ ID NO:6, поскомпозиції, де спосіб полягає в тому, що готують лідовність, представлену в SEQ ID NO:7, послідокомпозицію шляхом об'єднання моноклонального вність, представлену в SEQ ID NO:8, обидві посліантитіла до CD40, аргініну-НСl у кількості, достатдовності, представлені в SEQ ID NO:6 і SEQ ID ній для того, щоб зробити композицію практично NO:7, і обидві послідовності, представлені в SEQ ізотонічною, і забуферювального агента для підтID NO:6 і SEQ ID NO:8; римання значення рН композиції на рівні від прибг) моноклональне антитіло, яке містить амінокислизно 5,0 до приблизно 7,0, де забуферювальний лотну послідовність, вибрану із групи, яка включає агент являє собою буфер на основі цитрапослідовність, представлену в SEQ ID NO:2, посту/лимонної кислоти. лідовність, представлену в SEQ ID NO:4, послідо16. Спосіб одержання рідкої фармацевтичної комвність, представлену в SEQ ID NO:5, обидві посліпозиції, що містить моноклональне антитіло до довності, представлені в SEQ ID NO:2 і SEQ ID CD40, який полягає в тому, що готують композицію NO:4, і обидві послідовності, представлені в SEQ шляхом об'єднання моноклонального антитіла до ID NO:2 і SEQ ID NO:5; CD40, аргінін у його кислотній формі (аргінін-НСl) у ґ) моноклональне антитіло, яке має амінокислотну кількості, достатній для того, щоб зробити компопослідовність, кодовану молекулою нуклеїнової зицію практично ізотонічною, і забуферювального кислоти, що має нуклеотидну послідовність, вибагента для підтримання значення рН композиції на рану із групи, яка включає послідовність, предстарівні від приблизно 5,0 до приблизно 7,0, де забувлену в SEQ ID NO:1, послідовність, представлену ферювальний агент являє собою буфер на основі в SEQ ID NO:3, і обидві послідовності, представцитрату/лимонної кислоти. лені в SEQ ID NO:1 і SEQ ID NO:3; 17. Спосіб лікування індивідуума, що має раковий д) моноклональне антитіло, яке зв'язується з епіабо передраковий стан, який асоційований із клітопом, що має здатність до зв'язування з моноктинами, що експресують CD40, де спосіб полягає в лональним антитілом, яке продукується лінією тому, що вводять у терапевтично ефективній кільклітин гібридоми 5.9 або 12.12; кості фармацевтичну композицію за будь-яким з е) моноклональне антитіло, яке зв'язується з епіпп. 1-14. топом, що містить залишки 82-87 послідовності 18. Спосіб лікування індивідуума, що має запальне людського CD40, представленої в SEQ ID NO:10 захворювання або аутоімунне захворювання, що або SEQ ID NO:12; асоційоване із клітинами, які експресують CD40, є) моноклональне антитіло, яке зв'язується з епіде спосіб полягає в тому, що вводять у терапевтитопом, що містить залишки 82-89 послідовності чно ефективній кількості фармацевтичну композилюдського CD40, представленої в SEQ ID NO:10 цію за будь-яким з пп. 1-14. або SEQ ID NO:12; 5 Галузь техніки, до якої належить винахід Даний винахід стосується фармацевтичних препаративних форм, більш конкретно стабільних рідких фармацевтичних композицій, які містять антагоністичні антитіла до CD40, які призначені для проліферативних захворювань і захворювань, які мають аутоімунний або запальний компонент. Передумови створення винаходу Завдяки досягнутим зараз успіхам у розробці технології генної інженерії створені різні біологічно активні поліпептиди в кількостях, достатньо великих для їх застосування як лікарські засоби. Однак поліпептиди можуть втрачати біологічну активність через фізичну нестабільність, у тому числі через денатурацію й утворення розчинних і нерозчинних агрегатів, і через різні види хімічної нестабільності, такі як гідроліз, окислення й деамідування. На стабільність поліпептидів у рідких фармацевтичних препаративних формах можуть впливати, наприклад, такі фактори, як значення рН, іонна сила, температура, повторювані цикли заморожуваннявідтавання й механічні зсувні зусилля, що виникають, наприклад, у процесі обробки. Утворення агрегатів і втрата біологічної активності можуть бути також результатом фізичного перемішування й взаємодій молекул поліпептидів у розчині й на поверхнях розділу рідина-повітря в посудинах для зберігання. Інші конформаційні зміни можуть відбуватися в поліпептидах, адсорбованих на поверхнях розділу повітря-рідина й поверхнях розділу тверда речовина-рідина в процесі скороченняподовження поверхонь розділу в результаті перемішування в процесі транспортування або інших процесів. Таке перемішування може приводити до «заплутування», агрегації, утвореннячастинок білка й, зрештою, до його осадження з іншими адсорбованими білками. Загальний огляд даних про стабільність білкових фармацевтичних агентів наведений, наприклад, в Manning і ін., Pharm. Res. 6, 1989, стор. 903-918, і в Wang і Hanson, J. Parenteral Sci. Tech. 42, 1988, стор. 14. Нестабільність рідких фармацевтичних препаративних форм, які містять поліпептиди, привела до того, що ці препаративні форми упаковують у ліофілізованому вигляді разом з рідким середовищем, придатним для відновлення. Хоча ліофілізація підвищує стабільність при зберіганні композиції, у багатьох поліпептидів виявлені знижена активність або в процесі їх зберігання у висушеному стані (Pikal, Biopharm. 27, 1990, стор. 26-30), або через утворення агрегатів або втрати каталітичної активності при відновленні в рідку форму (див., наприклад, Carpenter і ін., Develop. Biol. Standard 74, 1991, стор. 225-239; Broadhead і ін., Drug Devel. Ind. Pharm. 18, 1992, стор. 1169-1206; Mumenthaler і ін., Pharm. Res. 11, 1994, ее.12-20; Carpenter і Crowe, Cryobiology 25, 1988, стор. 459470; і Roser, Biopharm. 4, 1991, стор. 47-53). Хоча застосування адитивів підвищує стабільність висушених білків, багато повторно гідратованих препаративних форм усе ще включають неприйнятні або небажані кількості неактивного агрегованого білка (див., наприклад, Townsend і DeLuca, J. Pharm. Sci. 80, 1983, стор. 63-66; Ноrа і ін., Pharm. Res. 9, 1992, стор. 33-36; Yoshiaka і ін., Pharm. 94264 6 Res, 10, 1993, стор. 687-691). Крім того, необхідність у відновленні є незручною, і вона зв'язана з можливістю неправильного дозування. До фармацевтично прийнятних поліпептидів належать отримані рекомбінантно моноклональні антитіла. Серед цього класу терапевтичних агентів антагоністичні антитіла до CD40, мішенню для яких служить представник сімейства TNFрецепторів CD40, є найбільш перспективними для лікування зв'язаних з В-клітинами злоякісних захворювань і негематологічних злоякісних захворювань, а також хвороб, які мають аутоімунний та/або запальний компонент. Рецептор CD40 являє собою розташований на клітинній поверхні антиген з молекулярною масою 50-55 кДа, який присутній на поверхні як здорових, так і неопластичних людських В-клітин, дендритних клітин, моноцитів, макрофагів, СD8+-Т-клітин, ендотеліальних клітин, моноцитів і епітеліальних клітин, деяких епітеліальних карцином і багатьох щільних пухлин, включаючи рак легені, молочної залози, яєчника, сечового міхура й ободової кишки. Антиген CD40 експресується також на активованих Тклітинах, активованих тромбоцитах, збуджених клітинах гладеньких м'язів судин, еозинофілах, синовіальних мембранах при ревматоїдному артриті, шкірних фібробластах і інших нелімфоїдних типах клітин. Залежно від типу клітин, які експресують CD40, лігування може індукувати внутрішньоклітинну адгезію, диференціювання, активацію й проліферацію. Наприклад, зв'язування CD40 з спорідненим лігандом, тобто CD40L (який позначають також як CD154), стимулює проліферацію й диференціювання В-клітин у плазматичні клітини, виробництво антитіл, перемикання ізотипу й створення Вклітинної пам'яті. У процесі В-клітинного диференціювання CD40 експресується на перед-Вклітинах, але відсутній після диференціювання в плазматичні клітини. Експресія CD40 на антигенпрезентуючих клітинах (АПК) відіграє важливу костимулювальну роль в активації цих клітин. Наприклад, встановлено, що агоністичні моноклональні антитіла до CD40 (МАт) імітують впливи Т-клітинхелперів при В-клітинній активації. У випадку присутності на прикріплених клітинах, які експрескють FcRII, ці антитіла індукують В-клітинну проліферацію (Banchereau і ін., Science 251, 1989, с. 70). Крім того, агоністичні МАт до CD40 можуть заміняти сигнал Т-клітин-хелперів, що приводить до секреції IgM, IgG і IgE у присутності IL-4 (Gascan і ін., J. Immunol. 147, 1991, стор. 8). Крім того, агоністичні МАт до CD40 можуть попереджати запрограмовану загибель клітин (апоптоз) В-клітин, виділених з лімфатичних вузлів. Ці та інші дані підтверджують сучасну теорію про те, що взаємодія CD40 і CD40L відіграє основну роль у регуляції як гуморальних, так і клітинноопосередкованих імунних відповідей. У проведені в останні роки дослідженнях виявлена більш широка роль взаємодії CD40/CD40L у різноманітних фізіологічних і патологічних процесах. Так, зв'язування CD40 з CD40L і наступна активація передачі сигналу CD40 являють собою необхідні стадії імунних відповідей; однак пору 7 94264 8 шення регуляції передачі сигналу CD40 може при1995, стор. 1152-1160), плоскоклітинна карцинома водити до захворювання. Встановлено, що шлях (SCC) (Аmо і ін., Eur. J. Dermatol. 10, 2000, стор. передачі сигналу CD40 бере участь в аутоімунно438-442; Posner і ін., Clin. Cancer Res. 5,1999, crop. му захворюванні (Ichikawa і ін., J. Immunol. 169, 2261-2270), папілярна карцинома щитовидної за2002, стор. 2781-2787 і Moore і ін.,J. Autoimmun. лози (Smith і ін., Thyroid 9, 1999, стор. 749-755), 19, 2002, стор. 139-145). Крім того, взаємодія шкірна злоякісна меланома (van den Oord і ін., Am. CD40/CD40L відіграє важливу роль у запальних J. Pathol. 149, 1996, стор. 1953-1961), карцинома процесах. Наприклад, виявлена понадекспресія як шлунка (Yamaguchi і ін. Int. J. Oncol. 23(6), 2003, CD40, так і CD40L в пошкодженнях при атеросклестор. 1697-1702) і карцинома печінки (див., наприрозі в організмі людини й при викликаному експеклад, Sugimoto і ін., Hepatology 30(4), 1999, стор. риментальним шляхом атеросклерозі. Стимуляція 920-926, у вказаній публікації обговорюється людCD40 індукує експресію руйнуючих матрикс ферська печінково-клітинна карцинома). Дані про сарментів і експресію тканинних факторів в асоційокоми, які експресують CD40, представлені, напривані з атеросклеротичною бляшкою типах клітин, клад, в Lollini і ін., Clin. Cancer Res. 4(8), 1998, таких як ендотеліальні клітини, гладеньоком'язеві стор. 1843-849, у вказаній публікації обговорюєтьклітини й макрофаги. Крім того, стимуляція CD40 ся людська остеосаркома й саркома Юінга. індукує виробництво прозапальних цитокінів, таких З урахуванням потенційних терапевтичних як IL-1, IL-6 і IL-8, і адгезійних молекул, таких як сприятливих впливів антагоністичних антитіл до ІСАМ-1 (фактор міжклітинної адгезії-1), Е-селектин CD40 на регуляцію опосередковуваної CD40L пеі VCAM (молекули адгезії судинного ендотелію). редачі сигналу CD40 при різних видах раку й аутоІнгібування взаємодії CD40/CD40L попереджає імунних/запальних захворюваннях і недоліків преатерогенез на створені з використанням тваринних паративних форм цих поліпептидів, існує моделях. На моделях, створених з використанням необхідність у створенні стабільних фармацевтичтрансплантатів, встановлено, що блокування взаних композицій, що містять ці антитіла. ємодії CD40/CD40L попереджає запалення. Було Короткий виклад суті винаходу встановлено, що зв'язування CD40/CD40L має Запропоновано стабільні рідкі фармацевтичні синергетичну дію з пептидом амілоїду-бета при композиції, які містять антагоністичне антитіло до хворобі Альцгеймера, підсилюючи активацію мікCD40 як компонент, який має терапевтичну або роглії, що приводить до нейротоксичності. У пацієпрофілактичну активність, і способи, придатні для нтів, що страждають від ревматоїдного артриту їх одержання. Вказані композиції містять антагоні(РА), рівень експресії CD40 підвищується в хондстичне антитіло до CD40, забуферювальний агент роцитах суглобів, таким чином, передача сигналу для підтримання значення рН композиції на рівні CD40, очевидно, бере участь у виробництві цитовід приблизно 5,0 до приблизно 7,0 і аргінін-НСІ у кінів і матриксних металопротеїназ, які викликають кількості, достатній для того, щоб зробити компоушкодження (див., Gotoh і ін., J. Rheumatol. 31, зицію практично ізотонічною. У деяких варіантах 2004, стор. 1506-1512). здійснення винаходу забуферювальний агент явАналогічно до цього, злоякісні В-клітини з пухляє собою буфер на основі цитрату/лимонної кислинних типів В-клітинної зародкової лінії експрелоти, антагоністичне антитіло до CD40 являє сосують CD40 і, імовірно, їх виживання й проліферабою антагоністичне антитіло до CD40 CHIR-12.12 ція залежать від передачі сигналу CD40. або CHIR-5.9 або його антигензв'язу вальний фраТрансформовані клітини пацієнтів, що страждають гмент, композиція містить аргінін-НСІ як засіб, який від В-клітинних лімфом з низьким ступенем злоякінадає ізотонічність, й композиція містить також сності й високозлоякісних В-клітинних лімфом, неіоногенну поверхнево-активну речовину та/або гострого В-клітинного лімфобластного лейкозу, L-метіонін як додатковий стабілізатор. Стабільні множинної мієломи, хронічного лімфоцитарного рідкі фармацевтичні композиції, які містять антаголейкозу, макроглобулінемієї Вальденстрема й ністичне антитіло до CD40, запропоновані у винахвороби Ходжкіна, експресують CD40. Експресія ході, знаходять застосування в способах лікування CD40 виявлена також в 2/3 випадків гострого мієпроліферативних захворювань і захворювань, що лобластного лейкозу й в 50% випадків зв'язаних зі мають аутоімунний та/або запальний компонент. СНІДом лімфом. Короткий опис деяких аспектів, представлених Для цілого ряду карцином і сарком також хана кресленні(ях) рактерні високі рівні експресії CD40, хоча роль На кресленнях показано: передачі сигналу CD40 у сполученні з експресією на Фіг. 1 - вплив різних буферів на чистоту CD40 на цих типах ракових клітин менш добре МАт CHIR-12.12 у препаративних формах, які збевивчена. До експресуючих CD40 карцином налерігали при 25°С протягом 3 місяців або 5 місяців, жать карцинома сечового міхура (Paulie і ін., J. оцінений за допомогою ГФ-РХВР-аналізу; Immunol. 142, 1989, стор. 590-595; Braeschна Фіг. 2 - вплив різних буферів на утворення Andersen і ін., J. Immunol. 142, 1989, стор. 562агрегатів у різних препаративних формах МАт 567), карцинома молочної залози (Ніrаnо і ін., CHIR-12.12, які зберігали при 25°С протягом 3 міBlood 93, 1999, стор. 2999-3007; Wingett і ін., Breast сяців або 5 місяців, оцінений за допомогою ГФCancer Res. Treat. 50, 1998, стор. 27-36); рак пеРХВР-аналізу; редміхурової залози (Rokhlin і ін., Cancer Res. 57, на Фіг. 3 - вплив різних буферів на фрагмента1997, стор. 1758-1768), нирково-клітинна карциноцію в різних препаративних формах МАт CHIRма (Kluth і ін., Cancer Res. 57, 1997, стор. 891-8912.12, які зберігали при 25°С протягом 3 місяців 9), недиференційована носоглоткова карцинома або 5 місяців, оцінений за допомогою ГФ-РХВР(UNPC) (Agathanggelou і ін., Am. J. Pathol. 147, аналізу; 9 94264 10 на Фіг. 4 - вплив різних буферів на чистоту на Фіг. 16 - вміст (в %) основних варіантів МАт МАт CHIR-12.12 у препаративних формах, які збеCHIR-12.12 у препаративних формах, які містили рігали при 40°С протягом 3 місяців або 5 місяців, або NaCl, або L-аргінін-НСІ як агент для надання оцінений за допомогою ГФ-РХВР-аналізу; ізотонічності, при їх зберіганні при 25°С протягом на Фіг. 5 - вплив різних буферів на утворення 2, 4 або 6 місяців, оцінений за допомогою СІЕХагрегатів у різних препаративних формах МАт РХВР-аналізу. CHIR-12.12, які зберігали при 40°С протягом 3 міДокладний опис винаходу сяців або 5 місяців, оцінений за допомогою ГФДаний винахід більш докладно описаний нижРХВР-аналізу; че з посиланням на додані креслення, на яких на Фіг. 6 - вплив різних буферів на фрагментапредставлені деякі, але не всі варіанти здійснення цію в різних препаративних формах МАт CHIRвинаходу. Природно, ознаки, які заявляються, мо12.12, які зберігали при 40°С протягом 3 місяців жуть мати різні форми, а винахід не обмежений або 5 місяців, оцінений за допомогою ГФ-РХВРпредставленими варіантами здійснення винаходу; аналізу; вказані варіанти здійснення винаходу представлена Фіг. 7 - отримані за допомогою диференціані таким чином, щоб даний опис задовольняв прильної сканувальної калориметрії термограми МАт йнятим юридичним вимогам. CHIR-12.12 у препаративних формах, що містять Багато модифікацій і інші варіанти здійснення або NaCl, або L-аргінін-НСІ як агент для надання винаходу, представлені в даному винаході, як поізотонічності; винно бути очевидно фахівцям в галузі, до якої на Фіг. 8 - вміст (в %) мономерної форми МАт належать даний винахід, мають цінні властивості, CHIR-12.12, що збереглася в препаративних форякі представлені в наведеному нижче описі й домах, які містили або NaCl, або L-аргінін-НСІ як даних кресленнях. Таким чином, слід розуміти, що агент для надання ізотонічності, при їх зберіганні обсяг винаходу не обмежений конкретними описапри 25°С протягом 2, 4 або 6 місяців, оцінений за ними варіантами здійснення винаходу, і мається допомогою ГФ-РХВР-аналізу; на увазі, що модифікації й інші варіанти здійснення на Фіг. 9 - кількість агрегатів (в %) МАт CHIRвинаходу підпадають під обсяг доданої формули 12.12 у препаративних формах, які містили або винаходу. Хоча в даному описі застосовують спеNaCl, або L-аргінін-НСІ як агент для надання ізоцифічні поняття, їх використовують тільки у звитонічності, при їх зберіганні при 25°С протягом 2, 4 чайному й відповідному змісті, а не з метою обмеабо 6 місяців, оцінений за допомогою ГФ-РХВРження. аналізу; Даний винахід стосується стабільних рідких на Фіг. 10 - кількість фрагментів (в %) МАт фармацевтичних композицій, які містять принаймні CHIR-12.12 у препаративних формах, які містили одне антагоністичне антитіло до CD40 або його або NaCl, або L-аргінін-НСІ як агент для надання антигензв'язувальний фрагмент як компонент, ізотонічності, при їх зберіганні при 25°С протягом який має терапевтичну або профілактичну актив2, 4 або 6 місяців, оцінений за допомогою ГФність, і способів, придатних для їх одержання. Для РХВР-аналізу; цілей даного винаходу мається на увазі, що понятна Фіг. 11 - вміст (в %) мономерної форми МАт тя «рідкий» відносно фармацевтичних композицій CHIR-12.12, що збереглася в препаративних форабо препаративних форм включає поняття «водмах, які містили або NaCl, або L-аргінін-НСІ як ний». Під поняттям «компонент, який має терапевагент для надання ізотонічності, при їх зберіганні тичну або профілактичну активність», мається на при 40°С протягом 2 або 4 місяців, оцінений за увазі, що антагоністичне антитіло до CD40 або допомогою ГФ-РХВР-аналізу; його антигензв'язувальний фрагмент спеціально на Фіг. 12 - кількість агрегатів (в %) МАт CHIRвключені в композицію для одержання необхідної 12.12 у препаративних формах, які містили або терапевтичної або профілактичної відповіді при NaCl, або L-аргінін-НСІ як агент для надання ізоздійсненні лікування, попередження або діагноститонічності, при їх зберіганні при 40°С протягом 2 ки захворювання або стану в індивідуума, коли або 4 місяців, оцінений за допомогою ГФ-РХВРфармацевтичну композицію вводять цьому індивіаналізу; дуумові. на Фіг. 13 - кількість фрагментів (в %) МАт Під поняттям «стабільні» розуміють, що фарCHIR-12.12 у препаративних формах, які містили мацевтичні композиції, запропоновані у винаході, або NaCl, або L-аргінін-НСІ як агент для надання забезпечують фізичну та/або хімічну стабільність ізотонічності, при їх зберіганні при 40°С протягом 2 антагоністичному антитілу до CD40 або його антиабо 4 місяців, оцінений за допомогою ГФ-РХВРгензв'язувального фрагмента. Це означає, що ананалізу; тагоністичне антитіло до CD40 або його антигензна Фіг. 14 - чистота (в %) МАт CHIR-12.12 у в'язувальний фрагмент практично зберігає фізичну препаративних формах, які містили або NaCl, або та/або хімічну стабільність і має необхідну біологіL-аргінін-НСІ як агент для надання ізотонічності, чну активність, тобто одним або декількома видапри їх зберіганні при 25°С протягом 2, 4 або 6 міми антагоністичної активності, вказаної в даному сяців, оцінений за допомогою СІЕХ-РХВР-аналізу; описі, включаючи (але, не обмежуючись тільки на Фіг. 15 - вміст (в %) кислотних варіантів МАт ними): інгібування секреції імуноглобуліну здороCHIR-12.12 у препаративних формах, які містили вими людськими периферичними В-клітинами, або NaCI, або L-аргінін-НСІ як агент для надання стимульованими Т-клітинами; інгібування вижиізотонічності, при їх зберіганні при 25°С протягом вання та/або проліферації здорових людських пе2, 4 або 6 місяців, оцінений за допомогою СІЕХриферичних В-клітин, стимульованих Т-клітинами РХВР-аналізу; лінії Jurkat; інгібування виживання та/або проліфе 11 94264 12 рації здорових людських периферичних В-клітин, за допомогою ДСН-ПААГ, ГФ та/або часопролітної стимульованих експресуючими CD40L клітинами мас-спектрометрії з матрично-активованою лазерабо розчинним лігандом CD40 (sCD40L); інгібуванною десорбцією/іонізацією; і розщеплення, асоціня антиапоптозних внутрішньоклітинних сигналів йованого зі змінами молекулярного заряду (напри«виживання» у будь-яких клітинах, стимульованих клад, асоційованого з деамідуванням), з sCD40L або твердофазним CD40L; інгібування використанням, наприклад, іонообмінної хроматотрансдукції сигналу CD40 у будь-якій клітині при графії (див., наприклад, методи, наведені нижче в лігуванні з sCD40L або твердофазним CD40L; інгіданому описі). бування проліферації людських злоякісних ВВважається, що антагоністичне антитіло до клітин; зниження чутливості, надання нечутливості CD40 або його антигензв'язувальний фрагмент (анергії) та/або переносимості індукції клітинампри приготуванні на його основі фармацевтичної мішеням, які несуть CD40, або клітинам, що несуть композиції, зберігає в цей момент часу необхідну споріднені ліганди CD40, включаючи (але, не оббіологічну активність, якщо відхилення необхідної межуючись тільки ними) Т-клітини й В-клітини; інбіологічної активності в цей момент від необхідної дукція експансії або активації CD4+CD25+біологічної активності в момент приготування фарегуляторних Т-клітин (див., наприклад, дані про рмацевтичної композиції становить приблизно відторгнення донорської алоантигенспецифічної 30%, переважно приблизно 20% за результатами тканини при взаємодії CD40-CD40L, van Maurik і придатного аналізу для визначення необхідної ін., J. Immunol. 169, 2002, стор. 5401-5404); цитобіологічної активності. Методи аналізу для оцінки токсичність за допомогою будь-якого механізму необхідної біологічної активності антагоністичних (включаючи (але, не обмежуючись тільки ними) антитіл до CD40 представлені в даному описі, а антитіло-обумовлену клітиннозалежну цитотоксианалізи активності їх антигензв'язувальних фрагчність (ADCC), комплементзалежну цитотоксичментів можна здійснювати відповідно до методів, ність (CDC), що знижує регуляцію проліферації описаних у попередніх заявках, які озаглавлені та/або апоптоз клітин-мішеней); модуляцію секре«Antagonist Anti-CD40 Monoclonal Antibodies and ції цитокінів клітиною-мішенню та/або експресії Methods for Their Use» («Антагоністичні монокломолекули на клітинній поверхні; і їх комбінації. нальні антитіла до CD40 і способи їх застосуванМетоди моніторингу стабільності білків добре ня»), поданих 4 листопада 2003 p., 26 листопада відомі в даній галузі (див., наприклад, Jones , Adv. 2003 р. і 27 квітня 2004 p., і переуступлених заявок Drag Delivery Rev. 10, 1993, стор. 29-90; Peptide на патент США 60/517337 (досьє в патентного поand Protein Drag Delivery, під ред. Lee, вид-во віреного № РР20107.001 (035784/258442)), Marcel Dekker, Inc., New York, New York, 1991; і 60/525579 (досьє в патентного повіреного № аналізи стабільності, наведені в даному описі). У РР20107.002 (035784/271525)) і 60/565710 (досьє в цілому, стабільність білків оцінюють при вибраній патентного повіреного № РР20107.003 температурі протягом певного періоду часу. У (035784/277214)) відповідно; і міжнародній заявці кращих варіантах здійснення винаходу стабільна на патент PCT/US2004/037152 (досьє в патентного утримуюче антитіло фармацевтична композиція повіреного № РР20107.004 (035784/282916)), яка забезпечується стабільність антагоністичного анназивається також «Antagonist Anti-CD40 титіла до CD40 або його антигензв'язувального Monoclonal Antibodies and Methods for Their Use» фрагмента при зберіганні при кімнатній темпера(«Антагоністичні моноклональні антитіла до CD40 і турі (приблизно 25°С) протягом принаймні 1 місяспособи їх застосування»), поданої 4 листопада ця, принаймні 3 місяців або принаймні 6 місяців, 2004 р. і опублікованої як WO 2005/044854; зміст та/або стабільність при зберіганні приблизно при кожного з документів повністю включений в даний 2-8°С протягом принаймні 6 місяців, принаймні 9 опис як посилання (див. також аналізи, описані в місяців, принаймні 12 місяців, принаймні 18 місяпопередній заявці, яка називається «Methods for ців, принаймні 24 місяця. Diagnosis and Treatment of Proliferative Disorders Вважається, що білок, такий як антитіло, при Mediated by CD40 Signaling», «Способи діагностиприготуванні на його основі фармацевтичної комки й лікування проліферативних захворювань, позиції зберігає фізичну стабільність у цей момент опосередковуваних передачею сигналу CD40», часу, якщо не виявлено візуальних ознак (тобто поданої 9 грудня 2005 p., і переуступленій заявці зміни кольору або втрати прозорості) або вимірюна патент США 60/749285 (досьє в патентного пованих ознак (наприклад, при використанні гельвіреного № РР028035.0002 (035784/304312)) і відфільтрації (ГФ) або розсіювання в УФ-променях) повідній міжнародній заявці на патент осадження, агрегації та/або денатурації у в казаній PCT/US2006/019414 (досьє в патентного повіренофармацевтичній композиції. Відносно хімічної стаго № РР028035.0003 (035784/311611)), поданої 18 більності вважається, що білок, такий як антитіло, травня 2006 р. і опублікованої як WO 2006/125143; при приготуванні на його основі фармацевтичної і в попередній заявці, яка називається «Methods for композиції, зберігає хімічну стабільність у цей моDiagnosis and Treatment of Diseases Having an мент часу, якщо оцінка хімічної стабільності свідAutoimmune and/or Inflammatory Component», чить про те, що білок (тобто антитіло) зберігає («Способи діагностики й лікування захворювань, біологічну активність, що представляє інтерес, у що мають аутоімунний та/або запальний комповказаній фармацевтичній композиції. Методи монінент»), поданої 9 грудня 2005 p., переуступленій торингу змін хімічної стабільності добре відомі в заявці на патент США 60/749336 (досьє в патентданій галузі й включають (але, не обмежуючись ного повіреного № РР028062.0002 тільки ними) методи виявлення хімічно змінених (035784/304311)), і відповідній міжнародній заявці форм білка в результаті розщеплення, наприклад, на патент PCT/US2006/019325 (досьє в патентного 13 94264 14 повіреного № РР028062.0003 (035784/311608)), 20,0мг/мл, від приблизно 20,0мг/мл до приблизно поданої 18 травня 2006 p., і опублікованої як WO 25,0мг/мл, від приблизно 25,0мг/мл до приблизно 2006/125117; зміст кожного з документів повністю 30,0мг/мл, від приблизно 30,0мг/мл до приблизно включений в даний опис як посилання. Аналізи 35,0мг/мл, від приблизно 35,0мг/мл до приблизно описані також в Schultze і ін., Proc. Natl. Acad. Sci. 40,0мг/мл, приблизно від 40,0мг/мл до приблизно USA 92, 1998, стор. 8200-8204; Denton і ін., Pediatr. 45,0мг/мл або від приблизно 45,0мг/мл до приблиTransplant 2, 1998, стор. 6-15; Evans і ін., J. зно 50,0мг/мл. В інших варіантах здійснення винаImmunol. 164, 2000, стор. 688-697; Noelle, Agents ходу до складу рідких фармацевтичних композицій Actions Suppl. 49,1998, стор. 17-22; Lederman і ін., антагоністичне антитіло до CD40 або його антигеCurr. Opin. Hematol. 3, 1996, стор. 77-86; Coligan і нзв'язувальний фрагмент входять у концентрації ін., Current Protocols in Immunology 13, 1991, с 12; приблизно 15,0мг/мл, приблизно 16,0мг/мл, прибKwekkeboom і ін., Immunology 79, 1993, с. з. 439лизно 17,0мг/мл, приблизно 18,0мг/мл, приблизно 444; і US 5674492 і 5847082; вміст яких включено 19,0мг/мл, приблизно 20,0мг/мл, приблизно як посилання. 21,0мг/мл, приблизно 22,0мг/мл, приблизно Антагоністичне антитіло до CD40 або його ан23,0мг/мл, приблизно 24,0мг/мл, приблизно тигензв'язу вальний фрагмент, на основі яких го25,0мг/мл, приблизно 26,0мг/мл, приблизно тують препаративну форму за допомогою спосо27,0мг/мл, приблизно 28,0мг/мл, приблизно бів, запропонованих у даному винаході, можна 29,0мг/мл, приблизно 30,0мг/мл, приблизно одержувати за допомогою будь-якого методу, ві31,0мг/мл, приблизно 32,0мг/мл, приблизно домого в даній галузі, включаючи методи, пред33,0мг/мл, приблизно 34.0мг/мл або приблизно ставлені в даному описі. В одному з варіантів здій35,0мг/мл. снення винаходу антагоністичне антитіло до CD40, Згідно із даним винаходом на основі антагонінаприклад моноклональне антитіло CHIR-12.12 стичного антитіла до CD40, наприклад моноклонаабо CHIR-5.9, або його антигензв'язувальний фрального антитіла CHIR-12.12 або CHIR-5.9, або його гмент одержують рекомбінантно в лінії клітин СКО антигензв'язувального фрагмента готують препавідповідно до описаного нижче методу. ративну форму з додаванням буфера, що підтриПісля одержання й очищення антагоністичне мує значення рН фармацевтичної композиції на антитіло до CD40 або його антигензв'язувальний рівні від приблизно рН 5,0 до приблизно рН 7,0, і фрагмент можна включати в препаративну форму аргінін у кислотній формі, позначений у контексті у вигляді рідкої фармацевтичної композиції за доданого опису як аргінін-НСІ, у кількості, достатній помогою описаного нижче способу. Якщо антагонідля того, щоб зробити композицію практично ізостичне антитіло до CD40 або його антигензв'язутонічною. Під поняттям «практично ізотонічна» вальний фрагмент слід зберігати до приготування мають на увазі, що водна препаративна форма на його основі препаративої форми, його можна має осмоляльність від приблизно 240мМолів/кг до приблизно 360мМолів/кг, переважно від приблизно заморожувати, наприклад при температурі -20°С, 240 до приблизно 340мМолів/кг, більш переважно а потім піддавати розморожуванню при кімнатній від приблизно 250 до приблизно 330мМолів/кг, ще температурі для подальшого приготування препабільш переважно від приблизно 260 до приблизно ративної форми на його основі. 320мМолів/кг, ще більш переважно від приблизно Рідкі фармацевтичні композиції, запропоновані 270 до приблизно 310мМолів/кг. У деяких варіану винаході, містять антагоністичне антитіло до тах здійснення винаходу осмоляльність рідкої фаCD40 або його антигензв'язувальний фрагмент у рмацевтичної композиції становить приблизно терапевтично або профілактично ефективній кіль295мМолів/кг. Методи визначення ізотонічності кості. Кількість антитіла або його антигензв'язуварозчину відомі фахівцям у даній галузі (див., нального фрагмента, які присутні у препаративній приклад, Setnikar і ін., J. Am. Pharm. Assoc. 48, формі, залежить від шляху введення й необхідно1959, с. 628). го об'єму дози. Таким чином, до складу фармацевАргінін-НСІ служить не тільки як агент для натичних композицій, запропонованих у даному видання і зотонічності, але також служить для стабінаході, антагоністичне антитіло до CD40, лізації антитіла від конформаційних змін, утвореннаприклад, антитіло CHIR-12.12 або CHIR-5.9, або ня агрегатів, фрагментації та/або деамідування в його антигензв'язувальний фрагмент входять у процесі зберігання рідких фармацевтичних компоконцентрації від приблизно 0,1мг/мл до приблизно зицій, запропонованих у винаході. Під поняттям «у 50,0мг/мл, від приблизно 0,5мг/мл до приблизно процесі зберігання» мають на увазі, що рідку фар40,0мг/мл, від приблизно 1,0мг/мл до приблизно мацевтичну композицію або препаративну форму 35,0мг/мл, від приблизно 1,0мг/мл до приблизно після приготування не відразу вводять індивідуу30,0мг/мл, від приблизно 5,0мг/мл до приблизно мові. Замість цього після приготування її впакову25,0мг/мл, від приблизно 5,0мг/мл до приблизно ють для зберігання або в рідкій формі, або в замо20,0мг/мл, від приблизно 10,0мг/мл до приблизно роженому стані, або у висушеній формі для 35,0мг/мл або від приблизно 15,0мг/мл до приблинаступного відновлення з одержанням рідкої форзно 25,0мг/мл. У деяких варіантах здійснення вими або іншої форми, придатної для введення іннаходу до складу рідких фармацевтичних комподивідуумові. Під поняттям «висушена форма» мазицій антагоністичне антитіло до CD40 або його ють на увазі, що рідку фармацевтичну композицію антигензв'язувальний фрагмент входять у конценабо препаративну форму сушать або сушінням трації від приблизно 0,1мг/мл до приблизно виморожуванням (тобто піддають ліофілізації; 5,0мг/мл, від приблизно 5,0мг/мл до приблизно див., наприклад, Williams і Роllі, J. Parenteral Sci. 10,0мг/мл, від приблизно 10,0мг/мл до приблизно Technol. 38, 1984, стор. 48-59), розпилювальним 15,0мг/мл, від приблизно 15,0мг/мл до приблизно 15 94264 16 сушінням (див. Masters, в: Spray-Drying Handbook, цевтичних композиціях, запропонованих у винахо5-е вид., вид-во Longman Scientific and Technical, ді, повинна змінюватися залежно від значення рН, Essez, U.K., 1991, стор. 491-676; Broadhead і ін., оптимального для стабільності конкретного антаDrug Devel. Ind. Pharm. 18, 1992, стор. 1169-1206; і гоністичного антитіла до CD40, що представляє Mumenthaler і ін., Pharm. Res. 11, 1994, стор. 12інтерес. Визначення оптимального значення рН 20), або сушінням на повітрі (Carpenter і Crowe, можна здійснювати за допомогою методів, загальCryobiology 25, 1988, стор. 459-470; і Roser, ноприйнятих для даної галузі, включаючи, наприBiopharm. 4, 1991. стор. 47-53). Конформаційні клад, диференціальну сканувальну калориметрію зміни, утворення агрегатів, фрагментація та/або (DSC), яку застосовують для оцінки конформаційдеамідування антитіла в процесі зберігання рідких ної стабільності; ДСН-ПААГ і гель фільтрацію (ГФфармацевтичних композицій може впливати на РХВР), що застосовують для оцінки агрегації й біологічну активність антитіла, приводячи до знифрагментації; і аналізи з використанням катіонооження терапевтичної ефективності фармацевтичбмінної РХВР (СІЕХ-РХВР), які застосовують для ної композиції. Крім того, утворення агрегатів може оцінки розщеплення, зв'язаного зі зміною заряду. викликати інші проблеми, такі як блокада трубок, Кращими значеннями рН рідких фармацевтичних мембран або насосів, коли фармацевтичну компокомпозицій, запропонованих у винаході, є значензицію, яка містить антитіло, вводять за допомогою ня рН, що становлять приблизно 5,0, 5,1, 5,2, 5,3, системи для інфузії. 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, Будь-який стереоізомер (тобто, L-, D- або DL6,6, 6,7, 6,8, 6,9, 7,0 і інші значення в діапазоні від ізомер) аргініну або комбінації стереоізомерів моприблизно рН 5,0 до приблизно рН 7,0. У деяких жуть бути присутні у фармацевтичних композиціях, варіантах здійснення винаходу забуферювальний запропонованих до винаході, якщо аргінін знахоагент підтримує значення рН фармацевтичної диться в кислотній формі, тобто у вигляді аргінінукомпозиції на рівні від приблизно рН 5,0 до прибНСІ. Переважно застосовують L-стереоізомер. До лизно рН 6,5, від приблизно рН 5,0 до приблизно складу композицій, запропонованих у винаході, рН 6,0, від приблизно рН 5,0 до приблизно рН 5,5, можуть входити також аналоги цієї амінокислоти. від приблизно рН 5,5 до приблизно 7,0, від прибПід поняттям «аналог амінокислоти» мають на лизно рН 5,5 до приблизно рН 6,5 або від приблиувазі похідне амінокислоти, яке зустрічається в зно рН 5,5 до приблизно рН 6,0. природних умовах, що має приблизно аналогічну Будь-який прийнятний забуферювальний необхідну дію в тому плані, що робить композицію агент, що підтримує значення рН рідкої фармацевпрактично ізотонічною, а також знижує утворення тичної композиції, що містить антагоністичне антиагрегатів, фрагментацію та/або деамідування потіло до CD40, на рівні від приблизно рН 5,0 до ліпептиду в процесі зберігання рідких фармацевприблизно рН 7,0, можна застосовувати в препатичних композицій, запропонованих у винаході. ративній формі, якщо при цьому зберігаються вкаПрийнятними аналогами аргініну є, наприклад, зані вище фізико-хімічна стабільність і необхідна аміногуанідин і N-моноетил-L-аргінін. Також як і біологічна активність антитіла. Прийнятними зааргінін, амінокислотні аналоги включають у компобуферювальними агентами є (але, не обмежуюзиції в кислій формі. чись тільки ними) загальноприйняті кислоти і їх Концентрація аргініну-НСІ у фармацевтичній солі, у яких протиіон може являти собою, наприкомпозиції повинна залежати від внеску в ствоклад, натрій, калій, амоній, кальцій або магній. рення тонічності інших компонентів. У деяких варіПрикладами загальноприйнятих кислот і їх солей, антах здійснення винаходу концентрація аргінінуякі можна застосовувати для забуферювання рідНСІ становить від приблизно 50мМ до приблизно кої фармацевтичної композиції є (але, не обмежу300мМ, від приблизно 50мМ до приблизно 250мМ, ючись тільки ними) лимонна кислота або цитрат, від приблизно 50мМ до приблизно 200мМ, від янтарна кислота або сукцинат, оцтова кислота або приблизно 50мМ до приблизно 175мМ, від прибацетат, винна кислота або тартрат, фосфорна лизно 50мМ до приблизно 150мМ, від приблизно кислота або фосфат, глюконова кислота або глю75мМ до приблизно 175мМ, від приблизно 75мМ конат, глутамінова кислота або глутамат, аспарадо приблизно 150мМ, від приблизно 100мМ до гінова кислота або аспартат, малеїнова кислота приблизно 175мМ, від приблизно 100мМ до прибабо малеат і яблучна кислота або малеат і буфери лизно 200мМ, від приблизно 100мМ до приблизно на основі яблучної кислоти або малату. Відомо, 150мМ, від приблизно 125мМ до приблизно що забуферювальний агент може являти собою 175мМ, від приблизно 125мМ до приблизно суміш кислоти й солі кислоти, наприклад, суміш 150мМ, від приблизно 130мМ до приблизно лимонної кислоти й цитрату (позначена в контексті 170мМ, від приблизно 130мМ до приблизно даного опису як буфер на основі цитрату/лимонної 160мМ, від приблизно 135мМ до приблизно кислоти), суміш янтарної кислоти й сукциата (поз155мМ, від приблизно 140мМ до приблизно 155мМ начена в контексті даного опису як буфер на осноабо від приблизно 145мМ до приблизно 155мМ. В ві сукцинату/янтарної кислоти), суміш оцтової кисодному з таких варіантів здійснення винаходу конлоти й ацетату (позначена в контексті даного центрація аргініну-НСІ становить приблизно опису як буфер на основі ацетату/оцтової кисло125мМ, приблизно 150мМ або приблизно 175мМ. ти), і т.п. для кожної з вищевказаних пар кислоЗначення рН рідкої фармацевтичної композита/сіль кислоти. Концентрація забуферювального ції, яка містить антитіло, впливає на стабільність агента може становити від приблизно 1мМ до привхідні в її склад антитіла, насамперед, впливаючи близно 50мМ, у тому числі приблизно 1мМ, 2мМ, на утворення агрегатів. Таким чином, кількість за5мМ, 8мМ, 10мМ, 15мМ, 20мМ, 25мМ, 30мМ, буферювального агента, який присутній у фарма35мМ, 40мМ, 45мМ, 50мМ або мати інші такі зна 17 94264 18 чення в діапазоні від приблизно 1мМ до приблизно буфер на основі цитрату/лимонної кислоти, у кон50мМ. У деяких варіантах здійснення винаходу центрації від приблизно 1мМ до приблизно 20мМ, концентрація забуферювального агента становить від приблизно 5мМ до приблизно 15мМ, переважвід приблизно 5мМ до приблизно 15мМ, у тому но приблизно 10мМ. В інших варіантах здійснення числі приблизно 5мМ, 6мМ, 7мМ, 8мМ, 9мМ, винаходу рідка фармацевтична композиція містить 10мМ, 11мМ, 12мМ, 13мМ, 14мМ, 15мМ або мати антагоністичне антитіло до CD40, наприклад, моінші значення в діапазоні від приблизно 5мМ до ноклональне антитіло CHIR-12.12 або CHIR-5.9, приблизно 15мМ. або його антигензв'язувальний фрагмент у концеУ деяких варіантах здійснення винаходу рідка нтрації від приблизно 0,1мг/мл до приблизно фармацевтична композиція містить у необхідній 50,0мг/мл, від приблизно 5,0мг/мл до приблизно концентрації (тобто, від приблизно 0,1мг/мл до 35,0мг/мл, від приблизно 10,0мг/мл до приблизно приблизно 50,0мг/мл, як вказане вище) антагоніс35,0мг/мл або від приблизно 10,0мг/мл до приблитичне антитіло до CD40, запропоноване у винахозно 20,0мг/мл; аргінін-НСІ в кількості, достатній ді, наприклад, моноклональне антитіло CHIR-12.12 для того, щоб зробити композицію практично ізоабо CHIR-5.9, або його антигензв'язувальний фратонічною, і забуферювальний агент, що представгмент, аргінін-НСІ у кількості, достатній для того, ляє собою буфер на основі цитрату натрію щоб зробити композицію практично ізотонічною, і /лимонної кислоти, у концентрації від приблизно забуферювальний агент, що представляє собою 1мМ до приблизно 20мМ, від приблизно 5мМ до буфер на основі цитрату/лимонної кислоти, при приблизно 15мМ, переважно приблизно 10мМ. цьому концентрація забуферювального агента є У деяких кращих варіантах здійснення винахотакий, що забуферювальний агент підтримує знаду рідка фармацевтична композиція містить антачення рН фармацевтичної композиції на рівні від гоністичне антитіло до CD40, наприклад, моноклоприблизно рН 5,0 до приблизно рН 7,0, переважно нальне антитіло CHIR-12.12 або CHIR-5.9, або від приблизно рН 5,0 до приблизно рН 6,5, у тому його антигензв'язувальний фрагмент; забуферючислі приблизно рН 5,0, 5,5, 6,0, і 6,5. Під «цитратвальний агент для підтримки значення рН фарманим» буфером мають на увазі буфер, що містить цевтичної композиції на рівні від приблизно рН 5,0 сіль лимонної кислоти. У кращому варіанті здійсдо приблизно рН 7.0; і аргінін-НСІ у концентрації нення винаходу протиіон цитрату являє собою від приблизно 100мМ до приблизно 200мМ. У декатіон натрію, і таким чином, компонентом цитратяких із цих варіантів здійснення винаходу забуфеного буфера є цитрат натрію. Однак очікується, що рювальний агент являє собою буфер на основі ефективним може бути будь-який катіон. Іншими цитрату натрію/лимонної кислоти в концентрації можливими катіонами цитрату є (але, не обмежувід приблизно 5мМ до приблизно 15мМ, рідка фаючись тільки ними) калій, амоній, кальцій і магній. рмацевтична композиція містить антагоністичне Як вказано вище, буфер на основі цитраантитіло до CD40, наприклад, моноклональне анту/лимонної кислоти містить суміш кислоти (тобто титіло CHIR-12.12 або CHIR-5.9, або його антигенлимонної кислоти) і сольової форми кислоти (тобзв'язувальний фрагмент, і значення рН фармацевто цитрат), при цьому протиіон сольової форми тичної композиції становить від приблизно рН 5,0 кислоти може являти собою будь-який прийнятний до приблизно рН 7,0, від приблизно рН 5,0 до прикатіон. В одному з варіантів здійснення винаходу близно рН 6,5 або від приблизно рН 5,5 до прибпротиіон сольової форми кислоти являє собою лизно рН 6,0. В інших варіантах здійснення винакатіон натрію й тому забуферювальний агент явходу рідка фармацевтична композиція містить ляє собою суміш лимонної кислоти й цитрату наантагоністичне антитіло до CD40, наприклад, мотрію. Як вказано вище, концентрація буфера на ноклональне антитіло CHIR-12.12 або CHIR-5.9, основі цитрату/лимонної кислоти може становити або його антигензв'язувальний фрагмент у концевід приблизно 1мМ до приблизно 50мМ, у тому нтрації від приблизно 0,1мг/мл до приблизно числі приблизно 1мМ, 2мМ, 5мМ, 8мМ, 10мМ, 50,0мг/мл, від приблизно 5,0мг/мл до приблизно 15мМ, 20мМ, 25мМ, 30мМ, 35мМ, 40мМ, 45мМ, 35,0мг/мл або від приблизно 10,0мг/мл до прибли50мМ або мати інші значення в діапазоні від прибзно 35,0мг/мл, у той числі приблизно 10,0мг/мл, лизно 1мМ до приблизно 50мМ. У деяких варіанприблизно 15,0мг/мл, приблизно 20,0мг/мл, прибтах здійснення винаходу концентрація буфера на лизно 25,0мг/мл, приблизно 30,0мг/мл або приблиоснові цитрату/лимонної кислоти становить від зно 35,0мг/мл; приблизно 150мМ аргінін-НСІ; і заприблизно 5мМ до приблизно 15мМ, у тому числі буферювальний агент являє собою приблизно 5мМ, 6мМ, 7мМ, 8мМ, 9мМ, 10мМ, 11мМ, 12мМ, 10мМ буфер на основі цитрату натрію/лимонної 13мМ, 14мМ або приблизно 15мМ. кислоти; при цьому значення рН препаративної В інших варіантах здійснення винаходу рідка форми становить приблизно 5,5. фармацевтична композиція містить антагоністичне Розщеплення білка через заморожуванняантитіло до CD40, наприклад, моноклональне анвідтавання або механічних зсувних впливів при титіло CHIR-12.12 або CHIR-5.9, або його антигенприготуванні рідких фармацевтичних композицій, зв'язувальний фрагмент у концентрації від прибзапропонованих у даному винаході, можна інгібулизно 0,1мг/мл до приблизно 50,0мг/мл, від вати шляхом включення поверхнево-активних реприблизно 5,0мг/мл до приблизно 35,0мг/мл, від човин у препаративну форму для зменшення поприблизно 10,0мг/мл до приблизно 35,0мг/мл або верхневого натягу на поверхні розділу розчинвід приблизно 10,0мг/мл до приблизно 20,0мг/мл; повітря. Таким чином, у деяких варіантах здійсаргінін-НСІ в кількості, достатній для того, щоб нення винаходу рідка фармацевтична композиція зробити композицію практично ізотонічною, і замістить антагоністичне антитіло до CD40, наприбуферювальний агент, що представляє собою клад, моноклональне антитіло CHIR-12.12 або 19 94264 20 CHIR-5.9, або його антигензв'язувальний фрагції від приблизно 50мМ до приблизно 300мМ, від мент; забуферювальний агент для підтримання приблизно 100мМ до приблизно 200мМ або від значення рН фармацевтичної композиції на рівні приблизно 50мМ до приблизно 150мМ; і фармацевід приблизно рН 5,0 до приблизно рН 7,0; аргінінвтична композиція містить також активнуНСІ у кількості, достатній для того, щоб зробити поверхнево-активну речовину, наприклад, полісокомпозицію практично ізотонічною; а також містить рбат 20, у кількості від приблизно 0,001% до прибповерхнево-активну речовину. В інших варіантах лизно 1,0% (мас./об.) або від приблизно 0,001% до здійснення винаходу рідка фармацевтична компоприблизно 0,5% (мас./об.). В інших варіантах здійзиція містить антагоністичне антитіло до CD40, снення винаходу рідка фармацевтична композиція наприклад, моноклональне антитіло CHIR-12.12 містить антагоністичне антитіло до CD40, наприабо CHIR-5.9, або його антигензв'язувальний фраклад, моноклональне антитіло CHIR-12.12 або гмент; забуферювальний агент для підтримання CHIR-5.9, або його антигензв'язувальний фрагзначення рН фармацевтичної композиції на рівні мент у концентрації від приблизно 0,1мг/мл до від приблизно рН 5.0 до приблизно рН 7,0; аргінінприблизно 50,0мг/мл, від приблизно 5,0мг/мл до НСІ у концентрації від приблизно 50мМ до приблиприблизно 35,0мг/мл або від приблизно 10,0мг/мл зно 300мМ, або від приблизно 100мМ до приблиздо приблизно 35,0мг/мл, у тому числі приблизно но 200мМ; а також містить поверхнево-активну 10,0мг/мл, приблизно 15,0мг/мл, приблизно речовину. 20,0мг/мл, приблизно 25,0мг/мл, приблизно Типові застосовувані поверхнево-активні ре30,0мг/мл або приблизно 35,0мг/мл; аргінін-НСІ у човини являють собою неіоногенні поверхневоконцентрації від приблизно 50мМ до приблизно активні речовини, у тому числі складні ефіри полі200мМ, включаючи приблизно 150мМ аргінін-НСІ; оксіетиленсорбітолу, такі як полісорбат 80 (Твін забуферювальний агент, що представляє собою 80) і полісорбат 20 (Твін 20); складні ефіри поліокбуфер на основі цитрату натрію/лимонної кислоти, сипропілену-поліоксіетилен}, такі як Pluronic F68; у концентрації від приблизно 5мМ до приблизно поліоксіетиленові спирти, такі як Brij 35; симети20мМ, у тому числі приблизно 10мМ; і фармацевкон; поліетиленгліколь, такий як ПЕГ400; лізофостична композиція необов'язково містить активнуфатидилхолін; і полioксіетилен-пара-третповерхнево-активну речовину, наприклад, полісооктилфенол, такий як Triton X-100. Класична старбат 20, у кількості від приблизно 0,001% до приббілізація фармацевтичних засобів поверхневолизно 1,0% (мас./об.), у тому числі від приблизно активними речовинами або емульгаторами описа0,001% до приблизно 0,5% (мас./об.), від приблизна, наприклад, в Levine і ін, J. Parenteral Sci. но 0,01% до приблизно 0,25% (мас./об.), від прибTechnol. 45(3), 1991, стор. 160-165, публікація лизно 0,025% до приблизно 0,2% (мас./об.), від включена в даний опис як посилання. Кращою приблизно 0,025% до приблизно 0,1% (мас./об.) поверхнево-активною речовиною, застосовуваною або від приблизно 0,05% до приблизно 0,2% при втіленні на практиці даного винаходу, є полі(мас./об.); при цьому значення рН рідкої фармацесорбат 20 або полісорбат 80. Коли в композицію втичної композиції знаходиться на рівні від прибвключають поверхнево-активну речовину, то її, як лизно рН 5,0 до приблизно рН 7,0, від приблизно правило, додають у кількості від приблизно рН 5,0 до приблизно рН 6,0, від приблизно рН 5,0 0,001% до приблизно 1,0%, від приблизно 0,001% до приблизно рН 5,5, від приблизно рН 5,5 до придо приблизно 0,5%, від приблизно 0,001% до приблизно рН 6,5, від приблизно рН 5,5 до приблизно близно 0,4%. від приблизно 0,001% до приблизно рН 6,0 або приблизно рН 5,5. 0,3%, від приблизно 0,001% до приблизно 0,2%, Рідка фармацевтична композиція може праквід приблизно 0,005% до приблизно 0,5%, від притично не містити будь-яких консервантів й інших близно 0,005% до приблизно 0,2%, від приблизно носіїв, ексципієнтів або стабілізаторів. В іншому 0,01% до приблизно 0,5%, від приблизно 0,01% до варіанті фармацевтична композиція необов'язково приблизно 0,2%, від приблизно 0,03% до приблизможе включати один або декілька консервантів, но 0,5%, від приблизно 0,03% до приблизно 0,3%, наприклад, антибактеріальних агентів, фармацеввід приблизно 0,05% до приблизно 0,5% або від тично прийнятних носіїв, ексципієнтів або стабіліприблизно 0,05% до приблизно 0,2%, при цьому заторів, представлених у даному описі, за умови, відсотки являють собою масові/об'ємні відсотки що вони не роблять несприятливого впливу на (мас./об.) фізико-хімічну стабільність антитіла до CD40 або Таким чином, у деяких варіантах здійснення його антигензв'язувального фрагмента. Приклавинаходу рідка фармацевтична композиція містить дами прийнятних носіїв, ексципієнтів і стабілізатоантагоністичне антитіло до CD40, наприклад, морів є (але, не обмежуючись тільки ними) додаткові ноклональне антитіло CHIR-12.12 або CHIR-5.9, забуферювальні агенти, співрозчинники, поверхабо його антигензв'язувальний фрагмент; забуринево-активні речовини, антиоксиданти, включаючи вающий агент, що являє собою буфер на основі аскорбінову кислоту й метіонін, хелатувальні агенцитрату/лимонної кислоти, наприклад, буфер на ти, такі як ЕДТК, комплекси з металами (наприоснові цитрату натрію/лимонної кислоти, у конценклад, комплекси Zn-білок) і біорозкладні полімери, трації від приблизно 1мМ до приблизно 50мМ, від такі як складні поліефіри. Обговорення складів і приблизно 5мМ до приблизно 25мМ або від прибвибір фармацевтично прийнятних носіїв, стабілізализно 5мМ до приблизно 15мМ; значення рН комторів і агентів для надання ізотонічності можна позиції знаходиться на рівні від приблизно рН 5,0 почерпнути в довіднику Remington's Pharmaceutical до приблизно рН 7,0, від приблизно рН 5,0 до приSciences, 18-е вид., вид-во Mack Publishing близно рН 6,5 або від приблизно рН 5,5 до прибCompany, Eaton, Pennsylvania, 1990, включеному в лизно рН 6,0; аргінін-НСІ є присутнім у концентраданий опис як посилання. 21 94264 22 Таким чином, в одному з варіантів здійснення приклад, полісорбат 20 або полісорбат 80, у кільвинаходу рідкі фармацевтичні композиції, які міскості від приблизно 0,001% до приблизно 1,0% тять антагоністичні антитіла до CD40 запропоно(мас./об.) або від приблизно 0.001% до приблизно вані у винаході, містять також амінокислоту метіо0,5% (мас./об.); і фармацевтична композиція доданін для інгібування окислення окислювальних тково містить метіонін у концентрації від приблизамінокислотних залишків у поліпептидних ланцюно 0,5мМ до приблизно 20,0мМ, від приблизно гах антитіл. Під поняттям «інгібування» мають на 0,5мМ до приблизно 10,0мМ, від приблизно 1,0мМ увазі мінімальне нагромадження окислених видів до приблизно 20,0мМ, від приблизно 1,0мМ до протягом часу. Інгібування окислення приводить приблизно 10,0мМ, від приблизно 1,0мМ до прибдо більш тривалого збереження антагоністичного лизно 7,0мМ, від приблизно 2,0мМ до приблизно антитіла до CD40 у відповідній молекулярній фор6,0мМ або від приблизно 2,5мМ до приблизно мі. Можна використовувати будь-який стереоізо5,0мМ. В інших варіантах здійснення винаходу мер метіоніну (L-, D- або DL-ізомер) або їх комбірідка фармацевтична композиція містить антагонінації. Кількість, яку додають, повинна являти стичне антитіло до CD40, наприклад, моноклонасобою кількість, достатню для інгібування окисльне антитіло CHIR-12.12 або CHIR-5.9 або його лення оксилюваних амінокислотних залишків, у антигензв'язувальний фрагмент, у концентрації від результаті якого кількість окислених видів повинна приблизно 0,1мг/мл до приблизно 50,0мг/мл, від відповідати кількості, встановлений регулювальприблизно 5,0мг/мл до приблизно 35,0мг/мл або ними органами. Як правило, це означає, що комвід приблизно 10,0мг/мл до приблизно 35,0мг/мл, у позиція містить не більше ніж від приблизно 10% тому числі приблизно 10,0мг/мл, приблизно до приблизно 30% продуктів окислення. Звичайно 15,0мг/мл, приблизно 20,0мг/мл, приблизно для досягнення вказаної мети додають метіонін у 25,0мг/мл, приблизно 30,0мг/мл або приблизно такій кількості, щоб співвідношення доданого меті35,0мг/мл; аргінін-НСІ у концентрації від приблизоніну й залишків метіоніну становило від приблизно 50мМ до приблизно 200мМ, у тому числі прибно 1:1 до приблизно 1000:1, найбільш переважно лизно 150мМ аргінін-НСІ; буфер на основі цитрату від 10:1 до приблизно 100:1. натрію/лимонної кислоти в концентрації від прибПереважну кількість метіоніну, яку додають, лизно 5мМ до приблизно 20мМ, у тому числі прибможна легко визначати емпірично при приготуванлизно 10мМ; необов'язково поверхнево-активну ні композиції, що містить антагоністичне антитіло речовину, наприклад, полісорбат 20, у кількості від до CD40, яке представляє інтерес або його антиприблизно 0,001% до приблизно 1,0% (мас./об.),у гензв'язувальний фрагмент, використовуючи різні тому числі від приблизно 0,001% до приблизно концентрації метіоніну й визначаючи відносний 0,5% (мас./об.), від приблизно 0,01% до приблизно вплив на утворення окислених видів поліпептиду 0,25% (мас./об.), від приблизно 0,025% до приблиза допомогою, наприклад, хроматографічного роззно 0,2% (мас./об.), від приблизно 0,025% до приділення видів молекул і ідентифікації з викорисблизно 0,1% (мас./об.) або від приблизно 0,05% до танням стандартів молекулярної маси поліпептиприблизно 0,2% (мас./об.); і необов'язково метіодів, наприклад, за допомогою ОФ-РХВР або нін, наприклад, у концентрації від приблизно хроматографії, заснованої на гідрофобній взаємо0,5мМ до приблизно 10,0мМ, від приблизно 1,0мМ дії (НІС), що описана в прикладі 1. Концентрація до приблизно 7,0мМ, від приблизно 2,0мМ до приметіоніну, при використанні якої досягається макблизно 6,0мМ або від приблизно 2,5мМ до прибсимальне інгібування окислення окислюваних амілизно 5,0мМ, у тому числі приблизно 2,0мМ, прибнокислотних залишків, що не виявляє при цьому лизно 2,5мМ, приблизно 3,0мМ, приблизно 3,5мМ, несприятливого впливу на зв'язане з амінокислоприблизно 4,0мМ, приблизно 4,5мМ, приблизно тою інгібування агрегації антитіла, може являти 5,0мМ або приблизно 5,5мМ; при цьому значення собою переважну кількість метіоніну, яку слід дорН рідкої фармацевтичної композиції становить давати в композицію для додаткового підвищення від приблизно рН 5,0 до приблизно рН 7,0, від стабільності антитіла. приблизно рН 5,0 до приблизно рН 6,0, від прибТаким чином, у деяких варіантах здійснення лизно рН 5,0 до приблизно рН 5,5, від приблизно винаходу рідка фармацевтична композиція містить рН 5,5 до приблизно рН 6,5, від приблизно рН 5,5 антагоністичне антитіло до CD40, наприклад, модо приблизно рН 6,0 або приблизно рН 5,5. ноклональне антитіло CHIR-12.12 або CHIR-5.9, У наступних варіантах здійснення винаходу ріабо його антигензв'язувальний фрагмент; забуфедка фармацевтична композиція містить моноклорювальний агент, що представляє собою буфер нальне антитіло CHIR-12.12 або CHIR-5.9, або на основі цитрату/лимонної кислоти, наприклад, його антигензв'язувальний фрагмент у концентрабуфер на основі цитрату натрію/лимонної кислоти, ції від приблизно 0,1мг/мл до приблизно 50,0мг/мл, у концентрації від приблизно 1мМ до приблизно від приблизно 5,0мг/мл до приблизно 35,0мг/мл 50мМ, від приблизно 5мМ до приблизно 25мМ або або від приблизно 10,0мг/мл до приблизно від приблизно 5мМ до приблизно 15мМ; значення 35,0мг/мл, у тому числі приблизно 10,0мг/мл, прирН фармацевтичної композиції становить від приблизно 15,0мг/мл, приблизно 20,0мг/мл, приблизно близно рН 5,0 до приблизно рН 7,0, від приблизно 25,0мг/мл, приблизно 30,0мг/мл або приблизно рН 5,0 до приблизно рН 6,5 або від приблизно рН 35,0мг/мл; аргінін-НСІ у концентрації від приблиз5,5 до приблизно рН 6,0; аргінін-НСІ є присутнім у но 100мМ до приблизно 200мМ, у тому числі приконцентрації від приблизно 50мМ до приблизно близно 150мМ аргінін-НСІ; буфер на основі цитра300мМ, від приблизно 100мМ до приблизно 200мМ ту натрію/лимонної кислоти в концентрації від або від приблизно 50мМ до приблизно 150мМ; у приблизно 5мМ до приблизно 20мМ, у тому числі ній присутня поверхнево-активна речовина, наприблизно 10мМ; необов'язково поверхнево 23 94264 24 активну речовину, наприклад, полісорбат 20, у ціями, які містять антагоністичне антитіло до кількості від приблизно 0,025% до приблизно 0,1% CD40, які приготовлені в забуференних розчинах, (мас./об.); і необов'язково метіонін, наприклад, у що містять хлорид натрію як агент, що надає ізоконцентрації від приблизно 2,0мМ до приблизно тонічність. Не вдаючись у теорію, можна припусти5,5мМ, у тому числі приблизно 5,0мМ; при цьому ти, що вказана підвищена стабільність при зберізначення рН рідкої фармацевтичної композиції ганні буде присутній у рідкої препаративної становить від приблизно рН 5,0 до приблизно рН форми, незалежно від того, чи зберігається вона у 6,0, у тому числі приблизно рН 5,5. формі, безпосередньо призначеній для наступного Крім вказаних вище агентів, інші стабілізатори, застосування, чи зберігається вона в заморожетакі як альбумін, етилендіамінтетраоцтова кислота ному стані й підлягає відтаванню перед застосу(ЕДТК) або одну з її солей, наприклад, динатрійванням, або її одержують у висушеній формі, такій ЕДТК, необов'язково можна додавати для додатяк ліофілізована, висушена на повітрі або висушекового підвищення стабільності рідких фармацевна розпиленням форма, призначена для наступнотичних композицій. При необхідності можна додаго відновлення в рідку форму або іншу форму певати альбумін у концентрації приблизно 1,0% ред застосуванням. Переважно композиції, (мас./об.) або менше. ЕДТК діє як поглинач іонів запропоновані у винаході, зберігають безпосередметалів, які, як відомо, каталізують багато реакцій ньо у вигляді рідкої форми, повністю реалізуючи окислення, являючи собою додатковий стабілізуюперевагу, пов'язану зі зручністю наявності рідкої чий агент. При необхідності ЕДТК можна додавати форми з підвищеною стабільністю при зберіганні, в концентраціях від приблизно 0,1 до приблизно простотою введення без відновлення й можливіс5,0мМ. тю постачати препаративну форму в попередньо При необхідності в стабілізовані рідкі фармазаповнених готових до вживання шприцах або у цевтичні композиції, що містять антагоністичне вигляді препаратів, які містять декілька доз, якщо антитіло до CD40, запропоновані в даному винапрепаративна форма сумісна з бактеріостатичниході, можна додавати цукри або цукрові спирти. ми агентами. Можна використовувати будь-який цукор, такий як При створенні винаходу встановлено, що коммоно-, ди- або олісахариди, або водорозчинні гліпозиції, запропоновані у винаході, у яких застосокани, включаючи, наприклад, фруктозу, глюкозу, вують аргінін-НСІ як агент для надання ізотонічноманозу, сорбозу, ксилозу, мальтозу, лактозу, сахасті й суміш кислотної й сольової форми, таку як розу, декстран, пулулан, декстрин, циклодекстрин, цитрат натрію/лимонна кислота, як забуферюварозчинний крохмаль, гідроксиетилкрохмаль і нальний агент, являють собою рідку фармацевтичну трієву сіль карбоксиметилцелюлози. Сахароза є композицію, що містить антагоністичне антитіло до найбільш кращою добавкою, яка представляє соCD40, що має підвищену стабільність при зберібою цукор. До цукрових спиртів належать сполуки, ганні щодо рідкої фармацевтичної композиції, що що складаються С4-С8вуглеводню з -ОН-групою, і містить антагоністичне антитіло до CD40, що годо них належать, наприклад, маніт, сорбіт, інозит, тують із використанням хлориду натрію й відповідгалактит, дульцит, ксиліт і арабитолм, при цьому ного забуферювального агента. Підвищена стабіманіт є найбільш кращим як добавка, яка предстальність при зберіганні композиції досягається вляє собою цукровий спирт. Вказані вище цукри завдяки впливу кислотної форми аргініну на стабіабо цукрові спирти можна застосовувати індивідульність антагоністичного антитіла до CD40, що ально або в комбінації. Не існує фіксованої межі має терапевтичну активність, більш конкретно застосовуваної кількості, якщо цукор або цукровий впливу на агрегацію, фрагментацію й деамідуванспирт розчинний у рідкому препараті й не робить ня поліпептиду в процесі зберігання рідких препанесприятливого впливу на стабілізуючу дію, що ративних форм. Крім того, включення аргініну-НСІ досягається за допомогою способів, запропоноваяк засобу, який надає ізотонічність, в рідку компоних у винаході. Переважно цукор або цукровий зицію, що містить антагоністичне антитіло до спирт застосовують у концентрації від приблизно CD40, що забуферена вказаним чином, дозволяє 1,0% до приблизно 15,0% (мас./об.), більш переодержувати практично ізотонічні рідкі фармацевважно від приблизно 2,0% до приблизно 10,0% тичні композиції без додавання додаткових аген(мас./об.). тів, які надають ізотонічність, таких як хлорид наПісля одержання рідкої фармацевтичної комтрію. позиції, запропонованої у винаході, її можна ліофіКислотна форма аргініну, включена в стабільні лізувати для попередження розщеплення. Методи рідкі фармацевтичні композиції, запропоновані у ліофілізації рідких композицій відомі звичайним винаході, захищає антагоністичне антитіло, яке фахівцям у даній галузі. Безпосередньо перед має терапевтичну активність, до CD40 або його застосуванням композицію можна відновлювати антигензв'язувальний фрагмент від фізичних і хістерильним розріджувачем (наприклад, розчином мічних змін, підвищуючи тим самим стабільність Рінгера, дистильованою водою або стерильним антитіла в процесі зберігання композиції. Під «підфізіологічним розчином), що може містити додатвищенням стабільності» мають на увазі, що один кові інгредієнти. Після відновлення композицію або декілька таких показників, як утворення агрепереважно вводять індивідуумові за допомогою гатів, фрагментація й деамідування антитіла, у методів, відомих фахівцям у даній галузі. процесі зберігання рідкої фармацевтичної компоРідкі фармацевтичні композиції, що містять зиції знижуються відносно показників, виявлених антагоністичне антитіло до CD40, запропоновані у при зберіганні рідкої фармацевтичної композиції, винаході, є стабільними й тому мають підвищену що містить антагоністичне антитіло до CD40 і анастабільність при зберіганні в порівнянні з композилогічні компоненти препаративної форми, за виня 25 94264 26 тком відсутності вказаного конкретного що надає активний компонент, якщо вони не впливають на ізотонічність і стабілізуючого агента. Вплив аргініпервинну стабілізуючу дію, що досягається за дону-НСІ на агрегацію антагоністичного антитіла до помогою аргініну-НСІ. Композиція повинна бути CD40 у процесі зберігання рідкої композиції легко безпечною при вибраному шляху введення, вона можна визначати, оцінюючи зміну кількості розповинна бути стерильною й повинна зберігати нечинного антитіла до CD40 у розчині із часом. Ріобхідну терапевтичну активність. вень розчинного антитіла до CD40 у розчині можна Фармацевтичні композиції, запропоновані в оцінювати кількісно за допомогою ряду аналітичданому винаході, можна одержувати, наприклад, них аналізів, адаптованих до визначення інтерес, шляхом попереднього змішування стабілізуючого що представляє, антитіла, такі аналізи являють й забуферювального агентів і будь-яких інших екссобою, наприклад, РХВР зі оберненою фазою ципієнтів до включення антагоністичного антитіла (ОФ)-РХВР гель-фільтрацію (ГФ)-РХВР і УФдо CD40, що представляє інтерес. Будь-які додатабсорбцію. Агрегацію можна оцінювати також за кові ексципієнти, які можна вводити для додаткодопомогою ДСН-ПААГ (див. також наведені нижче вої стабілізації композицій, запропонованих у даприклади). ному винаході, не повинні впливати на стабілізуючі Відносно агрегації ефективну кількість аргініефекти первинного агента, що надає ізотонічність і ну-НСІ для включення в запропоновану у винаході має стабілізуючу дію, тобто аргініну-НСІ, також у рідку фармацевтичну композицію, що містить ансполученні із забуферювальним агентом, які затагоністичне антитіло до CD40, для одержання стосовують для одержання нових представлених у стабільних фармацевтичних композицій, запроподаному описі композицій. Після додавання аргінінованих у винаході, слід розглядати як кількість, ну-НСІ для надання практичної ізотонічності й дощо приводить до зниження утворення агрегатів сягнення підвищеної стабільності антагоністичного протягом часу й, як наслідок, підвищує збереження антитіла до CD40, що представляє інтерес, знав розчині розчинного антагоністичного антитіла до чення рН рідкої композиції регулюють за допомоCD40 у його неагрегованій біологічно активній могою забуферювального агента, переважно у вкалекулярній формі. Так, наприклад, якщо антагонісзаному вище діапазоні, більш переважно до тичне антитіло до CD40 являє собою моноклонадосягнення оптимального для антагоністичного льне антитіло CD40 CHIR-12.12, описане нижче в антитіла до CD40, що представляє інтерес знаприкладах, ефективна кількість аргініну-НСІ, призчення рН, наприклад, до досягнення значення рН, начена для одержання стабільної композиції, защо становить приблизно від рН 5,0 до рН 7,0, пепропонованої у винаході, повинна являти собою реважно до досягнення значення рН, що станокількість, яка приводить до підвищення збереженвить приблизно 5,5, у випадку моноклонального ня антитіла CHIR-12.12 у його мономерній молекуантитіла CHIR-12.12. Хоча значення рН можна лярній формі. регулювати після додавання в композицію антагоНе вдаючись у теорію, підвищена стабільність ністичного антитіла до CD40, переважно його репри зберіганні запропонованої у винаході стабільгулювати до введення вказаного поліпептиду, ної рідкої композиції, що містить антагоністичне оскільки це знижує ризик денатурації поліпептиду. антитіло до CD40, може також бути зв'язана з інгіПотім для досягнення відповідного змішування бувальним впливом аргініну-НСІ на фрагментацію компонентів застосовують прийнятні механічні та/або деамідування в антитілі залишків глутаміну пристрої. та/або аспарагіну в процесі зберігання антитіла, Таким чином, даний винахід стосується спосощо має терапевтичну активність. Вплив аргінінубу підвищення стабільності антагоністичного антиНСІ на фрагментацію антитіла легко можна визнатіла до CD40 або його антигензв'язувального фрачати, оцінюючи зміни молекулярних видів у препагмента в рідкій фармацевтичній композиції. Спосіб ративній формі протягом часу, наприклад, за дополягає в тому, що об'єднують антагоністичне анпомогою аналізів на основі ДСН-ПААГ та/або ГФтитіло до CD40 або його антигензв'язувальний РХВР; див. нижче приклади. Вплив аргініну-НСІ на фрагмент із забуферювальним агентом, що підтдеамідування поліпептиду антитіла до CD40 у римує значення рН фармацевтичної композиції на процесі зберігання в рідкій композиції легко можна рівні приблизно від pH 5,0 до рН 7,0, і аргінін-НСІ у визначати, оцінюючи протягом часу кількість антакількості, достатній для того, щоб зробити компогоністичного антитіла до CD40, присутнього в його зицію практично ізотонічною. У деяких варіантах деамідованій формі. Методи оцінки молекулярних здійснення винаходу забуферювальний агент яввидів, тобто нативного або деамідованого виду, ляє собою буфер на основі цитрату/лимонної кисполіпептиду, присутніх у фазі розчину, добре відолоти, концентрація забуферювального агента стамі в даній галузі. Такі методи включають хроматоновить від приблизно 5мМ до приблизно 50мМ, а графічне розділення молекулярних видів і їх іденкількість аргініну-НСІ забезпечує концентрацію тифікацію на основі стандартів молекулярної маси цього агента аргініну-НСІ, що надає ізотонічність, у поліпептидів, наприклад, за допомогою ОФ-РХВР композиції від приблизно 50мМ до приблизно або катіонообмінної хроматографії (СІЕХ-РХВР), 300мМ. В інших варіантах здійснення винаходу які описані нижче в прикладах. антагоністичне антитіло до CD40 являє собою анЗапропоновані у винаході стабільні рідкі фартитіло CHIR-12.12 або CHIR-5.9 або його антигенмацевтичні композиції, що містять антагоністичне зв'язувальний фрагмент; забуферювальний агент антитіло до CD40, можуть містити інші сполуки, які являє собою буфер на основі цитрату напідвищують ефективність або підсилюють необтрію/лимонної кислоти в концентрації від приблизхідну якість антагоністичного антитіла до CD40, що но 5мМ до приблизно 25мМ; концентрація аргінінупредставляє інтерес, що служить як терапевтично НСІ у композиції становить приблизно 150мМ, і 27 94264 28 значення рН композиції становить приблизно 5,0, CD40-рецептор, що модулює ADCC, взаємодіють приблизно 5,5, приблизно 6,0 або приблизно 6,5. зі шляхами передачі сигналу CD40, насамперед Стабілізовану рідку фармацевтичну композишляхами передачі сигналу CD40, які опосередкоцію, що містить антагоністичне антитіло до CD40, вуються взаємодією CD40 з лігандом CD40 яке представляє інтерес, таке як моноклональне (CD40L), або обома. Під «антигеном CD40», «анантитіло CHIR-12.12 або CHIR-5.9, або його антитигеном CD40, який знаходиться на клітинній погензв'язувальний фрагмент, можна готувати у виверхні», «CD40-рецептором» або «CD40» мають гляді стандартної дози, і вона може мати признана увазі трансмембранний глікопротеїн, який начену для ін'єкції або інфузії форму, таку як розчин, лежить до сімейства рецепторів фактора некрозу суспензія або емульсія. Як відзначалося раніше, її пухлини (TNF) (див., наприклад, US 5674492 і можна зберігати в замороженій або висушеній фо4708871; Stamenkovic і ін., ЕМВО 8, 1989, стор. рмі, такій як ліофілізований порошок, який можна 1403; Clark, Tissue Antigens 36, 1990, с. 33; Barclay відновлювати з одержанням рідкого розчину, суі др., The Leucocyte Antigen Facts Book, 1997, 2-е спензії або емульсії перед введенням за допомовид.; вид-во Academic Press, San Diego). Ідентифігою будь-якого з різних методів, включаючи ораковано дві ізоформи людського CD40, кодовані льні або парентеральні шляхи введення. варіанти транскрипту цього гена, отриманими в Переважно її зберігають у вигляді рідкої препарарезультаті альтернативного сплайсингу. Перша тивної форми, реалізуючи перевагу, пов'язану з ізоформа (яку називають також «довгою ізофорпідвищеною стабільністю при зберіганні, для досямою» або «ізоформою 1») експресується у вигляді гнення якої використовують описані нижче спосополіпептиду-попередника, який складається з 277 би, запропоновані в даному винаході. Стабілізоваамінокислот (SEQ ID NO:12 (вперше описана в ну фармацевтичну композицію переважно GenBank під реєстраційним номером САА43045 і стерилізують фільтрацією через мембрану й зберіідентифікована як ізоформа 1 в GenBank під регають у контейнерах для стандартної дози або єстраційним номером NPJ301241), кодована SEQ декількох доз, таких як закриті пухирці або ампули. ID NO:11 (див.е GenBank, реєстраційні номери Додаткові методи приготування фармацевтичної Х60592 і NM_001250)), що несе сигнальну послікомпозиції, які, як правило, відомі в даній галузі, довність, яка складається з перших 19 залишків. можна застосовувати для додаткового підвищення Друга ізоформа (яку називають також «короткою стабільності рідких фармацевтичних композицій, ізоформою» або «ізоформою 2») експресується у представлених у даному описі, якщо вони не робвигляді поліпептиду-попередника, що складається лять негативного впливу на сприятливі впливи з 203 амінокислот (SEQ ID NO:10 (GenBank, реописаних вище кращих стабілізуючих і забуферюєстраційний номер NP_690593), кодируемого SEQ вальних агентів. Докладне обговорення складів і ID NO:9 (GenBank, реєстраційний номер. вибору фармацевтично прийнятних носіїв, стабіліNM_152854)), що також має сигнальну послідовзаторів і т.д. можна почерпнути в довіднику ність, представлену першими 19 залишками. ПоліRemington's Pharmaceutical Sciences, 18-е вид., пептиди-попередники цих двох ізоформ людського вид-во Mack Publishing Company, Eaton, CD40 характеризуються наявністю загальних перPennsylvania, 1990, включеному в даний опис як ших 165 залишків (тобто залишків 1-165 SEQ ID посилання. NO:10 і SEQ ID NO:12). Поліпептид-попередник Таким чином, даний винахід стосується вирокороткої ізоформи (представлений в SEQ ID бу, який представляє собою контейнер, що містить NO:10) кодується варіантом транскрипту (SEQ ID запропоновану стабільну рідку фармацевтичну NO:9), у якого відсутній кодувальний сегмент, що композицію антагоністичного антитіла до CD40, і приводить до зсуву трансляції рамки зчитування; необов'язково інструкцію з її застосування. Прийнутворена ізоформа CD40 містить більш короткий ятними контейнерами є, наприклад, пухирці, пляС-кінець (залишки 166-203 SEQ ID NO:10), що відшки й шприци. Контейнер може бути виготовлений різняються від С-кінця в довгій ізоформі CD40 (Сз різних матеріалів, таких як пластик або стекло. В кінець представлений залишками 166-277 SEQ ID одному з варіантів здійснення винаходу контейнер NO:12). Для цілей даного винаходу поняття «антиявляє собою скляний одноразовий пухирець містген CD40», «антиген CD40, що знаходиться на кістю 3-50 см3. В іншому варіанті у випадку готової клітинній поверхні», «CD40-рецептор» або «CD40» до застосування препаративної форми контейнер стосується як короткої, так і довгої ізоформ CD40. може являти собою, наприклад, скляний пухирець Антиген CD40 презентується на поверхні різмісткістю 3-100 см3. Контейнер містить препаратиних типів клітин, що буде описано нижче. Під повну форму й етикетку, нанесену на нього або доняттям «презентується на поверхні» і «експресудану до нього, контейнер може містити вказівки із ється на поверхні» мають на увазі, що весь або застосування. Виріб може включати також інші частина антигену CD40 знаходиться зовні клітини. матеріали, необхідні з погляду виробника й спожиПрезентований або експресований антиген CD40 вача, у тому числі інші буфери, розріджувачі, фіможе бути повністю або частково глікозилованим. льтри, голки, шприци й листівку-вкладиш в упакуПоняття «агоністична активність» стосується ванні з інструкціями із застосування. субстанції, яка функціонує як агоніст. Агоніст зв'яАнтитіла до CD40, застосовувані у фармацевзується з рецептором на клітині й ініціює реакцію тичних композиціях, запропонованих у винаході або активність, аналогічну або таку ж як реакція Фармацевтичні композиції, запропоновані в або активність, яка ініціюється лігандом рецептоданому винаході, містять антитіла до CD40, нара, що зустрічається в природних умовах. Агоніст самперед антагоністичні антитіла до CD40 або їх CD40 індукує будь-яку або всі (але, не обмежуюантигензв'язувальні фрагменти, мішенню яких є чись тільки ними) наступні відповіді: В-клітинну 29 94264 30 проліферацію й диференціювання, виробництво що розглянута В-клітинна реакція являє собою Вантитіл, міжклітинну адгезію, створення В-клітин клітинну проліферацію, те «істотна агоністична пам'яті, перемикання ізотипу, що підвищує регуляактивність повинна індукувати рівень В-клітинної цію експресії молекул, які знаходяться на клітинній проліферації, яка принаймні в 2 рази вище або поверхні, ГКГ класу II і CD80/86 і секрецію прозапринаймні в 3 рази вище, ніж рівень В-клітинної пальних цитокінів, таких як IL-8, IL-12 і TNF. Під проліферації, що індукується нейтральною субс«антагоністичною активністю» мають на увазі, що танцією або негативним контролем. В одному з субстанція функціонує як антагоніст. Антагоніст варіантів здійснення винаходу неспецифічний імуCD40 перешкоджає або знижує індукцію будь-яких ноглобулін, наприклад, lgG1, який не зв'язується з відповідей, які індукуються зв'язуванням CD40CD40, служить як негативний контроль. Субстанрецептора з лігандом-агоністом, насамперед ція «не має істотної агоністичної активності» поCD40L. Антагоніст може знижувати індукцію будьвинна мати агоністичну активність не більш ніж якої або всіх відповідей, обумовлених зв'язуванприблизно на 25% більш високою у порівнянні з ням агоністу, на 5%, 10%, 15%, 20%, 25%, 30%, агоністичною активністю, яка індукується нейтра35%, переважно на 40%, 45%, 50%, 55%, 60%, льною субстанцією або негативним контролем, більш переважно на 70%, 80%, 85% і найбільш переважно не більш ніж приблизно на 20% більш переважно на 90%, 95%, 99% або 100%. Методи високою, на 15% більш високою, на 10% більш оцінки специфічності зв'язування ліганду CD40 і високою, на 5% більш високою, на 1% більш висоантагоністичної активності терапевтичних агентів, кою, на 0,5% більш високою або навіть не більше спрямованих проти CD40, наприклад, антитіла до ніж приблизно на 0,1% більш високою, ніж агонісCD40, відомі в даній галузі й включають (але, не тична активність, яка індукується нейтральною обмежуючись тільки ними) стандартні аналізи консубстанцією або негативним контролем, при оцінці курентного зв'язування, аналізи, призначені для В-клітинної реакції. моніторингу секреції імуноглобулінів В-клітинами, У деяких варіантах здійснення винаходу стабіаналізи В-клітинної проліферації, аналізи Вльні рідкі фармацевтичні композиції, запропоноваклітинної проліферації, подібні розробленим ні у винаході, містять антагоністичне антитіло до Banchereau, аналізи активності Т-клітин-хелперів CD40. Такі антитіла не мають істотної агоністічної відносно виробництва антитіл, аналізи костимуляактивності, як вона визначена вище, при зв'язуції В-клітинної проліферації й аналізи підвищуваванні з антигеном CD40 на людській клітині. В одльної регуляції маркерів В-клітинної активації ному з варіантів здійснення винаходу антагоністи(див., наприклад, аналізи, описані в WO 00/75348 і чне антитіло до CD40 не мають істотної US 6087329, які включені в даний опис як посиагоністичної активності при оцінці однієї із клітинлання). Вказані аналізи описані в також у заявках, них відповідей. В іншому варіанті здійснення винаозаглавлених «Antagonist Anti-CD40 Monoclonal ходу антагоністичне антитіло до CD40 не мають Antibodies and Methods for Their Use» («Антагонісістотної агоністичної активності при оцінці більше тичні моноклональні антитіла до CD40 і способи їх однієї із клітинних відповідей (наприклад, пролізастосування»), поданих 4 листопада 2003 p., 26 ферація й диференціювання, або проліферація, листопада 2003 р. і 27 квітня 2004 p., і переуступдиференціювання й, у випадку В-клітин, виробницлених заявках на патент США 60/517337 (досьє в тво антитіл). У деяких варіантах здійснення винапатентного повіреного № РР20107.001 ходу антагоністичне антитіло до CD40 являє со(035784/258442)), 60/525,579 (досьє в патентного бою, наприклад, повністю людське моноклональне повіреного № РР20107.002 (035784/271525)) і антитіло CHIR-12.12 або CHIR-5.9, або його анти60/565,710 (досьє в патентного повіреного № гензв'язувальний фрагмент, описані нижче. РР20107.003 (035784/277214)) відповідно й у міжБудь-який з відомих у даній галузі аналізів монародній заявці на патент PCT/US2004/037152 жна застосовувати для вирішення питання про те, (досьє в патентного повіреного № РР20107.004 чи діє антитіло до CD40 як антагоніст однієї або (035784/282916)), що озаглавлена «Antagonist Antiдекількох В-клітинних відповідей. У деяких варіанCD40 Monoclonal Antibodies and Methods for Their тах здійснення винаходу антитіло до CD40 діє як Use» («Антагоністичні моноклональні антитіла до антагоніст принаймні однієї В-клітинної відповіді, CD40 і способи їх застосування»), поданої 4 лисвибраної із групи, яка включає В-клітинну пролітопада 2004 p., і опублікованої як WO ферацію, В-клітинну диференціювання, виробниц2005/044854); зміст кожного з перерахованих дотво антитіл, міжклітинну адгезію, створення Вкументів повністю включений в даний опис як поклітин пам'яті, перемикання ізотипу, що підвищує силання. регуляцію експресії молекул, які знаходяться на Під «істотною» агоністичною активністю мають клітинній поверхні, ГКГ класу II і CD80/86 і секрена увазі агоністичну активність, яка принаймні на цію прозапальних цитокінів, таких як IL-8, IL-12 і 30%, 35%, 40%, 45%, 50%, 60%, 70%, 75%, 80%, TNF. Найбільший інтерес являють собою антагоні85%, 90%, 95% або 100% вище, ніж агоністична стичні антитіла до CD40, які не мають істотної агоактивність, що індукується нейтральною субстанністичної активності відносно В-клітинної проліфецією або негативним контролем, при оцінці Врації при зв'язуванні з людським антигеном CD40 клітинної реакції. Переважно «істотна» агоністична на поверхні людської В-клітини. активність являє собою агоністичну активність, що В одному з варіантів здійснення винаходу анпринаймні в 2 вище або принаймні в 3 рази вище, титіло до CD40 має антагоністичну активність відніж агоністична активність, що індукується нейтраносно В-клітинної проліферації, яку оцінюють за льною субстанцією або негативним контролем, допомогою аналізу В-клітинної проліферації, напри оцінці В-клітинної реакції. Так, наприклад, якприклад, описаного в прикладі 4, нижче, і антагоні 31 94264 32 стичне антитіло до CD40 стимулює В-клітинну Під «лігандом CD40» мають на увазі будь-який проліферацію на рівні, що не більш ніж приблизно пептид, поліпептид або білок, який зв'язується з на 25% вище, ніж В-клітинна проліферація, що CD40 і активує один або декілька шляхів передачі індукується нейтральною субстанцією або негатисигналу CD40. Таким чином, «ліганди CD40» вним контролем переважно не більш ніж приблизвключають (але, не обмежуючись тільки ними) но на 20% вище, на 15 % вище, на 10% вище, на повнорозмірні білки-лігади CD40 і їх варіанти й 5% вище, на 1% вище, на 0,5% вище або навіть не фрагменти, які зберігають істотну функціональну більше ніж приблизно на 0,1% вище, ніж Вактивність відносно зв'язування й стимуляції переклітинна проліферація, яка індукується нейтральдачі сигналу CD40 на клітинах, які експресують ною субстанцією або негативним контролем. CD40. Модифікації нативного ліганду CD40, наВ інших варіантах антитіло до CD40 має антаприклад, людського ліганду CD40 (CD40L; який гоністичну активність відносно В-клітинної проліпозначають також як CD 154), включають (але, не ферації, що індукується іншим антитілом до CD40, обмежуючись тільки ними) заміни, делеції, укоронаприклад, антитілом S2C6 до CD40, що оцінюють чення, подовження, утворення злитих білків, фраза допомогою аналізу В-клітинної проліферації, гментів, пептидоміметиків і т.п. У деяких варіантах наприклад, описаного в прикладі 4, нижче, і рівень здійснення винаходу аналіз або оцінка біологічної В-клітинної проліферації, стимульованої іншим активності антагоністичного антитіла до CD40 антитілом до CD40 у присутності антагоністичного включає застосування розчинного CD40L, наприантитіла до CD40 становить не більш ніж приблизклад, розчинного рекомбінантного людського но 25% від рівня В-клітинної проліферації, що інCD40L (фірма Alexis Corporation, Бінгем, Нотінгедукується іншим антитілом до CD40 за відсутності мшир, Великобританія), для стимуляції передачі антагоністичного антитіла до CD40 (тобто принайсигналу CD40 на клітинах, які експресують CD40. мні 75%-не інгібування), переважно не більш ніж Під «опосередковуваної CD40L передачею сиприблизно 20%, 15%, 10%, 5%, 1%, 0,5%, або нагналу CD40» мають на увазі будь-який з видів біовіть не більше ніж приблизно 0,1% від рівня Влогічної активності, який є результатом взаємодії клітинної проліферації, що індукується іншим анрецептора CD40, що знаходиться на клітинній потитілом до CD40 за відсутності антагоністичного верхні, з лігандом CD40. Прикладами сигналів антитіла до CD40. CD40 є сигнали, які приведуть до проліферації й У наступних варіантах здійснення винаходу виживання клітин, які експресують CD40, і стимуантитіло до CD40 має антагоністичну активність ляції одного або декількох шляхів передачі сигнавідносно В-клітинної проліферації, яка індукується лу CD40 в клітинах, які експресують CD40. Понятклітинною лінією EL4B5, що оцінюють у за допомотя «передача сигналу» або «шлях трансдукції гою аналізу В-клітинної проліферації, наприклад, сигналу» CD40 стосується принаймні однієї з біоописаного в прикладі 4, нижче, і рівень В-клітинної хімічних реакцій або групи біохімічних реакцій, які проліферації, стимульований клітинною лінією є результатом взаємодії CD40-рецептора з ліганEL4B5 у присутності антагоністичного антитіла до дом CD40, наприклад CD40L, і які генерують сигCD40 становить не більш ніж приблизно 25% від нал, який, коли він передається через шлях перерівня В-клітинної проліферації, що індукується цієї дачі сигналу, приводить до активації однієї або клітинною лінією за відсутності антагоністичного декількох молекул розташованих нижче по ходу антитіла до CD40 (тобто принаймні 75%-не інгібукаскаду сигналу. Шляхи трансдукції сигналу вклювання), переважно не більш ніж приблизно 20%, чають ряд молекул трансдукції сигналу, які забез15%, 10%, 5%, 1%, 0,5%, або навіть не більше ніж печують передачу сигналу від CD40-рецептора, приблизно 0,1% від рівня В-клітинної проліферації, що знаходиться на клітинній поверхні, через плазщо індукується клітинами лінії EL4B5 за відсутносматичну мембрану клітини й через одну або декіті антагоністичного антитіла до CD40. лька молекул у серії молекул трансдукції сигналу, У наступних варіантах здійснення винаходу через цитоплазму й у деяких випадках у ядро кліантитіло до CD40 є антагоністом індукованого тини. Шляхи трансдукції сигналу CD40 включають, людськими Т-клітинами виробництва антитіл люднаприклад, шлях передачі сигналу АКТ, що привоськими В-клітинами, яке оцінюють за допомогою дить до активації АКТ і зрештою до активації NFаналізу активності людських Т-клітин-хелперів Β через шлях передачі сигналу NF-Β; і шляхи відносно виробництва антитіл В-клітинами, що передачі сигналу активованої мітогеном протеїнкіописаний нижче в прикладі 4. У цьому аналізі рінази (МАРК), включаючи шлях передачі сигналу вень виробництва антитіла ізотипу IgG, антитіла MEK/ERK і шлях передачі сигналу МЕK/р38, які ізотипу IgM або виробництво антитіла й ізотипу приводять до активації ERK і р38 відповідно. ПевIgG, і ізотипу IgB В-клітинами, стимульованими Тний баланс між активацією й блокадою цих шляхів клітинами, у присутності антагоністичного антитіла передачі створює перевага або для виживання, до CD40 становить не більш ніж приблизно 50% або для апоптозу клітин. від виробництва відповідного антитіла ВУ деяких варіантах здійснення винаходу стабіклітинами, стимульованими Т-клітинами, за відсульні фармацевтичні композиції, запропоновані у тності антагоністичного антитіла до CD40 (тобто винаході, містять антагоністичні антитіла до CD40, принаймні 75%-не інгібування), переважно не біякі блокують опосередковувану CD40L передачу льше ніж приблизно 25, 20%, 15%, 10%, 5%, 1%, сигналу CD40. Більше докладний опис ролі анта0,5%, або навіть не більше ніж приблизно 0,1% від гоністичних антитіл до CD40 у блокаді опосередрівня виробництва відповідного антитіла Вковуваної CD40L передачі сигналу CD40 див., наклітинами, стимульованими Т-клітинами, за відсуприклад, у попередніх заявках на патент, тності антагоністичного антитіла до CD40. озаглавлених «Antagonist Anti-CD40 Monoclonal 33 94264 34 Antibodies and Methods for Their Use» («АнтагонісПоняття «моноклональне антитіло» і «МАт» у тичні моноклональні антитіла до CD40 і способи їх контексті даного опису стосуються антитіла, отризастосування»), поданих 4 листопада 2003 p., 26 маного із практично гомогенної популяції антитіл, листопада 2003 р. і 27 квітня 2004 p., і переуступтобто індивідуальні антитіла, що входять у популених заявках на патент США 60/517337 (досьє в ляцію, ідентичні за винятком можливих мутацій, патентного повіреного № РР20107.001 що зустрічаються в природних умовах, які можуть (035784/258442)), 60/525,579 (досьє в патентного бути присутні у мінорних кількостях. повіреного № РР20107.002 (035784/271525)) і «Нативні антитіла» і «нативні імуноглобуліни», 60/565,710 (досьє в патентного повіреного № як правило, являють собою гетеротетрамерні гліРР20107.003 (035784/277214)) відповідно й у міжкопротеїни масою приблизно 150000 Да, що скланародній заявці на патент PCT/US2004/037152 даються із двох ідентичних легких (L) ланцюгів і (досьє в патентного повіреного № РР20107.004 двох ідентичних важких (Н) ланцюгів. Кожний лег(035784/282916)), що озаглавлена «Antagonist Antiкий ланцюг зчеплений з важким ланцюгом за доCD40 Monoclonal Antibodies and Methods for Their помогою одного ковалентного дисульфідного зв'яUse» («Антагоністичні моноклональні антитіла до зку, при цьому кількість дисульфідних містків CD40 і способи їх застосування»), поданої 4 лисзмінюється у важких ланцюгах різних ізотипів імутопада 2004 p., і опублікованої як WO ноглобулінів. Кожний важкий і легкий ланцюг має 2005/044854); зміст кожного з перерахованих дотакож дисульфідні містки усередині ланцюга, які кументів повністю включений в даний опис як помають регулярне просторове розташування. Кожсилання. Їх роль описана також у попередній заяний важкий ланцюг має на одному кінці варіабельвці, яка називається «Methods for Diagnosis and ну ділянку (VH), за якою розташовується константTreatment of Proliferative Disorders Mediated by них ділянок. Кожний легкий ланцюг має на одному CD40 Signaling» («Методи діагностики проліферакінці варіабельну ділянку (VL) і константну ділянку тивних порушень, опосередковуваних передачею на її іншому кінці; константна ділянка легкого лансигналу CD40»), поданої 9 грудня 2005 p., і в перецюга відповідає першій константній ділянці важкоуступленій заявці на патент США № 60/749285 го ланцюга, а варіабельна ділянка легкого ланцю((досьє в патентного повіреного № РР028035.0002 га відповідає варіабельній ділянці важкого (035784/304312)), і у відповідній у міжнародній ланцюга. Імовірно, конкретні амінокислотні залишзаявці на патент PCT/US2006/019414 (досьє в паки формують поверхню розділу між варіабельними тентного повіреного № РР028035.0003 ділянками легкого й важкого ланцюга. (035784/311611)), що подана 18 травня 2006 р. і Поняття «варіабельна» стосується того факту, опублікована як WO 2006/125143; і в попередній що серед антитіл послідовності певних ділянок заявці на патент, озаглавленої як «Methods for варіабельних ділянок значно відрізняються між Diagnosis and Treatment of Diseases Having an собою. Варіабельні ділянки обумовлюють специAutoimmune and/or Inflammatory Component» («Мефічність відносно зв'язування з антигеном. Однак тоди діагностики й лікування захворювань, що маваріабельність не рівномірно розподілена у варіають аутоімунний та/або запальний компонент»), бельних ділянках антитіл. Вона сконцентрована в що поданий 9 грудня 2005 p., і в переуступленій трьох сегментах, які називають ділянками, які визаявці на патент США 60/749336 (досьє в патентзначають комплементарність (CDR), або гіперваріного повіреного № РР028062.0002 абельними ділянками, у варіабельних ділянках, як (035784/304311)), і у відповідній у міжнародній легкого ланцюга, так і важкого ланцюга. Найбільш заявці на патент PCT/US2006/019325 (досьє в паконсервативні ділянки варіабельних ділянок розтентного повіреного № РР028062.0003 ташовані в каркасних (FR) ділянках. Кожна з варі(035784/311608)), що подана 18 травня, 2006 р. і абельних ділянок нативних важких і легких ланцюопублікований як WO 2006/125117; зміст кожного з гів містить чотири FR-ділянки, головним чином, перерахованих документів повністю включений в адоптованих до -складчастої конфігурації, які даний опис як посилання. зв'язані трьома CDR, які утворюють зв'язувальні, а Стабільні рідкі фармацевтичні композиції, зав деяких випадках утворюють частину пропоновані в даному винаході, містять антагонісскладчастої структури. CDR у кожному ланцюзі тичні антитіла до CD40, зокрема, антагоністичні підтримуються в тісній близькості FR-ділянками й антитіла до CD40 та/або їх антигензв'язувальні разом з CDR іншого ланцюга беруть участь в фрагменти. При описі вказаних антитіл застосовуутворенні антигензв'язувального центра антитіла ють наступні поняття й визначення. (див. Kabat і ін., NIH Publ. No. 91-3242, тім І, 1991, «Антитіло» і «імуноглобуліни» (Ig) означають стор. 647-669). Константні ділянки не беруть глікопротеїни, які мають однакові структурні харакучасть безпосередньо у зв'язуванні антитіла з антеристики. Поняття є синонімами. У деяких випадтигеном, але мають різні ефекторні функції, такі як ках специфічність відносно антигену імуноглобулізв'язування Fc-рецептора (Fc), участь антитіла в ну може бути відома. антитіло-обумовленій клітинній токсичності, ініціаПоняття «антитіло» застосовують у його найції комплемензалежній цитотоксичності й дегранубільш широкому розумінні, і воно стосується повляції гладеньких клітин. ністю зібраних антитіл, фрагменте антитіл, які моПоняття «гіперваріабельна ділянка» у контексжуть зв'язувати антиген (наприклад, Fab, F(ab')2, ті даного опису стосується амінокислотних залишFv, одноланцюгові антитіла, подвійні антитіла, хиків антитіла, які відповідальні за зв'язування з анмери антитіл, гібридні антитіла, біспецифічні антитигеном. Гіперваріабельна ділянка містить тіла, гуманізовані антитіла й т.п.) і рекомбінантих амінокислотні залишки з «ділянки, яка визначає пептидів, що містять вищевказані субстанції. комплементарність» або «CDR» (тобто залишки 35 94264 36 24-34 (L1), 50-56 (L2) і 89-97 (L3) у варіабельній двох чітко відмінних типів, які позначають як каппа ділянці легкого ланцюга й 31-35 (H1), 50-65 (Н2) і () і лямбда , на основі амінокислотних послідов95-102 (H3) у варіабельній ділянці важкого ланцюностей їх константних ділянок. га; Kabat і ін., Sequences of Proteins of Залежно від амінокислотної послідовності конImmunological Interest, 5-е вид., вид-во Public стантних ділянок їх важких ланцюгів імуноглобуліHealth Service, National Institute of Health, Bethesda, ни можна віднести до різних класів. Відомо п'ять MD, 1991) та/або залишки з «гіперваріабельній основних класів людських імуноглобулінів: IgA, петлі» (тобто залишки 26-32 (L1), 50-52 (L2) і 91-96 IgD, IgE, IgG i IgM, деякі з них можна додатково (L3) у варіабельній ділянці легкого ланцюга (H1), підрозділяти на підкласи (ізотипи), наприклад, 53-55 (Н2) і 96-101 (H3) у варіабельній ділянці lgG1, IgG2, IgG3, IgG4, IgA1 і IgA2. Константні діважкого ланцюга; Chothia і Lesk, J. Mol. Biol., 196, лянки важкого ланцюга, які відповідають різним 1987, стор. 901-917). У контексті даного опису макласам імуноглобулінів, позначають як альфа, ється на увазі, що залишки «каркасної ділянки» дельта, епсилон, гама й то відповідно. Структури або «FR» являють собою залишки варіабельної субодиниць і тривимірні конфігурації різних класів ділянці, відмінні від залишків гіперваріабельної імуноглобулінів добре відомі. Різні ізотипи мають ділянки. різні ефекторні функції. Наприклад, людські ізоти«Фрагменти антитіла» містять частину інтактпи lgG1 і IgG3 мають ADCC-активність (антитілоного антитіла, переважно антигензв'язувальну або обумовлену клітиннозалежну цитотоксичність). варіабельну ділянку інтактного антитіла. ПриклаПоняття «мітка» у контексті даного опису стодами фрагментів антитіла є Fab-, Fab-, F(ab')2- і сується сполуки або композиції, яку виявляють, які Fv-фрагменти; подвійні антитіла; лінійні антитіла кон'югують прямо або побічно з антитілом з одер(Zapata і ін., Protein Eng. 10,1995, стор. 1057-1062); жанням «міченого» антитіла. Мітка може являти молекули одноланцюгових антитіл; і мультиспесобою мітку, яка виявляється сама по собі, (наприцифічні антитіла, утворені із фрагментів антитіл. клад, радіоізотопні мітки або флуоресцентні мітки) Розщеплення антитіл папаїном приводить до або у випадку ферментативної мітки, може каталіутворення двох ідентичних антигензв'язувальних зувати хімічну зміну сполуки- або композиціїфрагментів, які називають «Fаb»-фрагментами, субстрату, які стають детектованими. кожний з яких несе один антигензв'язу вальний «Клітина-хазяїн» у контексті даного опису стоцентр, а назва «Рс»-фрагмента, що залишився, сується мікроорганізму або еукаріотичної клітини відображає його здатність легко кристалізуватися. або лінії клітин, яку культивують у вигляді матерії, У результаті обробки пепсином одержують F(ab')2що складається з однорідних клітин, яку можна фрагмент, що має два антигензв'язувальні центри застосовувати або яку застосовували як реципієнт й має здатність до перехресного зв'язування з андля рекомбінантного вектора або інших стерпних тигеном. полінуклеотидів, і вона включає потомство вихід«Fv»-фрагмент являє собою мінімальний франої клітини, яку було трансфектовано. Слід розумігмент антитіла, що містить повний сайт, що розпіти, що потомство індивідуальної клітини не обов'язнає антиген і зв'язується з антигеном. Ця ділянка зково може бути повністю ідентичним за складається з димеру однієї варіабельної ділянки морфологією або за комплементом геномної або важкого й однієї варіабельної ділянки легкого ланзагальної ДНК до вихідної батьківської клітини цюга, які знаходяться у тісній нековалентній асоцічерез мутацію, яка зустрічається в природних ації. Саме в цій конфігурації три CDR кожної варіумовах, випадкової або навмисної мутації. абельної ділянки взаємодіють із утворенням «Людські ефекторні клітини» являють собою антигензв'язувального центра на поверхні VH-VLлейкоцити, які експресують один або декілька FcR димеру. У цілому, шість CDR надають антитілу і здійснюють ефекторні функції. Переважно клітиспецифічність зв'язування з антигеном. Однак нани експресують принаймні FcRIII і мають таку віть одна варіабельна ділянка (або половина Fv, ефекторну функцію, як антитіло-обумовлена кліщо містить тільки три CDR, специфічних для антитиннозалежна цитотоксичність (ADCC). Прикладагену) має здатність розпізнавати й зв'язувати антими людських лейкоцитів, які опосередковують ген, хоча з більш низькою афікністю в порівнянні з ADCC, є мононуклеарние клітини периферичної повним сайтом зв'язування. крові (РВМС), природні клітини-кілери (NK), моноFab-фрагмент також містить константну ділянцити, макрофаги, еозинофіли й нейтрофіли, при ку легкого ланцюга й першу константну ділянку цьому кращими є РВМС і NK-клітини. Антитіла, які (СН1) важкого ланцюга. Fab-фрагмент відрізняєтьмають ADCC-активність, як правило, стосуються ся від Fab'-фрагментів, тим, що містить декілька ізотипу lgG1 або IgG3. Слід зазначити, що крім додаткових залишків на С-кінці СН1-ділянки важковиділення антитіл ізотипу lgG1 і IgG3, такі антитіго ланцюга, включаючи один або декілька залишла, які опосередковують ADCC, можна одержувати ків цистеїну із шарнірної ділянки антитіла. У коншляхом створення конструкції, що містить варіатексті даного опису «Fab'-SH» означає Fab'бельну ділянку із антитіла, що не має ADCC або фрагмент, у якому залишок(і) цистеїну константфрагмента варіабельної ділянки й константну діних ділянок несе(уть) вільну тіольну групу. Fab'лянку ізотипу lgG1 або IgG3. фрагменти одержують відновленням дисульфідноПоняття «Fc-рецептор» або «FcR» застосовуго містка важкого ланцюга F(ab')2-фрагмента. Віють для опису рецептора, який зв'язується з Fcдомі інші варіанти хімічних сполучень фрагментів ділянкою антитіла. Кращим FcR є FcR з нативною антитіл. людською послідовністю. Крім того, кращим є FcR, «Легкі ланцюги» антитіл (імуноглобулінів) різякий зв'язується з антитілом типу IgG (гамманих видів хребетних можна віднести до одного із рецептор), і включає рецептори підкласів FcRI, 37 94264 38 лінію трансгенних мишей, у якої після контрольноFcRII та FcRIII, у тому числі алель ні варіанти й го зараження антигеном утворювалися повністю отримані в результаті альтернативного сплайсингу людські антитіла, які мають високу афінність. Для форми цих рецепторів. FcRIІ-рецептори включацієї мети можна використовувати введення (інтегють FcRIIA («активуючий рецептор») і FcRIIB рацію) локусів розміром порядку мільйона підстав («інгібуючий рецептор»), які мають подібні амінолюдської зародкової лінії важкого ланцюга й легкокислотні послідовності, які відрізняються насампего ланцюга в мишей з делецією в ендогенному JHред своїми цитоплазматичними доменами. Актисєгмєнті, які описані вище. Такі миші (отримані вуючий рецептор FcRIIA містить відповідно до технології XenoMouse II (фірма імунорецепторний активуючий мотив, який несе Abgenix; Фремонт, шт. Каліфорнія)) несуть локус тирозин (ІТАМ) у цитоплазматичному домені. Інгірозміром 1,020 т.п. н. людського важкого ланцюга, буючий рецептор FcRIIB містить імунорецепторщо містить приблизно 66 VH-генів, повні DH- і JHний інгібуючий мотив, який несе тирозин (ІТІМ) у ділянки й три різні константні ділянки, а також нецитоплазматичному домені (див., Daeron, Anrm. суть локус розміром 800 т.п.н. людської -ланцюга, Rev. Immunol. 15, 1997, стор. 203-234). Дані про що містить 32 V-гена, J-сeгмeнти й С-гени. АнFcR узагальнені в Ravetch і Kinet, Annu. Rev. титіла, які утворюються в таких мишах, дуже подіImmunol. 9, 1991, стор. 457-492; Capel і ін., бні до людських у всіх аспектах, включаючи переImmunomethods 4, 1994. стор. 25-34; і de Haas і ін., групування, зборку й спектр генів. Рівень експресії J. Lab. Clin. Med. 126, 1995, стор. 330-341. Інші людських антитіл перевищує рівень експресії енFcR, включаючи ті, які можуть бути ідентифіковані догенних антитіл через делеції в ендогенному сев майбутньому, підпадають під поняття «FcR», гменті, що перешкоджає перегрупуванню генів у наведене в даному описі. Під поняття підпадає мишиному локусі. Таких мишей можна імунізувати також неонатальний рецептор, FcRn, що відповіантигеном, що представляє найбільший інтерес. дає за перенос материнських IgG плоду (Guyer і Сироватку з таких імунізованих тварин можна ін., J. Immunol. 117, 1976, с. 587, і Kim і ін., J. піддавати скринінгу відносно реактивності антитіла Immunol. 24, 1994, с. 249). на вихідний антиген. Лімфоцити можна виділяти з Відомі різні шляхи створення людських антилімфатичних вузлів або спленоцитів і можна додатіл. Наприклад, секретуючі клітини можна іммортково розділяти В-клітини на CD138-негативні й талізувати шляхом зараження вірусом ЕпштейнаCD19-позитивні клітини. Відповідно до одного з Бара (EBV). Однак заражені EBV клітини важко об'єктів такі В-клітинні культури (ВСС) можна зликлонувати й при їх застосуванні звичайно одержувати із клітинами мієломи з одержанням докладно ють відносно невисокий вихід імуноглобуліну описаних вище гібридом. (James і Bell, J. Immunol. Methods 100, 1987, стор. Відповідно до іншого об'єкта вказані В-клітинні 5-40). У майбутньому для імморталізації людських культури можна додатково піддавати скринінгу В-клітин можна буде використовувати інтродукцію переважно відносно реактивності на початковий певної комбінації трансформуючих генів. Така моантиген. Для скринінгу використовують імунофержливість переконливо продемонстрована сучасментний твердофазний аналіз (ELISA) з білком ними даними про те, що експресія каталітичної мішенню/антигеном, конкурентний аналіз із відосубодиниці теломерази в сполученні з більшим мими антитілами, які зв'язуються з антигеном, що онкопротеїном SV40 і онкогенним алелем H-ras представляє інтерес, і аналіз зв'язування in vitro з приводила до онкогенної конверсії здорових людкороткочасно трансфектованими СНО або іншими ських епітеліальних клітин і фібробластів (Hahn і клітинами, які експресують антиген-мішень. ін., Nature 400, 1999, стор. 464-468). У цей час моМоноклональні антитіла до CD40 відомі в дажна одержувати трансгенних тварин (наприклад, ній галузі (див., наприклад, розділи, що стосуються мишей), які після імунізації можуть продукувати В-клітинного антигену в: Leukocyte Typing III and спектр людських антитіл за відсутності ендогенноIV, під ред. McMichael, з Oxford University Press. го виробництва імуноглобулінів (Jakobovits і ін., New York, 1987; 1989, US 5674492; 5874082; Nature 362, 1993, стор. 255-258; Lonberg і Huszar, 5677165; 6056959; WO 00/63395; опубліковані міжInt. Rev. Immunol. 13, 1995, стор. 65-93; Fishwild і народні заявки на патент WO 02/28905 і WO ін., Nat. Biotechnol. 14, 1996, стор. 845-851; Mendez 02/28904; Gordon і ін, J. Immunol. 140, 1988, с. і ін., Nat. Genet. 15, 1997, стор. 146-156; Green, J. 1425; Valle і ін., Eur. J. Immunol. 19, 1989, с. 1463; Immunol. Methods 231, 1999, стор. 11-23; Tomizuka Clark і ін., PNAS 83, 1986, с. 4494; Paulie і ін., J. і ін., Proc. Natl. Acad. Sci. USA 97, 2000, стор. 722Immunol. 142, 1989, с. 590; Gordon і ін., Eur. J. 727; огляд, наведений в Little і ін., Immunol. Today Immunol. 17, 1987, с. 1535; Jabara і ін., J. Exp. Med. 21, 2000, стор. 364-370). Наприклад, було встано172, 1990, с. 1861; Zhang і ін., J. Immunol. 146, влено, що гомозиготна делеція гена в ділянці сти1991, с. 1836; Gascan і ін., J. Immunol. 147, 1991, с. ку важкого ланцюга (JН) у химерних мишах і несу8; Banchereau і ін., Clin. Immunol. Spectrum 3, 1991, чому мутанті в зародковій лінії мишах приводить с. 8; і Banchereau і ін., Science 251, 1991, с. 70; всі до повного інгібування виробництва ендогенних публікації включені в даний опис як посилання). антитіл (Jakobovits і ін., Proc. Natl. Acad. Sci. USA Інші моноклональні антитіла до CD40 являють 90, 1993, стор. 2551-2555). Перенос набору генів собою (але, не обмежуючись тільки ними) гуманіімуноглобулінів людської зародкової лінії в таку зовані антитіла до CD40, такі як SGN-40 (Таi і ін., мутантну зародкову лінію мишей приводить до Cancer Res. 64, 2004, с. з. 2846-52; US. 6838261), виробництва людських антитіл після контрольного що являє собою гуманізовану форму мишиного зараження антигеном (Jakobovits і ін., Nature 362, антитіла до CD40 SGN-14 (Francisco і ін., Cancer 1993, стор. 255-258). Mendez зі співавторами Res. 60, 2000, стор. 3225-3231), і агоністичні й ан(Nature Genetics 15, 1997, стор. 146-156) створили 39 94264 40 тагоністичні антитіла, описані в опублікованій зая5.9) і 153.8E2.D10.D6.12.12 (позначена в контексті вці на патент США №2004/0120948; яка повністю даного опису як лінія клітин 12.12). Ці лінії клітин включена в даний опис як посилання. створювали за допомогою спленоцитів з імунізоПредставляючими найбільший інтерес у конваних ксенотипічних мишей, що несуть локус важтексті даного винаходу є антагоністичні антитіла кого ланцюга людського IgG1 і локус людської до CD40 або їх антигензв'язувальні фрагменти, які ланцюга (отримані на основі XenoMouseслужать для блокади опосередковуваної CD40L технології; фірма Abgenix; Фремонт, шт. Каліфорпередачі сигналу CD40 і які можуть також модулюнія). Спленоцити зливали із клітинами мишиної вати ADCC, що, наприклад, характерно для антимієломи SP2/0 (фірма Sierra BioSource). Отримані тіла CHIR-12.12, описаного нижче. гібридоми субклонували декілька разів для ствоАнтагоністичні антитіла до CD40, призначені рення стабільних моноклональних клітинних ліній для застосування в стабільних рідких фармацев5.9 і 12.12. Інші антитіла, запропоновані у винахотичних композиціях, запропонованих у винаході, ді, можна одержувати аналогічно, використовуючи являють собою моноклональні антитіла або їх анмишей, трансгенних за локусами людського імунотигензв'язувальні фрагменти, які мають здатність глобуліну, або за допомогою інших методів, відоспецифічно зв'язуватися з людським антигеном мих у даній галузі та/або представлених у даному CD40, що експресується на поверхні людської кліописі. тини. У деяких варіантах здійснення винаходу анНуклеотидні й амінокислотні послідовності ватагоністичні антитіла до CD40, що входять у стабіріабельних ділянок антитіла CHIR-12.12 і амінокильні рідкі фармацевтичні композиції, мають сильну слотні послідовності варіабельних ділянок антитіафінність до зв'язування з одним сайтом антигену, ла CHIR-5.9 представлені в даному описі. Більш CD40 що знаходиться на поверхні клітин. Для таконкретно, амінокислотні послідовності лідерної, ких моноклональних антитіл характерне значення варіабельної і константної ділянок легкого ланцюконстанти рівноваги дисоціації (KD) для CD40, що га й важкого ланцюга МАт CHIR-12.12 наведені в становить принаймні 10-5М, принаймні 310-5Μ, SEQ ID NO:2 (повна послідовність легкого ланцюга переважно принаймні від 10-6Μ до 10-7М, більш МАт CHIR-12.12), SEQ ID NO:4 (повна послідов-8 переважно принаймні від 10 Μ до приблизно 10 ність важкого ланцюга МАт CHIR-12.12) і SEQ ID 12 М, що оцінюють за допомогою стандартного NO:5 (повна послідовність варіанта важкого лананалізу, такого як Віаcore. Віаcore-аналіз відомий цюга МАт CHIR-12.12, представленої в SEQ ID у даній галузі і його докладний опис наведений в NO:4, де варіант містить заміну серину на залишок «BIAapplications handbook». Методи, описані в WO аланіну в положенні 153 SEQ ID NO:4). Нуклеоти01/27160, можна застосовувати для модуляції дні послідовності, що кодують легкий ланцюг і ваафінності до зв'язування. жкий ланцюг МАт CHIR-12.12, представлені в SEQ Найбільший інтерес являють собою антагонісID NO:1 (кодувальна послідовність легкого ланцютичні антитіла до CD40, які не мають істотної агога МАт CHIR-12.12) і SEQ ID NO:3 (кодувальна ністічної активності, як описано вище, але мають послідовність важкого ланцюга МАт CHIR-12.12). антагоністичну активність при зв'язуванні з антигеАмінокислотні послідовності лідерної, варіабельном CD40 на людських клітинах, насамперед при ної і константної ділянок легкого ланцюга й важкозв'язуванні з антигеном CD40 на неопластичних го ланцюга МАт CHIR-5.9 представлені в SEQ ID людських В-клітинах. В одному з варіантів здійсNO:6 (повна послідовність легкого ланцюга МАт нення винаходу антагоністичне антитіло до CD40 CHIR-5.9), SEQ ID NO:7 (повна послідовність важне має істотної агоністічної активності у відношенні кого ланцюга МАт CHIR-5.9) і SEQ ID NO:8 (повна одного з В-клітинних відповідей. В іншому варіанті послідовність варіанта важкого ланцюга МАт здійснення винаходу антагоністичне антитіло до CHIR-5.9, представленої в SEQ ID NO:7, де варіCD40 не має істотної агоністичної активності у ант містить заміну серину на залишок аланіну в відношенні більше одній з В-клітинних відповідей положенні 158 SEQ ID NO:7). Крім того, гібридоми, (таких, наприклад, як проліферація й диференціюякі експресують антитіла CHIR-5.9 (лінія мишиної вання або проліферація, диференціювання й вигібридоми 131.2F8.5.9 (СМСС№12047) і CHIRробництво антитіл). Прийнятні моноклональні ан12.12 (лінія мишиної гібридоми титіла до CD40 мають людські константні ділянки; 153.8E2.D10.D6.12.12 (СМСС№12056), депоновані переважно вони можуть також мати частково або в АТСС (Американська колекція типових культур; повністю гуманізовані каркасні ділянки; і найбільш 10801 University Blvd., Manassas, Virginia 20110переважно являють собою повністю людські анти2209 (США)) 17 вересня 2003 p., депозити для тіла або їх антигензв'язувальні фрагменти. Прикцілей патентування позначені як РТА-5542 і РТАладами вказаних моноклональних антитіл є анти5543 відповідно. тіла, позначені в контексті даного опису як CHIRКрім антагоністичної активності антитіла до 5.9 і CHIR-12.12. CD40, що входять у стабільні рідкі фармацевтичні Таким чином, у деяких варіантах здійснення композиції, запропоновані в даному винаході, мовинаходу антагоністичне антитіло, яке присутнє у жуть мати інший механізм дії відносно пухлинних стабільних рідких композиціях, запропонованих у клітин. Наприклад, нативні антитіла CHIR-5.9 і винаході, являє собою моноклональне антитіло CHIR-12.12 мають ADCC-активність. В іншому ваCHIR-5.9 або CHIR-12.12. Антитіла CHIR-5.9 і ріанті варіабельні ділянки антитіл CHIR-5.9 і CHIRCHIR-12.12 являють собою повністю людські мо12.12 можна експресувати в антитілі іншого ізотиноклональні антитіла до CD40 ізотипу IgG1, які пу, що має ADCC-активність. Можна також кон'юпродукуються лініями клітин гібридом 131.2F8.5. 9 гувати нативні форми, рекомбінантні форми або (позначена в контексті даного опису як лінія клітин антигензв'язувальні фрагменти CHIR-5.9 або 41 94264 42 CHIR-12.12 із цитотоксином, терапевтичним агенпредставлена в SEQ ID NO:3, і обома послідовнотом або радіоактивним металом або радіоізотостями, які представлені й в SEQ ID NO:1 і SEQ ID пом, які будуть вказані нижче. NO:3; (5) моноклональне антитіло, яке зв'язується Моноклональні антитіла CHIR-5.9 і CHIR-12.12 з епітопом, що має здатність зв'язуватися з монокзв'язують розчинний CD40 в аналізах типу ELISA, лональним антитілом, яке продукується лінією попереджають зв'язування ліганду CD40 з розтаклітин гібридоми 5.9 або лінією клітин гидридоми шованим на клітинній поверхні CD40 і заміщають 12.12; (6) моноклональне антитіло, яке зв'язується раніше зв'язаний ліганд CD40, що встановлено за з епітопом, що містить залишки 82-87 амінокислодопомогою аналізів, заснованих на використанні тної послідовності, представленої в SEQ ID NO:10 методу проточної цитометрїї. Антитіла CHIR-5.9 і або SEQ ID NO:12; (7) моноклональне антитіло, CHIR-12.12 конкурують один з одним за зв'язуваняке конкурує з моноклональним антитілом CHIRня з CD40, але не конкурують із 15В8, моноклона5.9 або CHIR-12.12 при аналізі конкурентного зв'яльним антитілом до CD40, що описано в попередзування; і (8) моноклональне антитіло, яке являє ній заявці на патент США, сер. № 60/237556, за собою антигензв'язувальний фрагмент моноклоназвою «Human Anti-CD40 Antibodies» («Людські нального антитіла CHIR-12.12 або CHIR-5.9 або антитіла до CD40»), поданої 2 жовтня 2000 р. і вказаних вище в підпунктах (1)-(7) моноклональміжнародною заявкою РСТ PCT/US01/30857, таних антитіл, де фрагмент зберігає здатність спекож із назвою «Human Anti-CD40 Antibodies» цифічно зв'язуватися з людським антигеном CD40. («Людські антитіла до CD40»), поданої 2 жовтня Фахівцям у даній галузі повинно бути очевид2001 (досьє в патентного повіреного № но, що антитіла й антигензв'язувальні фрагменти РР16092.003), обидві повністю включені в даний вказаних антитіл, наведені в даному описі, вклюопис як посилання. При оцінці in vitro впливу на чають антитіла і їх антигензв'язувальні фрагменти, проліферацію В-клітин здорових людей CHIR-5.9 і які одержують рекомбінантно за допомогою метоCHIR-12.12 діють як антагоністичні антитіла до дів, добре відомих у даній галузі й представлених CD40. Крім того, CHIR-5.9 і CHIR-12.12 не індукунижче в даному описі, і включають, наприклад, ють сильну проліферацію людських лімфоцитів моноклональні антитіла CHIR-5.9 і CHIR-12.12 , здорових індивідуумів. Ці антитіла мають здатність отримані рекомбінантно. знищувати клітини-мішені, які експресують CD40, Додаткові антагоністичні антитіла до CD40 за допомогою антитіло-обумовленої клітиннозавключають моноклональні антитіла, позначені як лежної цитотоксичності (ADCC). За даними 5D12, 3А8 і 3С6, які секретуються гібрид омами, депонованими в АТСС під реєстраційними номеВіаcore-аналізу афінність до зв'язування CHIRрами НВ 11339, НВ 12024 і НВ 11340, відповідно 5.9 з людським CD40 характеризується значенням -8 (див., наприклад, US 6315998, що повністю вклю1,210 М, афінність до зв'язування CHIR-12.12 чений у даний опис як посилання). характеризується значенням 510-10М. Інші антагоністичні антитіла до CD40 відомі в Другі антагоністичні антитіла до CD40, які маданій галузі. До них належать людське антитіло до ють характеристики зв'язування, аналогічні до хаCD40, що яке продукується гібридомою, позначерактеристик описаних вище моноклональних антиною як F4-465, що описано в опублікованих заявтіл CHIR-5.9 і CHIR-12.12, включають (але, не ках на патент США 20020142358 і 20030059427; які обмежуючись тільки ними) наступні антитіла: (1) повністю включені в даний опис як посилання. F4моноклональні антитіла, які продукуються лініями 465 одержували з організму миші лінії НАС клітин гібридом, позначених як 131.2F8.5.9 (у кон(Kuroiwa і ін., Nature Biotech. 10, 2000, с. 1086), і тексті даного опису позначена як лінія клітин 5.9) і вона експресує людський легкий лямбда-ланцюг. 153.8E2.D10.D6.12.12 (у контексті даного опису Виробництво антитіл для фармацевтичних позначена як лінія клітин 12.12), які депоновані в композицій, запропонованих у винаході АТСС для цілей патентування під номерами № Антитіла, призначені для застосування у фарРТА-5542 і № РТА-5543 відповідно; (2) монокломацевтичних композиціях, запропонованих у данальне антитіло, яке містить амінокислотну посліному винаході, наприклад, представлені в описі довність, обрану й групи, яка включає послідовантагоністичні антитіла до CD40, можна одержуваність, що представлена в SEQ ID NO:2, ти за допомогою методу виробництва антитіл, віпослідовність, що представлена в SEQ ID NO:4, домого фахівцям у даній галузі. Так, поліклональпослідовність, що представлена в SEQ ID NO:5, ну сироватку можна одержувати за допомогою послідовності, які представлені й в SEQ ID NO:2 і в загальноприйнятих методів. У цілому, розчин, що SEQ ID NO:4, і послідовності, які представлені й в містить антиген, який представляє інтерес, тобто SEQ ID NO:2 і в SEQ ID NO:5; (3) моноклональне антиген CD40, спочатку використовують для імуніантитіло, яке містить амінокислотну послідовність, зації прийнятної тварини, переважно миші, щура, вибрану із групи, яка включає послідовність, що кролика або кози. Кролики або кози є кращими для представлена в SEQ ID NO:6, послідовність, що одержання поліклональної сироватки через об'єм представлена в SEQ ID NO:7, послідовність, що одержуваної сироватки й доступності мічених анпредставлена в SEQ ID NO:8, послідовності, які тикролячих і антикозячих антитіл. представлені й в SEQ ID NO:6 і в SEQ ID NO:7, і Поліклональну сироватку можна одержувати в послідовності, які представлені й в SEQ ID NO:6 і в трансгенній тварині, переважно миші, що несе SEQ ID NO:8; (4) моноклональне антитіло, амінолокуси людського імуноглобуліну. У кращому варікислотна послідовність якого кодується нуклеотианті здійснення винаходу Sf9-KnrraHH, які експредной послідовністю, що обрана із групи, яка вклюсують білок, що представляє інтерес, наприклад, чає нуклеотидну послідовність, що представлена в CD40, застосовують як імуноген. Імунізацію можна SEQ ID NO:1, нуклеотидну послідовність, що 43 94264 44 здійснювати також шляхом змішання або емульгунаприклад, в Clackson і ін., Nature 352, 1991, стор. вання розчину, який містить антиген, у фізіологіч624-628; Marks і ін., J. Mol. Biol. 222,1991, стор. ному розчині, переважно в ад'юванті, такому як 581-597; і US 5514548. повний ад'ювант Фрейнда, і ін'єкувати суміш або Під «епітопом» мають на увазі частину антиемульсію парентрально (як правило, підшкірно або генної молекули, до якої виробляється антитіло й з внутрішньом'язево). Звичайно досить використоякою антитіло зв'язується. Епітопи можуть містити вувати дозу 50-200 мкг/ін'єкцію. Як правило, через лінійні амінокислотні залишки (тобто залишки в 2-6 тижнів здійснюють вторинну імунізацію з викоепітопі розташовані послідовно один за одним ристанням однієї або декількох ін'єкцій білка у філінійно), нелінійні амінокислотні залишки (позназіологічному розчині, переважно в неповному чені в контексті даного опису як «нелінійні епітоад'юванті Фрейнда. Альтернативно до цього можпи»; у цих епітопах залишки не розташовані посліна одержувати антитіла шляхом імунізації in vitro з довно), або й лінійні, і нелінійні амінокислотні використанням методів, відомих у даній галузі, яку залишки. для цілей даного винаходу можна вважати еквіваМоноклональні антитіла можна одержувати за лентною до імунізації in vivo Поліклональну антидопомогою методу, описаного в Kohler і ін. Nature сироватку одержують шляхом взяття крові імунізо256, 1975, стор. 495-49, або за допомогою його ваної тварини в скляний або пластиковий модифікації. Як правило, миша імунізують розчиконтейнер, інкубування крові при 25°С протягом 1 ном, що містить антиген. Імунізацію можна здійсгод із наступним інкубуванням при 4°С протягом 2нювати також шляхом змішування або емульгу18 год. Сироватку виділяють центрифугуванням вання розчину, який містить антиген, у фізіологічному розчині, переважно в ад'юванті, (наприклад, при 1000 g протягом 10 хв.). Із кролитакому як повний ад'ювант Фрейнда, і ін'єкувати ків можна одержувати зразок крові об'ємом прибсуміш або емульсію парентрально. Будь-який мелизно 20-50 мл. тод імунізації, відомий у даній галузі, можна застоОтримання клітин Sf 9 (Spodoptera frugiperda) совувати для одержання моноклональних антитіл, описане в US 6004552, що включений у даний запропонованих у винаході. Після імунізації твариопис як посилання. У випадку CD40, метод у цілони в неї видаляють селезінку (і необов'язково дему полягає в наступному: послідовності, що кодукілька великих лімфатичних вузлів) і розщеплюють ють людський CD40 одержували рекомбінантно в із одержанням індивідуальних клітин. Спленоцити бакуловірусі за допомогою вектора для переносу. можна піддавати скринінгу, наносячи клітинну суПлазмідами разом із ДНК дикого типу бакуловірусу спензію на планшет або лунку, сенсибілізовану трансфектували клітини Sf 9. Інфіковані рекомбіантигеном, що представляє інтерес. В-клітини, які нантним бакуловірусом клітини Sf 9 ідентифікуваекспресують зв'язаний з мембраною специфічний ли й клонально очищали. для антигену імуноглобулін, зв'язуються із планКраще антитіло є моноклональним за своєю шетом і не відмиваються. Отримані в результаті Вприродою. Під «моноклональним антитілом» маклітини або всі розщеплені спленоцити потім індують на увазі антитіло, отримане з популяції праккують до злиття із клітинами мієломи з одержантично гомогенних антитіл, тобто індивідуальні анням гібридом і культивують у селективному серетитіла, що входять у популяцію, ідентичні за довищі. Утворені клітини висівають шляхом винятком можливих мутацій, що зустрічаються в серійного розведення й аналізують відносно вироприродних умовах, які можуть бути присутні у мібництва антитіл, які специфічно зв'язуються з аннорних кількостях. Поняття не обмежене видами тигеном, що представляє інтерес, (і які не зв'язуабо джерелами антитіла. Під поняття підпадають ються з неспорідненими антигенами). Відібрані повні імуноглобуліни, а також їх фрагменти, такі як гібридоми, які секретують моноклональне антитіло Fab, F(ab')2, Fv і інші, що зберігають антигензв'язу(МАт), потім культивують або in vitro (наприклад, у вальну функцію антитіла. Моноклональні антитіла флаконах для культури тканини, або в реакторах з є високо специфічними, спрямовані проти одного порожнім волокном), або in vivo (у вигляді асцитів антигенного сайту; наприклад, у випадку антитіл у мишах). до CD40, до антигену CD40, що знаходиться на Якщо антагоністичні антитіла до CD40 одерклітинній поверхні. Крім того, на відміну від загажують за допомогою методу рекомбінантної ДНК, льноприйнятих (поліклональних) препаратів антито ДНК, що кодує моноклональні антитіла, можна тіл, які, як правило, включають різні антитіла до легко виділяти й секвенувати за допомогою загарізних детермінантів (епітопів), кожне моноклональноприйнятих процедур (наприклад, за допомольне антитіло спрямоване проти однієї детермінагою олігонуклеотидних зондів, які можуть специфінти на антигені. Прикметник «моноклональне» чно зв'язуватися з генами, що кодують важкі й свідчить про те, що антитіло отримане із практичлегкі ланцюги мишиних антитіл). Представлені в но гомогенної популяції антитіл, а не сконструйоданому описі клітини гібридом служать як краще вано, як це прийнято при одержанні антитіла, за джерело вказаної ДНК. Після виділення ДНК мождопомогою будь-якого конкретного методу. Наприна переносити в експресійні вектори, якими потім клад, моноклональні антитіла, призначені для затрансфектують клітини-хазяї, такі як клітини Е. coli, стосування згідно із даним винаходом, можна одемавпячі COS-клітини, клітини яєчника китайського ржувати за допомогою методу гібридом, що хом'ячка (СНО) або клітини мієломи, які без вказаописаний в Kohler і ін., Nature 256, 1975, с. 495, ної трансфекції не продукують білок імуноглобуліабо можна одержувати методами рекомбінантної ну, у результаті відбувається синтез моноклональДНК (див., наприклад, US 4816567). «Моноклонаних антитіл у рекомбінантних клітинах-хазяїнах. льні антитіла» можна виділяти також з фагових Оглядові статті, що стосуються рекомбінантної бібліотек антитіл за допомогою методів, описаних, 45 94264 46 експресії в бактеріях ДНК, що кодує антитіла, ність, виведену з послідовностей імуноглобулінів з включають публікації Skerra і ін., Curr. Opinion in організму крім людини. В основному гуманізовані Immunol. 5, 1993, с. 256, і Phickthun, Immunol. антитіла являють собою людські імуноглобуліни Revs. 130, 1992, с 151. В альтернативному варіанті (антитіло-реципієнт), у яких залишки з гіперваріаантитіло можна одержувати в лінії клітин, такий як бельних ділянок (які називають також ділянками, лінія СНО-клітин, відповідно до методу, описаного які визначають комплементарність або CDR) рев US 5545403; 5545405; і 5998144; які включені в ципієнта замінені залишками з гіперваріабельної даний опис як посилання. У цілому, метод полягає ділянки видів крім людини (антитіло-донор), таких в наступному, лінію клітин трансфектують вектояк миша, щур, кролик або примат крім людини, які рами, які можуть експресувати легкий ланцюг і мають необхідну специфічність, афінність й потеважкий ланцюг відповідно. Шляхом трансфекції нціалом. Поняття «гіперваріабельна ділянка» стодвома білками, які знаходяться у різних векторах, сується амінокислотних послідовностей, які в суможна одержувати химерні антитіла. Іншою перекупності визначають афінність і специфічність вагою є правильнo глікозиловані антитіла. зв'язування Fv-фрагмента сайту зв'язування натиУ деяких варіантах здійснення винаходу антавного імуноглобуліну, що зустрічається в природгоністичне антитіло до CD40, наприклад, антитіло них умовах (див., наприклад, Chothia і ін., J. Mol. CHIR-12.12 або CHIR-5.9, або його антигензв'язу Biol. 196,1987, стор. 901-917; Kabat і ін., NIH вальний фрагмент одержують в СНО-клітинах за Publication No. 91-3242, з U. S. Dept. of Health and допомогою системи експресії гена GS (фірма Human Services, 1991). Поняття «константна діляLonza Biologies, Портсмут, шт. Нью-Гемпшир), у нка» стосується ділянки молекули антитіла, яке якій використовують глутамінсинтетазу як маркер обумовлює ефекторні функції. У проведеному ра(див. також US 5122464; 5591639; 5658759; ніше дослідженні, що стосується одержання неі5770359; 5827739; 5879936; 5891693 і 5981216; муногенних антитіл, призначених для лікування зміст яких повністю включений в даний опис як захворювання людини, мишині константні ділянки посилання). заміняли людськими константними ділянками. Крім того, антитіла, призначені для застосуКонстантні ділянки підлягаючі гуманізації антитіл вання у фармацевтичних композиціях, запропоноодержували з людських імуноглобулінів. Однак ваних у винаході, можуть являти собою химерні вказані гуманізовані антитіла усе ще викликали антитіла, які мають необхідні характеристики зв'янебажаний і потенційно небезпечну імунну відпозування. Так, наприклад, химерні антитіла до відь у людей і характеризувалися зниженням CD40, призначені для застосування в способах, афінності. Гуманізовані антитіла, наприклад, гумазапропонованих у винаході, можуть мати характенізовані антитіла до CD40, призначені для застористики зв'язування моноклональних антитіл сування у фармацевтичних композиціях, запропоCHIR-5.9 і CHIR-12.12, представлених у даному нованих у даному винаході, мають описі. Під «химерними» антитілами мають на увазі характеристики, аналогічні до характеристик батьантитіла, які найбільш переважно отримані за доківського антитіла, що представляє інтерес, наприпомогою технології рекомбінантної дезоксирибоклад, описаних вище моноклональних антитіл нуклеїнової кислоти і які містять як людські (вклюCHIR-5.9 і CHIR-12.12. чаючи отримані з імунологічно «споріднених» Гуманізацію можна здійснювати практично вівидів, наприклад, шимпанзе), так і компоненти, дповідно до методу, описаного Winter зі співавтоотримані з організму, крім людини. Так, константна рами (Jones і ін., Nature 321, 1986, с. з. 522-525; ділянка химерного антитіла найбільш переважно Riechmann і ін., Nature 332, 1988, стор. 323-327; практично ідентична до константної ділянки людVerhoeyen і ін., Science 239, 1988, стор. 1534ського антитіла, що зустрічається в природних 1536), шляхом заміни CDR або послідовностей умовах; варіабельна ділянка химерного антитіла CDR гризунів або мутантних CDR або послідовнонайбільш переважно виведена із джерела крім стей CDR гризунів на відповідні послідовності людини й має необхідну антигенну специфічність у людського антитіла (див. також US 5225539; відношенні антигену, що представляє інтерес, тоб5585089; 5693761; 5693762; 5859205; які включені то антигену CD40. Джерело крім людини може в даний опис як посилання). У деяких випадках являти собою взяте як джерело будь-яку хребетну залишки в каркасних ділянках однієї або декількох тварину, яку можна використовувати для одерваріабельних ділянок людського імуноглобуліну жання антитіл до людського антигену або матеріазаміняють на відповідні нелюдські залишки (див., лу, що містить людський антиген CD40. Такі дженаприклад, US 5585089; 5693761; 5693762 і рела крім людини включають (але, не 6180370). Крім того, гуманізовані антитіла можуть обмежуючись тільки ними) гризунів (таких, напримістити залишки, які не виявлені в антитіліклад, як кролик, щур, миша й т.д.; див., наприклад, реципієнті або в антитілі-донорі. Ці модифікації US 4816567, що включена в даний опис як посиздійснюють для додаткового вдосконалення харалання) і приматів крім людини (таких, наприклад, ктеристики антитіла (наприклад, для одержання як вузьконосі мавпи, вищі примати; див., напринеобхідної афінності). У цілому, гуманізоване анклад, US 5750105 і 5756096; які включені в даний титіло повинне містити практично повністю приопис в якості посилання). У контексті даного опису наймні одну й, як правило, дві варіабельні ділянки, поняття «імунологічно активний» відносно, наприу яких всі або практично всі гіперваріабельні діляклад, химерних антитіл до CD40, означає, що хинки відповідають ділянкам нелюдського імуногломерне антитіло зв'язується з людським CD40. буліну, а всі або практично всі каркасні ділянки Під поняттям «гуманізовані» мають на увазі мають послідовність людського імуноглобуліну. форми антитіл, які містять мінімальну послідовГуманізоване антитіло необов'язково повинне міс 47 94264 48 тити також принаймні частину константної ділянки ких фрагментів характерні властивості, аналогічні (Fc) імуноглобуліну, як правило, людського імуногдо властивостей відповідного повнорозмірного лобуліну. Додаткові деталі див. в Jones і ін., Nature антитіла. Так, наприклад, фрагмент повнорозмір331, 1986, стор. 522-525; Riechmann і ін., Nature ного антагоністичного антитіла до CD40 повинен 332, 1988, стор. 323-329; і в Presta, Curr. Op. Struct. специфічно зв'язуватися з людським антигеном Biol. 2, 1992, стор. 593-596; які включені в даний CD40, що експресується на поверхні людської кліопис як посилання. Таким чином, вказані «гуманітини, і не мати істотної агоністичної активності, зовані» антитіла можуть являти собою антитіла, у але проявляти антагоністичну активність при зв'яяких істотно менша ділянка, ніж інтактна людська зуванні з антигеном CD40 на людській клітині, яка варіабельна ділянка, замінена на відповідну посекспресує CD40. Вказані фрагменти позначають як лідовність із видів крім людини. На практиці гума«антигензв'язувальні» фрагменти. нізовані антитіла,як правило, являють собою Прийнятні антигензв'язувальні фрагменти анлюдські антитіла, у яких деякі залишки CDR і можтитіла містять частину повнорозмірного антитіла, ливо деякі залишки каркасної ділянки замінені на як правило, його антигензв'язувальну або варіабезалишки з аналогічних сайтів антитіл гризунів льну ділянку. Прикладами фрагментів антитіл є (див., наприклад, US 5225539; 5585089; 5693761; (але, не обмежуючись тільки ними) Fab-, F(ab')2- і 5693762; 5859205. Крім того, в US 6180370 і опубFv-фрагменти й одноланцюгові молекули антитіл. лікованій міжнародній заявці WO 01/27160 описані Під «Fab-фрагментом» мають на увазі одноваленгуманізовані антитіла й методики, призначені для тний антигензв'язувальний фрагмент імуноглобуодержання гуманізованих антитіл з поліпшеною ліну, який складається з легкого ланцюга й частиафінністю відносно попередньо відібраного антини важкого ланцюга. Під F(ab')2-фрагментом гену. мають на увазі двовалентний антигензв'язувальДаний винахід можна також втілювати на ний фрагмент імуноглобуліну, що містить як обидві практиці, використовуючи ксеногенні або модифілегкі ланцюга, так і частину обох важких ланцюгів. ковані антитіла, які продукуються в хазяїні-ссавці Під «одноланцюговими Fv-фрагментами» або крім людини, більш конкретно в трансгенній миші, «sFv» антитіла мають на увазі фрагменти, які місякі відрізняються інактивованими ендогенними тять VH- і VL-ділянки антитіла, причому ці ділянки локусами імуноглобуліну (Ig). У таких трансгенних присутні в одноланцюговому поліпептиді (див., тварин компетентні ендогенні гени, які експресунаприклад, US 4946778, 5260203, 5455030 і ють субодиниці легкого й важкого ланцюга імуног5856456, які включені в даний опис як посилання). лобулінів хазяїна, роблять нефункціональними й Як правило, поліпептид Fv містить також поліпепзаміняють на аналогічні локуси людського імуногтидний лінкер між VH- і VL-ділянками, що дозволяє лобуліну. Такі трансгенні тварини продукують sFv утворювати структуру, необхідну для зв'язулюдські антитіла, які в значній мірі позбавлені сування антигену. Огляд робіт, присвячених sFv, бодиниці легкого й важкого ланцюга імуноглобулідив. в Pluckthun, в: The Pharmacology of ну хазяїна (див., наприклад, US 5877397 і 5939598, Monoclonal Antibodies, т. 113, під ред. Rosenburg i які включені в даний опис як посилання). Moore, з Springer-Verlag, New York, 1994, стор. У деяких варіантах здійснення винаходу повні269-315. Антигензв'язувальні фрагменти антагоністю людські антитіла до CD40, наприклад, одерстичних антитіл до CD40, представлених у даному жують шляхом імунізації трансгенних мишей. Зокописі, можна кон'югувати також із цитотоксином рема, вказаних мишей одержують за допомогою для знищення ракових клітин-мішеней, що буде описано нижче. XenoMouse-технології (фірма Abgenix; Фремонт, Антитіла або фрагменти антитіл можна видішт. Каліфорнія), і вона описана в US 6075181, ляти також з фагових бібліотек антитіл, створених 6091001 і 6114598, які всі включені в даний опис як за допомогою методик, які описані, наприклад, в посилання. Для одержання представлених в описі McCafferty і ін., Nature 348, 1990, стор. 552-554 і в антитіл мишей, трансгенних за локусом важкого US 5514548. Clackson і ін., Nature 352, 1991, стор. ланцюга людського IgGi і локусом людського лег624-628 і Marks і ін., J. Mol. Biol. 222,1991, стор. кого -ланцюга, імунізували клітинами Sf 9, які 581-597 описали виділення мишиних і людських експресують людський CD40. Миши можуть бути антитіл відповідно за допомогою фагових бібліотакож трансгенними за іншими ізотипами. Повністек. У наступних публікаціях описане виробництво тю людські антитіла до CD40, які можна застосовисокоафінних (нМ-діапазон) людських антитіл вувати в стабільних рідких фармацевтичних комшляхом перестановки ланцюгів (Marks і ін., позиціях, запропонованих у даному винаході, Bio/Technology 10, 1992, стор. 779-783), а також за відрізняються здатністю до зв'язування, аналогічдопомогою комбінаторного зараження й рекомбіною до здатності до зв'язування, властивої преднації in vivo як стратегія для конструювання дуже ставленим у даному описі моноклональним антибільших фагових бібліотек (Waterhouse і ін., тілам до CHIR-5.9 і CHIR-12.12. Nucleic. Acids Res. 21, 1993, стор. 2265-2266). ТаФрагменти конкретного антитіла, що предстаким чином, вказані методики являють собою важвляє інтерес, наприклад, антитіла до CD40, вклюливі альтернативи одержання моноклональних чаючи антагоністичне антитіло до CD40, можна антитіл традиційним методам одержання монокзастосовувати в стабільних рідких фармацевтичлональних антитіл за допомогою гібридом. них композиціях, запропонованих у винаході, якщо Для одержання фрагментів антитіл розроблені вони зберігають необхідну афінність повнорозміррізні методики. Традиційно ці фрагменти одержуного антитіла. Так, наприклад, фрагмент антитіла ють за допомогою протеолітичного розщеплення до CD40 повинен зберігати здатність зв'язуватися інтактних антитіл (див., наприклад, Morimoto і ін., з поверхневим антигеном CD40 В-клітин. Для та 49 94264 50 Journal of Biochemical and Biophysical Methods запропонованих у даному винаході. Варіанти ан24,1992, стор. 107-117 і Brerman і ін., Science 229, титіл, як правило, можна тестувати відносно конк1985, с. 81). Однак ці фрагменти в цей час можна ретного виду активності, наприклад, антагоністичодержувати безпосередньо за допомогою рекомної активності, афінності й специфічності, з бінантних клітин-хазяїв. Наприклад, фрагменти використанням представлених у даному описі меантитіла можна виділяти з фагових бібліотек антитодів. тіл, описаних вище. В альтернативному варіанті Антагоністичне антитіло до CD40, отримане за Fab'-SH-фрагменти можна безпосередньо виділядопомогою будь-яких описаних вище методів або ти з Е. coli і хімічно зшивати з одержанням F(ab')2будь-якого іншого методу, представленого в дафрагментів (Carter і ін., Bio/Technology 10, 1992, ному описі, або будь-якого іншого методу, не стор. 163-167). Відповідно до іншого підходу представленого в даному описі, можна використоF(ab')2-фрагменти можна виділяти безпосередньо вувати аналогічно до антитіл CHIR-12.12 або з культури рекомбінантних клітин-хазяїв. Інші меCHIR-5.9, якщо воно має принаймні один із вказатодики одержання фрагментів антитіл повинні буних видів біологічної активності: інгібує секрецію ти очевидні фахівцеві в даній галузі. імуноглобулінів здоровими людськими В-клітинами Антагоністичні антитіла до CD40, призначені периферичної крові, стимульованими Т-клітинами; для застосування в стабільних рідких фармацевінгібує виживання та/або проліферацію здорових тичних композиціях, запропонованих у даному людських В-клітин периферичної крові, стимульовинаході, являють собою описані вище моноклованих Т-клітинами лінії Jurkat; інгібує виживання нальні антитіла CHIR-5.9 і CHIR-12.12, а також та/або проліферацію здорових людських В-клітин антитіла, які відрізняються від вказаних антитіл, периферичної крові, стимульованих клітинами, які але які зберегли їх CDR; і антитіла з одним або експресують CD40L або розчинний ліганд CD40 декількома амінокислотним(и) додаванням(ями), (sCD40L); інгібує «виживання» антиапоптозних делецією(ями) або заміною(ами), де антагоністичвнутрішньоклітинних сигналів у будь-яких клітинах, ну активність оцінюють за інгібуванням В-клітинної стимульованих sCD40L або твердофазним CD40L; проліферації та/або диференціюванням. Винахід інгібує трансдукцію сигналу CD40 у будь-якій клістосується також деімунізованих антитіл, насамтині після літуванням з sCD40L або твердофазним перед деімунізованих антагоністичних антитіл до CD40L; інгібує проліферацію людських злоякісних CD40, які можна одержувати відповідно до методу, В-клітин; знижує чутливість, робить нечутливим описаному, наприклад, у міжнародних заявках на (анергія) та/або обумовлює толерантність до індупатент WO 98/52976 і WO 0034317; які включені в кції несучих CD40 клітик-мішеней або клітин, що даний опис як посилання. При використанні цього несуть споріднені ліганди CD40, включаючи (але, методу залишки в антагоністичних антитілах до не обмежуючись тільки ними) Т-клітини й ВCD40, запропонованих у винаході, модифікують клітини; індукує експансію або активацію регулятак, щоб зробити антитіла неімуногенними або торних CD4+CD25+-T-клітин (див., наприклад, дані менш імуногенними для людей, при цьому вони про відторгнення донорської алоантигенспецифічзберігають свою антагоністичну активність відносної тканини в результаті взаємодії CD40-CD40L в но людських клітин, які експресують CD40, при Maurik і ін., J. Immunol. 169, 2002. стор. 5401-5404); цьому вказану активність оцінюють за допомогою обумовлює цитотоксичність за допомогою будьаналізів, наведених у даному описі. Також під обякого механізму, включаючи (але, не обмежуючись сяг даного винаходу підпадають злиті білки, що тільки ними) антитіло-обумовлену клітиннозалежмістять антитіло, яке представляє інтерес, наприну цитотоксичність (ADCC), комплементзалежну клад, антагоністичне антитіло до CD40 або його цитотоксичність (CDC), що знижує регуляцію профрагмент, вказані злиті білки можна синтезувати ліферації та/або апоптоз клітин-мішеней); модуабо експресувати із відповідних полінуклеотидних лює секрецію цитокінів та/або експресію молекул, векторів, відомих у даній галузі. Вказані злиті білки які знаходяться на клітинній поверхні, клітинамиописані в розділі даного опису, що стосується мішенями; і їх комбінаціями. Аналізи, призначені кон'югації антитіл. для оцінки необхідної біологічної активності антаБудь-яке відоме антитіло, яке має специфічгоністичних антитіл до CD40, представлених у даність зв'язування, що представляє інтерес, може ному описі, і їх антигензв'язувальних фрагментів мати варіації послідовності, отримані за допомоможна здійснювати за допомогою методів, описагою методів, описаних, наприклад, в опублікованих у попередніх заявках на патент, за назвою них патентах ЕР 0983303 А1, WO 00/34317 і WO «Antagonist Anti-CD40 Monoclonal Antibodies and 98/52976, які включені в даний опис як посилання. Methods for Their Use» («Антагоністичні моноклоНаприклад, було встановлено, що послідовності в нальні антитіла до CD40 і способи їх застосуванCDR можуть обумовлювати зв'язування антитіла з ня»), які подані 4 листопада 2003 р. 26 листопада молекулами ГКГ класу II і запускати небажану від2003 р. і 27 квітня 2004 г., і переуступлених заявок повідь Т-клітин-хелперів. Консервативна заміна на патент США 60/517337 (досьє в патентного поможе сприяти збереженню антитілом біологічної віреного № РР20107.001 (035784/258442)), активності, але втраті його здатності запускати 60/525579 (досьє в патентного повіреного № небажану Т-клітинну відповідь. Будь-які вказані PP20107.002 (035784/271525)) і 60/565710 (досьє в консервативні або неконсервативні заміни можна патентного повіреного № РР20107.003 здійснювати за допомогою методів, відомих у да(035784/277214)) відповідно; і міжнародній заявці ній галузі, таких як вказані в даному описі, і одерна патент PCT/US2004/037152 (досьє в патентного жувати антитіла, які можна використовувати в стаповіреного № РР20107.004 (035784/282916)), яка більних рідких фармацевтичних композиціях, називається також «Antagonist Anti-CD40 51 94264 52 Monoclonal Antibodies and Methods for Their Use» роткої ізоформи людського CD40 (див., GenBank, («Антагоністичні моноклональні антитіла до CD40 і реєстраційний № NP_690593), послідовність якої способи їх застосування»), поданої 4 листопада представлена в SEQ ID NO:10, кодируемая послі2004 р. і опублікованої як WO 2005/044854; зміст довністю, представленої в SEQ ID NO:9; див. такожного з документів повністю включений в даний кож GenBank, реєстраційний № NM_152854), або опис як посилання (див. також аналізи, описані в довгої ізоформи людського CD40 (див., GenBank, попередній заявці, яка називається «Methods for реєстраційні №№ САА43045 і NP_001241, посліDiagnosis and Treatment of Proliferative Disorders довність якої представлена в SEQ ID NO:12, кодоMediated by CD40 Signaling», «Способи діагностивана послідовністю, представленою в SEQ ID ки й лікування проліферативних захворювань, NO:11; див., GenBank, реєстраційні №№ Х60592 і опосередковуваних передачею сигналу CD40», NM_001250). В альтернативному варіанті конкуреподаної 9 грудня 2005 p., і переуступленій заявці нтні аналізи зв'язування з використанням раніше на патент США 60/749285 (досьє в патентного поідентифікованих прийнятних антагоністичних антивіреного № РР028035.0002 (035784/304312)) і відтіл до CD40 можна застосовувати для відбору моповідній міжнародній заявці на патент ноклональних антитіл, порівнянних по активності з PCT/US2006/019414 (досьє в патентного повіренораніше ідентифікованими антитілами. го № РР028035.0003 (035784/311611)), поданої 18 Антитіла, застосовувані в вказаних імуноанатравня 2006 р. і опублікованої як WO 2006/125143; лізах, можуть бути міченими або неміченими. Неі в попередній заявці, яка називається «Methods for мічені антитіла можна застосовувати при аглютиDiagnosis and Treatment of Diseases Having an нації; мічені антитіла можна застосовувати в Autoimmune and/or Inflammatory Component», різноманітних аналізах, використовуючи широку («Способи діагностики й лікування захворювань, розмаїтість міток. Виявлення утворення комплексу що мають аутоімунний та/або запальний компоантитіло-антиген між антитілом до CD40 і епітонент»), поданої 9 грудня 2005 p., і в переуступлепом, який представляє інтерес, можна полегшуваній заявці на патент США 60/749336 (досьє в патети, приєднуючи до антитіла субстанцію, які виявнтного повіреного № РР028062.0002 ляють. Прийнятні шляхи виявлення включають (035784/304311)), і відповідній міжнародній заявці застосування міток, таких як радіонукліди, фермена патент PCT/US2006/019325 (досьє в патентного нти, коферменти, флуоресцентні мітки, хемілюміповіреного № РР028062.0003 (035784/311608)), несцентні мітки, хромогени, субстрати ферментів поданої 18 травня 2006 p., і опублікованої як WO або кофакторів, інгібітори ферментів, комплекси 2006/125117; зміст кожного з документів повністю простетичних груп, вільні радикали, частинки, барвключений в даний опис як посилання. Аналізи вники й т.п.. Прикладами прийнятних ферментів є описані також в Schultze і ін., Proc. Natl. Acad. Sci. пероксидаза із хрону, лужна фосфатаза, USA 92,1998, стор. 8200-8204; Denton і ін., Pediatr. галактозидаза або ацетилхолінестераза; приклаTransplant. 2, 1998, стор. 6-15; Evans і ін., J. дами прийнятних комплексів простетичних груп є Immunol. 164, 2000, стор. 688-697; Noelle, Agents комплекси стрептавідин/біотин і авідин/біотин; Actions Suppl. 49, 1998, стор. 17-22; Lederman і ін., прикладами прийнятних флуоресцентних матеріаCurr. Opin. Hematol. 3, 1996, стор. 77-86; Coligan і лів є умбеліферон, флуоресцеїн, ізотіоціанат флуін., Current Protocols in Immunology 13, 1991, с 12; оресцеїну, родамін, дихлортриазиніламін флуореKwekkeboom і ін., Immunology 79, 1993, с. з. 439сцїину, дансилхлорид або фікоеритин; прикладом 444; і US 5674492 і 5847082; вміст яких включено люмінесцентного матеріалу є лумінол; прикладами як посилання. біолюмінісцентних матеріалів є люцифераза, люРепрезентативний аналіз, що дозволяє виявциферин і екворин; і прикладами прийнятних раляти антагоністичні антитіла до CD40, специфічні діоактивних матеріалів є 125І, 131І, 35S або 3Н. Вкадля епітопів антигену CD40, що застосовують у зані мічені реагенти можна застосовувати в даному описі, являє собою «аналіз конкурентного багатьох аналізах, таких як радіоімуноаналізи, зв'язування». Аналізи конкурентного зв'язування ферментні аналізи, наприклад, ELISA, флуоресцеявляють собою серологічні аналізи, у яких невідомі нтні імуноаналізи й т.п. (див., наприклад, US субстанції виявляють і кількісно оцінюють за їх 3766162; 3791932; 3817837 і 4233402). здатністю інгібувати зв'язування міченого відомо Будь-які раніше описані антагоністичні антитіліганду зі специфічним для нього антитілом. Це ла до CD40 або їх антигензв'язу вальні фрагменти стосується також конкурентних аналізів інгібуванможна кон'югувати перед застосуванням у фарманя. У репрезентативному конкурентному аналізі цевтичних композиціях, запропонованих у даному зв'язування мічений поліпептид CD40 осаджують винаході. Методи одержання кон'югованих антитіл антитілами-кандидатами в зразку, наприклад, у відомі в даній галузі. Так, антитіло можна мітити сполученні з моноклональними антитілами до одшляхом непрямого мічення або підходу, заснованого або декількох епітопів моноклональних антиного на непрямому міченні. Під «непрямим мечетіл, запропонованих у винаході. Антитіла до CD40, нием» або «підходом, заснованому на непрямому які специфічно взаємодіють із епітопом, що предміченні» мають на увазі, що хелатувальний агент ставляє інтерес, можна ідентифікувати шляхом ковалентно приєднують до антитіла й принаймні скринінгу серій антитіл, що утворилися до білка один радіонуклід, що представляє інтерес, вбудоCD40 або фрагменту білка, що містить конкретний вують у хелатувальний агент (див., наприклад, інтерес, що представляє, епітоп білка CD40. Нахелатувальні агенти й радіонукліди, описані в приклад, епітопи людського CD40, що представSrivagtava і Mease, Nucl. Med. Bio. 18, 1991, стор. ляють інтерес, являють собою епітопи, що містять 589-603, публікація включена в даний опис як полінійні та/або нелінійні амінокислотні залишки косилання). Прийнятні мітки являють собою флуо 53 94264 54 рофори, хромофори, радіоактивні атоми (насамCD40, наприклад, моноклонального антитіла перед 32Р і 125І), агенти, що реагують на електронCHIR-5.9 або CHIR-12.12, представленого в данону густину, ферменти й ліганди, які мають «партму описі, можна одержувати за допомогою мутацій нерів для специфічного зв'язування». Ферменти, у клонованій послідовності ДНК, що кодує антитіяк правило, виявляють по їхній активності. Наприло, яке представляє інтерес. Методи мутагенезу й клад, пероксидазу із хрону звичайно виявляють за зміни нуклеотидних послідовностей добре відомі в її здатністю перетворювати 3,3',5,5'даній галузі (див., наприклад, Techniques in тетраметилбензидин (ТМВ) з утворенням блакитMolecular Biology під ред. Walker i Gaastra, з ного пігменту, який можна оцінювати кількісно спеMacMillan Publishing Company, New York, 1983; ктрофотометричним методом. Поняття «партнер Kunkel, Proc. Natl. Acad. Sci. USA 82,1985, стор. для специфічного зв'язування» стосується білка, 488-492; Kunkel і ін., Methods Enzymol. 154, 1987, який має здатність зв'язуватися з молекулоюстор. 367-382; Sambrook і ін., Molecular Cloning: A лігандом з високою специфічністю, як, наприклад, Laboratory Manual, Cold Spring Harbor, New York, у випадку антигену й специфічного для нього мо1989; US 4873192; і процитовані в вказаних публіноклонального антитіла. Інші партнери для спекаціях посилання; вказані публікації включені в цифічного зв'язування являють собою біотин і авіданий опис як посилання). Посібник зі здійснення дин або стрептавідин, IgG і протеїн А і численні відповідних амінокислотних замін, які не повинні пари рецептор-ліганд, відомі в даній галузі. Слід впливати на біологічну активність поліпептиду, що розуміти, що у викладеному вище описі не стапредставляє інтерес, можна почерпнути з моделі, виться завдання розділити різні мітки на конкретні представленої в Dayhoff і ін., Atlas of Protein класи, оскільки деякі мітки можуть виконувати Sequence and Structure, вид-во Natl. Biomed. Res. свою функцію за допомогою декількох різних меFound., Washington, D.C., 1978, публікація включеханізмів. Наприклад, 125І може служити як радіоакна в даний опис як посилання. Кращими можуть тивна мітка або як агент, що реагує на електронну бути консервативні заміни, при яких заміняють густину. HRP може служити як фермент або як одну амінокислоту іншої з аналогічними властивоантиген для МАт. Крім того, можна комбінувати стями. Прикладами консервативних замін є (але, різні мітки для досягнення необхідного ефекту. не обмежуючись тільки ними) GlyAla, Наприклад, МАт і авідин також потрібно мітити при ValllеLeu, AspGlu, LysArg, AsnGln і втіленні на практиці даного винаходу: так можна PheTrpTyr. мітити МАт біотином і виявляти його присутність При конструюванні варіантів поліпептиду антаза допомогою авідину, міченого 125І, або МАт до гоністичного антитіла до CD40, що представляє біотину, міченого за допомогою HRP. Інші пересінтерес, наприклад, антитіла CHIR-12.12 або тановки й можливості повинні бути очевидні звиCHIR-5.9, здійснюють такі модифікації, що отричайним фахівцям у даній галузі, і вони розглядамані в результаті варіанти продовжують мати неються як еквіваленти в контексті даного винаходу. обхідну активність, тобто аналогічну афінність до В альтернативному варіанті антагоністичне зв'язування, і у випадку антагоністичних антитіл до антитіло до CD40, яке представляє інтерес, можна CD40, мають здатність до специфічного зв'язуванмітити шляхом прямого мічення або підходу, заня з людським антигеном CD40, який експресуєтьснованого на прямому міченні, при цьому радіонуся на поверхні людської клітини, і не мають істотклід ковалентно приєднують до антитіла (як праної агоністичної активності, але проявляють вило, через амінокислотний залишок). Кращі антагоністичну активність при зв'язуванні з антигерадіонукліди представлені в Srivagtava і Mease, ном CD40 на людській клітині, яка експресує CD40. 1991, вище. Підхід, заснований на непрямому міОчевидно, що будь-які мутації в ДНК, що кодує ченні, є найбільш кращим (див. також, наприклад, варіант поліпептиду, не повинні відбуватися в посопубліковані міжнародні заявки на патент WO лідовності за межами рами зчитування й переваж00/52031 і WO 00/52473, у яких для приєднання но не повинні приводити до створення комплеменрадіоактивної мітки до антитіл використовують тарних ділянок, які можуть приводити до лінкер; і мічені форми антитіл до CD40, описані в утворення вторинної структури мРНК (див. опубліUS 6015542; які включені в даний опис як посиковану заявку на європейський патент ЕР 75444). лання). Крім того, константну ділянку антагоністичного Варіанти антитіл антитіла до CD40 можна різноманітними шляхами Для приготування фармацевтичних композипіддавати мутації для зміни ефекторної функції. цій, запропонованих у даному винаході, можна Наприклад, див. US 6737056B1 і опубліковану заявикористовувати варіанти антагоністичного антивку на патент США № 2004/0132101А1, у яких опитіла до CD40, відомі в даній галузі. Такі варіанти сані мутації Fc, які оптимізують зв'язування антитіповинні зберігати необхідну здатність до зв'язула з Fc-рецепторами. вання батьківського антитіла. Так, наприклад, коли Переважно, варіанти антагоністичного рефеантагоністичне антитіло до CD40, яке піддягає ренс-антитіла до CD40 мають амінокислотні послівключенню в препаративну форму, являє собою довності, які ідентичні принаймні на 70% або 75%, варіант батьківського антитіла CHIR-12.12 або переважно ідентичні принаймні на 80% або 85% CHIR-5.9, то антитіло-варіант повинне зберігати більш переважно ідентичні принаймні на 90%, здатність до зв'язування, характерну для батьків91%, 92%, 93%, 94% або 95% до амінокислотної ського антитіла CHIR-12.12 або CHIR-5.9. Методи послідовності референс-антитіла, наприклад, створення варіантів антитіл у цілому, є доступнипредставленого в даному описі моноклонального ми в даній галузі. Наприклад, амінокислотну посантитіла CHIR-5.9 або CHIR-12.12, або вкороченолідовність варіантів антагоністичного антитіла до го фрагмента молекули референс-антитіла. Більш 55 94264 56 переважно послідовність молекул ідентична призастосування фармацевтичної композиції служить наймні на 96%, 97%, 98% або 99%. Для цілей дадля попередження або ослаблення будь-якого ного винаходу відсоток ідентичності послідовності виникаючого в наслідку симптому. У випадку теравизначають за допомогою алгоритму пошуку гомопевтичного застосування фармацевтичну компології Сміта-Ватермана, використовуючи для пошузицію використовують відразу (або незабаром піску афінного пролому штраф за відкриття пролому ля) прояву симптому. Терапевтичне застосування 12 і штраф за подовження пролому 2, матрицю фармацевтичної композиції служить для ослабBLOSUM 62. Алгоритм пошуку гомології Сміталення будь-якого вже наявного симптому. Ватермана викладений в Smith і Waterman, Adv. Типові шляхи введення включають (але, не Appl. Math. 2, 1981, стор. 482-489. Варіант може, обмежуючись тільки ними) оральне введення й наприклад, відрізнятися від антагоністичного репарентеральне введення, у тому числі внутрішференс-антитіла до CD40 приблизно 1-15 амінокиньовенну, внутрішньом'язову, підоболонкову, інслотними залишками, приблизно 1-10 амінокислотраназальну, під'язичну, внутрішньоартеріальну й тними залишками, наприклад, 6-10, приблизно 5, внутрішньочеревинну ін'єкцію або інфузію, і підшприблизно 4, 3, 2 або навіть 1 амінокислотним закірну ін'єкцію. Методи здійснення такого введення лишком. відомі звичайному фахівцеві в даній галузі. Для оптимального порівняльного аналізу двох У кращих варіантах здійснення винаходу фарамінокислотних послідовностей безперервний семацевтичні композиції, запропоновані у винаході, гмент варіанта амінокислотної послідовності може уводять внутрішньовенно. Внутрішньовенне ввемати додаткові амінокислотні залишки або вилудення здійснюють переважно шляхом інфузії прочені в результаті делеції амінокислотні залишки тягом періоду часу, що становить від приблизно 1 щодо амінокислотної референс-послідовності. до приблизно 10 год, більш переважно від приблиБезперервний сегмент, застосовуваний для порівзно 1 до приблизно 8 год, ще більш переважно від няння з амінокислотною референсприблизно 2 до приблизно 7 год, ще більш перепослідованістю, може включати принаймні 20 суважно від приблизно 4 до приблизно 6 год, залежміжних амінокислотних залишків, і може складатино від підмета введенню антагоністичного антитіла ся з 30, 40, 50 або більшої кількості амінокислотдо CD40. Первісну інфузію фармацевтичною комних залишків. Можна здійснювати корекції позицією можна здійснювати протягом періоду ідентичності послідовностей, асоційовані з консерчасу, що становить від приблизно 4 до приблизно вативними замінами залишків або проломами 6 год, з наступними більше швидкими інфузіями. (див. алгоритм пошуку гомології СмітаНаступні інфузії можна здійснювати протягом пеВатермана). ріоду часу, що становить від приблизно 1 до прибМетоди лікування за допомогою фармацевтилизно 6 год, у тому числі, наприклад, від приблизчних композицій, запропонованих у винахід но 1 до приблизно 4 год, від приблизно 1 до Фармацевтичні композиції, запропоновані в приблизно 3 год або від приблизно 1 до приблизно даному винаході, знаходять застосування при лі2 год. куванні індивідуума, що страждає від раку або пеІндивідуумові вводять фармацевтичну компоредракового стану, асоційованим з клітинами, які зицію, запропоновану у винаході, у фармацевтичекспресують CD40, або при лікуванні запального но ефективній кількості. Під «фармацевтично ефезахворювання та/або аутоімунного захворювання, ктивною кількістю» мають на увазі кількість, що асоційованого з клітинами, які експресують CD40. застосовують для лікування захворювання або Поняття «лікування» у контексті даного опису стостану, при цьому обробку можна здійснювати в сується нанесення або введення фармацевтичної профілактичних або терапевтичних цілях, як вкакомпозиції, що містить антагоністичне антитіло до зано вище. Причому, при введенні фармацевтично CD40, індивідуумові, або нанесення або введення ефективної кількості композиції індивідуумові, що фармацевтичної композиції, що містить антагонісмає потребу в лікуванні, вводять антагоністичне тичне антитіло до CD40, у виділену тканину або антитіло до CD40 у терапевтично ефективній дозі лінію клітин з організму індивідуума, де індивідуум або кількості. Під «терапевтично ефективною домає захворювання, симптом захворювання або зою або кількістю» або «ефективному кількістю» схильність до захворювання, при цьому метою є мають на увазі кількість антагоністичного антитіла вилікування, загоєння, полегшення, ослаблення, до CD40, що при його введенні приводить до одезміна, лікування, зменшення інтенсивності, поліпржання терапевтичної відповіді, близького до пошення стану або вплив на захворювання, симптозитивного, відносно лікування пацієнта, що стражми захворювання або схильність до захворювандає захворюванням, асоційованим з клітинами, які ня. експресують CD40. У деяких варіантах здійснення Під «індивідуумом» мають на увазі будь-яку винаходу терапевтично ефективна доза антагоністварину. Переважно індивідуум являє собою ссавтичного антитіла до CD40, наприклад, моноклонаця, найбільш переважно індивідуум являє собою льного антитіла CHIR-12.12 або CHIR-5.9, або його людину. Інші важливі крім людини ссавці являють антигeнзв'язувального фрагмента становить від собою (але, не обмежуючись тільки ними) собак, приблизно 0,01 мг/кг до приблизно 40 мг/кг, від кішок, корів, коней, овець і свиней. приблизно 0,01 мг/кг до приблизно 30 мг/кг, від Коли введення здійснюють із метою лікування, приблизно 0,1 мг/кг до приблизно 30 мг/кг, від прито воно може бути проведене з метою профілактиблизно 1 мг/кг до приблизно 30 мг/кг, від приблизки або терапії. У випадку профілактичного застоно 3 мг/кг до приблизно 30 мг/кг, від приблизно 3 сування фармацевтична композиція приводить до мг/кг до приблизно 25 мг/кг, від приблизно 3 мг/кг поліпшення будь-якого симптому. Профілактичне до приблизно 20 мг/кг, від приблизно 5 мг/кг до 57 94264 58 приблизно 15 мг/кг або від приблизно 7 мг/кг до і доброякісні клітини, у яких порушена регуляція приблизно 12 мг/кг. Встановлено, що метод лікуабо відсутня регуляція клітинного росту. вання може передбачати одне введення в терапеПід «протипухлинною активністю» мають на втично ефективній дозі або декілька введень у увазі зниження швидкості проліферації або нагротерапевтично ефективній дозі антагоністичного мадження злоякісних клітин, які експресують антитіла до CD40 або його антигензв'язувального CD40, і, як наслідок, зниження швидкості росту фрагмента. існуючої пухлини або пухлини, що виникає в проФармацевтичні композиції, запропоновані у цесі терапії, та/або деструкцію існуючих неопласвинаході, знаходять застосування при лікуванні тичних (пухлинних) клітин або знову утворилися будь-якого індивідуума, що має рак або передранеопластичних клітин, і, як наслідок, зниження ковий стан, що реагує на лікування з використанзагального розміру пухлини в процесі терапії. Теням анти-CD40 терапевтичного агента, більш конрапія з використанням фармацевтичних композикретно антагоністичного антитіла до CD40. Методи цій, які містять антагоністичне антитіло до CD40, визначення чутливості раку або передракового запропонованих у винаході, викликає фізіологічну стану на лікування антитілом до CD40 включають відповідь, сприятливу з позицій лікування різних діагностичні й прогностичні аналізи, наприклад, видів раку й передракових станів, асоційованих зі аналізи, описані в попередній заявці на патент, яка стимуляцією передачі сигналу CD40 на клітинах, знаходиться в одночасному розгляді й спільній які експресують CD40 у людини. власності, за назвою «Methods for Diagnosis and Поняття «рак» і «раковий» стосуються або Treatment of Proliferative Disorders Mediated by служать для опису фізіологічного стану в ссавців, CD40 Signaling» («Способи діагностики й лікування які, як правило, характеризуються нерегульованим проліферативних порушень, опосередковуваних клітинним ростом. Прикладами раку є (але, не обпередачею сигналів CD40»), поданої 9 грудня межуючись тільки ними) лімфома й лейкоз, і щільні 2005 p., і в переуступленій заявці на патент США пухлини. Під «зв'язаним із В-клітиною раком» або № 60/749285 (досьє в патентного повіреного № «раком В-клітинної зародків лінії» мають на увазі РР028035.0002 (035784/304312), і відповідній міжбудь-який тип раку, при якому порушення регуляції народній заявці на патент PCT/US2006/019414 або відсутність регуляція клітинного росту асоці(досьє в патентного повіреного № РР028035.0003 йовано із В-клітинами. (035784/311611)), поданої 18 травня 2006 p., і в Поняття «несприйнятливий» відносно раку опублікованої WO 2006/125143; зміст яких повнісстосується конкретного раку, який стійкий або не тю включений в даний опис як посилання. Аналогіреагуює на терапію конкретним терапевтичним чно до цього фармацевтична композиція, запроагентом, наприклад, антагоністичним антитілом до понована у винаході, знаходить застосування при CD40, що представляє інтерес. Рак може бути лікуванні будь-якого індивідуума, що має запальне несприйнятливим до терапії конкретним терапевта/або аутоімунне захворювання, що реагує на тичним агентом або з початку лікування конкретлікування з використанням анти-CD40 терапевтиним терапевтичним агентом (тобто не реагувати чного агента, більш конкретно антагоністичного на початкову обробку терапевтичним агентом), антитіла до CD40. Методи визначення чутливості або в результаті розвитку стійкості до терапевтичзапального та/або аутоімунного захворювання на ного агента, або в процесі початкового періоду лікування антитілом до CD40 включають діагнослікування терапевтичним агентом, або в процесі тичні й прогностичні аналізи, наприклад, аналізи, наступного періоду лікування терапевтичним агенописані в попередній заявці на патент, що знахотом. диться в одночасному розгляді й спільній власносФармацевтичні композиції, запропоновані в ті, за назвою «Methods for Diagnosis and Treatment даному винаході, знаходять застосування при ліof Diseases Having an Autoimmune and/or куванні індивідуума, що має потребу в терапевтиInflammatory Component» («Способи діагностики й чному втручанні в ракове або передраковий стан, лікування захворювань, що мають аутоімунний що опосередковується стимуляцією передачі сигта/або запальний компонент»), подану 9 грудня налу CD40 на клітинах, які експресують CD40, або 2005 г., і в переуступленій заявці на патент США в будь-яке запальне або аутоімунне захворюван№ 60/749336 (досьє в патентного повіреного № ня, що опосередковується передачею сигналу РР028062.0002 (035784/304311), і відповідній міжCD40 на клітинах, які експресують CD40. Під «клінародній заявці на патент PCT/US2006/019325 тинами, які експресують CD40» розуміють здорові, (досьє в патентного повіреного № РР028062.0003 передракові й злоякісні клітини, які експресують (035784/311608)), поданої 18 травня 2006 p., і в антиген CD40. У деяких варіантах здійснення виопублікованої WO 2005/125117; зміст яких повніснаходу клітина, яка експресує CD40, являє собою тю включений в даний опис як посилання. злоякісну В-клітину. Під «злоякісною» В-клітиною Поняття «пухлина» у контексті даного опису мають на увазі будь-яку неопластичну В-клітину, стосується будь-якого неопластичного клітинного включаючи (але, не обмежуючись тільки ними) Вросту й проліферації, як злоякісного, так і доброяклітини, отримані з лімфом, включаючи лімфоми з кісного, і всіх передракових і ракових клітин і тканизьким, середнім ступенем злоякісності й високонин. Поняття «неопластичний» у контексті даного злоякісні В-клітинні лімфоми, імунобластні лімфоопису стосується будь-якої форми порушеної реми, не-ходжкінські лімфоми, хвороба Ходжкіна, гуляції або відсутності регуляції клітинного росту індуквоані вірусом Епштейна-Бара (EBV) лімфоми як злоякісного, так і доброякісного, що приводить й зв'язані зі СНІДом лімфоми, а також гострий Вдо аномального росту тканини. Таким чином, до клітинний лімфобластний лейкоз, мієломи, хроніч«неопластичних клітин» належать як злоякісні, так ний лімфоцитарний лейкоз і т.п. В інших варіантах 59 94264 60 здійснення винаходу клітина, яка експресує CD40, Project», Cancer 49, 1982, стор. 2112-2135). Так, Вявляє собою клітину карциноми або саркоми. Під клітинні лімфоми низького ступеня злоякісності «клітиною карциноми, яка експресує CD40» або включають фолікулярну дрібноклітинну лімфому з «клітиною саркоми, яка експресує CD40» мають на розщепленими ядрами й фолікулярну лімфому увазі будь-яку злоякісну (тобто неопластичну) або змішаного типу з розщепленими ядрами й великопередракову клітину карциноми або саркоми щільклітинну лімфому; лімфоми проміжного ступеня ної пухлини, що експресує поверхневий антиген злоякісності включають фолікулярну великокліCD40. Для цілей даного винаходу ракові й передтинну лімфому, дифузійну дрібноклітинну лімфому пухлинні й передракові клітини, які експресують з розщепленими ядрами, дифузійну змішану дрібантиген CD40, позначають як «неопластичні клітиноклітинну й великоклітинну лімфому й дифузійну ни, які експресують CD40». Методи виявлення великоклітинну лімфому; а високозлоякісні лімфоекспресії CD40 у клітинах добре відомі в даній гами включають великоклітинні імунобластні, лімлузі й включають (але, не обмежуючись тільки фобластні лімфоми й дрібноклітинну лімфому з ними) методи ПЦР, імуногістохімії, проточної цирозщепленими ядрами Беркіта й не-беркітовського тометрії, Вестерн-блотингу, ELISA, і т.п. Якщо літипу. кування антагоністичним антитілом до CD40 або Встановлено, що фармацевтичні композиція, його антигензв'язу вальним фрагментом виправзапропоновані у винаході, можна застосовувати дано, то фармацевтичну композицію, що містить для терапевтичного лікування В-клітинних лімфом, антагоністичне антитіло до CD40 або його антигеякі класифікують відповідно до переглянутої євронзв'язувальний фрагмент, можна застосовувати за пейської й американської системи класифікації допомогою будь-якого прийнятного шляху введенлімфом (Revised European and American ня. Lymphoma Classification, REAL). Такі В-клітинні Індивідуум, що має потребу в терапевтичному лімфоми включають (але, не обмежуючись тільки втручанні з використанням фармацевтичної комними) лімфоми, які відносять до попередників Впозиції, запропонованої в даному винаході, може клітинних неоплазм, такі як В-клітинний лімфоблабути уражений або мати ризик розвитку або рецистний лейкоз/лімфома; неоплазми периферичних диву будь-якого ракового або передракового стаВ-клітин, включаючи В-клітинний хронічний лімфону, що опосередковується передачею сигналу цитарний лейкоз/дрібноклітинну лімфоцитарну CD40 на неопластичних клітинах, які експресують лімфому, лімфоплазмацитоїдну лімфоCD40. Прикладами таких ракових і передракових му/імуноцитому, лімфому із клітин мантії (MCL), станів є (але, не обмежуючись тільки ними) будьфолікулярну центральну лімфому (фолікулярна які види раку В-клітинної зародкової лінії, не зв'ялімфома) (включаючи дифузійну дрібноклітинну зані з В-клітинами гематологічні злоякісні захволімфому, дифузійну лімфому змішаного типу (дрірювання й щільні пухлини, для яких відомо, що бноклітинну й великоклітинну) і дифузійні великоквони опосередковуються передачею сигналу CD40 літинні лімфоми), В-клітинну лімфому маргінальної на CD40 неопластичних клітинах, які експресують. зони (включаючи лімфоми екстранодального, ноПрикладами видів раку В-клітинної зародкової дального й селезінкового типів), плазмоцитолінії, що містить які експресують CD40 неопластиму/мієлому, дифузійну великоклітинну В-клітинну чні клітини, є гострий лімфобластний лейкоз (ALL), лімфому первинно медіастинального підтипу (тихронічний лімфобластний лейкоз (CLL), пролімфомусна), лімфому Беркіта й високозлоякісну лімфоцитарний лейкоз (PLL), лейкемічний ретикульоз, му беркітовського типу; і некласифіковані низького хвороба Ходжкіна, множинна мієлома, макроглоступеня злоякісності або високозлоякісні В-клітинні булінемія Вальденстрома, хвороби важких ланцюлімфоми. гів, і лімфоми, включаючи (але, не обмежуючись Фармацевтичні композиції, запропоновані в тільки ними) дифузійну дрібноклітинну лімфоцитаданому винаході, можна застосовувати також для рну лімфому, фолікулярну лімфому, DLBCL (дилікування індивідуумів, які мають передраковий фузійну В-клітинна лімфома з розщепленими ядстан, такий як MGUS (моноклональна гаммапатія рами), лімфому лімфоїдної тканини, асоційованої невстановленої етіології). Приблизно в 25% пацієзі слизовими оболонками, моноцитоїдну Внтів з MGUS зрештою розвивається множинна клітинну лімфому, лімфому селезінки, лімфоматомієлома (MM) або споріднене порушення плазмаїдний гранулематоз, інтраваскулярний лімфоматичних клітин (Kyle, Mayo Clinic. Proc. 68, 1993, тоз, імунобластну лімфому, СНІД-зв'язану лімфостор. 26-36). Проліферація злоякісних плазматичму й т.п. них клітин у кістковому мозку, виявлення моноклоТаким чином, фармацевтичні композиції, занального білка (М-білок) у сироватці або сечі, анепропоновані у винаході, знаходять застосування мія, гіперкальцемія, ниркова недостатність і літичні при лікуванні індивідуумів, що страждають неушкодження кістки являють собою клінічні прояви ходжкінською лімфомою, що зв'язана з аномальMM, у той час як MGUS розпізнається клінічно за ною неконтрольованою проліферацією або нагроприсутністю М-білка в сироватці або сечі без інших мадженням В-клітин. Для цілей даного винаходу клінічних особливостей MM (див., наприклад, Kyle і такі лімфоми можна віднести відповідно до схеми Lust, Semin. Hematol. 26, 1989, стор. 176-200; Робочої класифікації (Working Formulation) до ВGreipp і Lust, Stem Cells, 13, 1995, стор. 10-21). клітинних лімфом, які поділяють на В-клітинну ліПацієнти, що мають MGUS, є безсимптомними й у мфому низького ступеня злоякісності, В-клітинну них стабільно виявляється М-білок (Kyle, Mayo лімфому проміжного ступеня злоякісності, високоClinic. Proc. 68, 1993, стор. 26-36). Коли MGUS злоякісну В-клітинну лімфому (див. «The Nonідентифікована в індивідуума, то підтримуюча теHodgkin's Lymphoma Pathologic Classification рапія за допомогою відповідної фармацевтичної
ДивитисяДодаткова інформація
Назва патенту англійськоюStable liquid antagonist anti-cd40 antibody-containing pharmaceutical composition
Автори англійськоюLu Xiaofeng, Chen Bao-Lu, Araya Kidisti, Okhamafe Augustus
Назва патенту російськоюСтабильная жидкая фармацевтическая композиция, которая содержит антагонистическое моноклональное антитело к cd40
Автори російськоюЛу Сяофен, Чень Бао-Лу, Арайа Кидисти, Окхамафе Аугустус
МПК / Мітки
МПК: A61K 47/06, A61P 35/00, A61P 37/00, A61K 39/395
Мітки: рідка, містить, антитіло, стабільна, фармацевтична, моноклональне, антагоністичне, композиція
Код посилання
<a href="https://ua.patents.su/64-94264-stabilna-ridka-farmacevtichna-kompoziciya-shho-mistit-antagonistichne-monoklonalne-antitilo-do-cd40.html" target="_blank" rel="follow" title="База патентів України">Стабільна рідка фармацевтична композиція, що містить антагоністичне моноклональне антитіло до cd40</a>
Попередній патент: Гідродинамічна муфта
Наступний патент: Спосіб електроопалення будинку
Випадковий патент: Спосіб прогнозування ризику розвитку обструктивних захворювань легень у працюючих в умовах високої запиленості