Способи зниження віруліцидної активності композицій, що містять pcv-2, і композиції, що містять рсv-2 з підвищеною імуногенністю
Номер патенту: 107581
Опубліковано: 26.01.2015
Автори: Кохлер Керолайн Енн, Хазраіназмпур Алі, Ейчмейєр Марк, Шеффер Меррілл, Айхенмюллер Бернд Колін, Хейвік Грегорі, Чжао Госун
Формула / Реферат
1. Спосіб отримання антигенної композиції, що містить PCV-2, що полягає в тому, що здійснюють стадії, на яких:
І) одержують першу рідину, що містить антиген PCV-2; і
II) відокремлюють щонайменше частину першої рідини від антигену PCV-2 шляхом здійснення стадії фільтрації з використанням фільтру, де частину першої рідини відокремлюють від антигену PCV-2 за допомогою заміни частини першої рідини на другу рідину, де друга рідина відмінна від першої рідини.
2. Спосіб за п. 1, в якому заміна частини першої рідини на другу рідину полягає в тому, що здійснюють стадії, на яких:
а) додають рідину за допомогою додавання другої рідини до першої рідини, що містить антиген PCV-2; і
б) концентрують антиген PCV-2 шляхом відділення частини першої та другої рідин.
3. Спосіб за п. 2, в якому стадію концентрування і стадію додавання рідини здійснюють практично одночасно.
4. Спосіб за п. 2 або 3, в якому стадію концентрування і стадію додавання рідини здійснюють щонайменше два рази.
5. Спосіб за п. 3 або 4, в якому фільтр включає напівпроникну мембрану.
6. Спосіб за п. 5, в якому напівпроникна мембрана має середній розмір пор, який менше розміру антигену PCV-2, що запобігає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани і утримує антиген PCV-2 на фільтрі.
7. Спосіб за будь-яким з пп. 3-6, в якому фільтр має такий середній розмір пор, який запобігає проходженню щонайменше 90 % білків з молекулярною масою від 50 до 500 кДа.
8. Спосіб за будь-яким з пп. 2-7, в якому на стадії концентрування концентрують антиген в 3-50 разів у порівнянні з об'ємом першої рідини.
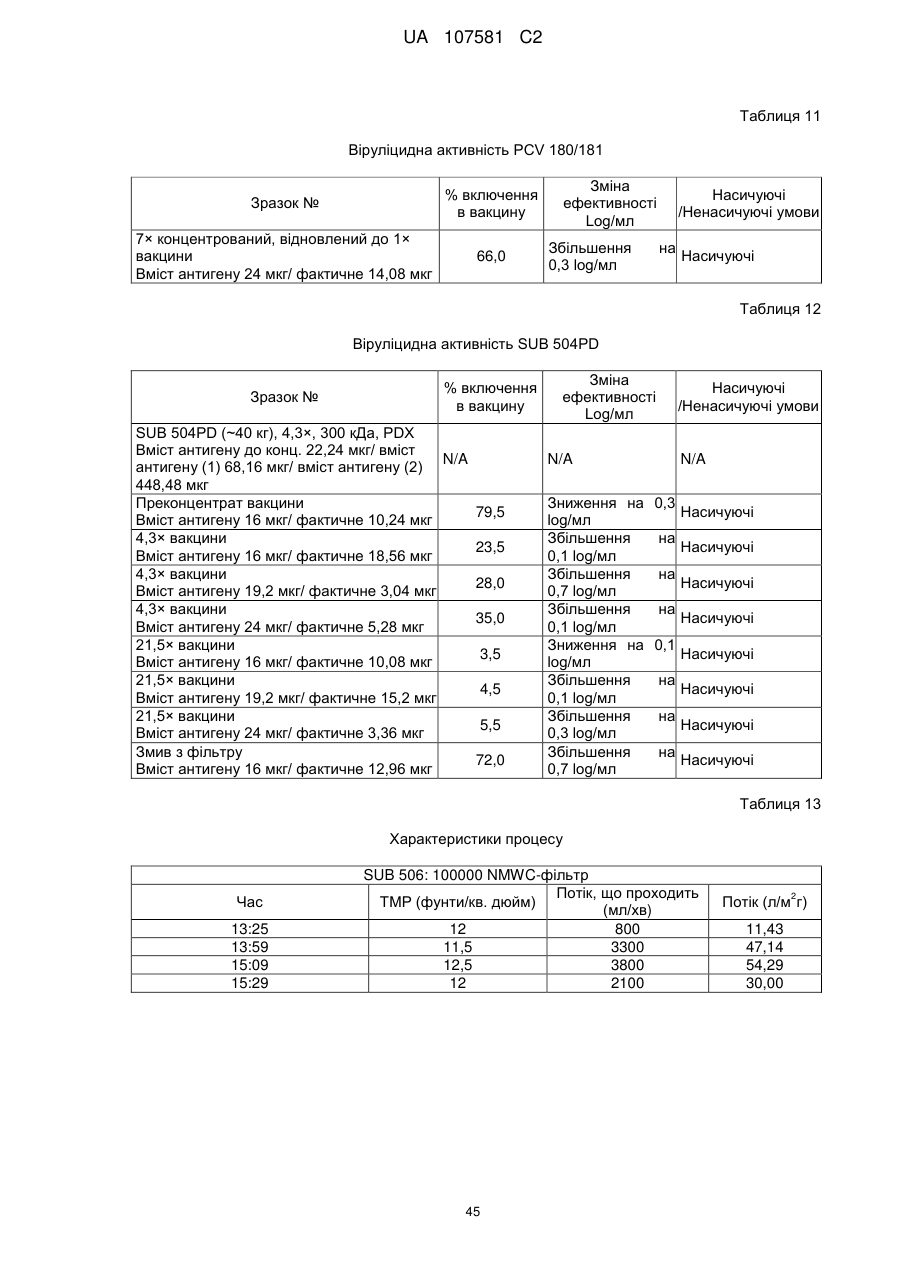
9. Спосіб за будь-яким з пп. 1-8, в якому віруліцидну активність, що містить PCV-2 антигенної композиції знижують щонайменше на 10 % в порівнянні з рідиною, яку не піддавали обробці згідно заявленого способу.
10. Спосіб за будь-яким з пп. 1-9, в якому антигенна композиція, що містить PCV-2, отримана шляхом здійснення стадій І) - II), викликає зменшення менш ніж на 1 log ТСID50/мл живого вірусу або менш ніж на 1 log КУО/мл живої бактерії після зміщування живого вірусу або живої бактерії з антигенною композицією, що містить PCV-2 протягом 2 або більше годин.
11. Спосіб за будь-яким з пп. 1-10, в якому антигенна композиція, що містить PCV-2, отримана шляхом здійснення стадій І) - II), викликає зменшення менш ніж на 0,7 log ТСID50/мл живого вірусу або менш ніж на 0,7 log КУО/мл живої бактерії після змішування живого вірусу або живої бактерії з антигенною композицією, що містить PCV-2 протягом 2 або більше годин.
12. Спосіб за будь-яким з пп. 1-11, де спосіб додатково полягає в тому, що здійснюють стадію, на якій збирають антиген PCV-2, що залишився після здійснений стадії II).
13. Спосіб за п. 12, де спосіб додатково полягає в тому, що здійснюють стадію, на якій здійснюють очистку продукту, зібраного після здійснення стадії II), який містить антиген PCV-2, за допомогою хроматографічного методу.
14. Спосіб за п. 13, в якому антиген PCV-2 очищають до досягнення ступеня чистоти антигену PCV-2, що становить більш ніж 50 мас. % в перерахунку на загальний вміст білка.
15. Спосіб за будь-яким з пп. 1-14, що додатково полягає в тому, що здійснюють стадію, на якій змішують антиген PCV-2, що залишився після здійснення стадії II), з додатковим компонентом, вибраним з групи, що включає фармацевтично прийнятні носії, ад'юванти, розріджувачі, ексципієнти та їх комбінації.
16. Спосіб за п. 15, в якому додатковий компонент являє собою ад'ювант.
17. Спосіб за п. 16, в якому ад'ювант являє собою карбомер.
18. Спосіб за будь-яким з пп. 1-17, в якому антиген PCV-2 являє собою білок ОRF-2 PCV-2.
19. Спосіб за будь-яким з пп. 1-18, в якому антиген PCV-2 являє собою вірусоподібні частинки білка ОRF-2.
20. Спосіб за будь-яким з пп. 1-19, де спосіб додатково полягає в тому, що здійснюють стадію, на якій об'єднують антигенну композицію, що містить PCV-2 щонайменше з одним додатковим антигеном.
21. Спосіб за п. 20, в якому щонайменше один додатковий антиген включає антиген вірусу репродуктивного та респіраторного синдрому свиней та/або антиген Mycoplasma hyopneumoniae.
22. Антигенна композиція, яка містить PCV-2 та яка отримана за допомогою способу за будь-яким з пп. 1-21.
23. Антигенна композиція, що містить PCV-2 за п. 22, де антигенна композиція, що містить PCV-2, викликає зменшення менш ніж на 1 log ТСID50/мл живого вірусу або менш ніж на 1 log КУО/мл живої бактерії після змішування живого вірусу або живої бактерії з антигенною композицією, що містить PCV-2 протягом щонайменше 2 год.
24. Антигенна композиція, що містить PCV-2 за п. 23, де антигенна композиція, що містить PCV-2, викликає зменшення менш ніж на 0,7 log ТСID50/мл живого вірусу або менш ніж на 0,7 log КУО/мл живої бактерії після змішування живого вірусу або живої бактерії з антигенною композицією, що містить PCV-2 протягом щонайменше 2 год.
25. Антигенна композиція, що містить PCV-2 за п. 23 або п. 24, в якій живий вірус являє собою вірус репродуктивного та респіраторного синдрому свиней (PRRS).
26. Імуногенна композиція, що включає антигенну композицію, яка містить PCV-2 та яка отримана за допомогою способу за будь-яким з пп. 1-21.
27. Імуногенна композиція, що включає антигенну композицію, що містить PCV-2, за будь-яким з пп. 22-24.
28. Імуногенна композиція за п. 27, де імуногенна композиція додатково містить ослаблений живий вірус або ослаблену живу бактерію з щонайменше одного іншого хвороботворного організму, що викликає захворювання у свиней.
29. Імуногенна композиція за п. 28, в якій ослаблений живий вірус являє собою вірус репродуктивного та респіраторного синдрому свиней (PRRS).
30. Імуногенна композиція за будь-яким з пп. 27-29, де імуногенна композиція додатково містить бактерії Mycoplasma hyopneumoniae.
31. Імуногенна композиція за будь-яким з пп. 27-30, де імуногенна композиція додатково містить ад'ювант.
32. Імуногенна композиція за п. 31, де ад'ювант являє собою карбомер.
33. Імуногенна композиція за пп. 26-32, де імуногенна композиція індукує захисну імунну відповідь проти PCV-2 після введення однієї дози імуногенної композиції.
34. Імуногенна композиція за пп. 26-32, де введення імуногенної композиції знижує лімфоїдне виснаження і запалення щонайменше на 80 % у тварини в порівнянні з твариною, якій не вводили імуногенну композицію.
35. Імуногенна композиція за пп. 29-32, де імуногенна композиція індукує захисну імунну відповідь проти вірусу PRRS після введення однієї дози імуногенної композиції.
36. Імуногенна композиція за пп. 30-32, де імуногенна композиція індукує захисну імунну відповідь проти Mycoplasma hyopneumoniae після введення однієї дози імуногенної композиції.
37. Імуногенна композиція за пп. 26-32, де в 2 мл імуногенної композиції міститься 1 доза антигену PCV-2.
38. Спосіб зменшення одного або кількох клінічних симптомів, що викликається PCV-2 інфекцією у тварини в порівнянні з твариною, якій не вводили імуногенну композицію, що полягає в тому, що здійснюють стадію, на якій вводять тварині імуногенну композицію за будь-яким з пп. 26-32.
39. Імуногенна композиція за будь-яким з пп. 26-32, призначена для зменшення одного або кількох клінічних симптомів, інфекції, що викликається PCV-2, у тварини в порівнянні з твариною, якій не вводили імуногенну композицію.
Текст
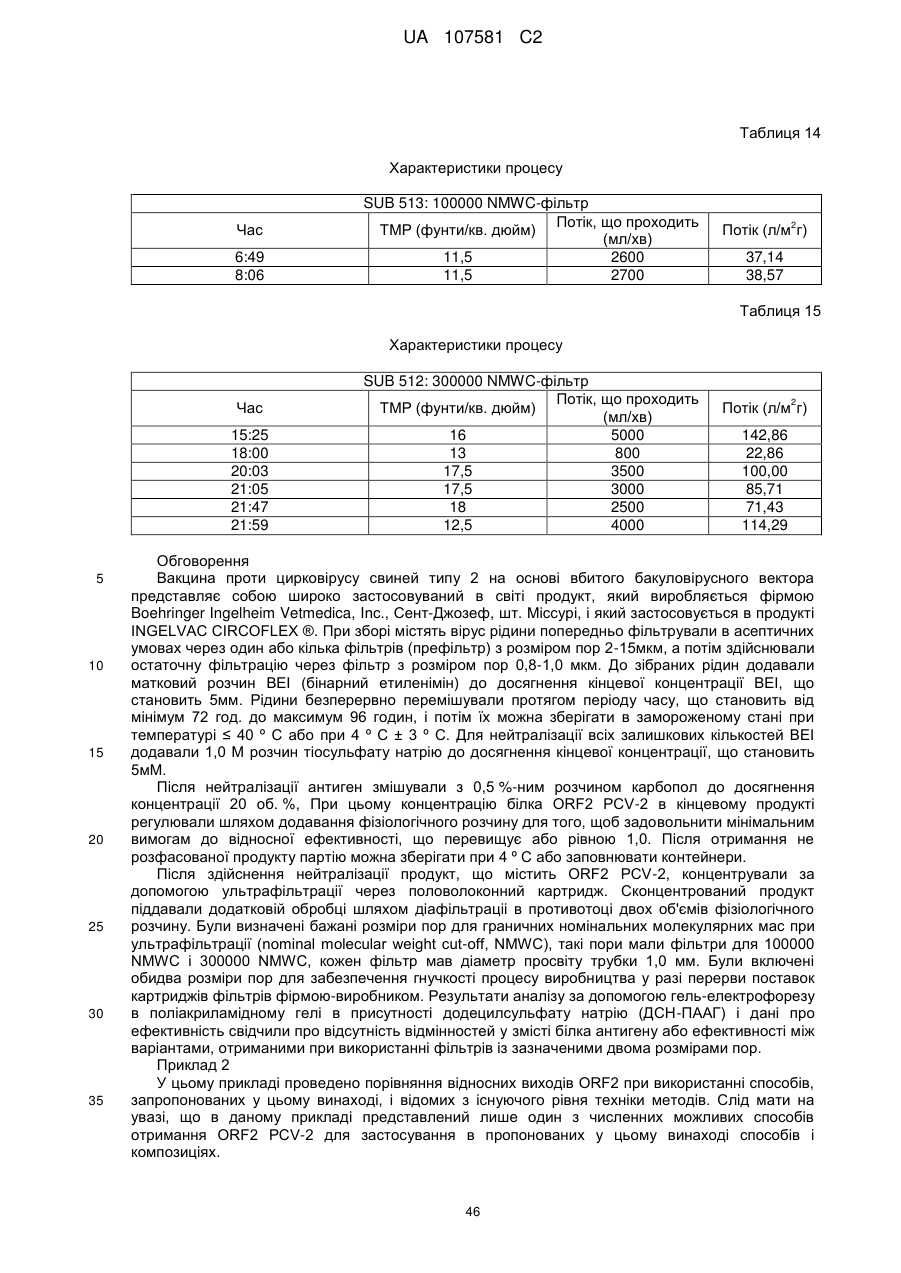
і/або Mycoplasma hyosynoviae (58). Таким чином, наступним об'єктом даного винаходу є спосіб отримання антигенної композиції, що містить PCV-2, що полягає в тому, що здійснюють стадії, на яких I) отримують антиген PCV-2, що міститься в першій рідини; II) відокремлюють щонайменше частину першої рідини від антигену PCV-2; і об'єднують антиген PCV-2 по меншій мірі з одним додатковим антигеном, бажано вірусним або бактеріальним антигеном, і більш бажано вірусним або бактеріальним антигеном з щонайменше одного іншого хвороботворного організму, що викликає захворювання у свиней. Бажано антиген PCV-2 представляє собою білок ORF-2 PCV2, більш бажано рекомбінантний білок ORF-2 PCV-2, і ще більш бажано вірусоподібні частинки білка ORF-2. Бажано частину першої рідини відокремлюють від антигену PCV-2 за допомогою заміни частини першої рідини на другу рідину. Заміна бажано полягає в тому, що здійснюють стадії, на яких: a) додають другу рідину до першої рідини, яка містить антиген PCV-2, і б) концентрують антиген PCV-2, бажано в 3-50 разів, ще більш бажано в 4-20 раз, і ще більш бажано в 7-10 разів, у порівнянні з об'ємом першої рідини за допомогою видалення частини першої та другої рідин від антигену PCV-2. Бажано стадію додавання рідини і стадію концентрування здійснюють кілька разів, бажано два рази, ще більш бажано три рази. В цьому випадку видаляють не тільки першу рідину, але також і суміш першої та другої рідин. Бажано кожну стадію додавання рідини здійснюють практично одночасно або послідовно із здійсненням стадії концентрування. Коли стадію концентрування і стадію додавання рідини виконують послідовно, то порядок здійснення стадій не має значення. Крім того, стадію концентрування бажано здійснюють шляхом фільтрації, бажано шляхом діа-або ультрафільтрації, з використанням фільтра, який бажано містить напівпроникну мембрану. Напівпроникна мембрана бажано має середній розмір пор, який менше розміру антигену PCV-2 і перешкоджає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани і утримує антиген PCV-2 на фільтрі, що потрібно для збору або виділення. Бажано середній розмір пор напівпроникної мембрани чи іншого фільтра, що застосовується відповідно даного винаходу, перешкоджає проходженню щонайменше 90 % білків з молекулярною масою від 50 21 UA 107581 C2 5 10 15 20 25 30 35 40 45 50 55 60 до 500 кДа, більш бажано щонайменше 90 % білків з молекулярною масою від 75 до 400 кДа, і найбільш бажано щонайменше 90 % білків з молекулярною масою від 100 до 300 кДа. Такий розмір пор є бажаним в тому випадку, коли антиген PCV-2 отримують у вигляді цілого вірусу або у вигляді вірусоподібних частинок. Додаткову очистку з метою отримання очищеного антигену PCV-2 можна здійснювати згідно описаної вище процедури. Бажані варіанти способу отримання описаної вище антигенної композиції, що містить PCV-2 додатково включають стадії, на яких I) отримують антиген PCV-2, що міститься в першій рідині, де антиген PCV-2 отримують з використанням вірусного вектора, бажано рекомбінантного бакуловірусного вірусного вектора, що містить і експресуючого антиген PCV-2, бажано ORF-2 PCV-2, і де антиген PCV-2 представляє собою білок ORF-2 PCV-2, більш бажано рекомбінантний білок ORF-2 PCV-2, і ще більш бажано вірусоподібні частинки білка ORF-2; II) відокремлюють щонайменше частину першої рідини від антигену PCV-2; III) інактивують рекомбінантний бакуловірусний вірусний вектор за допомогою агента, інактивуючого ДНК, бажано в присутності бінарного етиленіміну в концентрації від приблизно 1 до приблизно 20мм; IV) додають нейтралізуючий агент, який нейтралізує інактивуючий агент, в кількості, еквівалентній кількості інактивуючого агента, де нейтралізуючий агент бажано представляє собою розчин тіосульфату натрію, бажано сконцентрований до кінцевої концентрації, що становить від приблизно 1 до приблизно 20мм, і де інактивуючий агент бажано представляє собою BEI; і V) змішують антиген PCV-2, отриманий на стадії IV), з додатковим компонентом, вибраним з групи, що включає фармацевтично прийнятні носії, ад'юванти, розріджувачі, ексципієнти і їх комбінації. В іншому варіанті способу щонайменше один додатковий антиген є вірусний антиген, бажано антиген, отриманий з вірусу репродуктивного та респіраторного синдрому свиней. Ще більш бажано антиген, отриманий з вірусу репродуктивного та респіраторного синдрому свиней, представляє собою живий вірус і ще більш бажано модифікований живий вірус, ще більш бажано модифікований живий ослаблений вірус. Ще більш бажано антиген модифікованого живого вірусу репродуктивного та респіраторного синдрому свиней, представляє собою модифікований живий штам вірусу, який має реєстраційний номер ATCC VR 2332, і ще більш бажано представляє собою модифікований живий вірус (MLV) PRRS, застосовуваний у вакцині INGELVAC ®. Таким чином, наступним об'єктом даного винаходу є спосіб отримання антигенної композиції, що містить PCV-2, що полягає в тому, що здійснюють стадії, на яких I) отримують антиген PCV-2, що міститься в першій рідини; II) відокремлюють щонайменше частину першої рідини від антигену PCV-2; і об'єднують антиген PCV-2 з антигеном з вірусу репродуктивного та респіраторного синдрому свиней. Бажано антиген, отриманий з вірусу репродуктивного та респіраторного синдрому свиней, представляє собою живий вірус і ще більш бажано модифікований живий вірус, ще більш бажано модифікований живий ослаблений вірус. Ще більш бажано антиген модифікованого живого вірусу репродуктивного та респіраторного синдрому свиней, представляє собою модифікований живий штам вірусу, який має реєстраційний номер ATCC VR 2332, і ще більш бажано представляє собою MLV PRRS, застосовуваний у вакцині INGELVAC ®. Бажано антиген PCV-2 представляє собою білок ORF-2 PCV-2, більш бажано рекомбінантний білок ORF-2 PCV-2, і ще більш бажано вірусоподібні частинки білка ORF-2. Бажано частину першої рідини відокремлюють від антигену PCV-2 за допомогою заміни частини першої рідини на другу рідину. Заміна бажано полягає в тому, що здійснюють стадії, на яких: a) додають другу рідину до першої рідині, яка містить антиген PCV-2, і б) концентрують антиген PCV-2, бажано в 3-50 разів, ще більш бажано в 4-20 разів, і ще більш бажано в 7-10 разів, у порівнянні з об'ємом першої рідини за допомогою відділення частини першої та другої рідин від антигену PCV-2. Бажано стадію додавання рідини і стадію концентрування здійснюють кілька разів, бажано два рази, ще більш бажано три рази. В цьому випадку видаляють не тільки першу рідину, але також і суміш першої та другої рідин. Бажано кожну стадію додавання рідини здійснюють практично одночасно або послідовно із здійсненням стадії концентрування. Коли стадію концентрування і стадію додавання рідини виконують послідовно, то порядок здійснення стадій не має значення. Крім того, стадію концентрування бажано здійснюють шляхом фільтрації, бажано шляхом діа-або ультрафільтрації, з використанням фільтра, який бажано містить напівпроникну мембрану. Напівпроникна мембрана бажано має середній розмір пор, який менше розміру антигену PCV-2 і перешкоджає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани і утримує антиген PCV-2 на фільтрі, що потрібно для збору або виділення. Бажано середній розмір пор напівпроникної мембрани чи іншого фільтра, що застосовується відповідно даного винаходу, перешкоджає проходженню через фільтр щонайменше 90 % білків з молекулярною масою від 50 до 500 кДа, більш бажано щонайменше 90 % білків з молекулярною масою від 75 22 UA 107581 C2 5 10 15 20 25 30 35 40 45 50 55 60 до 400 кДа, і найбільш бажано щонайменше 90 % білків з молекулярною масою від 100 до 300 кДа. Такий розмір пор є бажаним в тому випадку, коли антиген PCV-2 отримують у вигляді цілого вірусу або у вигляді вірусоподібних частинок. Додаткову очистку з метою отримання очищеного антигену PCV-2 можна здійснювати згідно описаної вище процедури. В іншому об'єкті даного винаходу щонайменше один додатковий антиген представляє собою бактеріальний антиген, переважно з Mycoplasma hyopneumoniae. Бажано антиген з Mycoplasma hyopneumoniae представляє собою бактерин, і більш бажано бактерин Mycoplasma hyopneumoniae представляє собою INGELVAC ® MYCOFLEX. Таким чином, наступним об'єктом даного винаходу є спосіб отримання антигенної композиції, що містить PCV-2, що полягає в тому, що здійснюють стадії, на яких I) отримують антиген PCV-2, що міститься в першій рідини; II) відокремлюють щонайменше частину першої рідини від антигену PCV-2; і об'єднують антиген PCV-2 з бактеріальним антигеном, бажано Mycoplasma hyopneumoniae. Бажано антиген Mycoplasma hyopneumoniae представляє собою бактерин, і більш бажано бактерин Mycoplasma hyopneumoniae представляє собою INGELVAC ® MYCOFLEX. Бажано антиген PCV-2 представляє собою білок ORF-2 PCV-2, більш бажано рекомбінантний білок ORF-2 PCV-2, і ще більш бажано вірусоподібні частинки білка ORF-2. Бажано частину першої рідини відокремлюють від антигену PCV-2 за допомогою заміни частини першої рідини на другу рідину. Заміна бажано полягає в тому, що здійснюють стадії, на яких: a) додають другу рідину до першої рідині, яка містить антиген PCV-2, і б) концентрують антиген PCV-2, бажано в 3-50 разів, ще більш бажано в 4-20 раз, і ще більш бажано в 7-10 разів, у порівнянні з об'ємом першої рідини за допомогою видалення частини першої та другої рідин від антигену PCV-2. Бажано стадію додавання рідини і стадію концентрування здійснюють кілька разів, бажано два рази, ще більш бажано три рази. В цьому випадку видаляють не тільки першу рідину, але також і суміш першої та другої рідин. Бажано кожну стадію додавання рідини здійснюють практично одночасно або послідовно із здійсненням стадії концентрування. Коли стадію концентрування і стадію додавання рідини виконують послідовно, то порядок здійснення стадій не має значення. Крім того, стадію концентрування бажано здійснюють шляхом фільтрації, бажано шляхом діаабо ультрафільтрації, з використанням фільтра, який бажано містить напівпроникну мембрану. Напівпроникна мембрана бажано має середній розмір пор, який менше розміру антигену PCV-2 і перешкоджає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани і утримує антиген PCV-2 на фільтрі, що потрібно для збору або виділення. Бажано середній розмір пор напівпроникної мембрани чи іншого фільтра, що застосовується відповідно даного винаходу, перешкоджає проходженню через фільтр щонайменше 90 % білків з молекулярною масою від 50 до 500 кДа, більш бажано щонайменше 90 % білків з молекулярною масою від 75 до 400 кДа, і найбільш бажано щонайменше 90 % білків з молекулярною масою від 100 до 300 кДа. Такий розмір пор є бажаним в тому випадку, коли антиген PCV-2 отримують у вигляді цілого вірусу або у вигляді вірусоподібних частинок. Додаткову очистку з метою отримання очищеного антигену PCV-2 можна здійснювати згідно описаної вище процедури. В іншому об'єкті даного винаходу щонайменше один додатковий антиген включає вірусний антиген, бажано описаний вище антиген вірусу репродуктивного та респіраторного синдрому свиней, та бактеріальний антиген, бажано описаний вище антиген Mycoplasma hyopneumoniae. Бажано антиген вірусу репродуктивного та респіраторного синдрому свиней представляє собою живий вірус, більш бажано модифікований живий вірус і ще більш бажано модифікований живий штам вірусу, який має реєстраційний номер ATCC VR 2332, і ще більш бажано представляє собою MLV PRRS, застосовуваний у вакцині INGELVAC ®. Бажано антиген Mycoplasma hyopneumoniae представляє собою бактерин, і більш бажано бактерин Mycoplasma hyopneumoniae представляє собою INGELVAC ® MYCOFLEX. Таким чином, наступним об'єктом даного винаходу є спосіб отримання антигенної композиції, що містить PCV-2, що полягає в тому, що здійснюють стадії, на яких I) отримують антиген PCV-2, що міститься в першій рідини; II) відокремлюють щонайменше частину першої рідини від антигену PCV-2; і об'єднують антиген PCV-2 з вірусним антигеном, бажано з описаним вище антигеном вірусу репродуктивного та респіраторного синдрому свиней, і з бактеріальним антигеном, бажано з описаним вище антигеном Mycoplasma hyopneumoniae. Бажано антиген вірусу репродуктивного та респіраторного синдрому свиней представляє собою живий вірус, більш бажано модифікований живий вірус і ще більш бажано модифікований живий штам вірусу, який має реєстраційний номер ATCC VR 2332, і ще більш бажано представляє собою MLV PRRS, застосовуваний у вакцині INGELVAC ®. Бажано антиген Mycoplasma hyopneumoniae представляє собою бактерин і більш бажано бактерин Mycoplasma hyopneumoniae представляє собою INGELVAC® MYCOFLEX. Бажано антиген PCV-2 представляє собою білок ORF-2 PCV-2, більш бажано 23 UA 107581 C2 5 10 15 20 25 30 35 40 45 50 55 60 рекомбінантний білок ORF-2 PCV-2, і ще більш бажано вірусоподібні частинки білка ORF-2. Бажано частину першої рідини відокремлюють від антигену PCV-2 за допомогою заміни частини першої рідини на другу рідину. Заміна бажано полягає в тому, що здійснюють стадії, на яких: a) додають другу рідину до першої рідині, яка містить антиген PCV-2, і б) концентрують антиген PCV-2, бажано в 3-50 разів, ще більш бажано в 4-20 раз, і ще більш бажано в 7-10 разів, у порівнянні з об'ємом першої рідини за допомогою відділення частини першої та другої рідин від антигену PCV-2. Бажано стадію додавання рідини і стадію концентрування здійснюють кілька разів, бажано два рази, ще більш бажано три рази. В цьому випадку видаляють не тільки першу рідину, але також і суміш першої та другої рідин. Бажано кожну стадію додавання рідини здійснюють практично одночасно або послідовно із здійсненням стадії концентрування. Коли стадію концентрування і стадію додавання рідини виконують послідовно, то порядок здійснення стадій не має значення. Крім того, стадію концентрування бажано здійснюють шляхом фільтрації, бажано шляхом діа-або ультрафільтрації, з використанням фільтра, який бажано містить напівпроникну мембрану. Напівпроникна мембрана бажано має середній розмір пор, який менше розміру антигену PCV-2 і перешкоджає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани і утримує антиген PCV-2 на фільтрі, що потрібно для збору або виділення. Бажано середній розмір пор напівпроникної мембрани чи іншого фільтра, що застосовується відповідно даного винаходу, перешкоджає проходженню через фільтр щонайменше 90 % білків з молекулярною масою від 50 до 500 кДа, більш бажано щонайменше 90 % білків з молекулярною масою від 75 до 400 кДа, і найбільш бажано щонайменше 90 % білків з молекулярною масою від 100 до 300 кДа. Такий розмір пор є бажаним в тому випадку, коли антиген PCV-2 отримують у вигляді цілого вірусу або у вигляді вірусоподібних частинок. Додаткову очистку з метою отримання очищеного антигену PCV-2 можна здійснювати згідно описаної вище процедури. У даному винаході запропоновані не тільки способи отримання антигенних композицій, що містять PCV-2 але також і антигенна композиція, яка містить PCV-2. Таким чином, ще одним об'єктом даного винаходу є антигенна композиція яка містить PCV-2, що відрізняється тим, що антигенна композиція яка містить PCV-2 призводить до зниження менш ніж на 1 log TCID50/мл живого вірусу або менше ніж на 1 log КОЕ/мл живої бактерії після змішування живого вірусу або живої бактерії з антигенною композицією що містить PCV-2 і інкубації протягом 2 або більше годин, бажано протягом більш ніж 4 год., ще більш бажано протягом більш ніж 12 год., ще більш бажано протягом більш ніж 24 ч, ще більш бажано протягом більш ніж 2 днів, ще більш бажано протягом більш ніж 4 днів, ще більш бажано протягом більше ніж 7 днів, ще більш бажано протягом більш ніж 2 тижнів, ще більш бажано протягом більш ніж 4 тижнів, ще більш бажано протягом більш ніж 2 місяців, ще більш бажано протягом більш ніж 3 місяців, ще більш бажано протягом більш ніж 4 місяців, ще більш бажано протягом більш ніж 6 місяців, ще більш бажано протягом більш ніж 9 місяців, ще більш бажано протягом більш ніж 12 місяців, ще більш бажано протягом більш ніж 18 місяців, найбільш бажано протягом більш ніж 2 років. Більш бажано антигенна композиція яка містить PCV-2, отримана за допомогою представленого в цьому описі способу, призводить до зниження менш ніж на 0,9 log TCID50/мл живого вірусу або менш ніж на 0,9 log КОЕ / мл живої бактерії після змішування живого вірусу або живої бактерії з композицією на основі антигену PCV-2 і інкубації протягом 2 або більше годин, бажано протягом більш ніж 4 год., ще більш бажано протягом більш ніж 12 год., ще більш бажано протягом більш ніж 24 год., ще більш бажано протягом більш ніж 2 днів, ще більш бажано протягом більш ніж 4 днів, ще більш бажано протягом більше ніж 7 днів, ще більш бажано протягом більш ніж 2 тижнів, ще більш бажано протягом більш ніж 4 тижнів, ще більш бажано протягом більш ніж 2 місяців, ще більш бажано протягом більш ніж 3 місяців, ще більш бажано протягом більш ніж 4 місяців, ще більш бажано протягом більш ніж 6 місяців, ще більш бажано протягом більш ніж 9 місяців, ще більш бажано протягом більш ніж 12 місяців, ще більш бажано протягом більш ніж 18 місяців, найбільш бажано протягом більш ніж 2 років. Ще більш бажано антигенна композиція яка містить PCV-2, отримана за допомогою представленого в цьому описі способу, призводить до зниження менш ніж на 0,7 log TCID50/мл живого вірусу або менш ніж на 0,7 log КОЕ / мл живої бактерії після змішування живого вірусу або живої бактерії з такою, що містить антиген PCV-2 композицією, і інкубації протягом 2 або більше годин, бажано протягом більш ніж 4 год., ще більш бажано протягом більше ніж 12 год., ще більш бажано протягом більш ніж 24 год., ще більш бажано протягом більш ніж 2 днів, ще більш бажано протягом більш ніж 4 днів, ще більш бажано протягом більше ніж 7 днів, ще більш бажано протягом більш ніж 2 тижнів, ще більш бажано протягом більш ніж 4 тижнів, ще більш бажано протягом більш ніж 2 місяців, ще більш бажано протягом більш ніж 3 місяців, ще більш бажано протягом більш ніж 4 місяців, ще більш бажано протягом більш ніж 6 місяців, ще більш бажано протягом більш ніж 9 місяців, ще більш 24 UA 107581 C2 5 10 15 20 25 30 35 40 45 50 55 60 бажано протягом більш ніж 12 місяців, ще більш бажано протягом більш ніж 18 місяців, найбільш бажано протягом більш ніж 2 років. Ще більш бажано антигенна композиція яка містить PCV-2, отримана за допомогою представленого в цьому описі способу, призводить до зниження менш ніж на 0,5 log TCID50/мл живого вірусу або менш ніж на 0,5 log КОЕ / мл живої бактерії після змішування живого вірусу або живої бактерії з композицією на основі антигену PCV-2 і інкубації протягом 2 або більше годин, бажано протягом більш ніж 4 год., ще більш бажано протягом більш ніж 12 год., ще більш бажано протягом більш ніж 24 год., ще більш бажано протягом більш ніж 2 днів, ще більш бажано протягом більш ніж 4 днів, ще більш бажано протягом більше ніж 7 днів, ще більш бажано протягом більш ніж 2 тижнів, ще більш бажано протягом більш ніж 4 тижнів, ще більш бажано протягом більш ніж 2 місяців, ще більш бажано протягом більш ніж 3 місяців, ще більш бажано протягом більш ніж 4 місяців, ще більш бажано протягом більш ніж 6 місяців, ще більш бажано протягом більш ніж 9 місяців, ще більш бажано протягом більш ніж 12 місяців, ще більш бажано протягом більш ніж 18 місяців, найбільш бажано протягом більш ніж 2 років. Ще більш бажано антигенна композиція на основі PCV-2, отримана за допомогою представленого в цьому описі способу, призводить до зниження менш ніж на 0,3 log TCID50/мл живого вірусу або менш ніж на 0,3 log КОЕ / мл живої бактерії після змішування живого вірусу або живої бактерії з композицією на основі антигену PCV-2 і інкубації протягом 2 або більше годин, бажано протягом більш ніж 4 год., ще більш бажано протягом більш ніж 12 год., ще більш бажано протягом більш ніж 24 год., ще більш бажано протягом більш ніж 2 днів, ще більш бажано протягом більш ніж 4 днів, ще більш бажано протягом більше ніж 7 днів, ще більш бажано протягом більш ніж 2 тижнів, ще більш бажано протягом більш ніж 4 тижнів, ще більш бажано протягом більш ніж 2 місяців, ще більш бажано протягом більш ніж 3 місяців, ще більш бажано протягом більш ніж 4 місяців, ще більш бажано протягом більш ніж 6 місяців, ще більш бажано протягом більш ніж 9 місяців, ще більш бажано протягом більш ніж 12 місяців, ще більш бажано протягом більш ніж 18 місяців, найбільш бажано протягом більш ніж 2 років. Живий вірус може являти собою будь-який живий вірус, але бажано живий вірус представляє собою вірус PRRS, бажано вірус PRRS, що має реєстраційний номер ATCC VR 2332. Жива бактерія може являти собою будь-яку бактерію, але бажано вона представляє собою бактерію Mycoplasma hyopneumonia, бажано J-штам Mycoplasma hyopneumonia. Величину TCID50/мл можна визначати за допомогою стандартного титраційного аналізу in vitro, який дозволяє визначати кількість живого вірусу. Величину КОЕ / мл можна визначати за допомогою стандартного титраційного аналізу in vitro, який дозволяє визначати кількість живої бактерії. Поняття "на мл" бажано належить до 1 мл рідини. Згідно наступного об'єкта винаходу описана вище антигенна композиція яка містить PCV-2 містить додатковий компонент, вибраний з групи, що включає фармацевтично прийнятні носії, ад'юванти, розріджувачі, ексципієнти та їх комбінації. Бажано додатковий компонент представляє собою ад'ювант, ще більш бажано ад'ювант представляє собою полімер акрилової або метакрилової кислоти, і ще більш бажано ад'ювант представляє собою карбомер. Бажано ад'ювант додають в кількості, що становить від приблизно 100 мкг до приблизно 10 мг на дозу. Ще більш бажано ад'ювант додають в кількості, що становить від приблизно 100 мкг до приблизно 10 мг на дозу. І ще більш бажано ад'ювант додають в кількості, що становить від приблизно 500 мкг до приблизно 5 мг на дозу. Ще більш бажано ад'ювант додають в кількості, що становить від приблизно 750 мкг до приблизно 2,5 мг на дозу. Найбільш бажано ад'ювант додають в кількості, що становить приблизно 1 мг на дозу. У даному винаході запропоновані не тільки способи отримання антигенних композицій що містять PCV-2 та / або описані вище містять PCV-2 антигенні композиції, але винахід належить також до антигенної композиції, що містить PCV-2 яку можна отримувати за допомогою будьякого з представлених в цьому описі способів. Таким чином, наступним об'єктом даного винаходу є антигенна композиція, яка містить PCV-2 яка отримана за допомогою способу, що полягає в тому, що здійснюють стадії, на яких: I) одержують першу рідину, що містить антиген PCV-2, II) видаляють щонайменше частину першої рідини від антигену PCV-2. Бажано антиген PCV-2 застосовують в якості або в складі антигенної композиції, що містить PCV-2 Поняття "антигенна композиція, що містить PCV-2, отримана за допомогою представлених в цьому описі способів" належить також і до антигенної композиції, що містить PCV-2 яку можна отримувати за допомогою представленого в цьому описі способу. Таким чином, наступний об'єкт даного винаходу належить до антигенної композиції, що містить PCV-2 яку отримують шляхом відділення частини першої рідини від антигену PCV-2 за допомогою заміни частини першої рідини на другу рідину, де друга рідину відмінна від першої рідини. Таким чином, наступний об'єкт даного винаходу належить до антигенної композиції, що містить PCV-2 яку отримують за допомогою способу, що полягає в тому, що здійснюють стадії, на яких: I) одержують першу 25 UA 107581 C2 5 10 15 20 25 30 35 40 45 50 55 60 рідину, що містить антиген PCV-2, II) відокремлюють щонайменше частину першої рідини від антигену PCV-2, при цьому частину першої рідини відокремлюють від антигену PCV-2 за допомогою заміни частини першої рідини на другу рідину, де друга рідину відмінна від першої рідини. Бажано заміна частини першої рідини на другу рідину полягає в здійсненні стадій, на яких: a) додають другу рідину до першої рідині, яка містить антиген PCV-2, і б) концентрують антиген PCV-2 шляхом відділення частини першої та другої рідин від антигену PCV-2. Згідно наступного об'єкта винаходу антигенну композицію що містить PCV-2 бажано одержують за допомогою способу, в якому частину першої рідини відокремлюють від антигену PCV-2 шляхом здійснення стадії фільтрації з використанням фільтра. Однак, для відділення частини першої та другої рідини від антигену PCV-2 можна застосовувати також будь-які інші методи, відомі фахівцю в даній галузі, наприклад, центрифугування та / або хроматографію. Однак найбільш кращою є фільтрація. Бажаними методами фільтрації для видалення частини першої рідини є ультра-та / або діафільтрація. Стадію концентрування і стадію додавання рідини в представленому в цьому описі способі можна здійснювати практично одночасно або в альтернативному варіанті стадію концентрування і стадію додавання рідини можна здійснювати послідовно. Таким чином, наступний об'єкт даного винаходу належить до антигенної композиції, що містить PCV-2 яку отримують за допомогою способу, що полягає в тому, що здійснюють стадії, на яких: I) одержують першу рідину, що містить антиген PCV-2, II) відокремлюють щонайменше частину першої рідини від антигену PCV-2, при цьому частину першої рідини відокремлюють від антигену PCV-2 за допомогою заміни частини першої рідини на другу рідину, де друга рідину відмінна від першої рідини. Бажано заміна частини першої рідини на другу рідину полягає в здійсненні стадій, на яких: a) додають другу рідину до першої рідині, яка містить антиген PCV-2, і б) концентрують антиген PCV-2 шляхом відділення частини першої та другої рідин від антигену PCV-2, при цьому стадію додавання рідини здійснюють практично одночасно або послідовно. Коли стадію концентрування і стадію додавання рідини здійснюють послідовно, то порядок здійснення стадій не має значення. Наприклад, згідно наступного об'єкта винаходу стадію додавання рідини здійснюють перед стадією концентрування, а згідно альтернативному об'єкту винаходу стадію концентрування здійснюють перед стадією додавання рідини. Наступний об'єкт даного винаходу належить до антигенної композиції, що містить PCV-2 яку можна отримувати за допомогою представленого в цьому описі способу, в якому стадію додавання рідини і стадію концентрування можна здійснювати кілька разів незалежно від порядку їх здійснення. Наприклад, кожну з зазначених стадій можна здійснювати щонайменше два, щонайменше три, щонайменше чотири, щонайменше п'ять, щонайменше 10 разів і аж до будь-якої необхідної кількості разів. Відповідно до одного з об'єктів винаходу стадію концентрування і стадію додавання рідини кожну здійснюють щонайменше два рази. Згідно іншому об'єкту винаходу стадію концентрування і стадію додавання рідини кожну здійснюють щонайменше три рази. Згідно наступного об'єкта даного винаходу антигенну композицію що містить PCV-2 отримують за допомогою описаного вище способу, в якому фільтрація є кращим методом відділення частини першої рідини або, як це має місце в описаному вище випадку декількох стадій відділення частини суміші першої та другої рідин від антигену PCV-2. В якості фільтра можна використовувати будь-який зазвичай застосовуваний в даній галузі фільтр. Бажано фільтр включає напівпроникну мембрану. У ще одному бажаному варіанті напівпроникна мембрана має середній розмір пор, який менше розміру антигену PCV-2 і перешкоджає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани і утримує антиген PCV-2 на фільтрі. Згідно наступного об'єкта винаходу фільтр має середній розмір пор, який перешкоджає проходженню щонайменше 90 % білків з молекулярною масою від 50 до 500 кДа, більш бажано фільтр має середній розмір пор, який перешкоджає проходженню щонайменше 90 % білків з молекулярною масою від 75 до 400 кДа, і найбільш бажано фільтр має середній розмір пор, який перешкоджає проходженню щонайменше 90 % білків з молекулярною масою від 100 до 300 кДа. Такий розмір пор є бажаним в тому випадку, коли антиген PCV-2 отримують у вигляді цілого вірусу або у вигляді вірусоподібних частинок. Згідно ще одному об'єкту винаходу напівпроникна мембрана складається з матеріалу, вибраного з групи, що включає полісульфон, поліефірсульфон і регенеровану целюлозу. Однак можна використовувати будь-який інший матеріал, який дозволяє відокремлювати частину першої рідини і в разі стадії багаторазового повторення процесу відокремлювати частину суміші першої та другої рідин від антигену PCV-2. Згідно ще одному об'єкту винаходу фільтр вибирають з групи, що включає картридж для ультрафільтрації з половолоконною мембраною, фільтр з мембраною у вигляді плоского листа або касетний фільтр, при цьому найбільш кращим 26 UA 107581 C2 5 10 15 20 25 30 35 40 45 50 55 60 є картридж для ультрафільтрації з половолоконною мембраною. Таким чином, ще один об'єкт даного винаходу належить до антигенної композиції, що містить PCV-2 яку отримують за допомогою представлених в цьому описі способів, в яких фільтр бажано представляє собою або містить напівпроникну мембрану. Бажано напівпроникна мембрана має середній розмір пор, який менше ніж розмір антигену PCV-2 і перешкоджає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани. Бажано середній розмір пор напівпроникної мембрани перешкоджає проходженню щонайменше 90 % білків з молекулярною масою від 50 до 500 кДа, більш бажано щонайменше 90 % білків з молекулярною масою від 75 до 400 кДа, і найбільш бажано щонайменше 90 % білків з молекулярною масою від 100 до 300 кДа. Такий розмір пор є бажаним в тому випадку, коли антиген PCV-2 отримують у вигляді цілого вірусу або у вигляді вірусоподібних частинок. Як зазначено вище, стадія видалення, як правило, передбачає заміну частини першої рідини на частину другої рідини шляхом здійснення стадій, на яких а) додають другу рідину до першої рідини, що містить антиген PCV-2, і б) концентрують антиген PCV-2 шляхом відділення частини першої та другої рідин від антигену PCV-2, при цьому стадію додавання рідини і стадію концентрування здійснюють кілька разів, наприклад, два рази, три рази, 5 разів, 10 разів і т.д. Бажано стадію додавання рідини і стадію концентрування здійснюють два рази, найбільш бажано три рази. Стадію концентрування в запропонованому в цьому винаході способі отримання антигенної композиції, що містить PCV-2 здійснюють такою чином, щоб сконцентрувати антиген PCV-2 в 350 разів в порівнянні з обсягом першої рідини. Більш бажано стадію концентрування здійснюють такою чином, щоб сконцентрувати антиген PCV-2 в 4-20 разів в порівнянні з обсягом першої рідини. Найбільш бажано стадію концентрування здійснюють такою чином, щоб сконцентрувати антиген PCV-2 в 7-10 разів в порівнянні з обсягом першої рідини. Таким чином, наступним об'єктом даного винаходу є антигенна композиція, що містить PCV-2, отримана за допомогою описаного вище способу, згідно з яким антиген PCV-2 концентрують у 3-50 разів, бажано в 4-20 разів, і ще більш бажано в 7-10 разів у порівнянні з об'ємом першої рідини. Бажано частину першої рідини відокремлюють від антигену PCV-2 шляхом заміни частини першої рідини на другу рідину, здійснюючи стадії, на яких а) додають другу рідину до першої рідини, що містить антиген PCV-2, і б) концентрують антиген PCV-2 в 3-50 разів, бажано в 4-20 разів, і ще більш бажано в 7-10 разів, у порівнянні з об'ємом першої рідини за допомогою відділення частини першої та другої рідин від антигену PCV-2. Бажано стадію додавання рідини здійснюють практично одночасно або послідовно із здійсненням стадії концентрування. Коли стадію концентрування і стадію додавання рідини здійснюють послідовно, то порядок здійснення стадій не має значення. Крім того, стадію концентрування бажано здійснюють шляхом фільтрації, бажано шляхом діа-або ультрафільтрації, з використанням фільтра, який бажано містить напівпроникну мембрану. Напівпроникна мембрана бажано має середній розмір пор, який менше розміру антигену PCV-2 і перешкоджає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани. Бажано середній розмір пор напівпроникної мембрани перешкоджає проходженню через фільтр щонайменше 90 % білків з молекулярною масою від 50 до 500 кДа, більш бажано щонайменше 90 % білків з молекулярною масою від 75 до 400 кДа, і найбільш бажано щонайменше 90 % білків з молекулярною масою від 100 до 300 кДа. Такий розмір пор є бажаним в тому випадку, коли антиген PCV-2 отримують у вигляді цілого вірусу або у вигляді вірусоподібних частинок. Бажано додаткове очищення для отримання антигенної композиції, що містить PCV-2 яка містить поданий у цьому описі очищений антиген PCV-2, можна проводити шляхом здійснення додаткової стадії очистки III), на якій очищають за допомогою хроматографії (із застосуванням будь-якої з представлених в цьому описі методів) продукт, який містить антиген PCV-2, зібраний на стадії II), який отримують після відокремлення частини першої рідини. Для досягнення більш високого ступеня чистоти можна здійснювати другу стадію хроматографії, яка, проте, повинна бути відмінною від першої. Наприклад, якщо перша стадія очищення / стадія хроматографії представляє собою витискувальну хроматографію (гель-фільтрацію), то друга стадія повинна бути відмінною від неї, наприклад, вона може являти собою афінну хроматографію, іонообмінну хроматографію і т.д. Бажано, якщо перша стадія очищення антигену PCV-2, бажано очищення антигену ORF2 PCV-2, представляє собою витискувальну хроматографію (гель-фільтрацію), то друга стадія може являти собою іонообмінну хроматографію, бажано аніонообмінну хроматографію (АОХ). Бажаною матрицею для аніонообмінною хроматографії для цілей очищення антигену PCV-2, бажано ORF2 PCV-2, є Q Sepharose. Для маломасштабного виробництва, при роботі з обсягами, що становлять приблизно 50 мл, найбільш кращими є колонки, упаковані 5 мл HiTrap Q Sepharose HP. Аніонообмінну хроматографію можна 27 UA 107581 C2 5 10 15 20 25 30 35 40 45 50 55 60 здійснювати, наприклад, згідно методу, описаного в прикладі 3. В цілому метод полягає в наступному. Приблизно 50 мл пулу фракцій порожнього обсягу, отриманих після стадії гельфільтрації, можна завантажувати на АОХ-колонку при швидкості потоку 3,0 мл / хв. Після стадії відмивання з використанням, наприклад, 20мм Тріс, pH 6,5, 5мМ ДТТ, для видалення незв'язаного продукту можна здійснювати елюцію білка за допомогою однієї стадії з використанням взятого в кількості, що дорівнює 8 обсягами колонки, наступного буфера (20мм Тріс, pH 6, 5, 5мМ ДТТ, 1,0 М NaCl). Продукт, отриманий після АОХ, можна завантажувати знову на колонку з Q Sepharose і здійснювати елюцію згідно описаного вище методу для збільшення виходу. Така двостадійна процедура (гель-фільтрація з наступною аніонообмінною хроматографією) дозволяє ефективно відокремлювати антиген ORF2 PCV-2 від більшої частини інших білкових компонентів, які присутні в продукті, зібраному після культивування. Згідно ще одному об'єкту винаходу віруліцидну активність антигенної композиції, що містить PCV-2 отриманої за допомогою представлених в цьому описі способів, знижують щонайменше на 10 % в порівнянні з віруліцидною активністю рідини, яку не піддавали обробці зазначеним способом. Більш бажано віруліцидну активність антигенної композиції, що містить PCV-2, знижують щонайменше на 50 % в порівнянні з віруліцидною активністю першої рідини, яку не піддавали обробці зазначеним способом. Ще більш бажано віруліцидну активність антигенної композиції, що містить PCV-2, знижують щонайменше на 70 % в порівнянні з віруліцидною активністю першої рідини, яку не піддавали обробці зазначеним способом. Таким чином, ще один об'єкт даного винаходу належить до антигенної композиції, що містить PCV-2 отриманої за допомогою способу, який полягає в тому, що здійснюють стадії, на яких I) одержують першу рідину, що містить антиген PCV-2, II) відокремлюють по меншій мірі частину першої рідини від антигену PCV-2, при цьому віруліцидну активність, бажано відносно вірусу PRRS, яка містить PCV-2 антигенної композиції, отриманої після здійснення стадії II), знижують щонайменше на 10 %, бажано щонайменше на 50 %, більш бажано щонайменше на 70 %, ще більш бажано щонайменше на 90 % в порівнянні з віруліцидною активністю першої рідини. Бажано частину першої рідини, що має віруліцидною активністю, відокремлюють від антигену PCV-2 шляхом заміни частини першої рідини на другу рідину. Бажано заміна частини першої рідини на другу рідину полягає в тому, що здійснюють стадії, на яких: a) додають другу рідину до першої рідини, яка містить антиген PCV-2, і б) концентрують антиген PCV-2 бажано в 3-50 разів, ще більш бажано в 4-50 разів, і ще більш бажано в 7-10 разів в порівнянні з обсягом першої рідини шляхом відділення частини першої та другої рідини від антигену PCV-2. Бажано стадію додавання рідини здійснюють практично одночасно або послідовно із здійсненням описаної вище стадії концентрування. Коли стадію концентрування і стадію додавання рідини здійснюють послідовно, то порядок здійснення стадій не має значення. Крім того, стадію концентрування бажано здійснюють шляхом фільтрації, бажано шляхом діа-або ультрафільтрації, з використанням фільтра, який бажано містить напівпроникну мембрану. Напівпроникна мембрана бажано має середній розмір пор, який менше розміру антигену PCV-2 і перешкоджає проходженню щонайменше 90 % антигену PCV-2 через пори напівпроникної мембрани. Бажано середній розмір пор напівпроникної мембрани перешкоджає проходженню через фільтр щонайменше 90 % білків з молекулярною масою від 50 до 500 кДа, більш бажано щонайменше 90 % білків з молекулярною масою від 75 до 400 кДа, і найбільш бажано щонайменше 90 % білків з молекулярною масою від 100 до 300 кДа. Такий розмір пор є бажаним в тому випадку, коли антиген PCV-2 отримують у вигляді цілого вірусу або у вигляді вірусоподібних частинок. Додаткову очистку для отримання очищеного антигену PCV-2 можна здійснювати згідно описаної вище процедури. Наступний об'єкт даного винаходу належить до антигенної композиції, що містить PCV-2 отриманої за допомогою представленого в цьому описі способу, де антигенна композиція, що містить PCV-2 призводить до зниження менш ніж на 1 log TCID50 (бажано на 1 мл), бажано менше ніж на 0,9 log TCID50 (бажано на 1 мл), ще більш бажано менше ніж на 0,7 log TCID50(бажано на 1 мл), ще більш бажано менше ніж на 0,5 log TCID 50 (бажано на 1 мл), найбільше бажано менше ніж на 0,3 log TCID50 (бажано на 1 мл) живого вірусу, бажано живого PRRSV, або менш ніж на 1 log КОЕ (бажано на 1 мл), бажано менш ніж на 0,9 log КОЕ (бажано на 1 мл), ще більш бажано менш ніж на 0,7 log КОЕ (бажано на 1 мл), ще більше бажано менш ніж на 0,5 log КОЕ (бажано на 1 мл), найбільш бажано менш ніж на 0,3 log КОЕ (бажано на 1 мл) живої бактерії, бажано Mycoplasma hyopneumoniae, після змішування живого вірусу, бажано PRRSV, або живої бактерії, бажано Mycoplasma hyopneumoniae з такою, що містить PCV-2 антигенної композицією, і інкубації протягом 2 або більше годин, бажано протягом більш ніж 4 год., ще більш бажано протягом більш ніж 12 год., ще більш бажано протягом більш ніж 24 год., ще більш бажано протягом більш ніж 2 днів, ще більш бажано протягом більш ніж 4 днів, ще 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods of reducing verucidal activity in pcv-2 compositions and pcv-2 compositions with an improved immunogenicity
Автори англійськоюKohler, Caroline Ann, Zhao, Guosong, Khazraeinazmpour, Ali, Eichenmueller, Bernd Colin, Eichmeyer, Mark, Heiwick, Gregory, Schaeffer, Merrill
Автори російськоюКохлер Керолайн Энн, Чжао Госун, Хазраиназмпур Али, Айхенмюллер Бернд Колин, Эйчмейер Марк, Хейвик Грегори, Шеффер Меррилл
МПК / Мітки
МПК: A61K 39/12, A61P 31/20
Мітки: композицій, способи, містять, підвищеною, pcv-2, імуногенністю, зниження, композиції, рсv-2, активності, віруліцидної
Код посилання
<a href="https://ua.patents.su/65-107581-sposobi-znizhennya-virulicidno-aktivnosti-kompozicijj-shho-mistyat-pcv-2-i-kompozici-shho-mistyat-rsv-2-z-pidvishhenoyu-imunogennistyu.html" target="_blank" rel="follow" title="База патентів України">Способи зниження віруліцидної активності композицій, що містять pcv-2, і композиції, що містять рсv-2 з підвищеною імуногенністю</a>
Попередній патент: Спосіб і пристрій для перетворення теплової енергії з біомаси в механічну роботу
Наступний патент: Таблетований препарат (4′-трифторметилфеніл)аміду (z)-2-ціано-гідроксибут-2-еноєвої кислоти з поліпшеною стійкістю
Випадковий патент: Пристрій для визначення вибіркового коефіцієнта взаємної кореляції між струмом і напругою електричної дуги