Композиція для попередження інфекції mycoplasma spp.
Номер патенту: 115348
Опубліковано: 25.10.2017
Автори: Лю Сюе-Тао, Ван Чжи-Пен, Чень Цзен-Вен, Лінь Цзюнь-Хун, Се Мін-Вей, Фан Чіень-Юй, Ян Пін-Чен
Формула / Реферат
1. Композиція для попередження інфекції Mycoplasma spp., що містить:
активний інгредієнт, що містить білок Mhp145, та
фармацевтично прийнятний ад’ювант;
де зазначений Mph145 містить SEQ ID NO: 11.
2. Композиція за п. 1, де зазначений активний інгредієнт містить XylF та Mhp145, де зазначений XylF містить SEQ ID NO: 09.
3. Композиція за п. 1, де зазначений активний інгредієнт присутній у концентрації 50-3500 мкг/мл на основі загального об’єму зазначеної композиції.
4. Композиція за п. 1, де зазначений фармацевтично прийнятний ад’ювант являє собою повний ад’ювант Фрейнда, неповний ад’ювант Фрейнда, алюмогель, поверхнево-активну речовину, поліаніонний ад’ювант, пептид, масляну емульсію або їх комбінацію.
5. Композиція за п. 1, що додатково містить фармацевтично прийнятну добавку.
6. Композиція за п. 5, де зазначена фармацевтично прийнятна добавка являє собою розчинник, стабілізатор, розріджувач, консервант, антибактеріальний засіб, протигрибковий засіб, ізотонічний засіб, засіб, що затримує абсорбцію, або їх комбінацію.
7. Вектор експресії для попередження інфекції Mycoplasma spp., що містить плазміду, де зазначена плазміда містить:
нуклеотидну послідовність, що містить SEQ ID NO: 04,
ген, що кодує партнера для злиття, де зазначений партнер для злиття являє собою MsyB E. coli, та регуляторний елемент.
8. Вектор експресії за п. 7, де зазначений регуляторний елемент містить промотор та сайт зв’язування рибосом.
9. Вектор експресії за п. 7, де зазначена плазміда являє собою pET-MSY.
10. Вектор експресії за п. 7, який застосовують для системи експресії генів E. coli.
Текст
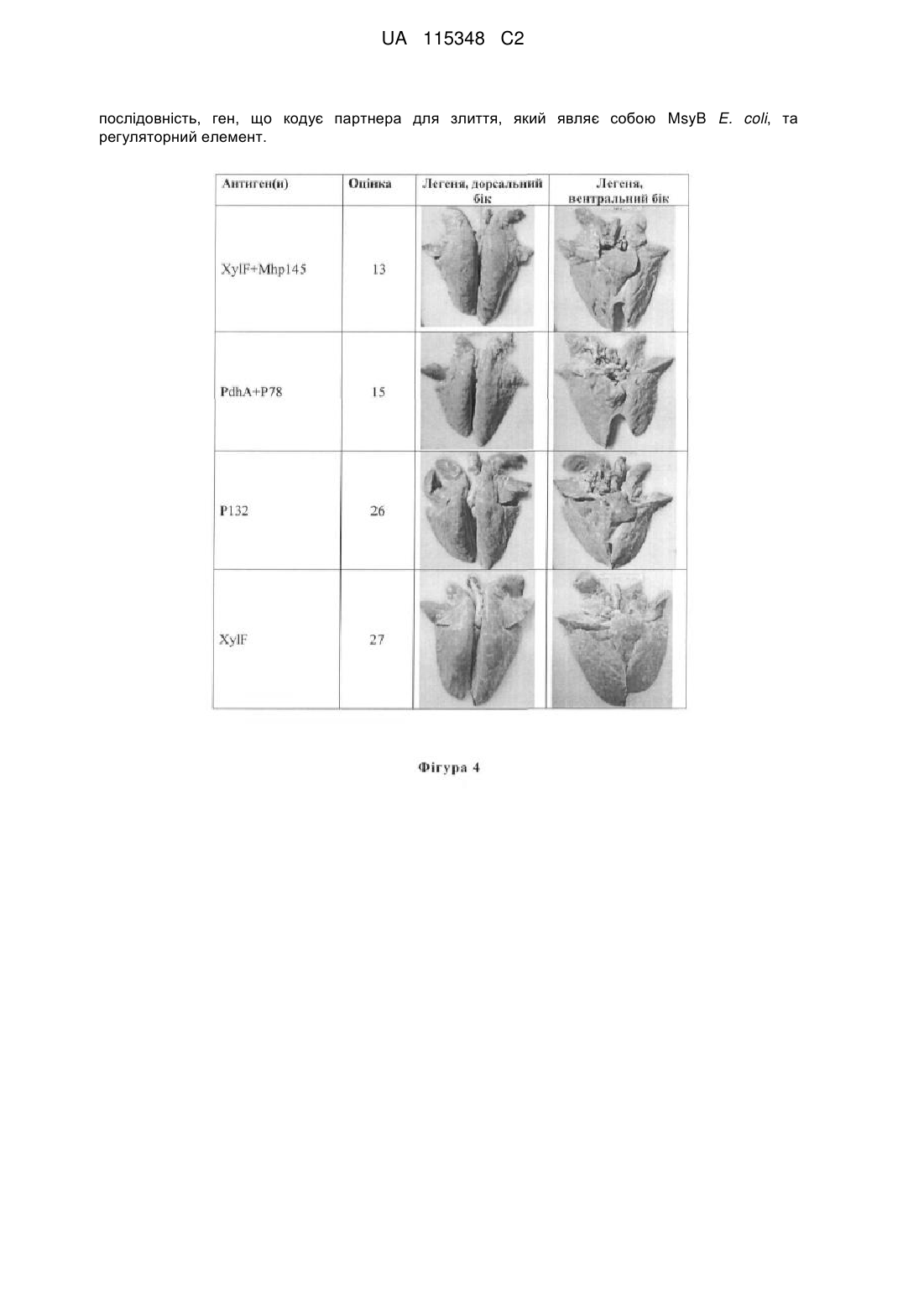
Реферат: Винахід стосується композицій для попередження інфекції Mycoplasma spp., що містить білок Mhp145 та фармацевтично прийнятий ад’ювант. Винахід також належить до вектора експресії для попередження інфекції Mycoplasma spp., що містить плазміду, яка містить нуклеотидну UA 115348 C2 (12) UA 115348 C2 послідовність, ген, що кодує партнера для злиття, який являє собою MsyB E. coli, та регуляторний елемент. UA 115348 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ВИНАХОДУ Дане розкриття відноситься до вакцини проти Mycoplasma spp., зокрема до субодиничної вакцини проти Mycoplasma spp. ПЕРЕДУМОВИ ВИНАХОДУ На даний час Mycoplasma spp. є найменшою відомою бактерією, здатної до аутореплікації за межами клітин-хазяїв. Хоча ензоотична пневмонія свиней не буде викликати загибель свиней, вона буде знижувати ефективність годування та викликає сповільнення росту, запалення та імуносупресію, а також робить свиней уразливішими до інфекції іншими патогенами, що, таким чином, викликає економічні збитки у галузі. На даний момент ензоотичну пневмонію свиней попереджують за допомогою трьох основних стратегій, що включають введення медикаментів, поліпшення умов навколишнього середовища та вакцинацію. У зв’язку з поганою ефективністю антибіотиків до Mycoplasma hyopneumoniae для попередження, введення медикаментів може використовуватись лише з метою лікування, та ним важко вдовольнити потреби для попередження. Більш того, беручи до уваги, що зловживання лікарськими засобами може приводити до більшої інфекції, що викликана стійкими до лікарських засобів бактерій, введення медикаментів потребує завбачливих планів, та на нього існує багато обмежень. Поліпшення умов навколишнього середовища створює основу для попередження інфекції Mycoplasma spp. Гарні санітарна обробка та управління у свинарниках будуть корисними у зниженні частоти виникнення інфекції. З іншого боку, більш повним може бути попередження шляхом вакцинації. У традиційних вакцинах у даній галузі застосовуються неактивні/мертві бактерії в якості активного інгредієнта даних вакцин. Проте, ціна традиційних вакцин є зависокою, оскільки Mycoplasma spp. є вибагливою бактерією, та її важко культивувати у лабораторії. Для зниження витрат на вакцини проти Mycoplasma spp. учені постійно намагаються розробити вакцини різних типів, такі як: (1) атенуйовані вакцини, (2) векторні вакцини, (3) субодиничні вакцини та (4) ДНКвакцини. З-поміж них субодиничні вакцини показують найбільший потенціал внаслідок переваж простоти одержання та високої безпеки. На сьогоднішній день існує декілька можливих білків-кандидатів, які можна використовувати у вакцинах проти M. hyopneumoniae; проте, немає додаткових повідомлень, що підтверджують білки, придатні для вакцин проти M. hyopneumoniae. КОРОТКИЙ ОПИС ВИНАХОДУ У світлі вищенаведеного однією з цілей даного винаходу є забезпечення антигенів, придатних для застосування у вакцинах проти M. hyopneumoniae та, таким чином, одержання нових вакцин проти M. hyopneumoniae таким чином, щоб витрати на попередження можна було зменшити. Іншою метою даного винаходу є забезпечення комбінації антигенів, яка придатна для застосування у вакцинах проти M. hyopneumoniae та, таким чином, забезпечення субодиничних вакцин із кращими характеристиками; отже, буде більше варіантів для задач попередження. Для досягнення вищезазначених цілей даний винахід передбачає рекомбінантний білок для одержання вакцини для попередження інфекції Mycoplasma spp., що містить амінокислотну послідовність SEQ ID NO: 08, SEQ ID NO: 09, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 або їх комбінацію. Даний винахід також передбачає вакцину для попередження інфекції Mycoplasma spp., що містить активний інгредієнт, який містить білок PdhA, XylF, EutD, Mhp145, P78, P132, Mhp389 або їх комбінацію, та фармацевтично прийнятний ад’ювант. Переважно, зазначений активний інгредієнт присутній у концентрації 50-3500 мкг/мл на основі загального об’єму зазначеної вакцини. Переважно, зазначений активний інгредієнт містить щонайменше два білки, вибрані з групи, що включає PdhA, XylF, EutD, Mhp145, P78, P132 та Mhp389. Переважно, зазначений активний інгредієнт містить PdhA та P78. Переважно, зазначений активний інгредієнт містить XylF та Mhp145. Переважно, зазначений фармацевтично прийнятний ад’ювант являє собою повний ад’ювант Фрейнда, неповний ад’ювант Фрейнда, алюмогель, поверхнево-активну речовину, поліаніонний ад’ювант, пептид, масляну емульсію або їх комбінацію. Переважно, зазначена вакцина додатково містить фармацевтично прийнятну добавку. Переважно, зазначена фармацевтично прийнятна добавка являє собою розчинник, стабілізатор, розріджувач, консервант, антибактеріальний засіб, протигрибковий засіб, ізотонічний засіб, засіб, що затримує абсорбцію, або їх комбінацію. Даний винахід також передбачає вакцину для попередження інфекції Mycoplasma spp., що 1 UA 115348 C2 5 10 15 20 25 30 35 40 45 50 55 60 містить активний інгредієнт, який містить амінокислотну послідовність SEQ ID NO: 08, SEQ ID NO: 09, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 або їх комбінацію, та фармацевтично прийнятний ад’ювант. Переважно, зазначений активний інгредієнт присутній у концентрації 50-3500 мкг/мл на основі загального об’єму зазначеної вакцини. Переважно, зазначений активний інгредієнт містить щонайменше дві амінокислотні послідовності, вибрані з групи, що включає SEQ ID NO: 08, SEQ ID NO: 09, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 та SEQ ID NO: 14. Переважно, зазначений активний інгредієнт містить амінокислотні послідовності SEQ ID NO: 08 та SEQ ID NO: 12. Переважно, зазначений активний інгредієнт містить амінокислотні послідовності SEQ ID NO: 09 та SEQ ID NO: 11. Переважно, зазначений фармацевтично прийнятний ад’ювант являє собою повний ад’ювант Фрейнда, неповний ад’ювант Фрейнда, алюмогель, поверхнево-активну речовину, поліаніонний ад’ювант, пептид, масляну емульсію або їх комбінацію. Переважно, зазначена вакцина додатково містить фармацевтично прийнятну добавку. Переважно, зазначена фармацевтично прийнятна добавка являє собою розчинник, стабілізатор, розріджувач, консервант, антибактеріальний засіб, протигрибковий засіб, ізотонічний засіб, засіб, що затримує абсорбцію, або їх комбінацію. Даний винахід також передбачає вектор експресії для попередження інфекції Mycoplasma spp., що містить плазміду, де зазначена плазміда містить нуклеотидну послідовність, яка містить щонайменше одну послідовність, вибрану із групи, що включає SEQ ID NO: 01, SEQ ID NO: 02, SEQ ID NO: 03, SEQ ID NO: 04, SEQ ID NO: 05, SEQ ID NO: 06 та SEQ ID NO: 07, та регуляторний елемент. Переважно, зазначений регуляторний елемент містить промотор та сайт зв’язування рибосом. Переважно, зазначена плазміда являє собою pET-MSY, pET-YjgD, pET-D або pET-SUMO. Переважно, зазначена плазміда додатково містить ген, що кодує партнера для злиття. Переважно, зазначений партнер для злиття являє собою msyB E. coli, yjgD E. coli, білок D бактеріофага лямбда або SUMO S. cerevisiae. Переважно, зазначений вектор експресії застосовують для системи експресії генів E. coli. Підсумовуючи, даний винахід відноситься до антигенів, які є придатними для застосування у якості активного інгредієнта субодиничної вакцини проти M. hyopneumoniae, та до субодиничної вакцини проти M. hyopneumoniae, одержаної з їх застосуванням. Дану субодиничну вакцину можна не лише ефективно застосовувати у задачах з попередження для зниження витрат на нього, розкриття даного винаходу також показує, що субодинична вакцина“коктейль” (тобто вакцина, що має щонайменше два антигени у якості активних інгредієнтів), у якій застосовується щонайменше два антигени за даним винаходом характеризується поліпшеною індукцією імунної відповіді. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ На фігурі 1 показано результат двовимірного електрофорезу білків у гелі, який проводили у ому 1 прикладі за даним винаходом. На фігурі 2 показано результат кольорової реакції продуктів Вестерн-блотингу, який ому проводили у 1 прикладі за даним винаходом. ому На фігурі 3 показано результат електрофорезу ПЛР продуктів, одержаних у 2 прикладі за даним винаходом. На фігурі 4 показані матеріали з експериментів з контрольного зараження, які проводили у ому 3 прикладі за даним винаходом. Опис позначень на фігурах: 1 XylF(ксилоза-зв’язуючий ліпопротеїн) 2 XylF(ксилоза-зв’язуючий ліпопротеїн) 3 XylF(ксилоза-зв’язуючий ліпопротеїн) 4 PdhA(альфа-субодиниця піруват-дегідрогенази E1) 5 Mhp145(периплазматичний цукор-зв’язуючий білок) 6 EutD(фосфотрансацетилаза) 7 EutD(фосфотрансацетилаза) 8 Mhp389 9 P78(ліпопротеїн) 10 P132 ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ 2 UA 115348 C2 5 10 15 20 25 30 35 40 45 50 55 60 Однією з основних підходів даного винаходу є пошук потенційних антигенів-кандидатів, придатних для субодиничних вакцин, шляхом застосування двовимірного електрофорезу білків у гелі разом із технологією імунологічного скринінгу та ідентифікація антигенів за допомогою мас-спектрометра. Потім характеристики даних субодиничних вакцин підтверджували за допомогою експериментів у моделях на тваринах. Коротко, процес розробки даного винаходу включав наступні стадії: (1) індукція імунної відповіді в експериментальних свиней шляхом ін’єкції традиційної вакцини проти M. hyopneumoniae та одержання сироватки, що містить антитіла до M. hyopneumoniae; (2) одержання загального білка M. hyopneumoniae для двовимірного електрофорезу білків у гелі; (3) проведення гібридизації зразків, одержаних у результаті двовимірного електрофорезу білків у гелі зі стадії (2), із застосуванням сироватки зі стадії (1) у ого якості 1 антитіла та потім збір білків, що показують позитивні результати (тобто антигенівим кандидатів), з гелю після доповнення 2 антитілом та після процедури проявлення; (4) ідентифікація антигенів-кандидатів, одержаних на стадії (3); (5) експресія зазначених антигенівкандидатів у великих кількостях із застосуванням системи експресії генів E. coli.; (6) оцінка ефективності даних субодиничних вакцин у зменшенні патологічних ознак у легені шляхом експериментів з контрольного зараження свиней та, таким чином, підтвердження цінності зазначених антигенів-кандидатів при застосуванні у якості активного інгредієнта субодиничної вакцини. Дана вакцина для попередження інфекції Mycoplasma spp. містить активний інгредієнт та фармацевтично прийнятний ад’ювант. У варіанті здійснення даного винаходу зазначений активний інгредієнт може являти собою PdhA, XylF, EutD, Mhp145, P78, P132 або Mhp389. У альтернативному варіанті здійснення, оскільки антигенні детермінанти будь-якого з вищезазначених білків не перекриваються, зазначений активний інгредієнт може являти собою злитий білок з будь-яких двох вищезазначених білків. У іншому альтернативному варіанті здійснення зазначений активний інгредієнт містить щонайменше два з вищезазначених білків, тобто являє собою так звану вакцину-“коктейль” за даним винаходом. У іншому варіанті здійснення даного винаходу зазначений активний інгредієнт може містити амінокислотну послідовність SEQ ID NO: 08, SEQ ID NO: 09, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 або їх комбінацію. У альтернативному варіанті здійснення, оскільки антигенні детермінанти, утворені при фолдингу пептиду із зазначеною амінокислотною послідовністю, не перекриваються, зазначений активний інгредієнт може являти собою злитий білок із щонайменше двома зазначеними послідовностями. У іншому альтернативному варіанті здійснення зазначений активний інгредієнт містить два або більше білків, які відповідно містять одну з вищезазначених амінокислотних послідовностей, тобто являє собою так звану вакцину-“коктейль” за даним винаходом. Зазначений фармацевтично прийнятний ад’ювант застосовують для поліпшення імунного ефекту зазначеного активного інгредієнта, стабілізації зазначеного активного інгредієнта та/або підвищення безпеки вакцин. Зазначений фармацевтично прийнятний ад’ювант за даним винаходом включає повний ад’ювант Фрейнда, неповний ад’ювант Фрейнда, алюмогель, поверхнево-активну речовину, поліаніонний ад’ювант, пептид, масляну емульсію або їх комбінацію, але не обмежується ними. Вакцина за даним винаходом може мати один або щонайменше два зазначені активні інгредієнти (тобто являє собою вакцину-коктейль). У прикладі даної вакцини зазначений активний інгредієнт присутній у концентрації 50-3500 мкг/мл на основі загального об’єму зазначеної вакцини. У переважному варіанті здійснення даного винаходу, коли зазначена вакцина містить лише один зазначений активний інгредієнт, зазначений активний інгредієнт присутній у концентрації 50-500 мкг/мл на основі загального об’єму зазначеної вакцини. У альтернативному варіанті здійснення даного винаходу дана вакцина містить щонайменше один зазначений активний інгредієнт, де загальна концентрація зазначеного(их) активного(их) інгредієнта(ів), що міститься(містяться) у зазначеній вакцині становить 50-1000 мкг/мл, 50-1500 мкг/мл, 50-2000 мкг/мл, 50-2500 мкг/мл, 50-3000 мкг/мл або 50-3500 мкг/мл на основі загального об’єму зазначеної вакцини. Інший аспект даного винаходу полягає у забезпеченні вектора експресії для попередження інфекції Mycoplasma spp. Зокрема, зазначений вектор експресії можна застосовувати для системи експресії генів E. coli. Тим не менш, не відступаючи від суті даного винаходу, спеціаліст у даній галузі техніки може модифікувати зазначений вектор на основі розкриття за даним винаходом та зробити зазначений вектор придатним для різних систем експресії генів, при цьому все ще залишаючись у обсязі даного винаходу. 3 UA 115348 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зазначений вектор експресії містить плазміду. Зазначена плазміда містить нуклеотидну послідовність, що містить щонайменше одну послідовність, вибрану із групи, яка включає SEQ ID NO: 01, SEQ ID NO: 02, SEQ ID NO: 03, SEQ ID NO: 04, SEQ ID NO: 05, SEQ ID NO: 06, SEQ ID NO: 07 та їх комбінацію, та регуляторний елемент. Зазначений вектор використовується системі експресії генів E. coli та для продукування антигенів за даним винаходом за допомогою E. coli. Іншими словами, зазначена нуклеотидна послідовність може транслюватися у амінокислотну послідовність даного антигену за допомогою системи експресії генів E. coli, та потім амінокислотна послідовність може піддаватися фолдингу у даний антиген. У альтернативному варіанті здійснення, оскільки роботі системи експресії генів E. coli не перешкоджають, та продукування зазначеної нуклеотидної послідовності та фолдинг утвореної в результаті з неї амінокислотної послідовності не заважають одне одному, зазначена плазміда може містити дві або більше зазначених нуклеотидних послідовностей. Зазначений регуляторний елемент відноситься до елемента, необхідного для ініціації транскрипції та трансляції у системі експресії. Зазначений регуляторний елемент буде містити щонайменше промотор та сайт зв’язування рибосом. Переважно, зазначений регуляторний елемент може додатково містити оператор, енхансерну послідовність або їх комбінацію. У переважному варіанті здійснення даного винаходу зазначена плазміда додатково містить ген, що кодує партнера для злиття. Зазначений партнер для злиття включає msyB E. coli, yjgD E. coli, білок D бактеріофага лямбда або SUMO S. Cerevisiae, але не обмежується ними. Зазначений MsyB є багатим кислими амінокислотами та може бути переважним для поліпшення розчинності білків, які необхідно продукувати. У наступних прикладах наведено випробування та експерименти за даним винаходом для додаткового пояснення ознак та переваг даного винаходу. Буде зрозуміло, що наступні приклади є ілюстративними та не будуть використовуватись для обмеження заявленого обсягу даного винаходу. Приклад 1. Скринінг на антигени-кандидати, придатні для застосування у якості активного інгредієнта субодиничної вакцини Одержання сироватки, що містить свинячі антитіла до Mycoplasma spp. Згідно із дослідженнями зі свині можна виділити сім Mycoplasma spp.: Mycoplasma hyopneumoniae, Mycoplasma hyorhinis, Mycoplasma hyosynoviae, Mycoplasma flocculare, Mycoplasma hyopharyngis, Mycoplasma sualvi, Mycoplasma bovigenitalium (Gourlay et al., 1978; Blank et al., 1996; Assuncao et al., 2005). З-поміж них M. hyopneumoniae є головним патогеном ензоотичної пневмонії свиней з відсотком зараження 25-93%. Таким чином, у даному винаході застосовували M. hyopneumoniae (штам PRIT-5) для імунних досліджень за допомогою методів протеоміки та у якості джерела генів, що кодують антигени. Середовище Friis (Friis et al., 1975) використовували для культивування M. hyopneumoniae. Згідно із планом експерименту відповідну кількість антибіотику або агару у концентрації 1,5% додавали до твердого середовища при складанні. Три SPF свині віком 4 тижні забирали з Дослідного інституту сільськогосподарських технологій (Agricultural Technology Research Institute) та годували однаковим кормом та тримали у однаковому навколишньому середовищі та при однакових умовах росту у свинарнику до експериментів. Після відгодовування до віку 32 дні, 46 днів та 60 днів свиням уводили 2 мл вакцини ® Bayovac MH-PRIT-5 (PRIT-5 M. hyopneumoniae) шляхом внутрішньом’язової ін’єкції. Потім свиней постійно годували до віку 74 дні та кров збирали з їх яремних вен. Зібрану кров поміщали у кімнатну температуру на 1 годину та зберігали при 4 °C. Наступного дня зібрану кров центрифугували при 1,107×g протягом 30 хвилин та супернатант видаляли у чисту пробірку та зберігали при -20 °C. Двовимірний електрофорез білків у гелі для загального білка з Mycoplasma spp. TM Набір для екстракції білка (загального білка) ReadyPrep (Bio-Rad, Каліфорнія, США) використовували для екстракції загального білка з Mycoplasma spp. Потім концентрацію зібраного білка визначали за допомогою застосування набору для аналізу білка Bio-Rad RC DC Protein Assay Kit (Каліфорнія, США). Детальний протокол можна дізнатися з опису продукту, або його можна модифікувати на основі добре відомих у даній галузі протоколів. Двовимірний електрофорез білків у гелі проводили у дві стадії: ізоелектричне фокусування (IEF) та електрофорез у поліакриламідному гелі з додецилсульфатом натрію (SDS-PAGE). IEF використовували для розділення білків у зразку з урахуванням їх ізоелектричної точки; SDSPAGE використовували для розділення білків у відповідності з їх молекулярною масою. Див. фігуру 1, на якій наведено результат двовимірного електрофорезу білків у гелі. 4 UA 115348 C2 5 10 15 20 Гібридизація ого Сироватку, одержану на стадії (1) використовували у якості 1 антитіла для гібридизації зі зразком, одержаним у результаті двовимірного електрофорезу білків у гелі на стадії (2). Після им доповнення 2 антитілом та проявлення за допомогою наступної процедури проявлення білки, що показували позитивні результати, збирали. Ці білки розпізнаються антитілом до Mycoplasma spp. та, отже, будуть придатні у якості антигенів-кандидатів для активного інгредієнта субодиничних вакцин. Гібридизацію проводили за допомогою Вестерн-блотингу. Коротко, 2D-гель після електрофорезу переносили на мембрану з PVDF. Потім мембрану інкубували та гібридизували им им послідовно з 1 антитілом (сироваткою, що містила антитіло до Mycoplasma spp.) та 2 антитілом (AP-кон’юговане антитіло до свинячого IgG). Після цього проводили кольорову реакцію із застосуванням розчину NBT/BCIP. Результат кольорової реакції продуктів Вестерн-блотингу наведений на фігурі 2, де 10 білків, позитивних за результатами імуногібридизації з антитілом до Mycoplasma spp., маркували як антигени-кандидати для застосування у якості активних інгредієнтів субодиничних вакцин. Ідентифікація одержаних антигенів-кандидатів Згідно із кольоровою реакцією продуктів Вестерн-блотингу гель, що відповідав позитивним місцям на мембрані, розрізали за допомогою мікропептиду та аналізували за допомогою масспектрометрії. Одержані дані від мас-спектрометрії потім порівнювали з амінокислотною послідовністю та базою даних білків для ідентифікації цих білків. Див. наступну таблицю 1, де наведені зазначені 10 білків, позитивних за імуногібридизацією з антитілом до Mycoplasma spp. Таблиця 1 10 білків, позитивних за імуногібридизацією з антитілом до Mycoplasma spp., та їх амінокислотна послідовність Кандидат 1 2 3 4 5 6 7 8 9 10 Назва XylF (ксилоза-зв’язуючий ліпопротеїн) XylF (ксилоза-зв’язуючий ліпопротеїн) XylF (ксилоза-зв’язуючий ліпопротеїн) PdhA (альфа-субодиниця піруват-дегідрогенази E1) Mhp145 (периплазматичний цукор-зв’язуючий білок) EutD (фосфотрансацетилаза) EutD (фосфотрансацетилаза) Mhp389 P78 (ліпопротеїн) P132 SEQ ID NO SEQ ID NO: 09 SEQ ID NO: 09 SEQ ID NO: 09 SEQ ID NO: 08 SEQ ID NO: 11 SEQ ID NO: 10 SEQ ID NO: 10 SEQ ID NO: 14 SEQ ID NO: 12 SEQ ID NO: 13 *XylF та EutD мають різні зарядові стани у клітинах та, таким чином, стають 3 та 2 позитивними положеннями на мембрані. 25 30 35 Приклад 2. Експресія зазначених антигенів-кандидатів у великій кількості за допомогою системи експресії генів E. coli Escherichia coli JM109 використовували у якості клітини-хазяїна для клонування, та Escherichia coli BL21 (DE3) використовували у якості клітин-хазяїнів для експресії білка. Клітини Escherichia coli культивували у середовищі LB (Luria-Bertani; Difco, Мічиган, США). Згідно із планом експерименту відповідну кількість антибіотику або агару у концентрації 1,5% додавали для твердого середовища при складанні. Ампліфікація генів, що кодують антигени-кандидати Після ідентифікації антигенів-кандидатів провели пошук генів, що кодують ці антигени, у базі даних NCBI (Національний центр біотехнологічної інформації). Специфічні праймери, що націлені на гени антигенів, конструювали відповідним чином. Потім гени антигенів ампліфікували із застосуванням специфічних праймерів та хромосоми M. hyopneumoniae PRIT-5 у якості матриці. Специфічні праймери, які застосовувались, наведені у наступній таблиці 2. 5 UA 115348 C2 Таблиця 2 Набір праймерів Кандидат PdhA XylF EutD Mhp145 P78 P132 Mhp389 5 10 15 20 25 Послідовності набору праймерів PdhAF (SEQ ID NO: 15) 5’-GATATAGGATCCATGGACAAATTTCGCTATGTAAAGCCT G-3’ PdhAR (SEQ ID NO: 16) 5’-CAATATGTCGACTTATTTTACTCCTTTAAAAAATTCAAGCG CTTC-3’ XylFF (SEQ ID NO: 17) 5’-GATATAGGATCCATGAATGGAATAAATTTCTTGGCTTAGGC TTAGTTTTTC-3’ XylFR (SEQ ID NO: 18) 5’-CAATATGTCGACTTAATTTTTATTAATATCGGTAATTAGTT TGTCTAAGC-3’ EUTDF (SEQ ID NO: 19) 5’-GATATAGGATCCATGACATACCAAGAATATCTTCAAGCAA G-3’) EUTDR (SEQ ID NO: 20) 5’-CAATATGTCGACCTATTTACCTTCTTCAAC TTGTAGAGCGCT-3’) Mhp145F (SEQ ID NO: 21) 5’-GATATAGGATCCATAGCTTCAAGGTCGAA TACAACTGC-3’ Mhp145R (SEQ ID NO: 22) 5’-CAATATGTCGACTTAATTTACCTTTTGGAG TATCCCATTTTC-3’ P78F (SEQ ID NO: 23) 5’-GATATAGGATCCTTATCCTATAAATTTAGG CGTTTTTTCC-3’ P78R (SEQ ID NO: 24) 5’-CAATATGTCGACTTATTTTGATTTAAAAGCAGGACCTAA AT-3’ P132F (SEQ ID NO: 25) 5’-GATATAGGATCCATTGGACTAACAATTTTTGAGAAATCATT TAG-3’ P132R (SEQ ID NO: 26) 5’-CAATATGTCGACTTATTCCTAAATAGCCCC ATAAAGTG-3’ Mhp389F (SEQ ID NO: 27) 5’-GATATAGGATCCATGGACAAATTTTCACGA ACTGTTCT-3’ Mhp389R (SEQ ID NO: 28) 5’-CAATATGTCGACCTAGATTTTAAAGGATTTTTTTAATTCAA TAATATAATC-3’ Полімеразну ланцюгову реакцію проводили (ПЛР) проводили з наборами праймерів, наведеними у таблиці 2 вище, для ампліфікації генів антигенів-кандидатів. Ампліфіковані гени потім використовували у системі експресії генів E. coli. Умови ПЛР були наступними: 5 хвилин при 98 °C (один цикл); 30 секунд при 94 °C, 30 секунд при 55 °C, X секунд при 68 °C (35 циклів); 5 хвилин при 68 °C (один цикл). Зазначена величина X являла собою час елонгації для ДНКполімерази, та її встановлювали залежно від розміру фрагмента, який необхідно ампліфікувати. Після ПЛР реакції проводили електрофорез для підтвердження того, чи містили ПЛР продукти фрагменти ДНК очікуваного розміру. Див. фігуру 3, на якій показано результат електрофорезу ПЛР продуктів; де смуга 1 являла собою ген eutD; смуга 2 являла собою pdhA; смуга 3 являла собою xylF; смуга 4 являла собою ген P78; смуга 5 являла собою ген P132; смуга 6 являла собою mhp145; смуга 7 являла собою mhp389. Клонування ПЛР продуктів Клонування проводили із застосуванням набору для клонування CloneJET PCR Cloning Kit TM та суміш для лігування трансформували у E. coli ECOS 9-5 (Yeastern, Тайпей, Тайвань). Детальний протокол можна дізнатися з опису продукту, або його можна модифікувати на основі добре відомих у даній галузі протоколів. Після трансформації бактерії культивували на твердому середовищі LB, що містить ампіцилін (100 мкг/мл), до утворення ними колоній. Потім проводили ПЛР колоній для скринінгу штамів, успішних у трансформації. Умови ПЛР були наступними: 5 хвилин при 95 °C (один цикл); 30 секунд при 95 °C, 30 секунд при 55 °C, X секунд при 72 °C (25 циклів); 7 хвилин при 72 °C (один цикл). Зазначена величина X являла собою час елонгації для ДНК полімерази, та її встановлювали залежно від розміру фрагмента, який необхідно ампліфікувати. Швидкість елонгації Taq ДНК-полімерази (Genomics, Тайпей, Тайвань) становить 1 т.н./хв.; таким чином, якщо Taq ДНК-полімеразу використовувати для ампліфікації фрагмента ДНК довжиною 1 т.н., зазначену величину X будуть встановлювати на 1 хвилину. 6 UA 115348 C2 5 10 15 20 25 Плазміди штамів, чиї рекомбінанті плазміди, як було підтверджено, містили вбудовану ДНК, потім відправляли на секвенування ДНК (Total Solution Provider of Systems Biology and Chemoinformatics Ltd.). Плазміди, що містили eutD, pdhA, xylF, ген P78, ген P132, mhp145 та mhp389, називали pJET-eutD, pJET-pdhA, pJET-xylF, pJET-P78, pJET-P132, pJET-mhp145, pJETmhp389, відповідно. Точкова мутація та клонування генів антигенів M. hyopneumoniae Перед ампліфікацією антигенів-кандидатів у системі експресії генів E. coli слід враховувати використання кодонів в різних організмів. Це значить, якщо ген містить кодон, який буде кодуватися неоднозначно у вихідного організму, з якого він походить, та E. coli, то ген слід модифікувати шляхом точкової мутації. Гени антигенів M. hyopneumoniae, pdhA, xylF, ген P78, ген P132, mhp145 та mhp389, містять кодон TGA (eutD не має труднощів з використанням кодонів, як інші). Кодон TGA транслювався у триптофан у Mycoplasma spp., але транслюється як стоп-кодон у E. coli. Для запобігання нездатності до продукування повного білка у системі експресії генів E. coli сконструювали праймери, що націлені на сайт TGA, та точкову мутацію із заміною TGA на TGG проводили із застосуванням полімеразної ланцюгової реакції з праймерами, що перекриваються. У результаті гени, які необхідно експресувати у системі експресії генів E. coli, можуть правильно транслюватись у антиген-кандидат за даним винаходом. Окрім цього, сайти розрізання BamHI у гені P78, гені P132 та mhp389 піддавали мовчазній мутації для зручності у клонуванні. Праймери, які використовували для точкової мутації, конструювали так, щоб сайт точкової мутації знаходився у центральній частині праймера, та щоб вони характеризувалися величиною Tm більш ніж 78 °C. Величину Tm праймерів для точкової розраховували за допомогою формули, наданої Invitrogene Co.: Tm = 81,5+0,41 (%GC) - 675/N - % неспівпадіння; де %GC відноситься до відсоткового вмісту GC у розрахунку на сумарну кількість нуклеотидів, що містяться у праймері, який розглядається; N відноситься до довжини праймера, який розглядається; % неспівпадіння відноситься до відсотку основ, які необхідно піддати мутації, у розрахунку на загальну кількість нуклеотидів, що містяться у праймері, який розглядається. Набори праймерів, що використовуються для вищезазначених генів, наведені у наступних таблицях 3-8. 30 Таблиця 3 Набори праймерів для точкової мутації у pdhA Праймер PdhAF SEQ ID NO: 29 PdhAM1 SEQ ID NO: 30 PdhAM2 SEQ ID NO: 31 PdhAM3 SEQ ID NO: 32 PdhAM4 SEQ ID NO: 33 PdhAM5 SEQ ID NO: 34 PdhAM6 SEQ ID NO: 35 PdhAM7 SEQ ID NO: 36 PdhAM8 Послідовність ДНК (від 5’ до 3’) GATATAGGATCCATGGACAAATTTCGCTATGTAAAGCCTG GCTAACAAAAGATGACTGGTTTGTCCCAGCTTTTCG CGAAAAGCTGGGACAAACCAGTCATCTTTTGTTAGC CTTGCAAATGCAATATTGGAATGGTAGCGAAAAAGG CCTTTTTCGCTACCATTCCAATATTGCATTTGCAAG CGAGGCGCTAAATATTGCAAGTATTTGGAAATGGCCAGTTGTTTTTTGCGTAAATAAC GTTATTTACGCAAAAAACAACTGGCCATTTCCAAATACTTGCAATATTTAGCGCCTCG GTTTTTTGCGTAAATAACAATCAATGGGCAATTTCAACCCCAAATAAATATG CATATTTATTTGGGGTTGAAATTGCCCATTGATTGTTATTTACGCAAAAAAC 7 UA 115348 C2 SEQ ID NO: 37 PdhAM9 SEQ ID NO: 38 PdhAM10 SEQ ID NO: 39 PdhAM11 SEQ ID NO: 40 PdhAM12 SEQ ID NO: 41 PdhAM13 SEQ ID NO: 42 PdhAM14 SEQ ID NO: 43 PdhAR SEQ ID NO: 44 GTTGAGTTTGTAACTTGGCGTCAAGGTGTTCATACC GGTATGAACACCTTGACGCCAAGTTACAAACTCAAC GAGAACACGAAAAATGGGAACCAATGCACCGG CCGGTGCATTGGTTCCCATTTTTCGTGTTCTC CCGAAAAACAAAAAATTTGGGATGAAGCGCTTGCGATTG CAATCGCAAGCGCTTCATCCCAAATTTTTTGTTTTTCGG CAATATGTCGACTTATTTTACTCCTTTAAAAAATTCAAGCGCTTC Таблиця 4 Набори праймерів для точкової мутації у xylF. Праймер XylFF SEQ ID NO: 45 XylFM1 SEQ ID NO: 46 XylFM2 SEQ ID NO: 47 XylFM3 SEQ ID NO: 48 XylFM4 SEQ ID NO: 49 XylFM5 SEQ ID NO: 50 XylFM6 SEQ ID NO: 51 XylFM7 SEQ ID NO: 52 XylFM8 SEQ ID NO: 53 XylFM9 SEQ ID NO: 54 XylFM10 SEQ ID NO: 55 XylFM11 SEQ ID NO: 56 XylFM12 SEQ ID NO: 57 XylFR SEQ ID NO: 58 Послідовність ДНК (від 5’ до 3’) GATATAGGATCCATGAAATGGAATAAATTTCTTGGCTTAGGCTTAGTTTTTC CATTTAACCAATCAAGTTGGGAGGCAATTCAACAACTTGG CCAAGTTGTTGAATTGCCTCCCAACTTGATTGGTTAAATG CTAATACCAACAAAAATGTTTGGGTACTTTCTGGTTTTCAACACG CGTGTTGAAAACCAGAAAGTACCCAAACATTTTTGTTGGTATTAG CGGTGATGCGATCACAAAATGGTTAAAAATCCCTGAAAATAAGC GCTTATTTTCAGGGATTTTTAACCATTTTGTGATCGCATCACCG TTATCATACTCGGAATTGACTGGACTGATACTGAAAATGTAATTC GAATTACATTTTCAGTATCAGTCCAGTCAATTCCGAGTATGATAA GAAGAAGCCGGATGGCTTGCAGGATATGC GCATATCCTGCAAGCCATCCGGCTTCTTC GGTTATCTAGCCGGAATTAAAGCTTGGAATCTAAAAAATTCTGATAAAAAAAC GTTTTTTTATCAGAATTTTTTAGATTCCAAGCTTTAATTCCGGCTAGATAACC CAATATGTCGACTTAATTTTTATTAATATCGGTAATTAGTTTGTCTAAGC 8 UA 115348 C2 Таблиця 5 Набори праймерів для точкової мутації у гені P78 Праймер P78F SEQ ID NO: 59 P78M1 SEQ ID NO: 60 P78M2 SEQ ID NO: 61 P78M3 SEQ ID NO: 62 P78M4 SEQ ID NO: 63 P78M5 SEQ ID NO: 64 P78M6 SEQ ID NO: 65 P78M7 SEQ ID NO: 66 P78M8 SEQ ID NO: 67 P78R SEQ ID NO: 68 Послідовність ДНК (від 5’ до 3’) GATATAGGATCCTTATCCTATAAATTTAGGCGTTTTTTCC CAATTAATAAAGTTTTGTTTGGTTGGATGATTAATAAAGCACTTGCTGATCC GGATCAGCAAGTGCTTTATTAATCATCCAACCAAACAAAACTTTATTAATTG GATATTAAAGAAATTGAAAGAATCTGGAAAAAATATGTCTCCGATGATCAAGG CCTTGATCATCGGAGACATATTTTTTCCAGATTCTTTCAATTTCTTTAATATC GCCCTTTCAGGAGGCTCCACTGATTCGGCA TGCCGAATCAGTGGAGCCTCCTGAAAGGGC GCCGCAAAAGCTTTTGTTAAATGGCTTTTGACAGAAAAAATAGTCT AGACTATTTTTTCTGTCAAAAGCCATTTAACAAAAGCTTTTGCGGC CAATATGTCGACTTATTTTGATTTAAAAGCAGGACCTAAAT Таблиця 6 Набори праймерів для точкової мутації у гені P132 Праймер P132F SEQ ID NO: 69 P132M1 SEQ ID NO: 70 P132M2 SEQ ID NO: 71 P132M3 SEQ ID NO: 72 P132M4 SEQ ID NO: 73 P132M5 SEQ ID NO: 74 P132M6 SEQ ID NO: 75 P132M7 SEQ ID NO: 76 P132M8 SEQ ID NO: 77 P132M9 SEQ ID NO: 78 P132M10 SEQ ID NO: 79 P132M11 SEQ ID NO: 80 P132M12 SEQ ID NO: 81 P132M13 Послідовність ДНК (від 5’ до 3’) GATATAGGATCCATTGGACTAACAATTTTTGAGAAATCATTTAG CTAACTTCTCTAAAAGGTTGGAAAGAAGAAGATGATTTTG CAAAATCATCTTCTTCTTTCCAACCTTTTAGAGAAGTTAG CTTTCTATTACTTTTGAACTCTGGGACCCAAATGGTAAATTAGTATC GATACTAATTTACCATTTGGGTCCCAGAGTTCAAAAGTAATAGAAAG CCCTGAAGGAGATTGGATAACTTTAGGGAG CTCCCTAAAGTTATCCAATCTCCTTCAGGG CTACCAGGAACTACCTGGGATTTCCATGTTGAAC GTTCAACATGGAAATCCCAGGTAGTTCCTGGTAG GGACAACTAATTTGGAGCCAGTTAGCTTCC GGAAGCTAACTGGCTCCAAATTAGTTGTCC GGAACAAAAAAGGAATGGATTCTTGTAGGATCTGG CCAGATCCTACAAGAATCCATTCCTTTTTTGTTCC CCAATACGCAAATATGGATAACCCGTCTAGGAAC 9 UA 115348 C2 SEQ ID NO: 82 P132M14 SEQ ID NO: 83 P132M15 SEQ ID NO: 84 P132M16 SEQ ID NO: 85 P132M17 SEQ ID NO: 86 P132M18 SEQ ID NO: 87 P132R SEQ ID NO: 88 GTTCCTAGACGGGTTATCCATATTTGCGTATTGG CCAAGGGGAAGTTCTCTGGACTACTATTAAATCCAAAC GTTTGGATTTAATAGTAGTCCAGAGAACTTCCCCTTGG CAAAAAACTTCACCTTTGGTGGATTGCTAATGATAGC GCTATCATTAGCAATCCACCAAAGGTGAAGTTTTTTG CAATATGTCGACT TATTCCTAAATAGCCCCATAAAGTG Таблиця 7 Набори праймерів для точкової мутації у mhp145. Праймер Mhp145F SEQ ID NO: 89 Mhp145M1 SEQ ID NO: 90 Mhp145M2 SEQ ID NO: 91 Mhp145R SEQ ID NO: 92 Послідовність ДНК (від 5’ до 3’) GATATAGG ATCCAT AGCTTCAAGGTCGAATACAACTGC AATAATTGCAGAAAAAATTCTTAAAGATCAATGGAAAACAAGTAAATATTCTGATTTTTATTCACAAT ATTGTGAATAAAAATCAGAATATTTACTTGTTTTCCATTGATCTTTAAGAATTTTTTCTGCAATTATT CAATATGTCGACTTA ATTTACCTTTTGGAGTATCCCATTTTC Таблиця 8 Набори праймерів для точкової мутації у mhp389 Праймер Mhp389F SEQ ID NO: 93 Mhp389M1 SEQ ID NO: 94 Mhp389M2 SEQ ID NO: 95 Mhp389M3 SEQ ID NO: 96 Mhp389M4 SEQ ID NO: 97 Mhp389M5 SEQ ID NO: 98 Mhp389M6 SEQ ID NO: 99 Mhp389R SEQ ID NO: 100 5 10 Послідовність ДНК (від 5’ до 3’) GATATAGGATCCATGGACAAATTTTCACGAACTGTTCT CAATAGTGACAATGGACCCCCCAAATGTTGGTCG CGACCAACATTTGGGGGGTCCATTGTCACTATTG GATAAAGGCGCATCATGGCTTGCGCTTGCACCAAC GTTGGTGCAAGCGCAAGCCATGATGCGCCTTTATC GGAAAACTTAAAGGTAAATGGACTTTTGGACTAACCTATTT AAATAGGTTAGTCCAAAAGTCCATTTACCTTTAAGTTTTCC CAATATGTCGACCTAGATTTTAAAGGATTTTTTTAATTCAATAATATAATC Спосіб для введення точкової мутації коротко пояснюється нижче. Хромосому M. hyopneumoniae PRIT-5 використовували у якості матриці, та фрагменти ДНК ампліфікували із застосуванням наборів праймерів, наведених у таблицях 3-8 вище. 50 мкл реакційної суміші для ПЛР містили 1 × GDP-HiFi буфер для ПЛР, 200 мкМ суміші дАТФ, дТТФ, дГТФ та дЦТФ, 1 мкМ праймерів, 100 нг хромосоми M. hyopneumoniae PRIT-5 та 1 одиницю GDP-HiFi ДНК-полімерази. Умови ПЛР були наступними: 5 хвилин при 98 °C (один цикл); 30 секунд при 94 °C, 30 секунд при 55 °C, X секунд при 68 °C (35 циклів); 5 хвилин при 10 UA 115348 C2 5 10 15 20 25 30 35 40 45 50 55 60 68 °C (один цикл). Зазначена величина X являла собою час елонгації для ДНК-полімерази, та її встановлювали залежно від розміру фрагмента, який необхідно ампліфікувати. Швидкість елонгації ДНК-полімерази GDP-HIFI (GeneDirex, Лас-Вегас, США) становить 1 т.н./15 секунд; таким чином, якщо ДНК-полімеразу GDP-HIFI використовувати для ампліфікації фрагмента ДНК довжиною 1 т.н., зазначену величину X слід встановлювати на 15 секунд. Після ПЛР реакції проводили електрофорез для підтвердження того, чи містили ПЛР-продукти фрагменти ДНК очікуваного розміру. Потім ПЛР продукт повертали для подальшого використання із TM застосуванням набору для системи екстракції гелю Gel-M . Після цього ПЛР продукт використовували у якості матриці та ампліфікували із застосуванням наборів праймерів, наведених у таблиці 2 вище. Умови ПЛР були наступними: 2 хвилини при 98 °C (один цикл); 30 секунд при 94 °C, 30 секунд при 55 °C, X секунд при 68 °C (35 циклів); 5 хвилин при 68 °C (один цикл). Зазначена величина X являла собою час елонгації для ДНК-полімерази, та її встановлювали залежно від розміру фрагмента, який необхідно ампліфікувати. Швидкість елонгації ДНК-полімерази GDP-HIFI (GeneDirex, Лас-Вегас, США) становить 1 т.н./15 секунд; таким чином, якщо ДНК-полімеразу GDP-HIFI використовуються для ампліфікації фрагмента ДНК довжиною 1 т.н., зазначену величину X необхідно встановлювати на 15 секунд. Після вищезазначеної стадії ампліфікації можна одержати послідовність повної довжини генів антигенів-кандидатів з точковою мутацією. Потім ПЛР продукт повертали для подальшого використання із застосуванням набору для TM системи очищення PCR-M Clean Up (GeneMark, Тайчжун, Тайвань), та його клонування проводили із застосуванням набору для клонування CloneJET PCR Cloning Kit. ПЛР колоній проводили для підтвердження, які після трансформації містили плазміду із вбудованою ДНК, та потім плазміди з них виділяли для секвенування ДНК (Total Solution Provider of Systems Biology and Chemoinformatics Ltd.). Плазміди, що містили мутовані гени антигенів-кандидатів, назвали pJET-pdhAM, pJET-xylFM, pJET-P78M, pJET-P132M, pJET-mhp145M, pJET-mhp389M, відповідно. Згідно із результатом секвенування послідовності ДНК генів антигенів-кандидатів після точкової мутації були такими, як наведено у SEQ ID NO: 01 (pdhA), SEQ ID NO: 02 (xylF), SEQ ID NO: 03 (eutD, не піддавався точковій мутації), SEQ ID NO: 04 (mhp145), SEQ ID NO: 05 (ген P78), SEQ ID NO: 06 (ген P132), SEQ ID NO: 07 (mhp389). Конструювання векторів експресії для експресії антигенів M. hyopneumoniae У цій частині експериментів плазміду pET-MSY використовували у якості кістяка для конструювання вектора експресії для експресії антигену M. hyopneumoniae. pET-MSY є похідною pET29a та має msyB E. coli. Отже, експресований рекомбінантний антиген буде містити партнера для злиття MsyB. MsyB багатий на кислі амінокислоти та здатний підвищувати розчинність експресованого білка. Після розщеплення pJET-eutD, pJET-pdhA, pJET-xylF, pJET-P78, pJET-P132, pJET-mhp145 та pJET-mhp389 за допомогою BamHI та SalI одержаний фрагмент ДНК вбудовували у pET-Msy, розщеплену раніше тими ж ферментами рестрикції, за допомогою лігази. Потім pET-Msy з фрагментом ДНК трансформували у E. coli ECOS 9-5. ПЛР колоній проводили для підтвердження штамів, які після трансформації містили плазміду із вбудованою ДНК, та потім плазміди з них виділяли для секвенування ДНК (Total Solution Provider of Systems Biology and Chemoinformatics Ltd.). Плазміди, у яких була підтверджена правильна послідовність ДНК, називали pET-MSYEutD, pET-MSYPdhA, pET-MSYXylF, pET-MSYP78, pET-MSYP132, pETMSYMhp145 та pET-MSYMhp389, відповідно. Ці одержані плазміди являли собою приклади векторів експресії за даним винаходом для попередження інфекції Mycoplasma spp. Експресія та виділення антигенів M. hyopneumoniae Вектори для експресії антигенів трансформували у E. coli BL21 (DE3). Одну колонію одержаних у результаті штамів після трансформації інокулювали у рідке середовище LB, що містило канаміцин (робоча концентрація: 30 мкг/мл). Після культивування протягом ночі при 37 °C та 180 об./хв. суспензію бактерій розводили у пропорції 1:100 та інокулювали знов у інше рідке середовище LB, що містило канаміцин (робоча концентрація: 30 мкг/мл). Бактерії культивували при 37 °C та 180 об./хв. доти, поки OD600 внаслідок цього не досягне приблизно 0,6-0,8. Потім 0,1 мМ IPTG додавали для індукції експресії. Після індукції протягом 4 годин осад збирали за допомогою центрифугування (10000×g, 10 хвилин, 4 °C) та експресію перевіряли за допомогою електрофорезу білків. Після цього афінну хроматографію на іммобілізованих іонах металів (IMAC) використовували для виділення білка шляхом ковалентного зв’язування між His-міткою на Nкінці рекомбінантного білка та іонів нікелю або іонів кобальту. Протокол виділення білка TM відповідав опису продукту QIAexpressionist (четверте видання, Qiagen). Осад суспендували у буфері для лізису (50 мМ NaH2PO4, 300 мМ NaCl, 10 мМ імідазол, pH 8,0) та збурювали за 11 UA 115348 C2 5 10 15 20 25 допомогою пристрою для обробки ультразвуком. Після центрифугування (8000×g, 15 хвилин) супернатант збирали та вносили у колонку з 1 мл смоли Ni-NTA. Рекомбінантні антигени будуть затримуватись на зазначеній смолі. Потім 15 мл буфера для промивання (50 мМ NaH 2PO4, 300 мМ NaCl, 20 мМ імідазол, pH 8,0) вводили у колонку для промивання смоли так, щоб можна було видалити неспецифічні білки, які затримались на ній. Насамкінець, додавали 20 мл буфера (50 мМ NaH2PO4, 300 мМ NaCl, 250 мМ імідазол, pH 8,0), щоб змити рекомбінантні антигени на смолі; причому імідазол у високій концентрації може конкурувати за сайт зв’язування на смолі з рекомбінантними білками та, таким чином, приводить до змивання рекомбінантних білків. Результат виділення потім оцінювали за допомогою електрофорезу білків. Антигени-кандидати за даним винаходом, зібрані при виділенні, можна потім використовувати для наступних імунних випробувань для підтвердження можливості їх застосування у якості активного інгредієнта субодиничних вакцин проти Mycoplasma spp. Приклад 3. Експерименти з зараження антигенами-кандидати за даним винаходом для перевірки напруженості імунітету У цьому прикладі антигени-кандидати за даним винаходом застосовувались у якості активного інгредієнта для одержання субодиничних вакцин та досліджувались щодо їх імунних ефектів у живих свиней. Одержання вакцин Один виділений рекомбінантний антиген або декілька виділених рекомбінантних антигенів змішували з алюмогелем у якості ад’юванта для одержання субодиничної вакцини або субодиничної вакцини-коктейлю. Об’єм кожної дози одержаної вакцини становив 2 мл, та вага кожного виду антигену, що містився у ній, становила 100 мкг. У наступній таблиці 9 наведено зразки, одержані у цьому прикладі для експериментів з зараження для перевірки напруженості імунітету. Таблиця 9 Зразки вакцин, одержані у прикладі 3 Зразок 1 2 3 4 5 6 7 8 9 30 35 40 45 Активний інгредієнт (антиген) PdhA XylF EutD Mhp145 P78 P132 Mhp389 PdhA + P78 XylF + Mhp145 Експерименти з зараження для перевірки напруженості імунітету проводили із застосуванням Bayovac® MH-PRIT-5 (виготовлений із застосуванням M. hyopneumoniae PRIT-5, у якості групи позитивного контролю), субодиничних вакцин (зразки 1-7 за даним винаходом) та вакцин-коктейлів (зразки 8 та 9 за даним винаходом). 33 SPF свині віком 4 тижні забирали з Дослідного інституту сільськогосподарських технологій (Agricultural Technology Research Institute) та годували однаковим кормом, тримали в однакових умовах навколишнього середовища та умовах росту у свинарнику до експериментів. Після відгодовування свиней до віку 35 днів та 49 днів свиням вводили 2 мл вищезазначеної вакцини шляхом внутрішньом’язової ін’єкції. Експерименти з контрольного зараження Вищезазначених свиней, у яких індукували імунну відповідь, піддавали контрольному зараженню Mycoplasma spp. у віці 109 днів для підтвердження імунного ефекту вищезазначених вакцин. Спершу, легені, зібрані від свиней, інфікованих Mycoplasma spp., подрібнювали у 20 мл середовища Friis та центрифугували при 148,8×g протягом 10 хвилин. Супернатант видаляли у чисту пробірку та знов центрифугували при 7,870×g протягом 40 хвилин. Потім супернатант зливали та осад суспендували у 6 мл середовища Friis з одержанням суспензії. Після цього суспензію послідовно фільтрували за допомогою мембран із розміром пор 5 мкм та 0,45 мкм з 12 UA 115348 C2 5 10 15 20 25 одержанням розчинів із бактеріями, необхідних для експериментів з контрольного зараження. Розчин із бактеріями (5 мл) вводили підданим наркозу свиням через їх трахеї. Через 28 днів після введення свиней умертвляли та розрізали для збору їх легень. Імунний ефект досліджували шляхом огляду легень та записували згідно із наступними критеріями: будь-яку з середніх-верхніх часток та верхніх часток із будь-якого боку легені, у якій спостерігали патологічну ознаку, оцінювали на 10 балів; будь-яку з середньої-верхньої частки та діафрагмальних часток із будь-якого боку легені, у якій спостерігали патологічну ознаку, оцінювали на 5 балів. Повна оцінка складала 55 балів. Записи спостережень наведені на фігурі 4. При порівнянні з результатами у свиней, що не піддавалися ін’єкції, сім антигенівкандидатів за даним винаходом були здатні забезпечувати імунні ефекти, еквівалентні ® традиційній вакцині (Bayovac MH-PRIT-5). Якщо брати до уваги кращу безпеку субодиничних вакцин, вакцини, що містили антигени-кандидати за даним винаходом будуть ще більш цінними. З іншого боку, застосування двох або більш антигенів, які будуть індукувати імунні ефекти, у одній вакцині не було типовим, оскільки два або більше антигенів можуть не забезпечувати подвоєного імунного ефекту. Фактично, існує більша імовірність того, що два або більше антигенів можуть взаємодіяти один з одним або заважати один одному та, отже, знижують імунний ефект вакцини. Згідно із результатом даного прикладу зразок 8 та зразок 9 за даним винаходом (тобто вакцина-коктейль) неочікувано забезпечували значне підвищення імунного ефекту. Це свідчить про те, що субодиничні вакцини за даним винаходом не тільки характеризується високою безпекою, а й також забезпечують кращий імунний ефект, коли антигени-кандидати за даним винаходом застосовують у комбінації. Спеціаліст у даній галузі техніки може легко зрозуміти будь-які можливі модифікації, виходячи з розкриття даного винаходу, без відступу від ідеї даного винаходу. Отже, вищенаведені приклади не слід використовувати для обмеження даного винаходу, а передбачається покриття будь-яких можливих модифікацій у межах ідеї та обсягу даного винаходу згідно із формулою винаходу, наведеною нижче. 13 UA 115348 C2 14 UA 115348 C2 15 UA 115348 C2 16 UA 115348 C2 17 UA 115348 C2 18 UA 115348 C2 19 UA 115348 C2 20 UA 115348 C2 21 UA 115348 C2 22 UA 115348 C2 23 UA 115348 C2 24 UA 115348 C2 25 UA 115348 C2 26 UA 115348 C2 27 UA 115348 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-mycoplasma spp. subunit vaccine
Автори англійськоюLin, Jiunn-Horng, Wang, Jyh-Perng, Hsieh, Ming-Wei, Chen, Zeng-Weng, Fang, Chien-Yu, Liu, Hsueh-Tao, Yang, Ping-Cheng
Автори російськоюЛинь Цзюнь-Хун, Ван Чжи-Пэн, Сэ Мин-Вэй, Чэнь Цзэн-Вэн, Фан Чиэнь-Юй, Лю Сюе-Тао, Ян Пин-Чэн
МПК / Мітки
МПК: C07K 14/30, C12N 15/31, A61K 39/02, C12N 15/62, C12N 15/70
Мітки: композиція, інфекції, mycoplasma, попередження
Код посилання
<a href="https://ua.patents.su/67-115348-kompoziciya-dlya-poperedzhennya-infekci-mycoplasma-spp.html" target="_blank" rel="follow" title="База патентів України">Композиція для попередження інфекції mycoplasma spp.</a>
Попередній патент: Гербіцидні композиції, які містять флуроксипір і флуметсулам
Наступний патент: Лінійний селектор
Випадковий патент: Самоконтряща гайка і засіб її установки