Парентеральна фармацевтична композиція, її застосування та способи лікування або попередження віл-інфекції у людини
Формула / Реферат
1. Парентеральна фармацевтична композиція, яка містить сполуку формули (І)
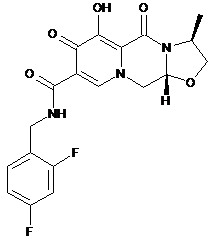 (І)
(І)
або її фармацевтично прийнятну сіль та систему поверхнево-активної речовини, яка містить полісорбат та поліетиленгліколь.
2. Фармацевтична композиція за п. 1 для підшкірного застосування.
3. Фармацевтична композиція за п. 1 для внутрішньом'язового застосування.
4. Фармацевтична композиція за будь-яким із пп. 1-3 для застосування один раз на місяць.
5. Фармацевтична композиція за будь-яким із пп. 1-3 для застосування один раз кожні два місяці.
6. Фармацевтична композиція за будь-яким із пп. 1-3 для застосування один раз кожні три місяці.
7. Фармацевтична композиція за будь-яким із пп. 1-3 для застосування при будь-яких інтервалах 30-365 діб.
8. Фармацевтична композиція за будь-яким із пп. 1-7, де кількість сполуки формули (І) дорівнює, приблизно, 10 мг - 500 мг на мл форми дозування.
9. Фармацевтична композиція за будь-яким із пп. 1-8, де розмір часточок є меншим або дорівнює 200 нм.
10. Фармацевтична композиція за будь-яким із пп. 1-8, де розмір часточок є в діапазоні 0,1-0,5 мкм.
11. Фармацевтична композиція за будь-яким із пп. 1-10, яку можна в кінці стерилізувати гамма-опромінюванням.
12. Спосіб лікування ВІЛ-інфекції в людини, який полягає в застосуванні фармацевтичної композиції за будь-яким із пп. 1-11.
13. Спосіб попередження ВІЛ-інфекції в людини, який полягає в застосуванні фармацевтичної композиції за будь-яким із пп. 1-11.
14. Застосування фармацевтичної композиції за будь-яким із пп. 1-11 у лікуванні або попередженні ВІЛ-інфекції.
Текст
Реферат: Заявлений винахід стосується парентеральних фармацевтичних композицій (3S,11aR)-N-[(2,4дифлуорофеніл)метил]-2,3,5,7,11,11а-гексагідро-6-гідрокси-3-метил-5,7-діоксо-оксазоло[3,2а]піридо[1,2-d]піразин-8-карбоксаміду, корисних у лікуванні або попередженні інфекцій вірусного імунодефіциту людини (ВІЛ), їх застосування та способів лікування або профілактики ВІЛінфекції у людини. UA 108250 C2 (12) UA 108250 C2 UA 108250 C2 5 10 15 20 25 30 35 40 45 У WO 2006/116764 розкрито клас композицій, корисних у лікуванні ВІЛ-інфекції та СНІД. Протягом довгого періоду часу продовжує існувати потреба щодо придатних для лікування фармацевтичних композицій. Ми виявили фармацевтичні композиції (3S,11аR)-N-[(2,4дифлуорофеніл)метил]-2,3,5,7,11,11а-гексагідро-6-гідрокси-3-метил-5,7-діоксо-оксазоло[3,2а]піридо[1,2-d]піразин-8-карбоксаміду, які є довгодіючими та, отже, придатними для застосування до пацієнтів у лікуванні інфекцій ВІЛ. Недодержання пацієнтом режимів є добре відомою, супутньою проблемою щодо комплексного лікування ВІЛ. Недодержання пацієнтом режимів є критичною проблемою в лікуванні ВІЛ, оскільки таке недодержання може призводити до появи багатовікових резистентних деформацій ВІЛ. Заявлений винахід спрямовано на вирішення проблеми недодержання розробкою рецептури (3S,11аR)-N-[(2,4-дифлуорофент)метил]-2,3,5,7,11,11а-гексагідро-6-гідрокси-3-метил5,7-діоксо-оксазоло[3,2-а]піридо[1,2-d]піразин-8-карбоксаміду як довгодіючої парентеральної композиції, придатної для застосування, наприклад, один раз на місяць, один раз кожні 2 місяці, один раз кожні 3 місяці, один раз кожні 6 місяців або один раз кожні 12 місяців. Композиції заявленого винаходу запропоновано для дозування один раз щомісяця або довше, вирішуючи в такий спосіб проблему незгоди пацієнта та навантаження пігулками. Заявлений винахід стосується фармацевтичних композицій (3S, 11aR)-N-[(2,4дифлуорофеніл)метил]-2,3,5,7,11,11а-гексагідро-6-гідрокси-3-метил-5,7-діоксооксазоло[3,2а]піридо[1,2-сІ]піразин-8-карбоксаміду, корисних у лікуванні або попередженні, вірусних інфекцій імунодефіциту людини (ВІЛ). Фігура 1: Профілі концентрація плазми-час сполуки формули (І) в окремого самця або самиці щура після одної підшкірної ін'єкції сполуки формули (І), принаймні, після 74-добового періоду без лікування при номінальній дозі 5, 30, або 100 мг/кг. Фігура 2: Профілі концентрація плазми-час сполуки формули (І) в окремої самиці щура після одної підшкірної ін'єкції сполуки формули (І), принаймні, після 74-добового періоду без лікування при номінальній дозі 5, 30, або 100 мг/кг. Фігура 3: Профілі концентрація плазми-час сполуки формули (І) в окремого самця або самиці щура після одної підшкірної ін'єкції сполуки формули (І), принаймні, після 74-добового періоду без лікування при номінальній дозі 2.5, 10, або 75 мг/кг. Фігура 4: Профілі концентрація плазми-час сполуки формули (І) в окремої самиці щура після одної підшкірної ін'єкції сполуки формули (І), принаймні, після 74-добового періоду без лікування при номінальній дозі 2.5, 10, або 75 мг/кг. (3S,11аR)-N-[(2,4-дифлуорофеніл)метил]-2,3,5,7,11,11а-гексагідро-6-гідрокси-З-метил-5,7діоксо-оксазоло[3,2-а]піридо[1,2-d]піразин-8-карбоксамід, сполука формули (І), також названа сполукою (І), має доказану противірусну активність проти вірусу імунодефіциту людини (ВІЛ). Згідно із заявленим винаходом запропоновано фармацевтичні композиції, які містять активну складову (3S,11аR)-N-[(2,4-дифлуорофеніл)метил]-2,3,5,7,11,11 а-гексагідро-6-гідрокси3-метил-5,7-діоксо-оксазоло[3,2-а]піридо[1,2-d]піразин-8-карбоксамід або його фармацевтично прийнятну сіль, придатну для застосування один раз щомісяця або довше. Подальшою особливістю заявленого винаходу є спосіб застосування цієї фармацевтичної композиції. Згідно із заявленим винаходом запропоновано фармацевтичні композиції, як містять (3S, 11 аR)-N-[(2,4-дифлуорофеніл)метил]-2,3,5,7,11,11а-гексагідро-6-гідрокси-3-метил-5,7-діоксооксазоло[3,2-а]піридо[1,2-d]піразин-8-карбоксамід або його фармацевтично прийнятну сіль та систему поверхнево-активної речовини. 1 UA 108250 C2 5 10 15 20 25 30 35 40 45 50 55 Згідно із заявленим винаходом запропоновано фармацевтичну композицію, яка містить терапевтично ефективну кількість (3S,11аR)-N-[(2,4-дифлуорофеніл)метил]-2,3,5,7,11,11 агексагідро-6-гідрокси-3-метил-5,7-діоксо-оксазоло[3,2-а]піридо[1,2-d]піразин-8-карбоксаміду або його фармацевтично прийнятної солі та систему поверхнево-активної речовини. Фармацевтично прийнятні солі охоплюють, але без обмеження, солі кальцію, магнію, натрію або калію та сольвати, як-то гідрати або алкоголяти. Термін "терапевтично ефективна кількість", як тут застосовано, означає достатню кількість ліків, сполуки, композиції, продукту або фармацевтичного засобу для полегшення, або реверсування, або лікування хвороби в людини, або іншого ссавця. Згідно із заявленим винаходом запропоновано парентеральні фармацевтичні композиції для застосування до суб'єкта, наприклад, людини. Згідно із заявленим винаходом запропоновано довгодіючі парентеральні фармацевтичні композиції, які містять сполуку формули (І) або її фармацевтично прийнятну сіль, та систему поверхнево-активної речовини для застосування один раз щомісяця. Згідно із заявленим винаходом запропоновано довгодіючі парентеральні фармацевтичні композиції, які містять сполуку формули (І) або її фармацевтично прийнятну сіль, та систему поверхнево-активної речовини для застосування один раз на два місяці (один раз кожні два місяці). Згідно із заявленим винаходом запропоновано довгодіючі парентеральні фармацевтичні композиції, які містять сполуку формули (І) або її фармацевтично прийнятну сіль, та систему поверхнево-активної речовини для застосування три рази за три місяці (один раз кожні три місяці). Згідно із заявленим винаходом запропоновано довгодіючі парентеральні фармацевтичні композиції, які містять сполуку формули (І) або її фармацевтично прийнятну сіль, та систему поверхнево-активної речовини для застосування один раз кожні шість або дванадцять місяців, або в будь-який момент часу в межах цього періоду. Згідно із заявленим винаходом запропоновано композиції для повільного вивільнення сполуки формули (І). Отже, щоб досягати терапевтичних рівнів ліків, сполуку формули (І) переважно вивільнено з композиції приблизно, у межах від одного до трьох місяців, або в будьякий момент часу в межах цього періоду. Утілення заявленого винаходу - фармацевтична композиція, придатна до парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовин, яка містить комбінацію полімерів, які забезпечують вивільнення сполуки формули (І) протягом періоду від одного до трьох місяців. Придатною комбінацією полімерів є, наприклад, полісорбат 20 та поліетиленгліколь (PEG) 3350. Придатна комбінація полімерів, тобто засіб зволожування та стабілізатор, потрібен для створення стабільної суспензії. Засоби зволожування можна вибирати із класу неіонних та аніонних поверхнево-активних речовин. Типові приклади засобів зволожування охоплюють похідні поліоксиетилен-рицинової олії, поліоксиетилен-етери сорбіту та жирної кислоти (полісорбат), етери сорбіту та жирних кислот (SPAN), полоксамери, як-то LUTROL™ F68, F108 та F127, які є блокспівполімерами етиленоксиду та пропіленоксиду, натрій додецилсульфат та натрій лаурилсульфат. Типові стабілізатори охоплюють, але без обмеження, наступне: поліетиленгліколі, кальцій карбоксиметилцелюлоза, натрій карбоксиметилцелюлоза, метилцелюлоза, гідроксиетилцелюлоза, гідроксипропілцелюлоза, гідроксиметилпропілцелюлоза, полісахариди, гіалуронова кислота, полівініловий спирт (PVA) та полівінілпіролідон (PVP). Приклад комбінації полімерів охоплює наступне: полісорбат, наприклад, полісорбат 20 або полісорбат 60, як засіб зволожування, та поліетиленгліколь (PEG), наприклад, PEG 3350, PEG4000 або PEG8000, як стабілізатор. Згідно із заявленим винаходом запропоновано парентеральну фармацевтичну композицію, як містить сполуку формули (І), або її фармацевтично прийнятну сіль та полісорбат 20, та поліетиленгліколь (PEG) 3350. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, яка може бути наноподрібненою до 200 нМ. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, яка може бути наноподрібненою до 200 нМ менше ніж за 10 год. на кульовому млині. 2 UA 108250 C2 5 10 15 20 25 30 35 40 45 50 55 60 Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, середній розмір часточок яких можна довести до 0,1-1.0 мкм. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, середній розмір часточок яких можна довести до 0,1-0,5 мкм або 0,2-0,4 мкм. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, середній розмір часточок яких можнадовести до 0,1-1.0 мкм, застосовуючи вологий помел на кульовому млині. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, середній розмір часточок яких можна довести до 0,1-1.0 мкм, застосовуючи технологію помелу під високим тиском, як-то мікрофлюїдизатор або інший тип ротор-статорного помелу або вихровий млин. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, придатну для загально відомих технологій стерилізації, як-то гама-опромінювання, опромінювання електронним променем та стерилізація в автоклаві. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, яку можна зробити, застосовуючи асептичну техніку. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, придатну для стерилізації гама-опромінюванням. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яка містить сполуку формули (І) та систему поверхнево-активної речовини, придатну для технологій стерилізації опромінюванням електронним променем або стерилізацією в автоклаві. Утілення заявленого винаходу - фармацевтична композиція для парентерального застосування, яку можна представляти як "готову до застосування" стерильну суспензію або ліофільну для відновлення вологовмісту. Звичайно фармацевтичні композиції заявленого винаходу містять 0,1-50 % за масою сполуки формули (І). Звичайно фармацевтичні композиції заявленого винаходу містять 0,1-5 % полісорбату 20, як поверхнево-активної речовини, та 0,1-5 % поліетиленгліколю. Фармацевтичні композиції заявленого винаходу можуть містити 0,1-10 % полісорбату 20, як поверхневоактивної речовини, та 0,1-10 % поліетиленгліколю. Композиції заявленого винаходу можна застосовувати підшкірною або внутрішньом'язовою ін'єкцією. Композиції заявленого винаходу можна застосовувати інтрадермальною або інтравентрикулярною ін'єкцією, або імплантатом. Композиції заявленого винаходу можна застосовувати іншими парентеральними шляхами застосування. Отримання композицій заявленого винаходу можна робити помелом, застосовуючи вологий помел на кульовому млині та стерилізувати гама-опромінюванням. Ще одною особливістю заявленого винаходу є спрощення режимів лікування ВІЛ із метою підсилення дотримання хворим режиму лікування забезпеченням спрощеної форми дозування, яка містить терапевтично ефективні кількості сполуки формули (І) або її фармацевтично прийнятної солі. Згідно із заявленим винаходом також запропоновано спосіб лікування ВІЛ-інфекцій у людини, цей спосіб полягає в застосуванні до названої людини композиції згідно з винаходом. Згідно із заявленим винаходом запропоновано застосування фармацевтичної композиції згідно з винаходом у лікуванні інфекцій ВІЛ. Згідно із заявленим винаходом запропоновано виготовлення медикаменту згідно з винаходом для застосування в медичному лікуванні. Згідно із заявленим винаходом також запропоновано спосіб лікування ВІЛ-інфекцій у людини, цей спосіб полягає в застосуванні до названої людини композиції згідно з винаходом перед, протягом, або після лікування сполукою формули (І) у формі таблетки або розчину. Спеціаліст у рівні техніки розуміє, що посилання щодо терміну "лікування" розповсюджується на лікування встановленої хвороби, інфекції або її симптомів. Згідно із заявленим винаходом також запропоновано спосіб попередження ВІЛ-інфекцій у людини, цей спосіб полягає в застосуванні до названої людини композиції згідно з винаходом. Згідно із заявленим винаходом запропоновано застосування фармацевтичної композиції згідно 3 UA 108250 C2 5 10 15 20 25 30 35 40 45 50 55 з винаходом у попередженні інфекцій ВІЛ. Згідно із заявленим винаходом запропоновано виготовлення медикаменту згідно з винаходом для застосування в профілактичному медичному лікуванні. Згідно із заявленим винаходом також запропоновано спосіб лікування або попередження ВІЛ-інфекцій у людини, цей спосіб полягає в застосуванні до названої людини композиції згідно з винаходом перед, протягом, або після лікування сполукою формули (І) у формі таблетки або розчину. Способи отримання сполуки формули (І) описано в WO 2006/116764, WO2010/011814, WO2010/068262, та WO2010/068253, які охоплено тут посиланням. Фармацевтичні композиції винаходу надано як фармацевтичні композиції, придатні для парентерального застосування. Композиції також можуть охоплювати безпечну та ефективну кількість інших активних складових, як-то протимікробні засоби, противірусні засоби або консерванти. Спеціаліст у рівні техніки розуміє, що кількість активних складових, потрібних для застосування в лікуванні слід змінювати згідно зі зміною факторів, охоплюючи сутність стану, який лікують, вік та стан пацієнта, та, зрештою, слід залежати від розсуду лікаря, ветеринарного лікаря або турботи практикуючого лікаря про здоров'я. Композиції заявленого винаходу надають можливість більшої свободи пацієнтам режимами складеного дозування та полегшують ретельність, потрібну для запам'ятовування часів комплексу добового дозування та режимів. Композиції заявленого винаходу, зокрема, є придатними для застосування наступним чином: одноразова доза щомісяця, один раз на два місяці або три місяці, або при будь-яких інтервалах за період 30 - 365 діб, охоплюючи кожні шість або дванадцять місяців. Переважно, композиції заявленого винаходу можна застосовувати один раз на місяць. Композиції заявленого винаходу дозволяють легке застосування в одиничній формі дозування, яке полягає в наступному: наприклад, приблизно, 1 мг - 800 мг, 100 мг – 800 мг сполуки формули (І), та, приблизно, 100 мг - 600 мг або, приблизно, 100 мг - 400 мг на одиничну форму дозування. Композиції заявленого винаходу можна застосовувати в комбінації з іншими фармацевтичними композиціями як складовою режиму лікування множинними ліками. Композиції заявленого винаходу також можна пакувати як виріб, який містить терапевтично ефективну кількість сполуки формули (І), або її фармацевтично прийнятної солі; та терапевтично ефективну кількість одного або більше з наступного: інгібітор нуклеозид-зворотної транскриптази, неінгібітор нуклеозид-зворотної транскриптази, інгібітор протеази, інгібітор інтегрази. Прикладом неінгібітору нуклеозид-зворотної транскриптази є рилпівірин гідрогенхлорид (ТМС-278). Пакувальний матеріал також може мати маркування та надруковану на ньому інформацію стосовно фармацевтичної композиції. Крім того, виріб може містити брошуру, повідомлення, попередження, інструкцію або листочок, які містять інформацію про продукт. Цю. форму фармацевтичної інформації найменовано у фармацевтичній промисловості як "листівкавкладиш". Листівку-вкладиш можна прикріплювати до або розміщувати з фармацевтичним виробом. Листівка-вкладиш та будь-яке маркування виробу надає інформацію стосовно фармацевтичної композиції. Інформація та маркування надає різні форми інформації, застосовані спеціалістами охорони здоров'я та пацієнтами, описуючи композицію, її дозування та різні інші характеристики, потрібні органам державного регулювання, як-то United States Food та Drug Agencies. Згідно із заявленим винаходом далі запропоновано наступні втілення: (a) Парентеральна фармацевтична композиція, яка містить ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі, для довгого строку лікування ВІЛ-інфекції або попередження ВІЛ-інфекції в особи при ризику інфікування ВІЛ, де композицію застосовано з інтервалами, принаймні, один тиждень. (b) Композиція за п. (а), де композицію застосовано один раз кожні два тижні. (c) Композиція за п. (а), де композицію застосовано один раз кожний місяць. (d) Композиція за будь-яким із п, п, (а) - (с), де ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі вибрано таким чином, що концентрацію плазми крові сполуки формули (І) в суб'єкта втримувалась протягом тривалого періоду часу на рівні між максимальним рівнем плазми крові, котрий є рівнем плазми крові, який спричиняє значні побічні дії, та мінімальним рівнем плазми крові, котрий є найнижчим рівнем плазми крові, при якому сполука формули (І) забезпечує ефективне лікування або попередження ВІЛ-інфекції. 4 UA 108250 C2 5 10 15 20 25 30 35 40 45 50 55 (e) Композиція за п. (d), де рівень плазми крові суб'єкта втримано на рівні, який дорівнює або вище, приблизно, 150 нг/мл, зокрема, який дорівнює або вище, приблизно, 600 нг/мл. (f) Композиція за будь-яким із пп. (а) - (e), де композицію застосовано підшкірно або внутрішньом'язово. (d) Композиція за будь-яким із пп. (а) - (f), яка містить указану вище систему поверхневоактивної речовини, яка містить полісорбат та /або поліетиленгліколь. (h) Спосіб лікування або попередження ВІЛ-інфекції в людини, який охоплює застосування фармацевтичної композиції за будь-яким з указаних вище пп. (а) - (d). Застосовувану дозу сполуки формули (І), як є кількістю сполуки (І) у парентеральній композиції для застосування згідно з винаходом, можна вибирати таким чином, щоб концентрацію плазми крові сполуки (І) у суб'єкта втримано протягом тривалого періоду часу вище мінімального рівня плазми крові. Термін "мінімальний рівень плазми крові" (або С мін) у цьому контексті стосується найнижчого ефективного рівня плазми крові, який дорівнює рівню плазми крові сполуки (І), який забезпечує ефективне попередження або лікування ВІЛ-інфекції. У випадку передачі ВІЛ від суб'єкта, інфікованого ВІЛ до неінфікованого ВІЛ суб'єкта, це є найнижчим рівнем плазми крові, який є ефективним для перешкоджання названій передачі. Рівень плазми крові сполуки (І) у суб'єкта можна втримувати на рівні вище мінімального рівня плазми крові, приблизно, 170 нг/мл, приблизно, 700 нг/мл, або приблизно, 1000 нг/мл. Рівні плазми крові сполуки (І) у суб'єкта можна втримувати вище цих мінімальних рівнів плазми крові, оскільки при нижчих рівнях ліки не можуть довше бути ефективними, таким чином підвищуючи ризик передачі ВІЛ-інфекції, та можуть бути субоптимальними для лікування ВІЛінфікованих суб'єктів. Рівні плазми сполуки (І) можна втримувати на вищих рівнях для запобігання розвитку ВІЛ-мутацій, підтримуючи запас безпечності. Перевагою способу застосування сполуки (І) є те, що високих рівнів С мін можна досягати без відповідних високих Смакс, що могло б пом'якшити потенціал побічних дій, асоційованих з Смакс. Ефективну кількість сполуки (І) для застосування можна вибирати таким чином, щоб концентрації плазми крові в суб'єкта втримано протягом тривалого періоду часу на рівні між максимальним рівнем плазми (або Смакс) та мінімальним рівнем плазми крові (або Смін)· У деяких утіленнях рівень плазми крові сполуки (І) у суб'єкта можна втримувати між мінімальним рівнем плазми крові (або С мін як указано вище) та нижчим максимальним рівнем плазми сполуки (І) (або Смакс) який визначено як рівень, який відповідає найнижчому рівню плазми крові, де сполука (І) діє терапевтично. Найнижчий рівень, де сполука (І) діє терапевтично, є найнижчим рівнем плазми крові, який є ефективним для затримки реплікації ВІЛ у суб'єктів, інфікованих ВІЛ, внаслідок чого вірусне навантаження ВІЛ є відносно невеликим, наприклад, де вірусне навантаження (представлене як число копій вірусної РНК у конкретному об'ємі сироватки), приблизно, є нижчим 200 копій/мл, зокрема, приблизно, нижчим 100 копій/мл, конкретніше - нижче 50 копій/мл, конкретно - нижче межи виявлення аналізу на ВІЛ. Як указано вище, рівні плазми крові сполуки (І) залежать від кількості активної складової в кожному застосованому парентеральному дозуванні. Однак, це також залежить від частоти застосувань (тобто, інтервалу часу між кожним застосуванням). Обидва параметри можна застосовувати, щоб спрямовувати рівні плазми крові до бажаних величин. Доза може бути вищою, де застосування є менш частим. Хоч рівні плазми сполуки (І) слід утримувати нижче максимальної або вище мінімальної величини, вони можуть перевершувати максимальну величину або падати нижче мінімальної величини протягом відносно коротких періодів часу, який може бути найкоротшим. Отже, максимальні та мінімальні рівні плазми можна зображувати як середні рівні плазми протягом певного періоду часу. В окремих випадках вихідний пік концентрації плазми може бути малим незабаром після застосування та після досягнення рівнями плазми постійного стану. Дозу для застосування можна розраховувати на базі, приблизно, 1 мг/добу - 50 мг/добу, краще - 3 мг/добу - ЗО мг/добу. Це відповідає тижневій дозі, приблизно, 7 мг -350 мг, краще, приблизно, 20 мг - 200 мг, або місячній дозі, приблизно, 30 мг - 1500 мг, краще, приблизно, 90 мг - 900 мг. Дози для інших режимів дозування можна легко розрахувати множенням добової дози на число діб між кожним застосуванням. Дозу для застосування можна розраховувати на базі, приблизно, 0,001 мг/кг//добу - 1 мг/кг/добу, краще - 0,05 мг/кг/добу - 0,5 мг/кг/добу. Це відповідає тижневій дозі, приблизно, 0,5 мг - 500 мг, краще, приблизно, 20 мг - 200 мг, або місячній дозі, приблизно, 30 мг - 1500 мг, краще, приблизно, 90 мг - 900 мг. Дози для інших режимів дозування можна легко розрахувати множенням добової дози на число діб між кожним застосуванням. 5 UA 108250 C2 5 10 15 20 25 30 35 40 45 50 Один раз відрегульовані рівні плазми крові сполуки (І) у суб'єкта можуть бути більш або менш стабільними. Після вихідного зростання рівнів плазми крові стійкого стану можна досягати протягом тривалого періоду часу. Під "стійким станом" мають на увазі стан, при якому кількість ліків, присутніх у плазмі крові суб'єкта, утримується на більш або менш однаковому рівні протягом тривалого періоду часу. Рівні плазми сполуки (І) потім можуть поступово із часом зменшуватися, та при досягненні мінімального рівня плазми можна застосовувати наступну дозу сполуки (І). Термін "утримується на більш або менш однаковому рівні" не вилучає те, що можуть бути малі коливання концентрацій плазми в прийнятному діапазоні, наприклад, у межах, приблизно, 30 %, приблизно, 20 %, або, приблизно, 10 %. Парентеральні композиції сполуки (І) можна застосовувати внутрішньовенною ін'єкцією або краще підшкірним або внутрішньом'язовим застосуванням. Заявлений винахід базовано на застосуванні парентеральних композицій активної складової сполуки (І) та, отже, природу носія вибрано для придатності до парентерального застосування. Носій у більшості випадків містять стерильну воду, хоча можна охоплювати інші складові, наприклад, для розчинності. Розчини для ін'єкції або суспензії, наприклад, можна отримувати з носієм, який містить фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину та розчину глюкози. Далі носій може містити згадану вище систему поверхнево-активної речовини, як-то полісорбат та поліетиленгліколь. Парентеральна фармацевтична композиція яка містить сполуку (І) заявленого винаходу є довгодіючою. Відповідно, композиція є корисною для лікування або попередження ВІЛ-інфекції із застосуванням протягом довгих інтервалів часу в порівнянні зі звичайними композиціями або іншими сполуками з хімічною структурою, подібною до структури сполуки (І). Композиції заявленого винаходу можна застосовувати до пацієнта з інтервалами, наприклад, один раз на тиждень, один раз на місяць, один раз кожні 2 місяці, або один раз кожні 3 місяці. Отже, композиції заявленого винаходу та їх застосування підшкірною (ПШ) або внутрішньом'язовою (ВМ) ін'єкцією при тих самих способах застосування призводять до дивовижного зниження медикаментозного (пігулка) навантаження або важкості щодо додержання пацієнтом режиму. Крім того, таке переміжне застосування композиції заявленого винаходу може сприяти підтриманню лікування при відповідному додержанні, що призводить до попередження появи резистентності до ліків ВІЛ та підтримання ефективності лікування протягом подовженого періоду часу. ПРИКЛАДИ У наступних прикладах описано та продемонстровано конкретні втілення в межах заявленого винаходу. Приклади надано виключно для ілюстрації, та вони не обмежують багато варіантів, які є вірогідними без відхилення від змісту та межи винаходу. Приклад 1; фармацевтична композиція Спосіб виробництва Сполуку формули (І), манітол, полісорбат 20, PEG 3350, та воду для ін'єкції змішували та мололи, застосовуючи вологий помел на кульовому млині. Отриману суспензію завантажували в 3 мл скляні пробірки USP Туре І із повним об'ємом 1.5 мл, пробірки закупорювали та герметизували, і потім стерилізували гама-опромінюванням. Приклад 2: розмір часточок Зразок суспензії сполуки формули (І) для ін'єкції, отриманий способом, який описано в прикладі 1, опромінювали гама-опромінюванням дозою 29.9-31.5 кГр. Час помелу був 5 год. Розмір часточок, визначений способом лазерної дифракції, був наступним: Х10=75нм Х50=157 нм Х90=646 нм X 50 досягав менше 200 нм. Приклад 3: гама-опромінювання 6 UA 108250 C2 5 10 15 20 25 Зразок суспензії сполуки формули (І) для ін'єкції, отриманої способом, який описано в прикладі 1, опромінювали гама-опромінюванням дозою 29.9-31.5 кГр. Зразки до гамаопромінювання та після гама-опромінювання тестували щодо забруднень ліків способом ВЕРХ. Загальні забруднення ліків, %площа /площа До гама-опромінювання 0,19 Після гама-опромінювання 0,16 Композиція є стабільною після гама-опромінювання. Приклад 4: спосіб виробництва при застосуванні мікрофлюїдизаатору високого тиску Спосіб виробництва Сполуку формули (І), манітол, полісорбат 20, PEG 3350, та воду для ін'єкції змішували та мікрофлюїдизували, застосовуючи Microfluidizer M-110P. Суспензію пропускали через камеру взаємодії (G10Z) з мінімальним внутрішнім розміром 87 мкм, та після 50 проходжень досягали розміру часточок, яку наведено нижче: Х10=82нм Х50=221 нм Х90=726 нм Приклад 5: фармакокінетика в щура Сполуку формули (І) один раз надавали самицям та самцям щурів (10/ стать/група) при 0 (наповнювач), 5, 30, або 100 мг/кг підшкірною ін'єкцією (ПШ), або 0 (наповнювач), 2,5, 10, або 75 мг/кг внутрішньом'язовою ін'єкцією (ВМ). Після дозування щурів утримували без лікування st протягом періоду 75-76-діб (ПШ, охоплюючи 1 5 контроль щури/стать) або 84-85-діб (ВМ, останній 5 контроль щури/стать; ВМ). Щурів із контролем наповнювачем піддавали ін'єкціям ПШ та ВМ. На фіг. 1-4 зображено профілі концентрація плазми - час залежно від способу застосування та статі. ФОРМУЛА ВИНАХОДУ 30 1. Парентеральна фармацевтична композиція, яка містить сполуку формули (І) OH O O N O N O H NH F F 35 40 (І) або її фармацевтично прийнятну сіль та систему поверхнево-активної речовини, яка містить полісорбат та поліетиленгліколь. 2. Фармацевтична композиція за п. 1 для підшкірного застосування. 3. Фармацевтична композиція за п. 1 для внутрішньом'язового застосування. 4. Фармацевтична композиція за будь-яким із пп. 1-3 для застосування один раз на місяць. 5. Фармацевтична композиція за будь-яким із пп. 1-3 для застосування один раз кожні два місяці. 6. Фармацевтична композиція за будь-яким із пп. 1-3 для застосування один раз кожні три місяці. 7 UA 108250 C2 5 10 15 7. Фармацевтична композиція за будь-яким із пп. 1-3 для застосування при будь-яких інтервалах 30-365 діб. 8. Фармацевтична композиція за будь-яким із пп. 1-7, де кількість сполуки формули (І) дорівнює, приблизно, 10-500 мг на мл форми дозування. 9. Фармацевтична композиція за будь-яким із пп. 1-8, де розмір часточок є меншим або дорівнює 200 нм. 10. Фармацевтична композиція за будь-яким із пп. 1-8, де розмір часточок є в діапазоні 0,1-0,5 мкм. 11. Фармацевтична композиція за будь-яким із пп. 1-10, яку можна в кінці стерилізувати гаммаопромінюванням. 12. Спосіб лікування ВІЛ-інфекції в людини, який полягає в застосуванні фармацевтичної композиції за будь-яким із пп. 1-11. 13. Спосіб попередження ВІЛ-інфекції в людини, який полягає в застосуванні фармацевтичної композиції за будь-яким із пп. 1-11. 14. Застосування фармацевтичної композиції за будь-яким із пп. 1-11 у лікуванні або попередженні ВІЛ-інфекції. 8 UA 108250 C2 9 UA 108250 C2 10 UA 108250 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions
Автори англійськоюMundhra, Deepak B., Pan, Rennan
Автори російськоюМундхра Дипак Б., Пэн Реннан
МПК / Мітки
МПК: A61K 47/30, A61P 31/18, A61K 31/4985
Мітки: віл-інфекції, попередження, фармацевтична, людини, способи, лікування, парентеральна, застосування, композиція
Код посилання
<a href="https://ua.patents.su/13-108250-parenteralna-farmacevtichna-kompoziciya-zastosuvannya-ta-sposobi-likuvannya-abo-poperedzhennya-vil-infekci-u-lyudini.html" target="_blank" rel="follow" title="База патентів України">Парентеральна фармацевтична композиція, її застосування та способи лікування або попередження віл-інфекції у людини</a>
Попередній патент: Протимікробна мембрана
Наступний патент: Гербіцидні композиції
Випадковий патент: Зонд для вихорострумового контролю та спосіб його виконання












