Ізольоване антитіло, яке зв’язує моноцитний хемоатрактантний білок 1 (мср-1) людини
Номер патенту: 97232
Опубліковано: 25.01.2012
Автори: Дас Анук, Бардрофф, Міхаель, Цуі, Пінг, Світ, Реймонд
Формула / Реферат
1. Ізольоване антитіло, що зв’язує моноцитний хемоатрактантний білок 1 (МСР-1) людини, яке включає варіабельну ділянку важкого ланцюга SEQ ID NO: 27 та варіабельну ділянку легкого ланцюга SEQ ID NO: 28.
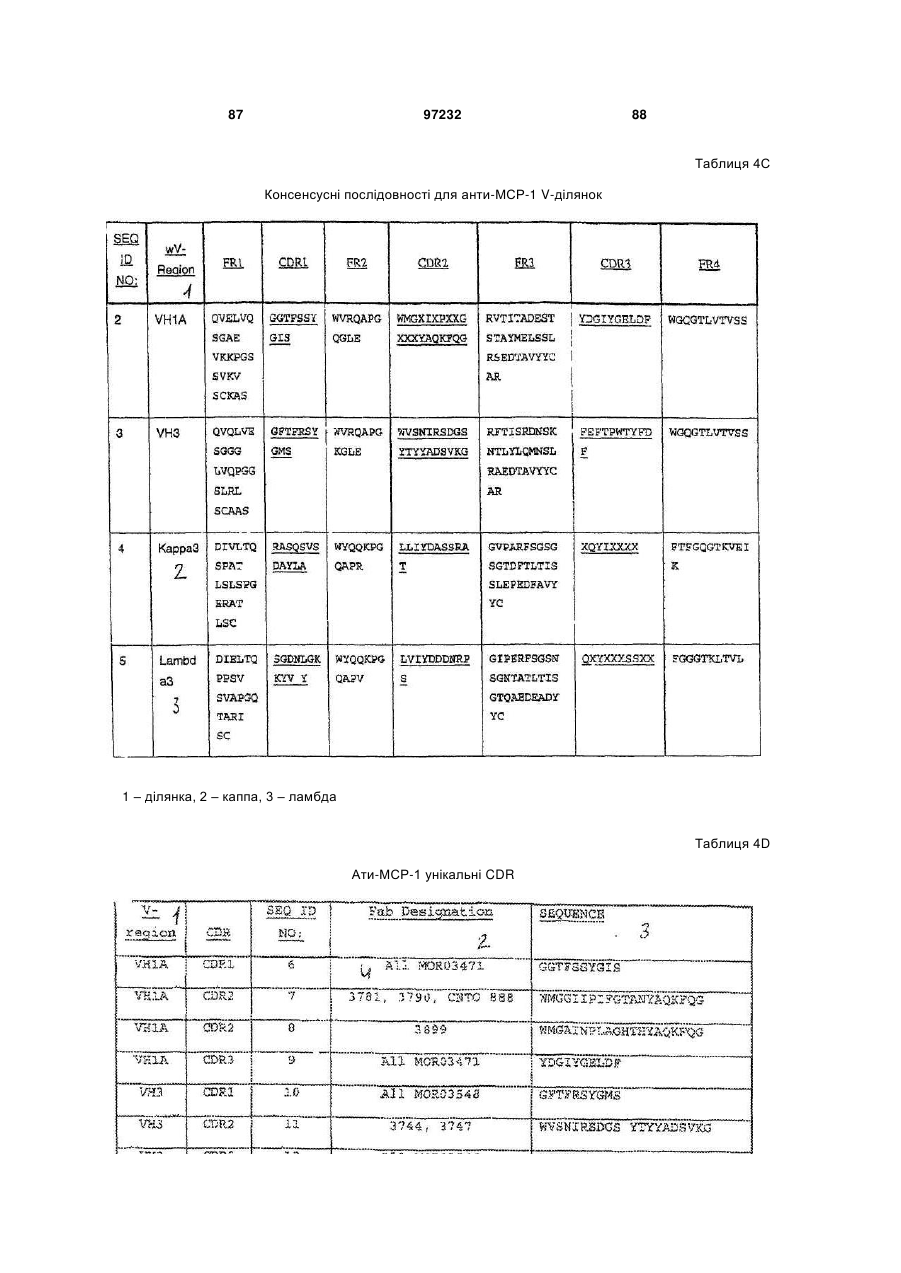
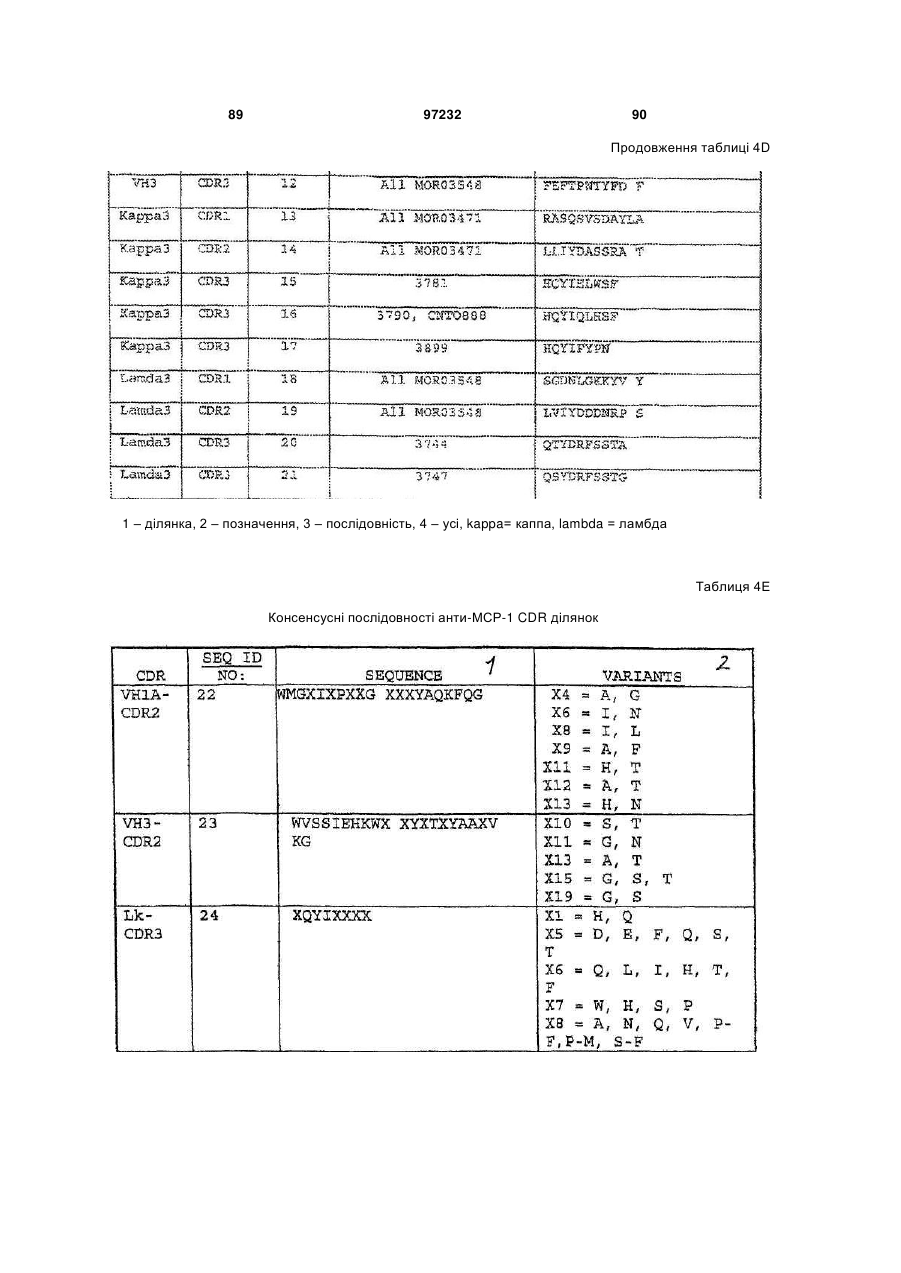
2. Ізольоване антитіло, що зв’язує МСР-1 людини, яке включає варіабельну ділянку важкого ланцюга та варіабельну ділянку легкого ланцюга, де варіабельна ділянка важкого ланцюга містить амінокислотні послідовності гіперваріабельних ділянок (CDR) важкого ланцюга SEQ ID NOs: 6, 7 та 9 та амінокислотні послідовності CDR легкого ланцюга SEQ ID NOs: 13, 14 та 16.
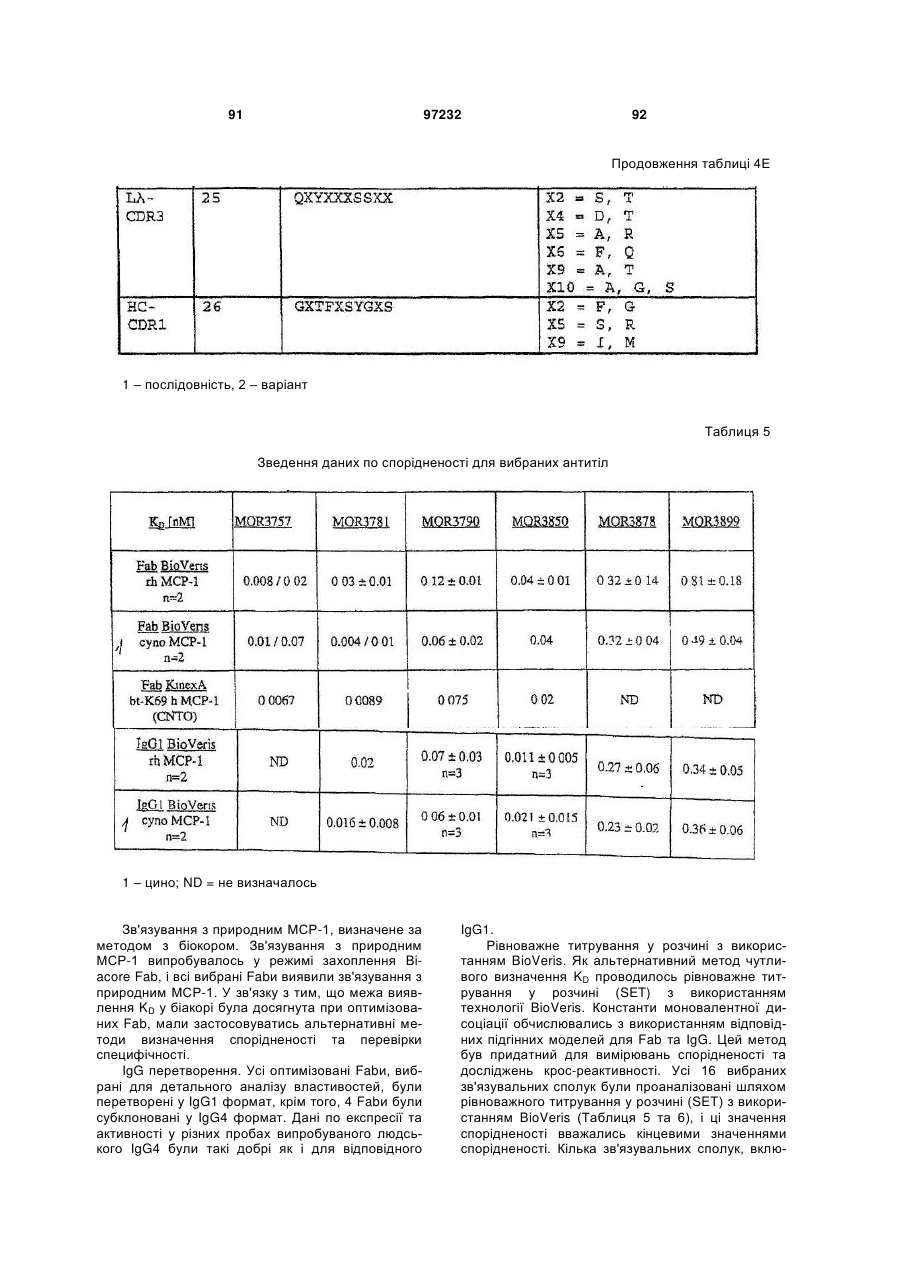
3. Антитіло за п. 1 або 2, яке відрізняється тим, що зв’язує МСР-1 людини з афінністю між 10-9 М та 10-12 М.
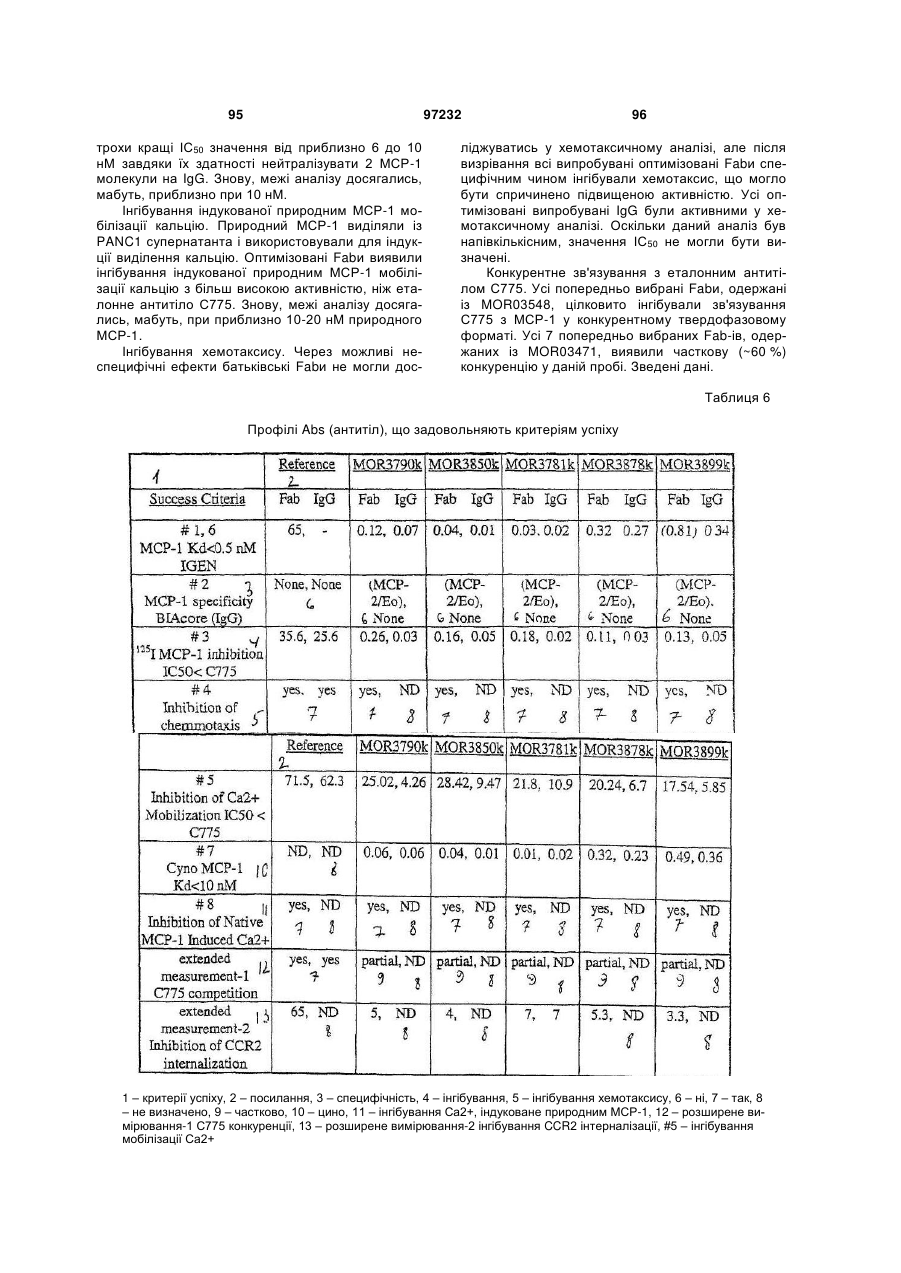
4. Антитіло за п. 1, яке відрізняється тим, що змінює біологічну активність МСР-1 людини у значній мірі, що вибрано з групи, яка містить зменшення, збільшення, антагонізм, агонізм, послаблення, пом’якшення, блокування, інгібування, відміну та втручання в активність МСР-1 поліпептиду.
5. Фармацевтична композиція, яка включає ізольоване МСР-1 антитіло за п. 1 та фармацевтично прийнятний носій або розріджувач.
6. Композиція за п. 5, яка відрізняється тим, що додатково включає сполуку або поліпептид, котрі вибрано з групи, що містить виявлювану мітку або репортер, TNF-антагоніст, протиінфекційні ліки, серцево-судинні (CV) системні ліки, ліки для центральної нервової системи (CNS), ліки для вегетативної нервової системи (ANS), ліки для респіраторного тракту, ліки для шлунково-кишкового тракту (GI), гормональні ліки, ліки для флюїдного або електролітного балансу, гематологічні ліки, протипухлинні ліки, імуномодуляторні ліки, очні, вушні або назальні ліки, ліки місцевого призначення, ліки, пов’язані з харчуванням, цитокін або цитокіновий антагоніст.
7. Спосіб для продукування ізольованого антитіла МСР-1 ссавця згідно з будь-яким із пп. 1-4, що включає запровадження клітини-хазяїна або трансгенної тварини, або трансгенної рослини, або рослинної клітини, котрі здатні експресуватись у відтворюваних кількостях даного антитіла.
8. Застосування антитіла за п. 1 або 2 для лікування МСР-1 залежних розладів.
9. Застосування за п. 8, яке відрізняється тим, що розлад вибрано з групи, що містить легеневі розлади та такі види раку, як рак простати, рак грудей та рак яєчників.
10. Антитіло, що зв’язує моноцитний хемоатрактантний білок-1 (МСР-1) людини, яке включає наступну послідовність варіабельної ділянки важкого ланцюга: QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYGISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARYDGIYGELDFWGQGTLVTVSS; та наступну послідовність варіабельної ділянки легкого ланцюга: EIVLTQSPATLSLSPGERATLSCRASQSVSDAYLAWYQQKPGQAPRLLIYDASSRATGVPARFSGSGSGTDFTLTISSLEPEDFAVYYCHQYIQLHSFTFGQGTKVEIK.
Текст
1. Ізольоване антитіло, що зв’язує моноцитний хемоатрактантний білок 1 (МСР-1) людини, яке включає варіабельну ділянку важкого ланцюга SEQ ID NO: 27 та варіабельну ділянку легкого ланцюга SEQ ID NO: 28. 2. Ізольоване антитіло, що зв’язує МСР-1 людини, яке включає варіабельну ділянку важкого ланцюга та варіабельну ділянку легкого ланцюга, де варіабельна ділянка важкого ланцюга містить амінокислотні послідовності гіперваріабельних ділянок (CDR) важкого ланцюга SEQ ID NOs: 6, 7 та 9 та амінокислотні послідовності CDR легкого ланцюга SEQ ID NOs: 13, 14 та 16. 3. Антитіло за п. 1 або 2, яке відрізняється тим, -9 що зв’язує МСР-1 людини з афінністю між 10 М -12 та 10 М. 4. Антитіло за п. 1, яке відрізняється тим, що змінює біологічну активність МСР-1 людини у значній мірі, що вибрано з групи, яка містить зменшення, збільшення, антагонізм, агонізм, послаблення, пом’якшення, блокування, інгібування, відміну та втручання в активність МСР-1 поліпептиду. 5. Фармацевтична композиція, яка включає ізольоване МСР-1 антитіло за п. 1 та фармацевтично прийнятний носій або розріджувач. 6. Композиція за п. 5, яка відрізняється тим, що додатково включає сполуку або поліпептид, котрі вибрано з групи, що містить виявлювану мітку або репортер, TNF-антагоніст, протиінфекційні ліки, серцево-судинні (CV) системні ліки, ліки для центральної нервової системи (CNS), ліки для вегетативної нервової системи (ANS), ліки для респіраторного тракту, ліки для шлунково-кишкового UA (21) a200713135 (22) 19.05.2006 (24) 25.01.2012 (86) PCT/US2006/019627, 19.05.2006 (31) 60/682,654 (32) 19.05.2005 (33) US (31) 60/682,620 (32) 19.05.2005 (33) US (46) 25.01.2012, Бюл.№ 2, 2012 р. (72) ДАС, АНУК, GB/US, СВІТ, РЕЙМОНД, US, ЦУІ, ПІНГ, US, БАРДРОФФ, МІХАЕЛЬ, DE (73) ЦЕНТОКОР, ІНК., US (56) WO 0202640 A2, 10.01.2002. WO 2004016769 A2, 26.02.2004. WO 2004024921 A1, 25.03.2004. EP 1538207 A1, 08.06.2005. WO 03048083 A2, 12.06.2003. KESAVAN PRABAKARAN ET AL: "Anti-CCL-2/MCP1 (monocyte chemoattractant protein-1) monoclonal antibodies effectively inhibit tumor angiogenesis and growth of human breast carcinoma." PROCEEDINGS OF THE AMERICAN ASSOCIATION FOR CANCER RESEARCH ANNUAL MEETING, vol. 46, April 2005 (2005-04), page 254, XP002557496 & 96TH ANNUAL MEETING OF THE AMERICANASSOCIATION-FOR-CANCER-RESEARCH; ANAHEIM, CA, USA; APRIL 16 -20, 2005 ISSN: 0197016X (ABSTRACT). TSUI PING ET AL: "Generation, characterization and biological activity of CCL2 (MCP-1/JE) and CCL12 (MCP-5) specific antibodies" HUMAN ANTIBODIES, IOS PRESS, AMSTERDAM, NL, vol. 16, no. 3-4, 1 January 2007 (2007-01-01), pages 117-125, XP009101113 ISSN: 1093-2607 (ABSTRACT). PERI G ET AL: "A new monoclonal antibody (5D3-F7) which recognizes human monocyte-chemotactic protein-1 but not related chemokines. Development of a sandwich ELISA and in situ detection of producing cells" JOURNAL OF IMMUNOLOGICAL METHODS, ELSEVIER SCIENCE PUBLISHERS B.V.,AMSTERDAM, NL, vol. 174, no. 1-2, 14 Sep 2 (19) 1 3 97232 4 тракту (GI), гормональні ліки, ліки для флюїдного або електролітного балансу, гематологічні ліки, протипухлинні ліки, імуномодуляторні ліки, очні, вушні або назальні ліки, ліки місцевого призначення, ліки, пов’язані з харчуванням, цитокін або цитокіновий антагоніст. 7. Спосіб для продукування ізольованого антитіла МСР-1 ссавця згідно з будь-яким із пп. 1-4, що включає запровадження клітини-хазяїна або трансгенної тварини, або трансгенної рослини, або рослинної клітини, котрі здатні експресуватись у відтворюваних кількостях даного антитіла. 8. Застосування антитіла за п. 1 або 2 для лікування МСР-1 залежних розладів. 9. Застосування за п. 8, яке відрізняється тим, що розлад вибрано з групи, що містить легеневі роз лади та такі види раку, як рак простати, рак грудей та рак яєчників. 10. Антитіло, що зв’язує моноцитний хемоатрактантний білок-1 (МСР-1) людини, яке включає наступну послідовність варіабельної ділянки важкого ланцюга: QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYGISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARYDGIYGELDFWGQGTLVTVSS; та наступну послідовність варіабельної ділянки легкого ланцюга: EIVLTQSPATLSLSPGERATLSCRASQSVSDAYLAW YQQKPGQAPRLLIYDASSRATGVPARFSGSGSGTD FTLTISSLEPEDFAVYYCHQYIQLHSFTFGQGTKVEI K. Дана заявка оголошує пріоритет попередніх патентних заявок США за серійними номерами 60/682654 та 60/682620 від 19 травня 2005 року, на які зроблено повне посилання. Даний винахід стосується антитіл, включаючи визначені частини або варіанти, специфічні щодо принаймні одного моноцитного хемоатрактантного білка-1 (МСР-1) білка людини або його фрагмента, так само як і анти-ідіотипних антитіл та нуклеїнових кислот, що кодують такі анти-МСР-1 антитіла, комплементарних нуклеїнових кислот, векторів, клітин-хазяїв та способів їх одержання і застосування, включаючи терапевтичні препарати, використання та пристрої. Моноцитний хемоатрактантний білок-1 (МСР1) людини (котрий також називається CCL-2), 8,6 кДа білок, що містить 76 амінокислотних залишків, є членом хемокін-бета (або С-С) родини цитокінів. Хемокіни являють собою низькомолекулярні (8-10 кДа), індукційні, секретовані, прозапальні, хемотактичні цитокіни, котрі, як було показано, відіграють центральну роль у периваскулярній трансміграції та акумулюванні специфічних підгруп лейкоцитів на сайтах ураження тканини. Були визначені дві основних родини у залежності від позиціонування чотирьох консервативних цистеїнів. СХС або хемокіни переважно притягують нейтрофіли, тоді як СС або -хемокіни притягують, головним чином, моноцити та інші лейкоцити, але не нейтрофіли (Leonard and Yoshimura et al., 1990). Члени моноцитної хемотаткичної білок-1 (МСР-1) родини утворюють основний компонент С-С родини хемокінів, і їх вважають головними хемокінами, що задіяні у рекрутменті моноцитів, макрофагів та активованих лімфоцитів. Що стосується гомології МСР1 від різних видів, то МСР-1 людини та мавпи відрізняються лише 2 амінокислотами, виявляючи ідентичність послідовності 97 %, тоді як мишачий МСР-1, 13,8 кДа білок, що містить 125 амінокислотних залишків, відрізняється від людського МСР-1 молекулярним розміром та мірою глікозилювання. Хемокінові рецептори належать до великої родини сполучених з G-білками, семи трансмембранних (7 ТМ) доменних рецепторів (GPCR, які також називаються серпентиннними рецепторами). Виходячи із номенклатури рецепторів, що була затверджена на конференції 1996 року (Gordon Research Conference) по хемотаткичним цитокінам, хемокінові рецептори, котрі зв'язують СХС хемокіни, позначаються як CXCR, і рецептори, котрі зв'язують СС хемокіни, позначаються як ССR. Відомо, що МСР-1 зв'язується і передає сигнали через хемокіновий рецептор CCR2. CCR2 являє собою семи транс-мембранний, сполучений з G-білком рецептор, що експресований на багатьох клітинах, включаючи моноцити, Т-клітини, Вклітини та базофіли. Були клоновані два МСР-1 специфічних рецептори, CCR2A та CCR2B, котрі передають сигнал як реакцію на наномолярні (нМ) концентрації МСР-1. CCR2A (CC-CKR2A) та CCR2B (CC-CKR2A) репрезентують дві кДНК, що кодують два МСР-1-специфічні рецептори з двома альтернативно сплайсованими відростками. МСР1 зв'язується з обома ізоформами з високою спорідненістю. МСР-1 індукує потік кальцію у клітинах, що експресують CCR2B, але не у клітинах, що експресують CCR2A. 5-кратно менша концентрація МСР-1 індукує хемотаксис у клітинах, що експресують CCR2B, у порівнянні з клітинами, що експресують CCR2A. Відомі й інші білки з деякою функціональною та послідовністною гомологією з МСР-1 людини. Особливо схожими з МСР-1 (GenBank NP_002973) є МСР-2 (GenBank NP_005614) та еотаксин (GenBank P_51671); МСР-2 має 61,8 відсоткову і еотаксин-1 має 63,2 відсоткову ідентичність послідовності з МСР-1. Область активності та спектр участі цих білків у гомеостатичних механізмах та патології людини не так добре зрозумілі для зазначених гомологів МСР-1. Наприклад, МСР-2 (під другою назвою CCL8) тісно споріднений з МСР-1 та МСР3 (під другою назвою CCL7, GenBank NP_006264), і застосовує як свої функціональні рецептори CCR1 і також CCR2B. МСР-3 білкова (97 амінокислот) послідовність виявляє 74 відсоткову ідентичність з МСР-1 та 58 відсоткову гомологію з МСР-2. Секретований МСР-3 відрізняється від МСР-1 тим, що він є N-глікозильований. МСР-4 (під другою назвою CCL13, GenBank NP_005399) поділяє 5661 відсоткову ідентичність послідовності з трьома відомими моноцитними хемотатктичними білками і 5 на 60 відсотків ідентичний з еотаксином-1. Функції МСР-4, як здається, вельми схожі з такими для МСР-3 та еотаксину. Подібно до МСР-3, МСР-4 є потенційним хемоатрактантом для моноцитів та Тлімфоцитів. Він інактивний на нейтрофілах. На моноцитах МСР-4 зв'язується з рецепторами, що розпізнають МСР-1, МСР-3, RANTES (CCL5) та еотаксин (CCR1 та CCR3 рецептори), і виявляє повну перехресну десенсибілізацію до еотаксину1. МСР-5 є мишачим СС-хемокіном і найбільш тісно споріднений з людським МСР-1 (66 % амінокислотної ідентичності). Генним символом для МСР5 є SCYA 12 (друга назва CCL12). Клітини, трансфековані хемокіновим рецептором CCR2, як було показано, реагують на МСР-5. Щодо загальної інформації по цитокінам та хемокінам дивись http://www.copewithcytokines.de/cope.cgi, і щодо сучасної системи класифікації, Zlotnik A., Yoshie O, 2000. Chemokines: a new classification system and their role in immunity. Immunity 12:121-127. 125I-MCP-1 зв'язується з моноцитами, і графічний аналіз Скетчарда (Scatchard) показує, що моноцити мають мінімум ~ 1700 зв'язувальних сайтів на клітину при Kd ~ 2 нМ (Yoshimura and Leonard, 1990). Останні приклади по рівноважному зв'язуванню на людських моноцитах виявили присутність приблизно 3000 зв'язувальних сайтів на клітину при Kd ~ 0,77 нМ (Ernest et al., 1994). 125IMCP-1 також продемонстрував високо споріднене зв'язування з dEoL-3 клітинами, що експресують CCR2 рецептор при Kd значенні 0,4 нМ (Sarau et al., 1997), підтверджуючи субнаномолярну спорідненість МСР-1 до свого рецептора. Для ідентифікації ділянок МСР-1, що контактують зі своїм рецептором, CCR2, усі оголені щодо поверхні залишки були заміщені аланіном. Деякі залишки також видозмінювались на інші амінокислоти для ідентифікації важливості заряду, гідрофобності або ароматичності у специфічних положеннях. Два кластери, головним чином, основних залишків (R24, K35, K38, K49 та Y13), розділених 35 А гідрофобною канавкою, знижували рівень зв'язування у 15-100 разів. Дані припускають модель, в якій велика площа поверхні МСР-1 контактує з рецептором, і акумуляція ряду слабких взаємодій дає 35 рМ спорідненість, що спостерігалась для білка мікроорганізмів дикого типу (WT) (Hemmerich et al., 1999). Область спорідненостей від 2 нМ до 35 рМ, що зазначається у літературі, може бути спричинена застосованими аналізами та відповідними обмеженнями даних аналізів. Відомі й інші білки з деякою функціональною та послідовністною гомологією з МСР-1 людини. Особливо схожими з МСР-1 (GenBank NP_002973) є МСР-2 (GenBank NP_005614) та еотаксин (GenBank P_51671); МСР-2 має 61,8 відсоткову і еотаксин-1 має 63,2 відсоткову ідентичність послідовності з МСР-1. Область активності та спектр участі цих білків у гомеостатичних механізмах та патології людини не так добре зрозумілі для зазначених гомологів МСР-1. Наприклад, МСР-2 тісно споріднений з МСР-1 та МСР-3 (GenBank NP_006264), і застосовує як свої функціональні рецептори CCR1 і також CCR2B. МСР-3 зв'язується з рецептором, позначеним як D6. МСР-3 також зв'язується з 97232 6 CCR10. МСР-3 білкова (97 амінокислот) послідовність виявляє 74 відсоткову ідентичність з МСР-1 та 58 відсоткову гомологію з МСР-2. Секретований МСР-3 відрізняється від МСР-1 тим, що він є Nглікозильований. МСР-4 (GenBank NP_005399) поділяє 56-61 відсоткову ідентичність послідовності з трьома відомими моноцитними хемотатктичними білками і на 60 відсотків ідентичний з еотаксином-1. Функції МСР-4, як здається, вельми схожі з такими для МСР-3 та еотаксину. Подібно до МСР-3, МСР-4 є потенційним хемоатрактантом для моноцитів та Т-лімфоцитів. Він інактивний на нейтрофілах. На моноцитах МСР-4 зв'язується з рецепторами, що розпізнають МСР-1, МСР-3, RANTES (CCR2). На еозинофілах МСР-4 має схожу ефективність та активність як і МСР-3, RANTES та еотаксин. МСР-4 поділяє рецептори з еотаксином (CCR1 та CCR3) і виявляє повну перехресну десенсибілізацію до еотаксину-1. Повідомляється й про інші антитіла, що здатні зв'язувати МСР-1: у JP9067399 розкрито антитіло, одержане із виділених кров'яних клітин, і у JP05276986 розкрита гібридома, що секретує IgM МСР-1 проти людини. Пізніше були розкриті антитіла, здатні зв'язувати множину бета-хемокінів, включаючи МСР-1 (WO03048083), та МСР-1 зв'язувальне антитіло, котре також зв'язує еотаксин (US20040047860). Відповідно, існує потреба у запровадженні людських антитіл, специфічних щодо МСР-1 людини, для застосування у терапії з метою послаблення або виключення симптомів хвороб, залежних від МСР-1, так само як і поліпшень відомих антитіл або їх фрагментів. Даний винахід запроваджує ізольовані антитіла людини, примата, ссавця, химерні, гуманізовані та/або CDR-прищеплені анти-МСР-1 антитіла та інші, отримані із імуноглобуліну білки, фрагменти, продукти розщеплення та інші їх визначені частини, та варіанти, так само як і композиції анти-МСР1 антитіл, кодуючі або комплементарні нуклеїнові кислоти, вектори, клітини-хазяї, композиції, препарати, пристрої, трансгенні тварини, трансгенні рослини, та способи їх одержання та використання, як описано та/або подано у даному тексті, сумісно з тим, що відомо у даній галузі. Окрім композиції антитіл даного винаходу як тут описано, антитіло даного винаходу визначається за його спорідненістю до МСР-1 людини, специфічністю щодо МСР-1 людини та здатністю блокувати біоактивність МСР-1 людини. Даний винахід також запроваджує принаймні одне ізольоване анти-МСР-1 антитіло, таке як, проте не обмежуючись принаймні одним антитілом, злитий білок антитіла або фрагмент, як описано у даному тексті. Антитіло згідно з даним винаходом включає будь-який білок або пептид, що містить молекулу, котра включає принаймні частину імуноглобулінової молекули, таку як, проте не обмежуючись цим, принаймні один домен, що зв'язує ліганд, такий як, проте не обмежуючись цим, варіабельна ділянка важкого або легкого ланцюга, гіперваріабельна ділянка (CDR) важкого або легкого ланцюга, або її частина, що зв'язує ліганд, як подано у Таблицях 4А, B, D та Е (SEQ ID 7 NO: 6-26; та, при потребі, функціонально асоційований з рамковою ділянкою (наприклад, FR1, FR2, FR3, FR4 або її фрагментом, як описано у Таблиці 4С (SEQ ID NO: 2-5), що включає додатково, при потребі, принаймні СН1, шарнір, СН2 або СН3 імуноглобуліну людини. Принаймні одна амінокислотна послідовність антитіла може включати додатково, при потребі, принаймні одну визначену субституцію, інсерцію або делецію, як описано у даному тексті або як відомо у даній галузі. В одному варіанті частини антитіла, що зв'язують ліганд, включають SEQ ID NO: 27 та 28. В одному аспекті даний винахід запроваджує принаймні одне ізольоване анти-МСР-1 антитіло ссавця, що містить принаймні одну варіабельну ділянку, яка включає SEQ ID NO: 27 або 28. В іншому аспекті даний винахід запроваджує принаймні одне ізольоване анти-МСР-1 антитіло ссавця, що містить або (і) усі гіперваріабельні ділянки (CDR) важкого ланцюга амінокислотних послідовностей ID NOS: 6, 7 та 9; або (іі) усі CDR легкого ланцюга амінокислотних послідовностей SEQ ID NOS: 13, 14 та 16. Даний винахід також запроваджує, в одному аспекті, ізольовані молекули нуклеїнової кислоти, включаючи комплементарні, або гібридизовані з полінуклеотидом, котрий кодує специфічні антиМСР-1 антитіла, включаючи принаймні одну визначену послідовність, домен, частину або її варіант. Даний винахід також запроваджує рекомбінантні вектори, що включають зазначені молекули нуклеїнової кислоти анти-МСР-1 антитіла, клітинихазяї, котрі містять такі нуклеїнові кислоти та/або рекомбінантні вектори, так само як і способи приготування та/або використання таких антитілонуклеїнових кислот, векторів та або клітин-хазяїв. Принаймні одне антитіло даного винаходу зв'язує принаймні один визначений епітоп, специфічний щодо принаймні одного МСР-1 білка або варіанту, або похідної, як запроваджено у SEQ ID NO: 1. Даний принаймні один епітоп може включати принаймні одну ділянку, що зв'язує антитіло, котра включає принаймні одну частину зазначеного білка, де даний епітоп складається, краще, із принаймні 1-5 амінокислот принаймні однієї його ділянки, такої як, проте не обмежуючись цим, принаймні одного функціонального, екстрацелюлярного, розчинного, гідрофільного, зовнішнього або цитоплазмового домена зазначеного білка або будь-якої його частини. Дане принаймні одне антитіло може, при потребі, включати принаймні одну визначену частину принаймні однієї гіперваріабельної ділянки (CDR) (наприклад, CDR1, CDR2 або CDR3 варіабельна ділянка важкого або легкого ланцюга, запроваджена як SEQ ID NOS: 27 та 28, відповідно), запровадженої як SEQ ID NOS: 6, 7, 9, 13, 14 та 16; і що додатково містить, при потребі, принаймні одну константну або варіабельну рамкову ділянку або будь-яку її частину, де зазначене антитіло блокує, інгібує або запобігає принаймні одній активності, такій як, проте не обмежуючись цим, МСР-1 зв'язуванню з рецептором на поверхні клітин, CCR2 рецепторній інтерналізації, стимульованій МСР-1 Са2+ мобілізації або будь-якій іншій придатній ві 97232 8 домій МСР-1 пробі. Таким чином, анти-МСР-1 антитіло може бути піддано скринінгу на відповідну активність згідно з відомими способами, такими як, проте не обмежуючись цим, принаймні одна біологічна активність щодо МСР-1 білка. Даний винахід також запроваджує принаймні одне МСР-1 анти-ідіотипне антитіло до принаймні одного МСР-1 антитіла даного винаходу. Зазначене анти-ідиотипне антитіло включає будь-який білок або пептид, що включає молекулу, котра містить принаймні частину молекули імуноглобуліну, таку як, проте не обмежуючись цим, принаймні одну частину, що зв'язує ліганд (LBP), таку як, проте не обмежуючись цим, гіперваріабельну ділянку (CDR) важкого або легкого ланцюга, або її частину, що зв'язує ліганд, варіабельну ділянку важкого ланцюга або легкого ланцюга, константну ділянку важкого ланцюга або легкого ланцюга, рамкову ділянку, або будь-яку її частину, що може бути уведена в анти-ідіотипне антитіло даного винаходу. Анти-ідіотипне антитіло даного винаходу може включати або бути одержаним від будь-якого ссавця, такого як, але не обмежуючись цим, людина, миша, кріль, щур, гризун, примат і таке подібне. Даний винахід також запроваджує, в одному аспекті, ізольовані молекули нуклеїнової кислоти, включаючи комплементарні, або гібридизовані з полінуклеотидом, котрий кодує принаймні одне МСР-1 анти-ідіотипне антитіло, включаючи принаймні одну визначену послідовність, домен, частину або її варіант. Даний винахід також запроваджує рекомбінантні вектори, що включають зазначене МСР-1 анти-ідіотипне антитіло, яке кодує молекули нуклеїнової кислоти, клітини-хазяї, котрі містять такі нуклеїнові кислоти та/або рекомбінантні вектори, так само як і способи приготування та/або використання таких анти-ідіотипне антитіло-нуклеїнових кислот, векторів та/або клітин-хазяїв. Даний винахід також запроваджує принаймні один спосіб для експресії принаймні одного антиМСР-1 антитіла, або МСР-1 анти-ідиотипного антитіла у клітині-хазяїні, що включає культивування клітини-хазяїна, як тут описано, за умов, що принаймні одне анти-МСР-1антитіло експресоване у визначуваній та/або відтворюваній кількостях. Даний винахід також запроваджує принаймні одну композицію, що включає (а) ізольоване антиМСР-1 антитіло, що кодує нуклеїнову кислоту, та/або антититіло як тут описано; і (b) придатний носій або розріджувач. Даний носій або розріджувач, при потребі. може бути фармацевтично прийнятним, згідно з відомими носіями або розріджувачами. Дана композиція може, при потребі, додатково включати принаймні одну додаткову сполуку, білок або композицію. Даний винахід також запроваджує принаймні одне анти-МСР-1 антитіло, у способі чи композиції, для застосування терапевтично ефективної кількості з метою модуляції або лікування принаймні одного стану, пов'язаного з МСР-1, у клітині, тканині, органі, у тварини чи пацієнта, та/або, до, після або підчас даного стану, як це відомо у даній галузі та/або описано у даному тексті. Даний винахід також запроваджує принаймні 9 одну композицію, пристрій та/або спосіб доставки терапевтично або профілактично ефективної кількості принаймні одного анти-МСР-1 антитіла згідно з даним винаходом. Даний винахід також запроваджує принаймні одне анти-МСР-1 антитіло, у способі чи композиції, для діагностування принаймні одного стану, пов'язаного з МСР-1, у клітині, тканині, органі, у тварини чи пацієнта, та/або, до, після або підчас даного стану, як це відомо у даній галузі та/або описано у даному тексті. Даний винахід також запроваджує принаймні одну композицію, пристрій та/або спосіб доставки для діагностування принаймні одного анти-МСР-1 антитіла згідно з даним винаходом. В одному аспекті, даний винахід запроваджує принаймні одне ізольоване анти-МСР-1 антитіло ссавця, що включає принаймні одну варіабельну ділянку, яка містить SEQ ID NO: 27 або 28. В іншому аспекті, даний винахід запроваджує принаймні одне ізольоване анти-МСР-1 антитіло ссавця, що містить або (і) усі гіперваріабельні ділянки (CDR) важкого ланцюга амінокислотних послідовностей SEQ ID NOS: 6, 7 та 8 або 9; або (іі) усі CDR легкого ланцюга амінокислотних послідовностей SEQ ID NOS: 13, 14 та 15 або 16. В іншому аспекті, даний винахід запроваджує принаймні одне ізольоване анти-МСР-1 антитіло ссавця, що містить принаймні одну зі (і) всіх гіперваріабельних ділянок (CDR) важкого ланцюга амінокислотних послідовностей SEQ ID NOS: 6, 7 та 8 або 9; або (іі) всіх CDR легкого ланцюга амінокислотних послідовностей SEQ ID NOS: 13, 14 та 15 або 16. Зазначене принаймні одне антититіло може, при потребі, бути одним із таких, що: зв'язує МСР1 зі спорідненістю, котра вибирається із принаймні -9 -10 -11 10 М, принаймні 10 М, принаймні 10 М, або, -12 принаймні, 10 М; у значній мірі нейтралізує принаймні одну активність принаймні одного МСР-1 білка. Також запроваджена ізольована нуклеїнова кислота, що кодує принаймні одне ізольоване анти-МСР-1 антитіло ссавця; вектор ізольованої нуклеїнової кислоти, що включає ізольовану нуклеїнову кислоту, та/або прокаріотну чи еукаріотну клітину-хазяїна, що включає дану ізольовану нуклеїнову кислоту. Зазначена клітина-хазяїн може, при потребі, бути, принаймні однією клітиною, що вибирається із NSO, COS-1, COS-7, HEK293, BHK21, CHO, BSC-1, Hep G2, YB2/0, 653, SP2/0, HeLa, клітини мієломи або лімфоми, або будьякого її деривату, її іморталізованої або трансформованої клітини. Крім того, запроваджений спосіб для продукування принаймні одного анти-МСР-1 антитіла, що включає трансляцію даного антитіла, котре кодує нуклеїнову кислоту, за умов in vitro, in 97232 10 vivo або in situ, так що дане МСР-1 антитіло експресоване у визначуваній та/або відтворюваній кількостях. Також запроваджена композиція, що включає принаймні одне ізольоване анти-МСР-1 антитіло ссавця і принаймні один фармацевтично прийнятний носій або розріджувач. Крім того, запроваджений спосіб для діагностування або лікування стану, пов'язаного з МСР-1, у клітині, тканині, органі або у тварини, що включає: (а) контактування або застосування композиції, що містить ефективну кількість принаймні одного ізольованого анти-МСР-1 антитіла даного винаходу, з або до, клітини, тканини, органу або тварини. Запроваджений також медичний пристрій, що включає принаймні одне ізольоване анти-МСР-1 антитіло ссавця даного винаходу, де даний пристрій придатний для контактування або застосування принаймні одного анти-МСР-1 антитіла з використанням принаймні однієї схеми, що вибирається із парентеральної, підшкірної, внутрішньом'язової, внутрішньовенної, інтрартикулярної, інтрабронхіальної, інтраабдомінальної, інтракапсулярної, внутрішньохрящевої, внутрішньополостної, внутрішньочеревної, інтрацелебелларної, інтрацеребровентрикулярної, у товсту кишку, інтрацервікальної, внутрішньошлункової, внутрішньопечінкової, внутрішньоміокардної, внутрішньокісткової, внутрішньотазової, внутрішньоперикардної, інтраперитонеальної, інтраплевральної, у простату, внутрішньолегеневої, інтраректальної, інтраренальної, інтраретинальної, інтраспінальної, внутрішньосуглобової, інтраторокальної, внутрішньоматочної, внутрішньоміхурової, болюсної, вагінальної, ректальної, трансбукальної, сублінгвальної, інтраназальної або трансдермальної схеми. Запроваджений також виріб для фармацевтичного або діагностичного застосування людиною, що включає пакувальний матеріал та контейнер, котрий містить розчин, частинкову або ліофілізовану форму принаймні одного ізольованого антиМСР-1 антитіла ссавця даного винаходу. Крім того, запроваджений спосіб для продукування принаймні одного ізольованого анти-МСР-1 антитіла ссавця даного винаходу, що включає запровадження клітина-хазяїна або трансгенної тварини, або трансгенної рослини, або рослинної кітини, котрі здатні експресуватись у відтворюваних кількостях даного антитіла. Крім того, у даному винаході запроваджено принаймні одне анти-МСР1 антитіло, що отримане за допомогою вищезазначеного способу. Даний винахід також запроваджує будь-який винахід, що тут описаний. 11 97232 Стислий опис лістінгу послідовностей SEQ ID NO: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Опис Людський МСР-1 (CCL2) та варіанти, застосовані для селекції анти-МСР-1 зв'язувальних елементів VHIA варіабельна послідовність важкого ланцюга: FR1, CDR1, FR2, CDR2 варіанти, FR3, CDR3, FR4 VH3 варіабельна послідовність важкого ланцюга: FR1, CDR1, FR2, CDR2 варіанти, FR3, CDR3, FR4 Каппа3 варіабельна послідовність легкого ланцюга: FR1, CDR1, FR2, CDR2, FR3, CDR3 варіанти, FR4 Ламбда3 варіабельна послідовність легкого ланцюга: FR1, CDR1, FR2, CDR2, FR3, CDR3 варіанти, FR4 VHIA CDR1 All MOR03471 VHIA CDR2 3781, 3790, CNTO 888 VHIA CDR2 3899 VHIA CDR3 All MOR03471 VH3 CDR1 All MOR03548 VH3 CDR2 3744, 3747 VH3 CDR3 All MOR03548 Каппа3 CDR1 All MOR034471 Каппа3 CDR2 All MOR034471 Каппа3 CDR3 3781 Каппа3 CDR3 3790, CNTO888 Каппа3 CDR3 3899 Ламбда3 CDR1 All MOR03548 Ламбда3 CDR2 All MOR03548 Ламбда3 CDR3 3744 Ламбда3 CDR3 3747 VH1A CDR2 Варіанти VH3 CDR2 Варіанти Lk CDR3 Варіанти L CDR3 Варіанти HC CDR1 Варіанти CNTO варіабельна ділянка важкого ланцюга CNTO варіабельна ділянка легкого ланцюга Даний винахід запроваджує принаймні одне очищене, ізольоване, рекомбінантне та/або синтетичне анти-МСР-1 антитіло людини, примата, гризуна, ссавця, химерні, гуманізовані, отримані методами генної інженерії та/або CDRтрансплантовані антитіла, і також МСР-1 антиідіотипні антитіла, так само як і композиції та кодуючі молекули нуклеїнової кислоти, що включають принаймні один полінуклеотид, який кодує принаймні одне анти-МСР-1 антитіло або антиідіотипне антитіло. Даний винахід також включає, проте не обмежуючись цим, способи одержання та використання таких нуклеїнових кислот та антитіл і анти-ідіотипних антитіл, включаючи діагностичні та терапевтичні композиції, способи та пристрої. Посилання На всі публікації або патенти, що цитовані у даному тексті, зроблені повні посилання, оскільки вони показують стан справ у цій галузі на час по 12 дання даної заявки та/або входять до опису та обґрунтування даного винаходу. Публікації стосуються будь-яких наукових або патентних публікацій, або будь-якої іншої інформації, що наявна у будь-якому медійному форматі, включаючи всі записані, електронні або друковані формати. На наступні роботи в даному тексті зроблені повні посилання: Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, NY (1987-2004); Sambrook, et al., Molecular Cloning: A nd Laboratory Manual, 2 Edition, Cold Spring Harbor, NY (1989); Harlow and Lane, Antibodies, A Laboratory Manual, Cjld Spring Harbor, NY (1989); Colligan, et al., eds., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2004); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, NY (1997-2004). Скорочення аа: амінокислота, BSA: альбумін бичачої сироватки: CDR: гіперваріабельні ділянки; ECL: електрохемілюмінесценція; HuCAL: бібліотека комбінаторних антитіл людини; HSA: альбумін сироватки людини; МСР-1: моноцитний хемоатрактантний білок-1; Ig: імуноглобулін; IPTG: ізопропіл -Dтіогалактозид; mAb: моноклональне антитіло; PBS: фосфатний буферний сольовий розчин, рН 7,4; SET: рівноважне титрування розчину; VH: варіабельна ділянка важкого ланцюга імуноглобуліну; VL: варіабельна ділянка легкого ланцюга імуноглобуліну. Визначення Як застосовується у даному тексті, "анти-CCL2 антитіло", "анти-МСР-1 антитіло", "частина антиМСР-1 антитіла" або "фрагмент анти-МСР-1 антитіла" та/або "варіант анти-МСР-1 антитіла" і таке подібне включають будь-який білок або пептид, що містить молекулу, котра включає принаймні частину імуноглобулінової молекули, таку як, проте не обмежуючись цим, принаймні одну гіперваріабельну ділянку (CDR) важкого або легкого ланцюга, або її частину, що зв'язує ліганд, варіабельну ділянку важкого або легкого ланцюга, константну ділянку важкого або легкого ланцюга, рамкову ділянку або будь-яку її частину, або принаймні одну частину МСР-1 рецептора або зв'язувального білка, котрий може бути уведений в антитіло даного винаходу. Таке антитіло, при потребі, додатково впливає на специфічний ліганд, у такий спосіб, проте не обмежуючись цим, що воно модулює, знижує, підвищує, протидіє, пом'якшує, послаблює, блокує, інігібує, анулює та/або перешкоджає принаймні одній МСР-1 активності або зв'язуванню, або МСР-1 рецепторній активності або зв'язуванню, in vitro, in situ та/або in vivo. Як приклад, що не вносить обмежень, придатне анти-МСР-1 антитіло, визначена частина або варіант даного винаходу можуть зв'язувати принаймні один МСР-1, або визначені його частини, варіанти або домени. Як застосовується у даному тексті, термін "епітоп" означає сегмент або деталь білка, здатну до специфічного зв'язування з антитілом. Епітопи звичайно складаються із хімічно активних поверхневих угрупувань молекул, таких як амінокислоти або бічні цукрові ланцюги, і звичайно мають спе 13 цифічні тривимірні структурні характеристики, так само як і специфічні зарядові характеристики. Конформаційні та нонконформаційні епітопи відрізняються тим, що зв'язок з першим, але не з другим втрачається у присутності денатуруючих розчинників. Протеїнові епітопи утворюються в результаті конформаційного складання МСР-1 молекули, що відбувається, коли амінокислоти із різних частин лінійної послідовності МСР-1 молекули близько підходять одна до одної у 3вимірному просторі. Під "МСР-1" мається на думці 76 амінокислотна послідовність, на яку посилаються у NCBI картотеці під номером доступу NP_002973, і вона також відома як МСР (моноцитний хемотактичний білок), SMC-CF (хемотактичний фактор клітин гладеньких м'язів), LDCF (хемотактичний фактор із лімфоцитів), GDCF (моноцитний хемотактичний фактор із гліоми), TDCF (хемотактичні фактори із пухлин), НС11 (цитокін 11 людини), MCAF (моноцитний хемотактичний та активуючий фактор). Генний символ SCYA2, JE ген на хромосомі людини 17, і нове позначення CCL2 (Zlotnik, Yoshie 2000. Immunity 12:121-127). JE є мишачим гомологом МСР-1/CCL2. Як застосовується у даному тексті, термін "людське антитіло" стосується антитіла, в якому у значній мірі кожна частина білка (наприклад, CDR, рамка, CL, CH домени (наприклад, СН1, СН2, СН3), шарнір, (VL, VH) одержується в результаті рекомбінаційних подій у людських зародково-лінійних імуноглобулінових генних послідовностях або із послідовностей дозрілих людських антитіл. Окрім виділених людських антитіл, таке людське антитіло може бути отримане шляхом імунізації трансгенних мишей, що здатні давати імунну реакцію на людські імуноглобулінові зародково-лінійні гени (Lonberg et al., Int Rev Immunol 13(1):65-93 (1995) and Fishwald et al., Nat Biotechnol 14(7):845-851 (1996), або може вибиратись із бібліотеки наборів людських антитіл як тут описано. Джерело таких генних послідовностей людини може бути знайдено у будь-якій придатній бібліотеці, такій як VBASE, база даних по генам людських антитіл (http://www.mrc-cpe.cam.ac.uk/imt-doc) або їх трансльованих продуктів, або на http://people.cryst.bbk.ac.uk/~ubcg07s/, що дає людські антитіла, класифіковані на групування, котрі базуються на схожості їх амінокислотних послідовностей. Під обсяг цього визначення підпадають композитні антитіла або функціональні фрагменти людських композитних антитіл, котрі включають рамкові ділянки від однієї або кількох послідовностей антитіл людини, та CDR ділянки від двох різних людських або нелюдських джерел. У межах визначення "людське антитіло" знаходиться композитне антитіло або функціональний фрагмент людського композитного антитіла, котре містить рамкові ділянки від зародково-лінійних та реаранжованих послідовностей антитіла людини, та CDR ділянки від двох різних вихідних антитіл. Людське композитне антитіло або функціональний фрагмент людського композитного антитіла згідно з даним розкриттям включає рамкові ділянки від однієї або кількох послідовностей антитіл людини, 97232 14 та CDR ділянки, одержані із послідовностей людського або нелюдського антитіла, або може бути цілком синтетичним. Таким чином, людське антитіло відрізняється від химерного або гуманізованого антитіла. Зазначається, що людське антитіло може бути продуковане нелюдською твариною або прокаріотною чи еукаріотною клітиною, що здатна експресувати функціонально реаранжовані людські імуноглобулінові (наприклад, з важким ланцюгом та/або легким ланцюгом) гени. Крім того, коли людське антитіло являє собою антитіло з одним ланцюгом, воно може включати лінкерний пептид, котрий відсутній у природних людських антитілах. Наприклад, Fv може містити лінкерний пептид, такий як два – приблизно вісім гліцинових або інших амінокислотних залишків, що з'єднує варіабельну ділянку важкого ланцюга та варіабельну ділянку легкого ланцюга. Такі лінкерні пептиди, як вважається. мають бути людського походження. "Гуманізовані" форми нелюдських (наприклад, мишачих) антитіл являють собою химерні антитіла, що у значній мірі замінили частини послідовностей, котрі були одержані із нелюдського імуноглобуліну. У більшості, гуманізовані антитіла являють собою людські імуноглобуліни (антитіло реципієнта), в яких CDR (ділянки, що визначають комплементарність, котрі також відомі як гіперваріабельні ділянки) залишки реципієнта замінюються CDR залишками від нелюдських видів (антитіло донора), таких як миша, щур, кріль або нелюдський примат, котрі мають потрібні специфічність, спорідненість та функціональну активність. У деяких випадках залишки рамкових ділянок (FR) людського імуноглобуліну замінюються відповідними нелюдськими залишками. Крім того, гуманізовані антитіла можуть містити залишки, котрі відсутні в антитілі реципієнта або в антитілі донора. Ці модифікації зроблені для додаткового удоскооналення властивостей антитіла. Загалом, гуманізоване антитіло включає у значній мірі всі із принаймні одного і, типово, двох варіабельних доменів, в яких усі або у значній мірі всі FR є рамковими ділянками людської імуноглобулінової послідовності. Зазначене гуманізоване антитіло буде включати принаймні частину імуноглобулінової константної ділянки (Fc), типово, ділянки людського IgG імуноглобуліну. Щодо подальших подробиць, дивись роботи Jones et al., Nature 321:522525 (1986); Reichmann et al., Nature 332:323-329 (1988); and Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Як тут застосовується, Kd антитіла стосується константи дисоціації, KD, антитіла для предетермінованого антигену і є мірою спорідненості (афінності) антитіла до специфічної мішені. -8 Антитіла високої спорідненості мають KD 10 М -9 або менше, краще, 10 М або менше, і навіть ще -10 краще, 10 М або менше, для предетермінованого антигену. Термін "Kdis" або "KD", або "Kd", як тут застосовується, як мається на думці, стосується швидкості дисоціації для конкретної взаємодії антитіло-антиген. "KD" являє собою відношення швидкості дисоціації (k2), що також називається "офф швидкість (koff)”, до швидкості асоціації (k1) або "он швидкість (kon)”. Таким чином, KD дорівнює k2/k1 15 або koff/kon і виражається як мольна концентрація (М). Звідси витікає, що чим менше KD, тим сильні-6 ше зв'язування. Так що KD 10 M (або 1 мікроМ) -9 вказує на слабке зв'язування, у порівнянні з 10 М (або 1 нМ). Як застосовується у даному тексті, "специфічність щодо", "специфічне зв'язування" та "специфічно зв'язується" стосується антитіла, що зв'язується з предетермінованим антигеном з більшою спорідненістю, ніж для других антигенів або білків. Типово, дане антитіло зв'язується з константою -7 дисоціації (КD) 10 M або менше, і зв'язується з предетермінованим антигеном з КD, що принаймні у два рази менша, ніж його KD для зв'язування з неспецифічним антигеном (наприклад, BSA, казеїн або будь-який інший визначений поліпептид), іншим, ніж зазначений предетермінований антиген. Фрази "антитіло, що визнає антиген", та "антитіло, специфічне щодо антигену", використовуються у взаємозамінний спосіб з терміном "антитіло, що специфічно зв'язується з антигеном" або "антиген специфічне антитіло", наприклад, МСР-1 специфічне антитіло. 1. Одержання антитіл даного винаходу Одержання людських антитіл, котрі є специфічними щодо людського МСР-1 білка або його фрагментів, таких як ізольований та/або МСР-1 білок або його частина (включаючи синтетичні молекули, такі як синтетичні пептиди), може проводитись з використанням будь-якого придатного способу, відомого у даній галузі. Антитіла людини можуть продукуватись з використанням різних способів, відомих у даній галузі. В одному варіанті антитіло людини вибирається із фаготеки, де дана фаготека експресує людські антитіла (Vaughan et al., Nature Biotechnology 14:309-314 (1996): Sheets et al. PITAS (USA) 95:6157-6162 (1998)); Hoogenboom and Winer, J. Mol. Biol., 227:381 (1991); Marks et al. J. Mol. Biol., 222:581 (1991)). Людські антитіла можуть бути також одержані шляхом уведення людських імуноглобулінових локусів у трансгенні тварини, наприклад, мишей, в яких ендогенні імуноглобулінові гени частково або цілком інактивовані. Наприклад, трансгенна миша, що включає функціонально реаранжований трансген важкого ланцюга людського імуноглобуліну, та трансген, котрий містить ДНК від локусу легкого ланцюга людського імуноглобуліну, що може піддаватись функціональному реаренжменту, може бути імунізована людським МСР-1 або його фрагментом з метою викликати продукування антитіл. При бажанні, клітини, що продукують антитіла, можуть бути ізольовані, і можуть бути одержані гібридоми або інші іморталізовані продукуючі антитіла клітини, як тут описано та/або відомо у даній галузі. Як альтернатива, антитіло, визначена частина або варіант можуть бути експресовані з використанням кодування нуклеїнової кислоти або її частини у придатній клітині-хазяїні. Після стимуляції відповідним антигеном спостерігається продукування людських антитіл, котре сильно нагадує таке, що спостерігається у людей у всіх відношеннях, включаючи реаренжмент генів, складання та спектр антитіл. Цей підхід описаний, наприклад, у патентах США за номерами 5545807, 97232 16 5545806, 5569825, 5625126, 5633425, 5661016, та у наступних наукових публікаціях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368:812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg and Huezar, Intern. Rev.Innunol. 13:65-93 (1995). Як альтернатива, людське антитіло може бути одержане шляхом іморталізації людських В лімфоцитів, що продукують антитіло, спрямованих проти антигену-мішені (такі В лімфоцити можуть бути виділені від особини або можуть бути піддані імунізації in vitro). Дивись, наприклад, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147 (1):86-95 (1991); та патент США за номером 5750373. Клітини, що продукують антитіла, можуть також бути одержані із периферичної крові або, краще, селезінкових або лімфатичних вузлів людей або інших придатних тварин, що були імунізовані потрібним антигеном. Може бути також застосована будь-яка інша придатна клітина-хазяїн для експресії ксеногенної або ендогенної нуклеїнової кислоти, що кодує антитіло, його визначений фрагмент або варіант, даного винаходу. Злиті клітини (гібридоми) або рекомбінантні клітини можуть бути ізольовані з використанням умов селективних культур або інших придатних відомих способів та клоновані шляхом граничного розведення або сортування клітин, або з використанням інших відомих методів. Клітини, що продукують антитіла з бажаною специфічністю, можуть бути вибрані з використанням придатного аналізу (наприклад, ELISA). В одному підході гібридома одержується шляхом злиття придатної імортальної клітинної лінії (наприклад, мієломної клітинної лінії, такої як, проте не обмежуючись цим, Sp2/0, Sp2/0-AG14, NSO, NS1, NS2, AE-1, L.5, >243, P3 × 63Ag8.653, Sp2 SA3, Sp2 MAI, Sp2 SS1, Sp2 SA5, U937, MLA 144, ACT IV, MOLT4, DA-1, JURKAT, WEHI, K-562, COS, RAJI, NIH 3T3, HL-60, MLA-144, NAMAIWA, NEURO 2A, або подібної, або гетеромілом, їх продуктів злиття, або будь-якої клітини або злитих клітин, одержаних із них, або будь-якої іншої придатної клітинної лінії, як відомо у даній галузі, дивись, наприклад, www.atcc.org, www.lifetech.com., і таке подібне), з клітинами, що продукують антитіла, такими як, проте не обмежуючись цим, ізольованими або клонованими селезінковими, із периферичної крові, лімфатичними, мигдаликовими або іншими імунними клітинами або клітинами, що містять В клітини, або будь-якими іншими клітинами, котрі експересують константну або варіабельну, або рамкову, або CDR послідовності важкого або легкого ланцюга, як ендогенної або ксеногенної нуклеїнової кислоти, як рекомбінантної або ендогенної, вірусну, бактеріальну, водоростеву, прокаріотну, амфібії, комахи, рептилії, риби, ссавця, гризуна, конячу, вівці, кози, барана, примата, еукаріотну, геномну ДНК, кДНК, рДНК, мітохондрійну ДНК або РНК, хлоропластну ДНК або РНК, гяРНК, мРНК, тРНК, однониткову, з подвійною або потрійною ниткою, гібридизовану, і таке подібне, 17 або будь-яку їх комбінацію. Дивись, наприклад, Ausubel, вище, та Colligan, Immunology, вище, глава 2, на які у даному тексті зроблені повні посилання. Людські антитіла, що зв'язуються з МСР-1 і що включають визначену варіабельну ділянку важкого або легкого ланцюга, можуть бути одержані з використанням придатних способів, таких як відображення фагів (Katsube, Y., et al., Int J Mol. Med, 1(5):863-868 (1998)). Можуть бути використані інші придатні способи продукування або виділення антитіл потрібної специфічності, включаючи, проте не обмежуючись цим, способи селекції рекомбінантного антитіла із пептидної або білкової бібліотеки (наприклад, проте не обмежуючись цим, бактеріофагу, рибосоми, олігонуклеотиду, РНК, кДНК або подібного, відображувальної бібліотеки; наприклад, як мається у Cambridge antibody Technologies, Cambridgeshire, UK; MorphoSys, Marinsreid/Planegg, DE; Biovation, Aberdeen, Scotland, UK; BioInvent, Lund, Sweden; Dyax Corp., Enzon, Affymax/Biosite; Xoma, Berkely, CA; Ixsys. Див., наприклад, EP 368684, PCT/GB91/01134; PCT/GB92/01755; PCT/GB92/002240; PCT/GB92/00883; PCT/GB93/00605; US 08/350260(5/12/94); PCT/GB94/01422; PCT/GB94/02662; PCT/GB97/01835; (CAT/MRC); WO90/14443; WO90/14430; PCT/US94/1234; WO92/18619; WO96/07754; (Scripps); WO96/13583; WO97/08320 (MorphoSys); WO95/16027 (BioInvent); WO88/06630; WO90/3809 (Dyax); US 4704692 (Enzon); PCT/US91/02989 (Affymax); WO89/06283; EP 371998; EP 550400; (Xoma); EP 229046; PCT/US91/07149 (Ixsys); або стохастично генеровані пептиди чи білки – US 5723323, 5763192, 5814476, 5817483, 5824514, 5976862 WO 86/05803, EP 590689 (Ixsys, тепер Applied Molecular Evolution (AME), на кожну із яких у даному тексті зроблено повне посилання), або що базуються на імунізації трансгенних тварин (наприклад, SCID миші, Nguyen et al., Microbiol. Immunol. 41:901-907 (1997); Sandhu et al., Crit. Rev. Biotechnol. 16:95118 (1996); Eren et al., Immunol. 93:154-161 (1998), на кожну із яких зроблено повне посилання. Специфічний варіант Заявники проілюстрували спосіб селекції та одержання людських антитіл з потрібними спорідненістю, специфічністю та біоактивністю щодо МСР-1 людини, виходячи із людської Fab бібліотеки відображення фагів. Загалом, із 10 пенінгів були піддані скринінгу 17856 клонів, що дало 1104 успішних спроб і нарешті 26 унікальних Fab. Для запровадження унікального ліганду, котрий ілюструє здатність антигену зв'язуватись з природними МСР-1 рецепторами, людський МСР1 та його аналоги або "мутеїни" були синтезовані у хімічний спосіб та модифіковані для специфічних застосувань у селекції, спорідненості та біологіч41 них пробах. Людський МСР-1 Ile та людський 43 МСР-1 Tyr були використані у первинному твердофазовому пенінгу, так само як і в інших аспектах селекції антитіл та пробах на афінне визрівання, і описані тут як біотинільовані версії МСР-1 мутеїну: 41 69 41 75 Ile , Lys(Biotin-PEG4) та (Ile , Lys(Biotin-PEG4) (SEQ ID NO: 1). 97232 18 Оскільки жодна із 26 унікальних Fab не мала виміряної спорідненості як KD 500 мг/л. На основі компонентів цих експресуючих векторів були розроблені антитіло-клонуючі вектори, корисні для НС та LC клонування, котрі включають генну промотор/транскрипційну ініціюючу нуклеїново-кислотну послідовність, 5" нетрансльовані послідовності та трансляційні ініціюючі нуклеїново-кислотні послідовності, нуклеїново-кислотні послідовності, що кодують сигнальну послідовність, інтрон/ексон сплайсінгові донорні послідовності для сигнального інтрону та J-C інтрону, і J-C інтрон енхансерні нуклеїново-кислотні послідовності. Плазміда р139, pUC19 плазміда, містить 5,8 kb EcoRI-EcoRI геномного фрагменту, клонованого із С123 гібридомних клітин, що секретують цілком мишаче M-T412 Ab; даний фрагмент містить промоторну та V ділянкову частину сМ-Т412 НС гена. Вихідним матеріалом для створення LC V ділянкового вектора була плазміда р39, pUC плазміда, що містить 3 kb HindIII-HindIII геномний фрагмент, клонований із С123 гібридомних клітин; цей фрагмент містить промоторну та V ділянкову частину сМ-Т412 LС гена. Створені методами генної інженерії вектори із р139 та р39 були сконструйовані для забезпечення зручного складання HC або LC генів, придатних для експресії у ссавцевій клітині-хазяіні, у двохстадійний процес, що включає 1) клонування ДНК, яка кодує бажану послідовність між спеціально створеними рестрикційними сайтами у векторі V ділянки, в результаті чого V-ділянкова кодуюча послідовність позиціонується безпосередньо нижче від кодованої вектором сигнальної послідовності, так само як і нижче від частини або всього генного промотору; та 2) перенесення фрагмента, що охоплює введену послідовність, із V ділянкового вектора до С ділянкового вектора у відповідній орієнтації, внаслідок чого результуюча плазміда складає кінцеву експресуючу плазміду, придатну для експресії у клітинах (Scallon et al. 1995 Cytokine 7(8):759-769). Клонування та експресія в СНО клітинах Плазміда рС4 є дериватом плазміди pSV2-dhfr (ATCC Accession No. 37146). Дана плазміда містить мишачий DHFR ген під контролем раннього промотора SV40. Клітини яєчника китайського хом'ячка або інші клітини, що не мають дигідрофолатної активності, котрі трансфековані цими плазмідами, можуть бути вибрані шляхом вирощування даних клітин у селективному середовищі (наприклад, альфа мінус МЕМ, Life Technologies, 33 Gaithersburg, MD), доповненому хіміотерапевтичним агентом метотрексатом. Ампліфікація DHFR генів у клітинах, резистентних до метотрексату (МТХ), добре документована (дивись, наприклад, F.W. Alt, et al., J. Biol. Chem. 253:1357-1370 (1978); J.L. Hamlin and C.Ma, Biochem. et Biophys. Acta 1097:107-143 (1990); and M.J. Page and M.A. Sydenham, Biotechnology 9:64-68 (1991)). Клітини, вирощені при підвищуваних концентраціях МТХ, виробляють резистентність до ліків шляхом перепродукування ферменту-мішені, DHFR, як результат ампліфікації DHFR гена. Якщо до зазначеного DHFR гена приєднаний другий ген, він звичайно ко-ампліфікований та переекспресований. Як відомо у даній галузі, цей підхід може бути використаний для розробки клітинних ліній, що несуть більше 1000 копій ампліфікованого(них) гена(ів). Опісля, коли метотрексат вилучений, отримують клітинні лінії, що містять ампліфікований ген, інтегрований в одну або кілька хромосому(м) клітинихазяїна. Плазміда рС4 містить для експресії гена, який являє інтерес, сильний промотор довгого кінцевого повтору (LTR) вірусу саркоми Рауза (Rous) (Cullen, et al., Molec. Cell. Biol. 5:438-447 (1985)) плюс фрагмент, виділений із енхансера найближчого раннього гена людського цитомегаловірусу (CMV) (Boshart, et al., Cell 41:521-530 (1985)). Нижче від даного промотора знаходяться рестрикційні ферментативні розщеплювальні сайти BamH1, Xba1 та Asp718, котрі дозволяють здійснювати інтеграцію даних генів. За цими клонувальними сайтами дана плазміда містить 3" інтрон та поліаденілувальний сайт препроінсулінового гена щура. Для експресії можуть також бути використані й інші високоефективні промотори, наприклад, людський b-актиновий промотор, SV40 ранній або пізній промотори, або довгі кінцеві повтори із інших ретровірусів, наприклад, HIV та HTLV1 (відповідно, ВІЛ та вірус людського Т-клітинного лейкозу). Tetoff та Tet-on (Clonetech) генні експресуючі системи та подібні системи можуть бути використані для експресії МСР-1 антитіла у регульований спосіб у клітинах ссавців (M. Gossen and H. Bujard, Proc. Natl. Acad. Sci. USA 89:5547-5551 (1992)). Для поліаденілування мРНК також можуть бути використані інші сигнали, наприклад, від людського гормону росту або глобінових генів. 4. Клітини-хазяї для продукування антитіл Принаймні одне анти-МСР-1 антитіло даного винаходу може, при потребі, бути одержано за допомогою клітинної лінії, змішаної клітинної лінії, іморталізованої клітини або клонової популяції іморталізованих клітин, як добре відомо у цій галузі. Дивись, наприклад, Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, NY (1987-2004); Sambrook et al., Molecular nd Cloning: A Laboratory Manual, 2 Edition, Cold Spring Harbor, NY (1989); Harlow and Lane, Antibodies, A Laboratory Manual, Cold Spring Harbor, NY (1989); Colligan, et al., eds., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2004); Colligan, et al., Current Protocols in Protein Science, John Wiley & Sons, NY, NY (1997-2004), на кожну із яких у даному тексті зроблено посилання. 97232 34 Для виробництва біофармацевтичних продуктів потрібна виробнича клітинна лінія, що здатна до ефективної та відновлювальної експресії рекомбінантного поліпептиду(ів). Дана клітинна лінія стабільна та прийнятна для фінансового обліку. З цією метою може бути застосований різновид ліній клітин-хазяїв. Як розуміння складності того, яким чином клітинна апаратура впливає на кінцеву кількість та склад біотерапевтичного продукту, вибір клітинної лінії, котра буде надавати потрібні властивості продукції та складу продукту, стає більш очевидним. На відмінність від більшості генів, що транскрибуються із безперервних геномних ДНК послідовностей, гени антитіл збираються із генних сегментів, які можуть бути значно відокремлені на зародковій лінії. Зокрема, гени важкого ланцюга утворені шляхом рекомбінації трьох геномних сегментів, що кодують варіабельну (V), розпізнавальну (D) та з'єднувальну (J)/константну (С) ділянки даного антитіла. Функціональні гени легкого ланцюга утворені шляхом з'єднання двох генних сегментів; один кодує V ділянку, і інший кодує J/C ділянку. Локуси важкого ланцюга та каппа легкого ланцюга містять багато V генних сегментів (оцінки варіюють від 100 до 1000), котрі, за оцінкою, охоплюють набагато більше 1000 kb. Ламбда локус, навпроти, набагато менший і, як було показано, охоплює приблизно 300 kb на хромосомі 16 у миші. Він складається із двох варіабельних генних сегментів та чотирьох з'єднувальних/константних (J/C) ділянкових генних сегментів. Утворення функціонального гена потребує рекомбінації між V та J/C елементами. У В-клітині, в якій антитіло продукується природним чином, контроль транскрипції генів як реаранжованого важкого ланцюга, так і реаранжованого каппа легкого ланцюга залежить як від активності промотора, специфічного до тканини, вище від V ділянки, так і від енхансера, специфічного до тканини, розміщеного у J-C інтроні. Ці елементи діють у синергічний спосіб. Крім того, у локусі каппа легкого ланцюга був ідентифікований другий В-клітинний специфічний енхансер. Цей додатковий енхансер розташований 9 kb нижче Сkappa. Таким чином, гібридомний метод іморталізації антитіло експресуючих генів залежить від ендогенної промоторної та енхансерної послідовностей батьківської В-клітинної лінії. Як альтернатива, нуклеїнові кислоти даного винаходу можуть бути експресовані у клітині-хазяїні шляхом укручування (шляхом маніпуляції) у клітину-хазяїна, що містить ендогенну ДНК, котра кодує антитіло даного винаходу. Такі методи добре відомі у даній галузі, наприклад, як описано у патентах США за номерами 5580734, 5641670, 5733746 та 5733761, на які у даній заявці зроблені повні посилання. Клонування геномної ДНК антитіла у штучний вектор є іншим способом створення клітин-хазяїв, здатних експресувати антитіла. Проте, експресія моноклональних антитіл поза сильним промотором підвищує шанси ідентифікації високопродуктивних клітинних ліній та одержання більш високих виходів моноклональних антитіл. Антитіла даного винаходу можуть одержуватись у трансфектомі 35 клітини-хазяїна з використанням, наприклад, комбінації рекомбінантних ДНК способів та методів трансфекції генів, як добре відомо у даній галузі (наприклад, Morrison, S. (1985) Science 229:1202). Системи для клонування та експресії біофармацевтичних препаратів, включаючи антитіла, у різновиді різних клітин-хазяїв добре відомі. Придатні клітини-хазяї включають бактерії, клітини ссавців, рослинні клітини, дріжджові та бакуловірусні системи, і трансгенні рослини та тварини. Ссавцеві клітинні лінії, що маються у даній галузі для експресії гетерологічних поліпептидних інтактних глікозильованих білків, включають яєчникові клітини китайського хом'ячка (СНО), HeLa клітини, ниркові клітини дитинчати хом'ячка (ВНК), NSO клітини меланоми миші та створені клітинні лінії, наприклад, SP2/0, YB2/0 (ATC CRL-1662) клітини мієломи щура, ниркові клітини ембріону людини (НЕК), клітини сітківки ембріону людини PerC.6, hep G2 клітини, BSC-1 (наприклад, АТСС CRL-26) та багато інших, що доступні від, наприклад, American Type Culture Collection, Manassas, Va (www.atcc.org). Звичайним бактеріальним хазяїном, якому віддається перевага, є E. coli. Клітини ссавців, такі як СНО клітини, клітини мієломи, НЕК293 клітини, ВНК клітини (ВНК21, ATСС CRL-10), мишачі Ltk-клітини та NIH3T3 клітини часто використовуються для стабільної експресії гетерологічних генів. Навпаки, клітинні лінії, такі як Cos (COS-1 ATCC CRL 1650; COS-7, ATCC CRL-1651) та НЕК293 звичайно використовуються для тимчасової експресії рекомбінантних білків. Ссавцеві клітини-хазяї для експресії рекомбінантних антитіл даного винаходу, яким віддається перевага, включають клітини мієломи, такі як Sp2/0, YB2/0 (ATC CRL-1662), NSO та P3 × 63.Ag8.653 (наприклад, SP2/0-Ag14), завдяки їх високій швидкості експресії. Зокрема, для застосування з NSO клітинами мієломи іншою експресуючою системою, якій віддається перевага, є GS генна експресуюча система, що розкрита у WO 87/04462, WO 89/01036 та ЕР 338841. Коли рекомбінантні експресуючі вектори, що кодують гени антитіл, уведені у клітини-хазяї ссавця, антитіла одержуються шляхом культивування клітин-хазяїв протягом періоду часу, достатнього для експресії антитіла у даних клітинах-хазяях, або, краще, секреції даного антитіла у культуральне середовище, в якому вирощуються клітини-хазяї. Антитіла можуть бути відновлені із культурального середовища за допомогою стандартних методів очищення білків. Ілюстрацією клітинних культур, придатних для одержання антитіл, їх визначених частин або варіантів, є клітини ссавців. Ссавцеві клітинні системи часто є у формі моношарів клітин, хоча можуть бути використані й суспензії клітин ссавців або біореактори. У даній галузі розроблений ряд придатних ліній клітин-хазяїв, що здатні експресувати інтактні глікозильовані білки, і вони включають COS-1 (наприклад, ATCC CRL 1650), COS-7 (наприклад, ATCC CRL-1651), HEK293, BHK21 (наприклад, ATCC CRL-10), CHO (наприклад, ATCC CRL 1610) та BSC-1 (наприклад, ATCC CRL-26) клітинні лінії, 97232 36 Cos-7 клітини, СНО клітини, hep G2 клітини, P3 × 63Ag8.653, SP2/0-Ag14, 293 клітини, HeLa клітини і таке подібне, котрі легко доступні, наприклад, від American Type Culture Collection, Manassas, Va (www.atcc.org). Клітини-хазяї, яким віддається перевага, включають клітини лімфоїдного походження, такі як клітини мієломи та лімфоми. Клітинихазяї, яким віддається особлива перевага, включають P3 × 63Ag8.653 клітини (АТС Accession Number CRL-1580) та SP2/0-Ag14 клітини (АТС Accession Number CRL-1851). CHO-K1 та DHFR-CHO клітини DG44 та DUKB11 (G. Urlaub, L.A. Chasin, 1980. Proc. Natl. Acad. Sci. U. S. A. 77, 4216-4220) використовуються для високорівневого білкового виробництва, оскільки ампліфікація генів, що являють інтерес, здійснюється шляхом уведення селектовного, ампліфіковного маркера, DHFR з використанням, наприклад, метотрексату (МТХ) (R.J. Kaufman, 1990. Methods Enzymol. 185:537-566). DHFR CHO клітини можуть бути успішно використані для продукування рекомбінантних mAb на високому рівні. DHFR CHO можуть продукувати анти-МСР-1 антитіла при 6 -1 -1 швидкості 80-110 мг 10 клітин діб або більше 6 -1 -1 200 мг 10 клітин діб . Для одержання експресії H- та L-ланцюгів у цих СНО клітинах був застосований різновид промоторів, наприклад, bактиновий промотор, людський CMV MIE промотор, Ad вірусний головний пізній промотор (MLP), RSV промотор та мишачий лейкемійний вірус LTR. Ряд векторів для mAb експресії описаний у літературі, де два Ig ланцюги несуться двома різними плазмідами з незалежним селектовним/ампліфіковним маркером. Вектори, що містять один ланцюг антитіла, наприклад, Н-ланцюг, зчеплений з DHFR маркером, та L-ланцюгова експреr суюча касета з Neo маркером, або навпаки, можуть бути використані для одержання до 180 мг -1 -1 гуманізованого mAb L 7 діб . Методи, що використовуються для первинної селекції та наступної ампліфікації, можуть варіювати і добре відомі фахівцям у даній галузі. Загалом, високорівнева mAb експресія може бути досягнута з використанням наступних стадій: первинна селекція та наступна ампліфікація потенційних клонів, коселекція (наприклад, у випадках, де як Н-ланцюговий так і Lланцюговий вектори несуть DHFR експресуючу одиницю) та ампліфікація, коампліфікація з використанням різних ампліфіковних маркерів, та первинна селекція і ампліфікація у масовій культурі з наступним клонуванням розведення для ідентифікації окремих високоекспресуючих клонів. Оскільки інтеграційні сайти можуть впливати на ефективність Н-ланцюгової та L-ланцюгової експресії і загальної mAb експресії, були створені окремі вектори, в яких дві Ig-ланцюгові експресуючі одиниці поміщені у тандем. Ці вектори також несуть доміr нуючий селектовний маркер, такий як Neo та DHFR експресуючу касету. Огляд дивись у роботі Ganguly, S. та A. Shatzman. Expression Systems, mammalian cells IN: Encyclopedia of Bioprocess Technology: Fermentation, Biocatalysis and Bioseparation. 1999, John Wiley & Sons, Inc. Cockett et al. (1990. Bio/Technology 8, 662-667) розробили GS систему для високорівневої експре 37 сії гетерологічних генів у СНО клітинах. Трансфекція експресуючого вектора, що містить кДНК (під транскрипційним контролем hCMV промотора) та GS міні ген (під контролем SV40 пізнього промотору), у СНО-К1 клітини (з наступною селекцією 20 мМ – 500 мМ MSX) може бути використана для вироблення клонів, що експресують антитіла даного винаходу у виходах, що порівнянні з цим для DHFR-CHO систем. Обговорюється GS система в цілому або частково у зв'язку з європейськими патентами за номерами 0216846, 0256055 та 0323997, і європейськоє патентною заявкою за номером 893039644. Як приклад, що не несе будь-яких обмежень, листя трансгенного тютюну, що експресує рекомбінантні білки, успішно застосовується для запровадження великих кількостей рекомбінантних білків, наприклад, з використанням індукованого промотору. Дивись, наприклад, Cramer et al., Curr. Top. Microbol. Immunol. 240:95-118 (1999) і цитовані там посилання. Крім того, трансгенний маїс використовується для експресії білків ссавця на рівнях комерційного виробництва, з біологічними активностями, еквівалентними отриманим в інших рекомбінантних системах або виділеним із природних джерел. Дивись, наприклад, Hood et al., Adv. Exp. Med. Biol. 464:127-147 (1999) та цитовані там посилання. Антитіла були також отримані у великих кількостях із насіння трансгенних рослин, включаючи насіння тютюну та бульби картоплі. Дивись, наприклад, Conrad et al., Plant Mol. Biol. 38:101-109 (1998) та цитовані там посилання. Таким чином, антитіла даного винаходу можуть також бути одержані з використанням трансгенних рослин згідно з відомими методами. Дивись також, наприклад, Fischer et al., Biotechnol. Appl. Biochem. 30:99-108 (Oct., 1999), Ma et al., Trends Biotechnol. 13:522-7 (1995); Ma et al., Plant Physiol. 109:341-6 (1995); Whitelam et al., Biochem. Soc. Trans. 22:940944 (1994); та цитовані там посилання. Дивись також, загалом, щодо експресії рослин та антитіл, проте не обмежуючись цим, патент США за номером 5959177. На кожну наведену вище роботу у даній заявці зроблено повне посилання. 5. Очищення антитіла Анти-МСР-1 антититіло може бути відновлене та виділене із рекомбінантних клітинних культур з використанням добре відомих методів, включаючи, але не обмежуючись цим, очищення білку А, осадження із сульфату амонію або етанолу, кислотну екстракцію, аніоно- або катіонообмінну хроматографію, фосфоцелюлозну хроматографію, гідрофобну інтеракційну хроматографію, афінну хроматографію, гідроксилапатитну хроматографію та лектинову хроматографію. Для очистки може застосовуватись також високопродуктивна рідинна хроматографія ("HPLC"). Дивись, наприклад, роботи Colligan, Current Protocols in Immunology, або Current Protocols in Protein Science, John Wiley & Sons, NY, NY, (1977-2001), наприклад, глави 1, 4, 6, 8, 9, 10, на кожну із яких у даній заявці зроблено повне посилання. Антитіла даного винаходу включають природно очищені продукти, продукти хімічних синтетичних процедур та продукти, одержані рекомбінант 97232 38 ними методами із еукаріотного хазяїна, включаючи, наприклад, клітини дріжджів, вищих рослин, комах та ссавців. У залежності від застосованого хазяїна у процедурі рекомбінантного одержання, антититіло даного винаходу може бути глікозильованим або неглікозильованим, де перевага віддається глікозильованому. Такі методи описані у багатьох стандартних лабораторних підручниках, таких як Sambrook, вище, розділи 17.37-17.42; Ausubel, вище, глави 10, 12, 13, 16, 18 та 20, Colligan, Protein Science, вище, глави 12-14, на які у даній заявці зроблені повні посилання. 6. Антитіла даного винаходу Анти-МСР-1 антитіла (що також називаються анти-CCL-2 антитіла або МСР-1 антитіла), корисні у методах та композиціях даного винаходу, можуть, при потребі, бути охарактеризовані високоафінним зв'язуванням з МСР-1, високоспецифічним зв'язуванням з МСР-1, здатністю інгібувати одну або кілька біологічних активностей, пов'язаних з МСР-1, та, при потребі і краще, тим, що мають низьку токсичність. Антитіла даного винаходу можуть зв'язувати людський МСР-1 з широким діапазоном спорідненостей (КD). У варіанті, якому віддається перевага, принаймні одне людське mAb даного винаходу може, при потребі, зв'язувати людський МСР-1 з високою спорідненістю. Наприклад, людське mAb може зв'язувати людський МСР-1 з KD, що дорів-7 нює або менше приблизно 10 М або, такою як, проте не обмежуючись цим, 0,1-9,9 (або будь-який -7 -8 -9 -10 -11 діапазон або значення) Х 10 , 10 , 10 , 10 , 10 , -12 -13 10 , 10 М, або будь-який діапазон або значення у цих межах. Спорідненість або авідність антитіла до антигену може бути визначена експериментально з використанням будь-якого придатного способу. (Див., наприклад, Berzofsky, et al., ”AntibodyAntigen Interactions”, In Fundamental Immunology, Paul, W.E., Ed., Raven Press: New York, NY (1984); Kuby, Janis Immunology, W.H. Freeman and Company: New York, NY (1992); та описані в цих роботах способи). Визначена спорідненість взаємодії конкретне антитіло-антиген може варіювати, якщо вимірювання проводяться за різних умов (наприклад, концентрація солі, рН). Таким чином, вимірювання спорідненості та інших антигензвязувальних параметрів (наприклад, KD, Ka, Kd) проводиться, краще, зі стандартизованими розчинами антитіла та антигену, та стандартизованим буфером, такими як стандартні розчини та буфери, що описані у даній заявці. Ізольовані антитіла даного винаходу містять амінокислотні послідовності антитіла, що розкриті у даній заявці, які кодуються будь-яким придатним полінуклеотидом або будь-яким ізольованим або виготовленим антитілом. Краще, коли людське антитіло або зв'язуючий антиген фрагмент зв'язує людський МСР-1 і, таким чином, частково або у значній мірі нейтралізує принаймні одну біологічну активність даного білка. Антитіло або його визначена частина, або варіант, що частково або, краще, у значній мірі нейтралізує принаймні одну біологічну активність принаймні одного МСР-1 білка або фрагмента, може зв'язати білок або фрагмент 39 і таким чином інгібувати активності, опосередковані через зв'язування МСР-1 з МСР-1 рецептором або через інші залежні або опосередковані МСР-1 механізми. Як застосовується у даному тексті, термін "нейтралізуюче антитіло" стосується антитіла, яке може інгібувати залежну від МСР-1 активність приблизно на 20-120 %, краще, на принаймні приблизно 10, 20, 30, 40, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100 % або більше, у залежності від проби. Здатність анти-МСР1 антитіла інгібувати залежну від МСР-1 активність оцінюється, краще, з використанням принаймні однієї придатної МСР-1 білкової або рецепторної проби, як описано у даній заявці та/або відомо у даній галузі. Людське антитіло даного винаходу може бути будь-якого класу (IgG, IgA, IgM, IgE, IgD і т.д.) або ізотипу, і може містити каппа або ламбда легкий ланцюг. В одному варіанті дане людське тіло містить IgG важкий ланцюг або визначений фрагмент, наприклад, принаймні один із ізотипів, IgG1, IgG2, IgG3 або IgG4. Антитіла цього типу можуть бути одержані шляхом використання трансгенної миші або іншого трансгенного нелюдського ссавця, що містить принаймні один людський трансген легкого ланцюга (наприклад, IgG, IgA та IgM (наприклад, 1, 2, 3, 4), як тут описано та/або відомо у даній галузі. В іншому варіанті МСР-1 людське антитіло проти людини містить IgG1 важкий ланцюг та IgG1 легкий ланцюг. Принаймні одне антититіло даного винаходу зв'язує принаймні один визначений епітоп, специфічний до принаймні одного МСР-1 білка, його фрагмента, частини або будь-якої їх комбінації. Принаймні один епітоп може включати принаймні одну ділянку, котра зв'язує антитіло, що містить принаймні одну частину білка, де даний епітоп складається, краще, із принаймні 1-3 амінокислот зі всією визначеною частиною суміжних амінокислот SEQ ID NO: 1. Загалом, людське антитіло або фрагмент, що зв'язує антиген, даного винаходу містить ділянку, що зв'язує антиген, котра включає принаймні одну людську гіперваріабельну ділянку (CDR1, CDR2 та CDR3) або варіант принаймні однієї варіабельної ділянки важкого ланцюга та принаймні одну людську гіперваріабельну ділянку (CDR1, CDR2 та CDR3) або варіант принаймні однієї варіабельної ділянки легкого ланцюга. Як приклад, що не вносить будь-яких обмежень, антитіло або частина, яка зв'язує антиген, або варіант можуть містити принаймні одну CDR3 важкого ланцюга, котра має амінокислотну послідовність SEQ ID NO: 9 або 12, та/або CDR3 легкого ланцюга, що має амінокислотну послідовність SEQ ID NO: 15-17, 20 або 21. В особливому варіанті антитіло або фрагмент, що зв'язує антиген, може мати ділянку, що зв'язує антиген, котра включає принаймні частину принаймні однієї CDR важкого ланцюга (наприклад, CDR1, CDR2 та/або CDR3), що має амінокислотну послідовність відповідних CDR 1, 2 та/або 3 (наприклад, SEQ ID NOS: 6-12 та/або 22, 23 і 26). В іншому особливому варіанті антитіло або частина, що зв'язує антиген, або варіант може мати ділянку, котра зв'язує антиген, що включає принаймні частину принаймні однієї CDR легкого ланцюга 97232 40 (тобто CDR1, CDR2 та/або CDR3), яка має амінокислотну послідовність відповідних CDR 1, 2 та/або 3 (наприклад, SEQ ID NOS: 13-21 та/або 24 та 25). У варіанті, якому віддається перевага, три CDR важкого ланцюга та три CDR легкого ланцюга антитіла або фрагмента, що зв'язує антиген, отримуються із відповідної CDR принаймні одного із Fab MOR0336, MOR03464, MOR03468, MOR03470, MOR03471, MOR03473, MOR03548 як тут описано, і рамкові ділянки важкого ланцюга отримуються із VH3 антитіла (SEQ ID NO: 2), і рамкові ділянки легкого ланцюга отримуються із антитіла каппа-типу (SEQ ID NO: 4). Такі антитіла можуть бути одержані шляхом хімічного з'єднання між собою різних частин (CDR та рамкових) даного антитіла з використанням звичайних способів, шляхом одержання та експресії молекули нуклеїнової кислоти, котра кодує антитіло, з використанням звичайних способів рекомбінантної ДНК технології або будь-якого іншого придатного способу. Анти-МСР-1 антитіло може включати принаймні одну варіабельну ділянку важкого або легкого ланцюга, що має визначену амінокислотну послідовність у рамкових ділянках. Наприклад, у варіанті, якому віддається перевага, анти-МСР-1 антитіло включає принаймні одну із варіабельних ділянок принаймні одного важкого ланцюга, при потребі, що має амінокислотну послідовність SEQ ID NO: 2 або 3, та/або принаймні одну варіабельну ділянку легкого ланцюга, при потребі, що має амінокислотну послідовність SEQ ID NO: 4 або 5. Клас антитіла або ізотип (IgA, IgD, IgE, IgG або IgM) визначається константними ділянками, що кодуються генами константної ділянки важкого ланцюга. Серед людського IgG класу є чотири підкласи або субтипи: IgG1, IgG2, IgG3 та IgG4, перелічені у порядку їх природного достатку у сироватці, починаючи від найвищого до найнижчого. IgА антитіла діляться на два підкласи, IgA1 та IgA2. Як застосовується у даному тексті, термін "перемикання ізотипу" також стосується переходу між IgG підкласами або субтипами. Даний винахід також стосується антитіл, фрагментів, що зв'язують антиген, імуноглобулінових ланцюгів та CDR, що містять амінокислоти у послідовності, котра суттєво така сама як амінокислотна послідовність, описана тут. Краще, коли такі антитіла або фрагменти, що зв'язують антиген, та антитіла, які містять такі ланцюги або CDR, можуть зв'язувати людський МСР-1 з високою спорідненістю (наприклад, KD менше або дорівнює приблизно -9 10 М). Амінокислотні послідовності, що суттєво такі самі як описані тут послідовності, включають послідовності, котрі містять консервативні амінокислотні замісники, так само як і амінокислотні делеції та/або інсерції. Консервативна амінокислотна заміна стосується заміщення першої амінокислоти другою амінокислотою, котра має хімічні та/або фізичні властивості (наприклад, заряд, структура, полярність, гідрофобність/гідрофільність), які схожі з властивостями першої амінокислоти. Консервативні заміни включають заміщення однієї амінокислоти другою у межах наступних груп: лізин (К), аргінін (R) та гістидин (Н); аспартат (D) та глутамат (Е); аспарагін 41 97232 (N), глютамін (Q), серин (S), треонін (Т), тирозин (Y), K, R, H, D та Е; аланін (А), валін (V), лейцин (L), ізолейцин (І), пролін (Р), фенілаланін (F), триптофан (W), метіонін (М), цистеїн (С) та гліцин (G); F, W та Y; C, S та Т. Анти-МСР-1 антитіло даного винаходу може включати одну або кілька амінокислотних замін, делецій або добавок, від природних мутацій або людських маніпуляцій, як визначено у даному тексті або зазначено у Knappik et al. US 6828422, для варіабельних ділянок, отриманих із людських зародкових генних послідовностей та групованих за подібностями послідовностей у родини, що позначаються VH1A, VH1B, VH2 і т.д., і за легкими лан 42 цюгами як каппа або ламбда підгрупи. Ці послідовності та інші послідовності, котрі можуть використовуватись у даному винаході, включають, проте не обмежуючись цим, конфігурації, подані у Таблиці 1, як також описано на Фігурах 1-42 РСТ публікації WO 05/005604 та US 10/872932 від 06/21/2004, на які у даній заявці зроблено повне посилання, де Фігури 1-42 являють приклади варіабельних та константних доменних послідовностей важкого та легкого ланцюга, рамок, субдоменів, ділянок та замін, частини яких можуть бути використані у Ig дериватних білках даного винаходу, як тут зазначено. Таблиця 1 Конфігурації антитіла людини Ряд амінокислотних замін, як розуміє фахівець у даній галузі, залежить від багатьох чинників, включаючи ті, що описані вище. Загалом, кількість амінокислотних замін, інсерцій або делецій для будь-якого заданого анти-МСР-1 антитіла, фрагмента або варіанта не буде перевищувати 40, 30, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, і буде така як 1-30 або будь-який інший інтервал чи значення у цьому інтервалі як тут визначено. Амінокислоти в анти-МСР-1 антитілі даного винаходу, котрі суттєві для функції, можуть бути ідентифіковані за допомогою методів, що відомі у даній галузі, таких як сайт-спрямований мутагенез або аланін-сканувальний мутагенез (наприклад, Ausubel, вище, глави 8, 15; Cunningham and Wells, Science 244:1081-1085 (1989)). В останній процедурі у кожний залишок у молекулі вводяться окремі аланінові мутації. Потім результуючі мутантні молекули випробуються на біологічну активність, таку як, проте не обмежуючись цим, принаймні одна МСР-1 нейтралізуюча активність. Сайти, кри 43 тичні щодо зв'язування антитіла, можуть також бути ідентифіковані методами структурного аналізу, такими як кристалізація, ядерний магнітний резонанс або фотоафінне маркування (Smith, et al., J. Mol. Biol. 224:899-904 (1992) and de Vos, et al., Science 255:306-312 (1992)). Анти-МСР-1 антитіла даного винаходу можуть включати, проте не обмежуючись цим, принаймні одну частину, послідовність або комбінацію, що вибрана із від 5 до всіх суміжних амінокислот принаймні однієї із SEQ ID NOS: 2-5 та 27-28. Анти-МСР-1 антитіло може додатково, при потребі, включати поліпептид із принаймні однієї із SEQ ID NOS: 27 та 28. В одному варіанті амінокислотна послідовність імуноглобулінового ланцюга або її частина має приблизно 100 % ідентичність з амінокислотною послідовністю відповідного ланцюга принаймні однієї із SEQ ID NOS: 27-28, за виключенням консервативних замін, котрі не змінюють специфічність зв'язування анти-МСР-1 антитіла. Наприклад, амінокислотна послідовність варіабельної ділянки легкого ланцюга може бути порівняна з послідовністю SEQ ID NO: 4 або 5, або амінокислотна послідовність важкого ланцюга може бути порівняна з SEQ ID NO: 2 або 3. Краще, коли амінокислотну ідентичність визначають з використанням придатного комп'ютерного алгоритму як це відомо у даній галузі. Як зрозуміло фахівцеві у даній галузі, даний винахід включає принаймні одне біологічно активне антитіло даного винаходу. Біологічно активні антитіла мають специфічну активність принаймні 20 %, 30 % або 40 %, і краще, принаймні 50 %, 60 % або 70 %, і найкраще, принаймні 80 %, 90 % або 95-100 % відносно природного (несинтетичного), ендогенного або спорідненого та відомого антитіла. Способи тестування та кількісного аналізу ензиматичної активності і специфічності субстрату добре відомі фахівцям у даній галузі і описані тут. В іншому аспекті даний винахід стосується людських антитіл та фрагментів, що зв'язують антиген, як тут описано, котрі модифіковані шляхом ковалентного приєднання органічної складової. Така модифікація може давати антитіло або фрагмент, що зв'язує антиген, з поліпшеними фармакокінетичними властивостями (наприклад, підвищений період in vivo пів-розкладу у сироватці). Органічна складова може являти собою лінійну або розгалужену гідрофільну полімерну групу, жирнокислотну групу або жирнокислотно-ефірну групу. В окремих варіантах гідрофільна полімерна група може мати молекулярну вагу від приблизно 800 до приблизно 120000 дальтонів і може являти собою поліалкановий гліколь (наприклад, поліетиленгліколь (PEG), поліпропіленгліколь (PPG), вуглеводний полімер, амінокислотний полімер або полівінілпіролідон, і жирнокислотна або жирнокислотно-ефірна група може містити від приблизно восьми до приблизно сорока вуглецевих атомів. Модифіковані антитіла та фрагменти, що зв'язують антиген, даного винаходу можуть включати одну або кілька органічних складових, що ковалентно зв'язані, прямо або опосередковано, з даним антитілом. Кожна органічна складова, котра зв'язана з антитілом або фрагментом, що зв'язує ан 97232 44 тиген, даного винаходу може бути, незалежно, гідрофільною полімерною групою, жирнокислотною групою або жирнокислотно-ефірною групою. Як застосовується у даному тексті, термін "жирна кислота" охоплює монокарбонові кислоти та дикарбонові кислоти. "Гідрофільна полімерна група", як термін, що тут використовується, стосується органічного полімеру, котрий більше розчинний у воді, ніж в октані. Наприклад, полілізин більш розчинний у воді, ніж в октані. Таким чином, антитіло, модифіковане шляхом ковалентного приєднання полілізину, охоплюється даним винаходом. Гідрофільні полімери, що придатні для модифікації антитіл даного винаходу, можуть бути лінійними або розгалуженими і включають, наприклад, поліалкангліколі (наприклад, PEG, монометоксиполіетиленгліколь (mPEG), PPG і таке подібне), вуглеводи (наприклад, декстрин, целюлоза, олігосахариди, полісахариди і таке подібне), полімери гідрофільних амінокислот (наприклад, полілізин, поліаргінін, поліаспартат і таке подібне), поліалканоксиди (наприклад, поліетиленоксид, поліпропіленоксид і таке подібне) та полівінілпіролідон. Краще, коли гідрофільний полімер, котрий модифікує антитіло даного винаходу, має молекулярну вагу від приблизно 800 до приблизно 150000 дальтонів як окрема молекулярна одиниця. Наприклад, можуть бути використані PEG5000 та PEG20000, де підрядкова цифра являє собою середню молекулярну вагу даного полімеру у дальтонах. Гідрофільна полімерна група може бути заміщена приблизно однією шістьма алкільними, жирнокислотними або жирнокислотно-ефірними групами. Гідрофільні полімери, що заміщені жирнокислотною або жирнокислотно-ефірною групою, можуть бути одержані за допомогою придатних методів. Наприклад, полімер, що містить аміногрупу, може бути сполучений з карбоксилатом жирної кислоти або жирнокислотним ефіром, і активований карбоксилат (наприклад, активований N,Nкарбоніл діімідазолом) на жирній кислоті або жирнокислотному ефірі може бути сполучений з гідроксильною групою на полімері. Жирні кислоти та жирнокислотні ефіри, придатні для модифікації антитіл даного винаходу, можуть бути насиченими або можуть містити одну або кілька одиниць ненасичення. Жирні кислоти, що придатні для модифікування антитіл даного винаходу, включають, наприклад, n-додеканоат (С12, лаурат), n-тетрадеканоат (С14, міристат), nоктадеканоат (С18, стеарат), n-ейкозаноат (С20, арахідат), n-докозаноат (С22, бегенат), nтриаконтаноат (С30), n-тетраконтаноат (С40), цис9-октадеканоат (С18, олеат), усі цис-5, 8, 11, 14ейкозатетраеноат (С20, арахідонат), октандикислоту, тетрадекандикислоту, октадекандикислоту, докозандикислоту, і таке подібне. Придатні жирнокислотні ефіри включають моноефіри дикарбонових кислот, що містять лінійну або розгалужену групу нижчого алкілу. Група нижчого алкілу може містити від одного до приблизно дванадцяти, краще, від одного до приблизно шести вуглецевих атомів. Модифіковані людські антитіла та фрагменти, що зв'язують антиген, можуть бути одержані з ви 45 користанням придатних методів, таких як за реакцією з одним або кількома модифікуючими агентами. "Модифікуючий агент", як термін, що тут використовується, стосується придатної органічної групи (наприклад, гідрофільний полімер, жирна кислота, жирнокислотний ефір), яка містить активуючу групу. "Активуюча група" являє собою хімічну складову або функціональну групу, котра, за відповідних умов, реагує із другою хімічною групою, утворюючи у такий спосіб ковалентний зв'язок між даним модифікуючим агентом та другою хімічною групою. Наприклад, амінореакційні активуючі групи включають електрофільні групи, такі як тозилат, мезилат, гало (хлоро, бромо, фторо, йодо), N-гідроксисукцинімідильні ефіри (NHS), і таке подібне. Активуючі групи, що можуть реагувати з тіолами, включають, наприклад, малеімід, йодоацетил, акрилоліл, піридил, дисульфіди, тіол 5-тіол2-нітробензойної кислоти (TNB-тіол), і таке подібне. Альдегідна функціональна група може бути сполучена з молекулами, що містять амін або гідразид, і азидна група може реагувати з тривалентною фосфорною групою з утворенням фосфорамідатних або фосфорімідних зв'язків. Придатні способи введення активуючих груп у молекули відомі у даній галузі (дивись, наприклад, Hermanson, G.T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996)). Активуюча група може бути прямо з'єднана з органічною групою (наприклад, гідрофільним полімером, жирною кислотою, жирнокислотним ефіром) або через лінкерну складову, наприклад, дивалентну С1-С12 групу, де один або кілька вуглецевих атомів можуть бути заміщені гетероатомом, таким як кисень, азот або сірка. Придатні лінкерні складові включають, наприклад, тетраетиленгліколь, -(CH2)3-, -NH-(CH2)6NH-, -(CH2)2-NH та –CH2-O-CH2-CH2-O-CH2-CH2-OCH-NH-. Модифікуючі агенти, що містять лінкерну складову, можуть бути отримані, наприклад, шляхом реакції моно-Вос-алкілдіаміну (наприклад, моно-Вос-етилендіаміну, моно-Вос-діаміногексану) з жирною кислотою у присутності 1-етил-3-(3диметиламінопропіл) карбодііміду (EDC) з утворенням амідного зв'язку між вільним аміном та карбоксилатом жирної кислоти. Вос захисна група може бути вилучена із даного продукту шляхом обробки трифторооцтовою кислотою (TFA) для експозиції первинного аміну, котрий може бути сполучений з іншим карбоксилатом, як описано, або може реагувати з малеїновим ангідридом, і результуючий продукт буде підданий циклізації з одержанням активованої малеімідо похідної даної жирної кислоти. (Дивись, наприклад, Thompson, et al., WO 92/16221, на яку у даному тексті зроблено повне посилання). Модифіковані антитіла даного винаходу можуть бути продуковані шляхом реакції людського антитіла або фрагмента, що зв'язує антиген, з модифікуючим агентом. Наприклад, органічні складові можуть бути зв'язані з антитілом у сайтнеспецифічній манері шляхом застосування амінореакційного модифікуючого агента, наприклад, NHS ефіру PEG. Модифіковані людські антитіла або фрагменти, що зв'язують антиген, можуть також бути одержані шляхом відновлення дисульфі 97232 46 дних зв'язків (наприклад, внутрішньоланцюгових дисульфідних зв'язків) антитіла або фрагмента, що зв'язує антиген. Відновлене антитіло або фрагмент, що зв'язує антиген, потім може реагувати з тіолреакційним модифікуючим агентом з утворенням модифікованого антитіла даного винаходу. Модифіковані людські антитіла та фрагменти, що зв'язують антиген, які включають органічну складову, котра зв'язана зі специфічними сайтами антитіла даного винаходу, можуть бути одержані з використанням придатних способів, таких як оборотний протеоліз (Fisch et al., Bioconjugate Chem., 3:147-153 (1992); Werlen et al., Bioconjugate Chem., 5:411-417 (1994); Kumaran et al., Protein Sci. 6(10):2233-2241 (1997); Itoh et al., Bioorg. Chem., 24(1): 59-68 (1996); Capellas et al., Biotechnol. Bioeng., 56(4):456-463 (1997)), та способів, котрв описані у роботі Hermanson, G.T., Bioconjugate Techniques, Academic Press: San Diego, CA (1996). 7. Анти-ідіотипні антитіла проти анти-МСР-1 антитіл На додаток до моноклональних або химерних анти-МСР-1 антитіл, даний винахід також спрямований на анти-ідіотипне (анти-Id) антитіло, специфічне щодо таких антитіл даного винаходу. АнтиId антитіло являє собою антитіло, котре визнає унікальні детермінанти, котрі, загалом, асоціюються з антиген-звязувальною ділянкою іншого антитіла. Анти-Id може бути одержане шляхом імунізації тварини того самого виду та генетичного типу (наприклад, штам миші) як джерела Id антитіла з антитілом або його ділянкою, що містить CDR. Імунізована тварина визнає та реагує на ідіотипні детермінанти імунізованого антитіла і продукує анти-Id антитіло. Анти-Id антитіло може також бути використано як "імуноген" для індукування імунної реакції в ще іншій тварині, продукуючи так зване анти-анти-Id антитіло. 8. Композиції антитіла, що містять додаткові терапевтично активні інгредієнти Дана композиція може, при потребі, додатково містити ефективну кількість принаймні однієї сполуки або білка, котрі вибираються із принаймні одних дерматологічних ліків, протизапальних ліків, анальгетиків, ниркових ліків (наприклад, ангіотензин рецепторний блокатор (ARB) або антагоніст), протиінфекційних ліків, серцево-судинних (CV) системних ліків, ліків центральної нервової системи (CNS), ліків вегетативної нервової системи (ANS), ліків респіраторного тракту, ліків шлунковокишкового тракту (GI), гормональних ліків, ліків для флюїдного або електролітного балансу, гематологічних ліків, протипухлинних ліків, імуномодуляційних ліків, офтальмічних, вушних або назальних ліків, ліків місцевого призначення, ліків, пов'язаних з харчуванням, або такого подібного. Такі ліки добре відомі у даній галузі, включаючи препарати, показання, дозування та застосування для кожних, що тут представлені (дивись, наприst клад, Nursing 2001 Handbook of Drugs, 21 edition, Springhouse Corp., Springhouse, PA, 2001; Health Professional's Drug Guide 2001, ed., Shannon, Wilson, Stang, Prentice-Hall, Inc., Upper Saddle River, NJ; Pharmcotherapy Handbook, Wells et al., ed., Appleton & Lange, Stamford, CT, на які у даній заявці 47 зроблені повні посилання). Композиції анти-МСР-1 антитіла даного винаходу можуть також включати принаймні одну із будь-якої придатної та ефективної кількості композицію або фармацевтичну композицію, яка містить принаймні одне анти-МСР-1 антитіло проти клітини, тканини, органу, тварини або пацієнта, котрий потребує такої модуляції, лікування або терапії, яка, при потребі, додатково містить принаймні один, вибраний із принаймні одного TNF, антагоніст (наприклад, проте не обмежуючись цим, TNF хімічний або білковий антагоніст, TNF моноклональне або поліклональне антитіло або фрагмент, розчинний TNF рецептор (наприклад, р55, р70 або р85) або фрагмент, його злиті поліпептиди, або TNF антагоніст з малою молекулою, наприклад, TNF зв'язуючий протеїн І або ІІ (ТВР-1 або ТВР-2), нерелімонмаб, інфліксимаб, ентерасепт, CDP-571, CDP-870, афелімомаб, ленерсепт і таке подібне), протиревматичний засіб (наприклад, метотрексат, ауранофен, ауротіоглюкозу, азатіоприн, етанерсепт, золото-натрій тіомалат, гідроксихлорокін сульфат, лефлуномід, сульфасалзин), м'язовий релаксант, наркотичний, нестероїдний протизапальний засіб (NSAID), анальгетик, анестетик, седативний засіб, місцевий анестетик, нервовом'язовий блокатор, протимікробний засіб (наприклад, аміноглікозид, протигрибковий засіб, протипаразитний засіб, противірусний засіб, карбапенем, цефалоспорин, флуорохінолон, макролід, пеніцилін, сульфонамід, тетрациклін, інший протимікробний засіб), протипсоріатичний засіб, кортикостероїд, анаболічний стероїд, зв'язаний з діабетом агент, мінерал, ліки, що пов'язані з харчуванням, тіреоїдний агент, вітамін, зв'язаний з кальцієм гормон, ліки проти діареї, протикашльові ліки, протиблювотний засіб, противиразкові ліки, проносний засіб, антикоагулянт, еритропіетин (наприклад, епоетин альфа), філграстим (наприклад, G-CSF, Neupogen), сарграмостим (GM-CSF, лейкін), агент проти хронічної легеневої обструктивної хвороби (COPD), анти-фібротичний агент, імунізаційний засіб, імуноглобулін, імунодепресант (наприклад, базиліксимаб, циклоспорин, дацлізумаб), гормон росту, ліки, що замінюють гормони, модулятор естрогенного рецептора, мідриатичний засіб, циклоплегічний засіб, алкілуючий агент, антиметаболітний засіб, міотичний інгібітор, радіофармацевтичний засіб, антидепресант, агент проти маніакального стану, антипсихотичні ліки, анкзіолітики, гіпнотичні засоби, симпатоміметик, стимулятор, донепезил, такрин, протиастматичні ліки, бета агоніст, інгаляційний стероїд, лейкотрієновий інгібітор, метилксантин, кромолін, епінефрин або аналог, дорназ альфа (пульмозим), цитокін або цитокіновий антагоніст. Приклади, що не вносять будь-яких обмежень, таких цитокінів включають, проте не обмежуючись цим, будь-який із IL-1 – IL-29. Придатні дози добре відомі у даній галузі. Дивись, наприклад, роботи Wells et al., eds., nd Pharmacotherapy Handbook, 2 Edition, Appleton and Lange, Stamford, CT (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, CA (2000), на кожну із яких у даній заявці зроблені 97232 48 повні посилання. Такі протиракові або протиінфекційні композиції можуть також містити молекули токсину, котрі асоційовані, зв'язані, скомпоновані або сумісно застосовуються з принаймні одним антитілом даного винаходу. Даний токсин, при потребі, селективно вбиває патологічну клітину або тканину. Даною патологічною клітиною може бути ракова або інша клітина. Такі токсини можуть бути, проте не обмежуючись цим, очищеними або рекомбінантними токсинами, або фрагментами токсинів, що містять принаймні один функціональний цитотоксичний домен токсину, наприклад, вибраний із принаймні одного токсину із рицину, дифтерійного токсину, отрутного токсину, або бактеріального токсину. Термін токсин також включає як ендотоксини, так і екзотоксини, що продукуються будьякими природними, мутантними або рекомбінантними бактеріями чи вірусами, котрі можуть спричинити будь-який патологічний стан у людей та інших ссавців, включаючи токсиновий шок, котрий може спричинити смерть. Такі токсини можуть включати, проте не обмежуючись цим, ентеротоксигенний E. coli, термолабільний ентеротоксин (LT), теплостійкий ентеротоксин (ST), цитотоксин Shigella, ентеротоксин Aeromonas, токсин-1 синдрому токсичного шоку (TSST-1), стафілококовий ентеротоксин А (SEA), B (SEB), або C (SEC), стрептококові ентеротоксини і таке подібне. Такі бактерії включають, проте не обмежуючись цим, штамми виду ентеротоксигенної E. coli (ETEC), ентерогеморагічної E. coli (наприклад, штамми серотипу 0157:Н7), стафілококові види (наприклад, Staphylococcus aureus, Staphylococcus pyogenes),виду Shigella (наприклад, Shigella dysenteriae, Shigella flexneri, Shigella boydii, та Shigella sonnei), виду Salmonella (наприклад, Salmonella typhi, Salmonella cholera-suis, Salmonella enteritidis), виду Clostridium (наприклад, Clostridium perfringens, Clostridium dificile, Clostridium botulinum), виду Camphlobacter (наприклад, Camphlobacter jejuni, Camphlobacter fetus), виду Heliobacter (наприклад, Heliobacter pylori), виду Aeromonas (наприклад, Aeromonas sobria, Aeromonas hydrophila, Aeromonas caviae), Pleisomonas shigelloides, Yersina enterocolitica, виду Vibrios (наприклад, Vibrios cholerae, Vibrios parahemolyticus), виду Klebsiella, Pseudomonas aeruginosa, та Streptococci. Дивись, наприклад, роботи Stein, ed., INrd TERNAL MEDICINE, 3 ed., pp 1-13, Little, Brown and Co., Boston, (1990); Evans et al., eds., Bacterial Infections of Humans: Epidemiology and Control, 2d. Ed., pp 239-254, Plenum Medical Book Co., New York (1991); Mandell et al., Principles and Practice of Infections Diseases, 3d. Ed., Churcill Livingstone, New York (1990); Berkow et al., eds., The Merck Math nual, 16 edition, Merck and Co., Rahway, N.J., 1992; Wood et al., FEMS Microbiology Immunology, 76:121-134 (1991); Marrack et al., Science, 248:705711 (1990), на кожну із яких у даній заявці зроблені повні посилання. Сполуки на основі анти-МСР-1 антитіла, композиції або комбінації даного винаходу можуть додатково включати принаймні одну із будь-яких допоміжних речовин, таких як, проте не обмежую 49 чись цим, розріджувач, зв'язувальна речовина, стабілізатор, буфери, солі, ліпофільні розчинники, консерванти, ад'юванти або таке подібне. Перевага віддається фармацевтично прийнятним допоміжним речовинам. Приклади, що не вносять будьяких обмежень, та способи приготування таких стерильних розчинів добре відомі у даній галузі, такі як, проте не обмежуючись цим, Gennaro, Ed., th Remington's Pharmaceutical Sciences, 18 Edition, Mack Publishing Co. (Easton, PA) 1990. Фармацевтично прийнятні носії можуть, звичайно, вибиратись у такий спосіб, щоб бути придатними до способу застосування, розчинності та/або стійкості даної композиції на основі анти-МСР-1 антититіла, фрагмента або варіанта, як це добре відомо у даній галузі або як описано у даній заявці. Фармацевтичні наповнювачі та добавки, корисні у даній композиції, включають, проте не обмежуючись цим, білки, пептиди, амінокислоти, ліпіди та вуглеводи (наприклад, цукри, включаючи моносахариди, ди-, три-, тетра- та олігосахариди; дериватизовані цукри, такі як алдитоли, альдонові кислоти, етерифіковані цукри і таке подібне; та полісахариди або цукрові полімери), котрі можуть включатись окремо або у комбінації, як 1-99,99 % за вагою або об'ємом. Ілюстративні білкові наповнювачі включають сироватковий альбумін, такий як сироватковий альбумін людини (HSA), рекомбінантний альбумін людини (rHA), желатин, казеїн і таке подібне. Репрезентативні компоненти амінокислота/антититіло, котрі можуть також діяти як буфери, включають аланін, гліцин, аргінін, бетаїн, гістидин, глутамінову кислоту, аспарагінову кислоту, цистеїн, лізин, лейцин, ізолейцин, валін, метіонін, фенілаланін, аспартам і таке подібне. Однією із амінокислот, якій віддається перевага, є гліцин. Вуглеводні наповнювачі, придатні для використання у даному винаході, включають, наприклад, моносахариди, такі як фруктоза, мальтоза, галактоза, глюкоза, D-маноза, сорбоза і таке подібне; дисахариди, такі як лактоза, цукроза, трегалоза, целобіоза і таке подібне; полісахариди, такі як рафіноза, мелецитоза, мальтодекстрини, декстрани, крохмалі і таке подібне; та альдитоли, такі як маніт, ксиліт, мальтит, лактит, ксиліт сорбіт (глюцит), міоінозитол і таке подібне. Вуглеводні наповнювачі, яким у даному винаході віддається перевага, включають маніт, трегалозу та рафінозу. Композиції на основі анти-МСР-1 антититіла можуть також включати буфер або агент, що регулює величину рН; типово, даний буфер являє собою сіль, що одержана із органічної кислоти або основи. Репрезентативні буфери включають солі органічної кислоти, такі як солі лимонної кислоти, аскорбінової кислоти, глюконової кислоти, карбонової кислоти, винної кислоти, бурштинової кислоти, оцтової кислоти або фталевої кислоти; Tris, трометамін гідрохлорид або фосфатні буфери. Буфери, яким віддається перевага у даних композиціях, включають солі органічної кислоти, такі як цитрат. Крім того, композиції даного винаходу на основі анти-МСР-1 антититіла можуть включати полімерні наповнювачі/добавки, такі як полівінілпіролідони, фіколи (полімерний цукор), декстрани 97232 50 (наприклад, циклодекстрини, такі як 2гідроксипропіл--циклодекстрин), поліетиленгліколі, ароматизатори, протимікробні агенти, підсолоджувачі, антиоксиданти, антистатики, поверхневоактивні речовини (наприклад, полісорбати, такі як "TWEEN 20" та "TWEEN 80"), ліпіди (наприклад, фосфоліпіди, жирні кислоти), стероїди (наприклад, холестерин), та хелатуючі агенти (наприклад, EDTA). Ці та додаткові відомі фармацевтичні наповнювачі та/або добавки, придатні для використання у композиціях даного винаходу на основі антиМСР-1 антититіла, частини або варіанта відомі у даній галузі, наприклад, як перелічено у книзі "Remington: The Science & Practice of Pharmacy", th 19 ed., Williams & Williams, (1995) та у книзі "Phynd sician's Desk Reference", 52 ed., Medical Economics, Montvale, NJ (1998), на які у даній заявці зроблені повні посилання. Матеріали носіїв або наповнювачів, яким віддається перевага, включають вуглеводи (наприклад, сахариди та альдитоли) та буфери (наприклад, цитрат) або полімерні агенти. 9. Препарати Як зазначалось вище, даний винахід запроваджує стабільні препарати, придатні для фармацевтичного або ветеринарного застосування, які включають принаймні одне анти-МСР-1 антитіло у фармацевтично прийнятній композиції. Як зазначалось вище, даний винахід запроваджує виріб, що включає пакувальний матеріал та принаймні одну ампулу, яка містить розчин принаймні одного анти-МСР-1 антитіла з приписаними буферами та/або консервантами, при потребі, з водним розріджувачем, де зазначений пакувальний матеріал включає етикетку, котра зазначає, що даний розчин може зберігатись протягом періоду 1, 2, 3, 4, 5, 6, 9, 12, 18, 20, 24, 30, 36, 40, 48, 54, 60, 66, 72 годин або більше. Даний винахід також включає виріб, що включає пакувальний матеріал, першу ампулу, яка містить ліофілізовані принаймні одне анти-МСР-1 антитіло, та другу ампулу, яка містить водний розріджувач приписаного буфера або консерванту, де зазначений пакувальний матеріал включає етикетку, що інструктує пацієнта як відтворити принаймні одне антиМСР-1 антитіло у даному водному розріджувачі з одержанням розчину, котрий може зберігатись протягом 24 годин або більше. Інтервал кількостей принаймні одного антиМСР-1 антитіла у продукті даного винаходу включає вихідні кількості після відтворення, у вигляді вологої/сухої системи, з концентраціями від приблизно 1,0 мкг/мл до приблизно 1000 мг/мл, хоча робочими також є й менші та більші концентрації, у залежності від передбачуваної системи доставки, наприклад, склади розчинів будуть відмінними від складів для препарату трансдермального петча, пульмонарних, трансмукозальних або осмотичних чи мікропомпових способів. Водний розріджувач, при потребі, містить також фармацевтично прийнятний консервант. Консерванти, яким віддається перевага, включають такі, що вибираються із групи, яка включає фенол, m-крезол, р-крезол, о-крезол, хлорокрезол, бензи 51 ловий спирт, алкілпарабен (метил, етил, пропіл, бутил і таке подібне), бензалконій хлорид, бензетоній хлорид, натрій дегідроацетат та тимерозал або їх суміші. Концентрація консерванту, який застосовується у даному препараті, є концентрацією, що достатня для забезпечення протимікробного ефекту. Такі концентрації залежать від вибраного консерванту і легко визначаються фахівцем у даній галузі. При потребі, та краще, коли до даного розріджувача додаються інші наповнювачі, наприклад, агенти ізотонічності, буфери, антиоксиданти, консервуючі енхансери. Агент ізотонічності, такий як гліцерин, звичайно використовується при відомих концентраціях. Для запровадження поліпшеного рН контролю додається, краще, фізіологічно толерантний буфер. Дані препарати можуть покривати широкий діапазон рН, такий як від приблизно рН 4 до приблизно рН 10, краще, від приблизно рН 5 до приблизно рН 9, і найкраще, від приблизно рН 6,0 до приблизно рН 8,0. Краще, коли препарати даного винаходу мають рН від приблизно 6,8 до приблизно 7,8. Буфери, яким віддається перевага, включають фосфатні буфери, найкраще, фосфат натрію, особливо, фосфатний буферний сольовий розчин (PBS). Інші добавки, такі як фармацевтично прийнятні солюбілізатори, такі як Tween 20 (поліоксиетилен (20) сорбітан монолаурат), Tween 40 (поліоксиетилен (20) сорбітан монопальмітат), Tween 80 (поліоксиетилен (20) сорбітан моноолеат), Pluronic F68 (блок-сополімери поліоксиетиленполіоксипропілену) та PEG (поліетиленгліколь) або неіонні поверхнево-активні речовини, такі як полісорбат 20 або 80, або полоксамер 184 чи 188, Pluronic поліли, інші блок-сополімери, та хелатуючі агенти, такі як EDTA та EGTA, можуть, при потребі, додаватись до даних препаратів або композицій для зниження агрегації. Ці добавки особливо корисні, якщо для застосування даного препарату використовують помпу або пластиковий контейнер. Присутність фармацевтично прийнятної поверхнево-активної речовини знижує схильність даного білка до агрегації. Препарати даного винаходу можуть готуватись з використанням процесу, котрий включає змішування принаймні одного анти-МСР-1 антитіла та буферного розчину у кількостях, що достатні для запровадження білка у потрібних концентраціях. Варіанти цього процесу зрозумілі звичайному фахівцеві у даній галузі. Наприклад, порядок додавання компонентів, коли використовуються допоміжні добавки, температура та рН, при яких готується даний препарат, є чинниками, котрі можуть бути оптимізовані відносно даної концентрації та використаних засобів застосування. Заявлені препарати можуть бути запроваджені пацієнтам у вигляді розчинів або у вигляді подвійних ампул, що включають ампулу ліофілізованого принаймні одного анти-МСР-1 антитіла, що відтворюється за допомогою другої ампули, яка містить воду, консервант та/або наповнювачі, краще, фосфатний буфер та/або сольовий розчин і вибрану сіль, у водному розріджувачі. Як ампула з одним розчином, так і подвійна ампула, що потре 97232 52 бує відтворення, можуть бути використані багато разів, і це може бути достатнім для проведення одного циклу або множини циклів лікування пацієнта, що запроваджує більш зручну схему лікування, ніж є у теперішній час. Заявлені вироби корисні для застосування протягом періоду від негайного застосування до 24 годин або більше. Відповідно, заявлені тут вироби пропонують значні переваги пацієнту. Препарати даного винаходу можуть, при потребі, безпечно зберігатись при температурах від приблизно 2 до приблизно 40 °C і зберігають біологічну активність білка протягом тривалих періодів часу, що дає можливість зазначати на етикетці, що даний розчин може зберігатись та/або застосовуватись протягом періоду 6, 12, 18, 24, 36, 48, 72 або 96 годин, або більше. Якщо використовується консервований розріджувач, така етикетка може зазначати застосування до принаймні 1-12 місяців, протягом півроку, півтора років та/або двох років. Заявлені продукти можуть запроваджуватись пацієнтам опосередковано, тобто шляхом запровадження в аптеки, клініки або інші такі установи та заклади прозорих розчинів або подвійних ампул, що включають ампулу ліофілізованого принаймні одного анти-МСР-1 антитіла, що відтворюється за допомогою другої ампули, яка містить водний розріджувач. Прозорий розчин у цьому випадку може бути у кількості до одного літра або більше, запроваджуючи великий резервуар, із якого можуть братись один раз або багато разів менші порції розчину принаймні одного антитіла, для перенесення у менші ампули та постачатись аптекою або клінікою своїм покупцям та/або пацієнтам. Визнані пристрої, що містять зазначені одноампульні системи, включають перові інжекційні пристрої для доставки розчину, такі як BD Pens, BD Autojector, Humaject, NovoPen, B-DPen, AutoPen та OptiPen, GenotropinPen, Genotronorm Pen, Humatro Pen, Reco-Pen, Roferon Pen, Biojector, Iject, J-tip Needle-Free Injector, Intraject, Medi-Ject, наприклад, як виготовлені або розроблені Becton Dickensen (Franklin Lakes, NJ, www.bectondickenson.com), Disetronic (Burgdorf, Switzerland, www.disetronic.com; Biojet, Portland, Oregom (www.biojet.com); National Medical Products, Weston Medical (Peterborough, UK, www.weston-medical.com), Medi-Ject Corp (Minneapolis, MN, www.medijet.com). Визнані пристрої, що містять зазначені двохампульні системи, включають перові інжекційні системи для відтворення ліофілізованих ліків у картриджах для доставки відтвореного розчину, такі як HumatroPen. Продукти, що тут заявлені, включають пакувальний матеріал. Даний пакувальний матеріал запроваджує, окрім інформації, яка подається на вимогу контрольних агенцій, інформацію щодо умов застосування даного продукту. Пакувальний матеріал даного винаходу запроваджує інструкції для пацієнта, як відтворити принаймні одне антиМСР-1 антититіло у водному розріджувачі для одержання розчину та застосування даного розчину протягом періоду 2-24 години або більше для двохампульного вологого/сухого продукту. Для одноампульного продукту у вигляді розчину етике 53 тка вказує, що такий розчин може застосовуватись протягом періоду 2-24 години або більше. Заявлені тут продукти придатні для фармацевтичного застосування людиною. Інші препарати або способи стабілізації антиМСР-1 антитіла можуть давати інші, ніж прозорі розчини ліофілізованого порошку, що містять зазначене антитіло. Серед непрозорих розчинів є препарати, що включають частинкові суспензії, зазначені частинки являють собою композицію, що містить анти-МСР-1 антитіло у структурах змінних розмірів, котрі відомі як мікросфери, мікрочастинки, наночастинки, наносфери або ліпосоми. Такі відносно гомогенні у значній мірі сферичні частинкові препарати, що містять активний агент, можуть бути одержані шляхом контактування водної фази, котра містить активний агент і полімер, і неводної фази, з наступним випаровуванням неводної фази, що спричинює коалесценцію частинок із водної фази, як зазначено у US 4589330. Пористі мікрочастинки можуть бути одержані з використанням першої фази, що містить активний агент та полімер, диспергований у безперервному розчиннику, і вилученням зазначеного розчинника із суспензії шляхом осушування виморожуванням або розведення-екстракції-осадження, як зазначається у US 4818542. Полімери для таких препаратів, яким віддається перевага, являють собою природні або синтетичні сополімери полімеру, що вибирається із групи, яка складається із желатинового агару, крохмалю, арабіногалактану, альбуміну, колагену, полігліколевої кислоти, полілактонової кислоти, гліколід-L(-) лактид полі(епсилон-капролактону, полі(епсилон-капролактон-СО-лактонової кислоти), полі(епсилон-капролактон-СО-гліколевої кислоти), полі(-гідрокси масляної кислоти), поліетиленоксиду, поліетилену, полі(алкіл-2ціаноакрилату), полі(гідроксиетил метакрилату), поліамідів, полі(амінокислот), полі(2-гідроксиетил DL-аспартаміду), полі(ефір сечовини), полі(Lфенілаланін/етиленгліколь/1,6-діізоціанатогексану) та полі(метилметакрилату). Полімерами, яким віддається особлива перевага, є поліефіри, такі як полігліколева кислота, полілактонова кислота, гліколід-L(-)лактид полі(епсилон-капролактон, полі(епсилон-капролактон-СО-лактонова кислота), та полі(епсилон-капролактон-СО-гліколева кислота. Розчинники, що придатні для розчинення полімеру та/або активного агента включають: воду, гексафтороізопропанол, метиленхлорид, тетрагідрофуран, гексан, бензол або гексафтороацетон сесквігідрат. Процес диспергування фази, що містить активний агент, з другою фазою може включати екструзію під тиском зазначеної першої фази через сопло для впливу на утворення крапель. Сухі порошкові препарати можуть бути одержані з використанням процесів, інших, ніж ліофілізація, таких як розпилювальна сушка або екстракція розчинника шляхом випарювання або осадженням кристалічної композиції з наступною однією або кількома стадіями для видалення водного або неводного розчинника. Одержання препарату за методом розпилювальної сушки описано у US 6019968. Сухі порошкові композиції на основі антитіла можуть бути одержані шляхом розпилю 97232 54 вальної сушки розчинів або суспензій антитіла, і, при потребі, наповнювачів, у розчиннику за умов, що забезпечують запровадження вдихуваних порошків. Розчинники можуть включати полярні сполуки, такі як вода та етанол, котрі можуть легко осушуватись. Стабільність антитіл може бути підвищена шляхом здійснення процедур розпилювальної сушки за відсутності кисню, таких як під захисним шаром азоту або з використанням азоту як осушувального газу. Іншим відносно сухим препаратом є дисперсія множини перфорованих мікроструктур, диспергованих у суспензійному середовищі, яке, типово, містить гідрофтороалкановий пропелант, як зазначено у WO 9916419. Стабілізовані дисперсії можуть уводитись у легені пацієнта з використанням інгалятора з вимірною дозою Устаткування, придатне для комерційного виробництва медикаментів методом розпилювальної сушки, виробляється фірмою Buchi Ltd. або Niro Corp. Принаймні одне анти-МСР-1 антитіло у стабільному або консервованому препаратах або розчинах, що тут описані, може призначатись пацієнту згідно з даним винаходом з використанням різновиду засобів доставки, включаючи підшкірні або внутрішньом'язові ін'єкції; трансдермальний, пульмонарний, трансмукозальний засоби, імплантацію, осмотичну помпу, картридж, мікропомпу, або інші засоби, як зрозуміло і добре відомо фахівцеві у даній галузі. 10. Терапевтичне застосування Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї пов'язаної з МСР-1 хвороби у клітині, тканині, органі, у тварини або пацієнта, як відомо у даній галузі або як тут описано, з використанням принаймні одного МСР-1 антитіла даного винаходу. Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї пов'язаної з МСР-1 хвороби у клітині, тканині, органі, у тварини або пацієнта, включаючи, проте не обмежуючись цим, принаймні одну злоякісну хворобу, метаболічну хворобу, імунну або запальну хворобу, серцевосудинну хворобу, інфекційну хворобу або неврологічну хворобу. Такі стани вибираються із, проте не обмежуючись цим, хвороб або станів, опосередкованих адгезією клітин та/або ангіогенезом. Такі захворювання або стани включають імунний розлад або хворобу, серцево-судинний розлад або хворобу, інфекційний, злоякісний та/або неврологічний розлад або хворобу, або інші відомі чи визначені споріднені з МСР-1 стани. Зокрема, дані антитіла корисні для лікування хвороб, котрі включають ангіогенез, таких як очна хвороба та неопластична хвороба, реконструкція тканини, така як рестеноз, і проліферація деяких типів клітин, зокрема, карцинома епітеліальних та плоских клітин. Особливі показання включають використання у лікуванні атеросклерозу, рестенозу, ракових метастазів, ревматоїдного артриту, діабетичної ретинопатії та дегенерації жовтої плями. Нейтралізуючі антитіла даного винаходу також придатні для запобігання або лікування небажаної резорбції кісток або деградації, наприклад, як знайдено при остеопорозі 55 або є результатом PTHrP надекспресії деякими пухлинами. Дані антитіла можуть бути також корисними у лікуванні різних фіброзних захворювань, таких як пневмофіброз, діабетична нефропатія, гепатит та цироз. Таким чином, даний винахід запроваджує спосіб для модуляції або лікування принаймні однієї пов'язаної з МСР-1 хвороби у клітині, тканині, органі, у тварини або пацієнта, як відомо у даній галузі або як тут описано, з використанням принаймні одного МСР-1 антитіла даного винаходу. Конкретні показання розглянуті нижче. Легеневі хвороби Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї легеневої хвороби у клітині, тканині, органі, у тварини або пацієнта, включаючи, проте не обмежуючись цим, принаймні одну із таких як: пневмонія, абсцес легень; професійні легеневі захворювання, спричинені агентами у формі пилу, газів або туману; астма, облітеруючий фіброзний бронхіоліт, порушення дихання, алергічні легеневі захворювання, включаючи пневмоніт (екзогенний алергічний альвеоліт), алергічний бронхолегеневий аспергильоз та реакції на ліки; респіраторний дистрессиндром у дорослих (ARDS), синдром Гудпасчера, хронічне обструктивне захворювання легень (COPD), ідіопатичні інтерстиціальні легеневі захворювання, такі як ідіопатичний легеневий фіброз та саркоїдоз, десквамативна інтерстиціальна пневмонія, гостра інтерстиціальна пневмонія, пов'язана з респіраторним бронхіолітом інтерстиціальна хвороба легень, ідіопатичний облітеруючий бронхіоліт з пневмосклерозом, лімфоцитний інтерстиціальний пневмоніт, гранулематоз клітин Лангерганса, ідіопатичний гемосидероз легень; гострий бронхіт, легенево-альвеолярний протеїноз, бронхоектаз, плевральні розлади, ателектаз, муковісцидоз та легеневі пухлини, і емболія легень. Злоякісні хвороби Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї злоякісної хвороби у клітині, тканині, органі, у тварини або пацієнта, включаючи, проте не обмежуючись цим, принаймні одну із таких як: лейкоз, гострий лейкоз, гострий лімфоїдний лейкоз (ALL), В-клітинний, Тклітинний або FAB ALL, гострий мієлобластний лейкоз, хронічний мієлолейкоз (CML), хронічний лімфолейкоз (CLL), гістіолімфоцитоз Бернарда, мієлодиспластичний синдром (MDS), лімфома, множинна мієлома, саркома Капоші, рак ободової та прямої кишки, рак підшлункової залози, рак нирок, рак молочної залози, назофарингеальний рак, злоякісний гістіоцитоз, паранеопластичний синдром/гіперкальцімія злоякісності, тверді пухлини, рак передміхурової залози, рак плоских клітин, саркоми, злоякісна меланома, особлива метастатична меланома, гемангіома, метастатична хвороба, резорбція кісток, пов'язана з раком, болі у кістках, пов'язані з раком, і таке подібне. Імунно-споріднені хвороби Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї імунноспорідненої хвороби у клітині, тканині, органі, у тварини або пацієнта, включаючи, проте не обме 97232 56 жуючись цим, принаймні одну із таких як: ревматоїдний артрит, ювенільний ревматоїдний артрит, системний початковий ювенільний ревматоїдний артрит, псоріатичний артрит, анкілозивний спондилоартрит, виразка шлунка, серонегативна артропатія, остеоартрит, запальна кишкова хвороба, виразковий коліт, системний червоний вовчак, антифосфоліпідний синдром, іридоцикліт/увеїт/ретробульбарний неврит, ідіопатичний фіброз легень, системний васкуліт/грануломатоз Вегенера, саркоїдоз, орхіт/вазектомійновидалювальні процедури, алергічні/атопічні хвороби, астма, алергічний риніт, екзема, алергічний контактний дерматит, алергічний кон'юктивіт, пневмоніт, трансплантати, відторгнення трансплантатів органу, реакція "трансплантат проти хазяїна", синдром системної запалальної реакції, сепсисний синдром, грампозитивний сепсис, грамнегативний сепсис, культурно-негативний сепсис, фунгальний сепсис, нейтропенічна пропасниця, уросепсис, менінгококемія, травма/крововилив, опіки, експозиція до іонізуючого випромінювання, гострий панкреатит, респіраторний дистрес-синдром у дорослих, ревматоїдний артрит, гепатит, індукований алкоголем, хронічні запальні патології, саркоїдоз, патологія Крона, анемія дрепаноцитів, діабет, нефроз, атопічні хвороби, алергічні реакції, алергічний риніт, сінна пропасниця, переніальний риніт, кон'юктивіт, ендометріоз, астма, уртікарія, системний анафалакс, дерматит, перніціозна анемія, гемолітичні хвороби, тромбоцитопенія, відторгнення трансплантатів будь-якого органа або тканини, відторгнення трансплантатів нирок, відторгнення серцевого трансплантата, відторгнення печінкового трансплантата, відторгнення трансплантата підшлункової залози, відторгнення легеневого трансплантата, відторгнення трансплантата кісткового мозку (BMT), відторгнення шкірного алотрансплантата, відторгнення трансплантата хряща, відторгнення кісткового трансплантата, відторгнення трансплантата тонкої кишки, відторгнення трансплантата фетального тимуса, відторгнення трансплантата паращитоподібної залози, відторгнення ксенотрансплантата будь-якого органа або тканини, відторгнення алотрансплантата, алергічні анти-рецепторні реакції, хвороба Граве, хвороба Рейно, інсулінорезистентний діабет типу В, астма, міастенія, цитотоксичність, опосередкована антитілом, алергічні реакції типу ІІІ, системний червоний вовчак, синдром РОЕМS (поліневропатія, органомегалія, ендокринопатія, моноклональна гаммопатія та синдром змін шкіри), поліневропатія, органомегалія, ендокринопатія, моноклональна гаммопатія, синдром змін шкіри, антифосфоліпідний синдром, пемфігус, склеродерма, змішана хвороба з'єднувальної тканини, ідіопатична хвороба Едісона, цукровий діабет, хронічний активний гепатит, первинний біліарний цироз, вітіліго, васкуліт, синдром пост-МІ кардіотомії, алергія типу IV, контактний дерматит, алергічний пневмоніт, відторгнення алотрансплантата, гранулома, спричинена інтрацелюлярними організмами, реакція на ліки, метаболічна/ідіопатична хвороба, хвороба Вілсона, гемахроматоз, дефіцит альфа-1інгібітора трипсину, діабетична ретинопатія, тироі 57 дит Хашимото, остеопороз, діагностика системи гіпоталамус-гіпофіз-надниркова залоза, первинний біліарний цироз, тироідит, енцефаломієліт, кахексія, муковісцидоз, неонатальна хронічна легенева хвороба, хронічна обструктивна легенева хвороба (COPD), спадковий гематофагоцитарний лімфоцитарний гістіоцитоз, дерматологічні стани, псоріаз, алопеція, нефротичний синдром, нефрит, гломерулярний нефрит, гостра ниркова недостатність, гемодіаліз, уремія, токсичність, гестоз, ОКТ3 терапія та анти-CD3 терапія, цитокінна терапія, хіміотерапія, радіаційна терапія (наприклад, включаючи, проте не обмежуючись цим, тоастенія, анемія, кахексія і таке подібне), хронічна саліцилатна інтоксикація, і таке подібне. Дивись, наприклад, Merck th th Manual, 12 -17 Editions, Merck & Company, Rahway, NJ (1972, 1977, 1982, 1987, 1992, 1999), Pharmacotherapy Handbook, Wells et al., eds., Second Edition, Appleton and Lange, Stamford, Conn. (1998, 2000), на кожну із яких зроблені повні посилання. Серцево-судинні хвороби Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї серцевосудинної хвороби у клітині, тканині, органі, у тварини або пацієнта, включаючи, проте не обмежуючись цим, принаймні одну із таких як: синдром серцевого удару, інфаркт міокарда, природжений порок серця, удар, ішемічний удар, крововилив, артеріосклероз, атеросклероз, діабетична атеріосклеротична хвороба, гіпертензія, артеріальна гіпертензія, вазоренальна гіпертензія, непритомність, шок, сифіліс серцево-судинної системи, серцева недостатність, хронічне легеневе серце, первинна легенева гіпертензія, серцеві аритмії, передсердня ектопічна систола, тріпотіння передсердь, фібриляція передсердя (тривала або пароксизмальна), постперфузійний синдром, запальна реакція штучного кровообігу, хаотична або мультифокальна предсердня тахікардія, регулярна вузька QRS тахікардія, специфічні аритмії, фібріляіція шлуночків, аритмії пучка Гіса, атріо-вентрикулярна блокада, ніжки пучка Гіса блокада, ішемічні розлади міокарда, захворювання коронарної артерії, стенокардія, інфаркт міокарда, кардіоміопатія, дилатантна застійна кардіоміопатія, рестриктивна кардіоміопатія, вальвулярні хвороби серця, ендокардит, хвороби перикарда, серцеві пухлини, перефирійна аневризма та аневризма аорти, розшарування аорти, запалення аорти, оклюзія абдомінальної аорти та її гілок, периферичні судинні розлади, оклюзивні артеріальні розлади, периферична атеросклеротична хвороба, тромбангіїт облітеруючий, функціональні периферичні артеріальні розлади, симптом та хвороба Рейно, акроціаноз, еритромелалгія, венозні хвороби, венозний тромбоз, варикозні вени, артеріовенозний свищ, лімфедема, ліпедема, нестабільна стенокардія, реперфузійна травма, післяпомповий синдром, ішемічно-реперфузійна травма і таке подібне. Такий спосіб може, при потребі, включати призначення ефективної кількості композиції або фармацевтичної композиції, яка містить принаймні одне анти-МСР-1 антитіло, клітині, тканині, органу, тварині або пацієнту, що потребують такої модуляції, 97232 58 лікування або терапії. Неврологічні хвороби Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї неврологічної хвороби у клітині, тканині, органі, у тварини або пацієнта, включаючи, проте не обмежуючись цим, принаймні одну із таких як: нейродегенеративні хвороби, множинний склероз, мігреневі головні болі, СНІД-деменційний комплекс, деміелінізаційніхвороби, такі як множинний склероз та гострий поперечний мієліт; екстрапірамідальні та церебеларні розлади, такі як ураження кортикоспінальної системи; розлади базальних ядер або церебеларні розлади; гіперкінетичні розлади, такі як хорея Хантінгтона та сенільна хорея; розлади руху, спричинені ліками, такі як ті, що індуковані ліками, які блокують допамінові рецептори центральної нервової системи; гіпокінетичні розлади, такі як хвороба Паркінсона; прогресуючий надядерний параліч; структурні ураження мозочка; спіноцеребеларні дегенерації, такі як спінальна атаксія, атаксія Фридрейха, церебеларні кортикальні дегенерації, множинні системні дегенерації (Mencel, Dejerine-Thomas, Shi-Drager, and Machado-Joseph); системні розлади (хвороба Рефсама, абеталіпопротеїнемія, атаксія, телангіектазія та мультисистемний мітохондріальний розлад); деміелінізаційні коркові розлади, такі як множинний склероз, гострий поперечний мієліт; та розлади рухової одиниці, такі як нейрогенні м'язові атрофії (деградація клітин переднього рога, така як бічний аміотрофічний склероз, спінальна м'язова атрофія дітей раннього віку та юнацька спінальна м'язова атрофія); хвороба Альцгеймера; синдром Дауна у середньому віці; дифузна хвороба тіла Леві; сенільна деменція типу тіла Леві; синдром ВернікеКорсакова; хронічний алкоголізм; хвороба Крейтцфельда-Якоба; підгострий склеротичний паненцефаліт, хвороба Халерордена-Спатца; та деменція боксерів і таке інше. Такий спосіб може, при потребі, включати призначення ефективної кількості композиції або фармацевтичної композиції, яка містить принаймні одне TNF антитіло або його частину, або варіант, клітині, тканині, органу, тварині або пацієнту, що потребують такої модуляції, лікування або терапії. Дивись, наприклад, the th Merck Manual, 16 Edition, Merck & Company, Rahway, NJ (1992). Фіброзні стани Окрім описаних вище станів та хвороб, даний винахід також запроваджує спосіб для модуляції або лікування фіброзних станів різних етіологій, таких як фіброз печінки (включаючи, проте не обмежуючись цим, цироз, індукований алкоголем, вірусний цироз, автоімунний гепатит); фіброз легень (включаючи, проте не обмежуючись цим, склеродерму, ідіопатичний легеневий фіброз); фіброз нирок (включаючи, проте не обмежуючись цим, склеродерму, діабетичний нефрит, гломерулярний нефрит, люпус-нефрит); дермальний фіброз (включаючи, проте не обмежуючись цим, склеродерму, гіпертрофічні та кілоїдні шрами, опіки); мієлофіброз; нейрофіброматоз; фіброма; кишковий фіброз; та фібротичні спайки, спричинені хірургічними процедурами. 59 Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї рани, травми або ушкодження тканини, або хронічного стану, який спричинений або пов'язаний з ними, у клітині, тканині, органі, у тварини або пацієнта, включаючи, проте не обмежуючись цим, принаймні одну із таких як: тілесне ушкодження або травма, пов'язані з хірургією, включаючи торакальну, абдомінальну, краніальну або оральну хірургію; або де дана рана вибирається із групи, яка складається із асептичних ран, забитих ран, різаних ран, рваних ран, тупих травм, відкритих ран, проникних ран, наскрізних ран, колотих ран, септичних ран, інфарктів та поверхневих ран; або де дана рана вибирається із групи, яка складається із ішемічних виразок, пролежнів, фістул, тяжких укусів, термічних опіків та ран донорської ділянки; або де дана рана являє собою афтозну рану, травматичну рану або рану, пов'язану з герпесом. Рани донорської ділянки являють собою рани, котрі, наприклад, виникають у зв'язку з вилученням твердої тканини із однієї ділянки тіла та перенесенням її до іншої ділянки тіла, наприклад, у зв'язку з трансплантацією. Рани, спричинені такими операціями, вельми болісні, і тому поліпшене лікування дуже потрібне. Фіброз ран також піддається терапії анти-МСР-1 антитілами, оскільки першими клітинами, котрі окупують область навколо рани, є нейтрофіли, і потім моноцити, котрі активуються макрофагами. Макрофаги, як вважають, мають суттєве значення для ефективного загоювання ран, яке полягає у тому, що вони також відповідають за фагоцитоз патогенних організмів та очищення від залишків тканини. Крім того, вони виділяють множину факторів, що задіяні у наступних подіях процесу загоєння. Макрофаги приваблюють фібробласти, котрі розпочинають продукування колагену. Майже всі процеси відновлення тканини включають раннє формування з'єднувальної тканини, стимуляція цього та наступних процесів поліпшує загоєння тканини, проте, перевиробництво з'єднувальної тканини та колагену може спричинити виникнення фібротичної тканини, як характеризується як непружна та гіпоксична. Анти-МСР-1 антитіла даного винаходу можуть бути використані у способах модуляції, лікування або запобігання таким наслідкам загоєння ран. Зазначені антитіла даного винаходу можуть також бути використані у способах модуляції або лікування принаймні одного симптому хронічного відторгнення трансплантованого органу, тканини або клітини, такого як серцевий трансплантат. Інші терапевтичні застосування анти-МСР-1 антитіл Даний винахід також запроваджує спосіб для модуляції або лікування принаймні однієї інфекційної хвороби у клітині, тканині, органі, у тварини або пацієнта, включаючи, проте не обмежуючись цим, принаймні одну із таких як: гостра або хронічна бактеріальна інфекція, гострий та хронічний паразитарний або інфекційний процеси, включаючи бактеріальну, вірусну та грибкову інфекції, ВІЛ інфекція/ВІЛ невропатія, менінгіт, гепатит (А, В або С, або подібне), септичний артрит, перитоніт, пневмонія, епіглотит, e. coli 0157:h7, гемолітичний 97232 60 уремічний синдром/тромболітична тромбоцитопенічна пурпура, малярія, геморагічна пропасниця денге, лейшманіоз, лепра, синдром токсичного шоку, стрептококовий міозит, газова гангрена, мікобактеріальний туберкульоз, мікобактеріальний avium intracellulare, легеневий пневмоцистоз, запальна хвороба тазових органів, орхіт/епідидиміт, легіонельоз, хвороба Лайма, грип а, вірус Епштейна-Барра, вітальний гемафагоцитарний синдром, вітальний енцефаліт/асептичний менінгіт і таке подібне. Будь-який спосіб даного винаходу може включати призначення ефективної кількості композиції або фармацевтичної композиції, яка містить принаймні одне анти-МСР-1 антитіло, клітині, тканині, органу, тварині або пацієнту, котрі потребують такої модуляції, лікування або терапії. Такий спосіб може, при потребі, додатково включати принаймні один засіб, що вибирається із принаймні одного TNF антагоніста (наприклад, проте не обмежуючись цим, TNF антитіла або фрагмента, розчинного TNF рецептора або фрагмента, його злитих білків або TNF антагоніста з малою молекулою), протиревматичного засобу (наприклад, метотрексат, ауранофін, ауротіоглюкоза, азатіоприн, етанерсепт, золото натрій тіомалат, гідроксихлорокін сульфат, лефлуномід, сульфасалзин), м'язового релаксанту, наркотичного засобу, нестероїдних протизапальних ліків (NSAID), анальгетика, анестетика, седативного засобу, анестетика місцевого призначення, нейром'язового блокатора, протимікробного засобу (наприклад, аміноглікозид, протигрибковий, протипаразитичний, противірусний засіб, карбапенем, цефалоспорин, флурохінолон, макролід, пеніцилін, сульфонамід, тетрациклін, інший протимікробний засіб), протипсоріатичного засобу, кортикостероїду (дексаметазон), анаболічного стероїду (тестостерон), агента, що пов'язаний з діабетом, мінерального, харчового, тироїдного агента, вітаміну, гормону, що містить кальцій, антидіарейного, протикашльового, протиблювотного, противиразкового, проносного засобу, еритропоетину (наприклад, епоетин альфа), філграстиму (наприклад, G-CSF, Neupogen), сарграмостиму (GM-CSF, Leukine), імунізаційного засобу, імуноглобуліну (ритуксимаб), імунодепресанту (наприклад, базиліксимаб, циклоспорин, даклізумаб), гормону росту, гормонного антагоністу, репродуктивного гормонного антагоністу (флутамід, нілутамід), гормонного модулятора виділення (лепролід, гозерелін), ліків-замінників гормону, модулятора естрогенного рецептора (тамоксифен), ретиноїду (третиноїн), інгібітору топоізомерази (етопозид, іринотекан), цитоксину (доксорубіцин), мідриатичного, циклоплегічного, алкілуючого агента (карбоплатин), нітроіприту (мелфален, хлорабуцил), нітрозосечовини (кармустин, естрамустин), протиметаболітного засобу (метотрексат, цитарабін, флуороурацил), мітотичного інгібітору (вінкристин, таксол), радіофармацевтичного засобу (йод 131-тозитумомаб), радіосенсибілізатору (мізонідазол, тірапазамін), антидепресанту, агента проти маніакальних станів, антипсихотичного, анксіолітичного, гіпнотичного, симпатоміметичного засобу, стимулятора, донепезилу, такрину, ліків
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated antibody that binds to human monocyte chemoattractant protein-1 (mcp-1)
Автори англійськоюDas Anuk, Sweet, Raymond, Tsui Ping, Bardroff Michael
Назва патенту російськоюИзолированное антитело, которое связывает моноцитный хемоатрактантный белок 1 (мср-1) человека
Автори російськоюДас, Анук, Свит, Реймонд, Цуи, Пинг, Бардрофф, Михаэль
МПК / Мітки
МПК: C12N 15/13, C12P 21/08, A61K 39/395, C07K 16/24
Мітки: моноцитний, людини, мср-1, ізольоване, зв'язує, білок, хемоатрактантний, антитіло, яке
Код посилання
<a href="https://ua.patents.su/67-97232-izolovane-antitilo-yake-zvyazueh-monocitnijj-khemoatraktantnijj-bilok-1-msr-1-lyudini.html" target="_blank" rel="follow" title="База патентів України">Ізольоване антитіло, яке зв’язує моноцитний хемоатрактантний білок 1 (мср-1) людини</a>
Попередній патент: Ізольоване антитіло, яке специфічно зв’язується з il-6, композиція, що його містить, та його застосування
Наступний патент: Процес виробництва вакцин
Випадковий патент: Вихрова тепломасообмінна камера