Спосіб отримання струмопровідного детектуючого нанорозмірного моношару для отримання імунохімічного біосенсора
Номер патенту: 107445
Опубліковано: 10.06.2016
Автори: Мартинов Артур Вікторович, Джелалі Володимир Володимирович
Формула / Реферат
1. Спосіб отримання струмопровідного детектуючого нанорозмірного моношару для отримання імунохімічного біосенсора, який відрізняється тим, що як лінкер між імуноглобуліном та металом електрода та/або наночастками колоїдного металу використовують основу амінокислоти лізину.
2. Спосіб за п. 1, який відрізняється тим, що імуноглобулін - це поліклональний імуноглобулін.
3. Спосіб за п. 1, який відрізняється тим, що імуноглобулін - це моноклональний імуноглобулін.
Текст
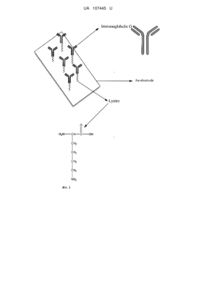
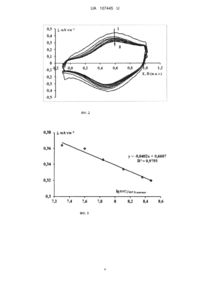
Реферат: Спосіб отримання струмопровідного детектуючого нанорозмірного моношару для отримання імунохімічного біосенсора. Як лінкер між імуноглобуліном та металом електрода та/або наночастками колоїдного металу використовують основу амінокислоти лізину. UA 107445 U (12) UA 107445 U UA 107445 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до медицини та електрохімії і може бути використана для розробки методів миттєвої електро-імунохімічної ідентифікації та кількісного визначення антигенів в імунології, мікробіології, вірусології. Пошук нових швидких методів діагностики інфекційних захворювань та ідентифікації імунологічних маркерів, на кшталт CD є вельми актуальною задачею сучасної науки. Перший електрохімічний амперометричний біосенсор був розроблений Кларком у 1961 році [1] для встановлення рівня кисню (цукру) у крові. Інші види біосенсорів - імунні електрохімічні біосенсори були розроблені для детекції продуктів взаємодії антитіл з антигенами та використовуються в медицині для ідентифікації бактерій. Недоліками сучасних біосенсорів є вельми низька відтворюваність результатів в залежності від серії електродів, низька ефективність та недовготривалість роботи їх робочих електродів. Однією з актуальних задач у розробці новітніх імунохімічних біосенсорів є пошук нових речовин-посередників для створення наношару імуноглобулінів на поверхні електрода. Нами запропоновано для активації адсорбції імуноглобулінів на поверхню електродів як лінкер наносити основу амінокислоти лізину. Відомий спосіб сорбції імуноглобулінів на поверхню електродів через систему колоїдні наночастки золота (Аu) / меркаптоетиламін [2]. Метод включає створення наночасток Аu з хлориду золота (розмір 16 нм) з послідовним нанесенням на них імуноглобулінів через лінкер меркаптоетиламін та аналогічну обробку Аu-електрода меркаптоетиламіном та імуноглобулінами. Недоліком методу є використання нестійкої відносно токсичної речовини меркаптоетиламіну. Останній не здатний довготривалий період утримувати наночастки Аu з імуноглобулінами, приєднаними до поверхні, у зв'язку з окисленням сульфгідрильних груп меркаптоетиламіну під впливом кисню, світла та інших речовин. Цей недолік робить біосенсор нестійким протягом часу, а біосенсор - нездатним на валідацію протягом довготривалого періоду. Згідно із представленою корисною моделлю, поставлена задача розробити метод отримання більш стійких у часі імунохімічних біосенсорів. Поставлена задача вирішується шляхом використання як лінкера між електродами/ наночастками металів/ імуноглобулінами основи амінокислоти лізину (Фіг. 1). Методика включає нанесення на електрод 0,02-0,5 % розчину основи лізину, його швидке висушування з нанесеним лізином та наступне нанесення імуноглобуліну на висушений шар лізину. Також можна, окрім електрода, аналогічним чином обробити наночастки металів: готові наночастки інертних металів змішати з 0,02-0,5 % розчином основи лізину та ліофілізувати розчин. Після розчинення ліофілізату у розчині імуноглобулінів утворюються наномолекулярний шар імуноглобулінів на наночастках Аu. При нанесенні таких наночасток на оброблений лізином та імуноглобуліном електрод утворюється сендвіч-подібна структура, яка є стабільною у часі, не руйнується під впливом світла, окиснювачів та не гідролізується. Приклад 1. Отримання наночасток золота відбувається з хлориду золота за методикою [3]. До суспензії отриманих наночасток (0,1-0,5 % сухого залишку) додавали 0,02-0,5 % розчин основи лізину, розливали у флакони та ліофілізували. Іммобілізацію імуноглобуліну на наночастках золота проводили шляхом розведення ліофілізованого розчину розчином імуноглобуліну на прикладі протистафілококового імуноглобуліну G, кількість іммобілізованого імуноглобуліну становила від 10 до 200 мкг/мл. Отримання золотого електрода з іммобілізованими імуноглобулінами проводили наступним чином: після знежирювання золотого електрода (золоті прямокутні пластинки розмірами до 6×7 мм) хлороформом та відмивання його від різноманітних окислів хромовою сумішшю в розчині "піраньї", яка представляє собою суміш Н2О2 та концентрованої H2SO4 в співвідношенні 1:3 [4], наносили розчин основи лізину з концентрацією основної речовини 0,02-0,5 %, висушували у вакуумному випаровувачі. На отриманий електрод з лізином наносили розчин імуноглобулінів та термостатували при 37 °C протягом 12 годин. Надлишок імуноглобуліну, що не зв'язався з електродами змивали бідистильованою водою. Приклад 2. Отримані електроди були застосовані для вимірювання [5] вольт-амперметричних залежностей. Реєстрацію циклічних вольтамперних характеристик (ЦВАХ) здійснювали за допомогою потенціостату ПІ - 50.1.1, керованого програматором П - 8 і цифрового осцилографа RIGOL DS1022DC. Синхроімпульси 7 кроку програматора використовували для запуску початку запису експериментальних даних через USB порт. Запис експериментальних даних здійснювали в файл з розширенням xls. 1 UA 107445 U 5 10 15 В експериментах використовували скляну комірку, робочим об'ємом 4 мл, що задовольняє усім вимогам для прецизійних вимірювань. Робочий, допоміжний та електрод порівняння відділялися один від одного скляними шліфами. Умови експерименту були аналогічними тим, що наведені в [6]. Як фоновий розчин використовували фосфатний буферний розчин (PBS), що моделює параметри фізіологічних -1 -1 -1 -1 рідин організму, такого складу: 8 г•л NaCl, 0,2 г•л КСl, 1,44 г•л Na2HPO4, 0,24 г•л КН2РО4 с рН = 7,4 [7]. Розчин АГ S.aureus у PBS готували на бідистильованій воді. У розчин добавляли різну кількість клітин інактивованого нагріванням S.aureus. Кількість клітин встановлювали з 2 використанням денсилометра в перерахунку на lg КУО/мл. Робочий електрод - Аu 00. S=1,8 см . Крутизна 10 мА/V. На біосенсор накладали трикутну напругу від -0,1 до 1 В відносно нормального водневого електрода. Швидкість розгортання за потенціалом дорівнювала -1 0,5 В•с . Вимірювання проводили при температурі розчину 25 °C. На фіг. 2 представлена вольт-амперометрична залежність (j=f(E)), а на фіг. 3 розрахована з неї залежність між логарифмами експериментально встановленої та теоретично розрахованої КУО стафілококу (lg) в розчині, що вимірювався. Як видно з фіг. 2 та 3, спостерігається лінійна залежність фактично за всіма координатами вольтамперометричної залежності та концентрацією клітин в діапазоні від 1 до 9 lg КУО, що підтверджує ефективність та чутливість розробленого сенсора, а також можливість кількісного визначення антигенів в діапазоні від 1 до 9 lg КУО. 20 25 30 35 40 45 Джерела інформації: 1. Turner A.P.F., Karube I., Wilson G. S. (Eds.),.Biosensor: Fundamentals and Applications, Oxford University Press, Oxford, UK, 1987. 2. Purvis D, Leonardova O, Farmakovsky D, Cherkasov V. An ultrasensitive and stable potentiometric immunosensor. Biosens. Bioelec. 18, 1385-1390 (2003). 3. Martin C. R., Micher D. T., Anal. Chem. 5 (1998) 332A. 4. Guang-Quan Mo, Jian-Shan Ye, Wei-De Zhang. Unusual electrochemical response of ZnO nanowires-decorated multiwalled carbon nanotubes // Electrochimica Acta. - 2009. - V. 55. - P. 511515. 5. Джелали В. В. Количественная экспресс-идентификация антигенов и антител. //SEMST2013. - Т. 4 (10), № 1. - С. 85-96. 6. Захаренко Е. К., Джелали В. В., Волянский А. Ю., Волянский Д. Л., Городницкая Н. И. Биосенсор на основе мономолекулярного слоя антител Stapylococcys aureus для регистрации антигенов Stapylococcys aureus. // Проблеми сучасної електрохімії // Вопросы химии и химической технологии. - 2011. - № 4. - С. 202-204. 7. Ge Y., Huang С, Sen D., Yu H. Z. Electrochemical investigation of DNA-modified surfaces: Fromquantitation methods to experimental conditions // J. Electroanal. Chem. - 2007. - V. 602. - P. 156-162. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 1. Спосіб отримання струмопровідного детектуючого нанорозмірного моношару для отримання імунохімічного біосенсора, який відрізняється тим, що як лінкер між імуноглобуліном та металом електрода та/або наночастками колоїдного металу використовують основу амінокислоти лізину. 2. Спосіб за п. 1, який відрізняється тим, що імуноглобулін - це поліклональний імуноглобулін. 3. Спосіб за п. 1, який відрізняється тим, що імуноглобулін - це моноклональний імуноглобулін. 2 UA 107445 U 3 UA 107445 U 4 UA 107445 U Комп’ютерна верстка О. Гергіль Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12R 1/19, A61K 39/108, G01N 33/569
Мітки: моношару, нанорозмірного, імунохімічного, спосіб, струмопровідного, отримання, біосенсора, детектуючого
Код посилання
<a href="https://ua.patents.su/7-107445-sposib-otrimannya-strumoprovidnogo-detektuyuchogo-nanorozmirnogo-monosharu-dlya-otrimannya-imunokhimichnogo-biosensora.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання струмопровідного детектуючого нанорозмірного моношару для отримання імунохімічного біосенсора</a>
Попередній патент: Спосіб збільшення об’єму кісткової тканини альвеолярного паростка нижньої щелепи
Наступний патент: Спосіб діагностики секреторних порушень підшлункової залози
Випадковий патент: Застосування ацилсульфонамідів для покращення врожайності рослин