Спосіб оцінки ефективності регенерації травмованого периферійного нерва під впливом ліпофлавону на пізніх етапах (в експерименті)
Номер патенту: 87206
Опубліковано: 27.01.2014
Автори: Храпай Олена Володимирівна, Чайковський Юрій Богданович
Формула / Реферат
Спосіб оцінки ефективності регенерації травмованого періферійного нерва під впливом ліпофлавону на пізніх етапах (в експерименті), що включає дослідження нервових тканин, який відрізняється тим, що після відтворення стандартної моделі травми периферійного нерва вводять параневрально протягом десяти днів ліпофлавон дозою 0,1 мг/кг, ліпін дозою 0,1 мг/кг, корвітин дозою 0,2 мг/кг, через 12 тижнів роблять забір матеріалу для подальшого ультраструктурного дослідження, визначають щільність нервових волокон і кут їх відхилення від осі травмованого нерва, отримані результати порівнюють з контролем і при зменшенні дегенерації нервових волокон і кровоносних судин, а також зниженні розвитку фіброзу у травмованому нерві оцінюють ефективність регенерації периферійного нерва під впливом ліпофлавону на пізніх етапах.
Текст
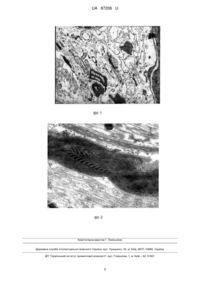
Реферат: UA 87206 U UA 87206 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до медицини, а саме до фармакотерапії хвороб нервової системи, і може бути використана для покращення результатів лікування травматичних ушкоджень периферійного нерва. Проблема регенерації нервових стовбурів привертає до себе увагу багатьох дослідників у галузі біології і медицини, так як ушкодження периферичних нервів призводить до інвалідизації, особливо в молодому віці. Одночасно з цим даний аспект є недостатньо вивченим, оскільки як і раніше більш 60 % постраждалих стають інвалідами ІІ-ІII груп (1,3,4,5) Пошук нових ефективних методів лікування травми периферійних нервів, незважаючи на багаторічні дослідження, залишається актуальним (1,3,4,5). Незважаючи на розроблені хірургічні і терапевтичні методи лікування даної патології, функціональні результати регенерації периферійних нервів далеко не завжди задовільні (6,7). В основу корисної моделі поставлена задача вивчення характеру процесів де- і регенерації в травматично пошкодженому нерві у щурів, а також їх фармакологічна корекція ліпофлавону на пізніх етапах відновного процесу. Поставлена задача вирішується тим, що у відомому способі, що включає дослідження нервових тканин, згідно з корисною моделлю, після відтворення стандартної моделі травми периферійного нерва вводять параневрально протягом десяти днів ліпофлавон дозою 0,1 мг/кг, ліпін дозою 0,1 мг/кг, корвітин дозою 0,2 мг/кг, через 12 тижнів роблять забір матеріалу для подальшого ультраструктурного дослідження, визначають щільність нервових волокон і кут їх відхилення від осі травмованого нерва, отримані результати порівнюють з контролем і при зменшенні дегенерації нервових волокон і кровоносних судин, а також зниженні розвитку фіброзу у травмованому нерві оцінюють ефективність регенерації периферійного нерва під впливом ліпофлавону на пізніх етапах. Спосіб здійснюється наступним чином: Досліди проведені на 14 білих щурах (самках) масою тіла 200-250 г. Тварини були розділені на 3 групи: І - контроль, інтактні тварини (n=7); II - травма нерва (n=9); III - травма з використанням ліпофлавону (n=10). Повну аксотомію сідничного нерва експериментальних тварин відтворювали у наступному порядку: виробляли оперативний доступ до правого сідничого нерва, останній мобілізували і перерізали на рівні середини стегнової кістки щурів. Проксимальний і дистальний кінці нерва зшивали епіневральним швом ниткою "Ethicon" (Шотландія) 10 / 0 на атравматичній голці, залишаючи діастаз розміром 1 мм. Проксимальний відділ нерва на відстані 3-5 мм від області травмування размозжали за допомогою пінцета. Рану зашивали наглухо. Препарати вводили параневрально протягом десяти днів після травми. Ліпофлавон ("Біолік", Харків) вводили в дозі 0,1 мг / кг, Ліпін ("Біолік", Харків) - 0,1 мг / кг, Корвітин ("Борщагівський хіміко-фармацевтичний завод", Київ) - 0,2 мг / кг. Через 12 тижнів у тварин виробили забір матеріалу для подальшого ультраструктурного дослідження. Окремі зразки нерва (проксимальний і дистальний кінці, зона шва) фіксувалися в 2,5 % розчині глутаральдегід з подальшою дофіксацією в 1 % розчині осмієвої кислоти на фосфатному буфері при рН 7,4. Матеріал зневоднюють в спиртах висхідної концентрації і заливають в суміш епоксидних смол Епон-аралдіт. З епоксидних блоків виготовляють ультратонкі зрізи на ультратомі Райхарт (Голландія). Для підвищення контрастності ультратонкі зрізи фарбують розчином уранілацитату і цитратом свинцю, переглядали в електронному мікроскопі ЕМ-400т фірми Philips (Голландія) [6]. Морфометричні дослідження проводились на мікроскопі Olympus BX 51 (Японія) за допомогою програми (UTHSCSA ImageTool, Version 2.0 (alpha 3) для Microsoft Windows 95, Windows NT). Вимірювали площу мієлінових нервових волокон та їх осьових циліндрів, товщину і площа мієлінової оболонки, середня кількість ламелей мієлінової оболонки у нервовому волокні [2]. Достовірність міжгрупових відмінностей чисельних значень оцінювали згідно з t-критерієм Ст'юдента. На момент взяття зразків тканини експериментальних тварин в області невротомії спостерігалися зрощення решт дистального і проксимального відділів нерва, в зоні шва виявляли розвиток посттравматичного рубця і відновлення васкуляризації нерва. Через 12 тижнів у тканині нерва спостерігали виражені структурні зміни в нервових волокнах і стінці капілярів у всіх досліджуваних відділах перерізаного нерва. У проксимальному відділі нерва встановлено наявність набряку навколо капілярів, що виявляється в відшаруванні базальної мембрани від структурно змінених ендотеліоцитів. Ендотелій на люменальній поверхні формує випинання, цитоплазма різко вакуолізована мікропіноцитозними везикулами. В окремих місцях базальна мембрана має виражену деструкцію. Навколо капілярів проксимального відділу визначаються численні пучки колагенових волокон, які орієнтовані в різних напрямках. У цих зонах встановлена інфільтрація 1 UA 87206 U 5 10 15 20 25 30 35 40 45 50 55 60 лейкоцитами. Мієлінові оболонки пошкоджених нервових волокон деформовані, вони втратили свою округлу або овальну форму, набуваючи не властиву їм структуру. Зустрічаються полігональні і плоскі мієлінізовані нервові волокна. В окремих волокнах аксоплазми електроннощільні, без наявності очікуваних органел. Також у проксимальному відділі відзначається наявність безмієлінових нервових волокон у стані гідропічної дистрофії. Шванівські клітини таких волокон електронно-щільні. Відзначено значне зменшення морфометричних показників нервових волокон (Таблиця 1). У зоні безпосередньої невротомії нами були встановлені суттєві відмінності в організації структури нерва, описані для попереднього відділу травмованого нерва. У зоні шва сформований сполучнотканинний рубець, який практично повністю позбавлений судинних елементів нерва. Судини в зоні формування рубця регенерували по периферії і відрізняються за своїм ультраструктурними особливостям від судин нерва інтактних тварин. Капіляри, локалізовані ближче до рубця, характеризуються вираженими порушеннями: їх стінка тонка, а ядра окремих ендотеліоцитів набувають полігональної, зірчастої форми. Люменальна і базальна поверхні цих клітин формують випинання. Цитоплазма багатьох ендотеліоцитів наповнена множинними мікропіноцитозними везикулами, особливо на базальному полюсі клітин. Мітохондрії цих клітин пошкоджені, вони не мають властиву даними органоїдам організацію кріст: крісти відсутні або роздуті. У зоні рубця зустрічаються також капіляри в стазованому стані, в просвіті яких скупчення еритроцитів і тромбоцитів. Перицити даної досліджуваної області травмованого нерва розташовані на певній відстані від базальної мембрани капілярів, навколо них відзначається набряк тканини. Досить високий рівень васкуляризації встановлений на периферії регенераційної невроми. Саме вздовж цієї новоствореної судинної системи відзначаються процеси регенерації нервових стовбурів. Мієлінова оболонка регенерованих нервових волокон в зоні шва має локальні розшарування ламелі, але частіше вона гомогенно профарбована осмієм, електронно-щільна. Аксоплазма цих волокон має елементи аксоскелета, везикули і мітохондрії. Цитоплазма активованих нейролемоцитів характеризується ознаками активації: визначаються стопки апарату Гольджі та ендоплазматичного ретикулуму, відновлюється мікрорегіональна базальна мембрана навколо окремих нервових волокон. Також в зоні шва зустрічаються регенеровані нервові волокна овальної і плоскої форми. В окремих волокнах мієлінова оболонка деформована у вигляді нашарування, при цьому повного ультраструктурного відновлення ламелярної організації мієліну, характерного для інтактних нервових волокон, не встановлено. У зоні шва відзначається скупчення активованих фібробластів і макрофагів. Навколо них розташовані численні пучки різноспрямованих колагенових волокон, стан неоколагеногенезу. При вивченні дистального відділу сідничного нерва щурів при повній невротомії була встановлена різко виражена картина структурно-функціональних змін. Судини середнього калібру своєю внутрішньою поверхнею формують листоподібні випинання, які різко звужують просвіт судини. Капіляри в цьому відділі нерва характеризуються високою транспортної активністю, що виявляється у формуванні численних мікропіноцитозних везикул в цитоплазмі ендотеліоцитів. Базальна мембрана таких капілярів дисоційована, з локальною деструкцією. На периферії капілярів відзначаються осередки рубцювання: скупчення численних пучків колагенових волокон і активованих фібробластів з макрофагами. Поблизу цих зон волокна знаходяться в стані дегенерації, їх мієлінові оболонки деформовані, електронно-щільні. У міжклітинному просторі зустрічаються окремі ламелеподібні просвіти. Безмієлінові волокна також з ознаками порушень структурної організації, їх аксолема відшарована від відростків нейролемоцитів. Одночасно з цим багато шванівських клітин в активному стані: цитоплазма з елементами апарату Гольджі та ендоплазматичного ретикулуму, мітохондріями. Ядра клітин з диспергованим хроматином. Мієлінізовані нервові волокна відокремлені від навколишньої міжклітковини мікрорегіональною базальною мембраною, яка в багатьох зонах має ознаки деструкції. Між регенерованими нервовими волокнами встановлено наявність груп активованих фібробластів і макрофагів, пучки колагенових волокон. Слід зазначити, що кількість вказаних клітин значно більше, ніж у проксимальному відділі травмованого нерва. Зустрічаються окремі макрофаги і нейролемоцити з фагоцитованими фрагментами детриту пошкоджених нервових волокон. При вивченні дії ліпофлавону встановлено, що в проксимальному відділі травмованого нерва нервові волокна розташовувалися групами і між ними зустрічалися колби зростання. Навколо регенерованих волокон були присутні пучки колагенових волокон, як і у тварин без лікування препаратом. У зростаючих аксонах зустрічаються елементи цитоскелету, мітохондрії. В окремих місцях зростаючі аксони розташовані групами. Встановлено, що Ліпофлавон стимулює ангіогенез в області травми нерва. У цьому відділі травмованого нерва множинні кровоносні судини формують анастомози. Відзначається 2 UA 87206 U 5 10 15 відновлення ультраструктурної організації гемокапилярів: у проксимальному відділі і зоні шва, а їх базальна мембрана менш пошкоджена. В області шва при введенні Ліпофлавону також зустрічаються колби зростання і нервові волокна на різних стадіях мієлінізованого процесу. У аксонах добре розвинені елементи аксоскелета, присутні мітохондрії і везикули. У дистальному відділі капіляри характеризуються локальним відшаруванням базальної мембрани і їх локальною деструкцією. При використанні ліпофлавону зростає кількість регенерованих нервових волокон у проксимальному і дистальному відділі. У всіх досліджуваних відділах травмованого нерва зустрічаються новоутворені нервові волокна. Встановлено відновлення їх ультраструктурної організації. Мієлінові оболонки мають нормальну структуру без набряку та розшарування (фіг. 1,2). Лише в деяких нервових волокнах зустрічається локальне розшарування ламелей мієліну. Шванівські клітини характеризуються високою синтетичною активністю, про що свідчить зростання в ядрах кількостей еухроматину і формування відростків, що контактують з регенерованими нервовими волокнами. При впливі Ліпофлавону встановлено збільшення кількості ламелей мієлінових оболонок в проксимальному відділі і області шва (Таблиця 2). Таким чином, Ліпофлавон робить істотний вплив на процеси регенерації та відновлення нервових волокон кровоносних судин і нервових волокон у травмованому нерві. Відновлення структурної організації нерва в більшому ступені відбувається в проксимальному відділі і зоні шва. Таблиця 1 Показники морфометричних змін нервових волокон дистального відділу нерва при травмуванні і застосуванні лікарських засобів Група Площа Площа осьового мієлінового 2 циліндра (мкм ) 2 волокна (мкм ) Товщина мієлінової оболонки (мкм) 1,13±0,21 0,85±0,19а 0,90±0,15а 0,52±0,11а Площа мієлінової 2 оболонки (мкм ) Контроль 84,77±18,98 73,27±12,63 7,26±0,27 Травма (проксимальний відділ) 54,27±12,18а 44,83±13,62а 5,54±0,24а Травма (область травми) 39,74±7,33а 33,86±10,09а 5,72±0,24а Травма (дистальний відділ) 26,62±9,34а 22,04±10,97а 3,40±0,16а Ліпофлавон (проксимальний 43,20±14,00а 37,54±11,81а 0,80±0,11а 5,22±0,12а, с відділ) Ліпофлавон (область травми) 33,08±6,07а, 26,47±6,51а 0,75±0,16а 4,91±0,18а, b Ліпофлавон (дистальний 36,06±9,20а 30,41±11,20а 0,81±0,11а, b 5,42±0,12а, b відділ) а - достовірно по відношенню до контролю (р
ДивитисяДодаткова інформація
Автори англійськоюKhrapai Olena Volodymyrivna, Chaikovskyu Yurii Bohdanovych
Автори російськоюХрапай Елена Владимировна, Чайковский Юрий Богданович
МПК / Мітки
МПК: A61K 31/00
Мітки: нерва, впливом, спосіб, регенерації, оцінки, експерименті, етапах, периферійного, ліпофлавону, пізніх, травмованого, ефективності
Код посилання
<a href="https://ua.patents.su/7-87206-sposib-ocinki-efektivnosti-regeneraci-travmovanogo-periferijjnogo-nerva-pid-vplivom-lipoflavonu-na-piznikh-etapakh-v-eksperimenti.html" target="_blank" rel="follow" title="База патентів України">Спосіб оцінки ефективності регенерації травмованого периферійного нерва під впливом ліпофлавону на пізніх етапах (в експерименті)</a>
Попередній патент: Спосіб оцінки розвитку стравохідно-шлункового переходу
Наступний патент: Спосіб блокади шийного симпатичного сплетіння
Випадковий патент: Система автоматичного регулювання швидкості обертання електричних двигунів групи витяжних вентиляторів