Гуманізовані антитіла проти tl1a
Номер патенту: 104132
Опубліковано: 10.01.2014
Автори: Куксі Бріджет А., Рошке Віктор, Канакарадж Паланісамі, Роузен Крейг, Сміт Роджер
Формула / Реферат
1. Виділений антигензв'язувальний поліпептид, що специфічно зв'язується з TL1A, який містить:
(a) варіабельну область важкого ланцюга гуманізованого антитіла, яка містить:
(1) CDR-Н1, яка містить амінокислотну послідовність TSNMGVV;
(2) CDR-Н2, яка містить амінокислотну послідовність HILWDDREYSNPALKS; i
(3) CDR-Н3, яка містить амінокислотну послідовність MSRNYYGSSYVMDY, і
(b) варіабельну область легкого ланцюга гуманізованого антитіла, яка містить:
(1) CDR-L1, яка містить амінокислотну послідовність SASSSVNYMН;
(2) CDR-L2, яка містить амінокислотну послідовність STSNLAS; і
(3) CDR-L3, яка містить амінокислотну послідовність НQWNNYGТ.
2. Поліпептид за п. 1, де варіабельна область важкого ланцюга гуманізованого антитіла містить амінокислотну послідовність
QVTLKESGPALVKPTQTLTLTCTFSGFSLSTSNMGVVWIRQPPGKALEWLAHILWDDREYSNPALKSRLTISKDTSKNQVVLTMTNMDPVDTATYYCARMSRNYYGSSYVMDYWGQGT VTVSS.
3. Поліпептид за п. 1, де варіабельна область легкого ланцюга гуманізованого антитіла містить амінокислотну послідовність DIQLTQSPSFLSASVGDRVTITCSASSSVNYMHWYQQKPGKAPKLLIYSTSNLASGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCHQWNNYGTFGQGTKVEIKR.
4. Антигензв'язувальний поліпептид, що специфічно зв'язується з TL1A, який містить варіабельну область важкого ланцюга гуманізованого антитіла за п. 2 і варіабельну область легкого ланцюга гуманізованого антитіла за п. 3.
5. Поліпептид за будь-яким з пп. 1-4, де поліпептид вибраний з групи, що складається з молекули антитіла, фрагмента Fab, фрагмента Fab', фрагмента F(ab')2 і молекули scFv.
6. Поліпептид за п. 5, де молекула являє собою молекулу антитіла.
7. Антитіло за п. 6, яке специфічно зв'язується з TL1A і має:
(a) варіабельну область легкого ланцюга, що має послідовність
DIQLTQSPSFLSASVGDRVTITCSASSSVNYMHWYQQKPGKAPKLLIYSTSNLASGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCHQWNNYGTFGQGTKVEIKR; і
(b) варіабельну область важкого ланцюга, що має послідовність
QVTLKESGPALVKPTQTLTLTCTFSGFSLSTSNMGVVWIRQPPGKALEWLAHILWDDREYSNPALKSRLTISKDTSKNQVVLTMTNMDPVDTATYYCARMSRNYYGSSYVMDYWGQGTLVTVSS.
8. Поліпептид за п. 6, де антитіло являє собою химерне антитіло, яке містить константну область важкого ланцюга людини і константну область легкого ланцюга людини.
9. Поліпептид за будь-яким з пп. 6 або 7, де антитіло являє собою молекулу IgG (наприклад молекулу IgGl або IgG4).
10. Поліпептид за п. 1, де поліпептид являє собою молекулу scFv.
11. Поліпептид за п. 10, де scFv має формулу, вибрану з групи, що складається з NH2-L-VH-X-VK-COOH і NH2-L-VK-Х-VH-СООН; де L являє собою лідерну послідовність; VH являє собою варіабельну область важкого ланцюга гуманізованого антитіла; X являє собою лінкерний поліпептид; і VK являє собою варіабельну область легкого ланцюга гуманізованого антитіла.
12. Поліпептид за п. 1, де поліпептид являє собою злиту молекулу Fab HSA.
13. Поліпептид за п. 12, де злита молекула Fab HSA має формулу, вибрану з групи, що складається з NH2-VН-CH1-HSA-COOH або NH2-НSA-CH1-VН-СООН в поєднанні з NH2-VK-CK-COOН; де VН-CН1-НSA або HSA-CН1-VH являє собою варіабельну область важкого ланцюга гуманізованого антитіла (VH) іконстантний домен 1 важкого ланцюга людини (СН1), одержані у вигляді злитого білка з сироватковим альбуміном людини (HSA), який потім укладається з його спорідненою варіабельною областю легкого ланцюга гуманізованого антитіла (VK) і константним доменом κ-ланцюга (СΚ) людини з утворенням злитого білка Fab-НSA або НSA-Fab.
14. Поліпептид за будь-яким з пп. 1-13, кон'югований з терапевтичним або діагностичним засобом.
15. Поліпептид за п. 14, де терапевтичний засіб вибраний з групи, що складається з цитотоксичного засобу, радіоактивної мітки, імуномодулятора, гормону, ферменту, олігонуклеотиду, фотоактивного терапевтичного засобу або їх поєднання.
16. Поліпептид за п. 14, де діагностичний засіб вибраний з групи, що складається з радіоактивної мітки, фотоактивного діагностичного засобу, засобу, що активується ультразвуком, або нерадіоактивної мітки.
17. Поліпептид за будь-яким з пп. 1-16, де поліпептид є антагоністом TL1A.
18. Поліпептид за будь-яким з пп. 1-16, де поліпептид не є агоністом TL1A.
19. Поліпептид за будь-яким з пп. 1-18, де поліпептид зв'язується з TL1A з константою зв'язування, що складає щонайменше приблизно 106М-1 (переважно щонайменше приблизно 107М-1, більш переважно щонайменше приблизно 108М-1, навіть більш переважно щонайменше приблизно 109М-1).
20. Фармацевтична композиція, що містить будь-який з поліпептидів за пп. 1-19 і носій.
21. Фармацевтична композиція за п. 20, яка додатково містить терапевтичний або діагностичний засіб.
22. Спосіб лікування або діагностування запального захворювання або стану, який включає введення композиції за будь-яким з пп. 20 або 21 пацієнту, який цього потребує.
23. Спосіб лікування або діагностування імунологічного захворювання або стану, який включає введення композиції за будь-яким з пп. 20 або 21 пацієнту, який цього потребує.
24. Спосіб лікування або діагностування злоякісного захворювання або стану, який включає введення композиції за будь-яким з пп. 20 або 21 пацієнту, який цього потребує.
25. Спосіб за будь-яким з пп. 22-24, де захворювання або стан вибрані з групи, що складається з аутоімунного захворювання (наприклад звичайного вовчака), запального захворювання кишечнику (IBD), хронічного обструктивного захворювання легенів (COPD), артриту (наприклад ревматоїдного артриту), розсіяного склерозу, відторгнення трансплантата, пошкодження центральної нервової системи, Тh1-опосередкованих захворювань кишечнику, таких як хвороба Крона, псоріазу, лейкемії або лімфоми (наприклад хронічний лімфолейкоз (CLL)), атеросклерозу, карциноми легенів і карциноми товстої кишки.
26. Полінуклеотид, що кодує будь-який з поліпептидів за пп. 1-19.
27. Рекомбінантний полінуклеотид, який містить промоторну послідовність, функціонально пов'язану з будь-яким полінуклеотидом за п. 26.
28. Виділена клітина, трансформована полінуклеотидом за п. 27.
29. Спосіб одержання поліпептиду, що кодується рекомбінантним полінуклеотидом за п. 27, де спосіб включає:
a) культивування клітини, трансформованої рекомбінантним полінуклеотидом, для того, щоб експресувати поліпептид, що кодується; і
b) збирання експресованого таким чином поліпептиду.
Текст
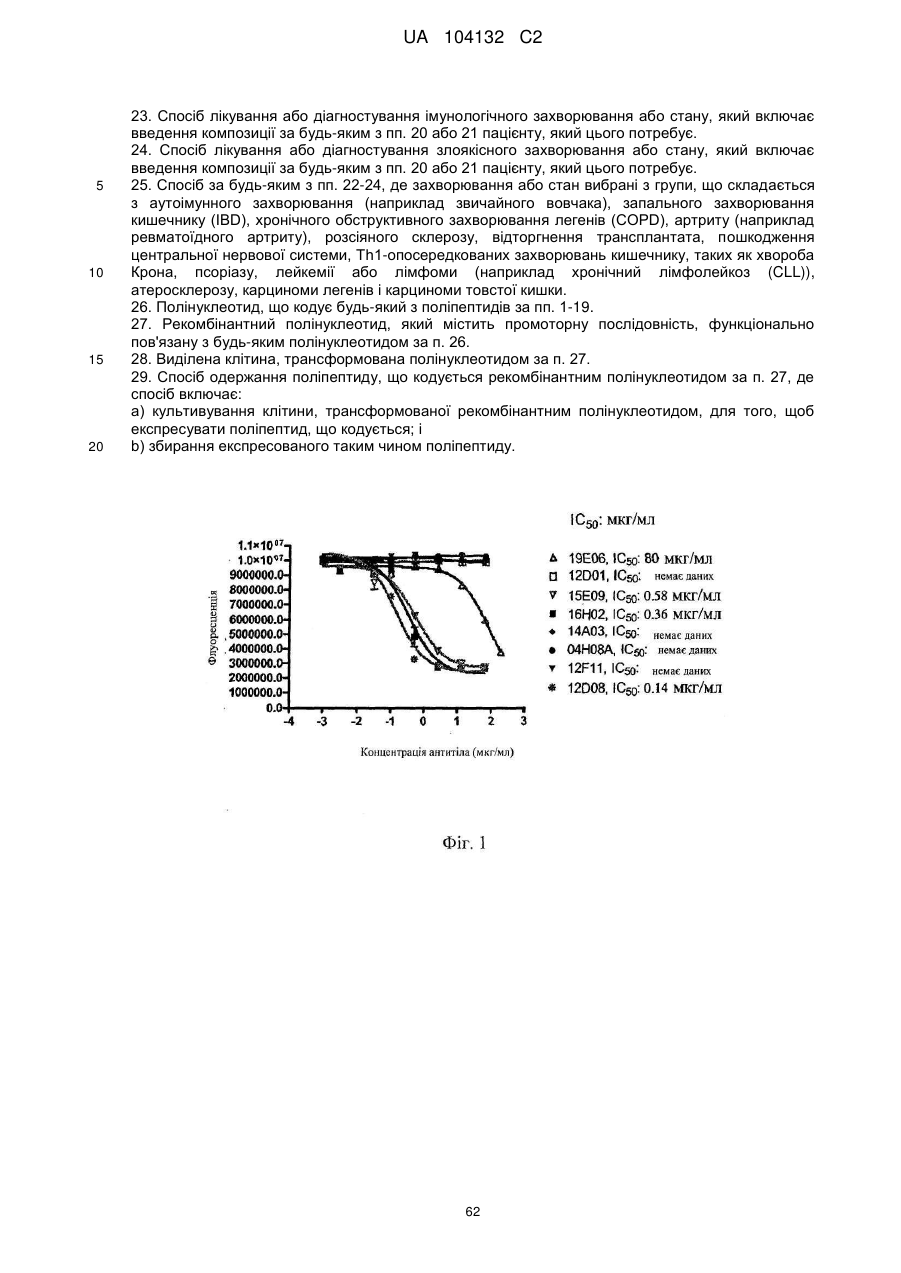
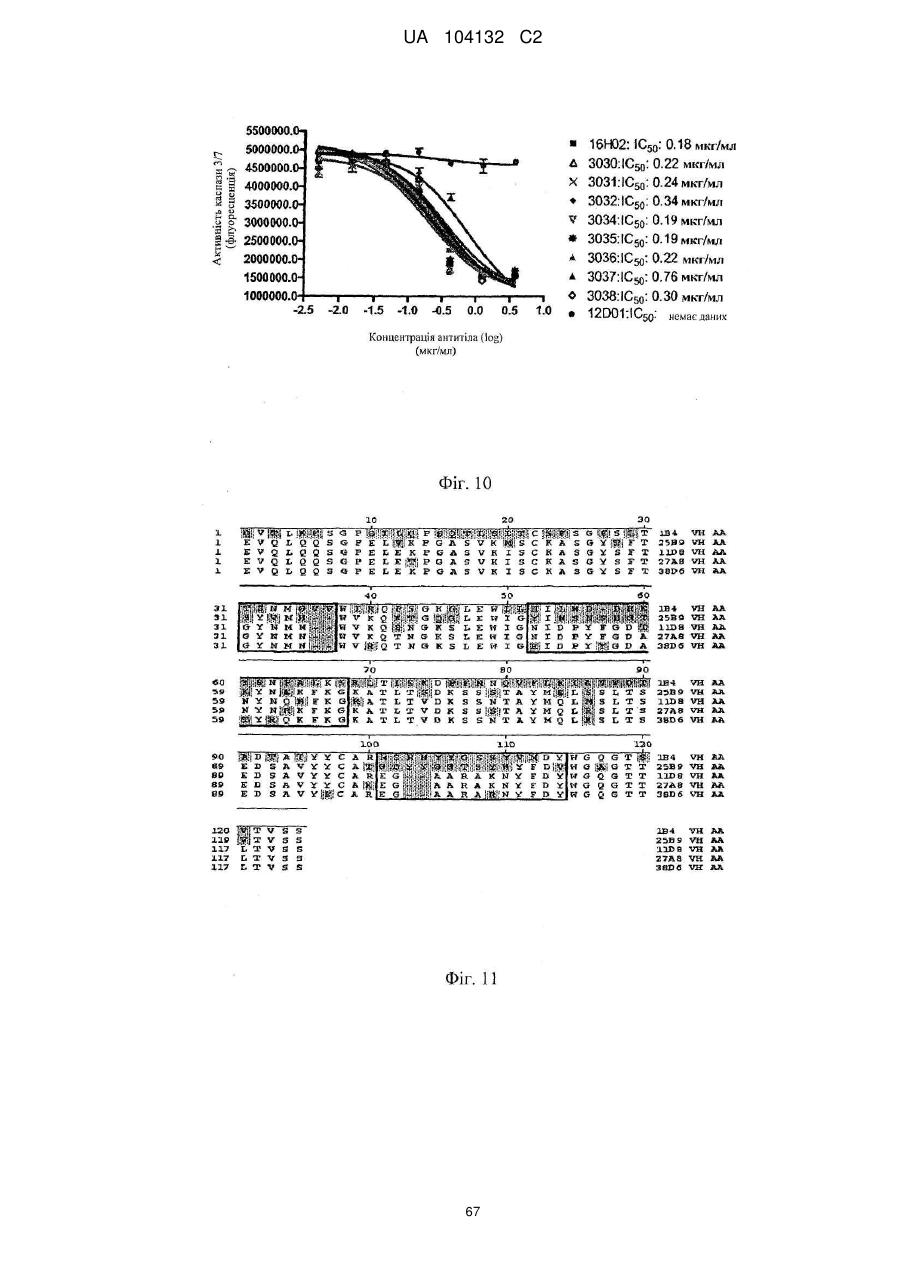
Реферат: Винахід стосується виділеного антигензв'язувального поліпептиду, що специфічно зв'язується з TL1A. UA 104132 C2 (12) UA 104132 C2 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 За даною заявкою вимагається перевага пріоритету за тимчасовою патентною заявкою США №60/987651, яка подана 13 листопада 2007 року. Таким чином, зміст цієї заявки включений як посилання в повному об'ємі. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Даний винахід стосується антитіл проти TL1A і способів одержання і застосування таких антитіл. Очікується, що ці антитіла можна використати, зокрема, для лікування запальних станів, таких як хвороба Крона. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Білки, що володіють структурною схожістю з фактором некрозу пухлини (TNF), в сукупності позначаються як надсімейство TNF. TL1A, член надсімейства TNF, являє собою TNF-подібний цитокін, який зв'язується з рецептором з доменом смерті (DR)3 і надає костимуляторні сигнали активованим лімфоцитам. За допомогою цієї взаємодії TL1A індукує секрецію IFN-γ і, отже, може брати участь в розвитку ефекторних відповідей Т-хелперів 1 типу. TL1A являє собою трансмембранний білок II типу і позначається як 15-й член надсімейства TNF (TNFSF15). TL1A експресується переважно ендотеліальними клітинами і моноцитами, і його експресія індукується під дією TNF-a і IL-1a. Migone et al., Immunity, 16:479-92 (2002). TL1a піддається підвищуючій регуляції прозапальними цитокінами TNF і IL-1, а також імунними комплексами (IC). Hsu et al., Exp. Cell Res., 292:241-51 (2004). TL1A опосередковує передачу сигналів через свій рецептор пізнавання - рецептор смерті DR3, активація якого, як відомо, індукує як фактори смерті, так і фактори виживання. Також передбачається, що TL1A, подібно TNF, циркулює в гомодержерній розчинній формі. Kim et al., J. Immunol. Methods, 298(l-2):l-8 (Mar. 2005). TL1A з високою афінністю зв'язується рецептором смерті 3 (DR3), що є членом сімейства рецепторів TNF, що містять домен смерті, а також називається Wsl-1, Apo-3, TRAMP і LARD і в цей час позначається як 25-й член надсімейства рецепторів TNF (TNFRSF25). У залежності від клітинного оточення, зв’язування DR3 з TL1A може запускати один або два шляхи передачі сигналу, активація фактора транскрипції NF-κВ або активація каспаз і апоптоз. TL1 бере участь в костимуляції Т-клітин і поляризації Th1-клітин. На активовані Т-клітини TL1A діє, зокрема, через свій поверхневий рецептор DR3, щоб стимулювати клітинне виживання і секрецію прозапальних цитокінів. Секретований рецептор-приманка 3 (DcR3), розчинний білок з сімейства рецепторів фактора некрозу пухлини (TNFR), блокує дію TL1A. Kim et al., «Identification of naturally secreted soluble form of TL1A, а TNF-like cytokine», J Immunol. Methods, 298:1-8 (2005). Вірогідні мішені терапевтичного впливу Алергія і астма Th2-поляризація CD4 Т-клітин при підвищених рівнях IgE і утворенні IL-13 NKT-клітинами є основною причиною запалення легені при алергії і астмі. TL1A грає основну роль в алергічному запаленні легені (Fang et al J. Exp. Med. 2008). TL1A костимулює утворення IL-4 і IL-13 в NKTклітинах. Блокування взаємодії TL1A і DR3 антитілами проти TL1A або домінантним негативним мутантом TL1A знімає запалення легені. Карцинома легенів і карцинома товстої кишки Члени надсімейства TNF і надсімейства рецепторів TNF регулюють імунологічні реакції і індукують апоптоз. DR3 переважно експресується Т-лімфоцитами і зазнає підвищуючої регуляції в процесі активації Т-клітин. Лігандом для DR3 є TL1A. TL1A також зв'язується з рецептором-приманкою DcR3/TR6, який експресується деякими карциномами легенів і карциномами товстої кишки і в деяких здорових тканинах. TL1A зазнає підвищуючої регуляції під дією прозапальних цитокінів TNF і IL-1. TL1A є більш довгим варіантом TL1 (також позначається як VEGI). Атеросклероз Крім того, також повідомлялося, що TL1A володіє ангіостатичною дією і індукує експресію генів металопротеїнази і IL-8 (Su et al., Exp. Cell Res., 312:266-277 (2006); Kang et al., Cytokine, 29:229-235 (2005)). Дійсно, TL1A і DR3 можуть бути залучені в патогенез атеросклерозу шляхом збільшення утворення прозапальних цитокінів і хемокінів і зниження стабільності бляшок, індукуючи ферменти, що руйнують позаклітинний матрикс (Kang et al., Cytokine, 29:229-235 (2005)). Ревматоїдний артрит Також існують дані, які вказують на те, що TL1A/DR3 залучені до етіології ревматоїдного артриту (Bossen et al, J. Biol. Chem., 281(20):13964-13971 (May 19, 2006). Запальне захворювання кишечника Дослідники виявили зв'язок між експресією TL1A і запальним захворюванням кишечника 1 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Prehn et al., Clin. Immunol., 112:66-77 (2004); Bamias et al., J. Immunol. 171:4868-4874 (2003)). Th1-опосередковані захворювання кишечника, такі як хвороба Крона Хвороба Крона являє собою важкий запальний розлад кишечника, який вражає молодих дорослих людей (у віці від 20 до 30 років). Вважають, що причинами цього стану є генетична схильність і фактори зовнішнього середовища, які викликають дисбаланс ефекторних (прозапальних) і регуляторних реакцій Т-клітин, що приводить до запалення слизової шлунково-кишкового тракту і розладу. Шлях TL1A/DR3 грає важливу роль в Th1-опосредованних захворюваннях кишечника, таких як хвороба Крона. Konstantinos et al., The Journal of Immunology, 2005, 174: 4985-4990 (2005); Bamias et al., J. Immunol. 171:4868-74 (2003). Отже, блокування шляху TL1A/DR3 може дати можливість лікування хвороби Крона. TL1A збільшує утворення IFN-γ за допомогою анти-CD3 плюс анти-CD28 і IL-12/IL-18стимульованих Т-клітин периферичної крові (ПК). Активація DR3 під дією TL1A індукує утворення сигнального комплексу, включаючи TRADD, TRAF2 і RIP і активовані NF-κВ і ERK, JNK і p38 мітоген-активовані протеїнкіназні шляхи. Kang et al., Cytokine, 29:229-35 (2005). TL1A може вивільнятися і циркулювати в гомодержерній розчинній формі. Wen et al., «TL1A-induced NF-kappaB activation and c-IAP2 production prevent DR3-mediated apoptosis in TF-1 cells», J. Biol. Chem., 278:39251-8 (2003). Рецептори смерті і їх ліганди грають ключову роль в підтримці тканинного гомеостазу і фізіологічному регулюванні запрограмованої клітинної смерті. Зв’язування лігандів смерті індукує олігомеризацію рецептора, залучення адаптерного білка за допомогою консервативного цитоплазматичного сигнального елемента, який називається доменом смерті, активацію каспаз і індукцію апоптозу. Young et al., Proc. Natl. Acad. Sci. USA, 103(22): 8303-8304 (May 30, 2006). Хоча рецептори смерті, такі як Fas/Apo-1/CD95, TNF-R1, TRAIL-R1, TRAIL-R2 або DR3, спочатку були описані як індуктори апоптозу, збільшується кількість свідоцтв того, що ці рецептори також мають функції, не пов'язані з апоптозом, включаючи регуляцію адаптивної імунної відповіді. У статті Bamias et al, Proc. Natl. Acad. Sci. USA, 103:8441-8446 (2006) повідомляється про те, що TL1A експресується дендритними клітинами власної пластинки слизової і про те, що він діє за допомогою посилення проліферації клітин пам'яті, але не + наївних CD4 Т-клітин, і виявляє синергетичний ефект разом з IL-12 і/або в малих дозах стимулює рецептори Т-клітин для різкого підвищення експресії гена IFN-γ. Вважають, що експресія IFN-γ в кишечнику є маркером запалення, і багато які стратегії лікування хвороби Крона основані на численних спробах придушувати активований стан імунної системи. Однак такі спроби (лікування стероїдами і імуносупресорними лікарськими засобами) не націлені саме на кишечник і, таким чином, ним властиві певні складності. Цілеспрямована терапія, основана на використанні антагоністів TNF-α, була успішно введена в 1990-х, і результати, про які повідомляється в літературному джерелі 1, кажуть про те, що терапія, направлена саме проти TL1A або його рецепторів, може забезпечити альтернативну цілеспрямовану терапію для цього виснажуючого захворювання. Як повідомляється в статті Bamias et al., Proc. Natl. Acad. Sci. USA, 103:8441-8446 (2006), схоже, TL1A володіє самим сильним ефектом, коли він експресується в кишечнику при запаленні. TL1A в поєднанні з IL-12/18 виявляє синергетичну дію при індукції експресії IFN-γ Тклітинами людини, хоч збільшена експресія також може спостерігатися в природних кілерах (Migone et al., Immunity., 16:479-492 (2002); Papadakis et al., J. Immunol. 174:4985-4990 (2005); Papadakis et al., J. Immunol. 172:7002-7007 (2004)). В статті Bamias et al., Proc. Natl. Acad. Sci. USA, 103:8441-8446 (2006) уперше повідомлялося про схожі спостереження, зроблені на моделях хвороби Крона на мишах, що розширює раніше одержані дані, оскільки вказує на те, що синергізм виникає, коли Т-клітинний рецептор стимульований слабо або коли Т-клітини зазнають впливу IL-12. Незважаючи на те, що дослідники Bamias et al. не спостерігали синергетичного ефекту, коли обробку білком TL1A комбінували з IL-18, цей результат можна не вважати дивним, оскільки як IL-18, так і TL1A передають сигнали через NF-κВ. Тоді як в початковому повідомленні дослідників Migone et al. було показано, що TL1A був костимуляторним сигналом для Т-клітин, дослідники Bamias et al. показали, що вона є Тклітиною пам'яті, яка відповідала більш виражено, відповідно до збільшеної здатності цієї Тклітинної популяції експресувати IFN-γ. Внаслідок того, що ця популяція проліферує, вона також виявляє більш високі рівні експресії рецептора TL1A, таким чином, додатково збільшуючи здатність клітин проліферувати і експресувати IFN-γ. Це відкриття можна вважати в деякій мірі несподіваним в зв'язку з тим, що єдиним відомим рецептором TL1A є DR3 - рецептор, що містить домен смерті, і можна передбачити, що включення цього рецептора приводить до 2 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітинної смерті. (TL1A передає сигнали через DR3 - його єдиний відомий рецептор на поверхні клітини. TL1A також зв'язується з розчинним рецептором-приманкою (DcR3)). Однак було показано, що NF-κВ-залежний антиапоптотичні гени, такі як інгібітор апоптозу 2, індукуються білком TL1A (Wen et al, J. Biol. Chem., 278:39251-39258 (2003)), і, отже, включення апоптозу або проліферації може залежати від типу клітин. Існуючі в цей час варіанти лікування хвороби Крона включають моноклональні антитіла проти TNF-α, інфликсимаб (Ремікейд; Centocor, Inc., Horsham, PA), моноклональні антитіла Адалімумаб (торгова назва Humira; Abbott), а також протизапальні засоби (наприклад, сульфасалазин), кортизон або стероїди (наприклад, преднізон), імунодепресанти (наприклад, 6-меркаптопурин) і антибіотики. Однак інфликсимаб є єдиним варіантом лікування, який володіє високою мірою спрямованості; інші варіанти лікування володіють низькою спрямованістю. Proc. Natl. Acad. Sci. U.S.A., 103(22): 8303-8304 (May 30, 2006). Це означає, що лікування не націлене на ділянку захворювання. У той час як інфликсимаб володіє високою спрямованістю і, як правило, добре переноситься, інфликсимаб може викликати рецидиви туберкульозної інфекції і погіршення при серцевій недостатності, демієлінізуючих захворюваннях і збільшення частоти виникнення лімфом. Отже, в даній галузі зберігається потреба в композиціях, які можна використати для лікування і діагностики різних запальних і імунних захворювань і розладів, таких як алергія/астма, ревматоїдний артрит, розсіяний склероз, хвороба Крона, запальне захворювання кишечника, хронічне обструктивне захворювання легенів, псоріаз, діабет 1-го типу і відторгнення трансплантата. Даний винахід стосується моноклональних антитіл проти TL1A і задовольняє цю потребу. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Розкриті молекули антигенів’язувального поліпептиду, який специфічно зв'язується з TNFподібним цитокіном TL1A (див. GenBank, інвентарний номер AF520785). Поліпептиди містять варіабельну область гуманізованого важкого ланцюга і варіабельну область гуманізованого легкого ланцюга. Наприклад, поліпептиди можуть містити каркасні області (FR) варіабельних областей легкого і важкого ланцюга антитіла людини при збереженні по суті антигензв’язувальної специфічності батьківського моноклонального антитіла. Варіабельна область гуманізованого важкого ланцюга і/або варіабельна область гуманізованого легкого ланцюга гуманізовані, щонайменше, приблизно на 87%, гуманізовані, щонайменше, приблизно на 90%, гуманізовані, щонайменше, приблизно на 95%, гуманізовані, щонайменше, приблизно на 98% або гуманізовані, щонайменше, приблизно на 100%, за винятком гіперваріабельних ділянок (CDR). Молекули антигензв’язувальних поліпептидів можуть бути одержані з донорних моноклональних антитіл (наприклад, донорних моноклональних антитіл миші) і можуть містити CDR з моноклональних антитіл (наприклад, CDR з моноклональних антитіл миші). Поліпептиди можуть виконувати функції антагоністів рецептора TL1A. Також даний винахід стосується фармацевтичних композицій, які містять поліпептиди згідно з даним винаходом, способів одержання таких поліпептидів і композицій і способів лікування суб'єктів, які в цьому мають потребу, композиціями згідно з даним винаходом. Приклади станів, які можна лікувати композиціями згідно з даним винаходом, включають, як необмежувальні приклади, аутоімунні захворювання (наприклад, звичайний вовчак), запальне захворювання кишечника (IBD), хронічне обструктивне захворювання легенів (COPD), артрит (наприклад, ревматоїдний артрит), розсіяний склероз, відторгнення трансплантату, пошкодження центральної нервової системи, Th1-опосередковане захворювання кишечника, таке як хвороба Крона, псоріаз, лейкемію або лімфому (наприклад, хронічний лімфолейкоз (CLL)), атеросклероз, карциному легенів і карциному товстої кишки. У деяких варіантах здійснення антигензв’язувальний поліпептид специфічно зв'язується з TL1A і містить: (a) варіабельну область важкого ланцюга гуманізованого антитіла, яка містить: (1) CDR-H1, яка містить амінокислотну послідовність ({L,S,N}Y{G,A}MN); (2) CDR-H2, яка містить амінокислотну послідовність (WINT{Y,N}TG{E,N}PTYA{D,Q}{D,G}F{K,T}G); і (3) CDR-H3, яка містить амінокислотну послідовність (D{T,Y}{A,G}{M,K}{D,Y}{Y,G}{A,D}{M,Y}{A,Y}{Y,A}MDY); і (b) варіабельну область легкого ланцюга гуманізованого антитіла, яка містить: (1) CDR-L1, яка містить амінокислотну послідовність ({K,R}SSQ{N,S}{I,L}V{H,Y}S{D,N}GNTYL{E,N,D}); (2) CDRL2, яка містить амінокислотну послідовність (KVSNR{F,D}S); і (3) CDR-L3, яка містить амінокислотну послідовність ({F,M}QG{S,T}H{V,-}{P,-}{L,-}{T,-}). У певних варіантах здійснення антигензв’язувальний поліпептид специфічно зв'язується з TL1A і містить: варіабельну область важкого ланцюга гуманізованого антитіла, яка містить (1) CDR-H1, яка містить послідовність, по суті що складається з або що складається з амінокислотної послідовності TSNMGVV; (2) CDR-H2, яка містить послідовність, по суті, що 3 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 складається з або що складається з амінокислотної послідовності HILWDDREYSNPALKS; і (3) CDR-H3, яка містить послідовність, по суті, що складається з, або що складається з амінокислотної послідовності MSRNYYGSSYVMDY. У деяких варіантах здійснення антигензв’язувальний поліпептид містить варіабельну область важкого ланцюга гуманізованого антитіла, яка містить послідовність, по суті, що складається з, або що складається з амінокислотної послідовності: QVTLKESGPALVΚPTQTLTLTCTFSGFSLSTSNMGVVWIRQPPGKALEWLAHILWDDREYSNPAL KSRLTISKDTSKNQVVLTMTNMDPVDTATYYCARMSRNYYGSSYVMDYWGQGTLVTVSS. У деяких варіантах здійснення поліпептидів (1) CDR-H1 складається з амінокислотної послідовності (LYGMN) або (NYGMN); (2) CDR-H2 складається з амінокислотної послідовності (WINTYTGEPTYADDFKG); (3) CDR-H3 складається з амінокислотної послідовності (DTAMDYAMAY) або (DYGKYGDYYAMDY); (4) CDR-L1 складається з амінокислотної послідовності (KSSQNIVHSDGNTYLE) або (RSSQSIVHSNGNTYLD); (5) CDR-L2 складається з амінокислотної послідовності (KVSNRFS); і (6) CDR-L3 складається з амінокислотної послідовності (FQGSHVPLT). У деяких варіантах здійснення поліпептид містить варіабельну область важкого ланцюга гуманізованого антитіла (Q{V,I}QLVQSG{S,P}ELKKPG{A,E}{S,T}VΚ{V,I}SCKASGYTFT{L,S,N}Y{G,A}MNWV{R,K}QAPG{Q,K} GL{E,K}WMGWINT{Y,N}TG{E,,N}PTYA{D,Q}{D,G}F{K,T}GRF{V,A}FSL{D,E}TS{V,A}STAYLQI{S,N}{S ,T}LK{A,N}ED{T,M}A{V,T}Y{Y,F}CARD{T,Y}{A,G}{M,K}{D,Y}{Y,G}{A,D}{M,Y}{A,Y}{Y,A}MDY)WGQGT{ L,S}VTVSS). Наприклад, поліпептид може містити варіабельну область важкого ланцюга гуманізованого антитіла (QVQLVQSGSELKKPGASVΚVSCKASGYTFTLYGMNWVRQAPGQGLEWMGWINTYTGEPTYADDF KGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARDTAMDYAMAYWGQGTLVTVSS) або (QVQLVQSGSELKKPGASVΚVSCKASGYTFTLYGMNWVΚQAPGKGLKWMGWINTYTGEPTYADDF KGRFVFSLDTSVSTAYLQISSLKAEDTAVYFCARDTAMDYAMAYWGQGTLVTVSS). Альтернативно, поліпептид може містити варіабельну область важкого ланцюга гуманізованого антитіла (QVQLVQSGSELKKPGASVΚVSCKASGYTFTNYGMNWVRQAPGQGLEWMGWINTYTGEPTYADDF KGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARDYGKYGDYYAMDYWGQGTLVTVSS) або (QVQLVQSGSELKKPGASVΚVSCKASGYTFTNYGMNWVRQAPGKGLKWMGWINTYTGEPTYAD DFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYFCARDYGKYGDYYAMDYWGQGTLVTVSS). У деяких варіантах здійснення поліпептид містить варіабельну область легкого ланцюга гуманізованого антитіла (DVVMTQ{T,S}PLSLPV{T,S}{P,L}G{E,D,Q}{P,Q}ASISC{K,R}SSQ{N,S}{I,L}V{H,Y}SDGNTYL{E,N}W{Y ,F}{L,Q}Q{K,R}PGQSP{Q,K,R}{L,V,R}LIYKVSNR{F,D}SGVPDRFSGSGSGTDFTLKI{S,N}RVEAED{L, V}GVY{Y,F}C{F,M}QG{S,T}H{V,-}{P,-}{L,-}{T,-}{F,W}G{G,S,Q}GTK{V,L}EIKR. Наприклад, поліпептид може містити варіабельну область легкого ланцюга гуманізованого антитіла (DVVMTQTPLSLPVTPGEPASISCKSSQNIVHSDGNTYLEWYLQKPGQSPQLLIYKVSNRFSGVPDRF SGSGSGTDFTLKISRVEAEDLGVYYCFQGSHVPLTFGGGTKVEIKR) або (DVVMTQSPLSLPVTLGQPASISCKSSQNIVHSDGNTYLEWFQQRPGQSPRRLIYKVSNRFSGVP DRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPLTFGGGTKVEIKR). В іншому варіанті здійснення поліпептид може містити варіабельну область легкого ланцюга гуманізованого антитіла (DVVMTQSPLSLPVTLGQPASISCKSSQNIVHSDGNTYLEWFQQRPGQSPRRLIYKVSNRFSGVPDR FSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPLTFGQGTKVEIKR). Також розкриті вариабельні області важких ланцюгів гуманізованих антитіл. Область важкого ланцюга гуманізованого антитіла може містити: (1) CDR-H1, яка містить амінокислотну послідовність ({L,S,N}Y{G,A}MN); (2) CDR-H2, яка містить амінокислотну послідовність (WINT{Y,N}TG{E,N}PTYA{D,Q}{D,G}F{K,T}G); і (3) CDR-H3, яка містить амінокислотну послідовність (DTAMDYAMAY). Наприклад, варіабельна область важкого ланцюга гуманізованого антитіла може містити амінокислотну послідовність (QVQLVQSGSELKKPGASVΚVSCKASGYTFTLYGMNWVRQAPGQGLEWMGWINTYTGEPTYADDF KGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARDTAMDYAMAYWGQGTLVTVSS). Альтернативно, поліпептид може містити варіабельну область важкого ланцюга гуманізованого антитіла (QVQLVQSGSELKKPGASVΚVSCKASGYTFTLYGMNWVΚQAPGKGLKWMGWINTYTGEPTYADDF KGRFVFSLDTSVSTAYLQISSLKAEDTAVYFCARDTAMDYAMAYWGQGTLVTVSS). В іншому прикладі варіабельна область важкого ланцюга гуманізованого антитіла містить: (1) CDR-H1, яка містить амінокислотну послідовність (NYGMN); (2) CDR-H2, яка містить 4 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотну послідовність (WINTYTGEPTYADDFKG); і (3) CDR-H3, яка містить амінокислотну послідовність (DYGKYGDYYAMDY). Наприклад, варіабельна область важкого ланцюга гуманізованого антитіла може містити амінокислотну послідовність (QVQLVQSGSELKKPGASVΚVSCKASGYTFTNYGMNWVRQAPGQGLEWMGWINTYTGEPTYA DDFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARDYGKYGDYYAMDYWGQGTLVTVSS) Альтернативно, поліпептид може містити варіабельну область важкого ланцюга гуманізованого антитіла (QVQLVQSGSELKKPGASVΚVSCKASGYTFTNYGMNWVΚQAPGKGLKWMGWINTYTGEPTYAD DFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYFCARDYGKYGDYYAMDYWGQGTLVTVSS). В іншому прикладі варіабельна область важкого ланцюга гуманізованого антитіла містить: (1) CDR-H1, яка містить амінокислотну послідовність (NYAMS); (2) CDR-H2, яка містить амінокислотну послідовність (TIYSGGGYTFYLDSLKG); і (3) CDR-H3, яка містить амінокислотну послідовність (HSYPMTTVITYAPYYFYY). Наприклад, варіабельна область важкого ланцюга гуманізованого антитіла може містити амінокислотну послідовність (QVQLVQSGSELKKPGASVΚVSCKASGYTFTNYAMSWVΚQAPGKGLKWMGTIYSGGGYTFYLDSLK GRFVFSLDTSVSTAYLQSSLKAEDTAVYFCARHSYPMTTV ITYAPYYFYYWGQGTLVTVSS). Також розкриті варіабельн області легких ланцюгів гуманізованих антитіл. Варіабельна область легкого ланцюга гуманізованого антитіла може містити: (1) CDR-L1, яка містить амінокислотну послідовність({K,R}SSQ{N,S}{I,L}V{H,Y}S{D,N}GNTYL{E,N,D}); (2) CDR-L2, яка містить амінокислотну послідовність (KVSNR{F,D}S); і (3) CDR-L3, яка містить амінокислотну послідовність ({F,M}QG{S,T}H{V,-} {P,-} {L,-} {T,-}). В інших варіантах здійснення антигензв’язувальний поліпептид специфічно зв'язується з TL1A і містить: варіабельну область легкого ланцюга гуманізованого антитіла, яка містить: (1) CDR-L1, яка містить послідовність, по суті що складається з, або що складається з амінокислотної послідовності SASSSVNYMH; (2) CDR-L2, яка містить послідовність, по суті що складається з, або що складається з амінокислотної послідовності STSNLAS; і (3) CDR-L3, яка містить послідовність, по суті що складається з, або що складається з амінокислотної послідовності HQWNNYGT. У деяких варіантах здійснення антигензв’язувальний поліпептид містить варіабельну область легкого ланцюга гуманізованого антитіла, яка містить послідовність, по суті що складається з, або що складається з амінокислотної послідовності: DIQLTQSPSFLSASVGDRVTITCSASSSVNYMHWYQQKPGKAPKLLIYSTSNLASGVPSRFSGSG SGTEFTLTISSLQPEDFATYYCHQWNNYGTFGQGTKVEIKR. Наприклад, варіабельна область легкого ланцюга гуманізованого антитіла може містити амінокислотну послідовність DVVMTQSPLSLPVTLGQPASISCKSSQNIVHSDGNTYLEWFQQRPGQSPRRLIYKVSNRFSGVPDRF SGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPLTFGGGTKVEIKR. В іншому варіанті здійснення поліпептид може містити варіабельну область легкого ланцюга гуманізованого антитіла (DVVMTQSPLSLPVTLGQPASISCKSSQNIVHSDGNTYLEWFQQRPGQSPRRLIYKVSNRFSGVP DRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPLTFGQGTKVEIKR). Альтернативно, поліпептид може містити варіабельну область легкого ланцюга гуманізованого антитіла DVVMTQTPLSLPVTPGEPASISCKSSQNIVHSDGNTYLEWYLQKPGQSPQLLIYKVSNRFSGVPDRFS GSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPLTFGGGTKVEIKR або DVVMTQTPLSLPVSLGDQASISCKSSQNIVHSDGNTYLEWYLQKPGQSPKVLIYKVSNRFSGVPDRF SGSGSGTDFTLKINRVEAEDVGVYFCFQGSHVPLTFGGGTKLEIKR. Область легкого ланцюга гуманізованого антитіла також може містити: (1) CDR-L1, яка містить амінокислотну послідовність ((RSSQSIVHSNGNTYLD); (2) CDR-L2, яка містить амінокислотну послідовність (KVSNRFS); і (3) CDR-L3, яка містить амінокислотну послідовність (FQGSHVPLT). Наприклад, варіабельна область легкого ланцюга гуманізованого антитіла може містити амінокислотну послідовність DVVMTQSPLSLPVTLGQPASISCRSSQSIVHSNGNTYLDWFQQRPGQSPRRLIYKVSNRFSGVPDRF SGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPLTFGGGTKVEIKR. Альтернативно, поліпептид може містити варіабельну область легкого ланцюга гуманізованого антитіла DVVMTQSPLSLPVTLGQPASlSCRSSQSIVHSNGNTYLDWFQQRPGQSPRRLIYKVSNRFSGVPDRF SGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPLTFGQGTKVEIKR. В іншому прикладі варіабельна область легкого ланцюга гуманізованого антитіла містить: (1) CDR-L1, яка містить амінокислотну послідовність (RSSQSIVHSNGNTYLD); (2) CDR-L2, яка містить амінокислотну послідовність (KVSNRFS); і (3) CDR-L3, яка містить амінокислотну послідовність (FQGSHVPLT). Наприклад, варіабельна область легкого ланцюга гуманізованого антитіла може містити амінокислотну послідовність 5 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 DVVMTQTPLSLPVTPGEPASISCRSSQSIVHSNGNTYLDWYLQKPGQSPQLLIYKVSNRFSGVPDRF SGSGSGTDFTLKISRVEAEDLGVYYCFQGSHVPLTFGGGTKVEIKR або (DVVMTQTPLSLPVSLGDQASISCRSSQSIVHSNGNTYLDWYLQKPGQSPKVLIYKVSNRFSGVPDRF SGSGSGTDFTLKINRVEAEDLGVYFCFQGSHVPLTFGGGTKLEIKR. Вищезгадані гуманізовані важкі ланцюги і гуманізовані легкі ланцюги можуть бути представлені в антигензв’язувальних поліпептидах, які специфічно зв'язуються з TL1A. Антигензв’язувальний поліпептид може бути вибраний з групи, що складається з молекули антитіла, Fab-фрагмента, Fab'-фрагмента, F(ab')2-фрагмента і молекули scFv. У деяких варіантах здійснення поліпептид являє собою молекулу антитіла. Молекули антитіл можуть містити химерні антитіла, які містять константну область важкого ланцюга людини і константну область легкого ланцюга людини. Наприклад, молекула антитіла може являти собою молекулу IgG (наприклад, молекулу IgG1 або IgG4), в якій поліпептид містить константні домени важкого ланцюга і легкого ланцюга молекули IgG. Поліпептид може являти собою молекулу scFv. Наприклад, scFv може мати формулу, вибрану з групи, що складається з формул NH2-L-VH-XVΚ-COOH і NH2-L-VΚ-X-VH-COOH; де L являє собою лідерну послідовність; VH являє собою варіабельну область важкого ланцюга гуманізованого антитіла; X являє собою лінкерний поліпептид; і VК являє собою варіабельну область легкого ланцюга гуманізованого антитіла. Поліпептид може являти собою злиту молекулу Fab HSA. Наприклад, злита молекула Fab HSA має формулу, вибрану з групи, що складається з NH2-VH-CH1-HSA-COOH в поєднанні з NH2VΚ-CK-COOH; де VH-CH1-HSA являє собою варіабельну область важкого ланцюга гуманізованого антитіла (VH) і константний домен 1 важкого ланцюга людини (CH1), одержану у вигляді злитого білка з сироватковим альбуміном людини (HSA), яка потім укладається з його родинною варіабельною областю легкого ланцюга гуманізованого антитіла (VК) і константним доменом κ-ланцюга (CK) людини з утворенням злитого білка Fab HSA. Антигензв’язувальний поліпептид можна додатково кон’югувати з або злити з терапевтичним або діагностичним засобом. Наприклад, терапевтичні засоби можуть бути вибрані з групи, що складається з цитотоксичних засобів, радіоактивних міток, імуномодуляторів, гормонів, ферментів, олігонуклеотидів, фотоактивних терапевтичних засобів або їх поєднань. Приклади діагностичних засобів можуть включати радіоактивні мітки, фотоактивні діагностичні засоби, засоби, що активуються ультразвуком, або нерадіоактивні мітки. Антигензв’язувальний поліпептид може бути антагоністом TL1A. Типово, поліпептид не є агоністом TL1A. Антигензв’язувальний поліпептид зв'язується з рецептором TL1A специфічно і з високою афінністю. Типово, поліпептид зв'язується з TL1A з константою зв’язування, щонайменше, 6 -1 7 -1 приблизно 10 M (переважно, щонайменше, приблизно 10 M , більш переважно, щонайменше, 8 -1 9 -1 приблизно 10 M , навіть більш переважно, щонайменше, приблизно 10 M ). Також розкриті фармацевтичні композиції, які містять вищезгадані антигенів’язувальні поліпептиди і носій, наприклад, розріджувач або ексципієнт. Фармацевтичний препарат може додатково містити додатковий терапевтичний або діагностичний засіб, як описаний в цьому документі. Також розкриті способи лікування або діагностування захворювання або стану, які включають введення розкритих фармацевтичних композицій потребуючому цього пацієнту. Наприклад, фармацевтичні композиції можна вводити для лікування або діагностики запальних, імунних і/або злоякісних захворювань або станів. Приклади захворювань і станів можуть включати аутоімунні захворювання (наприклад, звичайний вовчак), запальне захворювання кишечника (IBD), хронічне обструктивне захворювання легенів (COPD), артрит (наприклад, ревматоїдний артрит), розсіяний склероз, відторгнення трансплантату, пошкодження центральної нервової системи, хвороба Крона, псоріаз, діабет 1-го типу, карциному легенів і карциному товстої кишки і лейкемію або лімфому (наприклад, хронічний лімфолейкоз (CLL)). Також розкриті полінуклеотиди, які кодують вищезгадані поліпептиди. Полінуклеотиди можуть бути функціонально пов'язані з промоторами для експресії поліпептидів, що кодуються у відповідній клітині-хазяїні. По суті, способи одержання поліпептидів, що кодуються рекомбінантними полінуклеотидами можуть включати: a) культивування клітин, трансформованих рекомбінантним полінуклеотидом для того, щоб експресувати поліпептид, що кодується; і b) збір експресованого таким чином поліпептиду. Як попередній загальний опис, так і наступний короткий опис малюнків і докладний опис є ілюстративними і пояснювальними і призначені для того, щоб надати додаткове пояснення згідно з даним винаходом, як заявлено. Інші об'єкти, переваги і нові ознаки будуть без великих зусиль зрозумілі фахівцями в даній галузі з наступного докладного опису винаходу. 6 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 КОРОТКИЙ ОПИС КРЕСЛЕНЬ На фіг. 1 показане інгібування активності каспаз, індукованих з використанням TL1A людини (huTL1A), в клітинах TF-1 антитілами миші і хом'яка проти TL1A. АТ №1 - 19E06; АТ №2 - 12D01; АТ №3 - 15E09; АТ №4 - 16H02; АТ №5 - 14A03; АТ №6 - 04H08A; АТ №7 - 12Fl l; АТ №8 12D08. На фіг. 2 показано вирівнювання домену VH антитіла миші 16H02 проти TL1A з найближчим геном зародковою лінією людини, IGHV7-4-1-02. Вирівнювання використали як шаблон для створення 2 різних версій гуманізованої VH 16H02, позначених на малюнку як New Hum 16H02 VH №1 і VH №2. На фіг. 3 показана кількість мутацій, що відрізняють VH миші від VH людини, і процент гуманізації двох версій VH гуманізованого антитіла проти TL1A. На фіг. 4 показано вирівнювання домену VК антитіла миші 16H02 проти TL1A з найближчим геном зародкової лінії людини, A17. Вирівнювання використали як шаблон для створення 2 різних версій гуманізованої VH 16H02, позначених на малюнку як New Hum 16H02 VК №1 і VК №2. На фіг. 5 показана кількість мутацій, що відрізняють VК миші від VК людини, і процент гуманізації двох версій VК гуманізованого антитіла 16H02 проти TL1A. На фіг. 6 показані результати тимчасової трансфекції клітин 293F з використанням VH №1 і VH №2 антитіла людини 16H02 проти TL1A і VК №1 і VК №2 антитіла людини 16H02 проти TL1A для одержання повнорозмірної молекули гуманізованого антитіла. На фіг. 7 показана активність моноклональних антитіл 16H02 проти TL1A після одного циклу гуманізації, виходячи з інгібування активності каспаз, індукованих з допомогою TL1A, в клітинах TF-1 гуманізованими антитілами в порівнянні з контрольними антитілами миші проти TL1A. 12D01 = негативний контроль для антитіла миші проти TL1A; 16H02 = позитивний контроль для антитіла миші проти TL1A; 19E06 = контрольне антитіло хом'яка проти TL1A; 3009 = гуманізоване антитіло 16H02 VH №1 + VК №1 проти TL1A; 3010 = гуманізоване антитіло VH №2 + VК №1 16H02 проти TL1A; 3011 = гуманізоване антитіло VH №1 + VК №2 16H02 проти TL1A; 3012 = гуманізоване антитіло VH №2 + VК №2 16H02 проти TL1A. На фіг. 8 показані остаточні мутації, які необхідні для повної гуманізації каркаса VК 16H02. Для створення повністю гуманізованого легкого ланцюга 16H02 New Hum 16H02 VК №2 (див. фіг. 4) початкову послідовність вирівнювали з послідовністю гена зародкової лінії A17 і ідентифікували 3 окремих області або блоку (зафарбовані кола) для подальшого мутагенезу. Конструювали синтетичні легкі ланцюги, які містили всі можливі поєднання або з немутованої послідовності дикого типу VК №2 (=W), або з послідовності гена зародкової лінії A17 (=M) в кожній з 3 областей або блоків. На фіг. 9 показана тимчасова трансфекція ID і LDC # для остаточних версій VК гуманізованого 16H02. Створювали синтетичні легкі ланцюги, які містили всі можливі поєднання або з послідовності дикого типу (W) або з мутантної послідовності (M) в 3 окремих областях або блоках в New Hum 16H02 VК №2 з фіг. 8. Потім проводили котрансфекцію синтетичними легкими ланцюгами і New Hum 16H02 VH №1 з фіг. 2 і одержані антитіла тестували на інгібування активності каспаз, індукованих з допомогою huTL1A. На фіг. 10 показане інгібування активності каспаз, індукованих з використанням TL1A людини (huTL1A), в клітинах TF-1 за допомогою набору різних гуманізованих антитіл проти TL1A з фіг. 9. Активність повністю гуманізованого антитіла 16H02 проти TL1A, позначеного як 3038, порівнювали з активністю початкового антитіла миші 16H02 проти TL1A. На фіг. 11 показано вирівнювання послідовностей домену VH п'яти ведучих кандидатних антитіл миші проти TL1A: 1B4, 25B9, 11D8, 27A8 і 38D6. На фіг. 12 показано вирівнювання послідовностей домену VК п'яти ведучих кандидатних антитіл миші проти TL1A: 1B4, 25B9, 11D8, 27A8 і 38D6. На фіг. 13 показано вирівнювання послідовностей гуманізованого домену VH 1B4 (hum 1B4 VH AA) з початковим доменом VH миші (1B4 VH AA) і найближчим співпадаючим доменом VH зародкової лінії людини (VH2-70-10). На фіг. 14 показано вирівнювання послідовностей гуманізованого домену VК 1B4 (hum 1B4 VК AA) з початковим доменом VК миші (1B4 VК AA) і найближчим співпадаючим доменом VК зародкової лінії людини (VК- L8). На фіг. 15 показане інгібування активності каспаз, індукованих з використанням TL1A, одержаних з ссавця, в клітинах TF-1 гуманізованими антитілами (1B4, 11D8, 25B9) проти TL1A в порівнянні з антитілом миші 11D8. ДОКЛАДНИЙ ОПИС ПЕРЕВАЖНИХ ВАРІАНТІВ ЗДІЙСНЕННЯ Визначення 7 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антитіло, як описано в цьому документі, стосується повнорозмірної (тобто що зустрічається в природі або одержаної звичайними рекомбінантними процесами з використанням фрагментів генів імуноглобулінів) молекули імуноглобуліну (наприклад, до антитіла IgG) або імунологічно активної (тобто що специфічно зв'язується) частини молекули імуноглобуліну, такої як фрагмент антитіла. Фрагмент антитіла являє собою частину антитіла, таку як F(ab')2, F(ab)2, Fab', Fab, Fv, scFv і т.п. Незалежно від структури, фрагмент антитіла зв'язується з тим же антигеном, який розпізнається інтактним антитілом. Термін «фрагмент антитіла» включає аптамери, шпігельмери і діатіла. Термін «фрагмент антитіла» також включає будь-які синтетичні або одержані способами генної інженерії білки, які поводяться як антитіло, зв'язуючись зі специфічним антигеном з утворенням комплексу. Наприклад, фрагменти антитіл включають виділені фрагменти, що складаються з варіабельних областей, таких як фрагменти «Fv», що складаються з варіабельних областей важкого і легкого ланцюга, рекомбінантні одноланцюжкові поліпептидні молекули, в яких варіабельні області легкого і важкого ланцюга з’єднані пептидним лінкером («білки scFv»), злиті поліпептиди Fab HSA, в яких VH-CH1 одержаний в злитому з HSA вигляді, який потім укладається з його родинними VК-CK легкого ланцюга гуманізованого антитіла людини з утворенням Fab, і мінімальні розпізнавальні одиниці, що складаються з амінокислотних залишків, які імітують гіперваріабельну область. Гуманізоване антитіло являє собою рекомбінантний білок, в якому CDR з антитіла від тварини одного виду, наприклад, з антитіла гризуна, переносять з варіабельних областей важкого і легкого ланцюга антитіла гризуна у варіабельні домени важкого і легкого ланцюга людини або варіабельні домени важкого і легкого ланцюга, які мутували таким чином, що вони містять, щонайменше, частину амінокислотної послідовності варіабельних доменів важкого і легкого ланцюга людини (що відображено в «проценті гуманізації»). Константні домени молекули антитіла можуть бути одержані з константних доменів антитіла людини. Як застосовують в цьому документі, «процент гуманізації» обчислюють по кількості амінокислот в каркасній області, що розрізнюються (тобто відмінності не в CDR) між гуманізованим доменом і доменом зародкової лінії, яку віднімають із загальної кількості амінокислот і потім ділять різницю на загальну кількість амінокислот, помножену на 100. Як застосовують в цьому документі, «CDR» означає «гіперваріабельну ділянку», яка присутня у варіабельному домені важкого ланцюга (VH) антитіла або у варіабельному домені легкого ланцюга антитіла (VL або VК). Кожний варіабельний домен містить по три CDR, серед них CDR, які присутні у варіабельному домені важкого ланцюга, позначаються як CDR-H1, CDR-H2 і CDR-H3, і CDR, які присутні у варіабельному домені легкого ланцюга, означаються як CDR-L1, CDR-L2 і CDR-L3. У цьому документі використовується система нумерації по Кабату. По суті, CDR-H1 починається приблизно з 31-ої амінокислоти (тобто приблизно через 9 залишків після першого залишку цистеїну), містить приблизно 5-7 амінокислот, і закінчується на наступному залишку триптофану. CDR-H2 починається з п'ятнадцятого залишку після кінця CDR-H1, містить приблизно 16-19 амінокислот, і закінчується на наступному залишку аргініну або лізину. CDR-H3 починається приблизно з тридцять третього амінокислотного залишку після кінця CDR-H2; містить 3-25 амінокислот; і закінчується на послідовності W-G-X-G, де X означає будь-яку амінокислоту. CDR-L1 починається приблизно з 24-го залишку (тобто після залишку цистеїну); містить приблизно 10-17 залишків; і закінчується на наступному залишку триптофану. CDR-L2 починається приблизно з шістнадцятого залишку після кінця CDR-L1 і містить приблизно 7 залишків. CDR-L3 починається приблизно з тридцять третього залишку після кінця CDR-L2 (тобто після залишку цистеїну); містить приблизно 7-11 залишків і закінчується на послідовності F або W-G-X-G, де X означає будь-яку амінокислоту. Кон’югування з терапевтичним або діагностичним засобом Антигензв’язувальні поліпептиди, що описуються в цьому документі, можна кон’югувати або злити з терапевтичним засобом, який може включати радіоактивні мітки, імуномодулятори, гормони, фотоактивні терапевтичні засоби, цитотоксичні засоби, які можуть являти собою лікарські засоби або токсини, і їх поєднання. Лікарські засоби можуть включати будь-які лікарські засоби, які володіють фармакологічними властивостями, вибраними з групи, що складається з антимітотичних, антикіназних, алкілуючих, антиметаболічних засобів, антибіотиків, алкалоїдів, антиангіогенних, апоптотичних засобів і їх поєднань. Більш конкретно, ці лікарські засоби вибрані з групи, що складається з азотистого іприту, похідних етиленіміну, алкілсульфонатів, нітрозосечовин, триазенів, аналогів фолієвої кислоти, інгібіторів ЦОГ-2, аналогів піримідину, аналогів пурину, антибіотиків, ферментів, епіподофілотоксинів, координаційних комплексів платини, алкалоїдів барвінку, заміщених сечовин, похідних метилгідразину, супресорів кори надниркових залоз, антагоністів, ендостатину, таксолів, 8 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 камптотецинів, антрациклінів, таксанів і їх аналогів, і їх поєднань. Токсини, включені в даний винахід, можуть бути вибрані з групи, що складається з рицину, арбіну, α-токсину, сапорину, рибонуклеази (РНКази), наприклад, онконази, ДНКази I, стафілококового ентеротоксину-А, антивірусного білка лаконосу, гелоніну, дифтерійного токсину, екзотоксину Pseudomonas і ендотоксину Pseudomonas. Імуномодулятори можуть бути вибрані з групи, що складається з цитокінів, факторів росту стовбурових клітин, лімфотоксину, гемопоетичного фактора, колонієстимулюючих факторів (CSF), інтерферонів (IFN), еритропоетину, тромбопоетину і їх поєднань. Особливо ефективні такі лімфотоксини, як фактор некрозу пухлини (TNF), гемопоетичні фактори, такі як інтерлейкіни (IL), колонієстимулюючі фактори, такі як гранулоцитарний колонієстимулюючий фактор (G-CSF) або гранулоцитарно-макрофагальний колонієстимулюючий фактор (GMCSF)), інтерферони, такі як інтерферони -α, -β або -γ, і фактори росту стовбурових клітин, наприклад, фактор, що позначається як «фактор S1». Більш конкретно, імуномодулятори можуть включати IL-1, IL-2, IL-3, IL-6, IL-10, IL-12, IL-18, IL-21, інтерферон-γ, TNF-α або їх поєднання. Антигенз’вязувальні поліпептиди, що описуються в цьому документі, можуть бути кон’юговані або злиті з діагностичним засобом. Діагностичні засоби можуть включати фотоактивні діагностичні засоби або радіоактивні мітки, які володіють енергією між 60 і 4000 кеВ, або нерадіоактивні мітки. Радіоактивні мітки переважно являють собою γ-, β- і позитрон 125 131 123 124 86 186 188 62 випускаючі ізотопи, вибрані з групи, що складається з I, I, I, I, Y, Re, Re, Cu, 64 111 6768 99m 94m 18 11 13 15 76 Cu, In, Ga, Ga, Tc, Tc, F, C, N, O, Br і їх поєднань. Діагностичні засоби можуть включати контрастні засоби, наприклад, такі як марганець, залізо або гадоліній. Типові способи одержання антитіл проти TL1A з використанням гібридомної технології Мишей BALB/с можна імунізувати рекомбінантним білком TL1A (позаклітинний домен). У типовій процедурі 10 мг білка в 50 мл повного ад’юванта Фрейнда (Sigma) вводять підшкірно. Через 2-тижневі інтервали можна вводити від двох до чотирьох додаткових ін'єкцій в неповному ад’юванті Фрейнда, за якими йде кінцева імунізація антигеном в PBS. Альтернативно, ін'єкції можна вводити в подушечку стопи. Через три дні мишей забивають, видаляють селезінки або підколінні лімфатичні вузли, а лімфоцити можна виділяти для злиття. Лімфоцити можна зливати з клітинами плазмоцитоми P3X63Ag8.653 в співвідношенні 5:1 з використанням PEG/DMSO (Sigma) як засобу для злиття. Після злиття клітини можна ресуспендувати в 6 селективному середовищі HAT і висіяти по 10 клітин на ямку в 96-ямкові планшети. Використовуючи супернатанти від гібридом, які вижили при відборі в HAT, можна провести скринінг в прямому ELISA на присутність антитіл, що зв'язуються з TL1A. Можна ідентифікувати гібридоми, які секретують антитіла, що зв'язуються з TL1A, і можна провести додатковий скринінг з супернатантів на антитіла, що інгібують зв’язування TL1A з його рецептором DR3, за допомогою інгібування зв’язування в ELISA. Потім гібридоми, для яких підтверджене інгібування зв’язування TL1A, можна використати в скринінгу на інгібування активності каспаз, індукованих з використанням TL1A, в клітинах TF-1, щоб ідентифікувати клони, які продукують антагоністи TL1A. Типова стратегія гуманізації антитіла Однією із задач гуманізації антитіл проти TL1A є одержання доменів VH і VК, які гуманізовані на 70-100% і зберігають початкову афінність і специфічність зв’язування на 90100%. Сайт-специфічний мутагенез окремих положень з високим ризиком в VH і VК можна використати для подальшої гуманізації антитіл при збереженні афінності і специфічності зв’язування. Гуманізацію можна здійснювати за допомогою перенесення CDR і структурного аналізу і відтворення поверхні варіабельної області. (див. Jones et ah, NATURE (1986) May 29-Jun. 4;321(6069):522-5; Roguska et al, PROTEIN ENGINEERING, 1996, 9(10):895-904; і Studnicka et ah, Humanizing Mouse Antibody Frameworks While Preserving 3-D Structure. PROTEIN ENGINEERING, 1994, Vol.7, стор. 805). Дані про початкову послідовність антитіла і тривимірну структуру можна використати для того, щоб ідентифікувати ключові каркасні залишки, які необхідні для збереження афінності і специфічності зв’язування. Веб-сайт «Blast for Ig sequences», що підтримується NCBI, можна використати для того, щоб ідентифікувати найближчі збіги з областями VH і VК миші, використаними в дослідженні. Гени VH і VК зародкової лінії людини можна вибрати як гени, що найкраще співпадають з послідовностями VH і VК миші. Альтернативно, послідовності з природно експресованого репертуару антитіл людини можна використати як шаблон для гуманізації нарізно або в поєднанні з найближчим співпадаючим геном зародкової лінії людини. Після вирівнювання VH і VК антитіла миші проти TL1A з найближчими генами зародкової 9 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 лінії людини або з генами з експресованого репертуару можна оцінити вірогідний вплив кожного амінокислотного положення на зв’язування і імуногенність. Цю інформацію можна використати для того, щоб визначити низьку, помірну або високу міру ризику для мутації в кожному положенні. В одному з варіантів здійснення мутацій зазнають тільки положення з низьким або помірним ризиком, і при цьому уникають положень з високим ризиком. При необхідності, можна використати спосіб дозрівання афінності за допомогою вбудовування тирозинів попарно в кожне положення в CDR VH, VK або обох. Типове клонування і секвенування доменів VH і VК антитіла миші проти TL1A з гібридомних клітинних ліній Гібридомні клітини можна осадити, промити три рази в PBS і виділити РНК з допомогою тризолу (Invitrogen, номер по каталогу 15596-026), додержуючись протоколу виробника. З загальної РНК можна одержати кДНК з використанням набору 5' RACE (Rapid Amplification of cDNA Ends, Invitrogen, номер по каталогу 18374-058), додержуючись протоколу виробника. У короткому викладі РНК можна лігувати з випадковим гексамерним праймером, Random N6, а одноланцюжкову кДНК можна одержати з використанням негативної РНК-залежної ДНКполімерази Superscript II RNAase кДНК з dC на хвості можна ампліфікувати в ПЛР з використанням якірного праймера зі специфічністю до dC-хвоста і праймерів зі специфічністю до генів, які гібридизуються з висококонсервативними послідовностями ДНК в константному домені 1 важкого ланцюга миші (CH1) для одержання VH і в константному домене κ (Cκ) для одержання VК. Одержаний продукт ПЛР можна аналізувати електрофорезом в гелі, щоб підтвердити відповідність розмірів продуктів розмірам інтактних доменів VH або VК, потім очистити і лігувати у вектор TOPO TA (Invitrogen, номер по каталогу K4575-01), додержуючись протоколу виробника. Після трансформації в бактерії ДНК можна одержати з клонів, що містять вставку правильного розміру, а послідовність ДНК можна визначити з використанням реакційної суміші для секвенування Big Dye Terminator (Applied Biosystems, номер по каталогу 4336699) і ДНК-аналізатора 3700 ABI/Prism, додержуючись протоколу виробника. Типова гуманізація антитіл миші проти TL1A Антитіла миші проти TL1A можна ідентифікувати на основі даних про зв’язування і дані про послідовність, одержаних, як описано вище. Амінокислотну послідовність доменів VH і VК цих антитіл можна вирівняти з доменами VH і VК зародкової лінії людини з використанням доступних на сьогоднішній день публічних баз даних (тобто «Blast for IgG» в NCBI і «V-base» в MRC). У тих положеннях, в яких каркас послідовності миші відрізняється від зародкової лінії людини, можна використати ітеративний процес для того, щоб перетворити або мутувати каркас миші так, щоб він співпадав з відповідним каркасом зародкової лінії людини. Крім того, або альтернативно, певні амінокислотні залишки в CDR VH і VК можна мутувати за допомогою заміни на тирозин (тобто зробити афінно зрілими), щоб з деякою імовірністю компенсувати будь-яке зниження афінності, викликане змінами каркасних залишків. Афінно-зрілі і гуманізовані домени VH і VК миші можна створити за допомогою полімеразної ланцюгової реакції з використанням набору синтетичних олігонуклеотидних ДНК, що перекриваються. Як частину процесу конструювання синтетичного гена можна використати спосіб оптимізації кодонів, іншими словами, у всі амінокислотні позиції можна вбудувати кодони, які переважно використовуються клітинами ссавців для експресії генів. Синтетичні домени VH і VК можна клонувати в спеціалізовані вектори для експресії в ссавцях, які роблять можливою експресію відповідних доменів у випадку повністю гуманізованого кістяка антитіла IgG1, G4 або κ. Дрібномасштабне одержання гуманізованих антитіл можна здійснити за допомогою котрансфекції клітин 293F конструкцією IgG1 або IgG4 спільно з κ-конструкцією з використанням Lipofectamine (Invitrogen), додержуючись протоколу виробника. Супернатанти від тимчасово трансфікованих клітин можна пропустити через смолу з білком А або з білком G, і IgG можна очистити до гомогенності для тестування в клітинних тестах. Наступні приклади приведені для того, щоб проілюструвати даний винахід. Однак потрібно розуміти, що винахід не обмежується конкретними умовами або деталями, описаними в цих прикладах. Всі опубліковані і/або загальнодоступні документи, що описуються в цьому документі, в повному об'ємі включені за допомогою посилання. Приклад 1 Раніше продемонстроване одержання амінокислотних послідовностей доменів VH і VК моноклональних антитіл миші і хом'яка проти TL1A, як описано в цьому документі. Області CDR варіабельних доменів підкреслені. 12D08 VK: DVLMTQTPLS LPVSLGDQAS ISCRSSQSIV HSNGNTYLDW YLQKPGQSPN LLIYKVSNRF SGVPDRFSGS GSGTDFTLKI SRVEAEDLGV YYCFQGSHVP LTFGAGTKLE LKR 10 UA 104132 C2 5 10 15 20 25 30 35 40 45 50 55 60 16H02 VK: DVLMTQTPLS LPVSLGDQAS ISCKSSQNIV HSDGNTYLEW YLQKPGQSPK LLIYKVSNRF SGVPDRFSGS GSGTDFTLKI SRVEAEDLGV YYCFQGSHVP LTFGSGTKLE IKR 15E09 VK: ETTVTQSPAS LSMAIGEKVT IRCITSTDID DDMNWYQQKP GEPPKLLISE GNTLRPGVPS RFSSSGYGTD FVFTIENMLS EDVADYYCLQ SDNLPLTFGA GTKLELKR 19E06 VK: DIVMTQSPSS LAVSTGGTVT LTCLSSQSLF SSDTNKNYLN WYLQKPGQSP KLLVYHASTR LTGVPDRFIG SGSGTDFTLT INSVQAEDLG DYYCQQHFRP PFTFGRGTKL EIKR IB4 VK AA QIVLTQSPAIMSASLGAEITLTCSASSSVNYMHWYQQRSGTSPKLLIYSTSNLASGVPSRFSGSGS GTFYSLTISSVEAEDAADYYCHQWNNYGTFGGGTKLEIKR 25В9 VK AА ENVLTQSPAILAASLGQKVTMTCSASSSVSSGYLHWYQQKSGASPKPLIHRTSNLASGVPPRFSG SGSGTSYSLSISSVEAEDDATYYCQQWSGFPFTFGSGTKLEIKR 27A8 VK AA DIVLTQSPASLTVSLGQRATISCRASQNVSTSSYSHMHWSQQKPGQPPKLLIKYASNLDSGVPAR FSGSGSGTDFTLNIHPVEEEDIATYYCQHSWEIPYTFGGGTKLEIKR 11D8 VK AA DIVMTQSPASLTVSLGQRATISCRASQSVSTSSYSHMHWYQQKPGQPPKLLIRYASNLESGVPAR FSGSGSGTDFTLNIHPVEEEDTAIYYCQHSWELPYTFGGGTKLEIKR 38D6 VK AA DIVLTQFPASLPVSLGQRATISCRASQSVSTSSYSHMHWYQQKPGQPPKLLITYASNLDSGVPARI SGSGSGTDFTLNIHPVEEEDTATYYCHHSWELPYTFGGGTKLEIKR 12D08 VH: QIQLVQSGPE LKKPGETVKI SCKASGYTFT NYGMNWVKQA PGKGLKWMGW INTYTGEPTY ADDFKGRFAF SLETSASTAY LQINNLKNED MATYFCAKDY GKYGDYYAMD YWGQGTSVTV SS 16H02 VH: QIQLVQSGPE LKKPGETVKI SCKASGYTFT LYGMNWVKQA PGKGLKWMGW INTYTGEPTY ADDFKGRFAF SLETSASTAY LQINTLKNED MATYFCARDT AMDYAMAYWG QGTSVTVSS 15E09 VH: EVKLVDSGGG LVQPGDSLRL SCATSGFTFS DFYMEWVRQP PGKRLEWIAA SGNKANDYTT EYSASVKGRF IVSRDTSQSI LYLQMNDLRA EDTAIYYCVR DAGYGYWYFD VWGAGTTVTV SS 19E06 VH: QIQLQESGPS LVKPSQSLSL TCSVTGYSIT SDSYWNWIRQ FPGKNLVWMG YISYRGSTNY NPSLKSRISI TRDTSRNQFF LQLNSVTTED TATYYCARYS GYSFWYFDFW GQGTQVTVSS 1B4 VH a. QVTLKESGPGILQPSQTLSLTCSFSGFSLTTSNMGVVWIRQPSGKGLEWLLHILWDDREYSNPALKS RLTISKDPFNNQVFLKIANVDTADTATYYCARMSRNYYGSSYVMDYWGQGTSVTVSS 25B9 VH EVQLQQSGPELVKPGASVKMSCKASGYTFTSYVMHWVKQKTGQGLEWIGYINSNNDGTKYNEK FKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCATGDYYGGTSYWYFDVWGAGTTVTVSS 11D8 VH EVQLQQSGPELEKPGASVKISCKASGYSFTGYNMNWVKQSNGKSLEWIGNIDPYFGDTNYNQNF KGRATLTVDKSSNTAYMQLMSLTSEDSAVYYCAREGAARAKNYFDYWGQGTTLTVSS 27A8 VH EVQLQQSGPELETPGASVKISCKASGYSFTGYNMNWVKQTNGKSLEWIGNIDPYFGDANYNRKF KGKATLTVDKSSSTAYMQLRSLTSEDSAVYYCAKEGAARAKNYFDYWGQGTTLTVSS 38D6 VH AA EVQLQQSGPELEKPGASVKISCKASGYSFTGYNMNWVRQTNGKSLEWIGHIDPYYGDATYRQKF KGKATLTVDKSSNTAYMQLKSLTSEDSAVYFCAREGAARARNYFDYWGQGTTLTVSS Приклад 2 У цьому прикладі описаний протокол тесту для вимірювання інгібування активності каспаз, індукованих з використанням TL1A, в клітинах TF-1. Для визначення нейтралізуючої активності антитіл проти TL1A визначали їх вплив на активність каспаз, індукованих з використанням TL1A, в клітинах TF-1. Див. фіг. 1. Клітини TF-1 висівали по 75000 клітин на ямку в чорний 96-ямковий планшет з прозорим дном в середовище RPMI, що містить 1% ембріональної телячої сироватки. Клітини обробляли 10 мкг/мл циклогексамідом і 100 нг/мл TL1A в присутності або за відсутності різних концентрацій 11 UA 104132 C2 5 10 батьківських антитіл миші або хом'яка проти TL1A протягом 6 годин при 37°С. Активність каспаз вимірювали з допомогою Apo-One Homogeneous Caspase-3/7 Assay Kit (Promega). У кожну ямку з клітинами додавали рівні об'єми буфера Apo-One Homogeneous Caspase-3/7 Assay, що містить субстрат каспаз Z-DEVD-Rhodamine. Після інкубування протягом ночі вимірювали флуоресценцію у флуоресцентному рідері планшетів Wallac Victor2 з фільтром для збудливого світла 485 нм і фільтром для світла, що випускається 535 нм. Результати, приведені на фіг. 1, показують, що рівень флуоресценції, який корелює з активністю каспаз, знижується при збільшенні концентрації чотирьох (4) різних антитіл проти TL1A: АТ №1 - 19E06, АТ №3 - 15E09, АТ №4 - 16H02 і АТ №8 - 12D08. Фахівцям в даній галузі буде зрозуміло, що різні модифікації і зміни можна виконувати в способах і композиціях за даним винаходом без відхилення від суті або об'єму винаходу. Таким чином, мається на увазі, що даний винахід покриває модифікації і зміни за даним винаходом, передбачені об'ємом прикладених пунктів формули винаходу і їх еквівалентами. 12 UA 104132 C2 13 UA 104132 C2 14 UA 104132 C2 15 UA 104132 C2 16 UA 104132 C2 17 UA 104132 C2 18 UA 104132 C2 19 UA 104132 C2 20 UA 104132 C2 21 UA 104132 C2 22 UA 104132 C2 23 UA 104132 C2 24 UA 104132 C2 25 UA 104132 C2 26 UA 104132 C2 27 UA 104132 C2 28
ДивитисяДодаткова інформація
Автори російськоюSmith, Rodger, Kanakaraj, Palanisamy, Roschke, Viktor, Rosen, Craig, Cooksey, Bridget, A.
МПК / Мітки
МПК: A61P 29/00, C07K 16/28, A61P 35/00, A61P 37/06, A61K 39/395
Мітки: антитіла, гуманізовані
Код посилання
<a href="https://ua.patents.su/71-104132-gumanizovani-antitila-proti-tl1a.html" target="_blank" rel="follow" title="База патентів України">Гуманізовані антитіла проти tl1a</a>
Попередній патент: Модифікована ліпідом дволанцюжкова phk, яка має сильний ефект рнк-інтерференції
Наступний патент: Прозорий безводний гель, який містить ароматизатор
Випадковий патент: Дисмембратор