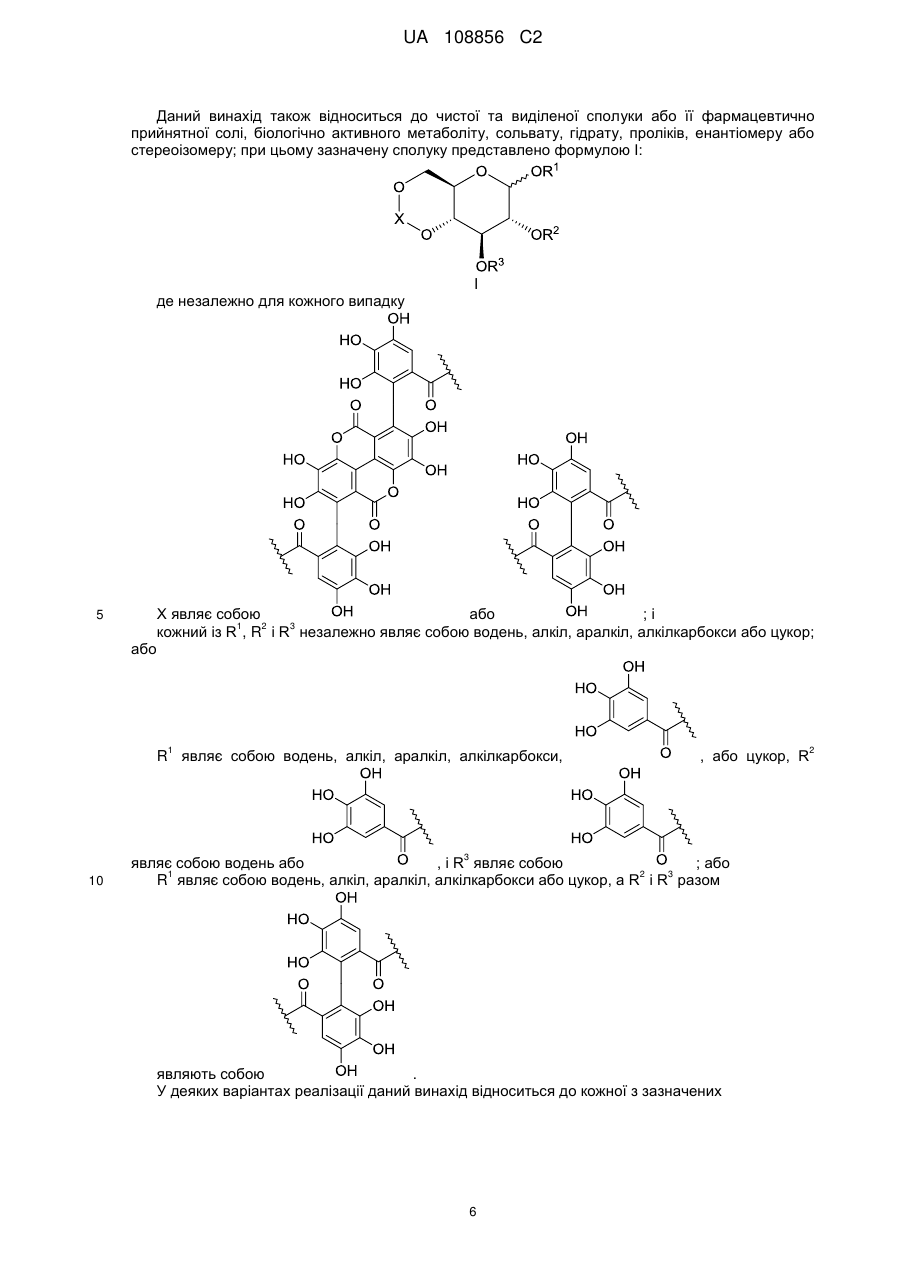
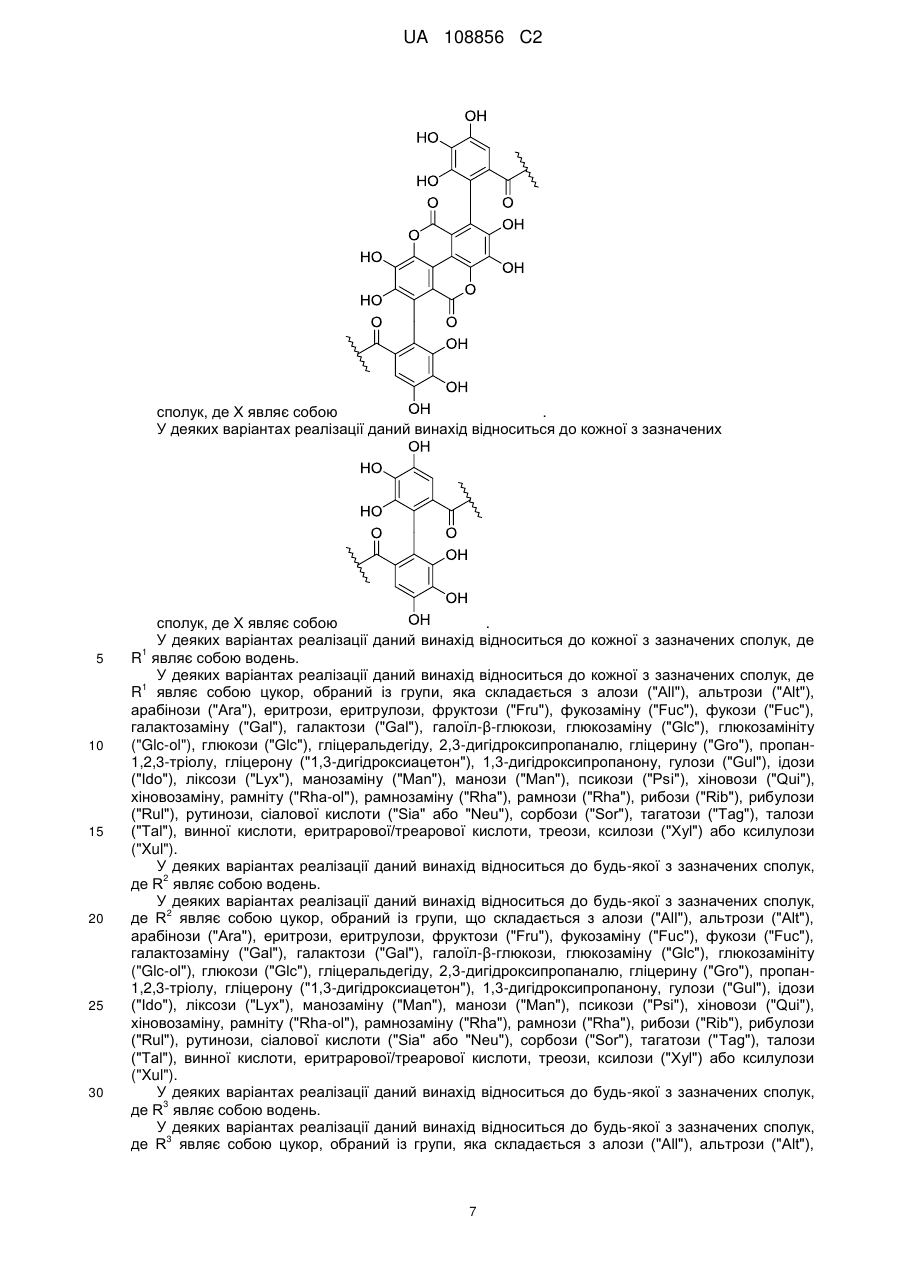
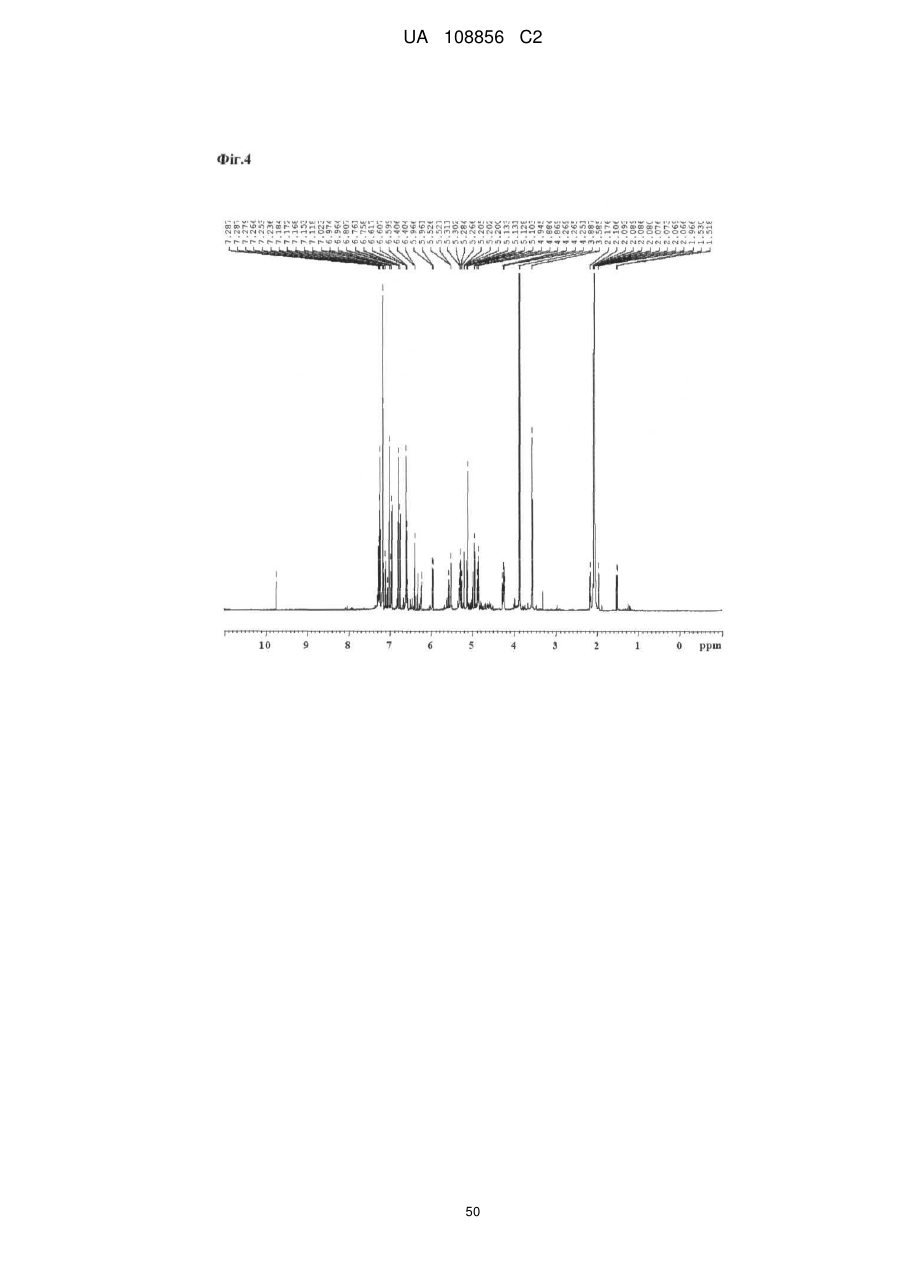
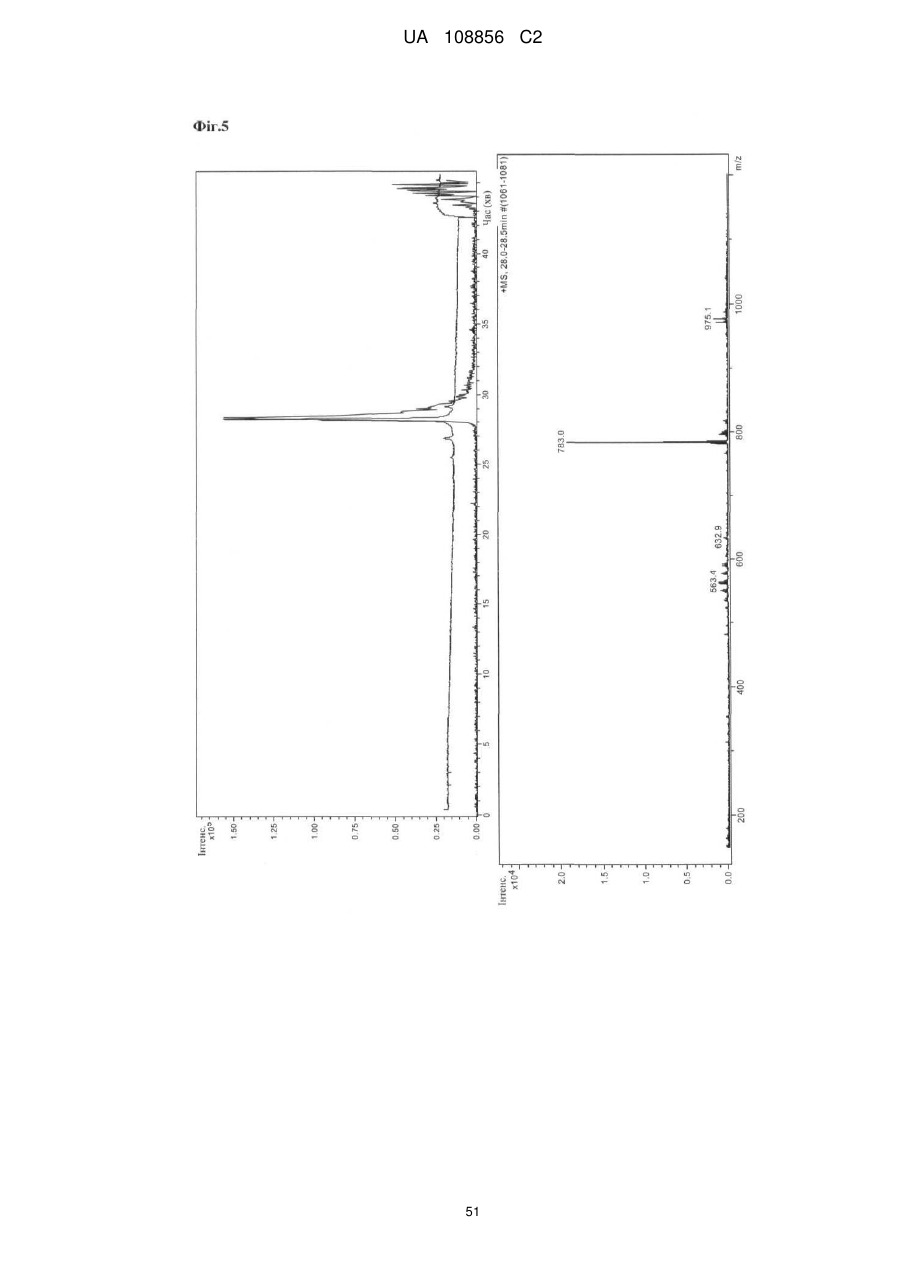
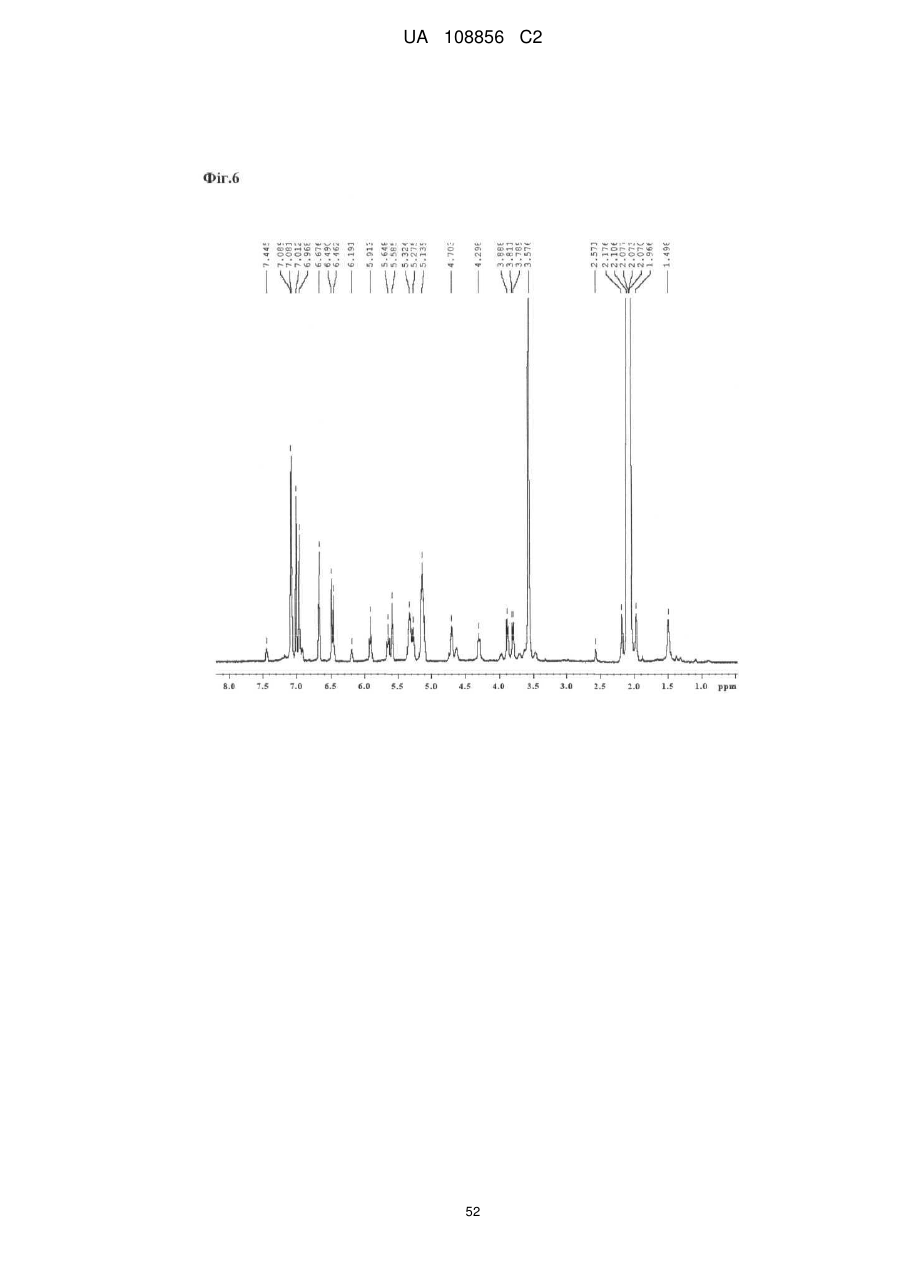
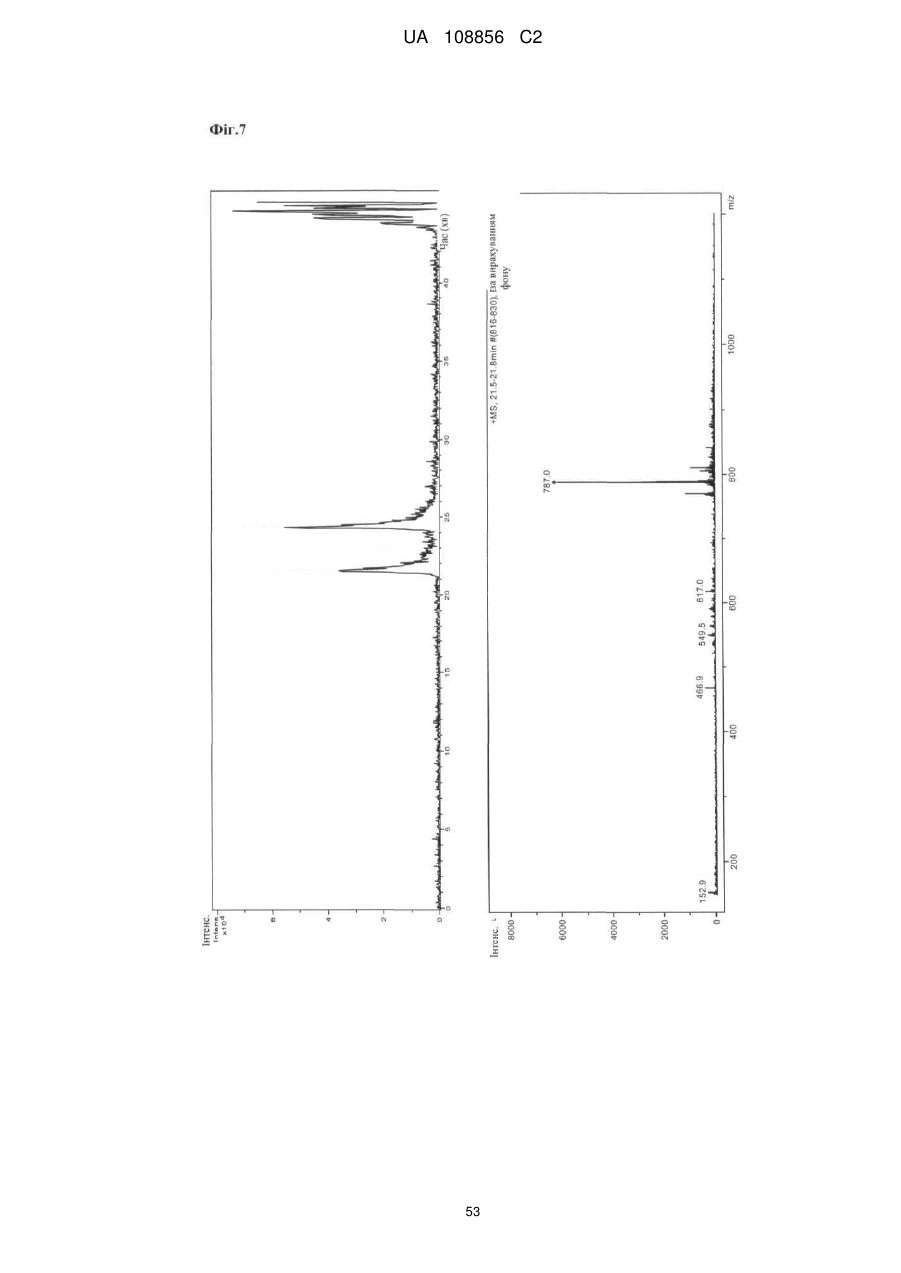
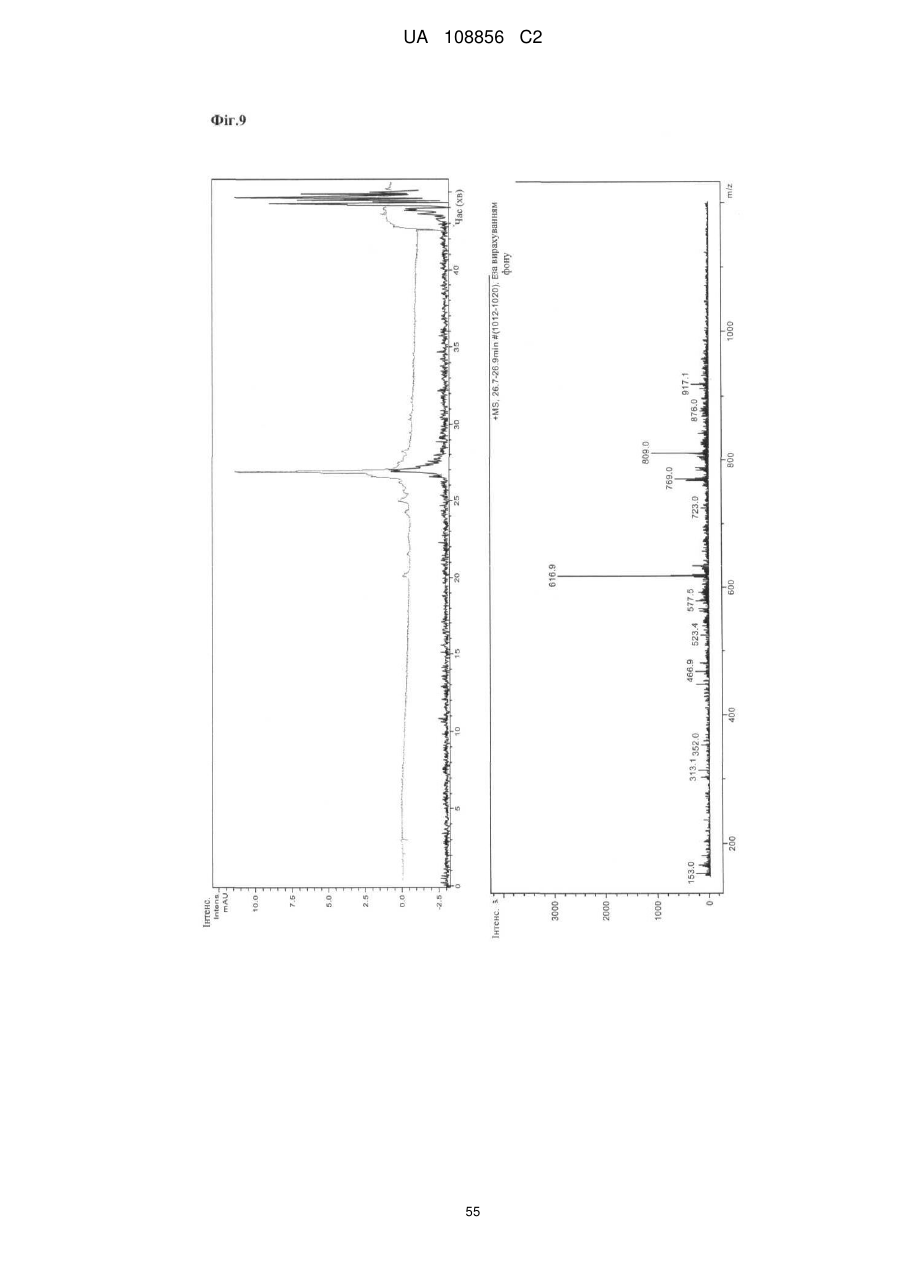
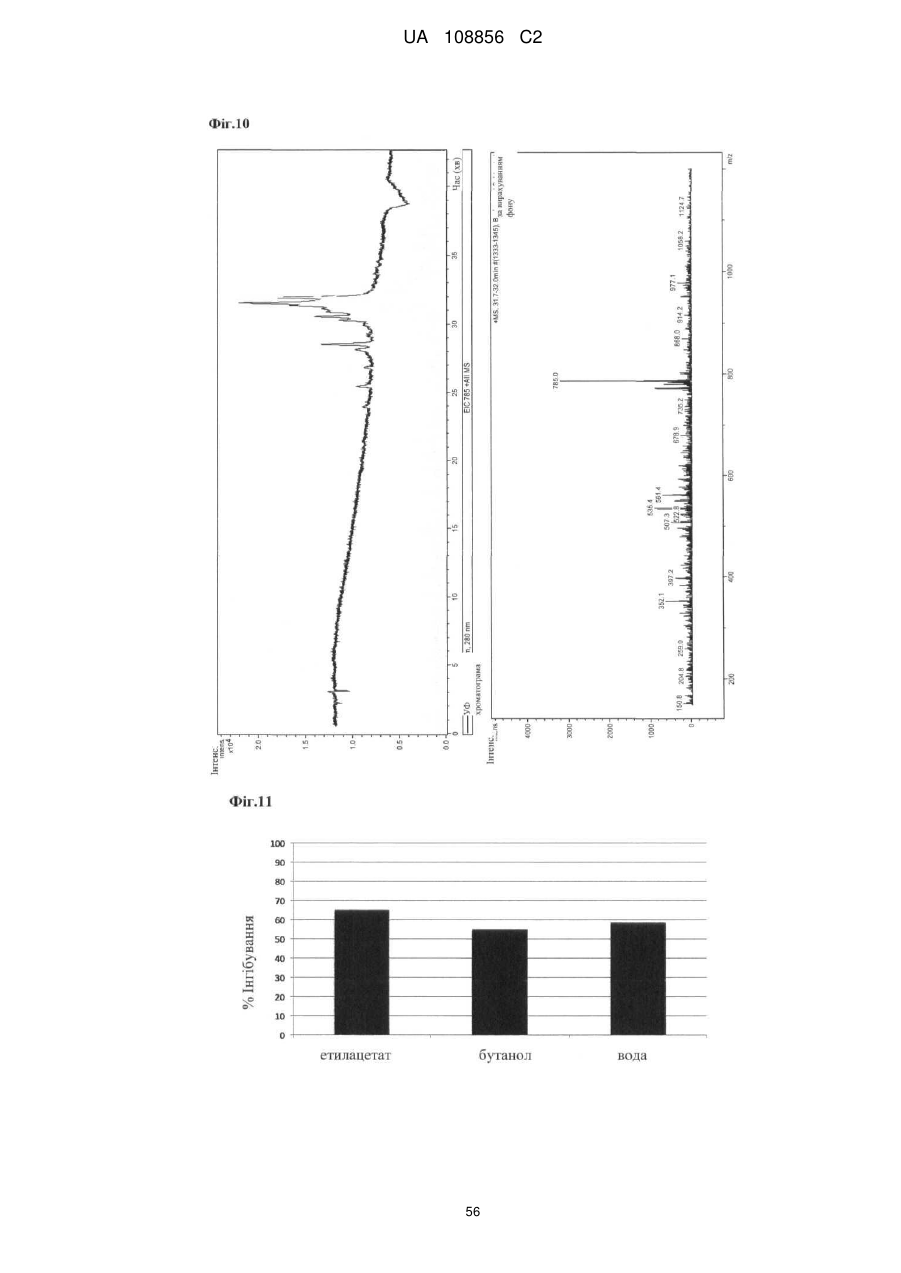
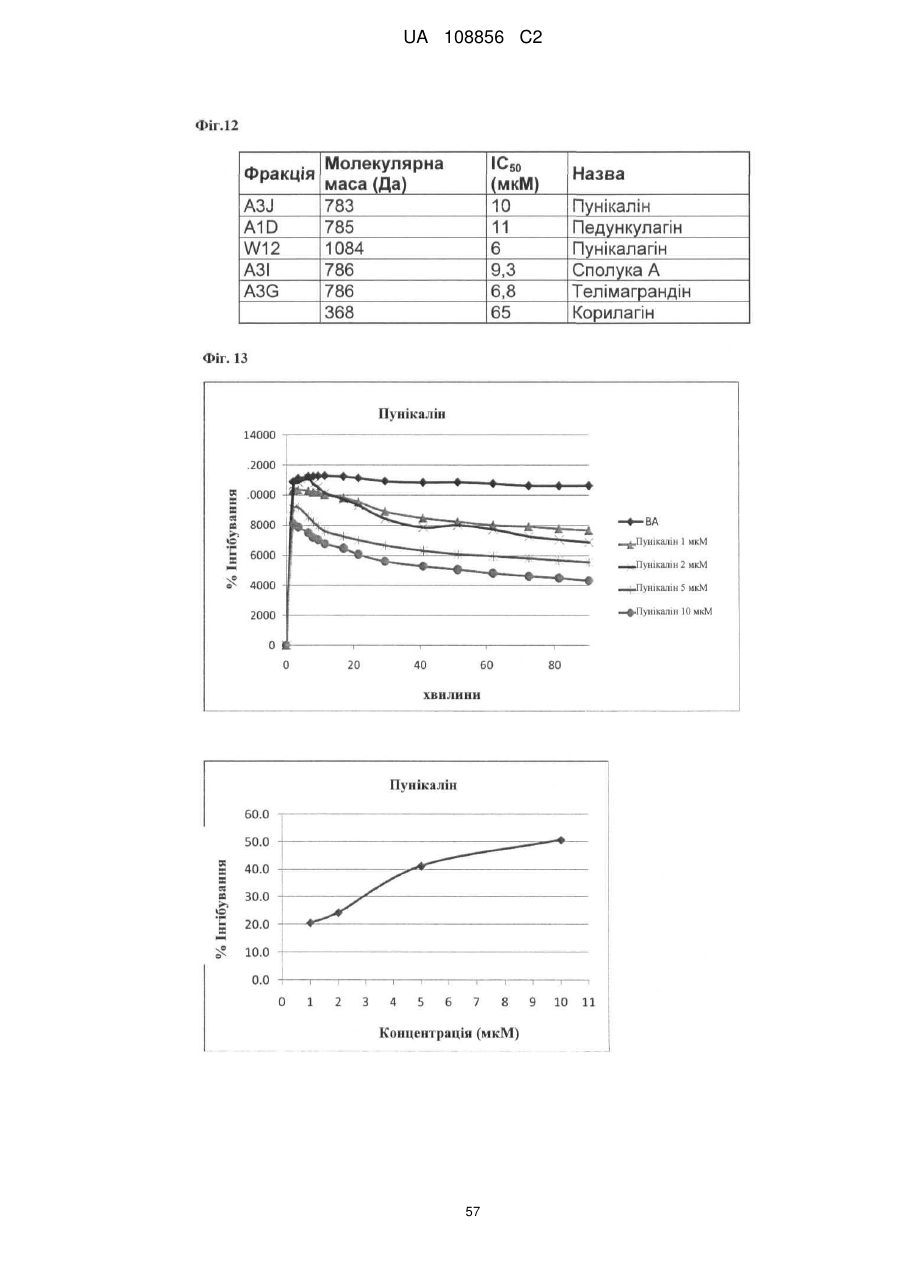
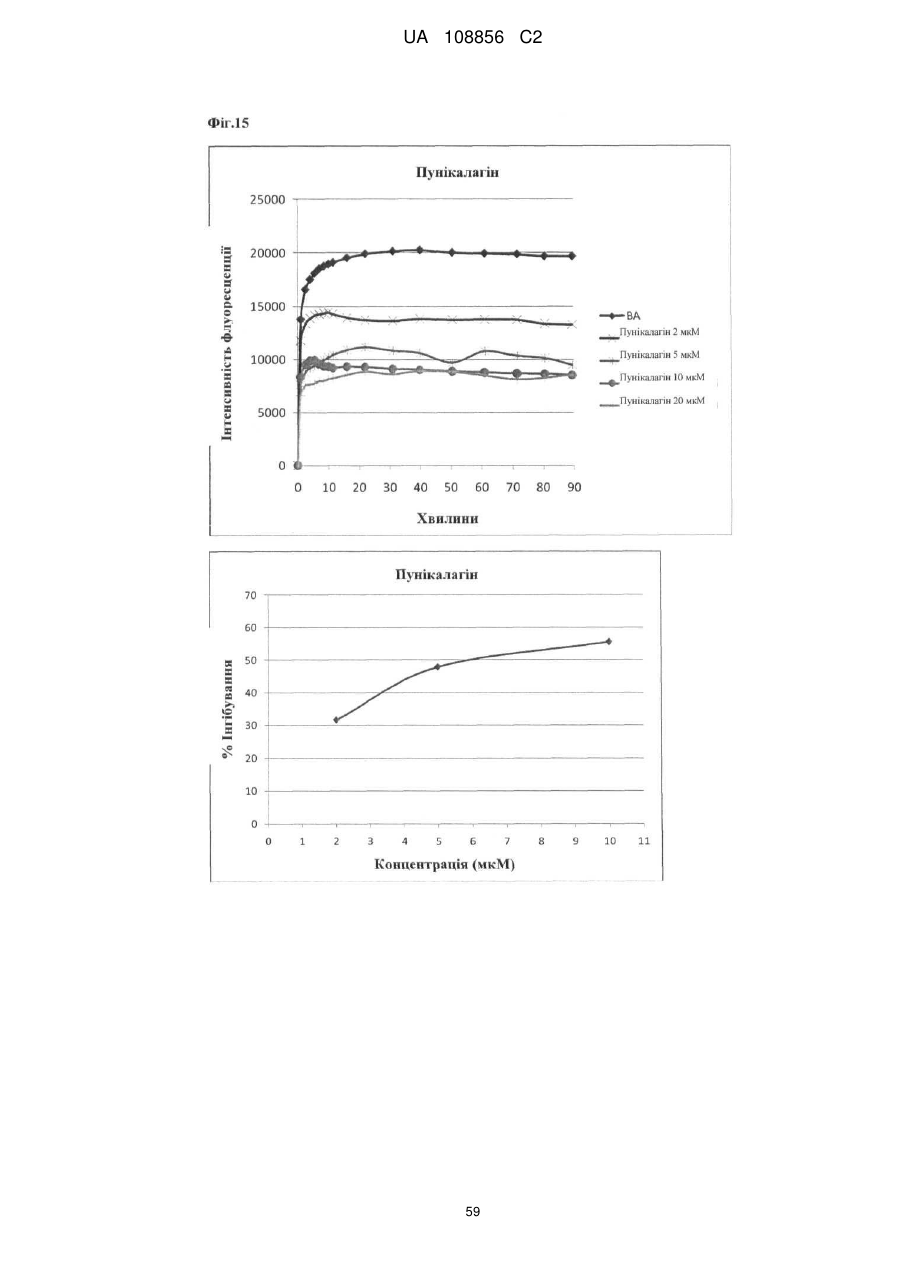
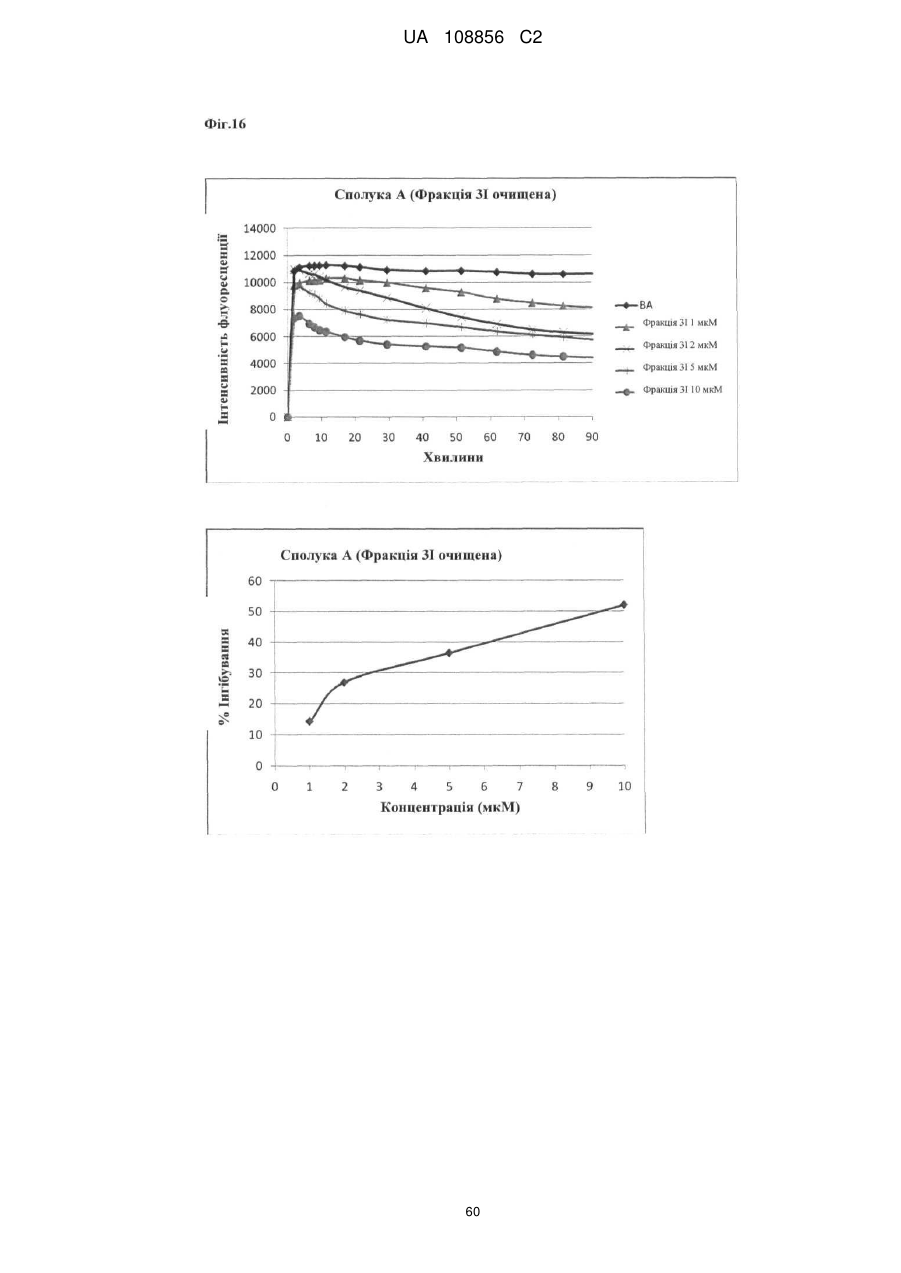
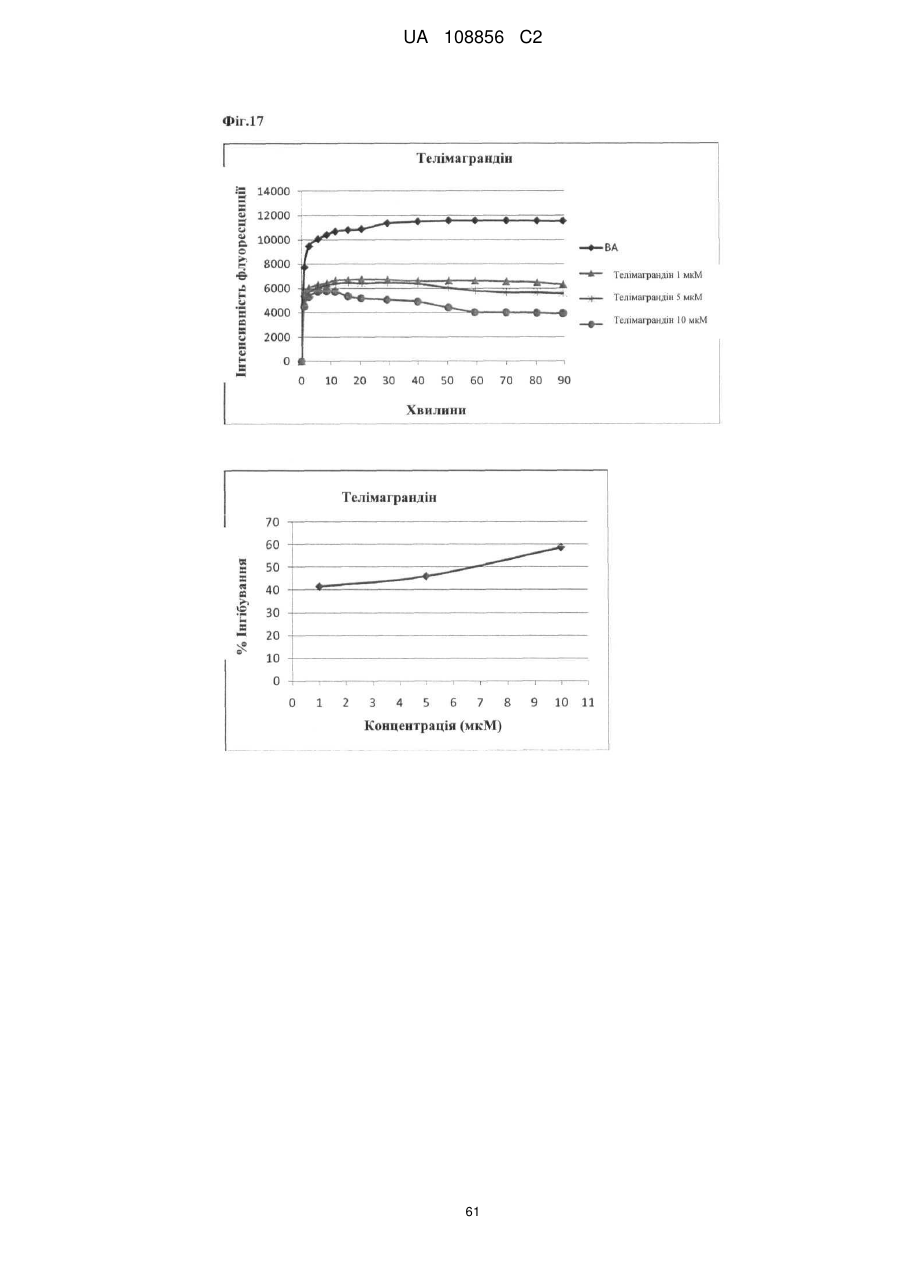
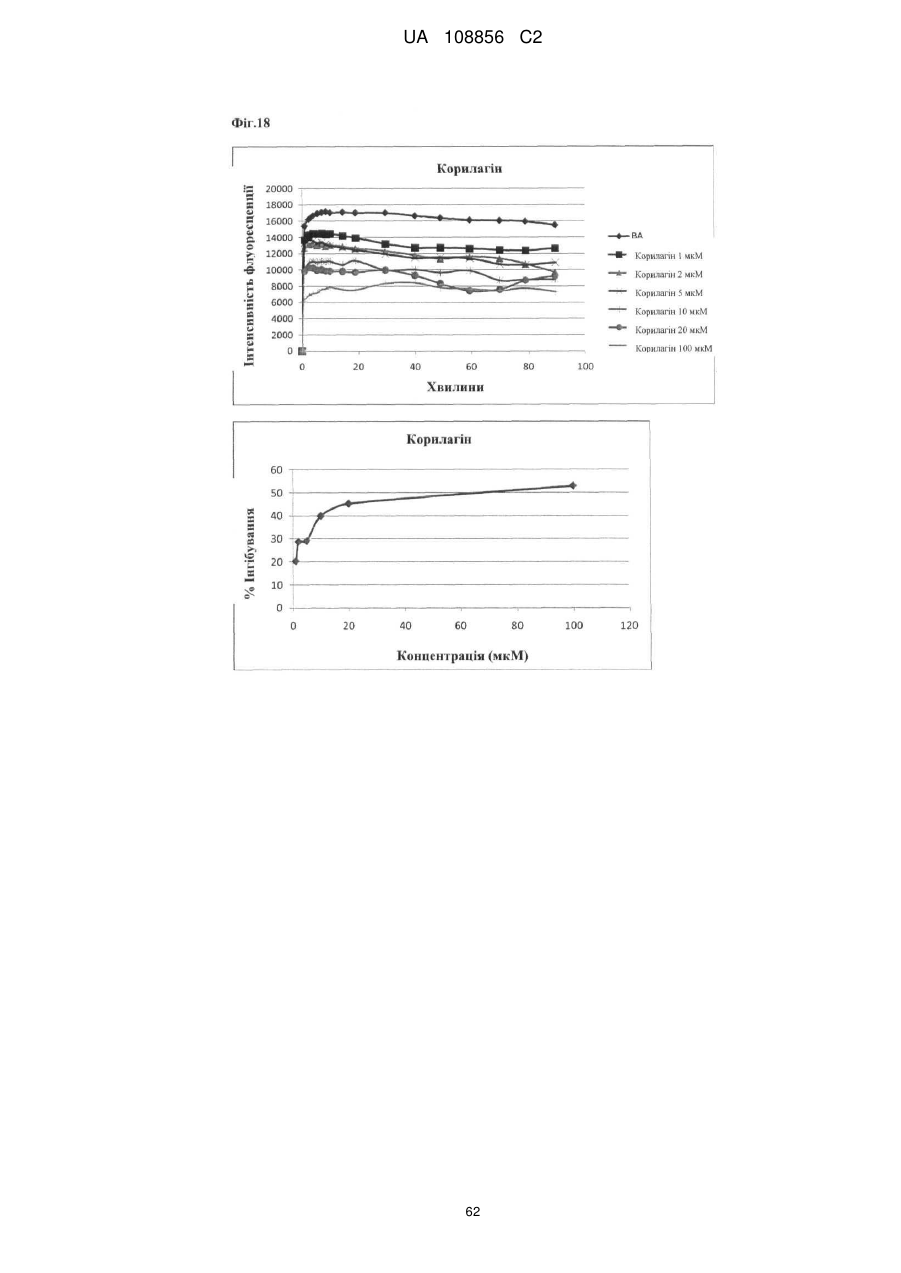
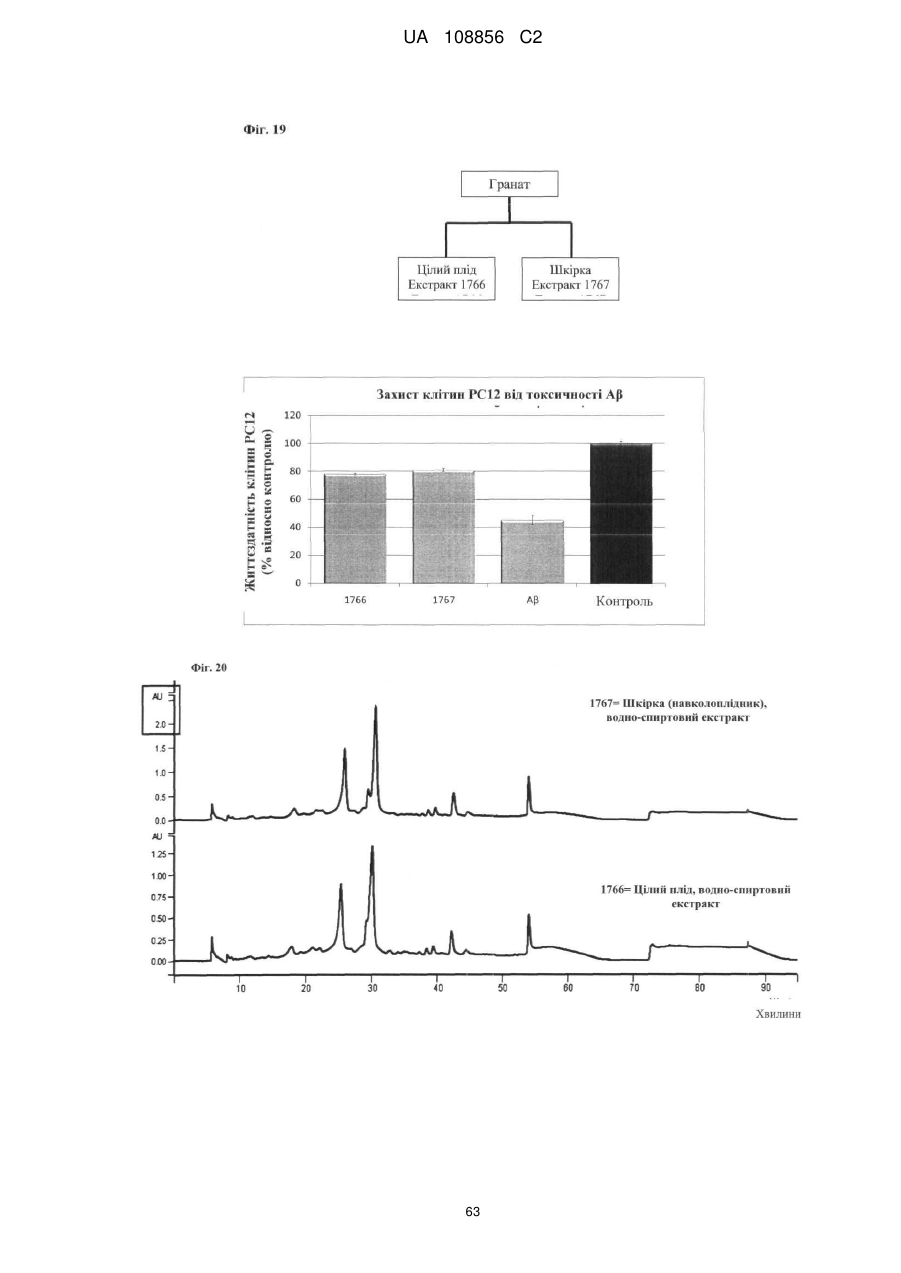
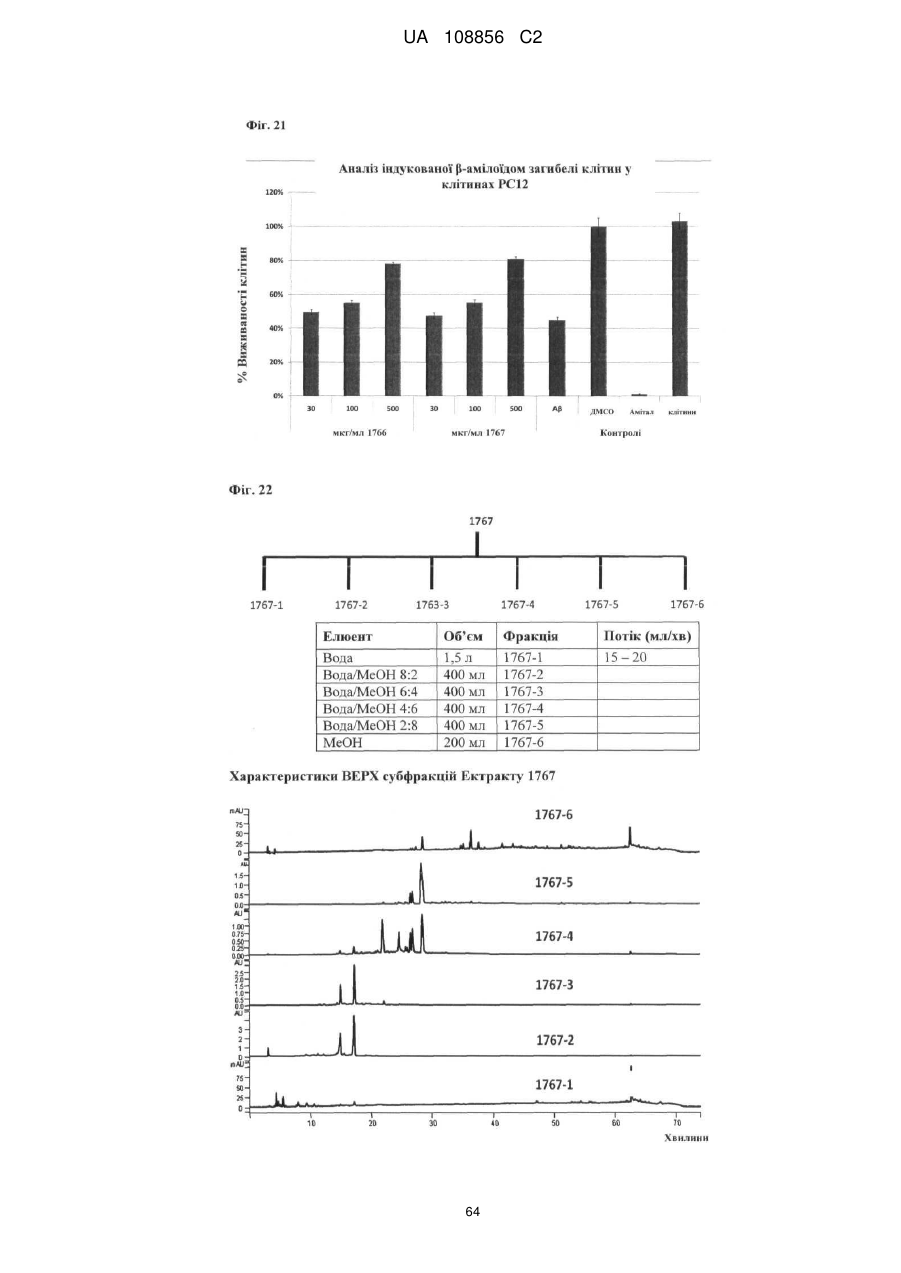
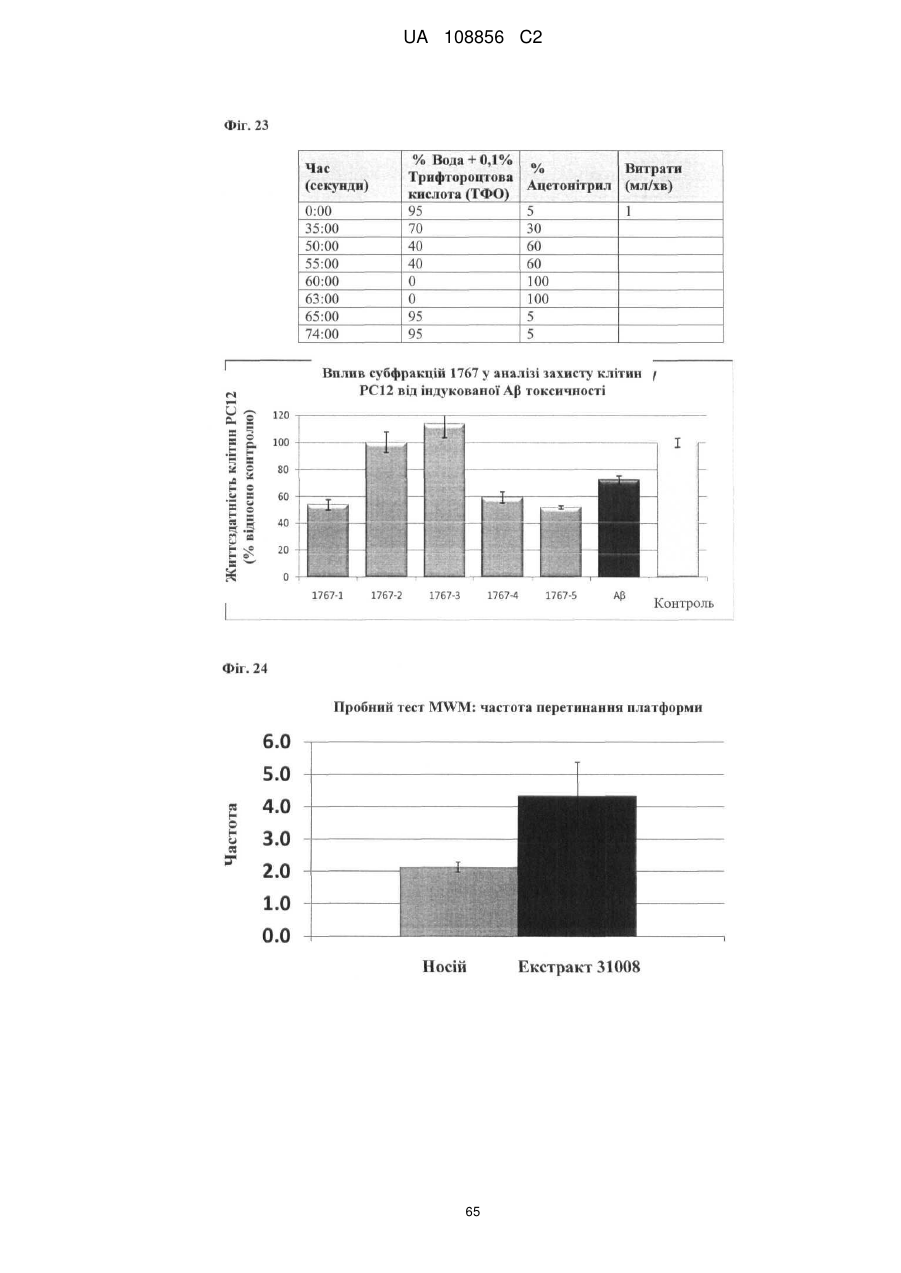
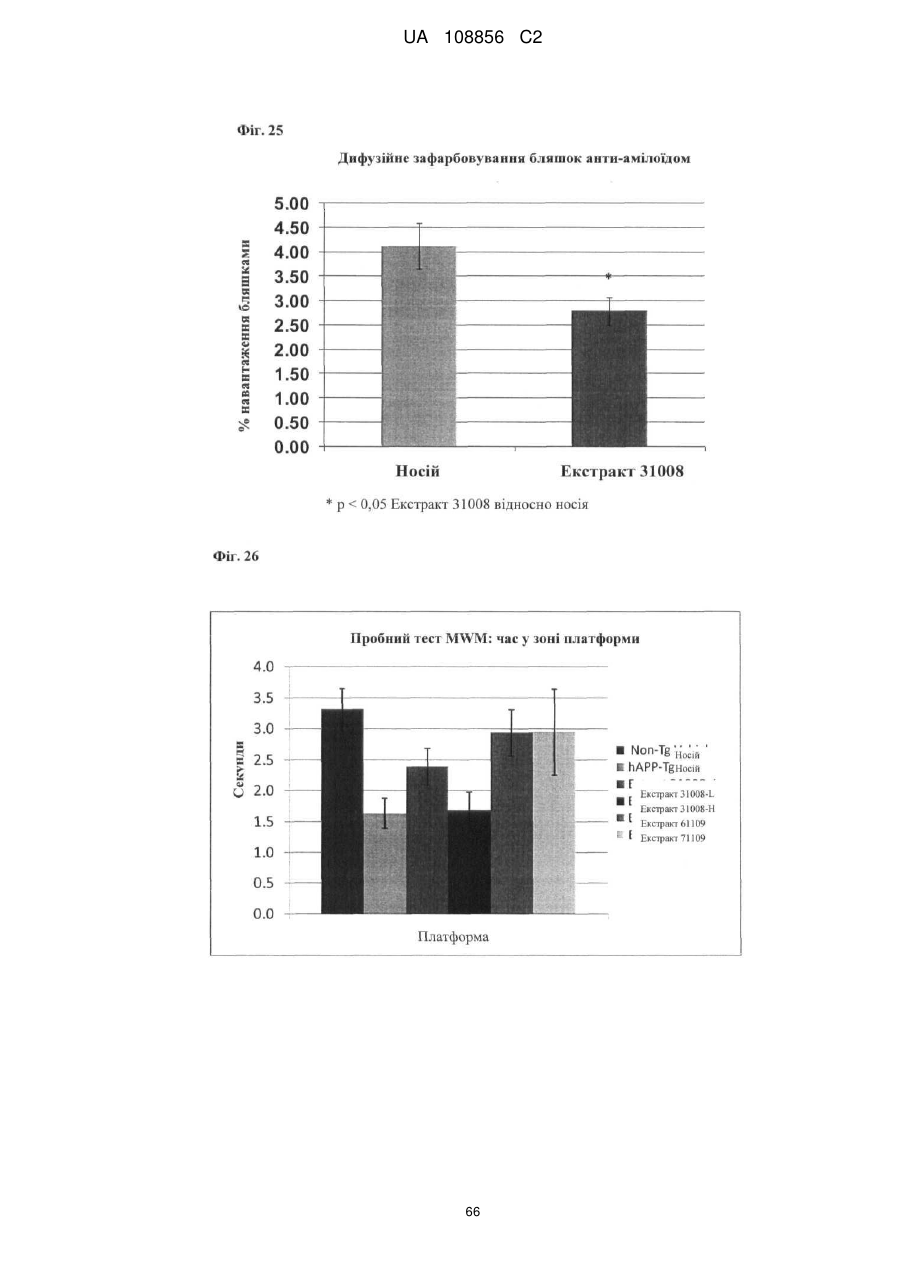
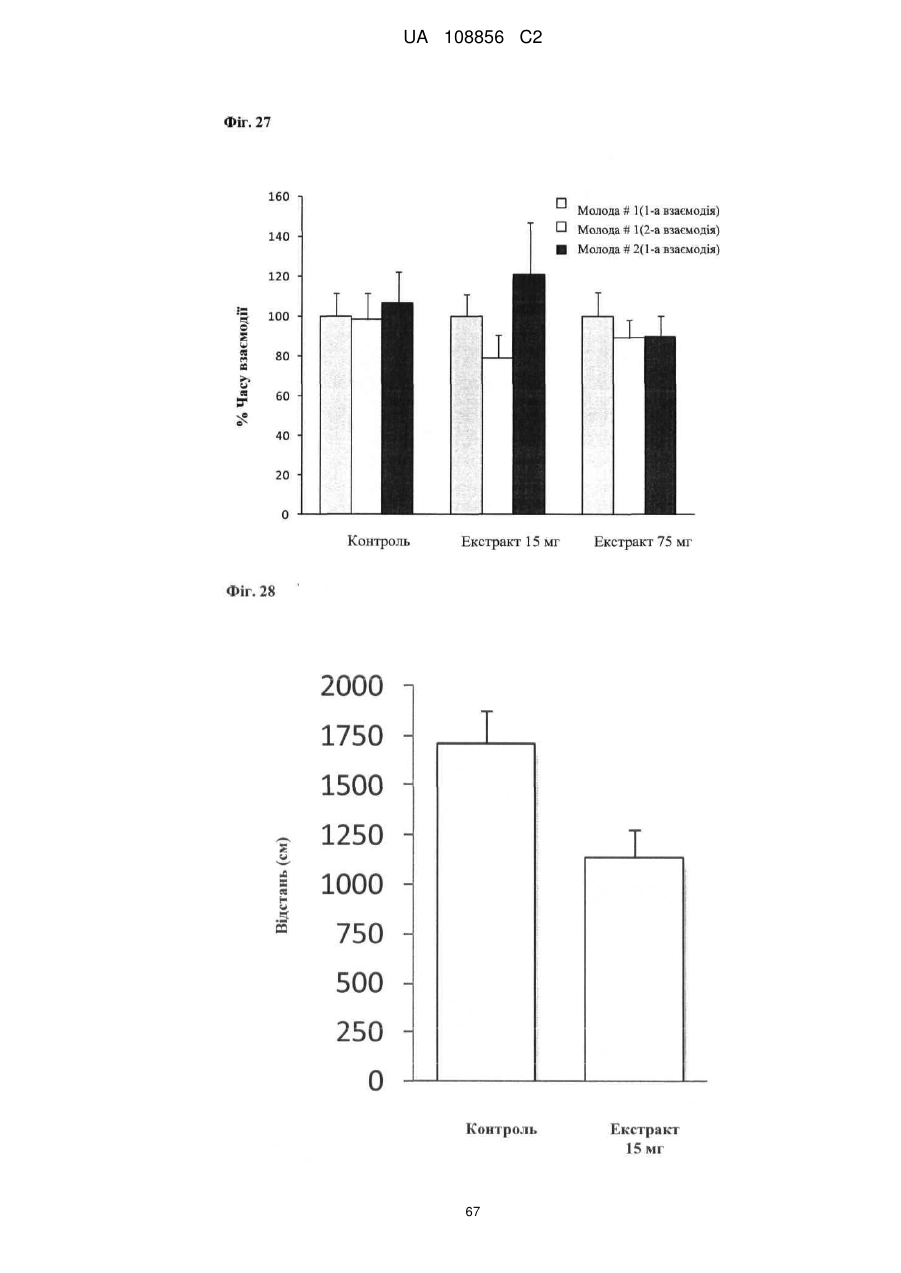
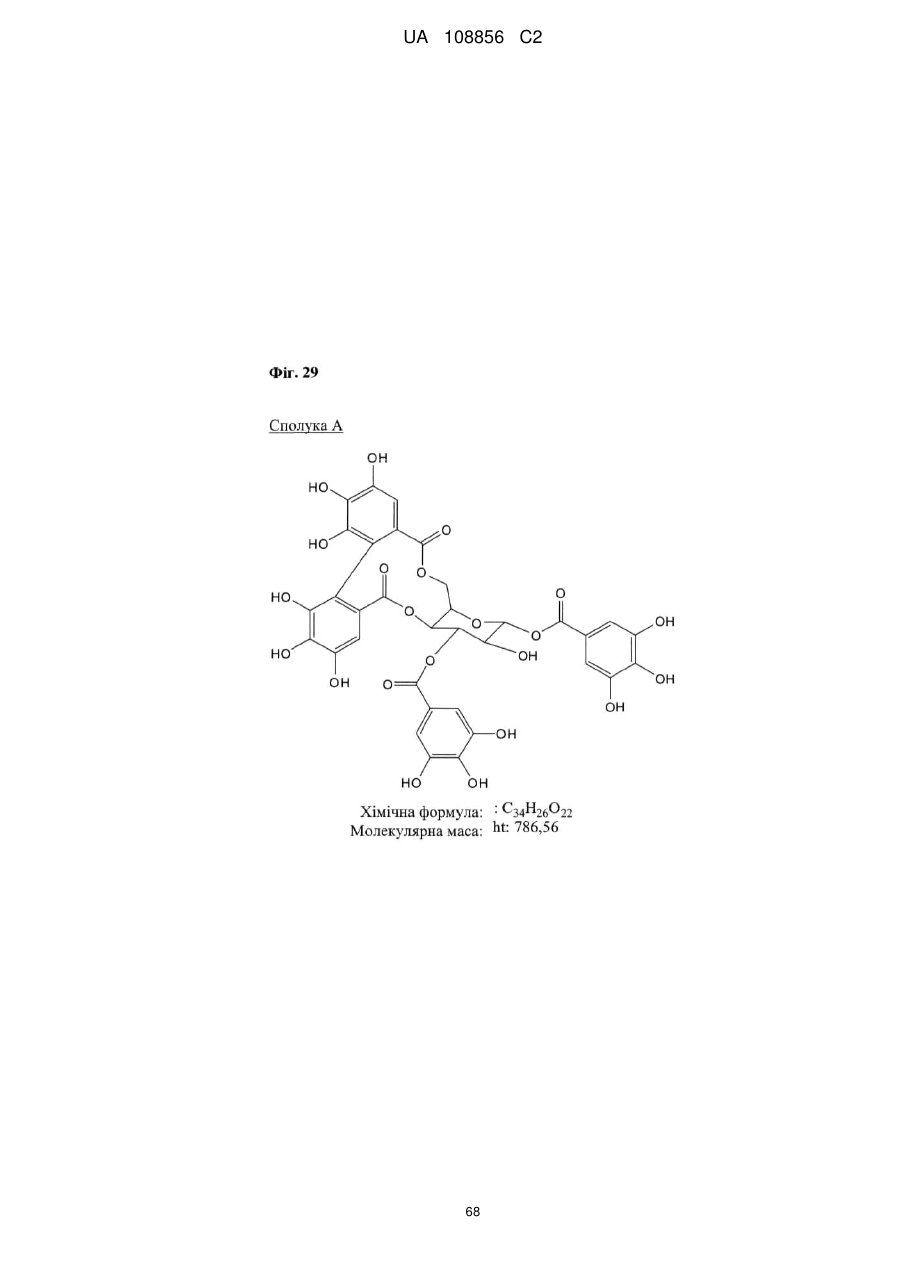
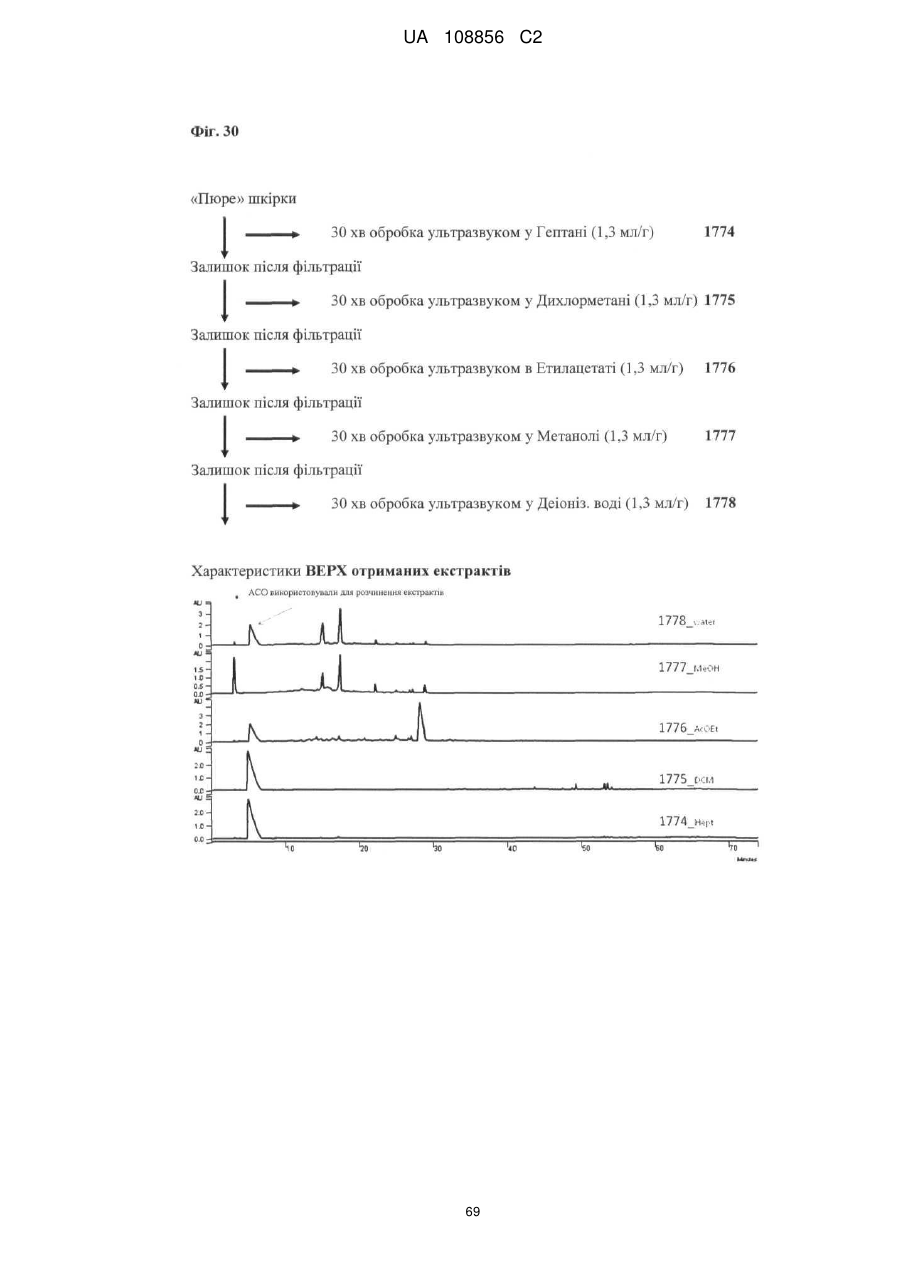
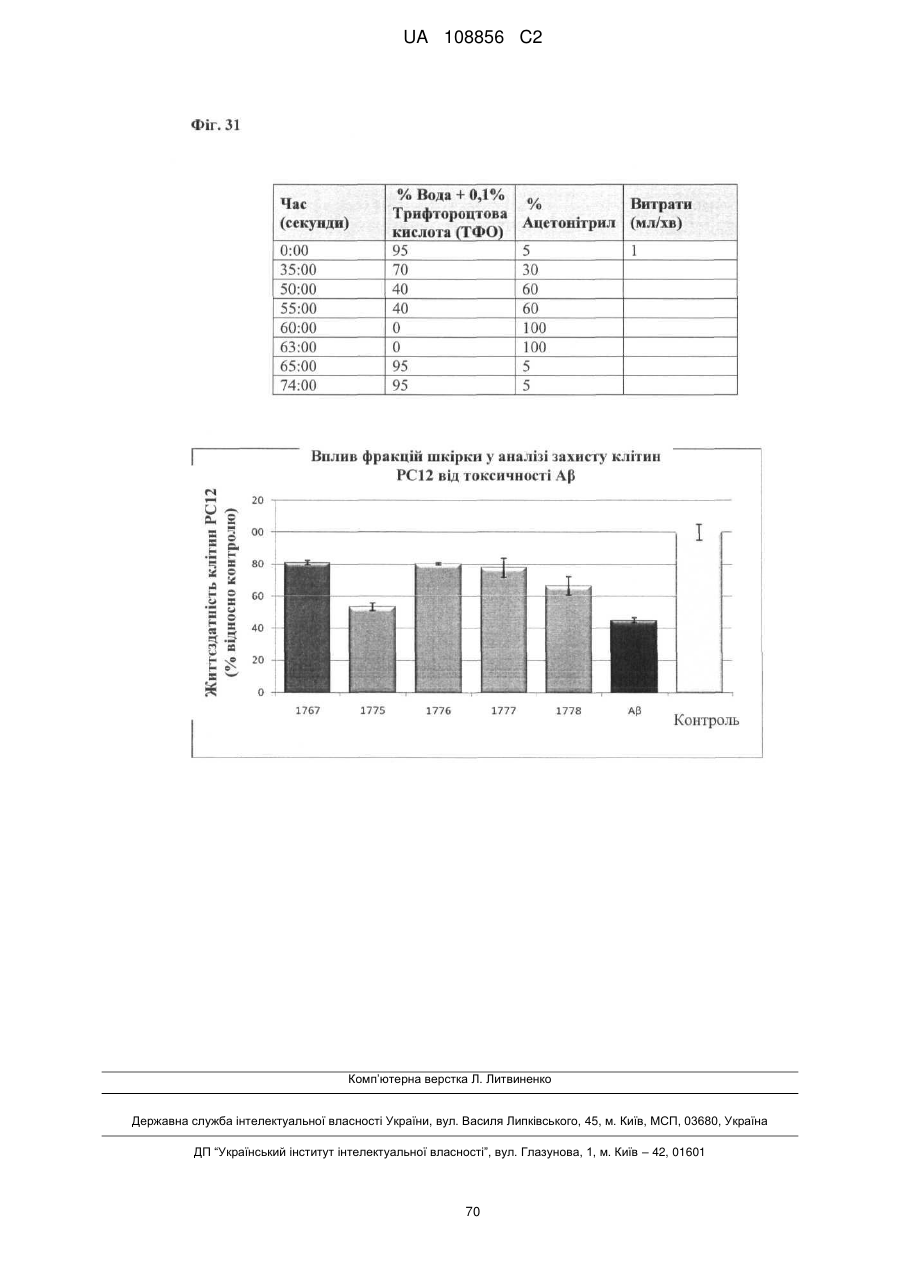
Пунікалін (punicalin) та пунікалагін (punicalagin) для захисту здоров’я головного мозку при нейродегенеративних розладах
Формула / Реферат
1. Застосування сполуки, вибраної з пунікаліну (Punicalin) або пунікалагіну (Punicalagin), або її фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомеру або стереоізомеру, у лікуванні або попередженні хвороби або стану, вибраного з групи, яка складається з когнітивних розладів, нейродегенеративних розладів, станів, пов'язаних з амілоїдозом, хвороби Альцгеймера, бічного аміотрофічного склерозу (БАС), хвороби Хантінгтона, хвороби Паркінсона, синдрому Дауна, когнітивного порушення, розладу пам'яті, розладу уваги, розладу часу реакції та розладу процесу навчання.
2. Застосування за п. 1, яке відрізняється тим, що сполука є чистою та виділеною.
3. Застосування за п. 1, яке відрізняється тим, що сполука є частиною нутрицевтичної композиції.
4. Застосування за п. 1, яке відрізняється тим, що сполука є частиною фармацевтичної композиції.
5. Застосування за п. 1, яке відрізняється тим, що сполука є частиною функціонального продукту харчування або функціонального харчового продукту.
6. Застосування за п. 1, яке відрізняється тим, що сполука є частиною медичного продукту харчування або медичного харчового продукту.
7. Застосування за п. 1, яке відрізняється тим, що сполука є частиною харчової добавки.
8. Застосування за п. 1, яке відрізняється тим, що сполука є частиною лікарського засобу рослинного походження.
9. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою когнітивне порушення і загальна когнітивна здатність покращується.
10. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою розлад пам'яті і пам'ять покращується.
11. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою когнітивне порушення і загальна когнітивна здатність підтримується.
12. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою розлад пам'яті і пам'ять підтримується.
13. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою когнітивне порушення.
14. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою нейродегенеративний розлад.
15. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою стан, пов'язаний з амілоїдозом.
16. Застосування за п. 15, яке відрізняється тим, що зазначений стан, пов'язаний з амілоїдозом, являє собою помірне когнітивне порушення (МСІ) або віковий розлад пам'яті (ААМІ).
17. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою бічний аміотрофічний склероз (БАС), хворобу Хантінгтона, хворобу Паркінсона або синдром Дауна.
18. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою хворобу Альцгеймера.
19. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою когнітивне порушення у людини.
20. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою розлад пам'яті у людини.
21. Застосування за п. 20, яке відрізняється тим, що зазначений розлад пам'яті являє собою розлад щонайменше одного показника, вибраного з групи, яка складається з короткочасної пам'яті, довгострокової пам'яті, консолідації пам'яті, процедурної пам'яті та декларативної пам'яті.
22. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою розлад уваги.
23. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою розлад часу реакції.
24. Застосування за п. 1, яке відрізняється тим, що хвороба або стан являє собою розлад процесу навчання.
25. Застосування сполуки, вибраної з пунікаліну або пунікалагіну, або її фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомера або стереоізомера, у виготовленні лікарського засобу для використання в лікуванні або попередженні хвороби або стану, вибраного з групи, яка складається з когнітивних розладів, нейродегенеративних розладів, станів, пов'язаних з амілоїдозом, хвороби Альцгеймера, бічного аміотрофічного склерозу (БАС), хвороби Хантінгтона, хвороби Паркінсона, синдрому Дауна, когнітивного порушення, розладу пам'яті, розладу уваги, розладу часу реакції та розладу процесу навчання.
26. Застосування за п. 25, яке відрізняється тим, що сполука є чистою та виділеною.
27. Застосування за п. 25, яке відрізняється тим, що лікарський засіб є частиною нутрицевтичної композиції.
28. Застосування за п. 25, яке відрізняється тим, що лікарський засіб є частиною фармацевтичної композиції.
29. Застосування за п. 25, яке відрізняється тим, що лікарський засіб є частиною функціонального продукту харчування або функціонального харчового продукту.
30. Застосування за п. 25, яке відрізняється тим, що лікарський засіб є частиною медичного продукту харчування або медичного харчового продукту.
31. Застосування за п. 25, яке відрізняється тим, що лікарський засіб є частиною харчової добавки.
32. Застосування за п. 25, яке відрізняється тим, що лікарський засіб є частиною лікарського засобу рослинного походження.
33. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою когнітивне порушення і загальна когнітивна здатність покращується.
34. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою розлад пам'яті і пам'ять покращується.
35. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою когнітивне порушення і загальна когнітивна здатність підтримується.
36. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою розлад пам'яті і пам'ять підтримується.
37. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою когнітивне порушення.
38. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою нейродегенеративний розлад.
39. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою стан, пов'язаний з амілоїдозом.
40. Застосування за п. 39, яке відрізняється тим, що зазначений стан, пов'язаний з амілоїдозом, являє собою помірне когнітивне порушення (МСІ) або віковий розлад пам'яті (ААМІ).
41. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою бічний аміотрофічний склероз (БАС), хворобу Хантінгтона, хворобу Паркінсона або синдром Дауна.
42. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою хворобу Альцгеймера.
43. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою когнітивне порушення у людини.
44. Застосування за п. 25, яке відрізняється тим. що хвороба або стан являє собою розлад пам'яті у людини.
45. Застосування за п. 44, яке відрізняється тим, що зазначений розлад пам'яті являє собою розлад щонайменше одного показника, вибраного з групи, яка складається з короткочасної пам'яті, довгострокової пам'яті, консолідації пам'яті, процедурної пам'яті та декларативної пам'яті.
46. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою розлад уваги.
47. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою розлад часу реакції.
48. Застосування за п. 25, яке відрізняється тим, що хвороба або стан являє собою розлад процесу навчання.
Текст
Реферат: UA 108856 C2 (12) UA 108856 C2 Винахід стосується застосування пунікаліну (Punicalin) або пунікалагіну (Punicalagin) у лікуванні або попередженні когнітивних розладів, нейродегенеративних розладів, станів, пов'язаних з амілоїдозом, хвороби Альцгеймера, бічного аміотрофічного склерозу (БАС), хвороби Хантінгтона, хвороби Паркінсона, синдрому Дауна, когнітивного розладу, розладу пам'яті, розладу уваги, розладу часу реакції та розладу процесу навчання. UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 РОДИННА ЗАЯВКА Дана заявка претендує на пріоритет на основі попередньої заявки на патент США 61/228374, поданої 24 липня 2009 року, зміст якої включений у даний опис за допомогою посилання. РІВЕНЬ ТЕХНІКИ Нейродегенеративні розлади і питання здоров'я головного мозку належать до числа основних назріваючих проблем у області охорони здоров'я, з якими зіштовхується наше старіюче суспільство. Хвороба Альцгеймера (ХА), безумовно, являє собою найпоширеніший із нейродегенеративних розладів. Відомо, що деякі вікові патології, такі як хвороба Паркінсона, хвороба Хантінгтона і бічний аміотрофічний склероз (БАС), мають деяку схожість за своєю патофізіологією з хворобою Альцгеймера, включаючи порушене укладання (фолдинг) білка і окисний стрес. Sayre, L. M., G. Perry, et al. (2008). "Oxidative stress and neurotoxicity". Chem Res Toxicol 21(1): 172-88. Крім селективної дегенерації нейронів, патологія при ХА характеризується наявністю двох ключових видів уражень головного мозку: позаклітинних сенільних бляшок (SP) і внутрішньонейронних нейрофібрилярних клубків (NFT). SP містять β-амілоїдні пептиди (Aβ), головним чином Aβ (1-42); тоді як NFT в основному складаються з асоційованого з мікротрубочками білка Tau в формі парних спіральних філаментів. Патофізіологія ХА також характеризується підвищеним утворенням розчинних пептидів бета-амілоїду - пептидів Aβ (140) і Aβ (1-42). Деякі недавні дослідження показують, що токсичність нейронів і порушена синаптична передача можуть бути наслідком підвищеного утворення розчинних олігомерів Aβ. Існує потреба в сполуках і композиціях, які лікують нейродегенеративні розлади і/або покращують здоров'я головного мозку. У ідеальному варіанті зазначені сполуки повинні мати хороші фармацевтичні властивості, такі як розчинність, біодоступність і/або мале число побічних ефектів. КОРОТКИЙ ОПИС ВИНАХОДУ Деякі аспекти даного винаходу відносяться до сполук, екстрактів і композицій на їхній основі, а також способів їхнього застосування для лікування нейродегенеративних розладів і/або покращення здоров'я головного мозку. У деяких варіантах реалізації зазначені сполуки являють собою флавоноїди граната. У деяких варіантах реалізації зазначені сполуки, екстракти і/або композиції можна застосовувати для лікування, контролю або попередження захворювання чи стану, пов'язаного з ушкодженням, індукованим утворенням фібрил або підвищеним ризиком утворення фібрил. Відповідно до одного з аспектів, даний винахід відноситься до композиції, яка містить сполуку або екстракт згідно з даним винаходом, таку як фармацевтична композиція, нутрицевтичний склад, медичний продукт харчування (також відомий як дієтичний продукт харчування для спеціальних медичних цілей), функціональний продукт харчування, добавка до продукту харчування або харчова добавка (також відома як фітомедичний продукт), яка містить одну або більше антиагрегаційних сполук згідно з даним винаходом. Зазначені композиції також можуть містити додатковий терапевтичний агент або можуть бути введені в комбінації з іншою терапевтичною сполукою. Інші аспекти даного винаходу відносяться до упакованих продуктів, які містять зазначені композиції та етикетку і/або інструкції із застосування для попередження агрегації у пацієнта групи ризику, для лікування захворювання або стану, пов'язаного з ушкодженням головного мозку, пов'язаним із типовими віковими захворюваннями, і/або для попередження і/або контролю пов'язаної з ним загибелі клітин. Додаткові аспекти, варіанти реалізації та переваги даного винаходу докладно розглянуті нижче. Більше того, наведена вище інформація і наступний докладний опис являють собою лише ілюстративні приклади різних аспектів і варіантів реалізації даного винаходу та призначені для забезпечення загального уявлення або основи для розуміння суті й характеру заявлених аспектів і варіантів реалізації. Додані фігури включені для додаткового розуміння різних аспектів і варіантів реалізації; вони включені в даний опис і є його частиною. Зазначені фігури разом із іншою частиною опису служать для пояснення принципів та дії описаних і заявлених аспектів та варіантів реалізації. Різні аспекти щонайменше одного з варіантів реалізації розглянуті нижче з посиланням на додані фігури. Зазначені фігури наведені для ілюстрації та пояснення і не обмежують об'єм даного винаходу. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На Фіг. 1 показані обрані сполуки згідно з даним винаходом. 1 На Фіг. 2 показаний спектр H ЯМР Пунікалагіну (Punicalagin). На Фіг. 3 показаний мас-спектр Пунікалагіну. 1 На Фіг. 4 показаний спектр H ЯМР Пунікаліну (Punicalin). 1 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 На Фіг. 5 показаний мас-спектр Пунікаліну. 1 На Фіг. 6 показаний спектр H ЯМР Телімаграндіну (Tellimagrandin). На Фіг. 7 показаний мас-спектр Телімаграндіну. 1 На Фіг. 8 показаний спектр H ЯМР Сполуки А. На Фіг. 9 показаний мас-спектр Сполуки А. На Фіг. 10 показаний мас-спектр Педункулагіну (Pedunculagin). На Фіг. 11 показані результати скринінгових аналізів на предмет інгібування агрегації з використанням Aβ25-35 і флуоресценції ThТ з різними фракціями, виділеними з використанням різних розчинників для екстракції. На Фіг. 12 показані молекули, ідентифіковані в екстрактах як біологічно активні, а також їх значення IC50 для інгібування агрегації Aβ25-35. На Фіг. 13 показані результати із застосуванням Пунікаліну в аналізах дозозалежної флуоресценції in vitro з використанням Aβ25-35. На Фіг. 14 показані результати із застосуванням Педункулагіну в аналізах дозозалежної флуоресценції in vitro з використанням Aβ25-35. На Фіг. 15 показані результати з застосуванням Пунікалагіну в аналізах дозозалежної флуоресценції in vitro з використанням Aβ25-35. На Фіг. 16 показані результати з застосуванням Сполуки А (3I) в аналізах дозозалежної флуоресценції in vitro з використанням Aβ25-35. На Фіг. 17 показані результати з застосуванням Телімаграндіну в аналізах дозозалежної флуоресценції in vitro з використанням Aβ25-35. На Фіг. 18 показані результати з застосуванням Корилагіну (Corilagin) в аналізах дозозалежної флуоресценції in vitro з використанням Aβ25-35. На Фіг. 19 показані результати аналізів клітин PC12, що демонструють інгібування токсичності нейронів, яка індукується Aβ, з використанням фракції зі шкірки граната, яка, як показано, містить Пунікалагін (дозування 500 мкг/мл). На Фіг. 20 показані характеристики ВЕРХ (254 нм) кількох екстрактів граната згідно з даним винаходом. На Фіг. 21 показаний аналіз індукованої β-амілоїдом загибелі клітин у клітинах PC12. На Фіг. 22 показані характеристики ВЕРХ кількох субфракцій Екстракту 1767. Дані характеристики одержували за допомогою аналітичної системи ВЕРХ Varian, оснащеної детектором на діодній матриці (DAD) з використанням колонки 250 мм 4,6 мм Ø 0,5 мкм "XRS C18" Varian. Використовуваний розчинник і градієнт показані на Фіг. 23. На Фіг. 23 показаний розчинник і градієнт, використовуваний для одержання слідів ВЕРХ; і графік, що демонструє біологічну активність субфракцій 1767 відносно виживаності клітин РС12 при токсичності Aβ. Усі субфракції аналізували при 30 мкг/мл. Субфракції 1767-2 і 1767-3 проявляють найвищу активність; оскільки вони також демонструють значні подібності характеристик ВЕРХ, їх об'єднували для подальшого фракціонування й аналізу. На Фіг. 24 показаний результат тесту водяного лабіринту Моріса наприкінці 3-місячного періоду лікування екстрактом граната 31008 у моделі ХА в миші (введення, починаючи через чотири місяці). На Фіг. 25 показані результати зафарбовування зрізів головного мозку мишей на предмет дифузійних амілоїдних бляшок наприкінці 3-місячного періоду лікування екстрактом граната 31008 у моделі ХА у миші (введення, починаючи через чотири місяці). На Фіг. 26 показаний результат тесту водяного лабіринту Моріса наприкінці 3-місячного періоду лікування Пунікалагіном або екстрактом граната 31008 (у двох різних дозах, низькою і високою), екстрактом 61109 і екстрактом 71109 у моделі ХА у миші (введення, починаючи через два місяці). На Фіг. 27 показані результати дослідження соціального впізнавання у старих пацюків (у якому екстракт являє собою 31008). На Фіг. 28 показані результати зворотнього тесту водяного лабіринту Моріса у старих пацюків (у якому екстракт являє собою 31008 і дозування становить 30 мкг/мл). На Фіг. 29 показана Сполука А. На Фіг. 30 показана блок-схема, яка демонструє виконувану за допомогою ультразвуку послідовну екстракцію зі шкірки граната різними розчинниками, які мають зростаючу полярність; і характеристики ВЕРХ отриманих екстрактів. Дані характеристики одержували за допомогою аналітичної системи ВЕРХ Varian, оснащеної детектором на діодній матриці (DAD) з використанням дифенільної колонки 250 мм 4,6 мм, Ø 0,5 мм "XRS pursuit". Використовуваний розчинник і градієнт показані на Фіг. 31. 2 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фіг. 31 показаний розчинник і градієнт, використовуваний для одержання слідів ВЕРХ; і графік, який демонструє біологічну активність субфракцій шкірки відносно виживаності клітин РС12 при токсичності Aβ. Усі субфракції аналізували при 500 мкг/мл. Фракція 1776 має найвищу активність і дуже цікаві характеристики ВЕРХ, відмінні від характеристик 1777 і 1778, основні піки яких схожі на Пунікалагін. Даний результат може вказувати на те, що інша сполука, відмінна від Пунікалагіну, може бути здатною захищати клітини PC12 від індукованої Aβ токсичності. Отже, 1776 відбирали для подальшого фракціонування. Телімаграндін ідентифікували у фракції екстракту 1776. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Деякі аспекти даного винаходу відносяться до сполук (а також екстрактів і композицій, які містять зазначені сполуки) і способів ефективного введення зазначених сполук, екстрактів або композицій суб'єкту, який цього потребує. Амілоїдоз У деяких варіантах реалізації сполуки інгібують згортання білка, який викликає агрегацію пептиду Aβ (тобто утворення амілоїдних бляшок). Ряд невиліковних, пов'язаних зі старінням або дегенеративних захворювань, пов'язують із загальним і фундаментальним патогенним процесом неправильного згортання і агрегації білка або пептиду, названим "амілоїдозом". Дані захворювання включають хворобу Альцгеймера, Паркінсона і Хантінгтона, і діабет II типу. Відкладення амілоїду, що присутні при даних захворюваннях, складаються з конкретних пептидів, характерних для кожного з цих захворювань, але незалежно від їхньої послідовності амілоїдні фібрили мають характерну структуру β-складчастого шару і спільний шлях агрегації. При кожному захворюванні конкретний білок або пептид неправильно згортається, приймає структуру β-складчастого шару і олігомеризується з утворенням розчинних проміжних агрегатів на шляху до утворення фібрил, в остаточному підсумку утворюючи нерозчинні амілоїдні волокна, бляшки або включення. Дані нерозчинні форми агрегованого білка або пептиду перетворюються через міжмолекулярну асоціацію β-ниток у β-складчасті шари. Останні дані вказують на те, що розчинні амілоїдні олігомери можуть бути основною причиною нейротоксичності. Амілоїдози визначають як захворювання, при яких зазвичай розчинні білки накопичуються в різних тканинах у вигляді нерозчинних відкладень фібрил, які багаті структурою β-складчастого шару і мають характерні властивості зв'язування барвника. Незважаючи на те, що конкретні поліпептиди, які є складовими зазначених відкладень, різні для кожного амілоїдозу, у даних розладів є кілька спільних ключових ознак. Найбільш помітною серед них є здатність білків, які високо розчинні в біологічних рідинах, поступово перетворюватися в нерозчинні волокнисті полімери, збагачені конформацією β-складчастого листа. Крім того, вони схильні до утворення схожого молекулярного механізма (шляхом міжмолекулярної асоціації β-ниток із утворенням розширених β-складчастих шарів) і, таким чином, схильні мати спільну схожу молекулярну структуру і спільну здатність зв'язувати певні барвники, такі як конго червоний і Тіофлавін Т. Дані захворювання і розлади, які в даному описі загалом називаються "амілоїдними захворюваннями", поділяються на дві основні категорії: (а) захворювання, які уражають головний мозок та інші відділи центральної нервової системи; і (b) захворювання, які уражають інші органи або тканини по всьому організму. Приклади амілоїдних захворювань, які підпадають під дані дві категорії, перераховані в наступних двох розділах; однак відомо багато інших прикладів рідкісних спадкових амілоїдних захворювань, не включених у даний опис, і додаткові форми амілоїдного захворювання, імовірно, будуть відкриті в майбутньому. Нейродегенеративні захворювання, пов'язані з амілоїдозом Багато різних нейродегенеративних захворювань пов'язані з неправильним згортанням і агрегацією конкретного білка або пептиду в конкретній частині головного мозку або іншій ділянці центральної нервової системи залежно від конкретного захворювання. Далі наведені приклади зазначених захворювань. Різні форми хвороби Альцгеймера (ХА), а також синдрому Дауна, спадкова церебральна геморагія з амілоїдозом (HCHWA, голландський тип), церебральна амілоїдна ангіопатія і також можливо помірний когнітивний розлад та інші форми деменції пов'язані з агрегацією пептиду, який складається з 40/42 залишків, названого β-амілоїдом, Aβ(1-40) або Aβ(1-42),який утворює нерозчинні амілоїдні волокна і бляшки в корі головного мозку, гіпокампі або іншій ділянці головного мозку в залежності від конкретного захворювання. Хвороба Альцгеймера також пов'язана з утворенням нейрофібрилярних клубків шляхом агрегації гіперфосфорильованого білка, названого tau, що також відбувається при лобово-скроневій деменції (хвороба Піка). 3 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 Хвороба Паркінсона (PD), деменція з тільцями Леві (DLB) і множинна системна атрофія (MSA) пов'язані з агрегацією білка, названого α-синуклеїном, яка призводить до утворення нерозчинних включень, названих "тільцями Леві". Хвороба Хантінгтона (HD), спинальна і бульбарна м'язова атрофія (SBMA, відома також як хвороба Кеннеді), дентаторубропалідолюїсова атрофія (DRPLA), різні форми спинально-церебелярної атаксії (SCA, типи 1, 2, 3, 6 і 7) і, можливо, деякі інші спадкові нейродегенеративні захворювання пов'язані з агрегацією різних білків і пептидів, які містять аномально протяжні повтори глутаміну (розширені ділянки поліглутаміну). Хвороба Крейтцфельда-Якоба (CJD), губкоподібна енцефалопатія великої рогатої худоби (BSE) у корів, скріпи в овець, куру, хвороба Герстмана-Штреуслера-Шейнкера (GSS), фатальне сімейне безсоння й, можливо, всі інші форми трансмісивної енцефалопатії пов'язані з неправильним згортанням, яке мимовільно поширюється, і агрегацією білків пріонів. Бічний аміотрофічний склероз (БАС), а також можливо деякі інші форми хвороби рухового нейрона (ХРН) пов'язані з агрегацією білка, названого супероксиддисмутазою. Сімейна британська деменція (СБД) і сімейна датська деменція (СДД) відповідно пов'язані з агрегацією пептидних послідовностей ABri і ADan, одержуваних із білка BRI. Спадкова церебральна геморагія з амілоїдозом (HCHWA, ісландський тип) пов'язана з агрегацією білка, названого цистатіном C. Системні захворювання, пов'язані з амілоїдозом Крім нейродегенеративних захворювань, перерахованих вище, широкий спектр системних, пов'язаних зі старінням, або дегенеративних захворювань пов'язаний із неправильним згортанням і агрегацією конкретного білка або пептиду в різних інших тканинах по всьому організму (тобто крім головного мозку). Далі наведені приклади зазначених захворювань. Діабет II типу (також відомий як діабет похилого віку або інсулін-незалежний діабет) пов'язаний із агрегацією пептиду, який складається з 37 залишків, названого острівцевим амілоїдним поліпептидом (IAPP або "амілін"), який утворює нерозчинні відкладення, пов'язані з прогресуючим руйнуванням інсулін-продукуючих β-клітин у острівцях Лангерганса в підшлунковій залозі. Пов'язаний із діалізом амілоїдоз (DRA) і амілоїд передміхурової залози пов'язані з агрегацією білка, названого β2-мікроглобуліном, або в костях, суглобах і сухожиллях при DRA, який розвивається протягом тривалих періодів гемодіалізу, або в передміхуровій залозі у випадку амілоїда передміхурової залози. Первинний системний амілоїдоз, системний AL-амілоїдоз і пов'язаний із мієломою амілоїдоз пов'язані з агрегацією легкого ланцюга імуноглобуліну (або в деяких випадках важкого ланцюга імуноглобуліну) з утворенням нерозчинних відкладень амілоїду, які поступово накопичуються в різних основних органах, таких як печінка, нирки, серце і шлунково-кишковий (ШК) тракт. Реактивний системний AA-амілоїдоз, вторинний системний амілоїдоз, сімейна середземноморська лихоманка і хронічне запальне захворювання пов'язані з агрегацією сироваткового білка амілоїду А, який утворює нерозчинні відкладення амілоїду, які накопичуються в основних органах, таких як печінка, нирки і селезінка; сенільний системний амілоїдоз (SSA), сімейна амілоїдна полінейропатія (FAP) і сімейна амілоїдна кардіоміопатія (FAC) пов'язані з неправильним згортанням і агрегацією різних мутантів білка транстиретіну (TTR), які утворюють нерозчинні включення в різних органах і тканинах, таких як серце (особливо при FAC), периферичні нерви (особливо при FAP) і шлунково-кишковий (ШК) тракт. Інша форма сімейної амілоїдної полінейропатії (FAP, тип II) пов'язана з агрегацією аполіпопротеїну AI в периферичних нервах; сімейний вісцеральний амілоїдоз і спадковий ненейропатичний системний амілоїдоз пов'язані з неправильним згортанням і агрегацією різних мутантів лізоциму, які утворюють нерозчинні відкладення в основних органах, таких як печінка, нирки і селезінка. Спадковий системний амілоїдоз фінського типу пов'язаний з агрегацією білка, названого гельсолін, у очах (зокрема, в рогівці). Амілоїдоз α-ланцюга фібриногену пов'язаний із агрегацією α-ланцюга фібриногену А, який утворює нерозчинні відкладення амілоїду в різних органах, таких як печінка і нирки. Пов'язаний із інсуліном амілоїдоз виникає при агрегації інсуліну в місці ін'єкції у діабетиків. Медулярна карцинома щитовидної залози пов'язана з агрегацією кальцитоніну в навколишніх тканинах. Ізольований амілоїдоз передсердь пов'язаний із агрегацією передсердного натрійуретичного пептиду (ANP) в серце. Різні форми катаракти пов'язані з агрегацією білків γ-кристалінів у кришталику очей. Патогенний механізм амілоїдних захворювань 4 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 Тоді як усі амілоїдні захворювання мають спільний патогенний процес амілоїдозу, точні молекулярні механізми, за допомогою яких даний спільний процес неправильного згортання і агрегації білка/пептиду пов'язаний із прогресуючою дегенерацією уражених тканин, неясні. У деяких випадках, включаючи багато системних амілоїдних захворювань, вважається, що чиста маса нерозчинного білка або пептиду просто переповнює уражені тканини, в остаточному підсумку призводячи до гострої недостатності органа. У інших випадках, включаючи більшість нейродегенеративних захворювань, перерахованих вище, симптоми захворювання розвиваються з появою лише дуже маленьких агрегатів. Отже, було висловлене припущення, що нерозчинні відкладення за своєю природою токсичні і можуть викликати прогресуюче руйнування клітин, наприклад, викликаючи запалення і окисний стрес, або шляхом прямого порушення клітинних мембран чи інших клітинних компонентів або процесів. Нещодавно було встановлено, що конкретні білки та пептиди, задіяні щонайменше в деяких із даних амілоїдних захворювань, утворюють різні розчинні олігомерні форми при агрегації, які варіюються за розміром від димерів і тримерів до набагато більших форм, які містять десятки або навіть сотні, або тисячі мономерів білка або пептиду. Більше того, зазначені олігомери за своєю природою токсичні для клітин in vitro при відсутності нерозчинних агрегатів і вони, очевидно, мають спільну структурну ознаку, оскільки всі вони можуть бути розпізнані тим самим антитілом, незважаючи на те, що вони можуть бути утворені білками або пептидами з амінокислотними послідовностями, які сильно відрізняються. Молекулярна структура даних токсичних розчинних олігомерів не відома і точний механізм, за допомогою якого вони вбивають клітини, також неясний, але було запропоновано кілька теорій. Згідно з однією з теорій, називаною "гіпотеза каналу", олігомери утворюють гетерогенні пори або проникні іонні канали, які дозволяють іонам вільно проходити через клітинні мембрани, тим самим порушуючи їхню цілісність, що в остаточному підсумку викликає загибель клітин. Як альтернатива або додатково, олігомери можуть утворювати протофібрили, які вбивають клітини за допомогою схожого або іншого механізму. Однак незалежно від точного патогенного механізму, до теперішнього часу зібрана величезна кількість даних, які показують, що спільний процес агрегації білка/пептиду являє собою основну причину цих і, можливо, інших амілоїдних захворювань. Даний винахід відноситься до хімічних сполук, екстрактів і композицій, які являють собою інгібітори пов'язаної з амілоїдом токсичності й, відповідно, будуть корисні при лікуванні амілоїдних захворювань і розладів. Раннє виявлення амілоїдних захворювань і розладів Завжди бажано виявляти захворювання на ранньому етапі їх розвитку. Раннє виявлення дозволяє рано почати лікування, що, в цілому, було доведено, забезпечує більший успіх у лікуванні різних захворювань. Нещодавно було виявлено, що аналіз очей людей і, зокрема, кришталиків очей може виявляти ознаки різних типів захворювань. Наприклад, було показано, що вимірювання світлорозсіювання всередині ока дають корисну діагностичну інформацію для виявлення і контролю розвитку таких захворювань, як хвороба Альцгеймера. Публікація заявки на патент США 2008/0088795 і патент США 7107092, повний зміст яких включений у даний опис за допомогою посилання. Крім того, зміни в головному мозку, вимірювані за допомогою МРТ і ПЕТ, аналізів ІФА і методу дифракційно-покращеного одержання зображень (diffractionenhanced imaging, DEI), окремо або в комбінації з тестами на запам'ятовування і детектуванням білків ризику в рідинах організму, також можуть призводити до більш ранньої та більш точної діагностики хвороби Альцгеймера. Сполуки згідно з даним винаходом Один із аспектів даного винаходу відноситься до сполук, які при введенні призводять до лікування або попередження нейродегенеративних розладів і/або покращення здоров'я головного мозку. Як більш докладно розглянуто нижче, у деяких варіантах реалізації зазначене введення сполуки призводить до меншої кількості відкладень амілоїдних фібрил у головному мозку тварин, яким давали композиції, що містять одну або більше сполук згідно з даним винаходом; і призводило до покращення або відновлення пам'яті у тварин, яким давали композиції, що містять одну або більше сполук згідно з даним винаходом. Наприклад, сполуки згідно з даним винаходом включають Пунікалін, Пунікалагін, Педункулагін, Телімаграндін, Корилагін, Гранатін А (Granatine A), Гранатін Б, Терміналін (Terminalin), Галагілдилактон (Gallagyldilactone) і Cполуку А, а також їх фармацевтично прийнятні солі, біологічно активні метаболіти, сольвати, гідрати, проліки, енантіомери або стереоізомери. 5 UA 108856 C2 Даний винахід також відноситься до чистої та виділеної сполуки або її фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомеру або стереоізомеру; при цьому зазначену сполуку представлено формулою I: I де незалежно для кожного випадку X являє собою або ;і 1 2 3 кожний із R , R і R незалежно являє собою водень, алкіл, аралкіл, алкілкарбокси або цукор; 5 або 1 R являє собою водень, алкіл, аралкіл, алкілкарбокси, , або цукор, R 3 10 являє собою водень або , і R являє собою ; або 1 2 3 R являє собою водень, алкіл, аралкіл, алкілкарбокси або цукор, а R і R разом являють собою . У деяких варіантах реалізації даний винахід відноситься до кожної з зазначених 6 2 UA 108856 C2 сполук, де X являє собою . У деяких варіантах реалізації даний винахід відноситься до кожної з зазначених 5 10 15 20 25 30 сполук, де X являє собою . У деяких варіантах реалізації даний винахід відноситься до кожної з зазначених сполук, де 1 R являє собою водень. У деяких варіантах реалізації даний винахід відноситься до кожної з зазначених сполук, де 1 R являє собою цукор, обраний із групи, яка складається з алози ("All"), альтрози ("Alt"), арабінози ("Ara"), еритрози, еритрулози, фруктози ("Fru"), фукозаміну ("Fuc"), фукози ("Fuc"), галактозаміну ("Gal"), галактози ("Gal"), галоїл-β-глюкози, глюкозаміну ("Glc"), глюкозамініту ("Glc-ol"), глюкози ("Glc"), гліцеральдегіду, 2,3-дигідроксипропаналю, гліцерину ("Gro"), пропан1,2,3-тріолу, гліцерону ("1,3-дигідроксиацетон"), 1,3-дигідроксипропанону, гулози ("Gul"), ідози ("Ido"), ліксози ("Lyx"), манозаміну ("Man"), манози ("Man"), псикози ("Psi"), хіновози ("Qui"), хіновозаміну, рамніту ("Rha-ol"), рамнозаміну ("Rha"), рамнози ("Rha"), рибози ("Rib"), рибулози ("Rul"), рутинози, сіалової кислоти ("Sia" або "Neu"), сорбози ("Sor"), тагатози ("Tag"), талози ("Tal"), винної кислоти, еритрарової/треарової кислоти, треози, ксилози ("Xyl") або ксилулози ("Xul"). У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 2 де R являє собою водень. У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 2 де R являє собою цукор, обраний із групи, що складається з алози ("All"), альтрози ("Alt"), арабінози ("Ara"), еритрози, еритрулози, фруктози ("Fru"), фукозаміну ("Fuc"), фукози ("Fuc"), галактозаміну ("Gal"), галактози ("Gal"), галоїл-β-глюкози, глюкозаміну ("Glc"), глюкозамініту ("Glc-ol"), глюкози ("Glc"), гліцеральдегіду, 2,3-дигідроксипропаналю, гліцерину ("Gro"), пропан1,2,3-тріолу, гліцерону ("1,3-дигідроксиацетон"), 1,3-дигідроксипропанону, гулози ("Gul"), ідози ("Ido"), ліксози ("Lyx"), манозаміну ("Man"), манози ("Man"), псикози ("Psi"), хіновози ("Qui"), хіновозаміну, рамніту ("Rha-ol"), рамнозаміну ("Rha"), рамнози ("Rha"), рибози ("Rib"), рибулози ("Rul"), рутинози, сіалової кислоти ("Sia" або "Neu"), сорбози ("Sor"), тагатози ("Tag"), талози ("Tal"), винної кислоти, еритрарової/треарової кислоти, треози, ксилози ("Xyl") або ксилулози ("Xul"). У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 3 де R являє собою водень. У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 3 де R являє собою цукор, обраний із групи, яка складається з алози ("All"), альтрози ("Alt"), 7 UA 108856 C2 5 10 15 арабінози ("Ara"), еритрози, еритрулози, фруктози ("Fru"), фукозаміну ("Fuc"), фукози ("Fuc"), галактозаміну ("Gal"), галактози ("Gal"), галоїл-β-глюкози, глюкозаміну ("Glc"), глюкозамініту ("Glc-ol"), глюкози ("Glc"), гліцеральдегіду, 2,3-дигідроксипропаналю, гліцерину ("Gro"), пропан1,2,3-тріолу, гліцерону ("1,3-дигідроксиацетон"), 1,3-дигідроксипропанону, гулози ("Gul"), ідози ("Ido"), ліксози ("Lyx"), манозаміну ("Man"), манози ("Man"), псикози ("Psi"), хіновози ("Qui"), хіновозаміну, рамніту ("Rha-ol"), рамнозаміну ("Rha"), рамнози ("Rha"), рибози ("Rib"), рибулози ("Rul"), рутинози, сіалової кислоти ("Sia" або "Neu"), сорбози ("Sor"), тагатози ("Tag"), талози ("Tal"), винної кислоти, еритрарової/треарової кислоти, треози, ксилози ("Xyl") або ксилулози ("Xul"). У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 1 2 3 де R , R і R кожний незалежно являє собою водень, алкіл, аралкіл, алкілкарбокси або цукор. У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 1 2 3 де R , R і R являють собою водень. У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 1 де R являє собою водень, алкіл, аралкіл, алкілкарбокси, 2 або цукор, R являє 3 собою водень або , і R являє собою . У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, де 20 R 1 являє собою водень, R 2 являє собою , і R 3 являє собою . У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 1 де R являє собою . У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, де R 1 являє собою , R 2 . 8 являє собою водень, і R 3 являє собою UA 108856 C2 У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 1 2 3 де R являє собою водень, алкіл, аралкіл, алкілкарбокси або цукор, а R і R разом являють собою . У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, 5 10 15 20 25 30 35 40 1 2 3 де R являє собою водень, а R і R разом являють собою . Даний винахід також включає мультимери формули I, такі як димери, у яких два мономери формули зв'язані, як описано в Reed, J. D., C. G. Krueger, et al. (2005). "MALDI-TOF mass spectrometry of oligomeric food polyphenols". Phytochemistry 66(18): 2248-63. Зазначені димери являють собою димери елагітанінів, які зустрічаються в природі; їх детальні структури не повністю пояснені, але вони містять основний структурний кістяк, ідентифікований у даному винаході. Тримери, тетрамери і більші олігомери також включені в даний винахід. Інакше кажучи, мультимери, наприклад, із двома, трьома, чотирма, п'ятьома, шістьома, сімома, вісьмома, дев'ятьома, десятьома або більше повторами включені в даний винахід. Деякі сполуки згідно з даним винаходом, які містять кислі замісники, можуть існувати у вигляді солей з фармацевтично прийнятними кислотами або основами. Багато сполук згідно з даним винаходом можуть бути отримані у вигляді солей з фармацевтично сумісними протиіонами (тобто фармацевтично прийнятних солей). Термін "фармацевтично прийнятна сіль" означає будь-яку нетоксичну сіль, яка при введенні реципієнту здатна утворювати або прямо, або опосередковано сполуку чи проліки сполуки згідно з даним винаходом. "Фармацевтично прийнятний протиіон" являє собою іонну частину солі, яка нетоксична при вивільненні зі зазначеної солі при введенні реципієнту. Фармацевтично сумісні солі можуть бути утворені багатьма кислотами, включаючи, але не обмежуючись ними, соляну, сірчану, оцтову, молочну, винну, яблучну, бурштинову тощо. Солі більш розчинні у водному або інших протонних розчинниках, ніж відповідні форми вільної основи. Кислоти, зазвичай використовувані для утворення фармацевтично прийнятних солей, включають неорганічні кислоти, такі як гідродисульфід, соляна, бромістоводнева, йодистоводнева, сірчана і фосфорна кислота, а також органічні кислоти, такі як паратолуолсульфонова, саліцилова, винна, дивинна, аскорбінова, малеїнова, бензолсульфонова, фумарова, глюконова, глюкуронова, мурашина, глутамінова, метансульфонова, етансульфонова, бензолсульфонова, молочна, щавлева, пара-бромфенілсульфонова, вугільна, бурштинова, лимонна, бензойна і оцтова кислота та інші неорганічні і органічні кислоти. Таким чином, зазначені фармацевтично прийнятні солі включають сульфат, піросульфат, бісульфат, сульфіт, бісульфіт, фосфат, моногідрофосфат, дигідрофосфат, метафосфат, пірофосфат, хлорид, бромід, йодид, ацетат, пропіонат, деканоат, каприлат, акрилат, форміат, ізобутират, капрат, гептаноат, пропіолат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, бутин-1,4-диоат, гексин-2,5-диоат, бензоат, хлорбензоат, метилбензоат, динітробензоат, гідроксибензоат, метоксибензоат, фталат, терефталат, сульфонат, ксиленсульфонат, фенілацетат, фенілпропіонат, фенілбутират, цитрат, лактат, бета-гідроксибутират, гліколят, малеат, тартрат, метансульфонат, пропансульфонат, нафталін-1-сульфонат, нафталін-2сульфонат, манделат і подібні солі. Типові фармацевтично прийнятні солі приєднання кислоти 9 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 включають солі, утворені мінеральними кислотами, такими як соляна кислота і бромістоводнева кислота, і, зокрема, солі, утворені органічними кислотами, такими як малеїнова кислота. Підходящі основи для утворення фармацевтично прийнятних солей з кислотними функціональними групами включають, але не обмежуються ними, гідроксиди лужних металів, таких як натрій, калій і літій; гідроксиди лужноземельних металів, таких як кальцій і магній; гідроксиди інших металів, таких як алюміній і цинк; аміак і органічні аміни, такі моно-, ди- або триалкіламіни, які не містять замісників або містять як замісники гідроксигрупу; дициклогексиламін; трибутиламін; піридин; N-метил, N-етиламін; диетиламін; триетиламін, моно-, біс- або трис-(2-гідрокси-нижчий алкіл-аміни), такі як моно-, біс- або трис-(2гідроксиетил)амін, 2-гідрокси-трет-бутиламін або трис-(гідроксиметил)метиламін, N,N-ди-алкілN-(гідроксиалкіл)-аміни, такі як N,N-диметил-N-(2-гідроксиетил)амін або три-(2гідроксиетил)амін; N-метил-D-глюкамін; і амінокислоти, такі як аргінін, лізин тощо. Деякі сполуки згідно з даним винаходом і їх солі можуть існувати в більше, ніж одній кристалічній формі, і даний винахід включає кожну індивідуальну кристалічну форму і їх суміші. Деякі сполуки згідно з даним винаходом і їх солі також можуть існувати в формі сольватів, наприклад, гідратів, і даний винахід включає кожний сольват і їх суміші. Деякі сполуки згідно з даним винаходом можуть містити один або більше хіральних центрів та існувати в різних оптично активних формах. Коли сполуки згідно з даним винаходом містять один хіральний центр, зазначені сполуки існують у двох енантіомерних формах, і даний винахід включає як енантіомери, так і суміші енантіомеров, такі як рацемічні суміші. Енантіомери можуть бути розділені способами, відомими фахівцеві в даній області техніки, наприклад, шляхом утворення діастереоізомерних солей, які можуть бути розділені, наприклад, шляхом кристалізації; шляхом утворення діастереоізомерних похідних або комплексів, які можуть бути розділені, наприклад, шляхом кристалізації, газорідинної або рідинної хроматографії; селективної реакції одного енантіомера з енантіомер-специфічним реагентом, наприклад, ферментативної етерифікації; або газорідинної чи рідинної хроматографії в хіральному оточенні, наприклад, на хіральному носії, наприклад, кварці, зі зв'язаним хіральним лігандом або в присутності хірального розчинника. Очевидно, що коли необхідний енантіомер перетворюють у іншу хімічну сполуку одним із способів розділення, описаних вище, можна використовувати додатковий етап для вивільнення необхідної енантіомерної форми. Як альтернатива, конкретні енантіомери можуть бути синтезовані за допомогою асиметричного синтезу з використанням оптично активних реагентів, субстратів, каталізаторів або розчинників чи шляхом перетворення одного енантіомера в інший шляхом асиметричної трансформації. Коли сполука згідно з даним винаходом містить більше одного хірального центра, вона може існувати в діастереоізомерних формах. Діастереоізомерні сполуки можуть бути розділені способами, відомими фахівцеві в даній області техніки, наприклад, шляхом хроматографії або кристалізації, і індивідуальні енантіомери можуть бути розділені, як описано вище. Даний винахід включає кожний діастереомер сполук згідно з даним винаходом і їх суміші. Деякі сполуки згідно з даним винаходом можуть існувати в різних таутомерних формах або у вигляді різних геометричних ізомерів, і даний винахід включає кожний таутомер і/або геометричний ізомер сполук згідно з даним винаходом і їх суміші. Деякі сполуки згідно з даним винаходом можуть існувати в різних стабільних конформаційних формах, які можуть бути розділюваними. Торсіонна асиметрія внаслідок обмеженого обертання навколо асиметричного одинарного зв'язку, наприклад, через стеричну перешкоду або напругу кільця, може дозволяти розділяти різні конформери. Даний винахід включає кожний конформаційний ізомер сполук згідно з даним винаходом і їх суміші. Деякі сполуки згідно з даним винаходом можуть існувати у цвітер-іонній формі, і даний винахід включає кожну цвітер-іонну форму сполук згідно з даним винаходом і їх суміші. У даному описі термін "проліки" відноситься до агента, який перетворюється у початковий лікарський засіб in vivo в результаті певного фізіологічного хімічного процесу (наприклад, проліки при фізіологічному рН перетворюються в необхідну лікарську форму). Проліки часто корисні, оскільки в деяких ситуаціях їх може бути легше вводити, ніж початковий лікарський засіб. Наприклад, вони можуть бути біодоступними шляхом перорального введення, тоді як початковий лікарський засіб – ні. Проліки також можуть мати покращену розчинність у фармакологічних композиціях у порівнянні з початковим лікарським засобом. Наприклад, без обмеження, проліки будуть являти собою сполуку згідно з даним винаходом, при цьому їх вводять у вигляді складного ефіру ("проліки") для полегшення "передачі" через клітинну мембрану, де розчинність у воді несприятлива, але потім він метаболічно гідролізується в карбонову кислоту при попаданні в клітину, де розчинність у воді сприятлива. Проліки мають багато корисних властивостей. Наприклад, проліки можуть бути краще розчинними у воді, ніж 10 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 кінцевий лікарський засіб, що тим самим полегшує внутрішньовенне введення лікарського засобу. Проліки також можуть мати більш високий рівень біодоступності при пероральному введенні, ніж кінцевий лікарський засіб. Після введення проліки ферментативно або хімічно розщеплюються з доставкою кінцевого лікарського засобу в кров або тканину. Типові проліки при розщепленні вивільняють відповідну вільну кислоту і зазначені залишки сполук згідно з даним винаходом, які утворюють складний ефір, що гідролізується, включають, але не обмежуються ними, замісники карбонових кислот (наприклад, -C(O)2H або фрагмент, який містить карбонову кислоту), у яких вільний водень заміщений на (C1-C4)алкіл, (C2C12)алканоїлоксиметил, (C4-C9)1-(алканоїлокси)етил, 1-метил-1-(алканоїлокси)-етил, який містить від 5 до 10 атомів вуглецю, алкоксикарбонілоксиметил, який містить від 3 до 6 атомів вуглецю, 1-(алкоксикарбонілокси)етил, який містить від 4 до 7 атомів вуглецю, 1-метил-1(алкоксикарбонілокси)етил, який містить від 5 до 8 атомів вуглецю, N(алкоксикарбоніл)амінометил, який містить від 3 до 9 атомів вуглецю, 1-(N(алкоксикарбоніл)аміно)етил, який містить від 4 до 10 атомів вуглецю, 3-фталідил, 4кротонолактоніл, бутиролактон-4-іл, ди-N,N-(C1-C2)алкіламіно(C2-C3)алкіл (такий як βдиметиламіноетил), карбамоїл-(C1-C2)алкіл, N,N-ди(C1-C2)-алкілкарбамоїл-(C1-C2)алкіл і піперидино-, піролідино- або морфоліно(C2-C3)алкіл. Типові проліки вивільняють гідроксил сполуки згідно з даним винаходом, при цьому вільний водень гідроксилу заміщений на (C1-C6)алканоїлоксиметил, 1-((C1-C6)алканоїлокси)етил, 1метил-1-((C1-C6)алканоїлокси)етил, (C1-C6)алкоксикарбонілоксиметил, N-(C1C6)алкоксикарбонілумінометил, сукциноїл, (C1-C6)алканоїл, α-аміно(C1-C4)алканоїл, арилацил і α-аміноацил або α-аміноацил-α-аміноацил, де зазначені α-аміноацильні групи незалежно являють собою будь-яку з L-амінокислот, які зустрічаються в природі і які виявляються в білках, -P(O)(OH)2, -P(O)(O(C1-C6)алкіл)2 або глікозил (радикал, отриманий у результаті відщеплення гідроксилу напівацеталю вуглеводу). Сполука може бути виділена і екстрагована (тобто відділена від сполук, із якими вона зустрічається в природі) або вона може бути отримана синтетично (тобто отримана з використанням способу синтезу) так, що в будь-якому разі рівень забруднюючих сполук або домішок не знижує або не впливає негативно на ефективність зазначеної сполуки згідно з даним винаходом. Деякі сполуки згідно з даним винаходом можуть бути екстраговані з природних джерел, таких як сік, листя, кора, навколоплідник або шкірка граната звичайного (Punica granatum). Lansky, E. P. and R. A. Newman (2007). "Punica granatum (pomegranate) and its potential for prevention and treatment of inflammation and cancer". J Ethnopharmacol 109(2): 177-206. Деякі сполуки також можуть бути виділені від волоських горіхів, Еускафісу японського (Euscaphis japonica), гравілату японського Thunb. var. китайського (Geum japonicum Thunb. var. chinense), Ожини (Rubus sp.), волоського горіха (Juglans regia), Піменти дводомної (Pimenta dioica), Дуба (Quercus), Клена, Дерну лікарського (Cornus officinalis), Ембліки лікарської (Emblica officinalis) (амла), плодів Міробалану чебуля (Terminalia chebula Retz) та індійського мигдалю (Terminalia catappa L), а також інших подібних видів. Наприклад, Пунікалін, Пунікалагін, Педункулагін і Телімаграндін були раніше виділені і охарактеризовані. Tanaka, K., G. Nonaka, et al. (1986). "Tannins and Related Compounds. XLI. 1) Isolation and Charactherization of Novel Ellagitannins, Punicacorteins A, B, C, and Punigluconin from the bark of Punica granatum L." Chem. Pharm. Bull 34(2): 656-663; Tanaka, K., G. Nonaka, et al. (1986). "Tannins and Related Compounds. XLI. 1). Revision of the Structures of Punicalin and Punicalagin, and Isolation and Charactherization of 2-O-Galloylpunicalin from the Bark of Punica granatum L." Chem. Pharm. Bull 34(2): 650-655; і Satomi, H., K. Umemura, et al. (1993). "Carbonic anhydrase inhibitors from the pericarps of Punica granatum L." Biol Pharm Bull 16(8): 787-90. У деяких варіантах реалізації сполука згідно з даним винаходом є щонайменше приблизно на 1 % - 99 % чистою. У деяких варіантах реалізації сполука згідно з даним винаходом є щонайменше приблизно на 10 % чистою. У деяких варіантах реалізації сполуки є щонайменше приблизно на 20 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 30 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 40 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 50 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 60 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 70 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 80 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 90 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 95 % чистими. У деяких варіантах реалізації сполуки є щонайменше приблизно на 99 % чистими. У деяких варіантах реалізації зазначені екстракти, які містять одну 11 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 або більше сполук згідно з даним винаходом з будь-якою з зазначених кількостей домішок, також можуть підходити для застосування як функціональні продукти харчування і харчові добавки або в функціональних продуктах харчування і харчових добавках. Зазначені екстракти більш докладно розглянуті нижче. Один із аспектів даного винаходу відноситься до сполуки або її фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомеру або стереоізомеру, який дає спектри на Фіг. 2 і 3. Один із аспектів даного винаходу відноситься до сполуки або її фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомеру або стереоізомеру, який дає спектри на Фіг. 4 і 5. Один із аспектів даного винаходу відноситься до сполуки або її фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомеру або стереоізомеру, який дає спектри на Фіг. 6 і 7. Один із аспектів даного винаходу відноситься до сполуки або її фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомеру або стереоізомеру, який дає спектри на Фіг. 8 і 9. Один із аспектів даного винаходу відноситься до сполуки або її фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомеру або стереоізомеру, який дає спектр на Фіг. 10. У деяких варіантах реалізації даний винахід відноситься до будь-якої з зазначених сполук, при цьому зазначена сполука або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер одержували шляхом екстракції з рослинного матеріалу, як зазначено в даному описі. Наприклад, один із аспектів даного винаходу відноситься до сполуки, отриманої способом, який включає етапи використання адсорбенту для зв'язування зазначеної сполуки; і елюювання зв'язаної сполуки з зазначеного адсорбенту. Виділення/одержання Як зазначено вище, екстракти, збагачені однією або більше сполуками згідно з даним винаходом, можуть бути вилучені з рослинного матеріалу, при цьому зазначений рослинний матеріал може включати плоди, шкірку, сік, листя, деревні стебла тощо. Рослини, що підходять для екстракції, включають гранат звичайний. Способи очищення описані в публікації заявки на патент США 2008/0318877 Seeram et al., повний зміст якої включений у даний опис за допомогою посилання. Суспензія речовини з рослинного матеріалу може бути отримана різними способами, відомими в даній області техніки, наприклад, змішуванням і водною екстракцією. Рослинний матеріал може бути підданий ферментній обробці, включаючи, але не обмежуючись ними, екстрактазу (extractase), пектиназу тощо. Водний розчин, що містить сполуки згідно з даним винаходом, поміщають у колонку з полімерним адсорбентом, яку потім промивають водним буфером з видаленням незв'язаної речовини. Сполуки, які представляють інтерес, зв'язуються зі смолою і можуть бути елюйовані полярним розчинником, наприклад, водою, етанолом, метанолом і ацетоном. Смола має поверхню, на якій адсорбуються сполуки. Клас адсорбційних смол являє собою полімерні зшиті смоли, які складаються зі стиролу і дивінілбензолу, такі як, наприклад, серія смол АМБЕРЛІТ (AMBERLITE), наприклад, АМБЕРЛІТ XAD-16, комерційно доступні від Rohm & Haas Co., Філадельфія, штат Пенсільванія. Інші полімерні перехреснозшиті стиролдивінілбензольні адсорбційні смоли, які підходять для застосування згідно з даним винаходом, являють собою XFS-4257, XFS-4022, XUS-40323 і XUS-40322, усе з яких виготовляє The Dow Chemical Company, Мідленд, штат Мічиган. Можна використовувати комерційно доступну, схвалену Управлінням з контролю якості харчових продуктів і лікарських засобів (FDA) стирол-дивінілбензольну (SDVB) зшиту сополімерну смолу (наприклад, АМБЕРЛІТ XAD-16, описану в патенті США 4297220, включеному в даний опис за допомогою посилання). Дана смола являє собою неіонну гідрофобну зшиту полістирол-дивінілбензольну адсорбуючу смолу. АМБЕРЛІТ XAD-16 має макросітчасту структуру як із неперервною полімерною фазою, так і з неперервною фазою пор. У деяких варіантах реалізації смола, використовувана згідно з даним винаходом, має розмір часток у діапазоні від 100-200 мікронів. Інші адсорбенти, такі як адсорбенти в серії адсорбентів АМБЕРЛІТ XAD, які містять гідрофобні макросітчасті зерна смоли з розміром часток у діапазоні 100-200 мікронів, також можуть бути ефективні в способах згідно з даним винаходом. Більше того, різні варіанти АМБЕРЛІТІВ, такі як серія адсорбентів АМЕРХРОМ CG (AMERCHROM CG), використовувані з 12 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 розміром часток у діапазоні 100-200 мікронів, також можуть підходити для застосування згідно з даним винаходом. Смоли промивають, наприклад, водою або водним буфером з видаленням незв'язаної речовини з екстракту. Для видалення адсорбованих сполук може бути використаний розчинник, такий як етилацетат або бутанол. Елюйовані сполуки по суті очищені в порівнянні з початковою речовиною і можуть бути додатково очищені, наприклад, шляхом хроматографії тощо, або можуть бути прямо використані в речовинах, що представляють інтерес. Кінцеву композицію можна збагачувати, фільтрувати, піддавати діалізу тощо з використанням способів, відомих у даній області техніки. У деяких варіантах реалізації відповідно до даного винаходу запропонована сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер, який по суті не містить інших сполук, які зустрічаються в рослинному матеріалі, з якого його екстрагують. У даному описі термін "по суті не містить" означає, що сполука складається зі значно більшої частки сполуки згідно з даним винаходом або його фармацевтично прийнятної солі, біологічно активного метаболіту, сольвату, гідрату, проліків, енантіомеру або стереоізомеру в порівнянні зі сполукою, яка зустрічається в рослинному матеріалі, з якого її екстрагують, або його екстрактах. У деяких варіантах реалізації відповідно до даного винаходу запропонована сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер у кількості від приблизно 1 мас. % до приблизно 99 мас. %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом з хімічною чистотою більше, ніж приблизно 2 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 10 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 20 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 30 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 40 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 50 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 75 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 80 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 85 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою більше, ніж приблизно 90 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою від приблизно 2 % до 10 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою від приблизно 10 % до 30 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою від приблизно 20 % до приблизно 40 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою від приблизно 30 % до приблизно 50 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою від приблизно 40 % до приблизно 60 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою від приблизно 50 % до приблизно 70 %. У деяких варіантах реалізації одержують сполуку згідно з даним винаходом із хімічною чистотою від приблизно 75 % до 95 %. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, ніж приблизно 50 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, ніж приблизно 25 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, ніж приблизно 20 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, 13 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 ніж приблизно 15 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, ніж приблизно 10 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, ніж приблизно 9 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не не більше, ніж приблизно 8 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, ніж приблизно 7 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, ніж приблизно 6 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У інших варіантах реалізації сполука згідно з даним винаходом або її фармацевтично прийнятна сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер містить не більше, ніж приблизно 5 відсотків площі ВЕРХ інших компонентів рослинного матеріалу, з якого його екстрагують, відносно загальної площі хроматограми ВЕРХ. У деяких варіантах реалізації зазначене рослинне джерело являє собою гранат звичайний. Крім того, сполуки згідно з даним винаходом можуть бути отримані напівсинтетичними способами, використовуючи як початкові речовини інші сполуки, які зустрічаються в екстрактах. Це можна здійснювати шляхом або хімічного, або біологічного перетворення виділеної сполуки або фракції екстракту, або суміші сполук. Хімічне перетворення можна здійснювати шляхом, але не обмежуючись ними, впливу температурою, рН і/або дії різними розчинниками. Біологічне перетворення можна здійснювати шляхом, але не обмежуючись ними, обробки виділеної сполуки або фракції екстракту, або суміші сполук рослинною тканиною, екстрактами рослинної тканини, іншими мікробіологічними організмами або виділеним ферментом будь-якого організму. Екстракти Один із аспектів даного винаходу відноситься до екстракту, який містить зазначену сполуку або сполуки, або їх фармацевтично прийнятні солі, біологічно активні метаболіти, сольвати, гідрати, проліки, енантіомери або стереоізомери. Інший аспект даного винаходу відноситься до екстракту, який містить від приблизно 1 % до приблизно 10 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту, який містить від приблизно 10 % до приблизно 20 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту, який містить від приблизно 20 % до приблизно 30 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту або композиції, який містить від приблизно 30 % до приблизно 40 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту або композиції, яка містить від приблизно 40 % до приблизно 50 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту або композиції, яка містить від приблизно 50 % до приблизно 60 % зазначеної сполуки або сполук, або їх фармацевтично 14 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту або композиції, яка містить від приблизно 60 % до приблизно 70 % зазначеної сполук або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту або композиції, яка містить від приблизно 70 % до приблизно 80 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту або композиції, яка містить від приблизно 80 % до приблизно 90 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту або композиції, яка містить від приблизно 90 % до приблизно 95 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. Інший аспект даного винаходу відноситься до екстракту або композиції, яка містить від приблизно 95 % до приблизно 99 % зазначеної сполуки або сполук, або їх фармацевтично прийнятних солей, біологічно активних метаболітів, сольватів, гідратів, проліків, енантіомеров або стереоізомерів. У деяких варіантах реалізації зазначений екстракт являє собою екстракт граната звичайного. Композиції Сполуки та екстракти згідно з даним винаходом можна застосовувати для одержання лікарських препаратів, нутрицевтиків, лікарських засобів рослинного походження, лікарських засобів на основі трав, добавки до продукту харчування, функціональних продуктів харчування, медичних продуктів харчування, харчових продуктів, косметичних засобів, напоїв тощо. Сполуки і/або екстракти згідно з даним винаходом можуть бути отримані у вигляді композиції з фармацевтично прийнятним носієм. Зазначені лікарські форми містять фізіологічно прийнятні носії, які за своєю природою нетоксичні і не мають терапевтичної дії. Приклади зазначених носіїв включають рослинні білки, соєві білки, іонообмінні речовини, софт-гелі, олії, оксид алюмінію, стеарат алюмінію, лецитин, сироваткові білки, такі як сироватковий альбумін людини, буферні речовини, такі як фосфати, гліцин, сорбінова кислота, сорбат калію, суміші неповних гліцеридів насичених рослинних жирних кислот, воду, солі або електроліти, такі як протамінсульфат, динатрійгідрофосфат, дикалійгідрофосфат, хлорид натрію, солі цинку, колоїдний диоксид кремнію,трисилікат магнію, полівінілпіролідон, речовини на основі целюлози і ПЕГ. Носії для топічних лікарських форм і лікарських форм на основі гелю включають полісахариди, такі як натрійкарбоксиметилцелюлоза або метилцелюлоза, полівінілпіролідон, поліакрилати, поліоксиетилен-поліоксипропіленові блок-сополімери, ПЕГ і деревні воскові спирти. Для всіх типів введення підходящим чином застосовують традиційні депо-форми. Зазначені форми включають, наприклад, мікрокапсули, нанокапсули, ліпосоми, пластирі, інгаляційні форми, спреї для носа, під'язичні таблетки і препарати з уповільненим вивільненням. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 0,01 мкг/мл до приблизно 200 мг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 1 мкг/мл до приблизно 250 мкг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 250 мкг/мл до приблизно 500 мкг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 500 мкг/мл до приблизно 750 мкг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 750 мкг/мл до приблизно 1 мг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 1 мг/мл до приблизно 25 мг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 25 мг/мл до приблизно 50 мг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 50 мг/мл до приблизно 100 мг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 100 мг/мл до приблизно 125 мг/мл. У деяких варіантах реалізації сполуки і/або 15 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 125 мг/мл до приблизно 150 мг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 150 мг/мл до приблизно 175 мг/мл. У деяких варіантах реалізації сполуки і/або екстракти можуть бути отримані в зазначених носіях у концентрації від приблизно 175 мг/мл до приблизно 200 мг/мл. У деяких варіантах реалізації сполуки, композиції і/або екстракти згідно з даним винаходом можуть бути комбіновані з лікарськими засобами на основі трав. Лікарські засоби, що представляють інтерес, на основі трав включають, але не обмежуються ними, активні фракції деяких рослинних препаратів, таких як кропива (кропива дводомна (Urtica dioica)), куркума (куркума довга (Curcuma longa)), чай; продукти морських або наземних тварин, наприклад, біологічно активні ліпіди новозеландського зеленого губчатого молюска (Perna canaliculus) або ему (Dromaius nova hollandiae). У деяких варіантах реалізації сполуки, композиції і/або екстракти згідно з даним винаходом можуть бути отримані у вигляді лікарських засобів рослинного походження. У даному описі термін "лікарський засіб рослинного походження" являє собою продукт, який складається з речовин рослинного походження, які можуть включати рослинні речовини, водорості, макроскопічні грибки або їх комбінації, і який призначений для застосування в діагностиці, вилікуванні, пом'якшенні, лікуванні або попередженні захворювання у людей. У деяких варіантах реалізації лікарський засіб рослинного походження може бути доступним у вигляді (але не обмеженим ними) розчину (наприклад, чай), порошку, таблетки, капсули, еліксиру, топічного засобу або ін'єкції. У деяких варіантах реалізації сполуки, композиції і/або екстракти згідно з даним винаходом можуть бути отримані у вигляді нутрицевтиків. Суміші нутрицевтиків, що представляють інтерес, включають продукти харчування для застосування у ветеринарії або у людей, включаючи батончики для здорового харчування, напої і добавки до напоїв тощо. Дані продукти посилені включенням біологічно активної сполуки, композиції і/або екстракту згідно з даним винаходом. Наприклад, при лікуванні нейродегенеративних захворювань, таких як хвороба Альцгеймера, звичайний раціон харчування пацієнта може бути доповнений складом нутрицевтиків, який приймається регулярно. Зазначені нутрицевтики можуть містити або не містити калорії. У даному описі термін "нутрицевтична композиція" включає продукт харчування, харчовий продукт, харчову добавку, поживну добавку або композицію добавок для продукту харчування або харчового продукту. Таким чином, у іншому варіанті реалізації даний винахід відноситься до нутрицевтика, при цьому зазначений нутрицевтик являє собою продукт харчування, харчовий продукт, харчову добавку, поживну добавку або композицію добавок для продукту харчування або харчового продукту. У даному описі термін "продукт харчування" відноситься до будь-якої їжі або корму, що підходить для споживання людьми або тваринами. Продукт харчування може являти собою готовий і упакований продукт харчування (наприклад, маіонез, заправку до салату, хліб або сир) або корм для тварин (наприклад, екструдований і гранульований корм для тварин, грубий змішаний корм або харчова композиція для свійських тварин). У даному описі термін "харчовий продукт" відноситься до будь-якої речовини, придатної для споживання людиною або твариною. Продукти харчування або харчові продукти, наприклад, являють собою напої, такі як безалкогольні і алкогольні напої, а також рідкий склад для додавання в питну воду і рідку їжу, безалкогольні напої являють собою, наприклад, прохолодні напої, спортивні напої, фруктові соки, такі як, наприклад, апельсиновий сік, яблучний сік і грейпфрутовий сік; лимонади, чаї, ароматизовані напої, молоко, замінники молока та інші молочні напої, такі як, наприклад, йогуртові напої, і дієтичні напої. У іншому варіанті реалізації продукти харчування або харчові продукти відносяться до твердих або напіврідких продуктів харчування, які містять композицію згідно з даним винаходом. Дані форми можуть включати, але не обмежуються ними, хлібобулочні вироби, такі як батончики, торти, печиво, пудинги, молочні продукти, кондитерські вироби, закуски або заморожені кондитерські вироби, або новинки (наприклад, морозиво, молочні коктейлі), готові заморожені страви, солодощі, закуски (наприклад, чіпси), рідку їжу, таку як супи, пастоподібні продукти, соуси, заправки до салатів, готові м'ясні продукти, сир, йогурт і будь-які інші продукти, які містять жир або олію, і компоненти харчових продуктів (наприклад, пшеничне борошно). Термін "продукти харчування" або "харчові продукти" також включає функціональні продукти харчування і готові продукти харчування, при цьому останні відносяться до будь-якого заздалегідь упакованого продукту харчування, схваленого для споживання людиною. У деяких варіантах реалізації нутрицевтичний склад може додатково містити куркумін або катехіни чаю, такі як галат епігалокатехіну (EGCG), L-тіаніни і ресвератрол. У деяких варіантах 16 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 реалізації нутрицевтичний склад може містити екстракти ягоди асаі, чорниці, журавлини, ожини, малини, бузини, звіробою, гінкго білоби, кави, какао, винних сортів винограду, екстракти виноградних кісточок, екстракти сої, фітоестрогени сої або комбінації зазначених речовин. У деяких варіантах реалізації сполуки, композиції і/або екстракти згідно з даним винаходом можуть бути отримані у вигляді харчових добавок. Харчові добавки згідно з даним винаходом можуть бути доставлені в будь-якому підходящому форматі. У деяких варіантах реалізації харчові добавки приготовляють для пероральної доставки. Компоненти харчової добавки згідно з даним винаходом утримуються в прийнятних наповнювачах і/або носіях для перорального споживання. Фактична форма носія й, таким чином, самої харчової добавки, не має критичного значення. Носій може являти собою рідину, гель, желатинову капсулу, капсулу, порошок, тверду таблетку (з покриттям або без покриття), чай тощо. Харчова добавка переважно перебуває в формі таблетки або капсули і найбільш переважно в формі твердої (з оболонкою) желатинової капсули. Підходящі наповнювачі і/або носії включають мальтодекстрин, карбонат кальцію, дикальційфосфат, трикальційфосфат, мікрокристалічну целюлозу, декстрозу, рисове борошно, стеарат магнію, стеаринову кислоту, кроскармелозу натрію, натрію крохмалю гліколят, кросповідон, сахарозу, рослинні камеді, лактозу, метилцелюлозу, повідон, карбоксиметилцелюлозу, кукурудзяний крохмаль тощо (включаючи суміші зазначених речовин). Типові носії включають карбонат кальцію, стеарат магнію, мальтодекстрин і суміші зазначених речовин. Різні компоненти і наповнювач і/або носій змішують і формують із одержанням необхідної форми з застосуванням традиційних технологій. На таблетку або капсулу згідно з даним винаходом може бути нанесене ентеросолюбильне покриття, яке розчиняється при рН приблизно від 6,0 до 7,0. Підходяще ентеросолюбильне покриття, яке розчиняється в тонкому кишечнику, а не в шлунку, являє собою ацетатфталат целюлози. Додатковий докладний опис технологій одержання і введення можна знайти в останньому виданні Remington's Pharmaceutical Sciences (Maack Publishing Co., Easton, Pa.). У інших варіантах реалізації харчову добавку одержують у вигляді порошку або рідини, яка підходить для додавання споживачем у продукт харчування або напій. Наприклад, у деяких варіантах реалізації харчова добавка може бути введена індивідуумові в формі порошку, наприклад, для використання шляхом змішування з напоєм або шляхом перемішування з напіврідким продуктом харчування, таким як пудинг, топінг, соус, пюре, каша або заправка до салатів, наприклад, або шляхом іншого додавання в їжу; наприклад, укладена в кришки контейнерів для харчового продукту або напою для вивільнення безпосередньо перед споживанням. Харчова добавка може містити один або більше інертних компонентів, зокрема, якщо необхідно обмежувати кількість калорій, які додаються в раціон харчування за допомогою зазначеної харчової добавки. Наприклад, харчова добавка згідно з даним винаходом також може містити додаткові компоненти, включаючи, наприклад, трави, вітаміни, мінерали, підсилювачі, барвники, підсолоджувачі, ароматизатори, інертні компоненти тощо. У деяких варіантах реалізації харчові добавки додатково містять вітаміни і мінерали, включаючи, але не обмежуючись ними, фосфат або ацетат кальцію, трьохосновний; фосфат калію, двоосновний; сульфат або оксид магнію; сіль (хлорид натрію); хлорид або ацетат калію; аскорбінову кислоту; ортофосфат заліза (III); ніацин; нікотинамід; сульфат або оксид цинку; пантотенат кальцію; глюконат міді; рибофлавін; бета-каротин; гідрохлорид піридоксину; мононітрат тіаміну; фолієву кислоту; біотин; хлорид або піколонат хрому; йодид калію; селенат натрію; молібдат натрію; філохінон; вітамін D3; ціанокобаламін; селеніт натрію; сульфат міді; вітамін А; вітамін С; інозит; йодид калію; L-триптофан, нікотинову кислоту, нікотинамід, нікотинамідрибозид; жирну кислоту омега-3 (таку як DHA, EPA і ALA); антоціани; ізофлавони; холін; уридинмонофосфат (УМФ); фосфоліпіди сої; фосфатидилсерин; S-аденозилметіонін (SAM); ацетил-L-карнітин (ALCAR); солі магнію; ацетат магнію; хлорид магнію; цитрат магнію; лактат магнію; глюконат магнію; і підолат магнію. У інших варіантах реалізації згідно з даним винаходом запропоновані поживні добавки (наприклад, енергетичні батончики або батончики, або напої, які являють собою замінники їжі), які містять сполуку, композицію і/або екстракт згідно з даним винаходом. Поживна добавка може служити як замінник їжі або закуски і, як правило, забезпечує калоріями. Однак, як зазначено вище, також можуть бути використані добавки, що не містять калорії. У деяких варіантах реалізації поживні добавки забезпечують вуглеводами, білками і жирами в збалансованих кількостях. Поживна добавка може додатково містити вуглевод, простий, із середньою довжиною ланцюга, або полісахариди, або їх комбінацію. Простий цукор може бути підібраний відносно необхідних органолептичних властивостей. Сирий кукурудзяний крохмаль є одним із прикладів складного вуглеводу. Якщо необхідно, щоб він зберігав структуру з високою молекулярною масою, його варто включати тільки в харчові склади або їх частини, які не 17 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 готують або не піддають тепловій обробці, тому що тепло буде розщеплювати складний вуглевод на прості вуглеводи, при цьому зазначені прості вуглеводи являють собою моно- або дисахариди. Поживна добавка містить, в одному з варіантів реалізації, комбінації джерел вуглеводу з трьома рівнями довжини ланцюгів (прості, середні та складні; наприклад, сахароза, мальтодекстрини і сирий кукурудзяний крохмаль). Джерела білка для включення в поживну добавку згідно з даним винаходом можуть являти собою будь-який підходящий білок, використовуваний у поживних складах, і можуть включати сироватковий білок молока, концентрат сироваткового білка молока, суху молочну сироватку, яйце, соєве борошно, соєвий білок соєвого молока, ізолят соєвого білка, казеїнат (наприклад, казеїнат натрію, казеїнат натрію кальцію, казеїнат кальцію, казеїнат калію), білок тваринного і рослинного походження та їх гідролізати або суміші. Соєвий білок має майже ідеальний PDCAA, коефіцієнт засвоюваності білка, скоректований за амінокислотним складом (PDCAAS), і за даним критерієм соєвий білок є поживним еквівалентом м'яса та яєць для росту і здоров'я людини. Дані білки мають високу біологічну цінність; тобто вони містять високу частку незамінних амінокислот. Див. Modern Nutrition in Health and Disease, eighth edition, Lea & Febiger, publishers, 1986, зокрема, том 1, сторінки 30-32. Поживна добавка також може містити інші компоненти, такі як один із або комбінація інших вітамінів, мінералів, антиоксидантів, волокон і інших харчових добавок (наприклад, білок, амінокислоти, холін, лецитин, омега-3 жирні кислоти та інші, розглянуті в даному описі). Вибір одного або декількох даних компонентів є питанням приготування складу, зовнішнього вигляду, переваг споживача і кінцевого споживача. Кількості даних компонентів, які додаються в харчові добавки згідно з даним винаходом, відомі фахівцеві. Додаткові вітаміни і мінерали, які можуть бути додані, включають, але не обмежуються ними, фосфат або ацетат кальцію, трьохосновний; фосфат калію, двоосновний; сульфат або оксид магнію; сіль (хлорид натрію); хлорид або ацетат калію; аскорбінову кислоту; ортофосфат заліза (III); антоціани; нікотинамідрибозид; солі магнію; нікотинамід; сульфат або оксид цинку; пантотенат кальцію; глюконат міді; рибофлавін; бета-каротин; гідрохлорид піридоксину; мононітрат тіаміну; фолієву кислоту; біотин; хлорид або піколонат хрому; йодид калію; селенат натрію; молібдат натрію; філохінон; вітамін D3; ціанокобаламін; селеніт натрію; сульфат міді; вітамін А; вітамін С; інозит; йодид калію. Поживна добавка може бути отримана в різних формах і безліччю способів одержання. У одному з варіантів реалізації для одержання харчового батончика готують рідкі компоненти; сухі компоненти додають із рідкими компонентами в міксер і змішують до одержання тіста; зазначене тісто поміщають у екструдер і екструдують; екструдоване тісто розрізають із одержанням підходящих довжин; і продукт охолоджують. Батончики можуть містити інші поживні речовини і наповнювачі для підсилення смаку, крім компонентів, зокрема, перерахованих у даному описі. Для фахівця в даній області техніки очевидно, що інші компоненти можуть бути додані до компонентів, зазначених у даному описі, наприклад, наповнювачі, емульгатори, консерванти для обробки або одержання поживної добавки. Крім того, ароматизатори, барвники, спеції, горіхи тощо, можуть бути включені в склади, зазначені в даному описі. Ароматизатори можуть перебувати в формі ароматизованих екстрактів, ефірних олій, шоколадних ароматизаторів, ароматизатора арахісове масло, крихт печива, хрусткого рису, ванілі або будь-якого комерційно доступного ароматизатора. Приклади підходящого ароматизатора включають, але не обмежуються ними, чистий екстракт анісу, імітаційний екстракт банана, імітаційний екстракт вишні, шоколадний екстракт, чистий екстракт лимона, чистий екстракт апельсина, чистий екстракт м'яти, імітаційний екстракт ананаса, імітаційний екстракт рому, імітаційний екстракт полуниці або чистий екстракт ванілі; або ефірні олії, такі як мелісова олія, лаврова олія, бергамотова олія, кедрова олія, олія волоського горіха, вишнева олія, корична олія, гвоздикова олія або олія перцевої м'яти. Емульгатори можуть бути додані для стабільності складів. Приклади підходящих емульгаторів включають, але не обмежуються ними, лецитин (наприклад, яйця або сої) і/або моно- і дигліцериди. Інші емульгатори очевидні фахівцеві в даній області техніки і вибір підходящого емульгатора (емульгаторів) буде почасти залежати від складу і кінцевого продукту. Консерванти також можуть бути додані в склади для продовження строку придатності продукту. Наприклад, використовують консерванти, такі як сорбат калію, сорбат натрію, бензоат калію, бензоат натрію або кальцій-динатрієва сіль ЕДТА. Крім вуглеводів, описаних вище, склади можуть містити натуральні або штучні (переважно низькокалорійні) підсолоджувачі, наприклад, сахариди, цикламати, аспартамін, аспартам, ацесульфам К і/або сорбіт. Зазначені штучні підсолоджувачі можуть бути необхідні, якщо 18 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 поживна добавка призначена для споживання індивідуумом із надлишковою вагою або ожирінням, або індивідуумом з діабетом II типу, схильним до гіперглікемії. Більше того, полівітамінна і мінеральна добавка може бути додана в склади згідно з даним винаходом для одержання підходящої кількості необхідної поживної речовини, яка відсутня в деяких раціонах харчування. Зазначена полівітамінна і мінеральна добавка також може підходити для попередження захворювань і захисту від втрат і дефіцитів поживних речовин, обумовлених способом життя. Доза та співвідношення сполуки (сполук) згідно з даним винаходом, які вводяться за допомогою зазначених складів, звичайно, будуть варіюватися залежно від відомих факторів, таких як фізіологічні характеристики конкретної композиції і режим та спосіб її введення; вік, стан здоров'я і маса тіла реципієнта; характер і ступінь симптомів; вид супутнього лікування; частота лікування; і бажаний ефект, що може бути визначений експертом у даній області за допомогою звичайних досліджень або за допомогою звичайного уявлення стосовно одержання нутрицевтичних композицій. У деяких варіантах реалізації склад містить у одній порції кількість від 1 мг до 10000 мг активного компонента (компонентів), наприклад, сполуки або сполук згідно з даним винаходом. У деяких варіантах реалізації склад містить у одній порції кількість від 1 мг до 2500 мг активного компонента (компонентів). У деяких варіантах реалізації склад містить в одній порції кількість від 2500 мг до 5000 мг активного компонента (компонентів). У деяких варіантах реалізації склад містить в одній порції кількість від 5000 мг до 7500 мг активного компонента (компонентів). У деяких варіантах реалізації склад містить в одній порції кількість від 7500 мг до 10000 мг активного компонента (компонентів). Для косметичних складів сполуки, композиції і/або екстракти згідно з даним винаходом можуть містити корисні для шкіри речовини. Зазначені речовини включають естрадіол; прогестерон; прегнанолон (pregnanalone); коензим Q10; метилсоланометан (methylsolanomethane) (МСМ); пептид міді (екстракт міді); екстракт планктонів (фітосома); гліколеву кислоту; койєву кислоту; аскорбілпальмітат; повністю-транс-ретинол; азелаїнову кислоту; саліцилову кислоту; бропароестрол (broparoestrol); естрон; андростендіон; андростандіоли тощо. Стероїди, як правило, будуть присутні в концентрації всього менш, ніж приблизно 2 % від маси композиції, тоді як інші корисні для шкіри речовини можуть бути присутнім на більш високих рівнях, наприклад, приблизно від 10 до 15 %. Сполуки, композиції і/або екстракти згідно з даним винаходом можуть містити косметично прийнятний носій для виконання функції розріджувача, диспергатор або носій для полегшення розподілу при нанесенні композиції на шкіру. Носії, крім або на додаток до води, можуть включати рідкі або тверді пом'якшуючі речовини, розчинники, зволожуючі речовини, загущувачі і порошки. Косметично прийнятний носій, як правило, буде становити від 0,1 % або 5 % до 99,9 %, переважно від 25 % до 80 % від маси композиції і може при відсутності інших косметичних допоміжних речовин становити баланс композиції. Відповідно до даного винаходу сполука, композиція і/або екстракт згідно з даним винаходом можуть бути отримані у вигляді фармацевтичних композицій, таких як композиції, які, зокрема, можуть підходити для лікування нейродегенеративних захворювань. Зазначені композиції містять сполуку згідно з даним винаходом або її фармацевтично прийнятну сіль, біологічно активний метаболіт, сольват, гідрат, проліки, енантіомер або стереоізомер, і фармацевтично прийнятний носій і/або наповнювач. Композиції згідно з даним винаходом можуть бути введені різними способами залежно від передбачуваного застосування, як добре відомо в даній області техніки. Наприклад, якщо композиції згідно з даним винаходом призначені для перорального введення, вони можуть бути отримані у вигляді таблеток, капсул, гранул, порошків або сиропів. Як альтернатива, склади згідно з даним винаходом можуть бути введені парентерально у вигляді ін'єкцій (внутрішньовенних, внутрішньом'язових або підшкірних), препаратів для краплинного вливання або супозиторіїв. Для застосування способом введення через слизову оболонку ока, композиції згідно з даним винаходом можуть бути отримані у вигляді очних крапель або очних мазей. Дані склади можуть бути отримані традиційними способами і, за необхідності, композиції можуть бути змішані з будь-якою традиційною добавкою, такою як наповнювач, зв'язувальна речовина, розпушувач, змащуюча речовина, коригувальна речовина, солюбілізуючий агент, суспензіонна допоміжна речовина, емульгатор або речовина для нанесення покриття. У складах згідно з даним винаходом змочувальні агенти, емульгатори і змащуючі речовини, такі як лаурилсульфат натрію і стеарат магнію, а також барвники, роздільні речовини, речовини 19 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 для нанесення покриття, підсолоджувачі, ароматизатори і віддушки, консерванти і антиоксиданти можуть бути присутніми в отриманих агентах. Розглянуті склади можуть підходити для перорального, назального, топічного (включаючи трансбукальне і сублінгвальне), ректального, вагінального введення, введення за допомогою аерозолів і/або парентерального введення. Склади можуть бути зручно представлені в дозованій лікарській формі і можуть бути отримані будь-якими способами, добре відомими в області фармації. Кількість композиції, яка може бути комбінована з речовиною-носієм для одержання однократної дози, буде варіюватися залежно від суб'єкта, що виліковується, і конкретного способу введення. Способи одержання даних складів включають етап приведення композицій згідно з даним винаходом в асоціацію з носієм і, можливо, одним або більше додатковими компонентами. У цілому, склади одержують шляхом рівномірного і ретельного приведення агентів в асоціацію з рідкими носіями або тонкоподрібненими твердими носіями, або обома, а потім, за необхідності, шляхом формування продукту. Склади, які підходять для перорального введення, можуть перебувати в формі капсул, крохмальних капсул, пігулок, таблеток, пастилок (з використанням ароматизованої основи, як правило, сахарози і камеді або трагаканту), порошків, гранул або у вигляді розчину, або суспензії у водній або неводній рідині, або у вигляді рідкої емульсії олія-в-воді або вода-в-олії, або у вигляді еліксиру або сиропу, або у вигляді пастилок (з використанням інертної основи, такої як желатин і гліцерин, або сахароза і камедь), при цьому кожна з зазначених форм містить заздалегідь певну кількість розглянутої композиції як активний компонент. Композиції згідно з даним винаходом також можуть бути введені у вигляді болюсу, електуарію або пасти. У твердих лікарських формах для перорального введення (капсулах, таблетках, пігулках, драже, порошках, гранулах тощо) розглянута композиція перебуває в суміші з одним або більше фармацевтично прийнятними носіями, такими як цитрат натрію або дикальційфосфат, і/або з кожною з наступних речовин: (1) наповнювачі або сухі розріджувачі, такі як крохмалі, лактоза, сахароза, глюкоза, маніт і/або кремнієва кислота; (2) зв'язувальні речовини, такі як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, сахароза і/або камедь; (3) зволожуючі речовини, такі як гліцерин; (4) розпушувачі, такі як агар-агар, карбонат кальцію, картопляний або тапіоковий крохмаль, альгінова кислота, деякі силікати і карбонат натрію; 5) інгібітори розчинення, такі як парафін; (6) прискорювачі абсорбції, такі як сполуки четвертинного амонію; (7) змочувальні агенти, такі як, наприклад, ацетиловий спирт і моностеарат гліцерину; (8) абсорбенти, такі як каолінова і бентонітова глина; (9) змащуючі речовини, такі як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію і суміші зазначених сполук; і (10) барвники. У випадку капсул, таблеток і пігулок композиції також можуть містити буферні агенти. Тверді композиції схожого типу також можна застосовувати як наповнювачі в м'якій і твердій желатиновій капсулах із застосуванням таких наповнювачів, як лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі тощо. Таблетка може бути отримана шляхом пресування або формування, можливо разом з одним або більше додатковими компонентами. Пресовані таблетки можуть бути отримані з використанням зв'язувальної речовини (наприклад, желатину або гідроксипропілметилцелюлози), змащуючої речовини, інертного розріджувача, консерванту, розпушувача (наприклад, натрію крохмалю гліколяту або зшитої натрійкарбоксиметилцелюлози), поверхнево-активної або диспергуючої речовини. Формовані таблетки можуть бути отримані шляхом формування в підходящому пристрої суміші розглянутої композиції, змоченої інертним рідким розріджувачем. Таблетки та інші тверді лікарські форми, такі як драже, капсули, пігулки і гранули, можуть являти собою таблетки з рисками або можуть бути отримані з покриттями і оболонками, такими як ентеросолюбильне покриття та інші покриття, добре відомі в області одержання фармацевтичних препаратів. Рідкі лікарські форми для перорального введення включають фармацевтично прийнятні емульсії, мікроемульсії, розчини, суспензії, сиропи та еліксири. Крім розглянутої композиції, зазначені рідкі лікарські форми можуть містити інертні розріджувачі, зазвичай застосовувані в даній області техніки, такі як, наприклад, вода або інші розчинники, солюбілізуючі агенти і емульгатори, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, олії (зокрема, бавовняна, арахісова, кукурудзяна, олія паростків, оливкова, касторова і кунжутна олія), гліцерин, тетрагідрофуриловий спирт, поліетиленгліколі і сорбітанові ефіри жирних кислот, і суміші зазначених речовин. Суспензії, крім розглянутої композиції, можуть містити суспендуючі агенти, такі як, наприклад, етоксильовані ізостеарилові спирти, поліоксиетиленсорбіт і сорбітанові ефіри, 20 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 мікрокристалічна целюлоза, метагідроксид алюмінію, бентоніт, агар-агар і трагакант, і суміші зазначених речовин. Склади для ректального або вагінального введення можуть бути представлені у вигляді супозиторію, який може бути отриманий шляхом змішування розглянутої композиції з одним або більше підходящими неподразнюючими наповнювачами або носіями, включаючи, наприклад, олію какао, поліетиленгліколь, віск для супозиторіїв або саліцилат, і який є твердим при кімнатній температурі, але стає рідким при температурі тіла, а, отже, буде плавитися в порожнині тіла і вивільняти активний агент. Склади, підходящі для вагінального введення, також включають песарії, тампони, креми, гелі, пасти, піни або склади у вигляді спрею, які містять зазначені носії, і які, як відомо в даній області техніки, є підходящими. Лікарські форми для трансдермального введення розглянутої композиції включають порошки, спреї, мазі, пасти, креми, лосьіони, гелі, розчини, пластирі та інгаляційні препарати. Активний компонент може бути змішаний у стерильних умовах із фармацевтично прийнятним носієм і будь-якими консервантами, буферами або пропелентами, які можуть бути необхідні. Крім розглянутої композиції, зазначені мазі, пасти, креми і гелі можуть містити наповнювачі, такі як жири тваринного і рослинного походження, олії, воски, парафіни, крохмаль, трагакант, похідні целюлози, поліетиленгліколі, силікони, бентоніти, кремнієва кислота, тальк і оксид цинку або суміші зазначених речовин. Крім розглянутої композиції, порошки і спреї можуть містити наповнювачі, такі як лактоза, тальк, кремнієва кислота, гідроксид алюмінію, силікати кальцію і поліамідний порошок або суміші даних речовин. Спреї можуть додатково містити традиційні пропеленти, такі як хлорфторвуглеводні і летучі вуглеводні, які не містять замісників, таких як бутан і пропан. Композиції згідно з даним винаходом як альтернатива можуть бути введені за допомогою аерозолю. Це здійснюють шляхом одержання водного аерозолю, ліпосомального препарату або твердих часток, які містять сполуку. Може бути використана неводна (наприклад, із фторвуглецевим пропелентом) суспензія. Можна застосовувати ультразвукові розпилювачі, оскільки вони мінімізують піддавання агента зсуву, який може призводити до розпаду сполук, які містяться в розглянутих композиціях. Зазвичай, водний аерозоль одержують шляхом одержання водного розчину або суспензії розглянутої композиції разом із традиційними фармацевтично прийнятними носіями і стабілізаторами. Зазначені носії і стабілізатори варіюються в залежності від вимог конкретної розглянутої композиції, але, як правило, включають неіонні поверхнево-активні речовини (Твіни (Tweens), Плюроніки® (Pluronics®) або поліетиленгліколь), безпечні білки, такі як сироватковий альбумін, сорбітанові ефіри, олеїнову кислоту, лецитин, амінокислоти, такі як гліцин, буфери, солі, цукри або цукрові спирти. Аерозолі, як правило, одержують із ізотонічних розчинів. Композиції згідно з даним винаходом, які підходять для парентерального введення, містять розглянуту композицію в комбінації з одним або більше фармацевтично прийнятними стерильними ізотонічними водними або неводними розчинами, дисперсіями, суспензіями або емульсіями, або стерильними порошками, які можуть бути відновлені з одержанням стерильних розчинів або дисперсій для ін'єкцій безпосередньо перед застосуванням, які можуть містити антиоксиданти, буфери, бактеріостати, розчинені речовини, що приводять склад до стану ізотонічності з кров'ю передбачуваного реципієнта, або суспендуючі агенти або загущувачі. Приклади підходящих водних і неводних носіїв, які можуть бути використані в композиціях згідно з даним винаходом, включають воду, етанол, поліоли (такі як гліцерин, пропіленгліколь, поліетиленгліколь тощо) і підходящі суміші зазначених речовин, рослинні олії, такі як оливкова олія, і органічні ефіри для ін'єкцій, такі як етилолеат. Підходяща текучість може бути збережена, наприклад, шляхом застосування матеріалів для покриття, таких як лецитин, шляхом підтримки необхідного розміру часток у випадку дисперсій і шляхом застосування поверхнево-активних речовин. У деяких варіантах реалізації композиції одержують у вигляді таблетки, пігулки, капсули або іншого підходящого складу для прийому всередину з одержанням терапевтичної дози в 10 складах для прийому всередину або менше. У іншому прикладі терапевтичну дозу одержують у 20, 15, 10, 5 або 3 складах для прийому всередину. Композиції згідно з даним винаходом можуть перебувати в формі дисперсного сухого порошку для доставки через легені. Композиції сухих порошків можуть бути отримані способами, відомими в даній області техніки, такими як ліофілізація і розмел на струминному млині, описані в публікації міжнародної заявки WO 91/16038 і описані в патенті США 6921527, обидва з яких включені в даний опис за допомогою посилання. Композиція згідно з даним винаходом може бути поміщена в підходящий контейнер для дози в кількості, достатній для забезпечення суб'єкта лікуванням однократними дозами. Зазначений контейнер для дози може 21 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 являти собою контейнер, який підходить для поміщення в підходящий пристрій для інгаляції для забезпечення аерозолізації композиції сухого порошку шляхом диспергування в потоці газу з утворенням аерозолю, а потім утримання отриманого таким чином аерозолю в камері з приєднаним загубником для наступного вдихання суб'єктом, який потребує лікування. Зазначений контейнер для дози включає будь-який контейнер, який містить композицію, відомий у даній області техніки, такий як желатинові або пластикові капсули зі знімною частиною, яка дозволяє направляти потік газу (наприклад, повітря) в контейнер для диспергування композиції сухого порошку. Прикладами зазначених контейнерів служать контейнери, представлені в патенті США 4227522; патенті США 4192309; і патенті США 4105027. Підходящі контейнери також включають контейнери, які використовуються спільно з порошковим інгалятором марки Glaxo's Ventolin® Rotohaler або порошковим інгалятором марки Fison's Spinhaler®. Інший підходящий контейнер для однократних доз, який забезпечує чудовий захист від вологи, отримують із ламінату з алюмінієвої фольги та пластику. Порошок на основі лікарського засобу поміщають за масою або за об'ємом при зниженому тиску в формувальну фольгу і герметично закривають покриваючим ламінатом із фольги та пластику. Зазначений контейнер для використання з пристроєм для інгаляції порошку описаний у патенті США 4778054, і його використовують із Glaxo's Diskhaler® (патенти США 4627432; 4811731; і 5035237); усі чотири з зазначених патентів США, наведені в цьому реченні, включені в даний опис за допомогою посилання. Терміни "трансдермальна система доставки", "трансдермальний пластир" або "пластир" відносяться до адгезивної системи, яка поміщається на шкіру для доставки дози лікарського засобу (засобів) із уповільненим вивільненням шляхом переходу з зазначеної лікарської форми через шкіру для поширення за допомогою великого кола кровообігу. Трансдермальні пластирі являють собою загальноприйняту технологію, використовувану для доставки широкого спектра лікарських засобів, включаючи, але не обмежуючись ними, скополамін від укачування, нітрогліцерин для лікування стенокардії, клофелін від гіпертонії, естрадіол при показаннях у період постменопаузи і нікотин для припинення паління. Пластирі, що підходять для застосування згідно з даним винаходом, включають, але не обмежуються ними, (1) пластир матричного типу; (2) пластир резервуарного типу; (3) багатошаровий пластир типу "лікарський засіб у адгезиві"; і (4) цільний пластир типу "лікарський засіб у адгезиві"; TRANSDERMAL AND TOPICAL DRUG DELIVERY SYSTEMS, стор. 249-297 (Tapash K. Ghosh et al. eds., 1997), включений у даний опис за допомогою посилання. Дані пластирі добре відомі в даній області техніки й, у цілому, комерційно доступні. У деяких варіантах реалізації фармацевтична композиція містить будь-яку розглянуту сполуку і/або екстракт, отриманий у кількості, достатній для лікування помірного когнітивного розладу, хвороби Альцгеймера, покращення довгострокової пам'яті, короткочасної пам'яті, декларативної пам'яті, процедурної пам'яті або когнітивних процесів, таких як увага, виконавча функція, час реакції або процес навчання в пацієнта на статистично значущу величину при оцінці стандартизованим тестом на визначення показників. У деяких варіантах реалізації фармацевтична композиція містить одну або більше розглянутих сполук і/або екстрактів, отриманих у кількості, достатній для покращення довгострокової пам'яті у пацієнта на статистично значущу величину при оцінці за допомогою одного або більше з наступних тестів: Тест Рея на слухомовне заучування (Rey Auditory and Verbal Learning Test, RAVLT), Кембриджська батарея тестів нейропсихологічної оцінки (Cambridge Neuropsychological Test Automated Battery, CANTAB); Дитяча шкала оцінки пам'яті (Children's Memory Scale, CMS); Тест для оцінки контекстуальної пам'яті (Contextual Memory Test); Тест для оцінки безперервної впізнавальної пам'яті (Continuous Recognition Memory Test, CMRT); Нейропсихологічна шкала пам'яті Денмана (Denman Neuropsychology Memory Scale); Оцінка пам'яті (Fuld Object Memory Evaluation, FOME); Тест "Пам'ять на фігури" ГрехемаКендала (Graham-Kendall Memory for Designs Test); Тест для оцінки пам'яті (Guild Memory Test); Батарея тестів навчання і пам'яті (Learning and Memory Battery, LAMB); Клінічна шкала самооцінки пам'яті (Memory Assessment Clinic Self-Rating Scale, MAC-S); Шкали оцінки пам'яті (Memory Assessment Scales, MAS); Тест Рендта для оцінки пам'яті (Randt Memory Test); Тест для оцінки впізнавальної пам'яті (Recognition Memory Test, RMT); Поведінковий тест оцінки пам'яті Рівермід (Rivermead Behavioral Memory Test); Варіант Рассела шкали пам'яті Векслера (Russell's Version of the Wechsler Memory Scale, RWMS); Тест для оцінки пам'яті і навчання (Test of Memory and Learning, TOMAL); Шкала пам'яті Вермонта (Vermont Memory Scale, VMS); Шкала пам'яті Векслера (Wechsler Memory Scale); і Батарея оцінки пам'яті і навчання (Wide Range Assessment of Memory and Learning, WRAML); Асоціація ім'я-прізвище (First-Last Name Association) (Youngjohn J. R., et al., Archives of Clinical Neuropsychology 6: 287-300 (1991)); 22 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 Асоціація ім'я-людина (Name-Face Association); Перерозглянута шкала пам'яті Векслера (Wechsler Memory Scale-Revised); (Wechsler, D., Wechsler Memory Scale-Revised Manual, NY, N.Y., The Psychological Corp. (1987)); Каліфорнійський тест вербального навчання – друге видання (California Verbal Learning Test-Second Edition) (Delis, D. C., et al., The Californian Verbal Learning Test, Second Edition, Adult Version, Manual, San Antonio, Tex.: The Psychological Corporation (2000)); Розпізнавання облич (Facial Recognition) (з затримкою, невідповідність зразку (delayed non-matching to sample)); Комп'ютеризована система оцінки когнітивних процесів (Cognitive Drug Research (CDR) Computerized Assessment Battery-Wesnes;); Тест Бушке на селективне запам'ятовування (Buschke's Selective Reminder Test) (Buschke, H., et al., Neurology 24:1019-1025 (1974)); Тест набору номера телефону (Telephone Dialing Test); і Перероблений короткий зорово-просторовий тест на запам'ятовування (Brief Visuospatial Memory Test-Revised). Набори Відповідно до даного винаходу також запропоновані набори для зручного і ефективного здійснення способів згідно з даним винаходом. Зазначені набори містять будь-яку розглянуту сполуку, композицію і/або екстракт, та засіб для полегшення дотримання способів згідно з даним винаходом. Зазначені набори забезпечують зручні і ефективні засоби для гарантії того, що суб'єкт, який виліковується, приймає підходящу активну речовину в правильному дозуванні належним чином. Дані засоби дотримання в зазначених наборах включають будь-який засіб, що полегшує введення активних речовин у відповідності зі способом згідно з даним винаходом. Зазначені засоби дотримання включають інструкції, упакування і засоби дозування, та їх комбінації. Компоненти набору можуть бути упаковані або для ручного, або частково чи повністю автоматизованого здійснення зазначених способів. У інших варіантах реалізації, що включають набори, даний винахід передбачає набір, який містить композиції згідно з даним винаходом і, можливо, інструкції з їх застосування. Наприклад, згідно з даним винаходом також запропоновані набори, які містять щонайменше одну дозу розглянутої сполуки, композиції і/або екстракту і часто багато доз, та інші матеріали для схеми лікування. Наприклад, в одному з варіантів реалізації набір згідно з даним винаходом містить достатню кількість розглянутої композиції на п'ять-тридцять днів і, можливо, пристрій і допоміжні матеріали, необхідні для вимірювання одного або більше показників, які стосуються схеми лікування. У іншому варіанті реалізації набори згідно з даним винаходом містять усі речовини і допоміжні матеріали, включаючи розглянуті композиції, для здійснення будь-яких способів згідно з даним винаходом. У ще одному варіанті реалізації набори згідно з даним винаходом, описані вище, додатково містять інструкції з застосування і введення розглянутих композицій. У одному з варіантів реалізації даний винахід являє собою фармацевтичний набір, який містить одну або більше розглянутих сполук, композицій і/або екстрактів у кількості, достатній для покращення довгострокової пам'яті у пацієнта, фармацевтично прийнятний носій і інструкції (письмові і/або ілюстровані) з застосування розглянутої сполуки, композиції і/або екстракту для покращення пам'яті. Доза Доза будь-якої сполуки, композиції і/або екстракту згідно з даним винаходом буде варіюватися залежно від симптомів, віку і маси тіла пацієнта, характеру і тяжкості розладу, що виліковується, способу введення і форми розглянутої композиції. Будь-який із розглянутих складів може бути введений у однократній дозі або у вигляді розділених доз. Ефективні дози композицій згідно з даним винаходом можуть бути легко визначені способами, відомими фахівцеві в даній області техніки, або як зазначено в даному описі. Доза може бути обрана так, щоб полегшувати розлад у суб'єкта таким чином, щоб забезпечувати щонайменше часткове полегшення, якщо не повне полегшення. Фахівець може визначити дану кількість, як зазначено в даному описі, а також з використанням інших способів, відомих у даній області техніки. Терапевтично ефективна кількість (тобто доза) сполуки згідно з даним винаходом може бути визначена способами, відомими в даній області техніки. Терапевтично ефективні кількості будуть залежати від віку і від загального фізіологічного стану пацієнта, способу введення і використовуваного фармацевтичного складу. У деяких варіантах реалізації терапевтичні дози можуть становити від приблизно 10 мг/добу до 10000 мг/добу, від приблизно 100 мг/добу до 2500 мг/добу або від 250 мг до приблизно 1000 мг/добу. У інших варіантах реалізації можуть бути використані інші діапазони, включаючи, наприклад, 50-250 мг/добу, 250-500 мг/добу і 500750 мг/добу. Кількість сполуки, необхідна для профілактичного лікування, називана профілактично-ефективною дозою, у цілому, така ж, що й описана для терапевтичного лікування. 23 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 У деяких варіантах реалізації вводять терапевтично низьку дозу сполуки або композиції згідно з даним винаходом. У деяких варіантах реалізації терапевтично ефективна доза становить від приблизно 50 мг/добу до приблизно 150 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 10 мг/добу до приблизно 20 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 20 мг/добу до приблизно 30 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 30 мг/добу до приблизно 40 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 40 мг/добу до приблизно 50 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 50 мг/добу до приблизно 60 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 60 мг/добу до приблизно 70 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 70 мг/добу до приблизно 80 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 80 мг/добу до приблизно 90 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 90 мг/добу до приблизно 100 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 100 мг/добу до приблизно 110 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 110 мг/добу до приблизно 120 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 120 мг/добу до приблизно 130 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 130 мг/добу до приблизно 140 мг/добу. У деяких варіантах реалізації терапевтична доза становить від приблизно 140 мг/добу до приблизно 150 мг/добу. Введення можна здійснювати один раз на добу, двічі на добу або частіше, і можна зменшувати під час підтримуючої фази лікування захворювання або розладу, наприклад, один раз на два або три дні, замість введення щодня або двічі на день. Доза і частота введення будуть залежати від клінічних ознак, які підтверджують підтримку фази ремісії при зменшенні або відсутності щонайменше однієї або більше клінічних ознак гострої фази, відомих фахівцеві в даній області техніки. Може бути необхідним ідентифікувати ефективну дозу або кількість і будь-які можливі впливи на час введення складу для кожної конкретної композиції згідно з даним винаходом. Це можна здійснювати шляхом проведення рутинного експерименту, зазначеного в даному описі, з використанням однієї або більше груп тварин, або у випробуваннях за участю людини за необхідності. Ефективність будь-якої розглянутої композиції і способу лікування може бути оцінена шляхом введення зазначеної композиції і оцінки впливу зазначеного введення шляхом вимірювання одного або більше відповідних показників і порівняння значень даних показників після лікування зі значеннями тих же показників до лікування. Точний час введення і кількість будь-якої конкретної розглянутої композиції, яка забезпечить найбільш ефективне лікування у даного пацієнта, буде залежати від активності, фармакокінетики і біодоступності розглянутої композиції, фізіологічного стану зазначеного пацієнта (включаючи вік, стать, тип і стадію захворювання, загальний фізичний стан, чутливість до даної дози і вид лікарського препарату), способу введення тощо. Під час лікування суб'єкта за станом його або її здоров'я можна спостерігати шляхом вимірювання одного або більше відповідних показників у заздалегідь визначені моменти часу протягом періоду лікування. Лікування, включаючи композицію, кількості, час введення і склад, може бути оптимізоване відповідно до результатів зазначеного спостереження. Періодично можна проводити переоцінку пацієнта з визначенням ступеня покращення шляхом вимірювання тих же параметрів. На основі даних переоцінок можна здійснювати коректування кількості (кількостей), яка вводиться, розглянутої композиції й, можливо, часу введення. Лікування можна починати з більш низьких доз, які менше оптимальної дози сполуки. Потім дозу можна підвищувати маленькими приростами до досягнення оптимального терапевтичного ефекту. Застосування розглянутих композицій може знижувати необхідну дозу кожного індивідуального агента, який міститься в зазначених композиціях, оскільки початок і тривалість дії різних агентів можуть бути доповнюючими. Токсичність і терапевтичну ефективність розглянутих композицій можна визначати за допомогою стандартних фармацевтичних процедур у культурах клітин або у експериментальних тварин, наприклад, для визначення LD50 і ED50. Дані, отримані в результаті аналізів культур клітин і досліджень у тварин, можуть бути використані при розробці діапазону доз для застосування у людей. Доза будь-якої розглянутої композиції, як правило, лежить у діапазоні циркулюючих концентрацій, які включають ED 50 з невеликою токсичністю або відсутністю токсичності. Доза може варіюватися в межах даного 24 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 діапазону залежно від використовуваної лікарської форми і використовуваного способу введення. Способи застосування Деякі аспекти даного винаходу відносяться до лікування суб'єкта, який має розлад пам'яті і/або когнітивної здатності. Зазначений суб'єкт може мати розлад консолідації пам'яті (процес зберігання нової інформації в довгостроковій пам'яті), розлад процесів короткочасної пам'яті, розлад довгострокової пам'яті, розлад декларативної пам'яті або розлад процедурної пам'яті. Суб'єктів лікують сполуками, зазначеними в даному описі, для підвищення, захисту і/або відновлення функції і показників довгострокової пам'яті, наприклад, для покращення процесу зберігання нової інформації в довгостроковій пам'яті у людей (консолідації пам'яті) або для покращення короткочасної пам'яті. Один із аспектів даного винаходу відноситься до способу, який включає етап введення суб'єкту кількості екстракту граната; при цьому зазначений екстракт містить активну фракцію, яка містить щонайменше один поліфенол; і зазначений екстракт одержували: шляхом віджимання соку та приготування, можливо з наступним фракціонуванням шляхом центрифугування і/або ультрафільтрації, перед висушуванням; шляхом віджимання соку та приготування, можливо з наступним фракціонуванням шляхом центрифугування і/або ультрафільтрації, перед адсорбцією на полімерній хроматографічній смолі, промиванням водою і елююванням розчинником; або шляхом віджимання соку та приготування, можливо з наступним фракціонуванням шляхом центрифугування і/або ультрафільтрації, перед адсорбцією на полімерній хроматографічній смолі, промиванням водою, елююванням розчинником і наступним сушінням. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт одержували шляхом віджимання соку та приготування, можливо з наступним фракціонуванням шляхом центрифугування і/або ультрафільтрації, перед висушуванням. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт одержували шляхом віджимання соку та приготування, можливо з наступним фракціонуванням шляхом центрифугування і/або ультрафільтрації перед адсорбцією на полімерній хроматографічній смолі, промиванням водою і елююванням розчинником. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт одержували шляхом віджимання соку та приготування, можливо з наступним фракціонуванням шляхом центрифугування і/або ультрафільтрації перед адсорбцією на полімерній хроматографічній смолі, промиванням водою, елююванням розчинником і наступним сушінням. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт сушать шляхом сушіння розпиленням. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт сушать під вакуумом (наприклад, 40 °C при 50 мбар). У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт фракціонують шляхом центрифугування. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт фракціонують шляхом ультрафільтрації. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому розчинник являє собою спирт (наприклад, етанол). У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначена смола являє собою полівінілстирол-дивінілбензольну смолу. У деяких варіантах реалізації концентрація в зазначених смолах може бути досягнута за допомогою адсорбції у воді при нормальному тиску або під вакуумом з наступним рясним промиванням водою з видаленням високополярних складових, таких як цукор, волокна та мінерали. За елююванням цукрів у ході етапів промивання стежать за допомогою стандартного рефрактометра і вимірюють вміст Брікса. Потім ініціюють елюювання шляхом зміни буфера на більш полярний розчинник, такий як етанол, метанол або суміш етанолу у воді. Крім того, в деяких варіантах реалізації повне елюювання молекул може супроводжуватися УФдетектуванням при 205 нм, наприклад. Див., наприклад, розділ "Очищення елагітанінів" ("Purification of Ellagitannins") патенту США 7638640, включеного в даний опис за допомогою посилання стосовно зазначеного розділу і в повному обсязі. 25 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому смола являє собою АМБЕРЛІТ XAD-16 (Rohm & Haas). Інший аспект даного винаходу відноситься до способу, який включає етап введення сполуки згідно з даним винаходом суб'єкту. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполука є чистою та виділеною. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі екстракту. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі екстракту; і зазначений екстракт по суті не містить поліфеноли, відмінні від зазначеної сполуки. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі екстракту; і молярне співвідношення молів сполуки і загального числа молів поліфенолів у зазначеному екстракті більше приблизно 0,99. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі екстракту; і молярне співвідношення молів сполуки і загального числа молів поліфенолів у зазначеному екстракті більше приблизно 0,9. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі екстракту; і молярне співвідношення молів сполуки і загального числа молів поліфенолів у зазначеному екстракті більше приблизно 0,85. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі екстракту; і молярне співвідношення молів сполуки і загального числа молів поліфенолів у зазначеному екстракті більше приблизно 0,8. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі екстракту; і молярне співвідношення молів сполуки і загального числа молів поліфенолів у зазначеному екстракті більше приблизно 0,75. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт цілого плода 1766. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт шкірки 1767. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 31008. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 31008-L або 31008-H. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 61109. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 71109. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 1767-1. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 1767-2. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 1767-3. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 1767-4. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 1767-5. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому екстракт являє собою екстракт 1767-6. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі нутрицевтичної композиції. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі функціонального продукту харчування і функціонального харчового продукту. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі медичного продукту харчування або медичного харчового продукту. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі харчової добавки. 26 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому сполуку вводять у складі фармацевтичної композиції. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому суб'єкт являє собою людину. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначена людина є людиною літнього віку. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначена людина не є людиною літнього віку. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначеній людині менше 20 років. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначеній людині від 20 до 40 років. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначеній людині від 40 до 60 років. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначеній людині від 60 до 80 років. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначеній людині від 80 до 100 років. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначеній людині від 100 до 120 років. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначена людина здорова. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначена людина нездорова. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому суб'єкт являє собою ссавця. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначений ссавець являє собою тварину. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому покращують загальну когнітивну здатність у суб'єкта. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому покращують пам'ять суб'єкта. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому підтримують загальну когнітивну здатність у суб'єкта. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому підтримують пам'ять суб'єкта. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому захищають нейрон або безліч нейронів у зазначеного суб'єкта. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому нейрони суб'єкта захищають частково або по суті. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, при цьому зазначений спосіб забезпечує лікування або попередження нейродегенеративного розладу. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому знижують швидкість прогресування зазначеного нейродегенеративного розладу. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому відстрочують виникнення зазначеного нейродегенеративного розладу. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, при цьому зазначений спосіб забезпечує лікування або попередження метаболічного синдрому, діабету II типу, дисліпідемії або ожиріння. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, при цьому зазначений спосіб забезпечує лікування або попередження пов'язаного з амілоїдозом стану в зазначеного суб'єкта. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначений пов'язаний із амілоїдозом стан являє собою помірний когнітивний розлад (MCI) або віковий розлад пам'яті (AAMI). У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, при цьому зазначений спосіб забезпечує лікування або попередження БАС, хвороби Хантінгтона, хвороби Паркінсона або синдрому Дауна. 27 UA 108856 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, при цьому зазначений спосіб забезпечує лікування або попередження хвороби Альцгеймера. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, при цьому зазначений спосіб забезпечує лікування розладу пам'яті у людини. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначений розлад пам'яті є наслідком одного або більше з: віковий розлад пам'яті, мінімальний когнітивний розлад, амнезія, деменція, нездатність до навчання, розлад пам'яті, пов'язаний із токсичним впливом, черепно-мозковий травма, аневризма головного мозку, хвороба Паркінсона, травма голови, хвороба Хантінгтона, хвороба Піка, хвороба Крейтцфельда-Якоба, інсульт, шизофренія, епілепсія, затримка розумового розвитку, хвороба Альцгеймера, вік, віковий розлад пам'яті, помірний когнітивний розлад, синдром дефіциту уваги, синдром дефіциту уваги з гіперактивністю, розсіяний склероз, синдром передньої сполучної артерії або пов'язана зі СНІДом деменція. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому пам'ять покращується у людини після зазначеного введення. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначене покращення пам'яті являє собою покращення щонайменше одного показника, обраного з групи, яка складається з покращення короткочасної пам'яті, довгострокової пам'яті, консолідації пам'яті, процедурної пам'яті й декларативної пам'яті. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому увага у людини покращується після зазначеного введення. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому виконавча функція у людини покращується після зазначеного введення. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому час реакції у людини покращується після зазначеного введення. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому процес навчання у людини покращується після зазначеного введення. Фахівець у даній області техніки може уявити суб'єктів, яким способи, зазначені в даному описі, можуть бути корисні. Наприклад, зазначений суб'єкт включає людей із підозрою на розлад пам'яті типу хвороби Альцгеймера, MCI, AAMI, хвороби Паркінсона або БАС. Попереджувальна дія сполук згідно з даним винаходом також може бути корисною для здорового літнього суб'єкта, який демонструє ознаку когнітивного розладу. Для фахівця в даній області техніки очевидно, що практикуючий лікар може використовувати різні критерії для визначення ознак розладу пам'яті. Зазначені критерії включають, але не обмежуються ними, Інструкції з діагностики і статистики психічних розладів, третє видання (Diagnostic and Statistical Manual of Mental Disorders, DSM-III) Центр діагностики і лікування хвороби Альцгеймера (Alzheimer's Disease Diagnostic and Treatment Center, ADDTC), Міжнародну статистичну класифікацію хвороб 10-го перерозгляду (International Statistical Classification of Diseases, ICDIO), Національний інститут з вивчення неврологічних розладів та інсульту - Міжнародна асоціація з дослідження і навчання в області наук про нервову систему (National Institute of Neurological Disorders and Stroke-Association Internationale pour la Recherche et Enseignment en Neurosciences, NINDS-AIREN) і Інструкції з діагностики та статистики психічних розладів, четверте видання (DSM-IV). Див. Pohjasvaara et al, Stroke 2000, 31, 2952-2957. Клінічна характеристика пацієнта з помірним когнітивним розладом перебуває в рамках компетенції практикуючого лікаря. Зазначене тестування пацієнта для виявлення зазначеного стану включає проведення ряду тестів розумових здатностей. Способи клінічної діагностики широко розглянуті і обговорені, наприклад, у Petersen et al, Arch. Neurol. 1999, 56, 303-308. Крім того, існує зростаюча кількість даних про те, що діабет II типу є чинником ризику розвитку хвороби Альцгеймера у людей; тому превентивне лікування, яке сповільнює прогресування нейродегенеративних захворювань, може спричинити корисний ефект людям зі схильністю до діабету II типу. Ho, L., W. Qin, et al. (2004). "Diet-induced insulin resistance promotes amyloidosis in a transgenic mouse model of Alzheimer's disease". FASEB J 18(7): 902-4; і Kojro, E. and R. Postina (2009). "Regulated Proteolysis of RAGE and AbetaPP as Possible Link Between Type 2 Diabetes Mellitus and Alzheimer's Disease". J Alzheimers Dis 16(4): 865-78. Інший аспект даного винаходу відноситься до способу інгібування агрегації пептиду або білка, який включає етап приведення зазначеного пептиду або білка в контакт із ефективною кількістю сполуки згідно з даним винаходом. У деяких варіантах реалізації даний винахід відноситься до будь-якого з зазначених способів, у якому зазначена сполука являє собою сполуку згідно з даним винаходом або її 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds, compositions and methods for protecting brain health in neurodegenerative disorders
Автори англійськоюRinsch, Khristopher, Dupraz, Philippe Victor, Leon
Автори російськоюРинш Кристофер, Дюпраз Филип Виктор Леон
МПК / Мітки
МПК: A61K 31/7024, A61K 36/185, A61K 31/352, A61K 31/357, A61P 25/28
Мітки: розладах, punicalagin, мозку, головного, пунікалагін, пунікалін, punicalin, захисту, нейродегенеративних, здоров'я
Код посилання
<a href="https://ua.patents.su/72-108856-punikalin-punicalin-ta-punikalagin-punicalagin-dlya-zakhistu-zdorovya-golovnogo-mozku-pri-nejjrodegenerativnikh-rozladakh.html" target="_blank" rel="follow" title="База патентів України">Пунікалін (punicalin) та пунікалагін (punicalagin) для захисту здоров’я головного мозку при нейродегенеративних розладах</a>
Попередній патент: Зволожуючий апарат, що містить принаймні один валик
Наступний патент: Енантіо- і стереоспецифічні синтези b-аміно-a-гідроксіамідів
Випадковий патент: Фармацевтичний препарат, який містить вориконазол