Спосіб одержання генетично трансформованих рослин з підвищеним вмістом крохмалю, рекомбінантна дволанцюгова днк-молекула
Формула / Реферат
1. Способ получения генетически трансформированных растений с повышенным содержанием крахмала, отличающийся тем, что осуществляют следующие стадии:
(a) введение в геном клетки растения рекомбинантной двухцепочечной ДНК-молекулы, состоящей из;
(і) промотора, действие которого в растениях вызывает продуцирование РНК-последовательности в целевых тканях растения;
(ii) структурной ДНК-последовательности, вызывающей продуцирование РНК-последовательности, которая кодирует слитый полипептид,включающий амино-концевой пластидный транзитный пептид и фермент АДФ-глюкозо-пирофосфорилазу;
(ііі) 3' -нетранслируемой ДНК-области, действие которой в клетках растения вызывает терминацию транскрипции и присоединение подиаденилированных нуклеотидов к 3' -концу РНК-последовательности;
(b) продуцирование трансформированных клеток растения; и
(c) регенерацию из трансформированных клеток растения генетически трансформированных растений с повышенным содержанием крахмала.
2. Способ по п. 1, отличающийся тем, что в нем указанным растением является картофель.
3. Способ по п. 1, отличающийся тем, что в нем указанным растением является томат.
4. Способ по п. 1, отличающийся тем, что в нем фермент АДФ-глюкозо-пирофосфорилаза разрегулирован с понижением аллостерической регуляции при сохранении адекватной каталитической активности.
5. Способ по п. 4, отличающийся тем, что в нем указанным растением является картофель.
6. Способ по п. 4, отличающийся тем, что в нем указанным растением является томат.
7. Способ по п. 4, отличающийся тем, что в нем источником структурной ДНК-последовательности являются бактерии.
8. Способ по п. 7, отличающийся тем, что в нем указанным растением является картофель.
9. Способ по п. 7, отличающийся тем, что в нем указанным растением является томат.
10. Способ по п. 4, отличающийся тем, что источником структурной ДНК-последовательности являются растения или водоросли.
11. Рекомбинантная двухцепочечная ДНК-молекула, включающая последовательности в следующем порядке:
(і) промотор, действие которого в растениях вызывает продуцирование РНК-последовательности в целевых тканях растения;
(іі) структурная ДНК-последовательность, вызывающая продуцирование РНК-последовательности, которая кодирует слитый полипептид, включающий амино-концевой пластидный транзитный пептид и фермент АДФ-гдюкозо-пирофосфорилазу;
(ііі) З'-нетранслируемая ДНК-область, действие которой в клетках растения вызывает терминацию транскрипции и присоединение полиаденилированных нуклеотидов к З'-концу РНК-последовательности; причем указанный промотор является гетерологичным по отношению к структурной ДНК.
12. ДНК-молекула по п. 11, отличающаяся тем, что указанный фермент АДФ-глюкозо-пирофосфорилаза разрегулирован с понижением аллостерической регуляции при сохранении адекватной каталитической активности.
13. ДНК-молекула по п. 11, отличающаяся тем, что указанный промотор является гетерологичным по отношению к источнику структурной ДНК АДФ-глюкозо-пирофосфорилазы.
14. ДНК-молекула по п. 11, отличающаяся тем, что источником указанной структурной ДНК-последовательности являются бактерии.
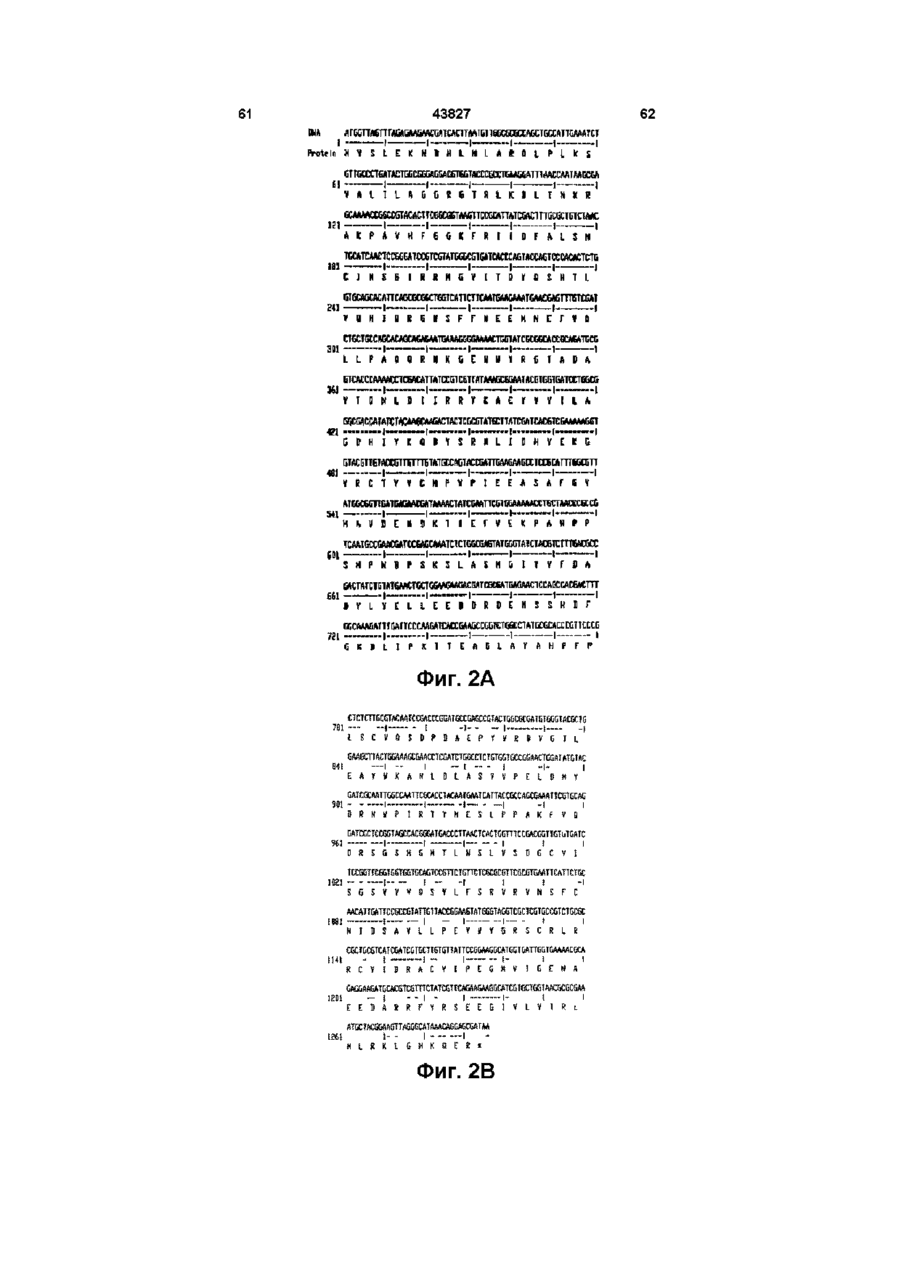
15. ДНК-молекула по п. 11, отличающаяся тем, что включает E.coli-glg С, которая имеет последовательность:
16. ДНК-молекула по п. 11. отличающаяся тем, что включает E.coli-gig C16, которая имеет последовательность:
17. ДНК-молекула по п. 11, отличающаяся тем, что включает LT2-glg С.
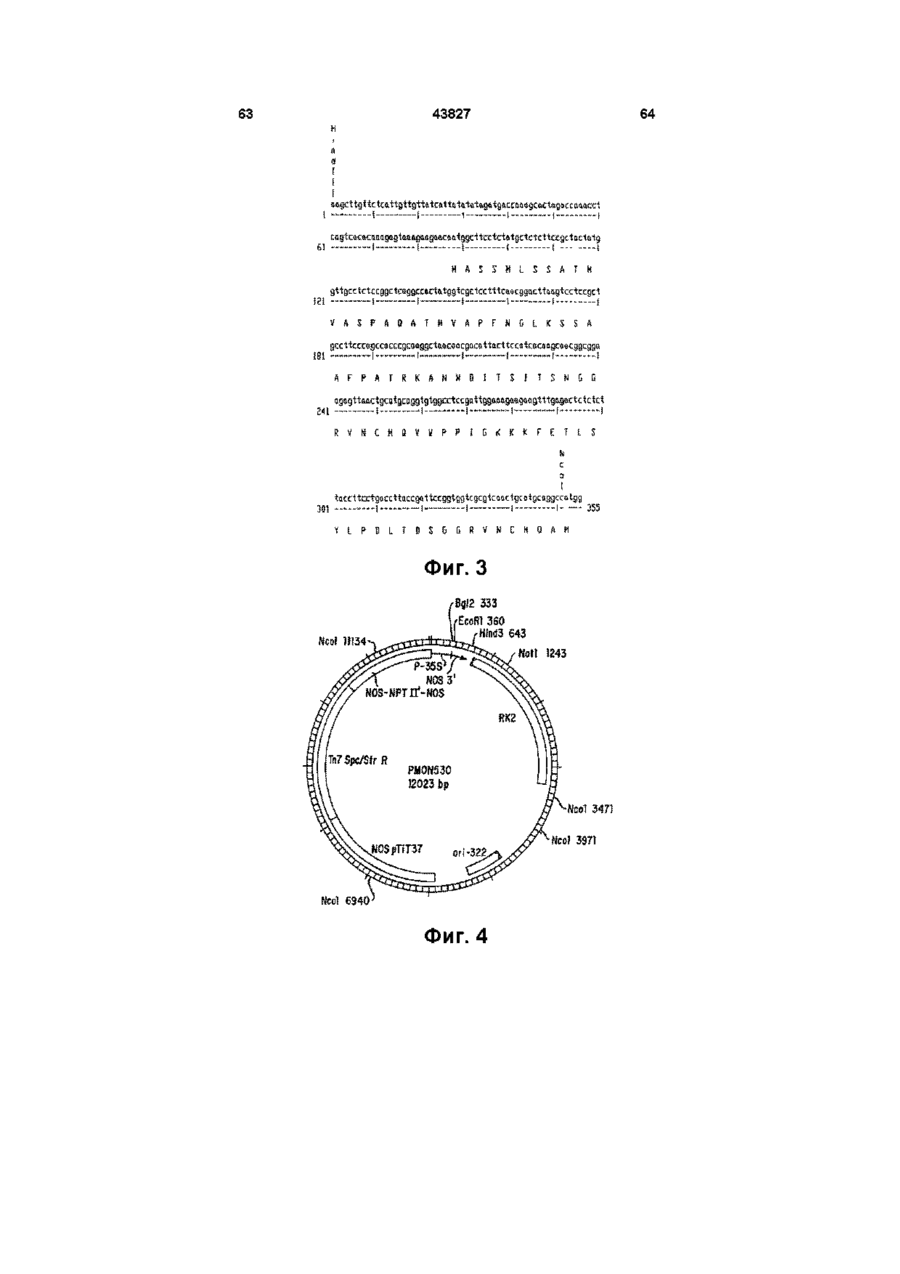
18. ДНК-молекула по п. 11, отличающаяся тем, что включает малую субъединицу АДФ-глюкозо-пирофосфорилазы картофеля, которая имеет последовательность:
19. ДНК-молекула по п. 11, где АДФ-глюкозо-пирофосфорилазой является АДФ-глюкозо-пирофосфорилаза эндосперма пшеницы.
20. ДНК-молекула по п. 11, где АДФ-глюкозо-пирофосфорилазой является АДФ-глюкозо-пирофосфорилаза эндосперма риса.
Текст
1 Способ получения генетически трансформированных растений с повышенным содержанием крахмала, отличающийся тем, что осуществляют следующие стадии (a) введение в геном клетки растения рекомбинантной двух цепочечной ДНК-молекулы, состоящей из, (і) промотора, действие которого в растениях вызывает продуцирование РНКпоследовательности в целевых тканях растения, (м) структурной ДНК-последовательности, вызывающей продуцирование РНКпоследовательности, которая кодирует слитый полипептид, включающий амино-концевой пластидный транзитный пептид и фермент АДФглюкозо-пирофосфорилазу, (ш) 3' -нетранслируемой ДНК-области, действие которой в клетках растения вызывает терминацию транскрипции и присоединение подиаденилированных нуклеотидов к 3' -концу РНКпоследовательности, (b) продуцирование трансформированных клеток растения, и (c) регенерацию из трансформированных клеток растения генетически трансформированных растений с повышенным содержанием крахмала 2 Способ по п 1, отличающийся тем, что в нем указанным растением является картофель 3 Способ по п 1, отличающийся тем, что в нем указанным растением является томат 4 Способ по п 1, отличающийся тем, что в нем фермент АДФ-глюкозо-пирофосфорилаза разрегулирован с понижением аллостерической регуляции при сохранении адекватной каталитической активности 5 Способ по п 4, отличающийся тем, что в нем указанным растением является картофель 6 Способ по п 4, отличающийся тем, что в нем указанным растением является томат 7 Способ по п 4, отличающийся тем, что в нем источником структурной ДНКпоследовательности являются бактерии 8 Способ по п 7, отличающийся тем, что в нем указанным растением является картофель 9 Способ по п 7, отличающийся тем, что в нем указанным растением является томат 10 Способ по п 4, отличающийся тем, что источником структурной ДНК-последовательности являются растения или водоросли 11 Рекомбинантная двухцепочечная ДНКмолекула, включающая последовательности в следующем порядке (і) промотор, действие которого в растениях вызывает продуцирование РНКпоследовательности в целевых тканях растения, (м) структурная ДНК-последовательность, вызывающая продуцирование РНКпоследовательности, которая кодирует слитый полипептид, включающий амино-концевой пластидный транзитный пептид и фермент АДФгдюкозо-пирофосфорилазу, (їм) З'-нетранслируемая ДНК-область, действие которой в клетках растения вызывает терминацию транскрипции и присоединение полиаденилированных нуклеотидов к З'-концу РНКпоследовательности, причем указанный промотор является гетерологичным по отношению к структурной ДНК 12 ДНК-молекула по п 11, отличающаяся тем, что указанный фермент АДФ-глюкозопирофосфорилаза разрегулирован с понижением аллостерической регуляции при сохранении адекватной каталитической активности 13 ДНК-молекула по п 11, отличающаяся тем, что указанный промотор является гетерологичным по отношению к источнику структурной ДНК АДФ-глюкозо-пирофосфорилазы 14 ДНК-молекула по п 11, отличающаяся тем, О 00 го 43827 что источником указанной структурной ДНКпоследовательности являются бактерии 15 ДНК-молекула по п 11, отличающаяся тем, что включает Е coh-glg С, которая имеет последовательность * здаш m GG ш м ш сс ті* АК TG SG CC CG CG п A с » T C G A T а Ш Vil Jtr l*v Gil La A Jjp Hii Uli Hit Uu All Aij Slit LU y j n 4 I S 10 li CA TG Ш KT SIT КС CG AAfflK GA GA CT GT КС C C I T T G G G 5 S K S S Arc o n ш ra GM MG щ ш t ^ m № m K G CGC C M CTS mt Vil S)r leu Slu Left»M His Uu Ш Uu Ш Щ 0І8 Ua y p С 1 І I D 1 І сел m mтаотGC cw m ев «я «* sat сю ют MC cisc C f» U« lyi it: Vil Hi U Пі Ua Mi Oy Gly Щ Slv ft: iij u l !D !S 30 T M C J m « C Ш Щ C t K» Ш C GC OA C IK GC C 5 A C G f M C T K G *.*j lyj Asp Ш Ihi Mi Lyi Ag Mi iy) Jte Ul Vll Hi)ft*Щ f r 35 ff IS Л! M TC CC MI M G ЇЙ K C S Id M T C W W TC G I G C K G T C G C C fl.y tyi ?ht Щ Пі IU lip fhi H Uu S»ft»Cyl lit Ш Sir U si s s is сто ЛЛ5 СЛІ AC С АЛА « в ЛАТ АЛЯ E G A осе GTA ТТС GGC 14 Alp fht Gly S«t Git! Vil H i Pto Gly All Tht StI Leu ЗИ Ki 33! Hi 1503 WS А С A A G G C A G T TAT ТТЛ Til G T G G T C IGC G A G T ATI Т G T A C A G A A A Gly Het *ig Vil Gin All lyi Leu Туг Азр Gly Туг l i p Glu Азр Ш W SIS 3iO 10SS GUI Л С AIT G A G« I K fAC Л Т G C « I TTS G C ATI А А А Л A G С A А C G С Л A Sly Ійг I H Glu AU Phi Tyr Аза ЛИ лап Lau Gly I I I Thr Lyi Lyj JSS J« 3fS CCS GTC C A G T ТП A C ПТ IAC SAC C A T A G C C A А С T C A C C A G C C C C Т A C Pco Ht Pro Asp Ph« Sat Pit* Туг Alp Arg $ « AU pto III Tyc Tdr Л0 3S ? 380 1103 USI С А CCT C A TA1 СТА C A C A ICA A A ATS CTI SAT ОСТ G T 5TC АСЛ Л G C C A A Gin Pro Л19 Tyt Uu Plo pro StI Lya Met Lau Alp All Азр Vil Tht 3SS Ш 3)5 IDS C T A T 5K АП G T C A G T TGI G G А С АЛ5 Л С TGJ A G ATI C T A C G A G T Т А S A Ajp in v i i i n Gly « » Sly Cyi Vil 1U Lys Лзп Cyi by) III His 06 m 410 US ІШ C T ICC О О GTT G A C C A A T A T6C A A T A O G SGA S A ATT AT* A Т G T G C. T C. A O Dls 5»: Vil Vil Gly Us AIJ Sai Cyi Па Sai Glu Sly All Па 111 ш at Ш5 ot С А G C KA СП TTG A G G S G A G T T C ІЛТ G G ACTC T G T G C Л A T G C A A A A C A G.u Aap Ser Lau Uu Hit Sly All Asp Туї l y i 61a TM Alp All Asp ш «о 13О ш GCT ЛС« ЛЛС АГС GC* G A TAC А Л А С G G SQC ЇТТ G O G A GIT СП S Л Л A T A л и Sac Asn Cat 31y 31y Tvi byt Asn Olu 81y I'M ї і і Glu Vil Leu 110 US MO Vi A G A G ITS CTS GCT G A A G G C *GT G C C A ATI SSC А С GSC A G G A C A G T C Т A Aig Lyj i*« Uu All AU Ip Gly Sir ї і і Pro III Sly 1U Gly Ly) (5) Ш Ш GCI o a c « :лл лзт сел елэ ллс ссе олт им ттс CAB sec лев GCT AU л и Sin Gin J * t Pro Glu Лш Pro Лар Тсс PM Gin Gly Ihc AU ПО 16І ISO WT 151 C C ATI Ш A A G C ATT Д С G C A G Л Т O C CGI A A G G A G C Т A A А C T O Jja Cys His l i e lyi Аг? All I t * IU Asp Lyi АІЛ All Arj III Gly *si do m НЭ! G C Ш GTC AAS »TC AIT Щ A A G C A C Ш С Л G A SCO G T AGS A A A A А A C Asp Am Vil lyj I U ! U Ми Lyi Asp ttlt Vil Gin Slu M l All At? Ш It! tSS **S UtT SAT ОСТ OK А А C A ТЛТ « 6 KM ITS TIT CAS GAB CAT ACT STI С П С A Лїр H i Vil hiр Туе S l u 210 2is г:о A>G ITT ЛІТ С А G C C C А А САЛ АСЛ G T K I G T ЛИ Л С Oil G C Л C A С A A С C l-p Pht I I * Sin Л!і Віз Лід Glu ТИ: Лір ЛІД Лір l i t The № AU Ш 2)0 23S G A CTB ССЛ ЛТО SAC SAG US COT G C AC! O A TIC SGI CTC »TG ЛЛЙ C C C All .4L P(O Hat Лір Сії Lyi Лі} Ш 24! ЛІІ ТЫ HI 250 Phi Oly Uu Kat by) !5i ATI СЛС О Л G A S3* Ca ЛІТ ЛИ G A ТП в » И З А Л CCS CA* KA Л A A А It« Ely y« І » ІИ SIS SII V ( 1 "J Ь 1381 1535 ї' »« »'* 19 ДНК-молекула по п 11, где АДФ-глюкозопирофосфорилазой является АДФ-глюкозопирофосфорилаза эндосперма пшеницы 20 ДНК-молекула по п 11, где АДФ-глюкозопирофосфорилазой является АДФ-глюкозопирофосфорилаза эндосперма риса UK Л 5 «Л S T AM С Л A f CCI T C ATI SK A T A S G *И ТЛІ C Л Ti T S T M л»Р L і Лсд Hi Ljs GU Met Pro Eh* lit ЛИ Sar Mtt Sly Ш Tyc :so аи ш Настоящее описание служит отчасти продолжением созаявки на патент США с серийным №07/539763, поданной 18 июня 1990г под заглавием " Повышенное содержание крахмала в растениях" Последние достижения в области генной инженерии создают предпосылки для получения растений, имеющих в своем составе инородные гены Теперь можно выводить сорта с уникальными сточки зрения агрономии, сбора и переработки урожая характеристиками Одним из наиболее желательных признаков является, разумеется, повышенное содержание и качество крахмала в различных сельскохозяйственных культурах Крахмал представляет собой полисахарид, который исходно образован молекулами глюкозы, соединенными между собой альфа - 1 - 4 и альфа - 1 - 6 связями Он присутствует в растительных клетках в форме нерастворимых в воде зерен или гранул Образующийся в процессе фотосинтеза крахмал локализуется и хранится в хлоропластах Кроме того, крахмал синтезируется в корнях и таких резервных органах, как клубни и семена В этих тканях, где фотосинтез отсутствует, крахмал находится в пластидах, называемых амилопластами Также как в хлоропластах, крахмал амилопластов сохраняется в форме гранул Размер последних варьирует в зависимости от вида растений Фактически крахмал состоит из амилозы и амилопектина - двух разных типов полимеров глюкозы Амилоза образована, в основном, линейными цепями из молекул глюкозы, связанных альфа - 1 - 4 связями Длина амилозной цепи составляет в среднем 1000 молекул глюкозы Амилопектин содержит более короткие цепи, в кото 43827 рых молекулы глюкозы связаны альфа - 1 - 6 связями Средняя длина таких цепей равна примерно 20 - 25 молекулам глюкозы До последнего времени не существовало единого мнения относительно роли АДФ-глюкозы и УДФ - глюкозы в качестве субстратов биосинтеза крахмала После выделения мутантных форм Arabidopsis, у которых отсутствует АДФглюкозопирофосфорилаза, общепризнанно, что в качестве субстрата биосинтеза крахмала растения используют АДФ - глюкозу Все биосинтетические реакции этого процесса происходят в хлоропластах или амилопластах Различают три стадии биосинтеза крахмала На первой стадии из глюкозо - 1 - фосфата и АТФ под воздействием АДФглюкозопирофосфорилазы (ЕС 2 7 7 27) образуется АДФ-глюкоза На втором этапе АДФ-глюкоза используется синтетазой крахмала (ЕС 2 4 1 21) для формирования линейных цепей крахмала, содержащих альфа - 1 - 4 связи На третьей стадии фермент (ы), разветвляющие прямую цепь (ЕС 2 4 1 18), вводят альфа - 1 - 6 связь, что приводит к формированию молекулы амилопектина Лимитирующая стадия биосинтеза крахмала в растениях остается предметом разногласий Предполагают, что такой стадией служит образование АДФ-глюкозы при участии АДФглюкозопирофосфорилазы, однако доказательства в пользу такого предположения отсутствуют В опубликованной заявке на Европейский патент №0368506 А2, которая касается АДФглюкозопирофосфорилазы, ставится под сомнение роль этого фермента в качестве ключевого фактора биосинтеза крахмала Аргумент, опровергающий возможность контролирующего воздействия АДФ-глюкозопирофосфорилазы в процессе биосинтеза крахмала, можно почерпнуть из результатов исследований с мутантным штаммом Arabidopsis (Zm, 1988a,в) Установлено, что этот мутант (TL 46) содержит только приблизительно 5% АДФ-глюкозопирофосфорилазной активности, обнаруживаемой в диких штаммах Тем не менее, мутантные растения все же продуцируют крахмал в количестве около 40% его общего биосинтеза в диких разновидностях Если АДФглюкозопирофосфорилаза действительно является лимитирующим процесс ферментом, то придется принять, что снижение ферментативной активности на 95% должно приводить к более чем 60% - ному уменьшению накопления крахмала Сходным образом, определение экстрагируемой активности в опытах ин витро позволяет сделать вывод, что указанный фермент может лимитировать скорость реакции лишь в том случае, если его активность ин виво значительно понижена аллостерическими регуляторами ферментативной активности Краткое описание изобретения Настоящее изобретение обеспечивает получение молекул ДНК, кодирующих АДФглюкозопирофосфорилазу (ADPgPP), которые можно использовать при выведении растений с повышенным содержанием крахмала Показано также, что ADPgPP - ферментативная активность в растительных клетках и тканях является лими 8 тирующим фактором биосинтеза крахмала Получение указанных молекул позволило в качестве одного из аспектов изобретения, предложить способ генетической трансформации растений для повышения содержания крахмала Способ предполагает следующие стадии а введение в геном растительной клетки рекомбинантной двунитевой молекулы ДНК, содержащей ниже перечисленные структурные элементы 1 промотор, функционирующий в растениях, таким образом, который обеспечивает образование последовательностей РНК в растительных тканях - мишенях, 2 структурную последовательность ДНК, которая индуцирует формирование РНК, кодирующей слитый полипептид, в состав которого входят ^ - концевой транспортный пептид пластид и фермент АДФ-глюкозопирофосфорилаза, 3 3' не транслируемую последовательность ДНК, действие которой в растительных клетках состоит в прекращении транскрипции и присоединении полиаденилированных нуклеотидов к 3' концу последовательности РНК б получение трансформированных растительных клеток, и в регенерация из трансформированных клеток генетически измененных растений с повышенным содержанием крахмала Другой аспект изобретения позволяет получить рекомбинантную двунитевую молекулу ДНК, имеющую в своем составе ниже перечисленные элементы а промотор, функция которого в растениях состоит в продукции РНК в тканях - мишенях, б структурную последовательность ДНК, которая индуцирует образование РНК, кодирующей слитый полипептид, состоящий из ^ - концевого транспортного пептида пластид и фермента АДФ глюко-зофосфорилазы, и в 3' не транслируемую область, функция которой в растительных клетках состоит в прекращении транскрипции и присоединении полиаденилированных нуклеотидов к 3' - концу последовательности РНК, причем указанный промотор гетерологичен по отношению к структурной ДНК В соответствии с еще одним аспектом изобретения получают бактериальные и трансформированные растительные клетки, которые соответственно содержат ДНК, имеющую в своем составе вышеупомянутые элементы (а), (б) и (в) Еще один аспект настоящего изобретения обеспечивает получение дифференцированных растений с повышенным содержанием крахмала Краткое описание рисунков На рисунке 1 показана нуклеотидная последовательность (SEQ Ю -^ О 1) и выведенная ами нокислотная последовательность (SEQ ID ^ О 2) для гена АДФ-глюкозопирофосфорилазы (glgC) из Е coli На рисунке 2 показана нуклеотидная последовательность (SEQ ID ^ О 3) и выведенная ами 43827 нокислотная последовательность (SEQ ID ^ О 4) для мутантного гена АДФглюкозопирофосфорилазы (glgC 16) из Е coh На рисунке 3 показана нуклеотидная последовательность (SEQ ID ^ О аминокислотная 5) и соответствующая последовательность (SEQ ID ^ О 6) для модифицированного транспортного пептида хлоропластов из гена ssRUBISCO IA Arabidopsis thahana На рисунке 4 представлена плазмидная карта для трансформирующего вектора pMON 530 На рисунке 5 показана нуклеотидная последовательность (SEQ ID ^ О аминокислотная 7) и соответствующая последовательность (SEQ ID ^ О 8) собранной малой субъединицы гена АДФ-глюкозопирофосфорилазы картофеля На рисунке 6 представлена практически полная нуклеотидная последовательность (SEQ ID ^ О 9) и соответствующая аминокислотная последовательность (SEQ ID ^ О 10) практически полной большой субъединицы гена АДФглюкозопирофосфорилазы картофеля На рисунке 7 представлена карта плазмиды для трансформирующего вектора рМО ^ 20113 На рисунке 8 представлена карта плазмиды для трансформирующего вектора рМО ^ 16938 На рисунке 9 представлена карта плазмиды для трансформирующего вектора рМО ^ 977 На рисунке 10 представлена карта плазмиды для трансформирующего вектора рМО ^ 16950 На рисунке II представлена карта плазмиды для трансформирующего вектора рМО ^ 10098 Подробное описание изобретения Экспрессия растительного гена, существующего в форме двунитевой ДНК, предполагает транскрипцию информационной РНК (мРНК) с одной из нитей ДНК РНК - полимеразой и последующий процессинг первичного транскрипта мРНК в ядре Такой процессинг охватывает 3' нетранслирумую область, которая обеспечивает присоединение полиаденилированных нуклеотидов к 3' концу РНК Транскрипция мРНК с ДНК регулируется одной из областей ДНК, которую обычно называют "промотором" Промотор включает последовательность оснований, которая служит сигналом для РНК - полимеразы ассоциироваться с ДНК и инициировать транскрипцию мРНК с одной из нитей ДНК, которая является матрицей для соответствующей комплиментарной нити РНК В литературе описано множество промоторов, проявляющих активность в растительных клетках К их числу относятся нопалинсинтетазный (NOS) и октопинсинтетазный (OCS) промоторы (их несут индуцирующие опухоль плазмиды (Agrobactenum tumefaciens) промоторы колимовирусов (например, вируса мозаики цветной капусты, СаМУ 19S и 35S и 35S - промоторы вируса норичниковой мо 10 заики) светочувствительный промотор из малой субъединицы рибулозо - 1,5 - бис - фосфаткарбоксилазы (ssRUBISCO - широко распространенного растительного полипептида), промотор гена белка, связывающего хлорофиллы а и в, и т п Все эти промоторы использовались для получения разнообразных типов рекомбинированных ДНК, обладающих способностью к экспрессии в растениях (см , например, публикацию РСТ под шифром WO 84/029/13 (Rogers с соавторами, Monsanto) Настоящее изобретение допускает использование промоторов, для которых известна или установлена способность вызывать транскрипцию РНК в растительных клетках Такие промоторы получают из самых разнообразных источников, включая растения и растительные вирусы К их числу относятся активированный промотор СаМУ 35S и промоторы, выделенные из генов растений, таких как гены ssRubisco Набор пригодных для целей изобретения промоторов не ограничивается перечисленными разновидностями Ниже будет показано, что предпочтительно выбирать промоторы, способные индуцировать достаточно высокую степень экспрессии, с тем чтобы получить эффективное количество АДФглюкозопирофосфорилазы, необходимой для желаемого увеличения содержания крахмала Кроме того, предпочтительно, чтобы экспрессия гена ADPgPP имела место в таких специфических растительных тканях, как ткани листьев, корней, клубней, семян, плодов и т п , и чтобы выбранный промотор обладал желаемой тканевой и стадийной специфичностью Специалистам известно, что количество АДФ - глюкозопирофосфорилазы, необходимое для индукции образования требуемого количества крахмала, может изменяться в зависимости от типа растения, известно также, что избыточная АДФ - глюкозопирофосфорила зная активность, может стать губительной для растений В связи с этим действие промотора можно оптимизировать, выбирая его с учетом требуемого уровня экспрессии в растительной ткани и такой его активности, которая необходима для получения трансформантов, которые обеспечивают желаемую АДФ - глюкозопирофисфорилазную активность в тканях - мишенях Такой подход к подбору трансформантов применяется в повседневной практике для экспрессии гетерологичных структурных генов в растениях, поскольку трансформанты, содержащие один и тот же гетерологичный ген отличаются в зависимости от места вставки гена в растительный геном (это явление обычно называют "эффектом положения") Желательно, чтобы промоторы, используемые в составе молекул двунитевой ДНК согласно настоящему изобретению, характеризовались относительно высоким уровнем экспрессии в тканях, где требуется повышение содержания крахмала, например в клубнях картофеля или в плодах томата В этом отношении наиболее предпочтительным промотором для картофеля является пататин, который более подробно описан в нижеследующих примерах Экспрессию молекул двунитевой ДНК по данному изобретению конститутивным промотором (который индуцирует 12 11 43827 экспрессию молекул ДНК во всех или в большинстепенью экспрессии в зеленых плодах, и клоны, стве растительных тканей) редко признают предкоторые практически не проявляли аналогичной почтительным способом, а в некоторых случаях активности в листьях Геномный саутерн - анализ она может оказаться губительной для растений продемонстрировал наличие небольшого числа Показано, что используемый в данном исслегенных копий (I - 2) Затем, путем скрининга банка довании промотор из пататинов класса 1, индуцигеномных клонов томата, были выделены проморующий экспрессию ADPgPP E coh обладает как торы для этих клонов к ДНК Указанный характер высокой активностью, так и специфичностью по действия этих промоторов на экспрессию был отношению к тканям клубней (Bevan et al , 1986, подтвержден слиянием с геном бета - глюкурониJefferson et al , 1990) Известны и другие гены, дазы (ГУЗ) и наблюдениями за экспрессией ГУЗ в обладающие специфической для клубней или потрансгенных плодах После этого производили вышенной способностью к экспрессии, в том чисслияние промоторов, индуцировавших экспрессию ле гены ADPgPP из картофельных клубней (Muller в большинстве клеток плодов, с СТР - glgCI6 и et al , 1990), сахарозосинтетазы (Salanoubat и другими glgC аллелями или генами ADPgPP из Belhard, 1987, 1989) основных клубневых белков, водорослей или высших растений II включая белковые комплексы с молекулярной Содержание крахмала в корневой ткани можмассой 22кДа и ингибиторы протеиназы но повысить посредством экспрессии гена АДФ(Hannapel, I990) и другие пататины классов 1 и 2 глюкозопирофосфорилазы с помощью специфи(Роспа - Sosa et al, I989, Mignery et al , 1988) ческих для нее промоторов Промотор гена кислой Помимо эндогенных промоторов растительной хитиназы (Бамас et al , 1990) вызывает экспресАДФ-глюкозопирофосфорилазы для экспрессии сию АДФ-глюкозопирофосфорилазы в корневой гена МФ - глюкозопирофосфорилазы в таких инткани Можно добиться экспрессии этого фермендивидуальных тканях, как ткани листьев, семян та в корневой ткани и путем применения специили плодов, можно использовать и другие промофичных для корней подобластей промотора СаМУ торы Одним из основных резервных белков сои 35S, которые уже известны (Benfey et al , 1989) (Glycme мах) является бета - конглицинин, известДля увеличения содержания крахмала в листьях ный также как белок с константной седиментации путем экспрессии гена АДФ7S (Tierney, 1987) Промотор бета - конглицинина глюкозопирофосфорилазы (в частности, гена можно использовать для суперэкспрессии гена glgC) может быть использован специфичный для АДФ - глюкозопирофосфорилазы Е coh или люболистовой ткани промотор типа ssRUBISCO или го другого организма в семенах для увеличения промотор гена, кодирующего белок, который содержания в них крахмала Использование эндообеспечивает связывание хлорофиллов а й в генного промотора позволило, в частности, доРНК, получаемая на матрице ДНК согласно биться экспрессии бета - субъединицы бета настоящему изобретению, также содержит 5' не конглицинина в семенах трансгенных петунии и транслируемую лидирующую последовательтабака, что свидетельствует о специфической ность Эту последовательность можно получить из природе действия промотора в семенах различпромотора, индуцирующего генную экспрессию, с ных видов растений (Bray, 1987) последующей ее модификацией, направленной на Зеины представляют собой группу резервных усиление трансляции мРНК Равным образом, 5' белков, которые имеются в эндосперме кукурузы не транслируемые участки можно получать из виПолучены геномные клоны генов зеина (Pedersen, русных РНК, из подходящих генов эукариот и из 1982), показано, что промоторы из этих клонов синтетических генных последовательностей Натакже пригодны для экспрессии генов АДФстоящее изобретение не лимитируется конструкглюкозопирофосфорилазы в семенах кукурузы и циями, которые описаны в нижеследующих придругих растений мерах, в которых не транслируемые участки Содержание крахмала в плодах томатов можполучают из 5' не транслируемой последовательно повысить посредством экспрессии гена АДФности, сопутствующей последовательности проглюкозопирофосфорилазы с помощью специфимотора Помимо прочего, не транслируемую лического для плодов промотора Показана индукдирующую последовательность можно получить ция гена АДФ-глюкозопирофосфорилазы в плодах из промотора или кодирующей последовательнотоматов промотором из геномного клона 2AII (Рести иной природы, как описано выше аг,1989) или промотором Е8 (Deikman, 1988) КроИскусственные ДНК согласно настоящему ме того, выделены новые специфичные для плоизобретению содержат также кодирующую струкдов промоторы, которые обладают выраженным и турную последовательность в виде двунитевой специфическим действием на экспрессию в проДНК, которая кодирует слитый полипептид, соцессе формирования плодов томатов С целью стоящий из ^ - ko-нцевого транспортного пептивыявления клонов кДНК, пригодных для специфида пластиды и фермента АДР - глюкозопирофосческой экспрессии в незрелых плодах, был прифорилазы АДФ-глюкозопирофосфорилаза, менен метод дифференциального скрининга с используемая в соответствии с данным изобретеиспользованием библиотеки к ДНК плодов томанием, предпочтительно должна слабо поддаватьтов Для этой цели служили зонды к ДНК, пригося аллостерическому контролю в растениях Татовленные из мРНК, которую экстрагировали на кую нерегулируемую АДФранних или поздних стадиях развития плодов, из объединенных проб тканей листьев и стеблей и из глюкозопирофосфорилазу отбирают из числа изкорневой ткани томатов После этого идентифивестных ферментов, обладающих нерегулируемой цировали клоны, характеризовавшиеся высокой биологической активностью, или получают по 43827 14 13 средством мутагенеза нативных АДФ - глюобладавших АДФ-глюкозопирофосфорилазной козопирофосфорилаз из бактерий, водорослей и активностью У Е coh К - 12 отсутствуют гены gig, высших растений, как подробно описано ниже В тогда как штамм AC7ORI - 504 характеризуется некоторых случаях, существенные различия приналичием дефектного гена АДФроды регуляторов, модулирующих активность глюкозопирофосфорилазы и проявляет в 5 - 7 раз АДФ-глюкозопирофосфорилаз дикого типа меньшую активность других ферментов, участ(ADPgPP), позволяют применять непосредственно вующих в биосинтезе гликогена Обе плазмиды, ген дикого типа При этом концентрация регулятоpEBL I и pEBL 3, продуцируют АДФров в органеллах растений благоприятствует проглюкозопирофосфорилазу в обоих мутантных явлению более выраженной ферментативной акштаммах Клонированную АДФтивности глюкозопирофосфорилазу частично очищали из Бактериальные АДФштамма AC7ORI Е coh, трансформированного плазмидой pEBL 3 Его АДФглюкозопирофосфорилазы глюкозопирофосфорилаза по кинетическим свойХорошо известна выраженная чувствительствам была сопоставима с частично очищенным ность АДФ-глюкозопирофосфорилазы Е coh к реферментом из исходного мутантного штамма (Е гуляторным воздействиям Показана способность coh К - 12 618) и частично очищенным ферментом фруктоза - 1,6 - дифосфата активировать этот из штамма 356 Е coh К - 12, который представляфермент посредством увеличения максимальной ет собой дикий тип родительской формы штамма скорости реакции (УтЭх) и повышения его сродства 618 Проведено также сопоставление уровня акк субстратам (Press, 1966 и Gentner, 1966) Кроме тивации и ингибирования ферментов дикого и мутого, фруктоза - 1,6 - дифосфат (ФДФ) может изтантного типа АДФ-глюкозопирофосфорилаза менять чувствительность фермента к таким ингиродительского штамма 356 под воздействием биторам, его активности, как аденозин - 5' монофруктоза - 1,6 - дифосфата активировалась прифосфат (АМФ) и неорганический фосфат (Pi) мерно в 45 раз по сравнению с первоначальной (Genter, 1968) величиной Сигмоидальная кривая активации хаВ 1981 г было произведено клонирование гена рактеризовалась крутизной Хилла порядка 1,7, а (glgC) АДФ-глюкозопирофосфорилазы из Е coh полумаксимальное стимулирование достигалось в К12, наряду с генами гликогенсинтетазы и разприсутствии 62 мкМ ФДФ АДФветвляющего фермента Полученная плазмида глюкозопирофосфорилаза мутантного штамма была обозначена как рОР12 (OKita, 1981) Ген 618 была более активна в отсутствие ФДФ, а в glgC, секвенированный в 1983г, содержит 1293 присутствии последнего активировалась не более чем в 1,8 - 2 раза Кривая активации последнего пар оснований (SEQ ID -^ О 1) и кодирует 431 фермента имела гиперболическую форму при крутизне Хилла 1,0 и полумаксимальной стимуляаминокислоту (SEQ ID -^ О 2) с расчетной молеции при 15 ± 3,1мкМ Фермент, экспрессия которокулярной массой 48762 (Baecker, 1983), как покаго происходила при использовании плазмиды зано на рисунке 1 pEBL 3, имел те же кинетические константы ФДФ, Ген glgC16 получали методом химического что и АДФ-глюкозопирофосфорилаза из мутантномутагенеза Е Coh К (штамм РА 601), используя го штамма 618 обработку ^ - метил - ^ 'нитрозогуанидином В настоящее время установлена последова(Cattaneo, 1969 и Creuzet - Sigal, 1972) Мутанты, синтезирующие гликоген, были идентифицировательность ДНК в гене glgC16 (SEQ ID ^ o 3) ны окрашиванием подвергавшихся мутагенному (Kumar, 1989) На рисунке 2 представляющем вывоздействию колоний йодом Установлено, что веденную аминокислотную последовательность, бактерии с мутантным glgC16 в стационарной фазе накапливают 48% гликогена по сравнению с кодируемую геном glgC16 (SEQ ID ^ О 4), мож20% у исходного штамма При сопоставлении кино отметить две замены аминокислотных остатков нетики АДФ-глюкозопирофосфорилазы в мутантпо сравнению с последовательности из неизогенном и родительском штаммах обнаружено, что ной формы Е coh К - 12 (штамм 3000), а именно фосфорилаза, кодируемая геном gigC16, обладазамену лизина глютаминовой кислотой в положеет более высоким сродством к АДФ - глюкозе в нии 296 и замену глицина на аспарагиновую киотсутствие активатора - фруктоза - 1,6 - дифосслоту в положении 336 фата (ФДФ), а концентрация ФДФ, необходимая Среди Е coh, было обнаружено известное для полумаксимальной активации фермента в число других мутантов с измененной АДФклетках с модифицированным геном glgC16 глюкозопирофосфорилазной активностью Эксуменьшается Установлено также снижение ингипрессия этих и других бактериальных АДФбирования АДФ-глюкозопирофосфорилазной акглюкозопирофосфорилаз дикого или мутантного тивности под воздействием 5' - АМФ (АМФ) в мутипов также может быть использована для усилетантных клетках ния продукции крахмала в растениях Leund (1986) сообщил о клонировании гена В клетках штамма 6047 Е colj К - 12 (glgC47) glgC16 из штамма 618 Е coh К - 12 Были полученакапливается примерно такое же количество глины два клона противоположной ориентации Эти когена в стационарной фазе, как и в штамме 618 клоны, обозначенные как pEBL I и pEBL 3, содер(glgC16) Штамм 6047, подобно штамму 618, хажат как ген glgC16, так и ген glgB (ген разветврактеризуется повышенным сродством к ФДФ и ляющего фермента) Обе плазмиды были трансболее высокой активностью в отсутствие ФДФ формированы в мутантных штаммах Е coh, не Тем не менее, фермент из штамма 6047 более 16 15 43827 чувствителен к ингибирующему действию АМФ по Rhodospinllum rubrum обнаружена АДФсравнению с ферментом из штамма 618 (Latil глюкозопирофосфорилаза, которая активируется Damotte, 1977) пируватом, но ни одно из изученных соединений, в том числе Рі, АМФ или АДФ, не оказывало на этот Мутант Sg5 E coh обладает более высоким фермент ингибирующего действия Изучены также сродством к своим аллостерическим активаторам АДФ-глюкозопирофосфорилазы из нескольких и пониженным сродством по отношению к алловидов водорослей, причем оказалось, что их регустерическому ингибитору нежели родительский ляция осуществляется тем же образом, что и рештамм (Govons, 1969, Govons, 1973 и Preiss, гуляция соответствующих ферментов высших 1973) Одни эти изменения делают фермент борастений Очевидно, что для усиления биосинтеза лее активным в физиологических условиях, что крахмала и его накопления в растениях можно позволяет бактериям накапливать в 2 - 3 раза использовать АДФ - глюкозопирофосфорилазы из больше гликогена по сравнению с родительской самых разнообразных организмов формой Мутантная АДФглюкозопирофосфорилаза из штамма Sg5, как и В дополнение к Е coh и растительным фермент дикого типа, существует в форме гомоADPgPP в качестве источников генов ADPgPP тетрамера Однако, в отличие от фермента дикого могут служить цианобактерии, водоросли, другие типа, мутантний фермент под воздействием ФДФ прокариотные и эукариотные клетки Этот перепреобразуется в олигомеры большего молекулярчень не исчерпывает всех возможных источников ного веса (Carlson, 1976) Так например, гены ADPgPP могут быть выделены из Svnechocystis и Anabaena с помощью олигонукАДФ-глюкозопирофосфорилаза из мутантного леотидов, соответствующих сайту - активатору штамма CL 1136 - 504 Е coh В также характеризуADPgPP E coh (аминокислотные остатки 25 - 42 ется повышенным сродством к активаторам и пона рисунке 1), который отличается высокой степениженным сродством к ингибиторам (Kappel, 1981 нью консервативности у самых разнообразных и Preiss, 1973) Этот мутант накапливает в 3 - 4 организмов Олигонуклеотиды, соответствующие раза больше гликогена чем клетки Е coh дикого указанной области, помогают выделить искомый типа В условиях активации очищенные ферменты ген в случае их применения в качестве зондов для из штамма CL 1136 - 504 и из дикого штамма скрининга геномных библиотек По альтернатив(AC7ORI) обладали сопоставимой специфической ной методике, для амплификации сегментов гена активностью Однако при полном отсутствии актиADPgPP 5' праймерами, соответствующими активаторов фермент из мутантного штамма проявлял ваторному сайту Е coh, и 3' праймерами, соответочень высокую активность, тогда как у фермента ствующими каталитическим участкам Е coh (надикого типа такое повышение отсутствовало пример, связывающим местам АДФ-глюкозы в Е Ген glgC из Salmonella typhimunum LT2 был coh), может быть использована ПЦР - реакция (см клонирован и секвенирован Leung and Пример 1) Продукты этой реакции пригодны в каPreiss(1987a) Этот ген кодирует аминокислотную честве зондов геномных библиотек при получении последовательность из 431 остатка с расчетной соответствующего полноразмерного гена молекулярной массой 45580 glgC ген из Salmonella typhimunum LT2 и аналогичный ген из Растительные АДФ-глюкозопирофосфорилазы Е coh К - 12 характеризуются 90% - ной гомолоБыло время, когда УДФ - глюкозу считали осгичностью аминокислотных последовательностей новным субстратом при биосинтезе крахмала в и 80% - ной гомологичностью на уровне ДНК Порастениях Однако, позднее было установлено, добно АДФ-глюкозопирофосфорилазе Е coh, тот что АДФ-глюкоза является более эффективным же фермент Salmonella typhimunum LT2 активирусубстратом этого процесса (Recondo, 1961) Тот ется ФДФ и ингибируется AMP Leund и Preiss, же автор показал, что в растительном материале 1987в) СТОЛЬ высокая степень консервативности присутствует АДФ-глюкозопирофосфорилазная аминокислотных последовательностей предполаактивность гает, что введение мутаций, сопровождающихся Частично очищенная АДФусилением активности ADPgPP у Е Coh, в ген глюкозопирофосфорилаза была получена из лиADPgPP S typhimunum приведет к сходному изместьев шпината, показана ее активация 3 - фоснению активности соответствующего фермента у фоглицератом (3 - ФГА) и ингибирование неоргаэтого организма ническим фосфатом (ghosh et al , 1966) Эти авторы предположили, что биосинтез крахмала в Известны и другие АДФ - глюкозофосфорилалистьях регулируется концентрацией АДФзы, охарактеризованные по их реакции на воздейглюкозы Первичным продуктом фиксации СОг в ствие активаторов и ингибиторов (см обзор процессе фотосинтеза является 3 - ФГА КонценPreiss, 1973) Установлено, что подобно АДФтрацияЗ-ФГАво время фотосинтеза увеличиваетглюкозопирофосфорилазе Eschenchia coh, АДФся, что приводит к активации АДФглюкозопирофосфорилазы из Aerobacter глюкозопирофосфорилазы В то же время, конaerogenes.Aerobacter cloacae,Citrobacter freundic и центрация неорганического фосфата уменьшаетEschenchia anrescens также активируются под ся в результате фотофосфорилирования, что совлиянием ФДФ и ингибируются в присутствии провождается ингибированием АДФАМФ АДФ-глюкозопирофосфорилаза из глюкозопирофосфорилазной активности Эти изAeromonas formicans активируется фруктоза - 6 менения в конечном итоге приводят к усилению фосфатом и ФДФ и ингибируется АДФ В то же продукции АДФ-глюкозы и биосинтеза крахмала В время АДФ-глюкозопирофосфорилаза из Serratia темноте концентрацияЗ-ФГАуменьшается, а конmarcescens не активировалась ни одним из испыцентрация неорганического фосфата возрастает, танных м т болитов В фотосинтезирующих 17 43827 вызывая снижение АДФглюкозопирофосфорилазной аісгивности с последующим уменьшением биосинтеза АДФ-глюкозы и крахмала (ghosh, 1966) Впоследствии, АДФ-глюкозопирофосфорилаза из листьев шпината была очищена до гомогенного состояния, в ней было установлено присутствие субъединиц с молекулярными массами 51 и 54 кДа (Morell, 1987) Используя антитела к обеим субъединицам, показали гомологичность белка с молекулярным весом 51 кДа как АДФглюкозопирофосфорилазе из эндосперма кукурузы, так и соответствующему ферменту из клубней картофеля Однако гомологичность белка шпината с молекулярной массой 54кДа обоим этим ферментом не установлена Последовательность клонированной к ДНК субъединицы АДФ-глюкозопирофосфорилазы из эндосперма риса была установлена Anderson(1989a) Полученный им клон кодирует белок, состоящий из 483 аминокислотных остатков Сопоставление АДФглюкозопирофосфорилазы из эндосперма риса и АДФ-глюкозопирофосфорилазы Е coh выявило примерно 30% - ную идентичность их первичной структуры В 1989г было проведено секвенирование почти полной последовательности клонированной к ДНК из эндосперма пшеницы (Olive, 1989) Оказалось, что аминокислотная последовательность АДФ-глюкозопирофосфорилазы из эндосперма пшеницы приблизительно на 24% идентична последовательности АДФглюкозопирофосфорилазы из Е coh В то же время, последовательность этих ферментов из пшеницы и риса характеризуется 40% - ной гомологичностью Дополнительное подтверждение существования дерегулируемых растительных АДФглюкозопирофосфорилаз дикого типа содержится в работе Olive с соавторами (Olive, 1989) Они установили, что АДФ-глюкозопирофосфорилазы из листьев и эндосперма пшеницы отличаются по характеру аллостерической регуляции АДФглюкозопирофосфорилаза эндосперма не активируется 3 - ФГА, а для снижения ее активности на 50% требуется в 10 раз больше ингибитора ортофосфата чем вслучае аналогичного фермента из листьев пшеницы АДФ-глюкозопирофосфорилаза из эндосперма кукурузы после очистки обладала такими же каталитическими и регуляторными свойствами, как другие растительные АДФглюкозопирофосфорилазы (Plaxton, 1987) Молекулярная масса нативного фермента из эндосперма кукурузы составляла 230000, он имел четыре субъединицы примерно одинакового размера Молекулярная масса нативной АДФглюкозопирофосфорилазы картофельных клубней составляет 200000, при массе субъединиц 50000 (Sowokmos, 1982) Активность АДФглюкозопирофосфорилазы из этого источника практически полностью определяется концентрациейЗ-ФГАи, также как активность других растительных АДФ-глюкозопирофосфорилаз, ингибируется неорганическим фосфатом Показано, что 18 АДФ-глюкозопирофосфорилазы из клубней и листьев картофеля обладают сходными физическими, каталитическими и аллостерическими свойствами (Anderson 1989B) Получение измененных генов АДФглюкозопирофосфорилазы посредством мутагенеза Специалистам известно, что усиление продукции крахмала может, помимо прочего, быть достигнуто применением генов АДФглюкозопирофосфорилазы, которые слабо поддаются аллостерической регуляции ("дерегулируемые гены") или, что более предпочтительно, в значительной мере нечувствительны к аллостерической регуляции ("нерегулируемые гены") при сохранении требуемой каталитической активности Кодирующая структурная последовательность для бактериальных или растительных АДФглюкозопирофосфорилаз из Е coh или другого подходящего хозяина может быть подвергнута мутагенному воздействию, а затем скринингу с целью выявления случаев повышенной продукции гликогена, как это описано для гена glgC16 E coh Следует помнить, что использование гена, кодирующего АДФ-глюкозопирофосфорилазу, который поддается модификации только соответствующими модуляторами (активаторами и ингибиторами), присутствующими в данной растительной ткани в концентрациях, которые не оказывают существенного воздействия на каталитическую активное т не требует какой - либо модификации фермента (гена) Такие " нерегулируемые " или " дерегулируемые " гены АДФ-глюкозопирофосфорилазы могут быть внедрены в растительный геном, как описано в данной заявке, для получения трансгенных растений, содержащих повышенное количество крахмала В качестве примера можно указать, что любой ген АДФ-глюкозопирофосфорилазы можно клонировать в Е coh В (штамм AC7ORI - 504) (Leund, 1986) Этот штамм имеет дефектный ген АДФглюкозопирофосфорилазы и отличается тем, что активность других гликоген - синтезирующих ферментов понижена в нем в 5 - 7 раз по сравнению с нормальной величиной к ДНК гена АДФ - глюкозопирофосфорилазы может быть локализована в плазмиде после промотора glgC E coh или любого другого бактериального промотора Полученную конструкцию подвергают направленному или неупорядоченному мутагенному воздействию, после чего наслаивают клетки на обогащенную среду, содержащую 1% глюкозы После развития колоний культуру погружают в йодный раствор, содержащий Ь и KI при процентном соотношении веса к объему воды соответственно 0,2 и 0,4 (Creuzet Sigal 1972) Колонии, синтезирующие повышенное количество гликогена, идентифицируются по более темному окрашиванию при сопоставлении с аналогичными культурами не модифицированных клеток Поскольку в процессе мутагенеза может произойти изменение и самого промотора, после первого же скрининга на наличие мутантной АДФглюкозопирофосфорилазы требуется повторное клонирование гена этого фермента в не модифицированном векторе, после этого тем же способом 43827 20 19 проводят скрининг полученной плазмиды Мутан1966), Copelad and Preiss, 1981, Sowokmos and ты, отобранные в течение обоих раундов скрининPreiss, 1982, Moell et al , 1987 Plaxton and Preiss, га тестируют на АДФ-глюкозопирофосфорилазную 1987, Preiss, 1988), а соотношениеЗ-ФГАи Pi имеактивность в присутствии активаторов и ингибитоет первостепенное значение для регуляции биоров и без них Новый мутант характеризуют путем синтеза крахмала посредством модуляции активсравнения реакции модифицированной и не моности ADPgPP (Santanus and Heber, 1965, Heldt et дифицированной АДФ-глюкозопирофосфорилаз al , 1977 Kaiser and Bassham,1979) Растительные на действие активаторов и ингибиторов АДФ-глюкозопирофосфорилазы представляют собой гетеротетрамеры двух крупных /"стянутых" В работе Plaxto и Preiss(1987) показано, что и двух малых/ "нестабильных" субъединиц (Morell АДФ-глюкозопирофосфорилаза из эндосперма et al , 1987, Lin et al , 1988a, 1988B, Knshnan et al , кукурузы регулируется таким же образом, как дру1986 OKita et al , 1990) Имеются убедительные гие растительные АДФ-глюкозопирофосфорилазы доказательства, что гетероте трамеры представ(Plaxton and Preiss, 1987) Одновременно эти авляют собой наиболее активную форму ADPgPP торы установили, что более ранние сообщения, Это подтверждается обнаружением мутантных согласно которым активность АДФ"бескрахмальных" растений, в которых отсутствуглюкозопирофосфорилазы из эндосперма кукурует одна или обе субъединицы (Tsai and Nelson, зы повышается в отсутствие активатора (3 - ФГА) 1966,Dickmson and Preiss, 1969, Lin et al , 1988a, и характеризуется пониженной чувствительностью 1988в) И свойствами гомотетрамера "ADPgPP" к неорганическому фосфату, были связаны с промалых субъединиц, который обладает лишь нетеолитическим расщеплением фермента в прозначительной ферментативной активностью (Lin et цессе его выделения Изменяя ген АДФal , 1988в) Кроме того, обе субъединицы обнаруглюкозопирофосфорилазы таким образом, чтобы живали способность к взаимодействию с предпополучать белок, аналогичный протеолитически лагаемыми эффекторами (Morell et al , 1988) расщепляемой АДФ-глюкозопирофосфорилазе из эндосперма кукурузы, наблюдали снижение аллоНерегулируемые ферментные разновидности стерической регуляции растительных ADPgPP были идентифицированы и При анализе жидкой культуры Е coh на АДФглюкозопирофосфорилазную активность, клетки подвергают центрифугированию, а затем ресуспендируют приблизительно в 2мл экстрагирующего буферного раствора (0.05М глицилглицина рН 7,0, 5,0мМ ДТЭ и 1,0мМ ЭДТА) на грамм клеточной массы Затем клетки лизируют, дважды помещая под пресс Полученные клеточные экстракты на 5мин помещают в микроцентрифугу, надосадочную жидкость обессоливают, пропуская через спиновую колонку g - 50 Оценку ферментативной активности при биосинтезе АДФ-глюкозы проводят с помощью одной из модификаций общепринятой методики (Haugen, 1976) В аналитическом объеме ЮОмкл содержится Юмкмолей Hepes рН 7,7, 50 мкг бычьего сывороточного альбумина, 0,05мкмоля С 14 - глюкоза 1 - фосфата, 0,15микромоля АТФ, 0,5микромоля МдСЬ, 0,1 мкг неорганического фосфата из дрожжей (кристаллического), 1мМ молибдата аммония, фермент, активаторы и ингибиторы (в соответствии с задачами исследования) и вода Смесь указанного состава инкубируют на протяжении Юмин при 37°, реакцию прекращают кипячением в течение бОсекунд Затем смесь помещают в микроцентрифугу, а 40мкл полученной надосадочной жидкости вводят в анионообменную колонку Synchrom Synchropak AX - 100 для высокоэффективной жидкостной хроматографии Для элюирования используют 65мМ КРі рН 5,5 Выход не прореагировавшего С 14 - глюкоза - 1 - фосфата регистрируют примерно через 7 - 8минут после начала элюции, а выход С1 - АДФ-глюкозы через 13минут О ферментативной активности судят по содержанию радиоактивности в пике АДФглюкозы Активность растительных ADPgPP строго регулируется как положительными (3 - фосфоглицерат, 3 - ФГА), так и отрицательными (неорганический фосфат, Pi) эффекторами (ghosh and Preiss, охарактеризованы теми же методами, с помощью которых были получены glgC16 E coh и сходные мутанты Имеются сообщения о клонировании из однодольных и двудольных растений разнообразных к ДНК ADPgPP или фрагментов таких к ДНК для больших и малых субъединиц (Anderson et al , 1989а Olive et al , 1989, Muller et al , 1990,Bhave et al , 1990, du Gardm and Berhm, 1991) Белки, кодируемые растительными кДНК, равно как и ДНК бактериального происхождения, отличаются высокой степенью консервативности (Bhave et al , 1990) В частности, высоко консервативная область, в состав которой входят также некоторые остатки, ответственные за функцию фермента и его взаимодействие с эффекторами, была обнаружена Morell et al, (1988) и du Gardm and Berhm (1991) Выделены клоны генов субъединиц ADPgPP картофельных клубней Среди них полный ген малой субъединицы, образованный путем соединения последовательностей первого экзона геномного клона с почти полноразмерной клонированной кДНК того же гена, и почти полный ген большой субъединицы Нуклеотидная (SEQ ID ^ о 7)и аминокислотная (SEQ ID ^ о 8) последовательности собранного таким образом гена малой субъединицы представлены на рисунке 5 Показанная нуклеотидная последовательность отличается от последовательности исходно выделенного гена следующим образом в кодон АТд был введен сайт Bgl2 + Ncol для более успешного клонирования гена в Е coh и растительных векторов экспрессии, для чего применяли сайт направленный мутагенез с использованием олигонуклеотидной затравки с последовательностью GTTgATAACAAgATCTgTTAACCATggCggCTTCC (SEQ ID N О 11) Сайт S a d интродуцировали в стоп - кодон, используя олигонуклеотидный праймер с последовательностью CCAgTTAAAACggAgCTCATCAgATgATgATTC 43827 21 N (SEQ ID ^ O 12) В качестве 3 - клонирующего сайта служил сайт S a d Внутренний сайт Bgl 2 удаляли, используя олигонуклеотидный праймер с последовательностью GTgTgAgAACATAAATCTTggATATgTTAC (SEQ ID N o 13) Экспрессию собранного таким образом гена осуществляли в Е coli под контролем промотора гесА в кассете РгесА - ген IOL (Wong et al , 1988) для получения поддающегося измерению количества белка Инициирующий метиониновый кодон внедряли посредством сайт - направленного мутагенеза, используя для этой цели олигонуклеотидную затравку с последовательностью GAATTCACAgggCCATggCTCTAgACCC (SEQ ID N 0 14), что обеспечивало экспрессию зрелого гена Нуклеотидная (SEQ ID ^ О 9) и аминокислотная (SEQ ID ^ О 10) последовательности для практически полноразмерной большой субъединицы гена представлены на рисунке 6 Инициирующий метиониновый кодон внедряли посредством сайт - направленного мутагенеза, используя олигонуклеотидный праймер с последовательностью A g T A A C g C T g T A T T T A C C A T ( E ID N 0 15) A A C A C T C A g C T C C g g T A T C gS Q на сформированном ^ - конце Назначение инициирующего метионинового кодона состоит в повышении эффективности экспрессии гена этой большой субъединицы в Е coli Сайт Hind 3 локализован на расстоянии 103 пар оснований после стоп - кодона и служит в качестве 3' - клонирующего сайта Полный ген ADPgPP выделен с помощью методики быстрой амплификации концов кДНК (5' - RACE метод, описанный Frohman, 1990, Frohman e t a l , 1988 и Loh etal ,1988 и Loh etal ,1989) Для этой цели использовали олигонуклеотидные затравки с последовательностями 1)gggAATTCAAgCTTggATCCCgggCCCCCCCCCCCCCCC(SEQ ID ^ О 16) 2) gggAATTCAAgCTTggATCCCggg (SEQ ID N 0 17) и 3) CCTCTAgACAgTCgATCAggAgCAgATgTACg (SEQ ID N О 18) Первые из двух этих последовательностей эквивалентны соответственно ANpolyC и А -^ праймерам, описанным Loh et al , (1989), а третья представляет собой ревертивный комплемент последовательности, локализованной в крупном гене ADPgPP после сайта Pstl с последовательностью,показанной на рисунке 6 Продукты полимеразной цепной реакции (ПЦР) 5' - праймера клонируются как фрагменты EcoRI/Hmd3/BaMHI - Pst I и легко соединяются с уже имеющейся частью гена Слабо регулируемые мутантные формы ADPgPP идентифицируют, скачала подсчетом колоний в подвергшейся мутагенному воздействию культуре Е coli, которые характеризуются повышенной продукцией гликогена, затем окрашиванием колоний в возрасте 24 - 48часов на пластинах из Лурия-агара, содержащего 1% глюкозы, и, наконец, анализом реакции ферментов ADPgPP из этих изолятов на положительные и 22 отрицательные эффекторы ферментативной активности (Cattaneo et al , 1969, Preiss et al , 1971) Аналогичный подход применяют при выделении вариантов растительных ADPgPP ферментов При наличии системы экспрессии гена каждой субъединицы, мутагенез таких генов осуществляют раздельно, используя любой из многочисленных методов, имеющихся для этой цели, как физических, так и химических (Miller, 1972), в культурах, которые содержат ген или очищенную ДНК Другой подход состоит в использовании методики ПЦР полного гена в присутствия ингибирующих ионов Мп + + В этих условиях высока частота ненаправленного включения нуклеотидов (Ehrhch, 1989) Реакцию ПЦР можно применять также в случае, когда праймер непосредственно примыкает к специфическому участку гена, после чего подвергшийся мутагенезу фрагмент реклонируют в неизмененные сегменты гена Для получения короткой области гена с высокой степенью мутагенной модификации используют также ненаправленное введение олигонуклеотидов, смешивая их в условиях синтетической реакции, которая завершается их рандомизированным включением во все положения указанной области Эта короткая область фланкируется ре-стрикционными сайтами, которые применяют для повторной вставки ее в остальную часть гена Полученные таким образом культуры или трансформанты подвергают скринингу по стандартной йодной методике с целью выявления культур или трансформантов с повышенным по сравнению с контролем содержанием гликогена Такой скрининг предпочтительно проводят в Е coli с недостаточностью только ADPgPP активности (например, Е coli LC618' - спонтанном мутанте LC618, описанном Cattaneo et al , 1969 и Creuzet-Sigal et al , 1972), т е в бактериях, с гликоген минусовым фенотипом, которые комплементарны гликоген положительным организмам по glgC E coli должны сохранять другие ферментативные активности, необходимые для биосинтеза гликогена Экспрессия обоих генов осуществляется одновременно в одном и том же хозяине (Е coli) , куда их вводят в составе совместимых плазмид, имеющих, кроме того, сходное количество копий в бактериальном хозяине с целью обеспечения максимальной продукции гетеротетрамеров К числу совместимых плазмид относятся плазмиды серии pBR322/pBR/327/pUC (отбор по реакции на ампициллин), конструирование которых базируется на использовании репликона ColEI, и плазмида рАСУС177 (отбор по реакции на канамицин), конструирование которой базируется на репликоне pl5A (Chand and Cohen, 1978) Применение отдельных плазмид дает возможность проводить скриниг двух модифицированных, мутантных популяции, после их введения в одного хозяина После повторного выделения плазмидной ДНК из колоний с более интенсивным окрашиванием йодным раствором кодирующие последовательности ADPgpp реклонируют в векторах экспрессии, оценивают фенотип и определяют активность ADPgPP, а также ее изменения под воздействием эффекторных молекул Улучшенные варианты характеризуются более высоким показателем у т а х , пониженной степенью ингиби 23 43827 рования отрицательным эффектором (Pi) и слабой зависимостью максимальной активности от положительного активатора (3-ФГА) При анализе этих улучшенных свойств активность ADPgPP оценивают в присутствии Pi при концентрации 0,045мМ (1о5= 0,045мМ) или в присутствии 3-ФГА при концентрации 0,075мМ (Aos - 0,075мМ) При этих концентрациях Pi, и 3-ФГА улучшенные варианты характеризуются соответственно снижением активности менее чем на 40% и ее увеличением более чем на 50% После выделения улучшенных вариантов и идентификации обусловливающей активность субъединицы (или субъединиц), проводят секвенирование нуклеотидов для выявления мутации (й) Наличие последней подтверждают, воссоздавая соответствующую модификацию посредством сайт-направленного мутагенеза с повторным определением активности ADPgPP в присутствии активатора и ингибитора После этого мутацию переносят в эквивалентный ген кДНК ADPgPP посредством реклонирования области, содержащей мутацию, из измененной бактериальной формы экспрессии в растительную форму, где имеется, транспортная последовательность амилопластов, или путем сайт-направленного мутагенеза полноразмерного нативного гена растительной ADPgPP Экспрессия АДФ-глюкозопирофосфорилазной активности в хлоропластах и амилопластах Известно, что биосинтез крахмала происходит в хлоропластах и амилопластах растений (в дальнейшем изложении эти структуры обобщенно именуются "пластидами") В пластидах изученных к настоящему моменту видов растений локализуется АДФ-глюкозопирофосфорилаза В проростках гороха локализация этого фермента ограничена хлоропластами (Levi, 1978) В листьях шпината в хлоропластах же локализуются все формы АДФглюкозопирофосфорилазной активности, вместе с крахмало-синтазой (Mares, 1978 и OKita, 1979) Иммуноцитохимическими методами установлено, что АДФ-глюкозопирофосфорилаза картофельных клубней присутствует исключительно в амилопластах (Kim, 1989) Исследования эндосперма риса также выявили преимущественную локализацию АДФ-глюкозопирофосфорилазной активности в амилопластах (Nakamura, 1989) Экспрессия многих локализованных в хлоропластах белков обеспечивается генами клеточных ядер, откуда они в качестве предшественников переносятся в хлоропласты специфичным для последних транспортным белком (СТР), который отделяется от них в процессе включения В качестве примеров связанных с хлоропластами белков можно назвать рибулезо-1,5-дифосфат карбоксилазу (ssRUBISCO, SSU), 5-энолпируватшикимат-Зфосфат синтазу (EPSPS), ферродоксин, ферродоксин-оксидоредуктазу, светопоглощающие белковые комплексы 1 и 2, а также тиоредоксин F Установлено, что в условиях in vivo и in vitro обычно не связанные с хлоропластами белки могут быть перенесены в них после слияния с последовательностями СТР, что вполне достаточно для обеспечения такого транспорта Точно также, экспрессия белков амилопластов в форме предшест 24 венников осуществляется ядерными генами, после чего они перекосятся в амилопласты специфичными для последних транспортными белками (АТР) Считается также, что хлоропласты и амилопласты формируются из одних и тех же пластид, а единственное функциональное различив между ними, состоит в том что первые локализуются в фотосинтетических клетках, а последние - в клетках, неспособных к фотосинтезу Более того,, в таких растениях, как Picea aBies наблюдали взаимопревращение обеих органелл (Senser, 1975) Имеются также сообщения, согласно которым геном амилопластов и хлоропластов данного растения практически неотличимы (Scott, 1984, Macherel, 1985, Catley, 1987) Показано также, что транспортный белок амилопластов может переносить связанные с ним белки на хлоропласты (Klosgen, 1989) В соответствии с одной из методик используют последовательность СТР, источником которой служит reHssRUBISCO IA из Arabidopsis thahana (SSU AI) (ТІмко, 1988) Эту последовательность СТР (СТР 1) конструируют, комбинируя несколько сайт-направленных мутагенных воздействий Последовательность нуклеотидов в СТР 1 (SEQ ID ^ О 5) и соответствующая аминокислотная последовательность (SEQ ID ^ О 6) показаны на рисунке 3 СТР 1 формируется из SSUIA СТР (аминокислотные остатки I - 55), первых 23 аминокислотных остатков зрелого белка SSUIA (56 - 78), серинового остатка (аминокислотный остаток в положении 79), нового фрагмента, повторяющего аминокислотную последовательность 50 - 56 СТР и двух первых фрагментов зрелого белка (аминокислотные остатки 80 - 87), аланинового и метионинового остатков в положениях 88 и 89 Рестрикционный сайт ^ col локализуется на З'-конце (перекрывает Met-кодон), что обеспечивает точное слияние с 5'-фрагментом гена АДФглюкозопирофосфорилазы На более поздней стадии вверх от ^ -концевой последовательности SSUIA вводят сайт Bgl 2, что облегчает вставку слитых фрагментов в трансформирующие векторы Слитые фрагменты собирают между структурами ДНК, кодирующими СТР 1, СТР и ген glgC16 из Е соїі, в результате чего образуется полная последовательность структурной ДНК, которая кодирует слитый полипептид, состоящий из транспортного пептида пластид и АДФглюкозопирофосфорилазы Понятно, что если в соответствии с настоящим описанием необходимо использовать либо одну из кДНК растительной АДФглюкозопирофосфорилазы, кодирующих стянутую и/или нестабильную субъединицы, либо обе кДНК растительной ADPgPP, кодирующих стянутую и нестабильную субъединицы, проще всего и предпочтительнее использовать СТР или АТР В связи с этим, для целей настоящего изобретения термин "транспортные пептиды пластид" должен обозначать транспортные пептиды и хлоропластов, и амилопластов Столь же очевидно, что, используя функциональные свойства данного вида транс 25 26 содержащем 40% метанола и 10% уксусной кислоты После этого его насыщают EN HANCE™ (DuPont) погружая на 20 - ЗОминут, а затем высушивают в гелевой сушилке С помощью аутографической методики, используя усиливающий экран в условиях экспозиции на протяжении ночи, оценивают включение АДФ-глюкозопирофосфорилазы в изолированные хлоропласты Альтернативный способ повышения содержания АДФ-глюкозы в растительных клетках состоит в выделении генов, кодирующих факторы транскрипции, которые взаимодействуют с локализованными выше их регуляторными элементами гена(ов) растительной АДФглюкозопирофисфорилазы Повышенная экспрессия этих факторов транскрипции в растительных клетках может сопровождаться усилением экспрессии гена АДФ-глюкозопирофосфорилазы В этих условиях сохраняется повышенное содержание крахмала благодаря увеличению активности АДФ-глюкозопирофосфорилазы, хотя механизм такого повышения носит иной характер Методы выделения факторов транскрипции описаны Katagin (1989) Полиаденилирующий сигнал 3' нетранслируемая область химерного растительного гена имеет в своем составе полиаденилирующий сигнал, назначение которого в растениях состоит в присоединении полиаденилатных нуклеотидов к З'-концу РНК В качестве примеров подходящих для этой цели З'-областей можно привести I) 3' транскрибируемые, не транслируемые области, включающие полиаденилирующий сигнал из плазмидных генов Agrobactenum, индуцирующих опухоли (Ті), В частности гена нопалинсинтазы (NOS), и 2) растительные гены типа генов резервного белка сои и малая субъединица гена рибулезо-1,5-дифосфат карбоксилазы (ssRUBISCO) Примером предпочтительной 3'области может служить соответствующая область гена NOS, которая более подробно описана в ниже Трансформация/регенерация растений К числу растений, в которых с помощью описанного изобретения можно увеличить содержание крахмала, относятся кукуруза, пшеница, рис, морковь, лук, горох, томат, картофель, батат, арахис, различные разновидности рапса, ячмень, сорго, маниок, банан, соя, салат, яблоня, орешник Этот перечень не является исчерпывающим Двунитевая молекула ДНК согласно настоящему изобретению, содержащая функциональноактивный ген растительной АДФглюкозопирофосфорилазы, может быть внедрена в растительный геном любым из используемых для этой цели способов Для этой цели пригодны трансформирующие векторы, получаемые из Tiплазмид Agrobactenum tumefaciens, а также описанные, Herrera-Estrella (1983), Bevan (1983), Klee (1985) и в издании ЕРО 120,516 (Schilperoort et al) Помимо применения трансформирующих векторов из Ті -плазмид или корневых плазмид (Ri) Agrobactenum, используют альтернативные способы внедрения полученных в соответствии с данным изобретением ДНК-конструкций в растительные клетки К их числу относятся, например, 43827 портного белка пластид для введения соответствующей АДФ-глюкозопирофосфорилазной активности в хлоропласты и/илиамилопласты растительной клетки,- в зависимости от тканевой специфичности промотора, можно получать и другие химерные конструкции Функциональные свойства слитого полипептида оценивают с помощью описанной ниже методики в условиях ин витро Анализ включения в пластиды Интактные хлоропласты выделяют из салата (Latuca Saliva, var longifoha) посредством центрифугирования в градиенте перколла/фиколла, пользуясь модифицированной методикой Bartlett et al (1982) Полученный осадок из интактных хлоропластов суспендируют в 0,5мл стерильного сорбитола (ЗЗОмМ) в 50мМ Hepes-KOH буфере рН 7,7 с известным содержанием хлорофилла, которое доводят до конечной величины 4мг/мл, используя вышеуказанный буферный раствор Определение хлорофилла проводят, как описано Arnon (1949) Выход интактных хлоропластов из одной головки салата в пересчете на хлорофилл составляет 3 - 6мг В типичном случае в ЗООмкл содержится 5мМ АТФ, 8,ЗмМ немеченого метионина, 322мМ сорбитола, 58,ЗмМ Hepes-KOH буфера (рН 8,0), 50мкл трансляционных продуктов лизата ретикулоцитов и интактные хлоропласты L Sativa (200мкг хлорофилла) Реакционную смесь помещают в стеклянную пробирку размером 10 х 75мм и слегка встряхивают при комнатной температуре непосредственно перед считывающим устройством спектроскопа на оптических волокнах при максимальной освещенности (150Ватт) В разные сроки отбирают аликвоты реакционной смеси объемом по 50мкл и подвергают их фракционированию посредством центрифугирования в силиконсю-масляном градиенте (ЮОмкл в полиэтиленовых пробирках на 150мкл) при 11000 х g в течение ЗОсекунд В этих условиях интактные хлоропласты осаждаются ниже силиконовомасляного слоя, а инкубационная среда (содержащая лизат ретикулоцитов) остается на поверхности градиента Сразу после центрифугирования силиконово-масляный градиент замораживают на сухом льду После этого осадок хлоропластов ресуспендируют в 50 - ЮОмкл лизисного буфера (ЮмМ Hepes-KOH pH7,5, 1мМ фетопротеина сыворотки жеребой кобылы, 1мМ бензамидина, 5мМ Е-амино-п-калроевой кислоты и 30мкг/мл апротинина) и центрифугируют в течение 20мин при 15000 х g для осаждения мембран тилакоидов Прозрачный супернатант (белки стромы), полученный в результате центрифугирования, и инкубационную среду, содержащую лизированные ретикулоциты, полученные в каждом эксперименте, объединяют с равным объемом 2Х NaDodSO4буфера для электрофореза в полиакриламидном геле, который осуществляют в соответствии с нижеследующим описанием Электрофорез в полиакриламидном геле с додецилсульфатом натрия проводят, как описано Laemmh (1970), в 3 - 17% (вес/объем) вязком акриламидном геле (60 х 1,5мм) с 3% (вес/объем) рыхлого акриламидного геля (5мм х 1,5мм) Гель фиксируют в течение 20 - ЗОминут в растворе, 43827 28 ДНК нопалинового типа из pTiT 37 Саутернанализ показал, что плазмида pMON 505 и любая имеющаяся в ней ДНК могут быть интегрированы в геном растительной клетки, иными словами, цельная плазмида представляет собой Т-ДНК, внедренную в геном растительной клетки Один из концов интегрированной ДНК локализован между правой краевой последовательностью и геном нопалин-синтазы, а другой - между краевой последовательностью и последовательностями pBR 322 В случае получения требуемого количества клеток (или протопластов), содержащих ген АДФглюкозопирофосфорилазы или соответствующую кДНК, эти клетки (или протопласты) могут быть регенерированы в цельное растение Выбор способа регенерации не является лимитирующим фактором, и для различных растений-хозяев имеются апробированные экспериментальные протоколы, в том числе для видов из семейства бобовых (люцерны, сои, клевера и других), зонтичных (моркови, укропа, сельдерея), крестоцветных (капусты, редиса, рапса и т п), тыквенных (дынь и огурцов), злаковых (пшеницы, риса, кукурузы и Плазмидный вектор pMON 530 (Rogeres, S g, других) пасленовых (картофеля, табака, томатов, 1987) может быть особенно полезным трансфорперца) и многих других культур (см , например, мирующим вектором на основе Agrobactenum для AMMirato, 1984, Shimamoto, 1989, Fromm, 1990, использования с целью трансформации двудольVasil, 1990) ных растений Плазмида pMON 530 (см рисунок 3) является производной плазмиды pMON 505, полуНижеследующие примеры имеют целью лучченной путем переноса фрагмента Stul-Hmd 3 ше проиллюстрировать настоящее изобретение и длиной 2,3килооснования из плазмиды pMON 316 не должны рассматриваться как ограничивающие (Rogers, S g , 1987) в плазмиду pMON 526 Посферу его применения Разумеется, допустимы следняя представляет собой простую производразнообразные модификации, упрощения и другие ную плазмиды pMON 505, в которой сайт Smul изменения предлагаемых методов и генных конэлиминирован посредством переваривания ХмаІ, струкций при условии следования духу и рамкам обработкой полимеразои Klenow'a и последующим изобретения легированием Плазмида pMON 530 сохраняет все Примеры свойства плазмида pMON 505 и вектора экспресси Пример 1 CaMV35S-NOS и содержит уникальный расщепДля экспрессии гена glgC16 E coh в растиляемый сайт для Smal между промотором и полительных клетках и переноса фермента на пластиаденилирующим сигналом ды, ген подлежит слиянию с ДНК, кодирующей специфичный для пластид транспортный пептид Бинарный вектор pMON 505 представляет со(именуемой в последующем геном СТР/АДФбой производное плазмиды pMON 200 (Rogers, глюкозопирофосфорилазы) и с соответствующими S g , 1987), в котором область, гомологичная регуляторными областями Это достигается клоплазмиде Ті (І_ ІН) заменена фрагментом Hind 3нированием гена gig C16 в наборе плазмидных Smal длиной 3,8 килосонования (pTYS 75) минивекторов, содержащих требуемые последоваплазмиды RK2 (Schmidhauser and Helmski, 1985) тельности Этот фрагмент содержит точку инициации репликации RK2 (onV) и точку инициации переноса (опТ) Плазмида pLP 226 содержит ген glgC16 на для конъюгации в Agrobactenum посредством профрагменте Нтс 2, который клонируют в вектор цедуры тройственного скрещивания (Horsch and pUC 8 в сайте Нтс 2 (Leung et al , 1986) Плазмиду Klee, 1986) Плазмида рМОТ 505 сохраняет все pLP 226 получали от д-ра Прейса (Gack Preiss) из важные свойства плазмиды pMON 200, в том чисМичиганского Университета и трансформировали ле синтетический мультилинкер для вставки жеее в замороженные, компетентные клетки Е coh лаемого фрагмента ДНК, химерный ген GM 101, соответствующим образом подготовленNOS/NPTII/NOS, обусловливающий устойчивость ные обработкой хлористым кальцием, как описано растительных клеток к канамицину, участок, опреSambrook с соавторами (1989) Трансформироделяющий устойчивость к спектиномициванные таким образом клетки наслаивали на плану/стрептомицину при селекции Е coh и А стины 2ХУТ (инфра), в составе которых имелся tumefaciens, интактный ген нопалин-синтазы для ампициллин в концентрации 100мкг/мл Очистку упрощения подсчета трансформантов и оценки плазмиды pLP 226 производили методом быстрой наследования в потомстве, точку инициации репщелочной экстракции (БЩЭ) из 5мл культуры поликации pBR 322 для обеспечения получения сле ее экспозиции в течение ночи (Birnboim and больших количеств вектора в Е coh Плазмида Doly, 1979) pMON 505 содержит только один край Т-ДНК, Для слияния гена glgC16 с ДНК, кодирующей имеющий своим происхождением правый конец Ттранспортный пептид хлоропластов, необходимо 27 применение липосом, электроперфорации химических агентов, облегчающих включение ДНК, введение свободной ДНК посредством микро бомбардировки и трансформация с использованием вирусов или пыльцы Плазмидный вектор экспрессии, необходимый для экспрессии гена glgC16 E coh и других ADРдРР генов в ОДНОДОЛЬНЫХ растениях, состоит из следующих компонентов промотора, характеризующегося специфичностью или повышенной экспрессией в аккумулирующих крахмал тканях однодольных растений (обычно в эндосперме), в частности промотора гена зеинов, присутствующего в эндосперме кукурузы (Pedersen et al , 1982), интрона, по которому происходит расщепление для облегчения экспрессии гена, например АДН 1интрона (Callas et at, 1987), и З'-аденилирующей последовательности, такой как последовательность 3' нопалин-синтазы (NOS - 3', Fraley et al, 1983) Такой вектор экспрессии может быть собран на репликонах, обеспечивающих большое число копий и пригодных для получения значительного количества ДНК 29 43827 30 наличие на 5'-конце гена сайта Ncol В равной межении еще одной ночи при 37° Ллазмиду ре, необходим сайт Sad, локализованный в нисвыделяли методом быстрой щелочной экстракции, ходящем от кодона-терминатора направлении, ДНК переваривали EcoRI.Ncol или их смесью Педля перемещения гена СТР/АДФреваренный материал фракционировали на агаглюкозопирофосфорилазы в следующий вектор розном геле, выделяя ожидавшиеся фрагменты Для того чтобы ввести эти сайты, использовали Плазмиду, полученную из образца 1, обозначали полимеразную цепную реакцию (^13), в которой как pMON20100 Она состояла из pgEM3zf+, ДНК матрицей служила плазмида pl_P 226, очищенная модифицированного SSU СТР Arabidopsis и гена методом быстрой щелочной экстракции, в количеglgC16 Слияние происходило таким образом, костве примерно 20нг Реакцию осуществляли в соторый обеспечивал транскрипцию с промотора ответствии с рекомендациями компанииSP6 полимеразы производителя (Perkm Elmer Cetus) Праймерами Для тестирования способности этой конструкслужили QSP3 и QSP7 Первый из них предназнации переносить АДФ-глюкозопирофосфорилазу в чался для вставки сайта Ncol, включающего старизолированные плазмиды салата, спайку товый кодон для гена glgC16 Праймер OSP7 гибСТР/АДФ-глюкозопирофосфорилаза транскрибиридизировали в 3' нетранслируемой области гена ровали и транслировали с целью получения меglgC16 и добавляли сайт Sad Термоциклизатор ченной 35 S АДФ-глюкозопирофосфорилазы Для был запрограммирован на 30 циклов со следуюполучения матрицы ДНК для транскрипции SP6 щими стадиями денатурирование при 94° в течеполимеразой, область, кодирующую СТР/АДФние 1 минуты, отжиг при 50° в течение 2 минут и глюкозопирофосфорилазу плазмиды pMON 20100, развертка при 72° в течение 3 минут Продолжиамплифицировали посредством ПЦР-реакции, тельность последней стадии после каждого цикла генерируя большое количество линейной ДНК С увеличивали на 15 секунд этой целью методом быстрой щелочной экстракПраймер QSP 3 ции получали 0,1 мкл очищенной pMON 20100, используя ее в качестве матрицы в ПЦР-реакции N 5'-ggAgTTAgCCATggTTAgTTTAgAg-3' (SEQ ID O 19) ^80 Затравкой служили коммерческий праймер Праймер QSP 7 промотора SP6 и (Ргомеда) и олиго QSP7 Прай5 99CC9A9CTC9TCAAC9CC9TCT9C9ATTT9TOC 3 (SEQ ID О 20) мер SP6 гибридизировался с промотором SP6 в В качестве вектора для клонирования продуквекторе и включал полную последовательность та полимеразной цепной реакции использовали промотора SP6 По этой причине продукт полимеpgEM3zf+ (полученный от Promega Мэдисон, Висразной цепной реакции при использовании в качеконсин), который переваривали Sad и Hind 3 Он стве праймера указанного олигонуклеотида долимел ДНК для модифицированной малой субедижен содержать последовательность, узнающую ницы СТР 1 Arabidopsis легированную по сайту SP6 полимеразу Праймер QSP7 образует гибрид с 3' не транслируемой областью гена glgC16 Это Hind 3 Последовательность ДНК (SEQ ID ^ О 5) тот же самый праймер, который применяли для и аминокислотная последовательность (SEQ ID введения сайта Sad в нисходящем направлении от кодона-терминатора glgC16 Термический цик^ 0 6) представлены на рисунке 3 лизатор был запрограммирован на 30 циклов с Развернутый в линию вектор обрабатывали денатурацией при 94° в течение 1 минуты, отжи5ед щелочной фосфатазы из кишечника телят в гом при 55° в течение 2 мин и разверткой при 72° течение ЗОмин при 56° Затем вектор и фрагмент, в течение 3 минут После каждого цикла продолполученный в ПЦР-реакции (^3) и содержавший жительность стадии развертки увеличивалась на ген glgC16 с новыми сайтами Ncol и Sad, наслаи15 секунд вали на агарозный гель и очищали фрагменты Праймер промотора SP6 связыванием на ДЭАЭ мембранах Протокол, использовавшийся, для очистки фрагментов связы5'-gATTTAggTgACACTATAg-3' (SEQ ID N 0 21) ванием на ДЭАЭ мембранах заимствован у Полимеразную цепную реакцию (ПЦГ ^80) Schleicher и Schuell и известен под названием проводили на агарозном геле в объеме 5мкл очи"Связывание и обнаружение ДНК и РНК с помосткой связыванием на мембране ДЭАЭ После щью S и S-ДЭАЭ мембран" элюции ДНК ее разводили в 20мкл ТЭ 2мкл очиЛигирование (^5) приводило к слиянию гена щенного на геле продукта реакции использовали в glgC16 и ДНК для модифицированного SSU СТР реакции транскрипции SP6 РНК-полимеразой ин Arabidopsis с pgEM3zf+ Продукт легирования совитро При постановке реакции следовали указадержал Змкг вектора переваренного Ncol и Sad, ниям изготовителя (Promega) для синтеза больвместе с Змкг продукта ПЦР ^13, который также ших количеств РНК (реакция в объеме ЮОмкл) был усечен Ncol и Sad и повторно очищен на геРНК, полученную в ПЦР-реакции ^80 с ДНК, исле 5мкл (из общего количества 20мкл) продукта пользовали для трансляции ин витро в системе легирования ФЪ трансформировали в замороженлизированных кроличьих ретикулоцитов ные компетентные клетки GMIOI, которые затем (Promega) Меченный 35 S белок, полученный в наслаивали на пластины 2XVT (16г/л бактотриптоПЦР-реакции (^80) с плазмидой pMON 20100, исна, Юг/л дрожжевого экстракта и Юг/л NaCI pH7,3, пользовали при тестировании включения в хлороотвержденных 1,5% агаром), содержавшие ампипласты ин витро, как описано ранее После проциллин цессинга проб из этой тест-системы их подвергали Образец 1 извлекали из пластины 1 после инэлектрофорезу в полиакриламидном геле с додекубации в течение ночи Его помещали в 4мл срецилсульфатом натрия (3 - 17% градиент) Гель в ды 2XVT и продолжали инкубирование на протятечение 20 - 30 минут фиксировали в растворе, N 43827 32 31 содержащем 40% метанол и 10% уксусную кислоприсутствия фрагмента EcoRI длиной 497 пар осту После этого его насыщали EN3HANCE™ в тенований в плазмиде pMON 20102, что характерно чение 20 - 30 минут с последующим подсушивадля гена glgC16 Эта плазмида содержала также нием в гелевой сушилке Результаты фрагмент Notl длиной 2,5килооснования, в состаауторадиографии получали после экспозиции в ве которого имелся промотор Еп-СаМУ35Э, ДНК течение ночи с применением усиливающего экрадля модифицированного SSU СТР Arabidopsis, ген на Полученные данные свидетельствуют о вклюglgC16 и З'-конец NOS чении слитого белка в изолированные хлороплаПосле этого кассету Notl длиной сты 2,5килооснования переносили в трансформирующий вектор pMoN 530 (рисунок 4) Этот вектор Затем была получена плазмида pMON 20100 имеет уникальный сайт Notl в области RK2, на для слияния с промоторомЕп-СаМТ35Э (Kay, R, расстоянии ровно 600 пар оснований от сайта 1987), а из плазмида pMON 999 выделяли З'-конец Hmd3 Вектор pMON 530 описан Rogers с соавтоNOS (Bevan, M , 1983) Реакция ПЦР^114 прохорами (1987) Двадцать (20)мкг этого вектора передила в присутствии плазмиды pMON 20100 в каваривали 40 единицами Notl в течение ночи при честве матрицы, а в качестве праймеров исполь37° После этого переваренный вектор дефосфозовали QSMII и QSMIO Первая ренатурировала рилировали 22 единицами щелочной фосфатазы до ДНК для модифицированного SSU СТР из кишечника телят при 37° в течение приблизиArabidop-CTP и формировала сайт ВдЗ длиной 7 тельно часа Вектор pMON 530 эктрагировали пар оснований вверх от стартового кодона АТд смесью фенола с хлороформом, потом хлороПлазмида QSMIO ренатурировала до З'-конца формом и, наконец, осаждали этанолом Десять гена glgC16 и добавляла сайт ХваІ непосредст(Ю)мкг плазмиды pMON 20102 также переваривавенно после кодона-терминатора, а также сайт ли в течение ночи при 37°, добавляя 40 единиц Sacl длиной 5 пар оснований Сайт Sad, ранее Notl Переваренный Notl вектор pMON 530 легиродобавленный к гену glgC16, локализовался на вали с кассетой Notl из плазмиды pMON 20102 расстоянии примерно 100 пар оснований вниз от при 15° на протяжении ночи Продукт легирования кодона-терминатора Термоциклизатор был запротрансформировали в замороженные компетентграммирован на 25 циклов со стадией денатураные клетки GM 101 Е coli, а трансформированные ции при 94° продолжительностью 1 минута, статаким образом клетки наслаивали на пластины со дией ренатурации при 55° продолжительностью 2 средой LB, содержавшей стрептомицин в конценминуты и стадией развертки при 72° продолжитрации 75мкг/мл тельностью 3 минуты После каждого цикла продолжительность последней стадии увеличивали Девять колоний, собранных с пластины, вына 15 секунд ращивали на среде LB (5мл) для скрининга ПлазQSMII праймер миды из культуры объемом 5мл получали мето5 A A A A C A A C A g C T C C A g T C C T C C 3 (SEQ ID g g g T T g A A Tg TC T T TCT T TC g дом быстрой щелочной экстракции Для скрининга ДНК сначала использовали переваривание Sail N О 22) продукты реакции разделяли на 1% агарозном QSMIO праймер геле Сопоставляя полученные данные с резульN,О 23) 5 ggCCgAgCTCTAgATTATCgCTCCTgTTTATgCCCTAAC 3 (SEQ ID татами переваривания Sail исходной плазмиды 95 из общего объема ЮОмкл полимеразной pMON 530, выделяли требуемую конструкцию, цепной реакции #114 осаждали этанолом и ресускоторую обозначали как pMON 20104 Ее ориентапендировали в 20мкл ТЭ 5мкл полученного матецию устанавливали посредством переваривания риала переваривали ВдЗ (4 единицы) и Sad (10 Pst 1 и двойного переваривания Ncol/ВдЗ Промоединиц) в течение ночи при 37° 5мкл (5мкг) вектотор Еп-СаМУ35Э управляющий геном СТР/АДФ ра pMON 999, содержащего промотор Епглюкозопирофосфорилазы, имеет ту же ориентаCaMY35S и З'-NOS, переваривали аналогичным цию что и промотор СаМУ35Э ,уже присутствуюспособом После переваривания рестриктивными щий в плазмиде pMON 530 ферментами, ДНК помещали на агарозный гель и очищали связыванием на мембранах ДЭАЭ КажВ порядке подготовки к трансформации клеток дую ДНК разводили в 20мкл ТЭ Один (1)мкл матабака плазмиду pMON 20104 посредством тройтериала из реакционной среды ^114 легировали с ственного скрещивания вводили в ASE Змкл вектора в общем объеме 20мкл Смесь для Agrobactenum, используя плазмиду-хелпер pRK легирования инкубировали при 14° в течение 7 2013 Микро организмы выращивали в среде LB, часов Десять (10)мкл продуктов легирования содержащей 25мкг/мл хлорамфеникола и трансформировали в замороженные компетент50мкг/мл канамицина, на протяжении 1,5 дней при ные клетки ММ294 и наслаивали их на пластины 30° Е coli, содержащих pRK 2013, в течение ночи LB (Юг/ л бактотриптона, 5г/л дрожжевого экскультивировали с канамицином (50мкг/мл) Источтракта, Юг/л NaCI и 1,5% агара до отверждения) ником этой культуры служили несколько колоний, вместе с ЮОмкг/мл ампициллина Колонии собиснятых с пластины Е coli содержавших pMON рали и инокулировали в пробирки, содержащие 2014, культивировали в среде LB с 75мкг/мл 5мл среды LB с 100мкг/мл ампициллина, оставлял стрептомицина После выращивания всех этих их для инкубации на ночь По окончании инкубакультур в пробирки добавляли по 4мл среды LB ции 5мл культуры использовали для изоляции вместе с ASE Agrobactenum, pRK 2013 и pMON плазмиднои ДНК методом быстрой щелочной экс20104 (по ЮОмкл каждого из компонентов) Смесь тракции Эти ДНК переваривали EcoRI, отдельные помещали в микроцентрифугу на 5мин, надосааликвоты переваривали Notl После анализа этих дочную жидкость отбрасывали, а осадок ресуспроб на агарозном геле получали подтверждение пендировали в оставшейся жидкости и пипеткой ІЛ| 33 переносили в центр пластины со средой LB После инкубации при 30° в течение ночи петлей переносили клетки на другую пластину со средой LB, содержавшей стрептомицин и хлора феникол в концентрациях соответственно 75 и 25мкг/мл После дополнительной экспозиции при 30° продолжительностью 1 - 2 дня на пластине для тройственного скрещивания pMON 20104, ASE Agrobactenum и pRK 2013 развивались колонии, тогда как на контрольных пластинах для скрещивания pMON 20104 и ASE (в отсутствие pRK 2013, необходимой для мобилизации) они отсутствовали По завершении тройственного скрещивания с пластины отбирали две колонии, которые инокулировали в жидкую среду, содержавшую 75мкг/мл стрептомицина, 25мкг/мл хлорамфеникола и 50мкг/мл канамицина Инкубация происходила при 30° Обе эти культуры использовали для трансформации в клетки табака 43827 34 агар Затем его помещали в центрифужные пробирки на 1,5мл и высушивали под вакуумом в аппарате SPEED УАС™ (Savant) Спустя несколько часов после начала сушки пробирки с содержимым взвешивали на аналитический весах с точностью до 0,1мг Затем пробирки снова переносили в аппарат SPEED УАС™ еще на несколько часов и повторно взвешивали, чтобы установить, достиг ли вес сухого вещества постоянной величины Сухой каллюс измельчали в пробирке и тщательно перемешивали материал для получения гомогенной смеси Пробы каждого из высушенных образцов каллюса помещали в предварительно взвешенные пробирки для микроцентрифугирования объемом 1,5мл Эти новые пробирки с сухим материалом также взвешивали, рассчитывая, таким образом, вес сухого каллюса Вес отдельных образцов колебался от 9 до 34мг Протоколом трансформации в диски лиственной ткани табака предполагается использование здоровых листьев в возрасте приблизительно 1 месяц Спустя 1 5 - 2 0 минут после стерилизации поверхности листьев 10% раствором клорокса с сурфактантом их трижды ополаскивали в стерильной воде, с помощью стерильного пробойника для бумаги получали дискообразные фрагменты листьев и помещали их в среду MSI04 (соли MS 4,3г/л, сахароза ЗОг/л, витамин В5 500X 2мл/л, нафти л уксусная кислота 0,1мг/л, сывороточный альбумин крупного рогатого скота 1,0мг/л) нижней поверхностью вверх для преинкубации в течение 1 дня После этого диски переносили в культуру Agrobactenum ASE/pMON 20104, предварительно инкубировавшуюся в течение ночи и разведенную 1 5 (т е примерно до 0,бед оптической плотности) Перенос состоял в помещении дисков в центрифужные пробирки, в которых находилась культура Спустя 30 - 60 секунд жидкость сливали, а диски помещали между стерильной и фильтровальной бумагой После этого их переносили на пластину со средой MSI04, по-прежнему верхней поверхностью вниз, для одновременного культивирования с бумажным диском Через 2 - 3 дня совместного культивирования диски, в том же положении, переносили на селективные пластины со средой NSI04 Спустя еще 2 3 недели наблюдали образование каллюса, который отделяли от листовых дисков Проростки аккуратно срезали с каллюса после того как они приобретали достаточно большие размеры, чтобы отличать их от стебля, а затем помещали на безгормональную селективную среду для укоренения (MSO MS-соли 4,3г/л, сахароза ЗОг/л, витамин Bs 500Х 2мл/л) Корни развивались спустя 1 - 2 недели Укоренившиеся проростки переносили в почву и продолжали выращивать в условиях повышенной влажности (например, в пластмассовых контейнерах или мешках) Закаливание проростков производили постепенной экспозицией в условиях влажности окружающей среды Содержание крахмала в трансформированной ткани каллюса определяли с помощью модифицированной методики Lin, с соавторами (1988а) Каллюс извлекали из среды, тщательно отделяя В каждую пробирку добавляли приблизительно по 1мл 80%-ного этанола после чего помещали их в водяную баню при 70° для инкубации в течение 1 0 - 2 0 минут После центрифугирования сливали отделившийся этанол, дважды промывали пробы его новыми порциями, а после последней промывки высушивали пробы в аппарате SPEED VAC™ и в каждую пробирку добавляли по 200мкл 0,2н КОН Затем пробы встряхивали для полного перемешивания и нагревали при 100° в течение 30 минут Перед нагреванием в пробках иглой прокалывали несколько дырочек, чтобы предупредить самооткрывание пробирок и потерю анализируемого вещества За процедурой нагревания следовало добавление в пробирки 40мкл 1н уксусной кислоты (к каждому из образцов), а после нее - 35мкл (7,4 единиц) альфа-амилазы (панкреатической) Затем пробирки оставляли при 37° на 30 минут На следующей стадии в них добавляли по пять единиц (в 5мкл) амилоглюкозидазы Aspenllus mger вместе со 160мкл ЮОмМ ацетата натрия рН 4,6 Пробы нагревали при 55° на протяжении часа, затем кипятили в течение 2 - 3 минут и сразу же центрифугировали в микроцентрифуге После этого пробы снова высушивали в аппарате SPEED YAC™ и повторно суспендировали в 10ООмкл 10ОмМ трис-СІ буфера рН 7,5 Затем определяли содержание в пробах глюкозы, используя для этой цели коммерческую тест-систему компании Сигма {Ф 16 - 10) Методика основана на превращении присутствующей в пробах глюкозы (+АТФ) в глюкозо-6-фосфат и АДФ под воздействием гексокиназы После этого глюкозо-6-фосфат (+НАД) превращается в 6фосфоглюконат +НАДН Измеряемое увеличение поглощения при длине волны 340нм, обусловленное присутствием НАДН, прямо пропорционально концентрации глюкозы Все процедуры и расчеты осуществляли в соответствии с рекомендациями компании-изготовителя Реакция проходила, как описано в "Альтернативной методике" компании Сигма, при комнатной температуре в объеме Юмкл или при объеме пробы 5мкл с добавлением 5мкл ЮОмМ трис-СІ буфера рН 7,5 Процентное содержание крахмала рассчитывали делением количества (веса) глюкозы на сухой вес каллюса Для иммунологического анализа часть высушенного и гомогенизированного каллюса из каж 35 дой из 12 проб и двух контрольных образцов ресуспендировали в 200мкл экстракционного буферного раствора (ЮОмМ трис-СІ рН 7,1, 1мМ ЭДТА, 10% глицерин, 5мМ ДТТ и 1мМ бензамидин) Каждый из образцов перемешивали встряхиванием, подвергали микроцентрифугированию в течение 5 минут при максимальной скорости и переносили надосадочную жидкость в новые пробирки Концентрацию белка в каждой пробе определяли по методу Lowry с соавторами (1951), используя наборы Bio-Rad, а в качестве стандарта сывороточный альбумин крупного рогатого скота Двадцать пять (25)мкг из каждой пробы наносили на полиакриламидный гель с додецилсульфатом натрия (7 - 17% градиент) Материал одной пробы распределяли на два градиента, также поступали с контрольными образцами каллюса, а также с контрольными пробами, содержавшими Юнг очищенной АДФ-глюкозопирофосфорилазы Ecoh После электрофореза гели переносили на нитроцеллюлозу, используя аппарат Poly-Blot™ (Амепсап Bionetics) Процессинг перенесенного материала осуществляли в соответствии с протоколом компании Promega Фильтрование блокировали раствором сывороточного альбумина крупного рогатого скота в трис-натриевом буфере (ЮмМ трис-СІ рН 8,0, 150мМ NaCI и 0,05% твина-20) в течение 30 минут Десять (Ю)мл этого буфера перемешивали с 1,3мкл первичных кроличьих антител к АДФ-глюкозопирофосфорилазе Е coh после чего фильтры инкубировали с этими антителами на протяжении 30 минут После этого фильтры трижды промывали примерно 50мл буфера при продолжительности каждой промывки 5 минут Десять (Ю)мл этого же буфера, содержавшего 1,3мкл вторичных антител (козьи антитела к кроличьим антителам, конъюгированным с щелочной фосфатазой, фирмы Promega) также инкубировали с фильтрами в течение 30 мин с последующей трехкратной промывкой О наличии сигналов судили по цветным реакциям щелочной фосфатазы, которые количественно оценивали с помощью лазерного денситометра Результаты Процентное содержание Площади пиков крахмала 1 26,9 0,573 2 4,6 0,170 3 6,4 0,0 4 12,3 0,344 5 15,3 0,376 6 11,1 0,314 + Контроль 2 + Юнг 0,369 7 5,5 не определ 8 5,6 0,117 9 9,7 0,095 10 6,6 0,0 11 11,4 0,376 12 13,3 0,342 + Контроль 2 + Юнг Контроль 1 3,0 Контроль 2 3,7 Пробы каллюса 43827 36 спайковые пробы, использовавшиеся только для иммунологического анализа Приведенные результаты показывают содержание крахмала и площадь пиков, установленные в процессе иммунологического анализа Содержание крахмала представлено как его процентное отношение к сухому весу каллюса, а площадь пиков как обобщенный показатель денситометрического сканирования соответствующего образца Пробы 1 - 6 анализировали в одном геле, а пробы 7 - 12 - в другом Контрольные пробы (контроль 2) анализировали в обоих гелях, в присутствии Юнг очищенной ДЦФ-глюкозопирофосфорилазы Е coh и без нее Спайковые пробы имели указанные площади пиков Посторонние полосы при анализе неспайковых проб в обоих гелях отсутствовали Приведенные результаты показывают, что повышение продукции АДФ-глюкозы приводит к увеличению содержания крахмала в растительных клетках Пример 2 Описанную в Примере 1 плазмиду рМОН 20104 трансформировали в картофель сорта Дезире, следуя известному протоколу Sheerman и Bevan (1988) для дисковой трансформации клубней Свободные от вирусной инфекции клубни Solanum tuberosum var Desiree очищали от кожуры, быстро промывали в дистиллированной воде и в течение 15мин стерилизовали их поверхность 10% гипохлоридом натрия, в который добавляли несколько капель твина-20 Затем клубни 6 раз промывали стерильной водой и погружали в жидкую среду MS Стерильным буравом диаметром 1см извлекали кусочки клубней и скальпелем разрезали их на диски толщиной I - 2мм Диски помещали в плавающем состоянии в 20мл среды MS, содержащей ASE pMON 20104 Agrobactenum , 10мл культуры ASEpMON2014 Agrobactenum осаждали центрифугированием, осадок ресуспендировали в 20мл среды MS и только потом разливали по чашкам Петри перед помещением в нее дисков Чашки с культурой и листьями слегка встряхивали Спустя 20мин диски переносили на пластины с табачной питательной средой 3C5ZR, которая состояла из солей MS, 1 мг/л тиамина HCI, 0,5мг/л никотиновой кислоты, 0,5мг/л HCI пиридоксина, 3% сахарозы, 5мкМ зеатин-рибозида и ЗмкМ ИУК аспарагиновой кислоты рН 5,9) Спустя 48 часов инфицированные диски помещали на новые пластины с той же средой, но лишенные питательного слоя, в присутствии 500мкг/мл карбенициллина и ЮОмкг/мл канамицина Пластины покрывали парафилмом и инкубировали в течение 16-часового светового дня при 25° Культивирование дисков каждые 3 недели проводили в свежей среде, однако через 4 недели после его начала концентрацию в ней карбенициллина уменьшали с 500 до 200мкг/мл Развивающиеся побеги отделяли и помещали в большие пробирки для тестирования, содержавшие соли MS и витамин R3 (1мг/л НСІ-ти-амина, 0,5мг/л никотиновой кислоты, 0,5мг/л НСІ-пиридоксина) в сочетании с 200мкг/мл карбенициллина и ЮОмкг/мл канамицина После формирования корней растения переносили в почву и постепенно 43827 38 содержит правую краевую область Т-ДНК нопалинового типа (Fraley et al , 1985) Ген glgC16 был сконструирован главным образом для экспрессии в клубнях после помещения его под контроль специфичного для этих органов промотора Поступление белка glgC16 в плазмиды обеспечивалось его синтезом в форме С концевого слияния с П -концевым белковым фрагментом, кодирующим транспортную последовательность (СТР), которая имеет своим источником ген SSUIA из Arabidopsis thahana (TIMKO et al , 1989) Последовательность СТР отделяется в процессе включения, освобождая фермент glgC16 Другие сигналы экспрессии в растительной ткани также содержат З'-полиаденилирующие последовательности, источником которых служат последовательности NOS3', локализованные в нисходящем направлении от кодирующего участка вектора экспрессии Последний собирали следующим образом Пататиновый промотор вырезали из плазмиды рВ1241 3 в форме фрагмента Hind3-BaMHI и легировали его со слитой последовательностью CTPI-glgC16 (фрагмент Bgl2-Sacl из pMON 20102, см Пример 1) и плазмидным вектором типа pUC, вырезанным Hmd3 и S a d (эти клонирующие сайты в векторе фланкированы узнающими сайтами Notl) (Плазмида рВ1241 3 содержит промотор пататин-1, охватывающий область от сайта АссІ в Пример 3 положении 1323 до сайта Dral в положении Ткани картофеля подвергали трансформации 2289/эти положения соответствуют последоватакже с целью добиться экспрессии слитого пептельности, описанной Bevan с соавторами в тида СТР/АДФ-глюкозопирофосфорилазы под 1986г/, с линкером Hmd3, добавленным в первом контролем промотора пататина Последний индуиз указанных положений, и линкером ВамНІ, доцирует специфическую экспрессию ADPgPP в бавленным в последнем положении) клубнях картофеля и повышает в них содержание крахмала Эту кассету внедряли в виде сайта Notl в плазмиду pMON 886 таким образом, что экспресВектор, использовавшийся для трансформасия гена glgC16 имела место в той же ориентации, ции картофеля, представляет собой производное что и экспрессия гена ІЧРТП, кодирующего устойтрансформирующего вектора pMON 886, действие чивость к канамицину Это производное получило которого опосредуется через Agrobactenum обозначение pMON 20113 и представлено на риПлазмиду pMON 886 конструируют из хорошо изсунке 7 вестных фрагментов ДНК Фрагмент длиной 0,93килооснования, выделенный из транспосона Вектор pMON 20113 мобилизовали в аттенуиТп7, который кодирует резистентность бактерий к рованный штамм Agrobactenum tumefaciens, исспектиномицину /стрептомицину (Spc/Str), служит пользуя тройственную систему конъюгации и детерминантом при селекции Е coh и плазмиду-хелпер pRK 2013 (Ditta et al , 1980) Agrobactenum tumefaciens (Fling et al , 1985) Его Штамм ABI, несущий плазмиду Ті, аттенуировали соединяют с химерным геном резистентности к элиминированием генов фитогормона, вызывавканамицину, полученному для регуляции экспресших корневой рак растений Этот штамм предсии в растительных клетках с целью селекции ставляет собой модифицированный вариант трансформированных тканей Химерный ген соAgrobactenum tumefaciens A208, несущий инактистоит из промотора 35S (P-35S) вируса мозаики вированную плазмиду pTiC 58-производную плазцветной капусты длиной 0,35килооснований (Odell миды рМР 90RK (Konez and Schell, 1986) Инактиet al , 1985), гена неомицин-фосфотрансферазы 2 вированная плазмидаТі обладает функциями гена типа (NPT 2) длиной 0,83килооснований и 3' не trfA, который необходим для автономной репликатранслируемой области гена нопалин-синтазы ции вектора pMON после конъюгации в штамм длиной 0,26килооснований (NOS 3')(Fraley et al , ABI При инкубации растительной ткани с конъю1983) Следующий фрагмент представлен инициагатом ABI pMON,вектор переносится в растительтором репликации длиной 0,75килооснований из ные клетки под контролем аттенуированной плазплазмиды RK2 (Stalker et al , 1981) Его присоедимиды pMP90RK Ті, кодирующей соответствующие няют к фрагменту длиной 3,1 килооснований (от функции Sail до Pvul) плазмиды pBR 322, которая имеет После вышеописанной процедуры плазмиду точку инициации репликации для поддержания pMON 20113 трансформируют в картофель сорта культуры Е coh (on - 322) и сайт ВОМ для конъюРоссет Бербанк Для трансформации растений гационного транспорта в клетки Agrobactenum этого сорта стерильную культуру проростков выtumefaciens Наконец, фрагмент Pvul длиной ращивают в чашках со средой РМ, обогащенной О.Збкилооснований из плазмиды pTIT37, который аскорбиновой кислотой (25мг/л) при общем объе 37 закаливали Описанные предварительные эксперименты показывают, что возможность регенерации трансгенных растений, способных экспрессировать ген ADPgPP под контролем промотора En-CaMy35S выглядит весьма проблематичной На обогащенной сахарозой среде удалось получить одно растение картофеля, однако оно погибло после переноса в почву Такой результат не явился неожиданным Промотор En-CaMY35S является конститутивным промотором и индуцирует экспрессию гена ADPgPP во всех тканях растения Конститутивная экспрессия гена ADPgPP по всей вероятности нарушает поступление сахарозы к растущим частям вследствие опосредуемого через ADPgPP превращения сахарозы в крахмал в продуцирующих сахара клетках и тканях растений Таким образом, этот пример иллюстрирует экспрессию ADPgPP в растительных клетках и предпочтительность, в большинстве случаев, специфической экспрессии фермента в таких тканяхмишенях, как клубни картофеля или плоды томатов Это дает возможность специалистам отбирать из имеющегося набора растений, трансформированных промотором En-CaMy35S, формы, в которых экспрессия ADPgPP происходит в желаемом диапазоне 39 43827 ме среды 8мл Последняя содержит также неорганические соли Murashide и Skood (MS), 30г/л сахарозы, 0,17г/л NaH2PO4 Н2О, 0,4мг/л НСІ-тиамина и 100мг/л миоинозитола с 2г/л гелрита рН 6,0 для отверждения По достижении проростками длины примерно 5см вырезают отрезки междоузлий длиной 3 - 5мм и помещают в десятикратно разведенную культуру Agrobactenum tumefaciens, которую получают из маточной 4-дневной культуры микроорганизмов на пластинах и предварительно инкубируют в течение ночи Участки междоузлий совместно инкубируют в бактериальной культуре на протяжении 2 дней при 20° Для этой цели культуральную систему помещают на стерильную фильтровальную бумагу, которую, в свою очередь, подстилает питательный слой клеток табака на разведенной в 10 раз среде Р (десятикратно разведенные неорганические соли MS с органическими добавками в отсутствие казеина, как описано Garret et al (1980) при концентрациях сахарозы и агара соответственно ЗОг/л и 8,0г/л) По завершении совместного культивирования эксплантаты переносят в неразбавленную среду Р - 1 для индукции роста каллюса, в состав которой входят неорганические соли MS , органические добавки согласно Garret et al (1980) в отсутствие казеина, а также 5,0мг/л зеатин-рибозида (ZR) и 0,10мг/л нафтален-уксусной кислоты(ЫАА) (Garret et al , 1980а, 1980в) ДЛЯ ингибирования роста бактерий в культуральную среду вводили также карбенициллин и цефотаксим в концентрациях соответственно 500мг/л и 100мг/л Для селекции трансформированных клеток использовали канамицин в концентрации 100мг/л Трансформированные таким образом растения картофеля обладали способностью к экспрессии комплекса пататиновый промотор-СТР/АДФ-глюкозопирофосфорилаза-ген NOS и характеризовались повышенным содержанием крахмала в клубнях Спустя 4 недели после начала культивирования эксплантаты переносили в среду того же состава, в которой NAA была заменена гибберелловой кислотой (дАЗ) в концентрации 0,Змг/л (Garret et al , 1981) для стимуляции формирования проростков Последние начинали развиваться приблизительно через 2 недели после переноса в стимулирующую рост среду Эти проростки вырезали и помещали во флаконы со средой РМ для укоренения Спустя примерно 4 недели растения переносили в почву и постепенно закаливали Для оценки устойчивости проростков к действию канамицина, которая сообщалась ферментом неомицин-фосфотрансферазой 2, их помещали в среду РМ для укоренения, содержавшую канамицин в концентрации 50мг/л, и отбирали трансформированные клетки Регенерированные в культуре растения картофеля сорта Рассет Бербанк трансплантировали в горшки (6 дюймов или приблизительно 15,24см), где выращивали до полной зрелости в условиях теплицы Собранные клубни помещали на 2 дня при комнатной температуре для затвердевания кожуры, после чего отбирали все клубни размером более 2см и хранили при 9° в условиях высокой влажности Для определения удельного веса (УВ) спустя 40 3 дня после сбора клубней использовали самые крупные из них (по 2 - 3 от каждого растения), абсолютный вес которых обычно составлял 20 - 40г Удельный вес рассчитывали как разность между весом на воздухе и в воде с помощью формулы УВ = вес на воздухе/(вес на воздухе - вес в воде) Расчет процентного содержания крахмала и сухого вещества на основании удельного веса производили с помощью формул, предложенных Scheelem (1937) процентное содержание крахмала = 17,546 + (199,07) (УВ= 1,0988) процентное содержание сухого вещества = 24,182+ (211,04) (УВ= 1,0988) Для иммунологического анализа использовали белок, экстрагированный из свежей ткани сердцевины клубней, и проводили его, как описано для листьев томатов Анализ содержания крахмала в свежих срезах клубней производили по методу Lin (1988a) Для этого приблизительно 300мг ткани из сердцевины клубней помещали в центрифужную пробирку на 1,5мл и замораживали на сухом льду Затем ее подсушивали до постоянного веса в вакуумном концентраторе SPEED VAC (Savant) и определяли его конечную величину Содержание крахмала определяли примерно в 60мг сухого материала из отдельных клубней Сначала удаляли растворимые сахара, экстрагируя материал 1 мл 80%-ного этанола при 70° в течение 20 минут По завершении инкубации оставшийся этанол упаривали в вакуумном концентраторе, твердый остаток ресуспендироваи, в 400мкл 0,2М гидроокиси калия, измельчали и снова инкубировали в течение 30 минут при 100° для солюбилизации крахмала Раствор охлаждали и нейтрализовали добавлением 80мкл 1н уксусной кислоты Крахмал разлагали до глюкозы обработкой 14,8 единицами панкреатической альфаамилазы (Sigma Chemical, Sf Louis) при 37° на протяжении ЗОмин с последующей обработкой 10 единицами амилоглюкозидазы (Sigma Chemical, Sf Louis) В течение 60 минут при 55° Глюкозу выделяли методом ферментативного переваривания, используя гексокиназный набор компании Sigma Chemical (Sf Louis) Для иммунологического анализа и количественного определения крахмала использовали ткань сердцевины клубней, выращенных в условиях обычной теплицы Клубни растений, в которых происходила экспрессия ADPgPP E сої і, содержали в среднем на 26,4% больше крахмала, чем клубни контрольных растений Существенные различия содержания крахмала в индивидуальных растениях свидетельствуют о наличии двух популяций картофеля Одна из них, представленная контрольной разновидностью, характеризуется содержанием крахмала от 10,2 до 15% (в среднем 12,67%) Вторая популяция представлена растениями, в которых происходит экспрессия ADPgPP Е coli, при содержании крахмала от 12,1 до 19,1% (в среднем 16%) Наблюдавшееся увеличение содержания крахмала коррелировало с интенсивностью экспрессии ADPgPP E сої і Это свидетельствует о том, что именно эта экспрессия служит причине повышения содержания крахмала в картофельных клубнях 41 43827 Удельный вес определяли для 2 или 3 самых крупных клубней от каждого из 36 независимо полученных трансформантов, используя методику сопоставления веса клубней на воздухе и в воде (Kle-mkopf, 1987) Полученные результаты показывают, что клубни, в которых происходила экспрессия гена ADPgPP E сої і, характеризовались значительным увеличением удельного веса по сравнения с клубнями контрольных растений В среднем удельный вес возрастал с 1,068 у контрольных клубней до 1,088 в клубнях трансгенных растений (Таблица 1а) У наиболее продуктивных из полученных разновидностей удельный вес клубней достигал 1,100 Отдельные клубни одного и того же растения отличались по удельному весу Аналогичные различия были свойственны клубням от отдельных растений Тем не менее, клубни с повышенным удельным весом были получены только от растений, в которых происходила экспрессия ADPgPP E coh, причем это повышение в целом коррелировало с уровнем экспрессии гена glgC16 Содержание крахмала и сухого вещества в клубнях растений, в которых имела место экспрессия ADPgPP E coh, составляло соответственно 35,0 и 23,9%, а наиболее 42 продуктивные разновидности имели эти показатели на уровне 59,3 и 40,6% Содержание крахмала, определявшееся по освобождению глюкозы, во всех 26 полученных линиях сопоставляли с его расчетным содержанием в тех же клубнях по результатам определения удельного веса Полученные последним способом данные хорошо согласовывались с результатами непосредственной оценки (таблица 1в) В частности, клубни, в которых имела место экспрессия ADPgPP E coh, содержали 16,01% крахмала при определении методом количественного анализа по сравнению с 16,32% при расчете по удельному весу При оценке повышения содержания крахмала в отдельных мутантных линиях установлена достоверная корреляция между показателями содержания сухого вещества по данным прямого определения и расчетов, а также корреляция между обоими этими показателями и интенсивностью экспрессии гена glgC16 Таким образом, наблюдавшееся увеличение содержания сухого вещества в клубнях растений, способных к экспрессии ADPgPP E coh, обусловлено преимущественно отложением крахмала Таблица 1а Средний уд вес Среднее содержание крахмала, % Среднее содержание сухого в-ва,% Е coh ADPgPP + (15) 1,088(0,012) 15,40 21,90 Контроли (21) 1,068(0,010) 11,41 17,68 Примечание В скобках указано число растений, от каждого из которых взвешивали по 2 или 3 клубня После показателя удельного веса приведены величины стандартного отклонения (в скобках) Процентное содержание крахмала и сухого вещества рассчитывали на основании средних показателей удельного веса, как описано выше Контролями служили объединенные ткани клубней, трансформированных посредством введения векторной ДНК, но не содержавших гена glgC16, и клубней с геном glgC16, в которых отсутствовала экспрессия ADPgPP Е coh Таблица 1в Среднее соСреднее содержадержание ние крахмала (%), крахмала по данным фер(%), расчиментативного анатанное по уд лиза весу Е coh ADPgPP 16,32(1,47) + (11) Контроля (15) 11,96(1,37) 16,01 (2,00) 12,67(1,33) Примечание Средние показатели процентного содержания крахмала определяли экспериментально методом ферментативной деградации и рассчитывали на основании измерений удельного веса В скобках приведены величины стандартного отклонения Различия между разновидностями картофеля с экспрессией ADPgPP E coh и контролями, установленные при расчетах по удельному весу или определении ферментативным методом были статистически достоверны (р < 0,005 при использовании критерия Стьюдента) Пример 4 Фермент ADPgPP E coh кодируется единственным геном glgC а его активная форма функционирует в виде гомотетрамера (Preiss, 1984) В то же время растительный фермент является гетеротетрамером и кодируется по меньшей мере двумя различными генами (Copeland and Preiss,,1981) Ферменты ADPgPP из обоих источников являются строго регулируемыми белками, причем бактериальный фермент активируется фруктозо-1,6-дифосфатом и ингибируется АМФ (Preiss, 1984), а растительный фермент активируется 3-фосфоглицератом и ингибируется Pi (Copeland and Preiss, 1981, Preiss, 1984) К настоящему времени получено несколько хорошо охарактеризованных мутантных ADPgPP E coh, кинетические свойства которых суммированы и сопоставлены в таблице 2 (RoMeo, T and Preiss, G , 1989) Таблица 2 Штамм Накопление гликогена (мг/г клеток) Фруктозо1,6д и фосфат, А 0 5 (мкМ) АМФ 1о5 (мкМ) дикий тип 20 68 75 43 43827 Sg5 36 22 270 CL1136 74 5,2 680 618 70 15 860 Показано, что экспрессия варианта glgC16, обнаруженного в Е сої і, (штамм 618), приводит к усилению биосинтеза крахмала в растительных клетках Экспрессия других бактериальных ферментов ADPgPP в растительных клетках также стимулирует образование крахмала Точно также, экспрессия дикого типа гена glgC сопровождается усиленным накоплением крахмала Ген glgC дикого типа, имеющийся в геномном клоне Е coli, который был обозначен как рОР 12 (OKita et al , 1981), был выделен тем же методом, что и ген glgC16, как описано в Примере 1 Вкратце, сайт Ncol вводили в 5'-сайт, инициирующий трансляцию, а сайт Sad - в З'-кодон-терминатор посредством полимеразной цепной реакции с использованием праймеров QSP 3 и QSM 10, как описано в Примере 1 Полученный фрагмент NcolSacl лигировали в вектор pMON 20102 (описанный в примере 1), который предварительно переваривали Ncol и Sad, это приводило к формированию плазмиды pMON 16937 Химерный ген RSsu-qlgC конструировали посредством легирования рестрикционного фрагмента Xhol-Bql 2, содержащего промотор SsulA (Тімко et al , 1985), фрагмента Bgl 2-Sacl из pMON 16937, содержащего ген СТРІglgC, трансформирующего вектора pMON 977, переваренного Xhol и Sad Таким образом, получали, плазмиду pMON 16938 (рисунок 8) Плазмида pMON 977 содержит следующие хорошо охарактеризованные сегменты ДНК (рисунок 9) Вопервых, фрагмент длиной 0,93килооснований, выделенный из транспосона Тп7, который кодирует резистентность бактерий к спектиномицину/стрептомицину (Spc/Str) и служит детерминантом при селекции Е coli и Agrobactenum tumefaciens (Fling et al ,1985) Этот фрагмент присоединяли к химерному гену, кодирующему устойчивость к канамицину, который был сконструирован для экспрессии в растительных клетках с целью отбора трансформированных тканей В состав химерного гена входят промотор 35S (Р35S) вируса мозаики цветной капусты длиной 0,35килооснований (Odell et al , 1985), ген неомицин-фосфотрансферазы 2 типа длиной 0,83килосонований (NPT 2) и 3' не транслируемая область гена нопалин-синтазы (NOS 3') длиной 0,26килооснований (Fraley et al , 1983) Следующий сегмент - это участок инициации репликации длиной 0,75килооснований из плазмиды RK2 (опV) (Stalker et al , 1981) Его присоединяли к фрагменту длиной 33,1килооснований между сайтами Sal 1 и Pvu 1 из плазмиды pBR 322, который служит участком инициации репликации для Е coli (оп-322), и к сайту ВОМ для конъюгационного переноса в клетки Agrobactenum tumefaciens Еще один сегмент представляет собой фрагмент длиной О.Збкилооснований, локализованный между сайтами Pvu 1 и Всі 1 плазмида pTiT 37 и содержащий правую краевую область Т-ДНК нопалинового типа (Fraley et al , 1985) Последний сегмент 44 представляет собой вектор экспрессии, имеющий в своем составе 35S промотор вируса мозаики цветной капусты (0,65килооснований) (CaMY) амплифицированный дупликацией промоторной последовательности (P-E35S) (Kay et al , 1987), синтетический мультилинкер с несколькими уникальными клонирующими последовательностями и З'-не транслируемую область гена rBcS1 Е9 гороха (Е9-3 ) длиной 0,7килооснований (Coruzzi et al , 1984 Morelh et al , 1985) Плазмиду внедряли в Agrobactenum tumefaciens (штамм ABI), используя систему тройственного скрещивания, и применяли для трансформации Lycopersicon esculentum (разновидность UC82B) Клетки растений томата трансформировали, используя вышеописанные в общем виде штаммы Agrobactenum с помощью методики МсСогміск еі al (1986) Семядоли получали из 7 - 8-дневных сеянцев Поверхность семян в течение 20 минут стерилизовали 30%-ным раствором клорокса и проращивали их в ящиках Plantions на среде Дэвиса В состав последней входили М соли (4,3г/л), сахароза (20г/л) и витаминный раствор Nitsch (10мл/л) при рН 5,8 Раствор витаминов содержал 100мг/л миоинозитола, 5мг/л никотиновой кислоты, 0,5мг/л НСІ-пиридоксина 0,5мг/л НСІ-тиамина, 0,05мг/л фолевой кислоты, 0,05мг/л биотина и 2мг/л глицина Семена проращивали в течение 7 8 дней в ростовых камерах при температуре 25° и влажности 40% при освещении белыми люминесцентными лампами (80 Эйнштейн/м2/сек) Продолжительность светового дня составляла 16 часов После прорастания семян из семядолей готовили эксплантаты, прямоугольной формы, срезая апикальную меристему и гипокотиль тонким лезвием (^15) Эти срезы на коротких концах прорастающих семядолей увеличивали инфицируемую поверхность Эксплантаты промывали стерильной регенерационной жидкостью Дэвиса, чтобы предотвратить высыхание ткани Регенерационная среда Дэвиса имела в своем составе IX MS соли, 3% сахарозу, IX витамины и 2,0мг/л зеатина при рН 5,8 Этот раствор перед употреблением автоклавировали о 0,8% ІЧовІе-агаром Семядоли предварительно культивировали на "питательных пластинах", покрытых средой Calqene, содержащей антибиотики В состав этой среды входили 4,3г/л солей MS , 30г/л сахарозы, 0,1 г/л миоинозитола, 0,2г/л КН2РО4, 1,45мл/л раствора НСІ-тиамина (исходная концентрация 0,9мг/мл), 0,2мл раствора кинетина (исходная концентрация 0,5мг/мл) и 0, мл раствора дихлорофеноксиуксусной кислоты (исходная концентрация 0,2мг/мл) рН доводили до 6,0 добавлением КОН На пластины наслаивали суспензию клеток табака (ТХД), а сверху покрывали стерильной фильтровальной бумагой, пропитанной средой 2С005К Последняя состояла из смеси солей MS дівсо (4,3г/л), витаминов Bs 1000 X (1мл), сахарозы (ЗОг/л), ПХФК (2мл/л при концентрации исходного раствора 2мг/мл) и кинетина (10мкл/л при концентрации исходного раствора 0,5иг/мл) Культивирование семядолей в ростовых камерах продолжалось в течение суток при 25° и освещенности белыми люминесцентными лампами (40 - 50 45 46 консин) В большинстве растений, в которых происходила экспрессия ADPgPP E coh дикого типа, содержание этого фермента составляло 0,1% общего экстрагируемого белка Для проведения анализа содержания крахмала из 3 или 4 разных молодых, но полностью развернувшихся листьев тепличных растений во второй половине дня с помощью пробойника получали фрагменты ткани Пробы от каждого растения объединяли и с помощью аналитических весов Mettler определяли их сырой вес, который составлял 60 - 80мг/проба Затем удаляли растворимые сахара, трижды экстрагируя пробы 1мл 80%-ного этанола при 70°, всякий раз на протяжении 20 минут После последней экстракции весь оставшийся этанол упаривали в вакуумном концентраторе Speed Твердый материал ресуспендировали в 400мкл 0,2М гидроокиси калия измельчали и инкубировали на протяжении 30 минут при 100° для солюбилизации крахмала Полученный раствор охлаждали и нейтрализовали добавлением 80мкл 1н уксусной кислоты Крахмал разлагали до глюкозы обработкой панкреатической альфа-амилазой (14,8 единиц, Sigma Chemical, St Loms) в течение ЗОмин при 37°, затем обработку продолжали амилоглюкозидазой (Sigma Chemical, St Loms) на протяжении еще бОминут при 55° Количество глюкозы, освобождавшейся в результате ферментативного переваривания, оценивали с помощью гексокиназного набора компании Sigma Chemical, (St Loms), а результаты определения использовали для расчета содержания крахмала 43827 Эйнштейн/м2/сек) в условиях непрерывного светового дня После культивирования семядоли переносили в раствор Agrobactenum в лаг фазе Концентрация бактерий, содержавших плазмиду pMON 6938, составляла в этом растворе приблизительно 5 х 108клеток/мл Семядоли оставляли в бактериальном растворе для насыщения в течение 6 минут, затем помещали на диски из стерильной фильтровальной бумаги для удаления избытка влаги и переносили на пластину, покрытую питательным слоем, где оставляли для инкубации еще на 2 дня По истечении этого срока семядоли переносили на селекционные пластины с регенерационной средой Дэвиса, содержавшей 2мг/л зеатинрибозида, 500мкг/мл карбенициллина и 100мкг/мл канамицина Спустя 2 - 3 недели семядоли со сформировавшимися каллюсом и/или проростками помещали в свежую регенерационную среду Дэвиса, содержавшую карбенициллин и канамицин в указанных выше концентрациях Сразу после этого производили подсчет трансформированных колоний Ткань калл юса продолжали культивировать с регулярными трехнедельными интервалами, причем все аномально развивающиеся образования удаляли, чтобы обеспечить продолжение регенерации зачаточных проростков Последние формировались в течение 3 - 4 месяцев После появления достаточно сформировавшихся проростков их аккуратно отрезали от каллюса и помещали на селекционные пластины для укоренения Эти пластины были покрыты средой 0,5 х MSO, содержавшей 50мкг/мл канамицина и 500мкг/мл карбенициллина Корни проростков в такой среде развивались в течение 2 недель после начала культивирования Если этого не происходило, проростки отделяли от среды и пересаживали в селекционную среду, где продолжали культивирование при 22° Проростки с корнями пересаливали в горшки по достижении корнями длины 2см После этого растения закаливали при 21° и продолжительности светового дня 18 часов на протяжении 2 - 3 недель, а затем переносили в теплицу В теплице растения содержали при температуре 26° в дневное время и 21° в темное время суток при продолжительности светлого и темного времени соответственно 13 и 11 часов, до полного созревания Трансгенные растения томатов - носители плазмиды pMON 16938 тестировали методом иммунологического анализа на наличие продуктов экспрессии гена qlgC С этой целью из ткани листьев и стеблей, измельченных в соотношении 1 1 в 10ОмМ трис-буфере рН 7,5,экстрагировали белки Буферный раствор содержал также 35мМ KCI, 5Мм дитиотритола, 5мМ аскорбата, 1мМ ЭДТА, 1 Мм бензаглидина и 20% глицерина Концентрацию белка в экстрактах определяли методом Pierce Разделение белков производили в 3 - 17% градиенте полиакриламидного геля с додецилсульфатом натрия Фермент ADPgPP E coh идентифицировали с помощью козьих антител к очищенному ADPgPP из того же бактериального источника и комплексов щелочной фосфатазы с кроличьими антителами (Ргомеда, Madison, Вис Листья с растений томатов, в которых имела место экспрессия гена glgC, индуцированная промотором Ssu, в среднем содержали на 29% больше крахмала по сравнению с листьями контрольных растений, причем в самых продуктивных разновидностях это повышение достигало 107% (таблица 3) Таблица 3 Среднее содержание крахмала, %% Е coh ADPgPP + (7) Контроли (8) Стандартное отклонение 4,54 2,1 3,52 1,9 (Число изученных разновидностей приведено в скобках) Полученные результаты показывают, что ферменты ADPgPP с разными кинетическими свойствами усиливают биосинтез крахмала в трансгенных растениях Следует отметить, что высокая интенсивность экспрессии нерегулируемых мутантных форм ADPgPP в ткани листьев нежелательна, поскольку может отрицательно сказаться на росте и развитии растений Так использование гена glgC16 вместо glgC в вышеописанных экспериментах не сопровождалось регенерацией трансформантов с повышенным уровнем экспрессии продуктов гена glgC16 Для экспрессии гена glgC промотором пататином тот же самый фрагмент Bgl 2 - Sacl гена СТРI- glgC из плазмиды pMON 16937 и фрагмент Hind З-Вам HI, содержащий этот промотор, из плазми 43827 48 47 ды рВ1241 3 легировали в бинарный веісгор pMON 1 Заявитель Kishore, ganesh M 10098 (рисунок 2 ), переваренный Hind 3 и Sad 2 Название изобретения Повышенное содля формирования плазмиды pMON 16950 (рисудержание крахмала в растениях нок 10) Плазмида рВ1241 3 имеет промоторный 3 Количество последовательностей 23 участок пататина-1, простирающийся от сайта Accl 4 Адрес для переписки в положении 1323 до сайта Dra 1 в положении (A) округ Монсанто 22389 (эти положения соответствуют последова(Б) улица 700 Chesterfield Village Parkwey тельности, описанной Bevan et al , 1986) с линке(B) город Сент-Луис ром Hind 3, добавленным в последнее положение (Г) штат Миссури В плазмиде pMON 10098 содержаться следующие (Д) страна США участки ДНК (в порядке движения по часовой (Е) код 63198 стрелке на рисунке 2 1) Химерный ген, кодирую5 Доступная для компьютера форма щий устойчивость к канамицину, который конст(A) тип носителя мягкий диск руировали для экспрессии в растительных клетках (Б) компьютер совместимый с IBM PC с целью селекции трансформированной ткани (B) операторная система PC-DOS/MS-DOS Химерный ген построен из промотора 35S вируса (Г) программа публикуемый патент ^1,0, вамозаики цветной капусты длиной риант ^1,25 0,35килооснований (Odell et al , 1985), гена неоми6 Сведения о заявке цин-фосфотрансферазы 2 типа (KAN) длиной (A) номер заявки 0,83килооснований и 3' нетрансдируемой области (Б) дата представления гена нопалин-синтазы (NOS 3') длиной (B) классификация 0,26килооснований (Fraley et al, 1983) 2) Фраг8 Данные о посреднике/доверенном лице мент длиной 0,45килооснований от Cla 1 до Dra 1 (A) имя McBnde, Thomas P из октопиновой Ті плазмиды pTil 5955, содержа(Б) регистрационный № 32706 щий левую краевую область Т-ДНК (BazKer et al , (B) номер для справок/по реестру 38 - 21 1983), 3) сегмент длиной 0,75килооснований, со(10530)А держащий точку инициации репликации, из плаз9 Номера для телесвязи миды RK2 (оп-V) (Stalker et al , 1981), 4) Сегмент (А) телефон (314)537-7357 длиной З.Окилооснований локализованный между (Б) факс (314)537-6047 сайтами Sal 1 и Pst 1 в плазмиде pBR 322 который (2) Сведения о последовательности SEQ Ю содержит точку инициации репликации для поддержания культуры Е coli (on - 322) и сайт ВОМ No 1 для конъюгационного переноса в клетки 1 Характеристика последовательности Agrobactenum tumefaciens, 5) фрагмент длиной (А) длина 1296 пар оснований 0,93килооснований, выделенный из транспосона (Б) тип нуклеиновая кислота Т7, который кодирует устойчивость бактерий к (В)количество нитей две спектиномицину/стрептомицину (Spe/Str) (Fling et (Г) топология линейная al , 1985) и служит детерминантом при селекции Е 2 Молекулярный тип ДНК (геномная) coli и Agrobactenum tumefaciens, 6) фрагмент дли9 (А) наименование/код СДЭ ной О.Збкилооснований, заключенный между Pvu 1 (Б) локализация 1 1293 и Всі 1 плазмиды pTiT 37 и содержащий правую краевую область Т-ДНК нопалинового типа (Fraley 2 состав последовательности SEQ Ю -^ О 1 et al , 1985), 7) последний сегмент, представляюдалее следуют 15 стр для ксерокопирования, щий собой вектор экспрессии, который состоит из на которых дан перевод сопутствующих текстов промотора вируса мозаики цветной капусты (Са(подписей) МУ ) длиной 0,65ки-лооснований, амплифицированный дупликацией промоторной последоваАТС G T T ACT ТТЛ CAS JUG SAC GAT САС ТТЛ ATG Т ? Я GCS CSC САв С Т в l i e His 105 416 *15 12О TCC G I G GTT GGA CTC AGS TCA TDC ATA T C * SAG BGA GCA ATT ATA S e c V i l v e l Gly Ua A i s S e t Су» П а S e t O l u G l y A l * I I * H e «20 425 430 1!35 Lys Leu Leu Aid All. Lya Sly Sex Val Pro І ї в Gly U s Gly Lys 450 455 460 GAA GAC TCA CTT TTS ATG GGG GCA GAT TAC TAT GAG ACT GAT GCT GAC c l j А в р S e c L e a L a j rtet G l y A l e А э р T y t Т у г G i u T h e A s p A l e Азр 43» 440 445 І313 Cys Віз lie US AGG AAG Arg Lys GGC АТС GGC AAG G l y l i e G l y Ly3 460 !3S1 GCC CGT ATA GGG 1439 GAA GCG ОСТ A
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 15/54, A01H 5/00, C12N 5/10, C12P 19/04, C12N 15/31, C12N 15/09, C12N 9/12, C12N 15/82
Мітки: дволанцюгова, рекомбінантна, генетично, вмістом, трансформованих, крохмалю, підвищеним, спосіб, днк-молекула, рослин, одержання
Код посилання
<a href="https://ua.patents.su/72-43827-sposib-oderzhannya-genetichno-transformovanikh-roslin-z-pidvishhenim-vmistom-krokhmalyu-rekombinantna-dvolancyugova-dnk-molekula.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання генетично трансформованих рослин з підвищеним вмістом крохмалю, рекомбінантна дволанцюгова днк-молекула</a>