Спосіб одержання тимчасового еквіваленту дермального шару шкіри
Номер патенту: 112584
Опубліковано: 26.09.2016
Автори: Мацевич Лариса Леонідівна, Лукаш Любов Леонідівна, Папуга Олександр Євгенійович, Лукаш Сергій Іванович, Рубан Тетяна Панасівна
Формула / Реферат
Спосіб одержання тимчасового еквіваленту дермального шару шкіри, який відрізняється тим, що як основу еквіваленту дермального шару шкіри використовують плівку "Білкозин", з якої вирізають фрагменти, здатні повністю покрити дно чашок Петрі, розмір яких вибирають відповідно до мети використання, інкубують протягом доби в буферному розчині, що має рівень рН 7,2-7,4 та містить кольоровий хімічний індикатор, через добу змінюють буферний розчин і продовжують це робити доти, доки хімічний індикатор не буде демонструвати, що після добової інкубації рН розчину залишається незмінним, після цього заморожують фрагменти адаптованої плівки в морозильній камері побутового холодильника при температурі -18 °С протягом доби, після розморожування фрагменти адаптованої плівки занурюють у буферний розчин, що має рівень рН 7,2-7,4 і стерилізують автоклавуванням за режимом 0,5 атмосфери протягом 30 хвилин, готують суспензію культивованих фібробластів людини у 10 % розчині желатини на основі DMEM і паралельно стерильні фрагменти адаптованої плівки розміщують у чашках Петрі та інкубують у середовищі DMEM протягом години, потім наносять суспензію клітин на поверхню адаптованої плівки, готові фрагменти плівки утримують в холодильнику при 4 °С до застигання розчину желатини з утворенням гідрогелю.
Текст
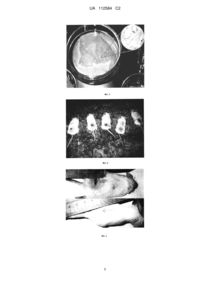
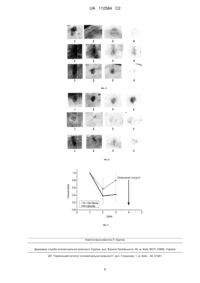
Реферат: Винахід належить до способу одержання тимчасового еквіваленту дермального шару шкіри, де як основу еквіваленту дермального шару шкіри використовують плівку "Білкозин", з якої вирізають фрагменти, здатні повністю покрити дно чашок Петрі, розмір яких вибирають відповідно до мети використання. Інкубують протягом доби в буферному розчині, що має рівень рН 7,2-7,4 та містить кольоровий хімічний індикатор. Через добу змінюють буферний розчин і продовжують це робити доти, доки хімічний індикатор не буде демонструвати, що після добової інкубації рН розчину залишається незмінним. Після цього заморожують фрагменти адаптованої плівки в морозильній камері побутового холодильника при температурі -18 °С протягом доби. Після розморожування фрагменти адаптованої плівки занурюють у буферний розчин, що має рівень рН 7,2-7,4 і стерилізують автоклавуванням за режимом 0,5 атмосфери протягом 30 хвилин, готують суспензію культивованих фібробластів людини у 10 % розчині желатини на основі DMEM і паралельно стерильні фрагменти адаптованої плівки розміщують у чашках Петрі та інкубують у середовищі DMEM протягом години. Потім наносять суспензію клітин на UA 112584 C2 (12) UA 112584 C2 поверхню адаптованої плівки, готові фрагменти плівки утримують в холодильнику при 4 °С до застигання розчину желатини з утворенням гідрогелю. UA 112584 C2 5 10 15 20 25 30 35 40 45 50 55 Пропонований винахід належить до сфери медицини, а саме до способу одержання тимчасового еквіваленту дермального шару шкіри, який може бути використаний для лікування масивних опіків і пошкоджень шкіри іншого генезу, а також для косметологічних цілей. Серед відомих у світі комерційно доступних еквівалентів шкіри на основі колагену, що вже пройшли клінічні випробовування і використовуються в клініці, є, наприклад, дермальні замінники шкіри EZ Derm (використовується колаген свиней) і Terudermis (використовується денатурований колаген великої рогатої худоби), дермо-епідермальні замінники шкіри Apligraf і OrCell (використовується гель з колагену типу І великої рогатої худоби). Колаген входить до складу інших клінічно доступних біоконструкцій у суміші з іншими речовинами. Однак, вони достатньо дорогі та виготовляються за кордоном. Відомий композиційний еквівалент живої шкіри, який включає дермальний пористий шар колагену, шар безпористого колагену і епідермальний шар культивованих кератиноцитів на шарі безпористого колагену, при цьому дермальний шар містить пористу колагенову губку, у складі якого знаходяться культивовані фібробласти. Безпористий колаген виробляється з 6 колагену типу 1, колагену типу 3 або їх сумішей (патент Російської федерації №2135191, МПК А61K 35/36, опублікований: 27.08.1999 р.). Недоліком еквіваленту є те, що даний замінник шкіри достатньо дорогий та складний у виготовленні. Відомий еквівалент шкіри, що є матрицею, яка складається з білків позаклітинного матриксу і містить клітини мезенхіми всередині і епідермальні клітини (базальні стовбурові кератиноцити) на своїй поверхні. Обидва типи клітин знаходяться у стадії активного росту (патент Російської 6 федерації № 2342164, МПК A61L 27/60, А61K 35/36, C12N 5/08, опублікований: 27.12.2008 p.). Даний замінник шкіри є достатньо дорогий та складний у виготовленні. Окрім того, вищезгадані еквіваленти шкіри не використовуються широко в Україні. В основу пропонованого винаходу поставлено задачу по створенню такого способу одержання тимчасового еквіваленту дермального шару шкіри, який би мав покращені експлуатаційні властивості, а саме був виготовлений з природного та недорогого матеріалу. Поставлена задача вирішується пропонованим способом одержання тимчасового еквіваленту дермального шару шкіри, а відповідно до пропозиції, як основу еквіваленту дермального шару шкіри використовують плівку "Білкозин", з якої вирізають фрагменти, здатні повністю покрити дно чашок Петрі, розмір яких вибирають відповідно до мети використання, інкубують протягом доби в буферному розчині, що має рівень рН 7,2-7,4 та містить кольоровий хімічний індикатор, через добу змінюють буферний розчин і продовжують це робити доти, доки хімічний індикатор не буде демонструвати, що після добової інкубації рН розчину залишається незмінним, після цього заморожують фрагменти адаптованої плівки в морозильній камері побутового холодильника при температурі -18 °C протягом доби, після розморожування фрагменти адаптованої плівки занурюють у буферний розчин, що має рівень рН 7,2-7,4, і стерилізують автоклавуванням за режимом 0,5 атмосфери протягом 30 хвилин, готують суспензію культивованих фібробластів людини у 10 % розчині желатини на основі DMEM і паралельно стерильні фрагменти адаптованої плівки розміщують у чашках Петрі та інкубують у середовищі DMEM протягом години, потім наносять суспензію клітин на поверхню адаптованої плівки, готові фрагменти плівки утримують в холодильнику при +4 °C до застигання розчину желатини з утворенням гідрогелю. Суть пропонованої корисної моделі пояснюється графічними матеріалами, де: - на фіг. 1 представлено фрагменти білкозинової плівки; - на фіг. 2 представлено готовий дермальний еквівалент шкіри на основі білкозинової плівки з включенням живих клітин; - на фіг. 3 представлено вигляд інтактних ран та ран з накладеними експериментальними біоконструкціями, зліва направо: тварини 1 та 4 належать до контрольної групи, а тварини 2, 3 та 5 - до дослідної; - на фіг. 4 представлено фотофіксацію стану опікової рани; - на фіг. 5 показано опікові рани у тварин контрольної. Під кожним знімком вказано час фотофіксації - 1, 2, 3 чи 4 доба досліду; - на фіг. 6 показано опікові рани у тварин дослідної групи. Стрілками вказано на видимі зони початкової епітелізації рани. Під кожним знімком вказано час фотофіксації - 1, 2, 3 чи 4 доба досліду; - та на фіг. 7 графічно представлено вплив аплікації дермального еквіваленту на динаміку розвитку опікової рани. Площа рани вимірювалася в умовних одиницях, де за 1 було прийнято значення цього показника на першу добу після індукції опіку, після усунення біоконструкції з поверхні рани. 1 UA 112584 C2 5 10 15 20 25 30 35 40 45 50 55 Поставлена задача вирішується за рахунок використання в способі одержання тимчасового еквіваленту дермального шару шкіри, плівки "Білкозин". Авторами вперше використано як основу тимчасового еквіваленту дермального шару шкіри - плівку „Білкозин" (виробник ВАТ "Прилукский завод "Белкозин", м. Прилуки, Україна) цілком вироблену з природного матеріалу, колагену, яка є міцною та еластичною. Також, значною її перевагою є те, що вона вже давно виробляється у великих кількостях для потреб харчової промисловості. Це, по-перше, вказує на те, що це нетоксичний продукт, а, по-друге, виготовлення біотехнологічних конструкцій на її основі не потребує налагодження серійного виробництва цієї плівки. Для здійснення способу одержання тимчасового еквіваленту дермального шару шкіри плівку "Білкозин" спеціально обробляли і адаптували з метою застосування її як матриці для желатинового клітиновмісного гідрогелю (фіг. 1, фіг. 2). Спочатку з плівки вирізали фрагменти за формою чашок Петрі (фірма "Anumbra", Німеччина) діаметром від 6 до 9 см, відповідно до конкретної мети використання (наприклад, до розміру і форми опікової рани того чи іншого конкретного пацієнта при його лікуванні). Фрагменти плівки „Білкозин" повинні покривати всю поверхню чашки Петрі, щоб желатиновий гель з клітинами не підтікав під плівку. Розпластані в чашках Петрі фрагменти білкозинової плівки інкубували в буферному розчині Хенкса (HBSS) з індикатором феноловим червоним (фірма „РАА", Австрія) для звільнення від низькомолекулярних фрагментів колагену, що дають кислу реакцію. Розчин змінювали кожну добу доти, доки хімічний індикатор не демонстрував, що після добової інкубації рН розчину залишається незмінним. Звільнюючись у розчин, ці фрагменти знижують рН розчин, що візуально виглядає як пожовтіння розчину. Тому розчин двічі видаляли і замінювали на свіжу порцію, де встановлювали оптимальний рН 7,2-7,4. Після цієї обробки фрагменти адаптованої плівки заморожували в морозильній камері при -18 °C протягом доби; ця процедура підвищувала м'якість та гнучкість цієї плівки. Після розморожування фрагменти адаптованої плівки занурювали у буферний розчин Хенкса (HBSS) і стерилізували автоклавуванням при режимі 0,5 атмосфери, 30 хвилин. Стерильні фрагменти адаптованої білкозинової плівки розміщували у чашках Петрі відповідного діаметру і добавляли культуральне середовище DMEM для адаптації до культивування живих клітин людини. Далі готували суспензію культивованих фібробластів людини. Для цього первині фібробласти людини вилучали із шматочків алогенної шкіри, що лишалися невикористаними під час планових хірургічних операцій, культивували у середовищі DMEM із додаванням 10 % фетальної сироватки великої рогатої худоби (фірма "РАА", Австрія), а також антибіотиків пеніциліну (100 Од/мл) та стрептоміцину (100 мкг/мл). Безпосередньо, перед використанням, клітини культивувалися до утворення субконфлюентного моношару (приблизно 70 % поверхні культурального посуду), таким чином, їх знімали з поверхонь у стані активної проліферації. При цьому, культуральне середовище відбирали, чашки Петрі або культуральні флакони з клітинами промивали фосфатним буферним розчином PBS з метою видалення залишків культурального середовища з сироваткою. Потім буферний розчин PBS відбирали з культурального посуду і додавали суміш 0,25 % розчину трипсину і 0,02 % розчину версену у співвідношенні 1:1. Після того, як клітини набували шароподібної форми і відкріплювались від поверхні, у культуральний посуд додавали стандартне середовище DMEM, але без сироватки. За допомогою камери Горяєва підраховували концентрацію клітин у суспензії і доводили концентрацію клітин до значення 2 млн./мл, додаючи середовище DMEM. Далі суспензію клітин змішували з рівною кількістю стерильного і підігрітого до 37 °C розчину желатини у середовищі DMEM (20 %) і суспендували, щоб клітини були рівномірно розподілені в рідкій фазі. Отриману суспензію, що містить у своєму складі желатин (10 %) і клітини в концентрації 1 млн./мл, переносили у чашки Петрі з фрагментами адаптованої білкозинової плівки у такій кількості, щоб товщина шару рідини над плівкою дорівнювала приблизно 5 мм. Далі виготовлені бішарові конструкції інкубували у холодильнику при температурі +4 °C протягом двох годин, доки розчин желатини, що містить живі клітини, не застигав, перетворившись у гідрогель. При цьому, гідрогель міцно зчеплювався з поверхнею білкозинової плівки, оскільки желатина має хімічний склад, наближений до такого у колагену (желатин є продуктом часткової деградації колагену). Безпосередньо після застигання, тимчасовий дермальний замінник шкіри вже готовий для практичного використання. Авторами перевірено життєздатність клітин у складі желатинового гідрогелю протягом трьох діб зберігання у холодильнику при температурі +4 °C (див. таблицю). 2 UA 112584 C2 Таблиця Доля життєздатних клітин серед усіх наявних у гідрогелі, % (при Р=0,95) 95±0,4 91±1,1 85,5±0,9 Час після висіву клітин 1 доба 2 доба 3 доба 5 10 15 20 25 30 35 40 45 50 Виживаність клітин зберігалась протягом 2 діб на дуже високому рівні, більше 90 %, на третю добу дещо знижувалась, але залишалась на достатньо високому рівні, 85,5 %. Також, як клітинний компонент використовували мультипотентні мезенхімальні стромальні клітини (ММСК) людини, які зберігалися довгий час у кріоконсервованому стані. Після кріоконсервування ММСК, як правило, культивували in vitro протягом декількох пасажів у тому ж самому середовищі, що й фібробласти людини. Таким чином, вироблений за пропонованим способом одержаний тимчасовий еквівалент дермального шару шкіри зберігався протягом двох-трьох діб без суттєвого зниження життєздатності клітин і придатний для лікування опікових ран. Одразу після утворення гідрогелю запропоновані біоконструкції можна використовувати для нанесення на опікові рани. При цьому, час зберігання готових еквівалентів шкіри до початку хірургічних процедур має бути як можна меншим, щоб уникнути загибелі або зниження життєздатності клітин у складі біоконструкції. Зразки розробленого тимчасового еквіваленту дермального шару шкіри було апробовано в попередньому експерименті із залученням лабораторних тварин - мишей лінії ICR. Чисельність контрольної та дослідної групи становила по 3 тварини. Миші мали опіки III ступеня. В дослідній групі тваринам на всю поверхню опікової рани здійснювалась аплікація фрагментів дермальних еквівалентів шкіри. Згадані біоконструкції накладалися таким чином, щоб поверхня гелю щільно прилягала до поверхні рани, та фіксувалися до неуражених ділянок шкіри за допомогою клею медичного БФ-6. Під дією температури тіла желатиновий гель, що містить клітини, поступово розплавлявся, а адаптована білкозинова плівка щільно прилягала до поверхні рани. Тривалість аплікації становила 8 годин. В контрольній групі тварин жодної обробки опікової рани не проводили. Тварини перебували в клітках з додатковим підігрівом до повного виходу зі стану наркозу. На фіг. 3 представлено вигляд інтактних ран та ран з накладеними експериментальними біоконструкціями, зліва направо: тварини 1 та 4 належать до контрольної групи, а тварини 2, 3 та 5 - до дослідної. Фотофіксацію стану опікової рани (фіг. 4) проводили раз на добу протягом 4х наступних діб, до утворення струпа. В подальшому, всі фото приводили до одного масштабу за допомогою графічного редактора Adobe Photoshop 8.0 та вимірювали площу поверхні опікової рани за допомогою спеціалізованої програми Scionlmage (beta-версія 4.0.2). Обробку експериментальних даних здійснювали за допомогою програми OriginPro 8.1. Площа рани вимірювалася в умовних одиницях, де за 1 (одиницю) було прийнято значення цього показника на першу добу після індукції опіку. Результати наведено на фіг. 5 та фіг. 6. Тенденція до зменшення площі поверхні опікової рани порівняно з контролем спостерігалася вже на другу добу досліду, а на третю добу цей показник в контрольній та дослідній групах відрізнявся статистично вірогідно (фіг. 6). На четверту добу досліду відбулося формування щільного струпу, після чого безпосереднє спостереження за поверхнею опікової рани стало неможливим до настання повного її загоєння. Проте, на доступних для безпосереднього візуального спостереження периферійних частинах опікової рани у тварин дослідної групи спостерігалися більш виражені ознаки епітелізації ранової поверхні (фіг. 5). Отримані результати свідчать про наявність сприятливого впливу аплікації запропонованого тимчасового еквіваленту дермального шару шкіри на процес загоєння рани, полегшення стану опікового хворого і перспективність застосування таких біоконструкцій у складі комплексної терапії опікової хвороби в клініці. Автори даної розробки мають досвід проведення клінічних досліджень з використанням тимчасових дермальних замінників шкіри штучного походження на основі поліакриламідних гідрогелів, що пройшли клінічні дослідження на обмеженому контингенті осіб в опіковому центрі Київської міської лікарні № 2 (1, 2). Дослідження на тваринах і в клініці вказують на те, що запропонований тимчасовий еквівалент дермального шару шкіри, створений з використанням природних речовин і стовбурових клітин шкіри, може бути більш ефективним при лікуванні опікових ран та при лікуванні пошкоджень шкіри іншого генезу і слугувати також для косметичних цілей, а також 3 UA 112584 C2 5 10 15 20 25 може бути економічно доцільнішим і ефективнішим в плані лікувального ефекту, завдяки використанню субстратів природного походження. 1. Косенко О.О. Штучний еквівалент шкіри на основі кополімерних гідрогелевих мембран з іммобілізованими мезенхімальними стовбуровими клітинами людини / 0.0. Косенко, Л.Л. Лукаш, Ю.М. Самченко [та інш.] // Біополім. і клітина. - 2006.- Т. 23, № 6. - С. 446-451. 7 2. Пат. UA № 82583, МПК А61K 31/74, А61K 35/12, A61L 15/00, A61L 27/00, А61Р 17/02. Біосумісний гідрогель медичного призначення та спосіб його одержання / Самченко Ю.М., Лукаш Л.Л., Косенко О.О. [и др.]. - а 2006 07473, 05.07.06; 10.01.08. ФОРМУЛА ВИНАХОДУ Спосіб одержання тимчасового еквіваленту дермального шару шкіри, який відрізняється тим, що як основу еквіваленту дермального шару шкіри використовують плівку "Білкозин", з якої вирізають фрагменти, здатні повністю покрити дно чашок Петрі, розмір яких вибирають відповідно до мети використання, інкубують протягом доби в буферному розчині, що має рівень рН 7,2-7,4 та містить кольоровий хімічний індикатор, через добу змінюють буферний розчин і продовжують це робити доти, доки хімічний індикатор не буде демонструвати, що після добової інкубації рН розчину залишається незмінним, після цього заморожують фрагменти адаптованої плівки в морозильній камері побутового холодильника при температурі -18 °С протягом доби, після розморожування фрагменти адаптованої плівки занурюють у буферний розчин, що має рівень рН 7,2-7,4 і стерилізують автоклавуванням за режимом 0,5 атмосфери протягом 30 хвилин, готують суспензію культивованих фібробластів людини у 10 % розчині желатини на основі DMEM і паралельно стерильні фрагменти адаптованої плівки розміщують у чашках Петрі та інкубують у середовищі DMEM протягом години, потім наносять суспензію клітин на поверхню адаптованої плівки, готові фрагменти плівки утримують в холодильнику при 4 °С до застигання розчину желатини з утворенням гідрогелю. 4 UA 112584 C2 5 UA 112584 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори англійськоюRuban Tetiana Panasivna, Lukash Liubov Leonidivna, Lukash Serhii Ivanovych
Автори російськоюРубан Татьяна Афанасьевна, Лукаш Любовь Леонидовна, Лукаш Сергий Иванович
МПК / Мітки
МПК: A61K 38/39, A61K 35/36, C12N 5/077, A61L 15/60
Мітки: шкіри, спосіб, тимчасового, одержання, еквіваленту, дермального, шару
Код посилання
<a href="https://ua.patents.su/8-112584-sposib-oderzhannya-timchasovogo-ekvivalentu-dermalnogo-sharu-shkiri.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання тимчасового еквіваленту дермального шару шкіри</a>
Попередній патент: Пристрій для транспортування і очистки коренебульбоплодів
Наступний патент: Універсальний шланговий бетононасос
Випадковий патент: Спосіб отримання біологічно активної добавки "біоком"