Спосіб виготовлення біокаркасів заданої форми для реконструктивної пластики кісткової тканини
Номер патенту: 121668
Опубліковано: 11.12.2017
Автори: Пантус Андрій Володимирович, Когут Володимир Любомирович, Рожко Микола Михайлович, Грекуляк Василь Васильович, Ковальчук Наталія Євгенівна
Формула / Реферат
Спосіб виготовлення біокаркасів заданої форми для реконструктивної пластики кісткової тканини, що включає попереднє зняття відбитку з наступним спіканням остеопластичного матеріалу, який відрізняється тим, що попереднє сканування вибраної ділянки щелепи здійснюють на спіральному комп'ютерному томографі з перенесенням даних комп'ютерної томографії в програмне забезпечення, проводять комп'ютерне моделювання відсутньої ділянки, створюють на основі віртуально сконструйованої відсутньої ділянки кісткової тканини "чорнову модель" шаблона шляхом тривимірного друку цієї ділянки з деградуючого (термопластичного) полімеру на основі дисперсії полівінілацетату при температурі 180 °C, поміщають в нього біосумісний матеріалу на основі b-трикальційфосфату (b-ТКФ), забезпечують його хімічну і/або термічну фіксацію з послідуючим розчиненням шаблона і отриманням біокаркаса на основі b-трикальційфосфату (b-ТКФ) заданої форми.
Текст
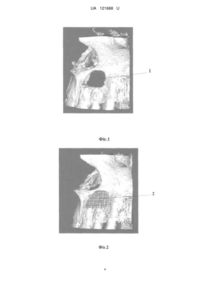
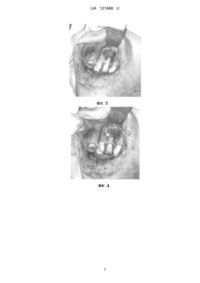
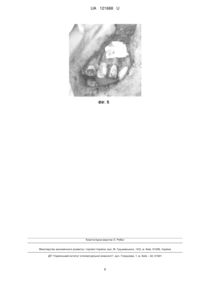
Реферат: Спосіб виготовлення біокаркасів заданої форми для реконструктивної пластики кісткової тканини включає попереднє зняття відбитку з наступним спіканням остеопластичного матеріалу. При цьому попереднє сканування вибраної ділянки щелепи здійснюють на спіральному комп'ютерному томографі з перенесенням даних комп'ютерної томографії в програмне забезпечення, проводять комп'ютерне моделювання відсутньої ділянки, створюють на основі віртуально сконструйованої відсутньої ділянки кісткової тканини "чорнову модель" шаблона шляхом тривимірного друку цієї ділянки з деградуючого (термопластичного) полімеру на основі дисперсії полівінілацетату при температурі 180 °C, поміщають в нього біосумісний матеріалу на основі -трикальційфосфату (-ТКФ), забезпечують його хімічну і/або термічну фіксацію з послідуючим розчиненням шаблона і отриманням біокаркаса на основі трикальційфосфату (-ТКФ) заданої форми. UA 121668 U (12) UA 121668 U UA 121668 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до медицини, зокрема до щелепно-лицевої хірургії та біоінженерії, а саме реконструктивної пластики кісткової тканини, і може застосовуватися як для виготовлення біологічно-сумісних каркасів на основі високочистого β-трикальційфосфату (βТКФ) для безпосередньої імплантації так і для вирощування на ньому кісткової тканини в біореакторі. Відома технологія тривимірного біодруку використовує для надання форми ряд термопластичних полімерів таких як полілактид (ПЛК, в англомовній абревіатурі - PLA), який одержують мікробіологічною ферментацією цукрів, які попередньо отримують гідролізом і екстракцією з природної сировини (кукурудзи, крохмалю і т. д.) ["Материалы для медицины, клеточной и тканевой инженерии" учеб. пособие / Т.Г. Волова, Е.И. Шишацкая, П. В. Миронов 2007, с. 171-185. Shikinami, Y. Bioresorbable devices made of forged composites of hydroxyapatite(HA) particles and poly-L-lactide (PLLA): Part I. Basic characteristiccs / Y. Shikinami, M. Okuno // Biomaterials.-1999. - Vol. 20. - P. 859-877.]. Відома також технологія на основі полігліколіду (ПГК, англійська абревіатура - PGA) продукту полімеризації із високою молекулярною вагою, що являє собою твердий, кристалічний полімер, з температурою плавлення порядку 228 °C; температура піклування становить 37 °C. Механічна міцність у поєднанні з пластичністю роблять цей полімер придатним для виготовлення різних конструкцій - від нетканих, губчастих матеріалів до пластин і гвинтів, які застосовують для фіксації кісткових уламків. Матеріал не має цитотоксичні властивості, забезпечує адгезію і підтримує проліферацію клітин. Однак механічна міцність імплантованих виробів з ПГК зберігається протягом нетривалого періоду, від 20 до 30 діб зі значною втратою маси виробу за цей період - до 40-50 % ("Материалы для медицины, клеточной и тканевой инженерии" учеб. пособие / Т.Г. Волова, Е.И. Шишацкая, П.В. Миронов. - 2007. - С. 171-185). Інша відома технологія тривимірного біодруку використовує для створення тривимірного каркаса полікапролактон (ре1). Це біодеградуючий поліестер, має низьку температуру плавлення близько 60 °C і температуру склування в - 60 °C. Частіше всього використовується у виробництві поліуретанів. Полікапролактон деградує у фізіологічних умовах (наприклад в людському тілі) і тому розглядається як імплантний матеріал. Зокрема він дуже цікавий з точки зору приготування довготривалих імплантних пристроїв, так як тривалість деградації навіть повільніша ніж для полілактиду. PCL був затверджений Управлінням продовольства і медикаментів (FDA) для спеціального призначення в людському тілі, наприклад пристрій по доставці медикаментів, хірургічна голка (продається під брендом Monocryl), який використовують у тканинній інженерії і т.д., а також в стоматології в стоматологічних шинах і як заповнювач зубного каналу. Властивості дуже схожі на гутаперчу, матеріал пом'якшується при дії температури і розчиняється такими розчинниками як хлороформ. Найголовнішою відмінністю зубного заповнювача на основі полікапролактону (Resilon або Real Seal) від гутаперчі, є те, що PCL - біодеградивний матеріал. Однак цей полімер не є настільки споріднений з кістковою тканиною як високочистий β-трикальційфосфат, оскільки період деградації матеріалу на його основі дуже довгий, крім того матеріал стимулює утворення сполучної тканини, що є не бажаним при відновленні кістки (β-ТКФ) [BIODEGRADABLE POLY-EPSILON-CAPROLACTONE (PCL) FOR TISSUE ENGINEERING APPLICATIONS: A REVIEW, Mohammed Abedalwafa, Fujun Wang, Lu Wang and Chaojing Li. - 2012. - С. 123-140]. Найбільш близьким до корисної моделі, що заявляється, за технічною суттю є відома технологія рут репліки, згідно з якою в методиці використовують матеріал, що являє собою чистий β трикальційфосфату (ТКФ) з високою мікро- і міжгранульною пористістю. Діаметр гранул від 800 до 1000 цм і при цьому кожна гранула покрита 10 µм гомогенною оболонкою полілактоідною, поліглюкоїдною кислотою (ПЛГК) [патент DS Dental Schlieren /Zurich, Швейцарія]. Пропонована терапія "Root Replica ™" полягає в негайному закритті поверхні рани свіжої лунки після видалення кореня, точною копією цього кореня, виготовленої із синтетичного, повністю деградованого біоматеріалу. Копія виготовляється безпосередньо у крісла хворого протягом 5-ти хвилин після видалення. Імплантат повністю резорбується протягом 6-12-ти місяців і заміщується кістковою тканиною. Виготовляють зліпок віддаленого кореня зуба і відразу ж поміщають в спеціальний реплікатор та заповнюють гранулами біоматеріалу, після невеликого ущільнення матеріалу і його нагрівання гранули спікають між собою, утворюючи механічно міцну, точну копію віддаленого кореня. Потім Root Replica ™ вводять в свіжу лунку альвеолярного відростка. Завдяки пористості і точному виготовленню копії кореня досягають безпосереднього контакту з кістковою стінкою альвеоли, що є основною для регенерації кісткової тканини на поверхні остеокондуктивного біоматеріалу [Інноваційна методика "ROOT REPLICA" для профілактики атрофії альвеолярного відростка після видалення кореня зуба // 1 UA 121668 U 5 10 15 20 25 30 35 40 45 50 55 Сучасна стоматологія, 2/2009 А.В. Павленко, P.P. Ілик, С.А. Горбань, Dr. Shterenberg A. - С. 6769]. Однак ця методика має обмеженість у використанні і використовується тільки для заповнення лунки видаленого зуба. Інші параметри об'єктів не передбачені через обмеження розмірів кювети. Крім цього дана методика не може відтворювати форми з віртуальних об'єктів. В основу корисної моделі поставлено задачу створення нового ефективного, простого та недороговартісного способу виготовлення каркаса запрограмованої форми з біоматеріалу на основі β-трикальційфосфату (β-ТКФ) шляхом відпрацювання системної послідовності пропонованих операцій з сканування патологічної ділянки, попереднього комп'ютерного моделювання відсутньої ділянки і створення шляхом тривимірного друку "чорнової моделі" шаблона цієї ділянки з деградуючого полімеру із заливкою в нього біосумісного матеріалу, його хімічної або термічної фіксації з послідуючим розчиненням шаблона, забезпечити можливість виготовлення готового каркаса, придатного як для безпосередньої імплантації в тіло людини, так і для вирощування фрагментів кісток в лабораторії. Поставлена задача вирішується тим, що за способом виготовлення біокаркасів заданої форми для реконструктивної пластики кісткової тканини, що включає попереднє зняття відбитку з наступним спіканням остеопластичного матеріалу, згідно з корисною моделлю, попередньо сканують вибрану ділянку щелепи на спіральному комп'ютерному томографі з перенесенням даних комп'ютерної томографії в програмне забезпечення, проводять комп'ютерне моделювання відсутньої ділянки, створюють на основі віртуально сконструйованої відсутньої ділянки кісткової тканини "чорнову модель" шаблона шляхом тривимірного друку цієї ділянки з деградуючого (термопластичного) полімеру на основі дисперсії полівінілацетату при температурі 180 °C, поміщають в нього біосумісний матеріал на основі β-трикальційфосфату (βТКФ), забезпечують його хімічну і/або термічну фіксацію з послідуючим розчиненням шаблона і отриманням біокаркаса на основі β-трикальційфосфату (β-ТКФ) заданої форми. Завдяки тому, що дисперсії полівінілацетату належать до термопластичних речовин і є нетоксичними, оскільки у своєму складі найчастіше містять: полівінілацетат, емульгатор (найчастіше полівініловий спирт), пластифікатор (дибутилфталат, дибутилсебаціанат) і дисперсійне середовище воду, що легко розчиняються у воді, і надрукований шаблон піддають одному з двох видів стерилізації (хімічній або гамма стерилізації). При цьому хімічну стерилізацію (згідно зі стандартом) шаблона проводять до внесення в шаблон стерильного біоматеріалу, гаммастерилізацію - як самого шаблона, так і виготовленого каркаса. Як приклад, при потужності установки 10 Вт/кг для отримання стерильності матеріалу його піддають впливу іонізуючих променів протягом приблизно 5 год. Доза стерилізації залежить як від матеріалу, що піддається стерилізації, так і від кількості і радіостійкості мікроорганізмів, що знаходяться в опромінюваному матеріалі. Медичні інструменти, в тому числі шприци, голки, катетери, перев'язувальні матеріали, ємності для переливається крові та інші вироби піддають стерилізації шляхом впливу дозою 2,5 кДж/кг. В надрукований шаблон поміщають біоматеріал на основі β-трикальційфосфату β-ТКФ). В залежності від біоматеріалу застосовують і принципи його фіксації. Якщо біоматеріал з гранул, покритих 10 цм гомогенною оболонкою з полілактоїдної, поліглюкоїдної кислот (ГТЛГК), такий матеріал фіксують шляхом спікання за температур нижчих за температуру плавлення шаблона. Якщо ж матеріал на основі βтрикальційфосфату (β-ТКФ) хімічного затвердіння при контакті з кров'ю або іншими рідинами, то його не піддають термообробці. Після фіксації матеріалу в шаблоні шаблон разом з матеріалом поміщають у стерильний фізіологічний розчин. Першими ознаками розчинення полімеру є розм'якшення стінок шаблона, які легко забирають фізичним методом. В результаті отримують каркас з біосумісного матеріалу на основі β-трикальційфосфату (β-ТКФ) заданої форми. Таким чином, отримано новий спосіб виготовлення біокаркасів на основі βтрикальційфосфату (β-ТКФ) заданої форми, системною сукупністю і послідовністю пропонованих операцій із сканування патологічної ділянки, попереднього комп'ютерного моделювання відсутньої ділянки, створення шляхом тривимірного друку "чорнової моделі" шаблона цієї ділянки з деградуючого полімеру із поміщенням в нього біосумісного матеріалу, його хімічною і/або термічною фіксацією з послідуючим розчиненням шаблона, і отриманням готового каркаса для використання як для безпосередньої імплантації в тіло людини, так і для вирощування фрагментів кісток в лабораторії, тобто маємо комплексне технічне рішення, достатнє для вирішення поставленої задачі корисної моделі. Суть способу пояснюють графічні матеріали. На Фіг. 1 наведено тривимірну реконструкцію кісткової тканини з дефектом, на Фіг. 2 віртуальне зображення створеної реконструкції ділянки з дефектом і на Фіг. 3 - кістковий дефект 2 UA 121668 U 5 10 15 20 25 30 верхньої щелепи, на Фіг. 4 - кістковий дефект верхньої щелепи закритий біокаркасом і на Фіг. 5 кістковий дефект верхньої щелепи з біокаркасом, прикритий мембраною. Спосіб здійснюють так. Приклад. Пацієнт Б., 40 р., звернувся в клініку хірургічної стоматології з метою санації ротової порожнини. При обстеженні виявлено кісту в ділянці верхньої щелепи зліва. На основі даних об'єктивного обстеження та рентгенологічних даних прийнято рішення про заміщення дефекту верхньої щелепи. З метою планування проведення дентальної імплантації пацієнтові проведено конусну спіральну комп'ютерну томографію на апараті Veraviewepocs фірми Morita. Дані комп'ютерної томографії в форматі Dikom перенесено в програмне забезпечення SimPlant Pro 11.04. В програмному забезпечені проведено тривимірну реконструкцію кісткової тканини з дефектом 1, наведеним на Фіг. 1. На віртуальному зображенні створили реконструкцію 2 ділянки з дефектом 1, наведену на Фіг. 2. Далі в комп'ютерній програмі на основі віртуально сконструйованої відсутньої ділянки кісткової тканини створили "чорнову модель" шаблона для поміщення біоматеріалу. Створений шаблон відправили на тривимірний FDM друк. "Чорнову модель" шаблона виготовили, як приклад, з термопластичного полімеру на основі дисперсії полівінілацетату при температурі 180 °C. В надрукований шаблон помістили біоматеріал на основі β-трикальційфосфату (β-ТКФ). Після хімічної фіксації даного матеріалу звільнили матеріал від шаблона шляхом розчинення шаблона у фізіологічному розчині і помістили біокаркас в рану, прикривши його мембраною під час операції з послідовністю, наведеною на Фіг. 3. Таким чином пропонованим способом досягли якісного заміщення дефекту верхньої щелепи і відновлення всіх її функцій. Скарг від пацієнта не надходило. Застосування способу виготовлення біокаркасів на основі β-трикальційфосфату (β-ТКФ) заданої форми, системною сукупністю і послідовністю пропонованих операцій із сканування патологічної ділянки, попереднього комп'ютерного моделювання відсутньої ділянки, створення шляхом тривимірного друку "чорнової моделі" шаблона цієї ділянки з деградуючого полімеру із поміщенням в нього біосумісного матеріалу, його хімічною і/або термічною фіксацією з послідуючим розчиненням шаблона, забезпечило можливість отримання готового каркаса для використання як для безпосередньої імплантації в тіло людини, так і для вирощування фрагментів кісток в лабораторії. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 35 40 45 Спосіб виготовлення біокаркасів заданої форми для реконструктивної пластики кісткової тканини, що включає попереднє зняття відбитку з наступним спіканням остеопластичного матеріалу, який відрізняється тим, що попереднє сканування вибраної ділянки щелепи здійснюють на спіральному комп'ютерному томографі з перенесенням даних комп'ютерної томографії в програмне забезпечення, проводять комп'ютерне моделювання відсутньої ділянки, створюють на основі віртуально сконструйованої відсутньої ділянки кісткової тканини "чорнову модель" шаблона шляхом тривимірного друку цієї ділянки з деградуючого (термопластичного) полімеру на основі дисперсії полівінілацетату при температурі 180 °C, поміщають в нього біосумісний матеріалу на основі -трикальційфосфату (-ТКФ), забезпечують його хімічну і/або термічну фіксацію з послідуючим розчиненням шаблона і отриманням біокаркаса на основі трикальційфосфату (-ТКФ) заданої форми. 3 UA 121668 U 4 UA 121668 U 5 UA 121668 U Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
Мітки: пластики, кісткової, біокаркасів, заданої, реконструктивної, спосіб, виготовлення, тканини, форми
Код посилання
<a href="https://ua.patents.su/8-121668-sposib-vigotovlennya-biokarkasiv-zadano-formi-dlya-rekonstruktivno-plastiki-kistkovo-tkanini.html" target="_blank" rel="follow" title="База патентів України">Спосіб виготовлення біокаркасів заданої форми для реконструктивної пластики кісткової тканини</a>
Попередній патент: Спосіб діагностики розвитку атеросклерозу
Наступний патент: Теплообмінна труба
Випадковий патент: Електричноскануючий вихрострумовий перетворювач