Імплантат для парентерального введення з контрольованою доставкою
Номер патенту: 26137
Опубліковано: 07.06.1999
Автори: Райс Тереза, Мансіні Каді Сюзан, Стібер Уільям Девід, Джонсон Девід Фарлі
Формула / Реферат
1. Имплантат для парентерального введения с контролируемой доставкой, содержащий сердцевину, включающую активное вещество и покрытие, отличающийся тем, что сердцевина содержит от одного до трех слоев, каждый из которых содержит 35 - 70% биологически активного протеина, пептида или полипептида, 17,6 - 50% жира или воска, не более 20% сахара, не более 5,3% буфера и не более 16% наполнителя в пересчете на общий вес сердцевины.
2. Имплантат по п.1, отличающийся тем, что биологически активный белок, пептид или полипептид выбирают из группы, состоящей из соматотропинов, соматомединов и ростовых факторов, включающих свиные, овечьи, конские, коровьи, птичьи и человеческие соматотропины, жир выбирают из группы, состоящей из глицеринового тримиристата, глицеринового трипальмитата и глицеринового тристеарата, буфер выбирают из группы, состоящей из бората натрия, карбоната натрия, одноосновного фосфата натрия, двухосновного фосфата натрия и их смеси, сахар выбирают из группы, состоящей из глюкозы, маннозы, сахарозы, рафинозы, сорбита, маннита и лактозы, покрытие включает один или два слоя, состоящие из полупроницаемого материала, и дополнительно имплантат содержит стабилизатор, поверхностно-активное вещество или их смеси.
3. Имплантат по п.1, отличающийся тем, что буфер является смесью одноосновного фосфата натрия и двухосновного фосфата натрия.
4. Имплантат по п.1, отличающийся тем, что покрытие является сополимером метакрилатного сложного эфира, содержащим от 1мас.% до 20мас.% этилцитрата или талька, а толщина покрытия составляет 3,81 × 10-5 - 6,5 × 10-5м.
5. Имплантат по п.1, отличающийся тем, что доза биологически активного белка, пептида или полипептида, находящаяся в каждом слое, увеличивается по направлению от центра к периферии.
6. Имплантат по п.1, отличающийся тем, что содержит 45 - 65% биологически активного протеина, пептида или полипептида, 15 - 50% жира или воска, 2,5 - 5% буфера и 1 - 15% наполнителя в пересчете на общий вес сердцевины.
7. Имплантат по п.2, отличающийся тем, что свиной соматропин выбирают из группы, состоящей из E34rpST, 1122L + E34rpST и A6TS11R + E34rpST.
Текст
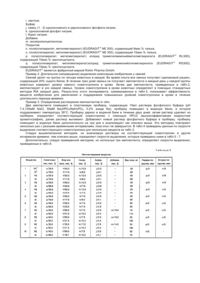
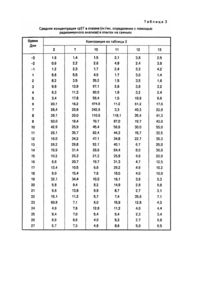
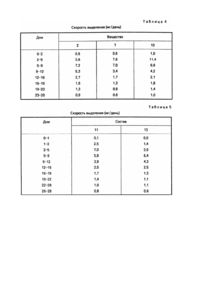
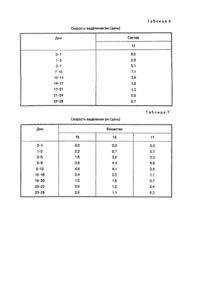
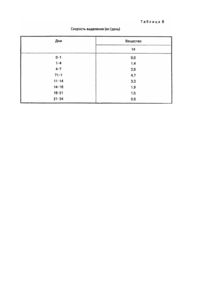
Хорошо известна необходимость разработки способов и композиций, которые постоянно и равномерно в течение длительного периода времени выделяют фармацевтические препараты, а также трудности, встречаемые на этом пути (патент США №4795644, A 61 K 9/54, 1989). Настоящее изобретение относится к имплантируемой композиции равномерного и постоянного продолжительного действия для парентерального введения дозы, биологически активного белка, пептида или полипептида, которая включает в себя компактную, с углублением и частично покрытую композицию, содержащую от одного до трех слоев, каждый из которых содержит по массе около 20 - 80% биологически активного белка, пептида или полипептида, около 10 - 70% жира или воска либо их смеси, от 0 до около 20% буфера или соли либо их смеси и от 0 до около 25% сахара. Неожиданно обнаружили, что повышенные уровни в крови биологически активных белков, пептидов и полипептидов можно получить и поддерживать в течение длительного периода времени с помощью имплантации животным компактной, с углублением и частично покрытой композиции согласно настоящему изобретению. Имплантируемая композиция по данному изобретению предпочтительно является компактной, с углублением и частично покрытой композицией, содержащей от одного до трех слоев, каждый из которых содержит по массе около 20 - 80% биологически активного белка, пептида или полипептида, около 10 - 75% жира или воска либо их смеси, около 1 20% буфера или соли либо их смеси и около 1 - 25% сахара. Более предпочтительным имплантируемым веществом по этому изобретению является компактная, с углублением и частично покрытая композиция, содержащая от одного до трех слоев, каждый из которых содержит по массе около 35 - 70% биологически активного белка, пептида или полипептида, около 15 - 50% жира или воска либо их смеси, около 1 10% буфера или соли либо их смеси и около 5 - до 15% сахара. Биологически активные белки, пептиды и полипептиды включают соматотропины, соматомедины, ростовые факторы и другие биологически активные белки и их фрагменты и производные. Предпочтительны белки, включающие свиные, овечьи, конские, коровьи, птичьи и человеческие соматотропины; а также белки, имеющие естественное, синтетическое, рекомбинантное или биосинтетическое происхождение. Более предпочтительными белками являются соматотропины с альтерациями на участке a-helix 3, участке a-helix 2, их комбинациями и в комбинации с другими мутациями с E34rpST, 1122L + E34rpST и A6TS11R + E34rpST, которые являются наиболее предпочтительными. Воски и жиры, которые целесообразно применять в композиции данного изобретения, вообще имеют точку плавления выше 40°C. Воск можно охарактеризовать как низкоплавкую органическую смесь или высокомолекулярное соединение, твердый при комнатной температуре и обычно в композиции, похожий на жиры и масла, за исключением того, что он не содержит глицеридов. Некоторые из них являются углеводородами; другие - сложными эфирами жирных кислот и спиртов. Эти соединения включают предельные или непредельные жирные кислоты, спирты, сложные эфиры, соли, эфиры с длиной цепочки C10-C24 или их смеси. Их классифицируют как липиды. Воски являются термопластиками, но так как они не являются высшими полимерами, то их не относят к семейству пластиков. Их общими свойствами являются гидрофобность, однородная текстура; нетоксичность, отсутствие неприятного запаха и цвета. Они являются горючими веществами и обладают хорошими диэлектрическими свойствами. Они растворимы в большинстве органических растворителей и не растворимы в воде. Основные их виды: I. Натуральные. 1. Животные (пчелиный воск, ланолин, шеллаковый воск, китайский воск насекомых). 2. Растительные (восконосная пальма, канделилла, тростниковый сахар). 3. Минеральные: а) окаменелые или земляные воски (озокерит, церизин, монтан); б) нефтяные воски (парафин, микрокристаллический гач или сырой парафин). II. Синтетические: 1. Этиленовые полимеры и полиэфир алкоксикислоты ("Карбовоск"). 2. Хлорированные нафталины ("Халовоск"). 3. Углеводородный вид через синтез Fischer-Tropseh. Жир, используемый в настоящем изобретении, можно охарактеризовать как глицериновый эфир жирных кислот таких, как миристиновая, стеариновая и пальмитиновая. Такие сложные эфиры и их смеси являются твердыми веществами при комнатной температуре и имеют кристаллическую структуру. Примерами являются лярд (полутвердый жир) и твердый жир. Между маслом и жиром не существует химических различий, единственным отличием является то, что жиры являются твердыми веществами при комнатной температуре, а масла - жидкими. Термин "жир" обычно относится, в частности к триглицеридам, тогда как термин "липид" является всеобъемлющим. Жир предпочтительно является составленным из моно-, ди- или триглицериновых эфиров жирных кислот с длиной цепочки C10-C24. В состав моно-, ди- или триглицеридов преимущественно входят миристаты, стеараты, пальмитаты, даураты, линолеаты, линоленаты, олеаты и их группы или смеси, имеющие точки плавления выше 50°C, что является наиболее предпочтительным, Глицериновый тримиристат является наиболее предпочтительным жиром. Сахара, которые целесообразно использовать в композиции в настоящем изобретении, включают моно-, ди- или трисахариды такие, как глюкоза, манноза, сорбит, маннит, лактоза, сахароза, мальтоза целлобиоза и рафиноза. Предпочтительными сахарами являются нередуцирующие моно-, ди- или трисахариды с сахарозой, рафинозой, сорбитом и маннитом, что является наиболее предпочтительным. К имплантируемым композициям настоящего изобретения добавляют буферы с целью доведения pH вещества до значения от около 6,0 до 8,5 для того, чтобы повлиять на растворимость соматотропина и в результате на выделение соматотропина из имплантируемого вещества. Буферы, которые целесообразно использовать в веществе данного изобретения, включают фосфаты, бораты, карбонаты, глицинаты и т.п. натрия и калия или их смеси в смеси с одноосновным фосфатом натрия и двухосновным фосфатом натрия, что является предпочтительным для доведения pH вещества до предпочтительного значения от около 6,5 до 8,0. Соли, которые целесообразно использовать в композиции в настоящем изобретении, включают такие соли, как хлорид натрия, хлорид калия и т.п. В состав заявленной композиции могут быть включены такие добавки, как стабилизаторы, антисептики (preservatives), поверхностно-активные вещества или их смеси. Предпочтительные стабилизаторы включают дегидроуксусную кислоту, салициланклид, сорбиновую кислоту, борную кислоту, бензойную кислоту и их соли, оксипропилцеллюлозу, оксипропилметилцеллюлозу, нитрит натрия и нитрат натрия. Количества упомянутых добавок, которые целесообразно использовать в изобретении, находятся в пределах около 0,1 - 20мас.%. Неожиданно обнаружилось, что повышенные уровни соматотропинов в крови можно получить и поддерживать в течение длительного периода времени с помощью имплантации животным композиции данного изобретения. Повышенные уровни биологически активных белков, пептидов и полипептидов в крови обычно наблюдают и связывают с полезными и/или терапевтическими воздействиями. Эти воздействия включают прирост массы, повышение скорости роста, улучшение эффективности использования кормов, уменьшение жировых отложений, улучшение соотношения содержания мяса к жиру, улучшение размеров мышц и улучшение молочной продуктивности молочных животных. Сохранение повышенных уровней в крови является показателем медленного выделения активного ингредиента. Такие свойства, как повышение скорости роста, улучшение эффективности использования кормов, улучшение соотношения содержания мяса к жиру и увеличение молочной продуктивности, обычно наблюдают, когда сохраняются повышенные уровни активного ингредиента в крови. Изобретение включает в себя использование композиции с целью увеличения скорости роста, улучшения эффективности использования кормов, увеличения содержания мяса у животных, улучшения молочной продуктивности, повышения и сохранения уровней соматотропинов в крови животных. Имплантируемая композиция настоящего изобретения, которую используют для введения биологически активного белка, пептида или полипептида, может быть получена с помощью соединения активного ингредиента, буфера или соли либо их смеси и сахара с расплавленным жиром, воском, либо их смесью для получения грубого порошка. Компактную и с углублением композицию затем получают с помощью таблеточного пресса с обычными размерами имплантата такими, как 5/32, 1/8 дюйма и т.п. с использованием специального верхнего перфоратора. Верхний перфоратор имеет конусообразную выступающую часть по центру перфоратора, которая делает коническое углубление в композиции при вдавливании. От одного до трех слоев грубого порошка затем помещают в пресс-форму и вдавливают с помощью специального верхнего перфоратора для образования компактных композиций с углублением. В предпочтительном варианте исполнения изобретения доза биологически активного белка, пептида или полипептида, присутствующего в каждом слое, увеличивается по мере удаления от углубления. Компактные композиции с углублением затем покрывают одним - двумя слоями из полупроницаемого материала для образования заявленных имплантируемых композиций. Углубление остается по существу непокрытым и становится каналом, по которому активный ингредиент выделяется из композиции в течение длительного периода времени. Полупроницаемые материалы, которые целесообразно использовать для покрытия спрессованной композиции с углублением, включают полупроницаемые полимеры такие, как сополимеры метакрилатного сложного эфира, полимеры этилцеллюлозы и т.п. Добавки такие, как пластификаторы и наполнители, могут быть добавлены к полупроницаемым полимерам в дозах 1 - 20мас.% с триэтилцитратом и тальком, которые являются предпочтительным пластификатором и наполнителем соответственно. Толщина каждого покрытия, окружающего компактное вещество с углублением, составляет около 0,5 - 25,0мл. Для того, чтобы способствовать дальнейшему пониманию изобретения, представлены следующие примеры. Изобретение не ограничивается этим, за исключением того, что определено в формуле изобретения. Пример 1. Получение имплантируемых композиций для парентерального введения соматотропинов. 1. Приготовление соматотропина, сахара, буфера и добавок в пределах размеров, пригодных для введения в жир, воск или их смесь, посредством распылительной сушки может быть выполнено с помощью растворенных соматотропина и сахара в воде и затем добавления желаемого раствора буфера такого, как смеси 1 : 2 одноосновного и двухосновного фосфата натрия. Такие добавки, как оксипропилцеллюлоза, могут быть добавлены и растворены. Затем раствор высушивают в распылительной мини-сушке Buchi, модель # 190. 2. Приготовление гранулированного порошка. Получают гомогенную смесь порошка, высушенного распылительной сушкой, в расплавленном жире, воске или их смеси, затем полученную смесь охлаждают для получения порошка. Из порошка делают таблетки при помощи таблеточного пресса Stores модель # 512, оборудованным 5/8-дюймовыми перфораторами и пресс-формами. Эти таблетки перемалывают, используя настольную микромолотковую мельницу (Glen Mills Microhammerilill), получают грубый гранулированный порошок. 3. Получение компактной композиции с углублением. Состоящую из слоев компактную композицию с углублением приготавливают с помощью одного таблеточного пресса Stores модель # 521, оборудованного 5/32-дюймовыми прессформами и специальными верхними перфораторами. Верхний перфоратор имеет конусообразный выступ размером 3мм по центру перфоратора. Основание перфоратора составляет около 1мм. Для получения состоящего из слоев компактного вещества с углублением сначала в пресс-форму помещают гранулированный порошок и слегка утрамбовывают внутренний край, затем в пресс-форму помещают гранулированный порошок, чтобы сделать край с углублением. Прессом управляют вручную, так что каждый имплантат делают по отдельности. Для получения однородных имплантатов используют 1/8-дюймовые пресс-формы и специальные верхние перфораторы. Верхний перфоратор имеет конусообразный выступ размером 3мм по центру перфоратора, основание выступа составляет около 1мм. Желаемую дозу гранулированного порошка помещают в пресс-форму и приготавливают однородную компактную композицию с углублением с помощью ручного управления прессом. 4. Получение частично покрытой имплантируемой композиции. Компактные композиции с углублениями покрывают одним или двумя слоями полупроницаемого полимерного материала, используя MINI-HI-COATERâ (фабричная марка Vector Laboratories). Поверхность в углублении остается по существу непокрытой и становится каналом, по которому активный ингредиент выделяется из композиции в течение продолжительного периода времени. Используя вышеописанную методику, а также материалы, приведенные в табл.1, получают имплантируемые композиции, приведенные далее в табл.2. Таблица 1 Соматотропин a. 1122L + E34rp.ST, b. E 34 rpST, c. A6TS11R + E34rpST, d. CAM - rpST e. коровий соматотропин. Жир или воск. f. глицериновый тримиристат g. глицериновый тристеарат. Сахар. h. сахароза, i. лактоза. Буфер j. смесь (1 : 2) одноосновного и двухосновного фосфата натрия, k. одноосновной фосфат натрия, l. борат натрия. Добавка m. оксипропилцеллюлоза. Покрытие n. поли(этилакрилат, метилметакрилат) (EUDRAGITâ NE 300), содержащий 8мас.% талька, o. поли(этилакрилат, метилметакрилат) (EUORAGITâ NE 300), содержащий 15мас.% талька, p. поли(этилакрилат, метилметакрилат) хлорид триметиламмонийметилметакрилата (EUDRAGITâ RL30D), содержащий 15мас.% триэтилцитрата, q. поли(этилакрилат, метилметакрилат)хлорид триметиламмонийэтилметакрилата (EUDRAGITâ RS30D), содержащий 15мас.% триэтилцитрата. EUDRAGITâ является фабричной маркой Rohm Pharma GmbH. Пример 2. Длительное (непрерывное) выделение композиции изобретения у свиней. Свиней делят на группы по четыре животных в каждой. Во время опыта все свиньи получают одинаковый рацион, содержащий 20% сырого белка. В течение трех дней свиньи не получают имплантанта и каждый день у каждой группы животных измеряют уровни свиного соматотропина в крови. Затем два имплантанта, приведенные в табл.2, имплантируют в ухо каждой свиньи. Уровни соматотропина в крови животных определяют в помощью стандартных методов RIA каждый день. Результаты этого эксперимента, суммированные в табл.3, показывают эффективность веществ изобретения для увеличения и поддержания повышенных уровней соматотропина в крови в течение длительного периода времени. Пример 3. Определение растворения имплантантов in vitro. Два имплантанта помещают в пластиковую пробирку, содержащую 10мл раствора фосфатного буфера (pH 7,4,100мМ NaCl, 50мМ Na2HPO4/NaH2PO4, 0,2% азида Na), пробирку помещают в водяную баню, в которой поддерживают температуру 39°C. Пробирку держат в водяной бане в течение двух дней, затем раствор удаляют из пробирки, определяют соответствующий соматотропин с помощью HPLG (высокоэффективная жидкостная хроматография), далее раствор выливают. Добавляют новый раствор фосфатного буфера в пробирку, пробирку помещают в водяную баню дополнительно на три дня и анализируют как описано выше. Эту методику повторяют несколько раз с разными временными интервалами, пока опыт не завершится. В табл.4 приведены данные по скорости выделения соответствующего соматотропина для нескольких веществ из табл.2. Следуя вышеописанной методике, но анализируя растворы на соответствующий соматотропин в других интервалах времени, чем описано выше, определяют скорости выделения, которые приведены ниже в табл.5 - 7. Дополнительно, следуя приведенной методике, но используя три имплантанта, определяют скорости выделения, приведенные в табл.8.
ДивитисяДодаткова інформація
Автори англійськоюStiber William David, Mancini Cadi Susan, Johnson David Farley, Rice Theresa
Автори російськоюСтибер Уильям Дэвид, Мансини Кади Сюзан, Джонсон Дэвид Фарли, Райс Тереза
МПК / Мітки
МПК: A61K 38/00, A61K 9/22
Мітки: імплантат, введення, парентерального, доставкою, контрольованою
Код посилання
<a href="https://ua.patents.su/8-26137-implantat-dlya-parenteralnogo-vvedennya-z-kontrolovanoyu-dostavkoyu.html" target="_blank" rel="follow" title="База патентів України">Імплантат для парентерального введення з контрольованою доставкою</a>
Попередній патент: Похідні арилсульфонаміду, суміші їх ізомерів або індивідуальні ізомери і їх фізіологічно переносимі адитивні солі з основами, що мають антитромботичну активність
Наступний патент: Генератор коливань текучого середовища і витратомір, що містить такий генератор
Випадковий патент: Заміщені єнамінони, їх похідні і їх застосування