Трансдермальна композиція, спосіб її одержання, спосіб лікування захворювань, чутливих до інгібування моноамінооксидази в
Номер патенту: 26892
Опубліковано: 29.12.1999
Автори: СЮЧ Тамаш, СЕЛЕЛЬ Анна, ЛЕНДЬЄЛ Йожеф, ТОТ Антал, Заводскі Сабо Анна, ПІНТЕР Янош, САБО Габриела, СЄГЄ Андраш, МАДЬЯР Кальман, МАРМАРОШІ Каталін
Текст
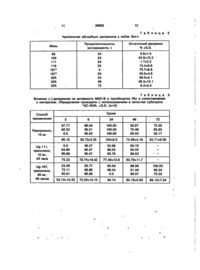
1. Трансдермальная композиция, содержащая активный ингредиент, в качестве которого использован оптически активный или рацемический Ы-метил-Ы-(фенилпропил)-2-пропиниламин, или N-метилN-( 1 -(4-фторофенил)-2-пропил)-2-пропиниламин, или их терапевтически приемлемые соли, и вспомогательные материалы, о т л и ч а ю щ а я с я тем, что в качестве вспомогательных материалов использованы жидкий полиоксиэтилен, твердый полиоксиэтилен, неионное поверхностно-активное соединение и пропиленгликоль при следующем весовом соотношении компонентов, мас.%: Активный ингредиент 5-15 Жидкий полиоксиэтилен 40-70 Твердый полиоксиэтилен 10-20 Неионное поверхностно- , активное соединение 2-30 Пропиленгликоль 2-20 при этом композиция находится в форме 20-100-процентной безводной лиотропной жидкой кристаллической системы. 2. Композиция по п.1, о т л и ч а ю щ а я с я тем, что она дополнительно содержит 0,5 мас.% полимера с показателем а более, чем 0,6. 3. Композиция по п.1, или п.2, о т л и ч а ю щ а я с я тем, что дополнительно содержит другие вспомогательные материалы в качестве эмульгирующих средств. 4. Способ получения трансдермальной безводной композиции путем смешивания активного ингредиента, в качестве которого используют оптически активный или рацемический Ы-метил-Ы-(фенил-2пропил)-2-пропиниламин или N-метил-Ы(1 -(4-фторофенил)-2-пропиниламин, или их терапевтически приемлемые соли, и вспомогательных материалов, о т л и ч а ю щ и й с я тем, что 4 0 - 7 0 мас.% жидкого полиоксиэтилена нагревают, добавляют в него 10-20 мас.% расплавленного твердого полиоксиэтилена, а затем в полученную смесь добавляют 2 - 3 0 мас.% неионного соединения и 5-15 мас.% активного ингредиента, разведенных 2 - 2 0 мас.% пропиленгликоля, получая 2 0 - 1 0 0 процентную лиотропную композицию в форме жидкой кристаллической системы, причем смешивание производят в безводной среде. 5. Способ по п.4, о т л и ч а ю щийся тем, что в полученную охлажденную смесь добавляют 0,5-2,0 мас.% полимера с показателем а более, чем 0,6. 6. Способ по п.4 или п.5, о т л и ч а ю щ и й с я тем, что в смесь добавляют другие вспомогательные материалы в качестве эмульгирующих средств в количестве, чтобы суммарное содержание компонентов в композиции составляло 100 мас.%. 7. Способ лечения заболеваний, чувствительных к ингибированию моноаминоок С > оо О 26892 сидазы В, путем нанесения на поверхность кожи трансдермальной композиции, о т л и ч а ю щ и й с я тем, что на поверхность кожи наносят терапевтически эффективное ксшичество трансдермальной композиции, охарактеризованной в пункте 1, в форме 20-100-процентной безводной лиотропной жидкой кристаллической системы. Изобретение относится к трансдермальной безводной композиции в форме 20-100% лиотропной жидкой кристаллической системы, содержащий активный ингредиент и вспомогательные материалы. Известно, что некоторые из применяемых в терапевтических целях активные ингредиенты обладают рядом преимуществ при трансдермальном введении. В зависимости от скорости освобождения активного ингредиента из трансдермальной композиции можно на протяжении периода от 1 дня до 1 недели обеспечивать его постоянный уровень в крови и поступления в нее необходимого для лечения данного заболевания количества действующего.вещества. Из литературы известно также, что депренил - препарат, ингибирующий активность моноаминооксидазы В и повторное включение допамина можно с успехом использовать для замедления развития болезни Паркинсона у людей на ранних ее стадиях (Tetrug r.W. и Langston I.V.). Действие депренила (селегелина). Природа и развитие болезни Паркинсона, Science, 1989, 245, 514-522; Научная группа по болезни Паркинсона. Влияние депренила на развитие инвалидности на ранних стадиях болезни Паркинсона, II, Engl. J.Med.,1989, 321, 1364-1371). Препарат назначают также вместе с лекарственными средствами, в состав которых входит L-допа, на поздних стадиях болезни Паркинсона (Birkmayer, Депренил (селегелин) в лечении болезни Паркинсона, Acta Neurologica Seand., 1983, Sreppl., 95, 103106). Его применяют также при некоторых формах шизофрении (опубликованная заявка РСТ № 90/01298), а согласно результатам последних испытаний он может использоваться также при старческом склерозе мозга (Pierren. Tario Robert M. Coken, Trey Sunderland 1-депренил при старческом склерозе мозга, Arch. Gent. PsychJatry т.44, май 1987; P.N.Tarid, T.Sunderland. Влияние 1-депренила на запоминание при старческом склерозе мозга, Psychopharmacology, 1987, 91, 489495; Gian Luigi Piccini, Giancarlo Finali, mas simo Piccirilli, Йейрофизиологическое действие 1 -депренила при старческом склерозе мозга, Clinical Neuropharmacology т.13, № 2, стр.147-163; E.Martini, J.Pataki, K.Szilagyi, V.Ventor. Краткая информация об исследованиях ранней фазы II.Изучение депренила у больных, страдающих слабоумием. Pharmacopsychiatr, 20, 1987, 256-257). В описаниях к патентам США №№ 4868218 и 4861800, а также к патенту РСТ WO № 89/09051 говорится о возможности трансдермального введения депренила. Согласно этим описаниям любая известная, используемая на практике система для трансдермального введения лекарственных средств в жидком или твердом виде пригодна для введения тем же путем депренила. Изучая препараты, описанные в вышеуказанных литературных источниках, а также другие традиционно применяемые o/W эмульгирующие основы мазей, W/o эмульгирующие основы мазей и гидрогели, было обнаружено полное отсутствие абсорбции активного ингредиента либо его полную абсорбцию в течение нескольких часов. Была поставлена задача получить кожное средство, в котором бы обеспечивалось равномерное и в достаточных для лечения данного заболевания количествах освобождение активного ингредиента на протяжении по меньшей мере 24, а при благоприятных обстоятельствах и 72 часов. Известно также, что некоторые поверхностно активные соединения в случае трансдермального введения образуют жидкую кристаллическую систему с вог дой (например, декаэтилоксидолеиловый эфир или бридж 96). Полиэтиленоксидная цепь поверхностно-активного соединения, входящего в состав такого крема, и вода образуют непрерывное гидрофильное пространство, которое играет вполне определенную роль в диффузии активного ингредиента. 5 10 15 20 25 30 35 40 45 26892 Манипулируя соотношением поверхностно-активных соединений, можно изменять поведение жидкой кристаллической системы и, следовательно, скорость диффузии активного ингредиента (Журн. of Controlled Release, 13, 1990, 73-81). Совершенно неожиданно было обнаружено, что при выборе соответствующего соединения лиотропная жидкая кристаллическая система может формироваться даже в безводной среде. Изменяя содержание отдельных компонентов, можно регулировать размер частиц жидких кристаллов и структуру кристаллической части общей системы. Таким путем удается получать препараты для трансдермального введения, которые обеспечивают равномерное освобождение активного ингредиента на протяжении 24, 48 или 72 часов, в соответствии с потребностями терапии данного заболевания. Приведенные выше данные показывают, что изобретение относится к безводной композиции для трансдермального введения в составе 20-100%-ной лиотропной жидкой кристаллической системы: 1-30 весовых % оптически активного или рацемического Ы-метил-Ы-(1-фенил2-пропил)-2-пропиниламина (именуемого в дальнейшем депренил) или N-метил-П(4-фторофенил)-2-пропил]-2-пропиниламина, или их терапевтически приемлемых солей, 4 0 - 7 0 весовых % жидкого полиоксиэтилена, 10-20 весовых % твердого полиоксиэтилена, 2-30 весовых % неионного поверхностно-активного соединения, 2-20 весовых % пропиленгликоля (при необходимости) 0,5-2 весовых % полимера с показателем а. более 0,6, а также другие (в случае необходимости) вспомогательные материалы, которые добавляют до конечной величины 100 весовых процентов в качестве эмульгирующих агентов В качестве жидкого полиоксиэтилена в композицию вводят полиоксиэгилен 200-600, предпочтительно полиоксиэтилен 400, а в качестве твердого полиоксиэтилена добавляют полиоксиэтилен 1500-6000, предпочтительно полиоксиэтилен 4000. Неионными поверхностно-активными соединениями могут служить комплексы полиэтилена с жирными кислотами и эфирами, полиоксиэтилена с жирными кислотами и спиртами, полиоксиэтилена и касторового масла, сорбитана, жирных кислот и эфиров, предпочтительно комплексы полиоксиэтилена, жирных кислот и эфиров. Другими вспомогательными материалами, пригодными для этой цели, являют 5 10 15 20 25 30 35 40 45 50 55 ся полисахариды, которые могут выполнять функцию эмульгирующих агентов. Полимер должен иметь степень скрученности, характеризующуюся величиной а более 0,6 (например, полиоксиэтилен35.000). Степень скрученности, т.е. проникающая способность полимера, описывается экспонентой а в уравнении Кука, Марка и Хонвика, описывающего взаимосвязь между фронтальной вязкостью и молекулярной массой (см. Rohrsetzer S., Kolloid»ka, Tankonyvkiado, 1986; D.J.Shaw- Введение в коллоидную химию и химию поверхностей, Muszaki Ronyvkiado, 1986, на венгерском языке). Композиция согласно настоящему изобретению может быть получена следующим способом: жидкий полиоксиэтилен нагревают, добавляют в него расплавленный твердый полиоксиэтилен, а затем поверхностно-активное соединение и активный ингредиент, разведенные подогретым полиэтиленгликолем, с последующим охлаждением полученной смеси и введением в нее полимера и, в случае необходимости, других вспомогательных материалов. Используемый в композиции активный ингредиент можно получить согласно описаниям европейских патентов №№ 0186680 и 0099302 Описанную композицию для чрескожного введения применяют для обработки кожи в требуемых дозах, после которой обработанный участок закрывают, например пластырем. Из-за низких доз активного ингредиента (5-10 мг/день) не смогли провести прямое определение его концентрации в крови. Поэтому был использован непрямой биохимический метод, оценивая ингибирование моноаминоксидазной активности (МАО) в тканях мозга и печени, а оставшееся количество неабсорбированного активного ингредиента определяли с помощью высоко эффективной жидкостной хроматографии в материале, который задерживался на пластыре. Задача этих исследований состояла в определении параметров абсорбции трансдермальных композиций, отличающихся по своему составу. В качестве модельных животных использовали крыс и собак, кожу которых на подлежащих обработке участках освобождали от шерсти. О кинетике абсорбции судили по количеству оставшегося неабсорбированного активного ингредиента (с помощью высоко эффективной жидкостной хроматографии). Кро 26892 ме того оценивали ингибирующее действие абсорбированного в-мозговой и печеночной тканях активного ингредиента на моноаминооксидазную активность (МАО). Методы тестирования состояли в следующем. Активность МАО в мозге и печени крыс определяли радиометрическим методом Вуртмана и Аксельрода (Biochem. Pharmacol., 1963, 12, 1417). Остаточное количество активного ингредиента на пластыре после его удаления с кожи подопытных животных определяли с помощью высоко эффективной жидкостной хроматографии. Количественную оценку производили с использованием калибровочной кривой, полученной посредством тестирования действия различных дозировок мази. Результаты проведенного исследования (степень ингибирования активности моноаминооксидазы В), показывают, что активный ингредиент*, исчезавший из-под пластыря (данные высокоактивной жидкостной хроматографии) абсорбировался тканями крыс. Данные измерений приведены в табл. 1. Результаты определения скорости абсорбции показали, что кожа крыс мало пригодна для кинетических исследований, поскольку большинство тестировавшихся препаратов абсорбировались в пределах часа после нанесения. Более подходящей моделью является кожа собак. При использовании этой модели, определение остаточной активности с помощью высокоактивной жидкостной хроматографии, позволяло быстро оценивать абсорбцию активных ингредиентов мазей при ее невысокой скорости. Результаты такой оценки показаны в табл. 2. В дальнейших экспериментах определяли активность МАО-В в мозге и тромбоцитах домашних свиней. Эти эксперименты проводили на самках породы "Большая белая" весом 25-30 кг. Каждое животное помещали в отдельную клетку и кормили по одинаковой схеме тем же кормом, что и до начала эксперимента. Животным первой группы перорально вводили 10 мг (-)-депренила в желатиновых капсулах. Пробы крови для определения активности МАО-В брали непосредственно перед введением препарата, а также через 3, 6, 24, 48, 72 и 96 часов после него. Сразу после взятия последней пробы живогных забивали и определяли активность МАО-А и МАО-В в ткани мозга. Животные второй группы получали 10 мг (-)-депренила в составе препарата для чрескожного введения U g - Ш . Пробы крови брали непосредственно перед введе 5 10 15 20 25 30 35 40 45 50 55 8 нием и спустя 3, 6, 24 и 48 часов после него. Нанесенный на кожу препарат удаляли по истечении 24 часов. Остаточное его содержание определяли посредством анализа материала с пластыря и его нейлоновой оболочки. Анализу с помощью высокоактивной жидкостной хроматографии подвергали также материал с пропитанных этанолом ватных тампонов, которыми протирали кожу. Животных забивали через 48 часов после нанесения мази и определяли активность МАО-А и МАОВ в ткани мозга. Кожу свиней третьей группы обрабатывали мазью Ug-167, которая содержала 20 мг (-)-депренила. Пробы крови брали непосредственно перед нанесением мази, спустя 3, 6, 24, 48 и 72 часа после ее нанесения. Пластырь удаляли через 48 часов. Остальные процедуры не отличались от описанных для второй группы подопытных животных. Пробы крови брали из V.cava cranialis с помощью пластмассового шприца на 20 мл с 1,5 мл 7,7%-ного раствора лимоннокислого натрия. Объем всех проб составлял 18,5 мл. Активность МАО измеряли радиометрическим методом, как описано Вуртманом и Аксельродом (Biochem.Pharmaicol., 12, 1414-1419, 1963), с небольшими изменениями (см. K.Magyar в: "Моноаминоксидазы и их избирательные ингибиторы" под ред. K.Magyar, Pergamon Press, Akademiai Kiado, Будапешт, стр.11-21, 1980). Для определения активности МАО в тромбоцитах использовали методику, предложенную Уилбергом и Ореландом (Med.Biol., 54, 137-144, 1976). Результаты ингибирования активности МАО-В тромбоцитах после перорального и трансдермального применения препарата представлены в табл. 3. Результаты определения активности МАО в мозге представлены на табл.4. В табл.5 представлены результаты изучения трансдермальной абсорбции депренила. Состав, размер частиц, процентное содержание жидкого кристаллического компонента в различных препаратах иллюстрируется следующими примерами: Uq-85 Полиоксиэтиленгликоль (ПЭГ) 4000 60,0 г ПЭГ-200 tOO.Or Пропиленгликоль . 30,0 г Депренил 3,0 г ПЭГ-400 ad 100,0 г 10 26892 Средний размер частиц: 72,7 микрона, жидкий кристаллический компонент 20%. Ug-111 ПЭГ-4000 '16,0 г ПЭГ-400 60,0 г Пропиленгликоль 8,0 г Кремофор ЕЛ 2,0 г Депренил 5,0 г ПЭГ-400 ad 100,0 г Средний размер частиц: 72,7 микрона, жидкий кристаллический компонент 20%. Ua-118 ПЭГ-4000 16,0 г ПЭГ-400 60,0 г Пропиленгликоль . 8,0 г Кремофор ЕЛ 2,0 г Депренил 5,0 г Миритол 318 3,0 г ПЭГ-400 ad 100,0 г Средний размер частиц: 36,4 микрона, жидкий кристаллический компонент: 50%. Ug-110 ПЭГ-4000 15,0 г ПЭГ-400 60,0 г Пропиленгликоль , « 10,0 г 5 10 15 20 25 Депренил 5,0 г Кремофор ЕЛ 5,0 г ПЭГ-400 ad 5,0 г Ug-167 19,0 г ПЭГ-4000 55,0 г ПЭГ-400 Пропиленгликоль 8,0 г Ксантановая смола ю,0 г Депренил 5,0 г ПЭГ-400 ad 100,0 г Средний размер частиц: 91-109 микрон, жидкий кристаллический компонент: 70-80%. Ua-325 ПЭГ 35.000 . 1,0 г ПЭГ-4000 15,0 г ПЭГ-400 53,5 г Пропиленгликоль 4,5 г Ксантановая смола 15,0 г Депренил 5,0 г Кремофор ЕЛ 6,0 г Жидкий кристаллический компонент: 100%. Состав вспомогательных материалов: Кремофор ЕД - глицерин-полизтиленгликоль-рацинолеат Миритол 318 - триглицерид Ксантановая смола - полисахарид. Т а б л и ц а 1 Влияние депренила (1 мг/кг подкожно) и содержащей его мази С85 на пластыре (3 мг/кг) на активность МАО-В (%) в сопоставлении с контролем. Определения проводили в безъядерной фракции гомогенатов мозговой и печеночной тканей, используя в качестве субстрата 14dC-ct>3A. ±S.D. (9 животных)* Сроки 0' 5' мин 15 мин 30 мин 45 мин 1 час 2 часа 4 часа 6 часов 24 часа 48 часов 72 часа 96 часов 7 дней 9 дней 11 дней 14 дней Мозг Печень пк / пластырь 0 79.02+1.58 87.09+2.05 86.74+3.00 83.04±1.46 89.36+2.60 73.59±1.77 76.99+3.38 69.19±3.58 32.20±5.45 13.56±1.97 0.63±0.95 0 0 9.6+6.86 45.07±13.72 60.60+3.84 66.9U1.88 73.09±5.05 53.22±3.42 55.30+2.96 41.49+3.50 80.50±3.24 72.05±2.54 76.56±1.13 56.00+2.37 32.15+12.49 18.16+5.22 14.88±2.92 0 п/к 0 63.23±11.98 74.94+1.10 57.63+5.23 67.86±9.22 86.04±7.81 64.34±8.11 68.54±5.25 54.75±11.58 56.44±7.59 44.26±3.45 26.27±15.77 24.22±3.13 пластырь 0 0 14.23+20.80 12.80±15.25 45.10+10.48 58.93±19.08 69.63+6.94 52.80+9.29 57.06±4.68 80.19+3.74 86.65±2.26 79.09+2.59 65.59±7.04 55.33± 11.69 47.66±5.43 39.18+4.34 0 *По 3 параллельных измерения на 3 животных в каждый из указанных сроков. 11 12 26892 Т а б л и ц а Чрескожная абсорбция депренила у собак Бигл Продолжительность эксперимента, ч ivia3b Остаточный депренил % ±S.D. 9 6±1.5 34.9+15.3 ' 1.7±2.2 13.4±6.6 75.7±6.8 40.6±4.9 58.5±4.1 28.3±12.1 8.4±2.4 24 24 24 24 4 24 24 48 72 85 100 111 118 167* 167* 325 325 325 Т а б л и ц а Влияние (-)-депренила на активность МАО-В в тромбоцитах (%) в сопоставлении с контролем, определения проводили с использованием в качестве субстрата и сЮ-ФЭА. ±S.D. (n=3) Сроки Способ применения 3 6 24 48 72 Перорально, 10 мг 97.77 92.52 0.0 86.04 96.51 95.63 100.00 100.00 100.00 82.67 70.48 69.93 72.32 65.63 50.17 95.15 92.73±3.35 100±0.0 74.36±4.16 52.71+6.56 Ug-111, чрескожно, 10 мг, 24 часа 0.0 54.80 95.66 36.27 86.47 95.47 52.68 86.02 93.76 60.70 92.03 98.63 75.23 72.74±18.42 77.49±12.6 83.79±11.7 Ug-167, чрескожно, 20 мг, 48 часов 23.29 72.11 65.81 55.77 95,90 65.05 90.94 98.54 0.0 88.56 91.44 90.57 100.00 89.34 75.02 53.74±15.33 72.24±12.13 94.74 90.19±0.85 88.12±7.24 2 14 26892 13 Т а б л и ц а Ингибирующее действие (-)-депренила на активность МАО (%) в сопоставлении с контролем. Определения проводили в безъядерной фракции гомогенатов мозга домашних свиней, используя в качестве субстрата Н С-ФЭА и 14С-5-окситриптамин. ±S.D. (n=3) 4 Мозг Способ применения и Перорально, 96 часов Ug-111, чрескожно (24 часа) 48 часов Ug-167, чрескожно (48 часов) 72 часа С-ФЭА 14 С-ОТ 73,22±8,13 20,14±6,0 56,31±10,03 16,39±8,77 86,76±6,67 18,50±3,81 Т а б л и ц а Трансдермальная абсорбция депренила у домашних свиней в сопоставлении с контролем Препарат Продолжительность эксперимента, ч Остаточное количество депренила (%±S.D.) Ug-111 Ug-167 Ug-167 24 24 24 5 14,2*5,5 36,5+9,3 6.U5.1 Упорядник Техред М. Келемеш Замовлення 538 Тираж Коректор М. Самборськг» Підписне Державне патентне відомство України, 254655, ГСП, Київ-53, Львівська пл., 8 Відкрите акціонерне товариство "Патент", м. Ужгород, вул. Гагаріна, 101
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 9/127, A61K 9/70, A61K 9/06, A61P 17/00, A61K 47/10, A61K 31/135, A61K 47/34
Мітки: одержання, моноамінооксидази, чутливих, захворювань, трансдермальна, інгібування, спосіб, лікування, композиція
Код посилання
<a href="https://ua.patents.su/8-26892-transdermalna-kompoziciya-sposib-oderzhannya-sposib-likuvannya-zakhvoryuvan-chutlivikh-do-ingibuvannya-monoaminooksidazi-v.html" target="_blank" rel="follow" title="База патентів України">Трансдермальна композиція, спосіб її одержання, спосіб лікування захворювань, чутливих до інгібування моноамінооксидази в</a>
Попередній патент: (s)-енантіомер або рацемат похідної 2-хлор-5-(2-хлор-4-трифторметилфенокси)бензоату, що має гербіцидну активність
Наступний патент: Спосіб одержання кристалічних цеолітних алюмосилікатів з мольним відношенням sio2/al2o3 не менше 20
Випадковий патент: Пристрій для вимірювання параметрів змінних магнітних полів