Кристалічна форма (-)-цис-4-аміно-1-(2-гідроксиметил-1,3-оксатіолан-5-іл)-(1н)-піримідин-2-ону (варіанти), способи її отримання та фармацевтична композиція
Номер патенту: 41265
Опубліковано: 17.09.2001
Автори: ЕВАНС Пол, РОБЕРТС Тоні Гордон, РАВЕНСКРОФТ Пол
Формула / Реферат
1. Кристаллическая форма (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде бипирамидальных кристаллов, имеющих точку плавления выше 170 °С и полосы поглощения в ИК-спектре при значениях 920 и 850 волновых чисел.
2. Кристаллическая форма по п. 1, имеющая точку плавления 177-178 °С.
3. Кристаллическая форма по любому из пп. 1-2, практически свободная от кристаллической формы, имеющей полосу поглощения в ИК-спектре при значении, примерно, 1100 волнового числа.
4. Кристаллическая форма (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде бипирамидальных кристаллов, имеющих полосы поглощения в ИК-спектре .при значениях 920 и 850 волновых чисел и эндотерму при начальной температуре 177-178 °С на ее кривой дифференциальной сканирующей калориметрии.
5. Кристаллическая форма (-)-Цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде игловидных кристаллов, имеющих точку плавления ниже 130° С и полосу поглощения в ИК-спектре при значении, примерно, 1110 волнового числа.
6. Кристаллическая форма по п. 5, имеющая точку плавления 124-127 °С.
7. Кристаллическая форма по любому из пп. 5-6, имеющая эндотерму с начальной температурой 124-127 °С на ее кривой дифференциальной сканирующей калориметрии.
8. Способ получения кристаллической формы (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде игловидных кристаллов, отличающийся тем, что (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)-пиримидин-2-он суспендируют в водном растворе, нагревают до 45 °С с получением раствора, которому дают охладиться так, чтобы соединение, определенное в любом из пп. 5-7, образовалось путем кристаллизации.
9. Способ получения кристаллической формы (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде игловидных кристаллов, отличающийся тем, что проводят азеотропную перегонку водного раствора этого соединения с пропан-1-олом.
10. Способ получения кристаллической формы (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде бипирамидальных кристаллов, отличающийся тем, что проводят перекристаллизацию из неводной среды, причем неводной средой является С2-С8-спирт.
11. Способ по п. 10, отличающийся тем, что в качестве неводной среды используют этанол или промышленный этанол, денатурированный метиловым спиртом.
12. Способ получения кристаллической формы (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде бипирамидальных кристаллов, отличающийся тем, что проводят старение (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в форме игловидных кристаллов в этаноле или промышленном этаноле, денатурированном метиловьм спиртом, при повышенной температуре.
13. Фармацевтическая композиция для лечения вирусных инфекций, содержащая активный компонент и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного компонента содержит (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он в кристаллической форме по любому из пп. 1-7 в эффективном количестве.
14. Фармацевтическая композиция по п. 13 в форме, пригодной для орального применения.
15. Фармацевтическая композиция по любому из пп. 13-14 в форме таблеток или капсул.
Текст
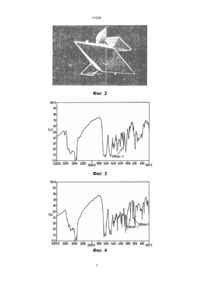
1. Кристаллическая форма (-)-цис-4-амино-1(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде бипирамидальных кристаллов, имеющих точку плавления выше 170°С и полосы поглощения в ИК-спектре при значениях 920 и 850 волновых чисел. 2. Кристаллическая форма по п. 1, имеющая точку плавления 177-178°С. 3. Кристаллическая форма по любому из пп. 1-2, практически свободная от кристаллической формы, имеющей полосу поглощения в ИК-спектре при значении, примерно, 1100 волнового числа. 4. Кристаллическая форма (-)-цис-4-амино-1-(2гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде бипирамидальных кристаллов, имеющих полосы поглощения в ИК-спектре при значениях 920 и 850 волновых чисел и эндотерму при начальной температуре 177-178°С на ее кривой дифференциальной сканирующей калориметрии. 5. Кристаллическая форма (-)-цис-4-амино-1-(2гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она в виде игловидных кристаллов, имеющи х точку плавления ниже 130°С и полосу поглощения в ИК-спектре при значении, примерно, 1110 волнового числа. 6. Кристаллическая форма по п. 5, имеющая точку плавления 124-127°С. 7. Кристаллическая форма по любому из пп. 5-6, имеющая эндотерму с начальной температурой 124-127°С на ее кривой дифференциальной сканирующей калориметрии. 8. Способ получения кристаллической формы (-)цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5 C2 (54) КРИСТАЛІЧНА ФОРМА (-)-ЦИС-4-АМІНО-1-(2-ГІДРОКСИМЕТИЛ-1,3-ОКСАТІОЛАН-5-ІЛ)-(1Н)-ПІРИМІДИН-2-ОНУ (ВАРІАНТИ), СПОСОБИ ЇЇ ОТРИМАННЯ ТА ФАРМАЦ ЕВТИЧНА КОМПОЗИЦІЯ 41265 Настоящее изобретение относится к аналогам нуклеозидов и их применению в медицине. Более конкретно изобретение относится к нуклеозидным аналогам 1,3-оксатиолана и к их применению для лечения вирусных инфекций. Соединение формулы (I) (-)-Энантиомер имеет химическое название (-)цис-4-амино-1-(2-оксиметил-1,3-оксатиолан-5-ил)(1Н)-пиримидин-2-он. Он имеет абсолютную стереохимию соединения формулы (I-1), которое имеет название (2R, цис)-4-амино-1-(2-оксиметил-1,3оксатиолан-5-ил)-(1Н)-пиримидин-2-он. Это соединение теперь известно как ЗТС. Предпочтительно ЗТС должен быть практически свободным от соответствующего (+)энантиомера, т.е. присутствует не более примерно 5% масс./масс. (+)-энантиомора, предпочтительно не более примерно 2%, в частности менее примерно 1% масс./масс. В международной заявке PCT/GB91/00706, публикация № WO 91/17159, описано получение ЗТС, это антивирусная активность и его применение в медицине. ЗТС описан и получен в WO 91/17153 в виде лиофильно высушенного порошка. Теперь мы нашли, что ЗСТ может быть получен в кристаллической форме и проявляет полиморфизм. Таким образом, в первом аспекте изобретение обеспечивает ЗТС в кристаллической форме. При кристаллизации из водного раствора ЗТС получают в форме кристаллов в виде игл (здесь далее форма 1). В этой форме кристаллы не являются удобными для фармацевтической рецептуры в твердых дозированных формах из-за их физических свойств, например, плохих характеристик текучести. Теперь мы обнаружили, что в определенных усло виях ЗТС может быть получен в виде практически бипирамидальных кристаллов (здесь далее форма II). Кристаллы в виде формы II обладают улучшенными характеристиками текучести и, следовательно, являются предпочтительными при производстве твердых дозированных форм. Кроме того, кристаллы формы I являются менее стабильными полиморфными формами и некоторые операции на фармацевтической установке, такие как измельчение, могут вызвать превращение формы І в форму II, нежелательная характеристика для производства твердых дозированных форм. ЗТС в виде бипирамидальных кристаллов имеет точку плавления выше примерно 170°С, в частности 177-178°С, когда чистое. ЗТС в виде иглоподобных кристаллов имеет точку плавления ниже примерно 124-127°С в чистом виде. ЗТС в форме II имеет характеристические полосы поглощения в инфракрасном (ИК) спектре, которые отсутствуют в ИК-спектре формы І. В частности форма II имеет сильные полосы поглощения при ~92°С и ~85°С волновых числах. Далее характеристическая полоса формы I при 1110 волновых числах отсутствует в спектре формы II. Форма II ЗТС кроме того показывает характеристическую эндотерму с началом при температуре 177-178°С на ее кривой дифференциальной сканирующей калориметрии (ДСК). Напротив, форма I показывает характеристическую эндотерму на кривой ее ДКС с началом при температуре 124-127°С. NH 2 N O N O HOCH 2 S , известно как ВСН-189 или NGPB-21 и было описано как обладающее противовирусной активностью, в частности против вирусов человеческого иммунодефицита (ВИЧ), причинных агентов СПИДа (5-я Противоспидовая конференция,Монреаль, Канада, 5-9 июня 1983 г.; Abstracts T.C.O.I и М.С.Р. 63; публикация европейской заявки на патент № 0382562). Соединение формулы (I) является рацемической смесью двух энантиомеров формул (I-1) и (I-2): NH 2 N O N (І-1), O HOCH 2 S NH 2 N O HOCH 2 N (І-2), O S и было описано и испытано в форме рацемата. Единственным соединением, одобренным в настоящее время для лечения состояний, вызываемых ВИЧ, является 3'-азидо-3'-деокситимидин (AZT, зидовудин BW 509U). Однако это соединение имеет значительную склонность к побочным эффектам и, следовательно, или не может быть выведено у значительного числа пациентов. В результате сохраняется потребность в создании соединений, которые являются эффективными против ВИЧ, но - имеющих значительно лучший терапевтический показатель. Хотя энантиомеры соединения формулы (I) являются равно мощными против ВИЧ, (-)-энантиомер обладает значительно меньшей цитотоксичностью, чем другой энантиомер, и, следовательно является предпочтительным соединением как антивирусный агент. 2 41265 Следовательно, в другом аспекте настоящего изобретения обеспечивается ЗТС в форме игловидных кристаллов. В другом аспекте обеспечивается ЗТС в виде бипирамидальных кристаллов. В еще одном аспекте изобретения обеспечивается ЗТС в кристаллической форме и имеющий точку плавления выше 170°С, в частности 177178°С. В альтернативном аспекте обеспечивается ЗТС в кристаллической форме и имеющий на его кривой ДСК эндотерму с началом при температуре 177-178°С. В еще одном аспекте обеспечивается ЗТС в кристаллической форме и имеющий полосы поглощения при волновых числах примерно 920 и примерно 850 в его ИК-спектре. В частности обеспечивается ЗТС, у которого в дополнение к полосам поглощения при этих волновых числа х практически отсутствует полоса при волновых числах 1110. ЗТС может быть получен из его рацемата путем разделения по любому способу, известному на данном уровне техники для разделения рацематов на составляющие их энантиомеры. В частности ЗТС может быть получен из известного рацемата с помощью хиральной ВЭЖХ, с помощью энантиоселективного катаболизма, медиировауного ферментом, при использовании подходящего фермента, такого как цитидиндеаминаза, или с помощью селективного ферментативного разложения подходящего производного с использованием 5'-нуклеотида. Подходящие способы получения ЗТС описаны в WO 91/17159. ЗТС в виде игловидных кристаллов может быть получен при кристаллизации соединения из водного раствора или путем азеотропной перегонки с пропан-1-олом. ЗТС в форме предпочтительных бипирамидальньх кристаллов может быть получен путем перекристаллизации из неводной среды, в частности низшего (С2-6) спирта, например, этанола, ИМС (промышленного этилового спирта, денатурированного метиловым спиртом) или пропан-1ола. В предпочтительном варианте ЗТС в бипирамидальной форме может быть получен из ЗТС в виде игл путем старения последнего в промышленном этиловом спирте, денатурированном метиловым спиртом (ИМС), или этаноле при повышенной температуре (30-70°С, предпочтительно около 50°С) в течение подходящего периода времени (например, 0,5-3 часа, особенно около 1 часа или более). Альтернативно ЗТС в бипирамидальной форме может быть получен при нагревании соединения в форме игл при температуре выше точки его плавления 124-127°С, в частности выше примерно 170°С, например, выше примерно 177-178°С, и предоставлении расплаву возможности остыть. При другой альтернативе ЗТС в бипирамидальной форме может быть получен при дроблении или растирании соединения в форме игловидных кристаллов. Предпочтительно ЗТС в форме бипирамидальных кристаллов практически не содержит игловидных кристаллов. Когда эти кристаллы получают перекристаллизацией или старением в жидкой среде, соединение обычно может быть полу чено полностью свободным от игловидных кристаллов. ЗТС в кристаллической форме может быть использован в качестве противовирусного агента, как описано в WO 91/17159, которая приведена здесь в качестве уровня те хники. ЗТС в кристаллической форме может быть сформулирован в виде фармацевтической композиции для использования в качестве противовирусного агента, как описано в WO 91/17153. На фиг. 1 показан ЭТС в виде игловидных кристаллов (форма I). На фиг. 2 показан ЗТС в виде кристаллов бипирамидальной формы (форма II). На фиг. 3 приведен ИК-спектр кристаллов формы I. На фиг. 4 приведен ИК-спектр формы II. На фиг. 5 приведена ДСК термограмма кристаллов формы I. На фиг. 6 приведена ДСК термограмма кристаллов формы II. Следующие примеры иллюстрируют изобретение, но не предназначены для его ограничения. Все температуры приведены в °С. Промежуточный продукт 1 5-метокси-1,3-оксатиолан-2-метанол, бензоат. Раствор 1,6 г хлорида цинка в 15 мл горячего метанола прибавляют при перемешивании к раствору 34,2 г диметилацеталя меркаптоацетальдегида и 48,3 г бензоилоксиацатальдегида в 1300 мл толуола, который затем кипятят с обратным холодильником в атмосфере азота в течение 50 минут. Концентрируют охлажденную смесь, разбавляют толуолом, затем фильтруют через кизельгур. Объединенные фильтраты и толуол промывают два раза водным насыщенным раствором бикарбоната натрия и рассолом, сушат над сульфатом магния, затем выпаривают до масла, которое подвергают хроматографии на колонке с силикагелем (2 кг, Мерк 9385), элюируя хлороформом, получают целевой продукт в виде масла (45,1 г) из смеси аноморев (примерно 1:1): 1 H-ЯМР (ДМСО-d6) d 3,1-3,3 (4Н), 3,42 (6Н), 4,4-4,6 (4Н), 5,41 (1Н), 5,46 (1Н), 5,54 (1Н), 5,63 (1Н), 7,46 (4Н), 7,58 (2Н), 8,07 (4Н); l макс. (СНВr3) 1717,6 см -1. Промежуточный продукт 2 (±)-цис-1-(2-бензоилоксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2,4-дион. Кипятят с обратным холодильником смесь тонко измельченных 9,62 г урацила, 50 мл гексаметилдисилазана и 30 мг сульфата аммония в атмосфере азота до тех пор, пока не получат прозрачный раствор. Его охлаждают и затем выпаривают до бесцветного масла, которое растворяют в атмосфере азота в 100 мл ацетонитрила. Раствор прибавляют к перемешиваемому охлажденному льдом раствору, 19,43 г 5-метокси-1,3-оксатиола2-метанола, бензоата (промежуточного продукта 1) в 600 мл ацетонитрила и прибавляют 14,7 мл триметилсилилтрифторметансульфоната. Убирают баню со льдом и раствор кипятят с обратным холодильником в атмосфере азота в течение 45 минут. После охлаждения и выпаривания остаток очищают хроматографией на колонке с 1 кг силикагеля (Мерк 9385), элюируя хлороформом/метанолом 9:1. Соответствующие фракции охла 3 41265 ждают и выпаривают, получают сырой остаток. Его подвергают фракционной кристаллизации из минимального количества горячего метанола (примерно 1200 мл), получают 6,32 г целевого продукта в виде белых кристаллов. 1 Н-ЯМР (ДМСО-d6) d 11,36 (1Н, шир.с), 7,508,000 (6Н, м), 6,20 (1Н, т), 5,46 (2Н, м), 4,62 (2Н, м), 3,48 (1Н, м), 3,25 (1Н, м). Промежуточный продукт 3 (±)-(цис)-4-амино-1-(2-бензоилоксиметил-1,3оксатиолан-5-ил)-(1Н)-пиримидин-2-он. Способ (а) Перемешивают суспензию 20,705 г цитозина и нескольких миллиграмм сульфата аммония в 110 мл гексаметилдисилазана и кипятят с обратным холодильником 2,5 часа в атмосфере азота. Удаляют растворитель выпариванием и растворяют твердый остаток в 350 мл сухого ацетонитрила. Этот раствор переносят, используя технику гибкой иглы, в перемешиваемый, охлаждаемый льдом раствор 43,57 г 5-метокси-1,3-оксатиолан-2-метанола, бензоата (промежуточного продукта 1) в 650 мл ацетонитрила в атмосфере азота. Прибавляют 33 мл триметилсилилтрифторметансульфоната, раствору дают нагреться до комнатной температуры (1,5 часа), а затем всю ночь кипятят с обратным холодильником. Оставшуюся смесь концентрируют, разбавляют 500 мл насыщенного водного раствора бикарбоната натрия, затем экстрагируют 3 ´ 500 мл этилацетата. Объединенные экстракты промывают 2 ´ 250 мл воды и 250 мл рассола, сушат над сульфатом магния, затем выпаривают, до пены, которую хроматографируют на колонке с 600 г силикагеля (Мерк 7734), элюируя смесями этилацетат-метанола, получают смесь аномеров (примерно 1:1 31,59 г). Смесь кристаллизуют из 45 мл воды и 3,0 мл этанола, получают 10,23 г твердого продукта, который перекристаллизовывают из 120 мл этанола и 30 мл воды, получают целевой продукт в виде 9,26 г твердого продукта; l макс, (МеОН) 229,4 мм (Е1% 610) 272,4 мм (Е1% 1 см 1 см 293): 1 H-ЯМР (ДМСО-d6) d 3,14 (1Н), 3,50 (1Н), 4,07 (2Н), 5,52 (1Н), 5,66 (1Н), 6,28 (1Н), 7,22 (2Н), 7,56 (2Н), 7,72 (2Н), 8,10 (2Н). Способ (б) Прибавляют 7,0 мл оксихлорида фосфора по каплям к перемешиваемой при охлаждении льдом суспензии 11,65 г 1,2,4-триазола в 120 мл ацетонитрила, затем прибавляют по каплям 22,7 мл триэтиламина, поддерживая внутреннюю температур у ниже 15°С. Через 10 минут медленно прибавляют раствор 6,27 г (±)-(цис)-1-(2-бензоилоксимети-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2,4-диона (промежуточного продукта 2) в 330 мл ацетонитрила. Затем продолжают всю ночь перемешивать при комнатной температуре. Смесь охлаждают на ледяной бане и медленно прибавляют 30 мл триэтиламина, затем 21 мл воды. Полученный раствор выпаривают и распределяют остаток между 400 мл насыщенного раствора бикарбоната натрия и 3 ´ 200 мл хлороформа. Объединенные хлороформные экстракты сушат над сульфатом магния, фильтруют и выпаривают, получают 9,7 г сырого остатка. Остаток растворяют в 240 мл диоксана-1,4 и прибавляют концентрированный водный раствор аммиака (уд. вес 0,880, 50 мл). Через 1,5 часа раствор выпаривают и растворяют остаток в метаноле. Это вызывает осаждение твердого продукта, который отфильтровывают. Маточник очищают хроматографией на колонке с силикагелем (600 г Мерк 9385). Соответствующие фракции объединяют и выпаривают, получают целевое соединение в виде 2,18 г желтовато-коричнового твердого продукта, идентичного полученному в способе (а). Промежуточный продукт 4 (±)-(цис)-4-амино-1-(2-оксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он. Перемешивают суспензию 8,19 г (цис)-4-амино-1-(2-бензоилксиметил-1,3-оксатиолан-5-ил)(1Н)-пиримидин-2-она (промежуточный продукт 3) и 8,24 г смолы Амберлит ИРА-400(ОН) в 250 мл метанола и, кипятят с обратным холодильником 1,25 часа. Отфильтровывают твердые продукты, затем промывают метанолом. Объединенные фильтраты выпаривают. Остаток тщательно растирают с 80 мл этилацетата. Полученный твердый продукт собирают фильтрованием, получают 5,09 г целевого продукта: 1 Н-ЯМР (ДМСО-d6) d 3,04 (1Н), 3,40 (1Н), 3,73 (2Н), 5,18 (1Н), 5,29 (1Н), 5,73 (1Н), 6,21 (1Н), 7,19 (2Н), 7,18 (1Н). Промежуточный продукт 5 (-)-цис-4-амино-1-(2-оксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он. (і) Три колбы емкостью 50 мл с питательным бульоном (Оксоид Лтд) инокулируют петлей каждый из Escherichia coli (ATCC 23848), соскобленной с Питательной Агаровой пластины. Колбы инкубируют в течение ночи при 37°С при встряхивании при 250 об/мин, а затем каждую колбу используют для инокуляции 41 СДД среды (глютаминовая кислота, 3 г/л; МgSO 4, 0,2 г/л; K2SO 4, 2,5 г/л; NaCI, 2,3 г/л; Na2HPO4, 2Н2О, г/л; NaH 2PO4, 2H2O, 0,6 г/л; цитидин, 1,2 г/л) в семилитровом ферментере. Культуры ферментируют при 750 об/мин. 37°С и аэрации 41 мин. После роста в течение 24 часов клетки собирают центрифугированием (5000 g, 30 минут), получают 72 г влажной массы. Слой клеток повторно суспендируют в 300 мл 20 мМ Трис HCI буфера (рН 7,5) и разрушают с помощью ультразвука (4 ´ 45 секунд). Клеточный дебрис удаляют центрифугированием (30000 g, 30 минут) и осаждают белок в надосадочной жидкости, добавляя сульфат аммония до концентрации 75%. Осадок собирают центрифугированием (30000 g, 30 минут) шарик повторно суспендируют в 25 мл HEPES буфера (100 мМ, рН 7,0), содержащего сульфат аммония (насыщение 75%). Готовят раствор фермента центрифугируя в течение 30 минут при 12000 об/мин. Надосадочную жидкость отбрасывают и слой растворяют в Трис HCI буфере (рН 7,0:100 мМ) до первоначального объема. (ii) Растворяют 115 мг промежуточного продукта 4 в 100 мл воды и перемешивают. Прибавляют 0,5 мл раствора фермента и смесь выдерживают при постоянном рН с помощью непрерывного добавления HCI (25 мМ). Конверсию контролируют с помощью хиральной ВЭЖХ, которая показывает, что (+)-энантиомер субстрата предпочтительно деаминирован. Через 22 часа (+)-энантиомор субстрата (время удерживания 12,5 мин) был полно 4 41265 стью удален, рН раствора доводят до 10,5 путем добавления конц. гидроксида натрия. Полученный выше раствор элюируют через колонку с QAE Сефадекс (А25; Фармасиа; 301 1,6 см), предварительно откалиброваную при рН 11. Колонку промывают 200 мл воды, а затем 0,1 М HCI. Собирают фракции по 40 мл и анализируют ВЭЖХ с обратной фазой. Объединяют фракции 513, содержащие (-)-энантиомер субстрата и устанавливают рН 7,5 с помощью HCI. Устанавливают рН фракции 47, содержащую деаминированный продукт, доводя рН до 7,5 с помощью разбавленного гидроксида натрия. Анализ с помощью хиральной ВЭЖХ показал, что этот материал представляет собой смесь, состоящую из одного энантиомера (время удерживания 10,2 мин.) в качестве основного компонента с другим энантиомером (время удерживания 8,5 мин.) в качество незначительного компонента (например, примерно 90%). (iii) Повторяют описанную выше стадию (іі) в большом масштабе. Инкубируют 363 мг соединения примера 1 в 250 мл воды с 0,5 мл раствора фермента, приготовленного, как на стадии (і). Добавляют, дополнительные аликвоты 0,5 мл фермента через 18 и 47 часов. Реакционную смесь перемешивают 70 часов, затем оставляют стоять еще 64 часа. Анализ с помощью хиральной ВЭЖХ показывает, что (+)-энантиомер субстрата полностью деаминирован, и доводят рН полученного раствора до 10,5 с помощью гидроксида натрия. Описанный выше раствор загружают в такую же QAE колонку и злюируют, как на стадии (і). Объединяют фракции 2-6, содержащие смесь остаточного субстрата и деаминированного продукта. Фракции 7-13, содержащие остаточный субстрат ((-)энантиомер), объединяют и доводят рН до 7,5. Фракции 25-26, содержащие деаминированный продукт, объединяют и нейтрализуют. Фракции 2-6 выше повторно элюируют через такую же QAE колонку. Фракции 3-11 из этой второй колонки содержат непрореагировавший субстрат ((-)энантиомер). Фракция 70 содержит деаминированный продукт. (iv) Объединяют фракции разделенного субстрата со стадии (іі) и (iii) и доводят рН до 7,5. Этот раствор элюируют через колонку ХАД-16 (40 ´ 2,4 см), залитую водой. Колонку промывают водой, а затем элюируют ацетоном: водой (1:4 объем/объем). Объединяют фракции, содержащие целевой (-)-энантиомер и сушат с вымораживанием, получают 190 мг белого порошка. Использованные выше методы ВЭЖХ являются следующими: 1. Аналитическая ВЭЖХ с обратимой фазой: Колонка: Основной патрон - Сферисорб ODS (5 uM) 150 ´ 4,6 мм. Элюент: дигидрофосфат аммония (50 мМ)+5% MeCN. Скорость потока: 1,5 мл/мин. Детекция: УФ, 270 нм. Времена удерживания: ВСН 189 5,5 мин, диаминированньй ВСН 189 8,1 мин. 2. Хиральная аналитическая ВЭЖХ: Колонка: Циклобонд I ацетил - 250 ´ 4,6 мм. Элюент: 0,2% триэтиламмонийацетат (рН 7,2). Скорость потока: 1,0 мл/мин. Детекция: УФ, 270 нм. Времена удерживания: ВСН 189 11,0 и 12,5 мин. деаминированный ВСН 189 8,5 и 10,2 мин. (Биопревращение затем контролировалось по потере пика при 12,5 мин и накоплении продукта при 10,2 мин.) Пример 1 Суспензию 64,8 г промежуточного продукта 5 в 200 мл воды нагревают до 45°С для получения раствора. Раствор охлаждают до 30°С. Продукт кристаллизуется в виде не перемешиваемой массы. Его разбивают и перемешивают суспензию при примерно 10°С в течение 1 часа. Продукт выделяют фильтрацией и промывают этанолом (ИМС, 2 ´ 30 мл, затем сушат в вакууме при 45°С в течение 24 часов, получают ЗТС в виде формы I (тонкие игловидные кристаллы). Соединение имеет ИК-спектр и ДСК термограмму, идентичные фиг. 3 и 5 соответственно. Пример 2 Суспензию 10,0 г соединения примера 1 в промышленном этаноле, денатурированном метиловым спиртом (ИМС, 200 мл, 20 объемов) кипятят с обратным холодильником для получения прозрачного раствора. Раствор фильтруют горячим и фильтрат разгоняют при атмосферном давлении до тех пор, пока не останется 100 мл (10 объемов) раствора. Раствор засевают аутентичным материалом 2 и дают ему остыть от 80° до 25°С в течение 1 часа. Кристаллизация начинается при 79°С. Суспензию перемешивают 1 час при 15°С. Продукт выделяют фильтрацией и промывают ИМС (IG мл, 1 объем). Сушка в вакууме при 50° дает целевое соединение в виде агрегатов бипирамид (8,42 г), т.пл. 179-181°С (-)-цис-4-амино-1-(2-оксиметил-2,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-она. В анализе найдено: С 41,9; Н 4,85; N 18,35. Для С 8Н11N3О 3S требуется: С 41,9; Н 4,8; N 18,3%. Соединение имеет ИК-спектр и ДСК термограмму, идентичные фиг. 4 и 6 соответственно. Пример 3 Медленно перемешивают суспензию 20,0 г продукта примера 1 в 100 мл (5 объемах) промышленного этанола, денатурированного метиловым спиртом (ИМС), при 50° в течение 1 часа. Удаляют маленький образец (примерно 100 мг), сушат в вакууме при 50°С и исследуют под микроскопом и с помощью дифференциальной сканирующей калориметрии (ДСК). Образец представляет собой 100% формы II (бипирамидальная). Суспензию перемешивают при 50° еще 2 часа и извлекают образец. Микроскопия не показывает изменений. Суспензию перемешивают при 50° в течение 22 часов, затем охлаждают до 20° и перемешивают 1 час. Суспензию фильтруют, продукт промывают 20 мл (1 объемом) ИМС и суша т в вакууме, получают 17,13 г белого кристаллического продукта (-)-цис-4-амино-1-(2-оксиметил2,3-ок-сатиолан-5-ил)-(1Н)-пиримидии-2-она, т.пл. 180-181°. В анализе найдено: С 41,85; Н 4,85; N 18,3. Для C8H11N3O3S требуется: С 41,9; Н 4,8; N 18,3%. Продукт имеет ИК-спектр и ДСК термограмму, идентичные приведенным на фиг. 4 и 6 соответственно. Пример 4 Данные рентгеновской кристаллографии для формы II Данные для кристалла: С8Н11N3О3S М=229,26. 5 41265 Тетрагональ, а=в =8,749 (3), с=26,523(9)А, V=2030/2/А3 (путем обработки по методу наименьших квадратов углов на диффрактометре для 14 автоматически центрированных отражений, 1=1,54184А). Пространственная группа Р43212 (№ 96), Z=8, Дc+1,50 см -3. F(000)=960, м(Сu-Ка)=27,5 см -1. Размеры данных кристалла 0,48 ´ 0,32 ´ 0,30 мм. Единичные кристаллы формы II (бесцветные бипирамиды) были исследованы рентгеновской дифракцией. Было измерено всего 1651 отрешение (3
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 411/00, A61K 31/505, A61P 31/12
Мітки: отримання, композиція, кристалічна, цис-4-аміно-1-(2-гідроксиметил-1,3-оксатіолан-5-іл)-(1н)-піримідин-2-ону, фармацевтична, варіанти, способи, форма
Код посилання
<a href="https://ua.patents.su/8-41265-kristalichna-forma-cis-4-amino-1-2-gidroksimetil-13-oksatiolan-5-il-1n-pirimidin-2-onu-varianti-sposobi-otrimannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма (-)-цис-4-аміно-1-(2-гідроксиметил-1,3-оксатіолан-5-іл)-(1н)-піримідин-2-ону (варіанти), способи її отримання та фармацевтична композиція</a>
Попередній патент: Пристрій для первинної обробки , перетворення , остаточної переробки відходів будь-якого виду та спосіб знищення і утилізації відходів будь-якого виду
Наступний патент: Друкарське видання
Випадковий патент: Оптичний пірометр