Ліпосомна композиція, яка містить селегілін, спосіб її одержання та фармацевтична композиція
Номер патенту: 44289
Опубліковано: 15.02.2002
Автори: ГААЛ Йожеф, МАДЬЯР Кальман, МЕЗЕІ Майкл, САТМАРІ Іштван, ЛЕНДЬЄЛ Йожеф, МАРМАРОШІ Тамашне, СЕБЕНІ Дьюла, СЕКАЧ Габор, ТУРІ Агнеш
Формула / Реферат
1. Липосомная композиция, отличающаяся тем, что содержит в качестве активного ингредиента (-)-N-![]() -диметил- N -(2-пропинилфенилэтиламин) (селегилин) и/или его соль.
-диметил- N -(2-пропинилфенилэтиламин) (селегилин) и/или его соль.
2. Липосомная, композиция по п. 1, отличающаяся тем, что содержит 0,1-40 вес.% селегилина и/или его соли,
от 2 до 40 вес.% липидов, предпочтительно фосфолипидов, от 30 до 90 вес.% воды.
3. Липосомная композиция по пункту 1 или 2, отличающаяся тем, что содержит от 0,1 до 20 вес.%, предпочтительно от 0,1 до 10 вес.% селегилина и/или его соли.
4. Липосомная композиция по пункту 2, отличающаяся тем, что содержит в качестве липида фосфолипид, предпочтительно фосфатидилхолин, и/или лизофосфатидилхолин, и/или фосфатидилсерин, и/или фосфатидилэтаноламин, и/или фосфатидилинозитол.
5. Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 10 вес.% холестерола.
6. Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 20 вес.% спирта, предпочтительно этанол или изопропанол.
7. Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 25 вес.% гликоля, предпочтительно пропиленгликоль или полиэтиленгликоль.
8. Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 3 вес.% антиоксиданта, предпочтительно токоферол или бутилгидроксианизол.
9. Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 3 вес.% консерванта, предпочтительно гермабен.
10. Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 2 вес.% агента, влияющего на вязкость, предпочтительно карбапола.
11. Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 50 вес.% циклодекстрина и/или производного циклодекстрина, предпочтительно ![]() -,
-, ![]() - или
- или ![]() -циклодекстрин, водорастворимый полимер циклодекстрина, метилированное, гидроксипропилированное или сукцинилметилированное производное циклодекстрина или любые его смеси.
-циклодекстрин, водорастворимый полимер циклодекстрина, метилированное, гидроксипропилированное или сукцинилметилированное производное циклодекстрина или любые его смеси.
12. Липосомная композиция по пунктам 1 или 2, отличающаяся тем, что используется для лечения болезни Альцгеймера, болезни Паркинсона, депрессии, паралича, расстройств движения или миелита.
13. Фармацевтическая композиция, отличающаяся тем, что содержит липосомную композицию, охарактеризованную в одном из пунктов 1-11, и обычные наполнители и разбавители и другие вспомогательные агенты.
14. Фармацевтическая композиция по п. 13, отличающаяся тем, что содержит, по меньшей мере, 10 вес.% от общего количества селегилина и/или его соли, заключенного в одно - или мультипластинчатые везикулы, а остальное количество селегилина - в растворе или твердой форме.
15. Фармацевтическая композиция по п. 13, отличающаяся тем, что она предназначена для перорального, парентерального или чрезкожного введения.
16. Фармацевтическая композиция по п. 13, отличающаяся тем, что используется для лечения болезни Альцгеймера, болезни Паркинсона, депрессии, паралича, расстройств движения или миелита.
17. Способ получения липосомной композиции, охарактеризованной в одном из пунктов 1 – 11, отличающийся тем, что выпаривают органический растворитель из органического раствора смеси липорастворимых компонентов, содержащего, по крайней мере, один липид и селегилин, затем объединяют полученный остаток с водным раствором спирта и/или гликоля при перемешивании.
18. Способ по п. 17, отличающийся тем, что в качестве органического растворителя используют смесь хлороформа и метанола.
Текст
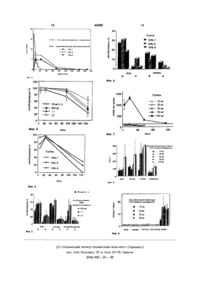
1 Липосомная композиция, отличающаяся тем, что содержит в качестве активного ингредиента (-J-N-*^ -диметилN -(2пропинилфенилэтиламин) (селегилин) и/или его соль 2 Липосомная, композиция по п 1, отличающаяся тем, что содержит 0,1-40 вес % селегилина и/или его соли, от 2 до 40 вес % липидов, предпочтительно фосфолипидов, от 30 до 90 вес % воды 3 Липосомная композиция по пункту 1 или 2, отличающаяся тем, что содержит от 0,1 до 20 вес %, предпочтительно от 0,1 до 10 вес % селегилина и/или его соли 4 Липосомная композиция по пункту 2, отличающаяся тем, что содержит в качестве липида фосфолипид, предпочтительно фосфатид илхолин, и/или лизофосфатидилхолин, и/или фосфатидилсерин, и/или фосфатидилэтаноламин, и/или фосфатид ил инозитол 5 Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 10 вес % холестерола 6 Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 20 вес % спирта, предпочтительно этанол или изопропанол 7 Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 25 вес % гликоля, предпочтительно пропиленгликоль или полиэтиленгликоль 8 Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 3 вес % антиоксиданта, предпочтительно токоферол или бутилгидроксианизол 9 Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 3 вес % консерванта, предпочтительно гермабен 10 Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 2 вес % агента, влияющего на вязкость, предпочтительно карбапола 11 Липосомная композиция по пункту 2, отличающаяся тем, что дополнительно содержит до 50 вес % циклодекстрина и/или производного циклодекстрина, предпочтительно а. Р . или уциклодекстрин, водорастворимый полимер циклодекстрина, метилированное, гидроксипропилированное или сукцинилметилированное производное циклодекстрина или любые его смеси 12 Липосомная композиция по пунктам 1 или 2, отличающаяся тем, что используется для лечения болезни Альцгеймера, болезни Паркинсона, депрессии, паралича, расстройств движения или миелита 13 Фармацевтическая композиция, отличающаяся тем, что содержит липосомную композицию, охарактеризованную в одном из пунктов 1-11, и обычные наполнители и разбавители и другие вспомогательные агенты 14 Фармацевтическая композиция по п 13, отличающаяся тем, что содержит, по меньшей мере, 10 вес % от общего количества селегилина и/или его соли, заключенного в одно - или мультипластинчатые везикулы, а остальное количество селегилина - в растворе или твердой форме 15 Фармацевтическая композиция по п 13, отличающаяся тем, что она предназначена для перорального, парентерального или чрезкожного введения 16 Фармацевтическая композиция по п 13, отличающаяся тем, что используется для лечения болезни Альцгеймера, болезни Паркинсона, де О 00 44289 прессии, паралича, расстройств движения или миелита 17 Способ получения липосомной композиции, охарактеризованной в одном из пунктов 1 - 1 1 , отличающийся тем, что выпаривают органический растворитель из органического раствора смеси липорастворимых компонентов, содержа щего, по крайней мере, один липид и селегилин, затем объединяют полученный остаток с водным раствором спирта и/или гликоля при перемешивании 18 Способ по п 17, отличающийся тем, что в качестве органического растворителя используют смесь хлороформа и метанола Изобретение относится к липосомным композициям, содержащим в качестве активного ингредиента селегилин (-)-(г\І-а-диметил-г\І-(2пропинилфенилэтиламин) и/или его соль Далее, изобретение относится к их получению, содержащим их фармацевтическим композициям и их терапевтическому использованию На сегодняшний день известно огромное количество липосомных композиций и способов их изготовления Такими композициями являются, например, "системы доставки лекарств" (DDS), как описано G Gregonadis с соавт (Receptor-mediated targeting of drugs, Plenum Press, New York, 243-266, 1980) Они содержат активный ингредиент, в инкапсулированном виде, заключенный в одну или более ламелярных мембран содержащих липиды, то есть, в липосомах На хорошую адсорбцию и биопред рас положен ость активного ингредиента(ов) может влиять, среди прочих, состав и способ получения липосом, таким образом, что они могут доставлять активный ингредиент в специфичную область В липосомных композициях активный ингредиент окружен одним или большим количеством липидных ламелл, которые также служат в качестве носителя активного ингредиента ствие небольшого объема воды, заключенной в малые одноламеллярные липидные везикулы (SUV) (описание к Патенту США № 4,089,801) Одноламеллярные липидные везикулы были получены другими методами, то есть, путем инъекции этанола [S Batzn и Е D Korn Biochem Biophys Acta 298 1015-1019, (1973)] или эфира [D Deamer и A D Bangham Biochem Biophys Acta 443, 629-634, (1976)] таким образом, что раствор липидов в органическом растворителе быстро вводили в буферный раствор и, таким образом, спонтанно образовывались одноламеллярные липосомы Метод является быстрым и широко используется, но приводит к получению разведенных липосомных рецептур и имеет плохую инкапсулирующую эффективность Одноламеллярные липосомы также могут быть получены используя так называемую детергент-устраняющую систему [Н G Weder и OZumbuehl Liposome Technology, под редакцией G Gregonadis, CRC Press Inc , Boca Raton Florida, TOM 1, Часть 7, стр 79-107, (1984)], при использовании которой липиды и другие вещества растворяют вместе с детергентами и затем детергенты устраняют диализом Получение одноламиллярных липосомных капсул проводят в соответствии с описанием к Патенту США № 4,234,871 (Papahadjopoulos) путем так называемой технологии выпаривания с обращенной фазой (REV) и в соответствии с описанием Патента США № 4,016,100 (Suzuki), путем лиофилизации водно-липидной дисперсии липидов и биологически активного вещества Мультиламеллярные липидные носители (MLV) впервые были получены и описаны Bangham с соавт (J Мої Biol 13,238-252,1965) Когда биологически активные вещества инкапсулированы в малые одноламеллярные липидные везикулы, водорастворимые вещества можно инкапсулировать с низкой эффективностью, вслед 44289 В опубликованном описании к заявке № WO стимулирующая и МАО-ингибиторная активность 93/20934 раскрыто получение стабильной водной (моноаминоксидаза), более точно, их селективная липосомной суспензии, которая может храниться в МАО-В ингибиторная активность Известны нетечение 6 месяцев при 40°С сколько способов их получения, см , например, описания к Патентам Венгрии № 151,090, 154,655 В процессе получения вышеуказанных липои 187,775 L-Депренил, одобрен FDA в 1989, как сомных композиций дисперсию липидов и водной агент для лечения болезни Паркинсона фазы вводят во взаимодействие на инертном твердом материале, в большинстве случаев, на Липосомная композиция, в соответствии с настеклянных шариках [описание к Патенту США № стоящим изобретением, содержит, предпочти4,485,054] тельно, от 0,1 до 40% по весу селегина (-)-[N-aдиметил-1\1-(2-пропинилфенилэтиламин) и или его В соответствия с описанием к Патенту США № соли, от 2 до 40% по весу липидов, предпочти4,761,288, который специально включен сюда в тельно, фосфолипидов, от 0 до 10% по весу холекачестве ссылки, мультифазные системы получастерола, от 0 до 20% по весу спирта, от 0 до 25% ют для улучшения адсорбции биологически активпо весу гликоля, от 0 до 3% по весу антиоксиданных веществ, имеющих плохую растворимость в та, от 0 до 3% по весу консерванта, от 0 до 2% по воде, которые содержат активный ингредиент в весу агента, влияющего на вязкость, от 0 до 50% форме высоконасыщенного раствора, в твердой по весу циклодекстрина или"производного циклоформе и инкапсулированы в одноламеллярные декстрина и от 30 до 90% по весу воды липидные везикулы Везикулы, раствор и твердая форма биологически активного соединения дисЛипосомная композиция, в соответствии с напергированы в гидроколлоидном геле Гидроколстоящим изобретением, содержит, предпочтилоидный гель получают, используя способ полутельно, от 0,1 до 20, наиболее предпочтительно, чения мультиламиллярных липидных везикул, от 0,1 до 10% по весу селегилина и/или его солей описанный в Патенте США № 4,485,054, который и, по крайней мере, 10% по весу от этого количеспециально включен сюда в качестве ссылки Тастве в одно-и или мультиламиллярной липидной ким образом, можно получить липосомные комповезикуле и остаточное необходимое количестве, зиции, в которых активный ингредиент присутстдо 100% по весу, в свободном состоянии и/или как вует в более высоких концентрациях, чем можно насыщенный раствор Липосомная композиция, в ожидать исходя из их водо- и/или липорастворисоответствии с изобретением, содержит в качестмости ве липида, предпочтительно, фосфолипид, предпочтительно, фосфатидилхолин, и/или лизофосВ описании к Патенту США № 4,937,078 расфатидилхолин, и/или фосфатидилсерин, и/или крыты липосомные композиции локально примефоофатидилэтаноламин, и/или фосфатид ил иноняемых анестетиков и анальгетиков, используезитол, в качестве спирта, предпочтительно, этамых в качестве активных ингредиентов Было нол или изопропанол, в качестве гликоля, предобнаружено, что локально применяемые активные почтительно, пропиленгликоль или ингредиенты являются более эффективными в полиэтиленгликоль, в качестве антиоксиданта, липосомно-инкапсулированном состоянии, чем предпочтительно, токоферол или ВНА (бутилгидобычная мазь, крем или липидные композиции роксианизол), в качестве консерванта, предпочтиОбразование самой липосомы может быть проветельно, гермабен (International Specialy Product, дено как описано в описаниях к Патентам США № Vienna, Austria), в качестве агента, влияющего на 4,485,054 и №4,761,288 вязкость, предпочтительно, углевод или произПолучение всех липосомных композиций было водное целлюлозы, предпочтительно, карборол направлено, прежде всего, на увеличение абсор(Carbomer, Goodrich, Cleveland), и в качестве цикбирующей способности и локальной концентрации лодекстрина и/или производного циклодекстрина, и/или на запланированную абсорбцию активных предпочтительно, а-, р или у-циклодекстрин, воингредиентов, имеющих плохую растворимость в дорастворимый полимер циклодекстрина, метиводе лированное, гидроксилированное или сукцинилНаше изобретение относится к получению лиметилированное производное циклодекстрина или посомных композиций из селегилина или его соего любые смеси лей, которые хорошо растворимы в воде и растворителях (1 г / Змл в воде, 1 г / 5мл в Композиции, в соответствии с изобретением, хлороформе или 1г / Змл в этаноле), а также, к могут содержать липосомную композицию, при оральному, парентеральному или местному теражелании, вместе с широко используемыми наполпевтическому применению, необязательно, в комнителями, разбавителями или вспомогательными позициях с контролируемом чрезкожным высвоагентами Композиция может быть введена, предбождением почтительно, орально, парентерально или в трансдермальной форме При получении трансСелегилин является известной фармацевтидермальной рецептуры, липосомная композиция ческой композицией, широко продаваемой под может быть нанесена на несущую поверхность, названием Джумекс, Депренил, Елдеприл или Lпредпочтительно, на фольгу, пленку или пластик Депренил, будучи очень эффективной, например, при лечении туберкулеза или при иммунной модуЛипосомные композиции могут быть получены ляции [A Dow The Депренил Story, Toronto как раскрыто в описаниях к Патентам США № Stoddard (1990), Inhibitors of Monoamme Oxidase B, 4,485,054 и 4,761,288, органический растворитель под редакцией I Szelenyi, Birkhauser Verlag, Baselвыпаривают из смеси органического растворителя Boston-Berlm, 237-358 (1993)] Одним из его важсодержащего липорастворимые компоненты, соных свойств является антидепрессантная, психодержащего, по крайней мере, один липид и селе 44289 8 гилин, затем объединяют с водным раствором легилином, меченных 3Н-изотопом, методом опводорастворимых компонентов при перемешиваределения радиоактивности нии В качестве смеси органического растворитеОтбирали пробы крови для определения конля, предпочтительно, используют смесь хлороцентрации в сыворотке до лечения и после 6, 24, форма и метанола 48, 72, 96, 120, 144 и 168 часов после введения Было измерено количество селегилина и его меЛипосомные композиции, в соответствии с таболитов, затем измеряли активность тромбоциизобретением, могут, предпочтительно, быть истов МАО-В пользованы для лечения болезни Альцгеймера, болезни Паркинсона, депрессии, паралича, расЗажимы Tagederm были удалены спустя 6 частройств движения или миелита сов и измеряли оставшееся не адсорбированное количество селегилина в спиртовом экстракте Липосомная композиция содержит активный После окончания эксперимента также была измеингредиент в мультифазной, одной/или мультирена МАО-активность на изолированном мозге, ламеллярной везикуле, в свободном состоянии и печени и кишечнике убитых животных При опрев его насыщенном растворе, то есть, мультифазделении активности ферментов МАО-А и МАО-В ной липосомной системе доставки лекарства Потакже была исследована селективность ингибиролученная таким образом липосомная система яввания фермента ляется стабильной и может легко быть разбавлена водой Ее реологические свойства Общая концентрация Депренила и его метаможно варьировать от разбавленной жидкости до болитов измерялась в крови и изолированном состояния желатина мозге, легких, селезенке, печени, сердце, желудке, тонком и толстом кишечнике и почках убитых жиС фармакологической точки зрения мы ставивотных, также на поверхности кожи, где проводили цель получить липосомные композиции содерлась липосомная обработка Образцы крови, для жащие селегилин, которые являются системами определения интервалов, отбирали из угла глаздоставки лекарств с контролируемым их высвобоной щели морских свинок и из большой шейной ждением и, таким образом, способны высвобожвены свиней дать точные дозы во время трансдерамального лечения даже при режиме дозировок "раз в недеПо истечении семнадцатого дня морских свилю" Способ введения и доза зависят, среди пронок забивали и мгновенно отбирали пробы крови чего, от заболевания (болезнь Альцгеймера, бопрямо из сердца В случае свиней пробы крови лезнь Паркинсона, депрессия, паралич, отбирали перед забиванием, как описано выше расстройство движения или миелит), от его тяжеОтобранные органы и ткани промеряли и гости, общего состояния пациента и пр могенизировали в 4-кратном объеме физиологического раствора хлорида натрия Три аликвоты Фармакологические и фармакокинетические по 5мкл вносили пипеткой в кюветы, содержащие исследования липосомных композиций in vivo 2мл Solune 350 и 0,5мл изопропанола Далее с проводились на морских свинках-альбиносах с пробами поступали как описано выше для проб весом от 300 до 350г (линия Сharless-River, SPF крови специфичное непатогенное качество) путем местного лечения, групп состоящих из трех животных, Радиоактивность органов определяют подсчеслучайно отобранных для тестирования том сцинциляций в жидкой фазе, полученные данные дают общее количество измеряемого ДеВторая фаза экспериментов была проведена пренила и метаболитов на свиньях весом от 20 до 22кг, путем лечения трех животных единственной дозой одной из Количество лекарства, оставшегося на пленке формул и Tegaderm также определяют радиоактивным методом Животных содержали раздельно в вольерах, на подстилке из древесной стружки при средней Специфическую радиоактивность определяют температуре 23°С, с одинаковым кормом и питьиз аликвотных проб исходных препаратов липоем сом, которые использовались для подсчета значений, относящихся к органам и тканям В качестве тестируемых композиций были использованы продукты в соответствии с ПримераМАО-активность в мозге определяли методом ми 1, 2, 3 и 6 Вуртмана и Аксельрода [Biochem Pharmacol 12, 1414-1419 (1963)], и содержание белка в гомогеЛипосомные препараты Депренила прилагали низатах определяли методом Лоури с соавт [J на безволосую часть спины (морские свинки) или Biol Chem 193,265-275(1951)] кожу шеи (свиньи) на поверхность 1,5 х 1,5 и 3 х Зсм соответственно, и, после высушивания в теМ АО-активность тромбоцитов исследовали чение нескольких минут, закрепляли Tegaderm методом Уиллберга и Оурленда [Med Biol 54, (производимым ЗМ, США) В качестве контроля 137-144(1976)] свиньям орально одни раз в день вводили таблетКонцентрацию селегилина и таких его метаки селегилина болитов, таких как амфетамин, метамфетамин и дезметил-селегилин, определяли с помощью гаВо время оценки измеряли МАОзовой хроматографии ингибирование в крови, мозге, печени и кишечнике, далее - концентрацию активного ингредиента в Биологические фармакологические результакрови Накопление активного ингредиента и его ты разъясняются на следующих фигурах метаболитов в различных органах свиней (крови, Фигура 1 и 2 показывают данные уровня мемозге, сердце, печени, почках, легких и селезенке) таболитов селегилина, например, метамфетамибыло исследовано после введения липосом с сена, в крови после одного трансдермального прикладывания селегилин-липосомной композиции 44289 В течение 24 часов (Фигура 1) измеряли дозозависимый уровень в крови, когда прикладывали, в основном, одноламиллярную липосомную композицию с маленькими везикулами с распределением в соответствии с Примером 6, при спользовании которой абсорбция и метаболизм происходят быстро В основном, мультиламеллярные липосомы попадающие в диапазон распределения частиц с большим размером (Примеры с 1 по 3) приводят к медленному снижению уровня в крови, компоненты имеющие низкое число ламелл обеспечивает относительно высокий уровень в крови в течение 72 часов и мультиламилярная композиция обеспечивает промеряемый уровень в крови даже после 168 часов (Фигура 2) В случае тех же композиций также можно установить, что композиция, обеспечивающая быструю абсорбцию, обеспечивает стабильное МАОингибирование, в то время как медленная адсорбция ведет к относительно быстрому восстановлению ингибирования в крови (Фигуры 3 и 4) Сходные данные были получены также при измерениях в мозге (Фигуры 5 и 6) Сходные уровни в крови были получены в радиоактивных тестах на морских свинках (неизмененный селегилин и его метаболиты вместе) (Фигура 7) В случае липосом с медленной адсорбцией, определяли значительный уровень в органах, несмотря на то, что уровень в крови снижался к 168 часу, как в мозге являющегося важным из-за эффекта, так и в печени, которая играет важную роль в метаболизме и во всех липофильных органах (Фигура 8 и Таблица 1) Эти органы могут служить как депо, выпускающее активный ингредиент позднее Кишечник содержит относительно малое количество субстанции, таким образом поддерживая данные ингибирования и отсутствие МАО-А ингибирования (Фигура 5) Фигура 9 (Таблица 1) сравнивает уровни, полученные в органах с количеством субстанций, аккумулированных в коже Хорошо видно, что хотя получают в органах значительные, выше 10нг/г, значения, которые выше известных постсмертных человеческих данных (пунктирная линия в Фигуре), все же присутствует значительный запас в коже, который может обеспечить поставку активного ингредиента в течение длительного времени Различные дозы, от 10 до 140мг, приводят к значительно более высокой разнице в крови (примерно, в 100 раз выше), чем в мозге (всего от 2 до 3 раз выше) (срав Фигуры 7 и 8) Исследования подтверждают следующие преимущества липосомных композиций, содержащих селегилин Активный ингредиент не попадает в желудочно-кишечный тракт, приводя, таким образом, к значительному понижению ингибирования сконцентрированного там МАО-А фермента, играющего важную роль в метаболизме тирамина, так как он не контактирует с активным ингредиентом Будучи введен любыми другими путями введения, кроме орального (внутривенное, внутримышечное, глазные капли, капли в нос, распылитель и пр), активный ингредиент избегает vena portae (лат воротная вена) и, таким образом, пер 10 вого пути метаболизма Таким образом, это обеспечивает повышенный уровень селегилина и пониженный уровень метаболита, понижение МАОА-ингибирования Менее возможно, что имеет место эффект "cheese" ("сыра") Более высокие дозы могут быть применены без побочных эффектов и, например, может быть расширено применение в качестве антидепресанта Метаболиты являются стимуляторами и вызывают бессонницу, снижение их уровня означает снижение побочных эффектов При чрезкожном введении кожа сохраняет количество активного ингредиента, необходимого для продолжительной адсорбции, путем, не лимитирующим его функцию Абсорбция липосомной композиции (в зависимости от состава) занимает примерно от 1 до 20 минут, после чего не нужна какая либо повязка и покрытие (повязка, Tegaderm), композиция не может быть смыта, таким образом, не препятствует умыванию, ее удаление не может быть источником страха даже при слабоумии При изменении состава (композиции или размера частиц) может быть достигнута оптимальная задержка (1 день, 1 неделя, несколько недель) При изменении отношения инкапсулированного и свободного ингредиента может быть достигнуто стабильное соотношение ингредиент метаболит, которое оптимально в отношении нейрозащитного и нейроподдерживающего эффектов Изобретение разъясняется следующими не ограничивающими примерами Примеры с 1 по 6 Получение липосомной композиции Депренила Пример 1 20г Фосфолипона 90-G (ненасыщенного фосфолипида) и Юг гидрохлорида селегилина растворяют в круглодонной колбе в 20мл смеси 2 1 хлороформа с метанолом при температуре 40°С К раствору добавляют ЮОг маленьких стеклянных горошин Растворитель выпаривают в вакууме в Rotavapor, и во время этой процедуры на стенке стеклянной колбы и на поверхности стеклянных горошин формируется тонкая пленка Туда добавляют 70 г смеси 1 3 этанола и воды, нагретой до 40°С Содержимое колбы хорошо перемешивают и затем перемешивают при средних оборотах, 200оборотов/минуту в течение 30 минут при 35°С Стеклянные горошины отфильтровывают через воронку Бюхнера без фильтровальной бумаги Фильтрат оставляют на один час при комнатной температуре для формирования липосомной системы Формирование липосом подтверждают исследованием на оптическом микроскопе Общий вес этого липосомного продукта (CH-L-1) равен ЮОг Липосомная структура подтверждается микроскопическим исследованием и измерением распределения размера частиц Пример 2 Композицию липосомного селегилина получают как описано в Примере 1 с той разницей, что в качестве фосфолипида используют Фосфолипон 90-Н Получают также ЮОг продукта (CH-L-2) Его липосомную структуру доказывают микроскопическим исследованием и измерением распределе 44289 12 11 ния размера частиц получено 135г продукта и доказано, что он является липосомной композицией путем его микроПример 3 скопического исследования и измерения распреПроцесс проходит как описано в Примере 1 с деления размера частиц той разницей, что фосфолипид в количестве, меньшем, чем 1г, и холестерол в количестве 1г Пример 6 растворяют в смеси органического растворителя Процесс происходит как описано в Примере 1 Полученный продукт называют (CH-L-3) стой разницей, что использовали 16г Фосфолипона 90-Н, 4г холестерола Юг гидрохлорида селеПример 4 гилина, 50г дистиллированной воды и 5г пропилен Процесе проходит как описано в Примере 1 с гликоля и качание проводили при оборотах той разницей, что использовали 20г селегилина и 250оборотов/минуту ЗОг фосфолипида Микроскопическим исследованием и измерением распределения размера часПутем микроскопического исследования и изтиц 118г продукта доказано, что продукт является мерения распределения размера частиц доказалипосомной композицией но, что полученный продукт (CH-L-10) является липосомной композицией Его средний размер Пример 5 частиц меньше, чем у продуктов, полученных в Процесс происходит как описано в Примере 2, соответствии с Примерами с 1 по 5 но использовали ЗОг селегилина, 40г фосфолипида и 40мл смеси хлороформа и метанола Было Депренил Фигура 3 МАО-В-ингибирование тромбоцитов после чрезкожного введения липосомной композиции (CHL-10) и орального введения традиционных таблеток Фигура 4 МАО-В-ингибирование в тромбоците в течении 168 часов после чрезкожного введения мультиламиллярной липосомной композиции Таблица 1 Фигура 5 МАО-ингибирование в мозге, печени Радиоактивность различных органов (в мгэкв/г и тонком кишечнике в течении 168 часов после ткани) морских свинок через одну неделю после чрезкожного введения липосомной композиции введения 140мг заключенного в липосомы 3Н деCHL-2 пренила (содержащих 14мг депренила, примерно Фигура 6 МАО-ингибирование в мозге и пече42мг/кг) Первые данные (в квадрате) измеряны ни в течении 168 часов после чрезкожного введечерез 24 часа, не включали в средние значения ния липосомных композиций Фигура 7 Концентрации в сыворотки, подсчии іиарнкиая pajіиаакїивиасть {ККГЭ1Ы / P ) танные на основе радиоактивности (немеченое CHL-1 CHL-2 СШ.-3 вещество и метаболит) после чрезкожного введезнач сред. S 0 знач сред s с ЭНЭЧ сред ния различных доз композиции CHL-2 IIJIS oisa ?мП 0J3! OS'S QOse О » a i65 аві ем» Фигура 8 Концентрация радиоактивного веOJJ6S 12!) ояо 0.1» «г™ щества (селегилин+метаболиты) в течении 168 Ьк) C.ISJ 10И C.2SZ ММ 0.37! •ли» OS» часов после чрезкожного введения композиции 0161 «рад Ш2 esss CHL-2 0.JB МИ ИЗИ 2JJ7J 0911 0.03! ftSJS am 0.Э9 ft«i Фигура 9 Радиоактивность различных органов 0.В1 ft»? «an. морских свинок и таковая в месте приложения в 0ЇК 0 61S 0.JI7 01Ї5 ОТОЇ ex* К1« 6.0OS В О» от ono течении 168 часов после чрезкожного введения 0.102 0IJ3 -дйП композиции CHL-2 1 30 50 мг (10 таблеток) п о ( 0030 СН L10 л ипосомкая ком 0 S r(SD мгсапегалина) ЛШ2 ашг, 1 r(1QB игеелегилина) 0ЯІІ 0ЛІІ 2 г (200 ИГ свлегилина] 100 120 э«*я (часы) Фигура 1 Средние уровни метамфетамина (± SD, n = 3) в плазме свиней после орального или чрезкожного лечения (-) Депренил (CHL-10) Фигура 2 Средние уровни метамфетамина (± SD, n = 3) в плазме свиней после чрезкожного лечения липосомной композицией, содержащей (-) 13 44289 ED— 300 «г 20 мг оелегмлимайкивогное п о (гйр^ралько) 14 m 30 сепегигаїнг/живсяіїцвів птосяиноч композиции} » СНЫ Д CHL-2 CHL-3 60 ВО печень мозг время (часы) 8 А Фиг, 6 120 1500 Группы --+-—О— І. • .,.#... 1000" 500О 10 мг 20 мг 30 мг 50 мг 140 мг 20 40 60 80 100 120 140 160 ФИГ. 3 Ч асы 1S0 часы Фиг. 7 100 400 Доза ПІІПОСОМНОЙ композ (CHL-2J (10% активного ингредиента) & 200" О 20 40 60 SO 100 120 140 печень часы селезенка Фиг а Фиг. 4 ш ЭОмг/кгп о 80 S } 60 Лилосомные иомпоз 10% активного ингредиента Доза липосомной композиции (10% активного ингредиента) 20 Ш 1 Г 10" Фиг. 5 20 мг тонким кишечник В А В мозг 30 мг Ш 2г печень З А 10 мг В Ш 500 мг 50 мг легкие печень селезенка кожа Фиг. 9 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044) 456 - 20 - 90 15 44289 16
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/137, A61K 9/127
Мітки: селегілін, одержання, ліпосомна, спосіб, містить, яка, фармацевтична, композиція
Код посилання
<a href="https://ua.patents.su/8-44289-liposomna-kompoziciya-yaka-mistit-selegilin-sposib-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Ліпосомна композиція, яка містить селегілін, спосіб її одержання та фармацевтична композиція</a>
Попередній патент: Підглазурний барвник синьо-голубого кольору для декорування фарфору і забарвлення фарфорових мас і глазурей
Наступний патент: Спосіб вирощування та утримання яєчних курей у закритих приміщеннях
Випадковий патент: Спосіб скринінгової діагностики ургентного нетримання сечі у жінок з гіперактивним сечовим міхуром