Електрохімічна комірка для визначення вмісту сірководню в повітрі
Номер патенту: 82971
Опубліковано: 27.08.2013
Автори: Лінючев Олександр Генадійович, Лінючева Ольга Володимирівна, Кушмирук Андрій Іванович, Косогін Олексій Володимирович, Мірошниченко Юлія Сергіївна
Формула / Реферат
1. Електрохімічна комірка для визначення сірководню в повітрі, яка містить принаймні робочий та допоміжний електроди, розділені просоченим розчином електроліту сепаратором, яка відрізняється тим, що виконана у вигляді таблетки, в якій пошаровим пресуванням поєднані електроди та сепаратор, розміщена в корпусі з проникною для сірководню мембраною, при цьому робочий електрод виконаний із пористого титану, активованого оксидом мангану (IV), допоміжний електрод виконаний із суміші стійкого в середовищі електроліту електропровідного матеріалу та оксиду мангану (IV) марки ЕДМ-2, сепаратор виконано з суміші полімерного зв'язуючого порошку фторопласту марки ФТ-4 МБ і гідрофілізуючої домішки порошку силікагелю, а як електроліт використовується розчин 5-7 m перхлоратної кислоти.
2. Електрохімічна комірка за п. 1, яка відрізняється тим, що вона окрім робочого та допоміжного електродів містить електрод порівняння того ж складу, що і допоміжний електрод двоелектродної комірки, причому допоміжний електрод та електрод порівняння розділені другим сепаратором.
Текст
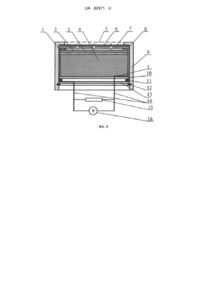
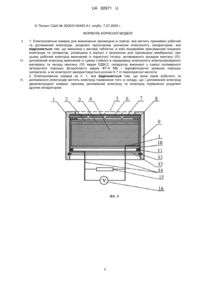
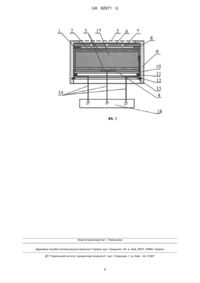
Реферат: Електрохімічна комірка для визначення сірководню в повітрі містить принаймні робочий та допоміжний електроди, розділені просоченим розчином електроліту сепаратором. Комірка виконана у вигляді таблетки, в якій пошаровим пресуванням поєднані електроди та сепаратор, розміщена в корпусі з проникною для сірководню мембраною. При цьому робочий електрод виконаний із пористого титану, активованого оксидом мангану (IV), допоміжний електрод виконаний із суміші стійкого в середовищі електроліту електропровідного матеріалу та оксиду мангану (IV) марки ЕДМ-2. Сепаратор виконано з суміші полімерного зв'язуючого порошку фторопласту марки ФТ-4 МБ і гідрофілізуючої домішки порошку силікагелю, а як електроліт використовується розчин 5-7 m перхлоратної кислоти. UA 82971 U (54) ЕЛЕКТРОХІМІЧНА КОМІРКА ДЛЯ ВИЗНАЧЕННЯ ВМІСТУ СІРКОВОДНЮ В ПОВІТРІ UA 82971 U UA 82971 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до області сенсорів, що являють собою електрохімічні комірки і використовуються у приладах газового аналізу. Корисна модель може бути використана для безперервного чи дискретного визначення сірководню при моніторингу повітряного середовища закритих просторів, об'єктів, пов'язаних з добуванням, переробкою і використанням природного газу і нафти, підприємств, пов'язаних з виробництвом чи споживанням сполук сірки, а також у комунальному господарстві. До відомих способів визначення газових домішок у повітрі належать інфрачервона спектроскопія, газова хроматографія, масспектрометрія [1]. Через складність апаратурного оформлення і високу трудомісткість ці способи малопридатні для безперервного контролю повітряного середовища і в основному використовуються для визначення сірководню в окремих газових пробах. Відомі способи одноразового детектування сірководню в повітрі за допомогою індикаторних хімічних реакцій [2]. Ці способи є напівкількісними і характеризуються низькою чутливістю. Відомі електрохімічні комірки потенціометричного типу, дія яких заснована на вимірюванні електрорушійної сили (ЕРС) між електродом порівняння і індикаторним електродом у розчинах, що поглинають визначувані сполуки з аналізованого газу [3]. Недоліками комірок цього типу є велика тривалість перехідного процесу і низька точність визначення, обумовлена нернстівською природою відгуку (зміна ЕРС комірок пропорційна логарифму концентрації визначуваного компонента). З цих же причин не знайшли широкого практичного застосування високотемпературні потенціометричні комірки на основі твердих електролітів із сульфатів натрію, калію, срібла і міді, натрійпровідних силікатів рідкоземельних металів [4], оксиду цирконію, допованого оксидом кальцію із провідністю по аніонам кисню [5]. Робочі температури таких сенсорів знаходяться в інтервалі 500-1300 °C. Внаслідок високої температури аналізу адсорбція і окиснення відновлюваних газів на електродах таких сенсорів перебігають неселективно. В результаті визначається сума відновлюваних газів, що унеможливлює визначення сірководню в багатокомпонентних середовищах. Широко застосовуються для визначення сірководню сенсори амперометричного типу, які характеризуються лінійною залежністю між струмовим сигналом і концентрацією визначуваного компоненту [6, 7]. Цьому типу сенсорів притаманна висока точність вимірювання в межах зміни концентрації газу на два-три порядки, завдяки чому вони зайняли панівне становище для моніторингу повітряного середовища на вміст сірководню. Структурно газові амперметричні сенсори являють собою електрохімічні комірки, на робочих електродах яких протікають реакції електрохімічного перетворення. По принципу дії амперометричні сенсори можна поділити на два типи: двоелектродні гальванічні сенсори і триелектродні сенсори із зовнішнім потенціостатуючим пристроєм. Найбільш близькою до заявленої корисної моделі є електрохімічна комірка амперометричного типу, що генерує струмовий сигнал, пропорційний вмісту сірководню в повітрі [8] (прототип). Дана комірка містить розділені сепараторами робочий, порівняння і допоміжний платинові або із сплавів платинових металів електроди і фоновий розчин електроліту. Електроди електрохімічного сенсора являють собою пористі пошарові структури, що включають фторопластову пористу основу з нанесеною на нею платиновою черню, яка за допомогою тетрафторетиленової емульсії при високій температурі фіксується на пористій мембрані. За допомогою зовнішнього потенціостатуючого пристрою підтримується задане значення потенціалу робочого електрода відносно електрода порівняння, за який використовується кисневий електрод, що являє собою гідрофобізований платиновий електрод, нанесений на фторопластову основу та ізольований від зовнішнього середовища. Як фоновий електроліт використаний водний розчин сульфатної кислоти. Дія цієї комірки заснована на анодному окисненні сірководню на робочому електроді на граничному дифузійному струмі. На допоміжному електроді комірки відбувається відновлення атмосферного кисню із споживанням протонів. Істотними недоліками робочих електродів із дрібнодисперсних платинових металів є низька селективність при визначенні відновлюваних газів і зниження каталітичної активності в часі. В основу корисної моделі поставлена задача створення електрохімічної комірки для визначення вмісту в повітрі сірководню зі стабільними в часі струмовими сигналами і високими селективністю, чутливістю, відтворюваністю і терміном служби шляхом використання газодифузійного робочого електрода, який селективно каталізує реакції окиснення визначуваного компонента. Поставлена задача вирішується тим, що як робочий електрод використовується газодифузійний тонкошаровий діоксидномангановий електрод на струмопровідній основі з пористого титану та малополяризований масивний діоксидномангановий допоміжний електрод, 1 UA 82971 U 5 10 15 20 25 30 35 40 45 50 55 60 що дозволяє за рахунок однакової природи електрохімічно активних речовин, які входять до складу електродів комірки, досягти мінімальних значень фонового струму, що підвищує роздільну здатність комірок. Перевагою запропонованої комірки є і те, що в ній не використовуються дорогоцінні метали. У випадку триелектродної конструкції сенсора допоміжний електрод комірки виконують з пористого титану, активованого платиновими металами або золотом, чи графіту. Електрод порівняння при цьому виконують аналогічно допоміжному електроду двоелектродної комірки. Комірка може бути виконана пошаровим пресуванням функціональних шарів у вигляді таблетки, що спрощує її монтаж і надає зачну механічну міцність. В двоелектродному варіанті виконання комірки мірою концентрації визначуваного газу в повітрі є сила струму, що протікає в зовнішньому колі між робочим і допоміжним електродами. Для розширення діапазону вимірювання концентрації визначуваних у повітрі сірководню комірка може бути виконана в триелектродному варіанті, де зовнішнім потенціостатуючим пристроєм задають робочому електроду потрібне значення потенціалу відносно неполяризованого електрода порівняння, а між робочим і допоміжним електродами протікає струм, сила якого пропорційна концентрації визначуваного газу в повітрі. Електроди комірки розділені сепараторами, які складаються з суміші порошків полімерного зв'язуючого і гідрофілізуючої добавки, наприклад суміші порошків фторопласту і силікагелю, просоченими розчином електроліту. При цьому сепаратори виконують функцію іонного провідника і забезпечують масообмін між електродами комірки. Як електроліт використовують розчини 5-7 моль/кг Н2О перхлоратної кислоти з високою буферною ємністю по іонах гідрогену (рН-1), який є стабільним в широкому діапазоні температур і відносної вологості навколишнього повітря і в якому корозійностійкий титан. Таким чином, на відміну від прототипу [8], в якому через адсорбцію і електрохімічне окиснення широкого загалу відновлюваних газів спостерігається низька селективність сенсора, а через відновлення на робочому електроді атмосферного кисню знижується його роздільна здатність, використання у корисній моделі як робочого газодифузійного електрода з пористого титану, активованого МnО2 і наявність у допоміжному електроді і електроді порівняння оксиду мангану (IV) марки ЕДМ-2, потенціали яких близькі, дозволяє експлуатувати комірку при малих фонових струмах, що суттєво підвищує чутливість та роздільну здатність. Вибірковість окиснення сірковмісних газів на титановому електроді, активованому МnО2, в присутності інших відновлюваних газів дозволяє підвищити в порівнянні з прототипом селективність сенсора. На Фіг.1 представлена схема двоелектродної комірки. Вона містить робочий електрод 2, сепаратор 3, допоміжний електрод 4 і змонтована в обичайці 8. Обичайку 8 фіксують у корпусі 9 за допомогою диска з діелектрика 10, герметизуючого гумового кільця 11, кришки 13 і стопорного кільця 12. Струмовідводи 1 в місці контакту з електродами виконані з корозійностійкого в середовищі електроліту матеріалу, наприклад з титану або танталу, і через кришку 13 з діелектрика зовнішніми провідниками 14 замкнені на резистор навантаження 15. Падіння напруги на резисторі 15, яке вимірюють високоомним вольтметром 16, є мірою струму, що протікає між електродами комірки. Сірководень з навколишнього середовища надходить до робочого електрода 2 через захисну металеву сітку 5, полімерну пористу мембрану 6 і дифузійні калібровані отвори в полімерному диску 7. На Фіг. 2 представлена схема триелектродної комірки. В цій комірці позиції 1-14 позначають ті ж елементи, що й в двоелектродній комірці (Фіг.1). В триелектродній комірці між допоміжним електродом 4 і електродом порівняння 17 міститься другий сепаратор 3. Струмовідводи 1 до відповідних електродів комірки зовнішніми провідниками 14 з'єднані з потенціостатуючим пристроєм 18, який призначений для підтримання на робочому електроді 2 заданого значення потенціалу відносно електрода порівняння 17 і вимірювання сили струму, що протікає між робочим 2 та допоміжним 4 електродами. Принцип дії комірки гальванічного типу з каталітично активними електродами з оксиду мангану (IV) при визначенні концентрації сірководню в повітрі полягає в наступному: потенціал робочого 2 та допоміжного 4 електродів в кислому середовищі визначається однією і тією ж електродною реакцією + 2+ МnО2+4Н +2е=Мn +2Н2О. (1) При відсутності сірководню в навколишньому середовищі із-за деякої відмінності значень безструмових потенціалів електродів із піролітичного МnО2 та ЕДМ-2 від рівноважного потенціалу реакції (1), пов'язаної із взаємодією оксиду мангану (IV) з титановим струмопідводом, через електроди комірки протікає згасаючий у часі фоновий струм до встановлення на обох елекродах потенціалу Е 2 UA 82971 U 2+ 5 10 15 20 25 30 35 40 45 50 55 60 Е = Е° - 0,118рН - 0,02951g[Mn ], (2) 2+ значення якого визначається рН фонового електроліту, концентрацією іонів Мn і величиною Е°, що залежить від ступеня відновлення оксиду мангану (IV). З появою в навколишньому середовищі сірководню відбувається його дифузія через мембрану 6 і калібровані дифузійні отвори полімерного диска 7, поглинання приелектродним шаром фонового електроліту і адсорбція на робочому електроді з подальшою хімічною взаємодією з оксидом мангану (IV), що призводить до зменшення стехіометрії останнього: 8MnO2+H2S+4H2O=H2SO4+8MnOOH. (3) При цьому потенціал робочого електрода зсувається в катодну сторону, що супроводжується появою струму, за рахунок реакції окиснення на робочому електроді нестехіометричного оксиду мангану + МnООН = МnО2+Н +е, (4) і відновлення оксиду мангану (IV) марки ЕДМ-2 допоміжного електрода згідно з реакцією (1). При окисненні нестехіометричного діоксиду мангану на робочому електроді 2, між робочим 2 і допоміжним 4 електродами у зовнішньому колі протікає струм, сила якого прямо пропорційна дифузійному потоку визначуваного газу через калібровані отвори полімерного диска 7. Таким чином, в двоелектродній гальванічній комірці реалізується сумарний процес + 2 2+ 4MnO2+H2S+6H =SO4 '+4Mn +4H2O. (5) При експлуатації двоелектродної гальванічної комірки згідно з реакцією (5) відбувається накопичення в фоновому електроліті іонів мангану з витратою оксиду мангану (IV) в допоміжному електроді, що обмежує ресурс роботи сенсора. Усунення цього недоліку реалізується шляхом використання триелектродної комірки, яка включає в себе робочий електрод з пористого титану, активованого МnО2, малополяризований масивний діоксидномангановий електрод порівняння і допоміжний електрод з матеріалу з низькою перенапругою відновлення кисню та стійкого в кислому середовищі. Допоміжний електрод може бути виконаний з пористого титану, активованого платиновими металами або золотом, чи графіту. При задаванні робочому електроду потенціалу електрода порівняння внаслідок різного стехіометричного складу оксидних електродів, а також різної активності іонів мангану в електроліті, спостерігається протікання згасаючого в часі фонового струму. Як і в двоелектродному гальванічному сенсорі, в триелектродному сенсорі під впливом адсорбції на робочому електроді сірководню за рахунок хімічного окиснення останнього газів за реакцією (3) зменшується стехіометрія оксиду мангану (IV). Оскільки потенціал робочого електрода відповідає потенціалу малополяризованого діоксидноманганового електрода порівняння з більш високою стехіометрією, то робочий електрод буде поляризованим, що призведе до виникнення у зовнішньому колі сенсора струму, сила якого пропорційна концентрації визначуваного газу. При цьому на електродах відбуваються спряжені реакції окиснення нестехіометричного оксиду мангану (IV) (5) на робочому електроді і відновлення атмосферного кисню на допоміжному електроді у відповідності до рівняння + О2+4Н + 4е = 2Н2О. (6) Як видно з реакцій (3), (4) і (6), сумарний процес в комірці триелектродного сенсора зводиться до окиснення сірководню і відновлення атмосферного кисню H2S+2О2=H2SO4. (7) Реакція (7) перебігає без споживання компонентів, що входять до складу комірки. В результаті перебігу електродних процесів (3), (4) і (6) між робочим 1 і допоміжним 4 електродами через зовнішнє коло протікає струм, сила якого пропорційна концентрації визначуваного газу в повітрі. Показники роботи дво - і триелектродних комірок наведені в наступних прикладах. Приклад 1. Двоелектродна комірка згідно Фіг. 1 виконана у вигляді спресованої таблетки, містить робочий електрод 2 з пористого титану, активованого 0,04 г МnО2, сепаратор 3 із суміші порошків силікагелю і фторопласту, і допоміжний електрод 4 із суміші порошків 7 г титану, 0,5 г оксиду мангану (IV) марки ЕДМ-2 і 0,05 г силікагелю. Для оксидів мангану стехіометричного складу в діапазоні МnО1,97 – МnО1,95 розрахований за законом Фарадея відповідно до реакції (1) ресурс робочого і допоміжного електродів відповідно складе 2,45 і 30,6 мАгод. Фоновим електролітом був розчин 5 моль/кг Н2О перхлоратної кислоти при рН-1. Випробування проводили з дифузійним опором 7 у вигляді фторопластового диска товщиною 1 мм з дванадцятьма дифузійними каналами діаметром 0,9 мм кожний. У ході випробувань вольтметром 16 вимірювали падіння напруги на резисторі 15 опором 100 Ом, по величині якого визначали силу струму, що протікає через комірки при заданій концентрації сірководню в аналізованому повітрі. Наприклад, при відсутності сірководню в повітрі на резисторі 3 UA 82971 U 5 10 встановлювалось падіння напруги 0,02 мВ, що відповідає фоновому струму 0,2 мкА, а при вмісті 30 ррm сірководню в повітрі падіння напруги на резисторі склало 3,2 мВ, що відповідає силі струму 32 мкА чи нормуванню сигналу 1,07 мкА/ppm H2S. Такі відновлювальні гази, як водень і оксид карбону(II), при концентраціях до 500 ррm не впливають на сигнал сенсора. Випробування проводили після виготовлення комірок і після 100 годин безперервної роботи при концентрації H2S в аналізованому повітрі 10 ррm. При випробуваннях визначали час відгуку комірки σ0,9 (час досягнення 90 % від сталого струмового сигналу після подачі визначуваного газу), діапазон концентрації визначуваного газу, в якому зберігається лінійність струмового сигналу від концентрації, нормування сигналу та кількість електрики, що пройшла через комірку за 100 год. Результати випробувань комірки приведені в таблиці. Як видно, показники роботи комірки, за виключенням σ0,9, залишалися стабільними після 100 год. експлуатації, а завдяки регенерації оксиду мангану на робочому електроді по реакції (4) кількість електрики, що пройшла, в півтора рази перевищила теоретичний курс. 15 Таблиця Показники Перехідний час, σ0,9, с після виготовлення після 100 год. експлуатації комірки при 10ppmH2S Нормування сигналу, мкА/ррm після виготовлення після 100 год. експлуатації комірки при 10 pmH2S Діапазон лінійності, ррm після виготовлення після 100 год. експлуатації комірки при 10 ppmH2S Кількість електрики, мАгод. після виготовлення після 100 год. експлуатації комірки при 10 pmH2S 20 25 30 35 40 Приклад 1 Приклад 2 80 30 100 32 1,07 ІД 1,05 1,1 1-100 5-250 1-100 5-250 0 0 1,2 1,2 При цьому на допоміжному електроді витрачено близько 10 % ЕДМ-2 за реакцією (1). Приклад 2. Триелектродна комірка (Фіг. 2) відрізняється від використаної в прикладі 1 наявністю електрода порівняння 17 того ж складу, що і допоміжний електрод комірки в прикладі 1, а допоміжний електрод комірки 4 виконаний з пористого титану, активованого платиною (0,01 г Pt). Комірка підключена до потенціостатуючого пристрою 18 як показано на Фіг.2, яким робочому електроду 2 задавали потенціал електрода порівняння 17 (біля 1,25 В відносно н.в.е.) і вимірювали силу струму в колі між робочим 2 і допоміжним 4 електродами. Як видно з таблиці, використання триелектродної комірки розширює діапазон лінійності і зменшує час відгуку комірки σ0,9. Джерела інформації: 1. Юнг Г. Инструментальные методы химического анализа. - М.: Мир, 1989.-608 с. 2. Муравьева С. И., Казнина Н. И., Порохова Е. К. Справ очник по контролю вредных веществ в воздухе. - М.: Химия, 1988,-320 с. 3. Агасян П. К., Николаева Е. Н. Основы электрохимических методов анализа (потенциометрический метод). - М.: МГУ, 1986.-193 с. 4. Леонова Л. С, Добровольский Ю. А., Укше Е. А., Ткачева Н. С, Габрельян А. В. Суперионные сенсоры для анализа серосодержащих газов. // Метрология.-1991. - № 6. - С. 4552. 5. Сомов С. И. Применение электрохимических элементов с твердым электролитом на основе диоксида циркония для химического анализа // Электрохимия.-1993. - Т 29, № 12 - С. 1462-1468. 6. Будников Г. К., Майстренко В. Н., Вяселев М. Р. Основы современного электрохимического анализа. - М.: Бином, 2003.-592 с. 7. Кальвода Р., Зыка Я., Штулик К. Электроаналитические методы в контроле окружающей среды. - М.: Химия, 1990.-240 с. 4 UA 82971 U 8. Патент США № 2005/0145493 А1, опубл. 7.07.2005 г. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 10 15 1. Електрохімічна комірка для визначення сірководню в повітрі, яка містить принаймні робочий та допоміжний електроди, розділені просоченим розчином електроліту сепаратором, яка відрізняється тим, що виконана у вигляді таблетки, в якій пошаровим пресуванням поєднані електроди та сепаратор, розміщена в корпусі з проникною для сірководню мембраною, при цьому робочий електрод виконаний із пористого титану, активованого оксидом мангану (IV), допоміжний електрод виконаний із суміші стійкого в середовищі електроліту електропровідного матеріалу та оксиду мангану (IV) марки ЕДМ-2, сепаратор виконано з суміші полімерного зв'язуючого порошку фторопласту марки ФТ-4 МБ і гідрофілізуючої домішки порошку силікагелю, а як електроліт використовується розчин 5-7 m перхлоратної кислоти. 2. Електрохімічна комірка за п. 1, яка відрізняється тим, що вона окрім робочого та допоміжного електродів містить електрод порівняння того ж складу, що і допоміжний електрод двоелектродної комірки, причому допоміжний електрод та електрод порівняння розділені другим сепаратором. 5 UA 82971 U Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Назва патенту англійськоюElectrochemical cell for determination of content of hydrogen sulfide in air
Автори англійськоюLiniucheva Olha Volodymyrivna, Kushmyruk Andrii Ivanovych, Kosohin Oleksii Volodymyrovych, Miroshnychenko Yulia Serhiivna, Liniuchev Oleksandr Hennadiiovych
Назва патенту російськоюЭлектрохимическая ячейка для определения содержания сероводорода в воздухе
Автори російськоюЛинючева Ольга Владимировна, Кушмирук Андрей Иванович, Косогин Алексей Владимирович, Мирошниченко Юлия Сергеевна, Линючев Александр Геннадиевич
МПК / Мітки
МПК: G01N 27/00
Мітки: визначення, вмісту, електрохімічна, повітрі, сірководню, комірка
Код посилання
<a href="https://ua.patents.su/8-82971-elektrokhimichna-komirka-dlya-viznachennya-vmistu-sirkovodnyu-v-povitri.html" target="_blank" rel="follow" title="База патентів України">Електрохімічна комірка для визначення вмісту сірководню в повітрі</a>
Попередній патент: Спосіб синтезу наногетероструктур “багатошарові вуглецеві нанотрубки – оксиди металів”
Наступний патент: Машина гичкозбиральна
Випадковий патент: Пристрій для індивідуального захисту живого організму від виробничої монотонії і шуму