Застосування ротиготину для лікування і профілактики синдрому паркінсона (плюс)
Формула / Реферат
1. Застосування ротиготину, його солей і проліків для приготування медикаменту, призначеного для профілактики і/або лікування синдрому Паркінсона (плюс), де проліками ротиготину є, зокрема, похідні фенольної гідроксигрупи, зокрема естери, наприклад арилкарбонільні естери, алкілкарбонільні естери або циклоалкілкарбонільні естери, зокрема алкілкарбонільні естери та циклоалкілкарбонільні естери, кожний з яких має до 6 атомів карбону, карбонати, карбамати, ацеталі, кеталі, ацилоксіалкілові етери, фосфати фосфонати, сульфати, сульфонати, тіокарбонільні естери, окситіокарбонільні естери, тіокарбамати, етери та силілетери.
2. Застосування за п. 1, яке відрізняється тим, що синдром Паркінсона (плюс) вибрано з групи, яку складають: мультисистемні атрофії, прогресивний супрануклеарний параліч, кортикогангліонна дегенерація і слабоумство з тілами Леві.
3. Застосування за будь-яким з попередніх пунктів, яке відрізняється тим, що синдром Паркінсона (плюс) характеризується відсутністю реакції на L-допа.
4. Застосування за будь-яким з попередніх пунктів, яке відрізняється тим, що медикамент призначено для парентерального, трансдермального або трансслизового введення пацієнту.
5. Застосування за будь-яким з попередніх пунктів, яке відрізняється тим, що ротиготин вводять пацієнту дозою 0,05-50 мг на день.
6. Застосування за п. 1, яке відрізняється тим, що проліками є алкілкарбонільний естер, який має до 6 атомів карбону.
7. Застосування за будь-яким з попередніх пунктів, яке відрізняється тим, що медикамент призначено для трансдермального введення пацієнту.
8. Застосування за п. 7, яке відрізняється тим, що фармацевтичну форму вибрано з групи, яку складають мазь, пасти, аерозоль, плівка, пластир або іонофоретичний пристрій.
9. Застосування за п. 7, яке відрізняється тим, що фармацевтичною формою є пластир.
Текст
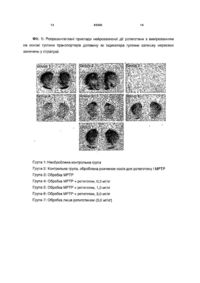
1. Застосування ротиготину, його солей і проліків для приготування медикаменту, призначеного для профілактики і/або лікування синдрому Паркінсона (плюс), де проліками ротиготину є, зокрема, похідні фенольної гідроксигрупи, зокрема естери, наприклад арилкарбонільні естери, алкілкарбонільні естери або циклоалкілкарбонільні естери, зокрема алкілкарбонільні естери та циклоалкілка C2 2 UA 1 3 85583 Мультисистемні атрофії належать до певного синдрому Шай-Дрегера, олівомос-томозжочкової атрофії (OPCA) і стрітонігральної дегенерації (SND) [Mark et al, Neurol CNn. 2001, 19(3): 607]. Віднесення хвороби Піка, геміпаркінсонізму і паркінсонізму до альцгеймерових і ALS пацієнтів і вестфальського варіанту хореї Хантингтон у до PPS не є однорідним у літературі, але у випадку даної заявки ці хвороби слід розглядати як об'єднані терміном PPS згідно з класифікацією Хобсона та др. [Hobson et al, Can J Neurol ScL 2003 Маг; 30 Suppl 1:р2]. 4 Спільним для хвороб, об'єднаних терміном синдром Паркінсона (плюс), є відсутність або швидке зниження реакції на L-допа або агоністів допаміну і наявність таких додаткових симптомів, як мозжочкові або пірамідальні ознаки, раннє або глибоке слабоумства у сполученні з розладами мови ковтання'у ранній фазі [Mark 2001, supra; Ger-lach et al, Die Parkinson-Krankheit, Springer, Vienna New York, 2003]. Таблиця 1 дає огляд діференційнодіагностичних критеріїв для декількох синдромів Паркінсона (плюс) і хвороби Паркінсона (ідіопатичного синдрому Паркінсона, IPS). Таблиця 1 Огляд класифікації деяких симптомів паркінсоноподібних розладів руху і диференційно-діагностичних характеристик Ригор/акінезія Мозжочкові ознаки Пірамідальні ознаки Постуральна нестабільність Слабоумство Окуломоторні розлади Дисфагія Ретроколіс Розлади сфінктера Імпотенція Синдром Паркінсона (плюс) Мульти-системна атрофія CBD SND OPCA ++ + ++/+++ + ++ ++ ++ + + + + + (+) + + ++ + + + + ++ PSP ++/+++ + +++ + +++ ++ ++ + IPS ++/+++ + + + + + SND: стріатонігральна дегенерація OPCA: олівомостомозжочкова атрофія CBD: кортикобазальна дегенерація PSP: прогресивний супрануклеарний параліч IPS: ідіопатичний синдром Паркінсона [Моди фіковано згідно з Mark MH, Об'єднання і розрізнення синдромів Паркінсона (плюс): слабоумство з тілами Леві, мультисистемна атрофія, прогресивний супрануклеарний параліч і кортикобазальна гангліонна дегенерація. Neurol CHn. 2001 Aug; 19(3): 607-27 і Gerlach M, Reichmann H, Riederer P, Die Parkinson-Krankheit, Springer Vienna New York, 2003]. Комп'ютерна томографія є важливим критерієм для диференціації між IPS і PPS. Пацієнти з IPS мають нормальні рівні рецептора допаміну у SPECT до пізніх стадій, а пацієнти з PPS показують ранню втрату пре- і постсинаптичних допамінергічних нейронів, що пов'язане з розпізнаним зниженням густини рецепторів гістаміну. РЕТаналіз підтверджує знижені вміст L-допа і метаболізм L-допа у пацієнтів з IPS (Gerlach et al., 2003, supra). Відсутність або слабкість реакції на L-допа ускладнює препаративне лікування PPS і взагалі призводить до симптоматичної терапії для деяких симптомів, наприклад, гіпотонії. Агоністи рецептора допаміну звичайно є малоефективними у лікуванні PPS (Mark, 2001, supra). Згідно з повідомленнями про певний терапевтичний успіх з індивідуальними агоністами до паміну, у деяких випадках дія є субстанційно залежною. Wenning et al (Lancet, 2004, 3, 93) повідомляють про терапевтичний успіх бромкриптину при лікуванні шести пацієнтів, але контрольне лікування лізуридом не дало результатів. Оскільки, як відомо, більшість агоністів допаміну не діють на один одиночний рецептор допаміну, але мають складний рецепторний профіль [Newman-Tancredi, J Pharmacol Exp Ther 2002, 303, 805], ефективність бромкриптину може бути з умовлена спеціальними властивостями рецепторного профілю або іншими не характеризованими властивостями, пов'язаними з субстанцією. Синдром Паркінсона (плюс) звичайно пов'язаний з допамінергічною нейродегенерацією у substantia nigra (Mark, 2001, supra). Отже, успішної терапії можна чекати від застосування ефективних нейропротекторів, які інгібують прогресивну деградацію допамінергічних нейронів [Dawson and Dawson VL, Nat Neurosci. 2002 Nov; 5 Suppl: 1058]. Ротиготин [(-)-5,6,7,8-тетрагідро-6-[пропіл[2-(2тієніл)етил]аміно]-1-нафтол] є відомим як агоніст допаміну і використовується у симптоматичній терапії проти хвороби Паркінсона. [У WO 02/089777] описано, наприклад, трансдермальне введення паркінсонівським пацієнтам 5 85583 ротиготину і пов'язане з цим поліпшення UPDRS (Уніфікована шкала показників хвороби Паркінсона). Це було описано і іншими авторами [Metman et al, CNn Neu-ropharmacol. 2001, 24(3): 163: Mucke НА, Rotigotin Schwarz Pharma. IDrugs. 2003 Sep; 6(91:894; Parkinson Study Груп, Arch Neurol. 2003 60(121:1721]. Показник UPDRS є важливим інструментом діагностики або лікування пацієнтів з хворобою Паркінсона [Fahn S, Elton RL, Members of UPDRS Development Committee (1987) Unified Parkinson's disease Rating Scale. In: Fahn, S, CD Marsden, DB Calne, M Goldstein (eds) Recent Developments in Parkinson's disease. VoI II. Macmillan Healthcare Information, Florham Park (NJ), pp 153-163, 293304]. Однак, показник UPDRS лише визначає результат дії активної субстанції на симптоми хвороби Паркінсона і не дає інформації про вплив активної субстанції на руйнування допамінергічних клітин, яке є основою симптомів. Апоптичні процеси грають важливу роль у патогенезі синдрому Паркінсона (плюс), зокрема, у тому, що стосується руйнування допамінергічних клітин [Lev et al, Prog Neuropsychopharmacol Biol Psychiatry. 2003; 27(2): 245; Michel et al, Rev Neurol (Paris). 2002; 158 Spec no 1: p 24]. Крім того, вважають, що на розвиток паркінсонізму і синдрому Паркінсона (плюс) дуже впливають інші нейродегенеративні процеси [Hirsch et al, Ann N Y Acad ScL 2003; 991.: 214]. 6 Отже, існує потреба у нейропротекторах, здатних припинити або навіть обернути руйнування допамінергічних клітин [Vila et al, Nat Rev Neurosci. 2003; 4(5): 365]. Тут розглядається модель MPTP для прогнозування нейрозахисних властивостей [Dawson, 2002, supra; Eberhardt O, Schulz JB, Toxicol Lett. 2003, 139(2-3): 135]. Експерименти несподівано показали, що ротиготин, який досі використовували лише для симптоматичної терапії ідіопатичної хвороби Паркінсона, має нейрозахисні властивості. Ротиготин несподівано показав бажаний фармакологічний профіль у моделі як гострої, так і субгострої MPTPI (Табл. 2, Фіг.1 і 2). Результати досліджень показали, що ротиготин відвертає апоптичні процеси. Наприклад, ротиготин показав нейрозахисну дію у моделі Паркінсона на мишах: після гострої MPTP, яка викликає симптоми Паркінсона у людей і мавп. Була виміряна кількість дегенеративних нейронів у гострій фазі і була встановлена функціональна цілісність стріатуму у субгострій фазі через визначення густини транспортерів допаміну термінальних кінцях нейронів. Було показано, що в обох випадках ротиготин проявив нейрозахисну дію: з одного боку кількість дегенеративних нейронів у середньому мозку знизилась після введення ротиготину (Table 2), і, з іншого боку, допамінергічна іннервація стріатума була повністю збережена або відновлена (Фіг.1 і 2). Таблиця 2 Кількість дегенеративних нейронів у моделі Паркінсона на мишах, показана з контрастуванням за допомогою FluoroJade без лікування і з лікуванням одним введенням ротиготину Група 1: Контрольна, оброблена носієм 2: Інтоксикація MPTP 3: Інтоксикація MPTP+ротиготин 0,3мг/кг 4: Інтоксикація MPTP+ротиготин 1,0мг/кг 5: Інтоксикація MPTP+ротиготин 3,0мг/кг 6: МРТР-носій+ротиготин 3,0мг/кг Кількість дегенеративних нейронів Стандартне відхилення 2,0 2,4 73,5 34,0 66,7 30,5 76,8 41,6 34,9 31,9 3,8 4,3 Нейрозахисна дія ротиготину була також досліджена на мавпах у пілотному дослідженні. У цій моделі, яка відображає прогресуюче руйнування допамінергічних клітин у приматів, мавпам (макакам) ін'єкцією вводили субпорогові токсичні дози MPTP протягом декількох днів. Через приблизно 2 тижні у моделі з'являлись паркінсонівські симптоми 2. Після досягнення певного рівня руйнування вводили щоденні ін'єкції ротиготинових рецептур, які збільшили рівень плазми через 24 год. Ін'єкції MPTP були припинені, коли моторна активність у контрольній групі знизилась до певного рівня (приблизно через 5 днів). Поведінку тварин оцінювали щоденно. Через 6 тижнів після початку введення MPTP ін'єкції ротиготину були припинені і тварин спостерігали протягом ще 2 тижнів без лікування. Було відзначено значне поліпшення моторної активності тварин, що пройшли лікування, і у подальшій фазі вимивання. Наприкінці лікування ротиготином або фази вимивання у кожному випадку одну групу тварин умертвляли і гістологічно і біохімічно вивчали стан базальних гангліїв. Густина нервових закінчень у стріатумі була значно вищою, ніж ця густина у тварин, що не отримали лікування. Вміст препроенкефаліну, що є показником непошкоджених перехресних зв'язків у "непрямому шляху" базальних гангліїв, показав тенденцію до нормалізації після лікування і після фази вимивання. Результати показують, що нейрозахисний потенціал ротиготину може бути підтверджений руйнуванням допамінергічних клітин на моделях приматів. Отже, можна дійти висновку, що існує антиапоптична, нейрозахисна дія також і у людини. Таким чином, ротиготин є активною субстанцією, яка ідеально підходить для виготовлення медичних препаратів, призначених для лікування і/або профілактики втрати допамінергічних нейро 7 85583 нів у пацієнтів з синдромом Паркінсона (плюс), оскільки на додаток до нейрозахисної дії допамінергічна дія ротиготину також може бути корисною. У порівнянні з попереднім застосуванням ротиготин, яке було обмежене чисто симптоматичним допамінергічним лікуванням пацієнтів з хворобою Паркінсона, лікування пацієнтів з синдромом Паркінсона (плюс) можна розглядати як нову область застосування, причому також для пацієнтів що не реагують або реагують неадекватно на лікування L-допа або агоністами допаміну без нейрозахисної дії. Отже, одним з аспектів винаходу є застосування ротиготину, його солей і проліків як медикаментів для профілактики і/або лікування синдрому Паркінсона (плюс), де термін синдром Паркінсона (плюс) включає такі хвороби: мультисистемні атрофії, прогресивний супрануклеарний параліч, кортикобазальна дегенерація, слабоумство з тілами Леві, хвороба Піка, геміпаркінсонізм, паркінсонізм у пацієнтів з хворобами Альц-геймера і ALS і вестфальський варіант хореї Хантингтона. Хвороби, які можна лікувати ротиготином бажано вибирати з групи, яку складають мультисистемні атрофії, прогресивний супрануклеарний параліч, кортикобазальна дегенерація, дифузне слабоумство з тілами Леві. Іншим аспектом винаходу є спосіб лікування пацієнтів з синдромом Паркінсона (плюс) введенням терапевтично достатньої кількості ротиготину, його солей і/або проліків або введенням медикаменту, що містить ротиготин або одну з його солей і/або проліки. Тут "проліками" ротиготину є сполуки, які розщеплюються, перетворюються або метаболізуються у тілі людини, зокрема, у плазмі, або після проходження через шкіру або слизову мембрану з перетворенням у терапевтично ефективну кількість ротиготину. Ротиготин має формулу Отже, проліки ротиготину є, зокрема, похідними фенольної гідроксигрупи, зокрема, естерами, наприклад, арилкарбонільними естерами, алкілкарбонільними естерами або циклоалкілкарбонільними естерами, зокрема, алкілкарбонільними естерами і циклоалкілкарбонільними естерами, кожний з яких має до 6 атомів карбону, карбонатами, карбаматами, ацеталями, кеталями, ацилоксиалкілетерами, фосфатами, фосфонатами, сульфатами, сульфонатами, тіокарбонільними естерами, окситокарбонільними естерами, тіокарбаматами, етерами і силілетерами. 8 Термін "алкілкарбонільні естери" включає сполуки, в яких атом оксигену ротиготи-ну у кожному випадку з'єднаний з -С(О)-алкільною групою. Алкілкарбонільний естер отримують естерифікацією фенольної гідроксигрупи алкановою кислотою, наприклад, оцтовою кислотою, пропіоновою кислотою, бутировою кислотою, ізобутировою кислотою або валеріановою кислотою. Термін "циклоалкілкарбонільні естери" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з -С(О)-циклоалкільною групою. Термін "арилкарбонільні естери" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з -С(О)-арил груп. Термін "карбонати" включає сполуки, в яких у кожному випадку атом оксигену of ротиготину з'єднаний з -C(O)-O-R груп. Термін "карбамати" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -C(O)-NRRI, -C(O)-NH-RI або -C(O)NH2. Термін "ацеталі" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -CH(OR)RL Термін "кеталі" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -C(OR)RI R2. Термін "ацилоксиалкілетери" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -CHR-O-C(O)-RI або групою -CH2-O-C(O)-RL Термін "фосфати" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -P(O2H)OR. Термін "фосфонати" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -P(O2H)R. Термін "сульфати" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -S(O)2OR. Термін "сульфонати" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -S(O)2R. Термін "тіокарбонільні естери" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -C(=S)-R. Термін "окситіокарбонільні естери" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -C(=S)-O-R. Термін "тіокарбамати" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -C(=S)-N-RR1, -C(=S)-NH-R1 або C(=S)-NH 2. Термін "етери" включає сполуки, в яких у кожному випадку атом оксигену ротиготину з'єднаний з групою -R. У цих визначеннях проліків кожна з R, R1, R2 незалежно вибрана з сукупності, яку складають гідроген, алкіл, циклоалкіл або арил, і, бажано, С16-алкільна група, С3-10-циклоалкільна група і феніл. "Алкіл" може бути розгалуженою або нерозгалуженою алкільною групою, яка, бажано, має 1-10 атомів C, більш бажано, 1-6 атомів C. Алкільні гру 9 85583 пи можуть бути заміщені одним або більше замісниками, наприклад, галогеном. "Циклоалкіл" є алкільною групою, яка може складатись з чистих кільцеутворюючих атомів C або, як варіант, може мати додаткові відгалужені атоми C. Бажана довжина ланцюга становить 310, більш бажано, 4-8 або 4-6 атомів C. "Арил" є, бажано, фенілом, який, як варіант, може бути заміщений в одній або більше позиціях, наприклад, алкокси, алкілом, галогеном або нітро. Фахівцям відома реакція ротиготину з відповідними реагентами-попередниками, наприклад, кислотними хлоридами, кислотними ангідридами, карбамілхлоридами, сульфонілхлоридами тощо, і дані можуть бути знайдені у відповідній літературі [див., наприклад, Bundgaard: Design of Prodrugs, Elsevier, Amsterdam, 1985; Higuchi і Stella: Prodrugs as novel drug delivery systems in American Chemical Society, Washington DC, 1975; Sloan: Prodrugs - Topical і Ocular Drug Delivery, Ed: M. Dekker, 1992; Roche: Design of biopharmaceutical properties through prodrugs і analogs, Washington, DC, 1977.] Різні проліки рацемату ротиготину (N-0437) і відповідні інструкції з виготовлення, а також методи аналізу описано, наприклад, у [Den Haas et al, Naunyn-Schmiedeberg's Arch Pharmacol 1990, 342, 655; Den Haas et al, Naunyn-Schmiedeberg's Arch Pharmacol 1990, 341, 186 і Den Haas et al, J Pharm Pharmacol 1991, 43.11.] Придатність похідних ротиготину як проліків може бути визначена інкубуванням сполуки у певних умовах з сумішшю ензимів, клітинним гомогенатом або ензимовмісною клітинною фракцією і демонструванням того, що ротиготин може бути отриманий у достатній кількості. Придатною ензимною сумішшю є, наприклад, суміш, що міститься у препараті печінки S9 від компанії Firma Gentest, Woburn, Ma, USA (Приклад 5). В іншому варіанті інкубація з свіжою кров'ю або плазмою, або навіть гомогенатом епідерми може показати незалежну від печінки метаболізацію проліків для утворення активного компонента. Трансдермальне застосування потребує перевірки проникнення через надріз шкіри in vitro. Остаточне визначення придатності і потенційної ефективності у медичних моделях здійснюється виявленням ротиготину, утвореного з проліків у плазмі: in vivo проліки мають вивільняти достатньо ротиготину для досягнення терапевтично ефективної сталої концентрації ротиготину у плазмі, як це відомо з клінічних або преклінічних досліджень. Ефективними концентраціями ротиготину взагалі є концентрації у межах 0,01-50нг/мл, бажано, 0,0520нг/мг, найкраще 0,1-10нг/мл у плазмі. Ротиготин є (S)-енантіомером 5,6,7,8тетрагідро-6-[пропіл[2-(2-тієніл)етил] аміно]-1нафтолу. Це означає, що, згідно з винаходом, вміст (R)-енантіомерів у медикаменті є низьким. Вміст (R)-енентіомеру у медикаменті має становити, бажано, менше 10моль%, більш бажано, менше 2моль%, найкраще менше 1% від кількості ротиготину. Ротиготин і його проліки можуть бути присутні у медикаменті як вільні основи або у формі фізіо 10 логічно прийнятних солей, наприклад, у формі гідрохлориду. "Фізіологічно прийнятні солі" включають нетоксичні адитивні солі ротиготину, утворені з органічними або неорганічними кислотами, наприклад, HCI. Існують різні способи застосування, придатні для введення ротиготину і його проліків, які можуть бути вибрані фахівцем і пристосовані згідно з вимогами, станом і віком пацієнта, потрібною дозою і інтервалом між введеннями. Бажаним способом введення ротиготину пацієнту є трансдермальний. У принципі фармацевтична форма може бути вибрана з групи, яку складають, наприклад, мазь, паста, аерозоль, плівка, пластир або іонтофоретичний пристрій. Бажаною формою ротиготину є пластир на шкіру, в якому активна субстанція зберігається у матриці адгезивного полімеру, наприклад, адгезивного полісилоксану. Приклади трансдермальних рецептур можна знайти у [WO 99/49852, WO 02/89777, WO 02/89778, WO 04/58247, WO 04/12730, WO 04/12721 або WO 04/50083]. Фармацевтична форма такого типу дозволяє досягти високого постійного рівня плазми і, отже, постійної допамінергічної стимуляції протягом усього інтервалу застосування [WO 02/89778; Metman, Clinical Neuropharmacol 24, 2001, 163]. Якщо бажаним є медичний продукт у формі підшкірної або внутрішньом'язової ін'єкції, ротиготин можна, наприклад, суспендувати як сольові кристали, наприклад, у формі кристалічного гідрохлориду у гідрофобному безводному середовищі і вводити ін'єкцією, як це описано у [WO 02/15903], або вводити у формі мікрокапсул, мікрочасток або імплантату на основі полімерів, здатних до біодеградації, як це описано, наприклад, у [WO 02/38646]. Іншими формами, придатними для введення ротиготину і його проліків є транс-слизові рецептури, наприклад, під'язичні або носові аерозолі, ректальні рецептури або аерозолі для введення у легені. Можливі дози ротиготину лежать у межах від 0,05 до приблизно 50мг/день, бажано, від 0,1 до 40мг/день, зокрема, від 0,2 до 20мг/день. Дозу можна поступово збільшувати, тобто лікування, як варіант, можна починати з низьких доз і потім підвищува ти до потрібного рівня. Зрозуміло, що інтервал між дозами може бути змінним залежно від застосованої кількості, способу введення пацієнту і денної потреби пацієнта. Наприклад, рецептуру для трансдермального застосування можна вводити один раз на день протягом трьох або семи днів, а при підшкірному або внутрішньом'язовому застосуванні можна, наприклад, проводити ін'єкції згідно з одно-, дво- або чотиритижневим циклом. У нейрозахисних фармацевтичних формах на додаток до ротиготину можуть бути застосовані і інші активні інгредієнти, які відвертають прогресивну втрату допамінергіч-них клітин. Приклади включають субстанції з антиапоптичною дією (міноцикліни, FK-506, циклоспорин A, 11 85583 zVAD) і нейротрофіни, наприклад, нейротропічний фактор, отриманий з гліальних клітин (GDNF). У комбінованій рецептурі вивільнення активних субстанцій у кожному випадку може відбуватись у значній мірі одночасно або навіть у послідовності. Послідовне введення може бути забезпечено, наприклад, такою фармацевтичною формою, як, наприклад, пероральна таблетка, яка має два шари з різними профілями вивільнення для різних фармацевтично активних компонентів. Комбінована ротиготинова рецептура згідно з винаходом може мати форму "комплекту компонентів", в якому антиаптотичні активні субстанції, призначені для введення, присутні у відмінних одна від одної рецептурах, які вводять одночасно або у певній часовій послідовності. Зрозуміло, що всі різні можливі фармацевтичні форми і режими застосування входять в об'єм винаходу. Приклади втілень: Приклад 1: ротиготинові пластирі 1,8г ротиготину (вільна основа) розчиняють у 2,4г етанолу і додають до 0,4г KoIlidon 90F (розчин у 1г етанолу). Цю суміш додають до 74%-го розчину силіконових полімерів (8,9г BioPSA 7-4201+8,9г BIO-PSA 7-4301 [Dow Corning]) у гептані. Після додання 2,65 г петролейного етеру суміш перемішують 1 год. при 700 об./хвил. і отримують гомогенну дисперсію. Після ламінування на поліестері і сушіння при 50°C кінцева маса пластира становить 50г/см 2. Приклад 2: ротиготинові суспензії (a) 1411,2г Miglyol 812 зважують у колбі Дюрана. Додають 14,4г Imwitor 312 і гріють протягом 30хвил. з перемішуванням при 80°C. Прозорий розчин охолоджують до кімнатної температури і фільтрують. (b) 1188г отриманого розчину (а) завантажують у скляний лабораторний реактор, додають 12г ротиготин HCI і гомогенізують протягом 10хвил. на Ultraturrax при 10000об./хвил. під нітрогеном. Суспензію вносять у коричневу скляну колбу при діючому Ultraturrax (2000об./хвил.). Приклад 3: субгостра модель з MPTP Щоб викликати інтоксикацію, мишам вводили 80мг/кг нейротоксину 1-метил-4-феніл-1,2,3,6тетрагідропіридину (MPTP) (порціями по 20мг/кг з двогодинним інтервалом, групи 3-6 на Фіг.1 і 2). Це призводить до дегенерації приблизно 50-60% нейронів substantia nigra (максимальна дегенерація - у групі 3 на Фіг.1 і 2). Ротиготин вводили щоденно дозами 0,3, 1 або 3мг/кг протягом 7 днів у формі так званої "рецептури з повільним вивільненням" (див. Приклад 2) (групи 4-6 на Фіг.1 і 2). Групі тварин, оброблених MPTP (гр упа 3) давали розчин ротиготину у носії (див. Приклад 2 без ротиготинHCl) і використовували як еталон. Контрольними є групи 1, 2 і 7, причому група 1 не отримувала лікування, група 2 отримала обробку носійними розчинами MPTP і ротиготину і група 7 отримала ли 12 ше ротиготин. Тварин вбили на 8 день, їх мозки видалили і заморозили. Заморожені секції інкубували з 100 1/млн.[125І] РЕ21 ([1251]-(Е)-N(3йодопроп-2-еніл)-2β-карбоксиметил-3β-(4'метилфеніл)-нортропан) у фосфатному буфері (рН 7,4), щоб визначити кількість транспортерів допаміну, ще присутніх у стріатумі, як індикатор функціонуючих нервових закінчень. Ротиготин сприяє виживанню нейронів і нейронних закінчень залежно від дози. Цим підтверджуються нейрозахисні властивості цієї субстанції (Фіг.1 і 2). Приклад 4: гостра модель MPTP (включаючи апоптоз) Щоб викликати інтоксикацію, мишам вводять 80мг/кг нейротоксину 1-метил-4-феніл-1,2,3,6тетрагідропіридину (MPTP) (порціями по 20мг/кг з двогодинним інтервалом, групи 3-6 на Фіг.1 і 2). Це призводить до дегенерації приблизно 50-60% нейронів substantia nigra (максимальна дегенерація - у групі 3 на Фіг.1 і 2). Приблизно за 16год. до цього вводять ротиготин щоденно дозами 0,3, 1 або 3мг/кг протягом 7 днів у формі так званої "рецептури з повільним вивільненням". Латентність дифузії і абсорбції означає, що ротиготин оптимально засвоюється при доданні MPTP. Тварини, що отримали лише розчин носія (див. Приклад 2, без ротиготин+НСІ) є контрольними. Через 24год. тварини були вбиті і мозки зафіксовані. Секції мозку мітили FluoroJade для виявлення дегенерованих клітин. Для ідентифікації допамінергічних нейронів було використане імуногістохімічне мічення тирозингідроксилазою. Це мічення не виявило різниці між обробленими і не обробленими тваринами; мічення FluoroJade виявило велику кількість дегенерованих нейронів, однак, нейрони не були повністю видалені (цим пояснюється відсутність різниці між мітками тирозингідроксилази). Це вказує на апоптичність руйнування клітин, яке не завершилось у момент вимірювання (апоптичні клітини не були повністю розчинені або фагоцитовані). Кількість дегенерованих нейронів було приблизно на 50% нижчою після застосування ротиготин, що додатково підтверджує його нейрозахисні властивості (Табл. 2). Приклад 5: перетворення проліків в активну субстанцію in vitro Мікросомну фракцію, що містить головні метаболічні ензими, отримали з гомогенатів клітин печінки людини, мавп, собак, щурів і/або мишей диференційним центрифугуванням; можна також отримати цитоплазмову фракцію. Субклітинну фракцію суспендували з буфером таким чином, щоб отримати розчин з визначеним вмістом протеїну. Після додання 1мкМ проліків, що підлягали тесту, вони були інкубовані при 37°С протягом 60хвил. Потім ротиготин квантифікували за допомогою РХВР/УФ або РХВР/МС і застосували згідно з квантифікацією. Для більш детального аналізу були вивчені концентраційні або часові послідовності. 13 85583 14 15 Комп’ютерна в ерстка Н. Лисенко 85583 Підписне 16 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of rotigotine for preventing and treating parkinson's plus syndrome
Автори англійськоюScheller Dieter
Назва патенту російськоюПрименение ротиготина для профилактики и лечения синдрома паркинсона (плюс)
Автори російськоюШеллер Дитер
МПК / Мітки
МПК: A61K 31/381, A61P 25/00
Мітки: паркінсона, синдрому, застосування, плюс, профілактики, ротиготину, лікування
Код посилання
<a href="https://ua.patents.su/8-85583-zastosuvannya-rotigotinu-dlya-likuvannya-i-profilaktiki-sindromu-parkinsona-plyus.html" target="_blank" rel="follow" title="База патентів України">Застосування ротиготину для лікування і профілактики синдрому паркінсона (плюс)</a>
Попередній патент: Конструкція свердловинного заряду вибухової речовини і спосіб її формування
Наступний патент: Спосіб оборотного перетворення електроенергії в теплоту