Поліморфні форми трет-бутилового ефіру аторвастатину та їхнє використання як проміжних сполук для одержання аторвастатину
Номер патенту: 86059
Опубліковано: 25.03.2009
Автори: Зупет Рок, Йаксе Рената, Стімац Антон, Смрколй Матей, Грцман Марія
Формула / Реферат
1. Кристалічна форма 1 трет-бутилового ефіру аторвастатину формули (II),
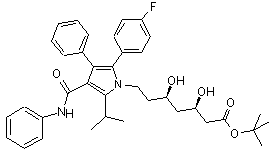 , (II)
, (II)
яка відрізняється наявністю в порошковій рентгенодіфрактограмі піків при значеннях кута 2-тета: 6,10°, 6,83°, 10,77°, 17,01° ±0,1°.
2. Кристалічна форма 1 за п. 1, яка відрізняється наявністю в порошковій рентгенодифрактограмі піків при значеннях кута 2-тета: 6,10°, 6,83°, 10,77°, 12,18°, 16,20°, 17,01°, 17,65°, 19,07°, 19,80°, 21,25°, 21,64°, 23,70°, 27,60° ±0,1°.
3. Кристалічна форма 1 трет-бутилового ефіру аторвастатину (II), яка відрізняється тим, що має криву, диференціальну скануючій калориметрії (ДСК), зображену на Фіг. 3, з початковою температурою близько 97 °С.
4. Спосіб одержання кристалічної форми 1, вказаної у будь-якому із пп. 1-3, в якому проводять:
розчинення будь-якої форми диметилкеталю трет-бутилового ефіру аторвастатину формули (І)
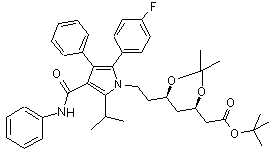 (І)
(І)
у розчиннику, що змішується з водою, і
додавання водяного розчину кислоти, переважно НСl, при температурі 10-50 °С, переважно при 10-40 °С, найбільш переважно при кімнатній температурі.
5. Спосіб за п. 4, в якому додатково продовжують взаємодію диметилкеталю трет-бутилового ефіру аторвастатину (І) з кислотою протягом 3-24 год. при тій же температурі до завершення реакції.
6. Спосіб за п. 5, що додатково включає додавання води до реакційної суміші після завершення реакції з осадженням трет-бутилового ефіру аторвастатину (II).
7. Спосіб за п. 6, де об'єм води, що додається до реакційної суміші, більший, ніж об'єм розчинника, що змішується з водою.
8. Спосіб за п. 6 або 7, де об'єм води, що додається до реакційної суміші, більший, ніж об'єм реакційної суміші.
9. Спосіб за будь-яким із пп. 4-8, де розчинник, що змішується з водою, і водяний розчин кислоти використовують у співвідношенні 10:1, переважно 6:1, і найбільш переважно 4:1 (за об'ємом).
10. Спосіб за будь-яким із пп. 4-9, де розчинником, що змішується з водою, є ацетонітрил.
11. Кристалічна форма 2 трет-бутилового ефіру аторвастатину формули (II)
 , (II)
, (II)
яка відрізняється наявністю в порошковій рентгенодіфрактограмі піків при значеннях кута 2-тета: 6,48°, 12,15°, 17,21°, 18,34°, 20,18°, 20,47°, 24,45°±0,1°.
12. Кристалічна форма 2 за п. 11, що відрізняється наявністю в порошковій рентгенодіфрактограмі піків при значеннях кута 2-тета: 6,48°, 7,59°, 10,97°, 12,15°, 15,02°, 17,21°, 18,34°, 20,18°, 20,47°, 21,59°, 24,45°, 26,07°, 29,41°![]() 0,1°.
0,1°.
13. Кристалічна форма 2 трет-бутилового ефіру аторвастатину формули (II),
 , (II)
, (II)
яка відрізняється тим, що має криву ДСК, зображену на Фіг. 4, з початковою температурою близько 144 °С.
14. Спосіб одержання кристалічної форми 2 трет-бутилового ефіру аторвастатину, вказаної у будь-якому із пп. 11-13, в якому проводять:
розчинення будь-якої форми диметилкеталю трет-бутилового ефіру аторвастатину формули (І)
 (І)
(І)
у розчиннику, що змішується з водою,
додавання водяного розчину кислоти, переважно НСl, і
нагрівання суміші до 50-100 °С, переважно до температури кипіння суміші.
15. Спосіб за п. 14, в якому додатково продовжують взаємодію диметилкеталю трет-бутилового ефіру аторвастатину (І) з кислотою протягом 3-24 год. при тій же температурі до завершення реакції.
16. Спосіб за п. 15, що додатково включає додавання води до реакційної суміші після завершення реакції з осадженням трет-бутилового ефіру аторвастатину (II).
17. Спосіб за п. 16, де об'єм води, що додається до реакційної суміші, більший, ніж об'єм розчинника, що змішується з водою.
18. Спосіб за пп. 16-17, де об'єм води, що додається до реакційної суміші, більший, ніж об'єм реакційної суміші.
19. Спосіб за будь-яким із пп. 14-18, де розчинником, що змішується з водою, є ацетонітрил.
20. Спосіб за будь-яким із пп. 14-19, де розчинник, що змішується з водою, і водяний розчин кислоти використовують у відношенні 10 до 1, переважно 6 до 1, найбільш переважно 4 до 1 (за об'ємом).
21. Застосування кристалічної форми 1 за будь-яким із пп. 1-3 для одержання аторвастатину в будь-якій формі, наприклад аторвастатину у вигляді вільної кислоти, лактону аторвастатину або для одержання солі аторвастатину в аморфній або кристалічній формі або їхньої суміші.
22. Застосування кристалічної форми 2 за будь-яким із пп. 11-13 для одержання аторвастатину в будь-якій формі, наприклад аторвастатину у вигляді вільної кислоти, лактону аторвастатину або для одержання солі аторвастатину в аморфній або кристалічній формі або їхньої суміші.
23. Застосування за п. 21 або 22 для одержання гемі-кальцієвої солі аторвастатину.
24. Спосіб одержання будь-якої форми аторвастатину, переважно гемі-кальцієвої солі аторвастатину, при якому здійснюють:
- взаємодію кристалічної форми 1 за будь-яким з пп.1-3 або кристалічної форми 2 за будь-яким із пп. 11-13 з основою в суміші трет-бутилметилового ефіру, метанолу і води, де об'єм води більший, ніж об'єм трет-бутилметилового ефіру,
- додавання солі кальцію для утворення гемі-кальцієвої солі аторвастатину, і
- додавання води до реакційної суміші для осадження гемі-кальцієвої солі аторвастатину.
Текст
1. Кристалічна форма 1 трет-бутилового ефіру аторвастатину формули (II), C2 2 (19) 1 3 86059 F O OH N OH NH O O , (II) яка відрізняється тим, що має криву ДСК, зображену на Фіг. 4, з початковою температурою близько 144 °С. 14. Спосіб одержання кристалічної форми 2 третбутилового ефіру аторвастатину, вказаної у будьякому із пп. 11-13, в якому проводять: розчинення будь-якої форми диметилкеталю третбутилового ефіру аторвастатину формули (І) F O NH N O O O O (І) у розчиннику, що змішується з водою, додавання водяного розчину кислоти, переважно НСl, і нагрівання суміші до 50-100 °С, переважно до температури кипіння суміші. 15. Спосіб за п. 14, в якому додатково продовжують взаємодію диметилкеталю трет-бутилового ефіру аторвастатину (І) з кислотою протягом 3-24 год. при тій же температурі до завершення реакції. 16. Спосіб за п. 15, що додатково включає додавання води до реакційної суміші після завершення реакції з осадженням трет-бутилового ефіру аторвастатину (II). Даний винахід відноситься до нових кристалічних форм 1 і 2 третинного бутилового ефіру [R(R*,R*)]-2-(4-фторфеніл)-b,d-дигідроксі-5-(1метилетил)-3-феніл-4-[(феніламіно)карбоніл]-1Нпірол-1-гептанової кислоти формули (II), який далі називають «трет-бутиловим ефіром аторвастатіну (II)». Винахід також відноситься до способу одержання цих кристалічних форм, для якого як вихідний матеріал використовується третинний бутиловий ефір (4R-цис)-6-{2-[2-(4-фторфеніл)-5-(1 4 17. Спосіб за п. 16, де об'єм води, що додається до реакційної суміші, більший, ніж об'єм розчинника, що змішується з водою. 18. Спосіб за пп. 16-17, де об'єм води, що додається до реакційної суміші, більший, ніж об'єм реакційної суміші. 19. Спосіб за будь-яким із пп. 14-18, де розчинником, що змішується з водою, є ацетонітрил. 20. Спосіб за будь-яким із пп. 14-19, де розчинник, що змішується з водою, і водяний розчин кислоти використовують у відношенні 10 до 1, переважно 6 до 1, найбільш переважно 4 до 1 (за об'ємом). 21. Застосування кристалічної форми 1 за будьяким із пп. 1-3 для одержання аторвастатину в будь-якій формі, наприклад аторвастатину у вигляді вільної кислоти, лактону аторвастатину або для одержання солі аторвастатину в аморфній або кристалічній формі або їхньої суміші. 22. Застосування кристалічної форми 2 за будьяким із пп. 11-13 для одержання аторвастатину в будь-якій формі, наприклад аторвастатину у вигляді вільної кислоти, лактону аторвастатину або для одержання солі аторвастатину в аморфній або кристалічній формі або їхньої суміші. 23. Застосування за п. 21 або 22 для одержання гемі-кальцієвої солі аторвастатину. 24. Спосіб одержання будь-якої форми аторвастатину, переважно гемі-кальцієвої солі аторвастатину, при якому здійснюють: - взаємодію кристалічної форми 1 за будь-яким з пп.1-3 або кристалічної форми 2 за будь-яким із пп. 11-13 з основою в суміші третбутилметилового ефіру, метанолу і води, де об'єм води більший, ніж об'єм трет-бутилметилового ефіру, - додавання солі кальцію для утворення гемікальцієвої солі аторвастатину, і - додавання води до реакційної суміші для осадження гемі-кальцієвої солі аторвастатину. метилетил)-3-феніл-4-[(феніламіно)карбоніл]пірол1-іл]етил}-2,2-диметил-1,3-діоксан-4-оцтової кислоти формули (І), що далі називається «диметилкеталь трет-бутилового ефіру аторвастатіну (І)». Більш точно, винахід відноситься до використання цих нових поліморфних форм як проміжних сполук для одержання фармацевтично прийнятних солей аторвастатіну. Попередній рівень техніки Трет-бутиловий ефір аторвастатіну (II), відомий і важливий попередник для одержання інгібітору HMG-Coa (3-гідроксі-3-метилглутарилкоензим 5 А) редуктази аторвастатіну ([R-(R*,R*)]-2-(4фторфеніл)-b,d-дигідроксі-5-(1-метилетил)-3феніл-4-[(феніламіно)карбоніл]-1Н-пірол-1гептанової кислоти) і його солей, а також фармацевтично прийнятних ефірів. Ці речовини відносяться до класу ліків, що називаються «статинами». Статини придушують біосинтез холестерину за допомогою конкурентного інгібування 3-гідроксі3метилглутарил-коензиму А редуктази, що каталізує перетворення HMG-CoA у мевалонат, що є швидкість-визначальною стадією в біосинтезі холестерину. В даний час вони є найбільш терапевтично ефективними ліками, придатними для лікування гіперліпідемії і гіперхолестеринемії, що є факторами ризику для артеріосклерозу і коронарної хвороби серця. Способи одержання аторвастатіну і ключових проміжних сполук розкриті, наприклад, у Патентах США No.: 5 003 080; 5 097 045; 5 103 024; 5 124 482; 5 149 837; 5 155 251; 5 216 174; 5 245 047; 5 248 793; 5 280 126; 5 342 952; 5 397 792; 4 681 893; 5 273 995 і 5 298 627. Крім того, К.Л. Бауман зі співавторами описали одержання диметилкеталя трет-бутилового ефіру аторвастатіну (І) шляхом синтезу Пааля-Кнорра піролів з використанням суміші трьох розчинників толуол-гептан-тетрагідрофуран (1:4:1), що каталізується триметилоцтовою кислотою, і перетворення (І) у гемі-кальцієву сіль аторвастатіну без виділення яких-небудь проміжних продуктів [Tetrahedron Lett. 1992, 33, 2283-2284]. Аналогічну процедуру описали Петер В.К. By зі співавторами в J. Label. Compd. Radiopharm., 1999, vol. 42, part II, 135-145 і B.C. Чен зі співавторами в J. Label. Compd. Radiopharm., 2000, vol. 43, part III, 261-270. Також у WO 02/059087 описано пряме перетворення диметилкеталя трет-бутилового ефіру аторвастатіну (І) у некристалічну гемі-кальцієву сіль аторвастатіну або лактон аторвастатіну без виділення проміжних продуктів. X.T. Лі із співавторами описали в J. Label. Compd. Radiopharm., 1999, vol. 42, part II, 129-133 одержання трет-бутилового ефіру аторвастатіну (II) відновленням відповідного β-кетоефіру. В WO 02/083637 і WO 02/083638 розкрито, що обробка диметилкеталя трет-бутилового ефіру аторвастатіну (І) у метанолі водяним розчином соляної кислоти дає складну суміш, що містить 5 проміжних продуктів, як показано за допомогою ВЕРХ (високоефективної рідинної хроматографії). Процентний вміст і розподіл виявлених сполук у реакційній суміші розрізняється в залежності від умов реакції. Однак, жоден із проміжних продуктів, включаючи трет-бутиловий ефір аторвастатіну (II), не був виділений, а реакційний розчин був далі оброблений розведеним водяним розчином гідроксиду натрія. Більш того, в WO 02/43667 і WO 03/016317 також описані труднощі в процесі одержання гмікальцієвої солі аторвастатіну, зокрема на стадії перетворення диметилкеталя трет-бутилового ефіру аторвастатіну (І), використовуючи кислотний каталізатор, у трет-бутиловий ефір аторвастатіну (II). Як показано, продукт, що містить інші сполуки, такі як лактон аторвастатіну й аторвастатін у ви 86059 6 гляді вільної кислоти, був виділений, наприклад, у вигляді олії, що вказує на забруднення третбутилового ефіру аторвастатіну (II), отриманого таким способом. Таким чином, ці способи не забезпечують одержання трет-бутилового ефіру аторвастатіну (II) у вигляді чітко встановленої кристалічної форми з високим ступенем чистоти. Викладене вище показує, що способи, відомі з попереднього рівня техніки, не забезпечують одержання трет-бутилового ефіру аторвастатіну (II) у кристалічній формі, а отже, і з високим ступенем чистоти. Більш того, ці способи, відомі з попереднього рівня техніки, не приводять до утворення гемікальцієвої солі аторвастатіну з фільтруємістю і чистотою, прийнятною для одержання фармацевтичних составів, оскільки присутні домішки складно видалити. Отже, дотепер існує потреба в способі одержання аторвастатіну, зокрема у вигляді його гемікальцієвої солі з гарною фільтруємістю і високою чистотою, що робить його прийнятним для готування фармацевтичних составів. Крім того, існує необхідність у попередниках, що дозволяють просто одержувати поліморфні форми аторвастатіну і його фармацевтично прийнятних солей або перетворювати в інші форми аторвастатіну і його фармацевтично прийнятних солей. Перераховані проблеми вирішуються даним винаходом. Докладний опис винаходу По-перше, винахід відноситься до двох добре охарактеризованих поліморфних форм третбутилового ефіру аторвастатіну (II), позначених як кристалічна форма 1 і форма 2, що є чудовими проміжними сполуками для одержання аторвастатіну і його похідних, зокрема для одержання аморфної гемі-кальцієвої солі аторвастатіну. Ці дві поліморфні форми були охарактеризовані рентгенографією і диференціальною скануючою калориметрією (ДСК). Порошкова рентгенографія була виконана за допомогою дифрактометра Phillips PW 3040/60 X'Pert PRO, використовуючи випромінювання CuKa 1.541874Ǻ. ДСК проводили за допомогою скануючого калориметра PerkinElmer DSC 7. Зразки масою близько 3 мг сканували в нагрівальному режимі 10°С/хв в атмосфері азоту у відкритих алюмінієвих кюветах для ДСК. Кристалічна форма 1 трет-бутилового ефіру аторвастатіну (II) за винаходом характеризується рентгенодифрактограмою з піками при значеннях кута 2-тета: 6,10°, 6,83°, 10,77°, 17,01° ±0,1° Переважно, щоб на рентгенодифрактограмі були піки при значеннях кута 2-тета: 6,10°, 6,83°, 10,77°, 12,18°, 16,20°, 17,01°, 17,65°, 19,07°, 19,80°, 21,25°, 21,64°, 23,70°, 27,60° ±0,1° Характерна рентгенодифрактограма зразку кристалічної форми 1 приводиться в Таблиці 1 за допомогою перерахування градусів 2-тета разом з відповідними інтенсивностями. У таблиці "s" означає високу відносну інтенсивність (від 30 до 100%), 7 86059 а «m» означає середню відносну інтенсивність (від 10 до 30%). Таблиця 1 2q 6,10 6,83 10,77 12,18 16,20 17,01 17,65 19,07 19,80 21,25 21,64 23,70 27,60 Інтенсивність s s s m m s m m m m m m m Крім того, кристалічна форма 1 третбутилового ефіру аторвастатіну (II) за винаходом охарактерізована кривою ДСК, що приведена на Фіг.3, з початковою температурою близько 97°С. Кристалічна форма 2 трет-бутилового ефіру аторвастатіну (II) за винаходом охарактерізована методом порошкової рентгенографії і має рентгенодифрактограму з піками при значеннях кута 2тета: 6,48°, 12,15°, 17,21°, 18,34°, 20,18°, 20,47°, 24,45° ± 0,1° Переважно, щоб на рентгенодифрактограмі були піки при значеннях кута 2-тета: 6,48°, 7,59°, 10,97°, 12,15°, 15,02°, 17,21°, 18,34°, 20,18°, 20,47°, 21,59°, 24,45°, 26,07°, 29,41° ±0,1° Характерна рентгенодифрактограма зразку кристалічної форми 2 приводиться в таблиці 2 за допомогою перерахування градусів 2-тета разом з відповідними інтенсивностями. У таблиці «s» означає високу відносну інтенсивність (від 30 до 100%), а «m» означає середню відносну інтенсивність (від 10 до 30%). Таблиця 2 2q 6,48 7,59 10,97 12,15 15,02 17,21 18,34 20,18 20,47 21,59 24,45 26,07 29,41 Інтенсивність S m m s m s s s s m s m m Крім того, кристалічна форма 2 третбутилового ефіру аторвастатіну (II) за винаходом охарактерізована кривою ДСК, що приведена на Фіг. 4, з початковою температурою близько 144°С. 8 Фіг. 1 ілюструє порошкову рентгенодифрактограму форми 1 трет-бутилового ефіру аторвастатіну (II). Фіг. 2 ілюструє порошкову рентгенодифрактограму форми 2 трет-бутилового ефіру аторвастатіну (II). Фіг. 3 ілюструє криву ДСК форми 1 третбутилового ефіру аторвастатіну (II). Фіг. 4 ілюструє криву ДСК форми 2 третбутилового ефіри аторвастатіну (II). Кристалічну форму 1 трет-бутилового ефіру аторвастатіну (II) за винаходом одержують способом, що включає розчинення будь-якої форми диметилкеталя трет-бутилового ефіру аторвастатіну (І) у розчиннику, що змішується з водою, і додаванням водяного розчину кислоти при температурі від 10 до 50°С, переважно при температурі від 10 до 40°С, і найбільш переважно при кімнатній температурі. Кристалічну форму 2 трет-бутилового ефіру аторвастатіну (II) за винаходом, одержують способом, що включає розчинення будь-якої форми диметилкеталя трет-бутилового ефіру аторвастатіну (І) в розчиннику, що змішується з водою, і додаванням водяного розчину кислоти при температурі від 50 до 100°С, переважно при кип'ятінні суміші зі зворотним холодильником. У способі одержання форми 1 і форми 2 диметилкеталь трет-бутилового ефіру аторвастатіну (І), що використовується як вихідний матеріал, може знаходитися в будь-якій формі, наприклад, бути присутнім у реакційному розчині, у фільтраті, у будь-якій неочищеній, поліморфній, безводній, сольватованій або гідратній формі або їхніх сумішах, отриманих відповідно до будь-якого способу, відомого фахівцю, або описаного на попередньому рівні техніки. Розчинниками, що змішуються з водою, є, переважно, органічні розчинники, зокрема ацетонітрил, 1,2-диметоксиетан, тетрагідрофуран, нижчі спирти, такі як метанол, етанол, пропанол, ізопропанол і бутанол, або етилацетат. Найкращим розчинником є ацетонітрил. Крім того, найкращою кислотою є соляна кислота. Також переважно, щоб при одержанні форм 1 і 2 трет-бутилового ефіру аторвастатіну (II), розчинник, що змішується з водою, і водяний розчин кислоти використовували у співвідношенні 10 до 1, переважніше 6 до 1 і найбільш переважно 4 до 1 (за об'ємом). Більш того, ефективно проводити взаємодію диметилкеталя трет-бутилового ефіру аторвастатіну (II) з кислотою при встановленій температурі протягом 3-24 год. Цього часу реакції досить для завершення реакції. Нарешті, ефективним є додавання води до суміші після завершення реакції для того, щоб осадити трет-бутиловий ефір аторвастатіну. Переважно, щоб вода додавалася в більшому об'ємі в порівнянні з розчинником, що змішується з водою, і більш переважно в об'ємі більшому, ніж загальний об'єм реакційної суміші. Несподівано подібна специфічна процедура осадження приводить до продукту, який можна виділити з високим виходом і високою чистотою. 9 Це є істотною перевагою в порівнянні зі способами, відомими з попереднього рівня техніки і що приводять до складних реакційних сумішей. Відповідно до способу за винаходом, можливо значною мірою зменшити вміст стійких домішок. Так, чистота отриманого трет-бутилового ефіру аторвастатіну (II) звичайно складає більше 98%, переважно більше 99%. В іншому кращому втіленні, можливо також одержати кристалічну форму 2 трет-бутилового ефіру аторвастатіну (II) кристалізацією третбутилового ефіру аторвастатіну (II) з конкретного розчинника, обраного з етилацетата, метанолу, етанолу, ацетонітрилу та ізопропанолу. Кращим розчинником є ацетонітрил або ізопропанол. Кристалічні форми 1 і 2 за винаходом ідеально підходять у якості проміжних сполук для одержання будь-якої форми аторвастатіну, наприклад, аторвастатіну у вигляді вільної кислоти, лактону аторвастатіну або солі аторвастатіну, або похідних аторвастатіну. Переважно кристалічні форми 1 і 2 використовувати для одержання будь-якої форми солі аторвастатіну в аморфній або будь-якій поліморфній формі, а найбільш переважно - для одержання аморфної гемі-кальцієвої солі аторвастатіну. Таким чином, винахід також відноситься до способу одержання будь-яких форм аторвастатіну, переважно гемі-кальцієвої солі аторвастатіну, з використанням для цього кристалічної форми 1 або кристалічної форми 2. Спосіб переважно включає: - взаємодію кристалічної форми 1 або кристалічної форми 2 з основою в суміші третбутилметилового ефіру, метанолу і води, де об'єм води більший, ніж об'єм трет-бутилметилового ефіру. - додавання солі кальцію для утворення гемікальцієвої солі аторвастатіну, і - додавання води до реакційної суміші для осадження гемі-кальцієвої солі аторвастатіну. Основою може бути, зокрема, NaOH, а сіллю кальцію можуть бути, зокрема, хлорид кальцію або ацетат кальцію. Несподівано виявилося, що спосіб за винаходом позбавлений недоліків, властивим відомим способам, і забезпечує простий, відтворений і рентабельний спосіб одержання однородно аморфної гемі-кальцієвої солі аторвастатіну з високим ступенем чистоти. Більш того, спосіб забезпечує одержання продукту з надзвичайно гарною фільтруємістю внаслідок великого розміру часток. Це істотно полегшує відділення продукту, що може бути важливо для високого виходу і чистоти продукту. Таким чином, даний винахід забезпечує перетворення диметилкеталя трет-бутилового ефіру аторвастатіну (І) у трет-бутиловий ефір аторвастатіну (II) з високим ступенем чистоти, а також перетворення останнього в гемі-кальцієву сіль аторвастатіну з високим ступенем чистоти в некристалічній, зокрема аморфній, формі. Крім того, даний винахід також пропонує спосіб для одержання фармацевтичного складу, що містить гемі-кальцієву сіль аторвастатіну з висо 86059 10 ким ступенем чистоти, що була отримана з кристалічної форми 1 і 2 трет-бутилового ефіру аторвастатіну (II) за винаходом, у некристалічній, зокрема аморфній, формі. Винахід далі ілюструється прикладами. Приклади Одержання форми 1 третинного бутилового ефіру [R-(R*,R*)]-2-(4-фторфеніл)-b,d-дигідроксі-5(1-метилетил)-3-феніл-4-[(феніламіно)карбоніл]1Н-пірол-1-гептанової кислоти (II) конденсацією 4фтор-a-[2-метил-1-оксопропіл]-g-оксо-Ν,βдифенілбензенбутанаміду і третинного бутилового ефіру (4R-цис)-6-(2-аміноетил)-2,2-диметил-1,3діоксан-4-оцтової кислоти Приклад 1 До розчину 1,32 г третинного бутилового ефіру (4R-цис)-6-(2-аміноетил)-2,2-диметил-1,3-діоксан4-оцтової кислоти (4,8 ммоль, 1,2 еквів.) у суміші 9:1 гептану і толуолу (30 мл) послідовно додали 0,49 г 2-метилмасляної кислоти (0,52 мл, 4,8 ммоль, 1,2 еквів.) і 1,66 г 4-фтор-a-[2-метил-1оксопропіл]-g-оксо-Ν,β-дифенілбензенбутанаміду (4,0 ммоль). Гетерогенну суміш перемішували при кип'ятінні зі зворотним холодильником в атмосфері аргону протягом 22 год. Жовтий розчин, що утворився, залишали охолоджуватися при кімнатній температурі, розбавляли 30 мл третбутилметилового ефіру і промивали послідовно 50 мл 1М NaOH, 30 мл 1М НСІ і, нарешті, сольовим розчином. Після випарювання розчинників утворювався в'язкий світло-коричневий осад, що розчиняли в 12 мл ацетонітрилу, 2,2 мл води і 0,6 мл 1М НСІ. Отриманий прозорий розчин перемішували ніч, протягом цього часу відбулося утворення осаду. Додали 10 мл води, а потім 20 мл ацетонітрилу, що переважно використовувати для того, щоб перевести напівтвердий осад у фільтруєму форму. Перемішування продовжували протягом щонайменше 1 год. Тверду речовину відфільтровували, висушений на повітрі матеріал двічі перекристалізовували з ацетонітрилу і продукт сушили у вакуумі при 20-25°С до постійної маси. Одержували 0,70 г, 28,5% кристалізованого третинного бутилового ефіру [R-(R*,R*)]-2-(4фторфеніл)-b,d-дигідроксі-5-(1-метилетил)-3феніл-4-[(феніламіно)карбоніл]-1Н-пірол-1гептанової кислоти (II) з температурою плавлення в діапазоні 60-90°С. Чистота отриманого продукту склала близько 96%. Приклад 2 До розчину 1,32 г третинного бутилового ефіру (4R-цис)-6-(2-аміноетил)-2,2-диметил-1,3-діоксан4-оцтової кислоти (4,8 ммоль) у суміші 9:1 гептану і толуолу (30 мл) додали послідовно 0,245 г 2метилмасляної кислоти (0,26 мл, 2,4 ммоль) і 1,66 г 4-фтор-a-[2-метил-1-оксопропіл]-g-оксо-N,bдифенілбензенбутанаміду (4,0 ммоль). Гетерогенну суміш перемішували при кип'ятінні зі зворотним холодильником в атмосфері аргону протягом 48 год. Отриманий жовтий розчин залишали охолоджуватися при кімнатній температурі, розбавляли 30 мл трет-бутилметилового ефіру і промивали послідовно 50 мл 1М NaOH, 30 мл 1М НСІ і, нарешті, сольовим розчином. Після випарювання розчинників утворювався в'язкий залишок жовтогаря 11 чого кольору, що розчиняли в 12 мл ацетонітрилу, 2,2 мл води і 0,6 мл 1М НСІ. Отриману суміш нагрівали при 45- 49°С з перемішуванням протягом 5,5 год. до повного перетворення проміжної речовини формули (І) згідно ВЕРХ аналізу. Суміш залишали охолоджуватися і продовжували перемішування при 20 - 25°С 2 години, протягом цього періоду почалося випадання осаду. Додали 10 мл води, а потім 10 мл ацетонітрилу, останній переважно використовувати для перетворення напівтвердого осаду у фільтруєму суспензію, після чого продовжували перемішування протягом 1 год. Тверду речовину відфільтровували, відфільтрований осад промивали 4 мл 50%-ного (об'єм/об'єм) водяного розчину ацетонітрилу, а потім продукт сушили у вакуумі при 20 - 25°С до постійної маси (0,754 г). Фільтрат, що залишився, перемішували при кімнатній температурі протягом ночі. Другу порцію осаду відфільтровували, промивали 4 мл 50%-ного (об'єм/об'єм) водяного розчину ацетонітрилу, а потім продукт сушили у вакуумі при 20 25°С до постійної маси (0,373г). Цей продукт згідно ВЕРХ аналізу є ідентичним продукту, отриманому з першої порції. Одержували 1,127 г, 45,8%-ного кристалізованого третинного бутилового ефіру [R-(R*,R*)]-2-(4фторфеніл)-b,d-дигідроксі-5-(1-метилетил)-3феніл-4-[(феніламіно)карбоніл]-1Н-пірол-1гептанової кислоти (II) з температурою плавлення 84 - 91 °С. Чистота отриманого продукту виявилася вище 98%. Одержання форми І третинного бутилового ефіру [R-(R*,R*)]-2-(4-фторфеніл)- b,d-дигідроксі-5(1-метилетил)-3-феніл-4-[(феніламіно)карбоніл]1Н-пірол-1-гептановой кислоти (II) Приклад 3 3 г, 4,58 ммоль третинного бутилового ефіру (4R-4цис)-6-{2-[2-(4-фторфеніл)-5-(1-метилетил)-3феніл-4-[(феніламіно)карбоніл]пірол-1-іл]-етил}2,2-диметил-1,3-діоксан-4-оцтової кислоти (І) помістили в 50 мл колбу і суспендували в 13,5 мл ацетонітрилу, 2,6 мл води і 0,72 мл 1М НСІ. Реакційну суміш перемішували не менше 12 годин, після чого додавали 30 мл води і перемішування продовжували не менше 1 год. Тверду речовину відфільтровували і відфільтрований осад промивали 1 мл води. Вологий осад сушили при 20 - 25°С протягом 3 годин і при 45-50°С протягом 6 год, поки ВВС (втрата ваги при сушінні) не склала
ДивитисяДодаткова інформація
Назва патенту англійськоюPolymorphs of atorvastatin tert-butylester and use as intermediates for the preparation of atorvastatin
Автори англійськоюStimac Anton, Zupet Rok, Grcman Marija, Smrkolj Matej, Jakse Renata
Назва патенту російськоюПолиморфные формы трет-бутилового эфира аторвастатина и их использование как промежуточных соединений для получения аторвастатина
Автори російськоюСтимац Антон, Зупет Рок, Грцман Мария, Смрколй Матей, Йаксе Рената
МПК / Мітки
МПК: C07D 207/34
Мітки: одержання, сполук, проміжних, аторвастатину, трет-бутилового, використання, ефіру, їхнє, поліморфні, форми
Код посилання
<a href="https://ua.patents.su/8-86059-polimorfni-formi-tret-butilovogo-efiru-atorvastatinu-ta-khneh-vikoristannya-yak-promizhnikh-spoluk-dlya-oderzhannya-atorvastatinu.html" target="_blank" rel="follow" title="База патентів України">Поліморфні форми трет-бутилового ефіру аторвастатину та їхнє використання як проміжних сполук для одержання аторвастатину</a>
Попередній патент: Прокатна кліть для виготовлення катаної штаби
Наступний патент: Бурильна головка
Випадковий патент: Гумова суміш












