Поліморфні форми похідної 1-піролу, проміжної сполуки для одержання аторвастатину
Номер патенту: 76496
Опубліковано: 15.08.2006
Автори: Сент Кірайі Жужа, Надь Кальман, Верецкейне Донат Дйордьі, Барта Ференц, ШІМІГ Дьюла, Котаі Нагі Петер, Грефф Зольтан, БАРКОЦІ Йожеф
Формула / Реферат
1. Кристалічна форма І трет-бутилового ефіру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)-пірол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілоцтової кислоти формули
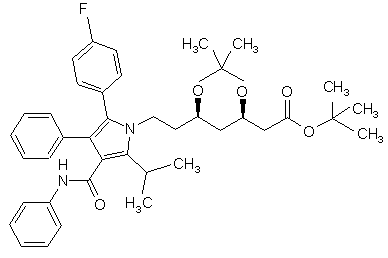 , (I)
, (I)
яка характеризується тим, що має порошкову рентгенограму, представлену в Таблиці 1 і на Фіг. 1, отриману за допомогою ![]() -випромінювання:
-випромінювання:
Таблиця 1
Положення дифракційних смуг і відносна інтенсивність (>10% поліморфної форми І)
№ піка
![]() [град]
[град]
d(hkl) ![]()
І (абс.) [cts]
І (віднос.) [%]
1
9.85
8.9800
6701
100.00
2
11.20
7.8983
996
14.86
3
13.14
6.7401
771
11.51
4
15.89
5.5793
1043
15.56
5
17.76
4.9940
2565
38.28
6
18.29
4.8508
2710
40.44
7
18.69
4.7483
2152
32.11
8
19.17
4.6300
3325
49.62
9
19.66
4.5155
983
14.67
10
20.24
4.3865
10064
15.88
11
21.10
4.2107
671
10.01
12
21.49
4.1351
1362
20.33
13
22.05
4.0310
889
13.27
14
22.90
3.8836
863
12.88
15
26.41
3.3749
681
10.16
16
26.95
3.3080
597
8.91
17
27.89
3.1995
612
9.13
2. Кристалічна форма II трет-бутиловото ефіру (4R-цис-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)-пірол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-іл-оцтової кислоти, що характеризується тим, що має порошкову рентгенограму, представлену в Таблиці 2 і на Фіг. 2, отриману за допомогою ![]() -випромінювання:
-випромінювання:
Таблиця 2
Положення дифракційних смуг і відносна інтенсивність (>10% поліморфної форми II)
№ піка
![]() [град]
[град]
d(hkl) ![]()
І (абс.) [cts]
І (віднос.) [%]
1
6.45
13.7061
463
18.54
2
6.94
12.7356
1639
65.64
3
11.43
7.7393
1331
53.30
4
12.21
7.2491
1039
41.61
5
12.53
7.0652
866
34.68
6
13.17
6.7223
1247
49.94
7
14.29
6.1983
2497
100.00
8
15.05
5.8866
998
39.97
9
16.45
5.3873
625
25.03
10
17.50
5.0665
1837
73.57
11
17.85
4.9690
2325
93.11
12
18.65
4.7584
1685
67.48
13
19.03
4.6626
1105
44.25
14
19.97
4.4468
1367
54.75
15
20.16
4.4055
1457
58.35
16
20.90
4.2495
946
37.89
17
21.36
4.1606
1616
64.72
18
21.99
4.0426
1169
46.82
19
22.24
3.9972
1486
59.51
20
22.74
3.9111
1471
58.91
21
23.80
3.7391
279
11.17
22
24.37
3.6526
422
16.90
23
24.69
3.6060
323
12.94
24
25.35
3.5141
628
25.15
25
25.71
3.4648
635
25.43
26
26.41
3.3750
332
13.30
27
27.73
3.2172
483
19.34
28
28.05
3.1812
395
15.82
29
28.64
3.1173
449
17.98
30
29.33
3.0452
409
16.38
31
29.77
3.0010
400
16.02
32
30.48
2.9330
249
9.97
Текст
1. Кристалічна форма І трет-бутилового ефіру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4фторфеніл)-5-(1-метилетил)-пірол-1-іл]етил]-2,2диметил-[1,3]діоксан-4-ілоцтової кислоти формули 3 76496 4 характеризується тим, що має порошкову рентгеотриману за допомогою Cu -випромінювання: нограму, представлену в Таблиці 2 і на Фіг. 2, Таблиця 2 Положення дифракційних смуг і відносна інтенсивність (>10% поліморфної форми II) № піка 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 2 [град] 6.45 6.94 11.43 12.21 12.53 13.17 14.29 15.05 16.45 17.50 17.85 18.65 19.03 19.97 20.16 20.90 21.36 21.99 22.24 22.74 23.80 24.37 24.69 25.35 25.71 26.41 27.73 28.05 28.64 29.33 29.77 30.48 o d(hkl) [ A ] 13.7061 12.7356 7.7393 7.2491 7.0652 6.7223 6.1983 5.8866 5.3873 5.0665 4.9690 4.7584 4.6626 4.4468 4.4055 4.2495 4.1606 4.0426 3.9972 3.9111 3.7391 3.6526 3.6060 3.5141 3.4648 3.3750 3.2172 3.1812 3.1173 3.0452 3.0010 2.9330 І (абс.) [cts] І (віднос.) [%] 463 1639 1331 1039 866 1247 2497 998 625 1837 2325 1685 1105 1367 1457 946 1616 1169 1486 1471 279 422 323 628 635 332 483 395 449 409 400 249 18.54 65.64 53.30 41.61 34.68 49.94 100.00 39.97 25.03 73.57 93.11 67.48 44.25 54.75 58.35 37.89 64.72 46.82 59.51 58.91 11.17 16.90 12.94 25.15 25.43 13.30 19.34 15.82 17.98 16.38 16.02 9.97 Винахід відноситься до нових поліморфних форм трет-бутилового ефіру (4R-цис)-6-[2-[3феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5-(1метилетил)-піррол-1-іл]етил]-2,2-диметил[1,3]діоксан-4-іл-оцтової кислоти і способу їхнього одержання. Зокрема, винахід відноситься до нових кристалічних форм І і II трет-бутлового ефіру (4R-цис)6-[2-[3-феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5(1-метилетил)-піррол-1-іл]етил]-2,2-диметил[1,3]діоксан-4-іл-оцтової кислоти і способу їхнього одержання. Трет-бутиловий ефір (4R-цис-6-[2-[3-феніл-4феніл-карбшоїл-2-(4-фторфеніл)-5-(1-метилетил)піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілоцтової кислоти формули є відомою корисною фармацевтичною проміж 5 76496 6 ною сполукою, яка використовується для одерні. жання ГМГ-КоА [інгібітору редуктази гідроксиметиУ патенті US 5155251 розкритий робочий прилглютарилкоензіму напівкальцієвої солі (3R,5R)клад патенту ЕР-В 330172. Дане посилання не 3,5-дигідрокси-[3-феніл-4-(феніламіно)карбоніл]-2містить відомості про точку плавлення і кристаліч(4-фторфеніл)-5-(1-метилетил)-1Н-піррол-1-ілну форму сполуки формули І. етилгептанової кислоти), що має МНН (міжнародВідповідно до статті в [журналі Tetrahedron ну непатентовану назву) аторвастатин. Letters, Vol. 33, Np. 17, 2283-2284 (1992)] реакцію Трет-бутиловий ефір (4R-цис)-6-[2-[3-феніл-4між сполуками формули II і III проводять у суміші фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)толуолу, гептану і тетрагідрофурана, 1:4:1, у припіррол-1-іл]-етил]-2,2-диметил-[1,3]діоксан-4-ілсутності півалової кислоти в якості каталізатора. оцтової кислоти формули І описаний у патенті ЕРВиділення продукту з реакційної маси не описано, В 330172. Відповідно до даного патенту треттакож не розкрито, чи утворюється сполука форбутиловий ефір (4R-цис)-6-[2-[3-феніл-4мули І у кристалічному вигляді. фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)Останнім часом з'явилася нагальна потреба в піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілчистих і морфологічно однорідних продуктах. Для оцтової кислоти формули І одержують взаємодією технологічних процесів усе більш і більш потрібні (4R-цис)-1,1-диметилетил-6-(2-аміноетил)-2,2продукти, що виявляють постійні, стабільні й ідендиметил-1,3-діоксан-4-ацетата формули тичні властивості при сушінні і фільтрації. У силу економічних причин існує необхідність у морфологічно однорідних продуктах, що можуть бути отримані способами, легко здійсненими в промисловому масштабі, придатними для масштабування і які дозволяють одержати продукт стійко ідентичної кристалічної форми. Відомо, що при фільтрації і сушінні аморфних речовин виникають труднощі, при масштабуванні процесу виробництва доводиться зіштовхуватися зі значними складностями, та й стабільність продукту також є недостатньою. з 2-[1-феніл-2-(4-фторфеніл)-2-оксоетил]-4Метою винаходу є створення нових кристалічметил-N-метил-N-феніл-3-оксопентанамідом форних форм трет-бутилового ефіру (4R-цис)-6-[2-[3мули феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5-(1метилетил)-піррол-1-іл]етил]-2,2-диметил[1,3]діоксан-4-іл-оцтової кислоти, які б легко фільтрувалися і сушилися, були стабільними протягом тривалого часу і добре зберігалися. Дана мета вирішується за допомогою даного винаходу. Винахід заснований на тому, що третбутиловий ефір (4R-цис)-6-[2-[3-феніл-4фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілоцтової кислоти формули І може бути отриманий у вигляді двох морфологічно однорідних поліморфних кристалічних форм, що задовольняють виклау суміші гептану і толуолу 9:1, при кипінні проденим вище вимогам. тягом 24 годин, охолодженням реакційної маси, Зазначені нові морфологічно однорідні полідодаванням пропанолу-2 і відділенням продукту, морфні форми позначені в описі винаходу до пащо випав, фільтрацією. У роботі відсутні дані про тенту й у формулі винаходу як поліморфи І і II. точку плавлення продукту, також не згадується Відповідно до одного аспекту даного винахопро його кристалічну форму. ду, отримана кристалічна форма І трет-бутилового Відповідно до патенту US 5103024 реакцію ефіру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2проводять в умовах, описаних у патенті ЕР-В (4-фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]330172, за винятком того, що використовують су2,2-диметил-[1,3]діоксан-4-іл-оцтової кислоти, що міш толуолу і гептану 9:1; далі реакційну масу нахарактеризується тим, що має порошкову рентгегрівають при кипінні протягом 24 годин, охолоджунограму, представлену в Таблиці 1 і на Фіг.1, ють, додають пропанол-2 і відокремлюють сполуку отриману за допомогою Сu -випромінювання: формули І, що випала, фільтрацією. Дані про точку плавлення і кристалічну форму продукту відсут 7 76496 8 піррол-1-іл]етил]-2,2-диметил-[ ,3]діоксан-4-ілТаблиця 1 оцтової кислоти в полярному протонному чи біполярному апротонному розчиннику, або розчиннику Положення дифракційних смуг і відносна інтенсиефірного типу при нагріванні з наступною криставність (>10% поліморфної форми І) лізацією і виділенням кристалічної форми І третбутилового ефіру (4R-цис)-6-[2-[3-феніл-4фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)І (абс.) № піка 2 [град] d (hkl) [Å] І (віднос.) [%] піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-іл[cts] оцтової кислоти; чи 1 9,85 8,9800 6701 100,00 с) суспендування аморфної чи кристалічної 2 11,20 7,8983 996 14,86 форми II трет-бутилового ефіру (4R-цис)-6-[2-[33 13,14 6,7401 771 11,51 феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5-(14 15,89 5,5793 1043 15,56 метилетил)-піррол-1-іл]етил]-2,2-диметил5 17,76 4,9940 2565 38,28 [1,3]діоксан-4-іл-оцтової кислоти в полярному про6 18,29 4,8508 2710 40,44 тонному чи біполярному апротонному розчиннику, 7 18,69 4,7483 2152 32,11 або розчиннику ефірного типу протягом 1-120 го8 19,17 4,6300 3325 49,62 дин з наступним виділенням кристалічної форми І 9 19,66 4,5155 983 14,67 трет-бутилового ефіру (4R-цис)-6-[2-[3-феніл-410 20,24 4,3865 10064 15,88 фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)11 21,10 4,2107 671 10,01 піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-іл12 21,49 4,1351 1362 20,33 оцтової кислоти. 13 22,05 4,0310 889 13,27 У якості полярного протонного розчинника може бути використаний нижчий спирт (кращі мета14 22,90 3,8836 863 12,88 нол, етанол, пропанол-2), вода чи суміш зазначе15 26,41 3,3749 681 10,16 них розчинників. Більш переважно в якості 16 26,95 3,3080 597 8,91 полярного протонного розчинника використовува17 27,89 3,1995 612 9,13 ти етанол, пропанол-2, воду чи суміш пропанолу-2 і води. Порошкова рентгенограма нової кристалічної У якості біполярного апротонного розчинника поліморфної форми І отримана в наступних умоможуть бути використані ацетон, ацетонітрил, вах: етилацетат, диметилформамід, диметилсульфокУстаткування: порошковий дифрактометр масид чи триамід гексаметилфосфорної кислоти. рки PHILIPS-XPERT PW 3710. Переважно використовувати ацетонітрил. Випромінювання: Cu ( : 1,54190Å). Як розчинник ефірного типу переважно може Монохроматор: графітовий. бути використаний ацетонітрил. Напруга порушення: 40кв. Точні реакційні умови для одержання кристаАнодний струм: 30МА. лічної форми І трет-бутилового ефіру (4R-цис)-6Стандартна речовина порівняння: SRM 675. [2-[3-феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5Слюдяний порошок (синтетичний фторграфіт), (1-метилетил)-піррол-1-іл]етил]-2,2-диметилсірий. №: 981307. [1,3]діоксан-4-іл-оцтової кислоти можуть бути про Вимір безперервний: /2 пробіг: 4,5 встановлені експериментально. про 35,00 2 . При виконанні способів а) і b) аморфну чи криВеличина кроку: 0,04° сталічну форму II трет-бутилового ефіру (4R-цис)Зразок: поверхня рівна, ширина 0,5мм, у квар6-[2-[3-феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5цовому утримувачі зразка, вимір і збереження (1-метилетил)-піррол-1-іл]етил]-2,2-диметилздійснювали при кімнатній температурі. [1,3]діоксан-4-іл-оцтової кислоти розчиняють у Згідно з ще одним аспектом винаходу, предполярному протонному чи біполярному апротонставлений спосіб одержання кристалічної форми І ному розчиннику, або розчиннику ефірного типу трет-бутилового ефіру (4R-цис)-6-[2-[3-феніл-4при кип'ятінні, розчин витримують при зазначеній фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)температурі протягом декількох хвилин, потім охопіррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-іллоджують до кімнатної температури і залишають оцтової кислоти, що включає на кристалізацію. Кристали відокремлюють фільтa) розчинення аморфного тирет-бутилового руванням або центрифугуванням. ефіру (4R-цис;-6-[2-[3-феніл-4-фенілкарбамоїл-2При виконанні способу с) аморфну чи криста(4-фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]лічну форму II трет-бутилового ефіру (4R-цис)-62,2-диметил-[1,3]діоксан-4-іл-оцтової кислоти в [2-[3-феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5полярному протонному чи біполярному апротон(1-метилетил)-піррол-1-іл]етил]-2,2-диметилному розчиннику, або розчиннику ефірного типу [1,3]діоксан-4-іл-оцтової кислоти суспендують у при нагріванні з наступною кристалізацією і видіполярному протонному чи біполярному апротонленням кристалічної форми І трет-бутилового ефіному розчиннику, або розчиннику ефірного типу ру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4протягом 1-120 годин, після чого кристалічну форфторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]-2,2му І трет-бутилового ефіру (4R-цис)-6-[2-[3-фенілдиметил-[1,3]Дюксан-4-іл-оцтової кислоти; чи 4-фенілкарбамоїл-2-(4-фторфеніл)-5-(1b) розчинення кристалічної форми II третметилетил)-піррол-1-іл]етил]-2,2-диметилбутилового ефіру (4R-цис-6-[2-[3-феніл-4[1,3]діоксан-4-іл-оцтової кислоти, що впала в осад, фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)відокремлюють фільтрацією або центрифугуван 9 76496 10 ням. Тривалість суспендування залежить від вико(4-фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]ристаного розчинника і може бути встановлена 2,2-диметил-[1,3]діоксан-4-іл-оцтової кислоти в експериментально. неполярному розчиннику при нагріванні з наступЗгідно з ще одним аспектом винаходу, отриною кристалізацією і виділенням кристалічної фомана кристалічна форма II трет-бутилового ефіру рми II трет-бутилового ефіру (4R-цис)-6-[2-[3(4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5-(1фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]-2,2метилетил)-піррол-1-іл]етил]-2,2-диметилдиметил-[1,3]діоксан-4-іл-оцтової кислоти, що ха[1,3]ДІоксан-4-іл-оцтової кислоти; або рактеризується тим, що має порошкову рентгеногb) розчинення кристалічної форми І третраму, представлену в Таблиці 2 і на Фіг.2, отримабутилового ефіру (4R-цис)-6-[2-[3-феніл-4фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)ну за допомогою Cu -випромінювання: піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілоцтової кислоти в неполярному розчиннику при Таблиця 2 нагріванні з наступною кристалізацією і виділенням кристалічної форми II трет-бутилового ефіру Положення дифракційних смуг і відносна інтенси(4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4вність (>10% поліморфної форми II) фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]-2,2диметил-[1,3]діоксан-4-іл-оцтової кислоти; або І (абс.) № піка 2 [град] d (hkl) [Å] І (віднос.) [%] c) взаємодія (4R-цис)-1,1-диметилетил-6-(2[cts] аміноетил)-2,2-диметил-1,3-діоксан-4-ацетата фо1 6,45 13,7061 463 18,54 рмули II с 2-[1-феніл-2-(4-фторфеніл)-2-оксоетил]2 6,94 12,7356 1639 65,64 4-метил-N-метил-N-феніл-3-оксопентанамідом 3 11,43 7,7393 1331 53,30 формули III у суміші толуолу, гептану і тетрагідро4 12,21 7,2491 1039 41,61 фурана, 1:4:1, у присутності півалової кислоти в 5 12,53 7,0652 866 34,68 якості каталізатора, додавання до реакційної су6 13,17 6,7223 1247 49,94 міші наприкінці реакції диізопропілового ефіру з 7 14,29 6,1983 2497 100,00 наступним виділенням кристалічної форми II трет8 15,05 5,8866 998 39,97 бутилового ефіру (4R-цис)-6-[2-[3-феніл-49 16,45 5,3873 625 25,03 фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)10 17,50 5,0665 1837 73,57 піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-іл11 17,85 4,9690 2325 93,11 оцтової кислоти. 12 18,65 4,7584 1685 67,48 Способи а) і b) можна проводити в умовах, описаних для одержання кристалічної форми І 13 19,03 4,6626 1105 44,25 трет-бутилового ефіру (4R-цис)-6-[2-[3-феніл-414 19,97 4,4468 1367 54,75 фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)15 20,16 4,4055 1457 58,35 піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-іл16 20,90 4,2495 946 37,89 оцтової кислоти. Як неполярний розчинник пере17 21,36 4,1606 1616 64,72 важно використовувати циклогексан, гептан, гек18 21,99 4,0426 1169 46,82 сан, толуол чи їхню суміш. Для збереження непо19 22,24 3,9972 1486 59,51 лярності інертний розчинник додатково може 20 22,74 3,9111 1471 58,91 містити невелику кількість розчинника ефірного 21 23,80 3,7391 279 11,17 типу (наприклад, диізопропілового чи ефіру тетра22 24,37 3,6526 422 16,90 гідрофурана). 23 24,69 3,6060 323 12,94 Точні реакційні умови для одержання криста24 25,35 3,5141 628 25,15 лічної форми II трет-бутилового ефіру (4R-цис)-625 25,71 3,4648 635 25,43 [2-[3-феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-526 26,41 3,3750 332 13,30 (1-метилетил)-піррол-1-іл]етил]-2,2-диметил[1,3]діоксан-4-іл-оцтової кислоти визначають екс27 27,73 3,2172 483 19,34 периментально. 28 28,05 3,1812 395 15,82 Відповідно до способу с) до реакційної суміші, 29 28,64 3,1173 449 17,98 отриманої в результаті взаємодії сполук формул II 30 29,33 3,0452 409 16,38 і III, яка проводиться в суміші толуолу, гептану і 31 29,77 3,0010 400 16,02 тетрагідрофурану, 1:4:1, у присутності пивалової 32 30,48 2,9330 249 9,97 кислоти в якості каталізатора, по завершенні реакції додають диізопропиловий ефір, після чого виПорошкова рентгенограма нової кристалічної діляють кристалічну форму II трет-бутилового ефіформи II отримана в умовах, описаних для крисру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4талічної форми І. фторфеніл)-5-(1-метилетил)-тррол-1-іл]етил]-2,2Згідно з ще одним аспектом винаходу, преддиметил-[1,3]діоксан-4-іл-оцтової кислоти. ставлений спосіб одержання кристалічної форми II З вищевикладеного видно, що поліморфні фотрет-бутилового ефіру (4R-цис)-6-[2-[3-феніл-4рми І і II можна перетворювати одну в іншу. фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)Даний винахід дає можливість одержання піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілтрет-бутилового ефіру (4R-цис)-6-[2-[3-феніл-4оцтової кислоти, що включає фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)a) розчинення аморфного трет-бутилового піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілефіру (4R-цис)-6-[2-[3-фетл-4-фенілкарбамоїл-2оцтової кислоти, що має однорідну кристалічну 11 76496 12 структуру з високим ступенем чистоти. Т. пл. 140-142°С. Даний винахід має наступні переваги: Приклад 3 - отриманий продукт, який легко фільтрувати і Одержання кристалічної форми І третсушити, і який має технологічно однорідні харакбутилового ефіру (4R-цис)-6-[2-[3-феніл-4теристики сушіння і фільтрації; фенілкарбамоіл-2-(4-фторфеніл)-5-(1-метилетил)- процес перекристалізації і морфологічно одпіррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілнорідна кристалічна структура забезпечують одеоцтової кислоти. ржання продукту високої чистоти; У колбу з круглим дном ємністю 10мл, облад- чистота, визначена методом ВЭЖХ, складає нану зворотним холодильником і термометром, >99,5%; завантажують 2г аморфного трет-бутилового ефі- морфологічно однорідний продукт винаходу ру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4стабільний при збереженні протягом тривалого фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]-2,2часу; диметил-[1,3]діоксан-4-іл-оцтової кислоти і 5мл - не потрібно ніяких особливих умов збереацетонітрилу. Суміш кип'ятять зі зворотним холоження; дильником протягом 5 хвилин, охолоджують до - спосіб винаходу може бути легко масштабокімнатної температури і залишають на ніч. Суспенваний і підходить для виробництва в промисловозію фільтрують, продукт промивають і сушать при му масштабі. 35-40°С до постійної ваги. У такий спосіб одержуДодаткові деталі даного винаходу представють 1,84г цільового продукту. Т. пл. 140-142°С. лені в наступних Прикладах, що не обмежують Приклад 4 обсяг охорони винаходу. Одержання кристалічної форми І третПриклад 1 бутилового ефіру (4R-цис)-6-[2-[3-феніл-4Одержання кристалічної форми II третфенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)бутилового ефіру (4R-цис)-6-[2-[3-феніл-4піррол-1-іл]етил]-2,2-диметил-[1,3] діоксан-4-ілфенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)оцтової кислоти. піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілУ колбу з круглим дном ємністю 10мл, обладоцтової кислоти з трет-бутилового ефіру (4R-цис)нану зворотним холодильником і термометром, 6-[2-[3-фетл-4-фенілкарбамоїл-2-(4-фторфеніл)-5завантажують 2г аморфного трет-бутилового ефі(1-метилетил)-піррол-1-іл]етил]-2,2-диметилру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4[1,3]діоксан-4-іл-оцтової кислоти, що містить крисфторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]-2,2талічну форму І. диметил-[1,3]діоксан-4-іл-оцтової кислоти і 3,5мл У колбу з круглим дном ємністю 10мл, обладпропанолу-2. Суміш кип'ятять зі зворотним холонану зворотним холодильником і термометром, дильником протягом 5 хвилин, охолоджують до завантажують 2г кристалічної форми І треткімнатної температури і залишають на ніч. Суспенбутилового ефіру (4R-цис)-6-[2-[3-феніл-4зію фільтрують, продукт промивають і сушать при фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)35-40°С до постійної ваги. У такий спосіб одержупіррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілють 1,85г цільового продукту. Т. пл. 140-142°С. оцтової кислоти і 5мл циклогексану. Суміш кип'яПриклад 5 тять зі зворотним холодильником протягом 5 хвиОдержання кристалічної форми І третлин, охолоджують до кімнатної температури і забутилового ефіру (4R-цис)-6-[2-[3-феніл-4лишають на ніч. Суспензію фільтрують, продукт фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)промивають і сушать при 35-40°С до постійної вапіррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілги. У такий спосіб одержують 1,87г цільового прооцтової кислоти. дукту. Т. пл. 128-130°С. У колбу з круглим дном ємністю 100мл, облаПриклад 2 днану зворотним холодильником і термометром, Одержання кристалічної форми І третзавантажують 2г аморфного трет-бутилового ефібутилового ефіру (4R-цис)-6-[2-[3-феніл-4ру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4фенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]-2,2піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілдиметил-[1,3]діоксан-4-іл-оцтової кислоти і 47мл оцтової кислоти з трет-бутилового ефіру (4R-цис)диізопропілового ефіру. Суміш кип'ятять зі зворот6-[2-[3-феніл-4-фенілкарбамоїл-2-(4-фторфеніл)-5ним холодильником протягом 5 хвилин, охоло(1-метилетил)-піррол-1-іл]етил]-2,2-диметилджують до кімнатної температури і залишають на [1,3]діоксан-4-іл-оцтової кислоти, що містить крисніч. Суспензію фільтрують, продукт промивають і талічну форму II. сушать при 35-40°С до постійної ваги. У такий споУ колбу з круглим дном ємністю 25мл, обладсіб одержують 1,74г цільового продукту. Т. пл. 140нану зворотним холодильником і термометром, 142°С. завантажують 2г кристалічні форми II третПриклад 6 бутилового ефіру (4R-цис)-6-[2-[3-феніл-4Одержання кристалічної форми І третфенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)бутилового ефіру (4R-цис)-6-[2-[3-феніл-4піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілфенілкарбамоіл-2-(4-фторфеніл)-5-(1-метилетил)оцтової кислоти і 5мл етанолу. Суміш кип'ятять зі піррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілзворотним холодильником протягом 5 хвилин, оцтової кислоти. охолоджують до кімнатної температури і залишаУ колбу з круглим дном ємністю 250мл, облають на ніч. Суспензію фільтрують, продукт промиднану зворотним холодильником і термометром, вають і сушать при 35-40°С до постійної ваги. У завантажують 2г аморфного трет-бутилового ефітакий спосіб одержують 1,81г цільового продукту. ру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4 13 76496 14 фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]-2,2оцтової кислоти. диметил-[1,3]діоксан-4-іл-оцтової кислоти і 130мл У колбу з круглим дном ємністю 50мл, обладсуміші пропанолу-2 і води, 2:1. Реакційну масу нану зворотним холодильником і термометром, кип'ятять зі зворотним холодильником протягом 5 завантажують 2г аморфного трет-бутилового ефіхвилин, охолоджують до кімнатної температури і ру (4R-цис)-6-[2-[3-феніл-4-фенілкарбамоїл-2-(4залишають на ніч. Суспензію фільтрують, продукт фторфеніл)-5-(1-метилетил)-піррол-1-іл]етил]-2,2промивають і сушать при 35-40°С до постійної вадиметил-[1,3]діоксан-4-іл-оцтової кислоти і 19мл ги. У такий спосіб одержують 1,80г цільового просуміші пропанолу-2 і води, 4:1. Реакційну масу дукту. Т. пл. 140-142°С. кип'ятять зі зворотним холодильником протягом 5 Приклад 7 хвилин, охолоджують до кімнатної температури і Одержання кристалічної форми І третзалишають на ніч. Суспензію фільтрують, продукт бутилового ефіру (4R-цис)-6-[2-[3-феніл-4промивають і сушать при 35-40°С до постійної вафенілкарбамоїл-2-(4-фторфеніл)-5-(1-метилетил)ги. У такий спосіб одержують 1,86г цільового пропіррол-1-іл]етил]-2,2-диметил-[1,3]діоксан-4-ілдукту. Т.пл. 140-142°С. Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPolymorhic forms of 1-pyrrol derivative, intermediary compound for the preparation of atorvastatin
Автори англійськоюBartha Ferenc, Nagy Kalman
Назва патенту російськоюПолиморфные формы производной 1-пиррола, промежуточного соединения для получения аторвастатина
Автори російськоюБарта Ференц, Надь Кальман
МПК / Мітки
МПК: C07D 405/06
Мітки: одержання, форми, похідної, 1-піролу, аторвастатину, сполуки, проміжної, поліморфні
Код посилання
<a href="https://ua.patents.su/7-76496-polimorfni-formi-pokhidno-1-pirolu-promizhno-spoluki-dlya-oderzhannya-atorvastatinu.html" target="_blank" rel="follow" title="База патентів України">Поліморфні форми похідної 1-піролу, проміжної сполуки для одержання аторвастатину</a>
Попередній патент: Засувка
Наступний патент: Спосіб забезпечення роботи водо-водневого двигуна
Випадковий патент: Засіб з кровоспинними властивостями для обробки і лікування ран і уражених слизових і шкірних покривів











