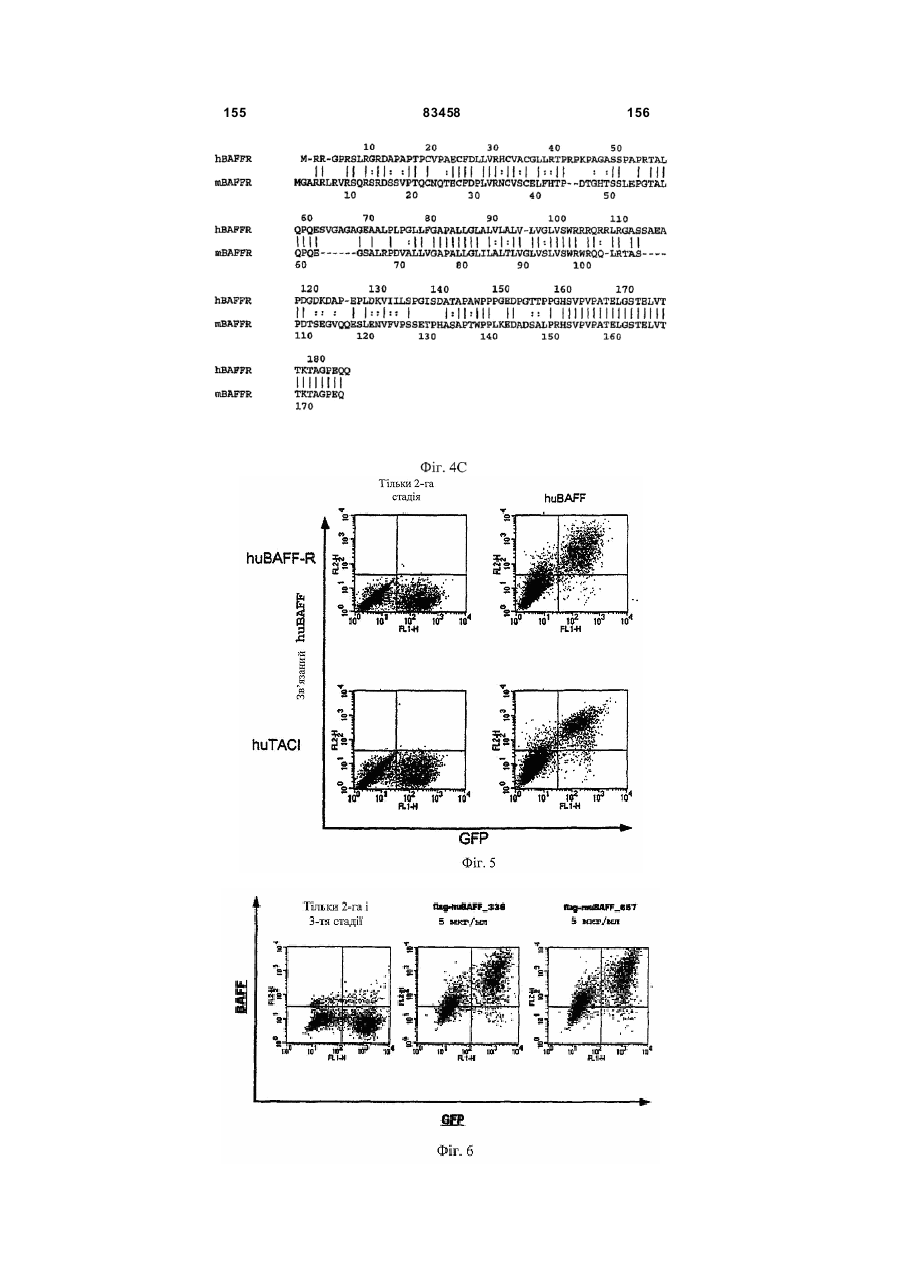
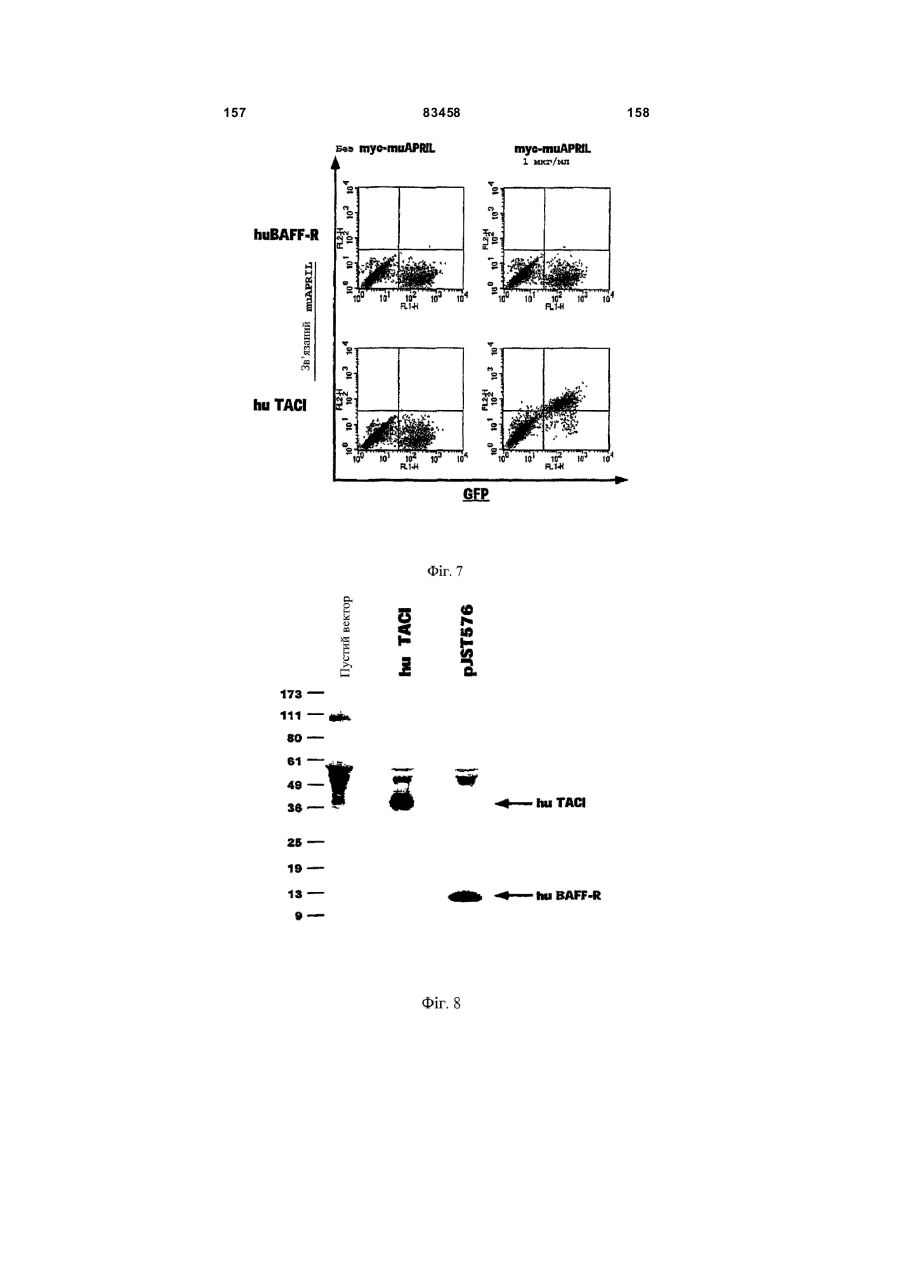
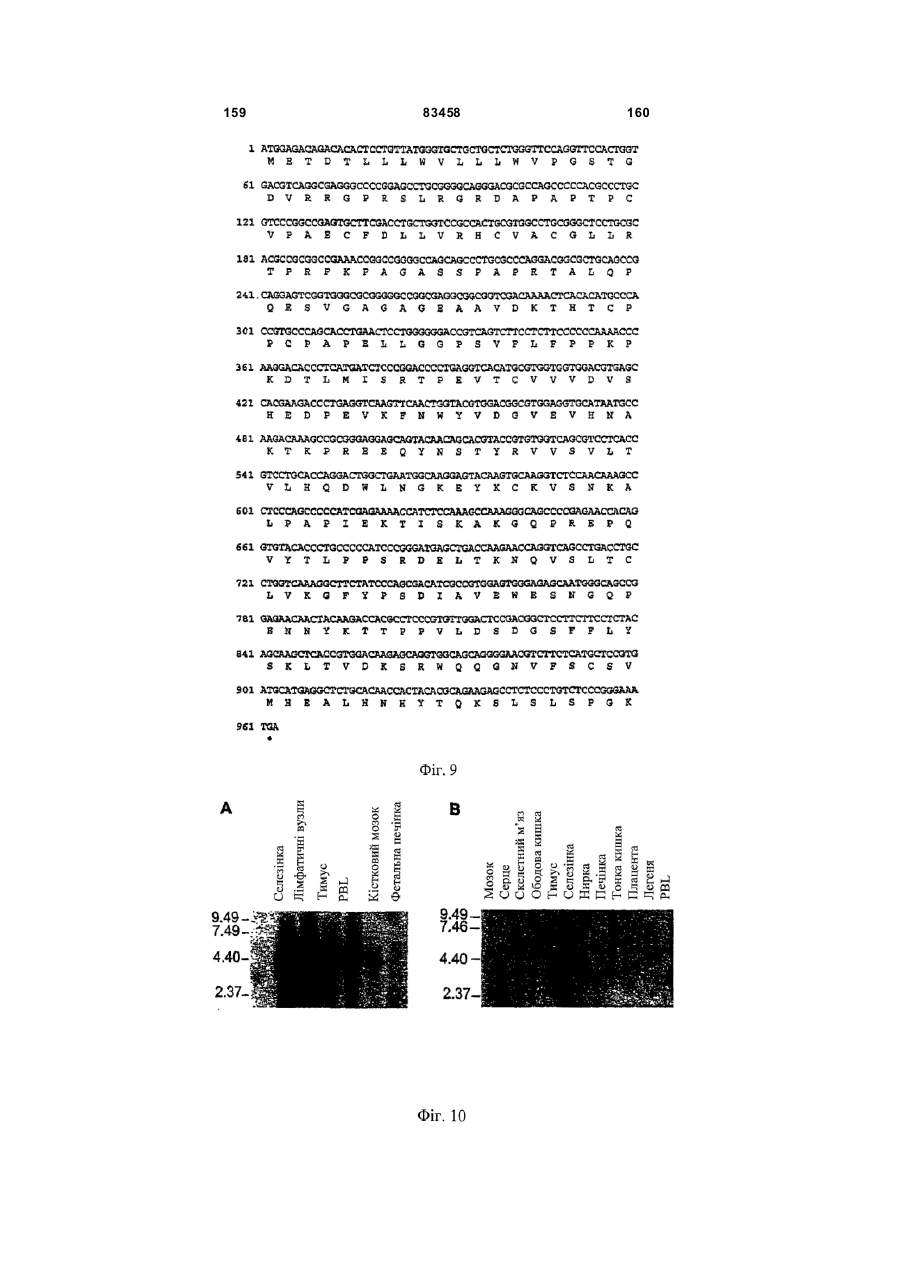
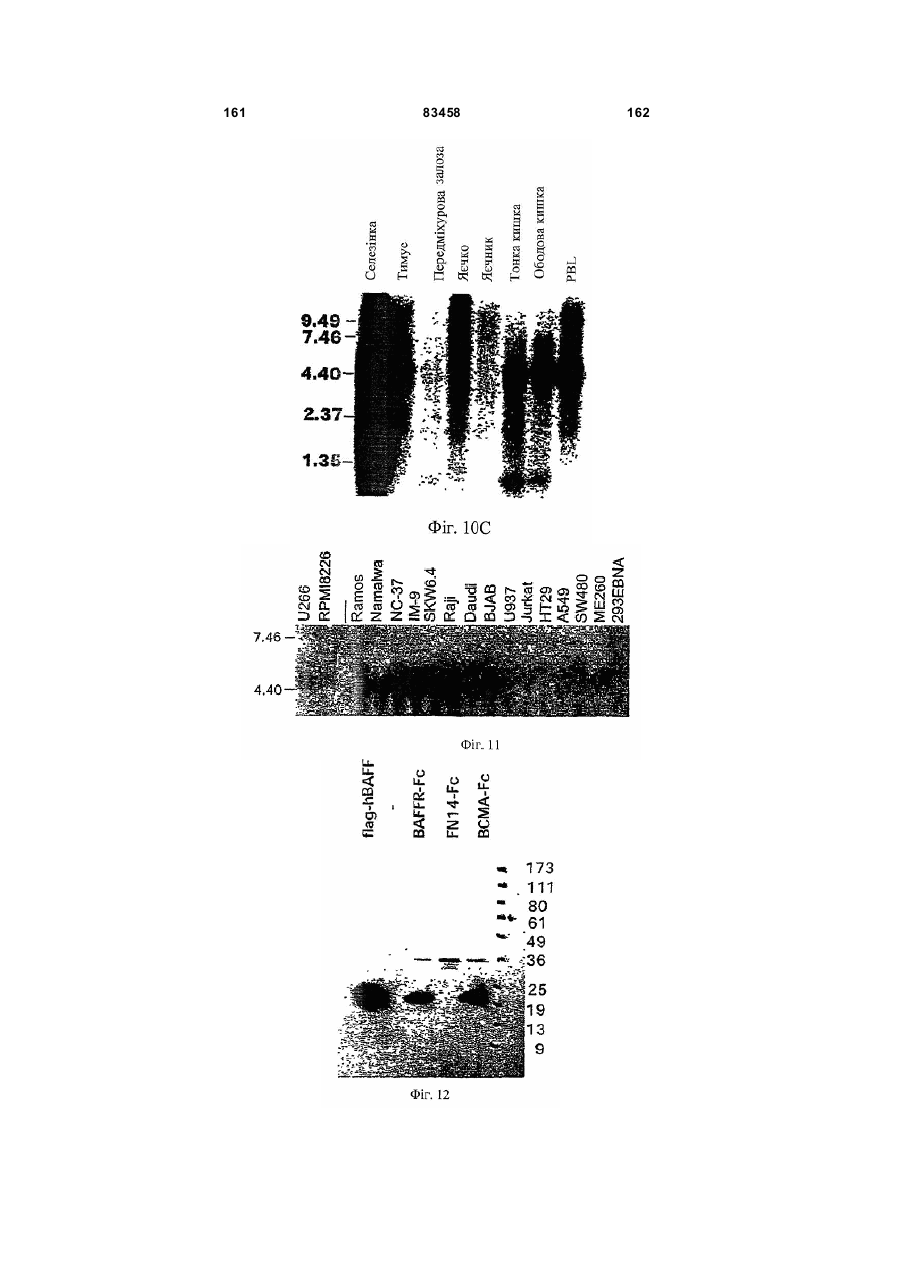
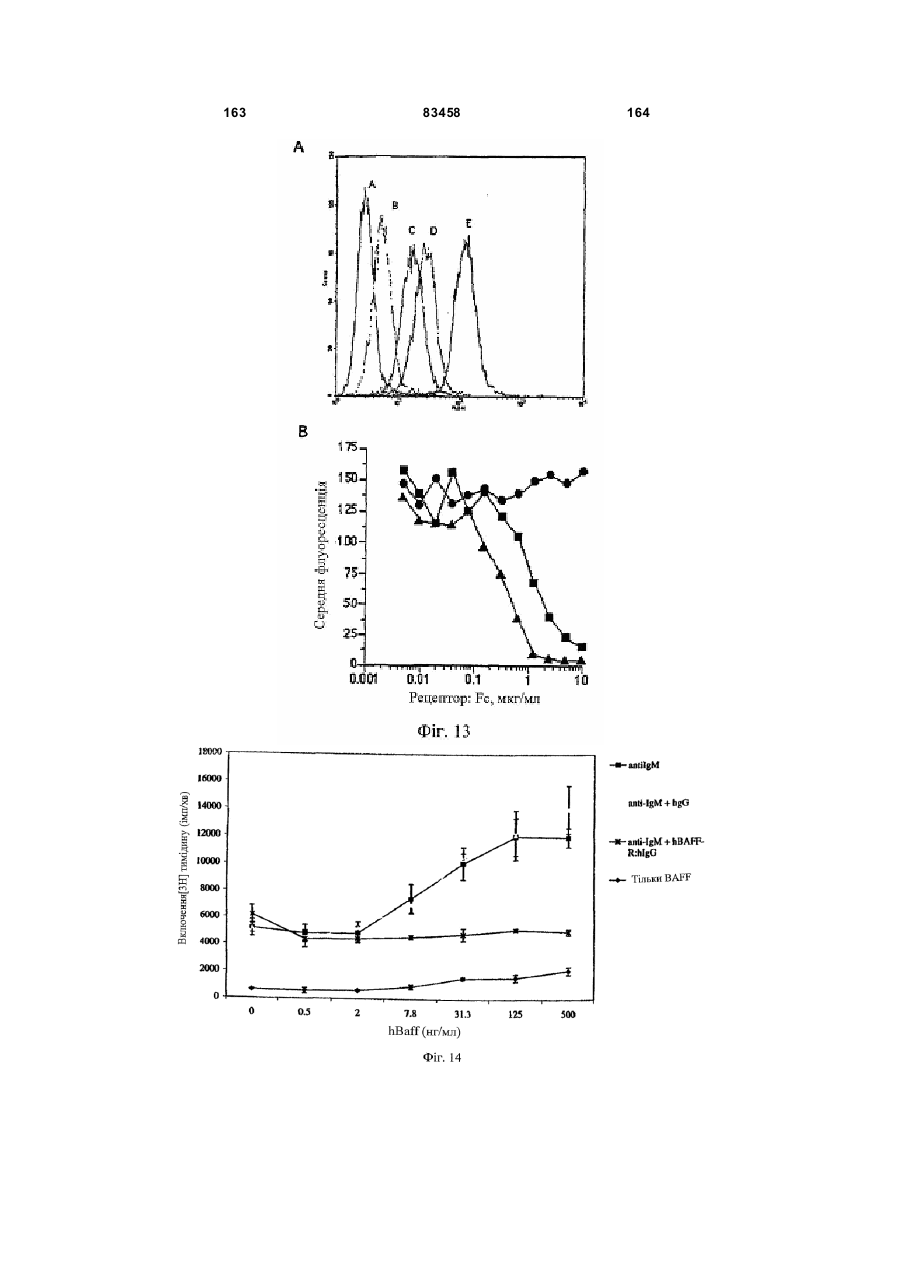
Виділений поліпептид baff-r (рецептор фактора активації в-клітин сімейства tnf)
Формула / Реферат
1. Виділений поліпептид BAFF-R (рецептор фактора активації В-клітин сімейства TNF), що містить амінокислотну послідовність, вибрану з групи, яка складається з:
(a) SEQ ID NО:5;
(b) фрагмента SEQ ID NО:5, що зв’язується з BAFF (фактор активації В-клітин сімейства TNF);
(с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична SEQ ID NО:5, або фрагмента SEQ ID NО:5;
(d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NО:5, або фрагмента SEQ ID NО:5;
(е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90% ідентична SEQ ID NО:5, або фрагмента SEQ ID NО:5;
(f) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 95% ідентична SEQ ID NО:5, або фрагмента SEQ ID NО:5; і
(g) SEQ ID NО:5 або фрагмента SEQ ID NО:5, модифікованих заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв’язується з BAFF.
2. Виділений поліпептид BAFF-R за п.1, де поліпептид містить амінокислотну послідовність, вибрану з групи, яка складається з:
(a) SEQ ID NO:10;
(b) фрагмента SEQ ID NО:10, який зв’язується з BAFF;
(с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична SEQ ID NО:10, або фрагмента SEQ ID NО:10;
(d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NО:10, або фрагмента SEQ ID NО:10;
(е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90 % ідентична SEQ ID NО:10, або фрагмента SEQ ID NО:10;
(f) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 95 % ідентична SEQ ID NО:10, або фрагмента SEQ ID NО:10;
(g) SEQ ID NО:10 або фрагмента SEQ ID NО:10, модифікованих заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF.
3. Виділений поліпептид BAFF-R за п. 1 або 2, де поліпептид містить амінокислотну послідовність, вибрану з групи, яка складається з:
(а) амінокислот 19-35 послідовності SEQ ID NО:5;
(b) амінокислот 19-35 послідовності SEQ ID NО:5, яка модифікована заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF;
(с) SEQ ID NО:13; та
(d) SEQ ID NО:13, яка модифікована заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв’язується з BAFF.
4. Виділений поліпептид BAFF-R за п. 1, де поліпептид містить амінокислотну послідовність, вибрану з групи, яка складається з:
(a) SEQ ID NО:15;
(b) SEQ ID NО:16;
(c) SEQ ID NО:17;
(d) SEQ ID NО:18;
(е) SEQ ID NО:19;
(f) SEQ ID NО:20;
(g) SEQ ID NО:21;
(h) SEQ ID NО:22;
(i) SEQ ID NО:23;
(j) SEQ ID NО:24;
(k) SEQ ID NО:25;
(l) SEQ ID NО:26;
(m) SEQ ID NО:27;
(n) SEQ ID NO:28;
(о) SEQ ID NО:29;
(р) SEQ ID NО:30;
(q) SEQ ID NО:31;
(r) SEQ ID NО:32;
(s) фрагмента будь-якої послідовності (a)-(r), який зв'язується з BAFF; та
(t) будь-якої послідовності (а)-(s), яка модифікована заміною однієї або декількох консервативних амінокислот, де модифікований поліпептид зв’язується з BAFF.
5. Виділений поліпептид BAFF-R за п. 4, який містить амінокислотну послідовність, вибрану з групи, що складається з:
(a) SEQ ID NO:19;
(b) SEQ ID NО:22;
(c) SEQ ID NO:24;
(d) SEQ ID NO:25;
(е) SEQ ID NO:26;
(f) SEQ ID NO:27; і
(g) фрагмента будь-якої послідовності (a)-(f), який зв'язується з BAFF.
6. Виділений поліпептид BAFF-R за п. 1 або п. 2, де поліпептид зв'язується з BAFF і має знижену здатність до агрегації у порівнянні з відповідним нативним поліпептидом BAFF-R, і де поліпептид містить:
(a) SEQ ID NO:5 або SEQ ID NO:10, де одна або декілька неконсервативних амінокислот в ділянці С19-L27 природного поліпептиду BAFF-R замінена відповідними амінокислотами поліпептиду BAFF-R з послідовністю SEQ ID NO:9; або
(b) фрагмент (а), який зв'язується з BAFF.
7. Виділений поліпептид BAFF-R за п. 6, де заміни введені в одне або декілька положень, вибраних з групи, що складається з:
(a) V20, Р21, А22 і L27 послідовності SEQ ID NO:10;
(b) V41, Р42, А43 і L48 послідовності SEQ ID NO:12; і
(c) C19-L27 послідовності SEQ ID NO:10, яка містить амінокислоти 2-71.
8. Виділений поліпептид BAFF-R за п. 7, який містить амінокислоти 2-71 послідовності SEQ ID NO: 10, де змінені амінокислоти вибрані з групи, що складається з:
(a) V20N, P21Q, А22Т і L27P;
(b) V20N і L27P;
(c) P21Q і L27P;
(d) L27P;
(е) V20N і L27A; і
(f) V20N і L27S.
9. Виділений поліпептид BAFF-R за будь-яким з пп. 1-8, де поліпептид є химерним білком.
10. Виділений поліпептид BAFF-R за п. 9, який містить амінокислотну послідовність, вибрану з групи, що складається з:
(a) SEQ ID NO:12;
(b) фрагмента SEQ ID NO:12, який зв’язується з BAFF;
(с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NO:12, або фрагмента SEQ ID NO:12; та
(d) SEQ ID NO: 12 або фрагмента SEQ ID NO:12, модифікованого заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF.
11. Виділений поліпептид BAFF-R за п. 10, що містить амінокислоти 23-92 послідовності SEQ ID NO:12 і Fc-фрагмент IgG1 людини.
12. Виділений поліпептид BAFF-R за п. 9, що містить амінокислотну послідовність, вибрану з групи, яка складається з:
(a) Fc-фрагмент антитіла;
(b) послідовностей, отриманих з білка імуноглобуліну;
(c) гетерологічних сигнальних послідовностей ,або
(d) глутатіон S-трансферази.
13. Виділений білок за п. 9, який містить константний домен імуноглобуліну і поліпептид BAFF-R, вибраний з групи, яка складається з:
(a) будь-якої послідовності з SEQ ID NO:13; SEQ ID NO:15; SEQ ID NO:16; SEQ ID NO:17; SEQ ID NO:18; SEQ ID NO:19; SEQ ID NO:20; SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:23; SEQ ID NO:24; SEQ ID NO:25; SEQ ID NO:26; SEQ ID NO:27; SEQ ID NO:28; SEQ ID NO:29; SEQ ID NO:30; SEQ ID NO: 31; і SEQ ID NO:32; і
(b) фрагмента послідовності (а), який зв'язується з BAFF.
14. Виділений поліпептид BAFF-R, що містить амінокислотну послідовність, вибрану з групи, яка складається з:
(a) SEQ ID NO:9;
(b) фрагмента SEQ ID NO:9, який зв’язується з BAFF;
(с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична SEQ ID NO:9, або фрагмента SEQ ID NO:9;
(d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NO:9, або фрагмента SEQ ID NO:9;
(е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90 % ідентична SEQ ID NO:9, або фрагмента SEQ ID NO:9; та
(f) SEQ ID NO:9 або фрагмента SEQ ID NO:9, модифікованих заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF.
15. Виділений поліпептид BAFF-R, що містить амінокислотну послідовність, вибрану з групи, яка складається з:
(a) SEQ ID NO:14;
(b) фрагмента SEQ ID NO:14, який зв’язується з BAFF;
(с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична SEQ ID NO:14, або фрагмента SEQ ID NO:14;
(d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NO:14, або фрагмента SEQ ID NO:14;
(е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90 % ідентична SEQ ID NO:14, або фрагмента SEQ ID NO:14; або
(f) SEQ ID NO:14 або фрагмента SEQ ID NO:14, модифікованих заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF.
16. Молекула нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує поліпептид BAFF-R за п. 14 або п. 15.
17. Молекула нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує поліпептид BAFF-R за будь-яким з пп. 1-13.
18. Молекула нуклеїнової кислоти за п. 17, де молекула містить нуклеотидну послідовність, вибрану з групи, що складається з:
(a) SEQ ID NO:3;
(b) SEQ ID NO:4;
(c) SEQ ID NO:6;
(d) SEQ ID NO:11;
(е) нуклеотидів 67-276 послідовності SEQ ID NO:11;
(f) нуклеотидів 67-276 і 280-960 послідовності SEQ ID NO:11;
(g) фрагмента щонайменше зі 100 послідовних нуклеотидів будь-якої послідовності (a)-(е), що кодує поліпептид, який зв’язується з BAFF;
(h) фрагмента будь-якої послідовності (а)-(f), що кодує поліпептид, який зв'язується з BAFF;
(і) нуклеотидної послідовності, що кодує поліпептид, який зв'язується з BAFF, і щонайменше на 70 % ідентична будь-якій послідовності (a)-(h);
(j) нуклеотидної послідовності, що кодує поліпептид, який зв'язується з BAFF, і щонайменше на 80 % ідентична будь-якій послідовності (a)-(h);
(k) нуклеотидної послідовності, що кодує поліпептид, який зв'язується з BAFF, і щонайменше на 90 % ідентична будь-якій послідовності (a)-(h).
19. Молекула нуклеїнової кислоти за п. 17 або п. 18, де молекула кодує поліпептид BAFF-R, який містить амінокислотну послідовність, вибрану з групи, що складається з:
(a) SEQ ID NO:5 або фрагмента SEQ ID NO:5, що зв’язується з BAFF;
(b) SEQ ID NO:10 або фрагмента SEQ ID NO:10, що зв’язується з BAFF;
(c) SEQ ID NO:13 або фрагмента SEQ ID NO:13, що зв’язується з BAFF;
(d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична будь-якій послідовності (а)-(с);
(е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична будь-якій послідовності (а)-(с);
(f) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90% ідентична будь-якій послідовності (а)-(с).
20. Молекула нуклеїнової кислоти за будь-яким з пп. 17-19, де нуклеотидна послідовність кодує поліпептид, який менший від повнорозмірного BAFF-R і який зв'язується з BAFF.
21. Молекула нуклеїнової кислоти за п. 17, де поліпептид, який кодується, вибраний з групи, що складається з:
(a) SEQ ID NO:19;
(b) SEQ ID NO:22;
(c) SEQ ID NO:24;
(d) SEQ ID NO:25;
(е) SEQ ID NO:26;
(f) SEQ ID NO:27; і
(g) фрагмента будь-якої послідовності (a)-(f), який зв'язується з BAFF.
22. Молекула нуклеїнової кислоти, яка містить нуклеотидну послідовність, яка:
(a) гібридизується у жорстких умовах з SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6, або нуклеотидами 67-276 послідовності SEQ ID NO:11; і
(b) гібридизується в жорстких умовах з послідовностями, комплементарними SEQ ID NO:3 або SEQ ID NO:4; або
(с) є комплементарною нуклеотидній послідовності SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6 або нуклеотидам 67-276 послідовності SEQ ID NO:11,
де жорсткі умови (а) і (b) визначаються 6Х SSC, 50 мМ Tris-HCl (pH 7,5), 1 мМ EDTA, 0,02% PVP, 0,02% Ficoll, 0,02% BSA і 500 мг/мл денатурованої ДНК сперми лосося при 65 °С, а потім одним або декількома промиваннями в 0,2 х SSC, 0,1% BSA при 50 °С, і де послідовністю нуклеотидів (а), (b) та (с) не є EST Al250289, SEQ ID NO:2 або номер доступу в Genbank no.Z99716.
23. Молекула нуклеїнової кислоти за п. 22, де нуклеотидна послідовність комплементарна молекулі нуклеїнової кислоти за п. 18.
24. Молекула нуклеїнової кислоти за п. 16, яка містить послідовність нуклеїнової кислоти, вибрану з групи, що складається з:
(a) SEQ ID NO:8;
(b) фрагмента SEQ ID NO:8, що містить щонайменше 100 послідовних нуклеотидів;
(c) послідовності нуклеїнової кислоти, яка кодує SEQ ID NO:14;
(d) послідовності нуклеїнової кислоти, що кодує поліпептид, який щонайменше на 70 % ідентичний SEQ ID NO:14 та зв’язується з BAFF;
(е) послідовності нуклеїнової кислоти, що кодує поліпептид, який щонайменше на 90 % ідентичний SEQ ID NO:14 і зв’язується з BAFF; і
(f) послідовності нуклеїнової кислоти, яка комплементарна будь-якій послідовності (а)-(е).
25. Вектор, що містить молекулу нуклеїнової кислоти за будь-яким з пп. 17-23.
26. Клітина, що містить вектор за п. 25.
27. Клітина за п. 26, де клітина являє собою клітину яєчника китайського хом'яка.
28. Клітина за п. 26, що містить молекулу нуклеїнової кислоти за п. 19.
29. Антитіло або поліпептид, що містить антигензв’язувальний домен антитіла, де антитіло або антигензв’язувальний домен поліпептиду специфічно зв'язуються з частиною поліпептиду за будь-яким з пп. 1-15.
30. Антитіло або поліпептид за п. 29, де антитіло або антигензв’язувальний домен поліпептиду специфічно зв'язуються з поліпептидом BAFF-R, амінокислотна послідовність якого вибрана з групи, яка складається з:
(a) SEQ ID NO:5;
(b) SEQ ID NO:10;
(c) SEQ ID NO:13; і
(d) фрагмента будь-якої послідовності (а)-(с), який зв'язується з BAFF.
31. Антитіло або його антигензв’язувальний домен за п. 29 або 30, де антитіло або антигензв’язувальний домен поліпептиду є одним або декількома з наступних:
(a) моноклональним;
(b) поліклональним;
(c) химерним;
(d) гуманізованим;
(е) одноланцюговим антитілом;
(f) фрагментом Fab; і
(g) фрагментом F(ab)'2.
32. Антитіло або поліпептид за п. 31, де антитіло або антигензв’язувальний домен поліпептиду специфічно зв'язується з поліпептидом за п. 2 або п. 3.
33. Антитіло за пп. 29 або 30, яке отримане за допомогою:
(a) гібридомного клону #2.1, задепонованого як АТСС No. РТА-3689; або
(b) гібридомного клону #9.1, задепонованого як АТСС No. РТА-3688.
34. Антитіло за будь-яким з пп. 29-33 або поліпептид за будь-яким з пп. 29-32, де антитіло або антигензв’язувальний домен поліпептиду блокують зв’язування BAFF з BAFF-R.
35. Антитіло або поліпептид за п. 34, де антитіло або антигензв’язувальний домен поліпептиду є гуманізованими.
36. Антитіло або поліпептид за п. 30, де антитіло або антигензв’язувальний домен поліпептиду є гуманізованими.
37. Гібридома, яка продукує антитіло за п. 29, вибрана з групи, що складається з гібридомного клону #2.1, задепонованого як АТСС No РТА-3689, і гібридомного клону #9.1, задепонованого як АТСС No. РТА-3688.
38. Фармацевтична композиція, що містить молекулу, вибрану з групи, яка складається з:
(a) поліпептиду за будь-яким з пп. 1-13; і
(b) антитіла або поліпептиду, що містить антигензв’язувальний домен антитіла, за будь-яким з пп. 29-36.
39. Фармацевтична композиція за п.38, що містить антитіло або поліпептид, який складається з антигензв’язуючого домену антитіла за п.36.
40. Поліпептид за будь-яким з пп. 1-13 або антитіло або поліпептид, що містить антигензв’язувальний домен антитіла, за будь-яким з пп. 29-36, для застосування в терапії.
41. Застосування поліпептиду за будь-яким з пп. 1-13 або антитіла або поліпептиду, що містить антигензв’язувальний домен антитіла, за будь-яким з пп. 29-36, для виробництва лікарського засобу для лікування, профілактики або уповільнення настання стану, вибраного з групи, яка складається зі: стану, опосередкованого В-клітинами, захворювання плазмацитів, аутоімунного захворювання, пухлинного захворювання, гіпертензії, серцево-судинного захворювання, захворювання нирок, захворювання, пов'язаного з порушенням проліферації В-клітин, лімфоми Беркіта, імуносупресивного захворювання, трансплантації органів, запалення або ВІЛ.
42. Застосування за п. 41, де захворюванням плазмоцитів є множинна мієлома, макроглобулінемія Вальденстрема, хвороба важких ланцюгів, первинний амілоїдоз або амілоїдоз, асоційований з імуноцитами, або моноклональна гаммапатія невстановленої етиології (MGUS).
43. Застосування за п. 41, де аутоімунним захворюванням є ревматоїдний артрит, системний червоний вовчак, міастенія гравіс, аутоімунна гемолітична анемія, ідіопатична тромбоцитопенічна пурпура, антифосфоліпідний синдром, хвороба Чагаса, хвороба Грейва, грануломатоз Вегенера, поліартрит нодозний або гломерулонефрит.
43. Застосування за п. 41, де пухлинним захворюванням є В-клітинна карцинома, лейкемія або лімфома.
45. Застосування за п. 41, де фармацевтичну композицію вводять для лікування, профілактики або затримання розвитку системного червоного вовчака.
46. Застосування за п. 41, де фармацевтичну композицію вводять для лікування, профілактики або затримання розвитку ревматоїдного артриту.
47. Застосування за п. 41, де фармацевтична композиція містить поліпептид за п. 3 або п. 5 і її вводять для лікування, профілактики або затримки розвитку системного червоного вовчака.
48. Застосування за п. 41, де фармацевтична композиція містить антитіло або поліпептид, що містить антигензв’язувальний домен антитіла за п. 36, і її вводять для лікування, профілактики або затримки розвитку системного червоного вовчака.
49. Застосування за п. 41, де фармацевтична композиція містить поліпептид за п. 3 або п. 5 і вводять для лікування, профілактики або затримки розвитку ревматоїдного артриту.
50. Застосування за п. 41, де фармацевтична композиція містить антитіло або поліпептид, що містить антигензв’язувальний домен антитіла, за п. 36, і її вводять для лікування, профілактики або затримки розвитку ревматоїдного артриту.
51. Виділений нуклеотидний зонд, який складається з 10-50 послідовних нуклеотидів, вибраних з:
(a) послідовності, вибраної з групи, яка складається з SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:6;
(b) SEQ ID NO:8;
(c) послідовності, комплементарної до послідовності, вибраної з групи, яка складається з SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:6; і
(d) вироджених послідовностей (а) або (b), які кодують ту ж амінокислотну послідовність.
52. Спосіб отримання поліпептиду BAFF-R, який передбачає стадії:
(a) отримання клітини за будь-яким з пп. 26-28;
(b) культивування клітини в умовах, прийнятних для експресії поліпептиду BAFF-R; і
(c) виділення поліпептиду BAFF-R.
53. Спосіб ідентифікації функціонально активного мутантного поліпептиду BAFF-R за будь-яким з пп. 1-15, де спосіб включає оцінку мутанту BAFF-R на одну або декілька наступних активностей:
(a) на здатність зв'язуватися з BAFF;
(b) на здатність зв'язуватися з внутрішньоклітинним білком-мішенню або з його біологічно активною частиною;
(c) на здатність специфічно зв'язуватися з анти-BAFF-R антитілом,
де наявність однієї або декількох цих активностей вказує на те, що такий мутант BAFF-R є функціонально активним.
54. Спосіб ідентифікації сполуки, яка модулює активність поліпептиду BAFF-R, який передбачає стадії:
(a) контактування поліпептиду BAFF-R за пп. 1-15 із сполукою; і
(b) визначення чи була змінена активність BAFF-R.
55. Спосіб отримання поліпептиду BAFF-R із зниженою здатністю до агрегації у порівнянні з відповідним природним поліпептидом BAFF-R, який передбачає стадії:
(a) трансформування клітини-хазяїна нуклеїновою кислотою, що кодує поліпептид BAFF-R за будь-яким з пп. 1-15, в якому одна або декілька неконсервативних амінокислот у ділянці С19-L27 замінені відповідними амінокислотами поліпептиду BAFF-R послідовності SEQ ID NO:9;
(b) культивування клітини в умовах, прийнятних для експресії поліпептиду BAFF-R з замінами амінокислот(и); і
(c) виділення поліпептиду BAFF-R за (b).
56. Спосіб за п. 55 де неконсервативна амінокислота є неполярною амінокислотою.
57. Спосіб за п. 56, де неполярна амінокислота замінена амінокислотою, вибраною з групи, що складається з проліну, серину або аланіну.
58. Трансгенна тварина, яка не є людиною, в геном якої введені екзогенні послідовності нуклеїнової кислоти, що кодують поліпептид BAFF-R за будь-яким з пп.1-15, або в якої змінені ендогенні послідовності нуклеїнової кислоти, що кодують поліпептид BAFF-R.
59. Набір, що містить щонайменше одне антитіло за будь-яким з пп. 29-36 і контроль.
60. Спосіб ідентифікації клітин або тканин з порушеною експресією BAFF-R, що включає:
(а) контактування олігонуклеотидного зонда, що містить щонайменше 10 послідовних нуклеотидів послідовності, вибраних з: SEQ ID NO: 1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6, і послідовностей, які комплементарні будь-якій послідовності SEQ ID NO: 1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:6, з біологічним зразком індивідуума; і
(b) вимірювання рівня нуклеїнової кислоти, що кодує BAFF-R, у біологічному зразку за визначенням рівнів мРНК BAFF-R; або
(c) визначення чи була мутована або делетована нуклеїнова кислота BAFF-R у біологічному зразку.
61. Діагностичний набір для ідентифікації клітин або тканин з порушеною експресією BAFF-R, який містить олігонуклеотидний зонд, що включає щонайменше 10 послідовних нуклеотидів послідовності, вибраної з: SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6, і послідовності, які комплементарні будь-якій послідовності SEQ ID NO: 1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:6.
62. Набір для визначення присутності BAFF-R у біологічному зразку, який містить:
мічену сполуку або агент, здатний виявляти поліпептид BAFF-R за будь-яким з пп.1-15 або мРНК, що кодує поліпептид BAFF-R за будь-яким з пп. 1-15, у біологічному зразку; пристрій для визначення кількості BAFF-R у зразку; і пристрій для порівняння кількості BAFF-R у зразку зі стандартом.
63. Спосіб діагностики захворювання, опосередкованого В-клітинами, у індивідуума, який передбачає стадії:
(a) взяття біологічного зразка у індивідуума;
(b) вимірювання кількості поліпептиду BAFF-R за будь-яким з пп.1-15 або нуклеїнової кислоти BAFF-R, що кодує поліпептид BAFF за будь-яким з пп. 1-15, у зразку, який був взятий у індивідуума; і
(c) порівняння кількості поліпептиду BAFF-R або нуклеїнової кислоти BAFF-R у зразку, який був взятий у індивідуума, з кількістю поліпептиду BAFF-R або нуклеїнової кислоти BAFF-R контрольного зразка,
де відмінність кількості поліпептиду BAFF-R або нуклеїнової кислоти BAFF-R у зразку, який був взятий в індивідуума, і кількості поліпептиду BAFF-R або нуклеїнової кислоти BAFF-R контрольного зразка вказує на захворювання, опосередковане В-клітинами, в індивідуума.
64. Застосування поліпептиду за будь-яким з пп. 1-13 для отримання діагностичного агента для діагностики захворювання, опосередкованого В-клітинами.
65. Поліпептид BAFF-R, отриманий способом:
(a) культивування клітини-хазяїна, яка містить молекулу нуклеїнової кислоти, що кодує поліпептид за будь-яким з пп. 1-13 в умовах, достатніх для експресії поліпептиду BAFF-R;
(b) виділення експресованого поліпептиду.
66. Химерний поліпептид, отриманий способом:
(а) культивування клітини-хазяїна, що містить молекулу нуклеїнової кислоти, яка кодує химерний поліпептид BAFF-R за будь-яким з пп. 9-13; і
(b) виділення експресованого химерного поліпептиду BAFF-R.
67. Поліпептид BAFF-R за п. 65 або химерний поліпептид за п. 66, де поліпептид BAFF-R містить амінокислоти 2-71 SEQ ID NO:10 або його фрагмент, який зв'язується з BAFF.
68. Поліпептид BAFF-R за п. 65 або химерний поліпептид за п. 66, де поліпептид BAFF-R містить амінокислоти 2-71 SEQ ID NO:10.
69. Химерний поліпептид BAFF-R за будь-яким з пп.66-68, де поліпептид не-BAFF-R містить домен Fc людського IgG.
70. Поліпептид BAFF-R за п. 65 або химерний поліпептид за будь-яким з пп. 66-68, де клітина-хазяїн є клітиною ссавця.
71. Поліпептид за п.70, де клітина ссавця є клітиною яєчника китайського хом'яка.
72. Поліпептид за п. 70, де клітина ссавця є клітиною 293 EBNA.
73. Спосіб детектування BAFF-R в біологічному зразку, взятому в індивідуума, що включає:
(а) отримання біологічного зразка в індивідуума;
(b) детекцію поліпептиду BAFF-R за будь-яким з пп. 1-15 у зразку, взятому в індивідуума, використовуючи антитіло або поліпептид, що містить антигензв’язувальний домен антитіла, за будь-яким з пп. 29-36.
74. Спосіб за п. 73, де антитіло або антигензв’язувальний домен поліпептиду є одним або декількома з наступних:
(а) моноклональним;
(b) поліклональним;
(с) химерним;
(d) гуманізованим;
(e) одноланцюговим антитілом;
(f) фрагментом Fab; та
(g) фрагментом F(ab)’2.
75. Спосіб визначення чи є геномна полідовність BAFF-R мутованою або делетованою, що включає:
(а) отримання біологічного зразка в індивідуума; та
(b) визначення чи є геномна послідовність BAFF-R мутованою або делетованою, використовуючи молекулу нуклеїнової кислоти, здатної до гібридизації в жорстких умовах з геномними послідовностями BAFF-R людини (SEQ ID NO:10) або BAFF-R миші (SEQ ID NO:9);
де жорсткі умови визначаються 6Х SSC, 50 мМ Tris-HCl (pH 7,5), 1 мМ EDTA, 0,02 % PVP, 0,02 % Ficoll, 0,02% BSA і 500 мг/мл денатурованої ДНК сперми лосося при 65 °С, а потім одним або декількома промиваннями в 0,2 х SSC, 0,1 % BSA при 50 °С.
76. Застосування молекули нуклеїнової кислоти за будь-яким з пп. 17-23 для отримання діагностичного агента для діагностики захворювання, опосередкованого В-клітинами.
77. Застосування антитіла за будь-яким з пп. 29-36 для отримання діагностичного засобу для діагностики захворювання, опосередкованого В-клітин.
78. Застосування зонда за п. 51 для отримання діагностичного засобу для діагностики захворювання, опосередкованого В-клітинами.
Текст
1. Виділений поліпептид BAFF-R (рецептор фактора активації В-клітин сімейства TNF), що містить амінокислотну послідовність, вибрану з групи, яка складається з: (a) SEQ ID NО:5; (b) фрагмента SEQ ID NО:5, що зв’язується з BAFF (фактор активації В-клітин сімейства TNF); (с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична SEQ ID NО:5, або фрагмента SEQ ID NО:5; (d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NО:5, або фрагмента SEQ ID NО:5; (е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90% ідентична SEQ ID NО:5, або фрагмента SEQ ID NО:5; (f) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 95% ідентична SEQ ID NО:5, або фрагмента SEQ ID NО:5; і (g) SEQ ID NО:5 або фрагмента SEQ ID NО:5, модифікованих заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв’язується з BAFF. 2. Виділений поліпептид BAFF-R за п.1, де поліпептид містить амінокислотну послідовність, вибрану з групи, яка складається з: (a) SEQ ID NO:10; (b) фрагмента SEQ ID NО:10, який зв’язується з BAFF; (с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична SEQ ID NО:10, або фрагмента SEQ ID NО:10; (d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NО:10, або фрагмента SEQ ID NО:10; (е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90 % ідентична SEQ ID NО:10, або фрагмента SEQ ID NО:10; (f) амінокислотної послідовності, яка зв'язується з 4 BAFF і щонайменше на 95 % ідентична SEQ ID NО:10, або фрагмента SEQ ID NО:10; (g) SEQ ID NО:10 або фрагмента SEQ ID NО:10, модифікованих заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF. 3. Виділений поліпептид BAFF-R за п.1 або 2, де поліпептид містить амінокислотну послідовність, вибрану з групи, яка складається з: (а) амінокислот 19-35 послідовності SEQ ID NО:5; (b) амінокислот 19-35 послідовності SEQ ID NО:5, яка модифікована заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF; (с) SEQ ID NО:13; та (d) SEQ ID NО:13, яка модифікована заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв’язується з BAFF. 4. Виділений поліпептид BAFF-R за п.1, де поліпептид містить амінокислотну послідовність, вибрану з групи, яка складається з: (a) SEQ ID NО:15; (b) SEQ ID NО:16; (c) SEQ ID NО:17; (d) SEQ ID NО:18; (е) SEQ ID NО:19; (f) SEQ ID NО:20; (g) SEQ ID NО:21; (h) SEQ ID NО:22; (i) SEQ ID NО:23; (j) SEQ ID NО:24; (k) SEQ ID NО:25; (l) SEQ ID NО:26; (m) SEQ ID NО:27; (n) SEQ ID NO:28; (о) SEQ ID NО:29; (р) SEQ ID NО:30; (q) SEQ ID NО:31; (r) SEQ ID NО:32; (s) фрагмента будь-якої послідовності (a)-(r), який зв'язується з BAFF; та (t) будь-якої послідовності (а)-(s), яка модифікована заміною однієї або декількох консервативних амінокислот, де модифікований поліпептид зв’язується з BAFF. 5. Виділений поліпептид BAFF-R за п.4, який містить амінокислотну послідовність, вибрану з групи, що складається з: (a) SEQ ID NO:19; (b) SEQ ID NО:22; (c) SEQ ID NO:24; (d) SEQ ID NO:25; (е) SEQ ID NO:26; (f) SEQ ID NO:27; і (g) фрагмента будь-якої послідовності (a)-(f), який зв'язується з BAFF. 6. Виділений поліпептид BAFF-R за п.1 або п.2, де поліпептид зв'язується з BAFF і має знижену здатність до агрегації у порівнянні з відповідним нативним поліпептидом BAFF-R, і де поліпептид містить: (a) SEQ ID NO:5 або SEQ ID NO:10, де одна або декілька неконсервативних амінокислот в ділянці С19-L27 природного поліпептиду BAFF-R замінена відповідними амінокислотами поліпептиду BAFF-R з послідовністю SEQ ID NO:9; або 5 83458 (b) фрагмент (а), який зв'язується з BAFF. 7. Виділений поліпептид BAFF-R за п.6, де заміни введені в одне або декілька положень, вибраних з групи, що складається з: (a) V20, Р21, А22 і L27 послідовності SEQ ID NO:10; (b) V41, Р42, А43 і L48 послідовності SEQ ID NO:12; і (c) C19-L27 послідовності SEQ ID NO:10, яка містить амінокислоти 2-71. 8. Виділений поліпептид BAFF-R за п.7, який містить амінокислоти 2-71 послідовності SEQ ID NO: 10, де змінені амінокислоти вибрані з групи, що складається з: (a) V20N, P21Q, А22Т і L27P; (b) V20N і L27P; (c) P21Q і L27P; (d) L27P; (е) V20N і L27A; і (f) V20N і L27S. 9. Виділений поліпептид BAFF-R за будь-яким з пп.1-8, де поліпептид є химерним білком. 10. Виділений поліпептид BAFF-R за п.9, який містить амінокислотну послідовність, вибрану з групи, що складається з: (a) SEQ ID NO:12; (b) фрагмента SEQ ID NO:12, який зв’язується з BAFF; (с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NO:12, або фрагмента SEQ ID NO:12; та (d) SEQ ID NO: 12 або фрагмента SEQ ID NO:12, модифікованого заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF. 11. Виділений поліпептид BAFF-R за п.10, що містить амінокислоти 23-92 послідовності SEQ ID NO:12 і Fc-фрагмент IgG1 людини. 12. Виділений поліпептид BAFF-R за п.9, що містить амінокислотну послідовність, вибрану з групи, яка складається з: (a) Fc-фрагмент антитіла; (b) послідовностей, отриманих з білка імуноглобуліну; (c) гетерологічних сигнальних послідовностей ,або (d) глутатіон S-трансферази. 13. Виділений білок за п.9, який містить константний домен імуноглобуліну і поліпептид BAFF-R, вибраний з групи, яка складається з: (a) будь-якої послідовності з SEQ ID NO:13; SEQ ID NO:15; SEQ ID NO:16; SEQ ID NO:17; SEQ ID NO:18; SEQ ID NO:19; SEQ ID NO:20; SEQ ID NO:21; SEQ ID NO:22; SEQ ID NO:23; SEQ ID NO:24; SEQ ID NO:25; SEQ ID NO:26; SEQ ID NO:27; SEQ ID NO:28; SEQ ID NO:29; SEQ ID NO:30; SEQ ID NO: 31; і SEQ ID NO:32; і (b) фрагмента послідовності (а), який зв'язується з BAFF. 14. Виділений поліпептид BAFF-R, що містить амінокислотну послідовність, вибрану з групи, яка складається з: (a) SEQ ID NO:9; (b) фрагмента SEQ ID NO:9, який зв’язується з BAFF; (с) амінокислотної послідовності, яка зв'язується з 6 BAFF і щонайменше на 70 % ідентична SEQ ID NO:9, або фрагмента SEQ ID NO:9; (d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NO:9, або фрагмента SEQ ID NO:9; (е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90 % ідентична SEQ ID NO:9, або фрагмента SEQ ID NO:9; та (f) SEQ ID NO:9 або фрагмента SEQ ID NO:9, модифікованих заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF. 15. Виділений поліпептид BAFF-R, що містить амінокислотну послідовність, вибрану з групи, яка складається з: (a) SEQ ID NO:14; (b) фрагмента SEQ ID NO:14, який зв’язується з BAFF; (с) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична SEQ ID NO:14, або фрагмента SEQ ID NO:14; (d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична SEQ ID NO:14, або фрагмента SEQ ID NO:14; (е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90 % ідентична SEQ ID NO:14, або фрагмента SEQ ID NO:14; або (f) SEQ ID NO:14 або фрагмента SEQ ID NO:14, модифікованих заміною однієї або декількох консервативних амінокислот, де модифікована послідовність зв'язується з BAFF. 16. Молекула нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує поліпептид BAFF-R за п.14 або п.15. 17. Молекула нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує поліпептид BAFF-R за будь-яким з пп.1-13. 18. Молекула нуклеїнової кислоти за п.17, де молекула містить нуклеотидну послідовність, вибрану з гр упи, що складається з: (a) SEQ ID NO:3; (b) SEQ ID NO:4; (c) SEQ ID NO:6; (d) SEQ ID NO:11; (е) нуклеотидів 67-276 послідовності SEQ ID NO:11; (f) нуклеотидів 67-276 і 280-960 послідовності SEQ ID NO:11; (g) фрагмента щонайменше зі 100 послідовних нуклеотидів будь-якої послідовності (a)-(е), що кодує поліпептид, який зв’язується з BAFF; (h) фрагмента будь-якої послідовності (а)-(f), що кодує поліпептид, який зв'язується з BAFF; (і) нуклеотидної послідовності, що кодує поліпептид, який зв'язується з BAFF, і щонайменше на 70 % ідентична будь-якій послідовності (a)-(h); (j) нуклеотидної послідовності, що кодує поліпептид, який зв'язується з BAFF, і щонайменше на 80 % ідентична будь-якій послідовності (a)-(h); (k) нуклеотидної послідовності, що кодує поліпептид, який зв'язується з BAFF, і щонайменше на 90 % ідентична будь-якій послідовності (a)-(h). 19. Молекула нуклеїнової кислоти за п.17 або п.18, де молекула кодує поліпептид BAFF-R, який містить амінокислотну послідовність, вибрану з групи, 7 83458 що складається з: (a) SEQ ID NO:5 або фрагмента SEQ ID NO:5, що зв’язується з BAFF; (b) SEQ ID NO:10 або фрагмента SEQ ID NO:10, що зв’язується з BAFF; (c) SEQ ID NO:13 або фрагмента SEQ ID NO:13, що зв’язується з BAFF; (d) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 70 % ідентична будь-якій послідовності (а)-(с); (е) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 80 % ідентична будь-якій послідовності (а)-(с); (f) амінокислотної послідовності, яка зв'язується з BAFF і щонайменше на 90% ідентична будь-якій послідовності (а)-(с). 20. Молекула нуклеїнової кислоти за будь-яким з пп.17-19, де нуклеотидна послідовність кодує поліпептид, який менший від повнорозмірного BAFFR і який зв'язується з BAFF. 21. Молекула нуклеїнової кислоти за п.17, де поліпептид, який кодується, вибраний з групи, що складається з: (a) SEQ ID NO:19; (b) SEQ ID NO:22; (c) SEQ ID NO:24; (d) SEQ ID NO:25; (е) SEQ ID NO:26; (f) SEQ ID NO:27; і (g) фрагмента будь-якої послідовності (a)-(f), який зв'язується з BAFF. 22. Молекула нуклеїнової кислоти, яка містить нуклеотидну послідовність, яка: (a) гібридизується у жорстких умовах з SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6, або нуклеотидами 67-276 послідовності SEQ ID NO:11; і (b) гібридизується в жорстких умовах з послідовностями, комплементарними SEQ ID NO:3 або SEQ ID NO:4; або (с) є комплементарною нуклеотидній послідовності SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6 або нуклеотидам 67-276 послідовності SEQ ID NO:11, де жорсткі умови (а) і (b) визначаються 6Х SSC, 50 мМ Tris-HCl (pH 7,5), 1 мМ EDTA, 0,02% PVP, 0,02% Ficoll, 0,02% BSA і 500 мг/мл денатурованої ДНК сперми лосося при 65 °С, а потім одним або декількома промиваннями в 0,2 х SSC, 0,1% BSA при 50 °С, і де послідовністю нуклеотидів (а), (b) та (с) не є EST Al250289, SEQ ID NO:2 або номер доступ у в Genbank no.Z99716. 23. Молекула нуклеїнової кислоти за п.22, де нуклеотидна послідовність комплементарна молекулі нуклеїнової кислоти за п.18. 24. Молекула нуклеїнової кислоти за п.16, яка містить послідовність нуклеїнової кислоти, вибрану з групи, що складається з: (a) SEQ ID NO:8; (b) фрагмента SEQ ID NO:8, що містить щонайменше 100 послідовних нуклеотидів; (c) послідовності нуклеїнової кислоти, яка кодує SEQ ID NO:14; (d) послідовності нуклеїнової кислоти, що кодує поліпептид, який щонайменше на 70 % ідентичний 8 SEQ ID NO:14 та зв’язується з BAFF; (е) послідовності нуклеїнової кислоти, що кодує поліпептид, який щонайменше на 90 % ідентичний SEQ ID NO:14 і зв’язується з BAFF; і (f) послідовності нуклеїнової кислоти, яка комплементарна будь-якій послідовності (а)-(е). 25. Вектор, що містить молекулу нуклеїнової кислоти за будь-яким з пп.17-23. 26. Клітина, що містить вектор за п.25. 27. Клітина за п.26, де клітина являє собою клітину яєчника китайського хом'яка. 28. Клітина за п.26, що містить молекулу н уклеїнової кислоти за п.19. 29. Антитіло або поліпептид, що містить антигензв’язувальний домен антитіла, де антитіло або антигензв’язувальний домен поліпептиду специфічно зв'язуються з частиною поліпептиду за будьяким з пп.1-15. 30. Антитіло або поліпептид за п.29, де антитіло або антигензв’язувальний домен поліпептиду специфічно зв'язуються з поліпептидом BAFF-R, амінокислотна послідовність якого вибрана з групи, яка складається з: (a) SEQ ID NO:5; (b) SEQ ID NO:10; (c) SEQ ID NO:13; і (d) фрагмента будь-якої послідовності (а)-(с), який зв'язується з BAFF. 31. Антитіло або його антигензв’язувальний домен за п.29 або 30, де антитіло або антигензв’язувальний домен поліпептиду є одним або декількома з наступних: (a) моноклональним; (b) поліклональним; (c) химерним; (d) гуманізованим; (е) одноланцюговим антитілом; (f) фрагментом Fab; і (g) фрагментом F(ab)'2. 32. Антитіло або поліпептид за п.31, де антитіло або антигензв’язувальний домен поліпептиду специфічно зв'язується з поліпептидом за п.2 або п.3. 33. Антитіло за пп.29 або 30, яке отримане за допомогою: (a) гібридомного клону #2.1, задепонованого як АТСС No. РТА-3689; або (b) гібридомного клону #9.1, задепонованого як АТСС No. РТА-3688. 34. Антитіло за будь-яким з пп.29-33 або поліпептид за будь-яким з пп.29-32, де антитіло або антигензв’язувальний домен поліпептиду блокують зв’язування BAFF з BAFF-R. 35. Антитіло або поліпептид за п.34, де антитіло або антигензв’язувальний домен поліпептиду є гуманізованими. 36. Антитіло або поліпептид за п.30, де антитіло або антигензв’язувальний домен поліпептиду є гуманізованими. 37. Гібридома, яка продукує антитіло за п.29, вибрана з групи, що складається з гібридомного клону #2.1, задепонованого як АТСС No РТА-3689, і гібридомного клону #9.1, задепонованого як АТСС No. РТА-3688. 38. Фармацевтична композиція, що містить молекулу, вибрану з гр упи, яка складається з: 9 83458 (a) поліпептиду за будь-яким з пп.1-13; і (b) антитіла або поліпептиду, що містить антигензв’язувальний домен антитіла, за будь-яким з пп.29-36. 39. Фармацевтична композиція за п.38, що містить антитіло або поліпептид, який складається з антигензв’язуючого домену антитіла за п.36. 40. Поліпептид за будь-яким з пп.1-13 або антитіло або поліпептид, що містить антигензв’язувальний домен антитіла, за будь-яким з пп.29-36, для застосування в терапії. 41. Застосування поліпептиду за будь-яким з пп.113 або антитіла або поліпептиду, що містить антигензв’язувальний домен антитіла, за будь-яким з пп.29-36, для виробництва лікарського засобу для лікування, профілактики або уповільнення настання стану, вибраного з групи, яка складається зі: стану, опосередкованого В-клітинами, захворювання плазмацитів, аутоімунного захворювання, пухлинного захворювання, гіпертензії, серцевосудинного захворювання, захворювання нирок, захворювання, пов'язаного з порушенням проліферації В-клітин, лімфоми Беркіта, імуносупресивного захворювання, трансплантації органів, запалення або ВІЛ. 42. Застосування за п.41, де захворюванням плазмоцитів є множинна мієлома, макроглобулінемія Вальденстрема, хвороба важких ланцюгів, первинний амілоїдоз або амілоїдоз, асоційований з імуноцитами, або моноклональна гаммапатія невстановленої етиології (MGUS). 43. Застосування за п.41, де аутоімунним захворюванням є ревматоїдний артрит, системний червоний вовчак, міастенія гравіс, аутоімунна гемолітична анемія, ідіопатична тромбоцитопенічна пурпура, антифосфоліпідний синдром, хвороба Чагаса, хвороба Грейва, грануломатоз Вегенера, поліартрит нодозний або гломерулонефрит. 43. Застосування за п.41, де пухлинним захворюванням є В-клітинна карцинома, лейкемія або лімфома. 45. Застосування за п.41, де фармацевтичну композицію вводять для лікування, профілактики або затримання розвитку системного червоного вовчака. 46. Застосування за п.41, де фармацевтичну композицію вводять для лікування, профілактики або затримання розвитку ревматоїдного артриту. 47. Застосування за п.41, де фармацевтична композиція містить поліпептид за п.3 або п.5 і її вводять для лікування, профілактики або затримки розвитку системного червоного вовчака. 48. Застосування за п.41, де фармацевтична композиція містить антитіло або поліпептид, що містить антигензв’язувальний домен антитіла за п.36, і її вводять для лікування, профілактики або затримки розвитку системного червоного вовчака. 49. Застосування за п.41, де фармацевтична композиція містить поліпептид за п.3 або п.5, її вводять для лікування, профілактики або затримки розвитку ревматоїдного артриту. 50. Застосування за п.41, де фармацевтична композиція містить антитіло або поліпептид, що містить антигензв’язувальний домен антитіла, за п.36, і її вводять для лікування, профілактики або 10 затримки розвитку ревматоїдного артриту. 51. Виділений нуклеотидний зонд, який складається з 10-50 послідовних нуклеотидів, вибраних з: (a) послідовності, вибраної з групи, яка складається з SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:6; (b) SEQ ID NO:8; (c) послідовності, комплементарної до послідовності, вибраної з групи, яка складається з SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:6; і (d) вироджених послідовностей (а) або (b), які кодують ту ж амінокислотну послідовність. 52. Спосіб отримання поліпептиду BAFF-R, який передбачає стадії: (a) отримання клітини за будь-яким з пп.26-28; (b) культивування клітини в умовах, прийнятних для експресії поліпептиду BAFF-R; і (c) виділення поліпептиду BAFF-R. 53. Спосіб ідентифікації функціонально активного мутантного поліпептиду BAFF-R за будь-яким з пп.1-15, де спосіб включає оцінку мутанту BAFF-R на одну або декілька наступних активностей: (a) на здатність зв'язуватися з BAFF; (b) на здатність зв'язуватися з внутрішньоклітинним білком-мішенню або з його біологічно активною частиною; (c) на здатність специфічно зв'язуватися з антиBAFF-R антитілом, де наявність однієї або декількох цих активностей вказує на те, що такий мутант BAFF-R є функціонально активним. 54. Спосіб ідентифікації сполуки, яка модулює активність поліпептиду BAFF-R, який передбачає стадії: (a) контактування поліпептиду BAFF-R за пп.1-15 із сполукою; і (b) визначення чи була змінена активність BAFF-R. 55. Спосіб отримання поліпептиду BAFF-R із зниженою здатністю до агрегації у порівнянні з відповідним природним поліпептидом BAFF-R, який передбачає стадії: (a) трансформування клітини-хазяїна нуклеїновою кислотою, що кодує поліпептид BAFF-R за будьяким з пп.1-15, в якому одна або декілька неконсервативних амінокислот у ділянці С19-L27 замінені відповідними амінокислотами поліпептиду BAFF-R послідовності SEQ ID NO:9; (b) культивування клітини в умовах, прийнятних для експресії поліпептиду BAFF-R з замінами амінокислот(и); і (c) виділення поліпептиду BAFF-R за (b). 56. Спосіб за п.55 де неконсервативна амінокислота є неполярною амінокислотою. 57. Спосіб за п.56, де неполярна амінокислота замінена амінокислотою, вибраною з групи, що складається з проліну, серину або аланіну. 58. Трансгенна тварина, яка не є людиною, в геном якої введені екзогенні послідовності нуклеїнової кислоти, що кодують поліпептид BAFF-R за будь-яким з пп.1-15, або в якої змінені ендогенні послідовності нуклеїнової кислоти, що кодують поліпептид BAFF-R. 59. Набір, що містить щонайменше одне антитіло за будь-яким з пп.29-36 і контроль. 60. Спосіб ідентифікації клітин або тканин з пору 11 83458 шеною експресією BAFF-R, що включає: (а) контактування олігонуклеотидного зонда, що містить щонайменше 10 послідовних нуклеотидів послідовності, вибраних з: SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6, і послідовностей, які комплементарні будь-якій послідовності SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:6, з біологічним зразком індивідуума; і (b) вимірювання рівня нуклеїнової кислоти, що кодує BAFF-R, у біологічному зразку за визначенням рівнів мРНК BAFF-R; або (c) визначення чи була мутована або делетована нуклеїнова кислота BAFF-R у біологічному зразку. 61. Діагностичний набір для ідентифікації клітин або тканин з порушеною експресією BAFF-R, який містить олігонуклеотидний зонд, що включає щонайменше 10 послідовних нуклеотидів послідовності, вибраної з: SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:6, і послідовності, які комплементарні будь-якій послідовності SEQ ID NO: 1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:6. 62. Набір для визначення присутності BAFF-R у біологічному зразку, який містить: мічену сполуку або агент, здатний виявляти поліпептид BAFF-R за будь-яким з пп.1-15 або мРНК, що кодує поліпептид BAFF-R за будь-яким з пп.115, у біологічному зразку; пристрій для визначення кількості BAFF-R у зразку; і пристрій для порівняння кількості BAFF-R у зразку зі стандартом. 63. Спосіб діагностики захворювання, опосередкованого В-клітинами, у індивідуума, який передбачає стадії: (a) взяття біологічного зразка у індивідуума; (b) вимірювання кількості поліпептиду BAFF-R за будь-яким з пп.1-15 або нуклеїнової кислоти BAFFR, що кодує поліпептид BAFF за будь-яким з пп.115, у зразку, який був взятий у індивідуума; і (c) порівняння кількості поліпептиду BAFF-R або нуклеїнової кислоти BAFF-R у зразку, який був взятий у індивідуума, з кількістю поліпептиду BAFF-R або нуклеїнової кислоти BAFF-R контрольного зразка, де відмінність кількості поліпептиду BAFF-R або нуклеїнової кислоти BAFF-R у зразку, який був взятий в індивідуума, і кількості поліпептиду BAFFR або нуклеїнової кислоти BAFF-R контрольного зразка вказує на захворювання, опосередковане В-клітинами, в індивідуума. 64. Застосування поліпептиду за будь-яким з пп.113 для отримання діагностичного агента для діагностики захворювання, опосередкованого Вклітинами. 65. Поліпептид BAFF-R, отриманий способом: (a) культивування клітини-хазяїна, яка містить молекулу нуклеїнової кислоти, що кодує поліпептид за будь-яким з пп.1-13 в умовах, достатні х для експресії поліпептиду BAFF-R; (b) виділення експресованого поліпептиду. 66. Химерний поліпептид, отриманий способом: (а) культивування клітини-хазяїна, що містить молекулу нуклеїнової кислоти, яка кодує химерний поліпептид BAFF-R за будь-яким з пп.9-13; і (b) виділення експресованого химерного поліпеп 12 тиду BAFF-R. 67. Поліпептид BAFF-R за п.65 або химерний поліпептид за п.66, де поліпептид BAFF-R містить амінокислоти 2-71 SEQ ID NO:10 або його фрагмент, який зв'язується з BAFF. 68. Поліпептид BAFF-R за п.65 або химерний поліпептид за п.66, де поліпептид BAFF-R містить амінокислоти 2-71 SEQ ID NO:10. 69. Химерний поліпептид BAFF-R за будь-яким з пп.66-68, де поліпептид не-BAFF-R містить домен Fc людського IgG. 70. Поліпептид BAFF-R за п.65 або химерний поліпептид за будь-яким з пп.66-68, де клітина-хазяїн є клітиною ссавця. 71. Поліпептид за п.70, де клітина ссавця є клітиною яєчника китайського хом'яка. 72. Поліпептид за п.70, де клітина ссавця є клітиною 293 EBNA. 73. Спосіб детектування BAFF-R в біологічному зразку, взятому в індивідуума, що включає: (а) отримання біологічного зразка в індивідуума; (b) детекцію поліпептиду BAFF-R за будь-яким з пп.1-15 у зразку, взятому в індивідуума, використовуючи антитіло або поліпептид, що містить антигензв’язувальний домен антитіла, за будь-яким з пп.29-36. 74. Спосіб за п.73, де антитіло або антигензв’язувальний домен поліпептиду є одним або декількома з наступних: (а) моноклональним; (b) поліклональним; (с) химерним; (d) гуманізованим; (e) одноланцюговим антитілом; (f) фрагментом Fab; та (g) фрагментом F(ab)’2. 75. Спосіб визначення чи є геномна полідовність BAFF-R мутованою або делетованою, що включає: (а) отримання біологічного зразка в індивідуума; та (b) визначення чи є геномна послідовність BAFF-R мутованою або делетованою, використовуючи молекулу нуклеїнової кислоти, здатної до гібридизації в жорстких умовах з геномними послідовностями BAFF-R людини (SEQ ID NO:10) або BAFF-R миші (SEQ ID NO:9); де жорсткі умови визначаються 6Х SSC, 50 мМ Tris-HCl (pH 7,5), 1 мМ EDTA, 0,02 % PVP, 0,02 % Ficoll, 0,02% BSA і 500 мг/мл денатурованої ДНК сперми лосося при 65 °С, а потім одним або декількома промиваннями в 0,2 х SSC, 0,1 % BSA при 50 °С. 76. Застосування молекули нуклеїнової кислоти за будь-яким з пп.17-23 для отримання діагностичного агента для діагностики захворювання, опосередкованого В-клітинами. 77. Застосування антитіла за будь-яким з пп.29-36 для отримання діагностичного засобу для діагностики захворювання, опосередкованого В-клітин. 78. Застосування зонда за п.51 для отримання діагностичного засобу для діагностики захворювання, опосередкованого В-клітинами. 13 83458 Даний винахід забезпечує новий рецепторний білок. Даний винахід відноситься, загалом, до нуклеїнових кислот і поліпептидів. Більш конкретно, даний винахід відноситься до нуклеїнових кислот, які кодують поліпептиди, що відносяться до рецептора BAFF, фактора активації В-клітин, що належить до сімейства Факторів Некрозу Пухлин («TNF»), який пов'язаний з експресією В-клітин і імуноглобулінів. Цей рецептор може бути використаний для лікування раків, лімфом, аутоімунних захворювань або спадкових генетичних порушень, в яких беруть участь В-клітини. Даний винахід відноситься до нового рецептора в сімействі TNF. Новий рецептор ідентифікований як ВAFF-рецептор («BAFF-R»). Сімейство TNF складається з пар лігандів і їх специфічних рецепторів, названих лігандами сімейства TNF і рецепторами сімейства TNF [Bazzoni and Beutler (1996) N.Engl. J.Med. 334(26): 1717-1725]. Це сімейство бере участь у регуляції імунної системи і, можливо, інших неімунологічних систем. Ця регуляція часто знаходиться на рівні «основного перемикання», так що передача сигналу сімейства TKF може приводити до великого числа подальших подій, найкраще визначених для TNF. TNF може ініціювати загальну захисну запальну реакцію організму на чужорідну інвазію, яка включає в себе змінене представлення молекул адгезії, що беруть участь в переміщенні клітин, продукування хемокінів для переміщення специфічних клітин в специфічні компартменти і примування (сенсибілізацію) різних ефекторних клітин. Як така регуляція цих шля хів має клінічний потенціал. Вважається, що індукція різних клітинних реакцій, опосередкована такими цитокінами сімейства TNF, ініціюється їх скріпленням зі специфічними клітинними рецепторами. Були ідентифіковані, щонайменше, два TNF-рецептора, що розрізняються, приблизно 55кДа (TNFR1) і 75кДа (TNFR2) [Hohman et al. (1989) J.Biol. Chem. 264: 1492714934; and Brockhaus et al. (1990) Proc. Natl. Acad. Sci. USA 87: 3127-3131]. Широкий поліморфізм був асоційований з генами обох TNF-рецепторів. Обидва TNFR мають загальну типову структуру рецепторів клітинної поверхні, що включає позаклітинний, трансмембранний і внутрішньоклітинний домени. Позаклітинна частина TNFR типу 1 і типу 2 містить картину амінокислотної послідовності, що повторюється, з чотирьох багати х цистеїнами доменів (CDR). Схожа картина CDR, що повторюється, існує в декількох інших білках клітинної поверхні, в тому числі рецепторі фактора зростання нервів р75, антигені CD40 В-клітин, нарівні з іншими. Ці рецептори є могутніми інструментами для з'ясування біологічних шляхів внаслідок легкості і перетворення в злиті з імуноглобулінами білки. Ці димерні форми розчинного рецептора є хорошими інгібіторами подій, опосередкованих або секретованими, або пов'язаними з поверхнею лігандами. 14 За допомогою скріплення з такими лігандами вони перешкоджають взаємодії цього ліганду з пов'язаними з клітинами рецепторами, які можуть передавати сигнал. Ці злиті білки рецептор-Fc не тільки застосовні в експериментальному значенні, але вони були успішно використані клінічно у вигляді TNF-R-Fc для лікування запалення кишечнику, ревматоїдного артриту і гострого клінічного синдрому, суп утнього введенню ОКТЗ (антигенного маркера популяції зрілих периферичних Тлімфоцитів у людини) [Eason et al. (1996) Transplantation 61 (2): 224-228; Feldmann et al. (1996) Int. Arch. Allergy Immunol. Ill (4): 362-365; і van Dullemen et al. (1995) Gastroenterol 109 (1): 129-135]. Можна передбачити, що маніпулювання багатьма подіями, опосередкованими передачею сигналів через сімейство TNF-рецепторів, буде мати широке застосування для лікування захворювань, в основі яких лежить порушення імунної системи, а також великого діапазону захворювань людини, які мають патологічні ускладнення внаслідок участі імунної системи. Розчинна форма нещодавно описаного рецептора, остеопротегерину, може блокувати втрату кісткової маси (остеопорозу), і, о тже, події, регульовані передачею сигналу рецептором TNF-сімейства, необов'язково обмежуються тільки регуляцією імунної системи [Simonet et al. (1997) Cell 89 (2): 309-319]. Антитіла до цього рецептора можуть блокувати скріплення ліганду і, отже, можуть також мати клінічне застосування. Такі антитіла часто є дуже довго живучими і можуть мати переваги над злитими білками розчинний рецептор-Fc, які мають більш короткі півперіоди існування в крові. Хоча інгібування опосередкованого рецептором шляху представляє терапевтичне застосування цих рецепторів, що найбільш використовується, застосуванням, що спочатку використовувалось, була активація TNF-рецепторів, яка виявила клінічну перспективу [Aggarwal and Natarajan (1996) Eur Cytokine Netw. 7 (2): 93-124]. Активація TNFрецепторів може ініціювати загибель клітин в клітинах-мішенях, і, отже, застосування до пухлин було і все ще залишається привабливим [Eggermont et al. (1996) Ann. Surg. 224 (6): 756765]. Цей рецептор може активува тися або введенням ліганду, тобто природним шляхом, або деякими антитілами, які можуть зшивати рецептор і є також сильними агоністами. Антитіла могли б мати перевагу в онкології, оскільки вони можуть зберігатися в крові протягом тривалих періодів, тоді як ліганди звичайно мають коротку тривалість життя в крові. Оскільки багато які з цих рецепторів можуть експресуватись більш селективно в пухлинах або вони можуть тільки передавати сигнал загибелі клітин або диференціювання в пухлинах, агоністичні антитіла могли б бути хорошою зброєю для лікування раку. Подібним чином, численні позитивні імунологічні події опосередковуються через рецептори TNF-сімейства, наприклад, запальні реакції хазяїна, продукування антитіл і т.д., і, отже, 15 83458 агоністичні антитіла могли б мати корисні ефекти в інших, неонкологічних застосуваннях. Парадоксально, інгібування шляху може мати клінічну користь при лікуванні пухлин. Наприклад, деякими пухлинами експресується Fas-ліганд, і ця експресія може приводити до загибелі Fasпозитивних лімфоцитів, полегшуючи тим самим здатність пухлини ухилятися від дії імунної системи. У цьому випадку інгібування Fas-системи могло б потім дозволити імунній системі реагувати з пухлиною іншими шляхами тепер, коли доступ є можливим [Green and Ware (1997) Proc. Natl( Acad. Sci. USA 94 (12): 5986-90]. Ліганд BAFF TNF-сімейства, також відомий як TALL-1, TH ANK, BL yS і zTNF4 [Sclneider et al. (1999) J. Exp. Med. 189 (11): 1747-1756; Shu et al. (1999) J. Leukoc. Biol 65 (5): 680-683; Mukhopadhyay et al. (1999) J. Biol Chem. 274 (23): 15978-15981; Moore et al. (1999) Science 285 (5425): 260-263; Gross et al. (2000) Nature 404 (6781): 995-999] посилює виживання В-клітин in vitro [Batten et al. (2000) J. Exp. Med. 192 (10): 14531466] і стає ключовим регулятором популяцій периферичних В-клітин in vivo. Миші, які понадекспресують BAFF, виявляють гіперплазію зрілих Вклітин і симптоми системного червоного вовчака (SLE) [Mackay et al. (1999) J. Exp. Med. 190 (11): 1697-1710]. Деякі пацієнти з SLE мають також значуще збільшені рівні BAFF в їх сироватці [Zhang et al. (2001) J. Immunol. 166 (1): 6-10]. Таким чином, було зроблене припущення, що аномально високі рівні цього ліганду можуть сприяти патогенезу аутоімунних захворювань за допомогою посилення виживання аутореактивних В-клітин [Batten et al. (2000) J. Exp. Med. 192 (10): 1453-1466]. BAFF, мембранний білок типу 2, продукується клітинами мієлоїдного походження [Schneider et al. (1999) J. Exp. Med. 189 (11): 1747-1756; Moore et al. (1999) Science 285 (5425): 260-263] і експресується або на клітинній поверхні, або знаходиться в розчинній формі [Schneider et al. (1999) J. Exp. Med. 189 (11): 1747-1756]. Раніше було показано, що два члени сімейства TNF-рецепторів, ВСМА і ТАСІ, взаємодіють з BAFF [Gross et al. (2000) Nature 404: 995-999; Thompson et al. (2000) J. Exp. Med. 192 (1): 129-135; Xia et al. (2000) J. Exp. Med. 192: 137-143; Marsters et al. (2000) Curr. Biol. 10 (13): 785-788; Shu et al. (2000) J. Leukoc. Biol. 65 (5): 680-683; Wu et al. (2000) J. Biol. Chem. 275: 3547835485]. Даний винахід оснований, частково, на виявленні "BAFF-R", рецепторного білка BAFF, полінуклеотидних послідовностей BAFF-R і поліпептидів BAFF-R, що кодуються цими послідовностями нуклеїнових кислот. В одному аспекті даний винахід забезпечує ізольовану молекулу нуклеїнової кислоти, яка кодує BAFF-R-поліпептид, або її фрагмент або похідне. Ця нуклеїнова кислота може включати в себе, наприклад, послідовність нуклеїнової кислоти, яка кодує поліпептид, щонайменше, на 50% ідентичний, або, щонайменше, на 90% ідентичний поліпептиду, що включає амінокислотну послідовність Фіг.2D (SEQ ID NО:5). 16 Даний винахід забезпечує також по суті чисту молекулу н уклеїнової кислоти, що містить послідовність, яка гібридизується при жорстких умовах з гібридизаційним зондом, причому послідовність нуклеїнової кислоти цього зонда складається з кодуючої послідовності Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) або комплементу вказаної кодуючої послідовності. У деяких варіантах послідовність нуклеїнової кислоти кодує поліпептид, що має послідовність Фіг.2D (SEQ ID NО:5) з, щонайменше, однією консервативною заміною амінокислоти. У деяких варіантах послідовність нуклеїнової кислоти кодує поліпептид, який зв'язує BAFF. Нуклеїнова кислота може включати в себе, наприклад, нуклеїнову кислоту, що включає в себе нуклеотидну послідовність, показану на Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6). Нуклеїнова кислота може бути, наприклад, фрагментом геномної ДНК, або вона може бути молекулою кДНК. У даний винахід включені також вектор, що містить одну або декілька з описаних тут н уклеїнових кислот, і клітина, що містить описані тут вектори або нуклеїнові кислоти. В іншому аспекті даний винахід забезпечує по суті чисту молекулу нуклеїнової кислоти, що кодує злитий білок, що включає, щонайменше, два сегменти, де один з цих сегментів включає поліпептид або його фрагмент, описані в амінокислотних послідовностях, приведених у вказаних вище варіантах даного винаходу. Даний винахід забезпечує також злитий білок, що включає, щонайменше, два або три сегменти, де перший сегмент включає гетерологічний сигнальний поліпептид, другий включає поліпептид або його фрагмент, описані в амінокислотних послідовностях BAFF-R, вказаних в приведених вище варіантах даного винаходу, і третій сегмент включає поліпептид імуноглобуліну. Альтернативно, перший сегмент включає фрагмент поліпептиду імуноглобуліну, що містить сигнальну послідовність, а другий сегмент включає фрагмент поліпептиду BAFF-R. В інших аспектах даний винахід забезпечує по суті чистий зв'язувальний агент, який специфічно зв'язується з поліпептидом вищезгаданих варіантів даного винаходу. Даний винахід відноситься також до клітинхазяїв, трансформованих рекомбінантним експресуючим вектором, що містить будь-яку з вищеописаних молекул нуклеїнових кислот. В іншому аспекті даний винахід включає в себе фармацевтичну композицію, яка включає в себе нуклеїнову кислоту BAFF-R і фармацевтично прийнятний носій або розріджувач. У наступному аспекті даний винахід включає в себе по суті очищений поліпептид BAFF-R, наприклад, будь-який з поліпептидів, що кодуються нуклеїновою кислотою BAFF-R. Даний винахід включає в себе також фармацевтичну композицію, яка включає в себе поліпептид BAFF-R і фармацевтично прийнятний носій або розріджувач. 17 83458 Ще в одному варіанті даний винахід забезпечує антитіло, яке зв'язується специфічно з поліпептидом BAFF-R. Це антитіло може бути, наприклад, моноклональним або поліклональним антитілом. Даний винахід включає в себе також фармацевтичну композицію, що включає в себе BAFF-R-антитіло і фармацевтично прийнятний носій або розріджувач. Даний винахід відноситься також до виділених антитіл, які зв'язуються з епітопом на поліпептиді, що кодується будь-якою з молекул нуклеїнових кислот, описаних вище. Далі, даний винахід відноситься до наборів, що містять антитіла, які зв'язуються з поліпептидом, що кодується будь-якою з молекул нуклеїнових кислот, описаних вище, і антитіло негативного контролю. Даний винахід забезпечує, далі, спосіб для одержання поліпептиду BAFF-R. Цей спосіб передбачає забезпечення клітини, що містить нуклеїнову кислоту BAFF-R, наприклад, вектора, який включає в себе нуклеїнову кислоту BAFF-R, і культивування цієї клітини в умовах, достатніх для експресії поліпептиду BAFF-R, що кодується цією нуклеїновою кислотою. Потім експресований поліпептид BAFF-R витягують з даної клітини. Переважно, клітина продукує мало ендогенного поліпептиду BAFF-R або взагалі не продукує ендогенний поліпептид BAFF-R. Ця клітина може бути, наприклад, прокаріотичною клітиною або еукаріотитчною клітиною. Даний винахід забезпечує спосіб індукції імунної відповіді у ссавця проти поліпептиду, що кодується будь-якою з описаних вище молекул нуклеїнових кислот, введенням цьому ссавцеві кількості поліпептиду, достатньої для індукції імунної відповіді. Даний винахід відноситься також до способів ідентифікації сполуки, яка зв'язується з поліпептидом BAFF-R, за допомогою контактування поліпептиду BAFF-R зі сполукою і визначення, чи зв'язується ця сполука з поліпептидом BAFF-R. Даний винахід відноситься також до способів ідентифікації сполуки, яка зв'язується з молекулою нуклеїнової кислоти, що кодує поліпептид BAFF-R, за допомогою контактування нуклеїнової кислоти BAFF-R зі сполукою і визначення, чи зв'язується ця сполука з цією молекулою нуклеїнової кислоти. Даний винахід забезпечує також способи ідентифікації сполуки, яка модулює активність поліпептиду BAFF-R, за допомогою контактування поліпептиду BAFF-R зі сполукою і визначення, чи модифікована активність цього поліпептиду BAFF-R. Даний винахід відноситься також до сполук, які модулюють активність поліпептиду BAFF-R, ідентифікованих за допомогою контактування поліпептиду BAFF-R зі сполукою і визначення, чи модифікує ця сполука активність поліпептиду BAFF-R, зв'язується з поліпептидом BAFF-R або зв'язується з молекулою нуклеїнової кислоти, що кодує поліпептид BAFF-R. В іншому аспекті даний винахід забезпечує спосіб діагностики опосередкованого В-клітинами стану, наприклад, аутоімунного порушення або раку, у суб'єкта. Цей спосіб передбачає забезпе 18 чення проби білка з суб'єкта і вимірювання кількості поліпептиду BAFF-R в цій пробі суб'єкта. Потім кількість BAFF-R в пробі суб'єкта порівнюють з кількістю поліпептиду BAFF-R в контрольній пробі білка. Зміна в кількості поліпептиду BAFF-R в пробі білка суб'єкта відносно кількості поліпептиду BAFF-R в контрольній пробі білка вказує на те, що суб'єкт має опосередкований В-клітинами стан. Контрольну пробу переважно беруть з відповідного індивідуума, тобто індивідуума схожого віку, тієї ж статі або іншого загального стану, але в якому не передбачається наявність цього стану. Альтернативно, контрольна проба може бути взята з суб'єкта в той час, коли в цьому суб'єктові не передбачали наявності даного порушення. У деяких варіантах, поліпептид ВAFF-R детектують з використанням BAFF-R-антитіла. У наступному аспекті даний винахід включає в себе спосіб діагностики опосередкованого Вклітинами стану, наприклад, аутоімунного порушення у суб'єкта. Цей спосіб передбачає забезпечення проби нуклеїнової кислоти, наприклад, РНК або ДНК, або обох, з суб'єкта і вимірювання кількості цієї нуклеїнової кислоти BAFF-R в пробі нуклеїнової кислоти суб'єкта. Потім цю кількість нуклеїнової кислоти BAFF-R в пробі нуклеїнової кислоти суб'єкта порівнюють з кількістю нуклеїнової кислоти BAFF-R в контрольній пробі. Зміна в кількості нуклеїнової кислоти BAFF-R в даній пробі відносно кількості нуклеїнової кислоти BAFF-R в контрольній пробі вказує на те, що даний суб'єкт має аутоімунний стан. У наступному аспекті даний винахід включає в себе спосіб діагностики онкогенного або аутоімунного стану у суб'єкта. Цей спосіб передбачає забезпечення проби нуклеїнової кислоти з суб'єкта та ідентифікацію, щонайменше, частини нуклеотидної послідовності нуклеїнової кислоти BAFF-R в пробі нуклеїнової кислоти суб'єкта. Потім цю кількість нуклеотидної послідовності BAFF-R в пробі суб'єкта порівнюють з нуклеотидною послідовністю BAFF-R контрольної проби. Зміна в нуклеотидній послідовності BAFF-R в пробі відносно нуклеотидної послідовності BAFF-R у вказаній контрольній пробі вказує, що суб'єкт має такий стан. У ще одному аспекті даний винахід забезпечує спосіб лікування або попередження або сповільнення опосередкованого В-клітинами стану. Цей спосіб включає в себе введення суб'єкту, для якого бажане таке лікування або попередження або сповільнення, нуклеїнової кислоти BAFF-R, поліпептиду BAFF-R або aHTH-BAFF-антитіла в кількості, достатній для лікування, попередження або сповільнення онкогенного або імунорегуляторного стану у суб'єкта. Стани, що діагностуються, які піддаються лікуванню, попереджаються або сповільнюються з використанням молекул нуклеїнових кислот BAFFR, поліпептидів BAFF-R або BAFF-R-антитіл, можуть бути раком або імунорегуляторним захворюванням. Ці захворювання включають в себе захворювання, які є аутоімунними за природою, такі як системний червоний вовчак, ревматоїдний артрит, важка псевдопаралітична міастенія, аутоімун 19 83458 на гемолітична анемія, ідіопатична тромбоцитопенічна пурпура, антифосфоліпідний синдром, хвороба Шагаса, хвороба Грейвса, гранулематоз Вегенера, нодозний поліартеріїт і швидко прогресуючий гломерулонефрит. Цей терапевтичний агент має також застосування в порушеннях плазматичних клітин, таких як множинна мієлома, макроглобулінемія Вальденстрема, хвороба з ураженням важких ланцюгів імуноглобуліну, первинний або імуноцит-асоційований амілоїдоз і моноклональна гаммапатія невстановленої етіології (MGUS). Онкологічні мішені включають в себе Вклітинні карциноми, лейкоз і лімфоми. Композиції і способи лікування з використанням нуклеїнових кислот, поліпептидів і антитіл даного винаходу можуть застосовуватися при будьякому стані, пов'язаному з небажаною проліферацією клітин. Зокрема, даний винахід може бути використаний для лікування пухлинних клітин, які експресують BAFF і/або BAFF-R. Композиції даного винаходу, що містять агоністи BAFF-R (такі як антитіла, які зв'язуються з BAFF-R і імітують BAFF), також можуть бути використані для лікування імунної недостатності, наприклад, пов'язаних з низькими кількостями Вклітин. Такі порушення можуть бути з умовлені, наприклад, опроміненням і/або хіміотерапією. В іншому аспекті даного винаходу забезпечений спосіб зменшення агрегації рекомбінантно експресованого білка. Цей спосіб передбачає порівняння гомологів білка або його злитого білка для визначення консервативних доменів і неідентичних амінокислот в консервативних доменах. Звичайно, щонайменше, одну неполярну амінокислоту замінюють на незаряджену полярну амінокислоту, або на пролін, аланін або серин. Якщо немає інших вказівок, всі технічні і наукові терміни, що використовуються тут, мають те ж саме значення, яке розуміється фахівцями з кваліфікацією в області, до якої відноситься цей винахід. Хоча способи і матеріали, схожі з описаними тут або еквівалентні описаним тут, можуть бути використані на практиці або при тестуванні даного винаходу, відповідні способи і матеріали описані нижче. Всі публікації, патентні заявки, патенти та інші посилання, що згадуються тут, включені як посилання в їх повному вигляді. У разі суперечності, контролем буде даний опис, в тому числі і відносно визначень. Крім того, матеріали, способи і приклади є тільки ілюстративними і не призначені для обмеження даного винаходу. Інші ознаки і переваги даного винаходу будуть очевидними з наступного докладного опису і формули винаходу. Фіг.1А показує ДНК-послідовність кДНК BJAB (SEQ ID NО:1), клоновану в pJST576. Фіг.1В показує повну ДНК-послідовність кДНК клону IMAGE 2000271 (EST AI250289) (SEQ ID NО:2). Фіг.2А показує нуклеотидну послідовність JST576 з видаленим інтроном, передбачену програмою GENESCAN (SEQ ID NО:3). Фіг.2В показує 1% агарозний гель ПЛРпродуктів, одержаних для BAFF-R з використанням або кДНК першого ланцюга, генерованої з 20 РНК BJAB або ІМ-9, або на кДНК JST576. Доріжка 1. Продукт HindIII-розщеплення лямбда-ДНК. Доріжка 2. Оліго-dТ-праймований продукт BAF225/BAF-191 BJAB. Доріжка 3. Оліго-dТпраймований продукт BAF-226/BAF-191 BJAB. Доріжка 4. Випадково праймований продукт BAF225/BAF-191 BJAB. Доріжка 5. Випадково праймований продукт BAF-226/BAF-191 BJAB. Доріжка 6. Оліго-dТ-праймований продукт ВAF-225/BAF-191 ІМ-9. Доріжка 7. Оліго-dТ-праймований продукт BAF-226/BAF-191 ІМ-9. Доріжка 8. Випадково праймований продукт ВAF-225/BAF-191 ІМ-9. Доріжка 9. Випадково праймований продукт BAF226/BAF-191 ІМ-9. Доріжка 10. В AF-225/BAF-191 кДНК JST576. Доріжка 11. BAF-226/BAF-191 кДНК JST576. Доріжка 12. BAF-225/BAF-191 без матриці. Доріжка 13. BAF-226/BAF-191 без матриці. Фіг.2С показує послідовність зрілого JST576 (BAFF-R) (SEQ ID NО:4) (також номер доступу GenBank AF373846), визначену секвенуванням маси ПЛР-продукту, що фланкує передбачений інтрон з кДНК першого ланцюга BJAB. Фіг.2D показує амінокислотну послідовність BAFF-R (JST576) (SEQ ID NО:5). Залишок A (Ala) (жирний шрифт) вказує послідовність, що утворюється внаслідок використання альтернативного акцепторного сайта сплайсингу. Передбачений трансмембранний домен взятий в блок, а передбачуваний сигнал зупинки транспорту є підкресленим. Фіг.3 показує сплайсовану версію JST576 (SEQ ID NО:6), що містить 5'-UTR-послідовність, одержану ОТ-ПЛР з кДНК першого ланцюга селезінки людини, і виведену амінокислотну послідовність (SEQ ID NО:7). Ця послідовність містить стоп-кодон зліва в рамці зчитування з АТС. Фіг.4А показує послідовність кДНК мишачого BAFF-R (SEQ ID NО:8) (також номер доступу GenBank AF373847). Фіг.4В показує амінокислотну послідовність мишачого BAFF-R (SEQ ID NО:9). Залишки Cys надруковані жирним шрифтом і підкреслені, а передбачений трансмембранний район взятий в блок. Фіг.4С показує гомологію між послідовностями білків BAFF-R людини (SEQ ID NО:10) і миші (SEQ ID NО:9). Фіг.5 зображає скріплення BAFF людини з трансфікованими JST576 клітинами. Клітини 293EBNA котрансфікували pJST576 або СА336 (huTACI) і репортерною конструкцією GFP. Клітини аналізували на скріплення BAFF з 1мкг/мл біотинільованого myc-huBAFF з подальшим додаванням SAV-PE. Фіг.6 показує скріплення BAFF людини і миші з JSТ576-трансфікованими клітинами. Клітини 293EBNA котрансфікували pJST576 і репортерною конструкцією GFP. Клітини аналізували через 24 години на скріплення BAFF з 5мкг/мл flag-huBAFF або flag-muBAFF з подальшим додаванням моноклонального антитіла М2 проти flag і мавпячого антимишачого IgG-PE. Фіг.7 показує, що APRIL не зв'язується з JSТ576-трансфікованими клітинами. Клітини 293EBNA котрансфікували pJST576 або СА336 21 83458 (huTACI) і репортерною, конструкцією GFP. Клітини аналізували на скріплення APRIL з 1мкг/мл myc-muAPRIL з подальшим додаванням антиmuAPRIL щурячого IgGb, біотинільованого антищурячого FcG2b і SAV-PE. Фіг.8 показує, що BAFF осаджує білок з JSТ576-трансфікованих клітин. Клітини 293EBNA котрансфікували або BAFF-R (pJST576), тільки вектором (СН269), або huTACI (CA336) і короткочасно мітили 35S-цистеїном і метіоніном. Екстракти імунопреципітували з використанням flag-huBAFF і піддавали електрофорезу в відновлювальних умовах на ДСН-ПААГ. Маркери молекулярної маси вказані зліва. Фіг.9 зображає послідовність нуклеїнової кислоти (SEQ ID NО:11) і виведену з неї амінокислотну послідовність (SEQ ID NО:12) гена, що кодує злитий білок huBAFF-R:Fc: н уклеотиди 1-63 кодують сигнальну послідовність мишачого IgG-каппа; нуклеотиди 64-66 використали для введення сайта рестриктази, нуклеотиди 67-276 кодують частину позаклітинного домену BAFF-R, н уклеотиди 277279 використали для введення сайта рестриктази і нуклеотиди 280-960 кодують Fc-район IgGl людини. Фіг.10 зображає результати Нозерн-блотаналізу з використанням EcoNI-фрагмента JST576 як зонд. Всі експозиції становили 4 дні. 10А: Clontech human Immune II blot; 10B; Clontech human 12 lane multi-tissue blot; 10C: Clontech human multi-tissue II blot. Фіг.11 показує результат Нозерн-блот-аналізу 20мкг тотальної РНК, виділеної з різних клітинних ліній. Цей блот зондували фрагментом рестрикції EcoNI JST576 і експонували протягом 4 днів. Здатність цих клітинних ліній зв'язувати BAFF, визначена FACS-аналізом, вказана нижче доріжки. Фіг.12 показує результати імунопреципітації з використанням BAFF-R:Fc. BAFF людини імунопреципітується за допомогою BAFF-R:Fc або ВСМА:Ес, але не Fn14-Fc. Контрольний білок BAFF показаний в доріжці 1. Фіг.13 показує, що злитий білок BAFF-R людини:Рс блокує скріплення BAFF людини з клітинами BJAB. Результати FACS-аналізу показані на Фіг.13А. Крива Ε представляє скріплення біотинільованого BAFF з клітинами BJAB у відсутності BAFF-R:Fc. Криві B-D представляють здатність BAFF зв'язува тися з клітинами BJAB в присутності 5мкг/мл, 1мкг/мл або 0,2мкг/мл., відповідно. Крива А є єдиною кривої другої стадії. Фіг.13В ілюструє здатність різних концентрацій BAFF-R:Fc (квадрати) в порівнянні з TACI:Fc (трикутники) або неспецифічного злитого білка LT_R:Fc (кружки) блокувати скріплення BAFF з експресуючими рецептор клітинами BJAB. Фіг.14 показує здатність BAFF-R:Fc блокувати BAFF-індуковану ко-стимуляцію В-клітин селезінки. Показаний графік включення [3Н]-тимідину (імп/хв.) в залежності від кількостей hBAFF (нг/мл), що збільшуються. Фіг.15 показує, що обробка BAFF-R:Fcl приводить до втрати периферичних В-клітин у здорової миші. 22 Фіг.16 показує, що обробка мишей злитим білком BAFF-R:Fc людини і миші знижує число В220+ В-клітин селезінки. Фіг.17 показує, що введення BAFF-R:Fc мишам знижує процент В220+ В-клітин лімфатичних вузлів. Фіг.18 показує, що введення ВAFF-R:Fc мишам знижує процент В220+ В-клітин периферичної крові. Фіг.19А показує дані FACS для супернатантів чотирьох клонів, які продукують антитіла, які зв'язують BAFF-R. Показаний також контрольний супернатант, який не містить антитіл, що зв'язують BAFF-R. Фіг.19В показує гістограму, яка показує, що два клони блокують скріплення BAFF з BAFF-R. (а) показує контроль без BAFF; (b) показує блокуючу активність антитіла з клону 2; (с) показує блокуючу здатність антитіла з клону 9; (d) показує криву для контрольного антитіла, яке не зв'язує BAFF-R. Фіг.20 показує зіставлення амінокислотних послідовностей позаклітинних доменів BAFF-R:Fc людини (hBAFF-R) і BAFF-R:Fc миші (mBAFF-R) і процент агрегації, що спостерігається при експресії злитих з Fc білків, що містять вказані послідовності. Пронумеровані клони JST представляють амінокислотні послідовності, що виявляють мутації (підкреслені) у вихідних послідовностях і одержану агрегацію експресованого білка. Показані часткові послідовності для BAFF-R людини (амінокислоти 2-71 послідовності SEQ ID NO:10; SEQ ID NО:13) і миші (амінокислоти 2-66 послідовності SEQ ID NО:9; SEQ ID NО:14); і відповідні частини наступних клонів: JST659 (SEQ ID NО:15), JST660 (SEQ ID NО:16), JST661 (SEQ ID NО:17), JST662 (SEQ ID NО:18), JST663 (SEQ ID NO:19), JST673 (SEQ ID NО:20), JST674 (SEQ ID NО:21), JST675 (SEQ ID NО:22), JST672 (SEQ ID NО:23), JST676 (SEQ ID NО:24), JST671 (SEQ ID NО:25), JST677 (SEQ ID NО:26) JST678 (SEQ ID NО:27), JST664 (SEQ ID NО:28), JST668 (SEQ ID NО:29), JST665 (SEQ ID NО:30), JST666 (SEQ ID NО:31) і JST667 (SEQ ID NО:32). Фіг.21 показує радіоавтограф білків, імунопреципітованих з використанням лізатів, приготованих з клітин, трансфікованих BAFF-R-i.c.d. (вн утрішньоклітинний домен BAFF-R) (доріжка 1), або трансфікованих контрольним вектором клітин (доріжка 2). Приблизно 6´106 клітин 293 Ε трансфікували конструкцією, що кодує BAFF-R-i.c.d. або псевдо- («пустою») плазмідою. Через 48 годин клітини метаболічно мітили 35S протягом 24 годин, лізували буфером для лізису, заздалегідь освітлювали і імунопреципітували антитілом anti-myc mAB, 9E10. Імунопреципітати розділяли електрофорезом на 10-20% ПААГ-ДСН при відновлювальних умовах. Посилальні роботи, патенти, патентні заявки і наукова література, в тому числі номери доступу для послідовностей бази даних GenBank, на які даються посилання тут, доводять знання їх фахівцями з кваліфікацією в даній області і включені тут як посилання в їх повному об'ємі тією ж самою мірою, як якби кожна з них була конкретно і індивідуально вказана як включена як посилання. Будь 23 83458 яка суперечність між будь-яким цитованим тут посиланням і конкретними описами даної заявки повинні вирішуватися на користь останньої. Подібно цьому, будь-яка суперечність між визначенням слова, що визнається в даній області, або фрази і визначенням слова або фрази, що конкретно даються в даному описі, повинно вирішуватися на користь останнього. Стандартні посилальні роботи, що викладають загальні принципи технології рекомбінантних ДНК, відомі фахівцям з кваліфікацією в даній області, включають в себе [Ausubel et al. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York (1998); Sambrook et al. MOLECULAR CLONING: A LABOR ATORY MANUAL, 2D ED., Cold Spring Harbor Laboratory Press, Plainview, New York (1989); Kaufman et al., Eds., HANDBOOK OF MOLECULAR AND CELLULAR METHODS IN BIOLOGY AND MEDICINE, CRC Press, Boca Raton (1995); McPherson, Ed., DIRECTED MUTAGENESIS: A PRACTIC AL APPROACH, IRL Press, Oxford (1991)]. Даний винахід описує нуклеїнові кислоти BAFF-R, ізольовані нуклеїнові кислоти, які кодують поліпептид BAFF-R або його частину, поліпептиди BAFF-R, вектори, що містять ці нуклеїнові кислоти, клітини-хазяї, трансформовані цими нуклеїновими кислотами BAFF-R, антитіла проти BAFF-R і фармацевтичні композиції. Описані також способи одержання поліпептидівBAFF-R, а також способи скринінгу, діагностика, лікування станів з використанням цих сполук і способи скринінгу сполук, які модулюють активність поліпептиду BAFF-R. Нуклеїнові кислоти і поліпептиди BAFF-R, а також BAFF-R-антитіла, а також фармацевтичні композиції, що обговорюються тут, застосовні, inter alia, для лікування раку і/або імунорегуляторних станів. Ці порушення включають в себе, наприклад, опосередковані В-клітинами захворювання, які є аутоімунними за природою, такі як системний червоний вовчак, ревматоїдний артрит, важка псевдопаралітична міастенія, аутоімунна гемолітична анемія, ідіопатична тромбоцитопенічна пурпура, антифосфоліпідний синдром, хвороба Шагаса, хвороба Грейвса, гранулематоз Вегенера, нодозний поліартеріїт і швидко прогресуючий гломерулонефрит. Цей терапевтичний агент має також застосування при порушеннях плазматичних клітин, таких як множинна мієлома, макроглобулінемія Вальденстрема, хвороба з ураженням важких ланцюгів імуноглобуліну, первинний або імуноцит-асоційований амілоїдоз і моноклональна гаммапатія невстановленої етіології (MGUS). Онкологічні мішені включають в себе В-клітинні карциноми, лейкоз і лімфоми. Нуклеїнові кислоти BAFF-R Один аспект даного винаходу відноситься до ізольованих молекул н уклеїнових кислот, які кодують білки BAFF-R або їх біологічно активні частини. Включені також фрагменти нуклеїнових кислот, достатні для їх використання як гібридизаційних зондів для ідентифікації BAFF-R-кодуючих н уклеїнових кислот (наприклад, мРНК BAFF-R), або фрагменти для використання як праймерів полімеразної ланцюгової реакції (ПЛР) для ампліфікації або 24 мутації молекул нуклеїнових кислот BAFF-R. У застосуванні тут термін «молекула нуклеїнової кислоти» включає в себе молекули ДНК (наприклад, кДНК або геномну ДНК), молекули РНК (наприклад, мРНК), аналоги ДНК або РНК, що генеруються з використанням аналогів нуклеотидів, і їх похідні, фрагменти і гомологи. Молекула нуклеїнової кислоти може бути одноланцюговою або дволанцюговою, але переважно є дволанцюговою ДНК. Термін «зонди» відноситься до послідовностей нуклеїнових кислот варіабельної довжини, переважно між, щонайменше, 10 нуклеотидами (нт) або приблизно, наприклад, 6000нт, в залежності від застосування. Зонди використовують для детектування ідентичних, схожих або комплементарних послідовностей нуклеїнових кислот. Зонди більшої довжини звичайно одержують з природного або рекомбінантного джерела, вони є високоспецифічними і гібридизуються набагато повільніше, ніж олігомери. Зонди можуть бути одно- або дволанцюговими і конструюються таким чином, щоб вони мали специфічність в ПЛР, способах гібридизації на основі мембрани або ELISA-подібних способах. «Ізольованою» молекулою нуклеїнової кислоти називають молекулу, яка відділена від інших молекул нуклеїнових кислот, які присутні в природному джерелі даної нуклеїнової кислоти. Приклади ізольованих молекул нуклеїнових кислот включають в себе, але не обмежуються ними, рекомбінантні молекули ДНК, що містяться у векторі, рекомбінантні молекули ДНК, що підтримуються в гетерологічній клітині-хазяїні, частково або по суті очи щені молекули нуклеїнових кислот і синтетичні ДНК- або РНК-молекули. Переважно, «ізольована» молекула нуклеїнової кислоти не містить послідовностей, які природно фланкують цю нуклеїнову кислоту (тобто послідовностей, локалізованих на 5'- і 3'-кінцях цієї нуклеїнової кислоти) в геномній ДНК організму, з якого одержана дана нуклеїнова кислота. Наприклад, в різних варіантах ізольована молекула нуклеїнової кислоти BAFF-R може містити менше ніж приблизно 50т.п.н., 25т.п.н., 5 т.п.н., 4т.п.н., 3т.п.н., 2т.п.н., 1т.п.н. 0,5т.п.н. або 0,1т.п.н. н уклеотидних послідовностей, які природно фланкують дану молекулу н уклеїнової кислоти в геномній ДНК клітини, з якої одержана ця нуклеїнова кислота. Крім того, «ізольована» молекула нуклеїнової кислоти, така як молекула кДНК, може по суті не містити іншого клітинного матеріалу або культурального середовища при одержанні рекомбінантними способами або при одержанні з хімічних попередників при хімічному синтезі. Молекула нуклеїнової кислоти даного винаходу, наприклад, молекула нуклеїнової кислоти, що має нуклеотидну послідовність Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фі г.3 (SEQ ID NО:6) або комплемент будь-якої з цих нуклеотидних послідовностей, може бути ізольована з використанням стандартних способів молекулярної біології і забезпеченої тут ін формації про послідовності. З використанням повних послідовностей або частини послідовностей нуклеїнових кислот Фіг.1А, В, 25 83458 2А, С і 3 як гібридизаційного зонда, послідовності нуклеїнових кислот BAFF-R можуть бути ізольовані з використанням стандартної гібридизації і стандартних способів клонування [наприклад, як описано в Sambrook et al., Eds., MOLECULAR CLONING: A LABORATOR Y MANU AL 2ND ED., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989; і Ausubel, et al., Eds., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York, NY, 1993]. Нуклеїнова кислота даного винаходу може бути ампліфікована з використанням кДНК, мРНК або, альтернативно, геномної ДНК як матриці і відповідних олігонуклеотидних праймерів згідно зі стандартними способами ПЛР-ампліфікації. Ампліфікована таким чином нуклеїнова кислота може бути клонована у відповідний вектор і охарактеризована аналізом секвенування ДНК. Крім того, олігонуклеотиди, відповідні нуклеотидним послідовностям BAFF-R, можуть бути одержані стандартними синтетичними способами, наприклад, з використанням автоматичного ДНК-синтезатора. У застосуванні тут термін «олігонуклеотид» відноситься до ряду пов'язаних нуклеотидних залишків, причому олігонуклеотид має достатнє число нуклеотидних основ для використання в ПЛРреакції. Коротка олігонуклеотидна послідовність може бути основана на геномній або кДНКпослідовності або сконструйована з геномної або кДНК-послідовності і використана для ампліфікації, підтвердження або виявлення присутності ідентичної, схожої або комплементарної ДНК або РНК в конкретній клітині або тканині. Олігонуклеотиди включають частини послідовності нуклеїнової кислоти, що мають, щонайменше, приблизно 10 нуклеотидів і так багато, як 50 нуклеотидів, переважно приблизно 15-30 нуклеотидів. Вони можуть бути синтезовані хімічно і можуть бути використані як зонди. В іншому варіанті ізольована молекула нуклеїнової кислоти даного винаходу включає молекулу нуклеїнової кислоти, яка є комплементом нуклеотидної послідовності, показаної на Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6). В іншому варіанті ізольована молекула нуклеїнової кислоти даного винаходу включає молекулу нуклеїнової кислоти, яка є комплементом нуклеотидної послідовності, показаної на Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), або частиною цієї нуклеотидної послідовності. Молекула нуклеїнової кислоти, яка комплементарна нуклеотидній послідовності, показаної на Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NO:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), є послідовністю, яка є досить комплементарною нуклеотидній послідовності, показаній на Фіг.1A (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), щоб вона могла зв'язуватися водневими зв'язками з малою кількістю помилкових спаровувань або взагалі без помилкових спаровувань з нуклеотидною послідовністю, показаною на Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ 26 ID NО:4) і Фіг.3 (SEQ ID NО:6), з утворенням за допомогою цього стабільного дуплекса. У застосуванні тут термін «комплементарне» відноситься до спаровування основ за УотсономКриком або Хугстіном між нуклеотидними ланками молекули нуклеїнової кислоти, і термін «скріплення» означає фізичну або хімічну взаємодію між двома поліпептидами або сполуками або пов'язаними поліпептидами або сполуками, або їх комбінаціями. Скріплення включає в себе іонні, неіонні, ван-дер-ваальсові, гідрофобні взаємодії і т.д. Фізична взаємодія може бути або прямою, або опосередкованою. Посередні взаємодії можуть відбуватися за допомогою або внаслідок дій іншого поліпептиду або сполуки. Прямим скріпленням називають взаємодії, які не відбуваються за допомогою або без допомоги дії іншого поліпептиду або сполуки, а здійснюються без інших істотних хімічних проміжних продуктів. Крім того, молекула нуклеїнової кислоти даного винаходу може включати тільки частину послідовності нуклеїнової кислоти Фіг.1А (SEQ ID NО:1), Фіг.1В (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), наприклад, фрагмент, який може бути використаний як зонд або праймер, або фрагмент, що кодує біологічно активну частину BAFF-R. Забезпечені тут фрагменти визначаються як послідовності з довжиною з, щонайменше, б нуклеотидів, що безперервно йдуть одним за одним або, щонайменше, 4 амінокислот, що безперервно йдуть одна за одною , достатньої для можливості специфічної гібридизації у разі нуклеїнових кислот або для специфічного пізнавання епітопу у разі амінокислот, відповідно, і вони є щонайбільше меншими, ніж повнорозмірна послідовність. Фрагменти можуть бути одержані з будь-якої безперервної частини переважної послідовності нуклеїнової кислоти або амінокислотної послідовності. Похідними є послідовності нуклеїнових кислот або амінокислотні послідовності, утворені з природних сполук або безпосередньо, або модифікацією, або частковою заміною. Аналогами є послідовності нуклеїнових кислот або амінокислотні послідовності, які мають структур у, схожу, але не ідентичну відносно природної сполуки, але відрізняються від неї відносно певних компонентів або бічних ланцюгів. Аналоги можуть бути синтетичними або мати відмінне еволюційне походження і можуть мати схожу або протилежну метаболічну активність в порівнянні з активністю дикого типу. Похідні і аналоги можуть бути повнорозмірними або мати іншу довжину, якщо похідне або аналог містить модифікований нуклеотид або аналог модифікованої амінокислоти, як описано нижче. Похідні і аналоги нуклеїнових кислот або білків даного винаходу включають в себе, але не обмежуються ними, молекули, що включають райони, які є по суті гомологічними відносно нуклеїнових кислот або білків даного винаходу, з ідентичністю в різних варіантах, що дорівнює, щонайменше, приблизно 45%, 50%, 70%, 80%, 95%, 98% або навіть 99% (з переважною ідентичністю, 80-99%) відносно послідовності нуклеїнової кислоти або амінокислотної послідовності ідентичного розміру 27 83458 або при порівнянні з зіставленою послідовністю, коли зіставлення проводять з використанням комп'ютерної програми гомології, відомої в даній області, або кодуюча нуклеїнова кислота яких здатна гібридизуватись з комплементом послідовності, що кодує вищезазначені білки, при жорстких, помірно жорстких умовах або при умовах низької жорсткості. Див., наприклад, [Ausubel, et al, CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York, NY, 1993] і приведені нижче посилання. Прикладом такої програми є Gap (Геп)-програма (Wisconsin Sequence Analysis Package, Version 8 for UNIX, Genetics Computer Group, University Research Park, Madison, WI) з використанням установок за умовчанням, які використовують алгоритм Сміта і Уотермана [(1981) Ad v. Appl. Math. 2: 482-489], яка включена тут посиланням в її повному вигляді. «Гомологічна послідовність нуклеїнової кислоти» або «гомологічна амінокислотна послідовність» або їх варіації означають послідовності, що характеризуються гомологією на нуклеотидному рівні або на рівні амінокислот, як обговорювалося вище. Гомологічні нуклеотидні послідовності кодують послідовності ізоформ поліпептиду BAFF-R. Ізоформи можуть експресуватись в різних тканинах одного організму в результаті, наприклад, альтернативного сплайсингу РНК. Альтернативно, ізоформи можуть кодуватись різними генами. У даному винаході, гомологічні нуклеотидні послідовності включають в себе нуклеотидні послідовності, що кодують поліпептид BAFF-R інших видів, ніж людина, в тому числі, але не тільки, ссавців, і, отже, ці види можуть включати в себе, наприклад, мишу, щура, кролика, собаку, кішку, корову, коня та інші організми. Гомологічні нуклеотидні послідовності включають в себе також, але не обмежуються ними, алельні варіації, що природно зустрічаються, і мутації представлених тут нуклеотидних послідовностей. Однак, гомологічна нуклеотидна послідовність не включає в себе нуклеотидну послідовність, що кодує білок BAFF-R людини. Гомологічні послідовності нуклеїнових кислот включають в себе ті нуклеотидні послідовності, які кодують консервативні амінокислотні заміни (див. нижче) на Фіг.2D (SEQ ID NО:5), а також поліпептид, що має BAFF-R-активність. Гомологічна амінокислотна послідовність не кодує амінокислотну послідовність поліпептиду BAFF-R людини. Нуклеотидна послідовність, визначена з клонування гена BAFF-R людини, дозволяє генерувати зонди і праймери, сконструйовані для застосування в ідентифікації і/або клонуванні гомологів BAFF-R в інши х клітинних типах, наприклад, з інших тканин, а також гомологів BAFF-R з інших ссавців. Зонд/праймер звичайно містить по суті очищений олігонуклеотид. Цей олігонуклеотид звичайно включає район нуклеотидної послідовності, який гібридизується при жорстких умовах, щонайменше, зі складеною з приблизно 12, 25, 50, 100, 150, 200, 250, 300, 350 або 400 нуклеотидів, що безперервно йдуть один за одним, нуклеотидною послідовністю смислового ланцюга будь-якої з послідовностей Фіг.1А (SEQ ID NO:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID 28 NО:4) і Фіг.3 (SEQ ID NО:6), або нуклеотидною послідовністю антисмислового ланцюга будь-якої з послідовностей Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NO:4) і Фіг.3 (SEQ ID NО:6) або мутантом, що природно зустрічається, будь-якої з послідовностей Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6). Зонди на основі нуклеотидної послідовності BAFF-R людини можуть бути використані для детектування транскриптів або геномних послідовностей, що кодують той же самий або гомологічні білки. У різних варіантах цей зонд додатково включає приєднану до нього групу мітки, наприклад, ця група мітки може бути радіоізотопом, флуоресцентною сполукою, ферментом або кофактором ферменту. Такі зонди можуть бути використані як частина набору для діагностичного тесту для ідентифікації клітин або тканини, які неправильно експресують білок BAFF-R, наприклад, за допомогою вимірювання рівня кодуючої BAFF-R нуклеїнової кислоти в пробі клітин з суб'єкта, наприклад, детектування рівня мРНК BAFF-R або визначенням, чи був геномний ген BAFF-R мутований або делетований. Термін «поліпептид, що має біологічно активну частину BAFF-R», означає поліпептиди, що виявляють активність, схожу, але необов'язково ідентичну, з активністю поліпептиду даного винаходу, в тому числі зрілих форм, при вимірюванні в конкретному біологічному аналізі, із залежністю від дози або без залежності від дози. Фрагмент нуклеїнової кислоти, що кодує «біологічно активну частину BAFF-R», може бути одержаний ізолюванням частини будь-якої послідовності з Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NO:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), яка кодує поліпептид, що має біологічну активність BAFF-R (біологічна активність білків BAFF-R описана нижче), експресією цієї частини білка, що кодується BAFF-R (наприклад, рекомбінантною експресією in vitro) і оцінкою активності частини BAFF-R, що кодується. Наприклад, фрагмент нуклеїнової кислоти, що кодує біологічно активну частину BAFF-R, може необов'язково включати в себе домен скріплення BAFF. В іншому варіанті, фрагмент нуклеїнової кислоти, що кодує біологічно активну частин у BAFF-R, включає в себе один або декілька районів. Варіанти BAFF-R Далі, даний винахід включає в себе молекули нуклеїнових кислот, які відрізняються від нуклеотидних послідовностей, показаних на Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), внаслідок виродженості генетичного коду. Таким чином, ці нуклеїнові кислоти кодують той же самий білок BAFF-R, який кодується нуклеотидною послідовністю, показаною на Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6). В іншому варіанті ізольована молекула нуклеїнової кислоти даного винаходу має нуклеотидну послідовність, 29 83458 що кодує білок, який має амінокислотну послідовність, показану на Фіг.2D (SEQ ID NО:5). Фахівцеві з кваліфікацією в даній області буде зрозуміло, що, крім нуклеотидної послідовності BAFF-R людини, показаної в будь-якій з послідовностей Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), поліморфізм послідовності ДНК, який приводить до змін в амінокислотних послідовностях BAFF-R, може існувати в популяції (наприклад, популяції людини). Такий генетичний поліморфізм в гені BAFF-R може існувати серед індивідуумів в популяції внаслідок природної алельної варіації. У застосуванні тут терміни «ген» і «рекомбінантний ген» означають молекули нуклеїнової кислоти, що включають відкриту рамку зчитування, що кодує білок BAFF-R, переважно білок BAFF-R ссавця. Такі природні алельні варіації можуть звичайно приводити до 1-5% відхилення в нуклеотидній послідовності гена BAFF-R. Передбачається, що будь-які і всі подібні нуклеотидні варіації і виникаючий в результаті поліморфізм амінокислот в BAFF-R, які є результатом природної алельної варіації і які не змінюють функціональну активність BAFF-R, входять в об'єм даного винаходу. Крім того, передбачається, що молекули нуклеїнових кислот, які кодують білки BAFF-R з інших видів і, отже, мають нуклеотидну послідовність, яка відрізняється від послідовностей людини Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), знаходяться в об'ємі даного винаходу. Молекули нуклеїнових кислот, відповідні природним алельним варіантам і гомологам кДНК BAFF-R даного винаходу, можуть бути ізольовані на основі їх гомології з нуклеїновими кислотами BAFF-R людини, описаними тут, з використанням кДНК у людини або її частини, у вигляді гібридизаційного зонда згідно зі стандартними способами гібридизації при жорстких умовах гібридизації. Наприклад, кДНК розчинної BAFF-R людини може бути ізольована на основі його гомології з мембранопов'язаним BAFF-R людини. Подібним чином, кДНК мембранопов'язаного BAFF-R людини може бути ізольована на основі його гомології з розчинним ВAFF-R людини. Таким чином, в іншому варіанті ізольована молекула нуклеїнової кислоти даного винаходу має довжину, щонайменше, 6 нуклеотидів і гібридизується при жорстких умовах з молекулою нуклеїнової кислоти, що включає н уклеотидну послідовність будь-якої з послідовностей Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6). В іншому варіанті ця нуклеїнова кислота має довжину, щонайменше, 10, 25, 50, 100, 250 або 500 нуклеотидів. В іншому варіанті ізольована молекула нуклеїнової кислоти даного винаходу гібридизується з кодуючим районом. У застосуванні тут термін «гібридизується при жорстких умовах» призначений для опису умов гібридизації і промивання, при яких нуклеотидні послідовності, щонайменше, на 60% гомологічні одна одній, звичайно залишаються гібридизованими одна з одною. 30 Гомологи (тобто нуклеїнові кислоти, що кодують білки BAFF-R, що походять з видів, інших ніж людина) або інші споріднені послідовності (наприклад, паралоги) можуть бути одержані з використанням умов гібридизації низької, помірної або високої жорсткості з повною конкретною послідовністю людини або з частиною цієї послідовності як зонда з використанням способів, добре відомих в даній області для гібридизації і клонування нуклеїнових кислот. У застосуванні тут фраза «жорсткі умови гібридизації» означає умови, при яких зонд, праймер або олігонуклеотид буде гібридизуватись з його послідовністю-мішенню, але не з іншими послідовностями. Жорсткі умови є послідовністьзалежними і будуть різними в різних обставинах. Більш довгі послідовності гібридизуються специфічно при більш високих температурах, ніж більш короткі послідовності. Звичайно жорсткі умови вибирають таким чином, щоб температура була приблизно на 5°С нижче ніж точка плавлення (Тm) для цієї конкретної послідовності при визначених іонній силі і рН. Тm є температурою (при визначених іонній силі, рН і концентрації нуклеїнової кислоти), при якій 50% зондів, комплементарних послідовності-мішені, гібридизуються з послідовністюмішенню при рівновазі. Оскільки послідовностімішені звичайно присутні в надлишку, при Тm, 50% цих зондів займають мішень при рівновазі. Звичайно, жорсткими умовами будуть умови, в яких концентрація солі дорівнює менше ніж приблизно 1,0Μ іон натрію, звичайно приблизно 0,01-1,0Μ іон натрію (або інших солей) при рН7,0-8,3, а температура дорівнює, щонайменше, приблизно 30°С для коротких зондів, праймерів або олігонуклеотидів (наприклад, 10 нуклеотидів - 50 нуклеотидів) і, щонайменше, приблизно 60°С для більш довгих зондів, праймерів і олігонуклеотидів. Жорсткі умови можуть бути також досягнуті з додаванням дестабілізуючих агентів, таких як формамід. Жорсткі умови відомі фахівцям в даній області і можуть бути знайдені в [CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, N. Y. (1989), 6.3.1-6.3.6]. Переважно, ці умови є такими, що послідовності, щонайменше, на приблизно 65%, 70%, 75%, 85%, 90%, 95%, 98% або 99% гомологічні одна з одною, звичайно залишаються гібридизованими одна з одною. Необмежувальним прикладом жорстких умов гібридизації є гібридизація у високосольовому буфері, що містить 6´SSC, 50мМ Трис-НСІ (рН7,5), мМ ЕДТА, 0,02% ПВП, 0,02 Фіколл, 0,02% БСА і 500мг/мл денатурованої ДНК сперми лосося при 65°С. За цією гібридизацією йдуть одне або декілька промивань в 0,2´SSC, 0,01% БСА при 50°С. Ізольована молекула нуклеїнової кислоти даного винаходу, яка гібридизується при жорстких умовах з послідовностями SEQ ID NО:1, SEQ ID NО:2, SEQ ID NО:3, SEQ ID NО:4, SEQ ID NО:6, відповідає молекулі нуклеїнової кислоти, що природно зустрічається. У застосуванні тут «молекула нуклеїнової кислоти, що природно зустрічається» означає молекулу РНК або ДНК, що має нуклеотидну послідовність, яка зустрічається в природі (наприклад, кодує природний білок). 31 83458 У другому варіанті забезпечена послідовність нуклеїнової кислоти, яка гібридизується з молекулою нуклеїнової кислоти, що включає нуклеотидну послідовність будь-якої з послідовностей Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), або її фрагментами, аналогами або похідними, в умовах помірної жорсткості. Необмежувальним прикладом умов гібридизації помірної жорсткості є гібридизація в 6´SSC, 5х розчині Денхардта, 0,5% ДСН і 100мг/мл денатурованій ДНК спермі лосося при 55°С, з подальшими одним або декількома промиваннями в 1´SSC, 0,1% ДСН при 37°С. Інші умови помірної жорсткості, які можуть бути використані, добре відомі в даній області. Див., наприклад, [Ausubel et al., Eds., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, NY, 1993; and Knegler, GENE TRANSFER AND EXPRESSION, A L ABOR ATORY MANUAL, Stockton Press, NY, 1990]. У третьому варіанті забезпечена нуклеїнова кислота, яка гібридизується з молекулою нуклеїнової кислоти, що включає нуклеотидну послідовність будь-якої з послідовностей Фіг.1А (SEQ ID NО:1), Фіг.1B (SEQ ID NО:2), Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) і Фіг.3 (SEQ ID NО:6), або її фрагментами, аналогами або похідними, в умовах низької жорсткості. Необмежувальним прикладом умов гібридизації низької жорсткості є гібридизація в 35% формаміді, 5´SSC, 50мМ Трис-НСІ (рН7,5), 5мМ ЕДТА, 0,02% ПВП, 0,02% Фіколі, 0,2% БСА, 100мг/мл денатурованій ДНК спермі лосося, 10% (маса/об'єм) декстрансульфаті при 40°С, з подальшими одним або декількома промиваннями в 2´SSC, 25мМ Трис-НСІ (рН7,4), 5мМ ЕДТА і 0,1% ДСН при 50°С. Інші умови низької жорсткості, які можуть бути використані, добре відомі в даній області (наприклад, що використовуються для міжвидових гібридизацій). Див., наприклад, [Ausubel et al, Eds., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, NY, 1993; and Kriegler, GENE TRANSFER AND EXPRESSION , A LABOR ATOR Y MANU AL, Stockton Press, NY, 1990; Shilo and Weinberg (1981) Proc. Natl. Acad. Sci. USA 78:6789-6792]. Консервативні мутації Фахівцеві з кваліфікацією в даній області буде також зрозуміло, що, крім алельних варіантів послідовності BAFF-R, що природно зустрічаються, які можуть існувати в популяції, зміни можуть бути введені мутацією в н уклеотидну послідовність Фіг.2А (SEQ ID NO:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6), що приводить до змін в амінокислотній послідовності білка, що кодується BAFF-R, без зміни функціональної активності цього білка BAFF-R. Наприклад, нуклеотидні заміни, що приводять до амінокислотних замін в «не-незамінних» амінокислотних залишках, можуть бути вироблені в послідовності будь-якої з Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6). «Ненезамінним» амінокислотним залишком є залишок, який може бути змінений, з послідовності дикого типу BAFF-R без зміни біологічної активності, тоді як «незамінний» амінокислотний залишок є необхідним для біологічної активності. Наприклад, пе 32 редбачається, що амінокислотні залишки, які є консервативними серед білків BAFF-R даного винаходу, є таким, що особливо не піддаються зміні. Крім того, передбачається також, що амінокислотні залишки, які є консервативними серед членів сімейства білків BAFF-R даного винаходу, є також такими, що особливо не піддаються зміні. Наприклад, білки BAFF-R даного винаходу можуть містити, щонайменше, один домен, який звичайно є консервативним районом в членах сімейства TNF. Як такі, ці консервативні домени, очевидно, не піддаються мутації. Однак, інші амінокислотні залишки (наприклад, залишки, які не є консервативними або є тільки напів консервативними серед членів білків BAFF-R), можуть не бути незамінними для активності і, отже, можуть бути, очевидно, такими, що піддаються зміні. Інший аспект даного винаходу відноситься до молекул нуклеїнових кислот, що кодують білки BAFF-R, які містять зміни амінокислотних залишків, які не є незамінними для активності. Такі білки BAFF-R відрізняються за амінокислотною послідовністю від амінокислотної послідовності з Фіг.2D (SEQ ID NО:5), але все ще зберігають біологічну активність. В одному варіанті ізольована молекула нуклеїнової кислоти включає нуклеотидну послідовність, що кодує білок, причому цей білок включає амінокислотну послідовність, щонайменше, на приблизно 45% гомологічну амінокислотних послідовності Фіг.2D (SEQ ID NО:5). Переважно, білок, що кодується цією молекулою нуклеїнової кислоти, є, щонайменше, на приблизно 60% гомологічним послідовності, щонайменше, на приблизно 70%, 80%, 90%, 95%, 98% і найбільш переважно на, щонайменше, приблизно 99% гомологічним послідовності Фіг.2D (SEQ ID NО:5). Ізольована молекула нуклеїнової кислоти, що кодує білок BAFF-R, гомологічний білку Фіг.2D, може бути створена введенням однієї або декількох нуклеотидних замін, додатків або делецій в нуклеотидну послідовність Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6), так що одна або декілька амінокислотних замін, додавань або делецій вводяться в білок, що кодується. Мутації можуть бути введені в Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4) або Фіг.3 (SEQ ID NО:6), наприклад, стандартними способами, такими як сайт-направлений мутагенез і ПЛРопосередкований мутагенез. Переважно, виробляють консервативні заміни амінокислот в одному або декількох передбачених не-незамінних амінокислотних залишках. «Консервативною амінокислотною заміною» є заміна, при якій амінокислотний залишок замінюють амінокислотним залишком, що має схожий бічний ланцюг. Сімейства амінокислотних залишків, що мають схожі бічні ланцюги, були визначені в даній області. Ці сімейства включають в себе амінокислоти з основними бічними ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними бічними ланцюгами (наприклад, аспарагінова кислота, глутамінова кислота), незарядженими полярними бічними ланцюгами (наприклад, гліцин, аспарагін, глутамін, серин, треонін, тирозин, цистеїн), неполярними бічними ланцюгами (наприклад, аланін, валін, лейцин, ізо 33 83458 лейцин, пролін, фенілаланін, метіонін, триптофан), бета-розгалуженими бічними ланцюгами (наприклад, треонін, валін, ізолейцин) і ароматичними бічними ланцюгами (наприклад, тирозин, фенілаланін, триптофан, гістидин). Таким чином, передбачений не-незамінний амінокислотний залишок в BAFF-R замінюють іншим амінокислотним залишком з того ж самого сімейства бічних ланцюгів. Альтернативно, в іншому варіанті мутації можуть вводитися випадковим чином вздовж всього або частини кодуючого ланцюга для BAFF-R, наприклад, насичувальним мутагенезом, і одержані мутанти можуть бути піддані скринінгу на біологічну активність BAFF-R. для ідентифікації мутантів, які зберігають активність. Після мутагенезу будь-якої з послідовностей Фіг.2А (SEQ ID NO:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6) білок, що кодується може бути експресований будь-яким рекомбінантним способом, відомим в даній області, і може бути визначена активність цього білка. В одному варіанті мутантний білок BAFF-R може бути перевірений на (1) здатність формувати взаємодії за типом білок-білок з іншими білками BAFF-R, іншими білками клітинної поверхні або їх біологічно активними частинами; (2) утворення комплексу між мутантним білком BAFF-R і лігандом BAFF-R; (3) здатність мутантного білка BAFFR зв'язуватися з внутрішньоклітинним білкоммішенню або його біологічно активною частиною; (наприклад, білками авідину); (4) здатність зв'язуватися з BAFF; або (5) здатність специфічно зв'язувати антитіло проти білка BAFF-R. Даний винахід забезпечує специфічні мутанти, що кодують поліпептид BAFF-R:Fc, сконструйовані для ослаблення агрегації експресованого білка при збереженні активності скріплення BAFF. Такі мутанти включають в себе, наприклад, клони, що кодують амінокислотні послідовності JST661 (SEQ ID NО:17), JST662 (SEQ ID NО:18), JST663 (SEQ ID NО:19), JST673 (SEQ ID NО:20), JST674 (SEQ ID NО:21), JST675 (SEQ ID NО:22), JST672 (SEQ ID NО:23), JST676 (SEQ ID NО:24), JST671 (SEQ ID NО:25), JST677 (SEQ ID NО:26) і JST678 (SEQ ID NО:27). Інші варіанти включають в себе мутанти, що кодують поліпептид BAFF-R або BAFF-R:Fc, який має характеристики агрегації, схожі з природним поліпептидом BAFF-R людини або BAFF-R:Fc, але також зв'язують BAFF, в тому числі, наприклад, послідовності, що включають амінокислотні послідовності JST659 (SEQ ID NО:15), JST660 (SEQ ID NО:16), JST664 (SEQ ID NО:28), JST668 (SEQ ID NО:29), JST665 (SEQ ID NО:30), JST666 (SEQ ID NО:31) і JST667 (SEQ ID NО:32). Інші варіанти включають в себе мутанти, що кодують поліпептид BAFF-R або BAFF-R:Fc, де консервативні амінокислоти між BAFF-R людини і миші замінені на інші консервативні амінокислоти, і де зберігається зв'язувальна активність поліпептиду BAFF-R або BAFF-R:Fc у відношенні BAFF. В інших варіантах мутанти кодують поліпептид BAFF-R або BAFF-R:Fc, що має амінокислоти, які не є консервативними між BAFF-R людини і миші, які були замінені на інші амінокислоти. Переважно, щонайменше, одна неполярна амінокислота замінена на 34 залишок проліну або на незаряджену полярну амінокислоту. Антисмислові молекули нуклеїнових кислот Інший аспект даного винаходу відноситься до ізольованих антисмислових молекул нуклеїнових кислот, які можуть гібридизуватись з молекулою нуклеїнової кислоти, що включає нуклеотидну послідовність Фіг.2А, С 3, або її фрагментами, аналогами або похідними, або є комплементарними цій молекулі нуклеїнової кислоти, або її фрагментам, аналогам або похідним. «Антисмислова» нуклеїнова кислота включає нуклеотидну послідовність, яка комплементарна «смисловій» нуклеїновій кислоті, що кодує білок, наприклад, комплементарна кодуючому ланцюгу дволанцюгової кДНКмолекули або комплементарна мРНКпослідовності. У специфічних аспектах забезпечені антисмислові молекули нуклеїнових кислот, які включають послідовність, комплементарну, щонайменше, приблизно 10, 25, 50, 100, 250 або 500 нуклеотидам або всьому кодуючому ланцюгу BAFF-R або тільки його частині. Додатково забезпечені молекули нуклеїнових кислот, кодуючі фрагменти, гомологи, похідні і аналоги білка BAFF-R будь-якої з Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6), або антисмислові нуклеїнові кислоти, комплементарні послідовності нуклеїнової кислоти BAFF-R будь-якої з Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6). В одному варіанті антисмислова молекула нуклеїнової кислоти є антисмисловою відносно «кодуючого району» кодуючого ланцюга нуклеотидної послідовності, що кодує BAFF-R. Термін «кодуючий район» означає район нуклеотидної послідовності, що включає кодони, які транслюються в амінокислотні залишки (наприклад, кодуючий білок район, BAFF-R людини відповідає нуклеотидам 13-568 Фіг.2А (SEQ ID NО:3) або нуклеотидам 13565 Фіг.2С (SEQ ID NО:4) або нуклеотидам 298849 Фіг.3 (SEQ ID NО:6)). В іншому варіанті антисмислова молекула нуклеїнової кислоти є антисмисловою відносно «некодуючого району» кодуючого ланцюга нуклеотидної послідовності, що кодує BAFF-R. Термін «некодуючий район» означає 5'- і 3'-послідовності, які фланкують кодуючий район, які не транслюються в амінокислоти (тобто названі також 5'- і 3'-нетрансльованими районами). За умови, що послідовності кодуючого ланцюга, що кодує BAFF-R, описані тут, антисмислові нуклеїнові кислоти даного винаходу можуть бути сконструйовані відповідно до правил спаровування основ Уотсона і Крику або Хугстіна. Антисмислова молекула нуклеїнової кислоти може бути комплементарною всьому кодуючому району мРНК BAFF-R, але більш переважно є олігонуклеотидом, який є антисмисловим відносно тільки частини кодуючого або некодуючого району мРНК BAFF-R. Наприклад, антисмисловий олігонуклеотид може бути комплементарним району, що оточує сайт початку трансляції мРНК BAFF-R. Антисмисловий олігонуклеотид може мати довжину, наприклад, приблизно 5, 10, 15, 20, 25, 30, 35, 40, 45 або 50 нуклеотидів. Антисмислова молекула нуклеїнової кислоти даного винаходу може бути 35 83458 сконструйована з використанням хімічного синтезу або реакцій ферментативного лігування з використанням процедур, відомих в даній області. Наприклад, антисмислова нуклеїнова кислота (наприклад, антисмисловий олігонуклеотид) може бути хімічно синтезована з використанням нуклеотидів, що природно зустрічаються, або різним чином модифікованих нуклеотидів, призначених для збільшення біологічної стабільності цих молекул або для збільшення фізичної стабільності дуплекса, що утворюється між антисмисловою і смисловою нуклеїновими кислотами, наприклад, можуть використовуватися фосфоротіоатні похідні і заміщені акридином нуклеотиди. Приклади модифікованих нуклеотидів, які можуть бути використані для генерування антисмислової нуклеїнової кислоти, включають в себе: 5фтор урацил, 5-бромурацил, 5-хлорурацил, 5йодурацил, гіпоксантин, ксантин, 4-ацетилцитозин, 5-(карбоксигідроксилметил)урацил, 5карбоксиметиламінометил-2-тіоуридин, 5карбоксиметиламінометилурацил, дигідроурацил, бета-D галактозилквеозин, інозин, N6ізопентеніладенін, 1-метилгуанін, 1-метилінозин, 2,2-диметилгуанін, 2-метиладенін, 2-метилгуанін, 3-метилцитозин, 5-метилцитозин, Ν6-аденін, 7метилгуанін, 5-метиламінометилурацил, 5метоксіамінометил-2-тіоурацил, бета-Sманозилквеозин, 5'-метоксикарбоксиметилурацил, 5-метоксіурацил, 2-метилтіо-N6-ізопентеніладенін, урацил-5-оксіоцтову кислоту (ν), вібутоксозин, псевдоурацил, квеозин, 2-тіоцитозин, 5-метил-2тіоурацил, 2-тіоурацил, 4-тіоурацил, 5метилурацил, метиловий ефір урацил-5оксіоцтової кислоти, 5-метил-2-тіоурацил, 3-(3аміно-3-N-2-карбоксипропіл)урацил, (acp3)w і 2,6діамінопурин. Альтернативно, антисмислова нуклеїнова кислота може бути одержана біологічно з використанням експресуючого вектора, в який була субклонована нуклеїнова кислота в антисмисловій орієнтації (тобто РНК, транскрибована з інсертованої нуклеїнової кислоти, буде мати антисмислову орієнтацію відносно нуклеїнової кислоти, що представляє інтерес, описаної додатково в наступному підрозділі). Антисмислові молекули нуклеїнових кислот даного винаходу звичайно вводять суб'єкту або генерують in situ таким чином, що вони гібридизуються або зв'язуються з клітинною мРНК і/або геномною ДНК, що кодує білок BAFF-R, інгібуючи тим самим експресію цього білка, наприклад, інгібуванням транскрипції і/або трансляції. Ця гібридизація може відбуватися за допомогою звичайної комплементарності нуклеотидів з утворенням стабільного дуплекса або, наприклад, у разі антисмислової молекули нуклеїнової кислоти, яка зв'язується з ДНК-дуплексами, за допомогою специфічних взаємодій в основній борозенці подвійної спіралі. Приклад способу введення антисмислових молекул нуклеїнових кислот даного винаходу включає в себе пряму ін'єкцію в ділянку тканини. Альтернативно, антисмислові молекули нуклеїнових кислот можуть бути модифіковані для вибраних клітин-мішеней і потім введені системно. Наприклад, для системного введення антисмисло 36 ві молекули можуть бути модифіковані таким чином, що вони специфічно зв'язуються з рецепторами або антигенами, експресованими на вибраній клітинній поверхні, наприклад, за допомогою скріплення антисмислових молекул нуклеїнових кислот з пептидами або антитілами, які зв'язуються з рецепторами або антигенами клітинної поверхні. Антисмислові молекули нуклеїнових кислот можуть також доставлятися в клітини з використанням описаних тут векторів. Для досягнення достатніх вн утрішньоклітинних концентрацій антисмислових молекул переважними є векторні конструкції, в яких антисмислова молекула нуклеїнової кислоти вміщена під контроль сильного промотора роl II або роl III. Ще в одному варіанті антисмислова молекула нуклеїнової кислоти даного винаходу є αаномерною молекулою нуклеїнової кислоти, αаномерна молекула нуклеїнової кислоти утворює специфічні дволанцюгові гібриди з комплементарною РНК, в яких, в протилежність звичайним βланкам, ланцюги йдуть паралельно один одному [Gaultier et al. (1987) Nucl. Acids Res. 15: 66256641]. Антисмислова молекула нуклеїнової кислоти може також містити 2'-О-метилрибонуклеотид [Inoue et al. (1987) Nucl. Acids Res. 15: 6131-6148] або химерний РНК-ДНК-аналог [Inoue et al. (1987) FEBS Lett. 215: 327-330]. Рибозими і ПНК-радикали Ще в одному варіанті антисмисловою нуклеїновою кислотою даного винаходу є рибозим. Рибозими є каталітичними РНК-молекулами з рибонуклеазною активністю, які здатні розщеплювати одноланцюгову нуклеїнову кислоту, таку як мРНК, відносно якої вони мають комплементарний район. Таким чином, рибозими (наприклад, «молотоголові» рибозими, описані в [Haselhoff and Gerlach (1988) Nature 334: 585-591], можуть бути використані для каталітичного розщеплення мРНКтранскриптів BAFF-R для інгібування за допомогою цього трансляції мРНК BAFF-R. Рибозим, що має специфічність відносно BAFF-R-кодуючої нуклеїнової кислоти, може бути сконструйований на основі описаної тут н уклеотидної послідовності ДНК BAFF-R (тобто SEQ ID NО:3, SEQ ID NО:4, SEQ ID NО:6). Наприклад, може бути сконструйоване похідне РНК Tetrahymena L-19 IVS, в якому нуклеотидна послідовність активного сайта є комплементарною нуклеотидній послідовності, яка повинна бути розщеплена, у BAFF-R-кодуючій мРНК. Див., наприклад, [Cech et al. U.S. Pat. No. 4 987 071; і Cech et al. патент США №5 116 742]. Альтернативно, мРНК BAFF-R може бути використана для відбору каталітичної РНК, що має специфічну рибонуклеазну активність, з пулу РНКмолекул. Див., наприклад, [Bartel et al., (1993) Science 261: 1411-1418]. Альтернативно, експресія гена BAFF-R може бути інгібована наділенням нуклеотидних послідовностей, комплементарних регуляторному району BAFF-R (наприклад, промотору BAFF-R і/або енхансерам BAFF-R), з утворенням потрійних спіральних структур, які запобігають транскрипції гена BAFF-R в клітинах-мішенях. Див. у загальному [Helene (1991) Anticancer Drug Des. 6: 569-84; 37 83458 Helene et al. (1992) Ann. N.Y. Acad. Sci. 660: 27-36; і Maher (1992) Bioassays 14: 807-15]. У різних варіантах нуклеїнові кислоти BAFF-R можуть бути модифіковані в частині основи, цукровій частині або фосфатному скелеті молекули для поліпшення, наприклад, стабільності, гібридизації або розчинності цієї молекули. Наприклад, дезоксирибозофосфатний скелет нуклеїнових кислот може бути модифікований для генерування пептиднуклеїнових кислот [див. Hyrap et al. (1996) Bioorg. Med. Chera. 4: 5-23]. У застосуванні тут терміни «пептиднуклеїнові кислоти» або «ПНК» означають міметики нуклеїнових кислот, наприклад, ДНК-міметики, в яких дезоксирибозофосфатний скелет замінений псевдопептидним скелетом і збережені тільки чотири природних нуклеооснови. Було показано, що нейтральний скелет ПНК робить можливою специфічну гібридизацію з ДНК і РНК в умовах низької іонної сили. Синтез ПНКолігонуклеотидів можна виконувати з використанням протоколів стандартного твердофазного пептидного синтезу, описаних в [Hyrap et al. (1996) Bioorg. Med. Chem. 4:5-23; Perry-O'Keefe et al. (1996) Proc. Natl. Acad. Sci. USA 93: 14670-675]. ПНК BAFF-R можуть бути використані для терапевтичних і діагностичних застосувань. Наприклад, ПНК можуть бути використані як антисмислові або антигенні агенти для послідовністьспецифічної модуляції експресії генів, наприклад, індукцією зупинки транскрипції або трансляції або інгібуванням реплікації. ПНК BAFF-R можуть бути також використані, наприклад, в аналізі мутацій єдиної пари основ в гені за допомогою, наприклад, ПНК-направленого утворення ПЛР-«клемпа»; як штучні рестриктази при застосуванні в комбінації з іншими ферментами, наприклад, S1-нуклеазами [Нуruр В. (1996) Bioorg. Med. Chem. 4: 5-23], або як зонди або праймери для ДНК-послідовності і гібридизації [Нуruр et al. (1996), Bioorg. Med. Chem. 4: 5-23; Perry-O'Keefe (1996) Proc. Natl. Acad. Sci. USA 93: 14670-675]. В іншому варіанті ПНК BAFF-R можуть бути модифіковані, наприклад, для посилення їх стабільності або клітинного поглинання, приєднанням ліпофільних або інших допоміжних груп до ПНК з утворенням ПНК-ДНК-химер або з використанням ліпосом або інших способів доставки лікарських засобів, відомих в даній області. Наприклад, можуть бути одержані ПНК-ДНК-химери BAFF-R, які можуть об'єднувати корисні властивості ПНК і ДНК. Такі химери дозволяють ферментам, які упізнають ДНК, наприклад, РНКазі і ДНК-полімеразам, взаємодіяти з ДНК-частиною, тоді як ПНК-частина забезпечує високу афінність скріплення і специфічність. ПНК-ДНК-химери можуть бути пов'язані з використанням лінкер відповідної довжини, вибраних в залежності від стекінгу основ, числа зв'язків між нуклеоосновами і орієнтації [Нуruр (1996) Bioorg. Med. Chem. 4: 5-23]. Синтез ПНК-ДНКхимер може виконуватися, як описано в [Нуruр (1996) Bioorg. Med. Chem. 4: 5-23; and Finn et al. (1996) Nucl. Acids Res. 24: 3357-63]. Наприклад, ланцюг ДНК може бути синтезований на твердому носії з використанням стандартного способу фосфорамідитного скріплення, і модифіковані нуклео 38 зидні аналоги, наприклад, 5'-(4метокситритил)аміно-5'дезокситимїдинфосфорамідит, можуть бути використані між ПНК і 5'-кінцем ДНК [Mag et al. (1989) Nucl. Acids Res. 17: 5973-88]. Потім ПНК-мономери зв'язують ступінчастим чином з одержанням химерної молекули з 5'-ПНК-сегментом і 3'-ДНКсегментом (Finn et al. (1996) вище). Альтернативно, химерні молекули можуть бути синтезовані з 5'-ДНК-сегментом і 3'-ПНК-сегментом. Див., наприклад, [Petersen et al. (1975) Bioorg. Med. Chem. Lett. 5: 1119-11124]. В інших варіантах олігонуклеотид може включати в себе інші приєднані групи, такі як пептиди (наприклад, для націлення на рецептори клітинихазяїна in vivo), або агенти, які сприяють транспорту через мембрану клітини [див., наприклад, Letsinger et al. (1989) Proc. Natl. Acad. Sci. USA 86: 6553-6556; Lemaitre et al. (1987) Proc. Natl. Acad. Sci. USA 84: 648-652; PCT Публікацію №WO 88/09810] або гематоенцефалічний бар'єр [див., наприклад, Публікацію PCT №WO 89/10134]. Крім того, олігонуклеотиди можуть бути модифіковані агентами розщеплення, що запускаються гібридизацією [див., наприклад, Krol et al., (1988) BioTechniques 6: 958-976] або інтеркалюючими агентами [див., наприклад, Zon, (1988) Pharm. Res. 5: 539-549]. Для цієї мети олігонуклеотид може бути кон'югований з іншою молекулою, наприклад, пептидом, зшиваючим агентом, що запускається гібридизацією, агентом транспорту, агентом розщеплення, що запускається гібридизацією, і т.д. Поліпептиди BAFF-R Один з аспектів даного винаходу відноситься до виділених білків BAFF-R і їх біологічно активних частин, або їх похідних, фрагментів, аналогів або гомологів. Забезпечені також поліпептидні фрагменти, придатні для застосування як імуногени для індукції BAFF-R-антитіл. В одному варіанті природні білки BAFF-R можуть бути виділені з клітин або тканин-джерел за допомогою відповідної схеми очищення з використанням стандартних способів очищення білків. В іншому варіанті білки BAFF-R одержують способами рекомбінантних ДНК. Альтернативно рекомбінантній експресії, білок або поліпептиди BAFF-R можуть бути синтезовані хімічно з використанням стандартних способів синтезу пептидів. «Виділені» або «очищені» білок або його біологічно активна частина по суті не містять клітинного матеріалу або інших забруднюючих (домішкових) білків з даної клітини або тканини-джерела, з яких одержаний даний білок BAFF-R, або по суті не містять хімічних попередників або інших хімікаліїв при хімічному синтезі. Вираз «які по суті не містять клітинного матеріалу» включає в себе препарати білка BAFF-R, в яких цей білок відділений від клітинних компонентів клітин, з яких він виділений, або одержаний рекомбінантним шляхом. В одному варіанті вираз «які по суті не містять клітинного матеріалу» включає в себе препарати білка BAFF-R, що мають менше ніж приблизно 30% (за сухою вагою) нe-BAFF-R-білка (також названого тут «забруднюючим (домішковим) білком»), більш переважно менше ніж приблизно 20% 39 83458 He-BAFF-R-білка, ще більш переважно менше ніж приблизно 10% нe-BAFF-R-білка і найбільш переважно менше ніж приблизно 5% He-BAFF-R-білка. При одержанні білка BAFF-R або його біологічно активної частини рекомбінантним шляхом, він також є по суті вільним від культурального середовища, тобто культуральне середовище представляє менше ніж приблизно 20%, більш переважно менше ніж приблизно 10%, і найбільш переважно менше ніж приблизно 5% об'єму препарату білка. Вираз «які по суті не містять хімічних попередників або інших хімікаліїв» включає в себе препарати білка BAFF-R, в яких цей білок відділений від хімічних попередників або інших хімікаліїв, які беруть участь в синтезі цього білка. В одному варіанті вираз «які по суті не містять хімічних попередників або інших хімікаліїв» включає в себе препарати білка BAFF-R, що мають менше ніж приблизно 30% (за сухою вагою) хімічних попередників або нe-BAFF-R-хімікаліїв, більш переважно менше ніж приблизно 20% хімічних попередників або нeBAFF-R-хімікаліїв, ще більш переважно менше ніж приблизно 10% хімічних попередників або нeBAFF-R-хімікаліїв, і найбільш переважно менше ніж приблизно 5% хімічних попередників або нeBAFF-R-хімікаліїв. Біологічно активні частини білка BAFF-R включають в себе пептиди, що містять амінокислотні послідовності, досить гомологічні або одержані з амінокислотної послідовності білка BAFF-R, наприклад, амінокислотної послідовності, показаної в SEQ ID NО:5, які включають в себе менше амінокислот, ніж повнорозмірні білки BAFF-R і виявляють, щонайменше, одну активність білка BAFF-R. Звичайно, біологічно активні частини включають домен або мотив з, щонайменше, однією активністю білка BAFF-R. Біологічно активна частина білка BAFF-R може бути поліпептидом, який має довжину, наприклад, щонайменше, 10, 25, 50, 100 або більше за амінокислоти. Біологічно активна частина білка BAFF-R даного винаходу може містити, щонайменше, один з вищезгаданих доменів, консервативних між білками BAFF-R. Альтернативна біологічно активна частина білка BAFF-R може містити, щонайменше, два з вищезгаданих доменів. Інша біологічно активна частина білка BAFF-R може містити, щонайменше, три з вищезгаданих доменів. Ще одна біологічно активна частина білка BAFF-R даного винаходу може містити, щонайменше, чотири з вищезгаданих доменів. Крім того, інші біологічно активні частини, в яких делетовані інші райони даного білка, можуть бути одержані рекомбінантними способами і оцінені на одну або декілька функціональних активностей нативного білка В AFF-R. В одному варіанті білок BAFF-R має амінокислотну послідовність, показану на Фіг.2D (SEQ ID NО:5). В інших варіантах білок BAFF-R є по суті гомологічним Фіг.2D (SEQ ID NО:5) і зберігає функціональну активність білка Фіг.2D (SEQ ID NО:5), але відрізняється за амінокислотною послідовністю внаслідок природної алельної варіації або мутагенезу, як описано детально нижче. Таким чином, в іншому варіанті білок BAFF-R є білком, який 40 включає амінокислотну послідовність, гомологічну, щонайменше, на приблизно 45% амінокислотної послідовності Фіг.2D (SEQ ID NО:5), і зберігає функціональну активність білків BAFF-R Фіг.2D(SEQ ID NO:5). У деяких варіантах даний винахід включає в себе специфічні мутанти поліпептиду BAFF-R:Fc, сконструйованого для ослаблення агрегації експресованого білка при збереженні BAFFзв'язувальної активності. Такі мутанти включають в себе, наприклад, клони, що кодують амінокислотні послідовності JST661 (SEQ ID NО:17), JST662 (SEQ ID NО:18), JST663 (SEQ ID NО:19), JST673 (SEQ ID NО:20), JST674 (SEQ ID NО:21), JST675 (SEQ ID NО:22), JST672 (SEQ ID NО:23), JST676 (SEQ ID NО:24), JST671 (SEQ ID NО:25), JST677 (SEQ ID NО:26) JST678 (SEQ ID NО:27). Інші варіанти включають в себе мутанти, що кодують поліпептид BAFF-R або BAFF-R:Fc, які мають характеристики агрегації, схожі з нативним поліпептидом BAFF-R людини або BAFF-R:Fc, але також зв'язують BAFF, в тому числі, наприклад, послідовності, що включають амінокислотні послідовності JST659 (SEQ ID NО:15), JST660 (SEQ ID NО:16), JST664 (SEQ ID NО:28), JST668 (SEQ ID NО:29), JST665 (SEQ ID NО:30), JST666 (SEQ ID NО:31) і JST667 (SEQ ID NО:32). Інші варіанти включають в себе мутанти, що кодують поліпептид BAFF-R або BAFF-R:Fc, де консервативні амінокислоти між BAFF-R людини і миші замінені іншими консервативними амінокислотами і де збережена зв'язувальна активність поліпептиду BAFF-R або BAFFR:Fc відносно BAFF. В інших варіантах мутанти кодують поліпептид BAFF-R або BAFF-R:Fc, що має амінокислоти, які не є консервативними між BAFF-R людини і миші, які були замінені на інші амінокислоти. Переважно, неполярні амінокислоти мутовані заміною їх на пролін або незаряджені полярні амінокислоти. Визначення гомології між двома або декількома послідовностями Для визначення процентної гомології двох амінокислотних послідовностей або двох нуклеїнових кислот ці послідовності вирівнюють для цілей оптимального порівняння (наприклад, можуть вводитися гепи в першій амінокислотній послідовності або послідовності нуклеїнової кислоти для оптимального вирівнювання з другою амінокислотною послідовністю або послідовністю нуклеїнової кислоти). Потім порівнюють амінокислотні залишки або нуклеотиди у відповідних положеннях амінокислот або положеннях нуклеотидів. Коли положення в першій послідовності зайняте тим же самим амінокислотним залишком або нуклеотидом, що і відповідне положення у другій послідовності, то ці молекули є гомологічними в цьому положенні (тобто в застосуванні тут «гомологія» амінокислоти або нуклеотиду еквівалентна «ідентичності» амінокислоти або нуклеотиду). Гомологія послідовності нуклеїнової кислоти може бути визначена як міра ідентичності між двома послідовностями. Гомологія може бути визначена з використанням комп'ютерних програм, відомих в даній області, таких як програма GAP (ГЕП), забезпечена в пакеті програм GCG. [Див. 41 83458 Needleman and Wunsch (1970) J. Моl. Biol. 48: 443453]. З використанням програми GAP GCG з наступними установками для порівняння послідовностей нуклеїнових кислот: штраф (пенальті) за створення гепу 5,0 і штра ф (пенальті) за подовження гепу 0,3, кодуючий район аналогічних послідовностей нуклеїнових кислот, вказаних вище, виявляє міру ідентичності переважно, щонайменше, 70%, 75%, 80%, 85%, 90%, 95%, 98% або 99%, причому CDS (кодуюча) частина послідовності ДНК показана на Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6). Термін «ідентичність послідовностей» означає міру, в якій дві полінуклеотидні або поліпептидні послідовності є ідентичними на основі залишок-зазалишком протягом конкретного району порівняння. «Процентну ідентичність послідовності» розраховують порівнянням двох оптимально вирівняних послідовностей протягом району порівняння, визначенням числа положень, в яких ідентичні основи нуклеїнових кислот (наприклад, А, Т, С, G, U або І, у разі нуклеїнових кислот) зустрічаються в обох послідовностях, з одержанням співпадаючих положень, розподілом числа співпадаючих положень на загальне число положень в районі порівняння (тобто на розмір вікна) і множенням результату на 100 з одержанням процента ідентичності послідовності. Термін «істотна ідентичність» в застосуванні тут означає характеристику полінуклеотидної послідовності, де даний полінуклеотид включає послідовність, яка має, щонайменше, 80%-ну ідентичність послідовності, переважно, щонайменше, 85%-ну ідентичність і часто 90-95%ну ідентичність послідовності, більш звичайно, щонайменше, 99%-ну ідентичність послідовності в порівнянні з посилальною послідовністю протягом району порівняння. Химерні і злиті білки Даний винахід забезпечує також химерні або злиті білки BAFF-R. У застосуванні тут «химерний білок» або «злитий білок» BAFF-R включає BAFFR-поліпептид, функціонально злитий з He-BAFF-Rполіпептидом. «BAFF-R-поліпептид» означає поліпептид, що має амінокислотну послідовність, відповідну BAFF-R, тоді як «He-BAFF-R-поліпептид» означає поліпептид, що має амінокислотну послідовність, відповідну білку, який не є по суті гомологічним білку BAFF-R, наприклад, білку, який відрізняється від білка BAFF-R і який одержаний з того ж самого або відмінного організму. У злитому білку BAFF-R BAFF-R-поліпептид може відповідати всьому білку або частині білка BAFF-R. В одному варіанті злитий білок BAFF-R включає, щонайменше, одну біологічно активну частину білка BAFF-R. В іншому варіанті злитий білок BAFF-R включає, щонайменше, дві біологічно активні частини білка BAFF-R. Ще в одному варіанті злитий білок BAFF-R включає, щонайменше, три біологічно активні частини білка BAFF-R. У злитому білку термін «функціонально пов'язані» вказує на те, що BAFF-R-поліпептид і He-BAFF-R-поліпептид злиті в рамці зчитування один з одним. He-BAFF-Rполіпептид може бути злитий з N-кінцем або Скінцем BAFF-R-поліпептиду. He-BAFF-Rполіпептид може бути, наприклад, Fc-частиною 42 антитіла. Вона може бути функціонально приєднана або до N-кінця, або до С-кінця BAFF-Rполіпептиду. Злиті з Fc-частиною білки описані в [Lo et al. (1998) Protein Enginering 11: 495-500, і патент США №5 541 087 і 5 726 044], описи яких включені тут як посилання. Наприклад, в одному варіанті злитий білок BAFF-R включає домен BAFF-R, функціонально пов'язаний з позаклітинним доменом другого білка. Такі злиті білки можуть бути додатково використані в скринінг-аналізах на сполуки, які модулюють активність BAFF-R (такі аналізи описані детально нижче). Ще в одному варіанті злитий білок є злитим білком GST-BAFF-R, в якому послідовності BAFFR злиті з С-кінцем послідовності GST (тобто глутатіон-S-трансферази). Такі злиті білки можуть полегшува ти очищення рекомбінантного BAFF-R. В іншому варіанті злитий білок є білком BAFFR, що містить гетерологічну сигнальну послідовність на його N-кінці. Наприклад, оскільки BAFF-R не містить власної сигнальної послідовності, гетерологічна сигнальна послідовність повинна бути злита з 5'-кінцем кодуючої послідовності BAFF-R для ефективної секреції злитого білка BAFF-R. Експресія і/або секреція BAFF-R може бути збільшена за допомогою використання різних гетерологічних сигнальних послідовностей. Ще в одному варіанті злитий білок є злитим білком BAFF-R-імуноглобулін, в якому послідовності BAFF-R, що включають один або декілька доменів, злиті з послідовностями, одержаними з члена сімейства білків імуноглобулінів. Злиті білки BAFF-R-імуноглобулін даного винаходу можуть включатись у фармацевтичні композиції і вводитись суб'єкту для інгібування взаємодії між лігандом BAFF-R і білком BAFF-R на поверхні клітини для супресії за допомогою цього BAFF-Rопосередкованої трансдукції сигналу in vivo. Злиті білки BAFF-R-імуноглобулін можуть бути використані для дії на біодоступність спорідненого BAFF-R ліганду. Інгібування взаємодії ліганд BAFFR/BAFF-R може бути корисним терапевтично як для лікування проліферативних і пов'язаних з диференціюванням порушень, так і для модуляції (наприклад, стимуляції або інгібування) виживання клітин. Крім того, злиті білки BAFF-R-імуноглобулін даного винаходу можуть бути використані як імуногени для одержання анти-BAFF-R-антитіл у суб'єкта, для очищення лігандів BAFF-R і в скринінганалізах для ідентифікації молекул, які інгібують взаємодію BAFF-R з лігандом BAFF-R. Химерний або злитий BAFF-R-білок даного винаходу може бути одержаний стандартними способами рекомбінантих ДНК. Наприклад, ДНКфрагменти, що кодують різні поліпептидні послідовності, лігують разом в рамці зчитування відповідно до загальноприйнятих способів, наприклад, з використанням затуплених або ступінчастих кінців для лігування, розщеплення рестрикційними ферментами для забезпечення відповідних кінців, заповнення липких кінців, якщо треба, обробки лужною фосфатазою, щоб уникнути небажаної сполуки і ферментативного лігування. В іншому варіанті злитий ген може бути синтезований зага 43 83458 льноприйнятими способами, в тому числі автоматичними ДНК-синтезаторами. Альтернативно, може проводитись ПЛР-ампліфікація фрагментів гена з використанням якірних праймерів, які приводять до утворення комплементарних виступів між двома послідовними фрагментами гена, які можуть бути потім випалені і повторно ампліфіковані з одержанням химерної генної послідовності [див, наприклад, Ausubel et al. Eds. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, 1992]. Крім того, багато які експресуючі вектори є комерційно доступними, причому ці вектори вже кодують частину молекули, що зливається (наприклад, GST-поліпептид). Кодуюча BAFF-R нуклеїнова кислота може бути клонована в такий експресуючий вектор, що так частина, що зливається, зв'язується в рамці зчитування з білком BAFF-R. У переважному варіанті злитий білок BAFF-R забезпечений послідовністю нуклеїнової кислоти (SEQ ID NО:11) і амінокислотною послідовністю (SEQ ID NО:12) Фіг.9. Агоністи і антагоністи BAFF-R Даний винахід відноситься також до варіантів білків BAFF-R, які функціонують або як агоністи BAFF-R (міметики), або як антагоністи BAFF-R. Варіанти білка BAFF-R можуть бути одержані мутагенезом, наприклад, дискретною точковою мутацією або укороченням білка BAFF-R. Агоніст білка BAFF-R може зберігати по суті ту ж самі біологічну активність або підпорядкований набір біологічної активності форми білка BAFF-R, що природно зустрічається. Антагоніст білка BAFF-R може інгібувати одну або декілька активностей форми білка BAFF-R, що природно зустрічається, наприклад, конкурентним скріпленням з членом каскаду передачі сигналу, що знаходиться по ходу або проти ходу каскаду, який включає в себе білок BAFF-R. Таким чином, специфічні біологічні ефекти можуть бути індуковані обробкою варіантом обмеженої функції. В одному варіанті обробка суб'єкта варіантом, що має підпорядкований набір біологічної активності форми білка, що природно зустрічається, має менші побічні дії у суб'єкта, в порівнянні з обробкою формою білків BAFF-R, що природно зустрічається. Варіанти білка BAFF-R, які функціонують або як агоністи BAFF-R (міметики), або як антагоністи BAFF-R, можуть бути ідентифіковані скринінгом комбінаторних бібліотек мутантів, наприклад, укорочених мутантів, білка BAFF-R на агоністичну або антагоністичну активність білка BAFF-R. В одному варіанті мозаїчну бібліотеку різноманітних варіантів BAFF-R одержують комбінаторним мутагенезом на рівні нуклеїнових кислот, причому вказана бібліотека кодується за допомогою мозаїчної бібліотеки генів. Мозаїчна бібліотека варіантів BAFFR може бути одержана, наприклад, ферментативним лігуванням суміші синтетичних олігонуклеотидів в послідовності генів, так що вироджений набір потенційних послідовностей BAFF-R експресується у вигляді індивідуальних поліпептидів, або альтернативно, у ви гляді набору більш крупних злитих білків (наприклад, фагове представлення), що містять в них набір послідовностей BAFF-R. Існує 44 множина способів, які можуть бути використані для одержання бібліотек потенційних варіантів BAFF-R з виродженої олігонуклеотидної послідовності. Хімічний синтез виродженої генної послідовності може виконуватись у автоматичному ДНКсинтезаторі, і потім синтетичний ген може бути лігований у відповідний експресуючий вектор. Застосування виродженого набору генів дозволяє забезпечити в одній суміші всі послідовності, що кодують бажаний набір потенційних послідовностей BAFF-R. Способи синтезу вироджених олігонуклеотидів відомі в даній області [див., наприклад, Narang (1983) Tetrahedron 39:3; Itakura et al. (1984) Ann. Rev. Biochem. 53: 323; Itakura et al. (1977) Science 198: 1056-1063; Ike et al. (1983) Nucl. Acids Res. 11:477-488). Бібліотеки поліпептидів Крім того, бібліотеки фрагментів кодуючої послідовності білка BAFF-R можуть бути використані для одержання мозаїчної популяції фрагментів BAFF-R для скринінгу і подальшого відбору варіантів білка BAFF-R. В одному варіанті бібліотека фрагментів кодуючої послідовності може бути одержана обробкою дволанцюгового ПЛРфрагмента кодуючої послідовності BAFF-R нуклеазою в умовах, в яких розрив одного ланцюга відбувається тільки приблизно один раз на молекулу, денатурацією дволанцюгової ДНК, ренатурацією цієї ДНК з утворенням дволанцюгової ДНК, яка може включати в себе смислові/антисмислові пари з продуктів з різними розривами одного ланцюга, видаленням одноланцюгових частин з повторно утворених дуплексів обробкою S1-нуклеазою і лігуванням одержаної бібліотеки фрагментів в експресуючий вектор. За допомогою цього способу може бути одержана експресуюча бібліотека, яка кодує N-кінцеві і внутрішні фрагменти різних розмірів білка BAFF-R. У даній області відомі декілька способів для скринінгу генних продуктів комбінаторних бібліотек, одержаних точковими мутаціями або укороченням, і для скринінгу кДНК-бібліотек на генні продукти, що мають вибрану властивість. Такі способи можуть бути адаптовані для швидкого скринінгу бібліотек генів, що генеруються комбінаторним мутагенезом білка BAFF-R. Способи, що найбільш широко використовуються, які придатні для високопродуктивного аналізу, для скринінгу великих бібліотек генів, звичайно включають в себе клонування бібліотеки генів в репліковані експресуючі вектори, трансформацію відповідних клітин одержаною бібліотекою векторів і експресію цих комбінаторних генів в умовах, в яких детектування бажаної активності полегшує виділення вектора, що кодує ген, продукт якого був детектований. REM (recrusive ensemble mutagenesis), новий спосіб, який посилює частоту появи функціональних мутантів в бібліотеках, може бути використаний в комбінації зі скринінг-аналізами для ідентифікації варіантів BAFF-R [Arkin and Yourvan (1992) Proc. Natl. Acad. Sci. USA 89: 7811-7815; Delgrave et al. (1993) Protein Engineering 6: 327-331]. Антитіла проти BAFF-R Виділений білок BAFF-R, або його частина або фрагмент, можуть бути використані як імуноген 45 83458 для генерування антитіл, які зв'язують BAFF-R, з використанням стандартних способів для одержання моноклональних і поліклональних антитіл. Може бути використаний повнорозмірний білок BAFF-R, або, альтернативно, даний винахід забезпечує антигенні пептидні фрагменти BAFF-R для застосування як імуногенів. Антигенний пептид BAFF-R включає, щонайменше, 8 амінокислотних залишків амінокислотної послідовності, показаної на Фіг.2D (SEQ ID NО:5), і включає в себе епітоп BAFF-R, так що антитіло, індуковане проти цього пептиду, утворює специфічний імунний комплекс з BAFF-R. Переважно, цей антигенний пептид включає, щонайменше, 10 амінокислотних залишків, більш переважно, щонайменше, 15 амінокислотних залишків, ще більш переважно, щонайменше, 20 амінокислотних залишків і найбільш переважно, щонайменше, 30 амінокислотних залишків. Переважними епітопами, що охоплюються терміном антигенний пептид, є райони BAFF-R, які локалізовані на поверхні цього білка, наприклад, гідрофільні райони. Як описано тут, послідовність білка BAFF-R Фіг.2D (SEQ ID NО:5) або її похідні, фрагменти, аналоги або гомологи можуть бути використані як імуногени в генеруванні антитіл, які імуноспецифічно зв'язують ці білкові компоненти. Термін «антитіло» в застосуванні тут означає молекули імуноглобуліну і імунологічно активні частини молекул імуноглобуліну, тобто молекули, які містять сайт скріплення антигену, який специфічно зв'язує (імунореагує з ним) антиген, такий як BAFF-R. Такі антитіла включають в себе, але не обмежуються ними, поліклональні, моноклональні, химерні антитіла, одноланцюгові, Fab і F(ab')2-фрагменти і експресуючу Fab бібліотеку. У конкретному варіанті описані антитіла до білків BAFF-R людини. Різні процедури, відомі в даній області, можуть бути використані для одержання поліклональних або моноклональних антитіл до послідовності білка BAFF-R Фіг.2D (SEQ ID NО:5) або його похідного, фрагмента, аналога або гомолога. Деякі з цих білків обговорюються нижче. Для одержання поліклональних антитіл різні відповідні тварини-хазяї (наприклад, кролик, коза, миша або інший ссавець) можуть бути імунізовані ін'єкцією природним білком або його синтетичним варіантом або їх похідним. Відповідний імуногенний препарат може містити, наприклад, рекомбінантно експресований білок BAFF-R або хімічно синтезований поліпептид BAFF-R. Цей препарат може додатково включати в себе ад'ювант. Різні ад'юванти, що використовуються для збільшення імунологічної відповіді, включають в себе, але не обмежуються ними, ад'ювант Фрейнда (повний або неповний), мінеральні гелі (наприклад, гідроксид алюмінію), поверхнево-активні речовини (наприклад, лізолецитин, плуронікові поліолі, поліаніони, пептиди, масляні емульсії, динітрофенол і т.д.), ад'юванти для людини, такі як Bacille Calmette-Guerin (BCG) і Corynebacterium pervum, або подібні імуностимуляторні агенти. Якщо бажано, молекули антитіл, направлені проти BAFF-R, можуть бути виділені з ссавця (наприклад, з крові) і додатково очищені добре відомими способами, 46 такими як протеїн Α-хроматографія, для одержання IgG-фракції. Термін «моноклональне антитіло» або «композиція моноклонального антитіла» в застосуванні тут відноситься до популяції молекул антитіл, які містять тільки один вид антигензв'язувального сайта, здатний імунореагувати з конкретним епітопом BAFF-R. Таким чином, композиція моноклонального антитіла звичайно виявляє єдину зв'язувальну афінність відносно конкретного білка BAFF-R, з яким вона імунореагує. Для одержання моноклональних антитіл, направлених проти конкретного білка BAFF-R або його похідних, фрагментів, аналогів або гомологів, може бути використаний будьякий спосіб, який забезпечує продукування молекул антитіл безперервним культивуванням клітинної лінії. Такі способи включають в себе, але не обмежуються ними, гібридомний спосіб [див. Kohler & Milstein, (1975) Nature 256: 495-497]; триомний спосіб; гібридомний спосіб з використанням В-клітин людини [див. Kozbor et al. (1983) Immunol Today 4: 72] і EBV-гібридомний спосіб для одержання моноклональних антитіл людини [див. Cole, et al. IN MONOCLONAL ANTIBODIES AND CANCER THERAPY, Alan R. Liss, Inc., 1985, pp.7796]. Моноклональні антитіла людини можуть бути використані в практиці даного винаходу і можуть бути одержані з використанням гібридом людини [Cole et al. (1983) Proc. Natl Acad. Sci. USA 80: 2026-2030] або трансформацією В-клітин людини вірусом Епстейна-Барра in vitro [див. Cole et al. IN MONOCLON AL ANTIBODIES AND CANCER THERAPY, Alan R. Liss, Inc., 1985 pp.77-96]. Згідно з даним винаходом, способи можуть бути адаптовані для одержання одноланцюгових антитіл, специфічних для білка BAFF-R [див., наприклад, патент США №4 946 778]. Крім того, способи можуть бути адаптовані для конструювання експресуючих Fab-бібліотек [див. Huse et al. (1989) Science 246: 1275-1281] для можливості швидкої і ефективної ідентифікації моноклональних Fabфрагментів з бажаною специфічністю відносно білка BAFF-R або його похідних, фрагментів, аналогів або гомологів. Надлюдські антитіла можуть бути «гуманізовані» способами, добре відомими в даній області. [Див., наприклад, патент США з номером 5 225 539]. Фрагменти антитіл, які містять ідіотипи до білка BAFF-R, можуть бути одержані способами, відомими в даній області, в тому числі, але не тільки: (і) Р(аb')2-фрагмент, що одержується розщепленням пепсином молекули антитіла; (іі) Fab-фрагмент, що одержується відновленням дисульфідних містків Р(аb')2-фрагмента; (ііі) Fabфрагмент, що одержується обробкою молекули антитіла папаїном і відновлювальним агентом, і (iv) Fv-фрагменти. Крім того, рекомбінантні aHTH-BAFF-Rантитіла, такі як химерні і гуманізовані моноклональні антитіла, що містять частини як людини, так і не-людини, які можуть бути одержані з використанням стандартних способів рекомбінантних ДНК, знаходяться в об'ємі даного винаходу. Такі химерні і гуманізовані моноклональні антитіла можуть бути одержані способами рекомбінантних ДНК, відомими в даній області, наприклад, з викорис 47 83458 танням способів, описаних в [Міжнародній публікації РСТ з номером PCT/US86/02269; Європейській патентній заявці з номером 184 187; Європейській патентній заявці з номером 171 496; Європейській патентній заявці з номером 173 494; Міжнародної публікації РСТ з номером WO 86/01533; патенті США з номером 4 816 567; Європейській патентній заявці з номером 125 023; Better et al. (1988) Science 240: 1041-1043; Liu et al. (1987) Proc. Natl. Acad. Sci. USA 84: 3439-3443; Liu et al.(1987) J.Immunol. 139: 3521-3526; Sun et al. (1987) Proc. Natl. Acad. Sci. USA 84: 214-218; Nishimura et al. (1987) Cancer Res. 47: 999-1005; Wood et al. (1985) Nature 314: 446-449; Shaw et al. (1988) J. Natl. Cancer Inst. 80: 1553-1559); Morrison (1985) Science 229: 1202-1207; Oi et al. (1986) BioTechniques 4: 214; U.S. Pat. No. 5,225,539; Jones et al. (1986) Nature 321: 552-525; Verhoeyan et al. (1988) Science 239: 1534; і Beidler et al. (1988) J. Immunol. 141: 4053-4060]. В одному варіанті способи для скринінгу антитіл, які володіють бажаною специфічністю, включають в себе, але не обмежуються ними, твердофазний імуноферментний аналіз (ELISA) та інші імунологічно-опосередковані способи, відомі в даній області. У конкретному варіанті, відбір антитіл, які є специфічними відносно конкретного домену білка BAFF-R, полегшується генеруванням гібридом, які зв'язуються з фрагментом білка BAFF-R, що володіє таким доменом. Антитіла, які є специфічними відносно одного або декількох доменів в білку BAFF-R, наприклад, доменів, що охоплюють вищеописані консервативні райони білків сімейства BAFF-R, або їх похідних, фрагментів, аналогів або гомологів, також забезпечені в даному винаході. AHTH-BAFF-R-антитіла можуть бути використані в способах, відомих в даній області, що відносяться до локалізації і/або кількісного визначення білка BAFF-R (наприклад, для застосування у вимірюванні рівнів білка BAFF-R у відповідних фізіологічних пробах, для застосування в діагностичних способах, для застосування у візуалізації цього білка і т.п.). У конкретному варіанті антитіла для білків BAFF-R або їх похідних, фрагментів, аналогів або гомологів, які містять виникаючий з цих антитіл домен скріплення, використовують як фармакологічно активні сполуки (далі названі «терапевтичними речовинами»). AHTH-BAFF-R-антитіло (наприклад, моноклональне антитіло) може бути використане для виділення BAFF-R стандартними способами, такими як афінна хроматографія або імунопреципітація. AHTH-BAFF-R-антитіло може полегшувати очищення природного BAFF-R з клітин і рекомбінантно продукованого BAFF-R, експресованого в клітинах-хазяях. Крім того, анти-BAFF-R-антитіло може бути використане для детектування білка BAFF-R (наприклад, в клітинному лізаті або клітинному супернатанті) для оцінки представленості і розподілу експресії білка BAFF-R. AHTH-BAFF-Rантитіла можуть бути використані діагностично для моніторингу рівнів білка в тканинах як частина процедури клінічного випробування, наприклад, для визначення ефективності конкретної схеми 48 лікування. Детектування може полегшуватися скріпленням (тобто фізичним скріпленням) антитіла з детектованою речовиною. Приклади детектованих речовин включають в себе різні ферменти, простетичні групи, флуоресцентні матеріали, люмінесцентні матеріали, біолюмінесцентні матеріали і радіоактивні матеріали. Приклади відповідних ферментів включають в себе пероксидазу хріну, лужну фосфатаз у, β-галактозидазу або ацетилхолінестеразу; приклади відповідних комплексів простетичних груп включають в себе стрептавідин/біотин і авідин/біотин; приклади відповідних флуоресцентних матеріалів включають в себе умбеліферон, флуоресцеїн, флуоресцеїнізотіоціанат, родамін, дихлортриазиніламінфлуоресцеїн, дансилхлорид або фікоеритрин; приклад люмінесцентного матеріалу включає в себе люмінол; приклади біолюмінесцентних матеріалів включають в себе люциферазу, люциферин і аекворин, і приклади відповідного радіоактивного матеріалу включають в себе 125 І, 131I, 35S або 3H. Рекомбінантні експресуючі BAFF-R вектори і клітини-хазяї Інший аспект даного винаходу відноситься до векторів, переважно експресуючих векторів, що містять нуклеїнову кислоту, що кодує білок BAFF-R або його похідні, фрагменти, аналоги або гомологи. У застосуванні тут термін «вектор» відноситься до молекули нуклеїнової кислоти, здатної транспортувати іншу нуклеїнову кислоту, з якою він був пов'язаний. Один тип вектора є «плазмідою», яка є кільцевою дволанцюговою петлею ДНК, в яку можуть бути ліговані додаткові ДНК-сегменти. Іншим типом вектора є вірусний вектор, де додаткові ДНК-сегменти можуть бути ліговані у вірусний геном. Деякі вектори здатні до автономної реплікації в клітині-хазяїні, в яку їх вводять (наприклад, бактеріальні вектори, що мають бактеріальний сайт ініціації реплікації (оріджин), і епісомні вектори ссавців). Інші вектори (наприклад, неепісомні вектори ссавців) інтегруються в геном клітини-хазяїна при введенні в клітину-хазяїна і за допомогою цього реплікуються разом з геномом хазяїна. Крім того, деякі вектори здатні до управління експресією генів, з якими вони функціонально пов'язані. Такі вектори називають тут «експресуючими векторами». Звичайно експресуючі вектори, що використовуються в способах рекомбінантних ДНК, часто знаходяться у формі плазмід. У даній заявці терміни «плазміда» і «вектор» можуть використовуватися взаємозамінно, оскільки плазміда є формою вектора, що найчастіше використовується. Однак, даний винахід має на увазі також і інші форми експресуючих векторів, такі як вірусні вектори (наприклад, дефектні за реплікацією ретровіруси, аденовіруси і аденоасоційовані віруси), які виконують еквівалентні функції. Рекомбінантні експресуючі вектори даного винаходу включають нуклеїнову кислоту даного винаходу у формі, придатній для експресії цієї нуклеїнової кислоти в клітині-хазяїні, що означає, що ці рекомбінантні експресуючі вектори включають в себе одну або декілька регуляторних послідовностей, вибраних на основі клітин-хазяїв, що використовуються для експресії, яка (які) функціонально 49 83458 пов'язані з підлягаючою експресії нуклеїновою кислотою. У рекомбінантному експресуючому векторі термін «функціонально пов'язана» означає, що нуклеотидна послідовність, яка представляє інтерес, пов'язана з регуляторною послідовністю (регуляторними послідовностями) таким чином, що створюється можливість експресії цієї нуклеотидної послідовності (наприклад, в системі транскрипції/трансляції in vitro або в клітині-хазяїні при введенні цього вектора в клітину-хазяїн). Термін «регуляторна послідовність» включає в себе промотори, енхансери та інші елементи регуляції експресії (наприклад, сигнали поліаденілування). Такі регуляторні послідовності описані, наприклад, в [Goeddel «Gene Expression Technology» METHODS IN ENZYMOLOGY 185, Academic Press, San Diego, Calif., 1990]. Регуляторні послідовності включають в себе послідовності, які управляють конститутивною експресією нуклеотидної послідовності в багатьох типах клітин-хазяїв, і послідовності, які управляють експресією нуклеотидної послідовності тільки в певних клітинах-хазяїнах (наприклад, тканеспецифічні регуляторні послідовності). Фахівцям з кваліфікацією в даній області буде зрозуміло, що конструкція експресуючого вектора може залежати від таких факторів як вибір клітинихазяїна, яка повинна бути трансформована, бажаного рівня експресії білка і т.д. Експресуючі вектори даного винаходу можуть бути введені в клітинухазяїна для продукування за допомогою цього білків або пептидів, в тому числі злити х білків або пептидів, що кодуються нуклеїновими кислотами, описаними тут (наприклад, білків BAFF-R, мутантних форм BAFF-R, злитих білків і т.д.). Рекомбінантні експресуючі вектори даного винаходу можуть бути сконструйовані для експресії BAFF-R в прокаріотичних або еукаріотичних клітинах. Наприклад, BAFF-R може експресуватись в бактеріальних клітинах, таких як Escherichia coli, клітинах комах (з використанням бакуловірусних експресуючих векторів), дріжджових клітинах або клітинах ссавців. Відповідні клітини-хазяї обговорюються додатково в [Goeddel, «Gene Expression Technology» METHODS IN ENZYMOLOGY 185, Academic Press, San Diego, Calif, 1990]. Альтернативно, рекомбінантний експресуючий вектор може транскрибуватись і транслюватися in vitro, наприклад, з використанням регуляторних послідовностей промотора Т7 і полімерази Т7. Експресію білків в прокаріотах найчастіше проводять в Е. coli з векторами, що містять конститутивні або промотори, що індукуються, керуючі експресією або злитих, або незлитих білків. Вектори злитих білків додають ряд амінокислот до білка, що кодується ними, звичайно до аміно-кінця рекомбінантного білка. Такі вектори злитих білків звичайно служать для досягнення трьох цілей: (1) для збільшення експресії рекомбінантного білка; (2) для збільшення розчинності рекомбінантного білка і (3) для сприяння очищенню рекомбінантного білка за допомогою дії як ліганду при афінному очищенні. Часто в експресуючі злиті білки вектори вводять сайт протеолітичного розщеплення в місці сполуки злитої частини і рекомбінантого білка для забезпечення відділення рекомбінантного білка від 50 цієї злитої частини після очищення злитого білка. Такі ферменти і їх споріднені послідовності розпізнавання, включають в себе фактор Ха, тромбін і ентерокіназу. Типові експресуючі злиті білки вектори включають в себе pGEX [Pharmacia Biotech Inc; Smith and Johnson (1988) Gene 67: 31-40], pMAL (New England Biolabs, Beverly, Mass.) і pRITS (Pharmacia, Piscataway, N.J.), які зливають глута тіон-8-трансферазу (GST), мальтозу Εзв'язувальний білок або білок А, відповідно, з рекомбінантним білком-мішенню. Приклади відповідних індукованих експресуючих не злиті білки векторів Е. соlі включають в себе pTrc [(Amrann et al, (1988) Gene 69:301-315) і рЕТ lid (Studier et al, «Gene Expression Technology» METHODS IN ENZYMOLOGY 185, Academic Press, San Diego, Calif., 1990, pp.60-89]. Однією стратегією максимізації експресії рекомбінантного білка в Е. соlі є експресія цього білка в бактерії-хазяїні з порушеною здатністю протеолітичного розщеплення рекомбінантного білка. [Див. Gottesman, «Gene Expression Technology» METHODS IN ENZYMOLOGY 185, Academic Press, San Diego, Calif., 1990, pp.119-128]. Іншою стратегією є зміна послідовності нуклеїнової кислоти, яка повинна бути вбудована в експресуючий вектор, таким чином, що індивідуальні кодони для кожної амінокислоти є кодонами, що переважно використовуються в Е. соlі [Wada et al, (1992) Nucleic Acids Res. 20: 2111-2118]. Така зміна послідовностей нуклеїнових кислот даного винаходу може бути виконана стандартними способами синтезу ДНК. В іншому варіанті експресуючий BAFF-R вектор є дріжджовим експресуючим вектором. Приклади векторів для експресії в дріжджах (наприклад, Saccharomyces cerevisiae) включають в себе pYepSecl [Baldari, et al, (1987) EMBO J. 6: 229-234], pMFa [Kurjan and Herskowitz, (1982) Cell 30: 933943], pJRY88 [Schultz et al. (1987) Gene 54: 113123], pYES2 (Invitrogen Corporation, San Diego, Calif.) і для P. pastoris включають в себе сімейство векторів рРІС (Invitrogen Corp, San Diego, Calif.). Альтернативно, BAFF-R може бути експресований в клітинах комах з використанням бакуловірусних експресуючих векторів. Бакуловірусні вектори, доступні для експресії білків в клітинах комах (наприклад, клітинах SF9), що культивуються, включають в себе серію рАс [Smith et al. (1983) Моl. Cell. Biol. 3: 2156-2165] і серію pVL [Lucklow and Summers (1989) Virology 170: 31-39]. Ще в одному варіанті нуклеїнову кислоту даного винаходу експресують в клітинах ссавців з використанням експресуючого вектора ссавців. Приклади експресуючих векторів ссавців включають в себе pCDMS [Seed (1987) Nature 329: 840-842] і рМТ2РС [Kaufman et al. (1987) EMBO J. 6: 187195]. При використанні в клітинах ссавців функції регуляції цього експресуючого вектора часто забезпечуються вірусними регуляторними елементами. Наприклад, звичайно промотори, що використовуються, одержують з поліоми, аденовірусу 2, цитомегаловірусу і вірусу мавп 40. Відносно інших відповідних систем експресії як для прокаріотичних, так і для еукаріотичних клітин [див., наприклад, частини 16 і 17 Sambrook et al., Molecular 51 83458 Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor N.Y., (1989)]. В іншому варіанті рекомбінантний експресуючий вектор ссавців здатний управляти експресією нуклеїнової кислоти переважно (преферентивно) в конкретному типі клітин (наприклад, тканеспецифічні регуляторні елементи використовуються для експресії цієї нуклеїнової кислоти). Тканеспецифічні регуляторні елементи відомі в даній області. Необмежувальні приклади відповідних тканеспецифічних промоторів включають в себе промотор альбуміну (печінка-специфічний; [Pinkert et al. (1987) Genes Dev. 1: 268-277], лімфоїд-специфічні промотори [Calame and Eaton (1988) Adv. Immunol. 43: 235-275], зокрема, промотори рецепторів Тклітин [Winoto and Baltimore (1989) EMBO J. 8: 729733] і імуноглобулінів [Banerji et al. (1983) Cell 33: 729-740; Queen and Baltimore (1983) Cell 33: 741748], нейрон-специфічні промотори (наприклад, промотор нейрофіламенту; [Byrne and Ruddle (1989) Proc. Natl. Acad. Sci. USA 86: 5473-5477]), специфічні для підшлункової залоза промотори [Edlund et al. (1985) Science 230: 912-916] і промотори, специфічні для молочної залози (наприклад, промотор молочної сироватки; [патент США №4 873 316 і Публікація Європейської заявки №264 166]. У даний винахід включені також регульовані стадією розвитку промотори, наприклад, промотори hox мишей [Kessel and Gruss (1990) Science 249: 374-379] і промотор α-фетопротеїну (ембріонального білка) [Campes and Tilghman (1989) Genes Dev. 3: 537-546]. Далі, даний винахід забезпечує рекомбінантний експресуючий вектор, що включає молекулу ДНК даного винаходу, клоновану в цей експресуючий вектор в антисмисловій орієнтації. Тобто, ця молекула ДНК функціонально пов'язана з регуляторною послідовністю таким чином, що створюється можливість експресії (транскрипцією цієї молекули ДНК) РНК-молекули, яка є антисмисловою відносно мРНК BAFF-R. Регуляторні послідовності, функціонально пов'язані з нуклеїновою кислотою, клонованою в антисмисловій орієнтації, можуть бути вибрані таким чином, що вони управляють безперервною експресією молекули антисмислової РНК в різних типах клітин, наприклад, вірусні промотори і/або енхансери, або регуляторні послідовності можуть бути вибрані таким чином, що вони управляють конститутивною, тканеспецифічною або клітиноспецифічною експресією антисмислової РНК. Цей антисмисловий експресуючий вектор може бути у формі рекомбінантної плазміди, фагміди або атенуйованого вірусу, в якому антисмислові нуклеїнові кислоти продукуються під контролем високоефективного регуляторного району, активність якого може бути визначена типом клітин, в які вводиться цей вектор. Відносно дискусії про регуляції експресії генів з використанням антисмислових генів [див. Weintraub et al. (1986) «Antisense RNA as a molecular tool for genetic analysis» Reviews Trends in Genetics, 1(1)]. Інший аспект даного винаходу відноситься до клітин-хазяїв, в які був введений рекомбінантний 52 експресуючий вектор даного винаходу. Терміни «клітина-хазяїн» і рекомбінантна «клітина-хазяїн» використовуються тут взаємозамінно. Зрозуміло, що такі терміни відносяться не тільки до конкретної клітини, що розглядається, але і до потомства або потенційного потомства такої клітини. Оскільки деякі модифікації можуть відбуватися в подальших генераціях внаслідок або мутації, або впливів навколишнього середовища, таке потомство може бути, насправді, неідентичним батьківській клітині, але воно все-таки включено в термін, що використовується тут. Клітиною-хазяїном може бути будь-яка прокаріотична або еукаріотична клітина. Наприклад, білок BAFF-R може експресуватись в бактеріальних клітинах, таких як Е. соlі, клітинах комах, дріжджових клітинах або клітинах ссавців (таких як клітини яєчника Китайського хом'ячка (СНО) або COS-клітинах). Ін ші відповідні клітини-хазяї відомі фа хівцям з кваліфікацією в даній області. Векторна ДНК може бути введена в прокаріотичні або еукаріотичні клітини загальноприйнятими способами трансформації або трансфекції. У застосуванні тут терміни «трансформація» і «трансфекція» означають різноманітні визнані в даній області способи введення чужорідної нуклеїнової кислоти (наприклад, ДНК) в клітину-хазяїна, в тому числі кальцій-фосфатну або кальцій-хлоридну копреципітацію, опосередковану ДЕАЕ-декстраном трансфекцію, ліпофекцію або електропорацію. Відповідні способи трансформації або трансфекції клітин-хазяїв можна знайти в [Sambrook et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor N.Y., (1989)] і іншому лабораторному керівництві. Для стабільної трансфекції клітин ссавців відомо, що в залежності від експресуючого вектора, що використовуються, і способу трансфекції тільки невелика фракція клітин може інтегрувати чужорідну ДНК в їх геном. Для ідентифікації і відбору цих інтегрантів ген, що кодує селектований маркер (наприклад, стійкість до антибіотиків), звичайно вводять в клітини-хазяї разом з геном, яка представляє інтерес. Різні селектовані маркери включають в себе маркери, який додають стійкість до лікарських засобів, таких як G418, гігроміцин і метотрексат. Нуклеїнова кислота, що кодує селектований маркер, може бути введена в клітинухазяїна на тому ж самому векторі, який кодує BAFF-R, або може бути введена на окремому векторі. Клітини, стабільно трансфіковані введеною нуклеїновою кислотою, можуть бути ідентифіковані відбором з лікарським засобом (наприклад, клітини, які включили ген селектованого маркера, будуть виживати, тоді як інші клітини гинуть). Клітина-хазяїн даного винаходу, наприклад, прокаріотична або еукаріотична клітина-хазяїн в культурі, може бути використана для продукування (тобто експресії) білка BAFF-R. Таким чином, даний винахід забезпечує додатково способи одержання білка BAFF-R з використанням клітинхазяїв даного винаходу. В одному варіанті цей спосіб включає в себе культивування клітинихазяїна даного винаходу (в яку був введений ре 53 83458 комбінантний експресуючий вектор, що кодує BAFF-R) у відповідному середовищі, так що продукується білок BAFF-R. В іншому варіанті цей спосіб додатково передбачає виділення BAFF-R з середовища або клітини-хазяїна. Трансгенні тварини Клітини-хазяї даного винаходу можуть бути також використані для одержання трансгенних тварин, крім людини. Наприклад, в одному варіанті клітиною-хазяїном даного винаходу є запліднений ооцит або ембріональна стовбурова клітина, в яку були введені кодуючі BAFF-R послідовності. Такі клітини-хазяї можуть бути потім використані для створення трансгенних тварин, крім людини, в яких екзогенні послідовності BAFF-R були введені в їх геном, або гомологічних рекомбінантних тварин, в яких ендогенні послідовності BAFF-R були змінені. Такі тварини застосовні для дослідження функції і/або активності BAFF-R і для ідентифікації і/або оцінки модуляторів активності BAFF-R. У застосуванні тут «трансгенна тварина» є твариною, крім людини, переважно ссавцем, більш переважно гризуном, таким як щур або миша, причому одна або більше клітин цієї тварини включають в себе трансген. Інші приклади трансгенних тварин включають приматів (крім людини), овець, собак, корів, кіз, курей, земноводних і т.д. Трансгеном є екзогенна ДНК, яка інтегрується в геном клітини, з якої розвивається трансгенна тварина і яка залишається в геномі зрілої тварини, управляючи експресією продукту, що кодується геном в одному або декількох типах клітин або тканин трансгенної тварини. У застосуванні тут «гомологічна рекомбінантна тварина» є твариною (крім людини), переважно ссавцем, більш переважно мишею, в якій ендогенний ген BAFF-R був змінений гомологічною рекомбінацією між ендогенним геном і екзогенною ДНК-молекулою, введеною в клітину цієї тварини, наприклад, ембріональну клітину цієї тварини, до розвитку цієї тварини. Трансгенна тварина даного винаходу може бути створена введенням кодуючої BAFF-R нуклеїнової кислоти в чоловічі пронуклеуси заплідненого ооциту, наприклад, мікроін'єкцією, ретровірусною інфекцією, і наданням цьому ооциту можливості розвиватися в псевдовагітній тварині-самиці, що виношує. ДНК-послідовність BAFF-R людини Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6) може бути введена як трансген в геном тварини (крім людини). Альтернативно, надлюдський гомолог гена BAFF-R людини, такий як ген BAFF-R миші (Фіг.4A) (SEQ ID NО:8), може бути виділений на основі гібридизації з кДНК BAFF-R людини (описаної більш детально вище) і використаний як трансген. Інтронні послідовності і сигнали поліаденілування можуть бути також включені в цей трансген для збільшення ефективності експресії трансгену. Тканеспецифічні регуляторні послідовності можуть бути функціонально пов'язані з трансгеном BAFF-R для управління експресією білка BAFF-R в конкретних клітинах. Способи одержання трансгенних тварин за допомогою маніпуляції і мікроін'єкції ембріона, зокрема, таких тварин як миші, стали загальноприйнятими в даній області і описані, наприклад, в [патенті США 54 №4 736 866; 4 870 009; і 4 873 191; і Hogan in MANIPULATING THE MOUSE EMBR YO, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986]. Подібні способи використовують для одержання інших трансгенних тварин. Трансгенна тварина-фундатор може бути ідентифікована на основі присутності трансгену BAFF-R в його геномі і/або експресії мРНК BAFF-R в тканинах або клітинах цих тварин. Потім трансгенна тваринафундатор може бути використана для розведення додаткових тварин, що несуть цей трансген. Крім того, трансгенні тварини, що несуть трансген, що кодує BAFF-R, можуть бути розмножені далі з одержанням інших трансгенних тварин, які несуть інші трансгени. Для створення гомологічної рекомбінантної тварини готують вектор, який містить, щонайменше, частину гена BAFF-R, в який була введена делеція, додавання або заміну для зміни за допомогою цього, наприклад, функціонального руйнування, гена BAFF-R. Геном BAFF-R може бути ген людини (наприклад, Фіг.2А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6)), але більш переважно цей ген є надлюдським гомологом гена BAFF-R людини. Наприклад, мишачий гомолог (Фіг.4А) гена BAFF-R людини Фіг.2 А (SEQ ID NО:3), Фіг.2С (SEQ ID NО:4), Фіг.3 (SEQ ID NО:6) може бути використаний для конструювання вектора для гомологічної рекомбінації, придатного для зміни ендогенного гена BAFF-R в мишачому геномі. В одному варіанті цей вектор сконструйований таким чином, що, при гомологічній рекомбінації, ендогенний ген BAFF-R є функціонально зруйнованим (тобто він вже не кодує функціональний білок; цей вектор називають також вектором «нокауту»). Альтернативно, вектор може бути сконструйований таким чином, що, при гомологічній рекомбінації, ендогенний ген BAFF-R є мутованим або іншим чином зміненим, але все ще кодує функціональний білок (наприклад, «лівий» регуляторний район може бути змінений для зміни за допомогою цього експресії ендогенного білка BAFF-R). У векторі для гомологічної рекомбінації змінена частина гена BAFF-R фланкована на його 5'- і 3'-кінцях додатковою нуклеїновою кислотою гена BAFF-R для забезпечення можливості гомологічної рекомбінації між екзогенним геном BAFF-R, що несеться цим вектором, і ендогенним геном BAFF-R в ембріональній стовбуровій клітині. Ця додаткова фланкуюча нуклеїнова кислота BAFF-R має достатню довжину для успішної гомологічної рекомбінації з ендогенним геном. Звичайно у вектор включають декілька т.п.н. фланкуючої ДНК (як на 5'-, так і на 3'-кінцях). [Див., наприклад, Thomas et al. (1987) Cell 51: 503] відносно опису векторів для гомологічної рекомбінації. Цей вектор вводять в лінію ембріональних стовбурови х клітин (наприклад, електропорацією), і клітини, в яких введений ген BAFF-R гомологічно рекомбінувався з ендогенним геном, BAFF-R, відбирають [див., наприклад, Li et al. (1992) Cell 69: 915]. Потім відібрані клітини ін'єкують в бластоцисту тварину (наприклад, миші) для утворення агрегованих химер. [Див., наприклад, Bradley, in 55 83458 TERATOCARCINOMAS AND EMBRYONIC STEM CELLS: A PRACTICAL APPROACH, Robertson, Ed. IRL, Oxford, 1987, pp.113-152]. Потім химерний ембріон може бути імплантований у відповідну псевдовагітну самицю-виношуючу тварину, і ембріон росте до кінця «вагітності». Потомство, яке несе гомологічно рекомбіновану ДНК в їх ста тевих зародкових клітинах, може бути використане для виведення тварин, в яких всі клітини тварини містять гомологічно рекомбіновану ДНК внаслідок передачі зародковою лінією цього трансгену. Способи конструювання векторів для гомологічної рекомбінації і гомологічні рекомбінантні тварини описані додатково в [Bradley (1991) Curr. Opin. Biotechnol. 2: 823-829; PCT International Publication Nos.: WO 90/11354; WO 91/01140; WO 92/0968; і WO 93/04169]. В іншому варіанті можуть бути одержані трансгенні тварини (крім людини), які містять вибрані системи, які забезпечують регульовану експресію даного трансгену. Одним з прикладів такої системи є система сrе/lохР-рекомбінази бактеріофага Р1. Відносно опису системи cre/loxP-рекомбінази [див., наприклад, Lakso et al. (1992) Proc. Natl. Acad. Sci. USA 89: 6232-6236]. Іншим прикладом системи рекомбінази є система рекомбінази FLP S. cerevisiae [O'German et al. (1991) Science 251: 1351-1355]. Якщо систему cre/loxP-рекомбінази використовують для регуляції експресії трансгену, необхідні тварини, що містять трансгени, що кодують як рекомбіназу Сrе, так і вибраний білок. Такі тварини можуть бути забезпечені конструюванням «подвійних» трансгенних тварин, наприклад, спаровуванням двох трансгенних тварин, одна з яких містить трансген, що кодує вибраний білок, а інша містить трансген, що кодує рекомбіназу. Клони трансгенних тварин (не людини), описані тут, можуть бути також одержані згідно зі способами, описаними в [Wilmut et al. (1997) Nature 385: 810-813]. Коротко, клітина, наприклад, соматична клітина, з трансгенної тварини може бути виділена і індукована для виходу з циклу зростання і вступу в фазу G 0. Потім клітину, що знаходиться в спокої, зливають, наприклад, з використанням електричних імпульсів, з енуклейованим ооцитом з тварини того ж виду, з якої виділена клітина, що знаходиться в спокої. Потім реконструйований ооцит культивують таким чином, що він розвивається до морули або бластули, і потім переносять його в псевдовагітну самицю-виношуючу тварину. Потомство, що народилося у такої самицівиношуючої тварини, буде клоном тварини, з якої виділена ця клітина, наприклад, соматична клітина. Фармацевтичні композиції Молекули нуклеїнових кислот BAFF-R, білки BAFF-R і анти-BAFF-R-антитіла (також звані тут «активними сполуками») даного винаходу і їх по хідні, фрагменти, аналоги і гомологи, можуть бути включені у фармацевтичні композиції, придатні для введення. Такі композиції звичайно містять молекулу н уклеїнової кислоти, білок або антитіло і фармацевтично прийнятний носій. У застосуванні тут « фармацевтично прийнятний носій» включає в 56 себе будь-які і всі розчинники, диспергуючі середовища, покриття, антибактеріальні і протигрибкові агенти, ізотонічні і затримуючі поглинання агенти і т.п., сумісні з фармацевтичним введенням. Відповідні носії описані в найбільш нещодавньому виданні Remington's Pharmaceutical Sciences, стандартному довіднику в даній області, який включений тут як посилання. Переважні приклади таких носіїв або розріджувачів включають в себе, але не обмежуються ними, воду, сольовий розчин, розчини Рінгера, розчин декстрози і 5% людський сироватковий альбумін. Можуть бути також використані ліпосоми і неводні носії, такі як нелеткі масла. Застосування таких середовищ і агентів для фармацевтично активних речовин відоме в даній області. За винятком загальноприйнятих середовищ або агентів, які несумісні з активною сполукою, передбачається застосування цих середовищ і агентів в цих композиціях. Додаткові активні сполуки також можуть включатися в ці композиції. Фармацевтичну композицію даного винаходу готують таким чином, щоб вона була сумісною з передбачуваним шляхом її введення. Приклади способів введення включають в себе парентеральне, наприклад, внутрішньовенне, інтрадермальне, підшкірне, пероральне (наприклад, інгаляцією), черезшкірне (локальне), трансмукозне і ректальне введення. Розчини або суспензії, що використовуються для парентерального, інтрадермального або підшкірного введення, можуть включати наступні компоненти: стерильний розріджувач, такий як вода для ін'єкцій, сольовий розчин, нелеткі масла, поліетиленгліколі, гліцерин, пропіленгліколь або інші синтетичні розчинники; антибактеріальні агенти, такі як бензиловий спирт або метилпарабени; антиоксиданти, такі як аскорбінова кислота або бісульфіт натрію; хелатоутворювачі, такі як етилендіамінтетраоцтова кислота (ЕДТА); буфери, такі як ацетати, цитрати або фосфати, і агенти для корекції тонічності, такі як хлорид натрію або декстроза. рН може коректуватися кислотами або основами, наприклад, хлористоводневою кислотою або гідроксидом натрію. Парентеральний препарат може бути взятий в ампули, одноразові шприци або флакони з множинними дозами, виготовлені з скла або пластику. Фармацевтичні композиції, придатні для ін'єкцій, включають стерильні водні розчини (якщо вони є водорозчинними) або дисперсії і стерильні порошки для незапланованого приготування стерильних ін'єкованих розчинів або дисперсій. Для внутрішньовенного введення відповідні носії включають фізіологічний розчин, бактеріостатичну воду, Кремофор EL (BASF Parsippany, N.J.) або забуферений фосфатом сольовий розчин (ФСБ). У всіх випадках композиція повинна бути стерильною і повинна бути текучою до міри легкого введення шприцом. Вона повинна бути стабільною в умовах приготування і зберігання і повинна бути збережена проти забруднюючої дії мікроорганізмів, таких як бактерії і грибки. Носієм може бути розчинник або дисперсійне середовище, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь і рідкий поліетиленгліколь і т.п.), і їх відповідні суміші. Відповідна теку 57 83458 чість може підтримуватися, наприклад, використанням покриття, такого як лецитин, за допомогою підтримки необхідного розміру частинок у разі дисперсії і використанням поверхнево-активних речовин. Попередження дії мікроорганізмів може досягатися з використанням різних антибактеріальних і протигрибкових агентів, наприклад, парабенів, хлорбутанолу, фенолу, аскорбінової кислоти, тимерозалу і т.п.В багатьох випадках буде переважне включення ізотонічних агентів, наприклад, цукрів, поліспиртів, такого як маніт, сорбіт, хлорид натрію, в композицію. Пролонговане всмоктування ін'єктованих композицій може досягатися включенням в композицію агента, який пролонгує всмоктування, наприклад, моностеарату алюмінію і желатини. Стерильні ін'єктовані розчини можуть бути приготовані включенням активної сполуки (наприклад, білка BAFF-R або анти-BAFF-R-антитіла) в необхідній кількості у відповідному розчиннику з одним або з комбінацією інгредієнтів, перерахованих вище, за необхідністю, з подальшою стерилізацією фільтруванням через мікропористу мембрану. Звичайно дисперсії готують включенням активної сполуки в стерильний носій, який містить основне диспергуюче середовище і необхідні інші інгредієнти з інгредієнтів, перерахованих вище. У разі стерильних порошків для приготування стерильних ін'єкційних розчинів способи приготування включають в себе вакуумне сушіння і ліофілізацію, які дають порошок активного інгредієнта плюс будь-який додатковий бажаний інгредієнт з його заздалегідь стерилізованого фільтрацією через мікропористу мембрану розчину. Пероральні композиції звичайно включають в себе інертний розріджувач або їсті вний носій. Вони можуть бути укладені в желатинові капсули або спресовані в таблетки. Для цілей перорального терапевтичного введення активна сполука може бути включена з наповнювачами і використана у формі таблеток, пастилок або капсул. Пероральні композиції можуть бути приготовані з використанням рідкого носія для застосування як рідини для полоскання рота, де сполуку в рідкому носії застосовують перорально і прополіскують рот і випльовують або проковтують. Фармацевтично сумісні зв'язувальні агенти і/або ад'юванти можуть бути включені як частина цієї композиції. Таблетки, пілюлі, капсули, пастилки і т.п.можуть містити будьякий з наступних інгредієнтів або сполук схожої природи: зв'язувальна речовина, така як мікрокристалічна целюлоза, трагакантова камедь або желатина; наповнювач, такий як крохмаль або лактоза, дезінтегруючий агент, такий як альгінова кислота, Примогель або кукурудзяний крохмаль; змащувальна речовина, така як стеарат магнію або Стеротес; ковзна речовина, така як колоїдальний діоксид кремнію; підсолоджувальний агент, такий як сахароза або сахарин; або ароматизуючий агент, такий як м'ята перцева, метилсаліцилат або апельсинова віддушка. Для введення інгаляцією сполуки доставляються у формі аерозольного спрею з контейнера, що знаходиться під тиском, або дозатора, який 58 містить відповідний пропелент, наприклад, газ, такий як діоксид вуглецю, або розпилювача. Системне введення може здійснюватися також трансмукозним або трансдермальним шляхом (через слизову оболонку або через шкіру). Для трансмукозного або трансдермального введення в композиції використовують підсилювачі проникнення (пенетранти), придатні для бар'єра, який повинен бути перетнутий. Такі посилюючі проникнення агенти звичайно відомі в даній області і включають в себе, наприклад, для трансмукозного введення, детергенти, жовчні кислоти і похідні фусидової кислоти. Трансмукозне введення може виконуватися з використанням спреїв для носа або супозиторіїв. Для трансдермального введення активні сполуки готують у вигляді мазей, пастоподібної маси, гелей або кремів, звичайно відомих в даній області. Сполуки даного винаходу можуть бути також приготовані у формі супозиторіїв (наприклад, з відповідними основами для супозиторіїв, такими як масло какао і інші гліцериди), або вмісних клізм для ректальної доставки. В одному варіанті активні сполуки готують з носієм, який буде захища ти ці сполуки проти швидкого виведення з тіла, наприклад, у вигляді композиції пролонгованого вивільнення, в тому числі імплантатів і мікроінкапсульованих систем доставки. Можуть використовуватися біодеградовані, біосумісні полімери, такі як етиленвінілацетат, поліангідриди, полігліколева кислота, колаген, поліортоефіри і полімолочна кислота. Способи приготування таких композицій будуть очевидними для фахівців з кваліфікацією в даній області. Ці матеріали можуть бути також одержані комерційно з Alza Corporation і Nova Pharmaceuticals, Inc. Як фармацевтично прийнятні носії можуть бути також використані ліпосомні суспензії (в тому числі ліпосоми, націлені на інфіковані клітини моноклональними антитілами до вірусних антигенів). Вони можуть бути приготовані згідно зі способами, відомими фахівцям з кваліфікацією в даній області, наприклад, як описано в [патенті США №4 522 811]. Особливо вигідно готува ти пероральні або парентеральні композиції у формі уніфікованих (стандартних) доз для легкості введення і однорідності доз. Формою стандартної дози в застосуванні тут називають фізично дискретні стандартні одиниці у вигляді одиничних доз для суб'єкта, що проходить лікування; причому кожна стандартна одиниця містить задану кількість активної сполуки, розраховану таким чином, що вона виконує бажану терапевтичну дію, разом з необхідним фармацевтичним носієм. Специфікація для форм стандартних доз даного винаходу диктується унікальними характеристиками конкретного активної сполуки і конкретного терапевтичного ефекту, який бажано одержати, і залежить безпосередньо від цих характеристик і ефекту. Молекули нуклеїнових кислот даного винаходу можуть бути інсертовані у вектори і використані як вектори генотерапії. Вектори генотерапії можуть доставлятися суб'єкту будь-яким шляхом введення, наприклад, як описано в [патенті США з номе 59 83458 ром 5 703 055]. Таким чином, доставка може включати, наприклад, внутрішньовенну ін'єкцію, локальне введення [див. патент США №5 328 470] або стереотаксичну ін'єкцію [див., наприклад, Chen et al. (1994) Proc. Natl. Acad. Sci. 91: 3054-3057]. Фармацевтичний препарат вектора генотерапії може включати вектор генотерапії в прийнятному розріджувачі або може містити матрикс для уповільненого вивільнення, в який впроваджений вектор доставки гена. Альтернативно, якщо повний вектор доставки гена не може бути одержаний інтактним з рекомбінантних клітин, наприклад, ретровірусні вектори, фармацевтичний препарат може включати в себе одну або декілька клітин, які продукують систему доставки гена. Фармацевтичні композиції можуть бути упаковані в контейнер, упаковку або розподільний пристрій разом з інструкціями для введення. Застосування і способи винаходу Молекули нуклеїнових кислот, білки, гомологи білків і антитіла, описані тут, можуть бути використані в одному або декількох з наступних способів: (а) скринінг-аналізах; (b) аналізах детектування (наприклад, хромосомному картуванні, гістотипуванні, судовій біології), (с) прогностичній медицині (наприклад, діагностичних аналізах, прогностичних аналізах, моніторингу клінічних випробувань і фармакогеноміці); і (d) способах лікування (наприклад, терапевтичного або профілактичного). Як описано тут, в одному варіанті білок BAFF-R даного винаходу здатний зв'язувати BAFF. Ізольовані молекули нуклеїнових кислот даного винаходу можуть бути використані для експресії білка BAFF-R (наприклад, через рекомбінантний експресуючий вектор в клітині-хазяїні при застосуваннях в генотерапії), для детектування мРНК BAFF-R (наприклад, в біологічній пробі) або генетичного пошкодження в гені BAFF-R, і для модуляції активності BAFF або BAFF-R, як описано додатково нижче. Крім того, білки BAFF-R можуть бути використані для скринінгу лікарських засобів або сполук, які модулюють активність або експресію BAFF-R, а також для лікування порушень, що характеризуються недостатнім або надмірним продукуванням BAFF і/або білка BAFF-R, або продукуванням форм білка BAFF-R, які мають зменшену або активність, що відхиляється від норми в порівнянні з білком BAFF-R дикого типу. Крім того, антиBAFF-R-антитіла даного винаходу можуть бути використані для детектування і виділення білків BAFF-R і модуляції активності BAFF і/або BAFF-R. Даний винахід відноситься також до нових агентів, ідентифікованих вищеописаними скринінганалізами, і їх застосуванням для способів лікування, описаних тут. Скринінг-аналізи Даний винахід забезпечує спосіб (також названий тут «скринінг-аналізом») для ідентифікації модуляторів, тобто кандидатів або тест-сполук або агентів (наприклад, пептидів, пептидоміметиків, невеликих молекул або інших лікарських засобів), які зв'язуються з білками BAFF-R або надають стимуляторну або інгібіторну дію, наприклад, на експресію BAFF-R або активність BAFF-R. 60 В одному варіанті даний винахід забезпечує аналізи для скринінгу кандидатів або тест-сполук, які зв'язуються з білком або поліпептидом BAFF-R або його біологічно активною частиною або модулюють активність білка або поліпептиду BAFF-R або його біологічно активної частини. Тест-сполуки даного винаходу можуть бути одержані будь-яким з численних підходів в способах з використанням комбінаторних бібліотек, відомих в даній області, в тому числі: біологічних бібліотек; паралельних твердофазних, що просторово розділяються, або «рідкофазних» бібліотек; способів синтетичних бібліотек, що вимагають обернення згортки при аналізі цифрового зображення; способу бібліотек типу «одна-гранула одна-сполука» і способів синтетичних бібліотек, що використовують відбір з використанням афінної хроматографії. Підхід біологічних бібліотек обмежений пептидними бібліотеками, тоді як чотири інших підходи застосовні до бібліотек сполук пептидів, непептидних олігомерів або невеликих молекул [Lam (1997) Anticancer Drug Des. 12: 145-167]. Приклади способів для синтезу молекулярних бібліотек можуть бути знайдені в даній області, наприклад, в: [DeWitt et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6909-6013; Erb et al. (1994) Proc. Natl. Acad. Sci. USA 91: 11422-11426; Zuckermann et al. (1994) J. Med. Chem. 37: 2678-2685; Cho et al. (1993) Science 261: 1303; Carrell et al. (1994) Angew Chem. Int. Ed. Engl. 33: 2059; Carell et al. (1994) Angew Chem. Int. Ed. Engl. 33: 2061; і Gallop et al. (1994) J. Med. Chem. 37: 1233-1251]. Бібліотеки сполук можуть бути представлені в розчині [наприклад, Houghten (1992) Biotechniques 13: 412-421] або на гранулах [Lam (1991) Nature 354: 8 2-84], на чіпах [Fodor (1993) Nature 364: 555556], бактеріях [Ladner, патент США №5 223 409], спорах [Ladner, патент США 5 223 409], плазмідах [Cull et al. (1992) Proc. Natl. Acad. Sci. USA 89: 1865-1869] або на фагу [Scott and Smith (1990) Science 249: 386-390; Devlin (1990) Science 249: 404-406; Cwirla et al. (1990) Proc. Natl. Acad. Sci. USA 87: 6378-6382; Felici (1991) J. Моl. Biol. 222: 301-310; Ladner, патент США 5 223 409]. В одному варіанті аналізом є аналіз на основі клітин, в якому клітину, яка експресує мембранозв'язану форму білка BAFF-R або його біологічно активну частину на поверхні клітини, контактують з тест-сполукою і визначають здатність цієї тестсполуки зв'язуватися з білком BAFF-R. Клітина може походити, наприклад, з ссавця або з дріжджів. Визначення здатності тест-сполуки зв'язуватися з білком BAFF-R може виконуватися, наприклад, скріпленням тест-сполуки з радіоізотопною або ферментативною міткою, так що скріплення тест-сполуки з білком BAFF-R або його біологічно активною частиною може бути визначено детектування міченої сполуки в комплексі. Наприклад, тест-сполуки можуть бути помічені 1251,35S, 14C або 3 Н, прямо або опосередковано, і радіоізотоп може бути детектований прямим рахунком радіовипромінювання або сцинтиляційним рахунком. Альтернативно, тест-сполуки можуть бути ферментативно міченими, наприклад, пероксидазою хріну, лужною фосфатазою або люциферазою, і ферме
ДивитисяДодаткова інформація
Назва патенту англійськоюThe isolated polypeptide baff-r (the receptor of the factor of activation of b-cells of the family tnf)
Автори англійськоюAmbrose Christine M., Tompson Jeffrey S.
Назва патенту російськоюВыделенный полипептид baff-r (рецептор фактора активации в-клеток семейства tnf)
Автори російськоюАмброуз Кристин М., Томпсон Джэффри С.
МПК / Мітки
МПК: C07K 16/28, G01N 33/53, C12Q 1/68, C07K 14/715, G01N 33/68, A61K 48/00, C12N 15/12, C07H 21/04, C12N 15/10, C12N 15/62, A61K 38/17
Мітки: активації, фактора, сімейства, рецептор, baff-r, поліпептид, в-клітин, виділений
Код посилання
<a href="https://ua.patents.su/84-83458-vidilenijj-polipeptid-baff-r-receptor-faktora-aktivaci-v-klitin-simejjstva-tnf.html" target="_blank" rel="follow" title="База патентів України">Виділений поліпептид baff-r (рецептор фактора активації в-клітин сімейства tnf)</a>
Попередній патент: Спосіб і пристрій для електровиділення важких металів з технологічних розчинів і стічних вод
Наступний патент: Пристрій для поточного контролю механічної частини рухомого складу залізниць
Випадковий патент: Лабіринтове ущільнення