Спосіб лікування з використанням глікопегильованого g-csf (варіанти)
Формула / Реферат
1. Спосіб підвищення продукції стовбурових клітин у донора, де зазначений спосіб включає введення зазначеному донору деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи, де зазначена полімерна модифікуюча група ковалентно приєднана до зазначеного пептиду біля глікозильного або амінокислотного залишку зазначеного пептиду за допомогою глікозильної зв'язувальної групи, де зазначена кількість являє собою одиничну дозовану форму, вибрану з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг.
2. Спосіб за п. 1, де зазначена полімерна модифікуюча група являє собою водорозчинний полімер.
3. Спосіб за п. 2, де зазначений водорозчинний полімер являє собою поліетиленгліколь.
4. Спосіб за п. 2, де зазначений водорозчинний полімер вибирається з лінійного водорозчинного полімеру і розгалуженого водорозчинного полімеру.
5. Спосіб за п. 1, де зазначена полімерна модифікуюча група і зазначена глікозильна зв'язувальна група ковалентно з'єднані за допомогою лінкера.
6. Спосіб за п. 5, де зазначена глікозильна зв'язувальна група включає модифікований залишок сіалової кислоти, і де зазначений модифікований залишок сіалової кислоти має структуру відповідно до формули:
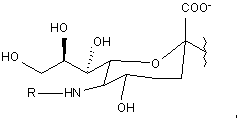
де R означає зазначену полімерну модифікуючу групу, і зазначена полімерна модифікуюча група приєднана до зазначеного залишку сіалової кислоти за допомогою зазначеного лінкера.
7. Спосіб за п. 6, де зазначений модифікований залишок сіалової кислоти має структуру відповідно до формули:
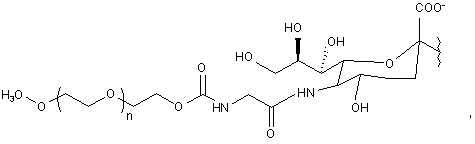
де n означає ціле число від 1 до 2000.
8. Спосіб за п. 1, де зазначена полімерна модифікуюча група має по суті гомодисперсний розподіл молекулярних мас.
9. Спосіб за п. 1, де зазначена глікозильна зв'язувальна група містить модифікований залишок сіалової кислоти, що має формулу:
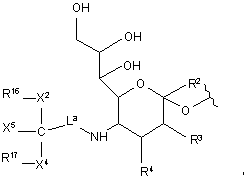
де R2 являє собою Н, CH2OR7, COOR7 або OR7,
де
R7 означає Н, заміщений або незаміщений алкіл або заміщений або незаміщений гетероалкіл;
R3 і R4 незалежно вибрані з Н, заміщеного або незаміщеного алкілу, OR8, NHC(O)R9,
де
R8 і R9 незалежно вибрані з Н, заміщеного або незаміщеного алкілу, заміщеного або незаміщеного гетероалкілу або сіалової кислоти;
La означає лінкер, вибраний зі зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу;
R16 і R17 означають незалежно вибрані полімерні "плечі";
X2 і X4 означають незалежно вибрані зв'язувальні фрагменти, що з'єднують полімерні групи R16 і R17 із С; і
X5 являє собою нереактивну групу.
10. Спосіб за п. 1, де зазначений амінокислотний залишок вибирається із серину і треоніну.
11. Спосіб за п. 1, де зазначений пептид G-CSF має амінокислотну послідовність SEQ ID NO: 1.
12. Спосіб за п. 11, де зазначений амінокислотний залишок являє собою треонін у положенні 134 SEQ ID NO: 1.
13. Спосіб за п. 6, де зазначена глікозильна зв'язувальна група містить субструктуру, вибирану з:
![]()
де
R1 означає зазначений модифікований залишок сіалової кислоти; і
р і q означають незалежні цілі числа, вибирані з 0 або 1.
14. Спосіб за п. 13, де q дорівнює 0.
15. Спосіб за п. 6, де зазначена глікозильна зв'язувальна група має формулу, вибирану з:
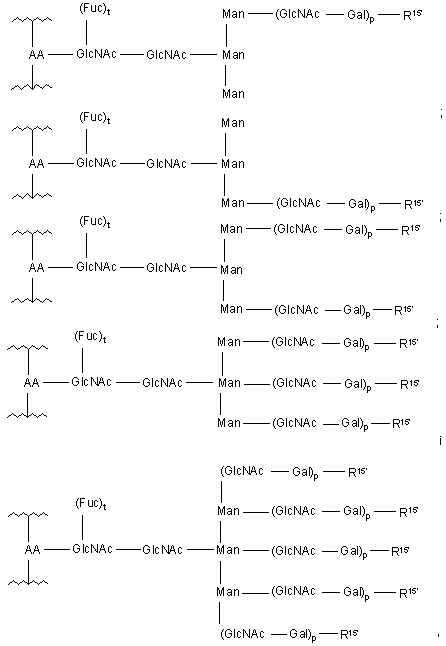
де
АА означає амінокислотний залишок зазначеного пептиду;
t означає ціле число, яке дорівнює 0 або 1;
р означає ціле число від 1 до 10; і
R15' вибирається з Н, ОН, сіалової кислоти, зазначеного модифікованого сіалільного залишку і Sia-Siap,
де
Siap означає зазначений сіалільний залишок,
де щонайменше один R15' вибирається із зазначеного модифікованого сіалільного залишку і Sia-Siap.
16. Спосіб за п. 15, де зазначений амінокислотний залишок являє собою залишок аспарагіну.
17. Спосіб збільшення числа гранулоцитів у суб'єкта, де зазначений суб'єкт придатний для трансплантації кісткового мозку, де зазначений спосіб включає введення зазначеному суб'єкту деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи, де зазначений пептид G-CSF має амінокислотну послідовність, наведену в SEQ ID NО: 1, і де зазначена полімерна модифікуюча група ковалентно приєднана до зазначеного пептиду G-CSF в області зазначеного пептиду G-CSF, яка починається гліцином у положенні 126 і закінчується серином у положенні 143, де зазначена кількість являє собою одиничну дозовану форму, вибрану з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг.
18. Спосіб лікування захворювання у суб'єкта, що потребує лікування, де зазначене захворювання характеризується пригніченням продукції білих кров'яних клітин у зазначеного суб'єкта, де зазначений спосіб включає стадію введення зазначеному суб'єкту деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи, де зазначена полімерна модифікуюча група ковалентно приєднана до зазначеного пептиду біля глікозильного або амінокислотного залишку зазначеного пептиду за допомогою глікозильної зв'язувальної групи, де зазначена кількість ефективна для полегшення зазначеного захворювання у зазначеного суб'єкта, де зазначена кількість являє собою одиничну дозовану форму, вибрану з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг.
19. Спосіб за п. 18, де зазначене пригнічення продукції білих кров'яних клітин обумовлене хіміотерапією, радіаційною терапією або ідіопатичною тромбоцитопенічною пурпурою.
20. Спосіб лікування нейтропенії або тромбоцитопенії у ссавця, який включає введення фармацевтично ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи, де зазначена полімерна модифікуюча група ковалентно приєднана до зазначеного пептиду біля глікозильного або амінокислотного залишку зазначеного пептиду за допомогою глікозильної зв'язувальної групи, де зазначена кількість являє собою одиничну дозовану форму, вибрану з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг.
21. Спосіб збільшення популяції кровотворних стовбурових клітин у культурі, де зазначений спосіб включає стадію додавання до зазначених стовбурових клітин ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи, де зазначена полімерна модифікуюча група ковалентно приєднана до зазначеного пептиду біля глікозильного або амінокислотного залишку зазначеного пептиду за допомогою глікозильної зв'язувальної групи, де зазначена кількість являє собою одиничну дозовану форму, вибрану з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг.
22. Спосіб підвищення гематопоезу або збільшення кількості кровотворних клітин-попередників у суб'єкта, де зазначений спосіб включає стадію введення зазначеному суб'єкту ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи, де зазначена полімерна модифікуюча група ковалентно приєднана до зазначеного пептиду біля глікозильного або амінокислотного залишку зазначеного пептиду за допомогою глікозильної зв'язувальної групи, де зазначена кількість являє собою одиничну дозовану форму, вибрану з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг.
23. Спосіб за п. 22, де зазначені кровотворні клітини-попередники являють собою клітини CD34+.
24. Спосіб забезпечення тривалого приживлення трансплантата кісткового мозку, де зазначений спосіб включає:
(a) введення донору зазначеного кісткового мозку пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи, де зазначена полімерна модифікуюча група ковалентно приєднана до зазначеного пептиду біля глікозильного або амінокислотного залишку зазначеного пептиду за допомогою глікозильної зв'язувальної групи, де вказаний пептид вводять в одиничній дозованій формі, вибраній з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг;
(b) виділення зазначеного кісткового мозку із зазначеного донора; і
(c) інфузію зазначеного кісткового мозку реципієнту.
25. Спосіб за п. 24, де донор являє собою ту ж особу, що і реципієнт.
26. Спосіб за п. 25, де донор являє собою особу, відмінну від реципієнта.
27. Спосіб збільшення числа кровотворних клітин-попередників у суб'єкта, де зазначений спосіб включає введення зазначеному суб'єкту:
(а) першої композиції, що містить сполуку формули (1), що представляє
1,1'-[1,4-фенілен-біс-(метилен)-біс-1,4,8,11-тетраазациклотетрадекан (AMD3100); і
(b) другої композиції, що містить пептид, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи, де зазначена полімерна модифікуюча група ковалентно приєднана до зазначеного пептиду біля глікозильного або амінокислотного залишку зазначеного пептиду за допомогою глікозильної зв'язувальної групи, де вказаний пептид вводять в одиничній дозованій формі, вибраній з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг.
28. Спосіб за п. 27, де зазначена перша композиція і зазначена друга композиція вводяться послідовно й у будь-якому порядку.
29. Спосіб за п. 27, де зазначена перша композиція і зазначена друга композиція вводяться одночасно.
30. Спосіб за п. 27, де зазначені кровотворні клітини-попередники являють собою клітини CD34+.
31. Дозована форма для перорального введення, яка включає компоненти:
(a) пептид, який являє собою ковалентний кон'югат пептиду G-CSF і водорозчинного полімеру, де зазначений водорозчинний полімер ковалентно приєднаний до зазначеного пептиду G-CSF біля глікозильного або амінокислотного залишку зазначеного пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи, де вказаний пептид представлений в одиничній дозованій формі, вибраній з 50 мкг/кг, 100 мкг/кг і 200 мкг/кг;
(b) поверхнево-активну речовину (речовини);
(c) жирну кислоту (кислоти);
(d) кишковорозчинний матеріал,
де зазначені компоненти (а), (b) і (с) змішують у рідкій фазі і ліофілізують перед об'єднанням з компонентом (d).
Текст
Реферат: У даному винаході представлений глікопегильований G-CSF, що має терапевтичну активність і має фармакокінетичні параметри і властивості, поліпшені в порівнянні з ідентичним або близько UA 99454 C2 (12) UA 99454 C2 аналогічним пептидом G-CSF, який не глікопегильований. Далі, у винаході представлені способи стимуляції гематопоезу у суб'єкта, особливо у суб'єкта, що піддавався або буде піддаватися радіаційній або хімічній терапії. Способи і композиції відповідно до винаходу можуть далі застосовуватися для попередження, полегшення і лікування мієлосупресивних ефектів таких терапій. UA 99454 C2 5 10 15 20 25 30 35 40 45 50 55 60 За дійсною заявкою вимагається пріоритет відповідно до дат подачі попередньої заявки на патент США № 60/909917, поданої 3 квітня 2007 року; попередньої заявки на патент США № 60/911788, поданої 13 квітня 2007 року; і попередньої заявки на патент США № 60/986240, поданої 7 листопада 2007 року, зміст яких повністю включений за допомогою посилання в дану заявку для будь-яких цілей. Гранулоцитарний колонієстимулюючий фактор (G-CSF) являє собою глікопротеїн, який стимулює виживання, проліферацію, диференціювання і функцію клітин-попередників нейтрофільних гранулоцитів і зрілих нейтрофілів. Обидві форми рекомбінантного людського GCSF, використовувані в клініці, являють собою потужні стимулятори гранулопоезу нейтрофілів, ефективні відносно попередження інфекційних ускладнень деяких нейтропенічних станів. Вони можуть використовуватися для прискорення відновлення популяції нейтрофілів після мієлосупресивних впливів. G-CSF зменшує хворобливість протиракової хіміотерапії шляхом зниження частоти фебрильної нейтропенії, хворобливість високодозової хіміотерапії з одночасною трансплантацією кісткового мозку, а також частоту і тривалість інфекційних захворювань у пацієнтів з важкою хронічною нейтропенією. Крім того, було показано, що G-CSF має терапевтичний ефект при введенні пацієнту після початку інфаркту міокарда. Добре відомо, що гостра мієлосупресія внаслідок цитотоксичної хіміотерапії є дозообмежувальним фактором при терапії раку. Також спостерігаються побічні ефекти відносно інших нормальних тканин, однак кістковий мозок має найбільшу чутливість до способів лікування, специфічних для проліферуючих клітин, таких як хіміотерапія і радіаційна терапія. Для деяких онкологічних хворих гематопоетична токсичність часто обмежує можливість підвищення дози хіміотерапії. Повторні або високодозові курси хіміотерапії можуть приводити до виснаження пулу кровотворних стовбурових клітин і їх потомства. Попередження і захист від побічних ефектів хіміотерапії і радіаційної терапії може принести велику користь онкологічним хворим. Було показано, що G-CSF і інші фактори росту зменшують тяжкість таких побічних ефектів шляхом збільшення кількості критичних клітин-мішеней, особливо кровотворних клітин-попередників. Людський G-CSF був клонований у 1986 році групами дослідників з Японії і США (дивіться, наприклад, Nagata et al., Nature 319, 415-418, 1986). Існує дві форми природного людського глікопротеїну, одна з яких містить 175, а інша 178 амінокислот. Для розробки фармацевтичних продуктів із застосуванням технології рекомбінантної ДНК використовувалася більш активна форма, яка зустрічається більш часто, що містить 175 амінокислот. Рекомбінантний людський G-CSF, синтезований у системі експресії Е. coli, називається філграстим. Структура філграстиму незначно відрізняється від природного глікопротеїну. Інша форма людського рекомбінантного G-CSF називається ленограстим і синтезується в клітинах яєчників китайського хом'ячка (СНО). hG-CSF являє собою мономерний протеїн, який димеризує рецептор G-CSF шляхом утворення комплексу 2:2 з 2 молекул G-CSF і 2 рецепторів (Horan et al., Biochemistry, 35(15): 4886-96 (1996)). За допомогою методу рентгенівської кристалографії були виявлені наступні залишки в складі G-CSF, що формують частину молекули, взаємодіючу з рецептором: G4, Р5, А6, S7, S8, L9, Р10, Q11, S12, L15, К16, Е19, Q20, L108, D109, D112, Т115, Т116, Q119, Е122, Е123 і L124 (дивіться, наприклад, Aritomi et al., (1999) Nature 401: 713). Наявні в продажу форми rhG-CSF мають короткочасну фармакологічну дію і часто мають вводитися пацієнту частіше одного разу на день протягом лейкопенічного стану. Більш довгий час напівжиття молекули в циркуляції дозволив би зменшити кількість введень, необхідних для полегшення лейкопенії і попередження інфекцій. Інша проблема наявних у продажу продуктів rhG-CSF полягає у виникненні дозозалежного болю в кістках. Оскільки біль у кістках, якої зазнають пацієнти, є значним побічним ефектом терапії rhG-CSF, бажана розробка продукту rGCSF, що не викликає болю в кістках, або розробка продукту, що не має цих ефектів у силу своєї природи або ефективності в малих дозах, недостатніх для розвитку болю в кістках. Таким чином, очевидна необхідність розробки поліпшених рекомбінантних молекул G-CSF. Були описані штучно одержані варіанти hG-CSF (дивіться патенти США №№ 5581476, 5214132, 5362853, 4904584 і Riedhaar-Olson et al., Biochemistry 35: 9034-9041, 1996). Також була описана модифікація hG-CSF і інших поліпептидів шляхом введення щонайменше одного додаткового вуглеводного ланцюга в порівнянні з нативним поліпептидом (патент США № 5218092). Крім того, були описані і вивчені полімерні модифікації нативного hG-CSF, включаючи додавання PEG-груп (дивіться, наприклад, Satake-Ishikawa et al., (1992) Cell Structure and Function 17: 157; Bowen et al., (1999) Experimental Hematology 27: 425; патенти США №№ 5824778, 5824784, WO 96/11953, WO 95/21629 і WO 94/20069). 1 UA 99454 C2 5 10 15 20 25 30 35 40 45 50 55 З рівня техніки відоме приєднання синтетичних полімерів до поліпептидного ланцюга з метою поліпшення фармакокінетичних властивостей глікопротеїнових лікарських засобів. Типовим прикладом полімеру, кон'югованого з пептидами, є поліетиленгліколь (PEG, ПЕГ). Було показано, що використання PEG для дериватизації пептидних лікарських засобів знижувало імуногенність пептидів. Наприклад, у патенті США № 4179337 (Davis et al.) розкриваються неімуногенні поліпептиди, такі як ферменти і пептидні гормони, зв'язані з поліетиленгліколем (PEG) або поліпропіленгліколем. Для таких пептидів, крім зниженої імуногенності, характерний збільшений час кліренсу з циркуляції в зв'язку зі збільшенням розміру кон'югатів розглянутих пептидів з PEG. Один метод приєднання PEG (і його похідних) до пептидів являє собою неспецифічне зв'язування через амінокислотний залишок пептиду (дивіться, наприклад, патент США № 4088538, патент США № 4414147, патент США № 4055635, а також РСТ WO 87/00056). Інший метод приєднання PEG до пептидів являє собою неспецифічне окислювання глікозильних залишків на глікопептиді (дивіться, наприклад, WO 94/05332). При використанні цих неспецифічних методів поліетиленгліколь приєднується випадково і неспецифічно до реактивних залишків у складі пептидного ланцюга. Очевидно, що для випадкового приєднання молекул PEG характерний ряд недоліків, включаючи гетерогенність кінцевого продукту й імовірність зниження біологічної або ферментативної активності пептиду. Таким чином, для виробництва лікарських пептидів переважна стратегія дериватизації, яка приводить до одержання специфічно міченого, легко характеризованого і практично гомогенного продукту. Такі способи розроблені. Специфічно мічені, гомогенні пептидні лікарські засоби можна одержувати in vitro за допомогою ферментів. На відміну від типових неспецифічних способів приєднання до пептиду синтетичного полімеру або іншої мітки, синтези, основані на ферментах, мають переваги регіоселективності і стереоселективності. Два головних класи ферментів, застосовних для синтезу мічених пептидів, включають глікозилтрансферази (наприклад, сіалілтрансферази, олігосахарилтрансферази, N-ацетилглюкозамінілтрансферази) і глікозидази. Ці ферменти можна використовувати для специфічного приєднання цукрів, які далі можна модифікувати для одержання лікарської речовини. Як альтернатива, глікозилтрансферази і модифіковані глікозидази можуть використовуватися для прямого перенесення модифікованих цукрів на поліпептидний ланцюг (дивіться, наприклад, патент США № 6399336 і публікації заявок на патент США 20030040037, 20040132640, 20040126838 і 20040142856, кожна з який включена в дану заявку за допомогою посилання). Також відомі способи, які комбінують елементи як хімічного, так і ферментативного синтезу (дивіться, наприклад, Yamamoto et al., Carbohydr. Res. 305:415-422 (1998) і публікацію заявки на патент США 20040137557, включені в дану заявку за допомогою посилання). У відповідь на потребу в поліпшеному лікарському G-CSF, у даному винаході представлений глікопегильований G-CSF, який має терапевтичну активність, а також поліпшені фармакокінетичні параметри і властивості у порівнянні з неглікопегильованими ідентичним пептидом G-CSF або його близьким аналогом. Далі в даному винаході представлені способи посилення гематопоезу у суб'єкта, особливо у суб'єкта, який одержував або буде одержувати лікування у вигляді радіаційної або хіміотерапії. Відповідно до вищесказаного, в одному аспекті в даному винаході представлені способи і композиції, що стимулюють продукцію стовбурових клітин у реципієнта трансплантата кісткового мозку. Ці способи і композиції включають введення реципієнту трансплантата кісткового мозку деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду GCSF і полімерної модифікуючої групи. В одному аспекті полімерна модифікуюча група ковалентно приєднана до пептиду біля глікозильного або амінокислотного залишку пептиду через інтактну глікозильну зв'язувальну групу. В іншому аспекті в даному винаході представлені способи і композиції, які збільшують число гранулоцитів у суб'єкта. Цей спосіб включає стадію введення суб'єкту деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. В одному аспекті пептид G-CSF має амінокислотну послідовність, наведену в SEQ ID NO:1, а полімерна модифікуюча група ковалентно приєднана до пептиду G-CSF в області амінокислотної послідовності, яка починається гліцином у положенні 126 і закінчується серином у положенні 143. Ще в одному аспекті в даному винаході представлені способи і композиції, які підвищують продукцію стовбурових клітин у суб'єкта. Ці способи включають стадію введення суб'єкту деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної 2 UA 99454 C2 модифікуючої групи. В подальшому аспекті пептид G-CSF включає структуру відповідно до формули , 5 де q дорівнює 0 або 1; і Sia-PEG має структуру відповідно до формули , 10 15 20 25 30 35 40 45 де n означає ціле число від 1 до 2000. В одному аспекті в даному винаході представлені способи попередження, лікування або ослаблення мієлосупресії, особливо мієлосупресії, обумовленої протипухлинною терапією. В одному аспекті цей спосіб включає введення реципієнту деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. В іншому аспекті в даному винаході представлені способи лікування захворювання у суб'єкта, для якого характерне пригнічення продукції білих кров'яних клітин. В одному аспекті спосіб лікування захворювання включає стадію введення суб'єкту деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. Кількість пептиду, що вводиться суб'єкту, достатня для ефективного полегшення стану суб'єкта. Ще в одному аспекті в даному винаході представлені способи лікування нейтропенії у ссавця. Ці способи включають стадію введення фармацевтично ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. Ще в одному аспекті в даному винаході представлені способи лікування тромбоцитопенії у ссавця. Ці способи включають стадію введення фармацевтично ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. В одному аспекті в даному винаході представлені способи збільшення популяції кровотворних стовбурових клітин у культурі. Ці способи включають стадію додавання до культури стовбурових клітин ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. В іншому аспекті в даному винаході представлені способи стимуляції гематопоезу у суб'єкта. Ці способи включають стадію введення суб'єкту ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF 3 UA 99454 C2 5 10 15 20 25 30 35 40 45 50 55 біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. Ще в одному аспекті в даному винаході представлені способи збільшення числа кровотворних клітин-попередників у суб'єкта. Ці способи включають стадію введення суб'єкту ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. В одному аспекті в даному винаході представлені способи стимуляції продукції стовбурових клітин у донора. Ці способи включають стадію введення донору ефективної кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. В іншому аспекті в даному винаході представлені способи підвищення тривалого приживлення трансплантата кісткового мозку у реципієнта. Ці способи включають стадію введення реципієнту кісткового мозку пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. Ще в одному аспекті в даному винаході представлені способи стимуляції кровотворних клітин-попередників у суб'єкта. Ці способи включають стадію введення суб'єкту першої композиції, що містить сполуку формули 1,1'-[1,4-феніленбіс-(метилен)-біс-1,4,8,11тетраазациклотетрадекан (AMD3100), і другої композиції, що містить пептид, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група ковалентного кон'югата може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи. Перша і друга композиції можуть вводитися суб'єкту послідовно в будьякому порядку або одночасно. В одному аспекті в даному винаході представлена дозована форма для перорального введення. Ця дозована форма для перорального введення може містити наступні компоненти: (а) пептид, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. Полімерна модифікуюча група може ковалентно приєднуватися до пептиду G-CSF біля глікозильного або амінокислотного залишку пептиду G-CSF за допомогою інтактної глікозильної зв'язувальної групи; (b) поверхнево-активну речовину (речовини); (с) жирну кислоту (кислоти); і (d) кишковорозчинний матеріал. В одному аспекті компоненти (а), (b) і (с) змішують у рідкій фазі і ліофілізують перед об'єднанням з компонентом (d). В іншому аспекті в даному винаході представлений спосіб підвищення продукції стовбурових клітин у донора, де спосіб включає стадії введення донору деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. В подальшому аспекті полімерна модифікуюча група ковалентного кон'югата приєднується до пептиду біля глікозильного або амінокислотного залишку пептиду за допомогою інтактної глікозильної зв'язувальної групи. Ще в одному аспекті винаходу кількість пептиду, що вводиться донору, знаходиться в інтервалі від 1 мг до приблизно 20 мг. Ще в одному аспекті винаходу представлений спосіб підвищення продукції стовбурових клітин у донора, де спосіб включає стадії введення донору деякої кількості пептиду, який являє собою ковалентний кон'югат пептиду G-CSF і полімерної модифікуючої групи. В подальшому аспекті полімерна модифікуюча група приєднується до пептиду біля глікозильного або амінокислотного залишку пептиду за допомогою інтактної глікозильної зв'язувальної групи. Ще в одному аспекті кількість пептиду, що вводиться донору, може знаходитися у вигляді одиничної дозованої форми. В одному втіленні одинична доза вибирається з 25, 50, 100 і 200 мкг/кг. На фіг. 1 наведені дані, які стосуються абсолютної кількості нейтрофілів (ANC) у відповідь на ХМ22 (25 мкг/кг; 50 мкг/кг; 100 мкг/кг) і нейласту (100 мкг/кг). На фіг. 2 наведені дані, які стосуються кількості CD34+ клітин у відповідь на ХМ22 (25 мкг/кг; 50 мкг/кг; 100 мкг/кг) і нейласту (100 мкг/кг). Фіг. 3 являє собою таблицю даних, які стосуються фармакокінетичних параметрів для чотирьох різних дослідних груп. На фіг. 4 наведені дані, які стосуються абсолютної кількості нейтрофілів (ANC) у відповідь на ХМ22 (6 мг) і нейласту (6 мг). 4 UA 99454 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. 5 наведені дані, які стосуються кількості CD34+ клітин у відповідь на ХМ22 (6 мг) і нейласту (6 мг). На фіг. 6 наведені дані фармакодинаміки, які стосуються кількості нейтрофілів у відповідь на G-CSF, глікоPEG-G-CSF, нейласту і контрольну композицію у яванських макак. На фіг. 7 наведені дані фармакокінетики, які стосуються концентрації зазначених композицій у плазмі у яванських макак. На фіг. 8 наведена схематична модель структури глікоPEG-G-CSF і його рецептора. На фіг. 9 наведені дані, які стосуються концентрації ХМ22 і нейласти в сироватці крові після введення трьох різних доз ХМ22 і 100 мкг/кг нейласти. На фіг. 10 наведені дані, які стосуються концентрації ХМ22 і нейласти в сироватці крові після введення 6 мг ХМ22 і 6 мг нейласти. ДОКЛАДНИЙ ОПИС ВИНАХОДУ І ПЕРЕВАЖНИХ ВТІЛЕНЬ Скорочення PEG, ПЕГ - поліетиленгліколь; PPG, ППГ - поліпропіленгліколь; Аrа - арабінозил; Fru фруктозил; Fuc - фукозил; Gal - галактозид; GalNAc-N-ацетилгалактозамініл; Glc - глюкозид; GlcNAc-N-ацетилглюкозамініл; Man - манозил; МаnАс - манозамініл ацетат; Хуl - ксилозил; NeuAc - сіаліл (N-ацетилнейрамініл); М6Р - манозо-6-фосфат; Sia - сіалова кислота, Nацетилнейрамініл і їх похідні й аналоги. "G-CSF" означає гранулоцитарний колонієстимулюючий фактор. Визначення Якщо не визначено інакше, значення всіх технічних і наукових термінів, використовуваних в даній заявці, в цілому збігається з загальноприйнятими значеннями, відомими фахівцю в галузі техніки, до якої належить даний винахід. Загалом, використовувані в даній заявці номенклатура і лабораторні процедури, що стосуються культури клітин, молекулярної генетики, органічної хімії і хімії і гібридизації нуклеїнових кислот, добре відомі і широко застосовуються в рівні техніки. Для синтезу пептидів і нуклеїнових кислот використовуються стандартні техніки. Загалом, техніки і процедури проводяться відповідно до загальноприйнятих способів, відомих з рівня техніки, і різних загальних керівництв (дивіться Sambrook et al., Molecular Cloning: A Laboratory Manual, 2 вид., (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, включене в дану заявку за допомогою посилання), посилання на які наводяться в тексті даного документа. Використовувані в даній заявці номенклатура і лабораторні процедури, що стосуються аналітичної хімії й органічного синтезу, описані нижче, добре відомі і широко застосовуються в рівні техніки. Для хімічних синтезів і хімічних аналізів використовуються стандартні техніки або їх модифікації. Всі олігосахариди, описані в даній заявці, описуються повною або скороченою назвою нередукуючого сахариду (тобто Gal), за яким іде конфігурація глікозидного зв'язку (α або β), зв'язок з кільцем (1 або 2), положення в кільці редукуючого сахариду, що бере участь у зв'язку (2, 3, 4, 6 або 8), і повна або скорочена назва редукуючого сахариду (наприклад, GlcNAc). Кожен сахарид переважно являє собою піранозу. В огляді Essentials of Glycobiology, ред. Varki et al., CSHL Press (1999) розглядається загальноприйнята глікобіологічна номенклатура. Передбачається, що в олігосахаридах наявні редукуючий і нередукуючий кінці незалежно від того, чи є сахарид на редукуючому кінці редукуючим сахаридом. Відповідно до прийнятої номенклатури, у даній заявці олігосахариди зображуються з нередукуючим кінцем ліворуч і редукуючим кінцем праворуч. Термін "сіалова кислота" стосується будь-якого представника сімейства дев'ятивуглецевих карбоксилованих цукрів. Представник сімейства сіалових кислот, що найбільш часто зустрічається, являє собою N-ацетилнейрамінову кислоту (2-кето-5-ацетамідо-3,5-дидезокси-Dгліцеро-D-галактононулопіраноз-1-онову кислоту (часто скорочується до Neu5Ac, NeuAc або NANA). Другий представник сімейства являє собою N-гліколілнейрамінову кислоту (Neu5Gc або NeuGc), де N-ацетильна група NeuAc гідроксилована. Третій представник сімейства сіалових кислот являє собою 2-кето-3-дезоксинонулозонову кислоту (KDN) (Nadano et al. (1986), J. Biol. Chem. 261:11550-11557; Kanamori et al., J. Biol. Chem. 265: 21811-21819 (1990)). Також сюди включаються 9-заміщені сіалові кислоти, такі як 9-О-С1-С6ацил-Neu5Ас, як 9-О-лактил-Nеu5Ас або 9-О-ацетил-Neu5Ac, 9-дезокси-9-фтор-Neu5Ас і 9-азидо-9-дезокси-Neu5Ас. Дивіться огляд сімейства сіалових кислот Varki, Glycobiology 2:25-40 (1992), Sialic Acids: Chemistry, Metabolism and Function, ред. R. Schauer (Springer-Verlag, New York (1992)). Синтез і використання сполук сіалових кислот у процедурі сіалізації розкриті в заявці на міжнародний патент WO 92/16640, опублікованій 1 жовтня 1992 року. Термін "пептид" означає полімер, який складається з мономерів-амінокислот, зв'язаних між собою амідними зв'язками, також називаний поліпептидом. Крім того, сюди включаються 5 UA 99454 C2 5 10 15 20 25 30 35 40 45 50 55 60 неприродні амінокислоти, такі як β-аланін, фенілгліцин і гомоаргінін. Також у даному винаході можуть використовуватися амінокислоти, не кодовані генами. Далі, у даному винаході можуть використовуватися модифіковані амінокислоти, які містять реактивні групи, сайти глікозилування, полімери, лікарські речовини, біомолекули і т. д. Всі амінокислоти, використовувані в даному винаході, можуть являти собою як D-, так і L-ізомери. У загальному випадку, переважним є L-ізомер. Крім того, у даному винаході можуть використовуватися інші пептидоміметики. При використанні в даній заявці "пептид" означає як глікозиловані, так і неглікозиловані пептиди. Також сюди включаються пептиди, не повністю глікозиловані в системі експресії пептиду. Дивіться огляд Spatola et al., у Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, ред. В. Weinstein, Marcel Dekker, New York, стор. 267 (1983). Амінокислотна або нуклеотидна послідовність пептиду "гомологічна" іншій послідовності, якщо вони до деякої міри ідентичні. Переважно, щоб гомологічна послідовність була щонайменше приблизно на 85 % ідентична еталонній послідовності, переважно ідентична приблизно на 90-100 %, більш переважно ідентична щонайменше приблизно на 91 %, ідентична щонайменше приблизно на 92 %, ідентична щонайменше приблизно на 93 %, ідентична щонайменше приблизно на 94 %, ще більш переважно ідентична щонайменше приблизно на 95-99 %, переважно ідентична щонайменше приблизно на 96 %, ідентична щонайменше приблизно на 97 %, ідентична щонайменше приблизно на 98 %, ще більш переважно ідентична щонайменше приблизно на 99 %, і ідентична приблизно на 100 % референській амінокислотній або нуклеотидній послідовності. Термін "кон'югат пептиду" стосується різновиду винаходу, де пептид кон'югується з модифікованим цукром як описано в даній заявці. Термін "амінокислота" стосується природних і синтетичних амінокислот, а також похідних і міметиків амінокислот, які мають подібну функцію з природними амінокислотами. Природними амінокислотами є амінокислоти, кодовані генетичним кодом, а також амінокислоти, що піддаються наступній модифікації, наприклад, гідроксипролін, γ-карбоксиглутамат і Офосфосерин. Аналоги амінокислот означають сполуки, які мають базову хімічну структуру, ідентичну природним амінокислотам, тобто містять α-вуглецевий атом з приєднаними воднем, карбоксильною групою, аміногрупою і R-групою, тобто гомосерин, норлейцин, метіонінсульфоксид, метіонінметилсульфоній. Такі аналоги мають модифіковані R-групи (наприклад, норлейцин) або модифіковані пептидні ланцюги, але зберігають базову хімічну структуру, ідентичну природним амінокислотам. Амінокислотні міметики означають хімічні сполуки, що мають структуру, відмінну від базової хімічної структури амінокислот, але функція яких подібна з функцією природних амінокислот. При використанні в даній заявці, термін "модифікований цукор" означає природний або неприродний цукор, приєднаний ферментативним способом до амінокислотного або глікозильного залишку пептиду в способі даного винаходу. Модифікований цукор вибирають із субстратів ферментів, включаючи, але не обмежуючись нуклеотидами цукрів (моно-, ди- і трифосфатами), активованими цукрами (наприклад, глікозилгалідами, глікозилмезилатами) і цукрами, які не є ні активованими, ні нуклеотидами цукрів. "Модифікований цукор" ковалентно функціоналізований "модифікуючою групою". Застосовні модифікуючі групи включають, але не обмежуються фрагментами PEG, лікарськими фрагментами, діагностичними фрагментами, біомолекулами і т. д. Модифікуюча група переважно являє собою неприродний або не немодифікований цукор. Точка функціоналізації модифікуючою групою вибирається таким чином, щоб вона не перешкоджала приєднанню "модифікованого цукру" ферментативним шляхом до пептиду. Термін "водорозчинний" означає фрагменти, що мають деяку виявлювану розчинність у воді. Способи виявлення і/або вимірювання розчинності у воді добре відомі з рівня техніки. Типові водорозчинні полімери включають пептиди, сахариди, поліефіри, поліаміни, полікарбоксокислоти і т. д. Пептиди можуть мати зміщувані послідовності або складатися з однієї амінокислоти, як наприклад, полілізин. Типовим полісахаридом є полісіалова кислота. Типовим полімером є поліетиленгліколь. Поліетиленімін являє собою типовий поліамін, і поліакрилова кислота являє собою типову полікарбонову кислоту. Полімерний ланцюг водорозчинного полімеру може являти собою поліетиленгліколь (тобто PEG). Однак, варто розуміти, що інші споріднені полімери також застосовні в даному винаході і що в зв'язку з цим термін PEG або поліетиленгліколь є таким, що включає, а не таким, що відрізняє. Термін PEG включає поліетиленгліколь у будь-якій формі, включаючи алкокси-PEG, дифункціональний PEG, багатоплечий PEG, роздвоєний PEG, розгалужений PEG, підвішений PEG (тобто PEG або споріднені полімери, одна або більш функціональних груп яких підвішені на полімерному ланцюзі) або PEG, що містить зв'язки, що руйнуються. 6 UA 99454 C2 5 10 15 20 25 30 35 40 45 50 55 60 Полімерний ланцюг може бути лінійним або розгалуженим. Розгалужені полімерні ланцюги відомі з рівня техніки. Звичайно розгалужений полімер складається з центральної частини і множини лінійних полімерних ланцюгів, зв'язаних з центральною частиною. Звичайно використовують розгалужені форми PEG, одержувані шляхом додавання етиленоксиду до різних поліолів, таких як гліцерин, пентаеритрит і сорбіт. Центральна частина також може складатися з декількох амінокислот, таких як лізин. Розгалужений поліетиленгліколь може загалом бути представлений формулою R-(PEG-OH)m, де R означає центральну частину, таку як гліцерин або пентаеритрит, a m означає кількість гілок. Також як полімерний ланцюг можуть використовуватися багатоплечі молекули PEG, такі як описані в патенті США № 5932462, повністю включеному в дану заявку за допомогою посилання. У даному винаході може використовуватися багато інших полімерів. Особливо застосовні в даному винаході непептидні водорозчинні полімерні ланцюги, що мають від 2 до 300 кінців. Приклади застосовних полімерів включають, але не обмежуються іншими поліалкіленгліколями, такими як поліпропіленгліколь ("PPG"), співполімери етиленгліколю і пропіленгліколю і ним подібних, поліоксіетилований поліол, поліолефіновий спирт, полівінілпіролідон, полігідроксипропілметакриламід, полі-α-гідроксикислота, полівініловий спирт, поліфосфазен, поліоксазолін, полі-N-акрилоїлморфолін, такий як описаний у патенті США № 5629384, повністю включеному в дану заявку за допомогою посилання, а також їх співполімери, терполімери і їх суміші. Незважаючи на те, що молекулярна вага полімерних ланцюгів може розрізнятися, звичайно він знаходиться в інтервалі від приблизно 100 Да до приблизно 100000 Да, часто від приблизно 6000 Да до приблизно 80000 Да. При застосуванні в даній заявці в контексті введення пептидного лікарського препарату пацієнту, "площа під кривою" ("AUC") визначається як повна площа під кривою, яка описує концентрацію лікарського препарату в системному кровотоці пацієнта як функцію від часу від нуля до нескінченності. При застосуванні в даній заявці в контексті введення пептидного лікарського препарату пацієнту, термін "час напівжиття" або "t1/2" визначається як час, необхідний для зменшення наполовину концентрації лікарського препарату в плазмі крові пацієнта. Для одного і того самого пептидного лікарського препарату може існувати декілька різних часів напівжиття залежно від множинних механізмів кліренсу, перерозподілу й інших механізмів, добре відомих з рівня техніки. Звичайно α-час напівжиття і β-час напівжиття визначаються таким чином, що αфаза виявляється пов'язаною з перерозподілом, а β-фаза - із кліренсом. Однак, для білкових лікарських препаратів, які більшою частиною не залишають кровотоку, може існувати щонайменше два часи напівжиття, пов'язаних із кліренсом. Для деяких глікозилованих пептидів швидкий кліренс під час β-фази може бути опосередкований рецепторами на макрофагах або ендотеліальних клітинах, які розпізнають термінальні галактозу, N-ацетилгалактозамін, Nацетилглюкозамін, манозу або фукозу. Більш повільне виведення в β-фазі може бути обумовлене клубочковою фільтрацією в нирках молекул, що мають ефективний радіус
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods of treatment using glycopegylated g-csf
Автори англійськоюZopf, David, A., Lubenau, Heinz
Назва патенту російськоюСпособ лечения с использованием гликопегилированнного g-csf (варианты)
Автори російськоюЦопф Девид А., Лубенау Хайнц
МПК / Мітки
МПК: A61K 38/19, A61P 7/00, A61P 35/00, A61K 47/48
Мітки: глікопегильованого, варіанти, g-csf, використанням, спосіб, лікування
Код посилання
<a href="https://ua.patents.su/84-99454-sposib-likuvannya-z-vikoristannyam-glikopegilovanogo-g-csf-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування з використанням глікопегильованого g-csf (варіанти)</a>
Попередній патент: Нагрівальний пристрій на базі матеріалу з карбонового волокна
Наступний патент: Епоксидна сполука, спосіб її одержання та спосіб одержання сполуки оксазолу
Випадковий патент: Радіоелектронний блок












