Кон’югат антитіло-лікарський засіб (adc), який зв’язується з білком 161p2f10b
Номер патенту: 115517
Опубліковано: 27.11.2017
Автори: Якобовіц Айя, Торгов Майкл, Моррісон Роберт Кендалл, Гудас Джин, Ан Зілі
Формула / Реферат
1. Кон'югат антитіло-лікарський засіб, що містить антитіло або його антигензв'язуючий фрагмент, який специфічно зв'язується з білком 161P2F10B, що містить амінокислотну послідовність з SEQ ID NO: 2, де антитіло або фрагмент містить амінокислотну послідовність VH області з SEQ ID NO: 7, від 20 залишку до 142, і VL області з SEQ ID NO: 8, від 20 залишку до 127, і де зазначене антитіло або фрагмент є кон'югованим з монометилауристатином F (MMAF), використовуючи лінкер.
2. Кон'югат антитіло-лікарський засіб за п. 1, де антигензв'язуючий фрагмент являє собою фрагмент Fab, F(ab')2 або Fv.
3. Кон'югат антитіло-лікарський засіб за п. 1, де антитіло є повністю людським антитілом.
4. Кон'югат антитіло-лікарський засіб за п. 1, який є рекомбінантно одержаним.
5. Кон'югат антитіло-лікарський засіб за п. 1, в якому лінкер є малеімідокапроїлом.
6. Кон'югат антитіло-лікарський засіб за п. 5, де кон'югат антитіло-лікарський засіб має наступну структуру:
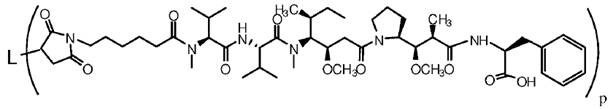 ,
,
де L означає анти-161P2F10B антитіло або його антигензв’язуючий фрагмент і p означає від 1 до 12.
7. Кон'югат антитіло-лікарський засіб за п. 6, де антитіло складається з амінокислотної послідовності важкого ланцюга SEQ ID NО: 7 від 20 залишку до 468 та амінокислотної послідовності легкого ланцюга SEQ ID NО: 8 від 20 залишку до 233.
8. Фармацевтична композиція, яка містить кон'югат антитіло-лікарський засіб за п. 1 у формі стандартної дози для людини.
9. Фармацевтична композиція за п. 8, де ця композиція призначена для лікування раку.
10. Фармацевтична композиція за п. 9, де рак являє собою рак нирки або рак печінки.
11. Спосіб інгібування росту ракових клітин у суб'єкта, що включає: введення зазначеному суб'єкту кон'югата антитіло-лікарський засіб за п. 1.
12. Спосіб доставки цитотоксичного засобу або діагностичного засобу в клітину, що включає:
забезпечення MMAF, кон'югованого (кон'югованих) з антитілом або його фрагментом, який специфічно зв'язується з білком 16IP2F10B, що містить амінокислотну послідовність з SEQ ID NO: 2, де антитіло або фрагмент містить амінокислотну послідовність VH області з SEQ ID NO: 7, від 20 залишку до 142, і VL області з SEQ ID NO: 8, від 20 залишку до 127, з утворенням кон'югата антитіло-лікарський засіб або фрагмент-лікарський засіб; і вплив на клітину кон'югатом антитіло-лікарський засіб або фрагмент-лікарський засіб.
13. Спосіб лікування пухлини у ссавця, що включає лікування ссавця ефективною кількістю кон'югата антитіло-лікарський засіб за п. 1.
14. Спосіб отримання кон'югата антитіло-лікарський засіб, що включає стадії: кон′югування антитіла або його антигензв'язуючого фрагмента з монометилауристатином F (MMAF) за допомогою лінкеру, де антитіло або його антигензв'язуючий фрагмент експресується клітиною-хазяїном, що містить нуклеотидну послідовність, яка кодує амінокислотну послідовність VH області, що містить SEQ ID NO:7, з 20 залишку до 142, а також нуклеотидну послідовність, яка кодує амінокислотну послідовність VL області, що складається з SEQ ID NO:8, залишку від 20 до 127, таким чином утворюючи кон'югат антитіло-лікарський засіб.
15. Спосіб отримання кон'югата антитіло-лікарський засіб за п. 14, який відрізняється тим, що антитіло або його антигензв'язуючий фрагмент є антигензв'язуючим фрагментом, який є Fab, F(ab')2 або Fv фрагментом.
16. Спосіб отримання кон'югата антитіло-лікарський засіб за п. 14, який відрізняється тим, що антитіло є повністю людським антитілом.
17. Спосіб за п. 14, де лінкер є малеімідокапроїлом.
18. Спосіб за п. 17, де кон'югат антитіло-лікарський засіб має наступну структуру:
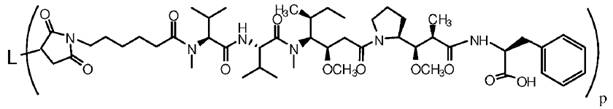 ,
,
де L означає анти-161P2F10B антитіло або його антигензв’язуючий фрагмент і p означає від 1 до 12.
19. Фармацевтична композиція, яка містить кон'югат антитіло-лікарський засіб, отриманий у спосіб за будь-яким за пп. 14-18, у формі стандартної дози для людини.
20. Фармацевтична композиція за п. 19, яка відрізняється тим, що композиція призначена для лікування раку.
21. Фармацевтична композиція за п. 20, яка відрізняється тим, що рак є раком нирки або раком печінки.
Текст
Реферат: Винахід стосується кон'югата антитіло-лікарський засіб для лікування раку, що містить антитіло або його антигензв'язуючий фрагмент, який специфічно зв'язується з білком 161P2F10B, що містить амінокислотну послідовність з SEQ ID NО: 2, де антитіло або фрагмент містить амінокислотну послідовність VH області з SEQ ID NО: 7, від 20 залишку до 142, і VL області з SEQ ID NО: 8, від 20 залишку до 127, і де зазначене антитіло є кон'югованим з монометилауристатином F (MMAF). UA 115517 C2 (12) UA 115517 C2 UA 115517 C2 5 10 Перехресне посилання на споріднену заявку [0001] Дана заявка заявляє перевагу попередньої заявки на патент США № 61/302489, поданої 8 лютого 2010 року. Зміст даної заявки включено в справжній документ посиланням у всій своїй повноті. Заява прав на винаходи, зроблені в федерально-спонсованих дослідженнях [0002] Немає даних. Посилання на перелік послідовностей, поданих через efs-web [0003] Повний зміст наступних електронних подач переліку послідовностей через сервер USPTO EFS-WEB, як встановлено і викладено в MPEP § 1730 II.B.2 (a) (C), включено в справжній документ посиланням у всій своїй повноті для всіх цілей. Перелік послідовностей ототожнюють за електронною формою текстового файлу в наступному вигляді: Ім’я файлу 511582006274Seqlist 15 20 25 30 35 40 45 50 55 Дата створення 27 січня 2011 г. Розмір (байти) 43630 байтів Область винаходу [0004] Справжній винахід, описаний в справжньому документі, належить до кон'югатів антитіло-лікарський засіб (ADC), які зв'язують білки, названі 161P2F10B. Дійсний винахід додатково належить до прогностичних, профілактичних і терапевтичних способів і композицій, придатних при лікуванні різних форм раку. Передумови винаходу [0005] Рак є другою провідною причиною смерті людей після ішемічного захворювання серця. У всьому світі від раку щороку помирають мільйони людей. В одних тільки Сполучених Штатах, як повідомляє Американське онкологічне товариство, рак є причиною смерті більше півмільйона людей на рік, при цьому на рік діагностується понад 1,2 мільйона нових випадків. Не дивлячись на те, що смертність в результаті захворювання серця значно знизилася, смертність в результаті раку загалом перебуває на підйомі. На початку наступного століття рак, за прогнозами, стане провідною причиною смерті. [0006] У всьому світі деякі форми раку виступають в ролі ведучих вбивць. За дуже небагатьма винятками, метастазування в результаті карциноми призводить до летального наслідку. Більш того, навіть для тих хворих на рак, які спочатку пережили свої форми первинного раку, загальний досвід показав, що їхнє життя кардинально змінилося. Багато хворих на рак відчувають сильне занепокоєння, викликане усвідомленням можливості рецидиву або неефективності лікування. Багато хворих на рак відчувають фізичні погіршення після лікування. Крім того, багато хворих на рак переживають рецидив. [0007] Не дивлячись на те, що такі раніше ідентифіковані маркери, як PSA, PSM, PCTA і 161P2F10B полегшували спроби діагностувати і лікувати рак простати, існує необхідність у виявленні додаткових маркерів і терапевтичних мішеней для раку простати і супутніх видів раку для додаткового поліпшення діагностики та терапії. [0008] Рак клітин ниркового епітелію (RCC) в даний час займає 10-е місце серед провідних причин смерті від раку в Сполучених Штатах. В США, за оцінками, щорічно у 51190 людей будуть діагностувати гіпернефрому, і приблизно 12890 померло від цього захворювання в 2007 році (Американське онкологічне товариство). Історично склалося, що лікування фокусувалося переважно на нефректомії з подальшою неспецифічною імунотерапією і, іноді, променевою терапією (Hauke, 2006). Неспецифічна імунотерапія включає лікування цитокінами інтерлейкіном-2 або інтерфероном-α, або як окремими засобами, або в поєднанні. Після хірургічного видалення протягом 1-3 років у 20-30% пацієнтів розвивається метастазування, частіше в легенях (Motzer, et al., 2006). Медіана виживаності пацієнтів з метастазуванням становить приблизно 13 місяців (Cohen and McGovern, 2005). [0009] З 2005 року шість (6) засобів були схвалені FDA для лікування запущеного раку клітин ниркового епітелію. Ці досягнення включають декілька засобів, які націлені на специфічні шляхи, залучені до раку клітин ниркового епітелію. Ці засоби включають сорафеніб (Nexavar ®, схвалений FDA в грудні 2005 року), сунітиніб (Sutent ®, схвалений FDA в січні 2006 року), темсіролімус (Torisel ®, схвалений FDA в травні 2007 року), еверолімус (Affinitor ®, схвалений FDA в березні 2009 року), бевацизумаб (Avastin ® в комбінації з інтерфероном альфа, схвалений FDA в серпні 2009 року) і пазопаніб (Votrient ®, схвалений FDA в жовтні 2009 року). Однак незважаючи на успіхи в лікуванні, метастатичний рак клітин ниркового епітелію залишається невиліковним, і тільки темсіролімус був схвалений на основі переваги в загальній виживаності. 1 UA 115517 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0010] Додатково, гепатоклітинна карцинома (тобто рак печінки) складає 80-90% всіх форм раку печінки. Цей тип раку печінки частіше зустрічається у чоловіків, ніж у жінок. Як правило, він спостерігається у людей у віці 50-60 років. Зазвичай, лікуванням раку печінки є агресивна хірургія або пересадка печінки, які можуть успішно лікувати невеликі або повільно зростаючі пухлини, якщо вони діагностовані на ранній стадії. Однак мало пацієнтів діагностується на ранній стадії. Хіміотерапія і методи променевої терапії зазвичай не ефективні. Однак ці методи лікування застосовують для зменшення розміру пухлини, тому хірургічне втручання має більше шансів на успіх. Сорафеніб тозилат (Nexavar ®) тепер доступний для пацієнтів з раком печінки. Прогноз для пацієнтів з раком печінки, як правило, несприятливий, оскільки тільки 10-20% гепатоклітинних карцином можна видалити за допомогою хірургічного втручання. Відповідно, існує необхідність в розробці засобу, що застосовується для лікування раку печінки. [0011] В даний момент реалізується терапевтичне застосування моноклональних антитіл (mAb) (G. Kohler and C. Milstein, Nature 256:495-497 (1975)). Моноклональні антитіла в даний час затверджені як терапії при трансплантації, раку, інфекційному захворюванні, серцевосудинному захворюванні і запаленні. Різні ізотопи мають різні ежекторні функції. Такі відмінності у функції знаходять своє відображення в різних 3-мірних структурах для різних ізотопів імуноглобуліну (PM Alzari, et al., Annual Rev. Immunol., 6:555-580 (1988)). [0012] Оскільки миші зручні для імунізації і розпізнавання більшості людських антигенів як чужорідних, mAb до мішеней людини з лікувальними можливостями як правило були мишачого походження. Однак мишачі mAb мають недоліки в якості терапевтичних засобів для людини. Вони вимагають більш частого дозування, так як mAb мають більш короткий період напіввиведення у людей, ніж людські антитіла. Що ще важливіше, повторне введення мишачих антитіл в людську імунну систему викликає відповідь імунної системи людини шляхом розпізнавання мишачого білка як чужорідного і формування відповіді людськими антимишачими антитілами (HAMA). Така HAMA-відповідь може призводити до алергічної реакції і швидкого видалення мишачих антитіл із системи, таким чином, перетворюючи лікування мишачими антитілами на марне. Щоб уникнути подібних поразок, були зроблені спроби створення людських імунних систем в мишах. [0013] Перші спроби покладали надії на утворення трансгенних мишей, здатних реагувати на антигени з антитілами, що мають людські послідовності (див. Bruggemann, et al., Proc. Natl. Acad. Sci. USA 86:6709-6713 (1989)), але були обмежені кількістю ДНК, яку можна стабільно підтримувати доступними носіями для клонування. Застосування векторів для клонування на основі штучної хромосоми дріжджів (YAC) зробило перший крок до включення великих фрагментів гаметичного типу локусу Ig людини в трансгенних ссавців. Фактично, більшість генів областей V, D і J людини, розташованих на тій же відстані, що виявляються в геномі людини, що і константні області людини, були включені в мишей з використанням YAC. Одна мишача трансгенна лінія відома як миші XenoMouse® і є комерційно доступною від Amgen Fremont, Inc. (Fremont CA). Короткий опис справжнього винаходу [0014] Даний винахід дає уявлення про кон'югати антитіло-лікарський засіб (ADC), які зв'язуються з білками 161P2F10B. В деяких варіантах здійснення даний винахід включає повністю людські антитіла, кон'юговані з терапевтичним засобом. [0015] Даний винахід також дає уявлення про різні імуногенні або терапевтичні композиції, такі як кон'югати антитіло-лікарський засіб, і стратегії лікування таких форм раку, як форми раку тканин, наведених у Таблиці I. [0016] Даний винахід відноситься до: [0017] [1] Кон'югату антитіло-лікарський засіб, що містить антитіло або його антигензв'язуючий домен, який специфічно зв'язується з білком 161P2F10B, що містить амінокислотну послідовність SEQ ID NO: 2, і де антитіло містить амінокислотну послідовність VH області SEQ ID NO: 7 , з 20 по 142, і VL області SEQ ID NO: 8, з 20 по 127, і де зазначене антитіло кон'юговане з монометилауристатином F (MMAF). [0018] [2] Кон'югату антитіло-лікарський засіб [1], де антигензв'язуючим доменом є Fab, F (ab ')2 або Fv домен. [0019] [3] Кон'югату антитіло-лікарський засіб [1], де антитіло є повністю людським антитілом. [0020] [4] Кон'югату антитіло-лікарський засіб [1], який є рекомбінантно отриманим. [0021] [5] Фармацевтичної композиції, яка містить кон'югат антитіло-лікарський засіб [1] у формі людської стандартної дози. [0022] [6] Фармацевтичної композиції [5], де композиція призначена для лікування раку. [0023] [7] Фармацевтичної композиції [6], де раком є рак нирки або печінки. 2 UA 115517 C2 5 10 15 20 25 30 35 40 45 50 [0024] [8] Способу інгібування росту ракових клітин у суб'єкта, що включає: введення зазначеному суб'єкту кон'югату антитіло-лікарський засіб [1]. [0025] [9] Способу доставки цитотоксичного засобу або діагностичного засобу в клітину, що включає: забезпечення MMAF, кон'югованого (кон'югованих) з антитілом або його антигензв'язуючим доменом, який специфічно зв'язується з білком 161P2F10B, що містить амінокислотну послідовність SEQ ID NO: 2, і де антитіло містить амінокислотну послідовність V H області SEQ ID NO: 7, з 20 по 142 , і VL області SEQ ID NO: 8, з 20 по 127, для формування кон'югату антитіло-лікарський засіб, і, дію на клітину кон'югатом антитіло-лікарський засіб або фрагмент-лікарський засіб. [0026] [10] Способу лікування пухлини у ссавця, що включає лікування ссавця ефективною кількістю кон'югату антитіло-лікарський засіб [1]. [0027] [11] Способу зменшення росту пухлини у ссавця, що включає лікування ссавця ефективною кількістю комбінації кон'югату антитіло-лікарський засіб [1] та опромінення. [0028] [12] Способу зменшення росту пухлини у ссавця, що включає лікування ссавця ефективною кількістю комбінації кон'югату антитіло-лікарський засіб [1] і хіміотерапевтичного засобу. [0029] [13] Способу зменшення росту пухлини у ссавця, що включає лікування ссавця ефективною кількістю комбінації кон'югату антитіло-лікарський засіб [1] і лікарського засобу або біологічно активної терапії. [0030] [14] Способу лікування раку у ссавця, що включає лікування ссавця ефективною кількістю комбінації кон'югату антитіло-лікарський засіб [1] і хіміотерапевтичного засобу. [0031] [15] Кон'югату антитіло-лікарський засіб (ADC), де при цьому ADC має формулу L-(LUD) p, де: (a) L являє собою антитіло, що включає антитіло або його антигензв'язуючий домен, який специфічно зв'язується з білком 161P2F10B, котрий містить амінокислотну послідовність SEQ ID NO: 2, і де антитіло містить амінокислотну послідовність VH області SEQ ID NO: 7, з 20 по 142, і VL області SEQ ID NO: 8, з 20 по 127; (b) LU являє собою лінкер; (c) D являє собою ланку лікарського засобу, де лікарський засіб є монометилауристатином F (MMAF); (d) p дорівнює 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 або 12. [0032] [16] Кон'югату антитіло-лікарський засіб (ADC), де при цьому ADC має наступну формулу, де Ab-S являє собою антитіло, що включає антитіло або його антигензв’язуючий домен, який специфічно зв'язується з білком 161P2F10B, котрий містить амінокислотну послідовність SEQ ID NO: 2, і де антитіло містить амінокислотну послідовність V H області SEQ ID NO: 7, з 20 по 142, і VL області SEQ ID NO: 8, з 20 по 127; p дорівнює 1, 2, 3, 4, 5 , 6, 7, 8, 9, 10, 11 або 12. [0033] [17] Кон'югату антитіло-лікарський засіб, що містить антитіло, яке специфічно зв'язується з білком 161P2F10B, що містить амінокислотну послідовність SEQ ID NO: 2, і де антитіло містить амінокислотну послідовність важкого ланцюга SEQ ID NO: 7, з 20 по 468, та легкого ланцюга SEQ ID NO: 8, з 20 по 233, і де зазначене антитіло кон'юговано з монометилауристатином F (MMAF). [0034] [18] Кон'югату антитіло-лікарський засіб (ADC), де при цьому ADC має формулу L-(LUD) p, де: (a) L являє собою антитіло, що включає антитіло, яке специфічно зв'язується з білком 161P2F10B, котрий містить амінокислотну послідовність SEQ ID NO: 2, і де антитіло містить амінокислотну послідовність важкого ланцюга SEQ ID NO: 7, з 20 по 468, та легкого ланцюга SEQ ID NO: 8, з 20 по 233; (b) LU являє собою лінкер; (c) D являє собою ланку лікарського засобу, де лікарський засіб є монометилауристатином F (MMAF); (d) p дорівнює 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 або 12. [0035] [19] Кон'югату антитіло-лікарський засіб (ADC), де при цьому ADC має наступну формулу, де Ab-S являє собою антитіло, що включає антитіло, яке специфічно зв'язується з білком 161P2F10B, котрий містить амінокислотну послідовність SEQ ID NO: 2, і де антитіло містить амінокислотну послідовність важкого ланцюга SEQ ID NO: 7, з 20 по 468, та легкого ланцюга SEQ ID NO: 8, з 20 по 233; p дорівнює 1, 2, 3, 4, 5, 6, 7, 8 , 9, 10, 11 або 12. 3 UA 115517 C2 Ab S O N O 5 10 15 20 25 30 35 40 45 50 O H N N O O H N N N O O O O O OH p Короткий опис фігур [0036] Фігура 1. кДНК та амінокислотна послідовність 161P2F10B показані на Фігурі 1. Відкрита рамка зчитування йде від 44 по 2671 нуклеїнову кислоту, включаючи стоп-кодон. [0037] Фігура 2. Нуклеїнова кислота і амінокислотні послідовності антитіл 161P2F10B. [0038] Фігура 2A. кДНК і амінокислотна послідовність важкого ланцюга H16-7.8. Підкреслено послідовність, яка лідирує, і двічі підкреслено варіабельну область важкого ланцюга. Пунктирне підкреслення показує константну область IgG2людини. [0039] Фігура 2B. кДНК і амінокислотна послідовність легкого ланцюга H16-7.8. Підкреслено послідовність, яка лідирує, і двічі підкреслено варіабельну область легкого ланцюга. Пунктирне підкреслення показує константну область капа-ланцюга Ig людини. [0040] Фігура 3. Амінокислотні послідовності антитіл 161P2F10B. [0041] Фігура 3A. Амінокислотна послідовність важкого ланцюга H16-7.8. Підкреслено послідовність, яка лідирує, і двічі підкреслено варіабельну область важкого ланцюга. Пунктирне підкреслення показує константну область IgG2 людини. [0042] Фігура 3B. Амінокислотна послідовність легкого ланцюга H16-7.8. Підкреслено послідовність, яка лідирує, і двічі підкреслено варіабельну область легкого ланцюга. Пунктирне підкреслення показує константну область капа-ланцюга Ig людини. [0043] Фігура 4. Вирівнювання антитіл H16-7.8 з зародковою лінією людини. [0044] Фігура 4A. Вирівнювання легкого ланцюга H16-7.8 з VH4-31/D5-12/JH6 зародкової лінії людини. [0045] Фігура 4B. Вирівнювання легкого ланцюга H16-7.8 з A26/JK1 зародкової лінії людини. [0046] Фігура 5. Рекомбінантна експресія H16-7.8 в CHО-клітинах. Послідовності важкого і легкого ланцюга H16-7.8 клонували у вектори експресії. Вектори трансфікували в CHO-клітини. 3T3-контрольні і клітини 3T3-161P2F10B фарбували за допомогою H16-7.8, одержаних, або з клітин гібридоми, або з CHO-клітин. Зв'язування реєстрували проточною цитометрією. Результати показують, що H16-7.8, рекомбінантно експресоване в CHO-клітинах, секретується і специфічно зв'язується з 161P2F10B на клітинній поверхні. [0047] Фігура 6. Клітинне зв'язування і афінність H16-7.8 та H16-7.8mcMMAF. H16-7.8 та H167.8mcMMAF тестували у відношенні зв'язувальної афінності до 161P2F10B, що ендогенно експресуються на клітинах Ku812. Стисло, одинадцять (11) розведень H16-7.8 або H167.8mcMMAF інкубували з клітинами Ku812 (50000 клітин на лунку) протягом ночі за 4 °C у кінцевій концентрації від 160нM до 0,0001 нМ. В кінці інкубації клітини відмивали і інкубували з ідентифікуючим антитілом до hlgG-PE протягом 45 хв за 4 °C. Після відмивання незв'язаних ідентифікуючих антитіл, клітини аналізували за допомогою FACS. Отримали значення середньої інтенсивності флуоресценції (MFI) (див. Таблицю IV). Значення MFI були введені в програмне забезпечення Graphpad Prisim та проаналізовані з використанням рівняння для одного сайту зв'язування (гіперболи) Y = Bmax * X / (Kd + X) для побудови кривих насиченості H16-7.8 або H16-7.8mcMMAF, показаних на Фігурі 6. Bmax - це величина MFI при максимальному зв'язуванні H16-7.8 або H16-7.8mcMMAF з 161P2F10B; Kd є афінністю зв'язування H16-7.8 або H16-7.8mcMMAF, яка являє собою концентрацію H16-7.8 або H167.8mcMMAF, необхідну для досягнення напівмаксимального зв'язування . Обчислена афінність (Kd) H16-7.8 та H16-7.8mcMMAF становить 0,06 нМ і 0,19 нМ, відповідно, по 161P2F10B, що ендогенно експресується на поверхні клітин Ku812. [0048] Фігура 7. Зв'язування H16-7.8 і H16-7.8mcMMAF з раковими нирковими клітинами. Людські клітини UGK-3 (світлоклітинний рак нирки від пацієнта) і клітини RXF-393 (світлоклітинний рак нирки) були пофарбовані за допомогою 10 мкг/мл нативних H16-7.8, H167.8mcMMAF або ізотипічного контролю людського IgG2 та проаналізовані за допомогою FACS. Результати на Фігурі 7 (ліві секції) демонструють сильне фарбування двох різних ниркових пухлинних клітин за допомогою H16-7.8 (сірі лінії), але не контрольним MAb (жирні гістограми). Секції справа демонструють подібне сильне фарбування тих же ниркових пухлинних клітин за допомогою H16-7.8mcMMAF (сірі лінії). (Фігура 7; праві секції). Ці результати показують, що як H16-7.8, так і H16-7.8mcMMAF зв'язують нативний антиген 161P2F10B, експресований на поверхні людських ракових клітин. Кон'югація нативного H16-7.8 з утворенням H16-7.8mcMMAF 4 UA 115517 C2 5 10 15 20 25 30 35 40 45 50 55 не змінювала зв'язування на клітинній поверхні з нативним антигеном 161P2F10B, експресованим на людських ракових клітинах. [0049] Фігура 8. Клітинна цитотоксичність за участі H16-7.8mcMMAF. 2000 життєздатних клітин KU812 висівали у трьох екземплярах у 0 день і дозволяли відновитися протягом ночі. На наступний день додавали серійні розведення 1:4 різних партій H16-7.8mcMMAF або контрольних MAb, кон'югованих з mcMMAF, додали з отриманням кінцевих концентрацій. Клітини залишили інкубуватися протягом шести (6) днів, після чого в кожну лунку додали 20 мкл Alamar blue. Планшети інкубували протягом додаткових чотири (4) годин та інтенсивність флуоресценції вимірювали на флуоресцентному планшетному рідері, використовуючи довжину хвилі збудження 540 нм і довжину хвилі емісії 620 нм. Результати демонструють, що обидві партії H16-7.8mcMMAF потужно інгібували проліферацію клітин KU812. Визначили, що IC 50 становіть 0,2 нМ та 0,1 нМ для партій (1) і партії (2), відповідно. Повністю людське контрольне MAb, яке не зв'язує клітини KU812, кон'югували з mcMMAF з отриманням DAR 3,9 (+ / - 0,2). Контрольний ADC (контрольний mcF) не інгібував клітинну проліферацію KU812, додатково демонструючи специфічність цитотоксичності. Таким чином, ці результати показують, що H167.8mcMMAF може вибірково доставляти цитотоксичний лікарський засіб до клітин, які експресують 161P2F10B, викликаючи їх загибель. [0050] Фігура 9. Ефективність H16-7.8mcMMAF в підшкірно утвореному ксенотрансплантаті людського раку нирки UG-K3 у SCID-мишей. В цьому експерименті отриманий у пацієнта ксенотрансплантат раку нирки людини UG-K3 підтримували серійними пасажами у SCID-мишей. Вихідні пухлини були отримані в стерильних умовах і подрібнені на дрібні шматочки. Шматочки пухлин ферментативно розщепили до одноклітинних суспензій з використанням Liberase 6 Blendzyme (Roche Applied Science, Індіанаполіс, Індіана). 1,5 x10 клітин вводили в боки окремих SCID-мишей, і пухлинам дозволили рости без обробки доти, поки вони не досягли приблизного 3 об’єму 100 мм . Тварини були випадково розподілені по наступним групам: група, що обробляється H16-7.8mcMMAF, контрольна H16-7.8 і контрольна 5% декстроза. H167.8mcMMAF та H16-7.8 вводили в дозі 10 мг/кг один раз на 0 день внутрішньовенним струменевим введенням. Кількість введеного H16-7.8mcMMAF і H16-7.8 була заснована на індивідуальній масі кожної тварини, отриманій безпосередньо перед введенням дози. Контрольну 5% декстрозу вводили в дозі 150 мкл на тварину. Зростання пухлини відстежували за допомогою вимірів штангенциркулем кожні 3-4 дні до кінця дослідження. Об’єм пухлини 2 розраховують як Ширина xДовжина/2, де ширина - це найменший вимір, а довжина найбільший. Тварини контрольних груп були гуманно піддані евтаназії, коли пухлини досягли 3 приблизно 1000 мм . Тварин в групі, яку оброблювали H16-7.8mcMMAF, відстежували протягом додаткових двох тижнів перед умертвінням. Статистичний аналіз був проведений в останній момент часу, коли стали доступні дані обох контрольних груп, з використанням критерію Крускала-Уолліса з α = 0,05. [0051] Результати продемонстрували, що лікування світлоклітинних ниркових ксенотрансплантатних пухлин UG-K3 з використанням H16-7.8mcMMAF в усіх досліджених дозах і режимах, призводило до значного інгібування росту пухлини у SCID-мишей. [0052] Фігура 10. Інгібування росту утворених ортотопічних ксенотрансплантатів UG-K3 за допомогою H16-7.8mcMMAF. Здатність H16-7.8mcMMAF інгібувати ріст утворених пухлин нирки, вирощених ортотопічно, була оцінена з використанням отриманих від пацієнтів пухлинних ксенотрансплантатів UG-K3. Стисло, вихідні маси пухлин UG-K3 розщепили ферментативно і 1,5 мільйона життєздатних клітин були хірургічно імплантовані в нирки самців SCID-мишей в 0 день. Пухлинам дозволили рости протягом 7 днів, після чого тварини були випадково розподілені по 4 різним групам обробки (n = 10 на групу). Тварини, випадково розподілені в групу A, отримували контрольні ADC в кількості 5 мг/кг, групу B, отримували H16-7.8mcMMAF в кількості 3 мг/кг, і групу C. отримували H16-7.8mcMMAF в кількості 5мг/кг, що вводяться кожні 4 дні до загальної кількості 4 дози. Група D отримувала H16-7.8mcMMAF в кількості 10 мг/кг одноразово. В кінці дослідження (41 день) тварин забили, і праву і ліву нирки зважували на електронних вагах. Маси пухлин, нанесені на графік, були визначені шляхом віднімання ваги безпухлинної протилежної нирки від ваги правої нирки, що несе пухлину. [0053] Результати демонстрували, що обробка світлоклітинних ниркових ксенотрансплантантних пухлин UG-K3 з використанням H16-7.8mcMMAF у всіх досліджених дозах і режимах призводила до значного інгібування росту пухлини. Маси пухлин у всіх групах, котрі оброблювали H16-7.8mcMMAF (B, C, і D), були менше 1% мас пухлин у контрольній оброблюваній групі. Ці відмінності були високо статистично достовірні (p
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody drug conjugates (adc) that bind to 161p2f10b proteins
Автори англійськоюTorgov, Michael, Morrison, Robert, Kendall, Jakobovits, Aya, Gudas, Jean, An, Zili
Автори російськоюТоргов Майкл, Моррисон Роберт Кендалл, Якобовиц Айя, Гудас Джин, Ан Зили
МПК / Мітки
МПК: C07K 16/18, A61K 39/395
Мітки: кон'югат, засіб, зв'язується, антитіло-лікарський, adc, 161p2f10b, білком
Код посилання
<a href="https://ua.patents.su/86-115517-konyugat-antitilo-likarskijj-zasib-adc-yakijj-zvyazuehtsya-z-bilkom-161p2f10b.html" target="_blank" rel="follow" title="База патентів України">Кон’югат антитіло-лікарський засіб (adc), який зв’язується з білком 161p2f10b</a>
Попередній патент: Декоративний годинник
Наступний патент: Пристрій для подачі доїльної склянки до тварини, спосіб подачі доїльної склянки до тварини і обертова платформа, яка містить цей пристрій
Випадковий патент: Пристрій для наведення компоновки противикидного обладнання на устя фонтануючої свердловини


























































































