Рідка форма г-ксф
Формула / Реферат
1. Медикамент, що являє собою водну рідку форму гранулоцитарно-колонієстимулюючого фактора (Г-КСФ), яка складається з Г-КСФ та цукрового спирту, поверхнево активної речовини у концентрації 0,05-0,06 мг/мл, ацетату у концентрації 5-20 мМоль як буферну речовину із рівнем рН 4,15-4,3.
2. Медикамент за п. 1, який відрізняється тим, що містить амінокислоти та/або гліцерин, та/або вуглеводи, та/або консервувальні речовини.
3. Медикамент за п. 1 або 2, який відрізняється тим, що Г-КСФ неглікований.
4. Медикамент за будь-яким з пп. 1-3, який відрізняється тим, що концентрація Г-КСФ складає 0,6 мг/мл.
5. Медикамент за будь-яким з пп. 1-4, який відрізняється тим, що поверхнево-активною речовиною є полісорбат.
6. Медикамент за будь-яким з пп. 1-5, який відрізняється тим, що цукровим спиртом є сорбіт.
7. Медикамент за будь-яким з пп. 1-6, який відрізняється тим, що концентрація цукрового спирту складає 5 % (вага/об'єм).
8. Медикамент за будь-яким з пп. 1-7, який відрізняється тим, що концентрація ацетату складає приблизно 10 мМоль.
9. Медикамент за будь-яким з пп. 1-8, який відрізняється тим, що переважно не містить амінокислот та/або додаткових білків.
10. Медикамент за будь-яким з пп. 1-9, який відрізняється тим, що є розчином для ін'єкцій або інфузій.
11. Медикамент, що містить водну рідку форму Г-КСФ як розчин для ін'єкцій або інфузій, який складається з людського неглікованого метіонілу Г-КСФ у концентрації 0,6 мг/мл та сорбіту у концентрації 5 % (вага/об'єм), полісорбату 80 у концентрації 0,05-0,06 мг/мл та ацетату у концентрації приблизно 10 мМоль як буферної речовини із рівнем рН 4,2±0,15.
12. Медикамент за будь-яким з пп. 1-11 для лікування раку, тяжкої хронічної нейропенії (ТХН), ВІЛ інфекцій, порушень центральної нервової системи, побічних ефектів від цитотоксичної хіміотерапії, або супутньої терапії хвороб, де потребується мобілізація периферійних кров'яних клітин-попередників.
13. Ємкість для введення рідких медикаментів, що представляють рідку медичну форму за будь-яким з пп. 1-11.
14. Ємкість за п. 13, яка відрізняється тим, що принаймні одна поверхня вказаної ємкості, що контактує із рідким препаратом, вкрита матеріалом, що містить силікон, або полімери політетрафторетилен або етилен-тетрафторетилен (ЕТФЕ).
15. Ємкість за п. 13 або 14, яка відрізняється тим, що являє собою шприц, ампулу, карпулу або контейнер для інфузій.
16. Ємкість за п. 15, яка відрізняється тим, що містить рідку форму, у концентрації 0,3 мг у 0,5 мл або 0,48 у 0,8 мл, стосовно концентрації Г-КСФ.
17. Набір для парентерального введення Г-КСФ, що містить ємкість за будь-яким з пп. 13-16, а також інструкції щодо зберігання та/або застосування.
18. Набір за п. 17, який відрізняється тим, що введення Г-КСФ передбачено у дозах 5-30 мкг/кг ваги тіла.
19. Набір за пп. 17, 18, який відрізняється тим, що містить 5 шприців або ампул.
20. Набір за будь-яким з пп. 17-19, який відрізняється тим, що містить безпечні відділення для шприців та голок для ін'єкцій та/або інфузій відповідно.
21. Набір за будь-яким з пп. 17-20, який відрізняється тим, що передбачено його зберігання при температурі 5 °C.
Текст
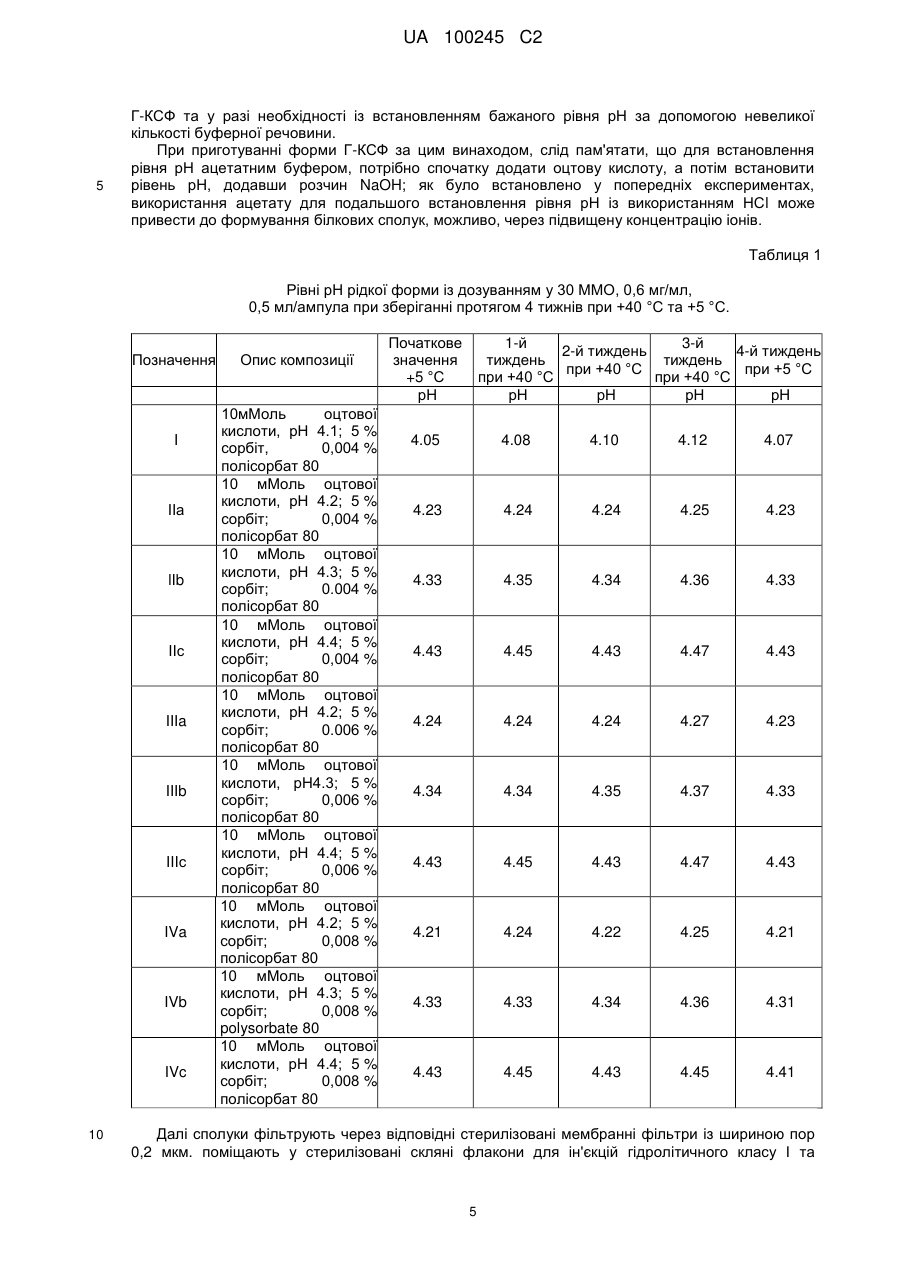
Реферат: Винахід стосується фармацевтичної рідкої форми Г-КСФ, яка містить Г-КСФ, цукровий спирт, ПАР у концентрації 0,05-0,06 мг/мл, ацетат у концентрації 5-20 мМоль як буферну речовину із рівнем рН 4,15-4,3. UA 100245 C2 (12) UA 100245 C2 UA 100245 C2 5 10 15 20 25 30 35 40 45 50 55 Об'єктом цього винаходу є стійкі, водні рідкі форми Г-КСФ, що головним чином складаються з Г-КСФ та цукрового спирту, поверхнево-активної речовини, буферної речовини із рівнем рН приблизно 4,1-4,4, та іноді амінокислот, та/або гліцерину, та/або вуглеводів, та/або консервувальних речовин. Багато з відомих на теперішній час лікарських форм білкових агентів мають недоліки. Наприклад, деякі препарати містять фармацевтичні добавки та допоміжні речовини, що не можуть бути категорично визначені як шкідливі з медичної точки зору. Через своє походження та фізико-хімічні властивості, полімери та білки мають деякий потенційний ризик стосовно їх придатності як фармацевтичних добавок. Білки людського та тваринного походження, а також білки, отримані з культур клітин, мають потенційний залишковий ризик виникнення вірусного зараження. Через свої антигенні властивості, інші зараження, подібні до білкових, які важко визначити аналітичним шляхом, також можуть викликати імунологічні реакції у людей. Більш того, білки тваринного походження можуть викликати імунологічні реакції у людей через свої властивості, характерні для окремих видів, в загалі. Також можливі віддалені реакції при повторному вживанні таких білків через деякий час. Поєднання сумішей із великою молекулярною масою також може привести до виникнення проблем. Полімери можуть накопичуватись в організмі через свою велику молекулярну масу та, таким чином, залишатись в організмі протягом тривалого часу, у випадку відсутності процесу біологічного розпаду. Це становить загрозу, особливо, при підшкірному застосуванні, тому що всмоктування та розповсюдження речовин потоком крові займає набагато більше часу, ніж при внутрішньовенному застосуванні. Залежно від молярної маси, полімери також можуть мати антигенні властивості. Крім того, домогтись чистоти полімерів важко через каталізатори, що використовуються у виробництві, або через наявність мономерів та інших фрагментів полімерів. Тому потрібно уникати використання полімерів у рідкій лікарській формі, наскільки це можливо, особливо із лікарськими формами, що застосовуються підшкірно. Крім того, як вказано у літературі, особливо негліковані форми Г-КСФ у порівнянні із глікованими формами Г-КСФ, отриманими з яйцеклітин китайських хом'яків, є дуже нестійкими через процеси окиснення та/або агрегації. Тому дуже важко стабілізувати негліковані форми ГКСФ та потрібно вживати спеціально розроблені заходи для приведення цієї молекули до стійкої лікарської форми. Використання поверхнево-активних речовин для стабілізування Г-КСФ з медичної точки зору в основному потрібно уникати, тому що поверхнево-активні речовини можуть призводити до виникнення місцевих подразнень. Форми із дуже низьким рівнем рН, особливо при підшкірному застосуванні, також можуть викликати місцеву несумісність у пацієнтів, наприклад, біль та місцеві подразнення тканин, тому що зазначений рівень рН нижчий за фізіологічний рівень рН від 7,0 до 7,5, присутній у тканинах. Нещодавно опублікована міжнародна заявка WO 2005/042024, подібна до інструкції ЕР 373 679, пропонує спосіб отримання стійких фармацевтичних сумішей Г-КСФ уникаючи додання до вказаних сумішей, окрім іншого, поверхнево-активних речовин, та, відповідно до сумішей, описаних у Прикладах, додаючи буферні речовини у дуже низькій концентрації. Немає інформації щодо переносимості медикаментів, описаних у заяві. У європейській патентній заявці ЕР 1 129 720 описується приготування Г-КСФ із рівнем рН у діапазони від 5 до 8, де сульфат повинен стабілізувати Г-КСФ, що міститься у препараті. Та знову, немає відомостей про переносимість препаратів Г-КСФ, описаних у заяві. Проблема, що знаходиться в основі цього винаходу, полягає у запропонуванні рідкої лікарської форми для Г-КСФ із відсутністю зазначених вище недоліків лікарських форм, відомих на цей час. Зокрема, фармацевтичний препарат повинен залишатись стійким протягом тривалого часу, а також бути прийнятним фізіологічно. Також він повинен бути зручним для самостійного використання пацієнтами та характеризуватись відсутністю викликання небажаних подразнень шкіри та болю у місці ін'єкцій, що часто трапляються при самостійному вживанні медикаментів шляхом ін'єкції або інфузії. Проблему вирішено за допомогою зразків, вказаних у патентних формах, та проілюстровано у подальших зразках. Зокрема, цей винахід стосується стійкої, водної рідкої форми Г-КСФ, що головним чином складається з Г-КСФ та цукрового спирту, поверхнево-активної речовини у концентрації приблизно 0,04-0,06 мг/мл, ацетату у концентрації приблизно 5-20 мМоль у якості буферної речовини із рівнем рН приблизно 4,1-4,4. Додатково можуть використовуватись амінокислоти, та/або гліцерин, та/або вуглеводи, та/або консервувальні речовини. Крім того, згідно із цим винаходом, рідка форма може містити додаткові фармацевтично прийнятні добавки. Однак, відсутність вказаних та/або інших добавок є кращою. 1 UA 100245 C2 5 10 15 20 25 30 35 40 45 50 55 У міжнародній заявці W0 94/14466, в основному представлено стійкі при зберіганні водні фармацевтичні препарати Г-КСФ, які повинні залишатись стійкими при рівні рН від 3,5-5 до 7-8 із використанням різних буферних систем. Однак, тільки рідкі препарати Г-КСФ із фосфатним буфером були протестовані щодо їхньої стійкості при зберіганні, коли окремі експериментальні препарати із іншими буферами були протестовані тільки після невеликого механічного струсу, тобто взмучування для появи мутності у зразках. У ході експериментів, проведених у межах цього винаходу, потрібно було визначити, що форми Г-КСФ, які було помічено ацетатним буфером у Прикладах W0 94/14466, особливо у формі 4, що містить 20 мМоль ацетату із рівнем рН 4,5, не мають бажаної стійкості, через те, були визначені критичні значення для утворення сполук та окиснених форм Г-КСФ. Відповідно, було спочатку визначено, що, як було показано в заявці ЕР 0 373 679, значення рН вище 4,0 призводить до формування сполук, а рідкої форми Г-КСФ із фізіологічно прийнятним рівнем рН, не можливо досягти з використанням ацетатної буферної системи, яка є кращою з точки зору інших параметрів. У міжнародній заявці WO 2005/039620 рідкі форми Г-КСФ із вмістом 0,6 мл/мл Г-КСФ, 10 мМоль ацетатного буферу, 0,004 % (вага/об'єм) твін 80 та 5 % (вага/об'єм) сорбіту із рівнем рН 4.0 та 4.2 використовувались як речовини для порівняння стійкості форм Г-КСФ під впливом механічного струсу та після замороження та розмороження препаратів Г-КСФ із сукцинатним буфером із рівнем рН 5.0 та 0,02 % (вага/об'єм) твін 20. Згідно із цими дослідженнями препарати Г-КСФ із ацетатним буфером були менш стійкими, тому подальше вивчення таких ацетатно-буферних сполук не вбачалось доцільним, як і розглядання їх у якості підходящих медикаментів. Але незважаючи на це, у ході експериментів, проведених у межах цього винаходу, на диво були відмічені позитивні властивості форм Г-КСФ із ацетатним буфером із рН>4,0 щодо їх стійкості при температурі зберігання у холодильнику та при 40 °C, тобто у межах температури тіла, також було відмічено на диво добру переносимість у пацієнтів, як наприклад, менше подразнень шкіри, у порівнянні із медикаментами, доступними у продажу. Зокрема, було встановлено, у межах цього винаходу, що поєднання оцтової кислоти та ацетату, відповідно у якості буферної речовини та поверхнево-активної речовини, такої як полісорбат 80, в особливій концентрації кожна, та з доданням цукрового спирту, наприклад, сорбіту, із встановленням рівня рН біля 4,2+0.15, дає рідку форму Г-КСФ, що надає молекулам Г-КСФ стійкість, необхідну для утворення медикаменту. Ця форма добре переноситься та майже повністю запобігає виникненню симптомів, які часто можна помічати на місці введення медикаменту. Це робить рідку форму Г-КСФ за цим винаходом підходящою та ефективною для використання за допомогою готових шприців та наборів, що надаються разом із препаратом, особливо для застосування вдома. Рідкі форми за цим винаходом, також мають перевагу, завдяки тому що в них майже не містяться білковоподібні та полімерні допоміжні речовини, використання яких може бути проблематичним з медичної точки зору. Згідно із клінічними дослідженнями, вказаними у Прикладах, вони також добре переносяться та вживаються, майже не викликаючи болі. В одному зразку рідка форма за цим винаходом не містить метіонину. Під час біохімічних експериментів та клінічних досліджень було виявлено ще одну перевагу: завдяки вибору буферної речовини в особливих концентраціях та із доданням цукрового спирту, потрібно додавати малі об'єми поверхнево-активних речовин -приблизно 0,04-0,06 мг/мл, які з одного боку є достатніми для стабілізації Г-КСФ та з іншого боку, не викликають значних подразнень шкіри або іншу непереносимість у пацієнтів. Це є особливою перевагою у таких рідких лікарських формах, які створюються для підшкірного застосування. Крім того, за допомогою засобів, передбачених цим винаходом, особливо нестійкі, негліковані молекули ГКСФ приймають стійку форму, достатню для фармацевтичних сполук. Цільовий вибір допоміжних речовин дає дуже добре переносимі рідкі лікарські препарати із вмістом Г-КСФ, які мають високу якість у відношенні стійкості білку та особливо підходять для використання за допомогою готових засобів для інєкцій та інфузій. У рідких формах за цим винаходом вміст поверхнево-активних речовин варіюється від 0,05 до 0,06 мг/мл, особливо оптимальним вмістом є приблизно 0,06 мг/мл. Серед вживаних поверхнево-активних речовин перевага віддається полісорбату, особливо полісобрату 80, також відомому як Твін 80©. Лікарські форми із вмістом Г-КСФ відповідно до цього винаходу містять агент у кількості, достатній для отримання терапевтичного ефекту. Зазвичай, використовуються концентрації агенту від 0,01 до 5 мг/мл, особливо 0,1-1 мг/мл, 0,3-0,8 мг/мл, та найкраще додавати у 2 UA 100245 C2 5 10 15 20 25 30 35 40 45 50 55 60 концентрації приблизно 0,06 мг/мл. Зокрема при підшкірному застосуванні, найкращими виявились дозування 0,3 мг/0,5 мл та 0,4 8мг/0,8 мл. Згідно із цим винаходом, у якості буферної речовини використовується оцтова кислота. При виготовленні рідкої форми відповідно до цього винаходу буферна речовина подається у формі вільної кислоти. Бажаний рівень рН сполуки встановлюється за допомогою додавання основ, наприклад, гідроксидів лужних та лужно-земельних металів або гідроокису амонію. З цієї мети краще використовувати гідроксид натрію. Концентрації буферної речовини оцтової кислоти у готових рідких лікарських формах становлять приблизно 5-20 мМоль/л. Для спрощення, надалі будемо звертатись до аніонних концентрацій вказаної кислоти, тобто оцтової. Термін "оцтова" також включає недисоціойвану оцтову кислоту. Переважно використовуються такі концентрації буферної речовини та рівень рН: 7,5-15 мМоль, особливо 10 мМоль оцтової кислоти та рН 4,1-4,4; переважно рН 4,15-4,3, та особливо рН 4,2. Г-КСФ, який використовується у рідких формах відповідно до цього винаходу, в основному має відношення до молекул Г-КСФ, отриманих за допомогою рекомбінантних методів, а також їхніх різновидів. Поняття Г-КСФ або різновид Г-КСФ за цим винаходом включають всі різновиди Г-КСФ, що зустрічаються у природі, а також білки Г-КСФ, отримані з них та змінені за допомогою технологій рекомбінації ДНК, зокрема гібридні білки, що також містять й інші послідовності білків, окрім частки Г-КСФ. Зокрема кращим у цьому значенні є мутеін Г-КСФ із N-термінальним залишком метоніну в положенні -1, який отримується через експресією клітин-прокаріотів. Також є підходящим різновид Г-КСФ без вмісту метоніну, що може бути отриманий відповідно до WO 91/11520. Поняття "різновид Г-КСФ" служить для визначення молекул Г-КСФ, у яких одна або більше амінокислот можуть бути видалені або замінені іншими амінокислотами, але якщо основні характеристики Г-КСФ залишаються без змін у великій мірі. Підходящі мутеіни Г-КСФ описані, наприклад, у заявці ЕР 0 45 6 200. Краще, якщо Г-КСФ, присутній у рідких формах відповідно до цього винаходу, є неглікованим. Для приготування прийнятної парентеральної лікарської форми можна використовувати добавки ізотонізованих допоміжних речовин, якщо ізотонії вдається досягти тільки завдяки осмотичним якостям агенту та допоміжних речовин, вживаних для стабілізації. З цієї мети, застосовуються особливо неіонізовані, добре переносимі допоміжні речовини, як наприклад маннітол, гліцерин або цукровий спирт. Для Г-КСФ віддається перевага сорбіту, який є особливо найкращим для переносимості рідких форм відповідно до цього винаходу. Оптимальна концентрація цукрового спирту у рідкій формі варіюється від приблизно 2,5 до 7,5 % (вага/об'єм), та найбільш оптимальною концентрацією є приблизно 5 % (вага/об'єм). Додавання солей для регулювання ізотонії не є кращим вибором, тому що солі та іони сприяють агрегації Г-КСФ. Тому солі краще додавати у невеликих дозах. Концентрації буферних речовин обираються таким чином, щоб стабілізувати рівень рН, а іонну силу утримувати на найнижчому можливому рівні. Оптимальні буферні концентрації складають до 2 0 мМоль, особливо оптимальною концентрацією є менше 15 мМоль. Крім того, готові суміші для ін'єкцій можуть містити наступні звичайні допоміжні речовини або добавки. Можна додавати такі антиоксиданти, як, наприклад, глутатіон, аскорбінова кислота або подібні речовини, як, наприклад, сечовина або такі амінокислоти, як метіонин, аргінін, лізин, орнітин тощо. У найбільш оптимальних зразках, водна рідка форма Г-КСФ відповідно до цього винаходу виготовляється у формі сумішей для ін'єкцій або інфузій та головним чином складається з людського неглікованого метіонілу-Г-КСФ у приблизній концентрації 0,6 мг/мл та сорбіту у приблизній концентрації 5 % (вага/об'єм), полісорбату 80 у приблизній концентрації 0,06 мг/мл, ацетату у приблизній концентрації 10 мМоль у якості буферної речовини при рівні рН приблизно 4.2. В інших аспектах та при тієї ж інтенсивності дозування, рідкі форми Г-КСФ відповідно до цього винаходу можуть використовуватись згідно із інструкцією до Нейпогену©, зокрема щодо дозування, застосування та медичного призначення, тому що у рідких формах цього винаходу слід вживати високо очищений, неглікований білок Г-КСФ типу філграстиму, виведеної у лабораторії культури Е. coli K12, Рідкі форми за цим винаходом часто використовуються у якості медикаментів для лікування захворювань, для лікування яких застосовується Г-КСФ, таких як рак, побічні ефекти, викликані цитотоксичною хіміотерапією, супутньою терапією хвороб, у якій виникає потреба в мобілізації периферійних кров'яних клітин-попередників, при тяжкій хронічній нейтропенії (ТХН), ВІЛ інфекціях та подібних захворюваннях. Відповідно, цей винахід зокрема відноситься до медикаментів, що містить одну з вищевказаних рідких форм Г-КСФ. 3 UA 100245 C2 5 10 15 20 25 30 35 40 45 50 55 В одному із зразків суміш Г-КСФ за цим винаходом призначена для приготування медикаментів для лікування таких неврологічних захворювань, як розладу центральної нервової системи, що є наслідком, наприклад, гострого порушення мозкового кровообігу, де похідні порушення можна полегшити або попередити за допомогою ранніх ін'єкцій, наприклад, у формі болюсів. В інших випадках рідкі форми за цим винаходом призначаються як медикаменти переважно для підшкірного та внутрішньовенного застосування, наприклад за у вигляді ін'єкцій за допомогою шприців-ручок або інфузій, якщо бажаним є довгострокове застосування Г-КСФ. Як було зазначено вище, рідка форма Г-КСФ за цим винаходом є стійкою протягом довгого періоду часу та загалом може зберігатись у будь-якій підходящій ємкості. Відповідно, цей винахід також стосується ємкості, що містить одну з рідких форм Г-КСФ, описаних вище у Прикладах. Бажано, щоб хоча б одна з поверхонь ємкості, яка контактує із рідкою формою, була вкрита матеріалом, що складається з політетрафторетилену або етилену-тетрафторетилену (ЕТФЕ). Типово, ємкістю є контейнер, що зазвичай використовується для зберігання та/або введення рідкого медикаменту, як, наприклад, флакон, шприц, ампула, карпула або ємкість для інфузій, де рідка форма Г-КСФ за цим винаходом спеціально призначена для використання у шприцах-ручках та ампулах. В обраному зразку рідка форма міститься у шприці або ампулі у концентрації, це стосується концентрації Г-КСФ, 0,3 мг у 0,5 мл або 0,4 8 мг у 0,8 мл. З огляду на те, що рідка форма Г-КСФ за цим винаходом не потребує додання додаткових допоміжних речовин або проведення заходів подальшого приготування, як фільтрація, змішування, тощо, рідкий препарат Г-КСФ за цим винаходом може бути приготований для безпосереднього застосування, наприклад, у медичному наборі. У зразку, який особливо підходить для терапевтів, фармацевтів та зокрема пацієнтів, цей винахід включає набір для парентерального застосування Г-КСФ, до якого входить одна або більше ємкостей, зазначених вище, переважно із інструкціями щодо зберігання та/або застосування. Зазвичай, Г-КСФ призначається у дозуванні від 5 до 30 г/кг ваги тіла, хоча можуть призначатись більші або менші дози, залежно від медичних вказівок та стадії захворювання. Набір за цим винаходом переважно містить 5 шприців або ампул, іноді більше - 7 шприців або ампул - наприклад, у випадку призначення застосування медикаменту кожного дня протягом тижня. Для забезпечення безпечного користування, набір за цим винаходом містить безпечні відділення для шприців та голок для ін'єкцій та/або інфузій відповідно. Тут також потрібно брати до уваги засоби безпечного від'єднання для голок та підготовлених або завчасно встановлених ущільнювальних кришечок. Як зазначено у Прикладах, рідкі препарати Г-КСФ за цим винаходом залишаються стійкими протягом довгого терміну, особливо при 5 °C, оптимально протягом щонайменше 4 тижнів. Тому перевага рідких препаратів, ємкостей та наборів за цим винаходом полягає у тому, що їх можна зберігати у звичайному холодильнику. Ці та інші зразки відповідно до цього винаходу вказані у патентних формах. Розкриття документів прототипів, наведених вище або далі, у цій заяві представлено у вигляді посилань, зокрема щодо рекомбінантної продукції Г-КСФ, буферних речовин, шприців та наборів. Ці та інші зразки є відкритими та доступними особам, кваліфікованим у цій сфері, та наведені в описанні та Прикладах цього винаходу. Джерелом додаткової літератури стосовно вищевказаних допоміжних речовин, а також електронних засобів, що можуть використовуватись відповідно до цього винаходу, можуть бути документи прототипів, наприклад, з публічних бібліотек, електронних засобів. Окрім того, в мережі Інтернет доступні наступні відкриті бази даних, як, наприклад "PubMed" (http://www.pubmed.gov). Технології виготовлення цього винаходу відомі особам, кваліфікованим у цій сфері. Ці технології можна знайти у відповідній літературі, наприклад: Molecular Cloning A Laboratory Manual, 2nd Ed., ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press: 1989); Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and C. C. Blackwell, eds., 1986). Приклади Далі у заяві, цей винахід представлений за допомогою оптимального зразку, який проте ніяким чином не обмежує об'єкт цього винаходу. Приклад 1: Приготування рідкого препарату Г-КСФ Суміші Г-КСФ, використані у Прикладах, були приготовлені розчиненням вищевказаних допоміжних речовин у воді для створення речовини для ін'єкцій із доданням зазначеної кількості 4 UA 100245 C2 5 Г-КСФ та у разі необхідності із встановленням бажаного рівня рН за допомогою невеликої кількості буферної речовини. При приготуванні форми Г-КСФ за цим винаходом, слід пам'ятати, що для встановлення рівня рН ацетатним буфером, потрібно спочатку додати оцтову кислоту, а потім встановити рівень рН, додавши розчин NaOH; як було встановлено у попередніх експериментах, використання ацетату для подальшого встановлення рівня рН із використанням НСl може привести до формування білкових сполук, можливо, через підвищену концентрацію іонів. Таблиця 1 Рівні рН рідкої форми із дозуванням у 30 ММО, 0,6 мг/мл, 0,5 мл/ампула при зберіганні протягом 4 тижнів при +40 °C та +5 °C. Позначення I IIа lIb IIс IIIa IIIb IIIс IVa IVb IVc 10 Опис композиції 10мМоль оцтової кислоти, рН 4.1; 5 % сорбіт, 0,004 % полісорбат 80 10 мМоль оцтової кислоти, рН 4.2; 5 % сорбіт; 0,004 % полісорбат 80 10 мМоль оцтової кислоти, рН 4.3; 5 % сорбіт; 0.004 % полісорбат 80 10 мМоль оцтової кислоти, рН 4.4; 5 % сорбіт; 0,004 % полісорбат 80 10 мМоль оцтової кислоти, рН 4.2; 5 % сорбіт; 0.006 % полісорбат 80 10 мМоль оцтової кислоти, рН4.3; 5 % сорбіт; 0,006 % полісорбат 80 10 мМоль оцтової кислоти, рН 4.4; 5 % сорбіт; 0,006 % полісорбат 80 10 мМоль оцтової кислоти, рН 4.2; 5 % сорбіт; 0,008 % полісорбат 80 10 мМоль оцтової кислоти, рН 4.3; 5 % сорбіт; 0,008 % polysorbate 80 10 мМоль оцтової кислоти, рН 4.4; 5 % сорбіт; 0,008 % полісорбат 80 Початкове значення +5 °C рН 1-й 3-й 2-й тиждень 4-й тиждень тиждень тиждень при +40 °C при +5 °C при +40 °C при +40 °C рН рН рН рН 4.05 4.08 4.10 4.12 4.07 4.23 4.24 4.24 4.25 4.23 4.33 4.35 4.34 4.36 4.33 4.43 4.45 4.43 4.47 4.43 4.24 4.24 4.24 4.27 4.23 4.34 4.34 4.35 4.37 4.33 4.43 4.45 4.43 4.47 4.43 4.21 4.24 4.22 4.25 4.21 4.33 4.33 4.34 4.36 4.31 4.43 4.45 4.43 4.45 4.41 Далі сполуки фільтрують через відповідні стерилізовані мембранні фільтри із шириною пор 0,2 мкм. поміщають у стерилізовані скляні флакони для ін'єкцій гідролітичного класу І та 5 UA 100245 C2 5 10 15 20 25 30 35 40 45 пломбують стерильними тефлонізованими гумовими пробками. Процес заповнення флаконів переважно проводять в атмосфері азоту. Приклад 2: Біохімічна стійкість форм Г-КСФ за цим винаходом Експериментальні препарати Г-КСФ зберігаються у закритих та запаяних флаконах у темному місці при вказаних температурах, далі перевіряються на чистоту білку та виникнення окислених формувань, сполук та дімерів із використанням стандартних технологій, таких як УФспектроскопія, зворотньо-фазова ВЕРХ із С4 та С18 нерухомою фазою, або ексклюзійна хроматографія розмірів (ЕХР ВЕРХ), ізоелектричне фокусування, ДСН-ПААГ за умов відновлення та не відновлення тіолу із подальшим срібним зафарбовуванням та аналізом імуноблоту; інформацію щодо вказаних технологій див. у прикладах заяви WO 94/14466, зміст якої подано в цьому документі за допомогою посилання. Рідкі форми Г-КСФ, вказані у Таблиці 1 Прикладу 1, були протестовані стосовно тривалості їх стійкості, як і було вказано. З форм із вмістом поверхнево-активних речовин > 0,006 % у прикладі було зазначено тільки форму із вмістом речовин 0,008 %, тому що форми із більшим вмістом поверхнево-активних речовин проявляють значно менш тривалу стійкості. Під час експериментів стосовно біохімічної стійкості Г-КСФ в експериментальних сумішах було встановлено, що при використанні поверхнево-активних речовин у більшій концентрації понад та включно 0,008 % може спостерігатись накопичення окиснених форм Г-КСФ у великій кількості. Тому, під час експериментів, проведених у межах цього винаходу, було визначено, всупереч інструкціям міжнародної заяви W0 94/14466, що вже більш низька концентрація поверхнево-активних речовин, та у будь-якому випадку висока концентрація поверхневоактивних речовин, негативно впливає на властивості розчину Г-КСФ щодо окислення. Крім того, було встановлено, що препарати Г-КСФ цього винаходу згідно із Таблицею 1 характеризуються тим, що відносний вміст окиснених видів нижчий 1 %, у той час, коли цей рівень перевищив порогове значення у контрольних зразках із вмістом поверхнево-активних речовин 0,008 % та більше, через що можна зробити висновок, що такі сполуки не можуть вважатись підходящими медикаментами. Подальші дослідження біохімічної стійкості Г-КСФ в експериментальних сумішах виявили, що форми за цим винаходом можуть у значній мірі попереджати агрегацію та окислення Г-КСФ без потреби додавання допоміжних речовин, таких як амінокислота та/або антиоксиданти. Приклад 3: Прийнятність форм Г-КСФ Одну із рідких форм за цим винаходом було протестовано у трифазному III клінічному дослідженні серед пацієнтів, хворих на рак, де окрім іншого, було перевірено реакцію пацієнтів у місці введення ін'єкції. У цьому дослідженні було перевірено на наявність припухлостей, почервонінь, чутливості до тиску та інші симптоми, що виникають у місці ін'єкцій. Для клінічних досліджень форму Г-КСФ за цим винаходом було обрано згідно із вказівками до експериментальних препаратів ІІа (ХМ02) у Таблиці 1 та представлено у дозуванні 5 мкг/кг ваги тіла в день. У ході цих досліджень було встановлено, що лише один пацієнт з загальної кількості 356 чоловік показав небажану реакцію, тобто тільки у 0,3 % випадків. У контрольних дослідженнях, проведених із препаратом Г-КСФ, доступним на ринку, Нейпогеном©, було виявлено, що форма Г-КСФ цього винаходу має переносимість, яка покращується фактором 4 стосовно побічних ефектів у місцях введення ін'єкцій у пацієнтів. Ці результати наведено у наступній таблиці. Таблиця 2: Частота виникнення реакцій у місці введення ін'єкцій у трифазному III клінічному дослідженні. Оцінка першого циклу хіміотерапії раку грудей, не-ходжкинської лімфоми та раку легенів. Медикамент ХМ02 Нейпоген© Плацебо 50 рН Загальна кількість Позитивний результат 4,2 4,0 7,0 356 249 72 1 3 0 % Позитивних результатів 0,3 1,2 0,0 Вищевказані дослідження довели, що поєднуючи оцтову кислоту та ацетат, відповідно у якості буферної речовини, та поверхнево-активну речовину, таку як полісорбат 80, в особливій концентрації кожна, із доданням такого цукрового спирту, як сорбіт, та із встановленням рівня рН приблизно 4,2±0,15, ми отримуємо стійку рідку форму Г-КСФ, яка надає молекулам Г-КСФ стабільності, необхідної для того, щоб утворити стійкий медикамент, що добре переноситься та дозволяє повністю уникнути симптоми, що можуть з'являтись у місці ін'єкцій при застосування 6 UA 100245 C2 медикаменту. У результаті чого з'являється рідка форма Г-КСФ відповідно до цього винаходу та набори, що надаються разом із препаратом, препарат особливо підходить та є кращим для використання у щприцах-ручках та наборах, які до нього додаються, зокрема для використання вдома. 5 ФОРМУЛА ВИНАХОДУ 10 15 20 25 30 35 40 45 50 1. Медикамент, що являє собою водну рідку форму гранулоцитарно-колонієстимулюючого фактора (Г-КСФ), яка складається з Г-КСФ та цукрового спирту, поверхнево активної речовини у концентрації 0,05-0,06 мг/мл, ацетату у концентрації 5-20 мМоль як буферну речовину із рівнем рН 4,15-4,3. 2. Медикамент за п. 1, який відрізняється тим, що містить амінокислоти та/або гліцерин, та/або вуглеводи, та/або консервувальні речовини. 3. Медикамент за п. 1 або 2, який відрізняється тим, що Г-КСФ неглікований. 4. Медикамент за будь-яким з пп. 1-3, який відрізняється тим, що концентрація Г-КСФ складає 0,6 мг/мл. 5. Медикамент за будь-яким з пп. 1-4, який відрізняється тим, що поверхнево-активною речовиною є полісорбат. 6. Медикамент за будь-яким з пп. 1-5, який відрізняється тим, що цукровим спиртом є сорбіт. 7. Медикамент за будь-яким з пп. 1-6, який відрізняється тим, що концентрація цукрового спирту складає 5 % (вага/об'єм). 8. Медикамент за будь-яким з пп. 1-7, який відрізняється тим, що концентрація ацетату складає приблизно 10 мМоль. 9. Медикамент за будь-яким з пп. 1-8, який відрізняється тим, що переважно не містить амінокислот та/або додаткових білків. 10. Медикамент за будь-яким з пп. 1-9, який відрізняється тим, що є розчином для ін'єкцій або інфузій. 11. Медикамент, що містить водну рідку форму Г-КСФ як розчин для ін'єкцій або інфузій, який складається з людського неглікованого метіонілу Г-КСФ у концентрації 0,6 мг/мл та сорбіту у концентрації 5 % (вага/об'єм), полісорбату 80 у концентрації 0,05-0,06 мг/мл та ацетату у концентрації приблизно 10 мМоль як буферної речовини із рівнем рН 4,2±0,15. 12. Медикамент за будь-яким з пп. 1-11 для лікування раку, тяжкої хронічної нейропенії (ТХН), ВІЛ інфекцій, порушень центральної нервової системи, побічних ефектів від цитотоксичної хіміотерапії, або супутньої терапії хвороб, де потребується мобілізація периферійних кров'яних клітин-попередників. 13. Ємкість для введення рідких медикаментів, що представляють рідку медичну форму за будь-яким з пп. 1-11. 14. Ємкість за п. 13, яка відрізняється тим, що принаймні одна поверхня вказаної ємкості, що контактує із рідким препаратом, вкрита матеріалом, що містить силікон, або полімери політетрафторетилен або етилен-тетрафторетилен (ЕТФЕ). 15. Ємкість за п. 13 або 14, яка відрізняється тим, що являє собою шприц, ампулу, карпулу або контейнер для інфузій. 16. Ємкість за п. 15, яка відрізняється тим, що містить рідку форму, у концентрації 0,3 мг у 0,5 мл або 0,48 у 0,8 мл, стосовно концентрації Г-КСФ. 17. Набір для парентерального введення Г-КСФ, що містить ємкість за будь-яким з пп. 13-16, а також інструкції щодо зберігання та/або застосування. 18. Набір за п. 17, який відрізняється тим, що введення Г-КСФ передбачено у дозах 5-30 мкг/кг ваги тіла. 19. Набір за пп. 17, 18, який відрізняється тим, що містить 5 шприців або ампул. 20. Набір за будь-яким з пп. 17-19, який відрізняється тим, що містить безпечні відділення для шприців та голок для ін'єкцій та/або інфузій відповідно. 21. Набір за будь-яким з пп. 17-20, який відрізняється тим, що передбачено його зберігання при температурі 5 °C. Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійськоюLiquid formulation of g-csf
Автори англійськоюHinderer, Walter, Lubenau, Heinz
Назва патенту російськоюЖидкая форма г-ксф
Автори російськоюХиндерер Вальтер, Любенау Хайнц
МПК / Мітки
МПК: A61K 47/12, A61K 38/19, A61P 35/00, A61K 9/08, A61K 47/26, A61P 7/00
Код посилання
<a href="https://ua.patents.su/9-100245-ridka-forma-g-ksf.html" target="_blank" rel="follow" title="База патентів України">Рідка форма г-ксф</a>
Попередній патент: Фармацевтична композиція гідрохлориду толперизону з контрольованим вивільненням
Наступний патент: Планування, основане на діючому цільовому навантаженні, із заглушенням взаємних перешкод у системі бездротового зв’язку
Випадковий патент: Вальцьовий верстат