Спосіб діагностики ендотеліальної дисфункції у хворих на аутоімунний тиреоїдит за наявності атеросклеротичного ураження судин
Номер патенту: 113894
Опубліковано: 27.02.2017
Автори: Мамонтова Тетяна Василівна, Чекаліна Наталія Ігорівна, Беркало Любов Володимирівна, Кайдашев Ігор Петрович, Казаков Юрій Михайлович, Весніна Людмила Едуардівна, Микитюк Марина Володимирівна
Формула / Реферат
Спосіб діагностики ендотеліальної дисфункції у хворих на аутоімунний тиреоїдит за наявності атеросклеротичного ураження судин, який включає визначення маркеру деструкції ендотеліальних частин у кров'яному руслі за допомогою виявлення експресії антигенів ендотеліоцитів CD32 та CD40 з використанням моноклональних антитіл на проточному цитофлуориметрі, який відрізняється тим, що як додатковий маркер, що обумовлює пошкодження ендотелію, визначають рівень у крові фактора некрозу пухлини α, та, за наявності вмісту циркулюючих ендотеліальних мікрочастинок > 2,5 × 107/л та фактору некрозу пухлини α > 7,9 пг/мл, визначають ендотеліальну дисфункцію.
Текст
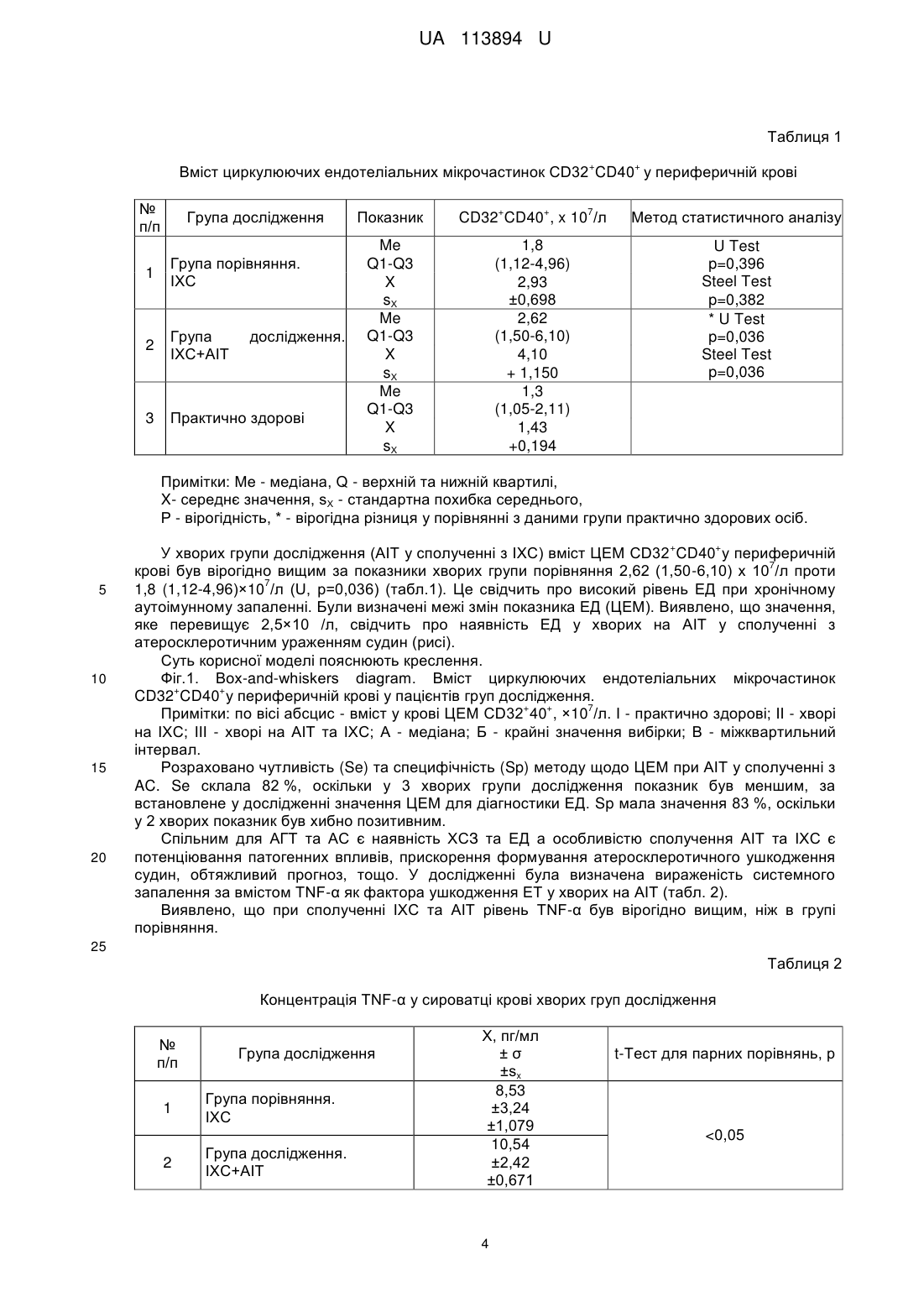
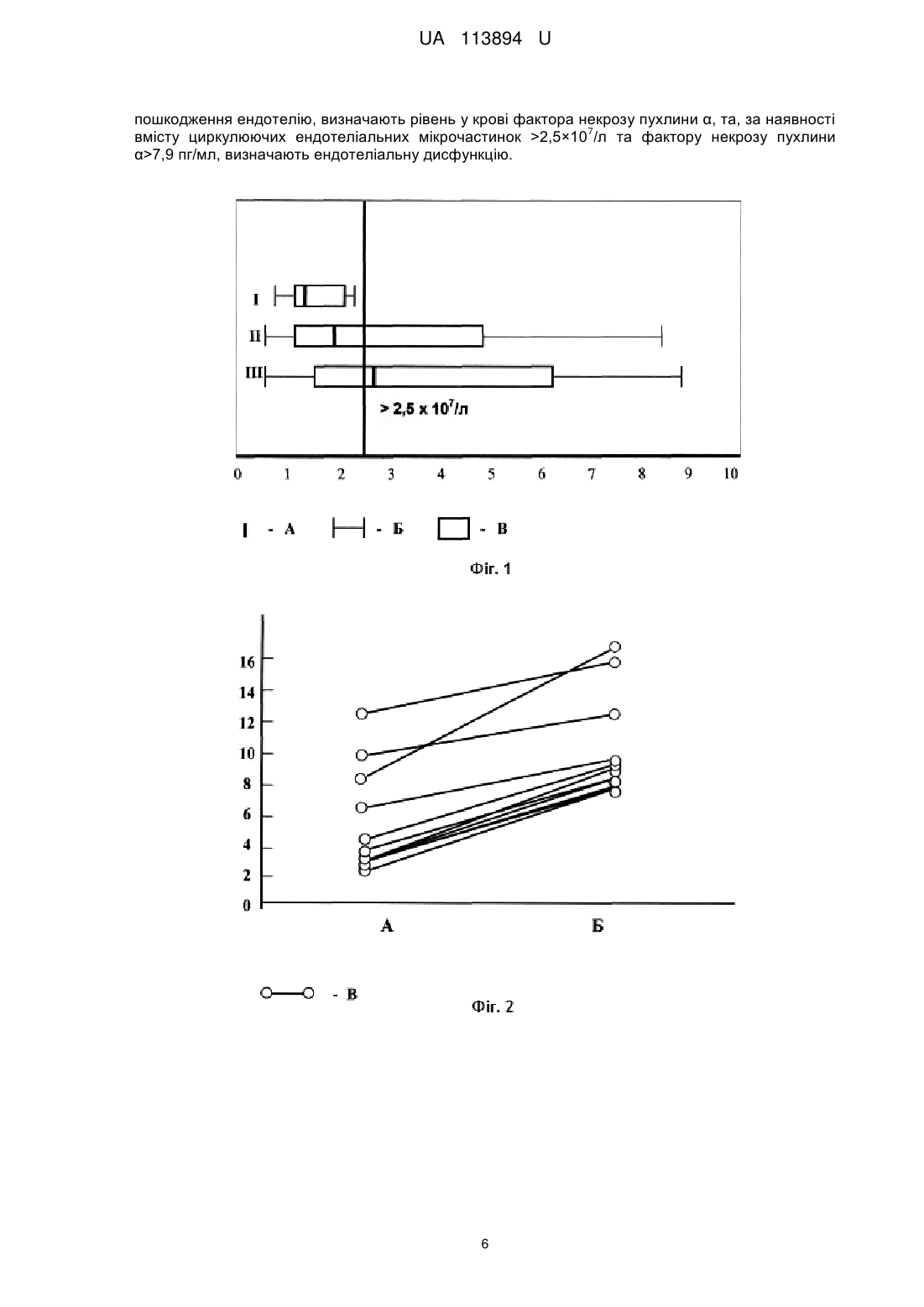
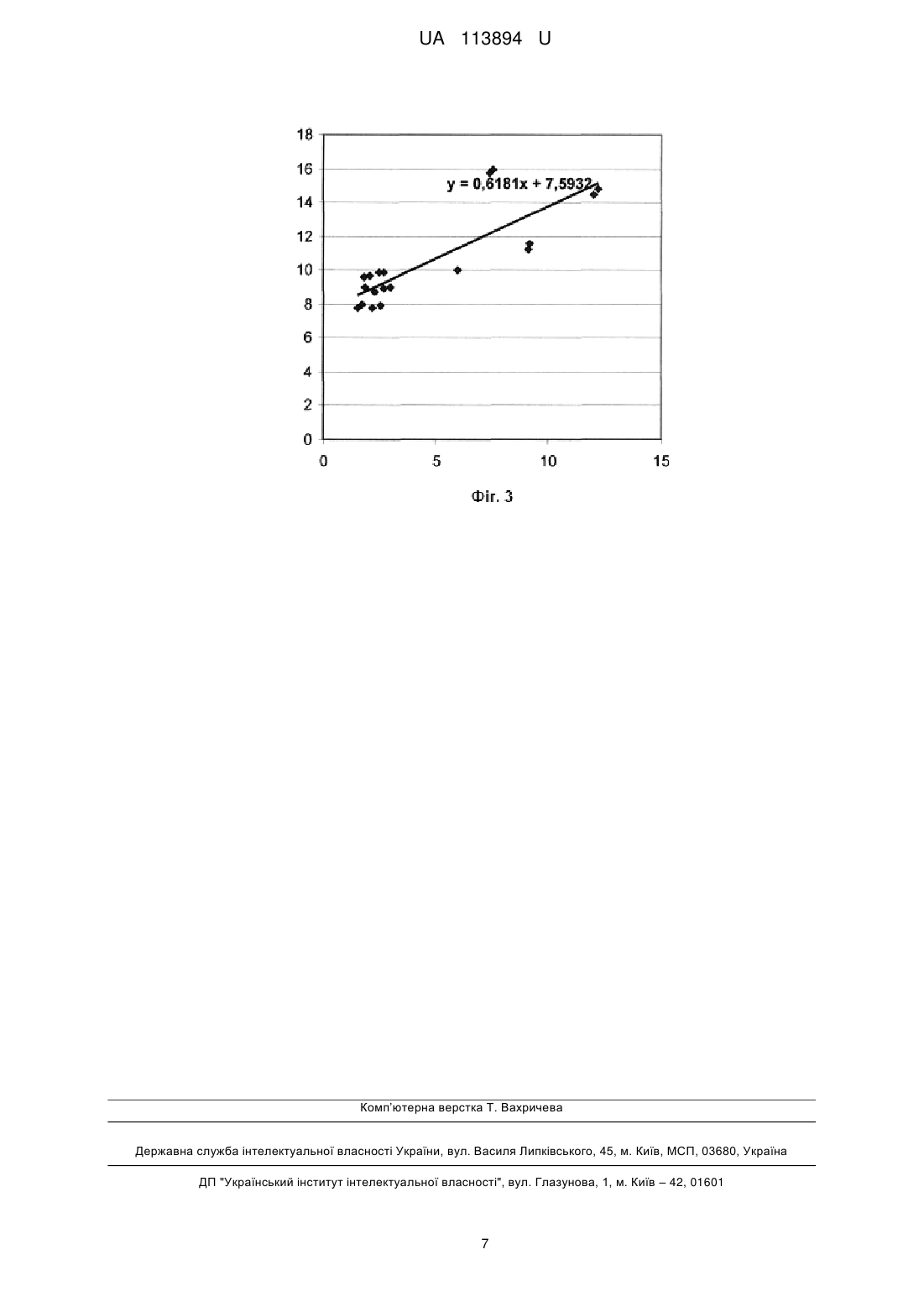
Реферат: Спосіб діагностики ендотеліальної дисфункції у хворих на аутоімунний тиреоїдит за наявності атеросклеротичного ураження судин включає визначення маркеру деструкції ендотеліальних частин у кров'яному руслі за допомогою виявлення експресії антигенів ендотеліоцитів CD32 та CD40 з використанням моноклональних антитіл на проточному цитофлуориметрі. Як додатковий маркер, що обумовлює пошкодження ендотелію, визначають рівень у крові фактора некрозу пухлини α, та, за наявності вмісту циркулюючих ендотеліальних мікрочастинок 7 >2,5×10 /л та фактору некрозу пухлини α >7,9 пг/мл, визначають ендотеліальну дисфункцію. UA 113894 U (12) UA 113894 U UA 113894 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до галузі медицини, а саме до ендокринології та кардіології, і може також бути використаний в діагностичних схемах різних хвороб, у патогенезі яких має значення ендотеліальна дисфункція. Коморбідність є однією з головних проблем сучасної медицини, характеризується "маскуванням" хворобливих станів, обтяжливим перебігом та негативним прогнозом. У переважній більшості рандомізованих клінічних досліджень коморбідність є критерієм виключення. Недостатній науково-практичний досвід зумовлює труднощі у діагностиці і лікуванні сполученої патології, яка є актуальним об'єктом вивчення. За даними ВООЗ, патологія ендокринної системи займає третє місце у світі після серцевосудинних та онкологічних захворювань за поширеністю та причинами смертності населення. В Україні в структурі ендокринної патології перше місце за поширеністю на сьогодні посідає патологія щитоподібної залози (ЩЗ) (44 %), а в західних регіонах, яким притаманний дефіцит йоду, цей показник сягає 70 %. Кількість випадків цієї патології в Україні за останні 10 років збільшилася з 489 тис. до 1 млн. 657 тис. [Чотирнадцяті Данилевські читання [Текст]. Досягнення та перспективи експериментальної і клінічної ендокринології: матеріали наук.-практ. конф. з міжнар. участю, 2-3 березня 2015 p.: збірник / ред. Ю. І. Караченцев [та ін.]. - Харків, 2015. - 190 с.]. Превалюють у структурі захворювань ЩЗ вузловий колоїдний зоб, злоякісні новоутворення та аутоімунний тиреоїдит (АІТ), який складає 20-30 % тиреоїдної патології в Україні. Поширеність АІТ в Україні за останні 10 років зросла на 68 %, а в перерахунку на 100 тис. населення - на 82 %. [Кравченко В.І. Динаміка захворюваності на патологію ЩЗ в Україні / Кравченко B.I., Постол СВ. // Міжнародний ендокринологічний журнал. - 2011. - 3 (35). - С. 2631]. Частота клінічно виражених форм AIT складає 1 %. Проте, АІТ є найчастішою причиною гіпотиреозу (70-80 % випадків), оскільки хронічне аутоімунне запалення призводить до апоптозу тиреоїдних клітин з наступним фіброзом та втратою функціональної активності ЩЗ [Weetman A. Chronic autoimmune thyroiditis / A. Weetman // The Thyroid a Fundamental and Clinical Text; eds L. E. Braverman & R. D. Utiger. - New York: Lippincot Williams, 2005. - P. 703]. Майже усі ендокринні захворювання залучають у патологічний процес серцево-судинну систему, або обтяжують перебіг серцево-судинних захворювань (ССЗ). Перше місце в світі серед причин смертності населення посідає ішемічна хвороба серця (ІХС). В Україні смертність від ССЗ складає 67,3 %, в структурі яких переважає смертність від ІХС (68,8 %) [Коваленко В.М. Стрес і хвороби системи кровообігу: [посібник] / В.М. Коваленко, В.М. Корнацький // - К.: ДУ "ННЦ "Інститут кардіології імені акад. М.Д. Стражеска", 2015. - 354 с.]. Враховуючи поширеність зазначеної патології, а також, частоту сполучення серцевосудинних та ендокринних захворювань, що обтяжують перебіг одне одного, або є патогенетичною основою для розвитку сполучених патологічних станів, є необхідним пошук нових ефективних методів діагностики і лікування за умов коморбідності. Аутоімунний процес супроводжується підвищенням вільно-радикального окислення (ВРО), що є неодмінним компонентом хронічного системного запалення (ХСЗ). ХСЗ є патогенетичною основою атеросклерозу (АС), беручи участь у перекисному окисненні ліпідів, активації клітин, ураженні біологічних мембран, формуванні ендотеліальної дисфункції (ЕД) [Саприн А.Н. Окислительный стресс и его роль в механизмах апоптоза и развития патологических процессов / А.Н. Саприн, Е.В. Калинина // Успехи биологии и химии. - 1999. - Т. 39. - С. 289-326]. Саме ЕД на сьогодні розцінюється як основний патогенетичний чинник формування атеросклеротичного ураження судин, яке є морфологічною основою ІХС. ЕД, що формується в умовах ХСЗ, є найбільш раннім етапом атерогенезу, в той же час, відіграє провідну роль у прогресуванні судинних змін, у формуванні атероматозної бляшки, її дестабілізації, розвитку атеротромбозу. Порушення вазомоторних, гемостатичних, адгезійних, ангіогенних властивостей ендотелію (ЕТ) виникає в результаті пошкодження клітинних мембран вільними радикалами, окислювально модифікованими ліпопротеїдами низької щільності (ЛПНЩ), імунними комплексами, моноцитами-макрофагами, цитокінами (ЦК), що призводить до активації ендотеліоцитів та апоптозу [Петрищев Н.Н. Типовые формы дисфункции эндотелия / Н.Н. Петрищев, Л.В. Васина, Т.Д. Власов // Клинич. лаб. консилиум. - 2007. - № 18. - С. 31-36]. ЕТ володіє потужною паракринною функцією, опосередковує і реалізує прозапальні реакції, утворюючи порочне коло формування судинного ушкодження [Lin P.J. Endothelium dysfunction in cardiovascular diseases / P.J. Lin P.J., C.H. Chang // Changgeng Yi Xue Za Zhi. - 1994. - Vol. 17, №3. - P. 198-210]. Тому, є актуальним пошук показових маркерів ЕД як при АІТ, так і при АС, для оптимізації діагностики, оцінки перебігу та ефективності лікувальних заходів. 1 UA 113894 U 5 10 15 20 25 30 35 40 45 50 55 60 Методи дослідження функції ЕТ артерій, переважно, ґрунтуються на оцінці його здатності продукувати NО у відповідь на фармакологічні (ацетилхолін, метахоліном, брадикінін, гістамін) або фізичні (зміна швидкості кровотоку) впливи, а також на оцінці рівня опосередкованих показників ендотеліальної функції (фактор фон Віллебранда, тканинний активатор плазміногену, тромбомодулін) [Перспективы медикаментозного лечения эндотелиальной дисфункции / Г.А. Романовская, Е.В. Акатова, Г.Н. Гороховская [и др.] // Фарматека. - 2005. №9. - Режим доступу: http://www.pharmateca. ru/ru/archive/article/603 9]. З цією метою використовують інструментальні дослідження - оклюзійну плетизмографію [Патент UA № 35061], лазерну допплерівську флоуметрію [Патент RU № 2449282; Патент KZ № 16504], двомірне та дуплексне ультразвукове сканування [Патент UA № 2345712; Патент RU № 2440018; Патент BY № 18671], ультразвукову допплерографію [Патент UA № 200604317; Патент BY № 18671], сфігмографію [Патент RU № 2440018] у сполученні з фармакологічними пробами (ацетилхолін, нітрати, тощо) та визначенням рівня ендотеліальних медіаторів у плазмі крові (фактора фон Віллебранду, мікроальбумінурії, аргініну, орнітину, цитруліну, тощо) [Патент UA № 99094907; Патент RU № 2428105; Патент BY № 16410], визначення NO у повітрі, що видихається [Патент RU № 2143689; Патент KZ № 16123; Патент KZ № 17282], визначення ЕД за рівнем десквамованих ендотеліоцітів в крові [Hiadovec J. Circulating endothelial cells as a sign of vessel wall lesions / J. Hiadovec // Physiol. Bohemoslov. - 1978. - Vol. 27, №2. - С 140-144; Патент UA № 58648; Патент RU № 2234094; Патент RU № 2338192; Патент RU № 2455641]. Існує спосіб дослідження ЕД при аутоімунному тиреоїдиті як фактора ризику АС, що базуються на визначенні ендотелійзалежної вазодилятації [Анализ эндотелиальной дисфункции пациентов с аутоиммунным тиреоидитом в зависимости от функціонального состояния щитовидной железы / Латыпова В.Н., Дамдинджорж Даваасурен, Идрисова Е.М. [и др.] // Сибирск. мед. журн. - 2011. - Том 26, № 4 (Выпуск 2). - С. 172-176]. Відомо спосіб діагностики ЕД при AIT та АС за умов метаболічного синдрому [В.В. Попов. Функциональное состояние эндотелия у женщин с метаболическим синдромом, ассоциированным с аутоиммунным тиреоидитом / В.В. Попов, Н.Ф. Прийма, Н.С. Канавец // Педиатр. - Т. IV, № 4. 2013. - С. 61-64]. Недоліком вказаних способів є можливість лише констатації наявності ЕД, проте неможливим є визначення її ступеню вираженості, а також утруднення проведення визначення ЕД у осіб з артеріосклерозом. Відомо спосіб діагностики ЕД за умов АІТ шляхом вивчення вмісту у крові ендотеліну-1 та антитіл до нього [Зуева А.А. Иммунопатологические сдвиги и уровень цитокинов в патогенезе аутоиммунного тиреоидита и дифузного токсического зоба: дис.… доктора мед. наук: 14.00.16 / Зуева Анна Анатольевна. - Чита, 2009. - 123 с]. Недоліком способу є виявлена залежність показнику ЕД від рівня гормонів ЩЗ та відсутність встановленого значення показника, що визначає наявність ЕД. Існує спосіб діагностики ЕД при субклінічному гіпотиреозі у сполученні з хронічною серцевою недостатністю, який полягає у визначенні ЕД за рівнем десквамованих ендотеліоцитів в крові. Досліджують циркулюючі ендотеліальні мікрочастинки (ЦЕМ) цитофлоуметричним методом шляхом виявлення специфічних поверхневих мембранних молекул за допомогою моноклональних антитіл проти антигенів CD31, CD 144, CD62E та annexinV [Березин А.Е. Влияние субклинического гипотиреоза на паттерн циркулирующих эндотелиальных микрочастиц у пациентов с хронической сердечной недостаточностью / А.Е. Березин, А.А. Кремзер // Серце і судини. - 2015. - №4. - С. 23-30]. Недоліком даного способу є відсутність встановленого значення кількості ЦЕМ, що могло б свідчити про наявність та ступінь вираженості ЕД, а також висока вартість методу через використання групи з чотирьох маркерів, хоча, за даними різних авторів, кількість маркерів майже не впливає на кінцеві результати, які можуть бути зіставлені одні з одним [Патент UA № 58648; Патент RU № 2234094; Патент RU № 2338192; Патент RU № 2455641]. Найбільш близьким до способу, що заявляється, є спосіб визначення ЦЕМ цитофлуориметричним методом шляхом виявлення специфічних поверхневих мембранних молекул за допомогою моноклональних антитіл проти антигенів CD32 та CD40 [Патент UA № 58648]. Спосіб було застосовано для виявлення ЕД при цукровому діабеті 2 типу та + + метаболічному синдромі [Куценко Н.Л. Определение содержания циркулирующих CD32 CD40 микрочастиц - модификация метода оценки деструкции эндотелиальных клеток / Н.Л. Куценко, Л.Г. Савченко, Э.И. Кайдашева [и др.] // Клиническая лабораторная діагностика. - 2011. - №7. С. 20-23]. Проте, не виявлені залежності показника ЕД від ступеню системного запалення, яке має важливий вплив при АІТ та є компонентом атерогенезу. Також, не встановлено числове значення показнику ЕД, що мало б діагностичну користь у клініці. 2 UA 113894 U 5 10 15 20 25 30 35 40 45 50 В основу корисної моделі поставлена задача розробити спосіб виявлення ЕД при АІТ у сполученні з атеросклеротичним ураженням судин шляхом удосконалення відомого способу визначення деструкції ендотеліальних частин у кров'яному руслі. Поставлена задача вирішується тим, що визначають маркер деструкції ендотеліальних частин у кров'яному руслі за допомогою виявлення експресії антигенів ендотеліоцитів CD32 та CD40 з використанням моноклональних антитіл на проточному цитофлуориметрі, який відрізняється тим, що у якості додаткового маркеру, що обумовлює пошкодження ендотелію, визначають рівень у крові фактора некрозу пухлини а, та, за наявності вмісту циркулюючих 7 ендотеліальних мікрочастинок (ІДЕМ) >2,5×10 /л та фактору некрозу пухлини a (TNF-α) >7,9 пг/мл, визначають ендотеліальну дисфункцію. TNF-α має широкий спектр впливу на усіх рівнях реалізації запального процесу в організмі: індукує синтез білків гострої фази гепатоцитами, сприяє проліферації та диференціюванню Тта В-лімфоцитів, продукції імуноглобулінів, NK-цитотоксичності, підвищує функціональну активність нейтрофілів, фібробластів, активує фагоцитоз, сприяє експресії ендотеліоцитами молекул адгезії [Кайдашев І.П. Сиртуїни - універсальні регулятори клітинних функцій / І.П. Кайдашев // Biopolymers and Cell. - 2012. - Vol. 28 (2). - P. 93-102; Cairins C.B. Bench to bedside: Tumor necrosis factor-alpha: From inflammation resuscitation / C.B. Cairins, E.A. Panacek, A.N. Harken // Acad. Emerg. Med. - 2000. - Vol. 7. - P. 930-941]. Для досягнення заявленого результату здійснено наступний об'єм заходів. Проведено обстеження 75 осіб. Відбір хворих здійснювався за наявністю ознак атеросклеротичного ураження судин шляхом визначення потовщення комплексу "інтима-медіа" (КІМ) загальних сонних артерій 0,9 мм і більше (з урахуванням віку) або, додатково, з наявністю атеросклеротичних бляшок (АБ), та доведеної за допомогою тесту з дозованим фізичним навантаженням (велоергометрія) ІХС (стенокардія напруги стабільна, І-ІІ ФК). Таким чином відібрано 55 пацієнтів обох статей (23 жінки та 32 чоловіки) віком від 48 до 72 років, що склали групу порівняння. Одночасно здійснювався відбір хворих за попередніми критеріями та, додатково, за наявністю затверджених маркерів АГТ: клінічні дані (скарги, пальпаторне дослідження ЩЗ), дані ультразвукового дослідження ЩЗ, підвищення антитіл до тиреопероксидази >250 МО/мл, та, за умов клінічного та субклінічного гіпотиреозу, підвищення рівня тиреотропного гормону у сироватці крові. Критеріями виключення з дослідження були наявність супутньої патології (цукровий діабет та інші ендокринні захворювання, захворювання сполучної тканини, артеріальна гіпертензія II стадії та вище, хронічні захворювання внутрішніх органів в маніфестній стадії, тощо). Також, не були включені до дослідження хворі на АГГ у стадії тиреотоксикозу, оскільки патогенетично зумовлена трансформація перебігу АГГ у подальшому передбачає формування прогресуючої гіпофункції ЩЗ за рахунок апоптозу тиреоцитів та розвитку фіброзних змін ЩЗ в умовах аутоімунного запалення. Саме цей період захворювання робить найбільший внесок у формування запальних та дегенеративнодистрофічних змін в організмі, у тому числі - розвиток та прогресування АС. За такими критеріями сформовано групу дослідження з 20 осіб (16 жінок та 4 чоловіки) віком 48-61 рік. За даними лабораторних аналізів, 4 хворих мали гіпотиреоз, 5 - субклінічний гіпотиреоз, решта еутиреоїдний варіант перебігу АГТ. Напередодні запланованого визначення показників ЕД було досягнуто еутиреоїдний стан у зазначених хворих шляхом призначення відповідних доз Lтироксину (25-75 мкг на добу), що підтверджено даними лабораторних досліджень. 15 добровольців склали групу здорових осіб. Результати дослідження наведені у таблицях 1 та 2. Підвищення ЦЕМ, що визначене за різними специфічними маркерами, відповідає наявності ЕД при різних патологічних станах [Endothelial microparticles in diseases / G.N. Chironi, CM. Boulanger, A. Simon [et al.] // Cell. Tissue Res. - 2009. - Vol. 335, № 1. - P. 143-151; Effect of periodic alterations in shear on vascular macromolecular uptake / M.H. Friedman, J.M. Henderson, J.A. Aukerman [et al.] // Biorheology. - 2000. - Vol. 37, № 4. - P. 265-277]. 3 UA 113894 U Таблиця 1 + + Вміст циркулюючих ендотеліальних мікрочастинок CD32 CD40 у периферичній крові № п/п Група дослідження 1 Група порівняння. ІХС 2 Група ІХС+АІТ 3 Практично здорові дослідження. + + 7 Показник CD32 CD40 , x 10 /л Метод статистичного аналізу Me Q1-Q3 X sХ Me Q1-Q3 X sХ Me Q1-Q3 X sХ 1,8 (1,12-4,96) 2,93 ±0,698 2,62 (1,50-6,10) 4,10 + 1,150 1,3 (1,05-2,11) 1,43 +0,194 U Test p=0,396 Steel Test p=0,382 * U Test p=0,036 Steel Test p=0,036 Примітки: Me - медіана, Q - верхній та нижній квартилі, X- середнє значення, sХ - стандартна похибка середнього, Р - вірогідність, * - вірогідна різниця у порівнянні з даними групи практично здорових осіб. + 5 10 15 20 + У хворих групи дослідження (AIT у сполученні з ІХС) вміст ЦЕМ CD32 CD40 y периферичній 7 крові був вірогідно вищим за показники хворих групи порівняння 2,62 (1,50-6,10) х 10 /л проти 7 1,8 (1,12-4,96)×10 /л (U, р=0,036) (табл.1). Це свідчить про високий рівень ЕД при хронічному аутоімунному запаленні. Були визначені межі змін показника ЕД (ЦЕМ). Виявлено, що значення, яке перевищує 2,5×10 /л, свідчить про наявність ЕД у хворих на АІТ у сполученні з атеросклеротичним ураженням судин (рисі). Суть корисної моделі пояснюють креслення. Фіг.1. Box-and-whiskers diagram. Вміст циркулюючих ендотеліальних мікрочастинок + + CD32 CD40 y периферичній крові у пацієнтів груп дослідження. + + 7 Примітки: по вісі абсцис - вміст у крові ЦЕМ CD32 40 , ×10 /л. І - практично здорові; II - хворі на ІХС; III - хворі на АІТ та IXC; A - медіана; Б - крайні значення вибірки; В - міжквартильний інтервал. Розраховано чутливість (Se) та специфічність (Sp) методу щодо ЦЕМ при АІТ у сполученні з AC. Se склала 82 %, оскільки у 3 хворих групи дослідження показник був меншим, за встановлене у дослідженні значення ЦЕМ для діагностики ЕД. Sp мала значення 83 %, оскільки у 2 хворих показник був хибно позитивним. Спільним для АГТ та АС є наявність ХСЗ та ЕД а особливістю сполучення АІТ та ІХС є потенціювання патогенних впливів, прискорення формування атеросклеротичного ушкодження судин, обтяжливий прогноз, тощо. У дослідженні була визначена вираженість системного запалення за вмістом TNF-α як фактора ушкодження ЕТ у хворих на АІТ (табл. 2). Виявлено, що при сполученні ІХС та АІТ рівень TNF-α був вірогідно вищим, ніж в групі порівняння. 25 Таблиця 2 Концентрація TNF-α у сироватці крові хворих груп дослідження № п/п Група дослідження 1 Група порівняння. ІХС 2 Група дослідження. ІХС+АІТ X, пг/мл ±σ ±sx 8,53 ±3,24 ±1,079 10,54 ±2,42 ±0,671 4 t-Тест для парних порівнянь, р 2,5×107/л відповідає значення TNF-α >7,9 пг/мл (фіг. 2). + + Фіг.2. Кількість ЦЕМ 32 40 та рівень TNF-α у крові хворих на АІТ у сполученні з ІХС По вісі ординат - значення показнику в абсолютних числах. + + 7 Примітки: А - Кількість ЦЕМ 32 40 , ×10 /л; Б - Концентрація TNF-α, пг/мл; В - пари даних кожного хворого. Було визначено тісний кореляційний зв'язок між показниками ЦЕМ та TNF-α (г=0,81) (фіг. 3). + + Фіг.3. Кореляційна залежність між значеннями показників ЦЕМ CD32 40 та TNF-α у хворих на АІТ у сполученні з ІХС. Примітки: по вісі абсцис - кількість ЦЕМ CD32+CD40+; по вісі ординат - рівень TNF- α. Визначено чутливість (Se) та специфічність (Sp) методу відносно значення TNF-α при АІТ у сполученні з AC. Se склала 100 %, оскільки у хворих групи дослідження за умов вмісту ЦЕМ 7 >2,5×10 /л (що відповідає ЕД) TNF-α в усіх випадках дорівнював або перевищував межу 7,9 пг/мл. Sp мала значення 82 %, оскільки у 3 хворих показник був хибно позитивним. Приклад 1. Хвора Н., 57 років. Діагноз: АІТ: атрофічна форма, гіпоплазія ЩЗ І ступеню, субклінічний гіпотиреоз, легка форма (ТТГ - 4,32 мМО/л, Т4 вільний - 14,3 пмоль/л.); ІХС: стенокардія напруги стабільна, II ФК, СНО, ризик середній. Лабораторні дані: загальний ХС 6,2 ммоль/л, ХС ЛПНЩ + + 7 4,34 ммоль/л, TNF-α - 11,5 пг/мл, ЦЕМ CD32 CD40 - 5,6× 0 /л. Хворій проводилося стандартне лікування (L-тироксин 50 мкг на добу, аторвастатин 10 мг на добу, ацетилсаліцилова кислота 75 мг на добу, нітрати короткої дії за вимогою). По закінченні курсу терапії відмічалося покращення загального стану хворого, підвищення працездатності. Результати лабораторних досліджень через 2 місяці: рівень ХС 5,4 ммоль/л, + + 7 рівень ХС ЛПНЩ 3,10 ммоль/л, TNF-α - 6,8 пг/мл, ЦЕМ CD32 CD40 - 1,9×10/л. Приклад 2. Хворий С, 60 років. Діагноз: ІХС: стенокардія напруги стабільна, II ФК, СНІ, без значущого порушення систолічної функції, ризик середній. Має обтяжливу спадковість за ССЗ. Лабораторні дані: рівень ХС 5,9 ммоль/л, рівень ХС ЛПНЩ 3,71 ммоль/л, TNF-α - 11,2 пг/мл, + + 7 ЦЕМ CD32 CD40 - 5,1×10 /л. Хворому призначено стандартну терапію (бісопролол 5 мг на добу, аторвастатин 10 мг на добу, ацетилсаліцилова кислота 75 мг на добу, нітрати короткої дії за вимогою, ресвератрол у дозі 100 мг) протягом 2 місяців. По закінченні курсу терапії відмічалося помірне покращення загального стану хворого. Результати лабораторних досліджень: рівень ХС 4,8 моль/л, рівень ХС ЛПНЩ 2,89 ммоль/л, + + 7 проте залишалися ознаки ЕД: TNF-α - 9,3 пг/мл, ЦЕМ CD32 CD40 - 4,6×10 /л. Приклад 3. Хвора С, 48 років. Діагноз: АІТ: гіпертрофічна форма, зоб І ступеню, легка форма, еутиреоз; ІХС: стенокардія напруги стабільна, II ФК, СНО, ризик середній. Лабораторні дані: загальний ХС + + 7 6,4 ммоль/л, ХС ЛПНЩ 4,15 ммоль/л, TNF-α - 10,2 пг/мл, ЦЕМ CD32 CD40 - 4,2×10 /л. Хворій проводилося стандартне лікування (бісопролол 5 мг на добу, аторвастатин 10 мг на добу, ацетилсаліцилова кислота 75 мг на добу, нитрати короткої дії за вимогою) протягом 2 місяців. Наприкінці курсу лікування хвора відмічала покращення загального самопочуття, підвищення фізичної активності. Результати досліджень: рівень ХС 5,1 ммоль/л, рівень ХС ЛПНЩ 3,25 + + 7 ммоль/л, TNF-α - 5,8 пг/мл, ЦЕМ CD32 CD40 - 1,8×10 /л. Таким чином, визначення кількості ЦЕМ за поверхневими антигенними маркерами апоптозу та активації ендотелюцитів у сполученні з вмістом TNF-α є сучасним високочутливим методом + + верифікації ЕД. Підрахунок циркулюючих в крові ендотеліальних мікрочастинок CD32 CD40 разом із визначенням вмісту TNF-α є більш вірогідним маркером ЕД: кількість ЦЕМ, що 7 перевищує значення 2,5×10 /л, у сполученні з TNF-α >7,9 пг/мл, свідчить про ЕД у хворих на АІТ за наявності атеросклеротичного ураження судин. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 55 Спосіб діагностики ендотеліальної дисфункції у хворих на аутоімунний тиреоїдит за наявності атеросклеротичного ураження судин, який включає визначення маркеру деструкції ендотеліальних частин у кров'яному руслі за допомогою виявлення експресії антигенів ендотеліоцитів CD32 та CD40 з використанням моноклональних антитіл на проточному цитофлуориметрі, який відрізняється тим, що як додатковий маркер, що обумовлює 5 UA 113894 U пошкодження ендотелію, визначають рівень у крові фактора некрозу пухлини α, та, за наявності 7 вмісту циркулюючих ендотеліальних мікрочастинок >2,5×10 /л та фактору некрозу пухлини α>7,9 пг/мл, визначають ендотеліальну дисфункцію. 6 UA 113894 U Комп’ютерна верстка Т. Вахричева Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП "Український інститут інтелектуальної власності", вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61B 5/0205
Мітки: діагностики, спосіб, ураження, атеросклеротичного, тиреоїдит, аутоімунний, дисфункції, хворих, судин, наявності, ендотеліальної
Код посилання
<a href="https://ua.patents.su/9-113894-sposib-diagnostiki-endotelialno-disfunkci-u-khvorikh-na-autoimunnijj-tireodit-za-nayavnosti-aterosklerotichnogo-urazhennya-sudin.html" target="_blank" rel="follow" title="База патентів України">Спосіб діагностики ендотеліальної дисфункції у хворих на аутоімунний тиреоїдит за наявності атеросклеротичного ураження судин</a>
Попередній патент: Агрегат комбінований передпосівний напівнавісний
Наступний патент: Пристрій для вимірювання зусилля притискання рейки до шпали клемою пружинного кріплення
Випадковий патент: Спосіб радіонуклідно-медикаментозного лікування хворих на рак передміхурової залози з множинними метастазами в скелет