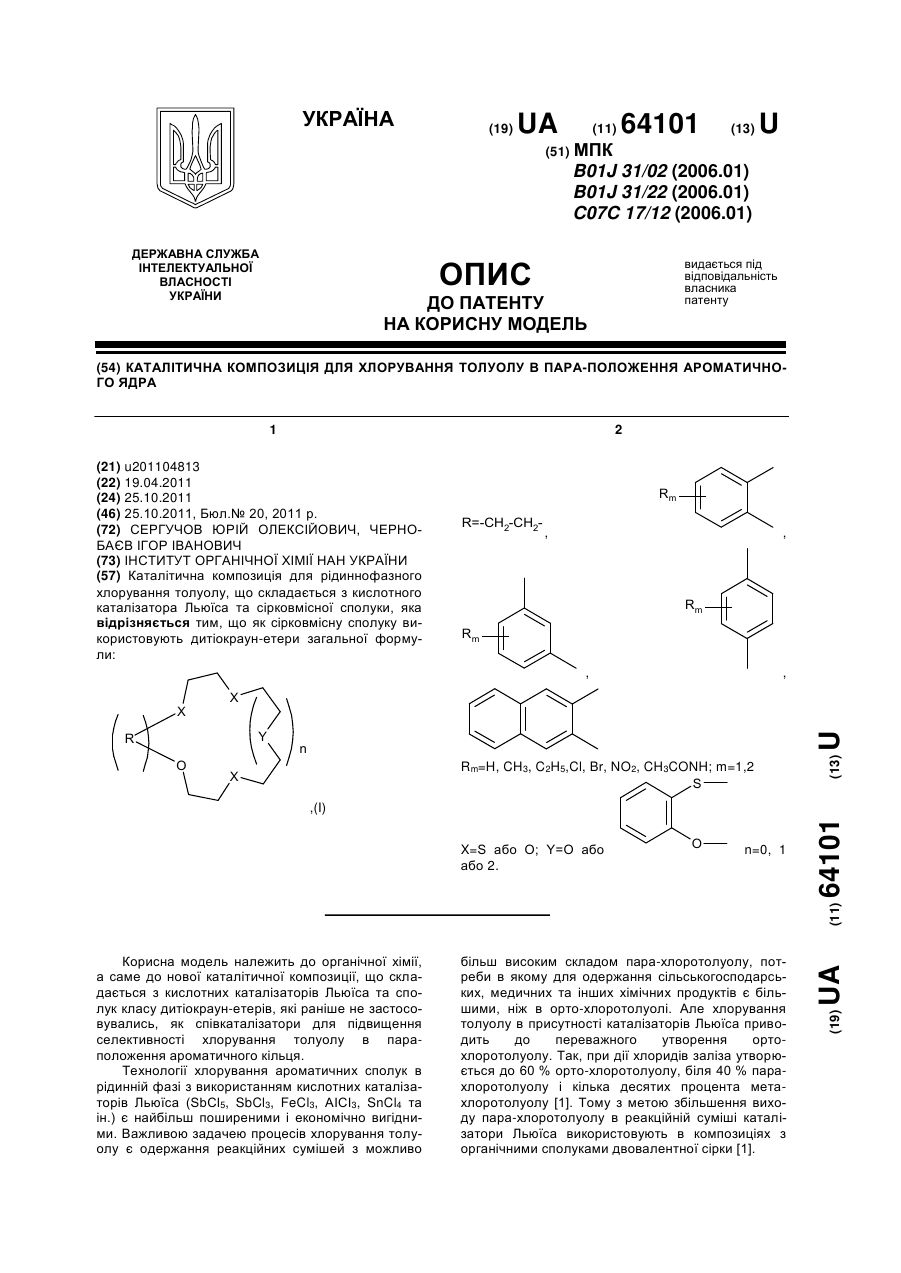
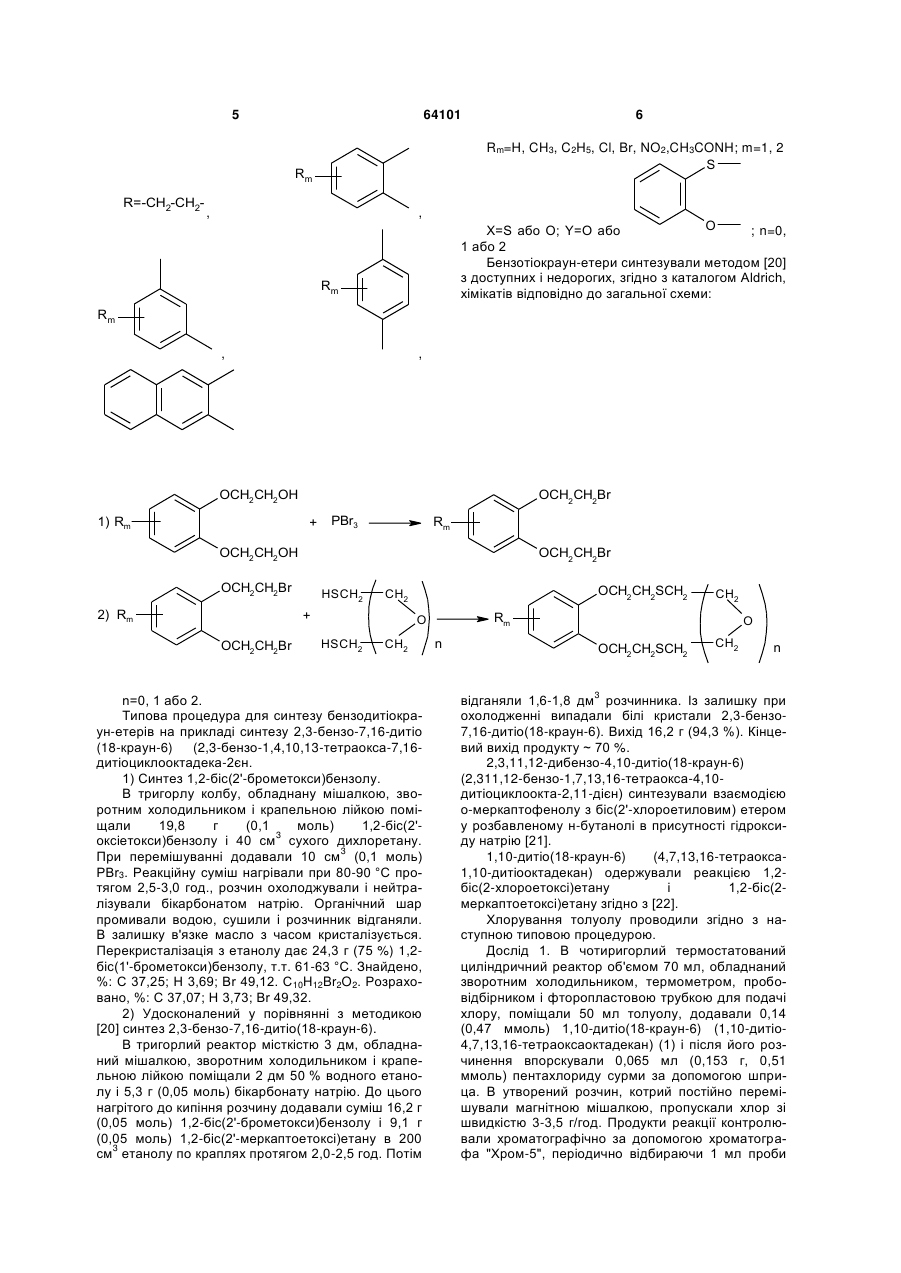
Каталітична композиція для хлорування толуолу в пара-положення ароматичного ядра
Номер патенту: 64101
Опубліковано: 25.10.2011
Формула / Реферат
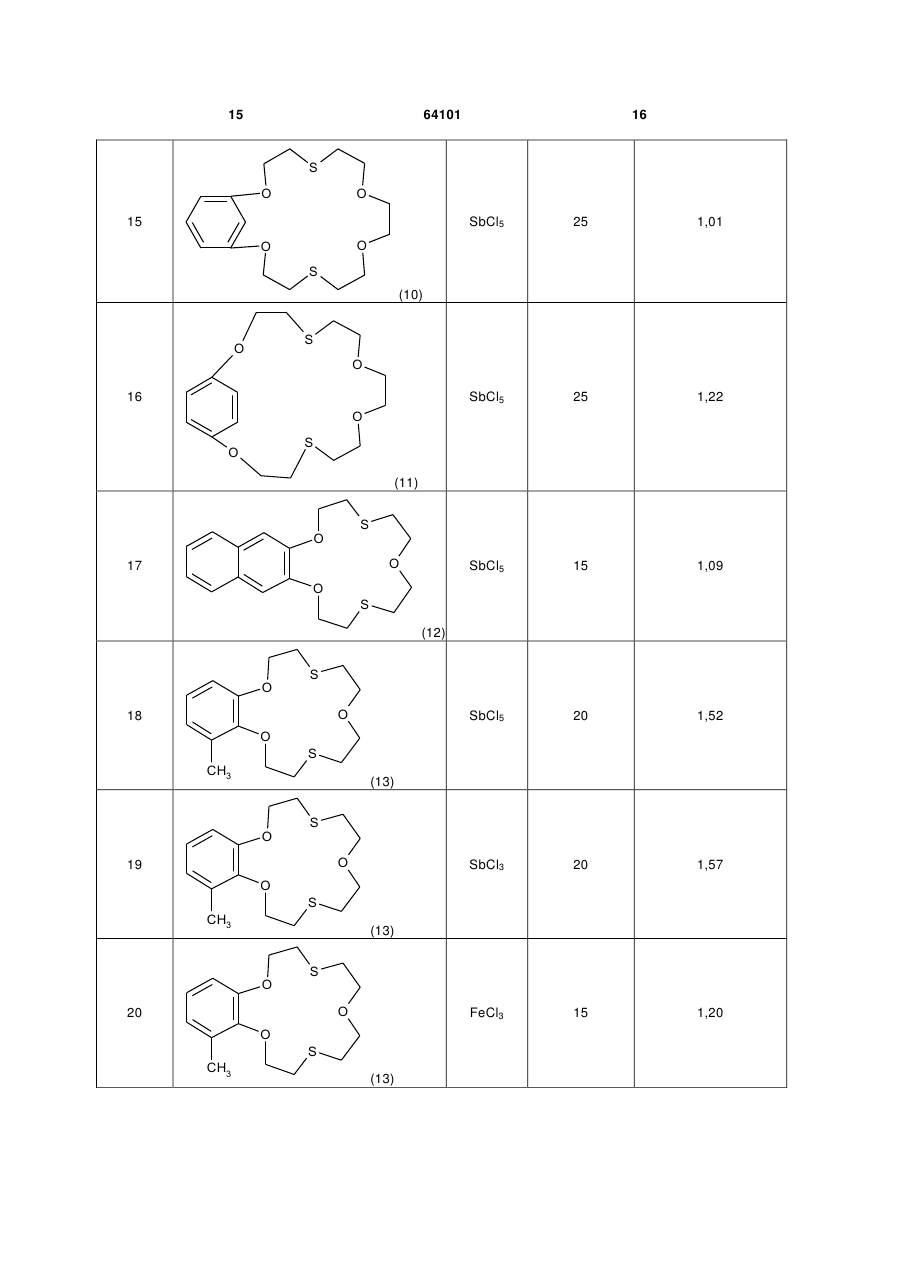
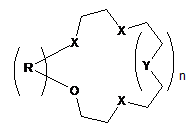
Каталітична композиція для рідиннофазного хлорування толуолу, що складається з кислотного каталізатора Льюїса та сірковмісної сполуки, яка відрізняється тим, що як сірковмісну сполуку використовують дитіокраун-етери загальної формули:
 ,(I)
,(I)
![]() ,
,  ,
,  ,
, 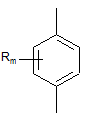 ,
, 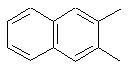
Rm=H, CH3, C2H5,Cl, Br, NO2, CH3CONH; m=1,2
X = S або O; Y=O або  n=0, 1 або 2.
n=0, 1 або 2.
Текст
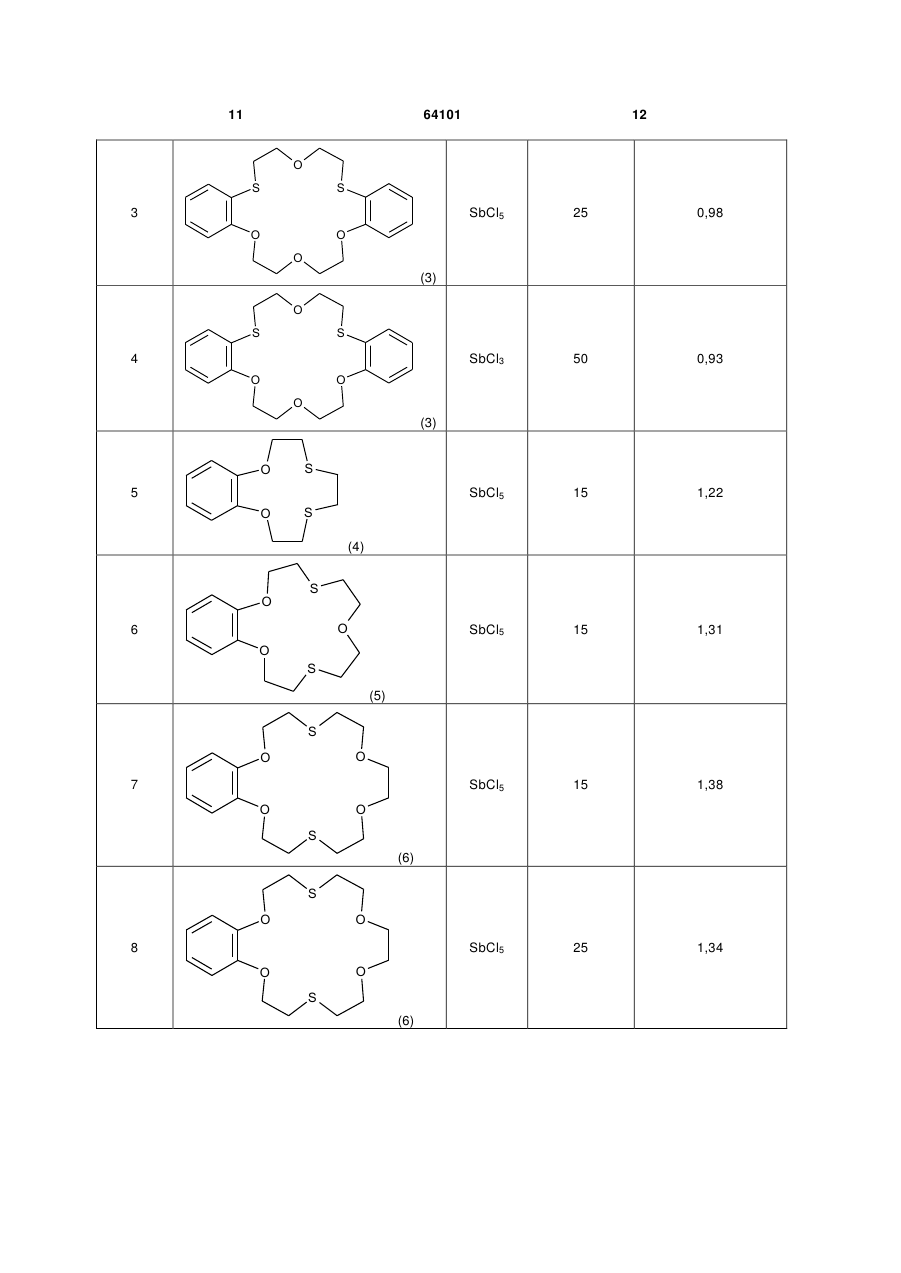
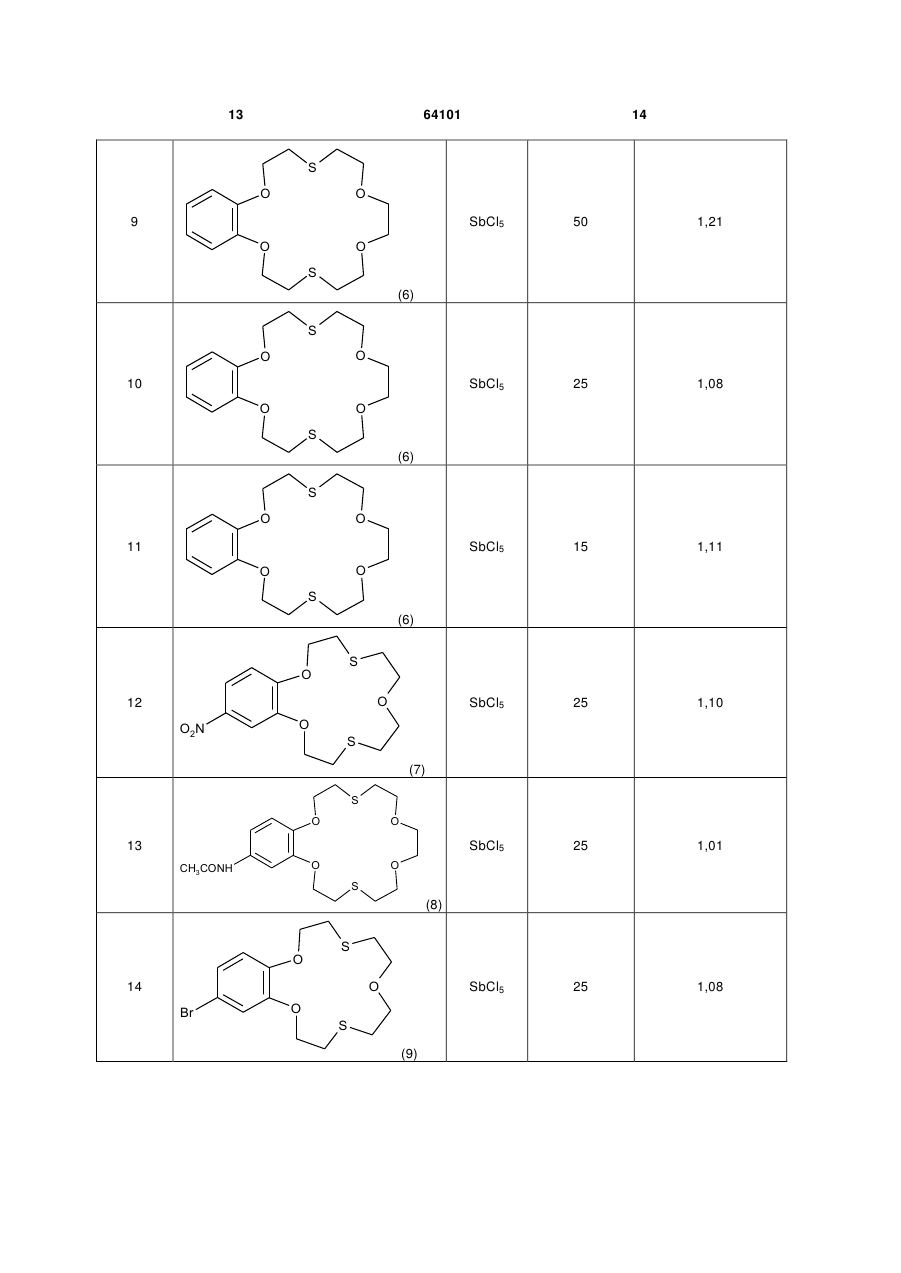
Каталітична композиція для рідиннофазного хлорування толуолу, що складається з кислотного каталізатора Льюїса та сірковмісної сполуки, яка відрізняється тим, що як сірковмісну сполуку використовують дитіокраун-етери загальної формули: Rm R=-CH2-CH2 , , Rm Rm , Y R O U X n Rm=H, CH3, C2H5,Cl, Br, NO2, CH3CONH; m=1,2 S X (13) X , O n=0, 1 більш високим складом пара-хлоротолуолу, потреби в якому для одержання сільськогосподарських, медичних та інших хімічних продуктів є більшими, ніж в орто-хлоротолуолі. Але хлорування толуолу в присутності каталізаторів Льюїса приводить до переважного утворення opтoхлоротолуолу. Так, при дії хлоридів заліза утворюється до 60 % орто-хлоротолуолу, біля 40 % парахлоротолуолу і кілька десятих процента метахлоротолуолу [1]. Тому з метою збільшення виходу пара-хлоротолуолу в реакційній суміші каталізатори Льюїса використовують в композиціях з органічними сполуками двовалентної сірки [1]. (19) Корисна модель належить до органічної хімії, а саме до нової каталітичної композиції, що складається з кислотних каталізаторів Льюїса та сполук класу дитіокраун-етерів, які раніше не застосовувались, як співкаталізатори для підвищення селективності хлорування толуолу в параположення ароматичного кільця. Технології хлорування ароматичних сполук в рідинній фазі з використанням кислотних каталізаторів Льюїса (SbCl5, SbCl3, FeCl3, АІСІ3, SnCl4 та ін.) є найбільш поширеними і економічно вигідними. Важливою задачею процесів хлорування толуолу є одержання реакційних сумішей з можливо UA (11) X=S або O; Y=O або або 2. 64101 ,(I) 3 Результати патентів [1-5] показують, що протягом тривалого часу при хлоруванні толуолу у присутності композицій кислотних каталізаторів Льюїса з кількома десятками сірковмісних співкаталізаторів різних типів (циклічних сульфідів, циклічних тримерів тіоальдегідів і тіокетонів, алкіл-, циклоалкіл-, аралкіл-, арилмеркаптанів і димеркаптанів, тіоетерів, тіокислот, алкіл естерів тіокислот, тіофену, бензотіофену, тетраметилсульфідів, фенілмеркаптану, диметилсульфіду, тіобензойної кислоти та багато інших) не вдавалось перевищити співвідношення пара/орто ізомерів хлоротолуолу 1,05. Наступна сходина у збільшенні співвідношення пара/орто-хлоротолуолів (n/о-ХТ) у межах 0,81,28 була досягнута при використанні похідних тіантрену як співкаталізаторів в композиціях з каталізаторами Льюїса при температурах хлорування толуолу у межах 30-60 °C [6-11]. Більш високе співвідношення n/о-ХТ, яке дорівнює 1,49, одержано в патенті [9] при температурі хлорування 0 °C, застосування якої в промислових процесах є несприятливим. Більш високого рівня співвідношення n/о-ХТ у межах 0,84-1,82 при температурі хлорування 50 °C досягнуто в патенті США [12] при використанні каталітичних композицій, які складаються з FeCl3 і комбінації біля 40 циклічних амідинів. Недоліком цих співкаталізатрів є їх складна будова і отже складні методи синтезу, наявність одного або двох атомів азоту в їх молекулах, які при хлоруванні можуть видалятись з молекул амідинів, перетворюючись у вибуховий трихлорид азоту, утворення помітної кількості (0,5-1,48 %) домішок метахлоротолуолу, який неможливо видалити дистиляцією з реакційної суміші, що погіршує якість товарних n-хлоротолуолу і о-хлоротолуолу. В патентах США [13, 14] застосовували композицію з каталізаторів Льюїса і співкаталізаторів з класу циклічних бензотіолактонів і бензотіотіонолактонів, а також циклічних уретанів, недоліком синтезу яких є використання токсичного фосгену. Співвідношення n/о-ХТ у присутності цих композицій не перевищувало значення 1,325. В патенті США [15] приводяться каталітичні композиції з солей металів 4-12 групи, лантанідів та актинідів Періодичної системи елементів та органічних сполук сірки, таких як діалкіл- і діарилсульфіди, діалкіл- і діарилдисульфіди, алкіл- і арилмеркаптани, тіофен, дибензотіофен, тіантрен, фенотіазин. З цих співкаталізаторів найкраще значення n/о-ХТ, що дорівнює 1,43, одержували при використанні фенотіазин-N-карбоніл хлориду, який синтезували взаємодією фенотіазину з токсичним фосгеном. Співвідношення n/о-ХТ у межах 1,1-1,67 досягнуто при використанні композицій каталізаторів Льюїса з заміщеними фенокстіінами [16-19]. Недоліком цих композицій є руйнація фенокстіінових сполук в присутності слідів вологи, що відмічається в патенті [12]. Найбільш близьким до заявлюваної каталітичної композиції є композиції, описані в патенті США 4444983 (1984) [18], який вибраний за прототип. В прикладах цього патенту приведені результати 64101 4 використання SbCl5, SbCl3 і FeCl3, як кислотних каталізаторів Льюїса, і сполук фенокстііну з хлороабо метильними замісниками в різних положеннях фенольних кілець. Найкращі результати у співвідношенні n/о-ХТ були одержані при використанні композицій SbCl5 - співкаталізатор і SbCl3 - співкаталізатор, які дорівнювали значенням 1,51 і 1,54 при 20 °C. Суттєвим недоліком цих композицій є трудомісткі, енергозатратні, чотиристадійні синтези основних співкаталізаторів, таких як хлоровані 3,9-диметил-2,6,8-трихлорофенокстіін і 3,6,9триметил-8-хлорофенокстіін, які до того ж одержують з низькими виходами. Синтез 3,9-диметил-2,6,8-трихлорофенокстііну починається з бромування 2,4-дихлоротолуолу у присутності АІСІ3 з утворенням 2,4-дихлоро-5бромотолуолу з виходом ~ 60 %. На другій стадії 2,4-дихлоро-5-бромотолуол реагує з пара-хлорокрезолом у присутності карбонату калію, йодиду калію і порошку міді при 170200 °C протягом 10 год. Реакційну суміш фільтрують, масло промивають розчином поташу і водою, сушать і перегоняють у вакуумі 7 мм Hg, збираючи фракцію при 188-193 °C. Вихід 3,5'-диметил-4,2',4'трихлородифенілового етеру ~ 55 %. На третій стадії синтезований етер при взаємодії з SCl2 у присутності гранульованого алюмінію при 80 °C циклізується з утворенням забрудненого 3,9-диметил-2,6,8-трихлорофенокстііну, температура топлення якого коливається у межах 127-142 °C. Загальний вихід сирого продукту ~ 23 %. Одержаний сирий продукт на четвертій стадії дохлоровують із суміші толуолу і великої кількості метанолу, що ще більше зменшує кінцевий вихід чистого співкаталізатора. Аналогічним чотиристадійним методом синтезують подібний співкаталізатор 3,6,9-триметил-8хлорофенокстіін. Задача корисної моделі - створення нової каталітичної композиції, використання якої приводило б до одержання високого, на рівні кращих світових досягнень, співвідношення пара/орто ізомерів хлоротолуолу зі спрощенням синтезу співкаталізаторів. Поставлена задача вирішується за рахунок каталітичної композиції, до складу якої входять сполуки класу тіокраун-етерів загальної формули: X X Y R O n X ,(I) 5 64101 Rm=H, CH3, C2H5, Cl, Br, NO2,CH3CONH; m=1, 2 S Rm R=-CH2-CH2 6 , , O X=S або O; Y=O або ; n=0, 1 або 2 Бензотіокраун-етери синтезували методом [20] з доступних і недорогих, згідно з каталогом Aldrich, хімікатів відповідно до загальної схеми: Rm Rm , , OCH2CH2OH 1) Rm OCH2CH2Br + PBr3 Rm OCH2CH2OH OCH2CH2Br OCH2CH2Br 2) Rm HSCH2 + OCH2CH2Br OCH2CH2SCH2 CH2 Rm O HSCH2 CH2 n=0, 1 або 2. Типова процедура для синтезу бензодитіокраун-етерів на прикладі синтезу 2,3-бензо-7,16-дитіо (18-краун-6) (2,3-бензо-1,4,10,13-тетраокса-7,16дитіоциклооктадека-2єн. 1) Синтез 1,2-біс(2'-брометокси)бензолу. В тригорлу колбу, обладнану мішалкою, зворотним холодильником і крапельною лійкою поміщали 19,8 г (0,1 моль) 1,2-біс(2'3 оксіетокси)бензолу і 40 см сухого дихлоретану. 3 При перемішуванні додавали 10 см (0,1 моль) РВr3. Реакційну суміш нагрівали при 80-90 °C протягом 2,5-3,0 год., розчин охолоджували і нейтралізували бікарбонатом натрію. Органічний шар промивали водою, сушили і розчинник відганяли. В залишку в'язке масло з часом кристалізується. Перекристалізація з етанолу дає 24,3 г (75 %) 1,2біс(1'-брометокси)бензолу, т.т. 61-63 °C. Знайдено, %: С 37,25; Н 3,69; Вr 49,12. C10H12Br2O2. Розраховано, %: С 37,07; Н 3,73; Вr 49,32. 2) Удосконалений у порівнянні з методикою [20] синтез 2,3-бензо-7,16-дитіо(18-краун-6). В тригорлий реактор місткістю 3 дм, обладнаний мішалкою, зворотним холодильником і крапельною лійкою поміщали 2 дм 50 % водного етанолу і 5,3 г (0,05 моль) бікарбонату натрію. До цього нагрітого до кипіння розчину додавали суміш 16,2 г (0,05 моль) 1,2-біс(2'-брометокси)бензолу і 9,1 г (0,05 моль) 1,2-біс(2'-меркаптоетоксі)етану в 200 3 см етанолу по краплях протягом 2,0-2,5 год. Потім CH2 n O OCH2CH2SCH2 3 CH2 n відганяли 1,6-1,8 дм розчинника. Із залишку при охолодженні випадали білі кристали 2,3-бензо7,16-дитіо(18-краун-6). Вихід 16,2 г (94,3 %). Кінцевий вихід продукту ~ 70 %. 2,3,11,12-дибензо-4,10-дитіо(18-краун-6) (2,311,12-бензо-1,7,13,16-тетраокса-4,10дитіоциклоокта-2,11-дієн) синтезували взаємодією о-меркаптофенолу з біс(2'-хлороетиловим) етером у розбавленому н-бутанолі в присутності гідроксиду натрію [21]. 1,10-дитіо(18-краун-6) (4,7,13,16-тетраокса1,10-дитіооктадекан) одержували реакцією 1,2біс(2-хлороетоксі)етану і 1,2-біс(2меркаптоетоксі)етану згідно з [22]. Хлорування толуолу проводили згідно з наступною типовою процедурою. Дослід 1. В чотиригорлий термостатований циліндричний реактор об'ємом 70 мл, обладнаний зворотним холодильником, термометром, пробовідбірником і фторопластовою трубкою для подачі хлору, поміщали 50 мл толуолу, додавали 0,14 (0,47 ммоль) 1,10-дитіо(18-краун-6) (1,10-дитіо4,7,13,16-тетраоксаоктадекан) (1) і після його розчинення впорскували 0,065 мл (0,153 г, 0,51 ммоль) пентахлориду сурми за допомогою шприца. В утворений розчин, котрий постійно перемішували магнітною мішалкою, пропускали хлор зі швидкістю 3-3,5 г/год. Продукти реакції контролювали хроматографічно за допомогою хроматографа "Хром-5", періодично відбираючи 1 мл проби 7 реакційної суміші, яку виливали в 5 % розчин КОН для нейтралізації хлору, додавали 2 мл метиленхлориду, органічний шар відділяли, промивали водою, висушували над СаСl2. Для розділення продуктів використовували колонки з фторованою кремнійорганічною фазою ФС-16 (10 %) на Хроматоні AW. Хлорування проводили протягом 10 год. при температурі 25 °C. Склад продуктів був такий: 39,79 % толуолу, 28,96 % орто-хлоротолуолу і 31,25 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,10. Дослід 2. Хлорування 50 мл толуолу у присутності 0,13 (0,55 ммоль)3-гідроксил-1,5-дитіо(13краун-4) (3-гідрокси-1,5-дитіо-8,11-діоксатридекан) (2) і 0,065 мл (0,153 г, 0,51 ммоль) SbCl5 проводили протягом 11 год. при температурі 25 °C згідно з методикою, що описана в прикладі 1. Отримано наступний склад продуктів: 37,79 % толуолу, 29,63 % орто-хлоротолуолу і 32,58 % парахлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,12. Дослід 3. Хлорування 50 мл толуолу проводили у присутності 0,20 г (0,51 ммоль) 2,3,11,12дибензо-4,13-дитіо (18-краун-6) (2,3,11,12дибензо-1,7,13,16-тетраокса-4,10-дитіоциклооктадека-2,11-дієн) (3) і 0,065 мл (0,153 г, 0,51 ммоль) SbCl5 протягом 11 год. при температурі 25 °C згідно з прикладом 1. Колір реакційної суміші світло-коричневий. Склад продуктів: 28,10 % толуолу, 36,34 % opтo-хлоротолуолу і 35,57 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 0,98. Дослід 4. Хлорування 50 мл толуолу проводили у присутності 0,20 г (0,51 ммоль) 2,3,11,12дибензо-4,13-дитіо (18-краун-6) (2,3,11,12дибензо-1,7,13,16-тетраокса-4,10-дитіоциклооктадека-2,11-дієн) (3) і 0,11 г (0,482 ммоль) SbCl5 протягом 9 год. при температурі 50 °C. Колір реакційної суміші темно-коричневий. Склад продуктів: 36,95 % толуолу, 32,60 % орто-хлоротолуолу і 30,46 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 0,93. Дослід 5. Хлорування 30 мл толуолу проводили аналогічно досліду 1, але у присутності 0,08 г (0,32 ммоль) 2,3-бензо-7,10-дитіо(12-краун-4) (2,3дибензо-7,10-дитіо-1,4-діоксадека-2-єн) (4) і 0,039 мл (0,092 г, 0,31 ммоль) SbCl5 протягом 8 год. при температурі 15 °C. Колір реакційної суміші темночервоний. Склад продуктів: 53,53 % толуолу, 20,98 % пара-хлоротолуолу і 25,49 % парахлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,22. Дослід 6. Хлорування 30 мл толуолу проводили згідно з типовою процедурою у присутності 0,10 г (0,33 ммоль) 2,3-бензо-7,13-дитіо(15-краун-5) (2,3-дибензо-7,13-дитіо-1,4,10-триоксапентадека2-єн) (5) і 0,039 мл (0,092 г, 0,31 ммоль) SbCl5 протягом 4 год. при 15 °C. Колір реакційної суміші темно-коричневий. Склад продуктів: 48,80 % толуолу, 22,04 % орто-хлоротолуолу і 29,16 % парахлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,32. Дослід 7. Хлорування 30 мл толуолу проводили аналогічно типовій процедурі, але у присутності 0,11 г (0,32 ммоль) 2,3-бензо-7,16-дитіо(18-краун 64101 8 6) (2,3-дибензо-7,13-дитіо-1,4,10,13тетраоксаоктадека-2-єн) (6) і 0,039 мл (0,092 г, 0,31 ммоль) SbCl5 протягом 8 год. при температурі 15 °C. Колір реакційної суміші коричневий. Склад продуктів: 37,31 % толуолу, 26,31 % opтoхлоротолуолу і 36,38 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,38. Дослід 8. Хлорування 50 мл толуолу проводили аналогічно досліду 7, але у присутності 0,16 г (0,47 ммоль) 2,3-бензо-7,16-дитіо(18-краун-6) (6) і 0,065 мл (0,153 г, 0,51 ммоль) SbCl5 протягом 12 год. при температурі 25 °C. Склад продуктів: 20,98 % толуолу, 39,52 % opтo-хлоротолуолу і 53,01 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,34. Дослід 9. Хлорування 50 мл толуолу проводили аналогічно досліду 7, але при температурі 50 °C. Склад продуктів після 14 год. хлорування наступний: 25,17 % толуолу, 33,60 % opтoхлоротолуолу і 40,64 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,21. Дослід 10. Хлорування 30 мл толуолу проводили у присутності 0,11 г (0,32 ммоль) 2,3-бензо7,16-дитіо(18-краун-6) (6) і 0,078 мл (0,184 г, 0,61 ммоль) SbCl5 (SbCl5:6=2:l) протягом 2 год. при 25 °C. Колір реакційної суміші темно-зелений. Склад продуктів: 70,97 % толуолу, 13,98 % ортохлоротолуолу і 15,05 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,08. Дослід 11. Хлорування 30 мл толуолу проводили у присутності 0,22 г (0,64 ммоль) 2,3-бензо7,16-дитіо(18-краун-6) (6) і 0,039 мл (0,092 г, 0,31 ммоль) SbCl5 (SbCl5:6=0,48) протягом 2 год. при 15 °C. Колір реакційної суміші темно-вишневий. Склад продуктів: 86,92 % толуолу, 6,20 % opтoхлоротолуолу і 6,88 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,11. Дослід 12. Хлорування 50 мл толуолу проводили аналогічно типовій процедурі у присутності 0,17 г (0,49 ммоль) 2,3-(6'-нітробензо)-7,13дитіо(15-краун-5) (2,3-(6'-нітробензо)-7,13-дитіо1,4,10-триоксапентадека-2-єн) (7) і 0,065 мл (0,153 г, 0,51 ммоль) SbCl5 протягом 10 год. при 25 °C. Розчин коричневого кольору. Склад продуктів: 40,85 % толуолу, 28,23 % opтo-хлоротолуолу і 30,92 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,10. Дослід 13. Хлорування 50 мл толуолу проводили по типовій процедурі, але у присутності 0,19 г (0,48 ммоль) 2,3-(6'-ацетамідобензо)-7,16-дитіо(18краун-6) (2,3-(6'-ацетамідобензо)-7,13-дитіо-1,4,10триоксаоктадека-2-єн) (8) і 0,065 мл (0,153 г, 0,51 ммоль) SbCl5 протягом 9 год. при температурі 25 °C. Склад продуктів: 34,54 % толуолу, 32,93 % орто-хлоротолуолу і 32,93 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,00. Дослід 14. Хлорування 50 мл толуолу проводили по типовій процедурі в присутності 0,18 г (0,48 ммоль) 2,3-(6'-бромобензо)-7,13-дитіо(15краун-5) (2,3-(6'-бромобензо)-7,13-дитіо-1,4,10триоксапентадека-2-єн) (9) і 0,065 мл (0,153 г, 0,51 ммоль) SbCl5 протягом 10 год. при 25 °C. Склад продуктів: 65,66 % толуолу, 16,54 % opтo 9 64101 хлоротолуолу і 17,80 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,08. Дослід 15. Хлорування 50 мл толуолу проводили у присутності 0,17 г (0,49 ммоль) 2,4-бензо8,17-дитіо(19-краун-6) (2,4-бензо-8,17-дитіо1,5,11,14-тетраоксанонадекаєн) (10) і 0,065 мл (0,153 г, 0,51 ммоль) SbCl5 протягом 18 год. при 25 °C. Склад продуктів: 8,38 % толуолу, 43,33 % opтo-хлоротолуолу і 48,29 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,11. Дослід 16. Хлорування 50 мл толуолу проводили у присутності 0,17 г (0,49 ммоль) 2,5-бензо9,18-дитіо(20-краун-6) (2,5-бензо-9,18-дитіо1,6,12,15-тетраоксаейкосиєн) (11) і 0,065 мл (0,153 г, 0,51 ммоль) SbCl5 протягом 12 год. Склад продуктів: 57,20 % толуолу, 19,30 % орто-хлоротолуолу і 23,50 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,22. Дослід 17. Хлорування 30 мл толуолу проводили у присутності 0,11 г (0,33 ммоль) 2,3-нафто7,13-дитіо(15-краун-5) (2,3-нафто-7,13-дитіо1,4,10-триоксапентадека-2-єн) (12) і 0,039 мл (0,092 г, 0,31 ммоль) SbCl5 протягом 2 год. при 15 °C. Колір реакційної суміші темно-коричневий. Склад продуктів: 86,37 % толуолу, 6,52 % ортохлоротолуолу і 7,12 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,09. Дослід 18. Хлорування 30 мл толуолу проводили у присутності 0,10 г (0,35 ммоль) 2,3-(6'метилбензо)-7,13-дитіо(15-краун-5) (2,3-(6'метилбензо)-7,13-дитіо-1,4,10-триоксапентадека2-єн) (13) і 0,039 мл (0,092 г, 0,31 ммоль) SbCl5 10 протягом 8 год. при 20 °C. Колір реакційної суміші темно-коричневий. Склад продуктів: 42,34 % толуолу, 22,90 % opтo-хлоротолуолу і 34,76 % парахлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,52. Дослід 19. Хлорування 30 мл толуолу проводили у присутності 0,14 г (0,446 ммоль) 2,3-(6'метилбензо)-7,13-дитіо(15-краун-5) (13) і 0,10 г (0,44 ммоль) SbCl3 протягом 6 год. при 20 °C. Колір реакційної суміші темно-вишневий. Склад продуктів: 66,57 % толуолу, 12,97 % opтoхлоротолуолу і 20,45 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,57. Дослід 20. Хлорування 50 мл толуолу проводили у присутності 0,16 г (0,51 ммоль) 2,3-(6'метилбензо)-7,13-дитіо(15-краун-5) (13) і 0,080 г (0,49 ммоль) FeCl3 протягом 8 год. при 15 °C. Колір реакційної суміші темно-вишневий. Склад продуктів: 69,64 % толуолу, 13,83 % opтo-хлоротолуолу і 16,54 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,20. Дослід 21. Хлорування 30 мл толуолу проводили у присутності 0,15 г (0,57 ммоль) 2,3-(6'метилбензо)-7,10-дитіо(12-краун-4) (2,3-(6'метилбензо)-7,10-дитіо-діоксаундека-2-єн) (14) і 0,043 мл (0,10 г, 0,33 ммоль) SbCl5 (SbCl5:(14)=0,58) протягом 6 год. при 15 °C. Колір реакційної суміші темно-вишневий. Склад продуктів: 74,32 % толуолу, 10,44 % орто-хлоротолуолу і 15,24 % пара-хлоротолуолу. Співвідношення пара/орто ізомерів хлоротолуолу 1,46. Результати дослідів 1-21 зведені в таблицю. Таблиця Хлорування толуолу в присутності каталітичної композиції кислота Льюїса - тіокраун-етер 2 Температура, °C 5 Співвідношення пара/орто 6 25 1,10 SbCl5 Тіокраун-етер 1 Кислота Льюїса 3 SbCl5 № досліда 25 1,12 S O O 1 O O S (1) O S OH 2 O S (2) 11 64101 12 O S S O O 3 SbCl5 25 0,98 SbCl3 50 0,93 SbCl5 15 1,22 SbCl5 15 1,31 SbCl5 15 1,38 SbCl5 25 1,34 O (3) O S S O O 4 O (3) O S O S 5 (4) O S O 6 O S (5) S O O 7 O O S (6) S O O 8 O O S (6) 13 64101 14 S O O 9 SbCl5 50 1,21 SbCl5 25 1,08 SbCl5 15 1,11 SbCl5 25 1,10 SbCl5 25 1,01 SbCl5 25 1,08 O O S (6) S O O 10 O O S (6) S O O 11 O O S (6) S O O 12 O2N O S (7) S O O O O 13 CH3CONH S (8) O S O 14 Br O S (9) 15 64101 16 S O O 15 SbCl5 25 1,01 SbCl5 25 1,22 SbCl5 15 1,09 SbCl5 20 1,52 SbCl3 20 1,57 FeCl3 15 1,20 O O S (10) S O O 16 O S O (11) S O O 17 O S (12) O S O 18 O S CH3 (13) O S O 19 O S CH3 (13) O S O 20 O S CH3 (13) 17 64101 O S O 21 S 18 CH3 SbCl5 1,46 (14) Головним компонентом каталітичної композиції корисної моделі є кислотні каталізатори Льюїса, з яких SbCl5,SbCl3 і FeCl3 представлені в дослідах. Співкаталізаторами каталітичної композиції є дитіокраун етери загальної формули (І), які раніше не використовували для підвищення селективності монохлорування толуолу в пара-положення. З досліджених дитіокраун етерів найбільшу селективність виявляють бензодитіокраун етери. Дослідження впливу співвідношення компонентів композиції каталізатор - спів-каталізатор 2:1,1:1,1:2 показало, що найкращий результат дає еквімольне співвідношення (1:1) на прикладі складу SbCl5-2,3-бензо-7,16-дитіо(18-краун-6) (досліди 9-11). Оптимальна кількість каталізатора Льюїса повинна бути 0,1 мол. %. Температура реакції у межах 15-50 °C прийнятна для практичного застосування. Для композиції метилбензодитіо(15-краун-5) (13) з SbCl5 і SbCl3 одержані найвищі співвідношення пара/opто-хлоротолуолів, які дорівнюють при 20 °C 1,52 (дослід 18) і 1,57 (дослід 19) відповідно. Це дещо перевищує значення співвідношень для композицій з аналогічними кислотами Льюїса, що приводяться в прототипі, і загалом відповідає рівню кращих світових досягнень [12, 18, 19]. Джерела інформації: 1. Моцарев Г.В., Успенская И.Н. Хлорпроизводные алкилароматических углеводородов. - М.: Химия, 1983. - С. 152. 2. Патент Франції №1491144 (С07С, заявлено 02.09.1966, опубліковано 26.06.1967). 3. Патент Англії №1116353 (С07С 25/04, заявлено 02.09.1964, опубліковано 06.06.1968). 4. Патент Англії №1153746 (С07С 25/04, заявлено 03.09.1965, опубліковано 29.05.1969). 5. Патент США №4031142 (С07С 25/04, заявлено 01.08.1975, опубліковано 21.06.1977). Комп’ютерна верстка А. Рябко 15 6. Патент США №4024198 (С07С 25/06; С07С 25/08, заявлено 01.08.1975, опубліковано 17.05.1977). 7. Патент США №4031144 (С07С 25/28, заявлено 22.03.1976, опубліковано 21.06.1977). 8. Патент США №4031147 (С07С 025/04, заявлено 01.08.1975, опубліковано 21.06.1977). 9. Патент США №4069263 (С07С 25/04, заявлено 03.01.1977, опубліковано 17.01.1978). 10. Патент США №4069264 (С07С 25/04, заявлено 03.01.1977, опубліковано 17.01.1978). 11. Патент США №4250122 (С07С 25/04, заявлено 07.09.1979, опубліковано 10.02.1981). 12. Патент США №5105036 (С07С 17/12; С07С 25/00 заявлено 06.02.1991, опубліковано 14.04.1992). 13. Патент США №5621153 (С07С 17/12; C07D 291/02; C07D 327/02 заявлено 21.04.1995, опубліковано 15.04.1997). 14. Патент США №5714603 (C07D291/08, заявлено 02.02.1996, опубліковано 03.02.1998). 15. Патент США №2006/0094912 (А1) (С07С 17/06, заявлено 19.12.2005, опубліковано 04.05.2006). 16. Патент Японії JP 56110630 (А) (опубліковано 01.09.1981). 17. Патент Японії JP 57175133 (А) (опубліковано 28.10.1982). 18. Патент США №4444983 (С07С 17/12, заявлено 15.04.1982, опубліковано 24.04.1984). 19. Патент США №4647709 (С07С 17/12, заявлено 29.08.1985, опубліковано 03.03.1987). 20. Авторское свидетельство СССР SU 1503251 А1 (С07С 43/29; C07D 327/00; С07С 79/35, опубліковано 12.11.1987). 21. Pedersen C.J., J.Org.Chem., Vol.36, N 2, 1971, p. 254-257. 22. Dann J.R., Chiesa P.P., Gates J.W., J. Org. Chem., Vol. 26, 1991, p. 1991-1995. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCatalyst composition for toluene chlorination in para-position of aromatic ring
Автори англійськоюSerhuchov Yurii Oleksiiovych, Chernobaiev Ihor Ivanovych
Назва патенту російськоюКаталитическая композиция для хлорирования толуола в пара-положение ароматического ядра
Автори російськоюСерчугов Юрий Алексеевич, Чернобаев Игорь Иванович
МПК / Мітки
МПК: C07C 17/12, B01J 31/22, B01J 31/02
Мітки: пара-положення, ядра, хлорування, композиція, ароматичного, толуолу, каталітична
Код посилання
<a href="https://ua.patents.su/9-64101-katalitichna-kompoziciya-dlya-khloruvannya-toluolu-v-para-polozhennya-aromatichnogo-yadra.html" target="_blank" rel="follow" title="База патентів України">Каталітична композиція для хлорування толуолу в пара-положення ароматичного ядра</a>
Попередній патент: Спосіб підвищення чутливості до цефотаксиму золотистого стафілокока, висіяного із ран, із використанням низькоінтенсивного лазерного випромінювання з довжиною хвилі 635 нм
Наступний патент: Пристрій для визначення питомого опору висмикуванню сталевих нагелів з деревини
Випадковий патент: Стенд для випробування на розтягування тяг гальмової системи вагонів