Біосинтетичний імплантат з металевим покриттям, його застосування і спосіб зменшення ризику формування сполучної тканини після імплантації
Номер патенту: 81982
Опубліковано: 25.02.2008
Автори: Брусе Адам, Брусе Ларс, Нільссон Бо, Корсгрен Оллє
Формула / Реферат
1. Біосинтетичний імплантат, що містить напівпроникний бар'єр, призначений для забезпечення дифузії або запобігання дифузії попередньо визначених речовин/матеріалів/молекул/клітин/клітинних ліній, що утворюються в організмі людини, з однієї сторони на протилежну сторону бар'єра, і для забезпечення дифузії або запобігання дифузії з вказаної протилежної сторони попередньо визначених речовин, що є такими ж, як вищезгадані речовини/матеріали/молекули/клітини/клітинні лінії, або відмінними від них, який відрізняється тим, що напівпроникний бар'єр має поверхневе покриття з біоактивного металу, такого як титан, де вказане поверхневе покриття є проникним, щоб забезпечити або запобігти вказаним видам дифузії.
2. Біосинтетичний імплантат, що містить напівпроникний бар'єр, призначений для забезпечення дифузії поживних речовин клітин організму і кисню з організму реципієнта з однієї сторони на протилежну сторону бар'єра, де знаходяться орган/клітини з організму донора, і для забезпечення дифузії з вказаної протилежної сторони попередньо вибраних речовин, що продукується органом/клітинами організму донора, який відрізняється тим, що напівпроникний бар'єр на вказаній одній стороні має поверхневе покриття з біоактивного металу, такого як титан, де поверхневе покриття є проникним, щоб забезпечити вказану дифузію.
3. Імплантат за п. 1 або 2, який відрізняється тим, що метал нанесений способом тонкого подрібнення, таким як розпилення або випарювання.
4. Імплантат за будь-яким з пп. 1-3, який відрізняється тим, що має форму контейнера.
5. Імплантат за будь-яким з пп. 1-4, який відрізняється тим, що бар'єр має вказане поверхневе покриття на обох сторонах.
6. Імплантат за будь-яким з пп. 1-5, який відрізняється тим, що покриття/покриття має/мають товщину приблизно від 5 нм, зокрема приблизно 50-250 нм.
7. Застосування імплантата за будь-яким з пп. 1-6 як біосинтетичної підшлункової залози.
8. Застосування імплантата за будь-яким з пп. 1, 3-6 як частини датчика на вимірювальному пристрої.
9. Спосіб зниження ризику формування/росту сполучної тканини в зв'язку з імплантатом, що містить напівпроникний бар'єр, який відрізняється тим, що бар'єр, щонайменше на одній стороні, забезпечений проникним покриттям з біоактивного металу.
10. Спосіб за п. 9, який відрізняється тим, що покриття одержують за допомогою тонкого подрібнення (розпилення, випарювання).
Текст
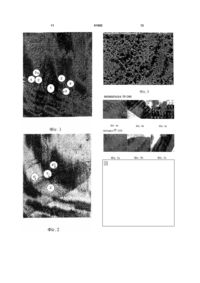
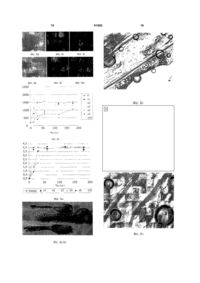
1. Біосинтетичний імплантат, що містить напівпроникний бар'єр, призначений для забезпечення дифузії або запобігання дифузії попередньо визначених речовин/матеріалів/молекул/клітин/клітинних ліній, що утворюються в організмі людини, з однієї сторони на протилежну сторону бар'єра, і для забезпечення дифузії або запобігання дифузії з вказаної протилежної сторони попередньо визначених речовин, що є такими ж, як вищезгадані речовини/матеріали/молекули/клітини/клітинні лінії, або відмінними від них, який відрізняється тим, що напівпроникний бар'єр має поверхневе покриття з біоактивного металу, такого як титан, де вказане поверхневе покриття є проникним, щоб забезпечити або запобігти вказаним видам дифузії. 2. Біосинтетичний імплантат, що містить напівпроникний бар'єр, призначений для забезпечення дифузії поживних речовин клітин C2 2 (19) 1 3 імуносупресуючих лікарських засобів (побічні ефекти, погіршення імунного захисту) розроблені біосинтетичні імплантати, що містять донорські тканину/клітини для імплантації і напівпроникний бар'єр або "фільтр", щоб забезпечити дифузію поживних речовин і кисню з організму реципієнта до імплантованих (тобто, трансплантованих) донорських тканини/клітин, але запобігти дифузіям механізмів імунного захисту (клітин) реципієнта, і в той же час, він повинен забезпечувати дифузію бажаних речовин, продукованих донорськими тканиною/клітинами в організм реципієнта. Приклади таких біосинтетичних імплантатів в патентній літературі включають [US-A-6632244 і WO 02/02745], де детально обговорена імплантація виділених острівців Лангерганса (біосинтетична підшлункова залоза) для одержання інсуліну в організмі реципієнта. У [US 6632244] також обговорюють ризик фіброзу (росту сполучної тканини) в організмі реципієнта, що призводить до закриття пор в бар'єрі сполучною тканиною, внаслідок чого імплантат "гине голодною смертю" (гіпоксія), оскільки він не одержує кисню і поживних речовин з організму реципієнта. Цей феномен має місце в бар'єрних матеріалах, що не є біосумісними. Згідно з останнім патентом, цей недолік усувають за допомогою біосумісного імплантата у вигляді тонкого шару з трьох компонентів: (а) ядра, що складається з живої тканини, трофічних факторів і клітин-"нянь", полімеру альгінату, зшитого, наприклад, кальцієм, і сітки з волокон для міцності, (b) покриття з полімеру альгінату, зшитого кальцієм для контролю проникності, і (с) покриття, що також містить зшитий полімер альгінату. Рекомендовано, щоб товщина імплантата не перевищувала 400мкм. Трансплантат, який також покритий альгінатом (багатошарове покриття), описаний в [патенті США 5876742]. Зазначено, що покриття не фібриногенне. Товщина покриття становить 20200мкм. У [патенті США 5782912] описаний імплантат зі стінкою, що складається з першої пористої мембрани, яка є проксимальною для тканини реципієнта і яка, як зазначено, сприяє формуванню судинних структур на межі поділу реципієнт-мембрана і тим самим запобігає формуванню сполучної тканини. Імплантат також містить другу пористу мембрану, яка формує імуноізольований простір. У даному просторі поміщена тканина, панкреатичні острівці, які повинні бути захищені від контакту з клітинами реципієнта. Друга мембрана допускає дифузію компонентів, що утворюються оточеною тканиною, яка продукує, наприклад, інсулін. Друга мембрана також допускає дифузію поживних речовин від реципієнта в простір для забезпечення тканини поживними речовинами. Мембрани зроблені з полімеру, а перша мембрана складається зі спеціальної тривимірної пористої структури. У даній патентній публікації зазначено, що "відомі біосумісні медичні імплантати складаються з кераміки і металів. За умови, що дані матеріали можна обробляти так, щоб забезпечити описані 81982 4 тут тривимірні структури, вони також можуть бути придатними в даному винаході". У [патенті США 5782912] також описане застосування засобу як покриття на вживленому датчику або на вживленому катетері, як засобів для транспортування фізіологічних факторів для імплантованих сенсорів, як засобів для транспортування лікарських засобів з камери або катетера в тканину реципієнта і як засобів для інкапсуляції трансплантованих клітин для лікування клітинних і молекулярних дефектів (імуноізоляції). Описані вище імплантати і інші імплантати на основі напівпроникних бар'єрів складні в розробці і їх важко виготовляти. Існує підстава вважати, що дані обставини перешкоджають одержанню імплантатів, що добре відтворюються з бажаними властивостями. Також існує підстава вважати, що бар'єр з судин, що утворюються, у відомих імплантатів недостатньо ефективний для запобігання фіброзу, оскільки до уваги не береться заповнений рідиною проміжок між сполучною тканиною і бар'єром. Задачею винаходу є одержання такого біосинтетичного напівпроникного імплантата описаного вище типу, тобто, що має властивість васкуляризації, яка інгібує ріст сполучної тканини (фіброз), при цьому, даний імплантат характеризується простотою в розробці і легкістю у виготовленні, в порівнянні з відомими імплантатами. Задача винаходу досягається за допомогою імплантата, який характеризується ознаками згідно з п.1 формули винаходу, і способу за п.9 формули винаходу. Переважні варіанти здійснення характеризуються ознаками, визначеними в залежних пунктах формули винаходу. Винахід оснований на несподіваному відкритті авторів винаходу, що якщо традиційний напівпроникний бар'єр, "фільтр", "мембрана", адаптовані для імплантації в організм людини і здатні до селективного пропускання поживних речовин, кисню, інших газів, тканинних/клітинних речовин, клітинних ліній, але через який не розповсюджуються механізми імунного захисту, забезпечені проникним покриттям з біосумісного або біологічно активного металу, проблеми з фіброзом значною мірою усуваються. Проведені експерименти дали авторам винаходу підставу вважати, що дана перешкоджаюча фіброзу дія є наслідком того факту, що кровоносні судини у реципієнта, якому імплантують бар'єр з біоактивним покриттям, "притягуються" до поверхні покриття і ростуть вздовж нього. У результаті росту сполучної тканини, фіброз, біля цієї поверхні блокується, і такий ріст сполучної тканини не виникає знов, поки кровоносні судини ростуть поряд з поверхнею біоактивного покриття. Кровоносні судини і ріст кровоносних судин поряд з поверхнею біоактивної судини, в свою чергу, приводять до того факту, що поживні речовини і кисень з кровоносних судин можуть транспортуватися (дифундувати) через імплантат без перешкод від сполучної тканини. 5 Тут "притягання" не треба інтерпретувати як суворий науковий вираз, оскільки механізм, що лежить в основі даного ефекту, ще не встановлений. Вираз швидше служить встановленню того факту, що, згідно з відкриттями авторів даного винаходу, кровоносні судини не ростуть (ростуть в недостатній мірі) у напрямку до поверхні або біля поверхні традиційного бар'єра що визначається як біосумісний чи ні - хоч кровоносні судини роблять це поряд з таким покриттям на традиційному бар'єрі, що складається з біоактивного металу. Потрібно зазначити, що металеве покриття не треба вважати напівпроникним бар'єром в доповнення до традиційного напівпроникного бар'єра, на який нанесений метал. Він є протилежністю альгінатному шару або полімерній мембрані у вказаних вище патентах, надаючи властивість васкуляризації і інгібування фіброзу нижче напівпроникного бар'єра або мембрани. Альгінатний/полімерний шар сам є напівпроникним і забезпечує проникність імплантата, яка є проникністю, відмінною від проникності нижче напівпроникного бар'єра. Металеве покриття імплантата за винаходом не має такого ефекту. Приклад 1 Відмінність в показниках росту сполучної тканини в зв'язку з імплантатом з напівпроникного бар'єра без покриття з біоактивного металу і з покриттям з біоактивного металу, згідно з винаходом, проілюстрована на Фіг.1 і 2. Фіг.1 являє собою фотографію із застосуванням світлового мікроскопа, що ілюструє традиційний імплантат, що містить острівці Лангерганса 1, оточені альгінатним бар'єром 2, де імплантат знаходиться в трансплантованому стані. Шар, позначений 3, ідентифікований як сполучна тканина. Фотографія показує, що сполучна тканина 3 знаходиться поряд з імплантатом, між імплантатом і тканиною/кровоносною судиною реципієнта 4. На Фіг.2 показаний імплантат, що складається з традиційного напівпроникного бар'єра 2', який на одній стороні, за винаходом, покритий титановим покриттям Т. Компонент, позначений 4', ідентифікований як кровоносна судина. Він розташований поряд з титановим покриттям Τ і навіть трохи проникає в покриття. Між кровоносною судиною і бар'єром немає сполучної тканини. Яких-небудь кровоносних судин по всій протяжності іншої сторони бар'єра, яка не має титанового покриття, майже немає. Напівпроникний бар'єр Напівпроникний бар'єр імплантату, де бар'єр виготовлений з полімерного матеріалу з вказаними вище властивостями відносно вказаного вище транспорту, може бути бар'єром того ж типу, який відомий з попереднього рівня техніки, наприклад, згідно з вказаним вище [патентом США 6372244], або яким-небудь іншим матеріалом гістосумісного типу, наприклад GoreTex®. Напівпроникні бар'єри з інших речовин, таких як вуглеводень, целюлоза, пластик (наприклад полікарбонат), гідрогелі, вже доступні в продажу, наприклад, від Мilliроrе Іnс, Baxter Іnс, 81982 6 Аmісоn і Pall Corporation. Їх продають або виготовляють за запитом з різним розміром пор в залежності від того, що необхідно блокувати або пропускати. Наприклад, в продажу існують напівпроникні бар'єри, що блокують дифузію клітин (імунний захист), але які пропускають крізь себе молекули (поживні речовини і кисень, а також речовини з організму реципієнта, якому імплантований бар'єр) і речовини з оточених бар'єром органа/частини органа/тканини донора в організм реципієнта, наприклад інсулін, що продукується острівцями Лангерганса, імплантованими в організм реципієнта. Бар'єр може бути в формі шару, яким оточена(і) тканина або клітини для імплантації, або в формі контейнера (резервуар, гільза), в який поміщені(а) клітини/тканина для імплантації. У цьому випадку біоактивне покриття щонайменше розташоване на зовнішній стороні контейнера. Покриття з біоактивного металу і його нанесення Покриття імплантата з біоактивного металу повинно бути проникним, тобто, мати пори/отвори, що дозволяють пройти (дифундувати) поживним речовинам, кисню і тканинним/клітинним речовинам, тобто покриття не повинно перешкоджати функціонуванню і меті використання напівпроникного бар'єра. Однак розмір пор не повинен запобігати проникненню імунного захисту; за це відповідає напівпроникний бар'єр. Таким чином, проникність покриття повинна бути щонайменше такою ж, як проникність бар'єра (приймаючи до уваги невеликий вплив металевого покриття на стінки пор напівпроникного бар'єра). Покриття може складатися з порошку/пудри, нанесених на бар'єр за допомогою якого-небудь процесу тонкого подрібнення, відомого з попереднього рівня техніки, або тонкоплівкової технології, такої як випарювання (PVD), напилення, або воно може бути в формі сітчастої структури або перфорованої (наприклад лазером) плівки, що прикріплюється яким-небудь відповідним способом, наприклад, приклеюванням до бар'єра із застосуванням біологічного клею або зварюванням її лазером. Прикріплення плівки прошиванням також є прийнятним способом. Іншу можливість являє собою "розпилення" частинок на бар'єр. При виборі способу нанесення покриття на бар'єр, неодмінно потрібно приймати до уваги характер матеріалу бар'єра, особливо термостійкість. Покриття повинно бути по суті безперервним, за допомогою чого мають на увазі запобігти росту сполучної тканини на нижчому напівпроникному бар'єрі. Хоч така вимога навряд чи створює проблеми, якщо покриття складається з плівки, вимогу необхідно брати до уваги, якщо покриття наносять на напівпроникний бар'єр із застосуванням способу, де покриття складається з частинок, які наносяться, наприклад, розпиленням, випаровуванням, хімічною преципітацією. Таким чином, необхідно забезпечити, щоб покриття з біоактивного матеріалу на напівпроникному бар'єрі було рівномірним і без значних вузлів, які можуть 7 викликати ріст сполучної тканини. З іншого боку, також необхідно забезпечити, щоб вимога відсутності вузлів в покритті не приводила до нанесення надмірного покриття так, щоб покриття ставало надмірної товщини і, таким чином, закупорювало пори в напівпроникному бар'єрі. Виявлено, що дуже хороших результатів (транспорт, як зазначено вище, і запобігання фіброзу) можна досягнути із застосуванням сучасного способу покриття з товщиною металевого покриття приблизно від 5нм і більше, більш переважно приблизно 50-250нм, незалежно від розміру пор бар'єра. З посиланням на вищезгадане необхідно зазначити, що, згідно з винаходом, не можна виключити, що частинки біоактивного матеріалу при покриванні проникають в пори/отвори бар'єра, таким чином, зменшуючи їх, за умови, що залишаються пори/отвори для вказаного транспорту або дифузії. Біоактивний метал Під біоактивним металом розуміють біосумісний метал, який в доповнення до біосумісності здатний, як зазначено вище, "притягати" тканину і прикріпляти її до себе. Такі речовини являють собою титан, цирконій, тантал і їх придатні сплави, як вже відомо. Згідно з винаходом, переважним є титан. Приклад 2, Фіг.3 Титанове покриття наносили на одну сторону напівпроникного бар'єра з целюлози, що складається з Diaflo YM5 LOT AN 01383А від Amicon. Нанесення проводили способом випарювання у випарнику Edwards Inc. Покриття наносили з товщиною в 30нм. Результат показаний на Фіг.3, з якої очевидно, що пори целюлозного бар'єра не закупорені титановими частинками, тобто, покривання не приводить до значної зміни поверхневої структури бар'єра. На Фіг.2 показаний цей бар'єр з покриттям як імплантатом у миші через місяць після імплантації. Приклад 3 Приклад повторювали із застосуванням фільтра з Мillipore Іnс, типу SS 3,0мкм. Одержані такі ж результати, як і в прикладі 1. Додаткові аспекти винаходу Основні ідеї винаходу придатні не тільки для напівпроникних бар'єрів, що оточують тканину/клітини організму донора для трансплантації реципієнту, які, таким чином, виживають внаслідок забезпечення поживними речовинами/киснем з організму реципієнта. Ідея винаходу також застосовна до інструментів, вимірювальних елементів і т.д., які необхідно ввести в живий організм, для забезпечення транспорту речовин, як правило, через напівпроникний бар'єр з протилежних сторін стінки бар'єра. Приклад такого застосування являє собою датчик виявлення цукру в крові з напівпроникним бар'єром, що оточує сенсорний елемент, імплантований в організм людини і сполучений з інсуліновим насосом для доставки інсуліну за допомогою інфузійного набору, введеного в організм, і також забезпеченого напівпроникним бар'єром за винаходом, 81982 8 відповідно до виявленого вмісту цукру в крові. Задача винаходу, тобто запобігання росту сполучної тканини поряд з бар'єром, в цих випадках також може вирішуватися за допомогою проникного титанового покриття, як описано вище. Приклади інших застосувань за винаходом являють собою секрецію лікарських засобів (хемотерапевтичних, анальгетиків і т.д.), трансплантацію органів (нирка, печінка і т.д.), клітини в резервуарі, що продукують еритропоетин, фактори згортання, гормон росту, інтерферон а, паратиреоїдні гормони, інсулін і т. д., штучні органи (наприклад клітини печінки), спосіб мікродіалізу. Очевидно, що винахід застосовний для людей, а також тварин. Металеве покриття може складатися з одного або декількох окремо нанесених шарів металу (плівки або порошку), і якщо бажаний селективний транспорт речовин через імплантат, шар/шари титану в імплантаті можуть знаходитися з бар'єром/бар'єрами в конструкції типу "сандвіч". Додаткові приклади Приклади 4 і 5 На Фіг.4а-4с і 5а-5с проілюстровані дослідження традиційних напівпроникних бар'єрів (мембран) з торговими марками TF-200 і Versapor®-200 від Pall Corporation. Структури покритих і непокритих Ті мембран досліджували із застосуванням мікроскопа LEICA M76 із зовнішнім джерелом світла. При покриванні мембран шаром Ті в порівнянні з непокритими мембранами не змогли виявити змін в структурі. Структуру мембрани також досліджували після інкубації покритих Ті мембран у водному розчині, і не спостерігали змін. Таким чином, структура мембрани зберігається і після процедури покривання, і після впливу водного розчину. На Фіг.4а проілюстрована мембрана TF-200 без модифікації, тобто без шару Ті; на Фіг.4b проілюстрована суха мембрана TF-200, покрита одним шаром Ті, а на Фіг.4с проілюстрована волога мембрана TF-200, покрита одним шаром Ті. На Фіг.5а проілюстрована мембрана Versapor®200 без модифікації, тобто без шару Ті; на Фіг.5b проілюстрована суха мембрана Versapor®-200, покрита одним шаром Ті, а на Фіг.5с проілюстрована волога мембрана Versapor®-200, покрита одним шаром Ті. Приклади 6 і 7 На Фіг.6a-6d і 7а-7с проілюстрована ефективність діалізу із застосуванням мембран Versapor®-200 і НТ-200 з Pall Corporation. На Фіг.6а проілюстрований пристрій для тестування ефективності діалізу зі склянкою 10, камерою для діалізу 11, мембраною 12 і магнітною мішалкою 13. Камеру для діалізу 11 заповнювали 1мл людської крові, що містить 0,5Μ глюкози і 2,5Ед/л інсуліну, а мембрану монтували на камеру. Діаліз проводили в склянці, наповненій 50мл PBS. Зразки збирали на 0, 15, 30, 60, 120, 180, 240 і 300 хвилинах і аналізували на поглинання при 280нм, встановлюючи концентрацію глюкози, концентрацію білків і вміст IgG. Між непокритими і покритими Ті мембранами Versapor®-200 і НТ-200 9 не змогли виявити відмінностей в ефективності діалізу. На Фіг.6b проілюстрований діаліз глюкози через мембрану Versapor®-200, на Фіг.6с проілюстрований діаліз білків через мембрану Versapor®-200 і на Фіг.6d проілюстрований діаліз IgG через мембрану Versapor®-200. На Фіг.7а проілюстрований діаліз глюкози через мембрану НТ-200, на Фіг.7b проілюстрований діаліз білків через мембрану НТ-200 і на Фіг.7с проілюстрований діаліз IgG через мембрану НТ200. Приклад 8 Пристрій TheraCyte™, див. Фіг.8а, по суті являє собою резервуар, що утворюється між двома листами мембран. Кожний лист складається з трьох шарів, зовнішнього шару з тканого поліефіру, середнього шару з PTFE з розміром пор 5 мкм і внутрішнього шару з PTFE з розміром пор 0,45мкм. Вважають, що два зовнішніх шари працюють як напрямна для формування кровоносних судин. Внутрішній шар являє собою ізолюючий шар для ізоляції клітин всередині від клітин зовні. Вказаний вище пристрій TheraCyte™ до і після покривання одним або двома шарами Ті досліджували із застосуванням мікроскопа LEICA M76 із зовнішнім джерелом світла і світлового мікроскопа Nikon Eclipse E600. Змін в структурі пристрою внаслідок процедури покривання Ті виявити не змогли. На Фіг.8b проілюстрований пристрій без модифікації (без покриття Ті), на Фіг.8с проілюстрований пристрій з одним шаром Ті, а на Фіг.8d проілюстрований пристрій з двома шарами Ті. На Фіг.8e-8g проілюстрований пристрій без модифікації, з одним шаром Ті і з двома шарами Ті, відповідно. На Фіг.8h-8j проілюстрований пристрій без модифікації, з одним шаром Ті і з двома шарами Ті, відповідно. На Фіг.8k-8m проілюстрований пристрій без модифікації, з одним шаром Ті і з двома шарами Ті, відповідно. На вказаних вище пристроях проводили діаліз в 0,9% NaCl. У пристрій вводили інсулін і радіоактивномічену глюкозу, відповідно. Зразки збирали на 0, 15, 30, 60, 120 і 180 хвилинах після початку діалізу. Глюкозу виявляли із застосуванням рідинного сцинтиляційного лічильника, а інсулін - із застосуванням імуноферментного аналізу (ІФА) ізоінсуліну. Результат: див. Фіг.8n і 8о. На Фіг.8n проілюстрований діаліз глюкози з пристрою TheraCyte™. Числа означають кількості шарів Ті на пристрої. K означає немодифікований пристрій. На Фіг.8о проілюстрований діаліз інсуліну з пристрою TheraCyte™. Числа означають кількості шарів, нанесених на пристрій. Контроль означає немодифікований пристрій. Пристрої TheraCyte™ імплантували самцям щурів LEWIS. Через 17 діб пристрої виймали. На мікроскопічному рівні непокриті пристрої оточені капсулою, що містить сироваткову рідину. Поперечні зрізи виявили наявність більш щільного контакту з тканиною для покритого Ті пристрою TheraCyte™, ніж для непокритого пристрою. Див. Фіг.8p-8s, зверху: Фіг.8р - два шари, Фіг.8r 81982 10 контроль (непокрите, немодифіковане), Фіг.8s один шар Ті. На Фіг.8t проілюстрований поперечний зріз контрольного пристрою (непокрите, немодифіковане), на Фіг.8u проілюстрований поперечний зріз пристрою з одним шаром Ті, а на Фіг.8v проілюстрований поперечний зріз пристрою з двома шарами Ті. На Фіг.9а і 9b проілюстровані резервуари TheraCyte™, імплантовані мишам під грудні м'язи. Резервуари залишали в мишах протягом 41 доби, а потім в пристрої ін'єктували розчин 30ммоль/л глюкози, що містить 14С-глюкозу. Зразки крові забирали, як указано на Фіг.9. На Фіг. продемонстровано, що у контрольної тварини з непокритим резервуаром (зафарбовані кола) рівень глюкози, що відображено і фактичною концентрацією і радіоактивністю, є постійним приблизно при 10ммоль/л аж до 20 хвилин з подальшим зростанням до 25ммоль/л через 75 хвилин. На відміну від цього у тварин з резервуаром з титановим покриттям рівні глюкози починають збільшуватися вже через 5 хвилин. Цей результат знаходиться у повній відповідності з відкриттям того, що титанове покриття забезпечує більш щільне з'єднання з оточуючою тканиною, тим самим, дозволяючи глюкозі дифундувати безпосередньо в тканини і оточуючі кровоносні судини. На відміну від цього, у контрольної тварини контакт між резервуаром і тканиною не є щільним, що приводить до утворення порожнини між речовиною і тканиною, і капсули з фіброзної тканини. Перед тим як досягнути судин тканини, глюкоза повинна дифундувати в рідину, розташовану в проміжку, і в капсулу з фіброзної тканини. Це пояснює затримку в збільшенні концентрації глюкози. На Фіг.10 проілюстрована частина імплантованого резервуара TheraCyte™ під електронним мікроскопом при збільшенні 11500. Світла частина зліва являє собою волокно шару тканого поліефіру, чорна лінія поряд з ним являє собою покриття Ті, а інше являє собою тканину організму поряд з покриттям Ті. Покриття Ті становить приблизно 100нм в товщину. 11 81982 12 13 81982 14 15 81982 16 17 81982 18
ДивитисяДодаткова інформація
Назва патенту англійськоюBiosynthetic implant with metal coating and method for reducing risk of connective tissue formation after implantation
Автори англійськоюBruce Adam, Nilsson Bo, Korsgren Olle
Назва патенту російськоюБиосинтетический имплантат с металлическим покрытием, его применение и способ уменьшения риска формирования соединительной ткани после имплантации
Автори російськоюБрусе Адам, Нильссон Бо, Корсгрен Олле
МПК / Мітки
МПК: A61L 27/00, A61F 2/02
Мітки: формування, тканини, біосинтетичний, застосування, імплантат, ризику, спосіб, металевим, покриттям, сполучної, зменшення, імплантації
Код посилання
<a href="https://ua.patents.su/9-81982-biosintetichnijj-implantat-z-metalevim-pokrittyam-jjogo-zastosuvannya-i-sposib-zmenshennya-riziku-formuvannya-spoluchno-tkanini-pislya-implantaci.html" target="_blank" rel="follow" title="База патентів України">Біосинтетичний імплантат з металевим покриттям, його застосування і спосіб зменшення ризику формування сполучної тканини після імплантації</a>
Попередній патент: Система захисту розгалужених трифазних електричних кіл від струмів віддалених коротких замикань
Наступний патент: Робоча лопатка газової турбіни
Випадковий патент: Вантажозахоплювальна траверса для довгомірних вантажів